Спосіб одержання n-заміщених (3-дигалометил-1-метилпіразол-4-іл)карбоксамідів
Номер патенту: 99460
Опубліковано: 27.08.2012
Автори: Халланд Ніна, Смідт Себастіан Пер, Рак Міхаель, Альтенхофф Ансгар Гереон, Райнхаймер Йоахим, Шмідт-Лайтофф Йоахім, Цірке Томас
Формула / Реферат
1. Спосіб одержання сполук формули (І)
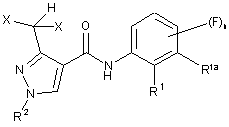 , (I)
, (I)
в якій
R1 означає феніл або С3-С7-циклоалкіл, які є незаміщеними або мають 1, 2 або 3 замісники Ra1, які незалежно один від іншого вибрані з галогену, С1-С8-алкілу, С1-С4-алкокси, С1-С4-алкілтіо, С1-С4-галоалкілу, С1-С4-галоалкокси, С1-С4-галоалкілтіо і С3-С7-циклоалкілу,
R1a означає водень або фтор, або
R1a разом з R1 означає С3-С5-алкандіїл або С5-С7-циклоалкандіїл,
який відрізняється тим, що С3-С5-алкандіїл і С5-С7-циклоалкандіїл є незаміщеними або мають 1, 2 або 3 замісники, вибрані з С1-С4-алкілу,
R2 означає водень, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл або С1-С4-алкокси-С1-С2-алкіл,
X означає F або Сl, і
n означає 0, 1, 2 або 3,
в якому здійснюють
А) одержання сполуки формули (II)
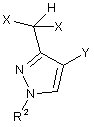 , (II)
, (II)
в якій
X означає F або Сl,
Y означає Сl або Вr, і
R2 має одне з наведених раніше значень; і
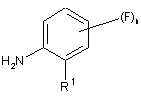
В) взаємодію сполуки формули (II) з монооксидом вуглецю і сполуки формули (III)
 , (ІІІ)
, (ІІІ)
в якій R1, R1a і n мають одне з зазначених раніше значень,
в присутності паладієвого каталізатора.
2. Спосіб за пунктом 1, в якому сполуку формули (І) вибрано зі сполук формули (I.1)
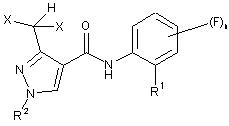 , (I.1)
, (I.1)
в якій R1, R2, X і n незалежно один від іншого мають одне із значень, наведених для сполук формули (І),
і в якому сполуку формули (III) вибрано зі сполук формули (III.1)
 , (III.1)
, (III.1)
в якій R1 і n незалежно один від іншого мають одне із значень, наведених для сполук формули (III).
3. Спосіб за одним з пунктів 1 або 2, в якому одержання сполуки формули (II), в якій Y означає Вr або Сl, включає:
А.1) одержання сполуки формули (IV)
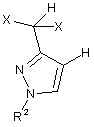 , (IV)
, (IV)
в якій
X означає хлор або фтор, і
R2 має одне з наведених раніше значень;
А.2) при необхідності у випадку, якщо X в сполуці формули (IV) означає хлор, обмін галогенів на фтор; і
А.3) хлорування або бромування сполуки формули (IV).
4. Спосіб за пунктом 3, який відрізняється тим, що одержують сполуку формули (IV), в якій X означає хлор, цю сполуку піддають обміну галогенів на фтор і потім одержану при цьому сполуку формули (IV), в якій X означає фтор, хлорують або бромують.
5. Спосіб за пунктом 4, який відрізняється тим, що обмін галогенів здійснюють за допомогою взаємодії з фторуючим агентом, який вибраний з фторидів лужних металів, фториду кобальту (III), фториду стибію, фториду молібдену, фториду водню, сумішей фториду водню/піридину, третинних гідрофторидів амонію і гідрофторидів триалкіламіну загальної формули n*НF/N(С1-С4-алкіл)3, де n означає 1, 2 або 3.
6. Спосіб за одним з пунктів від 3 до 5, який відрізняється тим, що сполуку формули (IV) у вигляді суміші з відповідним 5-ізомером піддають хлоруванню або бромуванню і потім одержану внаслідок цього сполуку формули (II) відділяють від 5-ізомера, що не вступив у взаємодію.
7. Спосіб за одним з пунктів від 3 до 6, в якому одержання сполуки формули (IV) здійснюють:
А. 1.1а) одержанням сполуки формули (V)
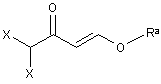 , (V)
, (V)
в якій
X означає Сl або фтор, і
Ra означає С1-С6-алкіл або С2-С6-алкеніл; і
А. 1.2а) взаємодією сполуки формули (V) зі сполукою гідразину формули R2HN-NH2, в якій R2 має одне з наведених раніше значень.
8. Спосіб за одним з пунктів від 3 до 6, в якому одержання сполуки формули (IV) включає:
А.1.1b) одержання сполуки формули (VI)
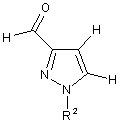 , (VI)
, (VI)
в якій R2 має одне з наведених раніше значень; а також
А.1.2b) взаємодію сполуки формули (VI) за допомогою переведення карбонільної групи в дигалометильну групу з придатним галогенуючим агентом.
9. Спосіб за одним з пунктів від 3 до 6, в якому одержання сполуки формули (IV) включає:
А. 1.1с) депротонування пропаргілальдегід-ацеталю;
А. 1.2с) взаємодію депротонованого пропаргілальдегід-ацеталю з стадії А. 1.1с зі сполукою формули СНХ2Сl, в якій X означає F або Сl; і
А. 1.3с) наступне переведення продукту взаємодії з стадії
А. 1.2с в сполуку формули (IV) зі сполукою гідразину формули R2HN-NH2, в якій R2 має одне з наведених раніше значень.
10. Спосіб за одним з пунктів від 3 до 6, в якому одержання сполуки формули (IV), в якій X означає фтор, включає:
A.1.1d) одержання сполуки формули (VII)
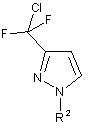 , (VII)
, (VII)
в якій R2 має одне з наведених раніше значень; і
A.1.2d) дехлорування сполуки формули (VII).
11. Спосіб за одним з пунктів від 3 до 6, в якому одержання сполуки формули (IV) включає:
А. 1.1e) одержання сполуки формули (VIII)
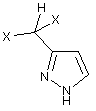 , (VIII)
, (VIII)
в якій X означає Сl або фтор; і
А.1.2е) N-алкілування сполуки формули (VIII).
12. Спосіб за пунктом 11, який відрізняється тим, що для одержання сполуки формули (VIII) сполуку формули V, відповідно до пункту 7, піддають взаємодії з гідразином.
13. Спосіб за пунктом 11, який відрізняється тим, що для одержання сполуки формули (VIII) депротонують ацеталь пропаргілальдегіду, одержаний депротонований ацеталь пропаргілальдегіду піддають взаємодії зі сполукою формули СНХ2Сl, в якій X означає F або Сl, і одержаний таким чином продукт взаємодії піддають реакції з гідразином.
14. Спосіб за пунктом 11, в якому одержання сполуки формули (VIII), в якій X означає F, включає:
одержання сполуки формули (IX)
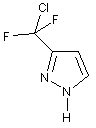 , (IX)
, (IX)
а також дехлорування сполуки формули (IX).
15. Спосіб за одним з пунктів 1 або 2, в якому одержання сполуки формули (II) включає:
А. 1') одержання сполуки формули (VI), як визначено в пункті 8,
А.2') хлорування або бромування сполуки формули (VI) в 4-положенні піразолу,
який відрізняється тим, що одержують сполуку формули (X)
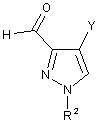 ,
,
в якій Y означає Сl або Вr, а також включає
А.3') переведення карбонільної групи сполуки формули (X) в дигалометильну групу.
16. Спосіб за одним з пунктів 1 або 2, в якому одержання сполуки формули (II), в якій Y означає Сl, включає:
A.1") одержання сполуки формули (XI)
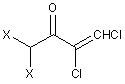 ,(ХI)
,(ХI)
в якій X означає F або хлор;
А.2") взаємодію сполуки формули (XI) з придатним похідним гідразину формули R2HN-NH2 до одержання сполуки загальної формули (II), в якій X означає F або Сl, Y означає Сl, і R2 має одне з наведених раніше значень; а також
А.3") при необхідності у випадку, якщо X в сполуці формули (II) означає хлор, обмін галогену на фтор.
17. Спосіб за одним з попередніх пунктів, в якому X в сполуках загальної формули (І) означає фтор.
18. Сполуки загальної формули (II), такі як визначені в пункті 1.
19. Сполука за пунктом 18, в якій Y означає хлор.
20. Сполука за пунктом 18, в якій Y означає бром.
21. Сполука за одним з пунктів від 18 до 20, в якій X означає фтор.
22. Сполука за одним з пунктів від 18 до 20, в якій X означає хлор.
23. Сполуки загальної формули (IV), такі як визначені в пункті 3, в яких Х означає фтор.
24. Сполуки загальної формули (VII), такі як визначені в пункті 10, в яких R2 означає С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл і С1-С4-алкоксі-С1-С4-алкіл.
25. Сполуки загальної формули (VIII), такі як визначені в пункті 11, в яких Х означає фтор.
26. Сполуки загальної формули (IX), як визначено в пункті 14.
27. Спосіб одержання сполук формули (II), таких як визначені в одному з пунктів від 17 до 21, що включає:
А.1) одержання сполуки формули (IV)
 , (IV)
, (IV)
в якій
X означає хлор або фтор, і
R2 має одне з наведених раніше значень;
А.2) при необхідності у випадку, якщо X в сполуці формули (IV) означає хлор, обмін галогену на фтор; і
А.3) хлорування або бромування сполуки формули (IV).
28. Спосіб за пунктом 27, який відрізняється тим, що одержують сполуку формули (IV), в якій X означає хлор, цю сполуку піддають обміну галогену на фтор і потім одержану при цьому сполуку формули (IV), в якій X означає фтор, хлорують або бромують.
29. Спосіб за пунктом 28, який відрізняється тим, що обмін галогенів здійснюють за допомогою взаємодії з фторуючим агентом, який вибраний з фторидів лужних металів, фториду кобальту(ІІІ), фториду стибію, фториду молібдену, фториду водню, сумішей фториду водню/піридину, третинних гідрофторидів амонію і гідрофторидів триалкіламіну загальної формули n*НF/N(С1-С4-алкіл)3, причому n означає 1, 2 або 3.
Текст
Реферат: Даний винахід належить до способу одержання N-заміщених (3-дигалометилпіразол-4іл)карбоксамідів формули (І) H X X N H N N R (F)n O R1a R 1 2 , (I) 1 1a в якій R означає при необхідності заміщений феніл або С 3-С7-циклоалкіл, R означає водень 1a 1 або фтор, або R разом з R означає при необхідності заміщений С3-С5-алкандіїл або С5-С72 циклоалкандіїл, R означає С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл або С1-С4-алкокси-С1-С2алкіл, X означає F або Сl, і n означає 0, 1, 2 або 3, в якому здійснюють A) одержання сполуки формули (II) UA 99460 C2 ОПИС ДО ПАТЕНТУ НА ВИНАХІД (12) UA 99460 C2 H X X Y N N R 2 , (II) 2 в якій X означає F або Сl, Y означає Сl або Вr, і R має одне з наведених раніше значень; і B) взаємодію сполуки формули (II) з монооксидом вуглецю і сполуки формули (III) (F)n H2N R1a R 1 , (ІІІ) 1 1a в якій R , R і n мають одне з зазначених раніше значень, в присутності паладієвого каталізатора; до застосовуваних проміжних продуктів для одержання способом відповідно до винаходу, а також до способу їх одержання. UA 99460 C2 5 10 15 20 25 30 Даний винахід відноситься до способу одержання N-заміщених (3-дигалометилпіразол-4іл)карбоксамідів, особливо N-заміщених (3-дифторметилпіразол-4-іл)карбоксамідів, до одержання застосовуваних проміжних продуктів, а також до способу їх одержання. Заявка WO 92/12970 описує (3-дифторметил-1-метилпіразол-4-іл)карбоксаміди та їх застосування як фунгіцидів. Одержання відбувається виходячи з 4,4-дифторетилацетоацетату, який послідовно взаємодіє з трифторетилортоформіатом і з метилгідразином, причому одержують (3-дифторметил-1-метилпіразол-4-іл)карбоксилат. Який потім омилюється до карбонової кислоти і на проміжній стадії відповідного хлорангідриду кислоти з придатним аміном переводять у відповідний амід. Заявка WO 2005/044804 описує карбоксилати фторметилзаміщених гетероциклів, такі як зокрема етиловий ефір 3-дифторметил-1-метил-1H-піразол-4-карбонової кислоти, а також їх одержання шляхом обміну галогенів на відповідні карбоксилати хлорметилзаміщених гетероциклів. Крім того, описується взаємодія одержаних сполук до одержання відповідних карбоксамідів. Неопублікований документ EP 06123461.3 описує одержання (3-дифторметил-1метилпіразол-4-іл)карбоксилатів виходячи з 2-алкоксиметилен-4,4,4-тригалоетилацетоацетатів шляхом часткового дегалогенування і взаємодії з придатним похідним гідразину. Далі описується взаємодія одержаних сполук до одержання відповідних карбоксамідів. Таким чином, всі відомі з рівня техніки способи одержання N-заміщених (3-дигалометилпіразол-4-іл)карбоксамідів походять з відповідних N-заміщених (3-дигалометил-піразол-4іл)карбоксилатів. Однак одержання N-заміщених (3-дигалометил-піразол-4-іл)карбоксилатів є порівняно коштовним. Тому в основі даного винаходу лежить завдання, надати альтернативний спосіб одержання N-заміщених (3-дигалометил-піразол-4-іл)карбоксамідів, який запобігає недоліки рівня техніки. Спосіб повинний замінити одержання відповідних карбоксилатів, їх омилення і наступне переведення у відповідні карбоксаміди, за допомогою порівняно менш коштовного шляху синтезу. Несподівано було винайдено, що це завдання вирішується шляхом синтезу, в якому піддають взаємодії не відомі до сих пір N-заміщені 4-бром-3-дигалометил-піразоли визначеної надалі формули (II) з монооксидом вуглецю і придатними анілінами в присутності паладієвого каталізатора. Сполуки формули (II) в свою чергу є доступними, наприклад, шляхом галогенування відповідних сполук визначеної надалі формули (IV). Таким чином, об'єктом даного винаходу є спосіб одержання сполук формули (I), H X O X (F)n N H N N 1a R (I) 1 R 2 35 40 45 50 R , в якій 1 R означає феніл або C3-C7-циклоалкіл, які є незаміщеними або a1 мають 1, 2 або 3 замісники R , які незалежно один від іншого вибрані з галоген, C1-C8-алкіл, C1-C4-алкокси, C1-C4-алкілтіо, C1-C4-галоалкіл, C1-C4-галоалкокси, C1-C4-галоалкілтіо і C3-C7циклоалкіл, 1a R означає водень або фтор, або 1a 1 R разом з R означає C3-C5-алкандиїл або C5-C7-циклоалкандиїл, причому C3-C5-алкандиїл і C5-C7-циклоалкандиїл є незаміщеними або мають 1, 2 або 3 замісники, вибраних з C 1-C4алкілу, 2 R означає водень, C1-C6-алкіл, C2-C6-алкеніл, C2-C6-алкініл або C1-C4-алкокси-C1-C2-алкіл, X означає F або Cl і n означає 0, 1, 2 або 3; що включає A) одержання сполуки формули (II) 1 UA 99460 C2 H X X Y N (II) N R 5 2 , в якій X означає F або Cl, Y означає Cl або Br і 2 R має одне з наведених раніше значень; і B) взаємодію сполуки формули (II) з монооксидом вуглецю і сполуки формули (III), (F)n R H2N R 10 1 (III) 1a 1 , 1a в якій R , R і n мають одне з зазначених раніше значень, в присутності паладієвого каталізатора. Особливий об'єкт даного винаходу відноситься до способу одержання сполук формули (I.1), H X O X (F)n N H N (I.1) 1 R N 2 15 20 25 R , в якій 1 R означає феніл або C3-C7-циклоалкіл, які є незаміщеними або a1 мають 1, 2 або 3 замісники R , які незалежно один від іншого вибрані з галоген, C1-C8-алкіл, C1-C4-алкокси, C1-C4-алкілтіо, C1-C4-галоалкіл, C1-C4-галоалкокси, C1-C4-галоалкілтіо і C3-C7циклоалкіл, 2 R означає водень, C1-C6-алкіл, C2-C6-алкеніл, C2-C6-алкініл або C1-C4-алкокси-C1-C2-алкіл, X означає F або Cl і n означає 0, 1, 2 або 3; що включає A) одержання сполуки формули (II) H X X Y N N R 30 (II) 2 , в якій X означає F або Cl, Y означає Cl або Br і 2 R має одне з наведених раніше значень; і B) взаємодію сполуки формули (II) з монооксидом вуглецю і сполуки формули (III.1), 2 UA 99460 C2 (F)n (III.1) H2N R 1 , 1 5 10 в якій R і n мають одне з зазначених раніше значень, в присутності паладієвого каталізатора, тобто спосіб відповідно до винаходу, в якому сполуку формули (I) вибрано зі сполук 1 2 формули (I.1), в якій R , R , X і n незалежно один від іншого мають одне із значень, наведених 1 для сполук формули (I), і в якій сполуку формули (III) вибрано зі сполук формули (III.1), в якій R і n незалежно один від іншого мають одне із значень, наведених для сполук формули (III). Описані надалі відносно сполук формул (I) і (III) і їх застосування переважні форми здійснення також логічно відносяться до сполук формул (I.1) і (III.1) і до їх застосування. Також об'єктом винаходу є сполуки формули (II), особливо сполуки формули (II), в якій X означає фтор. Також об'єктом винаходу є їх безпосередні попередники, сполуки формули (IV) 15 H X X H N (IV) N R 2 2 в якій R має одне з наведених раніше значень і X означає хлор або фтор. Далі об'єктом винаходу є сполука формули (VII), (VIII) і (IX), F H Cl F X X F N N N 2 R Cl F N N H N H X = F, Cl 20 25 30 35 (VII) (IX) (VIII) , які, як надалі пояснюється детальніше, простим способом можуть бути переведені в сполуки формули (IV). Далі об'єктом винаходу є спосіб одержання сполук формули (II), а також спосіб одержання їх попередників синтезу (IV), (VII), (VIII) і (IX). Застосовувані при визначенні перемінних поняття для органічних груп як, наприклад, вираження "галоген", представляють собою збірні поняття, які заміщуючи означають окремі члени цих груп органічних одиниць. Префікс C x-Cy в кожному випадку позначає число можливих атомів вуглецю. Поняття "галоген" означає кожного разу фтор, хлор, бром або йод, особливо фтор, або хлор. Прикладами інших значень є: Поняття "алкіл", такий як застосовується в C1-C8-алкілі і в поняттях C1-C4-алкокси, C1-C4алкокси-C1-C2-алкіл і C1-C4-алкілтіо, означає насичену, нерозгалужену або розгалужену вуглеводневу групу, що включає особливо від 1 до 8 атомів вуглецю відповідно від 1 до 4 атомів вуглецю, наприклад, метил, етил, пропіл, 1-метилетил, бутил, 1-метилпропіл, 2-метилпропіл, 1,1-диметилетил, пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 1,1-диметилпропіл, 1,2 3 UA 99460 C2 5 10 15 20 25 30 35 40 45 50 55 60 диметилпропіл, 2,2-диметилпропіл, 1-етилпропіл, гексил, 1-метилпентил, 2-метилпентил, 3метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-етилбутил, 2-етилбутил, 1,1,2триметилпропіл, 1,2,2-триметилпропіл, 1-етил-1-метилпропіл, 1-етил-2-метилпропіл, гептил, 1метилгексил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 1,1-диметилпентил, 1,2-диметилпентил, 1,3-диметилпентил, 1,4-диметилпентил, 2,2-диметилпентил, 2,3диметилпентил, 2,4-диметилпентил, 3,3-диметилпентил, 3,4-диметилпентил, 1-етилпентил, 2етилпентил, 1,1,2-триметилбутил, 1,1,3-триметилбутил, 1,2,2-триметилбутил, 1,2,3триметилбутил, 1,3,3-триметилбутил, 2,2,3-триметилбутил, 2,3,3-триметилбутил, 1-етил-1метилбутил, 1-етил-2-метилбутил, 1-етил-3-метилбутил, октил, 1-метилгептил, 2-метилгептил, 3-метилгептил, 4-метилгептил, 5-метилгептил, 6-метилгептил і їх ізомери. C1-C4-алкіл включає, наприклад, метил, етил, пропіл, 1-метилетил, бутил, 1-метилпропіл, 2-метилпропіл або 1,1диметилетил. Поняття "C2-C6-алкеніл" означає мононенасичені, нерозгалужені або розгалужені вуглеводневі залишки з від 2 до 6 С-атомами, переважно від 2 до 4 атомами вуглецю і одним подвійним вуглець-вуглецевим зв'язком в будь-якому положенні, наприклад, C2-C6-алкеніл, такий як етеніл, 1-пропеніл, 2-пропеніл, 1-метилетеніл, 1-бутеніл, 2-бутеніл, 3-бутеніл, 1-метил1-пропеніл, 2-метил-1-пропеніл, 1-метил-2-пропеніл, 2-метил-2-пропеніл, 1-пентеніл, 2-пентеніл, 3-пентеніл, 4-пентеніл, 1-метил-1-бутеніл, 2-метил-1-бутеніл, 3-метил-1-бутеніл, 1-метил-2бутеніл, 2-метил-2-бутеніл, 3-метил-2-бутеніл, 1-метил-3-бутеніл, 2-метил-3-бутеніл, 3-метил-3бутеніл, 1,1-диметил-2-пропеніл, 1,2-диметил-1-пропеніл, 1,2-диметил-2-пропеніл, 1-етил1пропеніл, 1-етил-2-пропеніл, 1-гексеніл, 2-гексеніл, 3-гексеніл, 4-гексеніл, 5-гексеніл, 1-метил-1пентеніл, 2-метил-1-пентеніл, 3-метил-1-пентеніл, 4-метил-1-пентеніл, 1-метил-2-пентеніл, 2метил-2-пентеніл, 3-метил-2-пентеніл, 4-метил-2-пентеніл, 1-метил-3-пентеніл, 2-метил-3пентеніл, 3-метил-3-пентеніл, 4-метил-3-пентеніл, 1-метил-4-пентеніл, 2-метил-4-пентеніл, 3метил-4-пентеніл, 4-метил-4-пентеніл, 1,1-диметил-2-бутеніл, 1,1-диметил-3-бутеніл, 1,2диметил-1-бутеніл, 1,2-диметил-2-бутеніл, 1,2-диметил-3-бутеніл, 1,3-диметил-1-бутеніл, 1,3диметил-2-бутеніл, 1,3-диметил-3-бутеніл, 2,2-диметил-3-бутеніл, 2,3-диметил-1-бутеніл, 2,3диметил-2-бутеніл, 2,3-диметил-3-бутеніл, 3,3-диметил-1-бутеніл, 3,3-диметил-2-бутеніл, 1етил-1-бутеніл, 1-етил-2-бутеніл, 1-етил-3-бутеніл, 2-етил-1-бутеніл, 2-етил-2-бутеніл, 2-етил-3бутеніл, 1,1,2-триметил-2-пропеніл, 1-етил-1-метил-2-пропеніл, 1-етил-2-метил-1-пропеніл, 1етил-2-метил-2-пропеніл. Поняття " C2-C6-алкініл" означає мононенасичені, нерозгалужені або розгалужені вуглеводневі залишки з від 2 до 6 С-атомами, переважно від 2 до 4, атомами вуглецю і одним потрійним вуглець-вуглецевим зв'язком в будь-якому положенні, наприклад, C2-C6-алкініл, такий як етиніл, 1-пропініл, 2-пропініл, 1-бутиніл, 2-бутиніл, 3-бутиніл, 1-метил-2-пропініл, 1-пентиніл, 2-пентиніл, 3-пентиніл, 4-пентиніл, 3-метил-1-бутиніл, 1-метил-2-бутиніл, 1-метил-3-бутиніл, 2метил-3-бутиніл, 1,1-диметил-2-пропініл, 1-етил-2-пропініл, 1-гексиніл, 2-гексиніл, 3-гексиніл, 4гексиніл, 5-гексиніл, 3-метил-1-пентиніл, 4-метил-1-пентиніл, 1-метил-2-пентиніл, 4-метил-2пентиніл, 1-метил-3-пентиніл, 2-метил-3-пентиніл, 1-метил-4-пентиніл, 2-метил-4-пентиніл, 3метил-4-пентиніл, 1,1-диметил-2-бутиніл, 1,1-диметил-3-бутиніл, 1,2-диметил-3-бутиніл, диметил-3-бутиніл, 3,3-диметил-1-бутиніл, 3,3-диметил-2-бутиніл, етил-2-бутиніл, 1-етил-3бутиніл, 2-етил-3-бутиніл або 1-етил-1-метил-2-пропініл. Поняття "C1-C4-алкокси" означає нерозгалужені або розгалужені насичені алкільні групи, що включають від 1 до 4 атомів вуглецю, які зв'язані з атомом кисню. Приклади включають C 1-C4алкокси, як, наприклад, метокси, етокси, OCH2-C2H5, OCH(CH3)2, n-бутокси, OCH(CH3)-C2H5, OCH2-CH(CH3)2 і OC(CH3)3. Поняття "C1-C4-алкілтіо" означає нерозгалужені або розгалужені насичені алкільні групи, що включають від 1 до 4 атомів вуглецю, які зв'язані з атомом сірки. Приклади включають C 1-C4алкілтіо, як, наприклад, метилтіо, етилтіо, SCH2-C2H5, SCH(CH3)2, n-бутилтіо, SCH(CH3)-C2H5, SCH2-CH(CH3)2 і SC(CH3)3. Поняття "C1-C4-галоалкіл", як застосовується тут і в галоалкільних одиницях C 1-C4галоалкокси і C1-C4-галоалкілтіо, позначає нерозгалужені або розгалужені алкільні групи з від 1 до 4 атомами вуглецю, причому атоми водню цих груп частково або повністю заміщені атомами галогену, наприклад, C1-C4-галоалкіл, такий як хлорметил, бромметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, фторетил, хлорофторметил, дихлорфторметил, хлордифторметил, 1-хлоретил, 1-брометил, 1-фторетил, 2-фторетил, 2,2дифторетил, 2,2,2-трифторетил, 2-хлор-2-фторетил, 2-хлор-2,2-дифторетил, 2,2-дихлор-2фторетил, 2,2,2-трихлоретил, пентафторетил і т.д. Поняття "C1-C4-галоалкокси" означає C1-C4галоалкільні групи, як визначені више, які зв'язані з атомом кисню. Приклади включають моно-, 4 UA 99460 C2 5 10 15 20 25 30 35 40 45 50 ди- і трифторметокси, моно-, ди- і трихлорметокси, 1-фторетокси, 1-хлоретокси, 2-фторетокси, 2-хлоретокси, 1,1-дифторетокси, 1,1-дихлоретокси, 1,2-дифторетокси, 1,2-дихлоретокси, 2,2дифторетокси, 2,2-дихлоретокси, 2,2,2-трифторетокси, 1,1,2,2-тетрафторетокси, 2,2,2трихлоретокси, 1,1,1,2,3,3-гексафторізопропокси, 1,1,2,3,3,3-гексафторізопропокси, 2-хлор-1,1,2трифторетокси або гептафторізопропокси. Поняття "C1-C4-галоалкілтіо" означає C1-C4-галоалкільні групи, як визначені раніше, які зв'язані з атомом сірки. Приклади включають моно-, ди- і трифтормет, моно-, ди- і трихлорметилтіо, 1-фторетилтіо, 1-хлоретилтіо, 2-фторетилтіо, 2-хлоретилтіо, 1,1дифторетилтіо, 1,1-дихлоретилтіо, 1,2-дифторетилтіо, 1,2-дихлоретилтіо, 2,2-дифторетилтіо, 2,2-дихлоретилтіо, 2,2,2-трифторетилтіо, 1,1,2,2-тетрафторетилтіо, 2,2,2-трихлоретилтіо, 1,1,1,2,3,3-гексафторізопропілтио, 1,1,2,3,3,3-гексафторізопропілтио, 2-хлор-1,1,2трифторетилтіо або гептафторізопропілтио. Поняття "C3-C7-циклоалкіл" як застосовується тут, описує циклічні вуглеводневі радикали, що включають від 3 до 7 атомів вуглецю. Прикладами циклічних радикалів є циклопропіл, циклобутил, циклопентил, циклогексил або циклогептил. Поняття "алкандиїл", як застосовується в C3-C5-алкандиїл, позначає насичені, нерозгалужені вуглеводневі групи, що включають від 3 до 5 атомів вуглецю, які зв'язані з обома кінцевими атомами вуглецю, такі як пропан-1,3-диїл, бутан-1,4-диїл і пентан-1,5-диїл. Поняття "циклоалкандиїл", як застосовується в C5-C7-алкандиїл, означає насичені, циклічні вуглеводневі групи, що включають від 5 до 7 атомів вуглецю як кільцеві члени, які зв'язані з двома будь-якими атомами вуглецю, такі як циклопентан-1,3-диїл, циклогексан-1,3-диїл, циклогексан-1,4-диїл, циклогептан-1,3-диїл і циклогептан-1,4-диїл. В способі одержання відповідно до винаходу сполук формули (I) зі сполук формул (II) і (III) на стадії B сполуки формул (II) і (III) переважно використовують в молярному співвідношенні (II): (III) від 0,5 : 1 до 2 : 1, переважно від 0,8 : 1 до 1,2 : 1. Зокрема використовують сполуку формули (III) в невеликому надлишку в перерахуванні на сполуку (II), тобто молярне співвідношення (II) : (III) знаходиться < 1, наприклад, в межах від 0,5 : 1 до 90 %. 2.b) реакція в присутності 1,1'-біс(дифенілфосфіно)фероцену (DPPF) Під захисним газом відважували Pd(C6H4CN)2Cl2 (2,3 мг, 0,0060 ммоль), DPPF (10,0 мг, 0,018 ммоль), триетиламін (91,1 мг, 0,9 ммоль), карбонат калію (124,4 мг, 0,9 ммоль), 4-бром-3дифторметил-1-метилпіразол (253,3 мг, 1,2 ммоль) і 2-(3,4,5-трифторфеніл)анілін (267,8 мг, 1,2 ммоль). Під аргоном додавали ацетонітрил (5 мл) і одержану реакційнусуміш збовтували протягом 10 хв. Потім реакційну суміш сильно збовтували під СО-тиском в 15 бар при температурі від 130 °C протягом 16 год. Після охолодження реакційної суміші для ГХ аналізу додавали DEGEE (0,2 мл) як внутрішній стандарт. 17 UA 99460 C2 5 10 15 20 25 30 35 40 45 50 55 Результат ГХ аналізу площ. %]: 76,49 ацетонітрил; 3,87 DEGEE; 0,00 4-бром-3дифторметил-1-метилпіразол; 2,10 2-(3,4,5-трифторфеніл)анілін; 12,25 амід N-(2-(3,4,5трифторфеніл)-феніл)-3-дифторметил-1-метилпіразол-4-карбонової кислоти. Це відповідає формальному виходу в > 85 %. 2.c) реакція в присутності 1,3-біс(ді-(2,6-диметоксифеніл)фосфіно)пропану ((o-MeO)-DPPP) Під захисним газом відважували Pd(C6H4CN)2Cl2 (23 мг, 0,0060 ммоль), (o-MeO)-DPPP (9,6 мг, 0,018 ммоль), карбонат калію (248,8 мг, 1,8 ммоль), 4-бром-3-дифторметил-1метилпіразол (253,3 мг, 1,2 ммоль) і 2-(3,4,5-трифторфеніл)анілін (26,8 мг, 1,2 ммоль). Під аргоном додавали N-метилпіролідон (NMP, 5 мл). Реакційну суміш збовтували протягом 10 хв. Потім реакційну суміш сильно збовтували під СО-тиском в 15 бар при температурі від 130 °C протягом 16 год. Після охолодження реакційної суміші для ГХ аналізу додавали DEGEE (0,2 мл) як внутрішній стандарт. Результат ГХ аналізу площ. %]: 83,14 NMP; 1,25 DEGEE; 0,17 4-бром-3-дифторметил-1метилпіразол; 3,15 2-(3,4,5-трифторфеніл)анілін; 2,87 амід N-(2-(3,4,5-трифторфеніл)-феніл)-3дифторметил-1-метилпіразол-4-карбонової кислоти. Це відповідає формальному виходу в > 34 %. 2.d) реакція в присутності 1,3-біс(дициклогексилфосфіно)пропану (DCPP) Під захисним газом відважували Pd(C6H4CN)2Cl2 (2,3 мг, 0,0060 ммоль), DCCP (7,9 мг, 0,018 ммоль), триетиламін (91,1 мг, 0,9 ммоль), карбонат калію (124,4 мг, 0,9 ммоль), 4-бром-3дифторметил-1-метилпіразол (253.3 мг, 1,2 ммоль) і 2-(3,4,5-трифторфеніл)анілін (26,8 мг, 1,2 ммоль). Під аргоном додавали ацетонітрил (MeCN, 5 мл). Реакційну суміш збовтували протягом 10 хв. Потім реакційну суміш сильно збовтували під СО-тиском в 15 бар при температурі від 130 °C протягом 16 год. Після охолодження реакційної суміші для ГХ аналізу додавали DEGEE (0,2 мл) як внутрішній стандарт. Результат ГХ аналізу площ. %]: 76,10 MeCN; 3,86 DEGEE; 1,20 4-бром-3-дифторметил-1метилпіразол; 4,26 2-(3,4,5-трифторфеніл)анілін; 8,54 амід N-(2-(3,4,5-трифторфеніл)-феніл)-3дифторметил-1-метилпіразол-4-карбонової кислоти. Це відповідає формальному виходу в > 61 %. 2.e) реакція в присутності 2-бутил-2-етил-1,3-біс-(дифенілфосфіно)-пропану (Bustar, Et, BuPepstar) Під захисним газом відважували Pd(C6H4CN)2Cl2 (2,3 мг, 0.0060 ммоль), Bustar (8,9 мг, 0,018 ммоль), триетиламін (91,1 мг, 0,9 ммоль), карбонат калію (124,4 мг, 0,9 ммоль), 4-бром-3дифторметил-1-метилпіразол (253,3 мг, 1,2 ммоль) і 2-(3,4,5-трифторфеніл)анілін (26,8 мг, 1,2 ммоль). Під аргоном додавали ацетонітрил (MeCN, 5 мл). Реакційну суміш збовтували протягом 10 хв. Потім реакційну суміш сильно збовтували під СО-тиском в 15 бар при температурі від 130 °C протягом 16 год. Після охолодження реакційної суміші для ГХ аналізу додавали DEGEE (0,2 мл) як внутрішній стандарт. Результат ГХ аналізу площ. %]: 77,50 MeCN; 3,88 DEGEE; 0.04 4-бром-3-дифторметил-1метилпіразол; 3,23 2-(3,4,5-трифторфеніл)анілін; 9,89 амід N-(2-(3,4,5-трифторфеніл)-феніл)-3дифторметил-1-метилпіразол-4-карбонової кислоти. Це відповідає формальному виходу в > 70 % 2.f) реакція в присутності 1,3-біс(ди-(2,6-диметоксифеніл)фосфіно)пропану (o-MeO-DPPP) Під захисним газом відважували Pd(C6H4CN)2Cl2 (2,3 мг, 0,0060 ммоль), o-MeO-dppp (9,6 мг, 0,018 ммоль), фосфат калію (382,1 мг, 1,8 ммоль), 4-бром-3-дифторметил-1-метилпіразол (25,3 мг, 1,2 ммоль) і 2-(3,4,5-трифторфеніл)анілін (26,8 мг, 1,2 ммоль). Під аргоном додавали диметилацетамід (DMA, 5 мл). Реакційну суміш збовтували протягом 10 хв. Потім реакційну суміш сильно збовтували під СО-тиском в 15 бар при температурі від 130 °C протягом 16 год. Після охолодження реакційної суміші для ГХ аналізу додавали DEGEE (0,2 мл) як внутрішній стандарт. Результат ГХ аналізу площ. %]: 80,12 DMA; 3,74 DEGEE; 1,50 4-бром-3-дифторметил-1метилпіразол; 3,34 2-(3,4,5-трифторфеніл)анілін; 8,00 амід N-(2-(3,4,5-трифторфеніл)-3дифторметил-1-метилпіразол-4-карбонової кислоти. Це відповідає формальному виходу в > 62 % 2.г) реакція в присутності 2,2-диметил-1,3-біс-(дифенілфосфіно)пропану (Pepstar) Під захисним газом відважували Pd(C6H4CN)2Cl2 (2,3 мг, 0,0060 ммоль), Pepstar (7,9 мг, 0,018 ммоль), карбонат калію (248,8 мг, 1,8 ммоль), 4-бром-3-дифторметил-1-метилпіразол (253,3 мг, 1,2 ммоль) і 2-(3,4,5-трифторфеніл)анілін (26,8 мг, 1,2 ммоль). Під аргоном додавали N-метилпіролідон (NMP, 5 мл). Реакційну суміш протягом 10 хв. збовтували. Потім реакційну суміш сильно збовтували під СО-тиском в 15 бар при температурі від 130 °C протягом 16 год. 18 UA 99460 C2 5 10 15 20 25 Після охолодження реакційної суміші для ГХ аналізу додавали DEGEE (0.2 мл) як внутрішній стандарт. Результат ГХ аналізу площ. %]: 17,98 NMP; 6,13 DEGEE; 2,11 4-бром-3-дифторметил-1метилпіразол; 3,76 2-(3,4,5-трифторфеніл)анілін; 13,48 N-(2-(3,4,5-трифторфеніл)феніл)-3дифторметил-1-метилпіразол-4-амід карбонової кислоти. Це відповідає формальному виходу в > 70 % 2.h) реакція в присутності 1-[2-(біс(етил)фосфіно)фероценіл]етил-ди-трет-бутилфосфін (Josiphos tBu2P-Fc-PEt2) Під захисним газом відважували Pd(C 6H4CN)2Cl2 (2,3 мг, 0,0060 ммоль), Josiphos tBu2P-FcPEt2 (10,4 мг, 0,018 ммоль), DBU (274,0 мг, 1,8 ммоль), 4-бром-3-дифторметил-1-метилпіразол (253,3 мг, 1,2 ммоль) і 2-(3,4,5-трифторфеніл)анілін (26,8 мг, 1,2 ммоль). Під аргоном додавали диметилформамід (DMF, 5 мл). Реакційну суміш збовтували протягом 10 хв. Потім реакційну суміш сильно збовтували під СО-тиском в 15 бар при температурі від 130 °C протягом 16 год. Після охолодження реакційної суміші для ГХ аналізу додавали DEGEE (0,2 мл) як внутрішній стандарт. Результат ГХ аналізу площ. %]: 58,85 DMF; 4,48 DEGEE; 0,37 4-бром-3-дифторметил-1метилпіразол; 4,34 2-(3,4,5-трифторфеніл)анілін; 9,66 амід N-(2-(3,4,5-трифторфеніл)-3дифторметил-1-метилпіразол-4-карбонової кислоти. Це відповідає формальному виходу в > 67 %. 2.i) дослідження CO-залежності від тиску реакції в присутності 2,2-диметил-1,3-біс(дифенілфосфіно)пропану (Pepstar) Розчин Pd(PhCN)2Cl2 (0.0375 ммоль) і Pepstar (0.1125 ммоль) в диметилформаміді (DMF, 5 мл) перемішували 30 хвилин при кімнатній температурі. Розчин, що містить преформований каталізатор, переводили в інертизаційний автоклав. Розчин діазабіциклоундецену (DBU, 16.5 ммоль), 3-дифторметил-1-метил-4-бромпіразол (15 ммоль) і 2-(3,4,5-трифторфеніл)анілін (15 ммоль) в DMF (40 мл) переводили в CO-протитечії до розчину каталізатора в автоклав. Реакцію проводили при перемішуванні при 150 °C і зазначеному в таблиці 1 CO-тиску до повної взаємодії бромпіразолу. Таблиця 1 досліди карбонілювання під різним CO-тиском Дослід 2.i.1 2.i.2 2.i.3 2.i.4 2.i.5 CO-тиск [бар] 10 15 25 30 40 Тривалість реакції [год.] 20 20 18.5 20 32 Виділений вихід [%] 81 68 70 66 21 30 35 40 45 50 Після закінченної реакції реакційну суміш змішували з метил-трет-бутиловим ефіром (MTBE, 50 мл) і промивали водою (30 мл). Водну фазу екстрагували за допомогою MTBE (4×30 мл). Потім органічні фази об'єднували, висушували і під зниженим тиском звільняли від розчинника. Залишок розчиняли в толуолі (10 мл) і при перемішуванні нагрівали. Потім додавали nгексан (10 мл). Через декілька хвилин утворювалися кристали, які через 1 год. відфільтровували, промивали гексаном і висушували. Фільтрат концентрували, утворений при цьому залишок розчиняли в толуолі і змішували з n-гексаном. Таким чином, можна було виділити з фільтрату іншій продукт. Необхідний для повної взаємодії час реакції, а також виділенні при реакції виходи можна отримати з таблиці 1. 1 H-ЯМР (499.8 МГц, CDCl3, внутрішній стандарт: TMS): d=3.87 (s, 3 H), 6.71 (t, J=54.2 Hz, 1 H); 6.98 (m, 2 H), 7.25 (m, 2 H), 7.39 (m, 1 H), 7.91 (br s, 2 H), 8.08 част. на млн. (d, J=8.2, 1 H). 13 C-ЯМР (125.7 МГц, CDCl3, TMS як внутрішній стандарт): d=39.51 (s), 111.5 (t, J=233.2 Hz), 113.60 (ddd, J=16.2 Hz, J=5.32 Hz), 116.52 (s), 123.79 (s), 125.41 (s), 129.22 (s), 130.11 (s), 131.58 (td, J=J = 1.0 Hz), 134.29 (td, J=7.0 Hz, J=5.0 Hz), 134.51 (s), 135.9 (s), 135.85 (s), 139.53 (dt, J=252.4 Hz, J=15.1 Hz), 142.7 (t, J=28.9 Hz), 151.3 (ddd, J=251.0 Hz, J=9.9 Hz, J=4.1 Hz), 159.65 част. на млн. (s). 2.k) реакція в присутності 2,2-диметил-1,3-біс-(дифенілфосфіно)пропану (Pepstar) Розчин Pd(PhCN)2Cl2 (0.008 ммоль) і Pepstar (0.024 ммоль) в диметилформаміді (DMF, 5 мл) 30 хвилин перемішували при кімнатній температурі. Розчин, що містить преформований 19 UA 99460 C2 5 10 15 20 25 30 35 40 45 50 55 60 каталізатор переводили в інертизаційний автоклав. Діазабіциклоундецен (DBU, 8.8 ммоль), бромід тетрабутиламонію (0.32 ммоль), а також розчини 3-дифторметил-1-метил-4бромпіразолі (8.8 ммоль) і 2-(3,4,5-трифторфеніл)аніліні (8 ммоль) в DMF (по 20 мл) переводили в CO-протитечії до розчину каталізатора в автоклав. Реакційну суміш перемішували 24 год. при 150 °C і під СО-тиском в 15 бар. Перетворення в перерахуванні на 2-(3,4,5-трифторфеніл)анілін склало 76 % при вибірковості в 100 %. Склад реакційного випуску відповідно до ГХ-аналізу був наступним: DMF 78.65 площ.-%, 3-дифторметил-1-метил-4-бромпіразол 0.0 площ.-%, DBU 12.98 площ.-%, 2(3,4,5-трифторфеніл)анілін 1.99 [площ.-%] і амід N-(2-(3,4,5-трифторфеніл)-феніл)-3дифторметил-1-метилпіразол-4-карбонової кислоти 6.38 площ.-%. Переробка відбувалась як описано в прикладі 2.i) і дала виділений вихід аміду N-(2-(3,4,5трифторфеніл)-феніл)-3-дифторметил-1-метилпіразол-4- карбонової кислоти в 45.4 %. 2.l) реакція в присутності 2-бутил-2-етил-1,3-біс-(дифенілфосфіно)-пропану (Bustar) Розчин Pd(PhCN)2Cl2 (0.0375 ммоль) і Bustar (0.1125 ммоль) в диметилформаміді (DMF, 10 мл) 30 хвилин перемішували при кімнатній температурі. Розчин, що містить преформований каталізатор, переводили в інертизаційний автоклав. Діазабіциклоундецен (DBU, 16.5 ммоль), а також розчини 3-дифторметил-1-метил-4-бромпіразолу (16.5 ммоль) і 2-(3,4,5трифторфеніл)аніліну (15 ммоль) в DMF (по 25 мл) переводили в CO-протитечії до розчину каталізатора в автоклав. Реакційну суміш перемішували 24 год. при 150 °C і під СО-тиском в 15 бар. Перетворення в перерахуванні на 2-(3,4,5-трифторфеніл)анілін складало 99 % при вибірковості в 94 %. Склад реакційного випуску відповідно до ГХ-аналізу був наступним: DMF 44.6 площ.-%, бромпіразол 0.1 площ.-%, DBU 29.7 площ.-%, 2-(3,4,5-трифторфеніл)анілін 0.3 [площ.-%] і N-(2-(3,4,5-трифторфеніл)-феніл)-3-дифторметил-1-метилпіразол-4-амід карбонової кислоти 22.7 площ.-%. Переробка відбувалась як описано в прикладі 2.i) і дала виділений вихід аміду N-(2-(3,4,5трифторфеніл)-феніл)-3-дифторметил-1-метилпіразол-4-карбонової кислоти в 78 %. 3. Одержання 3-дифторметил-N-метилпіразолу за допомогою взаємодії 3--дифторметилNH-піразолу з гідразином і наступного N-метилування 3.1 Одержання 3-дифторметил-NH-піразолу До розчину гідразин-гідрату (100 %-ий, 0,31 г, 0,063 моль) в оцтовій кислоті (10 мл) при температурі від 22 до 31 °C впускали по краплях розчин 1 г 86 %-ой суміші, що містить 1,1дифтор-4-етокси-3-бутен-2-он і 1,1-дифтор-4,4-диетокси-2-бутанон в співвідношенні 1,5 : 1, в оцтовій кислоті (3 мл) протягом 26 хв. Розчин перемішували 64 год. при 22 °C. Потім відганяли оцтову кислоту (42 °C/30 мбар). Олійний залишок ресуспендували в метил-трет-бутиловом ефірі (MTBE, 4 мл) і три рази промивали водою (10 мл). Пробу розчину MTBE концентрували під зниженим тиском (39 °C/ 25 мбар, пізніше 0,4 мбар). + 1 ІЕ-МС (ГХ-МС) [m/z]: 118 [M] ; H-ЯМР (400 МГц, CDCl3): = 6,65 (s, 1H), 6,8 (t, 1H), 7,68 (s, 13 1H), 10,2 част. на млн. (s, шир., NH); C-ЯМР (125 МГц, CDCl3): = 103,41, 111,09, 130,22, 146,41 част. на млн. 3.2 Одержання 3-дифторметил-N-метилпіразолу a) До розчину гідразин-гідрату (14,7 г, 0,294 моль) в оцтовій кислоті (600 мл) впускали по краплях при 22 °C розчин оцтової кислоти (40 мл) в 59 г 77,4 %-ой суміші, що містить 1,1дифтор-4-етокси-3-бутен-2-он (0,145 моль) і 1,1-дифтор-4,4-диетокси-2-бутанон (0,122 моль) в співвідношенні 1,1 / 1, протягом 76 хв. Розчин перемішували 16 год. при 22 °C. Потім видаляли оцтову кислоту під зниженим тиском (45 °C/28 мбар). Олійний залишок ресуспендували в етиловому ефірі оцтової кислоти (450 мл) і промивали водою (450 мл). Водну фазу однократно реекстрагували етиловим ефіром оцтової кислоти (250 мл). Мутну водну фазу фільтрували через кізельгур. Кізельгур повторно промивали невеликою кількістю етилового ефіру оцтової кислоти, водну фазу ще раз реекстрагували за допомогою MTBE (250 мл). Зібрані органічні розчини висушували над сульфатом натрію, фільтрували і під зниженим тиском звільняли від летких компонентів. Залишався осад в 41,5 г. b) Одну частину осаду (37,4 г, 0,24 моль) розчиняли в ацетоні (540 мл). До розчину вводили карбонат калію (57,4 г). Потім додавали по краплях диметилсульфат (52,4 г, 0,42 моль) протягом 73 хв. При цьому реакційна суміш нагрівалася до 31 °C. Потім реакційну суміш перемішували при температурі від 28,5 до 30 °C протягом 105 хв., наступні 18 год. при 21 °C і наступні 75 хв. при 29 до 37 °C. Реакційна суміш містила 2,7 % (ГХ-площ.) вихідного продукту, а також 6,8 % (ГХ-площ.) диметилсульфату. Потім в ротаційному випарному апараті видаляли прибл. 390 г ацетону (40 °C / 300 мбар). Залишок ресуспендували в воді (300 мл) і етиловому ефірі оцтової кислоти (200 мл). Після розділення фаз водну фазу екстрагували етиловим 20 UA 99460 C2 5 10 15 20 25 30 35 40 45 50 55 60 ефіром оцтової кислоти (100 мл). Зібрані органічні фази висушували над сульфатом натрію (30 г), фільтрували і під зниженим тиском звільняли від розчинника (40 °C / 400 до 300 мбар). Залишок (40,6 г) піддавали фракційній перегонці до виділення продукту. Головна фракція (20,4 г, температура переходу. 20 - 65 °C при 20 мбар) містила 3-дифтор-N-метилпіразол і 5-дифторN-метилпіразол в співвідношенні 4,7: 1 (ГХ-час утримання: 5-ізомер: 7,6 хв.; 3-ізомер: 9,2 хв.). Вихід протягом стадії a) і b) (після дистиляції): 47 % (сума обох ізомерів). Якщо приймають до уваги кількості продукту, що знаходяться в побічних фракціях і охолоджувальних уловлювачах, то виходить виправлений вихід в 58 %. 3-дифторметил-N-метилпіразол: 1 H-ЯМР (400 МГц, CDCl3): = 3,95 (s, 3H), 6,42 (s, 1H), 6,68 (t, 1H), 7,4 част. на млн. (s, 1H); 5-дифторметил-N-метилпіразол: 1 H-ЯМР (400 МГц, CDCl3): = 4,95 (s, 3H), 6,42 (s, 1H), 6,68 (t, 1H), 7,4 част. на млн. (s, 1H). Одержаний таким чином 3-дифторметил-N-метилпіразол може застосовуватися в прикладі 1. 4. Одержання 3-дихлорметил-N-метилпіразол via in situ одержання 1,1-дихлор-4-етокси-3бутен-2-ону Дихлорацетилхлорид (98 %-ий, 30,2 г, 0,2 моль) при умовах кип'ятіння зі зворотнім холодильником (38 °C) вводили до простого етилвінілового ефіру (200 мл, прибл. 2,09 моль). Через 3 год. відганяли приблизно 60 мл надлишкового простого етилвінілового ефіру при 50 °C. Потім додавали толуол (100 мл). Леткі компоненти видаляли разом з толуолом під зниженим тиском (50 °C / 60 мбар). Залишок знову змішували з толуолом (100 мл). Одержаний таким чином жовтуватий розчин нагрівали до температури кип'ятіння зі зворотнім холодильником. Потім додавали по краплях при одночасній відгонці толуолу розчин метилгідразину (98 %-ий, 9,4 г, 0,2 моль) в толуолі (100 мл) протягом проміжку часу в 70 хв. Синхронно до реакційної суміші безперервно додавали толуол в кількості, відповідній як дистилят одержаному об'єму. Через наступні 30 хв. перемішувань охолоджували до 25 °C і промивали водою (1 × 100 мл і 1 × 50 мл). Водні фази екстрагували метиленхлоридом (2 × 100 мл). Органічні фази об'єднували і під зниженим тиском звільняли від розчинника (50 °C/15 мбар). Залишок (25,3 г) відділяли за допомогою флеш-дистиляції. Як дистилят (12,9 г, температура переходу. 56-60 °C / 0,3 до 0,2 мбар) одержували суміш ізомерів з 3-дихлорметил-N-метилпіразолу і 5-дихлорметил-Nметилпіразолу в співвідношенні 80 : 20 (ГХ-площ. %). Це відповідає виходу 3-дихлорметил-Nметилпіразолу в 36 %. 4a. Одержання 1,1-дихлор-4-етокси-3-бутен-2-ону Дихлорацетилхлорид (95 %-ий, 16,5 г, 0,11 моль) і простий етилвініловий ефір (99 %-ий, 48,7 г, 0,67 моль) об'єднували при прибл. 0 °C і 5 год. перемішували. Потім ще перемішували приблизно 11 год. при 22 °C. Потім більшу частину надлишкового простого етилвінілового ефіру видаляли дистиляцією під зниженим тиском (40 °C / 300-400 мбар). Із залишку (18,7 г) відділяли продукт за допомогою флеш-дистиляції (олійна баня 100 °C / 0,7 мбар; перехід 72 °C). Як дистилят одержували суміш продукту (15,6 г). Вона складалася на 80 % (ГХ-площ.-%) з цільового продукту. Далі суміш продукту складалась приблизно на 5 % (ГХ-площ. %) з 1,1дихлор-4,4-диетокси-2-бутанону. Вихід, включаючи відповідний діетилацеталь, склав приблизно 68 %. Одержаний таким чином 1,1-дихлор-4-етокси-3-бутен-2-он, наприклад, аналогічно прикладу 3 за допомогою взаємодії з метилгідразином може бути переведений в 3-дихлорметил-Nметилпіразол. 5. Одержання 3-дихлорметил-N-метилпіразолу виходячи з 1,1,4-трихлор-3-бутен-2-ону До розчину 1,1-диметилгідразину (9,5 г, 0,156 моль) в метил-трет-бутиловому ефірі (MTBE, 500 мл) при 20 °C додавали по краплях 1,1,4-трихлор-3-бутен-2-он (15 г, 0,078 моль) при нагріванні до 34 °C за 37 хв. Через 2 год. утворилася липка коричнева суспензія, яку фільтрували через кізельгур. Фільтрат концентрували під зниженим тиском. Залишок (7,6 г в'язкої олії) піддавали фракційній перегонці під зниженим тиском. Як головну фракцію одержували 3 г 3-дихлорметил-N-метилпіразолу з чистотою в 96,4 % (ГХ-площ.) (температура кипіння. 65 °C/ 0,3 мбар), яка при відстоюванні кристалізувалася. Шляхом перекристалізації одержували пробу з чистотою > 99 % (ГХ-площ.). 1 Тпл.: 38,5-40 °C; H-ЯМР (400 МГц, CDCl3): = 3,88 (s, 3H), 6,5 (s, 1H), 6,8 (s, 1H), 7,34 част. 13 на млн. (s, 1H); C-ЯМР (125 МГц, CDCl3): = 65,24, 104,10, 131,60, 151,50 част. на млн. 6. Одержання 3-дихлорметил-N-метилпіразолу via in situ одержання 1,1-дихлор-4-етокси-3бутен-2-ону і взаємодія з метилгідразином Дихлорацетилхлорид (98 %-ий, 15,1 г, 0,1 моль) при 10 °C вводили до простого етилвінілового ефіру (100 мл, прибл. 1,04 моль). Через 16 год. відганяли прибл. 30 мл 21 UA 99460 C2 5 10 15 20 25 30 35 40 45 50 55 60 надлишкового простого етилвінілового ефіру при 50 °C. Після цього додавали толуол (100 мл) і леткі компоненти випаровували разом з толуолом під зниженим тиском (50 °C / 60 мбар). Залишок розчиняли в толуолі (приблизно 100 мл). Цей розчин змішували з оцтової кислотою (100 мл). Потім при нагріванні до 30 °C додавали по краплях водний розчин метилгідразину (40 %-ий, 11,5 г, 0,1 моль) протягом 15 хв. Утворилася 2-фазна суміш, яку перемішували наступні 12 год. при 25 °C. Потім фази розділяли, і толуол відганяли під зниженим тиском (50 °C/ 10 мбар). Залишок ресуспендували в толуолі (100 мл) і знову концентрували. Як залишок одержували 12,0 г суміші ізомерів 3-дихлорметил-N-метилпіразолу і 5-дихлорметил-Nметилпіразолу в співвідношенні 57 : 43 (ГХ-площ.-%). 7. Одержання 3-дихлорметил-NH-піразолу виходячи з 1,1-дихлор-4-етокси-3-бутен-2-ону До розчину гідразин-гідрату (9,7 г, 0,193 моль) в оцтовій кислоті (100 мл) при 22 °C додавали по краплях розчин 36,4 г суміші, що містить 1,1-дихлор-4-етокси-3-бутен-2-он (0,154 моль) і 1,1дихлор-4,4-диетокси-2-бутанон (21,5 ммоль), в оцтову кислоту (20 мл) протягом 50 хв. Розчин перемішували протягом 20 год. при 22 °C. Потім оцтову кислоту видаляли шляхом дистиляції (42 °C/25 мбар, пізніше 0,2 мбар). Олійний залишок ресуспендували в метил-трет-бутиловому ефірі (MTBE, 150 мл) і три рази промивали водою (30 мл). Органічну фазу фільтрували через кізельгур. Фільтрат концентрували (39 °C/ 400 до 25 мбар, пізніше 0,4 мбар). Одержували 27 г сирого продукту, який містив ще прибл. 9 % оцтової кислоти. Його використовували без додаткової очистки в послідовних реакціях. + 1 ІЕ-МС (ГХ-МС) [m/z]: 150 [M] ; H-ЯМР (400 МГц, CDCl3): = 6,65 (s, 1H), 6,9 (s, 1H), 7,75 (s, 13 1H), 10,5 част. на млн. (s, шир., 1H); C-ЯМР (125 МГц, CDCl3): = 66,16, 102,76, 130,35, 150,31 част. на млн. 8. Одержання 3-дифторхлорметил-NH-піразолу виходячи з 4-бутокси-1-хлорo-1,1-дифторобут-3-ен-2-ону До розчину 4-бутокси-1-хлорo-1,1-дифторо-бут-3-ен-2-ону (1,2 г, 0,005 моль) в етанолі (6 мл) протягом 10 хвилин впускали по краплях гідразингідрат (80 %-ий, 0,52 г, 0,008 моль). Потім перемішували 5 год. при умовах кип'ятіння зі зворотнім холодильником. Одержану світлокоричневу суспензію концентрували в ротаційному випарному апараті. Залишок ресуспендували з етиловим ефіром оцтової кислоти (20 мл) і водою (20 мл). Після розділення фаз водну фазу знову екстрагували етиловим ефіром оцтової кислоти (20 мл). Органічні фази об'єднували, висушували над MgSO4, фільтрували і під зниженим тиском звільняли від летких компонентів. Світло-червоний олійний залишок (0,35 г) складався приблизно до 65 % з 3дифторхлорметил-NH-піразолу і до 35 % з етилового ефіру піразол-3-карбонової кислоти. + 1 3-дифторхлорметил-NH-піразол: ІЕ-МС [m/z]: 152 [M] ; H-ЯМР (500 МГц, CDCl3): = 6,68 (s, 13 1H), 7,9 (s, 1H), 11,5-13,5 част. на млн. (s, шир., NH); C-ЯМР (125 МГц, CDCl3): = 103,61, 124,76, 131,18, 147,91 част. на млн. + 1 Етиловий ефір піразол-3-карбонової кислоти: ІЕ-МС [m/z]: 140 [M] ; H-ЯМР (500 МГц, CDCl3): = 1,38 (t, 3H), 4,32 (q, 2H), 6,8 (s, 1H), 7,8 (s, 1H), 11,5-13,5 част. на млн. (s, шир., NH); 13 C-ЯМР (125 МГц, CDCl3): = 14,24, 60,2, 107,80, 132,30, 141,00, 161,60 част. на млн. 9. Одержання 3-дифторхлорметил-N-метилпіразолу виходячи з 4-бутокси-1-хлор-1,1дифторбут-3-ен-2-ону До розчину метилгідразину (0,43 г, 0,009 моль) в толуолі (15 мл) впускали по краплях протягом 20 хв. розчин 4-бутокси-1-хлор-1,1-дифторбут-3-ен-2-ону (2 г, 0,009 моль) в толуолі (5 мл). Реакція протікає злегка екзотермічно. Реакційну суміш потім перемішували при 0 °C 30 хв. ГХ проба показує повну взаємодію до одержання 2 нових продуктів. Поряд з цим виявляється n-бутанол. Потім реакційну суміш перемішували наступні 2 дні при кімнатній температурі. Жовтий реакційний розчин потім концентрували в ротаційному випарному апараті. Олійний залишок (1,4 г) ресуспендували в толуолі, змішували з p-толуолсульфокислотою на кінчику шпателю (0,1 г) і перемішували при 80 °C 1,5 год. Потім реакційну суміш по черзі промивали насиченим водним розчином NaHCO3 (20 мл) і водою (20 мл). Після концентрування органічної фази як залишок одержували жовту олію (0,3 г). + 1 ІЕ-МС [m/z]: 166 [M] ; H-ЯМР (500 МГц, CDCl3): = 3,95 (s, 3H), 6,55 (s, 1H), 7,72 част. на 13 млн. (s, 1H); C-ЯМР (125 МГц, CDCl3): = 147,20, 104,35, 133,10, 39,65, 124,44 част. на млн. 10. Одержання 3-дифторхлорметил-N-метилпіразол виходячи з 4-бутокси-1-хлор-1,1дифторбут-3-ен-2-он До розчину 4-бутокси-1-хлор-1,1-дифторбут-3-ен-2-ону (80 %-ий, 8 г, 0,03 моль) в оцтовій кислоті (60 мл) протягом 30 хвилин впускали по краплях розчин метилгідразину (1,6 г, 0,034 моль) в оцтовій кислоті (10 мл). Реакція протікає злегка екзотермічно. Розчин перемішували прибл. 16 год. при 25 °C. Потім реакційний розчин концентрували під зниженим тиском (50 °C / 30 мбар). ГХ аналіз залишку дав співвідношення ізомерів в 11 : 1 на користь 3 22 UA 99460 C2 5 10 15 20 25 30 35 40 45 50 55 60 ізомера (ГХ-час утримання: 4,3 хв. (5-ізомер); 8,2 хв. (3-ізомер)). Залишок змішували з метилтрет-бутиловим ефіром (MTBE, 20 мл) і водою (20 мл). Після розділення фаз органічну фазу висушували над сульфатом натрію, фільтрували і під зниженим тиском звільняли від летких компонентів (50 °C / 30 мбар). Олійний залишок (3,7 г) досліджували шляхом ГХ аналізу. Площі обох ізомерів відповідали 73 % ГХ загальної площі і знаходились у співвідношенні 49 : 1 на користь 3-ізомера. Вихід склав приблизно 58 %. + ІЕ-МС (ГХ-МС) [m/z]: 166 [M] . 11. Одержання 3-дифторхлорметил-NH-піразолу виходячи з 4-бутокси-1-хлор-1,1-дифторбут-3-ен-2-ону До розчину 4-бутокси-1-хлор-1,1-дифторбут-3-ен-2-ону (80 %-ий, 8 г, 0,03 моль) в оцтовій кислоті (60 мл) впускали по краплях розчин гідразингідрату (1,7 г, 0,034 моль) в оцтову кислоту (10 мл) протягом 30 хвилин. Реакція протікала злегка екзотермічно. Реакційну суміш перемішували приблизно 16 год. при 25 °C. Потім реакційну суміш звільняли від летких компонентів (50 °C / 30 мбар). Залишок змішували з метил-трет-бутиловим ефіром (MTBE, 20 мл) і водою (20 мл). Після розділення фаз органічну фазу висушували над сульфатом натрію, фільтрували і звільняли від розчинника (50 °C / 30 мбар). Олійний залишок (5,1 г) відповідно до ГХ аналізу складався до 80 % з 3-дифторхлорметил-NH-піразолу (ГХ час утримання: 11,9 хв.). Це відповідає виходу в 89 %. 12. Одержання 1-метилпіразол-3-карбальдегіду виходячи з 4-(диметиламіно)-1,1диметоксибут-3-ен-2-ону До розчину NaOH (131,4g, 3,29 моль) в воді (1700 мл) додавали по краплях при охолодженні метилгідразин (151,3 г, 3,29 моль). Потім при кімнатній температурі додавали по краплях 4(диметиламінo)-1,1-диметоксибут-3-ен-2-он (569 г, 3,28 моль) і протягом ночі перемішували. До реакційної суміші додавали соляну кислоту (36 %-ий, 219,6 г, 2.17 моль) і 4 год. перемішували. Потім реакційну суміш встановлювали розчином їдкого натру (10 %-ий) до значення pH в 9,4. Після багаторазової екстракції метиленхлоридом (500 мл), органічні фази промивали водою, висушували над сульфатом магнію, фільтрували і під зниженим тиском звільняли від розчинника. Олійний залишок відповідно до ГХ аналізу мав чистоту в 73 %. Поряд з цільовим 1метилпіразол-3-карбальдегідом залишок як побічний продукт містив 10,7 % 5-карбальдегіду. Його відділяли шляхом дистиляції під зниженим тиском (температура переходу: 55 °C при 2,5 до 2,3 мбар). Вихід 1-метилпіразол-3-карбальдегіду складав 53 %. 1 H-ЯМР (CDCl3): = 4,05 (s, 3H) 6,8 (s, 1H), 7,5 (s, 1H), 9,95 част. на млн. (s, 1H). 13. Одержання 4-бром-3-дихлорметил-1-метилпіразолу виходячи з 1-метилпіразол-3карбальдегіду 13.1 Одержання 4-бром-1-метилпіразол-3-карбальдегіду шляхом бромування 1-метилпіразол-3-карбальдегіду До розчину 1-метилпіразол-3-карбальдегіду (40 г, 0,36 моль) в диметилформаміді (DMF, 320 мл) додавали по краплях при 3-5 °C розчин N-бромсукциніміду (NBS, 64,6 г, 0,36 моль) в DMF (160 мл) (злегка екзотермічний). Реакційну суміш нагрівали потім до кімнатної температури і наступні 2 год. перемішували. Після цього реакційну суміш при перемішуванні вводили в суміш з води (1400 мл) і розчину їдкого натру (конц., 15 мл) і чотири рази екстрагували метил-третбутиловим ефіром (MTBE, 100 мл). Органічні фази об'єднували і промивали нас. розчином NaCl, висушували над сульфатом магнію, фільтрували і потім під зниженим тиском звільняли від розчинника. Одержували 4-бром-1-метилпіразол-3-карбальдегид у вигляді твердої речовини (42,9 г, 98 %-ий відповідно до ГХ аналізу, вихід 61,3 %). 1 13 H-ЯМР (CDCl3): = 4,0 (s, 3H), 7,55 (s, 1H), 9,95 част. на млн. (s, 1H); C-ЯМР (CDCl3): = 40,3, 95,1, 133,0, 146,5, 184,6 част. на млн. 13.2 Одержання 4-бром-3-дихлорметил-1-метилпіразолу виходячи з 4-бром-1-метилпіразол3-карбальдегіду 4-бром-1-метилпіразол-3-карбальдегід (4,0 г, 0,02 моль) поміщали разом з трифенілфосфіном (5,9 г, 0,022 моль) в хлорбензол (40 мл). Потім додавали по краплях тіонілхлорид (2,6 г, 0,022 моль) при кімнатній температурі. Після здійсненого додавання реакційну суміш нагрівали протягом однієї години до 50 °C і протягом ночі перемішували при кімнатній температурі. Після цього додавали лід (40 г) і два рази екстрагували метиленхлоридом (100 мл). Органічні фази висушували над сульфатом магнію, фільтрували і під зниженим тиском звільняли від розчинника. Олійний залишок відділяли шляхом фракційної перегонки. Цільовий продукт (3,4 г, 95 %-ий, вихід 66 %) виділяли при температурі переходу в 95 °C при 3,8 мбар. 1 13 H-ЯМР (CDCl3): = 3,9 (s; 3H), 6,75 (s; 1H), 7,4 част. на млн. (s, 1H); C-ЯМР (CDCl3): = 39,9, 63,1, 95,1, 132,0, 147,8 част. на млн. 23 UA 99460 C2 5 10 15 20 25 30 35 40 45 50 55 60 14. Одержання 4-бром-3-дихлорметил-1-метилпіразолу 14.1 Одержання (Z)-1,1-дихлор-3,4-дибромбут-3-ен-2-он з 1,2-диброметилену і дихлорацетилхлориду До суспензії з 1,2-диброметилену (10,2 г, 0,055 моль) і AlCl3 (4,88 г, 0,036 моль) впускали по краплях при кімнатній температурі дихлорацетилхлорид (5,4 г, 0,036 моль) (злегка екзотермічний). Реакційну суміш недовго нагрівали до 55 °C і потім переробляли. Реакційну суміш вводили в крижану воду (50 г) (спінена і сильне реагування) і три рази екстрагували метиленхлоридом (100 мл). Органічні фази промивали при 10 °C насиченим розчином NaHCO3, висушували над сульфатом магнію, фільтрували і під зниженим тиском звільняли від розчинника (30 °C, 50 мбар). Одержували 11,7 г чорної олії, яка містила приблизно до 12 % (Z)1,1-дихлор-3,4-дибромбут-3-ен-2-ону і до 29 % (Z)-3-бром-1,1,4-трихлорбут-3-ен-2-он. Вихід (Z)1,1-дихлор-3,4-дибромбут-3-ен-2-ону відповідає 13 %. 1 13 H-ЯМР (CDCl3): = 6,6 (s, 1H), 7,85 част. на млн. (s, 1H); C-ЯМР (CDCl3): = 66,7, 129,6, 135,9, 179,6 част. на млн. 14.2 Одержання 4-бром-3-дихлорметил-1-метилпіразолу з (Z)-1,1-дихлор-3,4-дибромбут-3ен-2-ону Розчин (Z)-1,1-дихлор-3,4-дибромбут-3-ен-2-ону (50 %-ий, 10 г, 0,0685 моль) в діетиловому ефірі (75 мл) впускали по краплях при -40 °C повільно до ефірного розчину метилгідразину (4 г, 0,086моль). Потім перемішували 2 год. при 0 °C і при кімнатній температурі протягом ночі. Потім реакційну суміш фільтрували, і залишок промивали на фільтрі метил-трет-бутиловим ефіром (MTBE). Фільтрат під зниженим тиском звільняли від розчинника. Одержували 6,7 г коричневої олії з вмістом 4-бром-3-дихлорметил-1-метилпіразолу в 53 % (відповідно до ГХ аналізу). Це відповідає виходу в 86,4 %. 15. Одержання 4-бром-3-дифторметил-1-метилпіразолу шляхом фторування 4-бром-1метилпіразол-3-карбальдегіду До розчину 4-бром-1-метилпіразол-3-карбальдегіду (22,1 г, 0,12моль) в метиленхлориді (120 мл) додавали по краплях при -20 °C (діетиламіно)трифторид сірки (DAST, 47,1 г, 0,29 моль). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Потім реакційну суміш обережно вводили в суміш лід-вода (400 г) і два рази екстрагували метиленхлоридом (100 мл). Органічну фазу два рази промивали водою (100 мл) і два рази насиченим водним розчином NaCl. (100 мл), висушували над сульфатом магнію, фільтрували і під зниженим тиском звільняли від розчинника. Залишок відділяли шляхом фракційної перегонки. 4-бром-3-дифторметил-1-метилпіразол (температура переходу 51 °C при 2,5 мбар) виділяли з чистотою в 97 % (ГХ аналіз) з виходом в 24,2 г (48,7 %). 1 H-ЯМР (CDCl3): = 3,9 (s; 3H), 6,65 (t; 1H), 7,45 част. на млн. (s, 1H). 16. Одержання 4-бром-3-дифторметил-1-метилпіразолу шляхом обміну галогенів 4-бром-3-дихлорметил-1-метилпіразол (3,0 г; 0,01 моль; 90 %-ий відповідно до ГХ аналізу) перемішували з триетиламін-трисгідрофторидом (25 г, 0,16 моль) при 160 °C під власним тиском (
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the production of n-substituted (3-dihalomethyl-1-methyl-pyrazole-4-yl)carboxamides
Автори англійськоюZierke, Thomas, Rheinheimer Joachim, Rack, Michael, Smidt, Sebastian, Peer, Altenhoff, Ansgar Gereon, Schmidt-Leithoff, Joachim, Challand, Nina
Назва патенту російськоюСпособ получения n-замещенных (3-дигалометил-1-метилпиразол-4-ил)карбоксамидов
Автори російськоюЦирке Томас, Райнхаймер Йоахим, Рак Михаэль, Смидт Себастиан Пер, Альтенхофф Ансгар Гереон, Шмидт-Лайтофф Йоахим, Халланд Нина
МПК / Мітки
МПК: C07D 231/14
Мітки: 3-дигалометил-1-метилпіразол-4-іл)карбоксамідів, спосіб, n-заміщених, одержання
Код посилання
<a href="https://ua.patents.su/34-99460-sposib-oderzhannya-n-zamishhenikh-3-digalometil-1-metilpirazol-4-ilkarboksamidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання n-заміщених (3-дигалометил-1-метилпіразол-4-іл)карбоксамідів</a>
Попередній патент: Похідні 9-(піразол-3-іл)-9н-пурин-2-аміну і 3-(піразол-3-іл)-3н-імідазо[4,5-b]піридин-5-аміну та їх застосування для лікування раку
Наступний патент: Похідні n5-(2-етоксіетил)-n3-(2-піридиніл)-3,5-піперидинкарбоксаміду, призначені для застосування як інгібітори реніну
Випадковий патент: Спосіб обробки кар'єрних та шахтних вод хлориднонатрієвого типу












