Спосіб одержання заміщених 7-гідрокси-7-метил-2-(алкілтіо)n,5-діарил-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-a] піримідин -6-карбоксамідів
Номер патенту: 50266
Опубліковано: 25.05.2010
Автори: Чебанов Валентин Анатолійович, Афанасіаді Людмила Михайлівна, Десенко Сергій Михайлович, Муравйова Олена Олександрівна
Формула / Реферат
Спосіб одержання заміщених 7-гідрокси-7-метил-2-(алкілтіо)-N,5-діарил-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-а]піримідин-6-карбоксамідів формули І
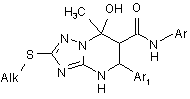 , I
, I
дe Аr = С6Н5; 2-СН3О-С6Н4; 4-СН3О-С6Н4; 2,4-диCH3-C6H3; 2-CH3-C6H4; 4-СlС6Н4
Alk = СН3; СН2СН3; СН(СН3)2; СН2С6Н5; СН2(3-СН3-С6Н4); СН2(3-Сl-С6Н4);
СН2(4-Сl-С6Н4); CH2(4-F-C6H4); CH2(2,4-диCH3-C6H4);CH2(3-CH3O-C6H4);
Аr1 = С6Н5; 2-СН3О-С6Н4; 3-СН3О-С6Н4; 4-СН3О-С6Н4; 4-СН3-С6Н3; 2-СН3С6Н4; 4-Сl-С6Н4; 4-Вr-С6Н4; 4-F-C6H4; 3-Cl-C6H4; 2-СІ-С6Н4; 3-Вr-С6Н4; 2,4-диCl-C6H3; 3,4-диCl-C6H3;
2,6-диCl-C6H3; 3-F-C6H4; 2-F-C6H4; 2-F-6-Cl-C6H3; 3,4-диCH3O-C6H3; 2,4-диCH3O-C6H3;
2,5-диCH3O-C6H3; 2,3-диCH3O-C6H3; 3,4,5-триCH3O-C6H2; 2,4,5-триCH3O-C6H2; 4-SCH3-C6H4; 4-CH(CH3)2-C6H4; 4-CH3CH2-C6H4; 4-CH3CH2O-C6H4; 2-CH3CH2O-C6H4; 4-CN-C6H4;
4-COOH-C6H4; 4-COOCH3-C6H4; 4-NO2-C6H4; 3-NO2-C6H4; 4-OH-C6H4; 3-OH-C6H4;
3,4-диOH-C6H3; 3-CH3O-4-OH-C6H4; 4-CH3O-3-OH-C6H4; 3-CH3CH2O-4-OH-C6H4;
3-CH3O-4-CH3CH2O-C6H4; ![]() -C4H3S;
-C4H3S; ![]() -C4H3S;
-C4H3S; ![]() -C5H4N;
-C5H4N; ![]() -C5H4N;
-C5H4N;
який включає конденсацію рівномолярних кількостей дикарбонільної сполуки, ароматичного альдегіду і 3-алкілтіо-5-аміно-1Н-1,2,4-триазолу у розчиннику, який відрізняється тим, що як дикарбонільну сполуку використовують арилзаміщені аніліди ацетооцтової кислоти формули CH3COCH2CONHAr, а як розчинник - етиловий спирт, реакцію конденсації проводять при температурі 18-25 °С упродовж 20-40 хвилин до утворення цільового продукту.
Текст
Спосіб одержання заміщених 7-гідрокси-7метил-2-(алкілтіо)-N,5-діарил-4,5,6,7тетрагідро[1,2,4]триазоло[1,5-а]піримідин-6карбоксамідів формули І OH O HC U 2 50266 1 3 50266 4-CH(CH3)2-C6H4; 4-CH3CH2-C6H4; 4-CH3CH2OC6H4; 2-CH3CH2O-C6H4; 4-CN-C6H4; 4-COOH-C6H4; 4-COOCH3-C6H4; 4-NO2-C6H4; 3-NO2-C6H4; 4-OHC6H4; 3-OH-C6H4; 3,4-диOH-C6H3; 3-CH3O-4-OHC6H4; 4-CH3O-3-OH-C6H4; 3-CH3CH2O-4-OH-C6H4; 3-CH3O-4-CH3CH2O-C6H4; -C4H3S; -C4H3S; C5H4N; -C5H4N; Сполуки формули І є складними азотвмісними гетероциклічними системами, що виконують найважливіші функції у біоенергетиці живого організму, мають різні види фізіологічної активності і широко використовуються у фармакологічній і медичній хімії, як антигіпертензивні засоби [Alwal К.S. et. al., J. Med.Chem., 1991, 34, p.806]; мають альфа-адреноблокуючі властивості, що викликають розширення периферичних судин [РСТ IntWO 9907695, 1999, А61К31/513, C07D239/22]; є блокаторами іонів кальцію і/або калію [Alwal К. S., Bioorg. Med.Chem. Lett, 1991, 1, p.291]; антагоніс 4 тами нейропептидів [РСТ Int.WO 9833791, 1998, A61K31/513, C07D401/00]. Відомий спосіб одержання структурного аналога сполук формули І - етил-5-алкіл-2-алкілтіо-7арил-4,7-дигідро[1,2,4]триазоло[1,5-а]піримідин-6карбоксилату формули II, описаний у [Giong Chen et. al., J. Heterocyclic Chem., 46, 139(2009)] Ar O N S N Alk O N R1 N H , де Аr=4-СН3О-С6Н4; 4-СІС6Н4; 4-СН3-С6Н4 і інші; АІк=СН3; СН2С6Н5; R1=СН3; СН2СІ; CF3; Спосіб здійснюється за схемою: Ar N S N O O NH H + NH2 + O R1 EtOH, HCl Alk Alk Ar N S Alk N N S O Ar (II) O N N O N H R1 NaBH4 CH3OH O O N N H R1 Розчин -кетоефіру (дикарбонільна сполука), ароматичного альдегіду і 3-аміно-5-алкілтіо-1,2,4триазолу (рівномолярні співвідношення 1 ммоль) у 3мл етилового спирту, що вміщує каталітичні кількості концентрованої НСl, кип'ятять 18 годин. Реакційну суміш охолоджують до кімнатної температури, осад фільтрують, перекристалізовують із етанолу і одержують чистий етил-5-алкіл-2алкілтіо-7-арил-4,7-дигідро[1,2,4]триазоло[1,5a]піримідин-6-карбоксилату формули II. Час реакції складає приблизно 20-23 години. Виходи сполук формули II складають 30-70% в залежності від електронної природи замісників R1 і Аr. Недоліком відомого способу одержання є неможливість отримання кінцевих продуктів структури, що заявляється, в одну стадію, як вказано у джерелі інформації. За відомим способом одержують тільки дигідроізомери, а не тетрагідроізомери (як у способі, що заявляється). Для одержання тетрагідроізомерів необхідно провести ще одну стадію реакції - відновлення дигідросполуки у тетрагідросполуку, але автори відомого джерела не наводять цю стадію. У цьому випадку спосіб одержання сполук структури, що заявляється, складався б із двох послідовних технологічних операцій. Крім того, до недоліків відомого способу одержання структурного аналога слід віднести тривалість технологічного процесу, невеликі виходи сполук, а також необхідність додаткового очищення кінцевих продуктів. Відомий спосіб одержання структурного аналога сполук формули І -5,7-дифеніл-4,5,6,7тетрагідро[1,2,4]триазоло[1,5-a]піримідину формули III, описаний [Десенко С.М., Шишкин О.В. и др. Химия гетероцикл. соед. - 1994. - №7. - С.981]. C6H5 N N N (III) N H C6H5 , Спосіб складається із двох стадій і реалізується за схемою: 5 50266 6 C6 H5 N N O NH N DMF + NH2 C6 H5 C6 H5 C6 H5 NaBH4 N N N H C6 H5 N CH3OH N N N H C6 H5 III На першій стадії еквівалентні кількості 3-аміно1,2,4-триазолу і халкону конденсують у диметилформаміді, нагріваючи суміш у продовж 1 години. Одержують 5,7-дифеніл-4,7-дигідро[1,2,4]триазоло [1,5-а]піримідин з виходом 68%. На другій стадії продукт, одержаний на першій стадії, нагрівають у метанолі в присутності NaBH4 15 хвилин. При цьому дигідропродукт переходить у тетрагідроізомер 5,7-дифеніл-4,5,6,7тетрагідро[1,2,4]триазоло[1,5-а]піримідин формули III з виходом 71%. Недоліком відомого способу є двостадійність технологічного процесу з виділенням проміжного і кінцевого продуктів. Не дивлячись на нетривалий час синтезу і нескладність хімічних реакцій, спосіб має обмежене застосування, тому що не дозволяє різноманітити асортимент нових біологічно активних речовин. У випадку використання замість халкону різних його заміщених виникає необхідність збільшення стадій технологічного процесу, його тривалості, додаткової трати хімічних реактивів і збільшення енергоресурсів. Слід також відмітити, O R1 O що боргідрид натрію NaBH4 дуже гігроскопічний препарат, що потребує проведення реакції в умовах повного зневоднення посуду і реактивів. Відомий спосіб одержання структурного аналога сполук формули І -етил-2-алкілтіо-7-гідрокси7-алкіл-5-арил-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-а]піримідин-6-карбоксилату формули IV шляхом одностадійної багатокомпонентної реакції, що описана [Qiong Chew. et. al., J. Heterocyclic Chem.,2009,46,p.l39-148]. HO R1 O N S N Alk ші; + N S Ar O TSA,H2O N S Alk N NH2 Ar , де Аr=4-CH3O-C6H4; 4-CIC6H4; 4-CH3-C6H4 і ін Ar NH N H (IV) Alk=CH3; CH2C6H5; R1=CH3; CH2CI; CF3; Спосіб реалізується за схемою: H O O N N O HO O N N H N + S Alk N R1 O O N N H Ar Alk Розчин 1 ммоль -кетоефиру (дикарбонільна сполука), 1 ммоль ароматичного альдегіду і 1 ммоль 3-аміно-5-алкілтіо-1,2,4-триазолу у 3мл води, що вміщує каталітичні кількості толуолсульфокислоти (TSA), нагрівають при 80°С упродовж 10 годин. Суміш екстрагують тричі СН2СІ2, екстракт сушать над Na2SO4 і фільтрують. Фільтрат конденсують під пониженим тиском, залишок очищують на хроматографічній колонці (адсорбент - SiO2), одержують суміш двох ізомерів (ди- і тетрагідроізомери), яку розділити дуже складно. Виходи тетрагідроізомеру знаходяться у межах приблизно 539% и лише у випадку R1=CF3 виходи складають 54-80%. Недоліком відомого способу одержання є неможливість отримання індивідуальних тетрагідроізомерів. Крім того, складність розділення суміші двох ізомерів (навіть на хроматографічній колонці) не дозволяє одержувати чисті тетрагідроізомери з високими виходами. Тривалість процесу одержання кінцевих продуктів, включаючи екстракцію і хроматографування суміші, складає приблизно 20 25 годин, що обмежує використання відомого способу навіть в умовах лабораторного синтезу. Як найближчий аналог за технічною суттю нами обрано останній із наведених аналогів. В основу корисної моделі поставлено задачу розробки простого і доступного способу одержання заміщених 7-гідрокси-7-метил-2-(алкілтіо)-N,5діарил-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-а]піримідин-6-карбоксамідів, який дозволяє скоротити час реакції, підвищити вихід і якість кінцевих продуктів. Рішення поставленої задачі забезпечується тим, що у способі одержання заміщених 7гідрокси-7-метил-2-(алкілтіо)-N,5-діарил-4,5,6,7тетрагідро[1,2,4]триазоло[1,5-а]піримідин-6-карбоксамідів, що включає конденсацію дикарбонільної сполуки, ароматичного альдегіду і 3-алкілтіо-5аміно-1Н-1,2,4триазолу у розчиннику, згідно з корисною моделлю, у якості дикарбонильної сполуки використовують арилзаміщені аніліди ацетооцтової кислоти формули СН3СОСН2СONHAr, в якості розчинника - етиловий спирт, реакцію конденсації 7 50266 проводять при температурі 18-25°С упродовж 2040 хвилин до утворення цільового продукту. Вибір компонентів реакції конденсації арилзаміщених анілідів ацетооцтової кислоти і розчинника для реакції - етилового спирту дозволяє здійснити синтез в одну стадію без використання каталізатора (як у прототипі). За способом, що заявляється, одержують індивідуальні тетрагідроізомери (про що свідчать 1Н ЯМР спектри) з високим виходом, виключається додаткова очистка кінцевих продуктів. Спосіб, що заявляється, дозволяє широко модифікувати хімічну структуру кінцевого продукту і одержувати великій набір заміщених триазолопіримідинів - потенційних біологічно активних речовин. Проведення реакції в умовах, що заявляються, забезпечує високу швидкість її протікання, що N S Alk N H NH O + NH2 приводить до зменшення тривалості технологічного процесу до 20-40 хвилин (у способі-прототипі 20-25 годин), виключає використання енергоресурсів, що дозволяє при необхідності швидко розробити промислову методику синтезу таких сполук. Варіювання температурного режиму реакції показало, що проведення синтезу нижче 18°С приводить до подовження часу реакції, а вище 25°С - недоцільно, тому що вже при цій температурі реакція проходить повністю. У таблиці 1 дано порівняльні характеристики способу, що заявляється, і способу за найближчим аналогом. У таблиці 2 наведено температури плавлення, виходи основних продуктів реакції, час синтезу і 1Н ЯМР спектри отриманих сполук. Спосіб, що заявляється, здійснюється за схемою: H3C O + Ar1 O H3C 8 N H Ar N r.t.,EtOH S Alk Аr=С6Н5; 2-СН3О-С6Н4; 4-СН3О-С6Н4; 2,4диCH3-C6H3; 2-CH3-C6H4; 4-СІС6Н4 дe Alk=СН3; СН2СН3; СН(СН3)2; СН2С6Н5; СН2(3-СН3-С6Н4); СН2(3-СІ-С6Н4); СН2(4-СІ-С6Н4); СН2(4-F-С6Н4);CH2(2,4-диCH3-C6H4); СН2(3-СН3-OС6Н4); Аr1=C6H5; 2-CH3O-C6H4; 3-СН3О-С6Н4; 4-СН3ОС6Н4; 4-СН3-С6Н3; 2-СН3С6Н4; 4-СІ-С6Н4; 4-Вr-С6Н4; 4-F-C6H4; 3-CI-C6H4; 2-CI-C6H4; 3-Br-C6H4; 2,4диCI-C6H3; 3,4-диCI-C6H3; 2,6-диCI-C6H3; 3-F-C6H4; 2-FC6H4; 2-F-6-CI-C6H3; 3,4-диCH3O-C6H3; 2,4диСН3ОС6Н3; 2,5-диCH3O-C6H3; 2,3-диCH3O-C6H3; 3,4,5триCH3O-C6H2; 2,4,5-триCH3O-C6H2; 4-SCH3-C6H4; 4-CH(CH3)2C6H4; 4-СН3СН2-С6Н4; 4-СН3СН2О-С6Н4; 2-СН3СН2ОС6Н4; 4-CN-C6H4; 4-COOH-C6H4; 4-COOCH3-C6H4, 4NO2-C6H4; 3-NO2-C6H4; 4-OH-C6H4; 3-OH-C6H4; 3,4-диOHC6H3; 3-СН3О-4-ОН-С6Н4; 4-СН3О-3-ОН-С6Н4; 3-СН3СН2О-4-ОН-С6Н4;3-СН3О-4-СН3СН2ОС6Н4; -C4H3S; -C4H3S; -C5H4N; -C5H4N; Суміш рівномолярних кількостей ароматичного альдегіду, 3-алкілтіо-5-аміно-1Н-1,2,4-триазолу і арилзаміщених анілідів ацетооцтової кислоти перемішують в етиловому спирті при 18-25°С впродовж 20-40 хвилин. Осад, що випав, відфільтровують, промивають етанолом, сушать. Загальна тривалість синтезу складає приблизно 60 хвилин. Нижче наведено приклади конкретного виконання синтезу заміщених 7-гідрокси-7-метил-2 N OH O Ar N H N N H Ar1 (алкілтіо)-N,5-діарил-4,5,6,7-тетрагідро[1,2,4]триазоло-[1,5-a]піримідин-6-карбоксамідів. Приклад 1. Одержання 5-(4-хлорфеніл)-2(етилтіо)-7-гідрокси-7-метил-N-феніл-4,5,6,7тетрагідро[1,2,4]триазоло[1,5-а]піримідин-6-карбоксаміду. Суміш, що складається з 0,15г (1ммоль) 3етилтіо-5-аміно-1Н-1,2,4-триазолу, 0,14г (1ммоль) 4-хлорбензальдегіду, 0,18 (1ммоль) аніліду ацетооцтової кислоти, перемішують в 20мл етилового спирту при 20°С протягом 20 хвилин. Осад, що випав, відфільтровують, промивають 10мл етанолу, сушать. Вихідні дані: Т. пл. 179-180°С. Вихід 0,40г (90%). Спектр 1Н ЯМР (ДМСО-d6), (м. ч.): 1.28 (м, 3Н, СН3), 1.76 (с, 3Н, СН3), 2.97 (кв, 2Н, SCH2), 3.08 (д, 1Н, СН), 5.00 (д, 1Н, СН), 6.78 (с, 1Н, NH), 6.997.54 (м, 9Н, АrН), 7.78 (с, 1Н, ОН), 9.72 (с, 1Н, CONH). Приклад 2. Одержання 2-(бензилтіо)-5-(4етилфеніл)-7-гідрокси-7-метил-К-(2-метоксіфеніл)4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-a]піримідин-6карбоксаміду. Одержують аналогічно прикладу 1. Для реакції беруть: 0,21г (1ммоль) 3-бензилтіо-5-аміно-1Н1,2,4-триазолу, 0,14г (1ммоль) 4-етилбензальдегіду, 0,21 (1ммоль) 2-метоксіаніліду ацетооцтової кислоти. Вихідні дані: Т. пл. 163-165°С. Вихід 0,48г (90%). Спектр 1Н ЯМР (ДМСО-d6), (м. ч.): 1.12 (м, 3Н, СН3), 1.79 (с, 3Н, СН3), 2.54 (кв, 2Н, СН2), 3.25 (д, 1Н, СН), 3.75 (с, 3Н, СН3О), 4.20 (д, 1Н, СН), 4.25 (д, 1Н, СН), 4.85 (д, 1Н, СН), 6.98 (с, 1Н, NH), 6.79-7.52 (м, 13Н, АrН), 7.76 (с, 1Н, ОН), 9.28 (с, 1Н, CONH). Решту прикладів зведено у таблицю 2. 9 50266 Як видно із тексту матеріалів, що заявляються, технічне рішення, що пропонується, має наступні переваги: - тривалість синтезу складає 20-40 хвилин (за найближчим аналогом 20-25 годин); - дозволяє підвищити вихід кінцевих продуктів до 65-90% у порівнянні з способом - найближчим аналогом (~5-39%); - широко варіювати у молекулі замісники різної електронної природи; 10 - спосіб, що заявляється, менш енергоємний у порівнянні зі способом - найближчим аналогом, тому що весь синтез проводиться при кімнатній температурі. Можливість широкої модифікації структури заміщених 7-гідрокси-7-метил-2-(алкілтіо)-N,5-діарил -4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-a]піримідин6-карбоксамідів і синтез широкої низки сполук за способом, що заявляється, знайде застосування як у лабораторній, так і у виробничій практиці. Таблиця 1 Вихід реакції Температура реакції, °С Час реакції, год Спосіб, що заявляється 65-90% 18-25 0,3-0,6 Спосіб - аналог 5-39% 80 20-25 Умови реакції без каталізатора без екстракції без хроматографування без перекристалізації з каталізатором толуолсульфакислота, екстракція, хроматографування, вакуумна відгонка розчинника Таблиця 2 № Сполука за способом, Т пл., °С що заявляється Час реакВихід, % ції, хвилини Alk=CH2C6H5 1 Аr=С6Н5 180-181 65 20 177-178 85 20 178-180 85 25 176-178 90 25 162-164 85 20 177-178 87 30 Аr1=4-СН3-С6Н4 Аlk=СН3СН2 2 Аr=С6Н5 Аr1=4-СН3СН2-С6Н4 Alk=CH2C6H5 3 Аr=2-СН3-С6Н4 Ar1=C6H5 Аlk=СН3СН2 4 Аr=4-Сl-С6Н4 Аr1=С6Н5 Аlk=СН2С6Н5 5 Ar=4-CH3O-C6H4 Аr1=4-СН3СН2-С6Н4 Аlk=СН2С6Н5 6 Аr=2-СН3О-С6Н4 Аr1=4-Вr-С6Н4 Комп’ютерна верстка Л. Ціхановська Підписне Спектр 1Н ЯМР 1.76 (с, 3Н,СН3), 2.22 (с,3Н, СН3), 3.08 (д, 1Н, СН), 4.22 (д, Н, СН), 4.26 (д, Н, СН), 4.96 (д, 1Н, СН), 6.71 (с, 1H,NH),6.96-7.41 (м, 14Н, АrН), 7.76 (1Н, с, ОН), 9.28 (1Н, с, CONH). 1.09 (м, 3Н,СН3), 1.28 (м, 3Н, СН3), 1.75 (с, 3Н,СН3), 2.54 (q, 2H, СН2), 2.97 (q, 2H,SCH2),3.08 (д 1Н, СН), 4.97 (д, 1Н, СН), 6.69 (1H,c,NH), 6.99-7.48 (м, 9Н, АrН), 7.68(с, 1Н, ОН), 9.69 (с, 1Н, CONH). 1.73 (с, 3Н,СН3), 2.20 (с,3Н,СН3), 3.10 (д, 1H, СН), 4.20 (д, Н, СН), 4.24 (д, Н, СН), 4.91 (д, 1Н, СН), 6.70 (с, 1Н, NH), 6.92-7.51 (м, 14Н, АrН), 7.79 (1Н, с, ОН), 9.30 (1H, с, CONH). 1.26 (м, 3Н,СН3), 1.78 (с, 3Н, СН3), 2.95 (кв, 2Н, SCH2),3.10(д, 1H, СН), 4.97 (д, 1Н, СН), 6.80 (с, 1H,NH), 7.01-7.58 (м, 9Н, АrН), 7.80 (с, 1Н, ОН), 9.68 (с, 1H, CONH). 1.13 (м, 3Н,СН3), 1.79 (с, 3Н, СН3), 2.55 (кв, 2Н,СН2),3.25(д, 1Н, СН), 3.75 (с, 3Н, ОСН3), 4.23 (д, Н, СН), 4.29 (д, Н, СН), 4.85 (д, 1H, СН), 6.98 (с, 1H, NH), 6.76-7.51(м, 13Н, АrН), 7.74 (с, 1Н, ОН), 9.27 (с, 1Н, CONH) 1.79 (с, 3Н,СН3),3.26 (д, 1H, СН), 3.75 (с, 3Н, ОСН3), 4.23 (д, Н, СН), 4.29 (д, Н, СН), 4.88 (д, 1Н,СН), 6.81-7.52 (м, 13Н, АrН), 7.84 (с, 1Н, ОН), 9.31 (с, 1Н, CONH) Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of substituted 7-hydroxy-7-methyl-2-(alkylthio)-n,5-diaryl-4,5,6,7-tetrahydro[1,2,4]triazolo[1,5-a]pyrimidin-6-carboxamides
Автори англійськоюMuraviova Olena Oleksandrivna, Chebanov Valentyn Anatoliiovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюСпособ получения замещенных 7-гидрокси-7-метил-2-(алкилтио)n,5-диарил-4,5,6,7-тетрагидро[1,2,4]триазоло[1,5-а] пиримидин -6-карбоксамидов
Автори російськоюМуравьева Алена Александровна, Чебанов Валентин Анатолиевич, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: C07D 239/00
Мітки: спосіб, піримідин, одержання, 7-гідрокси-7-метил-2-(алкілтіо)n,5-діарил-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-a, заміщених, 6-карбоксамідів
Код посилання
<a href="https://ua.patents.su/5-50266-sposib-oderzhannya-zamishhenikh-7-gidroksi-7-metil-2-alkiltion5-diaril-4567-tetragidro124triazolo15-a-pirimidin-6-karboksamidiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання заміщених 7-гідрокси-7-метил-2-(алкілтіо)n,5-діарил-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-a] піримідин -6-карбоксамідів</a>
Попередній патент: Пиловловлювач із відбиваючими конусами
Наступний патент: Логічний елемент
Випадковий патент: Спосіб виконання пластики передньої черевної стінки при хірургічному лікуванні пацієнтів з великими післяопераційними вентральними грижами









