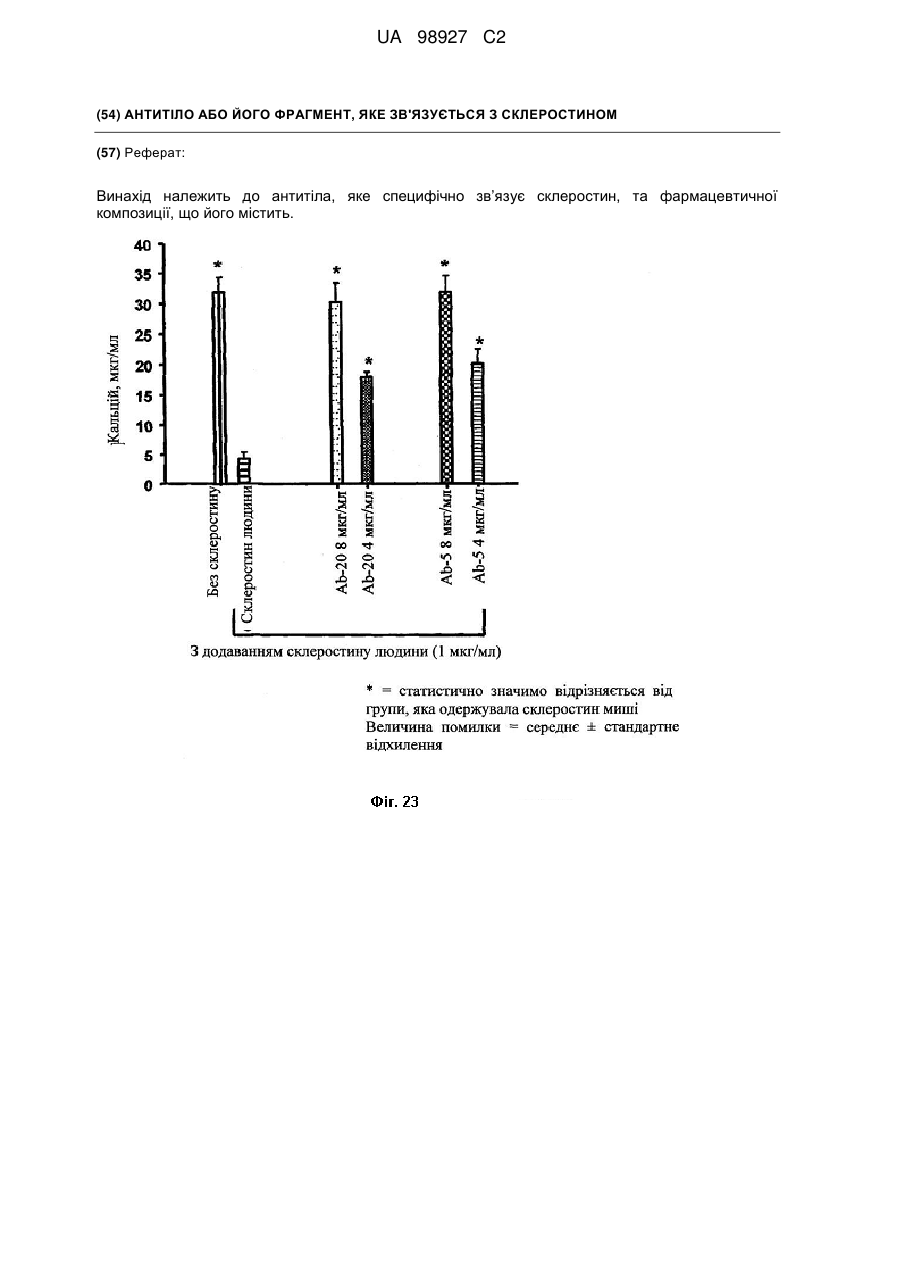
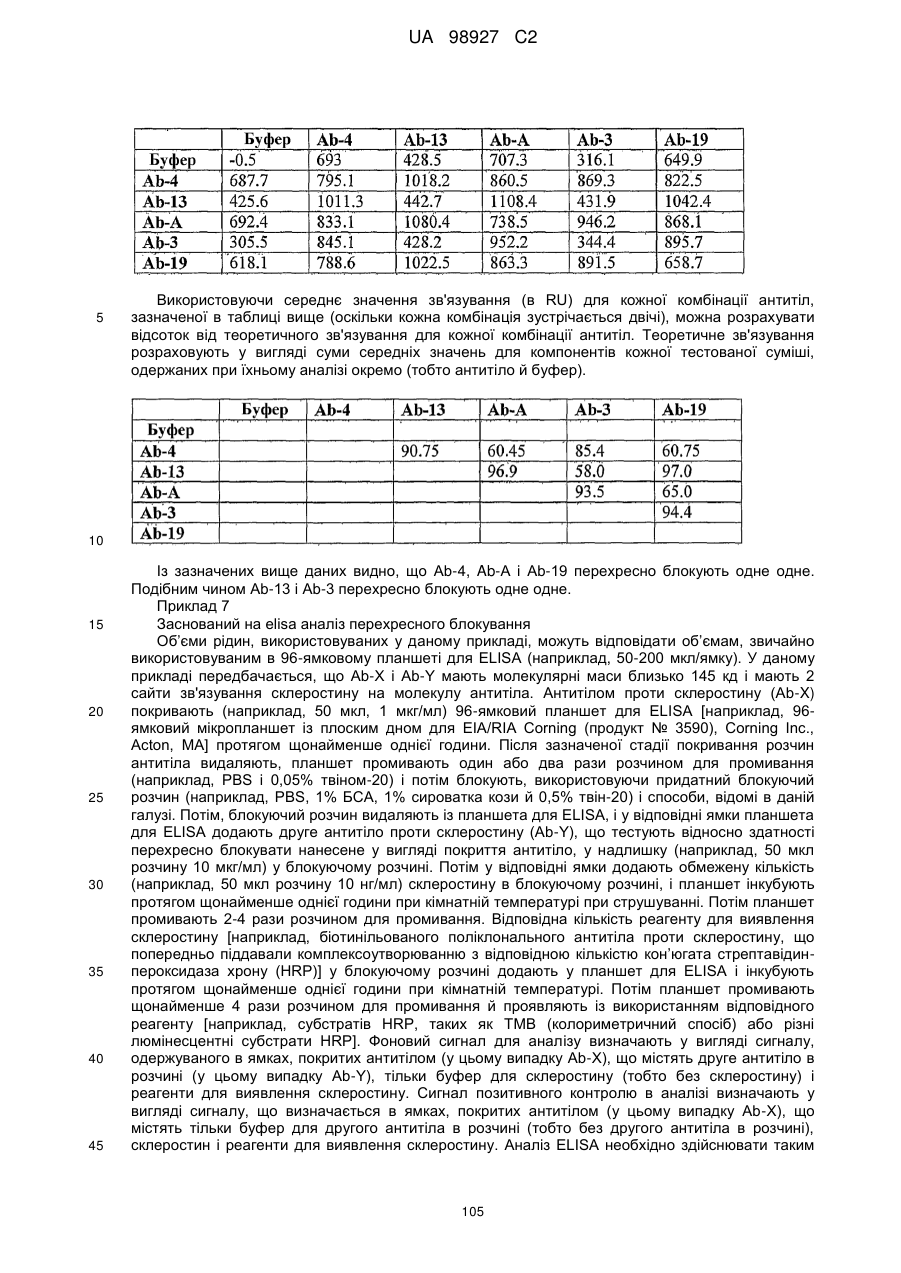
Антитіло або його фрагмент, яке зв’язується з склеростином
Номер патенту: 98927
Опубліковано: 10.07.2012
Автори: Хоффманн Келлі Сью, Поупплвелл Енді, Пашті Крістофер, Лу Сіен Сень, Уінтерс Аарон Джордж, Лоусон Еластейр, Летам Джон, Грехам Кевін, Уінклер Девід, Шен Веньян, Генрі Елістер Джеймс, Робінсон Мартін Кім
Формула / Реферат
1. Антитіло або його фрагмент, які перехресно блокують зв'язування щонайменше одного з антитіл Ab-A, Ab-1, Ab-4, Ab-5, Ab-19, Ab-20 і Ab-23 із склеростином і/або зв'язування якого з склеростином перехресно блокується щонайменше одним з антитіл Ab-A, Ab-1, Ab-4, Ab-5, Ab-19, Ab-20 і Ab-23, де
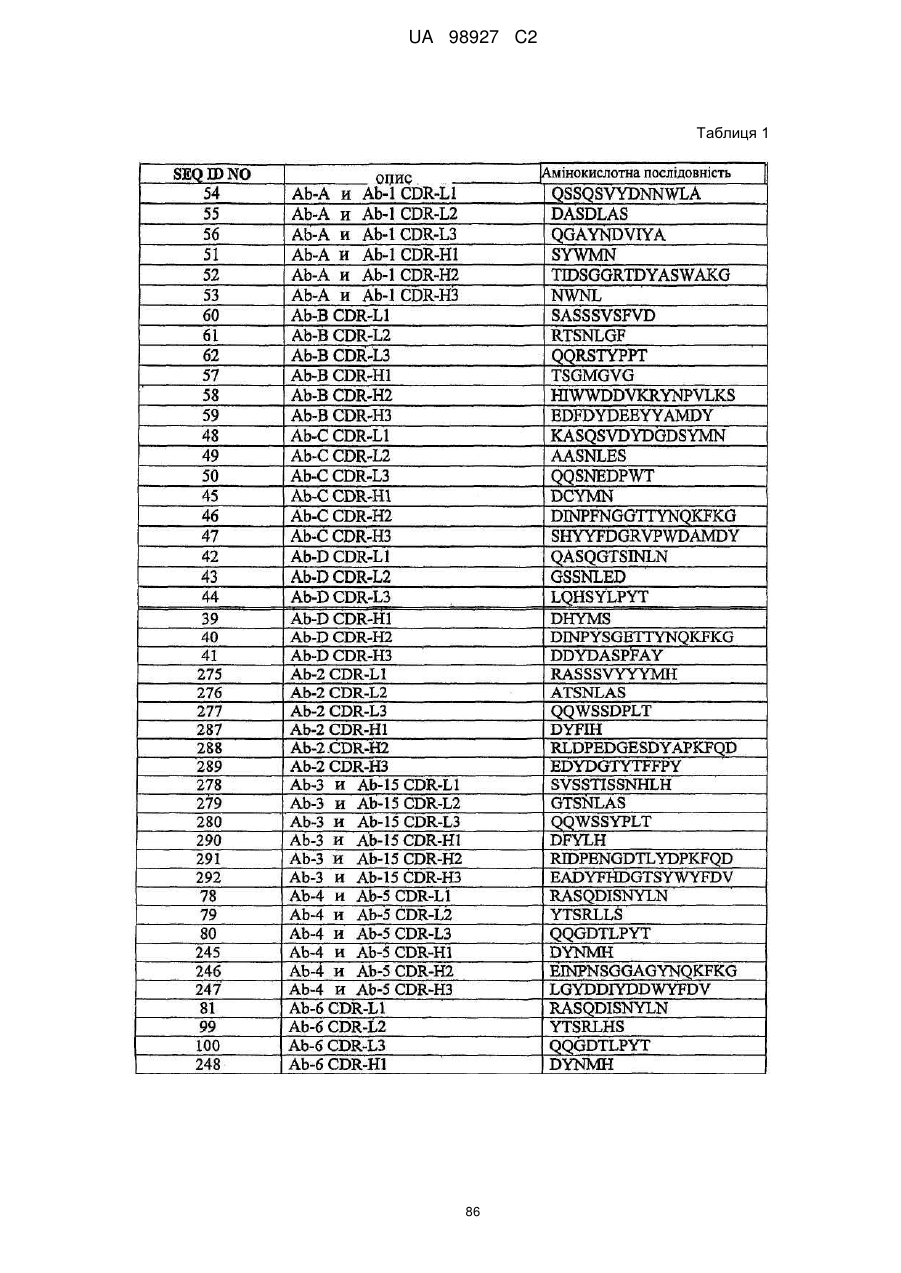
Ab-A і Ab-1 містять послідовності CDR SEQ ID NO:51-56;
Ab-4 і Ab-5 містять послідовності CDR SEQ ID NO:78-80 і 245-247; і
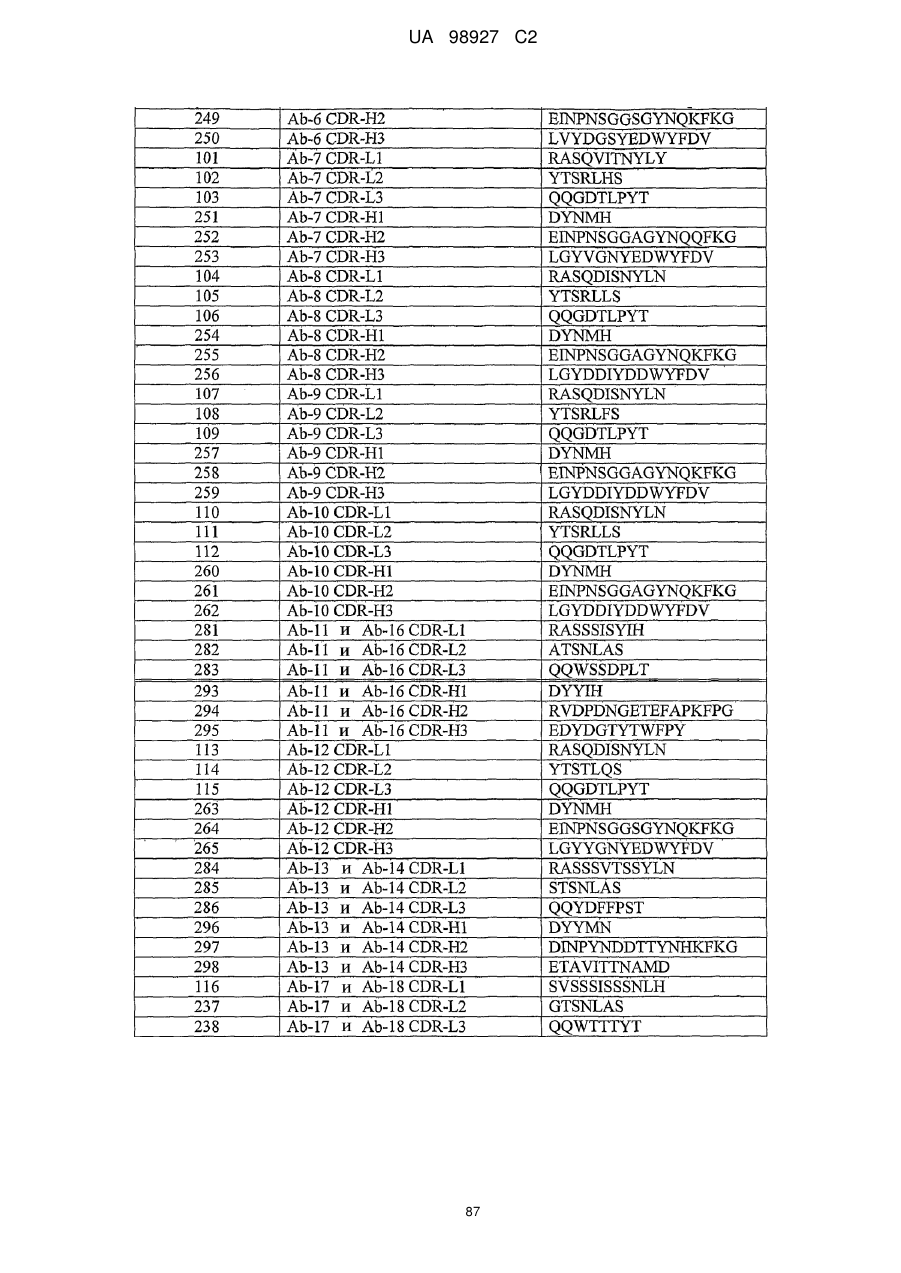
Ab-19, Ab-20 і Ab-23 містять послідовності CDR SEQ ID NO:239-241 і 269-271.
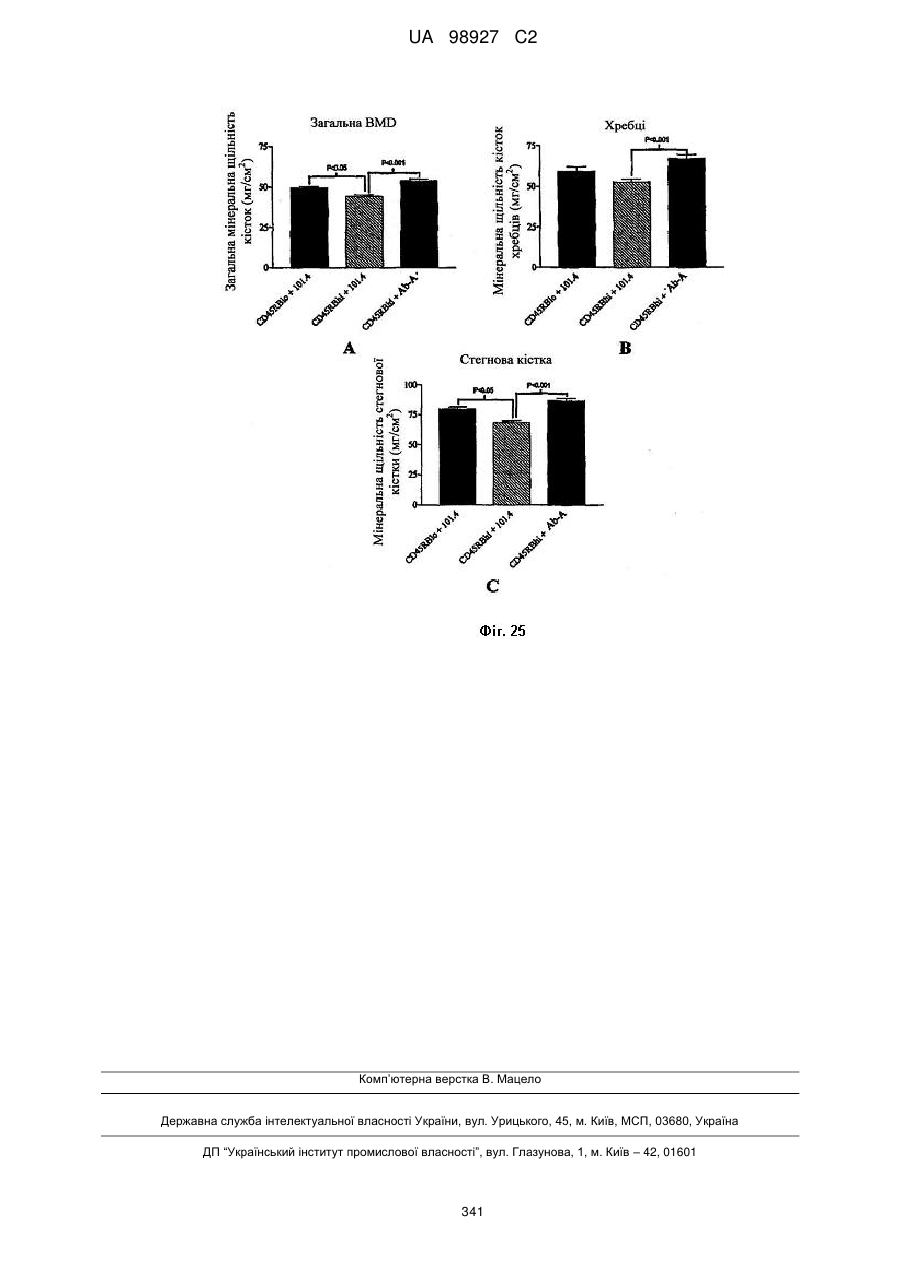
2. Антитіло або його фрагмент за п. 1, де вказане антитіло або його фрагмент може збільшувати щонайменше один з параметрів: остеогенез, мінеральну щільність кісток, вміст мінеральних речовин в кістках, кісткову масу, якість кісток і міцність кісток у ссавця і/або може блокувати інгібуючу дію склеростину в аналізі мінералізації, основаному на клітинах.
3. Антитіло або його фрагмент, що містять:
a) послідовності CDR SEQ ID NO:54, 55 і 56 і послідовності CDR SEQ ID NO:51, 52 і 53;
b) послідовності CDR SEQ ID NO:78, 79 і 80 і послідовності CDR SEQ ID NO:245, 246 і 247; або
с) послідовності CDR SEQ ID NO:239, 240 і 241 і послідовності CDR SEQ ID NO:269, 270 і 271, де антитіло або його фрагмент зв'язують склеростин SEQ ID NO:1.
4. Антитіло або його фрагмент за п. 3, що містить шість CDR, CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 і CDR-L3, де CDR-H1 являє собою SEQ ID NO:245, CDR-H2 являє собою SEQ ID NO:246, CDR-H3 являє собою SEQ ID NO:247, CDR-L1 являє собою SEQ ID NO:78, CDR-L2 являє собою SEQ ID NO:79, і CDR-L3 являє собою SEQ ID NO:80.
5. Антитіло або його фрагмент за п. 3, що містить шість CDR, CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 і CDR-L3, де CDR-H1 являє собою SEQ ID NO:269, CDR-H2 являє собою SEQ ID NO:270, CDR-H3 являє собою SEQ ID NO:271, CDR-L1 являє собою SEQ ID NO:239, CDR-L2 являє собою SEQ ID NO:240, і CDR-L3 являє собою SEQ ID NO:241.
6. Антитіло або його фрагмент за будь-яким з пунктів 1-5, які являють собою імуноглобулін, що містить важкі ланцюги і легкі ланцюги.
7. Антитіло або його фрагмент за будь-яким з пунктів 1-6, де антитіло являє собою моноклональне антитіло.
8. Антитіло або його фрагмент за будь-яким з пунктів 1-7, де антитіло являє собою химерне антитіло, гуманізоване антитіло або антитіло людини.
9. Антитіло або його фрагмент за будь-яким з пунктів 1-4, які містять фрагмент антитіла.
10. Антитіло або його фрагмент за п. 9, які містять фрагмент F (ab')2, Fab, Fab', Fv, Fc або Fd.
11. Антитіло або його фрагмент за будь-яким з пунктів 1-5, що містять важкий ланцюг, де вказаний важкий ланцюг містить поліпептид, що має щонайменше 85 % ідентичність з послідовністю, вказаною в SEQ ID NO:378; SEQ ID NO:327 або SEQ ID NO:366.
12. Антитіло або його фрагмент за будь-яким з пунктів 1-5 та 11, що містить легкий ланцюг, де вказаний легкий ланцюг містить поліпептид, що має щонайменше 85 % ідентичність з послідовністю, вказаною в SEQ ID NO:332; SEQ ID NO:376; SEQ ID NO:314 або SEQ ID NO:364.
13. Антитіло або його фрагмент за будь-яким з пунктів 1-5, що містить і важкий ланцюг, і легкий ланцюг, де
(а) важкий ланцюг містить поліпептид, що містить послідовності CDR SEQ ID NO:245-247 і, має щонайменше 85 % ідентичність з послідовністю, вказаною в SEQ ID NO:378, і легкий ланцюг містить поліпептид, що містить послідовності CDR SEQ ID NO:78-80 і має щонайменше 85 % ідентичність з послідовністю, вказаною в SEQ ID NO:376; або
(b) важкий ланцюг містить поліпептид, що містить послідовності CDR SEQ ID NO:269-271 і має щонайменше 85 % ідентичність з послідовністю, вказаною в SEQ ID NO:327, і легкий ланцюг містить поліпептид, що містить послідовності CDR SEQ ID NO:239-241 і має щонайменше 85 % ідентичність з послідовністю, вказаною в SEQ ID NO:314; або
(с) важкий ланцюг містить поліпептид, що містить послідовності CDR SEQ ID NO:269-271 і має щонайменше 85 % ідентичність з послідовністю, вказаною в SEQ ID NO:366, і легкий ланцюг містить поліпептид, що містить послідовності CDR SEQ ID NO:239-241 і має щонайменше 85 % ідентичність з послідовністю, вказаною в SEQ ID NO:364.
14. Антитіло або його фрагмент за будь-яким з пунктів 1-13, що містить константну ділянку легкого ланцюга і/або важкого ланцюга.
15. Антитіло або його фрагмент за п. 14, що містить константну ділянку IgG4 або IgG2.
16. Антитіло або його фрагмент, що містить:
(а) важкий ланцюг, що містить поліпептид, який має послідовність, вказану в SEQ ID NO:137, і легкий ланцюг, що містить поліпептид, який має послідовність, вказану в SEQ ID NO: 133;
(b) важкий ланцюг, що містить поліпептид, який має послідовність, вказану в SEQ ID NO:145 або 392, і легкий ланцюг, що містить поліпептид, який має послідовність, вказану в SEQ ID NO:141;
(с) важкий ланцюг, що містить поліпептид, який має послідовність, вказану в SEQ ID NO:335, і легкий ланцюг, що містить поліпептид, який має послідовність, вказану в SEQ ID NO:334;
(d) важкий ланцюг, що містить поліпептид, який має послідовність, вказану в SEQ ID NO:331, і легкий ланцюг, що містить поліпептид, який має послідовність, вказану в SEQ ID NO:341; або
(е) важкий ланцюг, що містить поліпептид, який має послідовність, вказану в SEQ ID NO:345 або 396, і легкий ланцюг, що містить поліпептид, який має послідовність, вказану в SEQ ID NO:341.
17. Моноклональне антитіло, що має важкий ланцюг, що містить SEQ ID NO:245, 246 і 247, і легкий ланцюг, що містить SEQ ID NO:78, 79 і 80, де антитіло зв'язує склеростин SEQ ID NO:1 з афінністю зв'язування (Kd), що менша або дорівнює 1 × 10-7 М.
18. Моноклональне антитіло за п. 17, в якому важкий ланцюг містить SEQ ID NO:378 і легкий ланцюг містить SEQ ID NO:376.
19. Моноклональне антитіло, що має важкий ланцюг, який містить SEQ ID NO:269, 270 і 271, і легкий ланцюг, який містить SEQ ID NO:239, 240 і 241, де антитіло зв'язує склеростин SEQ ID NO:1 з афінністю зв'язування (Kd), що менша або дорівнює 1 × 10-7 М.
20. Моноклональне антитіло за п. 19, в якому важкий ланцюг містить SEQ ID NO: 366 і легкий ланцюг містить SEQ ID NO:364.
21. Моноклональне антитіло за будь-яким з пунктів 17-20, де антитіло зв'язує склеростин SEQ ID NO: 1 з афінністю зв'язування (Kd), що менша або дорівнює 1 × 10-8 М.
22. Антитіло, яке має важкі ланцюги SEQ ID NO:145 або SEQ ID NO:392 і має легкі ланцюги SEQ ID NO:141.
23. Антитіло, яке має важкі ланцюги SEQ ID NO:345 або SEQ ID NO:396 і має легкі ланцюги SEQ ID NO:341.
24. Антитіло або його фрагмент за будь-яким з пунктів 1-23, які є виділеними.
25. Антитіло або його фрагмент за будь-яким з пунктів 1-23, які являють собою рекомбінантне антитіло або його фрагмент.
26. Фармацевтична композиція, яка містить антитіло або його фрагмент за будь-яким з пунктів 1-25 у комбінації з одним або декількома фармацевтично прийнятними ексципієнтами, розріджувачами або носіями.
27. Фармацевтична композиція за п. 26 для використання в поліпшенні результату лікування ссавця, що піддається одній або декільком з наступного: ортопедичній процедурі, процедурі, що проводиться на зубах, імплантаційній хірургії, заміні суглоба, кістковій пластиці, косметичній хірургії на кістках і відновленню кісток, наприклад, при зрощенні переломів, загоєнні переломів, що не зрослися, загоєнні при повільному зрощенні та при реконструкції обличчя; або в лікуванні або профілактиці щонайменше одного з наступного: ахондроплазія, ключично-черепний дизостоз, ехондроматоз, фіброзна дисплазія, хвороба Гоше, гіпофосфатемічний рахіт, синдром Марфана, множинні спадкові екзостози, нейрофіброматоз, недосконалий остеогенез, остеопетроз, остеопойкілоз, склеротичні ушкодження, псевдоартроз, піогенний остеомієліт, захворювання періодонта, індукована протиепілептичними засобами втрата кісткової маси, первинний і вторинний гіперпаратиреоїдизм, синдроми сімейного гіперпаратиреоїдизму, індукована невагомістю втрата кісткової маси, остеопороз у чоловіків, постклімактерична втрата кісткової маси, остеоартрит, нефрогенна остеодистрофія, інфільтративні захворювання кісток, втрата маси кісток ротової порожнини, остеонекроз щелепи, ювенільна форма хвороби Педжета, мелореостоз, метаболічні захворювання кісток, мастоцитоз, серпоподібноклітинна анемія/захворювання, пов'язана із трансплантацією органа втрата кісткової маси, пов'язана із трансплантацією нирки втрата кісткової маси, системний червоний вовчак, анкілозивний спондиліт, епілепсія, ураження шкіри у дітей ревматичного походження, таласемія, мукополісахаридози, хвороба Фабрі, синдром Тернера, синдром Дауна, синдром Кляйнфелтера, проказа, хвороба Пертеса, підлітковий ідіопатичний сколіоз, багатосистемне запальне захворювання у дітей, синдром Вінчестера, хвороба Менкеса, хвороба Вільсона, ішемічне захворювання кісток (таке як хвороба Легга-Кальве-Пертеса, регіонарний мігруючий остеопороз), анемічні стани, стани, викликані стероїдами, індукована глюкокортикоїдами втрата маси кісток, індукована гепарином втрата маси кісток, захворювання кісткового мозку, цинга, недостатнє харчування, дефіцит кальцію, остеопороз, остеопенія, алкоголізм, хронічне захворювання печінки, постклімактеричний стан, хронічні запальні стани, ревматоїдний артрит, запальне захворювання кишечнику, виразковий коліт, запальний коліт, хвороба Крона, олігоменорея, аменорея, вагітність, цукровий діабет, гіпертиреоїдизм, розлади щитовидної залози, розлади паратиреоїдної залози, хвороба Кушинга, акромегалія, гіпогонадизм, позбавлення рухливості або бездіяльність, синдром симпатичної рефлекторної дистрофії, регіонарний остеопороз, остеомаляція, втрата кісткової маси, пов'язана з заміною суглоба, пов'язана з ВІЛ втрата кісткової маси, втрата кісткової маси, пов'язана зі зниженням рівня гормону росту, втрата кісткової маси, пов'язана з кістозним фіброзом, пов'язана з хіміотерапією втрата кісткової маси, індукована пухлиною втрата кісткової маси, пов'язана зі злоякісною пухлиною втрата кісткової маси, втрата кісткової маси при гормональному руйнуванні, множинна мієлома, індукована лікарськими засобами втрата кісткової маси, нервова анорексія, пов'язана із захворюванням втрата маси кісток лицьової частини черепа, пов'язана із захворюванням втрата маси кісток краніальної частини черепа, пов'язана із захворюванням втрата кісткової маси щелепи, пов'язана із захворюванням втрата кісткової маси черепа, втрата кісткової маси, пов'язана зі старінням, втрата маси кісток лицьової частини черепа, пов'язана зі старінням, втрата маси кісток краніальної частини черепа, пов'язана зі старінням, втрата кісткової маси щелепи, пов'язана зі старінням, втрата маси кісток черепа, пов'язана зі старінням, і втрата кісткової маси, пов'язана з польотом у космос.
28. Поліпептид, який містить щонайменше одну з послідовностей SEQ ID NO:50, 51, 52, 53, 54, 55, 56, 78, 79, 80, 239, 240, 241, 245, 246, 247, 269, 270 і 271.
29. Поліпептид за п. 28, кон’югований щонайменше з одним з Fc, ПЕГ, альбуміну і трансферину.
Текст
Реферат: Винахід належить до антитіла, яке специфічно зв’язує склеростин, та фармацевтичної композиції, що його містить. UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Даний винахід головним чином належить до епітопів білка склеростину, включаючи білок склеростину людини, і зв’язувальних агентів (таких як антитіла), здатних зв'язуватися зі склеростином або його фрагментами. Рівень техніки Протягом життя людини спостерігаються дві або три різні фази змін кісткової маси (дивися Riggs, West J., Med. 154:63-77 (1991)). Перша фаза настає у чоловіків і жінок і триває до досягнення піка кісткової маси. Зазначена перша фаза досягається за допомогою лінійного росту хрящових ростових пластинок і радіального росту внаслідок певного ступеня стовщення надкісниці. Друга фаза починається приблизно у віці 30 років у випадку трабекулярної кістки (плоскі кістки, такі як хребці й кістки таза) і у віці приблизно 40 років у випадку трубчастої кістки (наприклад, довгих кісток, наявних у кінцівках) і триває до старості. Дана фаза характеризується повільною втратою кісткової маси й відбувається як у чоловіків, так і у жінок. У жінок також має місце третя фаза втрати кісткової маси, найбільш ймовірно внаслідок постменопаузної недостатності естрогенів. Під час зазначеної фази жінки можуть додатково втрачати кісткову масу із трубчастих кісток і із трабекулярної частини (дивися Riggs, вище). Втрата вмісту мінеральних речовин у кістках може бути викликана широкою множиною станів і може приводити до суттєвих медичних проблем. Наприклад, остеопороз є захворюванням, що підриває здоров'я людини й характеризується помітним зниженням маси й мінеральної щільності кісток кістяка, ушкодженням структури кісток, включаючи руйнування мікроархітектури кісток, і відповідним збільшенням ламкості кісток (тобто зниженням міцності кісток) і чутливості до переломів у людей, що страждають захворюванням. Остеопорозу у людей звичайно передує клінічна остеопенія (мінеральна щільність кісток, яка більше ніж на одне стандартне відхилення, але менше ніж на 2,5 стандартного відхилення нижче середнього значення для кісток дорослих молодих людей), стан, що зустрічається приблизно у 25 мільйонів людей у Сполучених Штатах Америки. У інших 7-8 мільйонів людей у США діагностований клінічний остеопороз (обумовлений як стан, при якому вміст мінеральних речовин у кістках більше ніж на 2,5 стандартного відхилення нижче, ніж у кістках дорослих молодих людей). Частота зустрічності остеопорозу в популяції людини збільшується з віком. Серед європеоїдів остеопороз переважає у жінок, які в США становлять 80% від всіх пацієнтів, хворих на остеопороз. Підвищена ламкість і чутливість до переломів кісток кістяка у людей похилого віку погіршується більш високим ризиком випадкових падінь у даній популяції. Переломи стегна, зап'ястя й хребців є найпоширенішими ушкодженнями, пов'язаними з остеопорозом. Переломи стегна, зокрема, викликають найбільший дискомфорт, і їхнє лікування є дорогим для пацієнта, а для жінок переломи стегна корелюють із високим рівнем смертності й захворюваності. Хоча остеопороз розглядають як збільшення ризику переломів внаслідок зниженої маси кісток, деякі наявні в цей час способи лікування захворювань кістяка можуть збільшувати щільність кісток у дорослих людей, і більшість доступних у цей час способів лікування головним чином діють за допомогою інгібування подальшої резорбції кісток, а не за рахунок стимуляції утворення нової кісткової тканини. У цей час призначають естроген для того, щоб сповільнити втрату кісткової маси. Однак існують деякі розбіжності в думках із приводу того, чи одержують пацієнти яку-небудь довгострокову користь, і чи робить естроген який-небудь вплив на пацієнтів старше 75 років. Крім того, вважають, що застосування естрогену збільшує ризик розвитку раку молочної залози й ендометріального раку. Для жінок у постменопаузний період також пропонували кальцитонін, остеокальцин з вітаміном K або високі дози кальцію в продуктах харчування з вітаміном D або без нього. Однак високі дози кальцію часто мають небажані побічні ефекти в шлунково-кишковому тракті, і необхідно постійно контролювати рівні кальцію в сироватці й сечі (наприклад, Khosla and Riggs, Mayo Clin. Proc. 70:978982, 1995). Інші сучасні терапевтичні способи лікування остеопорозу включають застосування TM TM TM TM біфосфонатів (наприклад, Fosamax , Actonel , Bonviva , Zometa , олпадронат, неридронат, скелід, бонефос), паратиреоїдного гормону, кальціолітиків, міметиків кальцію (наприклад, цинакальцету), статинів, анаболічних стероїдів, солей лантану й стронцію, і фториду натрію. Однак, такі терапевтичні засоби часто пов'язані з небажаними побічними ефектами (дивися Khosla and Riggs, вище). Склеростин, продукт гена SOST, відсутній при склеростеозі, захворюванні кістяка, що характеризується надмірним ростом кісток і високою щільністю кісток (Brunkow et al., Am. J. Hum. Genet., 68:577-589, 2001; Balemans et al., Hum. Mol. Genet., 10:537-543, 2001). Амінокислотна послідовність склеростину людини повідомляється в Brunkow et al., там же, і зазначена в даному описі у вигляді SEQ ID NO:1. Сутність винаходу 1 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 У даному описі розкриті композиції й способи, які можуть бути використані для збільшення щонайменше однієї ознаки: остеогенезу, мінеральної щільності кісток, вмісту мінеральних речовин у кістках, кісткової маси, якості кісток і міцності кісток, і які тому можна застосовувати для лікування широкої множини станів, при яких потрібне збільшення щонайменше однієї з ознак: остеогенезу, мінеральної щільності кісток, вмісту мінеральних речовин у кістках, кісткової маси, якості кісток і міцності кісток. Даний винахід також забезпечує інші пов'язані переваги, зазначені в даному описі. Винахід належить до областей (епітопів) склеростину людини, що упізнаються зв’язувальними агентами, описаними в даному описі, до способів застосування таких епітопів і способів одержання таких епітопів. Винахід також належить до епітопів, специфічних до області склеростину, ідентифікованої у вигляді петлі 2, і до зв’язувальних агентів, які специфічно зв'язуються з даною областю. Винахід також належить до епітопів, специфічних до області цистинового вузла склеростину, і до зв’язувальних агентів, таких як антитіла, що специфічно зв'язуються з такою областю. Винахід належить до зв’язувальних агентів, таких як антитіла, які специфічно зв'язуються зі склеростином. Зв’язувальні агенти можна характеризувати за їхньою здатністю перехресно блокувати зв'язування щонайменше одного антитіла, розкритого в даному описі, зі склеростином і/або перехресно блокуватися відносно зв'язування зі склеростином щонайменше одним антитілом, розкритим у даному описі. Антитіла й інші зв’язувальні агенти також можна охарактеризувати по картині зв'язування з пептидами склеростину людини в «аналізі конкурентного зв'язування пептидних епітопів склеростину людини», що описана в даному описі. Винахід належить до зв’язувальних агентів, таких як антитіла, які можуть збільшувати щонайменше одну з ознак: остеогенез, мінеральну щільність кісток, вміст мінеральних речовин у кістках, кісткову масу, якість кісток і міцність кісток у ссавця. Винахід належить до зв’язувальних агентів, таких як антитіла, які можуть блокувати інгібуючу дію склеростину в аналізі мінералізації, заснованому на клітинах. Винахід, крім того, належить до конструкцій поліпептидів, що містять два, три або чотири поліпептидних фрагменти, зв'язаних щонайменше одним дисульфідним зв'язком, які являють собою корову область цистинового вузла склеростину, і до антитіл, здатних специфічно зв'язуватися з ними. Винахід належить до способів одержання епітопів, що придатні для застосування як імуногени для утворення у ссавців зв’язувальних агентів, таких як антитіла, здатні специфічно зв'язуватися зі склеростином; у деяких варіантах утворені зв’язувальні агенти здатні нейтралізувати активність склеростину in vivo. Винахід належить до композиції, що викликає утворення антитіла, специфічного відносно склеростину, при введенні композиції тварині, при цьому композиція містить поліпептид, який має амінокислотну послідовність SEQ ID NO:6, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68 або SEQ ID NO:69. Винахід також належить до композиції, що викликає утворення антитіла, специфічного відносно склеростину, при введенні композиції тварині, при цьому композиція містить щонайменше один поліпептид, який по суті складається з амінокислотної послідовності SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 або SEQ ID NO:5; композиція може містити щонайменше дві або щонайменше три амінокислотні послідовності SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:5, і композиція може містити всі чотири амінокислотні послідовності SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:5. Винахід, крім того, належить до композиції, що викликає утворення антитіла, специфічного відносно склеростину, при введенні композиції тварині, при цьому композиція містить поліпептид, який має амінокислотні послідовності SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:5, у якому послідовності SEQ ID NO:2 і 4 зв'язані дисульфідним зв'язком у положеннях амінокислот 57 і 111 відносно SEQ ID NO:1, і SEQ ID NO:3 і 5 зв'язані щонайменше одним зв'язком з (a) дисульфідного зв'язку в положеннях амінокислот 82 і 142 відносно SEQ ID NO:1, і (b) дисульфідного зв'язку в положеннях амінокислот 86 і 144 відносно SEQ ID NO:1; поліпептид може зберігати третинну структуру відповідної області поліпептиду склеростину людини з послідовністю SEQ ID NO:1. Винахід також належить до поліпептиду T20.6, що по суті складається з багаторазово укороченого білка склеростину людини з послідовністю SEQ ID NO:1, у якому амінокислоти 150, 65-72, 91-100, 118-137 і 150-190 послідовності поліпептиду SEQ ID NO:1 відсутні; такий поліпептид може бути одержаний розщепленням склеростину людини трипсином, і білок може 2 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 бути виділений ВЕРХ-фракціонуванням. Винахід, крім того, належить до імуногенної частини T20.6 склеростину людини, що містить амінокислоти 51-64, 73-90, 101-117 і 138-149 послідовності SEQ ID NO:1, при цьому імуногенна частина містить щонайменше один зі зв'язків: (a) дисульфідний зв’язок між амінокислотами 57 і 111; (b) дисульфідний зв’язок між амінокислотами 82 і 142; і (c) дисульфідний зв’язок між амінокислотами 86 і 144; імуногенна частина може мати щонайменше два із зазначених дисульфідних зв'язків; і імуногенна частина може мати всі три дисульфідних зв'язки. Винахід, крім того, належить до імуногенної частини T20.6, одержаної із склеростину людини, що містить амінокислоти 57-64, 73-86, 111-117 і 138-144 послідовності SEQ ID NO:1, при цьому імуногенна частина містить щонайменше один зі зв'язків: (a) дисульфідний зв’язок між амінокислотами 57 і 111; (b) дисульфідний зв’язок між амінокислотами 82 і 142; і (c) дисульфідний зв’язок між амінокислотами 86 і 144; імуногенна частина може мати щонайменше два із зазначених дисульфідних зв'язків; і імуногенна частина може мати всі три дисульфідних зв'язки. Винахід також належить до поліпептиду, який по суті складається з білка склеростину людини з послідовністю SEQ ID NO:1, укороченою на C-кінці й N-кінці, при цьому у поліпептиді відсутні амінокислоти 1-85 і 112-190 послідовності SEQ ID NO:1. Винахід також належить до імуногенної частини склеростину людини, що містить амінокислоти 86-111 послідовності SEQ ID NO:1, при цьому імуногенна частина в основному може складатися з безперервно зв'язаних амінокислот CGPARLLPNAIGRGKWWRPSGPDFRC (SEQ ID NO:6). Винахід, крім того, належить до імуногенної частини склеростину щурів, що містить амінокислоти 92-109 послідовності SEQ ID NO:98, при цьому імуногенна частина в основному може складатися з безперервно зв'язаних амінокислот PNAIGRVKWWRPNGPDFR (SEQ ID NO:96). Винахід також належить до імуногенної частини склеростину щура, що містить амінокислоти 99-120 послідовності SEQ ID NO:98, при цьому імуногенна частина в основному може складатися з безперервно зв'язаних амінокислот KWWRPNGPDFRCIPDRYRAQRV (SEQ ID NO:97). Винахід належить до способу одержання імуногенної частини склеростину людини, який включає стадії: (a) обробки склеростину людини для одержання повного розщеплення трипсином; (b) збирання зразка після розщеплення трипсином, що має середню молекулярну масу 7122,0 дальтон (теоретична маса 7121,5 дальтон) або час утримання приблизно 20,6 хвилин, що визначається при елююванні з колонки для обернено-фазової ВЕРХ із лінійним градієнтом від 0,05% трифтороцтової кислоти до 90% ацетонітрилу в 0,05% TFA зі швидкістю потоку 0,2 мл/хв.; і (c) очищення імуногенної частини. Винахід належить до способу одержання антитіла, здатного специфічно зв'язуватися зі склеростином, який включає: (a) імунізацію тварини композицією, що містить поліпептид SEQ ID NO:6, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69, SEQ ID NO:96 або SEQ ID NO:97; (b) збирання сироватки від тварини; і (c) виділення із сироватки антитіла, здатного специфічно зв'язуватися зі склеростином. Винахід також належить до способу одержання антитіла, здатного специфічно зв'язуватися зі склеростином, який включає: (a) імунізацію тварини композицією, що містить поліпептид T20.6 або похідне T20.6; (b) збирання сироватки від тварини; і (c) виділення із сироватки антитіла, здатного специфічно зв'язуватися зі склеростином. Винахід, крім того, належить до способу виявлення антитіла проти склеростину в біологічному зразку, який включає стадії: (a) контактування біологічного зразка з поліпептидом, який по суті складається з послідовності SEQ ID NO:6, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69, SEQ ID NO:96 або SEQ ID NO:97, в умовах, що забезпечують утворення комплексу між антитілом і поліпептидом; і (b) виявлення присутності або відсутності комплексу, при цьому присутність комплексу 3 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 свідчить про те, що біологічний зразок містить антитіло проти склеростину. Винахід також належить до способу виявлення антитіла проти склеростину в біологічному зразку, який включає стадії: (a) контактування біологічного зразка з поліпептидом T20.6 або похідним T20.6 в умовах, що забезпечують утворення комплексу між антитілом і поліпептидом; і (b) виявлення присутності або відсутності комплексу, при цьому присутність комплексу свідчить, що біологічний зразок містить антитіло проти склеростину. Винахід, крім того, належить до зв’язуючого склеростин агента, такого як антитіло, що перехресно блокує зв'язування щонайменше одного з антитіл Ab-A, Ab-B, Ab-C або Ab-D з білком склеростином. Зв'язування зв’язуючого склеростин агента зі склеростином також може бути перехресно блоковане щонайменше одним з антитіл Ab-A, Ab-B, Ab-C або Ab-D. Ізольоване антитіло або його антигензв’язувальний фрагмент може бути поліклональним антитілом, моноклональним антитілом, гуманізованим антитілом, антитілом людини, химерним антитілом або тому подібним. Винахід, крім того, належить до зв’язуючого склеростин агента, такого як антитіло, зв'язування якого зі склеростином перехресно блокується щонайменше одним з антитіл Ab-A, Ab-B, Ab-C або Ab-D. Ізольоване антитіло або його антигензв’язувальний фрагмент може бути поліклональним антитілом, моноклональним антитілом, гуманізованим антитілом, антитілом людини, химерним антитілом або тому подібним. Винахід, крім того, належить до зв’язуючого склеростин агента, такого як ізольоване антитіло, що перехресно блокує зв'язування щонайменше одного з антитіл 1-24 (Ab-1-Ab-24) з білком склеростином. Зв'язування зв’язуючого склеростин агента зі склеростином також може бути перехресно блоковане щонайменше одним з антитіл 1-24 (Ab-1-Ab-24). Ізольованим антитілом або його антигензв’язувальним фрагментом може бути поліклональне антитіло, моноклональне антитіло, гуманізоване антитіло, антитіло людини або химерне антитіло. Винахід, крім того, належить до зв’язуючого склеростин агента, такого як ізольоване антитіло, зв'язування якого зі склеростином перехресно блокується щонайменше одним з антитіл 1-24 (Ab-1-Ab-24), при цьому ізольованим антитілом або його антигензв’язувальним фрагментом може бути поліклональне антитіло, моноклональне антитіло, гуманізоване антитіло, антитіло людини або химерне антитіло. Винахід, крім того, належить до зв’язувального агента, такого як ізольоване антитіло, що проявляє картину зв'язування з пептидами склеростину людини в «аналізі конкурентного зв'язування пептидних епітопів склеростину людини», подібну до картини зв'язування, що проявляється щонайменше одним з антитіл Ab-A, Ab-B, Ab-C або Ab-D, при цьому ізольованим антитілом або його антигензв’язувальним фрагментом може бути поліклональне антитіло, моноклональне антитіло, гуманізоване антитіло, антитіло людини або химерне антитіло. Винахід також належить до способу лікування захворювання кісток, пов'язаного щонайменше з одною з ознак: недостатнім остеогенезом, низькою мінеральною щільністю кісток, низьким вмістом мінеральних речовин у кістках, низкою кістковою масою, низькою якістю кісток і низкою міцністю кісток у ссавця, який включає введення суб'єктові, що потребує такого лікування, кількості зв’язувального агента проти склеростину, достатньої для збільшення щонайменше однієї з ознак: остеогенезу, мінеральної щільності кісток, вмісту мінеральних речовин у кістках, кісткової маси, якості кісток і міцності кісток, при цьому зв’язувальний проти склеростину агент включає антитіло або його зв’язуючий склеростин фрагмент. Винахід також належить до ізольованого поліпептиду склеростину або його фрагментів, при цьому поліпептид містить 6 консервативних залишків цистеїну, і його фрагменти містять від 7 до 14 амінокислот послідовності SEQ ID NO:2, від 8 до 17 амінокислот послідовності SEQ ID NO:3, від 8 до 18 залишків послідовності SEQ ID NO:4 і від 6 до 12 залишків послідовності SEQ ID NO:5; і поліпептид або його фрагменти стабілізовані дисульфідними зв'язками між послідовностями SEQ ID NO:2 і 4 і між послідовностями SEQ ID NO:3 і 5, поліпептид або фрагменти можуть містити 10-14 амінокислот послідовності SEQ ID NO:2, від 14 до 17 амінокислот послідовності SEQ ID NO:3, від 13 до 18 амінокислот послідовності SEQ ID NO:4 і від 8 до 12 залишків послідовності SEQ ID NO:5; і поліпептид або фрагменти можуть містити послідовності SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4 і SEQ ID NO:5. У даному винаході пропонуються антитіла, які специфічно зв'язуються зі склеростином людини. Антитіла характеризуються їхньою здатністю перехресно блокувати зв'язування щонайменше одного антитіла, зазначеного в даному описі, зі склеростином людини й/або характеризуються перехресним блокуванням їхнього зв'язування зі склеростином людини щонайменше одним антитілом, зазначеним у даному описі. Також пропонується ізольоване антитіло або його антигензв’язувальний фрагмент, які 4 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 можуть збільшувати щонайменше одну з ознак: остеогенез, мінеральну щільність кісток, вміст мінеральних речовин у кістках, кісткову масу, якість кісток і міцність кісток у ссавця. Також пропонується ізольоване антитіло або його антигензв’язувальний фрагмент, які можуть блокувати інгібуючу дію склеростину в аналізі мінералізації, заснованому на клітинах. Також пропонується зв’язувальний агент, такий як антитіло, що специфічно зв'язується зі склеростином людини й має щонайменше одну послідовність CDR, вибрану з SEQ ID NO:39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 78, 79, 80, 81, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 351, 352, 353, 358, 359 і 360, і їхніх варіантів, при цьому антитіло або його антигензв’язувальний фрагмент нейтралізує склеростин. Також пропонується зв’язувальний агент, такий як антитіло, що специфічно зв'язується зі склеростином людини й має щонайменше одну послідовність CDR, вибрану з SEQ ID NO:39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 78, 79, 80, 81, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274, 275, 276, 277, 278, 279, 280, 281, 282, 283, 284, 285, 286, 287, 288, 289, 290, 291, 292, 293, 294, 295, 296, 297, 298, 351, 352, 353, 358, 359 і 360, і їхніх варіантів. Також пропонуються області склеростину людини, які мають важливе значення для активності білка in vivo. Зазначені й інші аспекти даного винаходу стануть очевидними при звертанні до наступного докладного опису й прикладених креслень. Всі посилання, наведені в даному описі, включені при цьому у вигляді посилання в повному обсязі, також як у випадку, коли кожне посилання включають окремо. Короткий опис креслень На фіг. 1 зображені амінокислотні послідовності зрілої форми (після відщеплення сигнальних пептидів) легкого ланцюга (фіг. 1A) (SEQ ID NO:23) і важкого ланцюга (фіг. 1B) (SEQ ID NO:27) антитіла проти склеростину людини й проти склеростину миші Ab-A. На фіг. 2 зображені амінокислотні послідовності зрілої форми (після відщеплення сигнальних пептидів) легкого ланцюга (фіг. 2A) (SEQ ID NO:31) і важкого ланцюга (фіг. 2B) (SEQ ID NO:35) антитіла проти склеростину людини й проти склеростину миші Ab-B. На фіг. 3 зображені амінокислотні послідовності зрілої форми (після відщеплення сигнальних пептидів) легкого ланцюга (фіг. 3A) (SEQ ID NO:15) і важкого ланцюга (фіг. 3B) (SEQ ID NO:19) антитіла проти склеростину людини й проти склеростину миші Ab-C. На фіг. 4 зображені амінокислотні послідовності зрілої форми (після відщеплення сигнальних пептидів) легкого ланцюга (фіг. 4A) (SEQ ID NO:7) і важкого ланцюга (фіг. 4B) (SEQ ID NO:11) антитіла проти склеростину людини й проти склеростину миші Ab-D. На фіг. 5 показана мінеральна щільність кісток у мишей, виміряна у двох місцях кістяка (поперекові хребці й метафіз великогомілкової кістки) після 3 тижнів обробки наповнювачем, PTH (1-34), Ab-A або Ab-B. На фіг. 6 показана мінеральна щільність кісток у мишей, виміряна у двох місцях кістяка (поперекові хребці й метафіз великогомілкової кістки) після 2 тижнів обробки наповнювачем, PTH (1-34) або Ab-C. На фіг. 7 показана мінеральна щільність кісток у мишей, виміряна у двох місцях кістяка (поперекові хребці й метафіз великогомілкової кістки) після 3 тижнів обробки наповнювачем або Ab-D. На фіг. 8 зображена амінокислотна послідовність зрілої форми (після відщеплення сигнального пептиду) склеростину людини (SEQ ID NO:1). Також зображена нуклеотидна послідовність кодуючої області склеростину людини, яка кодує зрілу форму склеростину людини. Вісім цистеїнів пронумеровані від C1 до C8. Цистиновий вузол утворений трьома дисульфідними зв'язками (C1-C5; C3-C7; C4-C8). C2 і C6 також утворюють дисульфідний зв'язок, однак даний дисульфід не є частиною цистинового вузла. На фіг. 9 показана схема основної структури склеростину людини. Є N-кінцеве плече (від першого Q до C1) і C-кінцеве плече (від C8 до кінцевого Y). Між зазначеними плечима знаходиться структура цистинового вузла (утвореного трьома дисульфідами: C1-C5; C3-C7; C4C8) і три петлі, які позначені - петля 1, петля 2 і петля 3. Дистальні області петлі 1 і петлі 3 зв'язані C2-C6-дисульфідом. Зазначені потенційні сайти розщеплення трипсином (аргінін=R і 5 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 лізин=K). Зазначені деякі потенційні сайти розщеплення AspN (показані тільки залишки аспарагінової кислоти (D)). На фіг. 10 показані одержані за допомогою ВЕРХ пептидні карти склеростину людини після розщеплення або трипсином, або AspN. Показані пептиди склеростину людини, утворені при розщепленні трипсином (T19.2, T20, T20.6 і T21-22), також як пептиди склеростину людини, утворені при розщепленні AspN (AspN14.6, AspN18.6 і AspN22.7-23.5). На фіг. 11 показана інформація про послідовність і масу ізольованих зв'язаних дисульфідним зв'язком пептидів склеростину людини, утворених при розщепленні трипсином. Полож.послід. = положення в послідовності. Спост. = спостережувана. Спостережувану масу визначали в ESI-РХ-мс-аналізі. На фіг. 12 показана інформація про послідовність і масу ізольованих пептидів склеростину людини, утворених при розщепленні AspN. Пептид AspN22.7-23.5 містить 4 дисульфідних зв'язки. Полож.послід. = положення в послідовності. Спост. = спостережувана. Спостережувану масу визначали в ESI-РХ-мс-аналізі. На фіг. 13 показана лінійна схема чотирьох пептидів склеростину людини (T19.2, T20, T20.6 і T21-22), утворених при розщепленні трипсином. На фіг. 14 показана лінійна схема п'яти пептидів склеростину людини (AspN14.6, AspN18.6 і AspN22.7-23.5), утворених при розщепленні AspN. Пік ВЕРХ AspN14.6 складається із трьох пептидів, не зв'язаних дисульфідними зв'язками. На фіг. 15 показаний резонансний сигнал в одиницях (Ru) у заснованому на Biacore «аналізі конкурентного зв'язування пептидних епітопів склеростину людини». Оцінювали відносне зв'язування мАт з різними пептидами склеростину людини (у розчині) у порівнянні зі зв'язуванням мАт з інтактною зрілою формою склеростину людини (іммобілізованою на чипі Biacore). Дані показані для Ab-A. Використовували наступні пептиди склеростину людини: T19.2, T20, T20.6, T21-22, AspN14.6, AspN18.6 і AspN22.7-23.5. На фіг. 16 показаний резонансний сигнал в одиницях (Ru) у заснованому на Biacore «аналізі конкурентного зв'язування пептидних епітопів склеростину людини». Оцінювали відносне зв'язування мАт з різними пептидами склеростину людини (у розчині) у порівнянні зі зв'язуванням мАт з інтактною зрілою формою склеростину людини (іммобілізованою на чипі Biacore). Дані показані для Ab-B. Використовували наступні пептиди склеростину людини T19.2, T20, T20.6, T21-22, AspN14.6, AspN18.6 і AspN22.7-23.5. На фіг. 17 показаний резонансний сигнал в одиницях (Ru) у заснованому на Biacore «аналізі конкурентного зв'язування пептидних епітопів склеростину людини». Оцінювали відносне зв'язування мАт з різними пептидами склеростину людини (у розчині) у порівнянні зі зв'язуванням мАт з інтактною зрілою формою склеростину людини (іммобілізованою на чипі Biacore). Дані показані для Ab-C. Використовували наступні пептиди склеростину людини T19.2, T20, T20.6, T21-22, AspN14.6, AspN18.6 і AspN22.7-23.5. На фіг. 18 показаний резонансний сигнал в одиницях (Ru) у заснованому на Biacore «аналізі конкурентного зв'язування пептидних епітопів склеростину людини». Оцінювали відносне зв'язування мАт з різними пептидами склеростину людини (у розчині) у порівнянні зі зв'язуванням мАт з інтактною зрілою формою склеростину людини (іммобілізованою на чипі Biacore). Дані показані для Ab-D. Використовували наступні пептиди склеростину людини T19.2, T20, T20.6, T21-22, AspN14.6, AspN18.6 і AspN22.7-23.5. На фіг. 19 показані два зв'язуючі мАт епітопи склеростину людини. На фіг. 19A показана послідовність епітопа петлі 2 для зв'язування Ab-A і Ab-B зі склеростином людини (SEQ ID NO:6). На фіг. 19B показані послідовність, дисульфідні зв'язки й схема епітопа T20.6 для зв'язування Ab-C і Ab-D зі склеростином людини (SEQ ID NO:2-5). На фіг. 20 зображені одержані за допомогою ВЕРХ пептидні карти склеростину людини після розщеплення трипсином. На фіг. 20A показане розщеплення комплексу склеростину людини й Ab-D. На фіг. 20B показане розщеплення склеростину людини окремо. Зазначені піки пептидів T19.2, T20, T20.6 і T21-22. На фіг. 21 показані послідовність, дисульфідні зв'язки й схема епітопа «похідного 1 T20.6 (цистиновий вузол + 4 плеча)» для зв'язування Ab-D зі склеростином людини (SEQ ID NO:7073). На фіг. 22 показані результати аналізу мінералізації клітинної лінії остеобластів MC3T3-E1BF, використовуваного для ідентифікації нейтралізуючих мАт проти склеростину. Використовували склеростин миші (Sc1) у концентрації 1 мкг/мл. Моноклональні антитіла використовували в концентрації 10 і 5 мкг/мл. Кількісно оцінювали ступінь мінералізації (різні типи нерозчинного фосфату кальцію), вимірюючи рівень кальцію. На фіг. 23 зображені результати аналізу мінералізації клітинної лінії остеобластів MC3T3-E1 6 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 BF, використовуваного для ідентифікації нейтралізуючих мАт проти склеростину. Використовували склеростин людини (Sc1) у концентрації 1 мкг/мл. Моноклональні антитіла використовували в концентрації 8 і 4 мкг/мл. Кількісно оцінювали ступінь мінералізації (різні типи нерозчинного фосфату кальцію), вимірюючи рівень кальцію. На фіг. 24 показані результати аналізу мінералізації клітинної лінії остеобластів MC3T3-E1BF, використовуваного для ідентифікації нейтралізуючих мАт проти склеростину. Використовували склеростин людини (Sc1) у концентрації 1 мкг/мл. Моноклональні антитіла використовували в концентрації 10 мкг/мл. Кількісно оцінювали ступінь мінералізації (різні типи нерозчинного фосфату кальцію), вимірюючи рівень кальцію. На фіг. 25 зображені результати, одержані в моделі індукованої запаленням втрати маси кісток у мишей SCID. Обробка Ab-A захищала мишей від пов'язаної із запаленням втрати маси при коліті, яку вимірювали по загальній мінеральній щільності кісток (фіг. 25A), щільності кісткової тканини хребців (фіг. 25B) і щільності стегнової кістки (фіг. 25C). Докладний опис винаходу Дійсний винахід належить до областей білка склеростину людини, які містять епітопи, упізнавані антитілами, які також зв'язуються з повнорозмірним склеростином, і до способів одержання й застосування таких епітопів. Винахід також належить до зв’язувальних агентів (таких як антитіла), які специфічно зв'язуються зі склеростином або частинами склеростину, і до способів застосування таких зв’язувальних агентів. Зв’язувальні агенти застосовні для блокування або зменшення зв'язування склеростину людини з одним або декількома лігандами. Рекомбінантний склеростин людини/SOST комерційно доступний з R&D Systems (Minneapolis, MN, USA; 2006, № у каталозі 1406-ST-025). Крім того, комерційно доступний рекомбінантний склеростин миші/SOST з R&D Systems (Minneapolis, MN, USA; 2006, № у каталозі 1589-ST-025). Очищені для дослідження зв’язуючі склеростин моноклональні антитіла комерційно доступні з R&D Systems (Minneapolis, MN, USA; мишаче моноклональне: 2006, № у каталозі MAB1406; моноклональне щура: 2006, № у каталозі MAB1589). Патенти США №№ 6395511 і 6803453 і публікації патентів США 20040009535 і 20050106683, загалом, належать до антитіл проти склеростину. У використовуваному в даному описі розумінні мається на увазі, що термін склеростин людини включає білок з послідовністю SEQ ID NO:1 і його алельні варіанти. Склеростин може бути очищений із клітин-хазяїнів 293T, які були трансфековані геном, що кодує склеростин, за допомогою елюювання профільтрованого надосаду культуральної рідини клітин-хазяїнів на колонці з гепарином HP, використовуючи градієнт солі. Одержання й наступне очищення з використанням катіонообмінної хроматографії описані в прикладах 1 і 2. Зв’язувальні агенти відповідно до винаходу переважно являють собою антитіла, які визначені в даному описі. Термін «антитіло» належить до інтактного антитіла або його зв’язувального фрагмента. Антитіло може містити повну молекулу антитіла (включаючи варіанти у вигляді поліклонального, моноклонального, химерного, гуманізованого або антитіла людини, що має повнорозмірні важкі й/або легкі ланцюги) або може містити його антигензв’язувальний фрагмент. Фрагменти антитіл включають F(ab’) 2, Fab, Fab’, Fv, Fc і Fdфрагменти, і вони можуть бути включені в однодоменні антитіла, одноланцюгові антитіла, максіантитіла, міні-антитіла, внутрішньоклітинні антитіла, димерні антитіла, тримерні антитіла, тетрамерні антитіла, v-NAR і bis-scFv (дивися, наприклад, Hollinger and Hudson, 2005, Nature Biotechnology, 23, 9, 1126-1136). Поліпептиди антитіл також описані в патенті США № 6703199, включаючи поліпептидні моноантитіла проти фібронектину. Інші поліпептиди антитіл описані в публікації патенту США 2005/0238646, які являють собою одноланцюгові поліпептиди. Антигензв’язувальні фрагменти, одержувані з антитіла, можуть бути одержані, наприклад, протеолітичним гідролізом антитіла, наприклад, розщепленням пепсином або папаїном цілих антитіл звичайними способами. Як приклад, фрагменти антитіл можуть бути одержані ферментативним розщепленням антитіл пепсином з утворенням 5S-фрагмента, названого F(ab’)2. Зазначений фрагмент може бути додатково розщеплений з використанням відновлюючого тіол агента з одержанням моновалентних 3,5S Fab'-фрагментів. Необов'язково реакцію розщеплення можна здійснювати з використанням групи, яка блокує сульфгідрильні групи, які утворюються в результаті розщеплення дисульфідних зв'язків. Як альтернатива, ферментативне розщеплення з використанням папаїну безпосередньо дає два моновалентних Fab-фрагменти й Fc-фрагмент. Зазначені способи описані, наприклад, Goldenberg у патенті США № 4331647, Nisonoff et al., Arch. Biochem. Biophys. 89:230, 1960; Porter, Biochem. J. 73:119, 1959; Edelman et al., Methods in Enzymology 1:422 (Academic Press 1967); і Andrews, S.M. and Titus, J.A. Current Protocols in Immunology (Coligan J.E., et al., eds), John Wiley and Sons, New York (2003), сторінки 2.8.1-2.8.10 і 2.10A.1-2.10A.5. Також можна застосовувати інші способи 7 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 розщеплення антитіл, такі як розділення важких ланцюгів, з утворенням моновалентних фрагментів, що складаються з легкого й важкого ланцюгів (Fd), додаткове розщеплення фрагментів або інші ферментативні, хімічні або генетичні способи, за умови, що фрагменти зв'язуються з антигеном, який упізнається інтактним антитілом. Фрагмент антитіла також може являти собою будь-який синтетичний або генетично сконструйований білок. Наприклад, фрагменти антитіл включають ізольовані фрагменти, що складаються з варіабельної області легкого ланцюга, «Fv»-фрагменти, що складаються з варіабельних областей важкого й легкого ланцюгів, рекомбінантні одноланцюгові поліпептидні молекули, у яких варіабельні області легкого й важкого ланцюгів зв'язані пептидним лінкером (scFv-білки). Іншою формою фрагмента антитіла є пептид, що містить одну або декілька областей (CDR) антитіла, що визначають комплементарність. CDR (також називані «мінімальними одиницями упізнавання» або «гіперваріабельною областю») можуть бути одержані конструюванням полінуклеотидів, які кодують цікавлячі CDR. Такі полінуклеотиди одержують, наприклад, використовуючи полімеразну ланцюгову реакцію, щоб синтезувати варіабельну область, використовуючи мРНК із продукуючих антитіла клітин як матрицю (дивися наприклад, Larrick et al., Methods: A Companion to Methods in Enzymology 2:106, 1991; Courtenay-Luck, «Genetic Manipulation of Monoclonal Antibodies», in Monoclonal Antibodies: Production, Engineering and Clinical Application, Ritter et al. (eds.), page 166 (Cambridge University Press 1995); і Ward et al., «Genetic Manipulation and Expression of Antibodies», in Monoclonal Antibodies: Principles and Applications, Birch et al., (eds.), page 137 (Wiley-Liss, Inc. 1995)). Таким чином, в одному варіанті зв’язувальний агент містить щонайменше одну CDR, що описана в даній публікації. Зв’язувальний агент може містити щонайменше дві, три, чотири, п'ять або шість CDR, які описані в даній публікації. Зв’язувальний агент, крім того, може містити щонайменше один домен варіабельної області антитіла, зазначеного в даному описі. Домен варіабельної області може бути будь-якого розміру або мати будь-який амінокислотний склад, і, як правило, буде містити щонайменше одну послідовність CDR, яка відповідає за зв'язування зі склеростином людини, наприклад, CDR-H1, CDR-H2, CDR-H3 і/або CDR легкого ланцюга, спеціально описані в даній публікації, яка розташована поруч або в рамці зчитування з однією або декількома каркасними послідовностями. Загалом, домен варіабельної (V) області може мати будь-яку придатну структуру варіабельних доменів важкого (V H) і/або легкого (VL) ланцюга імуноглобуліну. Таким чином, наприклад, домен V-області може бути мономерним і може бути VH-доменом або VL-доменом, який здатний незалежно зв'язувати склеростин людини з -7 афінністю щонайменше рівною 1×10 M або меншою, як описано нижче. Альтернативно, домен V-області може бути димерним і може містити димери VH-VH, VH-VL або VL-VL. Димер V-області містить щонайменше один VH- і щонайменше один VL-ланцюг, які можуть бути нековалентно зв'язані (надалі називані FV). При бажанні ланцюги можуть бути ковалентно зв'язані або безпосередньо, наприклад, дисульфідним зв'язком між двома варіабельними доменами, або через лінкер, наприклад, пептидний лінкер, з утворенням одноланцюгового F v (scFV). Доменом варіабельної області може бути будь-який варіабельний домен, що зустрічається в природі, або його сконструйований варіант. Під сконструйованим варіантом мається на увазі домен варіабельної області, що був утворений з використанням методики конструювання рекомбінантної ДНК. Такі сконструйовані варіанти включають варіанти, утворені наприклад, з варіабельної області специфічного антитіла за допомогою інсерцій, делецій або замін в амінокислотних послідовностях специфічного антитіла. Конкретні приклади включають сконструйовані домени варіабельної області, що містять щонайменше одну CDR і, необов'язково, одну або кілька амінокислот каркаса з першого антитіла, і іншу частину домену варіабельної області із другого антитіла. Домен варіабельної області може бути ковалентно зв'язаний C-кінцевою амінокислотою щонайменше з одним іншим доменом антитіла або його фрагментом. Таким чином, наприклад VH-домен, який присутній у домені варіабельної області, може бути зв'язаний з доменом CH1 імуноглобуліну або його фрагментом. Подібним чином VL-домен може бути зв'язаний з C Кдоменом або його фрагментом. Таким чином, антитіло може являти собою, наприклад, Fabфрагмент, у якому антигензв’язувальний домен містить асоційовані VH- і VL-домени, ковалентно зв'язані на своїх C-кінцях з доменом CH1 і CK, відповідно. Домен CH1 може бути подовжений додатковими амінокислотами, наприклад, щоб одержати шарнірну область або частину домену шарнірної області, яка є в Fab'-фрагменті, або щоб одержати додаткові домени, такі як домени CH2 і CH3 антитіла. Як описано в даній публікації, зв'язувальні агенти містять щонайменше одну з CDR. Наприклад, одна або декілька CDR можуть бути введені у відомі каркасні області антитіл (IgG1, 8 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 IgG2 і т. д.) або кон’юговані з придатним носієм, щоб збільшити час їхнього напівжиття. Придатні носії включають без обмеження Fc, поліетиленгліколь (ПЕГ), альбумін, трансферин тощо. Зазначені й інші придатні носії відомі в даній галузі. Такі кон’юговані пептиди CDR можуть бути в мономерній, димерній, тетрамерній або іншій формі. В одному варіанті один або декілька розчинних у воді полімерів зв'язані в одному або декількох конкретних положеннях, наприклад, на амінокінці, зв'язувального агента. У деяких переважних варіантах зв’язувальний агент містить один або декілька зв'язаних розчинних у воді полімерів, включаючи без обмеження поліетиленгліколь, поліоксіетиленгліколь або поліпропіленгліколь. Дивися, наприклад патенти США №№ 4640835, 4496689, 4301144, 4670417, 4791192 і 4179337. У деяких варіантах похідний зв’язувальний агент містить один або кілька полімерів: монометоксиполіетиленгліколь, декстран, целюлозу або інші засновані на вуглеводах полімери, полі(N-вінілпіролідон)поліетиленгліколь, гомополімери пропіленгліколю, співполімер поліпропіленоксид/етиленоксид, поліоксіетильовані поліоли (наприклад, гліцерин) і полівініловий спирт, а також суміші таких полімерів. У деяких варіантах один або декілька розчинних у воді полімерів випадковим чином зв'язані з одним або декількома бічними ланцюгами. У деяких варіантах ПЕГ може діяти, поліпшуючи терапевтичну здатність зв’язувального агента, такого як антитіло. Деякі такі способи обговорюються, наприклад, у патенті США N 6133426, що включений у даний опис у вигляді посилання для будь-яких цілей. Буде зрозуміло, що зв’язувальний агент згідно з даним винаходом може мати щонайменше одну амінокислотну заміну, за умови, що зв’язувальний агент зберігає специфічність зв'язування. Таким чином, модифікації структур зв’язувальних агентів входять в обсяг винаходу. Модифікації можуть включати амінокислотні заміни, які можуть бути консервативними або неконсервативними, які не порушують здатність зв’язувального агента зв'язувати склеростин. Консервативні амінокислотні заміни можуть включати не амінокислотні залишки, що зустрічаються в природі, які звичайно вводять за допомогою хімічного синтезу пептидів, а не синтезом у біологічних системах. Вони включають пептидоміметики й інші зворотні або інвертовані форми амінокислотних залишків. Консервативна амінокислотна заміна також може включати заміну нативного амінокислотного залишку стандартним залишком, так щоб вона здійснювала невеликий вплив або не здійснювала впливу на полярність або заряд амінокислотного залишку в даному положенні. Неконсервативні заміни можуть включати заміну представником одного класу амінокислот або міметиками амінокислот представника з іншого класу з іншими фізичними властивостями (наприклад, розміром, полярністю, гідрофобністю, зарядом). Такі заміни залишків можуть бути введені в області антитіла людини, які гомологічні антитілам тварин, відмінних від людини, або в негомологічні області молекули. Крім того, фахівець у даній галузі може створити варіанти для тестування, які містять одну амінокислотну заміну в кожному необхідному положенні амінокислот. Потім варіанти можуть бути піддані скринінгу з використанням аналізів активності, відомих фахівцям у даній галузі. Такі варіанти можуть бути використані для одержання інформації про придатні варіанти. Наприклад, якщо виявлено, що заміна на конкретний амінокислотний залишок приводить до порушеної, небажано зниженої або невідповідної активності, то від варіантів з такою заміною можна відмовитися. Інакше кажучи, на підставі інформації, одержаної в результаті таких звичайних експериментів, фахівець у даній галузі легко може визначити амінокислоти, додаткових замін яких або окремо, або в комбінації з іншими мутаціями необхідно уникати. Фахівець у даній галузі може визначити придатні варіанти поліпептиду, що зазначений у даному описі, використовуючи добре відомі способи. У деяких варіантах фахівець у даній галузі може ідентифікувати придатні області молекули, які можуть бути змінені без порушення активності цілеспрямованим впливом на області, які не вважаються важливими для активності. У деяких варіантах можна ідентифікувати залишки й частини молекули, які є консервативними в подібних поліпептидах. У деяких варіантах навіть ті області, які можуть бути важливими для біологічної активності або для структури, можуть бути піддані консервативним амінокислотним замінам без порушення біологічної активності або без несприятливого впливу на структуру поліпептиду. Крім того, фахівець у даній галузі може проаналізувати дослідження структури-функції, у яких у подібних поліпептидах ідентифіковані залишки, важливі для активності або структури. На основі такого порівняння можна пророкувати значення амінокислотних залишків у білку, що відповідають амінокислотним залишкам, які мають важливе значення для активності або структури в подібних білках. Фахівець у даній галузі може вибрати хімічно подібні амінокислотні заміни для таких пророкованих важливих амінокислотних залишків. Фахівець у даній галузі також може проаналізувати тривимірну структуру й амінокислотну 9 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовність у порівнянні із тривимірною структурою подібних поліпептидів. На підставі такої інформації фахівець у даній галузі може пророкувати положення амінокислотних залишків антитіла відносно тривимірної структури. У деяких варіантах фахівець у даній галузі може виявити бажання не робити радикальних змін амінокислотних залишків, які, судячи із прогнозу, знаходяться на поверхні білка, тому що такі залишки можуть бути залучені у важливі взаємодії з іншими молекулами. Ряд наукових публікацій був присвячений пророкуванню вторинної структури. Дивися Moult J., Curr. Op. in Biotech., 7(4):422-427 (1996), Chou et al., Biochemistry, 13(2):222-245 (1974); Chou et al., Biochemistry, 113(2):211-222 (1974); Chou et al., Adv. Enzymol. Relat. Areas Mol. Biol., 47:45148 (1978); Chou et al., Ann. Rev. Biochem., 47:251-276 і Chou et al., Biophys. J., 26:367-384 (1979). Крім того, у цей час доступні комп'ютерні програми, що допомагають пророкувати вторинну структуру. Один зі способів пророкування вторинної структури заснований на моделюванні гомології. Наприклад, два поліпептиди або білка, які мають послідовність, ідентичну більше ніж на 30% або подібну більше ніж на 40%, часто мають подібну структурну топологію. Збільшення бази даних про структуру білків (PDB) у цей час забезпечило більш високу передбачуваність вторинної структури, включаючи можливу кількість вигинів у структурі поліпептиду або білка. Дивися Holm et al., Nucl. Acid. Res., 27(1):244-247 (1999). Було зроблене припущення (Brenner et al., Curr. Op. Struct. Biol., 7(3):369-376 (1997)), що існує обмежена кількість вигинів у даному поліпептиді або білку, і що після того, як буде з'ясована критична кількість структур, структурне прогнозування стане значно більш точним. Додаткові способи пророкування вторинної структури включають «протягування нитки» (Jones, D., Curr. Opin. Struct. Biol, 7(3):377-87 (1997); Sippl et al., Structure, 4(1):15-19 (1996)), «аналіз профілю» (Bowie et al., Science, 253:164-170 (1991); Gribskov et al., Meth. Enzym., 183:146-159 (1990); Gribskov et al., Proc. Nat. Acad. Sci., 84(13):4355-4358 (1987)) і «еволюційне зв'язування» (дивися Holm, вище, (1999), і Brenner, вище, (1997)). У деяких варіантах здійснення винаходу варіанти зв’язувальних агентів включають варіанти глікозилювання, у яких кількість і/або тип сайтів глікозилювання змінені в порівнянні з амінокислотними послідовностями вихідного поліпептиду. У деяких варіантах здійснення винаходу варіанти містять більшу або меншу кількість N-зв'язаних сайтів глікозилювання, ніж у нативному білці. N-зв'язаний сайт глікозилювання характеризується послідовністю: Asn-X-Ser або Asn-X-Thr, де амінокислотний залишок, позначений X, може являти собою будь-який амінокислотний залишок, за винятком проліну. Заміна амінокислотних залишків з утворенням такої послідовності створює потенційний новий сайт для додавання N-зв'язаного вуглеводного ланцюга. Альтернативно, заміни, які усувають таку послідовність, будуть видаляти існуючий Nзв'язаний вуглеводний ланцюг. Також пропонується перестановка N-зв'язаних вуглеводних ланцюгів, при якій видаляють один або декілька N-зв'язаних сайтів глікозилювання (звичайно сайтів глікозилювання, що зустрічаються в природі) і створюють один або кілька нових Nзв'язаних сайтів. Додаткові переважні варіанти антитіл включають варіанти по цистеїну, в яких один або кілька залишків цистеїну делетовані або замінені іншою амінокислотою (наприклад, серином) у порівнянні з вихідною амінокислотною послідовністю. Цистеїнові варіанти можуть бути застосовні в тому випадку, коли антитіла повинні бути піддані рефолдингу з утворенням біологічно активної конформації, наприклад, після виділення нерозчинних тілець включення. Цистеїнові варіанти, як правило, мають менше залишків цистеїну, ніж нативний білок, і звичайно мають парну кількість, щоб мінімізувати взаємодії через наявність неспарених цистеїнів. Необхідні амінокислотні заміни (або консервативні, або неконсервативні) можуть бути визначені фахівцями в даній галузі, коли такі заміни будуть потрібні. У деяких варіантах амінокислотні заміни можуть бути використані для ідентифікації важливих залишків антитіл до склеростину або для збільшення або зменшення афінності антитіл до склеростину, зазначених у даному описі. Відповідно до деяких варіантів переважними амінокислотними замінами є заміни, які: (1) зменшують чутливість до протеолізу, (2) зменшують чутливість до окислювання, (3) змінюють афінність зв'язування для утворення комплексів з білками, (4) змінюють афінності зв'язування, й/або (5) надають або модифікують інші фізико-хімічні або функціональні властивості таких поліпептидів. Відповідно до деяких варіантів одиночні або множинні амінокислотні заміни (у деяких варіантах консервативні амінокислотні заміни) можуть бути здійснені в природній послідовності (у деяких варіантах у частині поліпептиду поза домену(ів), що утворює міжмолекулярні контакти). У деяких варіантах консервативна амінокислотна заміна звичайно суттєво не змінює структурні ознаки вихідної послідовності (наприклад, заміна амінокислоти не повинна вести до руйнування спіралі, яка є у вихідній послідовності, або руйнування інших типів вторинної структури, які характерні для вихідної послідовності). Приклади відомих у даній галузі 10 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 вторинних і третинних структур поліпептидів описані в Proteins, Structures and Molecular Principles (Creighton, Ed., W. H. Freeman and Company, New York (1984)); Introduction to Protein Structure (C. Branden and J. Tooze, eds., Garland Publishing, New York, N. Y. (1991)); і Thornton et al. Nature 354:105 (1991), кожна з публікацій включена в даний опис у вигляді посилання. У деяких варіантах зв’язувальні агенти відповідно до винаходу можуть бути хімічно зв'язані з полімерами, ліпідами або іншими залишками. Зв’язувальні агенти можуть містити щонайменше одну з CDR, описаних у даній публікації, введену в біосумісну каркасну структуру. В одному прикладі біосумісна каркасна структура містить поліпептид або його частину, яка є достатньою для утворення конформаційно стабільної структурної опори або каркаса або кістяка, що здатна виводити одну або кілька послідовностей амінокислот, які зв'язуються з антигеном (наприклад, CDR, варіабельна область і т. д.), на локалізованій області поверхні. Такі структури можуть являти собою поліпептид, що зустрічається в природі, або «укладку» поліпептиду (структурний мотив) або можуть мати одну або кілька модифікацій, таких як додавання, делеції або заміни амінокислот у порівнянні із природним поліпептидом або «укладкою». Такі каркаси можуть бути одержані з поліпептиду будь-якого виду (або більше ніж одного виду), такого як людина, інший ссавець, інше хребетне, безхребетне, рослина, бактерія або вірус. Звичайно біосумісні каркасні структури засновані на каркасах або кістяках білків, відмінних від доменів імуноглобулінів. Наприклад, можна використовувати каркасні структури, засновані на фібронектині, анкірині, ліпокаліні, неокарциностатині, цитохромі b, цинковому пальці CP1, PST1, подвійній спіралі, LACI-D1, Z-домені й доменах тендрамізату (дивися, наприклад, Nygren and Uhlen, 1997, Current Opinion in Structural Biology, 7, 463-469). У переважних варіантах буде зрозуміло, що зв’язувальні агенти відповідно до винаходу включають гуманізовані антитіла, описані в даній публікації. Гуманізовані антитіла, такі як антитіла, зазначені в даному описі, можуть бути одержані з використанням способів, відомих фахівцям у даній галузі (Zhang, W., et al., Molecular Immunology. 42(12):1445-1451, 2005; Hwang W. et al., Methods, 36(l):35-42, 2005; Dall'Acqua WF, et al., Methods, 36(1):43-60, 2005; і Clark, M., Immunology Today. 21(8):397-402, 2000). Крім того, фахівцеві в даній галузі буде зрозуміло, що придатні зв’язувальні агенти включають частини зазначених антитіл, такі як одна або декілька CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 і CDR-L3, які спеціально описані в даній публікації. Щонайменше одна з областей CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 і CDR-L3 може мати щонайменше одну амінокислотну заміну, за умови, що зв’язувальний агент зберігає специфічність зв'язування CDR, що не містить замін. Частина зв’язувального агента, що не належить до CDR, може являти собою небілкову молекулу, при цьому зв’язувальний агент перехресно блокує зв'язування антитіла, розкритого в даному описі, зі склеростином і/або нейтралізує склеростин. Частина зв’язувального агента, що не належить до CDR, може являти собою небілкову молекулу, при цьому зв’язувальний агент має картину зв'язування з пептидами склеростину людини в «аналізі конкурентного зв'язування пептидних епітопів склеростину людини», подібну до картини зв'язування, що має щонайменше одне з антитіл Ab-A, Ab-B, Ab-C, Ab-D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab-6, Ab- 7, Ab-8, Ab-9, Ab-10, Ab-11, Ab-12, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-19, Ab-20, Ab-21, Ab-22, Ab-23 і Ab-24, і/або нейтралізує склеростин. Частина зв’язувального агента, що не належить до CDR, може складатися з амінокислот, при цьому зв’язувальний агент являє собою рекомбінантний зв’язувальний білок або синтетичний пептид, і рекомбінантний зв’язувальний білок перехресно блокує зв'язування антитіла, розкритого в даному описі, зі склеростином і/або нейтралізує склеростин. Частина зв’язувального агента, що не належить до CDR, може складатися з амінокислот, при цьому зв’язувальний агент являє собою рекомбінантний зв’язувальний білок, і рекомбінантний зв’язувальний білок має картину зв'язування з пептидами склеростину людини в аналізі конкурентного зв'язування пептидних епітопів склеростину людини (описаному нижче), подібну до картини зв'язування щонайменше одного з антитіл Ab-A, Ab-B, Ab-C, Ab-D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab-6, Ab-7, Ab-8, Ab-9, Ab10, Ab-11, Ab-12, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-19, Ab-20, Ab-21, Ab-22, Ab-23 і Ab-24, і/або нейтралізує склеростин. У тому випадку, коли антитіло містить одну або декілька CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 і CDR-L3, які описані вище, його можна одержати експресією в клітині-хазяїні, що містить ДНК, яка кодує зазначені послідовності. ДНК, яка кодує кожну послідовність CDR, можна визначити на основі амінокислотної послідовності CDR і синтезувати разом з будь-якими необхідними послідовностями ДНК каркаса варіабельної області антитіла й константної області, використовуючи методику синтезу олігонуклеотидів, способи сайтнаправленого мутагенезу й полімеразної ланцюгової реакції (ПЛР) у відповідних випадках. ДНК, яка кодує каркаси 11 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіабельної області й константні області, широко доступна фахівцям у даній галузі з баз даних генетичних послідовностей, таких як GenBank®. Кожна із зазначених вище CDR, як правило, буде розташована в каркасі варіабельної області в положеннях 31-35 (CDR-H1), 50-65 (CDR-H2) і 95-102 (CDR-H3) важкого ланцюга й у положеннях 24-34 (CDR-L1), 50-56 (CDR-L2) і 89-97 (CDR-L3) легкого ланцюга відповідно до системи нумерації Кабата (Kabat et al., 1987, в Sequences of Proteins of Immunological Interest, U.S. Department of Health and Human Services, NIH, USA). Після синтезу ДНК, яка кодує антитіло відповідно до винаходу або його фрагмент, може бути розмножена й експресована відповідно до кожного з множини добре відомих способів вирізання нуклеїнової кислоти, лігування, трансформації й трансфекції з використанням ряду відомих експресуючих векторів. Таким чином, у деяких варіантах експресія фрагмента антитіла може бути переважно здійснена в прокаріотичній клітині, такій як Escherichia coli (дивися, наприклад, Pluckthun et al., 1989 Methods Enzymol. 178:497-515). У деяких інших варіантах експресія антитіла або його фрагмента може бути переважно здійснена в еукаріотичній клітиніхазяїні, включаючи дріжджі (наприклад, Saccharomyces cerevisiae, Schizosaccharomyces pombe і Pichia pastoris), клітини тварин (включаючи клітини ссавців) або клітини рослин. Приклади придатних клітин тварин включають без обмеження клітини мієломи (такі як мишача лінія NSO), COS, CHO або клітини гібридоми. Приклади рослинних клітин включають клітини тютюну, кукурудзи, сої й рису. Можна одержати один або декілька експресуючих векторів, що реплікуються, які містять ДНК, що кодує варіабельну й/або константну область антитіла, і використати для трансформації придатної лінії клітин, наприклад, непродукуючої лінії клітин мієломи, такої як лінія NSO миші, або бактерій, таких як E. coli, у яких буде відбуватися продукування антитіла. Щоб одержати ефективну транскрипцію й трансляцію послідовність ДНК у кожному векторі повинна містити придатні регуляторні послідовності, зокрема промотор і лідерну послідовність, функціонально зв'язані з послідовністю варіабельного домену. Конкретні способи одержання антитіл таким чином, як правило, добре відомі й застосовуються в повсякденній практиці. Наприклад, основні nd способи молекулярної біології описані Maniatis et al. (Molecular Cloning, A Laboratory Manual, 2 rd ed., Cold Spring Harbor Laboratory, New York, 1989; дивися також Maniatis et al, 3 ed., Cold Spring Harbor Laboratory, New York, (2001)). Секвенування ДНК можна здійснити, як описано в Sanger et al. (PNAS 74:5463, (1977)) і в посібнику з секвенування Amersham International plc, і сайтнаправлений мутагенез можна здійснити відповідно до способів, відомих у даній галузі (Kramer et al., Nucleic Acids Res. 12:9441, (1984); Kunkel Proc. Natl. Acad. Sci. USA 82:488-92 (1985); Kunkel et al., Methods in Enzymol. 154:367-82 (1987); керівництво Anglian Biotechnology Ltd). Крім того, у численних публікаціях описані способи, що придатні для одержання антитіл за допомогою обробки ДНК, створення експресуючих векторів і трансформації й культивування придатних клітин (Mountain A. and Adair, J. R. в Biotechnology and Genetic Engineering Reviews (ed. Tombs, M P, 10, Chapter 1, 1992, Intercept, Andover, UK); «Current Protocols in Molecular Biology», 1999, F.M. Ausubel (ed.), Wiley Interscience, New York). У тому випадку, коли потрібно поліпшити афінність антитіл відповідно до винаходу, які містять одну або декілька із зазначених вище CDR, можна використовувати ряд протоколів дозрівання афінності, включаючи збереження CDR (Yang et al., J. Mol. Biol, 254, 392-403, 1995), перестановку ланцюгів (Marks et al., Bio/Technology, 10, 779-783, 1992), застосування мутантних штамів E.coli (Low et al., J. Mol. Biol., 250, 350-368, 1996), перетасовування ДНК (Patten et al., Curr. Opin. Biotechnol., 8, 724-733, 1997), фаговий дисплей (Thompson et al., J. Mol. Biol., 256, 788, 1996) і «статеву» ПЛР (Crameri, et al., Nature, 391, 288-291, 1998). Всі зазначені способи дозрівання афінності обговорюються Vaughan et al. (Nature Biotechnology, 16, 535-539, 1998). Інші антитіла відповідно до винаходу можуть бути одержані звичайними способами імунізації й злиття клітин, які описані в даній публікації й відомі в даній галузі. Моноклональні антитіла відповідно до винаходу можуть бути створені з використанням різних відомих способів. Загалом, моноклональні антитіла, які зв'язуються зі специфічними антигенами, можуть бути одержані способами, відомими фахівцям у даній галузі (дивися, наприклад, Kohler et al., Nature 256:495, 1975; Coligan et al. (eds.), Current Protocols in Immunology, 1:2.5.12. 6.7 (John Wiley and Sons 1991); патенти США №№ RE 32011, 4902614, 4543439 і 4411993; Monoclonal Antibodies, Hybridomas: A New Dimension in Biological Analyses, Plenum Press, Kennett, McKearn, і Bechtol (eds.) (1980); і Antibodies: A Laboratory Manual, Harlow and Lane (eds.), Cold Spring Harbor Laboratory Press (1988); Picksley et al., «Production of monoclonal antibodies against proteins nd expressed in E. coli», в DNA Cloning 2: Expression Systems, 2 Edition, Glover et al. (eds.), page 93 (Oxford University Press 1995)). З них можуть бути одержані фрагменти антитіл з використанням будь-якого придатного стандартного способу, такого як протеолітичне розщеплення, або, 12 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 необов'язково, за допомогою протеолітичного розщеплення (наприклад, з використанням папаїну або пепсину) з наступним м'яким відновленням дисульфідних зв'язків і алкілуванням. Альтернативно, такі фрагменти також можуть бути створені способами рекомбінантної генетичної інженерії, які описані в даній публікації. Моноклональні антитіла можуть бути одержані за допомогою ін'єкції тварині, наприклад щуру, хом'ячку, кролику або переважно миші, включаючи, наприклад, трансгенних або нокаутованих тварин, які відомі в даній галузі, імуногена, що містить склеростин людини з послідовністю SEQ ID NO:1 або його фрагмент, способами, відомими в даній галузі й описаними в даній публікації. Можна спостерігати наявність продукції специфічних антитіл після першої ін'єкції й/або після бустер-ін’єкції, одержуючи зразок сироватки й виявляючи присутність антитіла, що зв'язується зі склеростином людини або пептидом, з використанням кожного з декількох способів імунологічного аналізу, відомих у даній галузі й описаних у даній публікації. З організму тварин, продукуючих необхідні антитіла, витягають лімфоїдні клітини, найчастіше клітини із селезінки або лімфатичного вузла, щоб одержати B-лімфоцити. Потім B-лімфоцити зливають із сенсибілізованими лікарським засобом клітинами мієломи, що є партнерами для злиття, переважно клітинами, які є сингенними відносно імунізованої тварини і які необов'язково мають інші необхідні властивості (наприклад, не здатні експресувати ендогенні продукти генів Ig, наприклад, P3X63 - Ag 8.653 (ATCC № CRL 1580); NSO, SP20), щоб одержати гібридоми, які являють собою безсмертні лінії еукаріотичних клітин. Лімфоїдні клітини (наприклад, клітини селезінки) і клітини мієломи можна поєднувати протягом декількох хвилин з агентом, що стимулює злиття мембран, таким як поліетиленгліколь або неіоногенний детергент, і потім висівати при низькій щільності на селективне середовище, яке підтримує ріст клітин гібридоми, але не підтримує ріст незлитих клітин мієломи. Переважним селективним середовищем є середовище HAT (гіпоксантин, аміноптерин, тимідин). Після достатнього періоду часу, звичайно від одного до двох тижнів, спостерігають колонії клітин. Окремі колонії виділяють, і антитіла, продуковані клітинами, можна тестувати відносно активності зв'язування зі склеростином людини, використовуючи будь-який з множини імуноаналізів, відомих у даній галузі й описаних у даній публікації. Гібридоми клонують (наприклад, клонуванням на основі лімітуючого розведення або виділенням бляшок на м'якому агарі), і позитивні клони, які продукують антитіло, специфічне відносно склеростину, відбирають і культивують. Моноклональні антитіла з культур гібридом можуть бути виділені з надосадів культур гібридом. Альтернативний спосіб одержання мишачого моноклонального антитіла полягає в ін'єкції клітин гібридом у черевну порожнину сингенної миші, наприклад миші, що була піддана обробці (наприклад, примована пристаном), яка стимулює утворення асцитної рідини, що містить моноклональне антитіло. Моноклональні антитіла можуть бути виділені й очищені різними добре відомими способами. Такі способи виділення включають афінну хроматографію на білок A-сефарозі, ексклюзійну хроматографію по розміру й іонообмінну хроматографію (дивися, наприклад, Coligan на сторінках 2.7.1-2.7.12 і сторінках 2.9.1-2.9.3; Baines et al., «Purification of Immunoglobulin G (Ig)», в Methods in Molecular Biology, Vol. 10, pages 79-104 (The Humana Press, Inc. 1992)). Моноклональні антитіла можуть бути очищені афінною хроматографією з використанням придатного ліганду, вибраного на основі конкретних властивостей антитіла (наприклад, ізотипу важкого або легкого ланцюга, специфічності зв'язування й т. д.). Приклади придатних лігандів, іммобілізованих на твердій підкладці, включають білок A, білок G, антитіло проти константної області (легкого ланцюга або важкого ланцюга), антиідіотипічне антитіло й білок, що зв'язує TGF-бета, або їхній фрагмент або варіант. Антитіло згідно з даним винаходом також може бути моноклональним антитілом людини. Моноклональні антитіла людини можуть бути створені кожним з ряду способів, які будуть відомі фахівцям у даній галузі. Такі способи включають без обмеження трансформацію вірусом Епштейна-Барра (EBV) клітин периферичної крові людини (наприклад, що містять Bлімфоцити), імунізацію in vitro B-клітин людини, злиття клітин селезінки від імунізованих трансгенних мишей, що несуть вбудовані гени імуноглобулінів людини, виділення з фагових бібліотек V-областей імуноглобулінів людини або інших способів, які відомі в даній галузі й описані в даній публікації. Наприклад, моноклональні антитіла людини можуть бути одержані від трансгенних мишей, які були сконструйовані так, щоб одержати специфічні антитіла людини у відповідь на антигенну стимуляцію. Способи одержання антитіл людини від трансгенних мишей описані, наприклад, в Green et al., Nature Genet. 7:13, 1994; Lonberg et al., Nature 368:856, 1994; Taylor et al., Jnt. Immun. 6:579, 1994; у патенті США № 5877397; Bruggemann et al., 1997 Curr. Opin. Biotechnol. 8:455-58; Jakobovits et al., 1995 Ann. N. Y. Acad. Sci. 764:525-35. При використанні такого способу елементи локусу важкого й легкого ланцюга людини вводять у лінії мишей, одержані з ліній ембріональних стовбурових клітин, які містять цілеспрямовані 13 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 порушення ендогенних локусів важкого ланцюга й легкого ланцюга (дивися також Bruggemann et al., Curr. Opin. Biotechnol. 8:455-58 (1997)). Наприклад, трансгени імуноглобулінів людини можуть являти собою конструкції міні-генів або транслокули в штучних дріжджових хромосомах, які піддаються специфічному для B-клітин реаранжуванню й гіпермутуванню ДНК у лімфоїдній тканини мишей. Моноклональні антитіла людини можуть бути одержані імунізацією трансгенних мишей, які після цього можуть продукувати антитіла людини, специфічні для склеростину. Лімфоїдні клітини імунізованих трансгенних мишей можна використовувати для одержання секретуючих антитіла людини гідридом способами, описаними в даній публікації. Також із крові імунізованих тварин можуть бути одержані поліклональні сироватки, що містять антитіла людини. Інший спосіб створення антитіл людини відповідно до винаходу полягає в імморталізації клітин периферичної крові людини трансформацією EBV. Дивися, наприклад, патент США № 4464456. Така лінія імморталізованих B-клітин (або лінія лімфобластоїдних клітин), продукуючих моноклональне антитіло, що специфічно зв'язується зі склеростином, може бути ідентифікована способами імунологічного аналізу, які пропонуються в даному описі, наприклад ELISA, і потім виділена стандартними способами клонування. Стабільність лінії лімфобластоїдних клітин, продукуючих антитіло проти склеростину, може бути підвищена злиттям трансформованої лінії клітин з мієломою мишей з одержанням лінії гібридних клітин миша-людина відповідно до способів, відомим у даній галузі (дивися, наприклад, Glasky et al., Hybridoma 8:377-89 (1989)). Ще одним способом створення моноклональних антитіл людини є імунізація in vitro, що полягає в примуванні B-клітин селезінки людини склеростином людини з наступним злиттям примованих B-клітин з партнером для злиття, що дає гетерогібридоми. Дивися, наприклад, Boerner et al., 1991 J. Immunol. 147:86-95. У деяких варіантах відбирають B-клітину, що продукує антитіло проти склеростину людини, і з B-клітини клонують варіабельні області легкого ланцюга й важкого ланцюга способами молекулярної біології, відомими в даній галузі (WO 92/02551; патент США 5627052; Babcook et al., Proc. Natl. Acad. Sci. USA 93:7843-48 (1996)) і описаними в даній публікації. B-клітини імунізованої тварини можуть бути виділені із селезінки, лімфатичного вузла або зразка периферичної крові в результаті відбору клітин, які продукують антитіло, що специфічно зв'язується зі склеростином. B-клітини також можуть бути виділені з організму людини, наприклад, зі зразка периферичної крові. Способи виявлення окремих B-клітин, які продукують антитіло необхідної специфічності, добре відомі в даній галузі, наприклад, утворення бляшок, активоване флюоресценцією сортування клітин, стимуляція in vitro з наступною реєстрацією специфічного антитіла тощо. Способи відбору B-клітин, продукуючих специфічні антитіла, включають, наприклад, одержання суспензії окремих B-клітин у м'якому агарі, що містить склеростин людини. Зв'язування специфічного антитіла, що продукується B-клітиною, з антигеном, приводить до утворення комплексу, який може бути видимим у вигляді імунопреципітату. Після відбору B-клітин, продукуючих необхідне антитіло, гени специфічних антитіл можуть бути клоновані за допомогою виділення й ампліфікації ДНК або мРНК відповідно до способів, відомих у даній галузі й описаних у даній публікації. Іншим способом одержання антитіл відповідно до винаходу є фаговий дисплей. Дивися, наприклад, Winter et al., 1994 Annu. Rev. Immunol. 12:433-55; Burton et al., 1994 Adv. Immunol. 57:191-280. Комбінаторні бібліотеки генів варіабельних областей імуноглобулінів людини або миші можуть бути створені у фагових векторах, які можуть бути піддані скринінгу для відбору фрагментів Ig (Fab, Fv, sFv або їх мультимерів), які специфічно зв'язуються з білком, що зв'язує TGF-бета, або з його варіантом або фрагментом. Дивися наприклад патент США № 5223409; Huse et al., 1989 Science 246:1275-81; Sastry et al., Proc. Natl. Acad. Sci. USA 86:5728-32 (1989); Alting-Mees et al., Strategies in Molecular Biology 3:1-9 (1990); Kang et al., 1991 Proc. Natl Acad. Sci. USA 88:4363-66; Hoogenboom et al., 1992 J. Molec. Biol. 227:381-388; Schlebusch et al., 1997 Hybridoma 16:47-52 і посилання, цитовані в зазначених публікаціях. Наприклад, бібліотека, що містить множину полінуклеотидних послідовностей, які кодують фрагменти варіабельної області Ig, може бути вбудована в геном нитчастого бактеріофага, такого як M13 або його варіант, у рамці з послідовністю, яка кодує білок оболонки фага. Злитий білок може являти собою злиття білка оболонки з доменом варіабельної області легкого ланцюга й/або доменом варіабельної області важкого ланцюга. Відповідно до деяких варіантів Fab-фрагменти імуноглобуліну також можуть бути представлені на поверхні фагової частинки (дивися, наприклад, патент США № 5698426). Бібліотеки, експресуючі кДНК важкого й легкого ланцюга імуноглобуліну, також можуть бути TM одержані у фазі лямбда, наприклад, з використанням векторів λImmunoZap (H) і TM λImmunoZap (L) (Stratagene, La Jolla, California). Коротко, мРНК виділяють із популяції B-клітин 14 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 і використовують для створення бібліотек, експресуючих кДНК важкого й легкого ланцюгів імуноглобуліну, у векторах λImmunoZap(H) і λImmunoZap(L). Зазначені вектори можуть бути піддані скринінгу окремо або можуть бути експресовані разом з утворенням Fab-фрагментів або антитіл (дивися Huse et al., вище; дивися також Sastry et al., вище). Позитивні бляшки можуть бути потім перетворені в нелітичну плазміду, що забезпечує високий рівень експресії фрагментів моноклональних антитіл в E. coli. В одному варіанті в гібридомі варіабельні області гена, експресуючого моноклональне антитіло, що представляє інтерес, ампліфікують з використанням нуклеотидних праймерів. Зазначені праймери можуть бути синтезовані фахівцем у даній галузі або можуть бути придбані з комерційно доступних джерел (дивися, наприклад, Stratagene (La Jolla, California), які продають праймери для варіабельних областей миші й людини, включаючи поряд з іншими праймери для областей VHa, VHb, VHc, VHd, CH1, VL і CL). Зазначені праймери можуть бути використані для ампліфікації варіабельних областей важкого або легкого ланцюга, які потім TM TM можуть бути вбудовані у вектори, такі як ImmunoZAP H або ImmunoZAP L (Stratagene), відповідно. Зазначені вектори потім можуть бути введені в системи експресії, засновані на E. coli, дріжджах або ссавцях. З використанням зазначених способів можуть бути одержані більші кількості одноланцюгового білка, що містить злиття доменів VH і VL (дивися Bird et al., Science 242:423-426, 1988). Після одержання клітин, продукуючих антитіла відповідно до винаходу, з використанням кожного з описаних вище способів імунізації й інших способів гени специфічних антитіл можуть бути клоновані за допомогою виділення й ампліфікації ДНК або мРНК стандартними способами, які описані в даній публікації. Антитіла, одержувані з таких генів, можуть бути секвеновані й можуть бути ідентифіковані CDR, а ДНК, які кодують CDR, можуть бути піддані обробці, як описано раніше, щоб одержати інші антитіла відповідно до винаходу. Переважно, зв'язувальні агенти специфічно зв'язуються зі склеростином. Як і у випадку всіх інших зв’язувальних агентів і аналізів зв'язування, фахівцеві в даній галузі буде зрозуміло, що різні залишки, з якими зв’язувальний агент не повинен явно зв'язуватися, щоб бути терапевтично ефективним і придатним, важко й недоцільно перераховувати. Тому у випадку зв’язувального агента, розкритого в даному описі, термін «специфічно зв'язується» належить до здатності зв’язувального агента зв'язуватися зі склеростином, переважно склеростином людини, з більш високою афінністю, ніж він зв'язується з неспорідненим контрольним білком. Переважно, контрольним білком є лізоцим яєчного білка курей. Переважно, зв'язувальні агенти зв'язуються зі склеростином з афінністю, яка щонайменше в 50, 100, 250, 500, 1000 або 10000 разів вище, ніж афінність відносно контрольного білка. Зв’язувальний агент може мати -7 афінність зв'язування відносно склеростину людини, яка менше або дорівнює 1×10 М, менше -8 -9 -10 або дорівнює 1×10 М, менше або дорівнює 1×10 М, менше або дорівнює 1×10 М, менше -11 -12 або дорівнює 1×10 М або менше або дорівнює 1×10 М. Афінність можна визначити аналізом афінності в ELISA. У деяких варіантах афінність можна визначити в аналізі BIAcore. У деяких варіантах афінність можна визначити кінетичним способом. У деяких варіантах афінність можна визначити способом зрівноважування/розчинення. Такі способи описані більш докладно в даному описі або відомі в даній галузі. Зв'язуючі склеростин агенти згідно з даним винаходом переважно модулюють функцію склеростину в аналізі, заснованому на клітинах, описаному в даній публікації, і/або в аналізі in vivo, описаному в даній публікації, і/або зв'язуються з одним або декількома епітопами, описаними в даній публікації, і/або перехресно блокують зв'язування одного з антитіл, описаних у даній заявці, і/або їхнє зв'язування зі склеростином перехресно блокується одним з антитіл, описаних в даній заявці. Відповідно, такі зв’язувальні агенти можуть бути ідентифіковані з використанням аналізів, описаних у даній публікації. У деяких варіантах зв’язувальні агенти утворені першими ідентифікуючими антитілами, які зв'язуються з одним або декількома епітопами, пропонованими в даному описі, і/або нейтралізують у заснованих на клітинах аналізах і/або в аналізах in vivo, описаних у даній публікації, і/або перехресно блокують антитіла, описані в даній заявці, і/або їхнє зв'язування зі склеростином перехресно блокується одним з антитіл, описаних у даній заявці. CDR-області із зазначених антитіл потім використовують для вбудовування в придатні біосумісні каркаси, щоб створити зв'язуючі склеростин агенти. Частина зв’язувального агента, що не належить до CDR, може складатися з амінокислот або може являти собою небілкову молекулу. Аналізи, описані в даній публікації, дозволяють характеризувати зв’язувальні агенти. Переважно, зв'язувальні агенти згідно з даним винаходом являють собою антитіла, які визначені в даному описі. Фахівцеві в даній галузі буде зрозуміло, що деякі білки, такі як антитіла, можуть піддаватися 15 UA 98927 C2 5 10 15 різноманітним посттрансляційним модифікаціям. Тип і ступінь таких модифікацій часто залежать від лінії клітин-хазяїнів, використовуваної для експресії білка, а також від умов культивування. Такі модифікації можуть включати варіанти глікозилювання, окислювання метіоніну, утворення дикетопіперазину, ізомеризацію аспартату й дезамідування аспарагіну. Частою модифікацією є втрата основного залишку на карбоксильному кінці (такого як лізин або аргінін) у результаті дії карбоксипептидаз (які описані в Harris, R. J. Journal of Chromatography 705:129-134, 1995). Антитіла, називані Ab-A, Ab-B, Ab-C, Ab-D і Ab-1, описані нижче. «HC» належить до важкого ланцюга, і «LC» належить до легкого ланцюга. У випадку деяких зазначених нижче антитіл CDR вміщені в прямокутники, а константні (C) області показані жирним курсивом. Ab-D Антитіло D (також називане в даному описі Ab-D і Mab-D) є мишачим антитілом, що має високу афінність зв'язування зі склеростином. Картина зв'язування в аналізі BIAcore для Ab-D показана на фіг. 18. Амінокислотна послідовність зрілої форми (з вилученим сигнальним пептидом) легкого ланцюга Ab-D: Послідовність нуклеїнової кислоти, яка кодує зрілу форму (з вилученим сигнальним пептидом) LC Ab-D, показана нижче: 20 Амінокислотна послідовність LC Ab-D, включаючи сигнальний пептид, показана нижче: Послідовність нуклеїнової кислоти LC Ab-D, включаючи послідовність, яка кодує сигнальний пептид: 25 16 UA 98927 C2 Амінокислотна послідовність зрілої форми (з вилученим сигнальним пептидом) важкого ланцюга HC Ab-D показана нижче: 5 Послідовність нуклеїнової кислоти, яка кодує зрілу форму (з вилученим сигнальним пептидом) HC Ab-D: Амінокислотна послідовність Ab-D, включаючи сигнальний пептид: 17 UA 98927 C2 Послідовність нуклеїнової кислоти HC Ab-D, включаючи послідовність, яка кодує сигнальний пептид: 5 10 15 Послідовності CDR (області, що визначає комплементарність) у варіабельній області важкого ланцюга Ab-D показані нижче: CDR-H1: DHYMS (SEQ ID NO:39) CDR-H2: DINPYSGETTYNQKFKG (SEQ ID NO:40) CDR-H3: DDYDASPFAY (SEQ ID NO:41) Послідовності CDR варіабельної області легкого ланцюга Ab-D: CDR-L1: QASQGTSINLN (SEQ ID NO:42) CDR-L2: GSSNLED (SEQ ID NO:43) CDR-L3: LQHSYLPYT (SEQ ID NO:44) Ab-C Антитіло C (також називане в даному описі Ab-C і Mab-C) є мишачим антитілом, яке має високу афінність зв'язування зі склеростином. Картина зв'язування в аналізі BIAcore для Ab-C показана на фіг. 17. Амінокислотна послідовність зрілої форми (з вилученим сигнальним пептидом) легкого ланцюга Ab-C показана нижче: 18 UA 98927 C2 Послідовність нуклеїнової кислоти, яка кодує зрілу форму (з вилученим сигнальним пептидом) LC Ab-C: 5 Амінокислотна послідовність LC Ab-C, включаючи сигнальний пептид: Послідовність нуклеїнової кислоти LC Ab-C, включаючи послідовність, яка кодує сигнальний пептид: 10 Важкий ланцюг Ab-C Амінокислотна послідовність зрілої форми (з вилученим сигнальним пептидом) HC Ab-C: 19 UA 98927 C2 Послідовність нуклеїнової кислоти, яка кодує зрілу форму (з вилученим сигнальним пептидом) HC Ab-C, показана нижче: 5 Амінокислотна послідовність HC Ab-C, включаючи сигнальний пептид: Послідовність нуклеїнової кислоти HC Ab-C, включаючи послідовність, яка кодує сигнальний пептид: 20 UA 98927 C2 5 10 15 20 Послідовності CDR (області, що визначає комплементарність) у варіабельній області важкого ланцюга Ab-C показані нижче: CDR-H1: DCYMN (SEQ ID NO:45) CDR-H2: DINPFNGGTTYNQKFKG (SEQ ID NO:46) CDR-H3: SHYYFDGRVPWDAMDY (SEQ ID NO:47) Послідовності CDR варіабельної області легкого ланцюга Ab-C: CDR-L1: KASQSVDYDGDSYMN (SEQ ID NO:48) CDR-L2: AASNLES (SEQ ID NO:49) CDR-L3: QQSNEDPWT (SEQ ID NO:50) Ab-A Антитіло A (також називане в даному описі Ab-A і Mab-A) являє собою химерне антитіло кролика-миші, яке має високу афінність зв'язування зі склеростином. Картина зв'язування в аналізі BIAcore для Ab-A показана на фіг. 15. Легкий ланцюг Ab-A Амінокислотна послідовність зрілої форми (з вилученим сигнальним пептидом) LC Ab-A: Послідовність нуклеїнової кислоти, яка кодує зрілу форму (з вилученим сигнальним пептидом) LC Ab-A: 21 UA 98927 C2 Амінокислотна послідовність LC Ab-A, включаючи сигнальний пептид: 5 Послідовність нуклеїнової кислоти LC Ab-A, включаючи послідовність, яка кодує сигнальний пептид: Амінокислотна послідовність зрілої форми (з вилученим сигнальним пептидом) HC Ab-A: 10 Послідовність нуклеїнової кислоти, яка кодує зрілу форму (з вилученим сигнальним пептидом) HC Ab-A: 22 UA 98927 C2 Амінокислотна послідовність HC Ab-A, включаючи сигнальний пептид: 5 Послідовність нуклеїнової кислоти HC Ab-A, включаючи послідовність, яка кодує сигнальний пептид: 23 UA 98927 C2 5 10 Послідовності CDR (області, що визначає комплементарність) у варіабельній області важкого ланцюга Ab-A показані нижче: CDR-H1: SYWMN (SEQ ID NO:51) CDR-H2: TIDSGGRTDYASWAKG (SEQ ID NO:52) CDR-H3: NWNL (SEQ ID NO:53) Послідовності CDR варіабельної області легкого ланцюга Ab-A: CDR-L1: QSSQSVYDNNWLA (SEQ ID NO:54) CDR-L2: DASDLAS (SEQ ID NO:55) CDR-L3: QGAYNDVIYA (SEQ ID NO:56) Ab-A гуманізували, і воно назване антитілом 1 (також називаним у даному описі Ab-1), що має наступні послідовності: Послідовність нуклеїнової кислоти варіабельної області LC Ab-1, включаючи послідовність, яка кодує сигнальний пептид: 15 Амінокислотна послідовність варіабельної області LC Ab-1, включаючи сигнальний пептид: 20 Послідовність нуклеїнової кислоти варіабельної області HC Ab-1, включаючи послідовність, яка кодує сигнальний пептид: 24 UA 98927 C2 Амінокислотна послідовність варіабельної області HC Ab-1, включаючи сигнальний пептид 5 10 15 20 Послідовності CDR (області. що визначає комплементарність) у варіабельній області важкого ланцюга Ab-1 показані нижче: CDR-H1: SYWMN (SEQ ID NO:51) CDR-H2: TIDSGGRTDYASWAKG (SEQ ID NO:52) CDR-H3: NWNL (SEQ ID NO:53) Послідовності CDR варіабельної області легкого ланцюга Ab-1: CDR-L1: QSSQSVYDNNWLA (SEQ ID NO:54) CDR-L2: DASDLAS (SEQ ID NO:55) CDR-L3: QGAYNDVIYA (SEQ ID NO:56) Ab-B Антитіло B (також називане в даному описі Ab-B і Mab-B) являє собою антитіло миші, яке має високу афінність зв'язування зі склеростином. Картина зв'язування в аналізі BIAcore для AbB показана на фіг. 16. Легкий ланцюг Ab-B Амінокислотна послідовність зрілої форми (з вилученим сигнальним пептидом) LC Ab-B: Послідовність нуклеїнової кислоти, яка кодує зрілу форму (з вилученим сигнальним пептидом) LC Ab-B: Амінокислотна послідовність LC Ab-B, включаючи сигнальний пептид: 25 Послідовність нуклеїнової кислоти LC Ab-B, включаючи послідовність, яка кодує сигнальний пептид: 25 UA 98927 C2 Важкий ланцюг Ab-B Амінокислотна послідовність зрілої форми (з вилученим сигнальним пептидом) HC Ab-B: 5 Послідовність нуклеїнової кислоти, яка кодує зрілу форму (з вилученим сигнальним пептидом) HC Ab-B: 26 UA 98927 C2 Амінокислотна послідовність HC Ab-B, включаючи сигнальний пептид: 5 10 15 Послідовність нуклеїнової кислоти HC Ab-B, включаючи послідовність, яка кодує сигнальний пептид: Послідовності CDR (області, що визначає комплементарність) у варіабельній області важкого ланцюга Ab-B показані нижче: CDR-H1: TSGMGVG (SEQ ID NO:57) CDR-H2: HIWWDDVKRYNPVLKS (SEQ ID NO:58) CDR-H3: EDFDYDEEYYAMDY (SEQ ID NO:59) Послідовності CDR варіабельної області легкого ланцюга Ab-B: CDR-L1: SASSSVSFVD (SEQ ID NO:60) CDR-L2: RTSNLGF (SEQ ID NO:61) CDR-L3: QQRSTYPPT (SEQ ID NO:62). Антитіла, розкриті в даному описі, зв'язуються з областями склеростину людини, які важливі 27 UA 98927 C2 5 10 15 20 25 30 35 40 45 50 55 60 для активності білка in vivo. Зв'язування антитіла зі склеростином може корелювати, наприклад, зі збільшенням мінеральної щільності кісток, що досягається у випадку застосування антитіла in vivo, наприклад, як описано в прикладах 5 і 9 (миші) і прикладі 12 (мавпи). Збільшення щонайменше одного з показників: остеогенезу, вмісту мінеральних речовин у кістках, кісткової маси, якості кісток і міцності кісток, також може бути досягнуте у випадку застосування антитіла in vivo, наприклад як описано в прикладах 5 і 9 (миші) і прикладі 12 (мавпи). Оскільки зв'язування антитіла зі склеростином головним чином визначається послідовностями CDR, то антитіло для практичного здійснення винаходу може бути одержане з усіма або деякими з описаних послідовностей CDR у придатному каркасі, при цьому антитіло зберігає здатність специфічно зв'язуватися зі склеростином, і можна чекати, наприклад, що буде досягнуте збільшення мінеральної щільності кісток. Такі антитіла застосовні для лікування станів людини або тварини, які викликані, пов'язані або приводять щонайменше до одного з наслідків: низького остеогенезу, низької мінеральної щільності кісток, низького вмісту мінеральних речовин у кістках, низької кістковій масі, низької якості кісток і низької міцності кісток. Способи конструювання й експресії антитіл і їхніх фрагментів, що містять CDR згідно з даним винаходом, відомі фахівцям у даній галузі. Таким чином, сьогодення винахід в одному варіанті здійснення належить до ізольованого антитіла, включаючи Ab-A, або до його антигензв’язувального фрагмента, що специфічно зв'язується зі склеростином, і в якому варіабельний домен важкого ланцюга містить щонайменше одну CDR, яка має послідовності, зазначені у вигляді SEQ ID NO:51 для CDR-H1, SEQ ID NO:52 для CDR-H2 і SEQ ID NO:53 для CDR-H3. Антитіло або його антигензв’язувальний фрагмент може містити варіабельний домен важкого ланцюга, у якому CDR складаються щонайменше з одного з пептидів з послідовностями SEQ ID NO:51 для CDRH1, SEQ ID NO:52 для CDR-H2 і SEQ ID NO:53 для CDR-H3. У тому випадку, коли в антитілах відповідно до винаходу є присутнім легкий ланцюг, легкий ланцюг може являти собою будь-який придатний комплементарний ланцюг і зокрема може бути вибраний з легкого ланцюга, у якому варіабельний домен містить щонайменше одну CDR, що має послідовності, наведені у вигляді SEQ ID NO:54 для CDR-L1, SEQ ID NO:55 для CDR-L2 і SEQ ID NO:56 для CDR-L3. Антитіло або його антигензв’язувальний фрагмент може містити варіабельний домен легкого ланцюга, у якому CDR складаються щонайменше з одного з пептидів з послідовностями SEQ ID NO:54 для CDR-L1, SEQ ID NO:55 для CDR-L2 і SEQ ID NO:56 для CDR-L3. Даний винахід, крім того, належить до ізольованого антитіла, включаючи Ab-B, або до його антигензв’язувального фрагмента, що специфічно зв'язується зі склеростином і в якому варіабельний домен важкого ланцюга містить щонайменше одну CDR, що має послідовності, зазначені у вигляді SEQ ID NO:57 для CDR-H1, SEQ ID NO:58 для CDR-H2 і SEQ ID NO:59 для CDR-H3. Антитіло або його антигензв’язувальний фрагмент може містити варіабельний домен важкого ланцюга, у якому CDR складаються щонайменше з одного з пептидів з послідовностями SEQ ID NO:57 для CDR-H1, SEQ ID NO:58 для CDR-H2 і SEQ ID NO:59 для CDR-H3. У тому випадку, коли в антитілах відповідно до винаходу є присутнім легкий ланцюг, легкий ланцюг може являти собою придатний комплементарний ланцюг і зокрема може бути вибраний з легкого ланцюга, у якому варіабельний домен містить щонайменше одну CDR, що має послідовності, зазначені у вигляді SEQ ID NO:60 для CDR-L1, SEQ ID NO:61 для CDR-L2 і SEQ ID NO:62 для CDR-L3. Антитіло або його антигензв’язувальний фрагмент може містити варіабельний домен легкого ланцюга, у якому CDR складаються щонайменше з одного з пептидів з послідовностями SEQ ID NO:60 для CDR-L1, SEQ ID NO:61 для CDR-L2 і SEQ ID NO:62 для CDR-L3. Даний винахід також належить до ізольованого антитіла, включаючи Ab-C, або до його антигензв’язувального фрагмента, що специфічно зв'язується зі склеростином і в якому варіабельний домен важкого ланцюга містить щонайменше одну CDR, що має послідовності, зазначені у вигляді SEQ ID NO:45 для CDR-H1, SEQ ID NO:46 для CDR-H2 і SEQ ID NO:47 для CDR-H3. Антитіло або його антигензв’язувальний фрагмент може містити варіабельний домен важкого ланцюга, у якому CDR складаються щонайменше з одного з пептидів з послідовностями SEQ ID NO:45 для CDR-H1, SEQ ID NO:46 для CDR-H2 і SEQ ID NO:47 для CDR-H3. У тому випадку, коли в антитілах відповідно до винаходу є присутнім легкий ланцюг, легкий ланцюг може являти собою будь-який придатний комплементарний ланцюг і зокрема може бути вибраний з легкого ланцюга, у якому варіабельний домен містить щонайменше одну CDR, що має послідовності, зазначені у вигляді SEQ ID NO:48 для CDR-L1, SEQ ID NO:49 для CDR-L2 і 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSclerostin binding antibody or fragment thereof
Автори англійськоюPASZTY, Christopher, Robinson, Martyn Kim, Graham Kevin, Henry Alistair James, Hoffmann Kelly Sue, Latham John, Lawson Alastair, Lu Hsieng Sen, Popplewell Andy, Shen, Wenyan, Winkler David, Winters Aaron George.
Назва патенту російськоюАнтитело или его фрагмент, которое связывается со склеростином
Автори російськоюПашти Кристофер, Робинсон Мартин Ким, Грехам Кевин, Генри Элистер Джеймс, Хоффманн Келли Сью, Летам Джон, Лоусон Еластейр, Лу Сиен Сень, Поупплвелл Энди, Шень Веньянь, Уинклер Девид, Уинтерс Аарон Джордж
МПК / Мітки
МПК: C07K 16/46, A61K 39/395, C07K 16/18, C07K 14/51, C12N 15/13
Мітки: антитіло, фрагмент, яке, зв'язується, склеростином
Код посилання
<a href="https://ua.patents.su/343-98927-antitilo-abo-jjogo-fragment-yake-zvyazuehtsya-z-sklerostinom.html" target="_blank" rel="follow" title="База патентів України">Антитіло або його фрагмент, яке зв’язується з склеростином</a>
Попередній патент: Інгібітор мітотичних кінезинів та його використання
Наступний патент: 1,4-дигідропіридинконденсовані гетероцикли, спосіб їх одержання, застосування і композиція, що містить їх
Випадковий патент: Спосіб виробництва сталевого листа з zn-al покриттям і з оптимізованою чистовою обробкою, відповідний сталевий лист, деталь і автотранспортний засіб