Тверді форми n-((s)-2,3-дигідроксипропіл)-3-(2-фтор-4-йодфеніламіно)-ізонікотинаміду
Номер патенту: 112899
Опубліковано: 10.11.2016
Автори: Пома Марко, Кюн Клеменс, Бенкстон Дональд, Заль Крістоф, Беккер Аксель
Формула / Реферат
1. Тверда форма N-((S)-2,3-дигідроксипропіл)-3-(2-фтор-4-йодфеніламіно)-ізонікотинаміду або її фармацевтично прийнятні солі.
2. Тверда форма відповідно до пункту 1, у якій тверда форма або її фармацевтично прийнятна сіль являє собою кристалічну форму.
3. Тверда форма відповідно до пункту 2, у якій фармацевтично прийнятна сіль являє собою моногідрохлорид.
4. Тверда форма відповідно до пункту 2, яка являє собою вільну основу N-((S)-2,3-дигідроксипропіл)-3-(2-фтор-4-йодфеніламіно)-ізонікотинаміду.
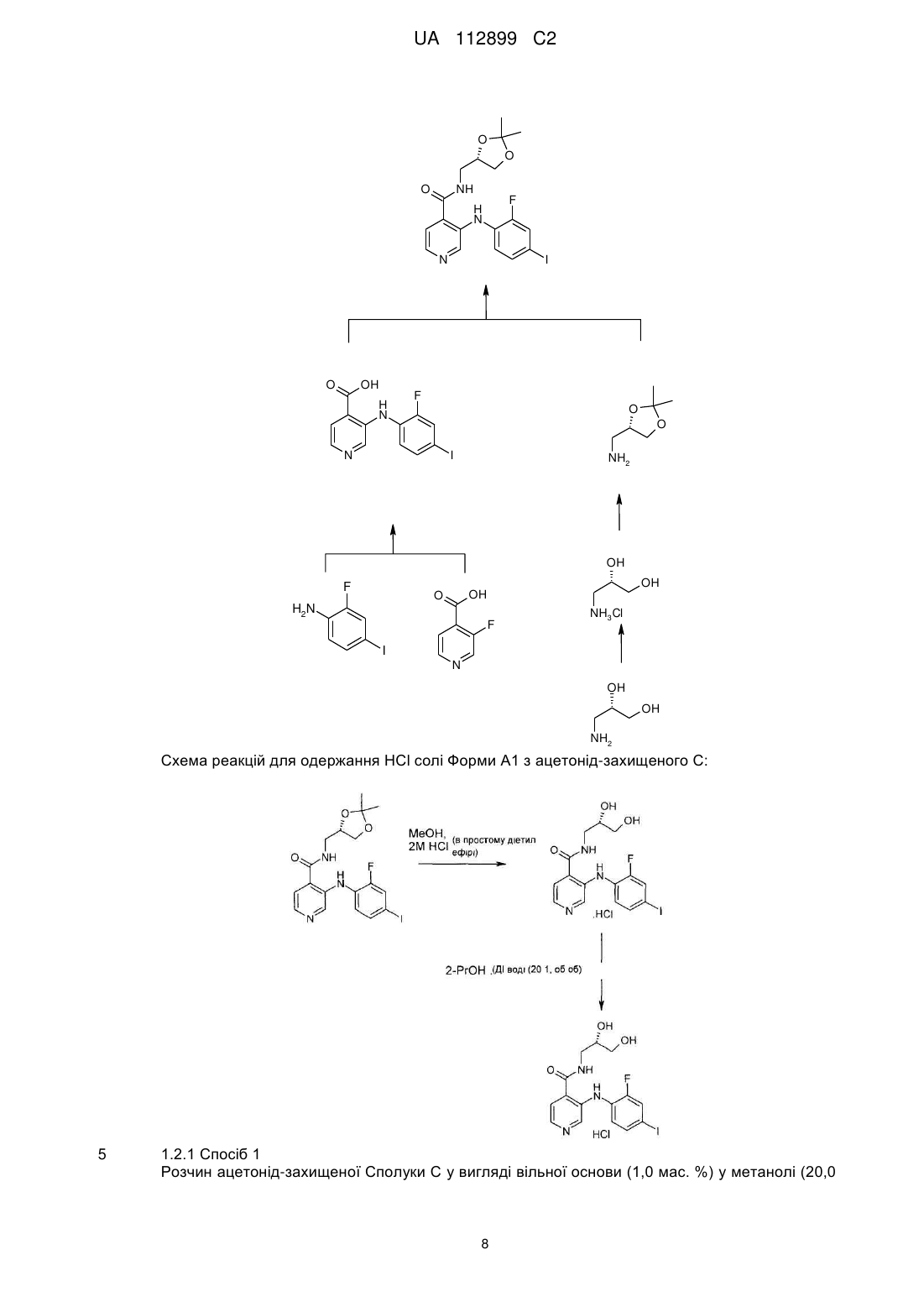
5. Тверда форма А1 відповідно до пункту 3, яка має характерні Сu-Ka1 рентгенівські піки при кутах 2θ, що відповідають 5,5±0,2, 16,8±0,2, 18,5±0,2, 19,1±0,2, 22,6±0,2, 23,0±0,2, 24,9±0,2, 25,2±0,2, 28,4±0,2, 29,2±0,2 градуса.
6. Тверда форма А1 відповідно до пункту 3, яка має характерні Сu-Ka1 рентгенівські піки при кутах 2θ, що відповідають одному або декільком наступних переліків піків:
a) 5,5±0,2, 16,8±0,2, 19,5±0,2, 23,0±0,2 градуса;
b) 5,5±0,2, 18,5±0,2, 19,1±0,2, 28,4±0,2, 29,6±0,2 градуса;
c) 15,9±0,2, 19,1±0,2, 24,9±0,2 градуса.
7. Тверда форма А1 відповідно до пункту 3, яка має групу симетрії кристалічної решітки Р21 з параметрами кристалічної решітки: а=9,6±0,1 Å, b=11,2±0,1 Å, с=16,6±0,1 Å і b=104,4±0,5° (a=g=90°), які виміряні при 301 K.
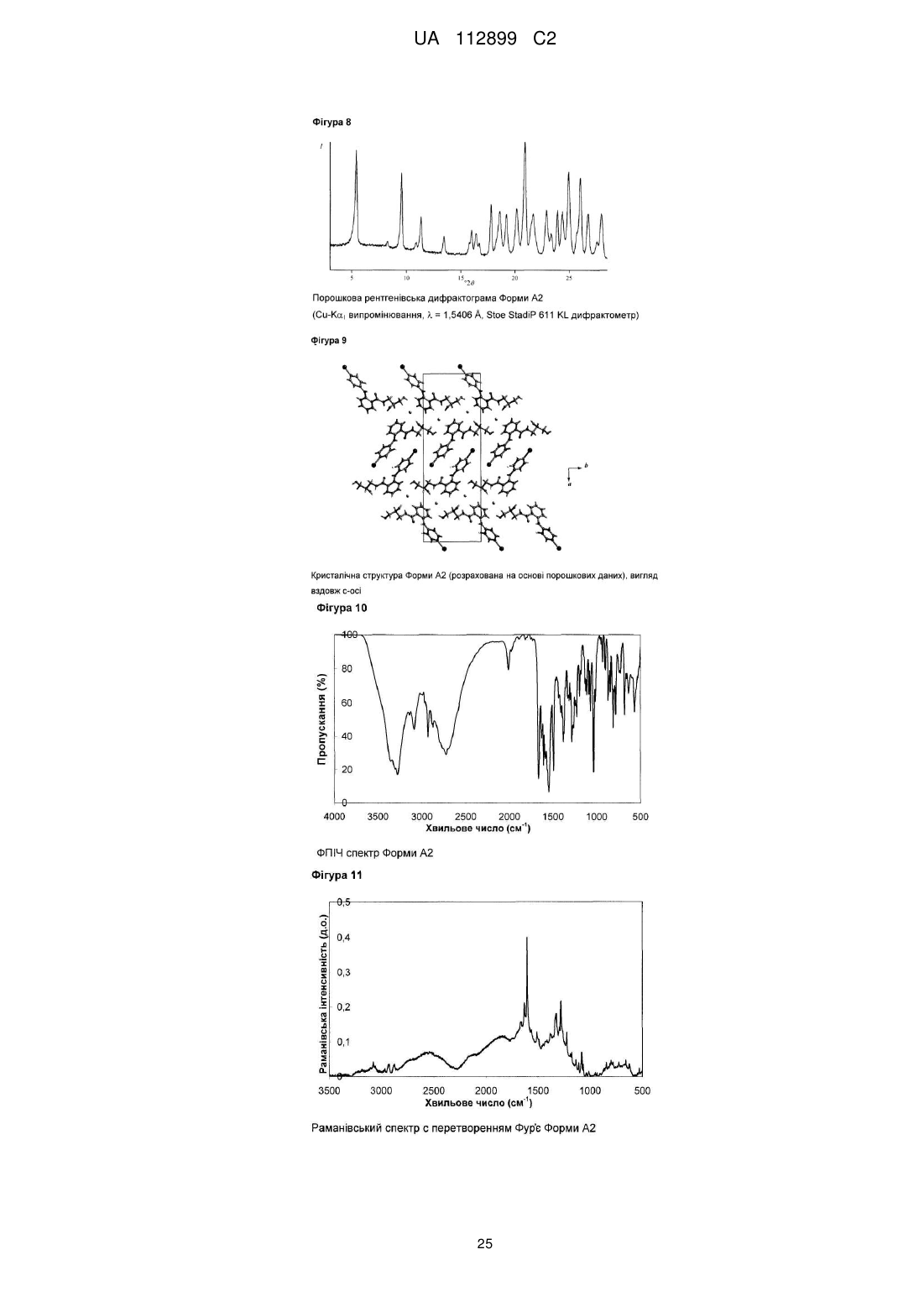
8. Тверда форма А2 відповідно до пункту 3, яка має характерні Сu-Ka1 рентгенівські піки при кутах 2q, що відповідають 5,4±0,2, 9,6±0,2, 18,4±0,2, 18,6±0,2, 20,9±0,2, 21,6±0,2, 23,9±0,2, 24,4±0,2, 25,0±0,2, 26,0±0,2 градуса.
9. Тверда форма A2 відповідно до пункту 3, яка має характерні Сu-Ka1 рентгенівські піки при кутах 2q, що відповідають одному або декільком наступних переліків піків:
a) 18,4±0,2, 18,6±0,2, 19,2±0,2, 20,2±0,2, 21,6±0,2 градуса;
b) 9,6±0,2, 11,3±0,2, 17,8±0,2, 23,9±0,2, 25,0±0,2 градуса.
10. Тверда форма А2 відповідно до пункту 3, яка має групу симетрії кристалічної решітки Р21212 з параметрами кристалічної решітки: а=32,3±0,1 Å, b=11,2±0,1 Å, с=4,8±0,1 Å, з a=b=g=90, які виміряні при 301 K.
11. Тверда форма В1 відповідно до пункту 4, яка має характерні Сu-Ka1 рентгенівські піки при кутах 2q, що відповідають 7,0±0,2, 14,0±0,2, 18,3±0,2, 19,0±0,2, 20,6±0,2, 21,2±0,2, 24,2±0,2, 25,1±0,2, 25,4±0,2, 27,9±0,2 градуса.
12. Тверда форма В1 відповідно до пункту 4, яка має групу симетрії кристалічної решітки Р21212 з параметрами кристалічної решітки: а=20,8±0,1 Å, b=15,7±0,1 Å, с=5,0±0,1 Å (a=b=g=90°), які виміряні при 301 K.
13. Тверда форма В2 відповідно до пункту 4, яка має характерні Сu-Ka1 рентгенівські піки при кутах 2q, що відповідають 8,7±0,2, 15,9±0,2, 17,4±0,2, 18,2±0,2, 18,8±0,2, 19,2±0,2, 21,3±0,2, 22,3±0,2, 23,3±0,2, 26,0±0,2 градуса.
14. Тверда форма В2 відповідно до пункту 4, яка має групу симетрії кристалічної решітки Р1 з параметрами кристалічної решітки: а=11,7±0,1 Å, b=15,7±0,1 Å, с=4,8±0,1 Å, a=92,2±0,5, b=101,3±0,5, g=102,9±0,5, які виміряні при 301 K.
15. Тверда форма відповідно до одного або декількох пунктів 1-14 як лікарський засіб.
16. Тверда форма відповідно до одного або декількох пунктів 1-14 для застосування для лікування злоякісного новоутворення.
17. Фармацевтична композиція, яка включає тверду форму відповідно до одного або декількох пунктів 1-14 як активний компонент разом із принаймні одним фармацевтично прийнятним носієм.
Текст
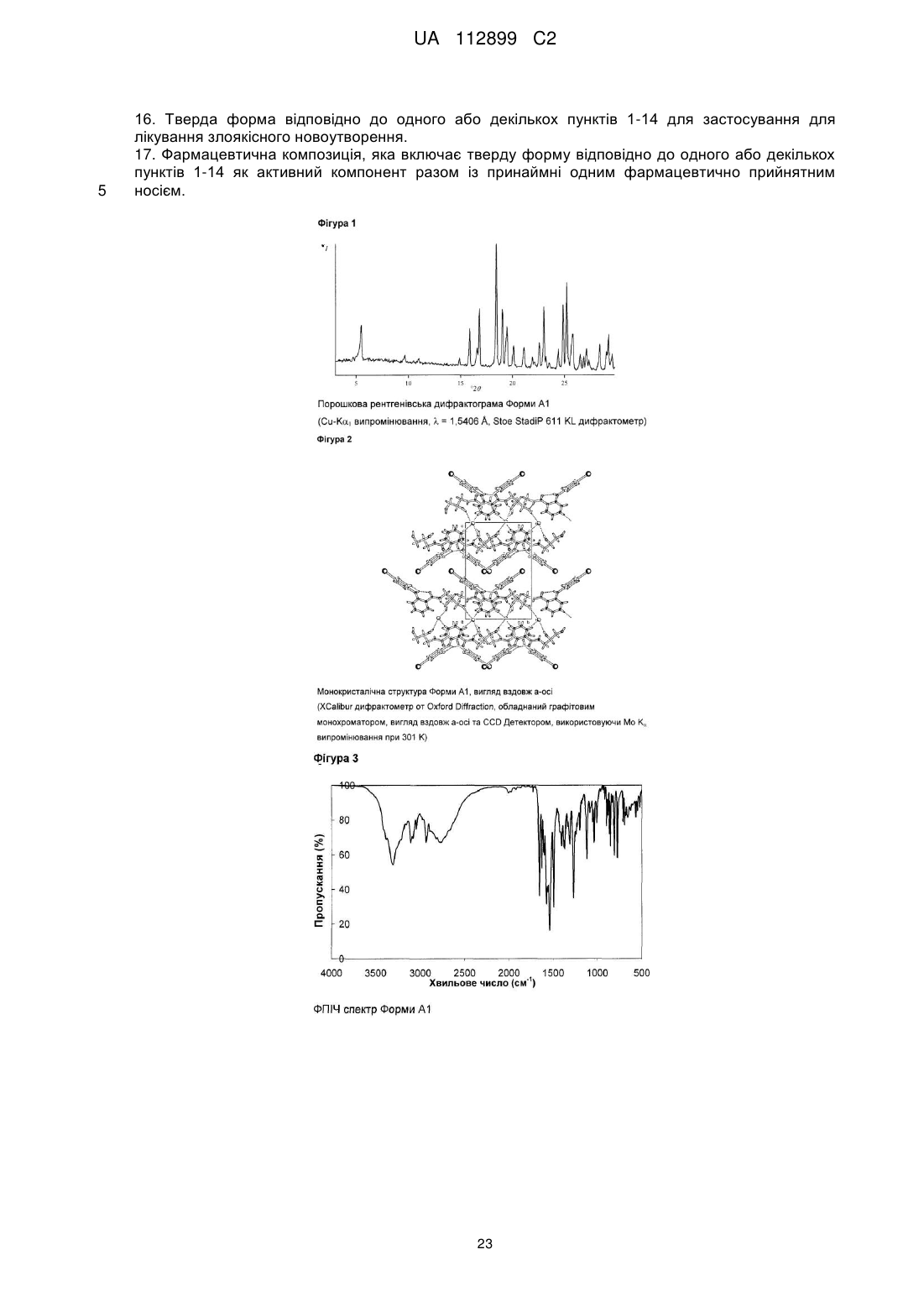
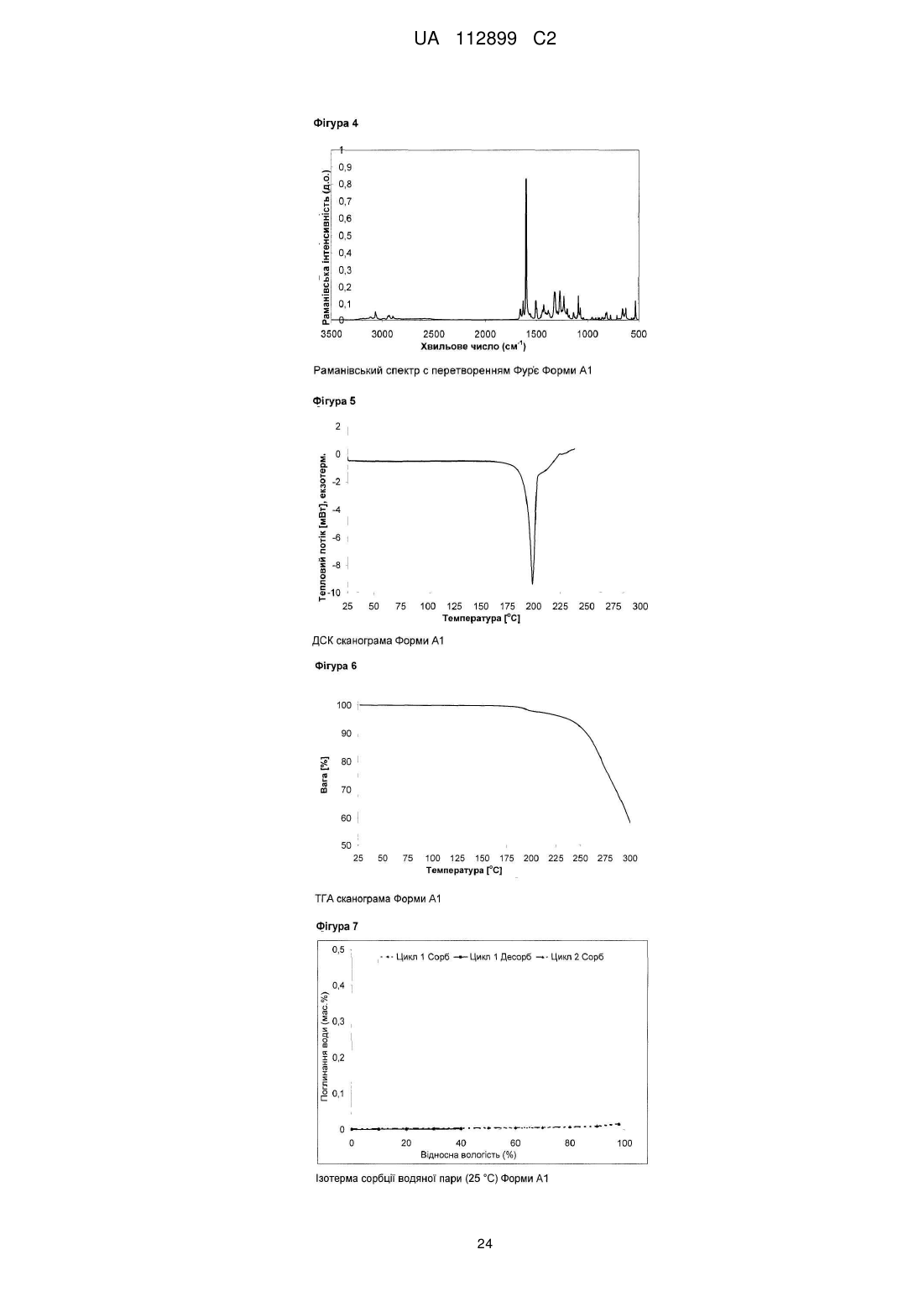
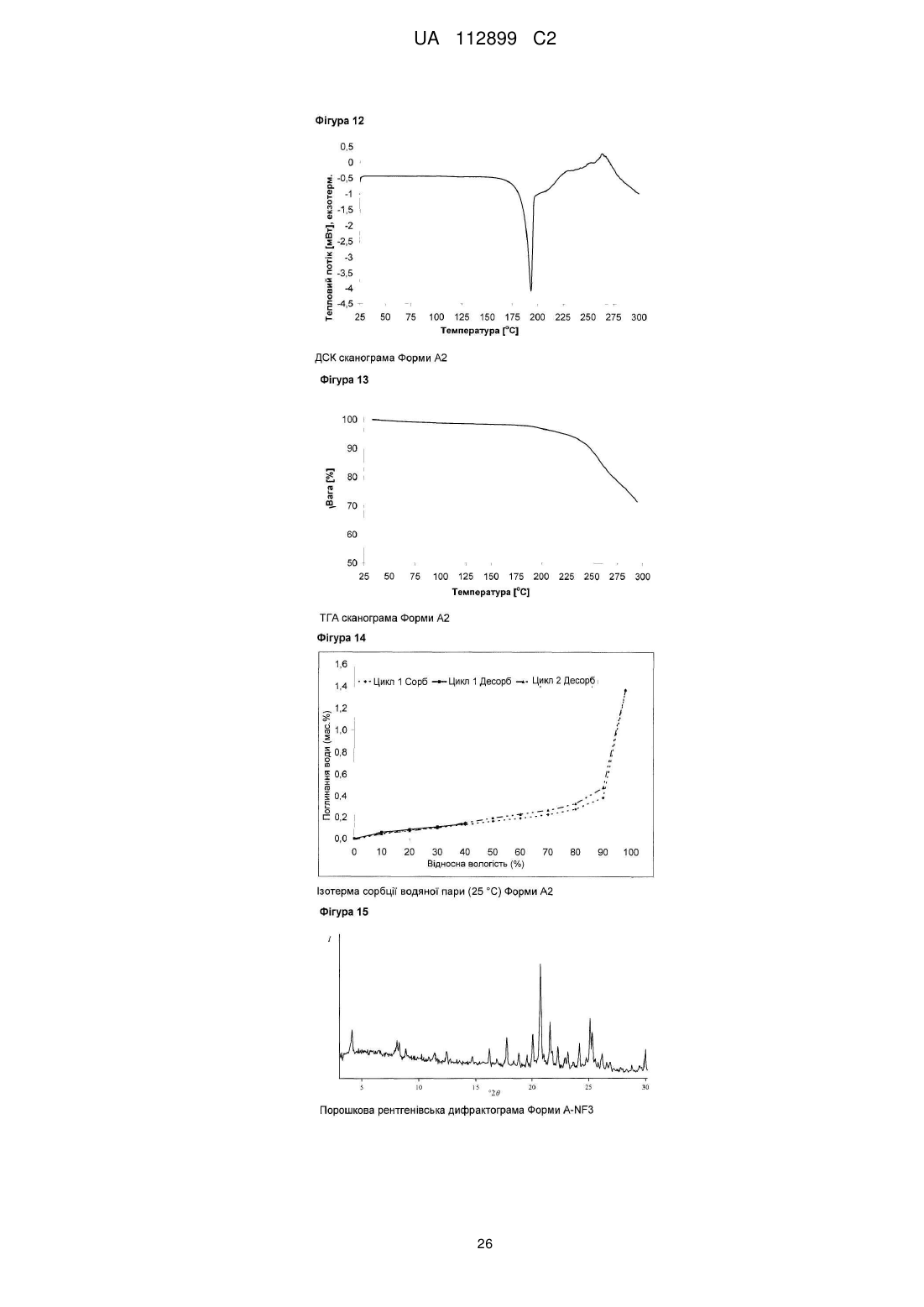
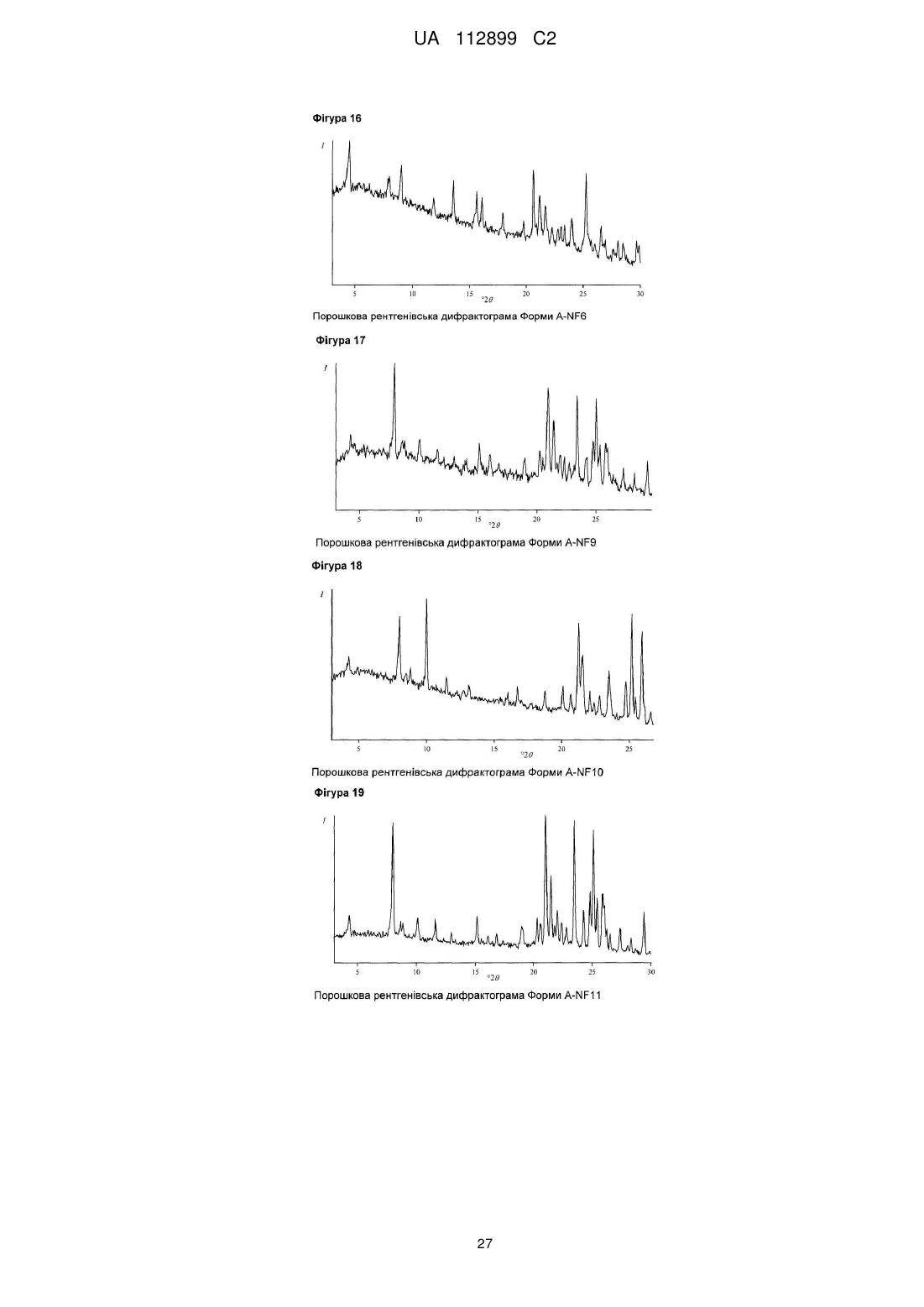
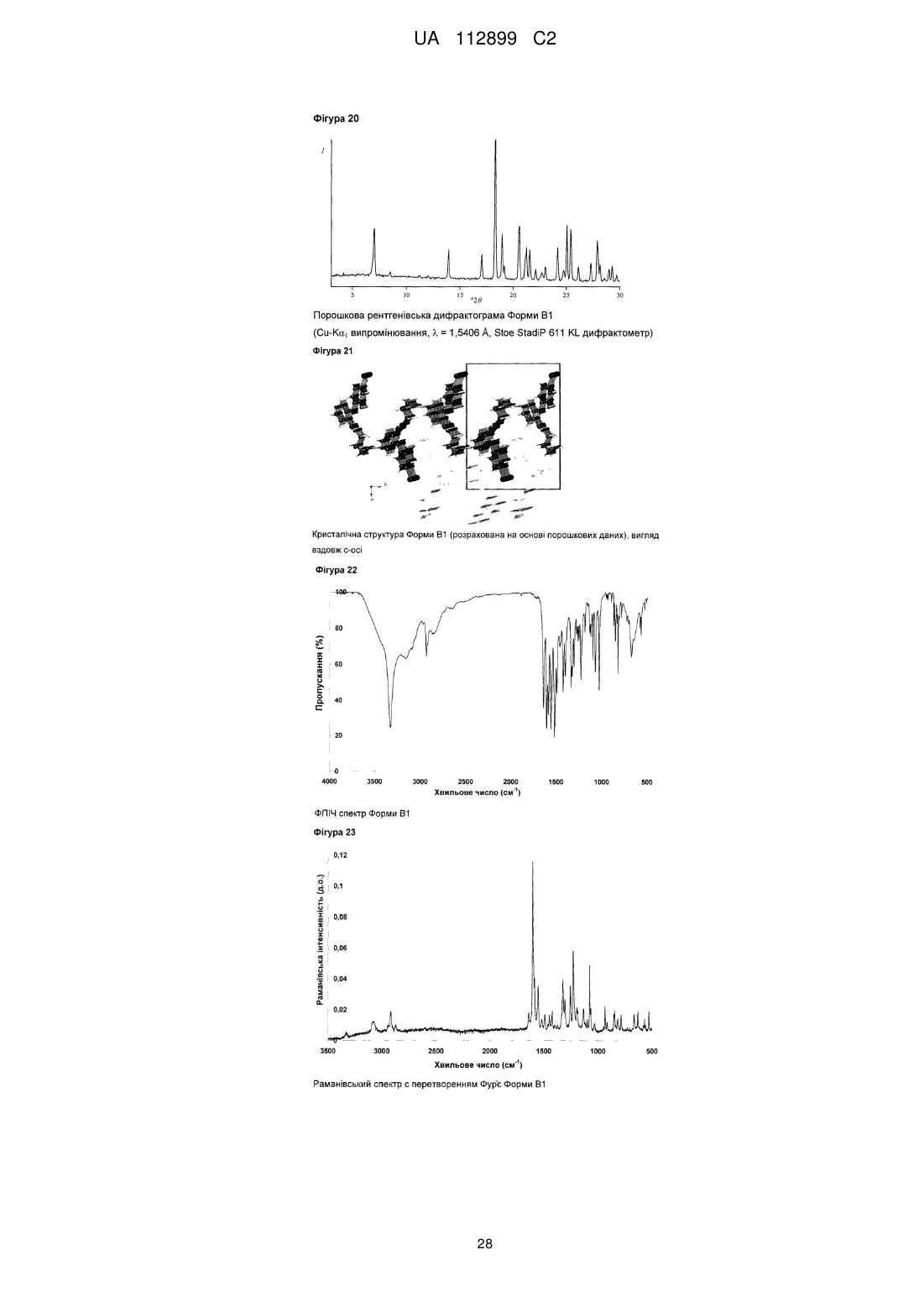
Реферат: Винахід стосується твердих форм N-((S)-2,3-дигідроксипропіл)-3-(2-фтор-4-йодфеніламіно)ізонікотинаміду, способів їх одержання і їх медичних застосувань. UA 112899 C2 (12) UA 112899 C2 UA 112899 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Винахід стосується твердих форм N-((S)-2,3-дигідрокси-пропіл)-3-(2-фтор-4-йодфеніламіно)-ізонікотинаміду, способів їх одержання, і їх медичних застосувань. Короткий виклад рівня техніки N-((S)-2,3-дигідрокси-пропіл)-3-(2-фтор-4-йод-феніламіно)-ізонікотинамід, для зручності використання, далі в даному винаході позначається як Сполука C, його використання як інгібітора кінази для лікування злоякісного новоутворення, і його одержання описане в заявці WO 2006/045514, сторінка 76, Приклад 115. Проте, тверда форма Сполуки не описана в WO 2006/045514, або іншим способом не опублікована дотепер, наскільки відомо заявникові. Однак, без твердої форми, неможливо забезпечити фармацевтично активний компонент у таблетці, яка являє собою дозовану форму для приготування, упакування, стабільності й дотримання хворим режиму й схеми лікування. Отже, для просування розробки Сполуки C як лікарської субстанції, існує нагальна потреба забезпечити принаймні одну тверду форму цієї сполуки. Опис винаходу Несподівано, винахідники даної патентної заявки вперше успішно забезпечили різні тверді форми C, які не тільки є кристалічними, але також і стабільними, тобто не перетворюються в інші форми в умовах приготування таблеток і зберігання. В одному специфічному аспекті винахід стосується кристалічних форм A1 і A2 моно гідрохлориду C. В іншому специфічному аспекті винахід стосується кристалічних форм B1 і B2 вільної основи C. Кристалічні форми характеризуються, наприклад, за допомогою рентгенівської порошкової дифрактометрії, дифрактометрії монокристала, С із урє-перетворенням, раманівської спектроскопії з ур є-перетворенням, диференціальної сканувальної калориметрії (ДСК) і термогравіметричного аналізу (ТГА), як далі показано в експериментальному розділі в даній заявці. Усі форми характеризуються високою кристалічністю, відсутністю гігроскопічності й високою температурною стабільністю. Крім того, форми A1 і A2 проявляють більш високу розчинність і більш швидкі кінетики розчинення, у порівнянні з формами B1 і B2. Крім того, даний винахід стосується фармацевтичних композицій, які включають тверду форму згідно із даним винаходом, разом із принаймні одним фармацевтично прийнятним носієм. " армацевтична композиція" означає один або декілька активних компонентів, і один або декілька інертних компонентів, які становлять носій, а також будь-який продукт, який утворюється, безпосередньо або опосередковано, у результаті комбінації, комплексоутворення або агрегації будь-яких двох або більше компонентів, або в результаті дисоціації одного або декількох компонентів, або в результаті реакцій інших типів або взаємодій одного або декількох компонентів. Таким чином, фармацевтичні композиції згідно із даним винаходом охоплюють будь-яку композицію, одержувану шляхом змішування сполуки згідно із даним винаходом й фармацевтично прийнятного носія. армацевтична композиція згідно із даним винаходом додатково може містити одну або декілька інших сполук як фармацевтично активні компоненти. армацевтичні композиції включають композиції, що підходять для орального, ректального, місцевого, парентерального (включаючи підшкірне, внутрішньом'язове, і внутрішньовенне), очного (офтальмічного), легеневого (назальна або букальна інгаляція), або назального введення, хоча найбільш підходящий шлях у будь-якому даному випадку буде залежати від природи й тяжкості станів, що піддаються лікуванню, і від природи активного компонента. Вони легко можуть бути представлені в одиничній дозованій формі й приготовлені за допомогою будь-якого зі способів, добре відомих в галузі фармацевтики. В одному варіанті здійснення, вказані сполуки й фармацевтична композиція придатні для лікування злоякісного новоутворення, такого як рак головного мозку, легенів, включаючи недрібноклітинний рак легенів, ободової кишки, товстої й прямої кишки, епідермоїдний, плоскоклітинний, сечового міхура, шлунка, підшлункової залози, молочної залози, голови й шиї, нирок, нирок, печінки, яєчників, передміхурової залози, матки, стравоходу, яєчок, жіночих статевих органів, включаючи ендометрій, щитовидної залози, меланома, включаючи NRAS або BRAF мутовану меланому, а також гематологічні злоякісні пухлини, такі як гострий мієлолейкоз, множинна мієлома, хронічний мієлолейкоз, мієлодний лейкоз, саркома Капоши, або будь-якого іншого типу сóлідних або рідких пухлин. Переважно, злоякісне новоутворення, що піддається лікуванню, вибирають із пухлин ободової кишки, легенів, молочної залози й гематологічних типів. 1 UA 112899 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таким чином, даний винахід також стосується застосування розкритих у даній заявці твердих форм Сполуки C для лікування вищевказаних захворювань. Протиракове лікування, визначене вище, може використовуватися у вигляді монотерапії або може включати, додатково до описаних у даній заявці твердих форм Сполуки C, загальноприйняту хірургію або променеву терапію або терапію лікарськими засобами. Така терапія лікарськими засобами, наприклад, хіміотерапія або прицільна терапія, може включати один або декілька, але переважно один, з наступних протипухлинних засобів: Алкувальні засоби Такі, як алтретамін, бендамустин, бусульфан, кармустин, хлорамбуцил, хлорметин, циклофосфамід, дакарбазин, іфосфамід, імпросульфан тозилат, ломустин, мельфалан, мітобронітол, мітолактол, німустин, ранімустин, темозоломід, тіотепа, треосульфан, мехлоретамін, карбоквон, апазиквон, фотемустин, глуфосфамід, паліфосфамід, піпоброман, трофосфамід, урамустин; Сполуки платини Такі, як карбоплатин, цисплатин, ептаплатин, міриплатин гідрат, оксаліплатин, лобаплатин, недаплатин, пікоплатин, сатраплатин; Речовини, що змінюють ДНК Такі, як амрубіцин, бісантран, децитабін, мітоксантрон, прокарбазин, трабектедин, клофарабін, амсакрин, бросталіцин, піксантрон, ларомустин; нгібітори топоізомерази Такі, як етопозид, іринотекан, разоксан, собузоксан, теніпозид, топотекан, амонафід, белотекан, ацетат еліптинію, ворелоксин; Модифікатори мікротрубочок Такі, як кабазитаксел, доцетаксел, ерибулін, іксабепілон, паклітаксел, вінбластин, вінкристин, вінорелбін, віндезин, вінфлунін, фосбретабулін, тезетаксел: Антиметаболіти Такі, як аспарагіназа, азацитидин, левофолінат кальцію, капецитабін, кладрибін, цитарабін, еноцитабін, флоксуридин, флударабін, фторурацил, гемцитабін, меркаптопурин, метотрексат, неларабін, пеметрексед, пралатрексатp, азатіоприн, тіогуанін, кармофур, доксифлуридин, елацитарабін, ралтітрексед, сапацитабін, тегафур, треметрексат; Протиракові антибіотики Такі, як блеоміцин, дактинoміцин, доксорубіцин, епірубіцин, ідарубіцин, левамізол, мілтефозин, мітоміцин C, ромідепсин, стрептозоцин, валрубіцин, зиностатин, зорубіцин, дауноробіцин, плікаміцин, акларубіцин, пепломіцин, пірарубіцин; Гормони/Антагоністи Такі, як абарелікс, абіратерон, бікалутамід, бузерелін, калустерон, хлортрианізен, дегарелікс, дексаметазон, естрадіол, фторкортолон, флуоксиместерон, флуамід, фульвестрант, гозерелін, гістрелін, лейпрорелін, мегестрол, мітотан, нафарелін, нандролон, нілутамід, октеотрид, преднізолон, ралоксифен, тамоксифен, тиротропін альфа, тореміфен, трилостан, трипторелін, діетилстилбестрол, аколбіфен, даназол, деслорелін, епітіостанол, ортеронел, ензалутамід; нгібітори ароматази Такі, як аміноглутетимід, анастрозол, ексеместан, фадрозол, летрозол, тестолактон, форместан; Низькомолекулярні інгібітори кінази Такі, як кризотиніб, дазатиніб, ерлотиніб, імaтиніб, лапaтиніб, нілoтиніб, пазопаніб, регорафеніб, руксолітиніб, сорфеніб, сунітиніб, вандетаніб, вемурафеніб, бозутиніб, гефітиніб, акситиніб, афатиніб, алісертиб, дабрафеніб, дакомітиніб, динацисліб, довітиніб, ензастаурин, нітеданіб, ленватиніб, лініфаніб, лінситиніб, маситиніб, мідостаурин, мотезаніб, нератиніб, орантиніб, перифозин, ронaтиніб, радотиніб, рігосертиб, типіфарніб, тивантиніб, тивозанід, траметиніб, пімасертиб, бриваніб аланінат, цедираніб, апатиніб, кабозантиніб S-малат, карфілзоміб, ібрутиніб, ікотиніб; ітосенсибілізуючі засоби Такі, як метоксален, порфімер натрій, талапорфін, темопорфін; Антитіла Такі, як алемтузумаб, безилезомаб, брентуксимаб ведотин, цетуксимаб, денозумаб, іпілімумаб, офатумумаб, панітумумаб, ритуксимаб, тозитумомаб, трастузумаб, бевацизумаб, катумаскомаб, елотузумаб, епатузумаб, фарлетузумаб, могамулизумаб, нецитумумаб, німотузумаб, обінутузумаб, окаратузумаб, ореговомаб, рамуцирумаб, рилотумумаб, силтуксимаб, тоцилізумаб, залутумумаб, занолімумаб, матузумаб, далотузумаб, онартузумаб, 2 UA 112899 C2 5 10 15 20 25 30 35 40 45 50 55 60 пертузумаб, ракотумомаб, табалімаб; Цитокіни Такі, як альдеслейкін, інтерферон альфа, інтерферон альфа2a, інтерферон альфа2b, тазонермін, тецелейкін, опрелвекін; Кон’югати лікарських засобів Такі, як денілейкін дифтитокс, ібритумомаб тіутексан, іобенгуан I123, преднімустин, трастузумаб емтанзин, естрамустин, гемтузумаб озогаміцин, афліберцепт, цинтредекін безудотокс, едотреотид, інотузумаб озогаміцин, наптумомаб естафенатокс, опортузумаб монатокс, технецій (99mtc) арцитумомаб, вінтафолід; Вакцини Такі, як сіпулейцел, вітеспен, емепепімут-s, oncovax, риндопепімут, trovax, стимувакс; Різні алітретиноїн, бексаротен, бортезоміб, еверолімус, ібандронова кислота, іміквімод, леналідомід, лентинан, метирозин, міфамуртид, памідронова кислота, пегаспаргаза, пентостатин, сипулейцел, сизофіран, тамібаротен, темсиролімус, талідомід, третиноїн, вісмодегіб, золендронова кислота, талідомід, вориностат, целекоксиб, циленгітід, ентиностат, етанідазол, ганетеспіб, індроноксил, ініпаріб, іксізоміб, лонідамін, німоразол, панобіностат, перетиноїн, плітидепсин, помалідомід, прокодазол, ридафоролімус, тасхінімод, телотристат, тимальфазин, тирапазамін, тозедостат, трабедерсен, убенімекс, вальсподар, гендицин, піцибаніл, реолізин, ретаспіміцин гідрохлорид, требананіб, вірулізин. Для практичного застосування, сполуки згідно із даним винаходом можна комбінувати як активний компонент в однорідній суміші з фармацевтичним носієм відповідно до загальноприйнятих фармацевтичних технологій приготування препаратів. Носій може мати різні форми залежно від форми препарату, бажаного для введення, наприклад, оральний або парентеральний (включаючи внутрішньовенний). При приготуванні композицій для пероральної дозованої форми, можна використовувати будь-які звичайні фармацевтичні засоби, такі як, наприклад, вода, гліколі, масла, спирти, ароматизатори, консерванти, барвники й інші. У випадку пероральних рідких препаратів, можна використовувати будь-які звичайні фармацевтичні засоби, такі як, наприклад, суспензії, еліксири й розчини; або носії, такі як крохмалі, цукри, мікрокристалічну целюлозу, розріджувачі, гранулюючі засоби, змащувальні речовини, сполучні, дезінтегратори й інші. У випадку пероральних твердих препаратів, композиція може мати такі форми, як, наприклад, порошки, тверді й м'які капсули й таблетки, при цьому тверді пероральні препарати є переважними в порівнянні з рідкими препаратами. У зв'язку із простою їх введення, таблетки й капсули являють собою найбільш сприятливу пероральну дозовану одиничну форму, у цьому випадку, мабуть, використовуються тверді фармацевтичні носії. Якщо це є бажаним, то таблетки можуть бути покриті оболонкою за допомогою стандартних водних або неводних технік. Такі композиції й препарати повинні містити принаймні 0,1 відсоток активної сполуки. Процентний вміст активної сполуки в цих композиціях може, ймовірно, змінюватися й може підходяще знаходитися в діапазоні від приблизно 2 відсотків до приблизно 60 відсотків ваги одиниці. Кількість активної сполуки в таких терапевтично корисних композиціях є такою, щоб була отримана ефективна доза. Активні сполуки також можна вводити інтраназально, як, наприклад, рідкі краплі або спрей. Таблетки, пігулки, капсули, і ін. також можуть містити сполучне, таке як трагакантова камедь, гуміарабік, кукурудзяний крохмаль або желатин; наповнювачі, такі як дикальцій фосфат; дезінтегратор, такий як кукурудзяний крохмаль, картопляний крохмаль, альгінову кислоту; змащувальну речовину, таку як стеарат магнію; і підсолоджувач, такий як сахароза, лактоза або сахарин. Якщо дозована одинична форма являє собою капсулу, то вона може містити, додатково до матеріалів вищевказаного типу, рідкий носій, такий як жирне масло. Різні інші матеріали можуть бути представлені у вигляді покриттів або модифікації фізичної форми дозованої одиниці. Наприклад, таблетки можуть бути покриті оболонкою за допомогою шелаку, цукру або обох речовин. Сироп або еліксир може містити, додатково до активного компонента, сахарозу як підсолоджувач, мітил і пропілпарабени як консерванти, барвник і ароматизатор, такий як вишневий або апельсиновий ароматизатор. Сполуки згідно із даним винаходом також можна вводити парентерально. Розчини або суспензії цих активних сполук можуть бути приготовлені у воді, підходяще змішані з поверхневоактивною речовиною, такою як гідрокси-пропілцелюлоза. Дисперсії також можуть бути приготовлені в гліцерині, рідких поліетилен гліколях і їх сумішах у маслах. При стандартних умовах зберігання й використання, ці препарати містять консервант для запобігання росту мікроорганізмів. армацевтичні форми, придатні для ін'єкційного застосування, включають стерильні водні 3 UA 112899 C2 5 10 15 20 25 30 35 40 45 50 55 60 розчини або дисперсії й стерильні порошки для екстемпорального приготування стерильних розчинів або дисперсій для ін'єкцій. У всіх випадках, форма повинна бути стерильною й повинна бути рідкою настільки, щоб існувала можливість легкого введення за допомогою шприца. Вона повинна бути стабільною в умовах приготування й зберігання й повинна бути захищена від забруднюючої дії мікроорганізмів, таких як бактерії й гриби. Носій може являти собою розчинник або дисперсійне середовище, що містить, наприклад, воду, етанол, поліол (наприклад, гліцерин, пропілен гліколь і рідкий поліетилен гліколь), їх підходящі суміші, і рослинні олії. Може використовуватися будь-який підходящий шлях введення для забезпечення ссавцеві, особливо людині, ефективної дози сполуки згідно із даним винаходом. Наприклад, можуть застосовуватися оральний, ректальний, місцевий, парентеральний, очний, легеневий, назальний, і інші. Дозовані форми включають таблетки, пастилки, дисперсії, суспензії, розчини, капсули, креми, мазі, аерозолі, і інші. Переважно сполуки згідно із даним винаходом вводяться перорально. Застосовувана ефективна доза активного компонента може значно змінюватися, залежно від конкретної використовуваної сполуки, способу введення, стану, що піддається лікуванню, і тяжкості стану, що піддається лікуванню. Така доза легко може бути встановлена кваліфікованим фахівцем у даній галузі техніки. При лікуванні запальних, дегенеративних або гіперпроліферативних захворювань, для яких показані сполуки згідно із даним винаходом, звичайно задовільні результати одержують при введенні сполук згідно із даним винаходом в добовій дозі від приблизно 0,01 міліграма до приблизно 100 міліграм на кілограм ваги тіла, переважно введена у вигляді однократної добової дози. Для більших ссавців, загальна добова доза становить від приблизно 0,1 міліграма до приблизно 1000 міліграм, переважно від приблизно 0,2 міліграма до приблизно 50 міліграм. У випадку дорослої людини вагою 70 кг, загальна добова доза звичайно буде становити від приблизно 0,2 міліграма до приблизно 200 міліграм. Ця схема дозування може регулюватися для забезпечення оптимальної терапевтичної відповіді. ігури ігура 1: Порошкова рентгенівська дифрактограма орми A1 ігура 2: Монокристалічна структура орми A1 ігура 3: П спектр орми A1 ігура 4: Раманівський спектр із перетворенням ур'є орми A1 ігура 5: ДСК сканограма орми A1 ігура 6: ТГА сканограма орми A1 ігура 7: зотерма сорбції водяної пари (25 °C) орми A1 ігура 8: Порошкова рентгенівська дифрактограма орми A2 ігура 9: Кристалічна структура орми A2 (розрахована на основі порошкових даних) ігура 10: П спектр орми A2 ігура 11: Раманівський спектр із перетворенням ур'є орми A2 ігура 12: ДСК сканограма орми A2 ігура 13: ТГА сканограма орми A2 ігура 14: зотерма сорбції водяної пари (25 °C) орми A2 ігура 15: Порошкова рентгенівська дифрактограма орми A-NF3 ігура 16: Порошкова рентгенівська дифрактограма орми A-NF6 ігура 17: Порошкова рентгенівська дифрактограма орми A-NF9 ігура 18: Порошкова рентгенівська дифрактограма орми A-NF10 ігура 19: Порошкова рентгенівська дифрактограма орми A-NF11 ігура 20: Порошкова рентгенівська дифрактограма орми B1 ігура 21: Кристалічна структура орми B1 (розрахована на основі порошкових даних) ігура 22: П спектр орми B1 ігура 23: Раманівський спектр із перетворенням ур'є орми B1 ігура 24: ДСК сканограма орми B1 ігура 25: ТГА сканограма орми B1 ігура 26: зотерма сорбції водяної пари (25 °C) орми B1 ігура 27: Порошкова рентгенівська дифрактограма орми B2 ігура 28: Кристалічна структура орми A2 (розрахована на основі порошкових даних) ігура 29: П спектр орми B2 ігура 30: Раманівський спектр із перетворенням ур'є орми B2 ігура 31: ДСК сканограма орми B2 (Морфологічний тип 1) ігура 32: ТГА сканограма орми B2 (Морфологічний тип 1) ігура 33: ДСК сканограма орми B2 (Морфологічний тип 2) 4 UA 112899 C2 5 10 ігура 34: ТГА сканограма орми B2 (Морфологічний тип 2) ігура 35: зотерма сорбції водяної пари (25 °C) орми B2 ігура 36: Порошкова рентгенівська дифрактограма орми B-S1 ігура 37: Порошкова рентгенівська дифрактограма орми B-S2 ігура 38: Розчинення Сполуки C тверді форми при pН 1,2 ігура 39: Розчинення Сполуки C тверді форми при pН 3,0 ігура 40: Розчинення Сполуки C тверді форми при pН 5,0 ігура 41: Розчинення Сполуки C тверді форми при pН 6,8 Скорочення Деякі скорочення, які можуть з'являтися в даній заявці, мають наступні значення: Позначення API Д ДМ А ДМСО ДСК П г ВЕРХ M MTBE н. NMP PBS PTFE КТ ТГА ТГ USP 15 20 25 Активний фармацевтичний компонент Деіонізована Диметилформамід Диметил Сульфоксид Диференціальна сканувальна калориметрія нфрачервона спектроскопія з перетворенням Година Високоефективна рідинна хроматографія Молярний (одиниця концентрації) Метиловий трет-бутиловий ефір Нормальний (одиниця концентрації) N-метилпіролідон осфатно-буферний сольовий розчин Політетрафторетилен Кімнатна температура (~23 °C) Термогравіметричний аналіз Тетрагідрофуран армакопея США ур'є Приклади Демонстраційні приклади, представлені нижче, призначені для ілюстрації переважних варіантів здійснення винаходу, і не призначені для обмеження обсягу винаходу або пунктів формули винаходу яким-небудь способом. Під моно гідрохлоридною формою мається на увазі стехіометричне співвідношення Сполуки C до HСl в інтервалі 0,8:1 і 1,2:1, переважно в інтервалі 0,9:1 і 1,1:1. Найбільш переважним є співвідношення 1:1. 1. Моно-гідрохлоридна орма A1 1.1 Характеристика орми A1 1.1.1 Рентгенівська порошкова дифрактометрія Порошкову рентгенівську дифрактограму орми A1 одержували за допомогою стандартних технік при КТ, як описано в Європейській армакопеї 6-е вид., частина 2.9.33, яка представлена на ігурі 1. Перелік характерних рентгенівських піків, що мають походження із цієї картини, представлений у Таблиці I: № 1 2 3 4 5 6 7 8 9 °2θ (Cu-Kα випромінювання) 0,2° 5,5 15,9 16,8 18,5 19,1 19,5 20,1 21,1 22,6 5 UA 112899 C2 10 11 12 13 14 15 16 17 18 23,0 24,4 24,9 25,2 25,7 27,1 28,4 29,2 29,6 Найбільш значимі рентгенівські піки з Таблиці I перераховані в Таблиці II: № 1 2 3 4 5 6 7 8 9 10 °2θ (Cu-Kα випромінювання) 0,2° 5,5 16,8 18,5 19,1 22,6 23,0 24,9 25,2 28,4 29,2 З розбивкою за орієнтацією зразка, найбільш характерні піки представлені в Таблицях III, IV 5 і V: Таблиця III-0kl орієнтація № 1 2 3 4 °2θ (Cu-Kα випромінювання) 0,2° 5,5 16,8 19,5 23,0 Таблиця IV-h0l орієнтація °2θ (Cu-Kα випромінювання) 0,2° 5,5 18,5 19,1 28,4 29,6 № 1 2 3 4 5 Таблиця V-hk0 орієнтація № 1 2 3 °2θ (Cu-Kα випромінювання) 0,2° 15,9 19,1 24,9 10 Таким чином, у переважному аспекті даній винахід стосується кристалічної форми A1, яка має характерні піки при кутах 2θ, представлені в Таблиці I. У більш переважному аспекті винахід стосується форми A1, яка має характерні піки при кутах 2θ , представлені в Таблиці II. 6 UA 112899 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому переважному аспекті винахід стосується форми A1, яка має характерні піки при кутах 2θ , представлені в одній або декількох Таблицях III, IV і V. 1.1.2 Рентгенівська монокристалічна дифрактометрія Додатково, дані монокристалічної рентгенівської структури одержували для орми A1, з якої розраховували просторову структуру A молекул, як презентовано на ігурі 2. орма A1 кристалізується в хіральну моноклінну групу симетрії кристалічної решітки P21 з параметрами кристалічної решітки; a=9,6±0,1 Å, b=11,2±0,1 Å, c=16,6±0,1 Å, і β = 104,4±0,5° (α = γ = 90°). З монокристалічної структури стає очевидно, що орма A1 являє собою безводну форму. У специфічному аспекті, винахід стосується кристалічної форми моно гідрохлориду Сполуки C, яка характеризується цими кристалографічними параметрами. 1.1.3 Вібраційна спектроскопія орма A1 додатково може бути охарактеризована за допомогою інфрачервоної й спектроскопії з перетворенням ур'є. П -раманівські й П спектри одержували за допомогою стандартних технік, як описано в Європейській армакопеї 6-е вид., частина 2.02.24 і 2.02.48. Для вимірювання П - і П -раманівських спектрів використовували спектрометр Bruker Vector 22 і Bruker RFS 100. П - спектри й П -раманівські спектри були скоректовані відносно базової лінії, використовуючи програмне забезпечення Bruker OPUS. П - спектр одержували, використовуючи пелети KВr як техніку приготування зразка. П спектр представлено на ігурі 3, з якого виведені положення смуг, як представлено нижче. -1 орма A1 положення смуг (+2 см , відносна інтенсивність*) -1 -1 -1 -1 -1 -1 -1 3108 см (m), 2935 см (m), 2772 см (m), 1655 см (s), 1539 см (s), 1493 см (s), 1380 см -1 -1 -1 -1 -1 (m), 1269 см (s), 1118 см (m), 1036 см (m), 808 см (m), 773 см (m) *”s" = сильне (пропускання < 50 %), "m" = середнє (50 % < пропускання 70 %) П -раманівський спектр представлено на ігурі 4, з якого виведені положення смуг, як представлено нижче: -1 орма A1 Раманівські положення смуг (+2 см , відносна інтенсивність*): -1 -1 -1 -1 -1 -1 -1 3065 см (w), 1628 см (m), 1599 см (s), 1503 см (m), 1319 см (m), 1267 см (m), 1230 см -1 (m), 1089 см (m) *”s" = сильне (відносна інтенсивність раманівського розсіювання > 0,2), "m" = середнє (0,2 > відносна інтенсивність раманівського розсіювання > 0,1), "w" = слабке (відносна інтенсивність раманівського розсіювання 160 C, без істотної втрати ваги аж до цієї температури. ДСК і ТГА профілі представлено на ігурах 5 і 6. ДСК сканограму орми A1 одержували на Mettler-Toledo ДСК 821 зі швидкістю нагрівання 5 K/хв., використовуючи газоподібний азот для продувки при 50 мл/хв. ТГА сканограму орми A1 одержували на Perkin-Elmer Pyris ТГА 1 зі швидкістю нагрівання 5 K/хв., використовуючи газоподібний азот для продувки при 50 мл/хв. - Поведінка сорбції водяної пари показала несуттєві рівні поглинання води 0,1), "m" = середнє (0,1 > відносна інтенсивність раманівського розсіювання > 0,02), "w" = слабке (відносна інтенсивність раманівського розсіювання < 0,02) 4.1.3 нші аналітичні методи Може бути показано, що орма B1 являє собою кристалічну безводну форму, яка додатково характеризується наступними фізичними властивостями: - Термічна характеристика орми B1 проявляє пік плавлення при прибл. 165 °C, з дуже невеликою втратою ваги тільки аж до цієї температури. ДСК і ТГА профілі представлено на ігурах 24 і 25, відповідно. ДСК сканограма орми B1 записана на Mettler-Toledo ДСК 821 зі швидкістю нагрівання 5 K/хв., використовуючи газоподібний азот для продувки при 50 мл/хв. ТГА сканограма орми B1 записана на Mettler-Toledo ТГА 851 зі швидкістю нагрівання 5 K/хв., використовуючи газоподібний азот для продувки при 50 мл/хв. - Поведінка сорбції водяної пари показує невеликі рівні поглинання води 20 (0,1 н. HСl)
ДивитисяДодаткова інформація
Автори англійськоюBecker, Axel, Saal, Christoph, Kuehn, Clemens, Bankston, Donald, Poma, Marco
Автори російськоюБеккер Аксель, Заль Кристоф, Кюн Клеменс, Бенкстон Дональд, Пома Марко
МПК / Мітки
МПК: A61K 31/44, C07D 213/81
Мітки: форми, тверді, n-((s)-2,3-дигідроксипропіл)-3-(2-фтор-4-йодфеніламіно)-ізонікотинаміду
Код посилання
<a href="https://ua.patents.su/35-112899-tverdi-formi-n-s-23-digidroksipropil-3-2-ftor-4-jjodfenilamino-izonikotinamidu.html" target="_blank" rel="follow" title="База патентів України">Тверді форми n-((s)-2,3-дигідроксипропіл)-3-(2-фтор-4-йодфеніламіно)-ізонікотинаміду</a>
Попередній патент: Індолкарбонітрили як селективні модулятори андрогенного рецептора
Наступний патент: Пневмокамерне двоступеневе стрічково-колодкове гальмо
Випадковий патент: Прилад для контролю якості поверхні