Індолкарбонітрили як селективні модулятори андрогенного рецептора
Формула / Реферат
1. Сполука формули:
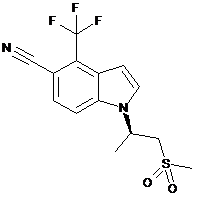 .
.
2. Фармацевтична композиція, яка містить сполуку за п. 1 та один або декілька фармацевтично прийнятних наповнювачів.
3. Спосіб лікування розладу, вибраного з атрофії м'язів, пов'язаної з хронічним обструктивним захворюванням легень (ХОЗЛ), атрофії м'язів, пов'язаної з хронічним захворюванням нирок (ХЗН), атрофії м'язів, пов'язаної з хронічною серцевою недостатністю (ХСН) та нетриманням сечі, який полягає у введенні пацієнту-людині сполуки за п. 1.
4. Застосування сполуки за п. 1 для отримання лікарського засобу, призначеного для лікування розладу, опосередкованого недугою, вибраною з атрофії м'язів, пов'язаної з хронічним обструктивним захворюванням легень (ХОЗЛ), атрофії м'язів, пов'язаної з хронічним захворюванням нирок (ХЗН), атрофії м'язів, пов'язаної з хронічною серцевою недостатністю (ХСН) та нетриманням сечі.
5. Сполука за п. 1 для застосування у лікуванні розладу, вибраного з атрофії м'язів, пов'язаної з хронічним обструктивним захворюванням легень (ХОЗЛ), атрофії м'язів, пов'язаної з хронічним захворюванням нирок (ХЗН), атрофії м'язів, пов'язаної з хронічною серцевою недостатністю (ХСН) та нетриманням сечі.
6. Спосіб прискорення відновлення та зцілення перелому тазостегнового суглоба, який полягає у введенні пацієнту-людині сполуки за будь-яким з п. 1.
7. Застосування сполуки за п. 1 у отриманні лікарського засобу для прискорення відновлення та зцілення перелому тазостегнового суглоба.
8. Сполука за п. 1 для застосування у прискоренні відновлення та зцілення перелому тазостегнового суглоба.
9. Спосіб прискорення загоєння опіків, який полягає у введенні пацієнту-людині сполуки за будь-яким з п. 1.
10. Застосування сполуки за п. 1 у отриманні лікарського засобу для прискорення загоєння опіків.
11. Сполука за п. 1 для застосування у прискоренні загоєння опіків.
12. Фармацевтична композиція за п. 2, яка містить 0,1-50 мг сполуки за п. 1.
13. Спосіб за будь-яким з пп. 3, 6 або 9, який полягає у введенні 0,1-50 мг сполуки за п. 1.
Текст
Реферат: Заявлений винахід стосується нестероїдних сполук, які є модуляторами андрогенного рецептора, а також способів отримання та застосування таких сполук. UA 112898 C2 (12) UA 112898 C2 UA 112898 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується нестероїдних сполук, які є модуляторами андрогенного рецептору та способів їх лікувального застосування. Ліганди стероїдного ядерного рецептора (ЯР), як відомо, відіграють важливу роль як у чоловічому, так і у жіночому здоров'ї. Тестостерон (T) та дигідротестостерон (ДГТ) є ендогенними стероїдними лігандами для андрогенного рецептору (AР), якій, очевидно, відіграє важливу роль у кожному типі тканини, знайденої у організмі ссавця. Під час розвитку плода андрогени відіграють важливу роль у статевому розмежуванні та у розвитку чоловічих статевих органів. Крім того, андрогени опосередковують статевий розвиток протягом пубертатного періоду. У дорослому організмі андрогени виконують різні функції, як-то функцію стимулювання та підтримки чоловічих допоміжних статевих органів та підтримки опорно-рухового апарату. Опосередкованим андрогенами поведінковими аспектами є, наприклад, когнітивна функція, сексуальність, агресія та настрій. Андрогени фізіологічно впливають на шкіру, кістки та скелетні м'язи, а також на кров, ліпіди та клітини крові. (Chang, C. and Whipple, G. Androgens and Androgen Receptors. ("Андрогени та андрогенні рецептори") Kluwer Academic Publishers: Boston, MA, 2002) Багато клінічних досліджень з застосуванням тестостерону показали значний приріст м'язової маси та функції разом зі зменшенням вісцерального жиру (див., наприклад, Bhasin (2003) S. J. Gerontol. A Biol. Sci. Med. Sci. 58:1002-8 та Ferrando, A. A. et al. (2002) Am. J. Phys. Endo. Met. 282: E601–E607). Андроген-заміщувальна терапія (АЗТ) у чоловіків покращує параметри складу тканин тіла, як-то м'язову масу, силу та мінеральну щільність кісткової тканини (див., наприклад, Asthana, S. et al. (2004) J. Ger., Series A: Biol. Sci. Med. Sci. 59: 461465). Існують також докази поліпшення менш помітних параметрів, як-то лібідо та настрою. Андрологи та інші фахівці все частіше застосовують андрогени для лікування симптомів дефіциту андрогенів. АЗТ-терапія з застосуванням тестостерону та його конгенерів є доступною у вигляді лікарських засобів для трансдермального, ін'єкційного та перорального застосування, хоча поточні параметри лікування мають протипоказання (наприклад, рак простати) та побічні дії, як-то збільшення гематокриту, печінкову токсичність та апное уві сні. Побічні дії при андрогенній терапії у жінок охоплюють акне, гірсутизм та зниження рівнів холестерину у вигляді ліпопротеїнів високої щільності (ЛПВЩ). Помітні побічні дії спостерігали також у чоловіків. Агенти, які можуть вибірково забезпечити перевагу андрогенів та значно зменшити профіль побічних дій матимуть велику терапевтичну цінність. Цікаво, що певні ЯР-ліганди, як відомо, діють вибірковим для тканини чином (див., наприклад, Smith et al. (2004) Endoc. Rev. 2545-71) та така вибірковість обумовлена специфічною здатністю цих лігандів діяти у якості агоністів у деяких тканинах у той час, як у інших тканинах вони не спричинюють жодної дії або навіть діють у якості антагоністів, отже ці молекули позначають терміном "селективний модулятор рецептора" (СМР). У якості агоніста тут позначено синтетичну сполуку, яка зв'язується з позаклітинним рецептором та імітує дію природного гормону, а. сполука, яка пригнічує дію природного гормону отримала назву антагоніста. Термін "модулятори" має відношення до сполук, наділених різними типами активності від повного агонізму до часткового агонізму та повного антагонізму. СМАР (селективні модулятори андрогенних рецепторів) є перспективним класом малих молекул фармакотерапевтичних речовин, з допомогою яких є можливість набути важливих переваг андрогенної терапії без небажаних побічних дій. Багато СМАР-сполук, які демонструють вибіркові для тканини дії зараз знаходяться ще на ранніх стадіях розробки (див., наприклад, Mohler, M. L. et al. (2009) J. Med. Chem. 52(12): 3597-617), наприклад, одна така примітна молекула СМАР, яка має назву Ostarine™ нещодавно пройшла перший та другий етап клінічних випробувань (див., наприклад, Zilbermint, M. F. та Dobs, A. S. (2009) Future Oncology 5(8):1211-20. Схоже, що дія цієї сполуки веде до збільшення кількості загальної вільної від жиру маси тіла та до підсилення функціональних здібностей. Завдяки підвищеній вибірковості анаболічних властивостей та проявленим активним андроген-зберігаючим властивостям, СМАР-сполуки повинні бути корисними у запобіганні та/або лікуванні багатьох жіночих та чоловічих хвороб, які охоплюють, але без обмеження саркопенію, кахексию (у тому числі недуги, пов'язані з раком, серцевою недостатністю, хронічною обструктивною хворобою легень (ХОЗЛ) та кінцевою стадією хронічної ниркової недостатності (ХНН), нетриманням сечі, остеопорозом, слабкістю, сухістю очей та іншими хворобливими станами, пов'язаними зі старінням або з андрогенною нестачею (див., наприклад, Ho et al. (2004) Curr Opin Obstet Gynecol. 16:405-9; Albaaj et al. (2006) Postgrad Med J 82:693-6; Caminti et al. (2009) J Am Coll Cardiol. 54(10):919-27; Iellamo et al. (2010) J Am Coll Cardiol. 56(16):1310-6; Svartberg (2010) Curr Opin Endocrinol Diabetes Obes. 17(3):257-61 та Mammadov et al. (2011) Int Urol Nephrol 43:10038). СМАР-сполуки також демонструють можливість їх застосування у сприянні регенерації та 1 UA 112898 C2 5 10 15 відновленні м'язів (див., наприклад, Serra et al. (Epub 2012 Apr 12) doi:10.1093 / Gerona / gls 083), а також у гормональній контрацепції у чоловіків, у лікуванні доброякісної гіперплазії передміхурової залози (ДГПЗ) та при загоюванні ран (див., наприклад, Demling (2009) ePlasty 9:e9). Предклінічні дослідження та новітні клінічні дані свідчать про наявність терапевтичного потенціалу СМАР-сполук у вирішенні незадоволених медичних потреб багатьох пацієнтів. Показано наявність переваг цього класу сполук у порівнянні зі стероїдними андрогенами (наприклад, вибіркова до типу тканин активність, прийнятність до перорального застосування, селективність до адренергічних рецепторів та втрата андрогенної дії), яка обіцяє велике майбутнє для їх терапевтичного застосування. Відповідно, у цей галузі знань залишається потреба у отриманні нових СМАР-сполук для терапевтичного застосування. Заявлений винахід стосується нестероїдних сполук, які є модуляторами андрогенного рецептору, а також застосування цих сполук у терапії. Стисло кажучи, у одному аспекті, заявленим винаходом передбачені сполуки за Формулою (I): або їх солі, в яких: 20 25 означає одиничний або подвійний зв'язок; 1 R - –CF3, –C≡N або гало; 2 R -H, C1-3 алкіл або –CHF2; 3 R - Н або C1-3 алкіл; 4 – R - C(O)OCH3, –C(CH3)2OH, –CH2OH, –CH2SCH3, –CH2S(O)2CH3, –C(O)CH3 або феніл або піридиніл, де зазначений феніл або піридиніл є вибірково заміщеним однією або двома групами, вибраними з –C≡N та гало; та 5 R - Н або метил. 1 2 3 5 4 – В іншому аспекті винаходу, R , R , R та R є такими, як визначено вище та R C(O)OCH3, –C(CH3)2OH, –C(CH3)(CF3)OH, –CH2OH, –CH2SCH3, –CH2S(O)2CH3, –C(O)CH3 або феніл або піридиніл, де зазначений феніл або піридиніл є вибірково заміщеним однією або двома групами, вибраними з –C≡N та гало. 1 30 В окремому втіленні винаходу означає одиничний або подвійний зв'язок; R - –CF3, –C≡N 2 3 або гало; R -H, C1-3 алкіл або –CHF2; R -H; 4 – R - C(CH3)(CF3)OH, –CH2SCH3, –CH2S(O)2CH3, –C(O)CH3 або феніл або піридиніл, де зазначений феніл або піридиніл є вибірково заміщеним однією або двома групами, вибраними з 5 –C≡N та гало та R є метилом. 35 В іншому втіленні винаходу означає одиничний або подвійний зв'язок; R - –CF3, –C≡N 2 3 або гало; R -H, C1-3 алкіл або –CHF2; R є C1-3 алкілом; 4 – R - C(CH3)(CF3)OH, –CH2SCH3, –CH2S(O)2CH3, –C(O)CH3 або феніл або піридиніл, де зазначений феніл або піридиніл є вибірково заміщеним однією або двома групами, вибраними з 5 –C≡N та гало та R - Н або метил. В іншому аспекті заявленого винаходу передбачено фармацевтичну композицію, яка містить сполуку заявленого винаходу та один або декілька фармацевтично прийнятних наповнювачів. Іншим аспектом заявленого винаходу передбачено сполуку за винаходом для застосування у якості активної терапевтичної речовини. Іншим аспектом заявленого винаходу передбачено сполуку за винаходом для застосування у прискоренні загоєння ран та опіків та у лікуванні гіпогонадизму, саркопенії, остеопорозу, атрофії м'язів, захворювань, які викликають виснаження, кахексії (у тому числі видів кахексії, 40 45 1 2 UA 112898 C2 5 10 15 20 25 30 35 40 пов'язаних з раком, хронічною обструктивною хворобою легень (ХОЗЛ), кінцевою стадією хронічної ниркової недостатності (ХНН), серцевою недостатністю, ВІЛ та лікуванням ВІЛ, цукровим діабетом першого та другого типу), слабкості, сухості очей, гіперплазії та раку передміхурової залози, раку молочної залози, вазомоторних станів, пов'язаних з менопаузою та андропаузою, сексуальної та еректильної дисфункції, депресії, фіброзного захворювання матки, ендометріозу, нетримання сечі (у тому числі нетримання сечі, пов'язаного з виснаженням м'язів та / або тканин м'язів тазового дна), акне, гірсутизму, застосування для чоловічої контрацепції, у лікуванні імпотенції, застосування у гормональній замісній терапії (як чоловічої, так і жіночої), у якості стимулятора гемопоезу, а також у якості анаболічного агента. В іншому аспекті заявленого винаходу передбачено застосування сполуки заявленого винаходу у виробництві лікарського засобу для прискорення загоєння ран та для лікування захворювань, вибраних з групи, яка охоплює гіпогонадизм, саркопенію, остеопороз, атрофію м'язів, хвороби, які викликають виснаження, атрофію м'язів та кахексію (в тому числі атрофію м'язів та кахексію, пов'язані з раком, хронічною обструктивною хворобою легень (ХОЗЛ), кінцевою стадією хронічної ниркової недостатності (ХНН), серцевою недостатністю, захворюванням на ВІЛ та його лікуванням та цукровим діабетом першого та другого типу), слабкість, сухість очей, гіперплазію та рак передміхурової залози, рак молочної залози, вазомоторні стани, пов'язані з менопаузою та андропаузою, сексуальну та еректильну дисфункцію, депресію, фіброзне захворювання матки, ендометріоз, нетримання сечі (у тому числі нетримання сечі, яке пов'язане з виснаженням м'язів та / або тканин м'язів тазового дна), акне, гірсутизм, а також застосування цієї сполуки для чоловічої контрацепції, у лікуванні імпотенції, у гормональній замісній терапії (як чоловічої, так і жіночої), у якості стимулятора гемопоезу, а також у якості анаболічного агента. В іншому аспекті заявленого винаходу передбачено спосіб лікування гіпогонадизму, саркопенії, остеопорозу, атрофії м'язів, захворювань, які викликають виснаження, кахексії (у тому числі видів кахексії, пов'язаних з раком, хронічною обструктивною хворобою легень (ХОЗЛ), кінцевою стадією хронічної ниркової недостатності (ХНН), серцевою недостатністю, ВІЛ та лікуванням ВІЛ, цукровим діабетом першого та другого типу), слабкості, сухості очей, гіперплазії та раку передміхурової залози, раку молочної залози, вазомоторних станів, пов'язаних з менопаузою та андропаузою, хронічної обструктивної хвороби легень (ХОЗЛ), сексуальної та еректильної дисфункції, депресії, фіброзного захворювання матки, ендометріозу, нетримання сечі (у тому числі нетримання сечі, пов'язаного з виснаженням м'язів та / або тканин м'язів тазового дна), акне, гірсутизму, імпотенції, спосіб, прийнятний для застосування у чоловічій контрацепції, у гормональній замісній терапії (як чоловічої, так і жіночої) або у якості стимулятора гемопоезу, який полягає у застосуванні сполуки заявленого винаходу. В іншому аспекті, заявленим винаходом передбачено спосіб лікування пошкоджень м'язів та прискорення м'язового відновлення, який полягає у застосуванні сполуки заявленого винаходу. Також винаходом передбачено застосування сполуки заявленого винаходу у лікуванні пошкоджень м'язів або у прискоренні м'язового відновлення. Додатково передбачено застосування сполуки заявленого винаходу у виробництві лікарського засобу для лікування пошкоджень м'язів або прискорення м'язового відновлення. В одному аспекті, заявленим винаходом передбачені сполуки за Формулою (I): (I) або їх солі, в яких: 45 означає одиничний або подвійний зв'язок; 1 R - –CF3, –C≡N або гало; 2 R -H, C1-3 алкіл або –CHF2; 3 R - Н або C1-3 алкіл; 3 UA 112898 C2 4 – R - C(O)OCH3, –C(CH3)2OH, –CH2OH, –CH2SCH3, –CH2S(O)2CH3, –C(O)CH3 або феніл або піридиніл, де зазначений феніл або піридиніл є вибірково заміщеним однією або двома групами, вибраними з –C≡N та гало; та 5 R - Н або метил. 5 1 2 3 5 4 – В іншому аспекті винаходу, R , R , R та R є такими, як визначено вище та R C(O)OCH3, –C(CH3)2OH, –C(CH3)(CF3)OH, –CH2OH, –CH2SCH3, –CH2S(O)2CH3, –C(O)CH3 або феніл або піридиніл, де зазначений феніл або піридиніл є вибірково заміщеним однією або двома групами, вибраними з –C≡N та гало. 10 В одному втіленні означає одиничний або подвійний зв'язок; 1 2 3 4 R - –CF3, –C≡N або гало; R -H, C1-3 алкіл або –CHF2; R - Н або C1-3 алкіл; R is, – 15 CH2S(O)2CH3 та R - Н або метил. У окремому втіленні винаходу означає одиничний або 1 2 3 подвійний зв'язок; R - –CF3, –C≡N або гало; R -H, C1-3 алкіл або –CHF2; R -H; 4 – R - C(CH3)(CF3)OH, –CH2SCH3, –CH2S(O)2CH3, –C(O)CH3 або феніл або піридиніл, де зазначений феніл або піридиніл є вибірково заміщеним однією або двома групами, вибраними з 5 –C≡N та гало та R є метилом. 5 1 20 25 30 В іншому втіленні винаходу означає одиничний або подвійний зв'язок; R - –CF3, –C≡N 2 3 4 – або гало; R -H, C1-3 алкіл або –CHF2; R є C1-3 алкілом; R - C(CH3)(CF3)OH, –CH2SCH3, – CH2S(O)2CH3, –C(O)CH3 або феніл або піридиніл, де зазначений феніл або піридиніл є 5 вибірково заміщеним однією або двома групами, вибраними з –C≡N та гало та R - Н або метил. 1 1 У деяких втіленнях R - –CF3, –C≡N або гало. У окремих втіленнях R - –CF3 або –C≡N. У 1 1 1 – інших втіленнях R є гало. У інших втіленнях R є Cl. У деяких бажаних втіленнях R - CF3. 2 2 У деяких втіленнях R -H, метил, етил, пропіл або –CHF2. У окремих втіленнях R -H, метил 2 2 або –CHF2. У деяких бажаних втіленнях R -H. У деяких бажаних втіленнях R є метилом. 3 3 3 У деяких втіленнях R -H. У інших втіленнях R є C1-3 алкілом. У окремих втіленнях R є 3 метилом або етилом. У деяких бажаних втіленнях R є метилом. 4 – У деяких втіленнях R - C(O)OCH3, –C(CH3)2OH, –CH2OH, –CH2SCH3, –CH2S(O)2CH3 або – 4 4 C(O)CH3. У інших втіленнях R - –C(CH3)(CF3)OH. У бажаних втіленнях R - –C(CH3)2OH або – 4 CH2S(O)2CH3. У окремих бажаних втіленнях R - –CH2S(O)2CH3. 4 В інших втіленнях R є фенілом або піридинілом, де зазначений феніл або піридиніл є вибірково заміщеним однією або двома групами, вибраними з –C≡N та гало. У інших втіленнях 4 R - наступну групу: 5 35 40 5 В одному втіленні R -H. У іншому втіленні R є метилом. 3 4 – У деяких втіленнях R -H; R - C(CH3)2OH, –CH2SCH3 або феніл або піридиніл, де зазначений феніл або піридиніл є вибірково заміщеним однією або двома групами, вибраними з –C≡N та 5 гало та R -H. 3 4 В інших втіленнях R - метил, етил або пропіл, R - –C(O)OCH3, –C(CH3)2OH, –CH2OH, – CH2SCH3, –CH2S(O)2CH3, –C(O)CH3 або феніл або піридиніл, де зазначений феніл або піридиніл 5 є вибірково заміщеним однією або двома групами, вибраними з –C≡N та гало та R -H. 3 4 5 В іншому втіленні R - метил, етил або пропіл; R - –C(CH3)2OH; та R -H. 3 4 5 В іншому втіленні R - метил, етил або пропіл; R - –C(CH3) (CF53)OH; та R -H. В іншому втіленні сполука має Формулу I": 4 UA 112898 C2 1 2 3 4 (I") 5 в якій R , R , R , R та R є такими, як визначено вище. В іншому втіленні сполука має Формулу I’’: 5 10 15 20 25 30 35 40 (I’’) 1 2 3 4 5 в якій R , R , R , R та R є такими, як визначено вище. Як тут застосовано, термін "гал ” або "галоге ” має відношення до групи, яка містить фтор, хлор, бром або йод. Як тут застосовано, термін "алкіл" має відношення до прямого або розгалуженого вуглеводневого ланцюга, бажаним чином такого, який має зазначену кількість карбонових атомів. Приклади застосованих тут алкілів охоплюють, але без обмеження, метил, етил, пропіл та ізопропіл. Як застосовано у цій заявці, наприклад, фразою "Cx-Cy алкіл, ” позначена бажана кількість атомів, як-то карбонових атомів, яка має відношення до зазначеної тут алкільної групи, яка містить визначену кількість карбонових атомів. У той час, як можливі втілення та бажані групи для кожної змінної загальним чином перелічені вище (для кожної змінної по окремості), заявленим винаходом також передбачені сполуки, у яких декілька з будь-яких змінних, наведених у Формулах (I), (I") або (I’’) є вибраними з зазначених аспектів або втілень та являють собою бажані, більш бажані чи найбільш бажані групи для кожної змінної. Таким чином, цей винахід призначений охоплювати всі комбінацій з усіх аспектів, втілень та бажаних, більш бажаних та найбільш бажаних груп. Також винаходом передбачені сполуки, вибрані з групи, яка охоплює: Метил 2-[5-ціано-2-метил-4-(трифторметил)-1H-індол-1-іл]пропаноат; Метил 2-[5-ціано-2-метил-4-(трифторметил)-1H-індол-1-іл]бутаноат; 2-метил-1-(1-метил-2-оксопропіл)-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(2-гідрокси-1,2-диметилпропіл)-2-метил-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(1-етил-2-оксопропіл)-2-метил-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(1-етил-2-гідрокси-2-метилпропіл)-2-метил-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(1-гідроксипропан-2-іл)-2-метил-4-(трифторметил)-1H-індол-5-карбонітрил; 2-метил-1-(1-(метилтіо)пропан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; 2-метил-1-(1-(метилсульфоніл)пропан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; 2-метил-1-(1-(метилтіо)бутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; 2-метил-1-(1-(метилсульфоніл)бутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(2-гідрокси-2-метилпропіл)-2-пропіл-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(3-гідрокси-3-метилбутан-2-іл)-2-пропіл-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(2-(метилтіо)етил)-2-пропіл-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(1-(метилтіо)пропан-2-іл)-2-пропіл-4-(трифторметил)-1H-індол-5-карбонітрил; 2-(дифторметил)-1-(3-гідрокси-3-метилбутан-2-іл)-1H-індол-4,5-дикарбонітрил; 2-(дифторметил)-1-(1-(метилтіо)пропан-2-іл)-1H-індол-4,5-дикарбонітрил; 2-(дифторметил)-1-(1-(метилсульфоніл)пропан-2-іл)-1H-індол-4,5-дикарбонітрил; 1-(3-оксобутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(3-гідрокси-3-метилбутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; (S)-1-(3-гідрокси-3-метилбутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; (R)-1-(3-гідрокси-3-метилбутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; 5 UA 112898 C2 5 10 15 20 25 30 35 40 45 50 55 60 (R)-1-(3-гідрокси-3-метилбутан-2-іл)-4-(трифторметил)індолiн-5-карбонітрил; 1-(2-гідрокси-2-метилпентаn-3-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(1-(метилтіо)пропан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(1-(метилсульфоніл)пропан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; (R)-1-(1-(метилсульфоніл)пропан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; (R)-1-(1-(метилсульфоніл)пропан-2-іл)-4-(трифторметил)індолiн-5-карбонітрил; 1-(1-(метилтіо)бутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(1-(метилсульфоніл)бутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; 4-хлор-1-(3-оксобутан-2-іл)-1H-індол-5-карбонітрил; (S)-4-хлор-1-(3-гідрокси-3-метилбутан-2-іл)-1H-індол-5-карбонітрил; (R)-4-хлор-1-(3-гідрокси-3-метилбутан-2-іл)-1H-індол-5-карбонітрил; 4-хлор-1-(2-гідрокси-2-метилпентаn-3-іл)-1H-індол-5-карбонітрил; 4-хлор-1-(3-гідрокси-2,3-диметилбутан-2-іл)-1H-індол-5-карбонітрил; (S)-4-хлор-1-(1-(метилтіо)пропан-2-іл)-1H-індол-5-карбонітрил; (S)-4-хлор-1-(1-(метилсульфоніл)пропан-2-іл)-1H-індол-5-карбонітрил; (R)-4-хлор-1-(1-(метилтіо)пропан-2-іл)-1H-індол-5-карбонітрил; (R)-4-хлор-1-(1-(метилсульфоніл)пропан-2-іл)-1H-індол-5-карбонітрил; (S)-1-(3-гідрокси-3-метилбутан-2-іл)-1H-індол-4,5-дикарбонітрил; (R)-1-(3-гідрокси-3метилбутан-2-іл)-1H-індол-4,5-дикарбонітрил; 1-(2-гідрокси-2-метилпентаn-3-іл)-1H-індол-4,5-дикарбонітрил; 1-(3-гідрокси-2,3-диметилбутан-2-іл)-1H-індол-4,5-дикарбонітрил; (R)-1-(1-(метилсульфоніл)пропан-2-іл)-1H-індол-4,5-дикарбонітрил; (R)-1-(1-(3-ціанофеніл)етил)-4-(трифторметил)-1H-індол-5-карбонітрил; 1-(1-(3-ціанофеніл)пропіл)-4-(трифторметил)-1H-індол-5-карбонітрил; (R)-1-(1-(5-ціанопіридин-3-іл)пропіл)-4-(трифторметил)-1H-індол-5-карбонітрил; (R)-4-хлор-1-(1-(5-ціанопіридин-3-іл)пропіл)-1H-індол-5-карбонітрил; (R)-1-(1-фенілетил)-1H-індол-4,5-дикарбонітрил; (R)-1-(1-(3-ціанофеніл)етил)-1H-індол-4,5-дикарбонітрил; (R)-1-(1-(5-ціанопіридин-3-іл)пропіл)-1H-індол-4,5-дикарбонітрил; та їх солі. Заявлений винахід також стосується сполук 4-хлор-1-((2R, 3S)-4,4,4-трифтор -3-гідрокси-3метилбутан-2-іл)-1H-індол-5-карбонітрилу та їх солей. Винаходом також передбачені сполуки, вибрані з групи, яка охоплює: 1-((2R, 3S)-4,4,4-трифтор-3-гідрокси-3-метилбутан-2-іл)-4-(трифторметил)-1H-індол-5карбонітрил; (S)-1-(1-(метилтіо)пропан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; (S)-1-(1-(метилсульфоніл)пропан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил; та їх солі. У бажаному втіленні сполука - (R)-1-(1-(метилсульфоніл)пропан-2-іл)-4-(трифторметил)-1Hіндол-5-карбонітрил. Вважається, що сполуки заявленого винаходу змінюють функцію одного або кількох ядерних гормональних рецепторів, зокрема вони змінюють функцію андрогенного рецептору ("AР"). Заявлений винахід охоплює сполуки, які є вибірковими або частковими агоністами, антагоністами або частковими антагоністами цього рецептора. Сполуки заявленого винаходу є корисними у лікуванні хвороб та станів, пов'язаних з цим рецептором, наприклад, хвороб або станів, які можна запобігти, пом'якшити або лікувати шляхом змінення функції або активності андрогенного рецептору. Таке змінення може бути ізольованим у певних тканинах або поширюватися на весь організм підданого лікуванню суб'єкта. Як тут застосовано, термін "лікування" має відношення до пом'якшення визначеного стану, усунення або зменшення його симптомів та до уповільнення або усунення його розвитку. Сполуки заявленого винаходу також можуть бути корисними у запобіганні або у затримці початкового виникнення такого стану у суб'єкта або відновлення такого стану у суб'єкта, який раніше потерпав від нього. Одним втіленням заявленого винаходу передбачено сполуку для застосування у лікувальній терапії. Особливим чином заявленим винаходом передбачено лікування розладів, опосередкованих андрогенною активністю. Більш докладно, заявленим винаходом передбачено лікування розладів, чутливих до анаболічної та / або андрогенної активності з вибірковою до певних тканин дією. Додатковим втіленням винаходу передбачено спосіб лікування ссавця, який страждає від розладу, опосередкованого андрогенною активністю, який полягає у введенні зазначеному суб'єкту ефективної кількості сполуки заявленого винаходу. 6 UA 112898 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одним втіленням заявленого винаходу є застосування його сполук заявленого винаходу у лікуванні різних розладів, які охоплюють, але без обмеження, остеопороз та/або запобігання зменшення кісткової маси, щільності або росту кісток, остеоартрит, пародонтит, хворобу Педжета, остеохондроплазію, атрофію м'язів, слабкість або вікові функціональні розлади (ВФР), сухість очей, саркопенію, кінцеву стадію захворювання нирок (ХНН), синдром хронічної втоми, хронічну міалгію, синдром гострої втоми, сепсис, хронічну печінкову недостатність, СНІД, втрату ваги, тромбоцитопенію, синдром вкороченої тонкої кишки, синдром подразненого кишечника, запальне захворювання кишечника, хворобу Крона та виразковий коліт, ожиріння, розлади харчової поведінки, включаючи анорексію, пов'язану з кахексією або старінням, гіперкортизолізм та синдром Кушинга, серцево-судинні захворювання або серцеву дисфункцію, застійну серцеву недостатність, високий кров'яний тиск, злоякісні хвороби, спричинені пухлинними клітинами, які містять андрогенний рецептор, як-то клітини раку молочної залози, мозку, шкіри, яєчників, сечового міхура, лімфатичної системи, печінки, нирок, матки, підшлункової залози, слизової оболонки матки, легенів, товстої кишки, передміхурової залози, гіперплазію передміхурової залози, гірсутизм, акне, себорею, андрогенну алопецію, анемію, надмірну волохатість, аденому та неоплазію передміхурової залози, гіперінсулінемію, нечутливість до інсуліну, цукровий діабет, синдром X, дисліпідемію, вазомоторні стани, пов'язані з менопаузою, нетримання сечі, атеросклероз, сексуальну дисфункцію, передменструальний синдром, фіброзне захворювання матки, проліферація гладком'язових клітин аорти, ендометріоз, синдром полікістозних яєчників, депресію, нервозність, дратівливість, стрес, зниження розумової енергії та низьку самооцінку. Також передбачено застосування сполук заявленого винаходу з метою прискорення відновлення кісток після перелому та їх загоєння, прискорення загоєння після заміни суглоба, прискорення росту або відновлення зубів, підтримку та зміцнення сили та функції м'язів, прискорення загоєння ран, підтримання сенсорної функції, загоєння травм та опіків, поліпшення когнітивної функції, підвищення лібідо, протидії токсикозу у вагітних жінок, контрацепції, при заміщенні чоловічого гормону або у лікуванні вікового андрогенного дефіциту. Додатковим втіленням винаходу передбачено спосіб лікування ссавця, який полягає у лікуванні різних розладів, які охоплюють, але без обмеження, остеопороз та/або запобігання зменшення кісткової маси, щільності або росту, остеоартрит, пародонтит, хворобу Педжета, остеохондроплазію, атрофію м'язів, слабкість або вікові функціональні розлади (ВФР), сухість очей, саркопенію, кінцеву стадію захворювання нирок (ХНН), синдром хронічної втоми, хронічну міалгію, синдром гострої втоми, сепсис, хронічну печінкову недостатність, СНІД, втрату ваги, тромбоцитопенію, синдром вкороченої тонкої кишки, синдром подразненого кишечника, запальне захворювання кишечника, хворобу Крона та виразковий коліт, ожиріння, розлади харчової поведінки, включаючи анорексію, пов'язану з кахексією або старінням, гіперкортизолізм та синдром Кушинга, серцево-судинні захворювання або серцеву дисфункцію, застійну серцеву недостатність, високий кров'яний тиск, злоякісні хвороби, спричинені пухлинними клітинами, які містять андрогенний рецептор, як-то клітини раку молочної залози, мозку, шкіри, яєчників, сечового міхура, лімфатичної системи, печінки, нирок, матки, підшлункової залози, слизової оболонки матки, легенів, товстої кишки, передміхурової залози, гіперплазію передміхурової залози, гірсутизм, акне, себорею, андрогенну алопецію, анемію, надлишкову волохатість, аденому та неоплазію передміхурової залози, гіперінсулінемію, нечутливість до інсуліну, цукровий діабет, синдром X, дисліпідемію, вазомоторні стани, пов'язані з менопаузою, нетримання сечі, атеросклероз, сексуальну дисфункцію, передменструальний синдром, фіброзне захворювання матки, проліферація гладком'язових клітин аорти, ендометріоз, синдром полікістозних яєчників, депресію, нервозність, дратівливість, стрес, зниження розумової енергії та низьку самооцінку. Також передбачено застосування сполук заявленого винаходу з метою прискорення відновлення кісток після перелому та їх загоєння, прискорення загоєння після заміни суглоба, прискорення росту або відновлення зубів, підтримку та зміцнення сили та функції м'язів, прискорення загоєння ран, підтримання сенсорної функції, загоєння травм та опіків, поліпшення когнітивної функції, підвищення лібідо, протидії токсикозу у вагітних жінок, контрацепції, при заміщенні чоловічого гормону або лікуванні вікового андрогенного дефіциту. Переважним чином, сполуки заявленого винаходу застосовують у замісній терапії з чоловічим або з жіночим гормоном або у лікуванні або запобіганні гіпогонадизму, остеопорозу, атрофії м'язів, хвороб, які викликають виснаження, кахексії, викликаної раком, старечої слабкості, гіперплазії та раку передміхурової залози, раку молочної залози, вазомоторних станів, пов'язаних з менопаузою та андропаузою, сексуальної та еректильної дисфункції, депресії, фіброзного захворювання матки та/або ендометріозу, акне та гірсутизму. Також 7 UA 112898 C2 5 10 15 20 25 30 35 40 45 50 55 сполуки заявленого винаходу застосовують для стимулювання кровотворення, чоловічої контрацепції, у лікуванні імпотенції та у якості анаболічних агентів, застосування яких полягає у введенні суб'єкту ефективної кількості сполуки заявленого винаходу. У деяких втіленнях винахід також охоплює застосування сполуки винаходу у лікуванні пошкодження м'язів. У окремих втіленнях пошкодження м'язів є наслідком хірургічної операції, травми, надмірних тренувань чи пошкодженням скелетних м'язів внаслідок фізичної праці. Необмежені приклади пошкодження м'язів внаслідок хірургічної операції охоплюють пошкодження м'язів після ендопротезування колінного суглоба, заміни передньої хрестоподібної зв'язки (ПХЗ), пластичної хірургії, ендопротезування кульшового суглобу, операцій протезування суглобів, відновлення сухожилля, хірургічного відновлення м'язів плечового пояса та після ампутації. Необмежені приклади травматичних пошкоджень м'язів охоплюють травми м'язів, отримані внаслідок бойових дій, дорожніх пригод та спортивні травми. Травматичні пошкодження м'язів можуть охоплювати рвані рани, закриті травми від тупих ударів, осколкові поранення, розтягнення або розриви м'язів, опіки, гострі розтягнення, хронічні розтягнення, травми, викликані ваговим або силовим навантаженням, травми, викликані "тунельним синдромом", відривом м'яза та синдром травматичного стискування. У одному втіленні пошкодження м'язів є травматичним пошкодженням та спосіб лікування полягає у введенні принаймні однієї великої дози сполуки винаходу одразу після отримання травматичного пошкодження (наприклад, у день отримання травми) з наступним періодичним введенням малої дози сполуки винаходу протягом періоду відновлення. Необмежені приклади пошкоджень м'язів внаслідок праці охоплюють пошкодження, спричинені рухами з високою повторюваністю, силовими рухами, незручними положеннями, тривалим та сильним механічним контактом між тілом та об'єктом та пошкодження, отримані внаслідок вібрації. Пошкодження м'язів внаслідок надмірних тренувань охоплюють невідновлювані або відновлювані пошкодження м'язів з втратою відновлення або втратою можливості збільшення фізичних навантажень. В іншому втіленні до пошкоджень м'язів, викликаних спортивними змаганнями чи виконанням вправ також відносять викликаний виконанням вправ синдром затримки болю у м'язах (DOMS). В іншому аспекті, винаходом передбачено спосіб лікування дегенеративного розладу м'язів, який полягає у введенні людині сполуки винаходу. В окремих втіленнях, дегенеративний розлад м'язів є м'язовою дистрофією, міотонічною дистрофією, поліміозитом або дерматомиозитом. Наприклад, зазначені способи можуть бути застосовані для лікування м'язової дистрофії, вибраної від м'язової дистрофії Дюшена, Беккера, вродженої м'язової дистрофії (м'язової дистрофії Фукуями), м'язової дистрофії Емері Дрейфус, Лейдена та Ландузи-Джерина. Способи винаходу також можуть бути застосовані для лікування міотонічної дистрофії першого типу (DM1 або міотонічної дистрофії Стейнерта), міотонічної дистрофії другого типу (DM2 або проксимальної міотонічної міопатії) або для лікування вродженої міотонії. У деяких втіленнях винахід також охоплює терапевтичну комбінацію, у якої сполуку винаходу вводять суб'єкту у поєднанні з імплантацією біологічного каркасу (наприклад, каркасу, який містить позаклітинний матрикс), який сприяє відновленню м'язів. Такі каркаси є добре відомі у цей галузі (див., наприклад, Turner and Badylack (2012) Cell Tissue Res. 347(3):759-74 та US Patent No. 6 576 265. Бажано застосування каркасів, які містять незшитий матеріал позаклітинного матриксу. В іншому аспекті винаходом передбачено спосіб лікування пошкодження сухожилля, який полягає у введенні суб'єкту у разі потреби сполуки заявленого винаходу. В окремому втіленні, винаходом передбачено спосіб підсилення утворення стійкої зони взаємодії сухожилля з кісткою. У схожому втіленні, винаходом передбачено спосіб збільшення порогу напруги, що веде до відмови сухожиль, наприклад хірургічно відновлених сухожиль У додатковому втіленні, винаходом передбачено спосіб зменшення фіброзу у місці відновлення для хірургічно відновлених сухожиль. У окремому втіленні, винаходом передбачено спосіб лікування пошкодження сухожиль, пов'язаних з м'язами плечового поясу. Ссавцем, який потребує лікування сполукою заявленого винаходу звичайно є людина. В іншому втіленні, підданий лікуванню розлад є атрофію м'язів, пов'язаною з хронічним обструктивним захворюванням легень (ХОЗЛ). 8 UA 112898 C2 5 10 15 20 25 30 35 40 45 50 55 60 В іншому бажаному втіленні, підданий лікуванню розлад є атрофією м'язів, пов'язаною з хронічною хворобою нирок (ХХН) або з кінцевою стадією хронічної ниркової недостатності (ХНН). В іншому бажаному втіленні, підданий лікуванню розлад є атрофією м'язів, пов'язаною з хронічною серцевою недостатністю (ХСН). В іншому бажаному втіленні, сполуку за винаходом застосовують для прискорення відновлення та зцілення кісток після перелому стегна, наприклад, для прискорення відновлення та зцілення кісток після перелому тазостегнового суглоба. В іншому бажаному втіленні, сполуку за винаходом застосовують для лікування нетримання сечі (як-то нетримання сечі, пов'язаного з виснаженням м'язів та / або тканин м'язів тазового дна). Сполуки заявленого винаходу можуть кристалізуватися у вигляді більш, ніж однієї форми, маючи характеристику, відому, як поліморфізм та такі поліморфні форми ("поліморфи") знаходяться в межах обсягу Формули (I), (I") або (I’’). Звичайно випадки поліморфізму трапляються у відповідь на змінення температури, тиску або обох цих факторів. Поліморфізм також може бути результатом змінень процесу кристалізації. Поліморфи можна розрізнити з допомогою різних фізичних характеристик, відомих у цій галузі, як-то даних рентгеноструктурного аналізу, розчинності та температури плавлення… Деякі описані тут сполуки містять один або декілька хіральних центрів або, в іншому випадку, вони можуть існувати у вигляді численних стереоізомерів. Обсяг цього винаходу охоплює суміші стереоізомерів, а також очищені енантіомери або енантіомерно / діастереомерно збагачені суміші. Також до обсягу винаходу належать індивідуальні ізомери сполук, представлених Формулою (I), (I") або (I’’), а також їх будь-які повністю або частково врівноважені суміші. Заявлений винахід також охоплює індивідуальні ізомери сполук за вищенаведеними формулами у вигляді сумішей їх ізомерів з одним або декількома перевернутими хіральними центрами. Звичайно, але не обов'язково, солі заявленого винаходу є фармацевтично прийнятними солями. Сполуки, які тут охоплюються терміном "фармацевтично прийнятні солі" мають відношення до нетоксичних солей сполук заявленого винаходу, які можуть бути кислотноадитивними солями. Типові подібні солі охоплюють ацетат, бензолсульфонат, бензоат, бікарбонат, бісульфат, битартрат, борат, бромід, едетат кальцію, камзилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, едетат, едизилат, естолат, езилат, фумарат, глюцептат, глюконат, глутамат, гліколіларсанілат, гексилрезорцинат, гідрабамін, гідробромід, гідрохлорид, гідроксинафтоат, йодид, ізотіонат, лактат, лактобіонат, лаурат, малат, малеат, манделат, мезілат, метилбромід, метілнітрат, метілсульфат, первинний кислий малеат, мукат, напсилат, нітрат, N-метилглюкамін, оксалат, памоат (ембонат), пальмитат, пантотенат, фосфат/дифосфат, полігалактуронат, калій, саліцилати, натрій, стеарат, субацетат, сукцинат, сульфат, танат, тартрат, теоклат, тозилат, тріетіодид, триметиламоній та солі валерату. Інші солі, які не є фармацевтично прийнятними також можуть бути корисними для отримання сполук заявленого винаходу та їх слід розглядати для отримання ще одного аспекту винаходу. Як тут застосовано, термін "сольват" має відношення до комплексу змінної стехіометрії, утвореного розчиненою речовиною (у заявленому винаході така речовина є сполукою за Формулою (I), (I") або (I’’)) та розчинником. Прийнятні для заявленого винаходу розчинники не повинні впливати на біологічну активність розчиненої речовини. Необмежені приклади прийнятних розчинників охоплюють, але без обмеження, воду, метaнол, етанол та оцтову кислоту. Переважним чином, застосовані розчинники є фармацевтично прийнятними. Необмежені приклади прийнятних фармацевтично прийнятних розчинників охоплюють воду, етанол та оцтову кислоту. Найбільш переважним застосованим розчинником є вода. Як тут застосовано, термін "ефективна кількість" означає кількість ліків або фармацевтичного агента, яка буде викликати біологічну або медичну відповідь тканини, системи, тварини або людини, яку бажає отримати, наприклад, дослідник або клініцист. Біологічною або медичною відповіддю може вважатися відповідь, отримана в результаті профілактики або лікування. Термін "терапевтично ефективна кількість" означає будь-яку кількість, застосування якої у порівнянні з відповідним суб'єктом, який не отримав такої кількості, веде до покращення лікування, загоєння або послаблення хвороби, розладу або побічної дії або зменшує швидкість розвитку хвороби або розладу. Цей термін також охоплює кількості, ефективні для покращення нормальної фізіологічної функції. Для застосування у терапії, терапевтично ефективні кількості сполукиза Формулою (I) (I") або (I’’) можуть бути застосовані у вигляді необробленої хімічної речовини. Крім того, активний інгредієнт може бути представлений у вигляді фармацевтичної композиції. 9 UA 112898 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно, винахід також стосується фармацевтичних композицій, які містять ефективні кількості сполук за даним винаходом та один або більше фармацевтично прийнятних носіїв, розріджувачів або наповнювачів, у яких сполуки заявленого винаходу є такими речовинами, як тут описано, а носій (і), розчинник (і) або наповнювач (і) повинен бути прийнятним з точки зору сумісності з іншими інгредієнтами препарату та не повинен бути шкідливим для реципієнта фармацевтичної композиції. У відповідності з іншим аспектом винаходу також передбачено спосіб отримання фармацевтичного препарату, який полягає у змішуванні сполуки заявленого винаходу з одним або декількома фармацевтично прийнятними носіями, розчинниками або наповнювачами. Терапевтично ефективна кількість сполуки заявленого винаходу буде залежати від кількох факторів, які повинні бути розглянуті, як-то від типу, віку та ваги реципієнта, точного стану, який вимагає лікування та його тяжкості та від природи препарату та шляху його застосування. В кінцевому рахунку, величину терапевтично ефективної кількості повинен визначати на свій розсуд практикуючий лікар або ветеринар. Ефективна кількість сполуки даного винаходу для лікування людей, які страждають від захворювань, як-то стареча слабкість, як правило, повинна знаходитися у межах 0,01-100 мг / кг маси тіла реципієнта (ссавця) на добу. Більш звичайно, ця ефективна кількість повинна знаходитися у межах 0,001-1 мг/кг маси тіла на добу. Отже, для дорослого ссавця вагою 70 кг актуальна кількість цієї сполуки на добу буде звичайно 0,07-70 мг, або 0,1-20 мг, або 1-10 мг. Ця кількість може бути застосованою у вигляді денної одиничної дози або у вигляді кількох (як-то двох, трьох, чотирьох п'яти або більше) субдоз таким чином, що загальна денна доза буде такою ж саме. Ефективна кількість солі, сольвату може бути визначена у вигляді частки ефективної кількості сполуки за Формулою (I), (I") або (I’’) у чистому вигляді. Подібні дози також повинні бути прийнятними для лікування інших зазначених тут станів. Фармацевтичні препарати можуть бути представлені у формі одиничних доз, які містять заздалегідь визначену кількість активного інгредієнта на одиницю дози. Така одиниця може містити, як необмежений приклад, 0,1-100 мг сполуки заявленого винаходу, або 0,1-50 мг, або 0,5-15 мг залежно від стану, який підлягає лікуванню, способу застосування, віку, ваги та стану пацієнта. Бажані препарати у вигляді лікарських форм з однократним дозуванням містять або щоденну дозу або зазначені вище субдози, як тут вище або її відповідну фракцію або активний інгредієнт. Такі фармацевтичні композиції можуть бути отримані будь-яким добре відомим у фармацевтичній галузі способом. Фармацевтичні композиції можуть бути адаптовані для застосування будь-яким прийнятним шляхом, наприклад, шляхом перорального (у тому числі букального або сублінгвального), ректального, назального, місцевого (у тому числі трансбукального, сублингвального або трансдермального), вагінального або парентерального (включаючи підшкірне, внутрішньом'язове, внутрішньовенне або внутришкірне) введення. Такі композиції можуть бути отримані будь-яким відомим у фармацевтичній галузі способом, наприклад шляхом залучення до композиції активного інгредієнта з носієм (носіями) або наповнювачем (наповнювачами). Фармацевтичні препарати, пристосовані для перорального введення можуть мати вигляд окремих одиниць, як-то капсул або таблеток; порошків або гранул; розчинів або суспензій, кожна з яких існує разом з водною або неводною рідиною; харчових пін або речовин у вигляді збитої маси; або рідких емульсій типу "олія у воді" або "вода в олії" Активний лікарський компонент у вигляді таблетки або капсули, призначений, наприклад, для перорального введення, може бути поєднано з нетоксичним фармацевтично прийнятним носієм для перорального застосування, як-то етанол, гліцерин, вода тощо. Порошки головним чином отримують шляхом подрібнення сполук у частинки прийнятного розміру та змішування їх з відповідним фармацевтичним носієм, наприклад, їстівним вуглеводом, як-то крохмаль або маніт. Також у складі фармацевтичного препарату можуть бути присутні ароматизатори, консерванти, диспергуючі агенти та барвники. Капсули можуть бути отримані шляхом отримання порошку, рідини або суспензійної суміші та інкапсуляції цієї речовини з допомогою желатину або будь-якого іншого прийнятного матеріалу оболонки. Перед інкапсуляцією до суміші можуть бути додані гліданти та мастила, якто колоїдний діоксид кремнію, тальк, стеарат магнію, стеарат кальцію або твердий поліетиленгліколь. Також для поліпшення доступності лікарського засобу при ковтанні капсули можуть бути додані розпушувачі або солюбілізатори, як-то агар-агар, карбонат кальцію або карбонат натрію. Крім того, у разі необхідності або по бажанню до складу суміші можуть бути включені прийнятні в'яжучі речовини, мастильні матеріали, розпушувачі та барвники. Приклади прийнятних в'яжучих речовин охоплюють крохмаль, желатин, природні цукри, як-то глюкоза або 10 UA 112898 C2 5 10 15 20 25 30 35 40 45 50 55 60 бета-лактоза, кукурудзяні підсолоджувачі, природні та синтетичні камеді, як-то аравійська камедь, трагакант або альгінат натрію, карбоксиметилцелюлозу, поліетиленгліколь, воски тощо. Мастила для застосування у цих лікарських формах, охоплюють, наприклад, олеат натрію, стеарат натрію, стеарат магнію, бензоат натрію, ацетат натрію, хлорид натрію тощо. Розпушувачі охоплюють, без обмеження, крохмаль, метилцеллюлозу, агар, бентоніт, ксантанову камедь тощо. Таблетки можуть бути отримані, наприклад, шляхом отримання порошкової суміші з утворенням гранул або грудочок матеріалу та додаванням мастила та розпушувача з пресуванням отриманого матеріалу у таблетки. Порошкова суміш може бути отримана шляхом змішування відповідним чином подрібнених сполук з розріджувачем або основою, як описано вище. Додаткові інгредієнти охоплюють в'яжучі речовини, як-то карбоксиметилцелюлозу, альгінати, желатини або полівінілпіролідон, розчин антипіренів, як-то парафіну, прискорювачі поглинання, як-то солі четвертинних основ та / або агенти абсорбції, як-то бентоніт, каолін, дикальцію фосфат. Порошкова суміш може бути піддана вологому гранулюванню з в'яжучою речовиною, як-то сироп, крохмальний клейстер, слиз акації або розчини целюлозних або полімерних матеріалів та продавлюванню крізь сито. В якості альтернативи гранулюванню порошкову суміш можна завантажити у машину для виробництва таблеток та отримані грубо сформовані грудки розбити на гранули. Гранули можуть бути змащені для запобігання прилипання до таблетки з отриманням заготовок з допомогою додавання стеаринової кислоти, стеарату, тальку або мінеральної оливи. Потім змащену суміш піддають пресуванню з отриманням таблеток. Сполуки заявленого винаходу також можуть бути об'єднані з сипким інертним носієм та піддані безпосередньому пресуванню у таблетки без етапів гранулювання або утворення агрегатів. Також може бути передбачено прозоре або непрозоре захисне покриття, яке складається з герметизуючого шару шелаку, покриття з цукру або полімерного матеріалу та гладке покриття з воску. Для розрізнення лікарських форм з різним дозуванням до цього покриття можуть бути додані барвники. Різні види рідини для перорального застосування, як-то розчини, сиропи та еліксири можуть бути отримані у вигляді стандартної лікарської форми таким чином, що обумовлена кількість рідини буде містити задану кількість сполуки. Сиропи можуть бути отримані, наприклад, шляхом розчинення сполуки у відповідним чином ароматизованому водному розчині, тоді як еліксири отримують шляхом застосування нетоксичного спиртового носія. Суспензії звичайно можуть бути отримані шляхом диспергування сполуки у нетоксичному наповнювачі. Також можуть бути додані солюбілізатори та емульгатори, як-то етоксильовані ізостеарилові спирти та поліоксиетилен-сорбітолові етери. Прийнятні для застосування відповідно за ® ® винаходом солюбілізатори охоплюють Cremophor EL, вітамін E, ПЕГ та Solutol . Також можуть бути додані консерванти та/або смакові домішки, як-то такі як масло м'яти перцевої, або натуральні підсолоджувачі, сахарин або інші штучні підсолоджувачі. У разі необхідності, стандартні лікарські препарати для перорального застосування можуть бути мікрокапсульовані. Також може бути отримано препарат для подовження або підтримання вивільнення, наприклад, шляхом застосування покриття з зернистого матеріалу або вбудовування такого матеріалу у полімери, віск тощо. Сполуки заявленого винаходу також можна застосовувати у вигляді ліпосомних систем доставки, таких як невеликі одношарові везикули, великі одношарові везикули та багатошарові везикули. Ліпосоми можуть бути отримані з різних фосфоліпідів, як-то холестерин, стеаріламін або фосфатидилхоліни. Також сполуки заявленого винаходу можуть бути доставлені шляхом застосування моноклональних антитіл у якості індивідуальних носіїв, до яких приєднані молекули цих сполук. Сполуки заявленого винаходу також можуть бути з'єднані з розчинними полімерами в якості носіїв лікарського засобу, яких можна "націлити". Такі полімери можуть охоплювати полівінілпіролідон (ПВП), сополімер пірану, полігідроксипропілметакриламід-фенол, полігідроксиетиласпартамід-фенол або поліетиленоксид-полілізин, заміщений залишками пальмітоїлу. Крім того, сполуки можуть бути з'єднані з класом біорозкладаних полімерів, корисних для досягнення контрольованого вивільнення лікарського засобу. Приклади таких полімерів охоплюють, наприклад, полімолочну кислоту, поліепсілонкапролактон, полігідроксимасляну кислоту, поліортоестери, поліацеталі, полідігідропірани, поліціаноакрилати та зшиті або амфіпатичні блок-сополимери гідрогелів. Лікарські препарати, адаптовані для трансдермального введення можуть бути представлені у вигляді окремих пластирів, призначених залишатися в тісному контакті з епідермісом реципієнта протягом тривалого періоду часу. Наприклад, активний інгредієнт може бути 11 UA 112898 C2 5 10 15 20 25 30 35 40 45 50 55 60 доставлено з пластиру з допомогою хімічних підсилювачів, іонофорезу, некавітаційного ультразвуку, шляхом застосування мікроголок, термоабляції, микродермабразії та електропорації, як загальним чином описано у Nature Biotechnology, 26(11), 1261-1268 (2008), включеному сюди шляхом посилання у зв'язку з зазначеними системами доставки. Лікарські препарати, адаптовані для місцевого введення можуть бути отримані у вигляді мазей, кремів, суспензій, лосьйонів, порошків, розчинів, паст, гелів, спреїв, аерозолів або олій. Для лікування очей або інших зовнішніх тканин, наприклад рота та шкіри можуть бути застосовані препарати у вигляді мазей або кремів. Для отримання препарату у вигляді мазі може бути застосовано активний інгредієнт або на парафіновій або на мазевій основі, яку можна змішувати з водою. Альтернативним чином, активний інгредієнт може бути отримано у вигляді крему з кремовою основою типу "олія-у-воді" або основою типу "вода-в-олії". Лікарські препарати, адаптовані для місцевого введення у око охоплюють очні краплі, у яких активний інгредієнт є розчиненим або суспендованим у прийнятному носії, особливо у водному розчиннику. Лікарські препарати, адаптовані для місцевого введення у рот охоплюють льодяники, пастилки та рідкі препарати для полоскання рота. Лікарські препарати з твердим носієм, адаптовані для назального введення охоплюють грубозернистий порошок, який має розмір часток, наприклад, в діапазоні 20-500 мкм. Порошок застосовують подібно вживанню нюхального тютюну, тобто шляхом швидкої інгаляції з контейнера з порошком, який підносять впритул до носа. Прийнятні препарати для назального введення з рідким носієм охоплюють назальні спреї та каплі з водним або маслянистим розчином активного інгредієнта. Лікарські препарати, адаптовані для введення шляхом інгаляції охоплюють дрібні частинки пилу або аерозолів, які можуть бути отримані з допомогою різних типів дозованих аерозолів під тиском, небулайзерів або інсуфляторів. Лікарські препарати, адаптовані для ректального введення можуть бути представлені у вигляді супозиторіїв або клізм. Лікарські препарати, адаптовані для вагінального введення можуть бути представлені у вигляді вагінальних супозиторіїв, тампонів, кремів, гелів, паст, пін або спреїв. Лікарські препарати, адаптовані для парентерального введення охоплюють водні та неводні стерильні ін'єкційні розчини, які можуть містити антиоксиданти, буфери, бактеріостатичні та розчинені речовини, які надають композиції ізотонічність, подібну до ізотонічності крові передбачуваного реципієнта; а також водні та неводні стерильні суспензії, які можуть включати суспендуючі агенти та загусники. Ці препарати можуть бути представлені у вигляді одиничних доз або можуть знаходитися у багатодозових контейнерах, наприклад у запаяних ампулах та флаконах та можуть зберігатися у ліофілізованому стані, який вимагає тільки додавання стерильного рідкого носія, наприклад, води для ін'єкцій, безпосередньо перед застосуванням препарату. На основі стерильних порошків, гранул та таблеток також можуть бути отримані ін'єкційні розчини та суспензії для негайного застосування. На додачу до детально перелічених вище інгредієнтів, препарати можуть містити також інші прийнятні у цей галузі агенти в залежності від типу вибраного препарату. Наприклад, препарати, прийнятні для перорального введення можуть містити смакові домішки або барвники. Сполуки заявленого винаходу та їх солі та сольвати можуть бути застосовані окремо або у поєднанні з іншими терапевтичними агентами у лікуванні зазначених вище станів. Наприклад, при лікуванні крихкості кісток, комбінацію за винаходом можна застосувати разом з іншими анаболічними або спрямованими до лікування остеопорозу терапевтичними агентами. У якості прикладу, комбінаційне лікування остеопорозу за винаходом буде полягати у введенні принаймні однієї сполуки заявленого винаходу та у застосуванні принаймні одного іншого препарату для лікування остеопорозу, як-то, наприклад, Boniva® (ібандронат натрію), Fosamax® (алендронат), Actonel® (ризедронат натрію) або Prolia™ (деносумаб). Сполука (сполуки) заявленого винаходу та інший (інші) фармацевтично активний (активні) агент(агенти) можуть бути введені разом або по окремості та, у разі окремого застосування, це введення може бути здійснено одночасно або послідовно у будь-якому порядку. Кількість (кількості) сполуки (сполук) заявленого винаходу та іншого фармацевтично активного агента (агентів) та відповідні проміжки часу введення можна буде вибрати з метою досягнення бажаного комбінованого терапевтичного ефекту. Введення сполуки заявленого винаходу у комбінації з іншими лікувальними агентами може бути здійснено комбінативно шляхом одночасного введення: (1) унітарної фармацевтичної композиції, яка містить обидві сполуки; або (2) окремих фармацевтичних композицій, кожна з яких містить одну з цих сполук. Альтернативним чином, 12 UA 112898 C2 5 10 15 20 25 30 35 40 45 50 55 60 комбінацію може бути введено окремо послідовним шляхом, який полягає у введенні спочатку одного лікувального агента, а потім другого та навпаки. Таке послідовне введення може бути обмеженим або віддаленим у часі. Інші потенційні терапевтичні комбінації містять сполуки даного винаходу у поєднанні з іншими сполуками заявленого винаходу, стимуляторами росту, стимуляторами секреції гормону росту (наприклад, з греліном), фактором вивільнення гормону росту та його аналогами, гормоном росту людини та його аналогами (наприклад, препаратами Genotropin®, Humatrope®, Norditropin®, Nutropin®, Saizen®, Serostim®), соматомединами, альфа-адренергічними агоністами, агоністами серотоніну 5-HTD, пригнічувачами соматостатину або вивільнення соматостатину, пригнічувачами 5-альфа-редуктази, пригнічувачами ароматази, агоністами або антагоністами GnRH, паратиреоїдним гормоном, естрогеном, тестостероном, SERM (селективними модуляторами рецепторів естрогену), агоністами або антагоністами прогестеронового рецептора та/або з іншими модуляторами ядерних гормональних рецепторів. Сполуки заявленого винаходу можуть бути застосовані у лікуванні різних розладів та станів, отже вони можуть бути застосовані у поєднанні з різними іншими прийнятними терапевтичними агентами, які є корисними у лікуванні цих розладів або станів. Необмежені приклади такого застосування охоплюють застосування комбінації даного винаходу з антидіабетичними агентами, лікувальними засобами, спрямованими проти розвитку остеопорозу, засобами проти ожиріння, протизапальними засобами, заспокійливими агентами, антидепресантами, антигіпертензивними агентами, антитромбоцитарними, антитромботичними та тромболітичними препаратами, серцевими глікозидами, агентами, які зменшують рівні холестерину, гіполіпідемічними засобами, антагоністами минералокортикоїдного рецептора, пригнічувачами фосфодіестерази, кінази, тироїдними міметиками, анаболічними агентами, засобами противірусної терапії, засобами для лікування когнітивних розладів, розладів сну, сексуальної дисфункції, контрацептивами, цитотоксичними агентами, з променевою терапією, антипроліферативними та протипухлинними агентами. Крім того, сполуки заявленого винаходу можуть бути об'єднані з харчовими добавками, як-то амінокислоти, тригліцериди, вітаміни (в тому числі вітамін D, див., наприклад, Hedström et al. (2002) J Bone Joint Surg Br. 84(4):497-503), мінералами, креатином, пілоєвою кислотою, карнитином або коензимом Q10. Зокрема сполуки заявленого винаходу вважаються корисними для окремого застосування або для застосування у поєднанні з іншими агентами у прискоренні загоєння ран та у лікуванні гіпогонадизму, саркопенії, остеопорозу, м'язової атрофії, хвороб, які викликають виснаження, різних типів кахексії (в тому числі пов'язаних з раком, хронічною обструктивною хворобою легень (ХОЗЛ), кінцевою стадією хронічної ниркової недостатності (ХНН), серцевою недостатністю, захворюванням на ВІЛ та його лікування та цукровим діабетом першого та другого типу), слабкості, сухості очей, гіперплазії та раку передміхурової залози, раку молочної залози, вазомоторних станів, пов'язаних з менопаузою та андропаузою, нетримання сечі, сексуальної та еректильної дисфункції, депресії, фіброзного захворювання матки, ендометріозу, акне, гірсутизму, імпотенції, а також для застосування у чоловічої контрацепції та у гормональній замісній терапії (як чоловічої, так і жіночої) та застосування у якості стимулятора гемопоезу та анаболічного агента. Сполуки заявленого винаходу можна отримати з допомогою різних способів, як-то з допомогою добре відомих стандартних способів синтезу. Ілюстративні загальні способи синтезу наведені нижче з наступним отриманням певних сполук заявленого винаходу у робочих прикладах. На всіх зображених нижче схемах застосування захисних груп для чутливих сполук або реакційних груп здійснено за необхідністю згідно за загальними принципами синтетичної хімії. Захисними групами можна маніпулювати у відповідності зі стандартними способами органічного синтезу (T. W. Green та P. G. M. Wuts (1991) Protecting Groups in Organic Synthesis (“ Захисні групи у органічному синтезі “), John Wiley & Sons, включено сюди шляхом посилання щодо захисних груп). Ці групи видаляють на зручній стадії синтезу сполуки з застосуванням відомих фахівцям у цій галузі способів. Вибір процесів, а також умов реакції та порядку їх виконання повинен бути сумісним з процесом отримання сполук за Формулою (I), (I") або (I’’). Досвідченим фахівцям у цей галузі також зрозуміло можливе існування стереоцентру у сполуках за Формулою (I), (I") або (I’’). Відповідним чином, заявлений винахід охоплює всі можливі стереоізомери, а також не тільки рацемічні сполуки, але й окремі енантіомери. Якщо бажано отримати сполуку у вигляді одиничного енантіомера, то така сполука може бути отримана шляхом стереоспецифічного синтезу або шляхом розділення кінцевого продукту або будь-якої прийнятної проміжної сполуки. Розділення кінцевого продукту, проміжної сполуки або початкового матеріалу може бути здійснено з допомогою будь-якого прийнятного відомого у цей 13 UA 112898 C2 галузі способу. Див., наприклад, Stereochemistry of Organic Compounds ("Стереохімія органічних сполук") by E. L. Eliel, S. H. Wilen та L. N. Mander (Wiley-Interscience, 1994), включено сюди шляхом посилання щодо стереохімії. Схема 1 5 10 15 20 Cполуки за Формулою (I) можуть бути синтезованими шляхом алкілування полізаміщених індолів з альфа-галоестерами (Схема 1). Початкові індоли можуть бути отримані згідно за опублікованими процедурами (див.,наприклад, US2008139631A1). Потім до відповідних естерів додають реагенти Гріньяра, як-то метилмагній йодид з отриманням сумішей метилкетонів та третинних спиртів. Схема 2 Наступна структурна диверсифікація для отримання сполуки за Формулою (I) полягає у скороченні таких саме індолів, які несуть естери за Схемою 1 (Схема 2). Отримані первинні спирти потім обробляють мезилхлоридом з наступною обробкою тіометоксидом натрію для отримання тіоетерів. В результаті окиснення з препаратом Oxone® отримують відповідні метилсульфони. Схема 3 Інший спосіб отримання сполук за Формулою (I) починається з застосування полізаміщених aрилфторидів, отриманих шляхом простого арильного літіювання наявних у продажу 4 14 UA 112898 C2 5 10 15 фторбензонітрилів з наступним згашуванням реакції йодом (Схема 3). Потім відповідні йодоарени з'єднують з TMS-ацетиленом шляхом стандартних способів опосередкованого паладієм синтезу. Отримані алкініларени далі обробляють амінами з отриманням вторинних амінових проміжних сполук, які утворюють циклічні структури з отриманням відповідних індолів після обробки основою. Відсутні у продажу амінові сполуки-партнери для етапу нуклеофільного заміщення були синтезовані з допомогою стандартних способів. Скорочення. Символи та позначення, застосовані у процесах, схемах та прикладах цієї заявки узгоджено зі схемами та позначеннями, застосованими у сучасній науковій літературі, як-то, наприклад, у науковому журналі Journal of the American Chemical Society або Journal of Biological Chemistry. Зокрема, у прикладах та у тексті цього документу можуть бути застосовані наступні скорочення: г. (грами); мг. (міліграми); л (літри); мл(мілілітри); мкл (мікролітри); N (нормальність); M (молей); мM (мілімолей); Гц (Герц); мГц (мегагерц); rt (кімнатна температура); хв. (хвилин); год. (годин); д. (доба); МС (мас-спектроскопія); РХМС (рідинна хроматомас-спектроскопія); ГХМС (газова хроматомас-спектроскопія); ESI (іонізація електророзпилюванням); ВЕРХ (високоефективна рідинна хроматографія); рsi (Фунт-сила на квадратный дюйм) H2 (газоподібний водень) Pd(C) (паладієва чернь); ee (енантіомерна чистота); NH4Cl (хлорид амонію); THF (тетрагідрофуран); MeCN (ацетонітрил); CH2Cl2 (метиленхлорид); Pd(PPh3)4 (тетракісфенілфосфін паладію); NaOH (гідроксид натрію); TFA (трифторцтова кислота); CDCl3 (дейтерований хлороформ); CD3OD (дейтерований метанол); SiO2 (діоксид кремнію); DMSO (диметилсульфоксид); EtOAc (етилацетат); Na2SO4 (сульфат натрію); HCl (соляна кислота); CHCl3 (хлороформ); DMF (N, N-диметилформамід); PhMe (толуол); Cs2CO3 (карбонат цезію); Me (метил); Et (етил); EtOH (етанол); MeOH (метaнол); t-Bu (трет-бутил); Et2O (діетиловий етер); N2 (азот); нас. (насичений); NaHCO3 (бікарбонат натрію); K2CO3 (карбонат калію); Zn(CN)2 (ціанід цинку); NMP (N-метил-2-піролідон); DIEA (діізопропілетиламін); LiBH4 (боргідрид літію); Et3N (тріетиламін); Oxone (пероксомоносульфат калію); LDA (діізопропіламід літію); Na2S2O3 (тіосульфат натрію); DIPA (діізопропіламін); PTFE (політетрафторетилeн); KOtBu (калій t-бутоксид); гекс. (гексани); напівпреп. (напівперпаративне); NaCNBH3 (ціаноборгідрид натрію); CuI (йодид міді); Pd(PPh3)2Cl2 (біс(трифенілфосфін)паладію хлорид); безв.(безводний); DMAC (диметилацетамід); dppf (1,1'-біс(дифенілфосфіно)фероцен); Pd2(dba)3 (трис(дибензилиденацетон)дипаладий (0)); PMHS (полі(метилгидросилоксан); MsCl (мезилхлорид); вод. (водний); TBAF (тетра-n-бутиламонію бромід) n-BuLi (n-бутиллітій); TsOH (толуолсульфонова кислота); MTBE (метил t-бутиловий етер); Boc2O (di-t-бутилдикарбонат). Всі температури, якщо не вказано іншого, наведені у цьому документі у градусах Цельсію o ( C). Всі реакції, якщо не вказано іншого, відбувалися у інертному середовищі при кімнатній температурі. Реагенти, застосовані без синтетичних компонентів були придбані з торгівельних джерел або отримані з допомогою способів, описаних у науковій літературі. UPLC-MS – аналіз (надзвичайно ефективна рідинна хроматографія з мас-спектроскопією) було здійснено з допомогою хроматографічної системи Waters Acquity UPLC system з застосуванням колонки Waters BEH C18 розмірами 2,1 × 50 мм при 40 °C. Була отримана 15 UA 112898 C2 5 10 15 20 25 30 35 неповна петля з переповненням голки (0,5 мкл) та зразки піддали УФ-визначенню з довжиною хвилі 210-350 нм та частотою сканування 40 Гц (детектор з фотодіодною матрицею Waters Acquity). Градієнт води +0,2 % мурашиної кислоти (об./об.) (розчинник A) / ацетонітрилу +0,15 % мурашиної кислоти (об./об.) (розчинник B) було здійснено з початковим співвідношенням 95/5 % (A/B) до 1/99 % (протягом 1,10 хв.) та він тривав до 1,5 хв. Швидкість потоку дорівнювала 1 мл/хв. Мас-спектроскопічний аналіз здійснювали з допомогою мас-спектрометра Waters Acquity SQD зі скануванням шляхом змінної позитивної / негативної іонізації електроспреем (125-1000 атомних одиниць маси) з часом сканування у 105 мілісекунд та затримкою сканування у 20 мілісекунд. 1 ЯМР H спектри були отримані з допомогою ЯМР-спектрофотометру Varian Inova (400 MГц). Зразки розчинили у 99,9 % дейтерованому хлороформі-D, DMSO-d6 або d4-метанолі, як зазначено для кожного зразка. Хімічні зсуви відображені у мільйонних частках (мд., δ -одиниці). Константи з'єднання наведені у Герцах (Гц). Структура розщеплення описує наявні мультіплетності, позначені як s (синглет), d (дуплет), t (триплет), q (квартет), m (мультиплет) або b (уширений). Приклади Для цілей наступних прикладів, якщо зазначено, що сполуку "синтезували, як описано" у іншому Прикладі, то це вказує на те, що цю сполуку синтезували істотно так, як описано у іншому прикладі та з такими змінами, які знаходяться у прийнятних межах у цієї галузі. Приклад 1 Метил 2-[5-ціано-2-метил-4-(трифторметил)-1H-індол-1-іл]пропаноат. Суміш 2-метил-4-(трифторметил)-1H-індол-5-карбонітрилу (див., наприклад, US2008139631A1) (0,300 г., 1,338 мМ), карбонату цезію (0,654 г., 2,007 мМ) та метил 2бромопропаноату (0,223 мл, 2,007 мМ) у DMF (3 мл) нагрівали при 90 °C протягом години. Після охолодження реакційну суміш розділили між Et 2O (30 мл) та водою (25 мл). Органічну фазу промили водою (20 мл) та розсолом (10 мл). Об'єднані водні фази промили Et 2O (2 × 25 мл). Органічні фази об'єднали, промили розсолом, підсушили над Na 2SO4, відфільтрували та піддали концентруванню. Залишок очистили шляхом хроматографії на силікагелі з елююванням градієнтом 5-40 % EtOAc-гексану з отриманням метил 2-[5-ціано-2-метил-4-(трифторметил)-1Hіндол-1-іл]пропаноату (0,419 г., вихід - 94 %): MS (ESI): m/z 311 (MH+). Приклад 2 Метил 2-[5-ціано-2-метил-4-(трифторметил)-1H-індол-1-іл]бутаноат. Сполуку синтезували подібно тому, як зазначено у Прикладі 1 з застосуванням 2-метил-4(трифторметил)-1H-індол-5-карбонітрилу та метил 2-бромобутаноату: MS (ESI): m/z 325 (MH+). Приклади 3 та 4. Приклад 3 16 UA 112898 C2 Приклад 4 5 10 15 20 2-метил-1-(1-метил-2-оксопропіл)-4-(трифторметил)-1H-індол-5-карбонітрил (Приклад 3) та 1-(2-гідрокси-1,2-диметилпропіл)-2-метил-4-(трифторметил)-1H-індол-5-карбонітрил (Приклад 4). До крижаного розчину йодистого метил-магнію (3M у Et2O) (0,322 мл, 0,967 мМ) у Et2O (1 мл) додали розчин метил 2-[5-ціано-2-метил-4-(трифторметил)-1H-індол-1-іл]пропаноату (Приклад 1) (0,100 г., 0,322 мМ) у Et2O (1 мл). Гетерогенну суміш перемішували на крижаній бані протягом 5 хв., потім при кімнатній температурі протягом 10 хв. та потім ще приблизно годину при 38 °C. Після охолодження реакційну суміш розвели EtOAc (5 мл), додали водний насичений розчин NH4Cl (5 мл) та отриману суміш розділили між EtOAc (25 мл) та водою (15 мл). Органічну фазу промили розсолом, підсушили над Na2SO4, відфільтрували та піддали концентруванню. Залишок очистили шляхом хроматографії на силікагелі з послідовним елююванням 50 %, 75 % та 100 % CH2Cl2-гексанами з отриманням 2-метил-1-(1-метил-2-оксопропіл)-4-(трифторметил)1H-індол-5-карбонітрилу (0,008 г., вихід - 8 %, менш полярний продукт) (MS (ESI): m/z 295 (MH+)) та 1-(2-гідрокси-1,2-диметилпропіл)-2-метил-4-(трифторметил)-1H-індол-5-карбонітрилу (0,069 г., вихід - 60 %, більш полярний продукт) (MS (ESI): m/z 311 (MH+). Приклади 5 та 6. Приклад 5 Приклад 6 25 1-(1-етил-2-оксопропіл)-2-метил-4-(трифторметил)-1H-індол-5-карбонітрил (Приклад 5) та 1(1-етил-2-гідрокси-2-метилпропіл)-2-метил-4-(трифторметил)-1H-індол-5-карбо нітрил (Приклад 6). Сполуку синтезували подібно тому, як зазначено у Прикладах 3 та 4 з застосуванням метил 2-[5-ціано-2-метил-4-(трифторметил)-1H-індол-1-іл]бутаноату 17 UA 112898 C2 5 10 15 20 25 30 Приклад 5. (вихід - 8 %): 1-(1-етил-2-оксопропіл)-2-метил-4-(трифторметил)-1H-індол-5карбонітрил: MS (ESI): m/z 309 (MH+). Приклад 6 (вихід - 53 %): 1-(1-етил-2-гідрокси-2-метилпропіл)-2-метил-4-(трифторметил)-1Hіндол-5-карбонітрил: MS (ESI): m/z 325 (MH+). Приклад 7 1-(1-гідроксипропан-2-іл)-2-метил-4-(трифторметил)-1H-індол-5-карбонітрил До крижаного розчину метил 2-(5-ціано-2-метил-4-(трифторметил)-1H-індол-1-іл) пропаноату (Приклад 1) (0,263 г., 0,848 мМ) у THF (5 мл) по краплям додали LiBH4 (2M у THF) (1,695 мл, 3,39 мМ). Після закінчення додавання відновника холодну баню усунули та суміш перемішали при кімнатній температурі. Через 2 год. реакційну суміш знову охолодили на крижаній бані та повільно додали насичений водний розчин NH4Cl (15 мл). Потім суміш розчинили EtOAc (40 мл) та повільно додали до неї 1N HCl (10 мл). Отримані фази відокремили та водну фазу промили EtOAc (20 мл). Об'єднані органічні фази промили розсолом, підсушили над Na 2SO4, відфільтрували та піддали концентруванню. Залишок очистили шляхом хроматографії на силікагелі з застосуванням 20-60 % градієнта EtOAc-гексан з отриманням 1-(1-гідроксипропан-2іл)-2-метил-4-(трифторметил)-1H-індол-5-карбо нітрилу (0,212 г., вихід - 83 %) у вигляді білої твердої речовини: MS (ESI): m/z 283 (MH+). Приклад 8 2-метил-1-(1-(метилтіо)пропан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил. A. 2-(5-ціано-2-метил-4-(трифторметил)-1H-індол-1-іл)пропілметансульфонат. До розчину 1-(1-гідроксипропан-2-іл)-2-метил-4-(трифторметил)-1H-індол-5-карбо нітрилу (Приклад 7) (0,110 г., 0,390 мМ) та Et3N (0,068 мл, 0,487 мМ) у CH2Cl2 (4 мл) по краплям додали метансульфонілхлорид (0,038 мл, 0,487 мМ). Після двохгодинного перемішування при кімнатній температури реакційну суміш піддали концентруванню до сухого стану. Залишок розділили між EtOAc (30 мл) та 0.2N HCl (15 мл). Органічну фазу промили водою та розсолом, підсушили над Na2SO4, відфільтрували та піддали концентруванню. Залишок очистили шляхом хроматографії на силікагелі з застосуванням градієнта 25-60 % EtOAc-гексан з отриманням 2-(5-ціано-2-метил4-(трифторметил)-1H-індол-1-іл)пропілметансуль-фонату (0,145 г., вихід - 97 %) у вигляді безбарвного масла: MS (ESI): m/z 361 (MH+). 18 UA 112898 C2 5 10 15 20 25 30 B. 2-метил-1-(1-(метилтіо)пропан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил. До розчину 2-(5-ціано-2-метил-4-(трифторметил)-1H-індол-1-іл)пропілметансульфонату (0.145 г., 0.402 мМ) у DMF (3 мл) однією порцією додали тіометоксид натрію (0.056 г., 0.805 мМ). Через 90 хв. до реакційної суміші додали ще частину тіометоксиду натрію (2 екв.) та суміш перемішували ще протягом години. Потім реакційну суміш розвели водою (25 мл) та екстрагували EtOAc (30 мл). Органічну фазу промили 0.1N HCl (1 × 20 мл) та розсолом, підсушили над Na2SO4, відфільтрували та піддали концентруванню. Залишок очистили шляхом хроматографії на силікагелі з застосуванням градієнта 0-30 % EtOAc-гексан з отриманням 2метил-1-(1-(метилтіо)пропан-2-іл)-4-(трифторметил)-1H-індол-5-карбо нітрилу (0,094 г.,вихід 71 %) у вигляді безбарвного масла: MS (ESI): m/z 313 (MH+). Приклад 9 2-метил-1-(1-(метилсульфоніл)пропан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил. До крижаного розчину 2-метил-1-(1-(метилтіо)пропан-2-іл)-4-(трифторметил)-1H-індол-5карбонітрилу (Приклад 8) (0,045 г., 0,144 мМ) у MeOH (4 мл) додали розчин препарату Оксон (Oxone) (0,133 г., 0,216 мМ) у воді (2 мл) та через годину додали ще певну кількість препарату Оксон (0,100 г., 0,163 мМ) та суміш перемішали при кімнатній температурі. Через 30 хв. реакційну суміш розвели водою (10 мл) та екстрагували EtOAc (20 мл). Органічну фазу промили розсолом, підсушили над Na2SO4, відфільтрували та піддали концентруванню. Залишок очистили шляхом препаративної ВЕРХ-хроматографії (колонка Phenomenex Luna; градієнт: 10100 % MeCN- вода з 0.1 % TFA). Фракції, які містили продукт підлужили водним насиченим розчином K2CO3 та потім сконцентрували до водної фази, яку екстрагували EtOAc. Органічну фазу промили розсолом, підсушили над Na 2SO4, відфільтрували та піддали концентруванню з отриманням 2-метил-1-(1-(метил сульфоніл)пропан-2-іл)-4-(трифторметил)-1H-індол-5карбонітрилу: MS (ESI): m/z 345 (MH+). Приклад 10 2-метил-1-(1-(метилтіо)бутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил. Процес синтезу проводили у 3 етапи, починаючи з метил 2-[5-ціано-2-метил-4(трифторметил)-1H-індол-1-іл]бутаноату (Приклад 2) з застосуванням процедур, подібних описаним у Прикладах 7 та 8: MS (ESI): m/z 327 (MH+). Приклад 11 19 UA 112898 C2 5 10 15 20 25 2-метил-1-(1-(метилсульфоніл)бутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил. Сполуку синтезували подібно тому, як описано у Прикладі 9 з застосуванням 2-метил-1-(1(метилтіо)бутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрилу (Приклад 10): MS (ESI): m/z 359 (MH+). Приклад 12 1-(2-гідрокси-2-метилпропіл)-2-пропіл-4-(трифторметил)-1H-індол-5-карбонітрил. Суміш 2-пропіл-4-(трифторметил)-1H-індол-5-карбонітрилу (0,025 г., 0,099 мМ) (див., наприклад, US2008139631A1), Cs2CO3 (0,129 г., 0,396 мМ), йодіду калію (0,0165 г., 0,099 мМ) та доступного у продажу 1-хлор-2-метилпропан-2-олу (0,041 мл, 0,396 мМ) у DMF (2 мл) нагрівали з температурою 80 °C протягом 90 хв. та потім нагрівали ще протягом години з температурою 120 °C. Далі до реакційної суміші додали ще певну кількість 1-хлор-2-метилпропан-2-олу (0,041 мл, 0,396 мМ), Cs2CO3 (0,129 г., 0,396 мМ) та йодиду калію (0,0165 г., 0,099 мМ) та отриману суміш нагрівали при 120 °C ще протягом 6 год. Після охолодження реакційну суміш розділили між EtOAc (25 мл) та водою (20 мл). Органічну фазу промили водою та розсолом, підсушили над Na2SO4, відфільтрували та піддали концентруванню. Залишок очистили шляхом препаративної ВЕРХ-хроматографії (колонка Phenomenex Luna; градієнт: 10-90 % MeCN-вода з 0.1 % TFA). Фракції, які містили продукт піддали концентруванню до водної фази, яку потім розділили між EtOAc (25 мл) та насиченим водним розчином NaHCO 3 (20 мл). Органічну фазу промили розсолом, підсушили над Na2SO4, відфільтрували та піддали концентруванню. В результаті цієї хроматографії не відбулося відокремлення продукту від початкового індолу, який не приймав участі у реакції, тому матеріал піддали хроматографії у силікагелі з застосуванням градієнта 50 %-100 % CH2Cl2-гексани з отриманням 1-(2-(метилтіо)етил)-2-пропіл-4(трифторметил)-1H-індол-5-карбонітрилу (0,014 г., вихід - 42 %) у вигляді білої твердої речовини: MS (ESI): m/z 325 (M+H). Приклад 13 1-(3-гідрокси-3-метилбутан-2-іл)-2-пропіл-4-(трифторметил)-1H-індол-5-карбонітрил. 30 A. Метил 2-(5-ціано-2-пропіл-4-(трифторметил)-1H-індол-1-іл)пропаноат. 20 UA 112898 C2 Зазначену сполуку синтезували подібно тому, як описано у Прикладі 1 з застосуванням 2пропіл-4-(трифторметил)-1H-індол-5-карбонітрилу та метил 2-бромопропаноату: MS (ESI): m/z 339 (MH+). 5 B. 1-(3-гідрокси-3-метилбутан-2-іл)-2-пропіл-4-(трифторметил)-1H-індол-5-карбонітрил. Зазначену сполуку синтезували подібно тому, як описано у Прикладі 4 з застосуванням метил 2-(5-ціано-2-пропіл-4-(трифторметил)-1H-індол-1-іл) пропаноату: MS (ESI): m/z 339 (MH+). Приклад 14 10 1-(2-(метилтіо)етил)-2-пропіл-4-(трифторметил)-1H-індол-5-карбонітрил. Суміш 2-пропіл-4-(трифторметил)-1H-індол-5-карбонітрилу (0,025 г., 0,099 мМ), Cs2CO3 (0,129 г., 0,396 мМ), (2-хлороетил)(метил)сульфану (0.039 мл, 0.396 мМ) та йодиду калію (0,0165 г., 0,099 мМ) у DMF (2 мл) нагріли до 80 °C. Через приблизно 1 год. до реакційної суміші додали додаткову кількість Cs2CO3 (0,129 г., 0,396 мМ), (2-хлороетил) (метил)сульфану (0,039 мл, 0,396 мМ) та йодиду калію (0,0165 г., 0,099 мМ) та нагрівання тривало ще протягом години. Після охолодження реакційну суміш розділили між EtOAc (25 мл) та водою (20 мл), органічну фазу промили водою та розсолом, підсушили над Na 2SO4, відфільтрували та піддали концентруванню. Залишок очистили шляхом препаративної ВЕРХ-хроматографії (колонка Phenomenex Luna; градієнт: 10-90 % MeCN-вода з 0.1 % TFA). Фракції, які містили продукт піддали концентруванню до водної фази, яку потім розділили між EtOAc (25 мл) та насиченим водним розчином NaHCO3 (20 мл). Органічну фазу промили розсолом, підсушили над Na 2SO4, відфільтрували та піддали концентруванню з отриманням 1-(2-(метилтіо)етил)-2-пропіл-4(трифторметил)-1H-індол-5-карбонітрилу: MS (ESI): m/z 327 (M+H). Приклад 15 15 20 25 30 1-(1-(метилтіо)пропан-2-іл)-2-пропіл-4-(трифторметил)-1H-індол-5-карбонітрил. Зазначену сполуку синтезували у три етапи, починаючи з метил 2-(5-ціано-2-пропіл-4(трифторметил)-1H-індол-1-іл)пропаноату (Приклад 13A) з застосуванням процедур, подібних описаним у Прикладах 7 та 8: MS (ESI): m/z 341 (M+H). Приклад 16 2-(дифторметил)-1-(3-гідрокси-3-метилбутан-2-іл)-1H-індол-4,5-дикарбонітрил. 21 UA 112898 C2 5 A. Метил 2-(4,5-диціано-2-(дифторметил)-1H-індол-1-іл)пропаноат. Зазначену сполуку синтезували подібно тому, як описано у Прикладі 1 з застосуванням 2(дифторметил)-1H-індол-4,5-дикарбонітрилу (див., наприклад, US2008139631A1) та метил 2бромопропаноату: MS (ESI): m/z 304 (M+H). 10 B. 2-(дифторметил)-1-(3-гідрокси-3-метилбутан-2-іл)-1H-індол-4,5-дикарбонітрил. Зазначену сполуку синтезували подібно тому, як описано у Прикладі 4 з застосуванням метил 2-(4,5-диціано-2-(дифторметил)-1H-індол-1-іл)пропаноату: MS (ESI): m/z 304 (M+H). Приклад 17 15 20 2-(дифторметил)-1-(1-(метилтіо)пропан-2-іл)-1H-індол-4,5-дикарбонітрил. Зазначену сполуку синтезували у три етапи, починаючи з метил 2-(4,5-диціано-2(дифторметил)-1H-індол-1-іл)пропаноату (Приклад 16A) з застосуванням процедур, подібних описаним у Прикладах 7 та 8: MS (ESI): m/z 306 (M+H). Приклад 18 2-(дифторметил)-1-(1-(метилсульфоніл)пропан-2-іл)-1H-індол-4,5-дикарбонітрил. Зазначену сполуку синтезували подібно тому, як описано у Прикладі 9 з застосуванням 2(дифторметил)-1-(1-(метилтіо)пропан-2-іл)-1H-індол-4,5-дикарбо- нітрилу (Приклад 17): MS (ESI): m/z 338 (M+H). Приклади 19 та 20. Приклад 19 22 UA 112898 C2 Приклад 20 5 10 1-(3-оксoбутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил (Приклад 19) та 1-(3-гідрокси3-метилбутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил (Приклад 20). A. Метил 2-(5-ціано-4-(трифторметил)-1H-індол-1-іл)пропаноат. Зазначену сполуку синтезували подібно тому, як описано у Прикладі 1 з застосуванням 4(трифторметил)-1H-індол-5-карбонітрилу (див., наприклад, US2008139631A1) та метил 2бромопропаноату: MS (ESI): m/z 297 (MH+). Приклад 19 Приклад 20 15 20 B. 1-(3-оксобутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил (Приклад 19) та 1-(3гідрокси-3-метилбутан-2-іл)-4-(трифторметил)-1H-індол-5-карбо- нітрил (Приклад 20) Зазначену сполуку синтезували подібно тому, як описано у Прикладах 3 та 4 з застосуванням метил 2-(5-ціано-4-(трифторметил)-1H-індол-1-іл)пропаноату. Приклад 19: (вихід - 8 %): 1-(3-оксобутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил: MS (ESI): m/z 281 (MH+). Приклад 20: (вихід - 53 %): 1-(3-гідрокси-3-метилбутан-2-іл)-4-(трифторметил)-1H-індол-5карбонітрил: MS (ESI): m/z 297 (MH+). Приклад 21 23 UA 112898 C2 (S)-1-(3-гідрокси-3-метилбутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил. 5 10 15 20 25 30 35 A. 2-(4-фтор -2-(трифторметил)феніл)-1,3-діоксолан. До розчину доступного у продажу 4-фтор -2-(трифторметил)бензальдегід (15 г., 78 мМ) у толуолі (90 мл) додали етиленгліколь (21,77 мл, 390 мМ) та TsOH (0,743 г., 3,90 мМ). Суміш потім нагрівали (з насадкою Дина-Старка, прикріпленою до парціального конденсатора) на масляній бані до 140 °C протягом 4 год., з отриманням приблизно 1,4-1,5 мл води, яка наближалося до очікуваного об'єму. Результати тонкошарової хроматографії (20 % EtOAcгексан) показали наявність головної та більш полярної плями. Суміш розчинили у EtOAc (100 мл) та промили водою (50 мл). Органічну фазу промили водою (1 × 50 мл) та розсолом (50 мл), підсушили над Na2SO4, відфільтрували та піддали концентруванню. Залишок очистили з допомогою хроматографії на колонці з силікагелем (колонка ISCO, 330 г.) з елююванням градієнтом 0-10 % EtOAc-гексан. Вага отриманих чистих фракцій продукту складала 9,83 г. (вихід - 51 %): MS (ESI): m/z 237 (M+H). B. 2-(4-фтор -3-йодо-2-(трифторметил)феніл)-1,3-діоксолан. До розчину 2-(4-фтор -2-(трифторметил)феніл)-1,3-діоксолану (2,52 г., 10,65 мМ) та DIPA (0,150 мл, 1,067 мМ) у безводному THF (30 мл) при -78 °C по краплям додали розчин n-BuLi (nбутиллітію) у гексанах (4,26 мл, 10,65 мМ) з такою швидкістю, що внутрішня температура зберігалася на позначці < -70 °C. Отриманий блідий жовтий розчин перемішували три години при -78 °C та під час перемішування спостерігали зміну кольору на блакитний. Потім до реакційної суміші однією порцією додали йод (2,97 г., 11,71 мМ) (зі зміненням внутрішньої температури з -78 °C до -66 °C). Отриману суміш перемішували 30 хв., зняли з охолоджуючої бані та реакцію зупинили шляхом додавання 10 % Na2S2O3. Після набування кімнатної температури суміш налили у воду та екстрагували EtOAc (x3). Об'єднані органічні компоненти промили (водою, розсолом), підсушили над Na2SO4 та піддали концентруванню у вакуумі. Залишок очистили з допомогою рідинної хроматографії в умовах низького тиску (силікагель, EtOAc / гексани, градієнтне елюювання) з отриманням 2,49 г. суміші бажаного продукту та початкового матеріалу, який не приймав участь у хімічній реакції (зі співвідношенням приблизно 1 9:1, як було виміряно шляхом H ЯМР). Отриману суміш потім розділили шляхом рідинної хроматографії зі зворотною фазою (колонка C18, градієнт MeOH / вода) з отриманням 2-(4-фтор -3-йодо-2-(трифторметил)феніл)-1,3-діоксолану (2,13 г., 5,88 мМ, вихід – 55,2 %) у вигляді блідого жовтого масла: 1H ЯМР (400 MHz, CDCl3) δ мд 7,87 (dd, J=8.8, 5.7 Hz, 1 H) 7.23 (m, J=8.2, 7.5, 0.6, 0.6 Hz, 1 H), 6.23 (q, J=2.1 Hz, 1 H), 4.10-4.03 (m, 4 H). C. 4-фтор -3-йодо-2-(трифторметил)бензонітрил. Етап 1. 24 UA 112898 C2 5 10 15 20 25 30 35 40 45 50 До розчину 2-(4-фтор -3-йодо-2-(трифторметил)феніл)-1,3-діоксолану (9.43 г., 26.0 мМ) у ацетоні (60 мл) додали водний розчин соляної кислоти (52,1 мл, 52,1 мМ) та суміш 1 нагрівали з дефлегмуванням впродовж 15 год. (повне перетворення дослідили з допомогою H ЯМР). Отриману суміш охолодили, повільно налили у насичений розчин NaHCO 3 та екстрагували EtOAc (x3). Об'єднані органічні компоненти промили (водою, розсолом), підсушили над Na2SO4 та піддали концентруванню у вакуумі з отриманням 8.09 г блідої жовтої сиропоподібної речовини, яка кристалізувалося при стоянні (бензальдегід с загальною концентрацією приблизно 25,4 мМ). Етап 2. До розчину бензальдегіду, отриманого на Етапі 1 та Et3N (7,08 мл, 50,8 мМ) у хлороформі (75 мл) однією порцією додали гідрохлорид гідроксиламіну (1,864 г., 26,8 мМ) та отриману суміш перемішували при кімнатній температурі. Через 3 год. після цього до реакційної суміші додали ще певну частину гідрохлориду гідроксиламіну (0,441 г.; 6,35 мМ) та перемішування тривало ще 1 протягом ночі. Повне перетворення на оксим було виявлено через 18 год. з допомогою H ЯМРаналізу. Етап 3. До розчину, отриманого на Етапі 2 додали Et3N (7,08 мл, 50,8 мМ) та суміш охолодили на крижаній бані, після чого до неї по краплям протягом 15 хв. додавали розчин трифосгену (8,27 г., 27,9 мМ) у хлороформі (20 мл). Повне перетворення було виявлено через 1 год. з допомогою 1 H ЯМР-аналізу. Отриману суміш промили (двічі водою, NaHCO3, розсолом), підсушили над Na2SO4 та піддали концентруванню у вакуумі. Отриману необроблену тверду речовину піддали повторній кристалізації з гептану з отриманням 4-фтор-3-йодо-2-(трифторметил) бензонітрилу 1 (5,88 г., 18,67 мМ, вихід – 71,7 %) у вигляді блідої жовтої твердої речовини: H ЯМР (400 MHz, CDCl3) δ 7.85 (ddd, J=8.6, 5.1, 0.5 Hz, 1 H), 7.36 (ddd, J=8.6, 6.6, 0.5 Hz, 1 H); MS (GCMS EI) m/z + 315 ([M] , 100 %). Альтернативний шлях отримання сполуки за Прикладом 21C: 4-фтор -3-йодо-2-(трифторметил)бензонітрил. До свіжоприготованого розчину LDA (119 мМ) у безводному THF (250 мл) при -45 °C по краплям додали розчин доступного у продажу 4-фтор-2-(трифторметил) бензонітрилу (21,5 г., 114 мМ) у THF (30 мл) зі швидкістю, яка дозволила внутрішній температурі суміші зберігатися на рівні < -40 °C (впродовж додавання розчин став темним). Отриману суміш перемішували 30 хв. при -45 °C, охолодили до -70 °C та однією порцією додали йод (31,7 г., 125 мМ) (-70 °C → 52 °C). Отриману суміш перемішували протягом години, охолоджуючу баню усунули та реакцію зупинили шляхом додавання 10 % Na2S2O3 (приблизно 250 мл) та 1N HCl (приблизно 125 мл). Отриману суміш тричі екстрагували EtOAc, об'єднані органічні компоненти промили (водою, розсолом), підсушили над Na2SO4 та піддали концентруванню у вакуумі. Залишок двічі очистили з допомогою рідинної хроматографії в умовах низького тиску (силікагель, EtOAc / гексани, градієнтне елюювання) з наступною рекристалізацією з гептану (30 мл) з отриманням 4-фтор-3йодо-2-(трифторметил) бензонітрилу (15,79 г., 50,1 мМ, вихід – 44,1 %) у вигляді блідої жовтої 1 твердої речовини: H ЯМР (400 MHz, CDCl3) δ 7.85 (ddd, J=8.6, 5.1, 0.5 Hz, 1 H), 7.36 (ddd, J=8.6, + 6.6, 0.5 Hz, 1 H); MS (GCMS EI) m/z 315 ([M] , 100 %). D. 4-фтор -2-(трифторметил)-3-((триметилсиліл)етиніл)бензонітрил. 20 мл посудину наповнили 4-фтор-3-йодо-2-(трифторметил)бензонітрилом, (0,315 г., 1,00 мМ), Pd(PPh3)2Cl2 (0,014 г., 0,020 мМ) та CuI (0,0076 г., 0,040 мМ) та зачинили її гумовою мембраною. Потім з допомогою шприца до суміші додали безводний PhMe (5 мл) та DIPA (0,210 мл, 1,500 мМ) та суміш дегазували 10 хв. шляхом барботування азотом з одночасним зануренням посудини в ультразвукову баню. Потім з допомогою шприца до суміші додали по краплям етинілтриметилсилан (0,155 мл, 1,100 мМ) та мембрану замінили обтискною кришкою, 25 UA 112898 C2 5 10 15 20 25 30 35 40 45 покритою політетрафторетиленом. Отриману суміш перемішували у термостаті протягом 60 °C. Після охолодження суміш розчинили у EtOAc та відфільтрували через целіт. Фільтрат промили (насиченим NH4Cl, водою, розсолом), підсушили над Na2SO4 та піддали концентруванню у вакуумі. Залишок очистили з допомогою рідинної хроматографії в умовах низького тиску (силікагель, EtOAc / гексани, градієнтне елюювання) з отриманням 4-фтор-2-(трифторметил)-3((триметилсиліл) етиніл)бензонітрилу (0,231 г., вихід - 81 %) у вигляді світло-помаранчевого 1 масла: H ЯМР (400 MHz, CDCl3) δ 7.75 (ddd, J=8.7, 5.0, 0.6 Hz, 1 H), 7.39 (ddd, J=8.6, 7.8, 0.5 Hz, + + 1 H), 0.28 (s, 9 H); MS (GCMS EI) m/z 285 ([M] , 15 %), 270 ([M-CH3] , 100 %). E. (S)-метил 2- (дибензиламіно)пропаноат. Доступний у продажу гідрохлорид (S)-метил 2-амінопропаноату (10.0 г., 71.6 мМ) суспендували у DMF (35 мл), після чого до реакційної суміші додали K 2CO3 (31.7 г., 229 мМ) з наступним додаванням бензілброміду (18.21 мл, 158 мМ) та отриману суміш перемішували протягом 38 год. при кімнатній температурі. Хромато-масспектрометричний аналіз виявив добрий рівень перетворення продукту протягом цього часу. Реакційну суміш відфільтрували та тверді компоненти промили EtOAc. Отриманий фільтрат потім розчинили у воді та EtOAc та шари рідини розділили. Водну частину екстрагували невеликими кількостями EtOAc. Об'єднані органічні частини підсушили над Na2SO4, відфільтрували та піддали концентруванню з отриманням блідо-жовтого в'язкого масла, яке потім очистили шляхом хроматографії (120 г колонка ISCO з силікагелем, відбір при 254 нм, загальний градієнт - гексани /EtOAc) з отриманням бажаного продукту (15.76 г., 75 %): MS (ESI) m/z 284 (M+H). F. (S)-3-(дибензиламіно)-2-метилбутан-2-ол. (S)-метил 2-(дибензиламіно)пропаноат (15,76 г., 55,6 мМ) розчинили у Et2O (400 мл), потім охолодили до приблизно 0ºC та додали йодид метилмагнію (27,7 мл, 3 M), після чого суміш, яка набула гетерогенного білого кольору, залишили нагріватися до температури навколишнього середовища. Проведена наступного дня (17 год.) рідинна хроматомас-спектрометрія показала наявність перетворення компонентів реакційної суміші на бажаний продукт. Реакцію повільно зупинили насиченим водним розчином NH4Cl та потім розчинили у воді та EtOAc. Шари відокремили та водну частину екстрагували EtOAc. Об'єднані органічні частини підсушили над Na2SO4, відфільтрували та піддали концентруванню з отриманням блідо-жовтого масла., яке після сушіння було ідентифіковано в якості бажаного продукту з допомогою рідинної хроматомас-спектрометрії. Отриманий матеріал застосували безпосередньо на наступному етапі: MS (ESI) m/z 284 (M+1). G. (S)-3-аміно- 2-метилбутан-2-ол (S)-3-(дибензиламіно)-2-метилбутан-2-ол (15,76 г., 55,6 мМ) розчинили у MeOH (250 мл) та потім обробили Pd(C) (2,0 г., 10 % сухої ваги, 50 % води). Реакційну посудину потім продули азотом та відкачали газ до вакууму (сім циклів продування та відкачування) та потім здійснили ще два подібні цикли, продуваючи колбу воднем з тиском у 448,1594 кПа (65 psi) (який підтримували у посудині протягом перших двох годин з нагнітанням у разі потреби). Далі реакційну суміш залишили перемішуватися протягом ночі при температурі навколишнього середовища, після чого реакційну посудину знов по черзі піддали циклам відкачування до вакууму та продування азотом та каталізатор усунули шляхом фільтрування крізь целіт. Позосталу тверду сполуку промили MeOH та додали воду для зменшення можливості 26 UA 112898 C2 5 10 15 20 25 30 35 виникнення пожежі. Фільтрат обережно піддали концентруванню з допомогою роторного вакуумного випарювача (40 мм. рт. ст…, 45 °C) з наступним застосуванням умов високого 1 вакууму з отриманням блідо-жовтої густої рідини (5,60 г., 98 %). З допомогою HЯМР-аналізу було підтверджено відсутність метанолу. Надмірна дія високого вакууму призвела до втрати 1 продукту: H ЯМР (400 MHz, DMSO-d6) δ 4.12 (bs, 1 H), 2.57 (q, J=6.5 Hz, 1 H), 1.40 (bs, 2 H), 1.03 (s, 3 H), 1.00 (s, 3 H), 0.90 (d, J=6.7 Hz, 3 H). H. (S)-1-(3-гідрокси-3-метилбутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил. 4-фтор-2-(трифторметил)-3-((триметилсиліл)етиніл)бензонітрил (0,063 г., 0,221 мМ), (S)-3аміно- 2-метилбутан-2-ол (0,060 г., 0,582 мМ) та DIEA (0,077 мл, 0,442 мМ) об'єднали у N-метил2-піролідоні (NMP) (0,5 мл) та нагріли до 90ºC. Рідинний хроматомас-спектрометричний аналіз, який здійснили через 9 год. після нагрівання показав наявність доброго перетворення компонентів реакційної суміші на аніліновий проміжний продукт та певний бажаний індоловий продукт. Далі реакційну суміш охолодили до кімнатної температури та потім обробили KOtBu (1,98 мл, 1 M у THF). Незважаючи на нагрівання, обробка основою не призвела до перетворення на бажаний індол. Реакцію потім зупинили додаванням насиченого водного розчину NH4Cl та реакційну суміш екстрагували EtOAc. Об'єднані органічні фракції потім піддали концентруванню до отримання жовтого масла, яке потім розчинили NMP (1 мл). Додавання нової кількості KOtBu (1,98 мл, 1 M у THF) призвело до появи темно-коричневого розчину, який потім нагріли до 50ºC. Рідинний хроматомас-спектрометричний аналіз, який здійснили через 0,5 год. після нагрівання, показав наявність перетворення цього проміжного продукту на бажаний індол. Далі реакцію знову зупинили додаванням насиченого водного розчину NH4Cl та реакційну суміш екстрагували EtOAc. Об'єднані органічні компоненти піддали концентруванню до отримання жовтого масла та потім очистили шляхом хроматографії (колонка ISCO, стандартний градієнт гексани / EtOAc, 24 г. силікагелю) з отриманням бажаного продукту. Далі отриману суміш очистили з допомогою напівпрепаративної хроматографії зі зворотною фазою (колонка Agilent, визначення при 230 нм) з отриманням бажаного продукту у вигляді безбарвної гуми: MS (ESI): m/z 297 (MH+). Приклад 22 (R)-1-(3-гідрокси-3-метилбутан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил. Зазначену сполуку синтезували подібно тому, як описано у Прикладі 21, починаючи процес з застосування доступного у продажу гідрохлориду (R)-метил 2-амінопропаноату: MS (ESI): m/z 297 (MH+). Приклад 23 (R)-1-(3-гідрокси-3-метилбутан-2-іл)-4-(трифторметил)індолін-5-карбонітрил. До розчину (R)-1-(3-гідрокси-3-метилбутан-2-іл)-4-(трифторметил)-1H-індол-5-карбо нітрилу (Приклад 22) (0,017 г., 0,057 мМ) у TFA (1.5 мл) на крижаній бані частинами додали NaCNBH 3 27 UA 112898 C2 5 10 (0,0721 г., 1,148 мМ). Після перемішування на цій бані протягом години реакційну суміш по частинам піддали концентруванню. Отриманий залишок розчинили у CH 2Cl2 (20 мл) та промили 0,5 N NaOH (10 мл). Органічну фазу промили 0,5 N NaOH (1 × 10 мл) та розсолом, підсушили над Na2SO4, відфільтрували та піддали концентруванню. Залишок очистили шляхом хроматографії на силікагелі з застосуванням градієнту 10-40 % EtOAc-гексан з отриманням (R)1-(3-гідрокси-3-метилбутан-2-іл)-4-(трифторметил)індолiн-5-карбо- нітрилу: MS (ESI): m/z 299 (M+H). Приклад 24 1-(2-гідрокси-2-метилпентаn-3-іл)-4-(трифторметил)-1H-індол-5-карбонітрил. A. Метил 2-(5-ціано-4-(трифторметил)-1H-індол-1-іл)бутаноат. Зазначену сполуку синтезували подібно тому, як описано у Прикладі 1 з застосуванням 4(трифторметил)-1H-індол-5-карбонітрилу та метил 2-бром бутаноату: MS (ESI): m/z 311 (MH+). 15 20 25 B. 1-(2-гідрокси-2-метилпентаn-3-іл)-4-(трифторметил)-1H-індол-5-карбонітрил. Зазначену сполуку синтезували подібно тому, як описано у Прикладі 4 з застосуванням метил 2-(5-ціано-4-(трифторметил)-1H-індол-1-іл)бутаноату: MS (ESI): m/z 311 (MH+). Приклад 25 1-(1-(метилтіо)пропан-2-іл)-4-(трифторметил)-1H-індол-5-карбонітрил. Зазначену сполуку синтезували у три етапи, починаючи з метил 2-(5-ціано-4(трифторметил)-1H-індол-1-іл)пропаноату (Приклад 19A) з застосуванням процедур, подібних описаним у Прикладах 7 та 8: MS (ESI): m/z 299 (MH+). Приклад 26 28
ДивитисяДодаткова інформація
Назва патенту англійськоюIndolecarbonitriles as selective androgen receptor modulators
Автори англійськоюTurnbull, Philip, Stewart, Cadilla, Rodolfo
Автори російськоюТернбулл Филип Стюарт, Кадиллья Родолфо
МПК / Мітки
МПК: C07D 401/06, A61K 31/44, C07D 209/10, C07D 209/08, A61K 31/40
Мітки: андрогенного, індолкарбонітрили, модулятори, рецептора, селективні
Код посилання
<a href="https://ua.patents.su/54-112898-indolkarbonitrili-yak-selektivni-modulyatori-androgennogo-receptora.html" target="_blank" rel="follow" title="База патентів України">Індолкарбонітрили як селективні модулятори андрогенного рецептора</a>
Попередній патент: Біциклічно заміщені урацили та їх застосування для лікування і/або профілактики захворювань
Наступний патент: Тверді форми n-((s)-2,3-дигідроксипропіл)-3-(2-фтор-4-йодфеніламіно)-ізонікотинаміду
Випадковий патент: Спосіб реконструкції шлунково-кишкового тракту після видалення шлунка












