Спосіб одержання (r)- та (s)-n-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфанаміду та його захищених похідних
Формула / Реферат
1. Спосіб одержання сполуки формули (I-а):
 , формула (I-а)
, формула (I-а)
в якому здійснюють введення у взаємодію 5,6-дифтор-N1-(2-фтор-4-йодфеніл)-3-метоксибензол-1,2-діаміну зі сполукою формули (ІІ-а):
 , формула (ІІ-а)
, формула (ІІ-а)
де
R1 означає Н або захисну групу для спиртової групи;
R2 означає Н або захисну групу для спиртової групи; або
R1 та R2 разом з атомами кисню, до яких вони приєднані, утворюють циклічну захисну групу для 1,2-діольної групи.
2. Спосіб одержання сполуки формули (І-b):
 , формула (I-b)
, формула (I-b)
в якому здійснюють введення у взаємодію 5,6-дифтор-N1-(2-фтор-4-йодфеніл)-3-метоксибензол-1,2-діаміну зі сполукою формули (ІІ-b):
 , формула (ІІ-b)
, формула (ІІ-b)
де
R1 означає Н або захисну групу для спиртової групи;
R2 означає Н або захисну групу для спиртової групи; або
R1 та R2 разом з атомами кисню, до яких вони приєднані, утворюють циклічну захисну групу для 1,2-діольної групи.
3. Спосіб одержання (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду, в якому здійснюють введення у взаємодію сполуки формули (I-а) з кислотою, основою або нуклеофілом; або
експонування сполуки формули (I-а) УФ-випромінюванням:
 , формула (I-а)
, формула (I-а)
де
R1 означає Н або захисну групу для спиртової групи;
R2 означає Н або захисну групу для спиртової групи; або
R1 та R2 разом з атомами кисню, до яких вони приєднані, утворюють циклічну захисну групу для 1,2-діольної групи.
4. Спосіб одержання (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду, в якому здійснюють введення у взаємодію сполуки формули (І-b) з кислотою, основою або нуклеофілом; або експонування сполуки формули (І-b) УФ-випромінюванням:
 , формула (I-b)
, формула (I-b)
де
R1 означає Н або захисну групу для спиртової групи;
R2 означає Н або захисну групу для спиртової групи; або
R1 та R2 разом з атомами кисню, до яких вони приєднані, утворюють циклічну захисну групу для 1,2-діольної групи.
5. Спосіб за будь-яком із пунктів 1-4, де R1 та R2 разом з атомами кисню, до яких вони приєднані, утворюють циклічну захисну групу для 1,2-діольної групи.
6. Спосіб за пунктом 5, де циклічна захисна група для 1,2-діольної групи являє собою 5-членну циклічну захисну групу для 1,2-діольної групи.
7. Спосіб за пунктом 6, де циклічна захисна група для 1,2-діольної групи являє собою 2,2-диметил-1,3-діоксолан-4-іл.
8. Сполука (R)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид:
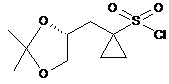 .
.
9. Сполука (S)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид:
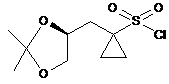 .
.
10. Сполука (R)-3-(2,2-диметил-1,3-діоксолан-4-іл)проп-1-ен-2-сульфонілхлорид:
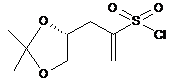 .
.
11. Сполука (S)-3-(2,2-диметил-1,3-діоксолан-4-іл)проп-1-ен-2-сульфонілхлорид:
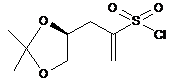 .
.
Текст
Реферат: Даний винахід стосується одержання (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду та (S)-N-(3,4-дифтор-2-(2фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду. UA 106762 C2 (12) UA 106762 C2 UA 106762 C2 5 10 ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ [0001] Даний винахід відноситься до галузей фармацевтичної хімії та синтетичної органічної хімії. (R)-N-(3,4-Дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід та (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонамід є відомими сполуками, що мають інгібувальні властивості щодо MEK ферментів та мають терапевтичну цінність (див. опубліковану заявку на патент США US 2008/0058340 A1). В даній заявці описуються способи їх одержання. СТИСЛИЙ ВИКЛАД СУТІ ВИНАХОДУ [0002] В даній заявці забезпечуються способи одержання сполук формули (I-a): формула (I-a) 1 які включають введення у взаємодію 5,6-дифтор-N -(2-фтор-4-йодфеніл)-3-метоксибензол 15 20 1,2-діаміну зі сполукою формули (II-a): , де 1 R означає H або захисну групу для спиртової групи; 2 R означає H або захисну групу для спиртової групи; або 1 2 R та R разом з атомами вуглецю, до яких вони приєднані, утворюють циклічну захисну групу для 1,2-діольної групи. [0003] В деяких варіантах здійснення, сполука формули (I-a) являє собою (R)-N-(3,4-дифтор2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропан-1-сульфонамід: [0004] В деяких варіантах здійснення, сполука формули (II-a) являє собою (R)-1-((2,2диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид: . [0005] Також у даній заявці забезпечуються способи одержання сполук формули (I-b): 25 формула (I-b) 1 які включають введення у взаємодію 5,6-дифтор-N -(2-фтор-4-йодфеніл)-3-метоксибензол 30 1,2-діаміну зі сполукою формули (II-b): , де 1 R означає H або захисну групу для спиртової групи; 2 R означає H або захисну групу для спиртової групи; або 1 2 R та R разом з атомами вуглецю, до яких вони приєднані, утворюють циклічну захисну групу для 1,2-діольної групи. 1 UA 106762 C2 [0006] В деяких варіантах здійснення, сполука формули (I-b) являє собою (S)-N-(3,4-дифтор2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропан-1-сульфонамід: 5 10 . [0007] В деяких варіантах здійснення, сполука формули (II-b) являє собою (S)-1-((2,2диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид: . [0008] Також у даній заявці забезпечуються способи одержання (R)-N-(3,4-дифтор-2-(2фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду, які включають введення у взаємодію сполуки формули (I-a) з кислотою, основою або нуклеофілом; або експонування сполуки формули (I-a) УФ-випромінюванням: формула (I-a) 20 де 1 R означає H або захисну групу для спиртової групи; 2 R означає H або захисну групу для спиртової групи; або 1 2 R та R разом з атомами вуглецю, до яких вони приєднані, утворюють циклічну захисну групу для 1,2-діольної групи. [0009] В деяких варіантах здійснення, сполука формули (I-a) являє собою (R)-N-(3,4-дифтор2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропан-1-сульфонамід: 25 . [0010] Також у даній заявці забезпечуються способи одержання (S)-N-(3,4-дифтор-2-(2фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду, які включають введення у взаємодію сполуки формули (I-b) з кислотою, основою або нуклеофілом; або експонування сполуки формули (I-b) УФ-випромінюванням: 15 формула (I-b) де 1 R означає H або захисну групу для спиртової групи; 2 R означає H або захисну групу для спиртової групи; або 2 UA 106762 C2 1 5 10 15 20 25 2 R та R разом з атомами вуглецю, до яких вони приєднані, утворюють циклічну захисну групу для 1,2-діольної групи. [0011] В деяких варіантах здійснення, сполука формули (I-b) являє собою (S)-N-(3,4-дифтор2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропан-1-сульфонамід: . 1 2 [0012] В деяких варіантах здійснення, R означає H та R означає захисну групу для 2 1 спиртової групи. В подальших або додаткових варіантах здійснення, R означає H та R означає захисну групу для спиртової групи. В подальших або додаткових варіантах здійснення, обидва 1 2 R та R означають захисну групу для спиртових груп. В подальших або додаткових варіантах 1 2 здійснення, обидва R та R означають водень. В подальших або додаткових варіантах здійснення, захисні групи є однаковими. В подальших або додаткових варіантах здійснення, 1 2 захисні групи є різними. В подальших або додаткових варіантах здійснення, R та R разом з атомами вуглецю, до яких вони приєднані, утворюють циклічну захисну групу для 1,2-діольної групи. В подальших або додаткових варіантах здійснення, циклічна захисна група для 1,2діольної групи являє собою 5-членну циклічну захисну групу для 1,2-діольної групи. В подальших або додаткових варіантах здійснення, циклічна захисна група для 1,2-діольної групи являє собою 2,2-диметил-1,3-діоксолан-4-іл. [0013] Також у даній заявці забезпечуються сполуки, придатні для одержання (R)-N-(3,4дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1сульфонаміду або (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонаміду. [0014] В деяких варіантах здійснення, забезпечуються сполуки (R)-1-((2,2-диметил-1,3діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид та (S)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропан-1-сульфонілхлорид: , . [0015] В деяких варіантах здійснення, забезпечуються сполуки (R)-3-(2,2-диметил-1,3діоксолан-4-іл)проп-1-ен-2-сульфонілхлорид та (S)-3-(2,2-диметил-1,3-діоксолан-4-іл)проп-1-ен2-сульфонілхлорид: 30 35 40 , . [0016] В деяких варіантах здійснення, забезпечуються сполуки (R)-1-((2,2-диметил-1,3діоксолан-4-іл)метил)циклопропан-1-сульфонат натрію та (S)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропан-1-сульфонат натрію: , . [0017] В деяких варіантах здійснення, забезпечуються сполуки (R)-1-((2,2-диметил-1,3діоксолан-4-іл)метил)циклопропантіол та (S)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропантіол: , . [0018] В деяких варіантах здійснення, забезпечуються сполуки 1,2-біс(1-(((R)-2,2-диметил1,3-діоксолан-4-іл)метил)циклопропіл)дисульфан та 1,2-біс(1-(((S)-2,2-диметил-1,3-діоксолан-4іл)метил)циклопропіл)дисульфан: 3 UA 106762 C2 5 10 15 20 25 30 35 40 45 50 55 , . ВКЛЮЧЕННЯ ОЗНАК ШЛЯХОМ ПОСИЛАННЯ [0019] Всі публікації та заявки на патенти, згадувані в даному описі винаходу, включені за допомогою посилання в тому ж самому ступені, як якщо би для кожної окремої публікації або заявки на патент було спеціально та індивідуально зазначено, що вона включена за допомогою посилання. СТИСЛИЙ ОПИС КРЕСЛЕНЬ [0020] Нові ознаки винаходу докладно викладаються в прикладеній формулі винаходу. Кращого розуміння ознак та переваг даного винаходу буде досягнуто шляхом посилання на наступний докладний опис, який пропонує ілюстративні варіанти здійснення, у яких використовуються принципи винаходу, та прикладені малюнки, де: [0021] Фігура 1 представляє три РХВР сліди N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду, де верхній слід 1(a) є РХВР слідом сирої речовини, інжектованої разом з аутентичним зразком (-) енантіомеру (одержаного шляхом хірального розділення рацемічної суміші обох ізомерів); середній слід 1(b) є РХВР слідом сирої речовини; а нижній слід 1(c) є РХВР слідом сирої речовини, інжектованої разом з аутентичним зразком (+) енантіомеру (одержаного шляхом хірального розділення рацемічної суміші обох ізомерів). 1 [0022] Фігура 2 представляє H ЯМР спектр (S)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропан-1-сульфонату натрію в CD3OD. 13 [0023] Фігура 3 представляє C ЯМР спектр (S)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропан-1-сульфонату натрію в CD3OD. ДОКЛАДНИЙ ОПИС ВИНАХОДУ [0024] У той час як кращі варіанти здійснення даного винаходу показані та описані в даному описі, для спеціалісту в даній галузі техніки буде очевидно, що такі варіанти здійснення надані винятково з метою ілюстрації. Численні варіації, зміни та заміни можуть бути здійснені спеціалістом в даній галузі техніки без відхилення від даного винаходу. Слід розуміти, що різні альтернативи варіантам здійснення винаходу, що описані тут, можуть використовуватися при здійсненні винаходу. Мається на увазі, що обсяг винаходу визначає наведена нижче формула винаходу, та що способи та структури в рамках обсягу цієї формули винаходу та їх еквіваленти таким чином покриваються. [0025] Часто необхідно мати альтернативні способи одержання корисних сполук. В даній заявці описані різноманітні способи одержання (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду та (S)-N-(3,4-дифтор-2(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1сульфонаміду, які, як відомо, мають інгібувальні властивості відносно ферментів MEK. I. ОДЕРЖАННЯ СПОЛУК Спосіб хімічного синтезу [0026] Розгляд нижче пропонується для ілюстрації того, яким чином, в принципі, отримати доступ до сполук, заявлених в даному винаході, й надання деталей деяких із множини способів, доступних для застосування в синтезі сполук винаходу. Тем не менше, цей розгляд не призначений для визначення або обмеження рамок реакцій або послідовностей реакцій, які є придатними для одержання сполук даного винаходу. Сполуки даного винаходу можуть бути одержані за допомогою порядку дій та методик, розкритих в розділі "Приклади" нижче, також як й за допомогою відомих методик органічного синтезу. [0027] Способи, які відомі практикуючому середньому спеціалісту в даній галузі техніки, можуть бути знайдені у різних довідниках та базах даних. Придатні довідники та наукові праці, які докладно описують синтез реагентів, придатних для одержання сполук, описаних в даній заявці, або надають посилання на статті, які описують одержання, включають наприклад, "Synthetic Organic Chemistry", John Wiley & Sons, Inc., Нью-Йорк; S. R. Sandler й ін., "Organic Functional Group Preparations, " 2-е вид., Academic Press, Нью-Йорк, 1983; H. O. House, "Modern Synthetic Reactions", 2-е вид., W. A. Benjamin, Inc. Менло Парк, Каліф. 1972; T. L. Gilchrist, "Heterocyclic Chemistry", 2-е вид., John Wiley & Sons, Нью-Йорк, 1992; J. March, "Advanced Organic Chemistry: Reactions, Mechanisms and Structure", 4-е вид., Wiley-Interscience, Нью-Йорк, 1992. Додаткові придатні довідники та наукові праці, які докладно описують синтез реагентів, придатних для одержання сполук, що описані в даній заявці, або надають посилання на статті, 4 UA 106762 C2 5 10 15 20 25 30 35 40 45 які описують одержання, включають, наприклад, Fuhrhop, J. and Penzlin G. "Organic Synthesis: Concepts, Methods, Starting Materials", Second, Revised and Enlarged Edition (1994) John Wiley & Sons ISBN: 3-527-29074-5; Hoffman, R.V. "Organic Chemistry, An Intermediate Text" (1996) Oxford University Press, ISBN 0-19-509618-5; Larock, R. C. "Comprehensive Organic Transformations: A Guide to Functional Group Preparations" 2-е вид. (1999) Wiley-VCH, ISBN: 0-471-19031-4; March, J. "Advanced Organic Chemistry: Reactions, Mechanisms, and Structure" 4-е вид. (1992) John Wiley & Sons, ISBN: 0-471-60180-2; Otera, J. (редактор) "Modern Carbonyl Chemistry" (2000) Wiley-VCH, ISBN: 3-527-29871-1; Patai, S. "Patai's 1992 Guide to the Chemistry of Functional Groups" (1992) Interscience ISBN: 0-471-93022-9; Quin, L.D. й ін. "A Guide to Organophosphorus Chemistry" (2000) Wiley-Interscience, ISBN: 0-471-31824-8; Solomons, T. W. G. "Organic Chemistry" 7-е вид. (2000) John Wiley & Sons, ISBN: 0-471-19095-0; Stowell, J.C., "Intermediate Organic Chemistry" 2-е вид. (1993) Wiley-Interscience, ISBN: 0-471-57456-2; "Industrial Organic Chemicals: Starting Materials and Intermediates: An Ullmann's Encyclopedia" (1999) John Wiley & Sons, ISBN: 3-527-29645-X, в 8 томах; "Organic Reactions" (1942-2000) John Wiley & Sons, в більш ніж 55 томах; та "Chemistry of Functional Groups" John Wiley & Sons, в 73 томах. [0028] Загалом, використовувані сполуки в реакціях, що описані в даному описі, можуть бути одержані відповідно до методик органічного синтезу, які відомі спеціалісту в даній галузі техніки, виходячи із доступних для придбання хімічних реагенти і/або із сполук, що описані в хімічній літературі. "Доступні для придбання хімічні реагенти" можуть бути одержані із звичайних комерційних джерел, включаючи Acros Organics (Пітсбург, Пенсільванія), Aldrich Chemical (Мілуокі, Вісконсин, у тому числі Sigma Chemical and Fluka), Apin Chemicals Ltd. (Мілтон Парк, Сполучене Королівство), Avocado Research (Ланкашир, Сполучене Королівство), BDH Inc. (Торонто, Канада), Bionet (Корнуолл, Сполучене Королівство), Chemservice Inc. (Вестчестер, Пенсильванія), Crescent Chemical Co. (Хауппауг, штат Нью-Йорк), Eastman Organic Chemicals, Eastman Kodak Company (Рочестер, штат Нью-Йорк), Fisher Scientific Co. (Пітсбург, Пенсільванія), Fisons Chemicals (Лестершир, Сполучене Королівство), Frontier Scientific (Логан, Юта), ICN Biomedicals, Inc. (Коста-Меса, Каліфорнія), Key Organics (Корнуолл, Сполучене Королівство), Lancaster Synthesis (Віндхем, Нью-Гемпшир), Maybridge Chemical Co. Ltd. (Корнуолл, Сполучене Королівство), Parish Chemical Co. (Орем, Юта), Pfaltz & Bauer, Inc. (Уотербері, Коннектикут), Polyorganix (Хьюстон, Техас), Pierce Chemical Co. (Рокфорд, Іллінойс), Riedel de Haen AG (Ганновер, Німеччина), Spectrum Quality Product, Inc. (Нью-Брансуік, НьюДжерсі), TCI America (Портленд, Орегон), Trans World Chemicals, Inc. (Роквілл, Меріленд), та Wako Chemicals USA, Inc. (Річмонд, Вірджинія). [0029] Особливі та аналогічні реагенти також можуть бути ідентифіковані через індекси відомих хімічних реагентів, складені хімічною реферативною службою (Chemical Abstract Service), підрозділом Американського хімічного товариства, які доступні в більшості публічних та університетських бібліотек, також як й через онлайн бази даних. Хімічні реагенти, які відомі, але не доступні для придбання в каталогах, можуть бути одержані звичайними фірмами хімічного синтезу, причому багато які із стандартних фірм-постачальників хімічних реактивів (наприклад, перерахованих вище) надають послуги синтезу на замовлення. Спосіб A: Ахіральний синтез, з наступним хіральним розділенням Ахіральний синтез N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонаміду був описаний раніше, (див. опубліковану заявку на патент США US 2008/0058340 A1), та узагальнений нижче на схемі 1. Продукт одержують у вигляді рацемічної суміші (R) та (S) енантіомерів, яку розділяють за допомогою хіральної РХВР. 5 UA 106762 C2 O S O Cl піридин -10°C HO O S I O O O S O O O K NCS S SOCl2 60°C O O- K+ BuLi O NH2 O S H N O Cl піридин 40°C O S O NH H N O F F F I O HO F OsO4 S O NH F H N O HO I F F I Хіральне розділення F F HO HO O S O NH O H N O F F HO 10 15 S O NH H N O I F 5 O F F I F Схема 1: Aхіральний синтез N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду Спосіб B: Синтез із хіральних вихідних речовин [0030] Схеми 2a, 3a, 4a, 5a та 6a показують шляхи синтезу, за допомогою яких можна було би одержати (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід, й вони розглянуті нижче. [0031] Схеми 2b, 3b, 4b, 5b та 6b показують шляхи синтезу, за допомогою яких можна було би одержати (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід, й вони розглянуті нижче. Схема 2a: (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл) -1-(2,3-дигідроксипропіл)циклопропан-1-сульфонамід 6 UA 106762 C2 5 10 15 20 Схема 2b: (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл) -1-(2,3-дигідроксипропіл)циклопропан-1-сульфонамід [0032] Спосіб B, Шлях I: Циклопропільну групу вводять по кінцях алкену діол-захищеного 4йодпент-4-ен-1,2-діолу, з утворенням захищеної похідної 3-(1-йодциклопропіл)пропан-1,2-діолу, яку потім сульфонілують. Сполучення з 5,6-дифтор-N1-(2-фтор-4-йодфеніл)-3-метоксибензол1,2-діаміном та заключне зняття захисту дає (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонамід, (S)-N-(3,4-дифтор-2-(2фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонамід або рацемічну суміш, залежно від використовуваної вихідної речовини. [0033] Спосіб B, Шлях II: В способі, який незначно відрізняється від вищевказаного шляху A, реакція циклопропанування може бути проведена після сполучення з діариламіном. Діолзахищений 4-йодпент-4-ен-1,2-діол перетворюють на сульфонілхлорид та потім сполучають з 5,6-дифтор-N1-(2-фтор-4-йодфеніл)-3-метоксибензол-1,2-діаміном. Амінні функціональності захищають, за необхідності, алкен перетворюють на циклопропільну групу та на закінчення будь-які захисні групи, що залишаються, видаляють за необхідності з одержанням (R)-N-(3,4дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1сульфонаміду, (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонаміду або рацемічної суміші, залежно від використовуваної вихідної речовини. [0034] Обидва із цих шляхів потребують як вихідну речовину діол-захищений 4-йодпент-4ен-1,2-діол, який може бути одержаний відповідно до наступної схеми: O O PG2 Захист "Введення PG1 O PG1 " HO 25 HO PG1 O Зняття захисту HO PG2 Йодування HO "Видалення PG1 O PG2 " HO I Захист PG3 O I "Введення PG3 O PG3 " Схема 3a: (R)-діол-захищений 4-йодпент-4-ен-1,2-діол O O Захист HO "Введення PG1 O PG1 " PG2 HO Зняття захисту HO PG1 O PG2 "Видалення 1 PG O PG2 " Йодування PG3 O HO I Захист HO "Введення PG3 O PG3 " 30 Схема 3b: (S)-діол-захищений 4-йодпент-4-ен-1,2-діол [0035] Вихідна речовина, гліцидол є у продажу у вигляді (R) енантіомеру, (S) енантіомеру або (R/S)-(+/-)- суміші. Спирт може бути захищений, наприклад, за допомогою реакції з 7 I UA 106762 C2 5 10 15 тбутилдиметилсилілхлоридом, або іншою придатною захисною групою. Альтернативно, TBS захищений гліцидол є у продажу у вигляді (R) енантіомеру, (S) енантіомеру або (R/S)-(+/-)рацемічної суміші. Сполучення з захищеним ацетиленом, з наступним зняттям захисту та йодуванням реагентом, таким як 9-йод-9-борабіцикло[3.3.1]нонан (9-I-BBN), забезпечує 4йодпент-4-ен-1,2-діол, який потім захищають по діольній групі. Необхідно відзначити, що незважаючи на те, що при цьому синтезі не відбувається інверсії стереохімії, використання як вихідної речовини (R)-(+)-гліцидолу буде приводити до утворення (S)-N-(3,4-дифтор-2-(2-фтор4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду; використання як вихідної речовини (S)-(-)-гліцидолу буде приводити до утворення (R)-N-(3,4дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1сульфонаміду. [0036] Спосіб B, Діол-захищений 1-(2,3-дигідроксипропіл)циклопропан-1-сульфонілхлорид: В деяких варіантах здійснення, використовують проміжну сполуку діол-захищений 1-(2,3дигідроксипропіл)циклопропан-1-сульфонілхлорид. 1,2-Діол захисні групи добре відомі в рівні техніки та включають такі як, але не обмежуються тільки ними, 1,3-діоксолан, 2-метил-1,3діоксолан, 2,2-диметил-1,3-діоксолан, 2-тбутил-1,3-діоксолан, 2-феніл-1,3-діоксолан, 1,4діоксаспіро[4.5]декан, ди-пара-метоксибензилоксиметиловий простий ефір, дитбутилдиметилсиліл простий ефір, й т.п.: 20 [0037] Схеми синтезу для одержання 1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан1-сульфонілхлориду забезпечуються нижче: Шлях i: 25 OEt HO EtO O BH3xSMe2 O OEt HO HO O PyH+ OTs OEt O OMe O Ti(OiPr)2 O O OH Br2 / PPh3 Піридин, ДХМ O OMe Br O O HO EtO OEt O i) тBuLi, Et2O ii) SO2Cl2 BH3xSMe2 O O SO2Cl O HO OEt HO O PyH+ OTsOMe O OMe O Br O i) тBuLi, Et2O ii) SO2Cl2 O OEt O SO2Cl O Шлях ii: 30 8 O Ti(OiPr)2 O O OH Br2 / PPh3 Піридин, ДХМ UA 106762 C2 HO OEt EtO O O ii) Захист PPh3 , Im, I2 O ДХМ OH O i) Відновлення O O I Na2SO3 EtOH SO3Na O O NMe2CH2I SO3Na O O Br OMe SiMe3 O HO Mg HO i) Br2 ii) NaOMe SiMe3 HO HO OMe Br Me3SOI тBuLi O i) ii) SO2Cl2 Br NaH SO3Na O O HO Cl O N 18C6 / ацетон Cl OEt i) Відновлення EtO O ii) Захист O O O O OH PPh3 , Im, I2 ДХМ O I Na2SO3 EtOH O SO3Na O O Cl SO2Cl O HO N N NMe2CH2I SO3Na O O Br OMe SiMe3 O HO Mg HO SiMe3 i) Br2 ii) NaOMe HO HO OMe Br Me3SOI тBuLi O i) ii) SO2Cl2 Br NaH SO3Na O O HO Cl O N 18C6 / ацетон Cl N N Cl SO2Cl O O Шлях iii: 5 SO2OBu O O SO2OBu O LG O LHMDS, ТГФ -78oC - КТ SO2Cl O O Спосіб B, Шлях III O SO2OBu PG O HO SO2OBu HO PG O SO2Cl Сполучення Зняття зхисту PG O NH2 O O NH F H N F F 10 S O "Видалення PG" HO F H N O HO I F I F Схема 4a: (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл) -1-(2,3-дигідроксипропіл)циклопропан-1-сульфонамід 15 O PG O SO2OBu HO PG O SO2OBu HO SO2Cl PG O NH2 O H N F F 9 F HO Сполучення Зняття захисту "Видалення PG"HO O S O NH H N O F I F F I UA 106762 C2 5 10 Схема 4b: (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл) -1-(2,3-дигідроксипропіл)циклопропан-1-сульфонамід [0038] Сполучення захищеного гліцидолу з циклопропансульфонатним складним ефіром, таким як бутилциклопропансульфонат, дає бутил 1-(2-гідрокси-3-захищенийгідроксипропіл)циклопропан-1-сульфонат. Перетворення сульфонату на сульфонілхлорид забезпечує сульфонілхлоридну похідну, 1-(2-гідрокси-3-захищений-гідроксипропіл)циклопропан1 1-сульфонілхлорид, який потім сполучають з 5,6-дифтор-N -(2-фтор-4-йодфеніл)-3метоксибензол-1,2-даміном. Видалення будь-яких захисних груп, що залишилися, за необхідності, дає (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід, (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонамід або рацемічну суміш, залежно від використовуваної вихідної речовини. Спосіб B, Шлях IV O NH2 O SO2Cl F H N S O O NH O Захист аміну F H N O I F F PG1 O S O N PGA PG1 O PGA F N I F F O HO N O "Введення PGA " F S O I F PGA Зняття захисту PGA F N O F "Видалення PG1" I O HO HO S O NH H N O "Видалення PGA" F F F I F 15 Схема 5a: (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід O NH2 O SO2Cl F H N S O O NH O Зхист аміну F H N O "Введення PGA " F I F F HO PG1 O N O S O N O PGA PG1 O PGA F N I F F O I F PGA PGA Зняття захисту F N F PG1" I "Видалення "Видалення PGA " HO HO O S O NH H N O F F F I F 20 25 S O Схема 5b: (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід 1 [0039] 5,6-Дифтор-N -(2-фтор-4-йодфеніл)-3-метоксибензол-1,2-діамін сполучають з циклопропансульфонілхлоридом з забезпеченням N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6метоксифеніл)циклопропансульфонаміду. Амінні групи за необхідності захищають, використовуючи придатні захисні групи, такі як, але не обмежуються тільки ними, пропіл, дипропіл, пара-метоксибензил, ди-пара-метоксибензил, циклічні групи, й т.п.: . 30 10 UA 106762 C2 5 [0040] Захищений за аміногрупою N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6метоксифеніл)циклопропансульфонамід сполучають з захищеним гліцидолом, що після заключного видалення захисних груп, за необхідності, дає (R)-N-(3,4-дифтор-2-(2-фтор-4йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонамід, (S)-N(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан1-сульфонамід або рацемічну суміш, залежно від використовуваного гліцидолу. Спосіб B, Шлях V O PG O S NH2 PGA F N O F PGA F N N SOCl2 O I O S PG O PG O F F Li PG O O O PG O S PG O Зняття захисту PGA F N O "Видалення PG" F HO HO O S O NH "Видалення PGA" I F H N O F F 10 I F O NH PGA F N F I F Окислення NH I F Схема 6a: (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід O PG O S O NH2 PGA F N F N SOCl2 O I F F PG O PG O S 20 25 PG O NH O NH O PGA F N F I F O Зняття захисту PGA F N F 15 PG O O S PG O F O Окислення PGA F N Li "Видалення PG" "Видалення PGA" HO HO O S O NH H N O I F F F I F Схема 6b: (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід 1 1 [0041] 5,6-Дифтор-N -(2-фтор-4-йодфеніл)-3-метокси-N -захищений бензол-1,2-діамін обробляють тіонілхлоридом, перетворюючи первинний амін на тиазат. Сполучення з діолзахищеним (1-(2,3-дигідроксипропіл)циклопропіл)літієм дає сульфінамідну похідну, яку окиснюють до сульфонаміду. Заключне видалення захисних груп, за необхідності, дає (R)-N(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан1-сульфонамід, (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід або рацемічну суміш, залежно від використовуваної вихідної речовини. Спосіб C1: Синтез з використанням хіральних реагентів – (i) хіральне епоксидування 11 I UA 106762 C2 O S O O NH O O S O NH O S F HO N Хіральне епоксидування PGA F N O HO PGA F O NH I F "Видалення PGA " NaH F F O I S O або O NH O O HO PGA S F HO N F O NH 10 F H N O I F F 5 I F або F F H N O I F [0042] Хіральне епоксидування (напр. епоксидування за Якобсеном (J. Am. Chem. Soc., 1991, 113, 7063-7064 або J. Am. Chem. Soc., 2003, 125, 5250-5251) з використанням гіпохлориту натрію / Mn-саленового каталізатора; або епоксидування за llli (J. Org. Chem., 2007, 72, 40934097) з використанням глюкоза-похідних кетонів та Оксону) захищеного за аміногрупою 1-алілN-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)циклопропан-1-сульфонаміду, з наступним розкриттям епоксидного циклу та видаленням захисних груп, за необхідності, дає цільові хіральні продукти. Спосіб C2: Синтез з використанням хіральних реагентів – (ii) хіральне окиснення кетону O HO HO O S O N PGA H N O O O F Oxidation S O N PGA H H N O F I S F HO F F O O O N PGA H N O I O NH F I F "PGA off" I F H N O Chiral Reduction F F F S or O HO S F HO O NH F H N O F I F 15 [0043] Окисне розщеплення (напр. озоноліз або окиснення за Лем'є-Джонсоном) захищеного за аміногрупою 1-аліл-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)циклопропан1-сульфонаміду, з наступним перетворенням на α-гідроксикетон, хіральне відновлення кетону (напр. відновлення за Корі, CBS) та видалення захисних груп, за необхідності дає цільові хіральні продукти. Спосіб C3: Синтез з використанням хіральних реагентів – (iii) хіральне окиснення алкенів 20 O S O NH O O H N (CF3CO) 2O F S O O NH O F 25 30 * L/OsO4 N HO S O O NH O CF3 F I F I F F F O HO * K2CO3 N NMO EtNi Pr2 F O HO CF3 F HO S O NH O MeOH I H2O H N F F I F де L означає хіральний допоміжний агент [0044] Захист 1-аліл-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6метоксифеніл)циклопропан-1-сульфонаміду у вигляді трифторацетаміду, з наступним асиметричним дигідроксилуванням (напр. асиметричним дигідроксилуванням за Шарплесу), та видалення захисних груп, за необхідності дає цільові хіральні продукти. Спосіб C4: Синтез із хіральних вихідних речовин [0045] Схема 7a нижче показує синтетичний шлях одержання (R)-N-(3,4-дифтор-2-(2-фтор-4йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду. 12 UA 106762 C2 [0046] Схема 7b нижче показує синтетичний шлях одержання (S)-N-(3,4-дифтор-2-(2-фтор-4йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонаміду. SO2Cl Сполучення PG3 O NH2 O H N PG3 O O PG3 O PG3 O O S O NH HO H N F Зняття захисту "Видалення I F F HO O S H N O F PG3" F F F O NH I F I F 5 Схема 7a: (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід SO2Cl Сполучення PG3 O NH2 O H N PG3 O O PG3 O PG3 O O S O NH HO H N F F F F F O S O NH Зняття захисту HO H N O "Видалення PG3" I F F I F I F 10 15 20 25 30 35 Схема 7b: (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід [0047] Сполучення діол-захищеного 1-(2,3-дигідроксипропіл)циклопропан-11 сульфонілхлориду з 5,6-дифтор-N -(2-фтор-4-йодфеніл)-3-метоксибензол-1,2-діаміном забезпечує діол-захищений продукт. В деяких випадках сполучення може бути виконано при підвищених температурах. Заключне зняття захисту дає (R)-N-(3,4-дифтор-2-(2-фтор-4йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфонамід, (S)-N(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан1-сульфонамід або рацемічну суміш, залежно від використовуваної вихідної речовини. Умови зняття захисту будуть залежати від використовуваних захисних груп(-и) й відомі спеціалісту в галузі органічної хімії. [0048] Способи одержання діол-захищеного 1-(2,3-дигідроксипропіл)циклопропан-1сульфонілхлориду включають: Шлях i Через сполучення гліцидолу з ацетиленом / галогенування / циклопропанування / сульфонілування: [0049] Вихідна речовина, гліцидол є у продажу у вигляді (R) енантіомеру, (S) енантіомеру або (R/S)-(+/-)- суміші. Спирт може бути захищений, наприклад, за допомогою реакції з тбутилдиметилсилілхлоридом (TBS-Cl), або іншою придатною захисною групою. Альтернативно, TBS захищений гліцидол є у продажу у вигляді (R) енантіомеру, (S) енантіомеру або (R/S)-(+/-)-рацемічної суміші. Сполучення з захищеним ацетиленом, (≡-PG2) з наступним зняттям захисту та йодуванням реагентом, таким як 9-йод-9-борабіцикло[3.3.1]нонан (9-I-BBN), забезпечує 4-йодпент-4-ен-1,2-діол, який потім захищають за діольною групою. Циклопропільну групу вводять по кінцях алкену діол-захищеного 4-йодпент-4-ен-1,2-діолу, з утворенням захищеної похідної 3-(1-йодциклопропіл)пропан-1,2-діолу, яку потім сульфонілують. Необхідно 13 UA 106762 C2 5 відзначити, що незважаючи на те, що при цьому не відбувається інверсії стереохімії, використання як вихідної речовини (R)-(+)-гліцидолу буде приводити до утворення (S)-N-(3,4дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1сульфонаміду; використання як вихідної речовини (S)-(-)-гліцидолу буде приводити до утворення (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонаміду. Шлях ii) Через 3,3'-(1,1'-дисульфандіілбіс(циклопропан-1,1-дііл))дипропан-1,2-діольну 3 проміжну сполуку (де PG =2,2-диметил-1,3-діоксолан): Шлях ii-a 10 Шлях ii-b 15 20 25 [0050] Проміжна сполука 1,2-біс(1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропіл) дисульфан може бути одержана або безпосередньо шляхом реакції 1,2дициклопропілдисульфану з 4-(бромметил)-2,2-диметил-1,3-діоксоланом (шлях ii-a), або шляхом сполучення 1,2-дициклопропілдисульфану з трет-бутилдиметил(оксиран-2ілметокси)силаном, з наступним видаленням TBS захисної групи та захистом діолу, що утворюється (шлях ii-b). [0051] 1,2-Біс(1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропіл) дисульфан може бути перетворений на сульфонілхлорид безпосередньо (шлях ii-c), або через сульфонатну сіль, яку потім перетворюють на хлорид (шлях ii-d). Альтернативно, дисульфан може бути відновлений до сульфіду, який потім окиснюють до сульфонату та перетворюють на сульфонілхлорид (шлях ii-e): Шлях ii-c O S O S + Br Основа S O S + S S O O 30 O Br Основа O O O 14 O O S S O UA 106762 C2 Шлях ii-d 5 Шлях ii-e O O S S O O 10 15 20 25 30 35 40 45 S S NaOH O Діоксан, H2O O O PPh3, HCl O O SO3- Na+ POCl3 O O SO2Cl O NaOH O Діоксан, H2O O ДМФА PPh3, HCl O SH O SH O ДМФА O SO3- Na+ POCl3 O SO2Cl O II. ЗАХИСНІ ГРУПИ [0052] В описаних реакціях може існувати необхідність в захисті хімічно активних спиртових і/або амінних функціональних груп. Захисні групи застосовують для блокування деяких або всіх спиртових і/або амінних функціональних груп для попередження їх участі в хімічних реакціях до тих пір, поки захисну групу не видаляють. В деяких варіантах здійснення, де потрібно декілька захисних груп, кожну захисну групу знімають різними способами. В других варіантах здійснення, де потрібно декілька захисних груп, різні захисні групи знімають однаковими способами. В деяких варіантах здійснення, де потрібно декілька захисних груп, одна захисна група може бути використана для захисту різних функціональностей (напр. циклічна група). Захисні групи можуть бути видалені шляхом обробки кислотою, основою, нуклеофілом, гідрогенолізу або шляхом експонування УФ-випромінюванням або комбінацією перерахованого. Наприклад, групи, такі як тритильна, диметокситритильна, ацетальна та т-бутилдиметилсилільна є нестійкими до дії кислот; групи, такі як метильна, етильна та ацетильна є нестійкими до дії основ, а групи, такі як т-бутилкарбаматна та бензильна видаляють гідролітично. Іншими формами захисних груп є смола, до якої може бути приєднано сполуку або проміжну сполуку. До тих пір, поки залишок приєднаний до смоли, ця функціональна група є блокованою й не може вступати у реакції. Як тільки згадану функціональну групу відщепити від смоли, вона набуває здатності вступати в реакції. Інші захисні групи, плюс опис методик, придатних для приєднання та видалення захисних груп, описані в роботі "Protecting Groups in Organic Synthesis " авт.Greene & Wuts, 3-е видання, 1999, John Wiley and Sons, Inc., Нью-Йорк, штат Нью-Йорк, що включена в даний опис шляхом посилання. [0053] В деяких варіантах здійснення, потрібні проміжні сполуки, що містять захищену спиртову групу. Захисні групи для спирту добре відомі спеціалісту в галузі органічної хімії, та добре описані в літературі (див., наприклад, "Protecting Groups in Organic Synthesis" авт. Greene & Wuts, 3-е видання, 1999, John Wiley and Sons, Inc., Нью-Йорк, штат Нью-Йорк; Глава 2 "Protection for the Hydroxyl Group, Including 1,2-and1,3-Diols"). Приклади захисних груп для спирту включають, але не обмежуються тільки ними, заміщені метилові прості ефіри, такі як метоксиметил, бензилоксиметил, н-метоксибензилоксиметил, т-бутоксиметил, тетрагідропіраніл, метоксициклогексил, метокситетрагідропіраніл, тетрагідрофураніл; заміщені етилові прості ефіри, такі як етоксіетил, т-бутил, аліл, пропаргил; заміщені бензилові прості ефіри, такі як н-метоксибензил, піколіл, дифенілметил, трифенілметил; силілові прості ефіри, такі як триметилсиліл, триізопропілсиліл, т-бутилдиметилсиліл, трибензилсиліл, трифенілсиліл; складні ефіри, карбонати, сульфонати й т.п. [0054] В деяких варіантах здійснення потрібні проміжні сполуки, що містять захищені 1,2діольні групи. Захисні групи для 1,2-діолов добре відомі спеціалісту в галузі органічної хімії. Приклади захисних груп для 1,2-діолів включають, але не обмежуються тільки ними, 1,3діоксолан, 2-метил-1,3-діоксолан, 2,2-диметил-1,3-діоксолан, 2-тбутил-1,3-діоксолан, 2-феніл 15 UA 106762 C2 1,3-діоксолан, 1,4-діоксаспіро[4.5]декан, ди-пара-метоксибензилоксиметиловий простий ефір, т ди- бутилдиметилсиліловий простий ефір, й т.п.: 5 10 ПРИКЛАДИ [0055] Приклади і синтези, забезпечені нижче, додатково ілюструють і є прикладом сполук даного винаходу і способів одержання таких сполук. Слід розуміти, що обсяг даного винаходу не обмежений, так чи інакше, обсягом наступних прикладів і синтезів. [0056] ПРИКЛАД 1: (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід СТАДІЯ A O СТАДІЯ B HO TMS TBS O т BuLi,BF3.EtO2 СТАДІЯ E TBS O ДХЕгексан TBS O MeOH HCl (водн.) HO ТГФ HO ДХМ I HO TBSOTf TBS O Піридин I СТАДІЯ G TBS O СТАДІЯ H СТАДІЯ F I 9-I-BBN TBS O ТГФ Et2Zn/ТФУ, CH2I2 TMS TBS O СТАДІЯ D СТАДІЯ C HO K2CO3 HO I O O i) тBuLi, Et2O I O PPTS/ДХМ O ii) SO2Cl2 O O SO2Cl NH2 СТАДІЯ I Піридин O H N F F I F HO HO O S O NH H N O F СТАДІЯ J HCl F ТГФ O O O 20 25 30 O NH H N O I F 15 S F F I F Стадія A: (R)-1-(трет-бутилдиметилсилілокси)-5-(триметилсиліл)пент-4-ин-2-ол [0057] трет-BuLi (12.4 мл, 1.7M, 21.1 ммоль) додають до розчину TMS-ацетилену (2.12 г, 21.7 ммоль) в ТГФ (40 мл) при -78 °C і реакційну суміш перемішують протягом додаткових 30 хв. Додають (R)-трет-бутилдиметил(оксиран-2-ілметокси)силан (2 г, 10.6 ммоль) і BF 3.EtO2 (3 г, 21.1 ммоль) і перемішують при -78 °C протягом 4.5 годин. Реакцію потім гасять шляхом додавання водного розчину хлориду амонію і суміш екстрагують етилацетатом (3 × 50 мл). Об'єднані органічні шари промивають соляним розчином, сушать (MgSO 4) і концентрують при зниженому тиску з одержанням цільової сполуки з кількісним виходом. Речовину використовують на наступній стадії без додаткового очищення. Стадія B: (R)-1-(трет-бутилдиметилсилілокси)пент-4-ин-2-ол [0058] Карбонат калію (2.14 г, 15.5 ммоль) додають до розчину (R)-1-(третбутилдиметилсилілокси)-5-(триметилсиліл)пент-4-ин-2-олу (3 г, 10.6 ммоль) в метанолі (100 мл) і суміш перемішують при кімнатній температурі протягом 8 годин. Розчинник вилучають при зниженому тиску і до масла, яке одержують, додають водний розчин хлориду амонію (100 мл). Суміш екстрагують етилацетатом (3 × 50 мл). Об'єднані органічні шари промивають соляним 16 UA 106762 C2 5 10 15 20 25 30 35 40 45 50 розчином, сушать (MgSO4) і концентрують при зниженому тиску. Сиру речовину очищають за допомогою флеш-хроматографії (biotage), використовуючи градієнт EtOAc в гексані з одержанням (R)-1-(трет-бутилдиметилсилілокси)пент-4-ин-2-олу (1.81 г, 8.44 ммоль, 80 %). 1 H ЯМР (CDCl3, 300МГц): δ 3.78-3.86 (m, 1H), 3.71 (dd, 1H), 3.64 (dd, 1H), 2.52 (d, 1H), 2.362.44 (m, 2H), 0.96 (s, 9H), 0.05 (s, 6H). Стадія C: (R)-4-Йодпент-4-ен-1,2-діол [0059] 9-Йод-9-борабіцикло[3.3.1]нонан (9-I-BBN) по краплях додають до розчину (R)-1-(третбутилдиметилсилілокси)пент-4-ин-2-олу (476 мг, 2.22 ммоль) в дихлорметані (2 мл) при 0 °C і реакційну суміш перемішують при 0 °C протягом 4 годин. потім додають. Потім додають льодяну оцтову кислоту (0.26 мл) і суміш перемішують протягом додаткової години при 0 °C. Реакцію гасять шляхом додавання водної суміші Na2CO3/Na2S2O3 (40 мл, 1:1) і розчин, який одержали, екстрагують етилацетатом (3 × 30 мл). Об'єднані органічні шари сушать (MgSO4) і концентрують при зниженому тиску з одержанням (R)-4-йодпент-4-ен-1,2-діолу. 1 H ЯМР (CDCl3, 300МГц): δ 6.11 (s, 1H), 5.85 (s, 1H), 3.98-4.07 (m, 1H), 3.74 (dd, 1H), 3.54 (dd, 1H), 2.62 (d, 2H), 2.19 (bs, OH), 1.64 (bs, OH). Стадія D: (R)-5-(2-йодаліл)-2,2,3,3,8,8,9,9-октаметил-4,7-діокса-3,8-дисиладекан [0060] Розчин (R)-4-йодпент-4-ен-1,2-діолу (224 мг, 1 ммоль) в ТГФ (6 мл) охолоджують до 0 °C, і по краплях додають піридин (293 мг, 3.7 ммоль) і трет-бутилдиметилсиліл трифторметансульфонат (TBSOTf). Реакційну суміш нагрівають до кімнатної температури, перемішують протягом додаткових 20 хв і розчинники вилучають при зниженому тиску. Сиру речовину розчиняють в хлороформі, промивають соляним розчином, сушать (MgSO4), концентрують при зниженому тиску, і очищають за допомогою флеш-хроматографії, використовуючи градієнт етилацетату в гексані, з одержанням (R)-5-(2-йодаліл)-2,2,3,3,8,8,9,9октаметил-4,7-діокса-3,8-дисиладекану (254 мг, 56 %). 1 H ЯМР (CDCl3, 500МГц): δ 6.13 (s, 1H), 5.79 (s, 1H), 3.86-3.95 (m, 1H), 3.64 (dd, J=10, 4 Гц, 1H), 3.49 (dd, J=10, 6 Гц, 1H), 2.52 (d, J=6 Гц, 2H), 2.35 (d, J=4 Гц, OH), 0.89 (s, 18H), 0.04 (s, 12H). Стадія E: (R)-5-((1-йодциклопропіл)метил)-2,2,3,3,8,8,9,9-октаметил-4,7-діокса-3,8дисиладекан [0061] Трифтороцтову кислоту (ТФО; 281 мг, 2.47 ммоль) додають до розчину діетилцинку (ZnEt2, 2.5 мл, 2.5M в гексані) в ДХЕ (1 мл) при 0 °C і перемішують протягом 35 хв. Потім при 0 °C додають дийодметан (CH2I2, 66 мг, 2.5 ммоль), і суміш перемішують протягом додаткових 20 хв. Додають розчин (R)-5-(2-йодаліл)-2,2,3,3,8,8,9,9-октаметил-4,7-діокса-3,8-дисиладекану (стадія D; 188 мг, 0.41 ммоль) в ДХЕ (2 мл) і реакційну суміш перемішують при кімнатній температурі протягом ночі. Реакцію потім гасять шляхом додавання суміші метанолу (5 мл) і соляного розчину (0.5 мл). Після перемішування протягом додаткового часу, суміш концентрують при зниженому тиску. Сиру речовину екстрагують водн. NH 4Cl/CHCl3 і органічний шар промивають соляним розчином, сушать (MgSO 4) і концентрують при зниженому тиску. Сиру речовину розтирають в гексані і розчин фільтрують і упарюють з одержанням (R)-5-((1йодциклопропіл)метил)-2,2,3,3,8,8,9,9-октаметил-4,7-діокса-3,8-дисиладекану (148 мг, 77 %). 1 H ЯМР (CDCl3, 500МГц): δ 3.91-3.95 (m, 1H), 3.60 (dd, J=10, 5 Гц, 1H), 3.47 (dd, J=10, 6 Гц, 1H), 1.95 (dd, J=10, 4 Гц, 1H), 1.28 (dd, J=10, 6 Гц, 1H), 0.99-1.07 (m, 2H), 0.75-0.90 (m, 2H), 0.89 (s, 18H), 0.12 (s, 3H), 0.08 (s, 3H), 0.04 (s, 6H). Стадія F: (R)-3-(1-йодциклопропіл)пропан-1,2-діол [0062] Водний розчин HCl (0.3 мл, 1 н.) додають до розчину (R)-5-((1-йодциклопропіл)метил)2,2,3,3,8,8,9,9-октаметил-4,7-діокса-3,8-дисиладекану (стадія E, 281 мг, 0.598 ммоль) в ТГФ (2 мл) при 0 °C. Суміш повільно нагрівають при кімнатній температурі і перемішують протягом 24 годин. Реакцію гасять шляхом додавання водного розчину NaHCO 3 і екстрагують етилацетатом. Об'єднані органічні шари промивають соляним розчином, сушать (MgSO4) і концентрують при 17 UA 106762 C2 зниженому тиску з забезпеченням (R)-3-(1-йодциклопропіл)пропан-1,2-діолу (0.598 ммоль), який використовують на наступній стадії без додаткового очищення. Стадія G: (R)-4-((1-йодциклопропіл)метил)-2,2-диметил-1,3-діоксолан 5 10 15 20 25 30 35 40 45 [0063] 2,2-Диметоксипропан (140 мг, 1.337 ммоль) і п-толуолсульфонат піридинію (PPTS, 6 мг) додають до розчину сирого (R)-3-(1-йодциклопропіл)пропан-1,2-діолу (стадія F, 0.598 ммоль), розчиненого в дихлорметані (3 мл), і суміш перемішують при кімнатній температурі протягом 2 годин. Розчинники вилучають при зниженому тиску і сирий продукт очищають за допомогою флеш-хроматографії, використовуючи елюант етилацетат/гексан (1:10) з одержанням (R)-4-((1-йодциклопропіл)метил)-2,2-диметил-1,3-діоксолану (84 мг, 50 %). 1 H ЯМР (CDCl3, 500МГц): δ 4.31-4.37 (m, 1H), 4.16 (dd, J=10, 5 Гц, 1H), 3.56 (dd, J=10, 8 Гц, 1H), 1.72-1.80 (m, 2H), 1.35 (s, 6H), 1.04-1.11 (m, 2H), 0.90-0.94 (m, 1H), 0.73-0.77 (m, 1H). Стадія H: (R)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид [0064] трет-Бутиллітій (0.2 мл, 0.34 ммоль, 1.7M) додають до розчину (R)-4-((1йодциклопропіл)метил)-2,2-диметил-1,3-діоксолану (стадія G, 45 мг, 0.16 ммоль) в ефірі (1 мл) при –78 °C, і суміш перемішують при –78 °C протягом 30 хвилин. Потім додають розчин тіонілхлориду (26 мкл) в ефірі (0.5 мл). Оранжевий розчин, який одержали нагрівають до кімнатної температури і концентрують при зниженому тиску. Залишок розчиняють в хлороформі, фільтрують і сушать при зниженому тиску з одержанням (R)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропан-1-сульфонілхлориду (23.7 мг, 57 %). m/z=255 [M+1] . Стадія I: (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-((2,2-диметил1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонамід 1 [0065] Розчин 5,6-дифтор-N -(2-фтор-4-йодфеніл)-3-метоксибензол-1,2-діаміну (22 мг, 0.065 ммоль) в сухому піридині (0.8 мл) додають до (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6метоксифеніл)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонаміду (стадія h) і суміш перемішують при кімнатній температурі протягом ночі. Розчинник потім вилучають при зниженому тиску і залишок розчиняють в етилацетаті, промивають соляним розчином, сушать (MgSO4) і концентрують з одержанням сирого (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6метоксифеніл)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонаміду, який використовують на наступній стадії без додаткового очищення. m/z=611 [M-1] Стадія J: (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід [0066] Сирий (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-((2,2диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонамід розчиняють в суміші ТГФ (1 мл) і HCl (1.2 н, 0.15 мл) і перемішують протягом ночі при кімнатній температурі. Розчинники вилучають при зниженому тиску і залишок розчиняють в етилацетаті. Органічну фазу промивають водним NaHCO3, сушать (Na2SO4), і концентрують з одержанням (R)-N-(3,4дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1сульфонаміду (1.4 мг, сирий). [0067] Сполуку аналізували за допомогою ВЕРХ з нормальними фазами, використовуючи колонку CHIRALPAK AD-H (20 × 250 мм) при кімнатній температурі, і використовуючи рухому фазу, яка складається із гексану і 2-пропанолу (80:20) при 12 мл/хв. Детектування проводили 18 UA 106762 C2 5 10 при 254 нм. Час утримання визначали таким, що дорівнює 22 хв, що відповідало часу утримання (+)N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)феніл)-1-(2,3-дигідроксипропіл) циклопропан-1-сульфонаміду. Фігура 1(a) представляє ВЕРХ слід сирої речовини, інжектованої разом з аутентичним зразком (-) енантіомеру (одержаного за допомогою хірального розділення рацемічної суміші обох ізомерів). Фігура 1(b) представляє ВЕРХ слід сирої речовини Фігура 1(c) представляє ВЕРХ слід сирої речовини, інжектованої разом з аутентичним зразком (+) енантіомеру (одержаного за допомогою хірального розділення рацемічної суміші обох ізомерів). [0068] ПРИКЛАД 2: (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід СТАДІЯ A O СТАДІЯ B HO TMS TBS O т BuLi,BF3.EtO2 СТАДІЯ E TBS O ДХЕ/гексан TBS O 9-I-BBN HO ДХМ K2CO3 СТАДІЯ G HO СТАДІЯ F I HCl (водн.) ТГФ HO HO I TBSOTf TBS O Піридин I TBS O TBS O MeOH ТГФ Et2Zn/ТФО, CH2I2 TMS TBS O СТАДІЯ D СТАДІЯ C HO I O СТАДІЯ H O i) тBuLi, Et2O I O PPTS/ДХМ O ii) SO2Cl2 O O SO2Cl NH2 СТАДІЯ I Піридин O H N F F I F HO HO O S O NH H N O F СТАДІЯ J HCl O ТГФ F O O S O NH H N O I F F F I F 15 Стадія A: (S)-1-(трет-бутилдиметилсилілокси)-5-(триметилсиліл)пент-4-ин-2-ол 20 25 30 35 [0069] трет-Бутиллітій (2 екв.) додають до розчину TMS-ацетилену (2 екв.) в ТГФ при -78 °C і реакційну суміш перемішують протягом додаткових 30 хв. Додають (S)-третбутилдиметил(оксиран-2-ілметокси)силан (1 екв.) і BF3.EtO2 (2 екв.) і перемішують при -78 °C протягом 4.5 годин. Реакцію гасять шляхом додавання водного розчину хлориду амонію і екстрагують етилацетатом (3x). Об'єднані органічні шари промивають соляним розчином, сушать (MgSO4) і концентрують при зниженому тиску з одержанням (S)-1-(третбутилдиметилсилілокси)-5-(триметилсиліл)пент-4-ин-2-олу. Стадія B: (S)-1-(трет-бутилдиметилсилілокси)пент-4-ин-2-ол [0070] Карбонат калію (1.5 екв.) додають до розчину (R)-1-(трет-бутилдиметилсилілокси)-5(триметилсиліл)пент-4-ин-2-олу (1 екв.) в метанолі і суміш перемішують при кімнатній температурі протягом 8 годин. Розчинник вилучають при зниженому тиску і додають водний розчин хлориду амонію. Суміш екстрагують етилацетатом (3x) і об'єднані органічні шари промивають соляним розчином, сушать (MgSO4), концентрують при зниженому тиску і очищають за допомогою флеш-хроматографії (biotage), використовуючи градієнт EtOAc в гексані. Стадія C: (S)-4-Йодпент-4-ен-1,2-діол [0071] 9-Йод-9-борабіцикло[3.3.1]нонан (9-I-BBN) по краплях додають до розчину (S)-1-(третбутилдиметилсилілокси) пент-4-ин-2-олу в дихлорметані при 0 °C і реакційну суміш перемішують при 0 °C протягом 4 годин. Додають льодяну оцтову кислоту і суміш перемішують протягом додаткової години при 0 °C. Реакцію гасять шляхом додавання водної суміші 19 UA 106762 C2 Na2CO3/Na2S2O3 (40 мл, 1:1), екстрагують етилацетатом (3x) і об'єднані органічні шари сушать (MgSO4) і концентрують при зниженому тиску з одержанням (S)-4-йодпент-4-ен-1,2-діолу. Стадія D: (S)-5-(2-йодаліл)-2,2,3,3,8,8,9,9-октаметил-4,7-діокса-3,8-дисиладекан 5 10 15 20 25 30 35 40 45 [0072] Розчин (S)-4-йодпент-4-ен-1,2-діолу (1 екв.) в ТГФ охолоджують до 0 °C, і піридин (3.7 екв.) і по краплях додають трет-бутилдиметилсиліл трифторметансульфонат (TBSOTf). Реакційну суміш нагрівають до кімнатної температури, перемішують протягом додаткових 20 хв і розчинники вилучають при зниженому тиску. Сиру речовину розчиняють в хлороформі, промивають соляним розчином, сушать (MgSO 4), концентрують при зниженому тиску, і очищають за допомогою флеш-хроматографії, використовуючи градієнт етилацетату в гексані, з одержанням (S)-5-(2-йодаліл)-2,2,3,3,8,8,9,9-октаметил-4,7-діокса-3,8-дисиладекану. Стадія E: (S)-5-((1-йодциклопропіл)метил)-2,2,3,3,8,8,9,9-октаметил-4,7-діокса-3,8дисиладекан [0073] Трифтороцтову кислоту (8 екв.) додають до розчину діетилцинку (16 екв.) в ДХЕ при 0 °C і перемішують протягом 35 хв. Дийодметан (8 екв.) додають при 0 °C, і суміш перемішують протягом додаткових 20 хв. Додають розчин (S)-5-(2-йодаліл)-2,2,3,3,8,8,9,9-октаметил-4,7діокса-3,8-дисиладекану (1 екв.) в ДХЕ і реакційну суміш перемішують при кімнатній температурі протягом ночі. Реакцію гасять шляхом додавання суміші метанолу і соляного розчину. Після перемішування протягом додаткового часу, суміш концентрують при зниженому тиску. Сиру речовину екстрагують водним NH4Cl/CHCl3 і органічний шар промивають соляним розчином, сушать (MgSO4) і концентрують при зниженому тиску. Сиру речовину розтирають в гексані і розчин фільтрують і упарюють з одержанням (S)-5-((1-йодциклопропіл)метил)-2,2,3,3,8,8,9,9октаметил-4,7-діокса-3,8-дисиладекану. Стадія F: (S)-3-(1-йодциклопропіл)пропан-1,2-діол [0074] Водний розчин HCl додають до розчину (S)-5-((1-йодциклопропіл)метил)2,2,3,3,8,8,9,9-октаметил-4,7-діокса-3,8-дисиладекану в ТГФ при 0 °C. Суміш повільно нагрівають до кімнатної температури і перемішують протягом 24 годин. Реакцію гасять шляхом додавання водного розчину NaHCO3, екстрагують етилацетатом, і об'єднані органічні шари промивають соляним розчином, сушать (MgSO4) і концентрують при зниженому тиску з забезпеченням (S)-3-(1-йодциклопропіл)пропан-1,2-діолу (0.598 ммоль). Стадія G: (S)-4-((1-йодциклопропіл)метил)-2,2-диметил-1,3-діоксолан [0075] 2,2-Диметоксипропан і п-толуолсульфонат піридинію додають до розчину (S)-3-(1йодциклопропіл)пропан-1,2-діолу, розчиненого в дихлорметані, і суміш перемішують при кімнатній температурі протягом 2 годин. Розчинники вилучають при зниженому тиску, і сирий продукт очищають за допомогою флеш-хроматографії, використовуючи елюант етилацетат/гексан (1:10). Стадія H: (S)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид [0076] трет-Бутиллітій (2 екв.) додають до розчину (S)-4-((1-йодциклопропіл)метил)-2,2диметил-1,3-діоксолану (1 екв.) в ефірі при -78 °C і суміш перемішують при -78 °C протягом 30 хвилин. Додають розчин тіонілхлориду в ефірі, суміш нагрівають до кімнатної температури і концентрують при зниженому тиску. Залишок розчиняють в хлороформі, фільтрують і сушать при зниженому тиску. Стадія I: (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-((2,2-диметил1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонамід 20 UA 106762 C2 1 5 10 15 [0077] Розчин 5,6-дифтор-N -(2-фтор-4-йодфеніл)-3-метоксибензол-1,2-діаміну в сухому піридині додають до (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-((2,2диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонаміду і суміш перемішують при кімнатній температурі протягом ночі. Розчинник вилучають при зниженому тиску, і залишок розчиняють в етилацетаті, промивають соляним розчином, сушать (MgSO 4) і концентрують. Стадія J: (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3дигідроксипропіл)циклопропан-1-сульфонамід [0078] (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-((2,2-диметил-1,3діоксолан-4-іл)метил)циклопропан-1-сульфонамід розчиняють в суміші ТГФ і HCl і перемішують протягом ночі при кімнатній температурі. Розчинники вилучають при зниженому тиску і залишок розчиняють в етилацетаті. Органічну фазу промивають водним NaHCO 3, сушать (Na2SO4), і концентрують. [0079] ПРИКЛАД 3: (R)-3-(2,2-диметил-1,3-діоксолан-4-іл)проп-1-ен-2-сульфонілхлорид СТАДІЯ A HO TBS O TMS HO СТАДІЯ C СТАДІЯ B 9-I-BBN HO K2CO3 I O O O СТАДІЯ D I i) тBuLi, Et O 2 O TBS O MeOH ДХМ HO PPTS/ДХМ O ii) SO2Cl2 O S O Cl O Стадія A: (R)-1-(трет-бутилдиметилсилілокси)пент-4-ин-2-ол 20 25 30 35 40 [0080] Карбонат калію (2.14 г, 15.5 ммоль) додають до розчину (R)-1-(третбутилдиметилсилілокси)-5-(триметилсиліл)пент-4-ин-2-олу (3 г, 10.6 ммоль) в метанолі (100 мл) і суміш перемішують при кімнатній температурі протягом 8 годин. Розчинник вилучають при зниженому тиску і до масла, яке одержують, додають водний розчин хлориду амонію (100 мл). Суміш екстрагують етилацетатом (3 × 50 мл). Об'єднані органічні шари промивають соляним розчином, сушать (MgSO4) і концентрують при зниженому тиску. Сиру речовину очищають за допомогою флеш-хроматографії (biotage), використовуючи градієнт EtOAc в гексані з одержанням (R)-1-(трет-бутилдиметилсилілокси)пент-4-ин-2-олу (1.81 г, 8.44 ммоль, 80 %). 1 H ЯМР (CDCl3, 300МГц): δ 3.78-3.86 (m, 1H), 3.71 (dd, 1H), 3.64 (dd, 1H), 2.52 (d, 1H), 2.362.44 (m, 2H), 0.96 (s, 9H), 0.05 (s, 6H). Стадія B: (R)-4-Йодпент-4-ен-1,2-діол [0081] 9-Йод-9-борабіцикло[3.3.1]нонан (9-I-BBN) по краплях додають до розчину (R)-1-(третбутилдиметилсилілокси)пент-4-ин-2-олу (476 мг, 2.22 ммоль) в дихлорметані (2 мл) при 0 °C і реакційну суміш перемішують при 0 °C протягом 4 годин. Потім додають льодяну оцтову кислоту (0.26 мл) і суміш перемішують протягом додаткової години при 0 °C. Реакцію гасять шляхом додавання водної суміші Na2CO3/Na2S2O3 (40 мл, 1:1) і розчин, який одержали, екстрагують етилацетатом (3 × 30 мл). Об'єднані органічні шари сушать (MgSO4) і концентрують при зниженому тиску з одержанням (R)-4-йодпент-4-ен-1,2-діолу. 1 H ЯМР (CDCl3, 300МГц): δ 6.11 (s, 1H), 5.85 (s, 1H), 3.98-4.07 (m, 1H), 3.74 (dd, 1H), 3.54 (dd, 1H), 2.62 (d, 2H), 2.19 (bs, OH), 1.64 (bs, OH). Стадія C: (R)-4-(2-йодаліл)-2,2-диметил-1,3-діоксолан 21 UA 106762 C2 5 10 [0082] 2,2-Диметоксипропан і п-толуолсульфонат піридинію (PPTS) додають до розчину (R)4-йодпент-4-ен-1,2-діолу в дихлорметані, і суміш перемішують при кімнатній температурі протягом 2 годин. Розчинники вилучають при зниженому тиску, і сирий продукт очищають за допомогою флеш-хроматографії, використовуючи елюант етилацетат/гексан (1:10). Стадія D: (R)-3-(2,2-диметил-1,3-діоксолан-4-іл)проп-1-ен-2-сульфонілхлорид [0083] трет-Бутиллітій додають до розчину (R)-4-(2-йодаліл)-2,2-диметил-1,3-діоксолану в ефірі при –78 °C і суміш перемішують при –78 °C протягом 30 хвилин. Потім додають розчин тіонілхлориду в ефірі, суміш нагрівають до кімнатної температури і концентрують при зниженому тиску. Залишок розчиняють в хлороформі, фільтрують і сушать при зниженому тиску. [0084] ПРИКЛАД 4: (S)-3-(2,2-диметил-1,3-діоксолан-4-іл)проп-1-ен-2-сульфонілхлорид СТАДІЯ A HO TBS O 15 TMS HO СТАДІЯ C СТАДІЯ B 9-I-BBN HO K2CO3 I O O O СТАДІЯ D I i) тBuLi, Et O 2 O TBS O MeOH ДХМ HO PPTS/ДХМ O ii) SO2Cl2 O S O Cl O Стадія A: (S)-1-(трет-бутилдиметилсилілокси)пент-4-ин-2-ол 20 25 30 35 40 45 [0085] Карбонат калію додають до розчину (S)-1-(трет-бутилдиметилсилілокси)-5(триметилсиліл)пент-4-ин-2-олу в метанолі і суміш перемішують при кімнатній температурі протягом 8 годин. Розчинник вилучають при зниженому тиску, додають водний розчин хлориду амонію, і суміш екстрагують етилацетатом (3x). Об'єднані органічні шари промивають соляним розчином, сушать (MgSO4), концентрують при зниженому тиску і очищають за допомогою флешхроматографії (biotage; етилацетат / гексан градієнт). Стадія B: (S)-4-Йодпент-4-ен-1,2-діол [0086] 9-Йод-9-борабіцикло[3.3.1]нонан (9-I-BBN) по краплях додають до розчину (S)-1-(третбутилдиметилсилілокси) пент-4-ин-2-олу в дихлорметані при 0 °C і реакційну суміш перемішують при 0 °C протягом 4 годин. Додають льодяну оцтову кислоту, і суміш перемішують протягом додаткової години при 0 °C. Додають водну суміш Na2CO3/Na2S2O3 (1:1) і розчин, який одержали, екстрагують етилацетатом (3x). Об'єднані органічні шари сушать (MgSO 4) і концентрують при зниженому тиску. Стадія C: (S)-4-(2-йодаліл)-2,2-диметил-1,3-діоксолан [0087] 2,2-Диметоксипропан і п-толуолсульфонат піридинію (PPTS) додають до розчину (S)4-йодпент-4-ен-1,2-діолу в дихлорметані і суміш перемішують при кімнатній температурі протягом 2 годин. Розчинники вилучають при зниженому тиску, і сирий продукт очищають за допомогою флеш-хроматографії, використовуючи елюант етилацетат/гексан (1:10). Стадія D: (S)-3-(2,2-диметил-1,3-діоксолан-4-іл)проп-1-ен-2-сульфонілхлорид [0088] трет-Бутиллітій додають до розчину (S)-4-(2-йодаліл)-2,2-диметил-1,3-діоксолану в ефірі при –78 °C і суміш перемішують при –78 °C протягом 30 хвилин. Потім додають розчин тіонілхлориду в ефірі, суміш нагрівають до кімнатної температури і концентрують при зниженому тиску. Залишок розчиняють в хлороформі, фільтрують і сушать при зниженому тиску. 22 UA 106762 C2 [0089] ПРИКЛАД 5: (R)-N-(3,4-Дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-3-(2,2диметил-1,3-діоксолан-4-іл)проп-1-ен-2-сульфонамід СТАДІЯ B СТАДІЯ A СТАДІЯ C HO 9-Br-BBN HO Br PPTS/ДХМ O Br i) тBuLi, Et2O O TBS O ДХМ HO O O ii) SO2Cl2 O S СТАДІЯ D O Піридин Cl O O 100°C NH2 O O H N O O S O NH H N O F F F I F F I F 5 Стадія A: (R)-4-бромпент-4-ен-1,2-діол 10 15 20 25 30 35 40 45 [0090] Розчин 9-бром-9-борабіцикло[3.3.1]нонан (9-Br-BBN) в дихлорметані (1M, 10.6 мл) по краплях додають до розчину (R)-1-(трет-бутилдиметилсилілокси)пент-4-ин-2-олу (755 мг, 3.53 ммоль) в дихлорметані (4 мл) при 0 °C, і суміш перемішують при 0 °C протягом 4 годин. Додають льодяну оцтову кислоту (0.65 мл, 11.35 ммоль) і перемішування продовжують при 0 °C протягом додаткової 1 години. Етаноламін (2.5 мл, 41.5 ммоль) додають і суміші дозволяють нагрітися до кімнатної температури. Реакцію гасять шляхом додавання водної суміші Na2CO3/Na2S2O3 (40 мл, 1:1), екстрагують етилацетатом (3 × 30 мл), і об'єднані органічні шари сушать (MgSO4) і концентрують при зниженому тиску з одержанням (R)-4-бромпент-4-ен-1,2діолу. m/z=182 [M+1] . Стадія B: (R)-4-(2-йодаліл)-2,2-диметил-1,3-діоксолан [0091] 2,2 Диметоксипропан (993 мг, 9.5 ммоль) і п-толуолсульфонат піридинію (PPTS, 320 мг, 1.27 ммоль) додають до розчину (R)-4-бромпент-4-ен-1,2-діолу (1.15 г, 6.36 ммоль) в дихлорметані (15 мл) і суміш перемішують при кімнатній температурі протягом 4 годин. Розчинники вилучають при зниженому тиску, і сирий продукт очищають за допомогою флешхроматографії (елюант етилацетат:гексан, 1:10) з одержанням (R)-4-(2-йодаліл)-2,2-диметил1,3-діоксолану (1.12 г, 80 %). 1 H ЯМР (500 МГц, ХЛОРОФОРМ-d) δ м.д. 1.34 (s, 3 H), 1.39 (s, 3 H), 2.52 (dd, J=14.49, 6.05 Гц, 1 H), 2.73 (dd, J=14.67, 6.60 Гц, 1 H), 3.60 (dd, J=8.16, 6.14 Гц, 1 H), 4.06 (dd, J=8.07, 6.05 Гц, 1 H), 4.34 (квин., J=6.28 Гц, 1 H), 5.78 (d, J=1.10 Гц, 1 H), 6.13 (d, J=1.10 Гц, 1 H). Стадія C: (R)-3-(2,2-диметил-1,3-діоксолан-4-іл)проп-1-ен-2-сульфонілхлорид [0092] Розчин трет-бутиллітію в гексані (1.7M, 7.65 мл) по краплях додають до розчину (R)-4(2-йодаліл)-2,2-диметил-1,3-діоксолану (1.21, 6.5 ммоль) в діетиловому ефірі (12 мл) при -78 °C, і реакційну суміш перемішують при -78 °C протягом 30 хв. Додають дихлорид сульфурилу (SO2Cl2, 538 мкл, 6.5 ммоль), суміш нагрівають до кімнатної температури і розчинники вилучають при зниженому тиску. Продукт використовують на наступній стадії без додаткового очищення. Стадія D: (R)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-3-(2,2-диметил1,3-діоксолан-4-іл)проп-1-ен-2-сульфонамід [0093] (R)-3-(2,2-диметил-1,3-діоксолан-4-іл)проп-1-ен-2-сульфонілхлорид із стадії C 1 розчиняють в піридині (12 мл) і додають 5,6-дифтор-N -(2-фтор-4-йодфеніл)-3-метоксибензол1,2-діамін (2.56 г, 6.5 ммоль). Розчин перемішують при 100 °C протягом 2 годин і потім розподіляють між водою і етилацетатом. Органічний шар промивають соляним розчином, сушать (MgSO4), концентрують при зниженому тиску і очищають за допомогою колонкової флеш-хроматографії на силікагелі (елюант 30 % етилацетат/гексани) з одержанням (R)-N-(3,4 23 UA 106762 C2 5 дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-3-(2,2-диметил-1,3-діоксолан-4-іл)проп-1ен-2-сульфонаміду (651 мг, 17 %). 1 H ЯМР (500 МГц, ХЛОРОФОРМ-d) δ м.д. 1.32 (s, 3 H), 1.39 (s, 3 H), 2.57-2.64 (m, 1 H), 2.642.72 (m, 1 H), 3.59 (dd, J=8.25, 6.60 Гц, 1 H), 3.78 (s, 3 H), 4.00-4.13 (m, 1 H), 4.27-4.36 (m, 1 H), 5.72 (s, 1 H), 5.92 (s, 1 H), 6.21 (s, 1 H), 6.41 (td, J=8.62, 5.14 Гц, 1 H), 6.47 (dd, J=11.19, 6.60 Гц, 1 H), 7.15 (s, 1 H) 7.25 (s, 1 H), 7.35 (dd, J=10.45, 1.83 Гц, 1 H). [0094] ПРИКЛАД 6: (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-3-(2,2диметил-1,3-діоксолан-4-іл)проп-1-ен-2-сульфонамід СТАДІЯ A СТАДІЯ C СТАДІЯ B HO 9-Br-BBN HO Br PPTS/ДХМ O Br i) тBuLi, Et2O O TBS O ДХМ HO O O ii) SO2Cl2 O S СТАДІЯ D O Піридин Cl O O 100°C NH2 O O H N O O S O NH H N O F F F I F F 10 I F Стадія A: (S)-4-бромпент-4-ен-1,2-діол 15 20 25 30 35 40 [0095] Розчин 9-бром-9-борабіцикло[3.3.1]нонану (9-Br-BBN) в дихлорметані по краплях додають до розчину (S)-1-(трет-бутилдиметилсилілокси)пент-4-ин-2-олу в дихлорметані при 0 °C, і суміш перемішують при 0 °C протягом 4 годин. Додають льодяну оцтову кислоту і перемішування продовжують при 0 °C протягом додаткової 1 години. Додають етаноламін і суміші дозволяють нагрітися до кімнатної температури. Реакцію гасять шляхом додавання водної суміші Na2CO3/Na2S2O3 (1:1), екстрагують етилацетатом (3x), і об'єднані органічні шари сушать (MgSO4) і концентрують при зниженому тиску з одержанням (S)-4-бромпент-4-ен-1,2діолу. Стадія B: (S)-4-(2-йодаліл)-2,2-диметил-1,3-діоксолан [0096] 2,2 Диметоксипропан (7.5 екв.) і п-толуолсульфонат піридинію (1 екв.) додають до розчину (R)-4-бромпент-4-ен-1,2-діолу (5 екв.) в дихлорметані і суміш перемішують при кімнатній температурі протягом 4 годин. Розчинники вилучають при зниженому тиску, і сирий продукт очищають за допомогою флеш-хроматографії (10 % етилацетат/гексан, елюант). Стадія C: (S)-3-(2,2-диметил-1,3-діоксолан-4-іл)проп-1-ен-2-сульфонілхлорид [0097] Розчин трет-бутиллітію в гексані (1.7M, 2 екв.) по краплях додають до розчину (S)-4(2-йодаліл)-2,2-диметил-1,3-діоксолану (1 екв.) в діетиловому ефірі при -78 °C, і реакційну суміш перемішують при -78 °C протягом 30 хв. Додають дихлорид сульфурилу (1 екв.), суміш нагрівають до кімнатної температури і розчинники вилучають при зниженому тиску. Стадія D: (S)-N-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-3-(2,2-диметил1,3-діоксолан-4-іл)проп-1-ен-2-сульфонамід [0098] (S)-3-(2,2-диметил-1,3-діоксолан-4-іл)проп-1-ен-2-сульфонілхлорид (1 екв.) 1 розчиняють в піридині і додають 5,6-дифтор-N -(2-фтор-4-йодфеніл)-3-метоксибензол-1,2-діамін (1 екв.). Розчин перемішують при 100 °C протягом 2 годин і потім розподіляють між водою і етилацетатом. Органічний шар промивають соляним розчином, сушать (MgSO 4), концентрують при зниженому тиску і очищають за допомогою колонкової флеш-хроматографії на силікагелі (30 % етилацетат/гексани елюант). [0099] ПРИКЛАД 7: (R)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1сульфонілхлорид 45 24 UA 106762 C2 O S O S + Br Основа S S O O O NCS, HCl SO2Cl O H2O, MeCN O O Стадія A: 1,2-Біс(1-(((R)-2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропіл)дисульфан 5 10 15 20 [00100] н-Бутиллітій (1.7 M в гексані, 1.2 екв.) по краплях додають протягом 1 години до розчину 1,2-дициклопропілдисульфану (1 екв.) в ТГФ (1.5 мл/ммоль) при -20 °C. Потім при 78 °C додають (S)-4-(бромметил)-2,2-диметил-1,3-діоксолан (1.1 екв.) і перемішування при 78 °C продовжують протягом додаткових 4 годин. Додають насичений водний розчин хлориду амонію і суміш екстрагують етилацетатом (3x). Об'єднані органічні екстракти сушать (Na2SO4) і очищають за допомогою флеш-хроматографії (елюант етилацетат в гексані). Стадія B: (R)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид [00101] До суміші 2 M HCl (0.6 мл/ммоль) і ацетонітрилу (3.4 мл/ммоль) додають Nхлорсукцинімід (NCS, 1 екв.), і суміш охолоджують до 10 °C. Розчин 1,2-біс(1-(((R)-2,2-диметил1,3-діоксолан-4-іл)метил)циклопропіл)дисульфану (2.5 екв.) в ацетонітрилі (0.25 мл/ммоль) по краплях додають до суміші, яку перемішують при температурі нижче 20 °C протягом 20 хвилин. Додають ді-ізо-пропіловий простий ефір (15 мл/ммоль) і відокремлений органічний шар промивають соляним розчином, сушать (Na2SO4), концентрують при зниженому тиску і сиру речовину очищають за допомогою флеш-хроматографії (етилацетат в гексані елюант). Див. Nishiguchi і інш., Синтез, 2006, 24, 4131-4134 для додаткових подробиць. [00102] ПРИКЛАД 8: 1,2-Біс(1-(((S)-2,2-диметил-1,3-діоксолан-4іл)метил)циклопропіл)дисульфан O S O S + O Br Основа S O S O NCS, HCl O H2O, MeCN O SO2Cl O 25 Стадія A: 1,2-Біс(1-(((S)-2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропіл)дисульфан 30 35 40 [00103] н-Бутиллітій (1.7 M в гексані, 1.2 екв.) по краплях додають протягом 1 години до розчину 1,2-дициклопропілдисульфану (1 екв.) в ТГФ (1.5 мл/ммоль) при -20 °C. Потім при 78 °C додають (R)-4-(бромметил)-2,2-диметил-1,3-діоксолан (1.1 екв.) і перемішування при 78 °C продовжують протягом додаткових 4 годин. Додають насичений водний розчин хлориду амонію і суміш екстрагують етилацетатом (3x). Об'єднані органічні екстракти сушать (Na2SO4) і очищають за допомогою флеш-хроматографії (етилацетат в гексані елюант). Стадія B: (S)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид [00104] N-Хлорсукцинімід (NCS, 1 екв.) додають до суміші 2 M HCl (0.6 мл/ммоль) і ацетонітрилу (3.4 мл/ммоль) і охолоджують до 10 °C. Розчин 1,2-біс(1-(((S)-2,2-диметил-1,3діоксолан-4-іл)метил)циклопропіл)дисульфану (2.5 екв.) в ацетонітрилі (0.25 мл/ммоль) по краплях додають до суміші, яку перемішують при температурі нижче 20 °C протягом 20 хвилин. Додають ді-ізо-пропіловий простий ефір (15 мл/ммоль) і відокремлений органічний шар промивають соляним розчином, сушать (Na2SO4), концентрують при зниженому тиску і сиру речовину очищають за допомогою флеш-хроматографії (етилацетат в гексані елюант). Див. Nishiguchi і інш., Синтез, 2006, 24, 4131-4134 для додаткових подробиць. 25 UA 106762 C2 [00105] ПРИКЛАД сульфонілхлорид 9: (R)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропан-1 5 СТАДІЯ A: (R)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонат натрію 10 15 20 25 30 35 40 [00106] 30 % Пероксид водню (9 екв.) додають до розчину 1,2-біс(1-(((R)-2,2-диметил-1,3діоксолан-4-іл)метил)циклопропіл)дисульфану (1 екв.) і ацетату натрію (2 екв.) в оцтовій кислоті (5 мл/ммоль). Розчин нагрівають при 80 °C протягом 1 години, охолоджують, концентрують при зниженому тиску і сиру речовину очищають за допомогою перекристалізації. Див. FernandezBolanos, і інш., Carbohydrate Research, 1988, 173(1), 33-40, для додаткових подробиць. СТАДІЯ B: (R)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид [00107] Розчин (R)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонату натрію (1 екв.) і фосфорил трихлориду (POCl3, 0.7 мл/ммоль) нагрівають при 80 °C протягом 1 години. Реакційну суміш охолоджують до кімнатної температури, виливають на лід, перемішують протягом 30 хвилин і екстрагують хлороформом (2x). Об'єднані органічні екстракти сушать (MgSO4) і концентрують при зниженому тиску. [00108] ПРИКЛАД 10: (S)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропан-1сульфонілхлорид СТАДІЯ A: (S)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонат натрію [00109] 30 % Пероксид водню (9 екв.) додають до розчину 1,2-біс(1-(((S)-2,2-диметил-1,3діоксолан-4-іл)метил)циклопропіл)дисульфану (1 екв.) і ацетату натрію (2 екв.) в оцтовій кислоті (5 мл/ммоль). Розчин нагрівають при 80 °C протягом 1 години, охолоджують, концентрують при зниженому тиску і сиру речовину очищають за допомогою перекристалізації. Див. FernandezBolanos, і інш., Carbohydrate Research, 1988, 173(1), 33-40, для додаткових подробиць. СТАДІЯ B: (S)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид [00110] Розчин (S)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонату натрію (1 екв.) і фосфорил трихлориду (POCl3, 0.7 мл/ммоль) нагрівають при 80 °C протягом 1 години. Реакційну суміш охолоджують до кімнатної температури, виливають на лід, перемішують протягом 30 хвилин і екстрагують хлороформом (2x). Об'єднані органічні екстракти сушать (MgSO4) і концентрують при зниженому тиску. [00111] ПРИКЛАД 11: (R)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропан-1сульфонілхлорид 26 UA 106762 C2 СТАДІЯ A: (R)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропантіол 5 10 15 20 [00112] Розчин 1,2-біс(1-(((R)-2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропіл)дисульфану (1 екв.) і трифенілфосфіну в суміші діоксану і води (4/1), яка містить дві краплі концентрованої соляної кислоти перемішують при 40 °C протягом 20 хв і концентрують при зниженому тиску. Сиру речовину очищають за допомогою флеш-хроматографії (етилацетат в гексані елюант). Див. Overman і інш., Синтез, 1974, 59-60 для додаткових подробиць. СТАДІЯ B: (R)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонат натрію [00113] Гідроксид натрію (4 екв.) додають до розчину (R)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропантіолу (1 екв.) в ДМФА (0.5мл/ммоль), і перемішують при кімнатній температурі протягом ночі і гідролізують. Суміш екстрагують етилацетатом (3x), і об'єднані органічні шари сушать (MgSO4), концентрують при зниженому тиску і сиру речовину перекристалізовують. СТАДІЯ C: (R)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид [00114] Розчин (R)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонату натрію (1 екв.) і фосфорил трихлориду (POCl3, 0.7 мл/ммоль) нагрівають при 80 °C протягом 1 години. Реакційну суміш охолоджують до кімнатної температури, виливають на лід, перемішують протягом 30 хвилин і екстрагують хлороформом (2x). Об'єднані органічні екстракти сушать (MgSO4) і концентрують при зниженому тиску. [00115] ПРИКЛАД 12: (S)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропан-1сульфонілхлорид O O 25 O S S PPh3, HCl NaOH O O Діоксан, H2O SH O SO3- Na+ POCl3 O SO2Cl ДМФА O O O СТАДІЯ A: (S)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропантіол 30 35 40 45 [00116] Розчин 1,2-біс(1-(((S)-2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропіл)дисульфану (1 екв.) і трифенілфосфіну в суміші діоксану і води (4/1), яка містить дві краплі концентрованої соляної кислоти перемішують при 40 °C протягом 20 хв і концентрують при зниженому тиску. Сиру речовинуочищають за допомогою флеш-хроматографії (етилацетат в гексані елюант). Див. Overman і інш., Синтез, 1974, 59-60 для додаткових подробиць. СТАДІЯ B: (S)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонат натрію [00117] Гідроксид натрію (4 екв.) додають до розчину (S)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропантіолу (1 екв.) в ДМФА (0.5мл/ммоль), і перемішують при кімнатній температурі протягом ночі і гідролізують. Суміш екстрагують етилацетатом (3x), і об'єднані органічні шари сушать (MgSO4), концентрують при зниженому тиску і сиру речовину перекристалізовують. СТАДІЯ C: (S)-1-((2,2-Диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонілхлорид [00118] Розчин (S)-1-((2,2-диметил-1,3-діоксолан-4-іл)метил)циклопропан-1-сульфонату натрію (1 екв.) і фосфорил трихлориду (POCl3, 0.7 мл/ммоль) нагрівають при 80 °C протягом 1 години. Реакційну суміш охолоджують до кімнатної температури, виливають на лід, перемішують протягом 30 хвилин і екстрагують хлороформом (2x). Об'єднані органічні екстракти сушать (MgSO4) і концентрують при зниженому тиску. 27 UA 106762 C2 5 10 [00119] ПРИКЛАД 13 1 Фігура 2 демонструє H ЯМР спектр (S)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропан-1-сульфонату натрію в CD3OD. 1 H ЯМР (400 МГц, CD3OD) δ м.д. 0.39 (ddd, J=9.85, 6.71, 5.27 Гц, 1 H), 0.57-0.76 (m, 2 H), 0.76-0.89 (m, 1 H), 1.31 (s, 3 H), 1.51 (dd, J=13.30, 2.76 Гц, 1 H), 1.57 (s, 3 H), 1.94-2.07 (m, 1 H), 2.89 (dd, J=13.80, 8.03 Гц, 1 H), 3.07 (dd, J=13.80, 4.27 Гц, 1 H), 4.51-4.62 (m, 1 H). [00120] ПРИКЛАД 14 13 Фігура 3 демонструє C ЯМР спектр (S)-1-((2,2-диметил-1,3-діоксолан-4іл)метил)циклопропан-1-сульфонату натрію в CD3OD. 13 C ЯМР (МЕТАНОЛ-d4) δ м.д. 10.30, 15.17, 21.75, 30.13, 38.88, 54.79, 58.37, 67.15, 101.78. ФОРМУЛА ВИНАХОДУ 15 1. Спосіб одержання сполуки формули (I-а): R R 1 2 O O O S O NH F H N O F I F , формула (I-а) 1 в якому здійснюють введення у взаємодію 5,6-дифтор-N -(2-фтор-4-йодфеніл)-3метоксибензол-1,2-діаміну зі сполукою формули (ІІ-а): R 25 R 2 1 O O O O R 20 1 O S Cl , формула (ІІ-а) де 1 R означає Н або захисну групу для спиртової групи; 2 R означає Н або захисну групу для спиртової групи; або 1 2 R та R разом з атомами кисню, до яких вони приєднані, утворюють циклічну захисну групу для 1,2-діольної групи. 2. Спосіб одержання сполуки формули (І-b): R 2 O O S O NH F H N O F I F , формула (I-b) 1 в якому здійснюють введення у взаємодію 5,6-дифтор-N -(2-фтор-4-йодфеніл)-3метоксибензол-1,2-діаміну зі сполукою формули (ІІ-b): R 30 1 R 2 O O S O Cl O , формула (ІІ-b) де 1 R означає Н або захисну групу для спиртової групи; 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPreparation of (r)- and (s)-n-(3,4-difluoro-2-(2-fluoro-4-iodophenylamino)-6-methoxyphenyl)-1-(2,3-dihydroxypropyl)cyclopropane-1-sulfonamide and protected derivatives thereof
Автори англійськоюMaderna, Andreas, Vernier, Jean-Michel
Автори російськоюМадерна Андреас, Вернье Жан-Мишель
МПК / Мітки
МПК: C07C 309/82, C07C 309/85, C07C 303/40, C07C 303/38, C07C 311/28
Мітки: одержання, захищених, s)-n-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфанаміду, спосіб, похідних
Код посилання
<a href="https://ua.patents.su/34-106762-sposib-oderzhannya-r-ta-s-n-34-diftor-2-2-ftor-4-jjodfenilamino-6-metoksifenil-1-23-digidroksipropilciklopropan-1-sulfanamidu-ta-jjogo-zakhishhenikh-pokhidnikh.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання (r)- та (s)-n-(3,4-дифтор-2-(2-фтор-4-йодфеніламіно)-6-метоксифеніл)-1-(2,3-дигідроксипропіл)циклопропан-1-сульфанаміду та його захищених похідних</a>
Попередній патент: Пристрій та спосіб виробництва чавуну, сталевого напівфабрикату та відновлювальних газів
Наступний патент: Фуразанобензимідазоли як проліки для лікування пухлинних або аутоімунних захворювань
Випадковий патент: Пневматичний висівний апарат