Засоби для лікування порушень із залученням модуляції рецепторів ріанодину
Номер патенту: 113759
Опубліковано: 10.03.2017
Автори: Вебб Яєль, Бертран Марк, Маркс Ендрю Р., Бельведер Сандро, Пегльон Жан-Луї, Янь Цзямін, Вільньов Ніколь
Формула / Реферат
1. Сполука, яка представлена структурою Формули (І):
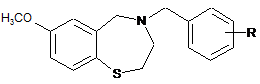 , (І)
, (І)
де
R являє собою СООН;
або її фармацевтично прийнятні солі.
2. Сполука за п. 1 у формі солі з фармацевтично прийнятною кислотою або основою.
3. Сполука за п. 2, яка відрізняється тим, що сіль вибирають з групи, що складається з натрію, калію, магнію, геміфумарату, гідрохлориду і гідроброміду, переважно сіль являє собою сіль натрію або геміфумарату.
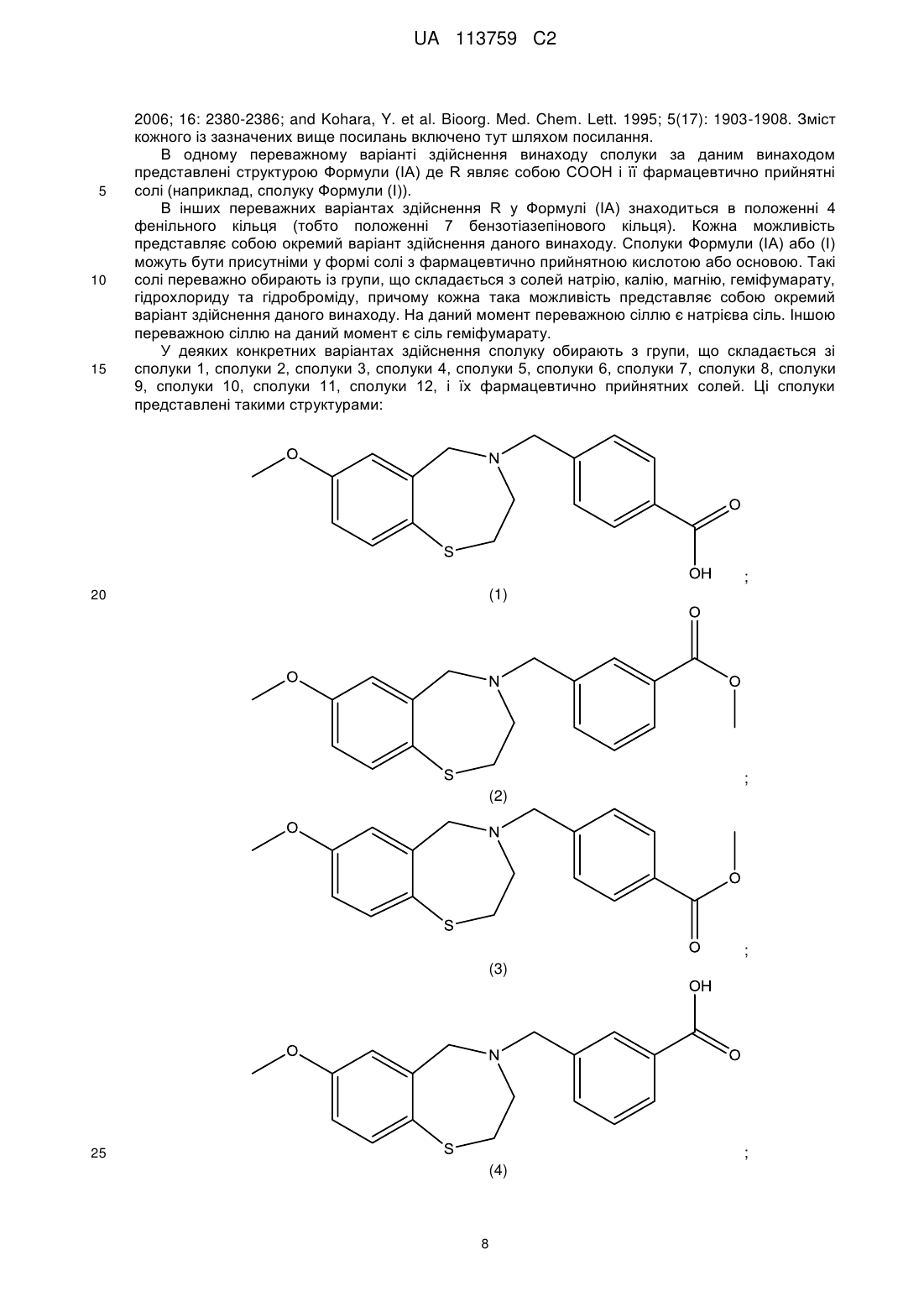
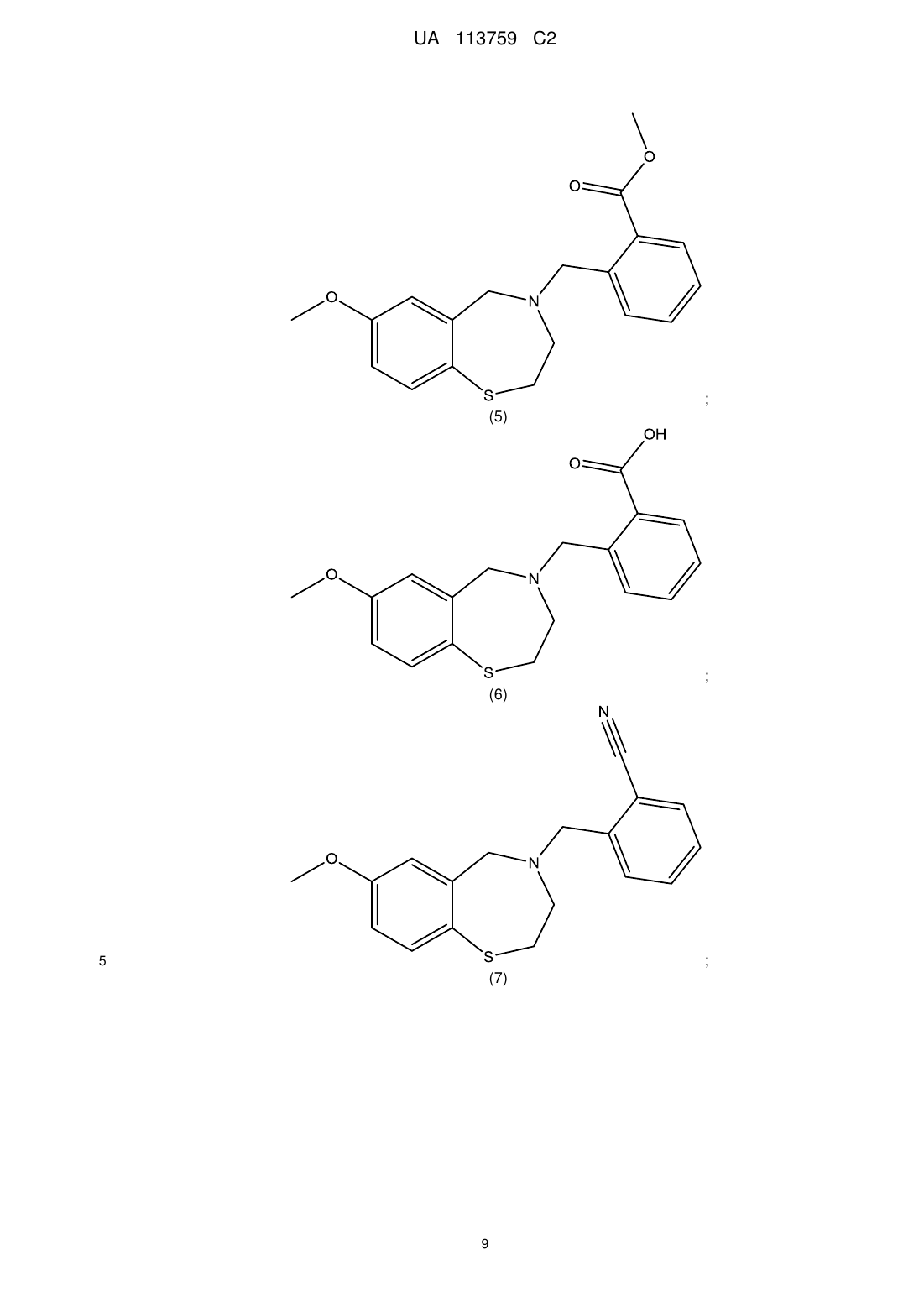
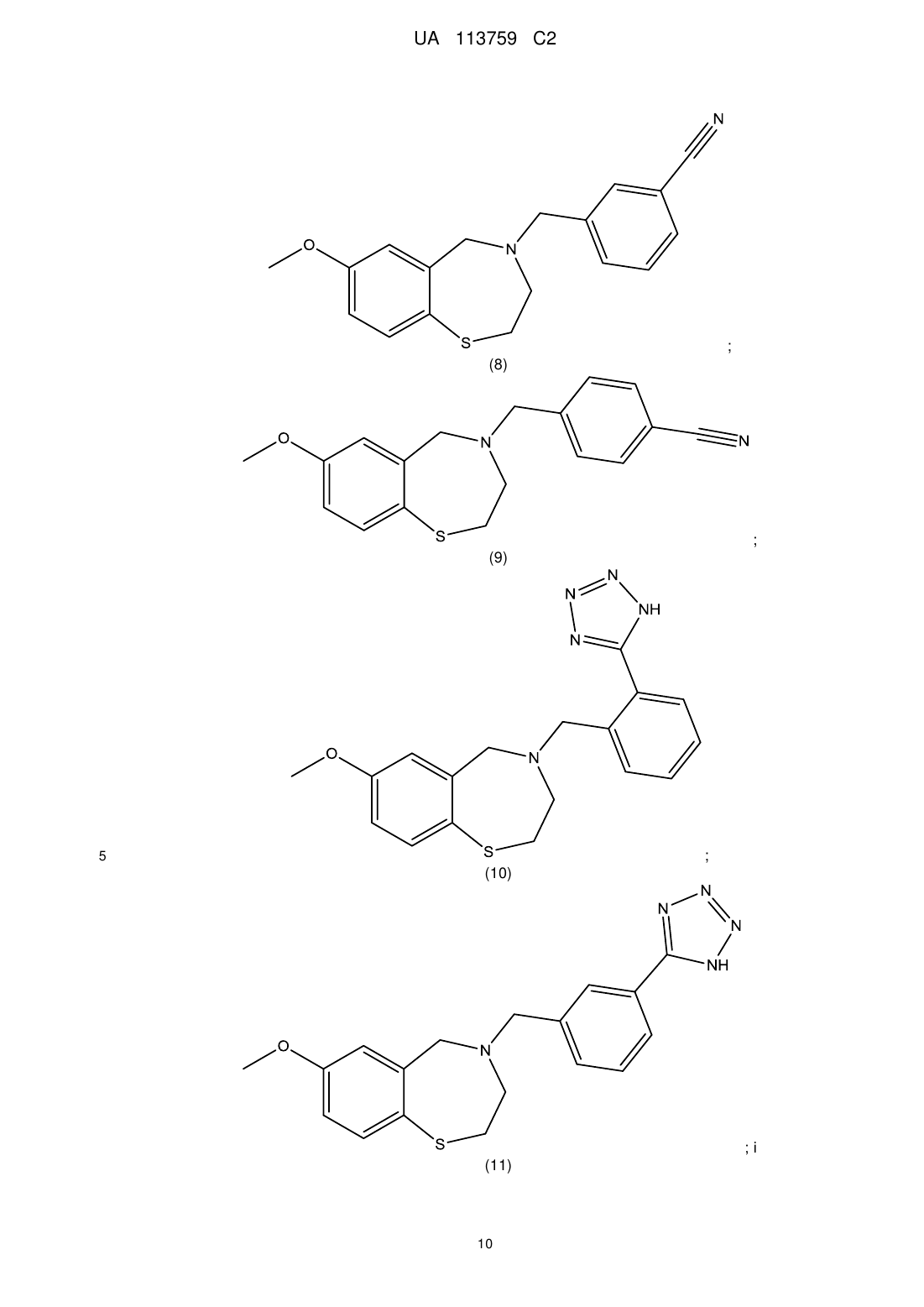
4. Сполука за п. 1, яку вибирають з групи, що складається з:
 ;
;
 і
і
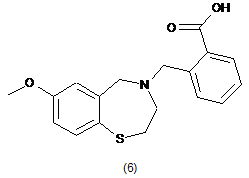 .
.
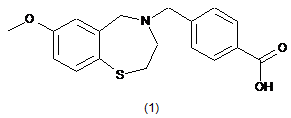
5. Сполука за п. 1, яка представлена структурою Формули (1):
 ,
,
або її фармацевтично прийнятні солі.
6. Сполука за п. 5 у формі солі з фармацевтично прийнятною кислотою або основою.
7. Сполука за п. 6, яка відрізняється тим, що сіль вибирають з групи, що складається з натрію, калію, магнію, геміфумарату, гідрохлориду і гідроброміду.
8. Сполука за п. 7, яка відрізняється тим, що сіль являє собою натрієву сіль.
9. Сполука за п. 7, яка відрізняється тим, що сіль являє собою сіль геміфумарату.
10. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-9 у поєднанні з одним або кількома фармацевтично прийнятними наповнювачами або носіями.
11. Фармацевтична композиція за п. 10 для застосування у лікуванні або профілактиці стану, вибраного з групи, що складається з серцевих порушень та захворювань, м'язової втоми, скелетно-м'язових порушень та захворювань, порушень та захворювань ЦНС, когнітивної дисфункції, нервово-м'язових порушень та захворювань, уражень та захворювань кісток, ракової кахексії, злоякісної гіпертермії, цукрового діабету, раптової серцевої смерті і синдрому раптової дитячої смерті, або для покращення когнітивної функції.
12. Спосіб лікування або профілактики стану, вибраного з групи, що складається з серцевих порушень та захворювань, м'язової втоми, скелетно-м'язових порушень та захворювань, порушень та захворювань ЦНС, когнітивної дисфункції, нервово-м'язових порушень та захворювань, уражень та захворювань кісток, ракової кахексії, злоякісної гіпертермії, цукрового діабету, раптової серцевої смерті і синдрому раптової дитячої смерті, або для покращення когнітивної функції, за яким вводять пацієнту, який цього потребує, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-9 або фармацевтичної композиції за п. 10 для здійснення такого лікування.
13. Фармацевтична композиція за п. 10 для застосування у лікуванні або профілактиці стану, вказаного в п. 11, де стан є пов'язаним з аномальною функцією рецептора ріанодину 1 (RyR1), рецептора ріанодину типу 2 (RyR2), рецептора ріанодину типу 3 (RyR3) або їх поєднання.
14. Фармацевтична композиція за п. 10 для застосування в способі лікування або профілактики стану, вказаного в п. 12, де стан є пов'язаним з аномальною функцією рецептора ріанодину 1 (RyR1), рецептора ріанодину типу 2 (RyR2), рецептора ріанодину типу 3 (RyR3) або їх поєднання.
15. Фармацевтична композиція за п. 10 для застосування у лікуванні або профілактиці стану, вказаного в п. 11, де серцеві порушення і захворювання вибирають з групи, що складається з порушень і захворювань, пов'язаних з нерегулярним серцебиттям, таких як порушення і захворювання, пов'язані з нерегулярним серцебиттям, вибрані з групи, що складається з передсердної і шлуночкової аритмії, передсердної і шлуночкової фібриляції, передсердної і шлуночкової тахіаритмії, передсердної і шлуночкової тахікардії, катехоламінергічної поліморфної шлуночкової тахікардії (КПШТ) та їх варіантів, викликаних фізичним навантаженням; порушення і захворювання, пов'язані з нерегулярним серцебиттям, викликані фізичним навантаженням; серцева недостатність; застійна серцева недостатність; хронічна серцева недостатність; гостра серцева недостатність; систолічна серцева недостатність; діастолічна серцева недостатність; гостра декомпенсована серцева недостатність; ішемічно-реперфузійне (І/Р) пошкодження серця; хронічна обструктивна хвороба легень; ішемічно-реперфузійне пошкодження після коронарної ангіопластики або після тромболізису при лікуванні інфаркту міокарда (ІМ) і високий кров'яний тиск.
16. Фармацевтична композиція за п. 10 для застосування в способі лікування або профілактики стану, вказаного в п. 12, де серцеві порушення і захворювання вибирають з групи, що складається з порушень і захворювань, пов'язаних з нерегулярним серцебиттям, таких як порушення і захворювання, пов'язані з нерегулярним серцебиттям, вибрані з групи, що складається з передсердної і шлуночкової аритмії, передсердної і шлуночкової фібриляції, передсердної і шлуночкової тахіаритмії, передсердної і шлуночкової тахікардії, катехоламінергічної поліморфної шлуночкової тахікардії (КПШТ) та їх варіантів, викликаних фізичним навантаженням; порушення і захворювання, пов'язані з нерегулярним серцебиттям, викликані фізичним навантаженням; серцева недостатність; застійна серцева недостатність; хронічна серцева недостатність; гостра серцева недостатність; систолічна серцева недостатність; діастолічна серцева недостатність; гостра декомпенсована серцева недостатність; ішемічно-реперфузійне (І/Р) пошкодження серця; хронічна обструктивна хвороба легень; ішемічно-реперфузійне пошкодження після коронарної ангіопластики або після тромболізису при лікуванні інфаркту міокарда (ІМ) і високий кров'яний тиск.
17. Фармацевтична композиція за п. 10 для застосування у лікуванні або профілактиці стану, вказаного в п. 11, де м'язова втома виникає внаслідок скелетно-м'язового захворювання, порушення або стану.
18. Фармацевтична композиція за п. 10 для застосування в способі лікування або профілактики стану, вказаного в п. 12, де м'язова втома виникає внаслідок скелетно-м'язового захворювання, порушення або стану.
19. Фармацевтична композиція за п. 10 для застосування у лікуванні або профілактиці стану, вказаного в п. 11, де скелетно-м'язове порушення, захворювання або стан вибирають з групи, що складається з скелетно-м'язової втоми, викликаної фізичним навантаженням; м'язової втоми, викликаної фізичним навантаженням, яка виникає в результаті тривалого фізичного навантаження або високоінтенсивного фізичного навантаження; вродженої міопатії; м'язової дистрофії, такої як м'язова дистрофія Дюшена (МДД), м'язова дистрофія Беккера (МДБ), поясно-кінцівкова дистрофія (ПКД), плечолопатково-лицева дистрофія, міотонічна м'язова дистрофія, вроджена м'язова дистрофія (ВМД), дистальна м'язова дистрофія, м'язова дистрофія Емері-Дрейфуса і окулофарингеальна м'язова дистрофія; спінальної м'язової атрофії (СМА), спінальної і бульбарної м'язової атрофії (СБМА), м'язової втоми, пов'язаної з віком, саркопенії, хвороби серцевини м'язових волокон, ракової кахексії, ураження сечового міхура і нетримання сечі.
20. Фармацевтична композиція за п. 10 для застосування в способі лікування або профілактики стану, вказаного в п. 12, де скелетно-м'язове порушення, захворювання або стан вибирають з групи, що складається з скелетно-м'язової втоми, викликаної фізичним навантаженням; м'язової втоми, викликаної фізичним навантаженням, яка виникає в результаті тривалого фізичного навантаження або високоінтенсивного фізичного навантаження; вродженої міопатії; м'язової дистрофії, такої як м'язова дистрофія Дюшена (МДД), м'язова дистрофія Беккера (МДБ), поясно-кінцівкова дистрофія (ПКД), плечолопатково-лицева дистрофія, міотонічна м'язова дистрофія, вроджена м'язова дистрофія (ВМД), дистальна м'язова дистрофія, м'язова дистрофія Емері-Дрейфуса і окулофарингеальна м'язова дистрофія; спінальної м'язової атрофії (СМА),спінальної і бульбарної м'язової атрофії (СБМА), м'язової втоми, пов'язаної з віком, саркопенії, хвороби серцевини м'язових волокон, ракової кахексії, ураження сечового міхура і нетримання сечі.
21. Фармацевтична композиція за п. 10 для застосування у лікуванні або профілактиці стану, вказаного в п. 11, де порушення і захворювання ЦНС вибирають з групи, що складається з хвороби Альцгеймера (ХА), нейропатії, судом, хвороби Паркінсона (ХП) і хвороби Хантінгтона (XX); і нервово-м'язові порушення і захворювання вибирають з групи, що складається зі спінально-церебелярної атаксії (СЦА) і бічного аміотрофічного склерозу (БАС, хвороби Лу Геріга).
22. Фармацевтична композиція за п. 10 для застосування в способі лікування або профілактики стану, вказаного в п. 12, де порушення і захворювання ЦНС вибирають з групи, що складається з хвороби Альцгеймера (ХА), нейропатії, судом, хвороби Паркінсона (ХП) і хвороби Хантінгтона (XX); і нервово-м'язові порушення і захворювання вибирають з групи, що складається зі спінально-церебелярної атаксії (СЦА) і бічного аміотрофічного склерозу (БАС, хвороби Лу Геріга).
23. Фармацевтична композиція за п. 10 для застосування у лікуванні або профілактиці стану, вказаного в п. 11, де когнітивна дисфункція є пов'язаною зі стресом або пов'язаною з віком, або когнітивна функція, яка потребує поліпшення, являє собою короткочасну пам'ять, довготривалу пам'ять, увагу або навчання, або когнітивна дисфункція є пов'язаною із захворюванням або порушенням, вибраним з групи, що складається з хвороби Альцгеймера (ХА), синдрому дефіциту уваги і гіперактивності (СДУГ), розладу аутистичного спектра (РАС), генералізованого тривожного розладу (ГТР), обсесивно-компульсивного розладу (ОКР), хвороби Паркінсона (ХП), синдрому посттравматичного стресу (ПТСР), шизофренії, біполярного розладу або великої депресії.
24. Фармацевтична композиція за п. 10 для застосування в способі лікування або профілактики стану, вказаного в п. 12, де когнітивна дисфункція є пов'язаною зі стресом або пов'язаною з віком, або когнітивна функція, яка потребує поліпшення, являє собою короткочасну пам'ять, довготривалу пам'ять, увагу або навчання, або когнітивна дисфункція є пов'язаною із захворюванням або порушенням, вибраним з групи, що складається з хвороби Альцгеймера (ХА), синдрому дефіциту уваги і гіперактивності (СДУГ), розладу аутистичного спектра (РАС), генералізованого тривожного розладу (ГТР), обсесивно-компульсивного розладу (ОКР), хвороби Паркінсона (ХП), синдрому посттравматичного стресу (ПТСР), шизофренії, біполярного розладу або великої депресії.
25. Фармацевтична композиція за п. 10 для застосування у лікуванні або профілактиці стану, вказаного в п. 11, де стан являє собою ракову кахексію, переважно викликану раком, який має метастази у кістки.
26. Фармацевтична композиція за п. 10 для застосування в способі лікування або профілактики стану, вказаного в п. 12, де стан являє собою ракову кахексію, переважно викликану раком, який має метастази у кістки.
27. Фармацевтична композиція за п. 10 для застосування в способі лікування або профілактики стану, вказаного в п. 12, де сполука за будь-яким з пп. 1-9 використовується у дозі, достатній для відновлення або поліпшення зв'язування калстабіну-2 з RyR2.
28. Фармацевтична композиція за п. 10 для застосування в способі лікування або профілактики стану, вказаного в п. 12, де сполука за будь-яким з пп. 1-9 використовується у дозі, достатній для відновлення або поліпшення зв'язування калстабіну-1 з RyR1.
29. Фармацевтична композиція за п. 10 для застосування в способі лікування або профілактики стану, вказаного в п. 12, де сполука за будь-яким з пп. 1-9 використовується у дозі, достатній для зниження витоку Са2+ через канал RyR.
30. Сполука за будь-яким з пп. 1-9 або її сіль для застосування у лікуванні або профілактиці стану, вибраного з групи, що складається з серцевих порушень та захворювань, м'язової втоми, скелетно-м'язових порушень та захворювань, порушень та захворювань ЦНС, когнітивної дисфункції, нервово-м'язових порушень та захворювань, уражень та захворювань кісток, ракової кахексії, злоякісної гіпертермії, цукрового діабету, раптової серцевої смерті і синдрому раптової дитячої смерті, або для покращення когнітивної функції.
31. Фармацевтична композиція за п. 10 в поєднанні з антисмисловим олігонуклеотидом (АО), який є специфічним для послідовності сплайсингу у мРНК-мішені, для посилення пропуску екзонів у зазначеній мРНК-мішені, для застосування в способі лікування або профілактики стану, вказаного в п. 12.
32. Фармацевтична композиція за п. 31 для застосування у лікуванні м'язової дистрофії Дюшена (МДД), яка відрізняється тим, що антисмисловий олігонуклеотид (АО) є специфічним для послідовності сплайсингу принаймні одного екзона гена МДД, переважно послідовності сплайсингу екзона 23, 45, 44, 50, 51, 52 та/або 53 гена МДД.
33. Спосіб лікування пацієнта, який має м'язову дистрофію Дюшена (МДД), за яким вводять зазначеному пацієнту сполуку за будь-яким з пп. 1-9, або фармацевтичну композицію за п. 10, у поєднанні з антисмисловим олігонуклеотидом (АО), який є специфічним для послідовності сплайсингу принаймні одного екзона гена МДД, переважно послідовності сплайсингу екзона 23, 45, 44, 50, 51, 52 та/або 53 гена МДД.
34. Спосіб отримання сполуки за будь-яким з пп. 1-9, за яким здійснюють взаємодію сполуки формули
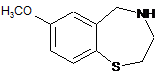
зі сполукою формули
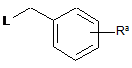 ,
,
де Ra являє собою COOR1 або CN; R1 являє собою С1-С4-алкіл і L являє собою заміщувану групу, для отримання сполуки формули:
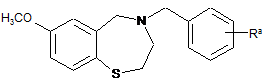 ; і
; і
конвертування групи Ra у групу R для отримання сполуки формули (І).
Текст
Реферат: Даний винахід стосується похідних 1,4-бензотіазепіну та їх застосування у лікуванні станів, порушень і захворювань, пов'язаних з рецепторами ріанодину (RyR), які регулюють функціонування кальцієвих каналів у клітинах. Винахід також описує фармацевтичні композиції, які містять такі сполуки, і їх застосування у лікуванні захворювань і станів, пов'язаних з RyR, зокрема порушень серцевої, скелетно-м'язової і центральної нервової системи (ЦНС). UA 113759 C2 (12) UA 113759 C2 UA 113759 C2 5 10 15 20 25 30 35 40 45 50 55 60 ГАЛУЗЬ ВИНАХОДУ Даний винахід відноситься до похідних 1,4-бензотіазепіну та їх використання для лікування порушень і захворювань, пов'язаних з рецепторами ріанодину (RyR), які регулюють функціонування кальцієвих каналів у клітинах. Винахід також описує фармацевтичні композиції, які містять такі сполуки і їх використання для лікування захворювань і станів, пов'язаних з RyR, зокрема, порушень серцевої, скелетно-м'язової і центральної нервової системи (ЦНС). ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ Саркоплазматичний ретикулум (СР) являє собою структуру в клітинах, яка функціонує, 2+ серед іншого, як спеціалізований внутрішньоклітинний кальцієвий (Са ) пул. Рецептори ріанодину (RyR) являють собою канали у саркоплазматичному ретикулумі, які відкриваються і 2+ закриваються, щоб регулювати вивільнення Ca з СР у внутрішньоклітинну цитоплазму клітини. 2+ 2+ Вивільнення Ca у цитоплазму з СР підвищує цитоплазматичну концентрацію Ca . Виявлена можливість RyR відноситься до ймовірності того, що RyR відкривається у будь-який певний 2+ момент, а, отже, є здатним вивільняти Ca у цитоплазму з СР. Існує три типи RyR, всі з яких є високо гомологічними: RyR1, RyR2 і RyR3. RyR1 знаходиться переважно у скелетних м'язах, а також інших тканинах, RyR2 знаходиться переважно у серці, а також інших тканинах, і RyR3 знаходиться у головному мозку, а також інших тканинах. RyR являє собою тетрамер. Частина комплексу RyR утворена чотирма поліпептидами RyR у поєднанні з чотирма FK506-зв'язуючими білками (FKBP) (калстабінами), зокрема FKBP12 (калстабін1) і FKBP12.6 (калстабін2). Калстабін1 зв'язується з RyR1 і RyR3, тоді як калстабін2 зв'язується з RyR2. Калстабіни зв'язуються з RyR (одна молекула на субодиницю RyR), стабілізують функцію RyR, сприяють сполученому гейтуванню між сусідніми RyR і запобігають 2+ аномальній активації (витоку Ca ) каналу шляхом стабілізації закритого стану каналу. Рецептор ріанодину 2 і серцево-судинні захворювання 2+ У серцевому поперечносмугастому м'язі, RyR2 є основним каналом вивільнення Ca , необхідним для електромеханічного (ЕМ) сполучення і скорочення м'язів. В процесі ЕМ сполучення, деполяризація клітинної мембрани серцевого м'яза під час нульової фази 2+ 2+ потенціалу дії активує потенціалзалежні канали Ca . Приплив Ca через відкриті 2+ потенціалзалежні канали в свою чергу ініціює вивільнення Ca з СР через RyR2. Цей процес є 2+ 2+ 2+ відомим як Са -індуковане вивільнення Ca . RyR2-опосередковане Ca -індуковане 2+ вивільнення Са потім активує скорочувальні білки у серцевій клітині, що призводить до скорочення серцевого м'яза. Фосфорилювання RyR2 протеїнкіназою А (ПКА) є важливою частиною реакції "боротьби або втечі" (адаптаційної антистресової реакції), яка підвищує приріст серцевого ЄС сполучення 2+ шляхом збільшення кількості вивільненого Са для даного тригера. Цей сигнальний шлях забезпечує механізм, за допомогою якого активація симпатичної нервової системи (СНС), у відповідь на стрес, призводить до підвищення об'ємної швидкості кровотоку серця. Фосфорилювання RyR2 протеїнкіназою А призводить до часткової дисоціації калстабіну2 з каналу, що, в свою чергу, призводить до підвищеної ймовірності відкриття, і підвищеного 2+ вивільнення Ca з СР у внутрішньоклітинну цитоплазму. Серцева недостатність (СН) характеризується стійким гіперадренергічним станом, при якому рівні катехоламінів у сироватці є хронічно підвищеними. Одним з наслідків такого хронічного гіперадренергічного стану є постійне ПКА-гіперфосфорилювання RyR2, таким чином, що 3-4 з чотирьох Ser2808 у кожному гомотетрамерному каналі RyR2 є хронічно фосфорильованими (Marx SO, et al. Cell, 2000;101(4):365-376). Зокрема, хронічне ПКАгіперфосфорилювання RyR2 пов'язане з елімінацією субодиниці калстабіну2, що стабілізує канал, з макромолекулярного комплексу каналу RyR2. Елімінація калстабіну призводить до 2+ діастолічного "витоку" Са з СР через комплекс RyR, що сприяє порушенню скорочувальної здатності (Marx et al., 2000). Внаслідок активації внутрішніх деполяризуючих струмів, цей 2+ діастолічний "витік" Ca з СР також пов'язаний зі смертельною серцевою аритмією (Lehnart et al, J Clin Invest. 2008;118(6):2230-2245). Дійсно, миші, створені методами генної інженерії, з RyR2, позбавленим сайту ПКА-фосфорилювання, є захищеними від прогресування СН після інфаркту міокарда (ІМ) (Wehrens XH et al. Proc Natl Acad Sci USA. 2006;103(3):511-518). Крім того, хронічне ПКА-гіперфосфорилювання RyR2 при СН пов'язане з ремоделюванням макромолекулярного комплексу RyR2, який включає в себе елімінацію фосфатаз (Marx et al. 2000) PP1 і PP2A (послаблюючи дефосфорилювання Ser2808) і цAMФ-специфічної фосфодіестерази типу 4 (PDE4D3) з комплексу RyR2. Елімінація PDE4D3 з комплексу RyR2 спричиняє стале підвищення місцевих рівнів цАМФ (Lehnart SE, et al., Cell 2005;123(1):25-35). 2+ Таким чином, діастолічний витік Ca з СР сприяє прогресуванню СН і аритмії. Крім того, нещодавній звіт засвідчив, що активація RyR2-S2808D+/+ (аспарагінова кислота, що заміняє 1 UA 113759 C2 5 10 15 20 25 30 35 40 45 50 55 60 серин 2808) у мишей, що імітує конститутивне ПКА-гіперфосфорилювання RyR2, демонструє елімінацію калстабіну2 і негерметичність (витік) каналу RyR2. У мишей RyR2-S2808D+/+ розвивається вікова кардіоміопатія, вони демонструють підвищене окислення і нітрозилювання 2+ 2+ RyR2, зниження вмісту накопиченого Ca в СР, та підвищення діастолічного витоку Са з СР. Після інфаркту міокарда, миші RyR2-S2808D+/+ мають підвищену смертність в порівнянні з однопослідними тваринами дикого типу (WT). Введення S107, 1,4-бензотіазепіну, що стабілізує взаємодії RyR2-калстабіну2 (WO 2007/024717), інгібує RyR2-опосередкований діастолічний витік 2+ Са з СР і знижує прогресування СН як у мишей дикого типу, так і у мишей RyR2-S2808D+/+ (Shan et al., J Clin Invest. 2010 Dec 1;120(12):4375-87). Крім того, RyR2 містить близько 33 вільних тіолових залишків, які роблять його дуже чутливим до стану клітинного окислення-відновлення. Окислення цистеїну сприяє відкриттю 2+ RyR і витоку Ca з СР. Shan et al., 2010, продемонстрували, що окислення і нітрозилювання 2+ RyR2 та дисоціація стабілізуючої субодиниці калстабіну2 з RyR2 викликає витік Са з СР. Катехоламінергічна поліморфна шлуночкова тахікардія (КПШТ) є спадковим порушенням у осіб зі структурно нормальним серцем. Понад 50 різних мутацій RyR2 були пов'язані з КПШТ. Пацієнти з КПШТ страждають від непритомності і раптової серцевої смерті (РСС) від малечого до дорослого віку, і до 35 років смертність становить до 50 %. Пацієнти з КПШТ мають шлуночкові аритмії у разі фізичного навантаження, але не зазнають аритмії у стані спокою. Мутації RyR2, пов'язані з КПШТ, призводять до втрати "герметичності" каналів RyR2 внаслідок зниження зв'язування субодиниці калстабіну2 (Lehnart et al., 2008). Миші, гетерозиготні по мутації R2474S у RyR2 (миші RyR2-R2474S), демонстрували спонтанні генералізовані тонікоклонічні напади (які сталися за відсутності серцевої аритмії), шлуночкові аритмії, викликані фізичним навантаженням, і РСС. Введення S107 підвищує зв'язування калстабіну2 з каналом RyR2-R2474S мутанта, інгібує витік каналу, запобігає серцевим аритміям і підвищує судомний поріг (Lehnart et al., 2008). Рецептор ріанодину 1 і скелетно-м'язові захворювання 2+ Скорочення скелетних м'язів активується шляхом вивільнення Ca з СР через канал RyR1. Деполяризація мембрани поперечної (T)-трубочки міоциту активує датчик напруги дигідропіридинового рецептора (Cav1.1), що в свою чергу активує канали RyR1 через пряму 2+ 2+ білок-білкову взаємодію, викликаючи вивільнення запасів Са з СР. Са зв'язується з тропоніном С, забезпечуючи виникнення актин-міозин поперечних зв'язків і скорочення саркомеру. В умовах тривалого м'язового стресу (наприклад, під час марафонського бігу) або при таких хворобах, як серцева недостатність, обидва з яких характеризується хронічною активацією симпатичної нервової системи (СНС), функція скелетних м'язів порушується, можливо 2+ внаслідок зміненого електромеханічного (ЕМ) сполучення. Зокрема, кількість Ca , вивільненого з СР під час кожного скорочення м'язу, зменшується, можуть мати місце явища аберантного 2+ 2+ вивільнення Ca і зворотне захоплення Ca сповільнюється (Reiken, S, et al. 2003. J. Cell Biol. 160:919-928). Ці спостереження наводять на думку про те, що шкідливі ефекти хронічної активації симпатичної нервової системи у скелетних м'язах можуть бути викликані, принаймні 2+ частково, дефектами у сигналізації Са . Макромолекулярний комплекс RyR1 складається з тетрамеру субодиниці 560-кДа RyR1, що утворює каркас для білків, які регулюють функцію каналу, включаючи ПКА і фосфодіестеразу 4D3 (PDE4D3), протєїнфосфатазу 1 (PP1) і калстабін1. А-кіназа якірний білок (mAKAP) націлює ПКА і PDE4D3 на RyR1, в той час як спінофілін націлює РР1 на канал (Marx et al. 2000; Brillantes et al., Cell, 1994, 77, 513-523; Bellinger et al. J. Clin. Invest. 2008, 118, 445-53). Каталітичні і регуляторні субодиниці ПКА, РР1 і PDE4D3 регулюють ПКА-опосередковане фосфорилювання RyR1 у Ser284 3 (Ser2844 у мишей). Було продемонстровано, що ПКА-опосередковане 2+ фосфорилювання RyR1 у Ser2844 підвищує чутливість каналу до цитоплазматичного Ca , знижує спорідненість (афінність) зв'язування калстабіну1 з RyR1, і дестабілізує закритий стан каналу (Reiken et al., 2003; Marx, S.O. et al., Science, 1998, 281:818-821). Концентрації калстабіну1 у скелетних м'язах, як повідомляється, становлять приблизно 200 нМ, і ПКАфосфорилювання RyR1 знижує спорідненість зв'язування калстабіну1 з RyR1 з приблизно 100200 нМ до понад 600 нМ. Таким чином, у фізіологічних умовах, зниження спорідненості зв'язування калстабіну1 з RyR1, в результаті ПКА-фосфорилювання RyR1 у Ser2843, є достатнім, щоб істотно зменшити кількість калстабіну1, присутнього у комплексі RyR1. Хронічне ПКА-гіперфосфорилювання RyR1 у Ser2843 (визначається як ПКА-фосфорилювання 3 або 4 з 4 ПКА Ser2843 сайтів, присутніх у кожному гомотетрамері RyR1) призводить до виникнення "негерметичних" каналів (тобто, каналів, схильних до відкриття у стані спокою), які сприяють дисфункції скелетних м'язів, пов'язаній з постійними гіперадренергічними станами, які 2 UA 113759 C2 5 10 15 20 25 30 35 40 45 50 55 60 виникають у пацієнтів з серцевою недостатністю (Reiken et al., 2003). Крім того, регулювання RyR1 шляхом посттрансляційних модифікацій, інших ніж фосфорилювання, наприклад, шляхом нітрозилювання вільних сульфгідрильних груп у цистеїнових залишках (S-нітрозилювання), а також шляхом окислення каналу, як повідомляється, підвищують активність каналу RyR1. S-нітрозилювання і окислення RyR1, кожне з яких, як було продемонстровано, знижують зв'язування калстабіну1 з RyR1. Як повідомлялося раніше у Bellinger et al. (Proc. Natl. Acad. Sci. 2008, 105(6):2198-2002), під час екстремального фізичного навантаження у мишей і людей, RyR1 поступово ПКАгіперфосфорилюється, S-нітрозилюється і зазнає елімінації PDE4D3 і калстабіну1, в результаті чого виникають "негерметичні "канали, які спричиняють зниження здатності до фізичного навантаження у мишей. Введення S107 запобігає елімінації калстабіну1 з комплексу RyR1, 2+ покращує формування сили і здатності до фізичного навантаження та знижує Са залежну активність нейтральної протеази - кальпаїну і рівні концентрації креатинін-кінази у плазмі крові. М'язова дистрофія Дюшена (МДД) є одним з найпоширеніших смертельних генетичних захворювань дитячого віку. МДД є зчепленою з Х-хромосомою і на неї страждає 1 з 3500 новонароджених хлопчиків, і зазвичай вона призводить до смерті у віці ~30 років від дихальної або серцевої недостатності. Мутації дистрофіну, пов'язані з МДД, призводять до повної втрати білка дистрофіну, тим самим порушуючи зв'язок між цитоскелетом субсарколеми і позаклітинним матриксом. Цей зв'язок має важливе значення для захисту і стабілізації м'язів проти травм, викликаних скороченням. У даний час МДД є невиліковною і більшість видів клінічної терапії є паліативними. Новими видами втручання у клінічних дослідженнях Фази I/II є пропуск екзонів, інгібування міостатину і підвищувальна регуляція атрофіну. Тим не менш, існують проблеми з системною доставкою, підтримкою пропуску екзонів і підвищувальною регуляцією атрофіну. Крім того, у клінічних дослідженнях Фази I/II інактивація міостатину для підвищення розміру м'язів не призвела до покращення міцності або функції м'язів. Сарколемна нестабільність внаслідок мутацій дистрофіну має каскадний ефект. Одним з основних ефектів є 2+ 2+ підвищена цитозольна концентрація Ca , яка призводить до активації Са -залежних протеаз (кальпаїнів). Іншим ефектом є запалення і підвищена активність індуцибельної синтази оксиду азоту (iNOS), що може призвести до окислення/нітрозилювання білків, ліпідів і ДНК. М'язова патологія МДД є прогресивною і набагато перевищує нестабільність сарколеми. Таким чином, патологія узгоджується з нестабільністю сарколеми, підвищуючи сприйнятливість до подальшої травми. Нещодавно було продемонстровано, що надмірне окислення або нітрозилювання RyR1 може порушити взаємодію калстабіну1 з комплексом RyR1, що призводить до нещільності RyR1 і м'язової слабкості у мишачої моделі м'язової дистрофії (mdx) і, що лікування за допомогою S107 покращує показники функції м'язів у цій мишачій моделі (Bellinger, A. et al. 2009, Nature Medicine, 15:325-330). Вікова втрата м'язової маси і сили (саркопенія) сприяє інвалідності і підвищенню смертності. Andersson, D. et al. (Cell Metab. 2011 Aug 3;14(2):196-207) повідомляють, що RyR1 від мишей, що зістарілися (24 місяці) є окисленим, цистеїн-нітрозильованим і збіднілим на калстабін1, порівняно з RyR1 від дорослих мишей молодшого віку (3-6 місяців). Така реконструкція комплексу каналу RyR1 призвела до утворення ''негерметичних'' каналів з підвищеною ймовірністю відкриття, що призводить до внутрішньоклітинного витоку кальцію у скелетних м'язах. Введення мишам, що зістарілися, S107 стабілізувало зв'язування калстабіну1 з RyR1, знизило внутрішньоклітинний витік кальцію, знизило реактивні форми кисню (ROS) і посилило 2+ тетанічне вивільнення Ca , специфічну для м'язів силу і здатність до фізичного навантаження. Міжнародні патентні публікації РСТ WO 2005/094457, WO 2006/101496 і WO 2007/024717 описують похідні 1,4-бензотіазепіну і їх використання при лікуванні серцевих, скелетно-м'язових і когнітивних порушень, серед інших. Міжнародна патентна публікація РСТ WO 2008/060332 відноситься до використання 1,4бензотіазепіну для лікування м'язової втоми у пацієнтів, які страждають від патології, такої як м'язова дистрофія, або у пацієнтів, які страждають від м'язової втоми в результаті стійкого, тривалого та/або інтенсивного навантаження або хронічного стресу. Міжнародна патентна публікація РСТ WO 2008/021432 відноситься до використання 1,4бензотіазепіну для лікування та/або профілактики захворювань, порушень і станів, які впливають на нервову систему. Міжнародна патентна публікація РСТ WO 2012/019076 відноситься до використання похідних 1,4-бензотіазепіну для лікування та/або профілактики серцевої ішемії/реперфузійного пошкодження. Fauconnier et al., Proc Natl Acad Sci USA, 2011, 108(32): 13258-63 повідомляють про те, що витік RyR, опосередкований активацією каспази-8, призводить до травми лівого шлуночка після ішемії-реперфузійного пошкодження міокарда, і що лікування за допомогою 3 UA 113759 C2 2+ 5 10 15 20 25 30 35 40 45 S107 інгібувало витік Ca з СР, знизило шлуночкові аритмії, розмір інфаркту і ремоделювання лівого шлуночка через 15 діб після реперфузії. Міжнародна патентна публікація РСТ WO 2012/019071 відноситься до використання похідних 1,4-бензотіазепіну для лікування та/або профілактики саркопенії. Міжнародна патентна публікація РСТ WO 2012/037105 відноситься до використання похідних 1,4-бензотіазепіну для лікування та/або профілактики нейронних порушень і захворювань, спричинених стресом. Існує потреба виявлення нових сполук, ефективних для лікування порушень і захворювань, пов'язаних з RyR, в тому числі скелетно-м'язових і серцевих порушень і захворювань. Більш конкретно, залишається потреба у виявленні нових засобів, які можуть бути використані для лікування порушень, пов'язаних з RyR, наприклад, усунення витоку в каналах RyR, і підвищення зв'язування калстабінів з ПКА-фосфорильованими / оксигенованими / нітрозильованими RyR та з мутантними RyR, які в іншому випадку мають понижену спорідненість (афінність) з калстабінами або не зв'язується з ними. СУТНІСТЬ ВИНАХОДУ Даний винахід відноситься до нових похідних 1,4-бензотіазепіну і їх фармацевтично прийнятних солей. У деяких варіантах здійснення винаходу сполуки за даним винаходом є ТМ стабілізаторами кальцієвих каналів рецептора ріанодину (RyR), які іноді називають "Rycals ". Даний винахід також відноситься до способів використання цих сполук для лікування порушень і захворювань, пов'язаних з RyR. Сполуки за даним винаходом обирають з похідних 1,4-бензотіазепіну, описаних у патенті WO 2007/024717. Патент WO 2007/024717 описує структурно подібні сполуки, проте, як додатково описано в даному документі, було виявлено, що ці сполуки є дуже нестійкими а, отже, їх терапевтичне застосування як лікарських засобів є обмеженим. Проблема, що лежить в основі цього застосування, таким чином, полягає у забезпеченні альтернативних похідних 1,4бензотіазепіну, які є не тільки фармакологічно активними, але також мають сприятливі властивості, такі як висока метаболічна стабільність, а, отже, є придатними як лікарські засоби при лікуванні захворювань і станів, пов'язаних з RyR, наприклад, порушень серцевої, скелетном'язової і центральної нервової системи (ЦНС). Несподівано було виявлено, що сполуки формули (I) є стабільними, а також фармакологічно активними, таким чином, забезпечуючи технічне рішення проблеми, що лежить в основі даного винаходу. Сполуки за даним винаходом представлені структурою Формули (I): (І) де R являє собою COOH; і її фармацевтично прийнятні солі. Сполуки Формули (I) можуть бути присутніми у формі солі з фармацевтично прийнятною кислотою або основою. Такі солі переважно обирають із групи, що складається з солей натрію, калію, магнію, геміфумарату, гідрохлориду та гідроброміду, причому кожна така можливість представляє собою окремий варіант здійснення даного винаходу. На даний момент переважною сіллю є натрієва сіль. Іншою переважною сіллю на даний момент є сіль геміфумарату. У деяких конкретних варіантах здійснення сполуку обирають з групи, що складається зі сполуки 1, сполуки 4 і сполуки 6 та їх фармацевтично прийнятних солей. Структури цих сполук описані нижче. У переважному варіанті здійснення винаходу сполука представлена структурою сполуки (1): 4 UA 113759 C2 5 10 15 20 25 30 35 40 45 (1) або її фармацевтично прийнятної солі. У деяких варіантах здійснення сполука 1 представлена як вихідна сполука. У інших варіантах здійснення, проте, сполука 1 представлена у формі солі з фармацевтично прийнятною кислотою або основою. Переважно, таку сіль обирають із групи, що складається з солей натрію, калію, магнію, геміфумарату, гідрохлориду та гідроброміду, причому кожна така можливість представляє собою окремий варіант здійснення даного винаходу. На даний момент переважною сіллю є натрієва сіль. Іншою переважною сіллю на даний момент є сіль геміфумарату. Даний винахід також відноситься до способів синтезу сполук за винаходом і їх солей. Даний винахід також забезпечує фармацевтичні композиції, які містять одну або більше зі сполук за даним винаходом, і, принаймні, одну добавку або ексципієнт, наприклад, наповнювачі, розріджувачі, зв'язуючі речовини, розпушувачі, буфери, барвники, емульгатори, агенти, що покращують смак, гелеутворювачі, ковзаючі речовини, консерванти, солюбілізатори, стабілізатори, суспендуючі агенти, підсолоджувачі, тонізуючі агенти, змочуючі агенти, емульгуючі агенти, диспергуючі агенти, агенти, що викликають набухання, сповільнювачі, змащувальні речовини, абсорбенти, і агенти, що підвищують в'язкість. Композиції можуть бути представлені у формі капсул, гранул, порошків, розчинів, саше, суспензій або таблетованій лікарській формі. Даний винахід також забезпечує способи лікування або профілактики різних порушень, захворювань і станів, пов'язаних з RyR, таких як серцеві, скелетно-м'язові, когнітивні, ЦНС і нервово-м'язові порушення і захворювання, та включає в себе введення пацієнту, який потребує такого лікування, кількості сполуки Формули (I) або її солі, що є ефективною для профілактики або лікування порушення або захворювання, пов'язаного з RyR. Даний винахід також забезпечує спосіб профілактики або лікування витоку в каналі RyR (в тому числі RyR1, RyR2 і RyR3) у пацієнта, включаючи введення пацієнту кількості сполуки Формули (I) або її солі, що є ефективною для профілактики або лікування витоку в RyR. Крім того, даний винахід відноситься до способу модуляції зв'язування RyR і калстабінів у пацієнта, який включає в себе введення пацієнту кількості сполуки Формули (I) або її солі, що є ефективною для модуляції кількості RyR-зв'язаного калстабіну. Даний винахід також відноситься до використання сполуки Формули (I) для виготовлення лікарського засобу для лікування та/або профілактики порушень, захворювань і станів, пов'язаних з RyR, таких як серцеві, скелетно-м'язові і когнітивні/ЦНС порушення і захворювання. В іншому варіанті здійснення даний винахід відноситься до використання сполуки Формули (I) для виготовлення лікарського засобу для профілактики або лікування витік у каналі RyR. В іншому варіанті здійснення даний винахід відноситься до використання сполуки Формули (I) для виготовлення лікарського засобу для модуляції кількості RyR-зв'язаних калстабінів. Способи винаходу можуть бути реалізовані у системі in vitro (наприклад, культивовані клітини або тканини) або in vivo (наприклад, у тварин, що не належать до людського роду або у людини). У деяких варіантах здійснення винаходу сполуки за даним винаходом представлені в поєднанні з терапією пропуску екзонів, наприклад, антисмислових олігонуклеотидів (АО), з тим щоб посилити пропуск екзонів у мРНК-мішені, наприклад, гена МДД, як описано далі. Інші ознаки і переваги даного винаходу стануть очевидними з нижченаведеного докладного опису та фігур. 5 UA 113759 C2 КОРОТКИЙ ОПИС ФІГУР Фігура 1А Імуноблот з антитілом калстабіну2, який показує зв'язування калстабіну2 з ПКАфосфорильованим RyR2 за відсутності (-) або у присутності 100 нМ сполуки 1. (+): зв'язування калстабіну з ПКА-нефосфорильованим RyR2. S36 (US 7.544.678) використовується як позитивний контроль. Фігура 1B Імуноблот з антитілом калстабіну2, який показує зв'язування калстабіну2 з ПКАфосфорильованим RyR2 за відсутності (-) або у присутності 100 нМ сполуки 2, сполуки 3 або сполуки 4. (+): зв'язування калстабіну з ПКА-нефосфорильованим RyR2. S36 використовується як позитивний контроль. Фігура 1C Імуноблот з антитілом калстабіну1, який показує зв'язування калстабіну1 з ПКАфосфорильованим RyR1 за відсутності (Neg) або у присутності зазначених концентрацій сполуки 1 або сполуки 4. (Pos): зв'язуваннякалстабіну з ПКАнефосфорильованим RyR1. S36 використовується як позитивний контроль. Фігура 2 Фігура 2А: Імуноблот з антитілом калстабіну1, який показує рівні калстабіну1 в імунопреципітованих комплексах RyR1 з лізатів великогомілкового м'яза мишей, яким вводили носій (50:50 ДМСО/ПЕГ), тільки ізопротеренол (ISO) або ізопротеренол разом із зазначеними концентраціями сполуки 1 в осмотичних насосах. S36 використовується як контроль при 3,6 мМ. Фігура 2B: кількісне визначення % калстабіну1, який повторно зв'язується з RyR1. Фігура 3 Щурячу модель хронічної серцевої недостатності індукували ішемічнореперфузійним (І/Р) пошкодженням. Для протоколу I/Р, передню низхідну ліву (ПНЛ) коронарну артерію перетискали протягом 1 години. Фігура 4 Об'єми лівого шлуночка (ЛШ) і фракція викиду (ФВ) у щурів, які отримували сполуку 1 по 5 мг/кг/добу (5MK) або 10 мг/кг/добу (10MK) у питній воді, в порівнянні з тваринами, які отримували носій (Н2О), і тваринами, які отримували плацебо. Хронічна серцева недостатність була індукована ішемічнореперфузійним (I/Р) пошкодженням. ПНЛ артерію перетискали протягом 1 години; лікування почалося через 1 тиждень після реперфузії і тривало протягом 3 місяців. Ехокардіографічні параметри були отримані після 1, 2 або 3 місяців лікування. Фігура 4А: Кінцево-діастолічний об'єм ЛШ; Фігура 4B: Кінцевосистолічний об'єм ЛШ; Фігура 4С: ФВ. Фігури 4А і 4В: §Р
ДивитисяДодаткова інформація
Назва патенту англійськоюAgents for treating disorders involving modulation of ryanodine receptors
Автори англійськоюYan, Jiaming, Belvedere, Sandro, Webb, Yael, Bertrand, Marc, Villeneuve, Nicole, Marks, Andrew R., Peglion, Jean-Louis
Автори російськоюЯнь Цзямин, Бэльведэр Сандро, Вэбб Яель, Бертран Марк, Вильнёв Николь, Маркс Эндрю Р., Пеглён Жан-Луи
МПК / Мітки
МПК: C07D 281/10, A61K 31/554
Мітки: порушень, засоби, рецепторів, ріанодину, залученням, модуляції, лікування
Код посилання
<a href="https://ua.patents.su/35-113759-zasobi-dlya-likuvannya-porushen-iz-zaluchennyam-modulyaci-receptoriv-rianodinu.html" target="_blank" rel="follow" title="База патентів України">Засоби для лікування порушень із залученням модуляції рецепторів ріанодину</a>
Попередній патент: Бульбашково-плівковий екстрактор
Наступний патент: Кожух для нанесення металооксидного покриття на скляні ємності осадженням пари
Випадковий патент: Спосіб лікування хворих на стабільну стенокардію напруги