Сполуки карбонілбензоксазину для підсилення глутаматергічних синаптичних відповідей
Номер патенту: 79940
Опубліковано: 10.08.2007
Автори: Харріс Клейтон, Мюллер Рудольф, Аллан Метью, Хуанг Їанїе, Маррс Крістофер М., Рахваль Станіслав, Роджерс Гері А.
Формула / Реферат
1. Сполука, що має структуру Іа або Іb:
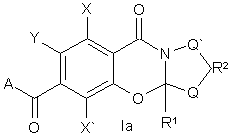 ,
,
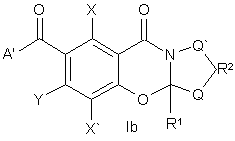 ,
,
де:
Q і Q' незалежно означають водень, -СН2-, -О-, -S-, алкіл або заміщений алкіл,
R1 означає водень, алкіл або разом з Q може бути циклоалкілом,
R2 може бути відсутній або, якщо є присутнім, може бути –СН2-, -CO-, -СН2СH2-, -CH2CO-, -CH2O-, -CRR'- і -CONR-,
Y означає водень або -OR3, або служить для зв'язування ароматичного кільця з А або А’ простим зв'язком, =N- або -NR-,
R3 означає водень, алкіл, заміщений алкіл або служить для зв'язування приєднаного кисню з А або А’, що є нижчим алкіленом, таким як метилен або етилен, або заміщеним нижчим алкіленом, таким як -CRR'-, що зв'язує ароматичне кільце з А з утворенням заміщеного або незаміщеного 6-, 7- або 8-членного кільця, або зв'язок, що зв'язує кисень з А з утворенням 5- або 6-членного кільця,
А означає -NRR', -OR, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, арил, заміщений арил, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка,
А’ означає -NRR’,
R означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або гетероциклоалкіл,
R' відсутній або означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або може бути з'єднаний з R з утворенням 4-8-членного кільця, що може бути заміщене Χ і може бути зв'язане з Y з утворенням 6-членного кільця, і яке може, необов'язково, містити один або два гетероатоми, такі як кисень, азот або сірка,
Χ і X' означають, незалежно, R, гало, -CO2R, -CN, -NRR', -NRCOR', -NO2, -N3 або -OR.
2. Сполука згідно з пунктом 1 з структурою Іа, як згадано вище, де
Q і Q' незалежно означають водень, -СН2-, -О-, -S-, алкіл або заміщений алкіл,
R1 означає водень, алкіл або разом з Q може бути циклоалкілом,
R2 може бути відсутній або, якщо є присутнім, може бути -СH2-, -CO-, -СН2СН2-, -СН2СО-, -СН2О- або -CONR-,
Y означає водень або -OR3, або служить для зв'язування ароматичного кільця з А простим зв'язком, =N- або -NR-,
R3 означає водень, алкіл, заміщений алкіл або служить для зв'язування приєднаного кисню з А, що є нижчим алкіленом, таким як метилен або етилен, або заміщеним нижчим алкіленом, таким як -CRR'-, що зв'язує ароматичне кільце з А з утворенням заміщеного або незаміщеного 6-, 7- або 8-членного кільця, або зв'язок, що зв'язує кисень з А з утворенням 5- або 6-членного кільця,
А означає -NRR', -OR, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, арил, заміщений арил, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка,
R означає водень, арил, арилалкіл, заміщений арил, заміщений арилкалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або гетероциклоалкіл,
R' відсутній або означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або може бути з'єднаний з R з утворенням 4-8-членного кільця, що може бути заміщене Χ і може бути зв'язане з Y, і яке може, необов'язково, містити один або два гетероатоми, такі як кисень, азот або сірка,
Χ і X' означають, незалежно, R, гало, -CO2R, -CN, -NRR', -NRCOR', -NO2, -N3 або -OR.
3. Сполука згідно з пунктом 1 з структурою Іb, як згадано вище, де:
Q і Q' незалежно означають водень, -СН3-, -О-, -S-, алкіл або заміщений алкіл,
R1 означає водень, алкіл або разом з Q може бути циклоалкілом,
R2 може бути відсутній або, якщо є присутнім, може бути –СН2-, -CO-, -СН2СН2-, -СН2СО-, -СН2О- і -CONR-,
Y означає водень або -OR3, або служить для зв'язування ароматичного кільця з А’ простим зв'язком, =N- або -NR-,
R3 означає водень, алкіл, заміщений алкіл або служить для зв'язування приєднаного кисню з А’, що є нижчим алкіленом, таким як метилен або етилен, або заміщеним нижчим алкіленом, таким як -CRR'-, що зв'язує ароматичне кільце з А’ з утворенням заміщеного або незаміщеного 6-, 7- або 8-членного кільця, або зв'язок, що зв'язує кисень з А’ з утворенням 5- або 6-членного кільця,
А’ означає -NRR', -OR, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, арил, заміщений арил, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка,
R означає водень, арил, арилалкіл, заміщений арил, заміщений арилкалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або гетероциклоалкіл,
R' відсутній або означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або може бути з'єднаний з R з утворенням 4-8-членного кільця, що може бути заміщене Χ і може бути зв'язане з Y з утворенням 6-членного кільця, і яке може, необов'язково, містити один або два гетероатоми, такі як кисень, азот або сірка,
Χ і X' означають, незалежно, R, гало, -CO2R, -CN, -NRR', -NRCOR', -NO2, -N3 або -OR.
4. Сполука згідно з будь-яким з пунктів 1-3, в якій Q і Q' означають -СН2-, а R2 означає –СН2-.
5. Сполука згідно з будь-яким з пунктів 1-4, в якій R1 означає водень.
6. Сполука згідно з будь-яким з пунктів 1-3 або 5, в якій Q і Q' означають -СН2-, a R2 означає –СН2СН2-.
7. Сполука згідно з будь-яким з пунктів 1-3 або 5, в якій Q` означає –СН2-, R2 означає –СН2- і Q означає -О- або -S-.
8. Сполука згідно з будь-яким з пунктів 1-3, 5 або 7, в якій Q означає -O-.
9. Сполука згідно з будь-яким з пунктів 1-3, в якій Q і Q` означають алкіл, а R2 відсутній.
10. Сполука згідно з будь-яким з пунктів 1-3, в якій Q і Q' означають алкіл, R2 відсутній, а R1 означає водень.
11. Сполука згідно з будь-яким з пунктів 1-3 або 10, в якій Y означає -OR3 і А означає -NRR', -OR, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, арил, заміщений арил, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка.
12. Сполука згідно з будь-яким з пунктів 1-3 або 11, в якій А означає алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, арил, заміщений арил, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка.
13. Сполука згідно з будь-яким з пунктів 1-3 або 12, в якій А означає алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, гетероцикл або заміщений гетероцикл, що містить один гетероатом, такий як кисень, азот або сірка.
14. Сполука згідно з будь-яким з пунктів 1-13, в якій А або А’ означає -NRR', R означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або гетероциклоалкіл, R1 означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або може бути приєднаний до R з утворенням 4-8-членного кільця, що може бути заміщене Χ і зв'язане з Y за допомогою R3, і яке може, необов'язково, містити один додатковий гетероатом, такий як кисень, азот або сірка, а Х і X' означають, незалежно, R, гало, -CO2R, -CN, -NRR', -NRCOR', -NO2, -N3 або -OR.
15. Сполука згідно з будь-яким з пунктів 1-13, в якій А або А’ означає -NRR', R означає алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або гетероциклоалкіл, R' означає водень, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або може бути приєднаний до R з утворенням 4-8-членного кільця, що може бути заміщене Χ і зв'язане з Y за допомогою R3, і яке може, необов'язково, містити один додатковий гетероатом, такий як кисень, азот або сірка, а Х і X' незалежно означають R, гало, -CO2R, -CN, -NRR', -NRCOR', -NO2, -N3 або -OR.
16. Сполука згідно з пунктом 15, в якій А або А’ означає -NRR' і R' приєднаний до R з утворенням 4-8-членного кільця, що може бути заміщене Х і зв'язане з Y за допомогою R3, і яке може, необов'язково, містити один додатковий гетероатом, такий як кисень, азот або сірка, а Х і X' означають, незалежно, R, гало, -СO2R, -CN, -NRR', -NRCOR', -NO2, -N3 або -OR.
17. Сполука згідно з пунктом 16, в якій А або А’ означає -NRR', і R' приєднаний до R з утворенням 5-членного кільця, що може бути заміщене Х і зв'язане з Y за допомогою R3, і яке може, необов'язково, містити один додатковий гетероатом, такий як кисень, азот або сірка, а Х і X' означають, незалежно, R, гало, -СО2 R, -CN, -NRR', -NRCOR', -NO2, -N3 або -OR.
18. Сполука згідно з пунктом 17, в якій А або А’ означає –NRR`, і R' приєднаний до R з утворенням 5-членного кільця, що може бути заміщене Х і зв'язане з Y за допомогою R3, і яке містить один додатковий гетероатом, такий як кисень, азот або сірка, а Х і X' означають, незалежно, R, гало, -СО2 R, -CN, -NRR', -NRCOR', -NO2, -N3 або -OR.
19. Сполука згідно з пунктом 16, в якій А або А’ означає -NRR', а R' приєднаний до R з утворенням 5-членного кільця, що зв'язується з Y за допомогою R3.
20. Сполука згідно з пунктом 16, в якій А або А’ означає -NRR', а R' приєднаний до R з утворенням 6-членного кільця, що може бути заміщене Х і зв'язане з Y за допомогою R3, і яке може, необов'язково, містити один додатковий гетероатом, такий як кисень, азот або сірка, а X і X' означають, незалежно, R, гало, -СО2 R, -CN, -NRR', -NRCOR', -NO2, -N3 або -OR.
21. Сполука згідно з будь-яким з пунктів 1-10, в якій Y означає -OR3.
22. Сполука згідно з пунктом 21, в якій R3 означає водень.
23. Сполука згідно з будь-яким з пунктів 1-3, в якій Y означає водень.
24. Сполука згідно з будь-яким з пунктів 1-3, в якій Y означає =Ν- або -NR-.
25. Сполука згідно з будь-яким з пунктів 1 -3, в якій Y означає =Ν-.
26. Сполука згідно з пунктом 23, в якій А означає -OR, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка.
27. Сполука згідно з пунктом 23, в якій А або А’ означає -NRR'.
28. Сполука згідно з пунктом 21, в якій А означає -OR, алкіл, заміщений алкіл, циколалкіл, заміщений циклоалкіл, циклоалкілалкіл, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка.
29. Сполука згідно з пунктом 21, в якій А або А’ означає -NRR'.
30. Сполука згідно з пунктом 4, в якій Y означає -OR3 або А означає -NRR'.
31. Сполука згідно з пунктом 30, в якій R1 означає водень.
32. Спосіб лікування ссавця, що страждає на гіпоглутаматергічний стан або дефіцит кількості або інтенсивності ексцитатних синапсів або кількості АМРА рецепторів, що приводить до порушення пам'яті або інших когнітивних функцій, при якому вводять згаданому ссавцеві, у фармацевтично прийнятному носії, ефективну кількість сполуки, вказаної в будь-якому з пунктів 1-31.
33. Спосіб лікування ссавця, в якому ссавцеві, що страждає на гіпоглутаматергічний стан або дефіцит кількості або інтенсивності ексцитатних синапсів або кількості АМРА рецепторів, у результаті чого виникає кортикально/стриарний дисбаланс, що приводить до шизофренії або шизофренічної поведінки, вводять, у фармацевтично прийнятному носії, ефективну кількість сполуки, вказаної в будь-якому з пунктів 1-31.
34. Спосіб згідно з пунктом 33, в якому згаданим станом є шизофренія.
35. Спосіб згідно з пунктом 33, в якому згаданим станом є хвороба Паркінсона.
36. Фармацевтична композиція, що містить ефективну кількість сполуки згідно з будь-яким з пунктів 1-31 у комбінації з фармацевтично прийнятним носієм, добавкою або наповнювачем.
37. Композиція згідно з пунктом 36, в якій згадана сполука складає приблизно від 0,5 до 75 ваг.% згаданої композиції, а згаданий носій, добавка або наповнювач складають приблизно від 25 до 95,5 ваг.% згаданої композиції.
38. Застосування сполуки, вказаної в будь-якому з пунктів 1-31, для виготовлення медикаменту для використання при лікуванні ссавця, що страждає на глутаматергічний стан або дефіцит кількості або інтенсивності ексцитатних синапсів або кількості АМРА рецепторів, що призводить до порушення пам'яті або інших когнітивних функцій.
39. Застосування сполуки, вказаної в будь-якому з пунктів 1-31, для виготовлення медикаменту для застосування при лікуванні шизофренії.
40. Застосування сполуки, вказаної в будь-якому з пунктів 1-31, для виготовлення медикаменту для застосування при лікуванні хвороби Паркінсона.
Текст
1. Сполука, що має структуру Іа або Іb: C2 2 (19) 1 3 79940 R' відсутній або означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або може бути з'єднаний з R з утворенням 4-8членного кільця, що може бути заміщене Χ і може бути зв'язане з Y з утворенням 6-членного кільця, і яке може, необов'язково, містити один або два гетероатоми, такі як кисень, азот або сірка, Χ і X' означають, незалежно, R, гало, -CO2R, -CN, NRR', -NRCOR', -NO2, -N3 або -OR. 2. Сполука згідно з пунктом 1 з структурою Іа, як згадано вище, де Q і Q' незалежно означають водень, -СН2-, -О-, -S-, алкіл або заміщений алкіл, R1 означає водень, алкіл або разом з Q може бути циклоалкілом, R2 може бути відсутній або, якщо є присутнім, може бути -СH2-, -CO-, -СН2СН2-, -СН2СО-, -СН2Оабо -CONR-, Y означає водень або -OR3, або служить для зв'язування ароматичного кільця з А простим зв'язком, =N- або -NR-, R3 означає водень, алкіл, заміщений алкіл або служить для зв'язування приєднаного кисню з А, що є нижчим алкіленом, таким як метилен або етилен, або заміщеним нижчим алкіленом, таким як -CRR'-, що зв'язує ароматичне кільце з А з утворенням заміщеного або незаміщеного 6-, 7або 8-членного кільця, або зв'язок, що зв'язує кисень з А з утворенням 5- або 6-членного кільця, А означає -NRR', -OR, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, арил, заміщений арил, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка, R означає водень, арил, арилалкіл, заміщений арил, заміщений арилкалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або гетероциклоалкіл, R' відсутній або означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або може бути з'єднаний з R з утворенням 4-8членного кільця, що може бути заміщене Χ і може бути зв'язане з Y, і яке може, необов'язково, містити один або два гетероатоми, такі як кисень, азот або сірка, Χ і X' означають, незалежно, R, гало, -CO2R, -CN, NRR', -NRCOR', -NO2, -N3 або -OR. 3. Сполука згідно з пунктом 1 з структурою Іb, як згадано вище, де: Q і Q' незалежно означають водень, -СН3-, -О-, -S-, алкіл або заміщений алкіл, R1 означає водень, алкіл або разом з Q може бути циклоалкілом, R2 може бути відсутній або, якщо є присутнім, може бути –СН2-, -CO-, -СН2СН2-, -СН2СО-, -СН2О- і CONR-, Y означає водень або -OR3, або служить для зв'язування ароматичного кільця з А’ простим зв'язком, =N- або -NR-, R3 означає водень, алкіл, заміщений алкіл або служить для зв'язування приєднаного кисню з А’, що є нижчим алкіленом, таким як метилен або етилен, або заміщеним нижчим алкіленом, таким 4 як -CRR'-, що зв'язує ароматичне кільце з А’ з утворенням заміщеного або незаміщеного 6-, 7або 8-членного кільця, або зв'язок, що зв'язує кисень з А’ з утворенням 5- або 6-членного кільця, А’ означає -NRR', -OR, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, арил, заміщений арил, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка, R означає водень, арил, арилалкіл, заміщений арил, заміщений арилкалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або гетероциклоалкіл, R' відсутній або означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або може бути з'єднаний з R з утворенням 4-8членного кільця, що може бути заміщене Χ і може бути зв'язане з Y з утворенням 6-членного кільця, і яке може, необов'язково, містити один або два гетероатоми, такі як кисень, азот або сірка, Χ і X' означають, незалежно, R, гало, -CO2R, -CN, NRR', -NRCOR', -NO2, -N3 або -OR. 4. Сполука згідно з будь-яким з пунктів 1-3, в якій Q і Q' означають -СН2-, а R2 означає –СН2-. 5. Сполука згідно з будь-яким з пунктів 1-4, в якій R1 означає водень. 6. Сполука згідно з будь-яким з пунктів 1-3 або 5, в якій Q і Q' означають -СН2-, a R 2 означає –СН2СН27. Сполука згідно з будь-яким з пунктів 1-3 або 5, в якій Q` означає –СН2-, R2 означає –СН2- і Q означає -О- або -S-. 8. Сполука згідно з будь-яким з пунктів 1-3, 5 або 7, в якій Q означає -O-. 9. Сполука згідно з будь-яким з пунктів 1-3, в якій Q і Q` означають алкіл, а R2 відсутній. 10. Сполука згідно з будь-яким з пунктів 1-3, в якій Q і Q' означають алкіл, R2 відсутній, а R1 означає водень. 11. Сполука згідно з будь-яким з пунктів 1-3 або 10, в якій Y означає -OR3 і А означає -NRR', -OR, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, арил, заміщений арил, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка. 12. Сполука згідно з будь-яким з пунктів 1-3 або 11, в якій А означає алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, арил, заміщений арил, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка. 13. Сполука згідно з будь-яким з пунктів 1-3 або 12, в якій А означає алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, гетероцикл або заміщений гетероцикл, що містить один гетероатом, такий як кисень, азот або сірка. 14. Сполука згідно з будь-яким з пунктів 1-13, в якій А або А’ означає -NRR', R означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або гетероциклоалкіл, R1 означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або може бути 5 79940 приєднаний до R з утворенням 4-8-членного кільця, що може бути заміщене Χ і зв'язане з Y за допомогою R3, і яке може, необов'язково, містити один додатковий гетероатом, такий як кисень, азот або сірка, а Х і X' означають, незалежно, R, гало, CO2R, -CN, -NRR', -NRCOR', -NO2 , -N3 або -OR. 15. Сполука згідно з будь-яким з пунктів 1-13, в якій А або А’ означає -NRR', R означає алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або гетероциклоалкіл, R' означає водень, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або може бути приєднаний до R з утворенням 4-8-членного кільця, що може бути заміщене Χ і зв'язане з Y за допомогою R3, і яке може, необов'язково, містити один додатковий гетероатом, такий як кисень, азот або сірка, а Х і X' незалежно означають R, гало, -CO2R, -CN, -NRR', -NRCOR', NO2, -N3 або -OR. 16. Сполука згідно з пунктом 15, в якій А або А’ означає -NRR' і R' приєднаний до R з утворенням 4-8-членного кільця, що може бути заміщене Х і зв'язане з Y за допомогою R3, і яке може, необов'язково, містити один додатковий гетероатом, такий як кисень, азот або сірка, а Х і X' означають, незалежно, R, гало, -СO2R, -CN, -NRR', -NRCOR', NO2, -N3 або -OR. 17. Сполука згідно з пунктом 16, в якій А або А’ означає -NRR', і R' приєднаний до R з утворенням 5-членного кільця, що може бути заміщене Х і зв'язане з Y за допомогою R3, і яке може, необов'язково, містити один додатковий гетероатом, такий як кисень, азот або сірка, а Х і X' означають, незалежно, R, гало, -СО2 R, -CN, -NRR', -NRCOR', -NO2, N3 або -OR. 18. Сполука згідно з пунктом 17, в якій А або А’ означає –NRR`, і R' приєднаний до R з утворенням 5-членного кільця, що може бути заміщене Х і зв'язане з Y за допомогою R3, і яке містить один додатковий гетероатом, такий як кисень, азот або сірка, а Х і X' означають, незалежно, R, гало, -СО2 R, CN, -NRR', -NRCOR', -NO2, -N3 або -OR. 19. Сполука згідно з пунктом 16, в якій А або А’ означає -NRR', а R' приєднаний до R з утворенням 5-членного кільця, що зв'язується з Y за допомогою R3. 20. Сполука згідно з пунктом 16, в якій А або А’ означає -NRR', а R' приєднаний до R з утворенням 6-членного кільця, що може бути заміщене Х і зв'язане з Y за допомогою R3, і яке може, необов'язково, містити один додатковий гетероатом, такий як кисень, азот або сірка, а X і X' означають, незалежно, R, гало, -СО2 R, -CN, -NRR', -NRCOR', -NO2, N3 або -OR. 21. Сполука згідно з будь-яким з пунктів 1-10, в якій Y означає -OR3. 22. Сполука згідно з пунктом 21, в якій R3 означає водень. 23. Сполука згідно з будь-яким з пунктів 1-3, в якій Y означає водень. 24. Сполука згідно з будь-яким з пунктів 1-3, в якій Y означає =Ν- або -NR-. 25. Сполука згідно з будь-яким з пунктів 1 -3, в якій Y означає =Ν-. 6 26. Сполука згідно з пунктом 23, в якій А означає OR, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка. 27. Сполука згідно з пунктом 23, в якій А або А’ означає -NRR'. 28. Сполука згідно з пунктом 21, в якій А означає OR, алкіл, заміщений алкіл, циколалкіл, заміщений циклоалкіл, циклоалкілалкіл, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка. 29. Сполука згідно з пунктом 21, в якій А або А’ означає -NRR'. 30. Сполука згідно з пунктом 4, в якій Y означає OR3 або А означає -NRR'. 31. Сполука згідно з пунктом 30, в якій R1 означає водень. 32. Спосіб лікування ссавця, що страждає на гіпоглутаматергічний стан або дефіцит кількості або інтенсивності ексцитатних синапсів або кількості АМРА рецепторів, що приводить до порушення пам'яті або інших когнітивних функцій, при якому вводять згаданому ссавцеві, у фармацевтично прийнятному носії, ефективну кількість сполуки, вказаної в будь-якому з пунктів 1-31. 33. Спосіб лікування ссавця, в якому ссавцеві, що страждає на гіпоглутаматергічний стан або дефіцит кількості або інтенсивності ексцитатних синапсів або кількості АМРА рецепторів, у результаті чого виникає кортикально/стриарний дисбаланс, що приводить до шизофренії або шизофренічної поведінки, вводять, у фармацевтично прийнятному носії, ефективну кількість сполуки, вказаної в будь-якому з пунктів 1-31. 34. Спосіб згідно з пунктом 33, в якому згаданим станом є шизофренія. 35. Спосіб згідно з пунктом 33, в якому згаданим станом є хвороба Паркінсона. 36. Фармацевтична композиція, що містить ефективну кількість сполуки згідно з будь-яким з пунктів 1-31 у комбінації з фармацевтично прийнятним носієм, добавкою або наповнювачем. 37. Композиція згідно з пунктом 36, в якій згадана сполука складає приблизно від 0,5 до 75 ваг.% згаданої композиції, а згаданий носій, добавка або наповнювач складають приблизно від 25 до 95,5 ваг.% згаданої композиції. 38. Застосування сполуки, вказаної в будь-якому з пунктів 1-31, для виготовлення медикаменту для використання при лікуванні ссавця, що страждає на глутаматергічний стан або дефіцит кількості або інтенсивності ексцитатних синапсів або кількості АМРА рецепторів, що призводить до порушення пам'яті або інших когнітивних функцій. 39. Застосування сполуки, вказаної в будь-якому з пунктів 1-31, для виготовлення медикаменту для застосування при лікуванні шизофренії. 40. Застосування сполуки, вказаної в будь-якому з пунктів 1-31, для виготовлення медикаменту для застосування при лікуванні хвороби Паркінсона. 7 79940 Даний винахід стосується сполук, фармацевтичних композицій і способів їх використання для профілактики і лікування церебральної недостатності, включаючи посилення рецепторів, що функціонують в синапсах у мережах головного мозку, відповідальних за поведінку більш високого порядку. Ці мережі головного мозку, що беруть участь у формуванні пізнавальних здібностей, зв'язані з погіршенням пам'яті, що спостерігається при різних видах слабоумства, а також з дисбалансом нейрональной активності між різними областями головного мозку, що, як вважається, викликає такі захворювання, як хвороба Паркінсона, шизофренія й афективні розлади або захворювання, що впливають на настрій. Зокрема, винахід стосується сполук, використовуваних для лікування таких станів, і способів використання цих сполук для такого лікування. Вивільнення глутамату в синапсах на багатьох ділянках у передньому мозку ссавців стимулює два класи постсинаптических, іонотропних рецепторів. Ці класи звичайно згадуються як рецептори АМРА/квисквалат і N-метил-D-аспарагінова кислота (NMDA). Рецептори АМРА/квисквалат опосредковують незалежну різницю потенціалів швидкого ексцитатного пост-синаптичного струму (швидкого ЕПСС), тоді як рецептори NMDA генерують залежну різницю потенціалів, повільний ексцитатний струм. Дослідження, виконані в зрізах гіпокампу або кори показують, що швидкий ЕПСС, опосередкований АМРА рецепторами, в основному є безумовним домінуючим компонентом у більшості глутаматергічних синапсів. АМРА рецептори не розподіляються рівномірно по головному мозку, а в значній мірі обмежуються кінцевим мозком і мозочком. Ці рецептори виявлені у високих концентраціях у поверхневих шарах кори головного мозку, у кожній з головних синаптичних зон гіпокампу, і в стриарному комплексі, як вказують [Monaghan et al., in Brain Research 324: 160-164 (1984)]. Дослідження на тваринах і людині показують, що ці стр уктури організують складні перцепційно-моторні процеси і забезпечують основу для поведінки більш високого порядку. Таким чином, АМРА рецептори опосередковують передачу в ти х мережах головного мозку, що відповідають за пізнавальну активність хазяїна. З ви ще приведених причин ліки, що модулюють і, тим самим, підсилюють функціонування АМРА рецепторів, можуть істотно сприяти пізнавальній ι інтелектуальній роботі. Такі ліки повинні також полегшувати кодування пам'яті. Експериментальні дослідження, як вказують [Arai and Lynch, Brain Research 598: 173-184 (1992)], показують, що збільшення параметра опосередкованого АМРА рецептором синаптичної відповіді підсилює індукцію довгострокового потенціювання (ІДП). ІДП стійке збільшення сили синаптичних контактів, що випливають за повторною фізіологічною активністю відомого типу, що відбувається в головному мозку під час навчання. Сполуки, що підсилюють функціонування глутаматних рецепторів форми АМРА, полегшують індукцію ІДП і засвоєння вивчених задач, що було 8 виміряно за допомогою безлічі зразків. [Див., наприклад, Granger et al., Synapse 15: 326-329 (1993); Staubli et al., PNAS 91: 777-781 (1994); Arai et al., Brain Res. 638: 343-346 (1994); Staubli et al., PNAS 91: 11158-11162 (1994); Shors et al., Neurosci. Let. 186: 153-156 (1995); Larson et al., J. Neurosci. 15: 8023-8030 (1995); Granger et al., Synapse 22: 332-337 (1996); Arai et al., JPET 278 : 627- 638 (1996); Lynch et al., Intemat. Clin. Psychopharm. 11:13-19 (1996); Lynch et al., Exp. Neurology 145: 89-92 (1997); Ingvar et al., Exp. Neurology 146: 553559 (1997); Hampson, et al., J. Neurosci. 18: 27482763 (1998); and Lynch and Rogers, Патент США 5,747, 492]. Існує значна кількість свідчень, що показують, що ІДП є основою пам'яті. Наприклад, сполуки, що блокують ІДП, перешкоджають утворенню пам'яті у тварин, а деякі ліки, що порушують процес навчання у людини, протидіють стабілізації ІДП, як описує [del Cerro and Lynch, Neuroscience 49:1-6 (1992)]. Прототип сполуки, що підсилює функцію АМРА рецептора, описаний [Ito et al., J. Ph ysio. 424: 533-543 (1990)]. Ці автори знайшли, що ноотропний препарат анірацетам (N-анізоїл-2-піролідинон) підсилює струми, опосередковані АМРА рецепторами мозку, експресованих в ооцитах Ксенопуса, не торкаючи відповідей g-аміномасляної кислоти (GABA), каїнової кислоти (KА), або NMDA рецепторів. Інфузія анірацетаму в зрізі гіпокампу також істотно збільшувала величини швидких синаптичних потенціалів без зміни мембранних властивостей у стані спокою. Вважається, що анірацетам підсилює синаптичні відповіді на декількох ділянках у гіпокампі, і що він не впливає на потенціали, опосередковані NMDA-рецепторами [Staubli et al., Psychobiology 18: 377-381 (1990) and Xiao et al., Hippocampus 1: 373-380 (1991)]. Виявлено, що анірацетам має надзвичайно швидкий початок дії і швидко виводиться, і може застосовуватися неодноразово без очевидних тривалих ефектів, що є бажаними властивостями для ліків, призначених для лікування порушень поведінки. Однак анірацетам дійсно має ряд недоліків. Периферійне введення анірацетама не впливає на мозкові рецептори. Препарат діє тільки при високих концентраціях (приблизно 1000мкм), і приблизно 80% препарату перетворяться в анізоїл-GABA після периферійного введення людині [Guenzi and Zanetti, J. Chromatogr. 530: 397-406 (1990)]. Виявлено метаболіт, анізоїл-GABA, що має меншу синаптичну активність, ніж анірацетам. Описано клас сполук, що модулюють АМРА рецептори, що не виявляють низької ефективності і характерної для анірацетаму нестійкості [Lynch and Rogers, US Patent 5,747, 492]. Ці сполуки, названі "Ampakines"Ò , можна замінити на бензаміди, що включають, наприклад, 1-(хіноксалін-6ілкарбоніл)піперидин (СХ516; AmpalexÒ ). Як правило, вони хімічно більш стійкі, ніж анірацетам і виявляють поліпшену біодоступність. СХ516 є активним в експериментах на тваринах, використовуваних для виявлення ефективних ліків для лікування порушень пам'яті, шизофренії і депресії. У трьох окремих клінічних іспитах СХ516 виявив 9 79940 ефективність у поліпшенні різних форм людської пам'яті [Lynch et al., Intemat. Clin. Psychopharm. 11: 13-19 (1996); Lynch et al., Exp. Neurology 145: 89-92 (1997); Ingvar etal., Exp. Neurology 146: 553-559 (1997)]. Виявлено, що бензоксазини - інший клас ампакінів, виявили дуже високу активність у моделях in vitro і in vi vo при оцінці імовірності їхнього впливу на посилення процесу пізнання [Rogers and Lynch; Патент США №5,736,543]. Заміщені бензоксазини являють собою жорсткі аналоги бензамідів з різними рецептормодулювальними властивостями гнучкого бензаміду, С Х516. Зненацька було виявлено, що деякі заміщені бензофуразанові і бензотіадіазолові сполуки, діють значно сильніше у тваринній моделі шизофренії, ніж попередні сполуки, і що вони також ефективні в посиленні процесу пізнання. Структурно ці сполуки подібні описаними в [Lynch and Rogers, Патент США №5,736,543]. Раніше описані структури, що містять 1,3бензоксазин-4-он фармакофори, заміщали на частині бензолу такими гетероатомами, як азот або кисень [Патенти США №№ 5736,543 і 5962,447], заміщеними алкілами [Патенти США №№ 5650,409 і 5783,587], або незаміщеними алкілами [Міжнародна заявка WO 99/42456]. Ще один клас сполук 1,3-бензоксазину містить зовнішній до кільця оксазину карбоніл [Патент США №6124,278], але не як замісник на структурі кільця бензолу. Недавно був виявлений новий клас карбонілзамещених сполук бензоксазину, що виявляють істотну активність на синаптичні відповіді гіпокампу і нейрональні струми цілих кліток, опосередковані АМРА рецепторами, а також у тваринних моделях пізнання і пам'яті. Карбонілзамещені 1,3бензоксазин-4-они є першими молекулами, що виявили активність як модулятори АМРА рецептора і які мають два важких атоми, що розгалужуються від того самого альфа атома до кільця бензолу в 6- або 7-положенні. Біологічна активність 6або 7карбонілзамещених 1,3-бензоксазинів була несподіваною, а ефективність у АМРА рецепторі була дивно високою; причому найбільш сильнодіючі 1,3бензоксазини є членами цього класу сполук. Ці сполуки описуються далі. Даний винахід включає, в одному з аспектів, сполуки, представленої структурою І, і описаної в Розділі II Детального опису, який приведений далі. Виявлено, що введення сполук цього класу підсилює синаптичні відповіді, опосередковані АМРА рецепторами. Зненацька було виявлено, що сполуки згідно із даним винаходом є значно більш ефективними, ніж раніше описані сполуки, для посилення функції АМРА рецепторів у первинних нейрональних культура х і в зрізах гіпокампу пацюків, і в посиленні когнітивної діяльності, наприклад 10 швидкодії в радіальному лабіринті з 8 відгалуженнями. Ця несподівана активність переноситься на фармацевтичні сполуки і відповідні способи застосування, включаючи способи лікування, при яких використовуються значно більш низькі концентрації (з розрахунку моль-на-моль) даних сполук у порівнянні з сполуками, відомими з попереднього рівня техніки. Здатність сполук відповідно до винаходу підсилювати відповіді, опосередковані АМРА рецептором дозволяє використовувати ці сполуки для різних цілей. Це включає сприяння вивченню моделей поведінки, залежних від глутаматних рецепторів, розгляд станів, при яких АМРА рецептори або синапси, що використовують ці рецептори, мають знижену кількість або ефективність, а також збільшення ексцитатной синаптичної активності для відновлення дисбалансу між мозковими підобластями або збільшення рівня нейротропних факторів. З іншого боку, винахід включає спосіб лікування у ссавця, що страждає від гіпоглутаматергічного стану, або від де фіциту кількості або інтенсивності ексцитатних синапсів, або від кількості АМРА рецепторів, що викликають порушення пам'яті або інших пізнавальних функцій. Такі стани можуть також викликати кортикальний/стриарний дисбаланс, що приводить до шизофренії або шизофренічної поведінки. Відповідно до даного способу, лікування такого суб'єкта проводять шляхом призначення ефективної кількості сполуки, представленої структурою І, і описаної в наступному Розділі II детального опису, у фармацевтично прийнятному носії. Ці й інші цілі й особливості винаходу стають більш очевидними з наступного нижче докладного опису винаходу із супровідними його кресленнями. На Фіг. зображені чотири сполуки згідно із даним винаходом, разом з однією з сполук з попередньої області техніки, що були досліджені на активність і описані в експериментальному розділі й у Таблицях 1 і 2, infra. І. Визначення Нижчеподані терміни мають наступні визначення, якщо не згадано інше. Інші терміни, що використовуються для опису даного винаходу, мають ті ж самі визначення, оскільки ці терміни звичайно використовуються фа хівцями в даній області техніки. Використовуваний тут термін "алкіл" стосується до повністю насиченого одновалентного радикала, що містить вуглець і водень, і який може бути неролозгалуженим ланцюгом, розгалуженим або циклічним ланцюгом. Прикладами алкільних груп є метил, етил, н-бутил, н-гетил, ізопропіл, 2метилпропіл, циклопропіл, циклопропілметил, циклобутил, циклопентил, циклопентилетил і циклогексил. Термін "заміщений алкіл" стосується до описаного вище алкілу, що включає одну або більше функціональних груп, такі, як нижчий алкіл, що містить 1-6 атомів водню, арил, заміщений арил, ацил, галоген (тобто, алкілгалогени, наприклад, CF3), гідрокси, алкокси, алкоксиалкіл, аміно, алкіл і діалкіламіно, ациламіно, ацилокси, арилокси, ари 11 79940 локсиалкіл, карбоксиалкіл, карбоксиамідо, тіо, тіоетери, як насичені, так і ненасичені циклічні вуглеводні, гетероцикли і т.і. Термін "арил" стосується заміщеного або незаміщеного одновалентного ароматичного радикала, що має одне кільце (наприклад, феніл) або декілька конденсованих кілець (наприклад, нафтил). Інші приклади включають гетероциклічні ароматичні кільцеві групи, що мають один або більше атомів азоту, кисню або атоми сірки в кільці, наприклад імідазоліл, фурил, піроліл, піридил, тієніл і індоліл. Термін "заміщений арил" стосується вищеописаного арилу, що містить одну або більше функціональних груп, таких, як нижчий алкіл, ацил, арил, галоген, алкілгалогени (наприклад, CF3), гідрокси, алкокоси, алкоксиалкіл, аміно, алкіл і діалкіламіно, ациламіно, ацилокси, арилокси, арилоксиалкіл, карбоксиалкіл, карбоксамідо, тіо, тіоетери, наприклад як насичені, так і ненасичені циклічні вуглеводні, гетероцикли і т.і. Терміни "гетероцикл" або "гетероциклічний" стосується карбоцикличного кільця, де один або більше атомів вуглецю заміщені одним або більше гетероатомами, такими, як азот, кисень або сірка. Приклади гетероциклів є, але не обмежуються, такі, як піперидин, піролідин, морфолін, тіоморфолін, піперазин, тетрагідрофуран, тетрагідропіран, 2-піролідинон, d-валеролактам, d-валеролактон і 2кетопіперазин. Термін "заміщений гетероцикл" стосується вищеописаного гетероциклу, що містить одну або більше функціональних груп, таких, як нижчий алкіл, ацил, арил, ціано, галоген, гідрокси, алкокси, алкоксиалкіл, аміно, алкіл і діалкіламіно, ациламіно, ацилокси, арилокси, арилоксиалкіл, карбоксиалкіл, карбоксамідо, тіо, тіоетери, наприклад як насичені, так і ненасичені циклічні вуглеводні, гетероцикл і т.і. Використовуваний тут термін "сполука" стосується будь-якої конкретно описаної тут хімічної сполуки. У межах його використання в контексті, термін у цілому стосується окремої сполуки, але в деяких випадках він може також відноситься до стереоізомерів і/або оптичних ізомерів (включаючи рацемічні суміші) описаних сполук. Термін "ефективна кількість" стосується кількості вибраної сполуки формули І, що використовується для посилення глутаматергічної синоптичної відповіді при підвищенні активності АМРА рецептора. Точна використовувана кількість варіюється в залежності від специфічно вибраної сполуки і її планованого застосування, віку і ваги суб'єкта, способу введення і т.і, і може бути легко визначено звичайними експериментами. У випадку лікування стану або стадії захворювання, ефективна кількість - це та кількість, що використовують для ефективного лікування специфічного стану або стадії захворювання. Термін "фармацевтично прийнятний носій" стосується носія або наповнювача, що має припустиму токсичність стосовно суб'єкта, якому його вводять. Фармацевтично прийнятні наповнювачи описані докладно [Е. W. Martin, in "FteMington's Pharmaceutical Sciences"]. 12 "Фармацевтично прийнятна сіль" аміносполуки, що розглядаються в даному винаході, є сіллю амонію, що має в якості протиіона неорганічний аніон, наприклад хлорид, бромід, йодид, сульфат, сульфіт, нітрат, нітрит, фосфат і т.і., або органічний аніон, наприклад ацетат, малонат, піруват, пропіонат, фумарат, цинамат, тозилат, і т.і. Використовуваний скрізь в описі термін «пацієнт» або «суб'єкт» для опису тварини, в основному ссавця тварини, включає людину, що піддається лікуванню з використанням сполуки або композиції згідно із даним винаходом. Для лікування або застосування з/або тими станами або захворюваннями, що є специфічними для визначеної тварини (зокрема, наприклад, людини як суб'єкта або пацієнта), термін пацієнт або суб'єкт відносяться до такої специфічної тварини. Термін «сенсорно моторні порушення» використовують для опису порушення, що з'являється у пацієнта або об'єкта через нездатність інтегрувати зовнішню інформацію, одержувану від п'яти відомих органів почуттів таким чином, щоб посилати відповідні фізичні відповіді, що приводять до руху і дії. Термін "когнітивна задача" або "когнітивна функція" використовується для опису зусиль або процесу, чинених пацієнтом або суб'єктом, при яких потрібні мислення або знання. Різноманітні функції сукупності паріетальних, темпоральних і фронтальних часток кори головного мозку, що складають приблизно 75% усієї тканини мозку людини, відповідають за велику частину обробки інформації, що відбувається між сенсорним входом і моторним виходом. Різноманітні функції сукупності кори головного мозку, найчастіше називають пізнавальною здатністю, що буквально означає процес, за допомогою якого ми пізнаємо світ. Вибірковий прояв уваги до специфічного стимулу, розпізнавання й ідентифікація цих релевантних особливостей стимулу, а також планування й іспит відповіді на досвід представляють деякі з процесів або здібностей, опосередкованих людським мозком, що зв'язані з пізнанням. Термін "мережа головного мозку" використовується для опису різних анатомічних областей мозку, що зв'язані один з одним через синоптичну активність нейронних клітин. Термін "АМРА рецептор" стосується сук упності білків, виявлених у деяких мембранах, що дозволяє позитивним іонам перетинати мембрану у відповідь на зв'язування глутамату або АМРА (DL-aаміно-3-гідрокси-5-метил-4-ізоксазолпропіонова кислота), але не NMDA. Термін "ексцитатний синапс" використовується для опису зв'язування клітина-клітина, в якій вивільнення хімічного посередника однією клітиною приводить до деполяризації зовнішньої мембрани іншої клітки. Ексцитатний синапс описує постсинаптичний нейрон, що має зворотний потенціал, що є більш позитивним, ніж граничний потенціал і, отже, у такому синапсі, нейромедіатор підсилює імовірність того, що ексцитатний постсинаптичний потенціал приведе до результату (нейрон запустить генерацію потенціалу дії). Зворотні потенціали анулювання і граничні потенціали визначають13 79940 постсинаптичне порушення і інгібування. Якщо зворотний потенціал для постсинаптичного потенціалу (ПСП) є більш позитивним, ніж поріг потенціалу дії, то ефект медіатора є ексцитатним і продукує ексцитатний постсинаптичний потенціал (ЕПСП) і запуск потенціалу дії нейроном. Якщо зворотний потенціал для постсинаптичного потенціалу є більш негативним, ніж поріг потенціалу дії, то медіатор є інгібуючим і може генерувати інгібуючі достсинаптичні потенціали (ІПСП), у такий спосіб скорочуючи імовірність того, що синапс запустить потенціал дії. Загальне правило для постсинаптичної дії: якщо зворотний потенціал є більш позитивним, ніж граничний, то відбувається порушення; інгібування відбувається, якщо зворотний потенціал є більш негативним, ніж граничний. [Див., наприклад, Chapter 7, NEUROSCIENCE, edited by Dale Purves, Sinauer Associates, Inc., Sunderland, MA 1997]. Термін "моторна задача" використовується для опису зусилля, що починається пацієнтом або суб'єктом, що приведе до руху або дії. Термін "перцептивна задача" використовується для опису дії пацієнта або суб'єкта, при якому увага спрямована на сенсорні входи. Термін "синоптична відповідь" використовується для опису біофізичних реакцій в одній клітині як наслідку вивільнення хімічних посередників іншою клітиною, з яким вона знаходиться в близькому контакті. Термін "гіпоглутаматергічний стан" використовується для опису стану або порушення, при якому передача, опосередкована глутаматом (або зв'язана з ексцитатними амінокислотами), нижче нормальних рівнів. Передача полягає у вивільненні глутамату, зв'язування з постсинаптичними рецепторами, і відкритті каналів, об'єднаних з цими рецепторами. Кінцевою точкою гіпоглутаматергічного стану є знижений ексцитатний прстсинаптичний струм. Це може бути результатом кожної з трьох вищевказаних фаз передачі. Стани або захворювання, що вважаються гіпоглутаматергічними станами і які можна лікувати, використовуючи сполуки, композиції і способи згідно із даним винаходом, включають, наприклад втрату пам'яті, слабоумство, депресію, порушення уваги, сексуальну дисфункцію, порушення руху, включаючи хворобу Паркінсона, шизофренію або шизофренічну поведінку, порушення пам'яті і здатності до навчання, включаючи ті захворювання, що є наслідком старіння, травми, удару і нейродегенеративних порушень, а також стану, обумовленого дією лікарських засобів, нейротоксичних агентів, хворобою Альцгеймера і старінням. Ці стани легко розпізнаються і діагностуються фахівцями в даній області техніки. Термін "кортико-стріарний дисбаланс" використовується для опису стану, в якій баланс нейронної активності у взаємозалежних корі головного мозку й основному стриарному комплексі відхиляється від звичайного. «Активність» може бути оці 14 нена шляхом електричної реєстрації або молекулярних біологічних методів. Дисбаланс може бути встановлений, шляхом застосування цих методів виміру до двох структур або за допомогою функціональних (поведінкових або фізіологічних) критеріїв. Термін "афективний розлад" або "розлад настрою" описує стан, коли сум або ейфорія надмірно інтенсивні і продовжуються понад очікуваний вплив стресової події життя або виникають усередині організму. Використовуваний тут термін "афективний розлад" охоплює всі типи розладу настрою, як описано, наприклад, у [Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition (DSM IV), pages 317-391]. Термін "шизофренія" використовують для опису стан у, що є звичайним типом психозу, що характеризується порушенням процесів мислення, такими, як марення і галюцинації, екстенсивним відходом інтересу індивідуума від інших людей і зовнішнього світу, і зосередження на власному я. В даний час шизофренію розглядають як групу розумових хвороб, а не одну окрему категорію, і проводять розподіл між реактивною шизофренією і повільною шизофренією. Використовуваний тут термін шизофренія або «шизофренічно подібна» включає всі типи шизофренії, включаючи амбулаторну шизофренію, кататонічну шизофренію, гебефренічну шизофренію, схован у шизофренію, повільну шизофренію, псевдоневротичну шизофренію, реактивну шизофренію, просту шизофренію, і зв'язані з нею психотичні розлади, що подібні шизофренії, але які не обов'язково діагностуються як шизофренія самі по собі. Шизофренія й інші психотичні розлади можуть бути діагностовано шляхом використання основних принципів, викладених, наприклад, у керівництві [Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition (DSM IV) Sections 293,81, 293,82, 295,10, 295,20, 295,30, 295,40, 295,60, 295,70, 295,90, 297,1, 297,3, 298,8]. Термін «функція мозку» використовують для опису комбінованих задач сприйняття, інтегрування, фільтрування і відповіді на зовнішні стимули і внутрішні мотиваційні процеси. Термін "порушення" використовують для опису функції, що працює на рівні, що є нижче нормального рівня. Порушені функції можуть значно впливати, оскільки, функція, що виконується слабко, фактично не існує або працює в режимі, що є значно нижчим нормального. Порушені функції можуть також бути субоптимальним. Серйозність порушення функції залежить від стану пацієнта і захворювання, що підлягає лікуванню. II. Сполуки, що підсилюють функцію АМРА рецепторів Даний винахід стосується, з одного боку, сполук, що мають властивість підсилювати функції АМРА рецептора. Ці сполуки мають структур у, Іа або Іb, що приведені нижче: 15 79940 в якій: Q і Q' незалежно означають водень, -СН2-, -О-, -S-, алкіл, або заміщений алкіл, R1 означає водень, алкіл або разом з Q може бути циклоалкілом, R2 може бути відсутній, або, якщо є присутнім, може бути -СН2-, -CO-, -CH2CH2-, -СН2СО-, -СН2О-, -CRR1-, і -CONR-, Υ означає водень або -OR3, або служить для зв'язування ароматичного кільця з А простим зв'язком, =N- або -NR-, R3 означає водень, алкіл, заміщений алкіл, або служить для зв'язування приєднаного кисню з А, що є нижчим алкіленом, таким, як метилен або етилен, або заміщеним нижчим алкіленом, таким як -CRR'-, що зв'язує ароматичне кільце з А з утворенням заміщеного або незаміщеного 6, 7 або 8-членного кільця, або зв'язок, що зв'язує кисень з А з утворенням 5- або 6-членного кільця, А означає -NRR', -OR, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, арил, заміщений арил, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка, R означає водень, арил, арилалкіл, заміщений арил, заміщений арилкалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, або гетероциклоалкіл, R' відсутній або означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або може бути з'єднаний з R з утворенням 4-8членного кільця, що може бути заміщене X і може бути зв'язане з Υ з утворенням 6-членного кільця і яке може, необов'язково, містити один або два гетероатоми, такі як кисень, азот або сірка, X і X' означають, незалежно, R, гало, -CO2R, CN, -NRR', -NRCOR', -NO2, -N3 або -OR. Синтез 1,3-бензоксазин-4-онових структур, заміщених карбонільними замісниками в 6- або 7положенні переважно здійснюють наступними методиками: 1) 6-карбонілзаміщені 1,3-бензоксазин4-онові структури можуть бути синтезовані селективними амінолізом з використанням триалкілалюмінію естерів 4-гідроксиізофталату, що супроводжується замиканням кільця, використовуючи альдегід. Подальші реакції, відомі фахівцям у даній області техніки, можуть виконуватися на естері, що залишається в 6-положенні, для перетворення естеру в різні інші карбоніли, що містять, але не обмежені замісниками, такими, як аміди, альдегіди, кетони, оксими або інші естери. 16 Подібним способом можна синтезувати 7карбонілзаміщені 1,3-бензоксазин-4-онові структури вільним прямим амінолізом естерів 2гідрокситерефталату, з наступною реакцією з альдегідом, як показано. Перетворення естеру, що не прореагував, з іншим карбонілом, що містить половини, як описано вище для 6-положення, входить у межі обсягу винаходу. Усі сполуки, описані в даній заявці, можна синтезувати ви щеописаним способом, використовуючи аналогічні синтетичні стадії, що спеціально представлені в описаних тут прикладах, а також ті, котрі відомі фахівцям у даній області техніки. Виділення стерео- і/або оптичних ізомерів у чистому вигляді можна здійснювати способами, що відомі фахівцям у даній області техніки. III. Спосіб лікування Відповідно до одного з аспектів винаходу, пропонується спосіб лікування ссавця, що страждає від гіпоглутаматергічного стану, або від недоліку кількості або інтенсивності ексцитатних синапсів або кількості АМРА рецепторів. У такого суб'єкта може спостерігатися розлад пам'яті або інших пізнавальних функцій, або може відбутися кортикально/стриарний дисбаланс, що приводить до втрати пам'яті, слабоумству, депресії, розладові уваги, сексуальної дисфункції, порушенню руху, шизофренії або шизофренічної поведінки. Розлад пам'яті і здатності до навчання, що піддаються лікуванню згідно із даним винаходом, включають ті порушення, що є наслідком старіння, травми, удару і нейродегенеративних порушень. Приклади нейродегенеративних порушень включають, але не обмежені тими, які викликаються лікарськими препаратами, нейротоксичними агентами, хворобою Альцгеймера, і старінням. Ці стани можуть відразу розпізнати і діагностувати спеціалісти в даній області техніки і проводити лікування шляхом уведення пацієнтові ефективної кількості одного або більшої кількості сполук згідно із даним винаходом. Згідно із даним винаходом спосіб лікування суб'єкта, що потребує лікування, включає введення у фармацевтично прийнятному носії ефективної кількості сполуки формули: де Q і Q' незалежно означають водень, -СН2-, -О-, -S-, алкіл або заміщений алкіл, R' означає водень, алкіл або разом з Q може бути циклоалкілом, 17 79940 R2 може бути відсутній або якщо є присутнім, може бути -СН2-, -CO-, -СН2СН2-, -СН2СО-, -СН2О-, -CRR'-, або -CONR-, Υ означає водень або -OR3, або служить для зв'язування ароматичного кільця з А як єдиним зв'язком, =N- або -NR-, R3 означає водень, алкіл, заміщений алкіл, або нижчий алкілен, наприклад метилен або етилен, або заміщений нижчий алкілен наприклад -CRR'-, що з'єдн ує ароматичне кільце з А з утворенням заміщеного або незаміщеного 5,6- або 7-членного кільця, або зв'язок, що з'єднує ароматичне кільце з А з утворенням 5- або 6-членного кільця, А означає -NRR', -OR, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, циклоалкілалкіл, арил, заміщений арил, гетероцикл або заміщений гетероцикл, що містить один або два гетероатоми, такі як кисень, азот або сірка; R означає водень, арил, арилалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл, або гетероциклоалкіл, R' означає водень, арил, арилкалкіл, заміщений арил, заміщений арилалкіл, алкіл, заміщений алкіл, циклоалкіл, заміщений циклоалкіл або може бути приєднаний до R з утворенням 4-8-членного кільця, що може заміщатися R або X або зв'язуватися з Υ через R3 і який може, необов'язково, містити один або два гетероатоми, такі як кисень, азот або сірка, X і X' незалежно означають R, гало, -CO2R, NRR1, -NRCOR 1, -NO2, -N 3 або -OR. Як згадано вище, лікування суб'єкта способом відповідно до винаходу сприяє посиленню активності АМРА рецепторів, і тому його можна застосовува ти для полегшення вивчення залежності різних видів поведінки від АМРА рецепторів, і проводити лікування таких захворювань, як розлад пам'яті, при якому знижена кількість або ефективність АМРА рецепторів, або синапсів, що використовують ці рецептори. Спосіб також використовують для посилення ексцитатної синоптичної активності для відновлення дисбалансу між мозковими підобластями, що може проявитися при шизофренії або шизофренічній поведінці, або іншому ви щеописаній поведінці. Виявлено, що сполуки, які уводяться відповідно до даного способу, є більш ефективними, ніж раніше описані сполуки, у посиленні ефективності АМРА рецептора, як показано в in vitro і in vi vo описаних нижче тестах. IV. Біологічна активність А. Посилення функції АМРА рецепторів Відповідно до способу даного винаходу синоптичні відповіді, опосередковані АМРА рецепторами, підсилюються при використанні описаних тут сполук. Ці сполуки представлені в наступним ниж че прикладах, і є значно більш сильнодіючими, ніж раніше описані сполуки в посиленні опосередкованих АМРА стр умів у здорових клітинах у к ультурах нейронів і функції АМРА рецептора в зрізах гіпокампу пацюка. Тести in vitro описані далі, а також нижче в Прикладі 64. 18 Відомо, що область ЕПСП (ексцитатного постсинаптичного потенціалу), зареєстрована в області СА1 після порушення СА3 аксонів, звичайно опосередковується АМРА рецепторами, що присутні в синапсах [Kessler et al., Brain Res. 560: 337341 (1991)]. Лікарські препарати, що вибірково блокують рецептор, вибірково блокують область ЕПСП [Muller et al., Science, вище]. Анірацетам, що, як виявлене, підвищує середній час відкриття каналу АМРА рецептора, також збільшує амплітуду синоптичного струму і продовжує його тривалість [Tang et al., Science, вище]. Ці ефекти відображені в області ЕПСП [див., наприклад, Staubli et al., Psychobiology,, вище; Xiao et al., Hippocampus, вище; Staubli Et al., Hippocampus 2: 4958 (1992)]. Повідомляється, що подібні результати отримані для раніше описаних стабільних бензамідних аналогів анірацетаму [Lynch and Rogers, Міжнародна публікація РСТ No,94/02475]. З одержанням даних, показаних у Таблиці І, біполярний ніхромний стимулюючий електрод поміщали в деревоподібний шар (stratum radiatum) гіпокампульної підобласті СА1 близько до границі підобласті СА3, як описано в Прикладі 64. Імпульси струм у (0,1мс) через стимулюючий електрод активізували популяцію комісурального волокна Шаффера, що виникає з нейронів у підвідділі СА3 і закінчується в синапсах на дендритах СА1 нейронів. Активація цих синапсів змушує їх вивільняти глутамат медіатор. Глутамат зв'язується з постсинаптичними АМРА рецепторами, що потім тимчасово відкривають зв'язаний з іонами канал і дозволяють потоку натрію входити в постсинаптичну клітину. Цей струм створює різницю потенціалів у позаклітинному просторі (область ЕПСП), що реєструють за допомогою записуючого електрода високого опору, поміщеного в середині stratum radiatum CA1. Інтенсивність струму стимулювання регулювали з одержанням напівмаксимальних ЕПСП (як правило, приблизно 1,5-2,0мВ). Парні імпульси стимулювання подавали кожні 40 секунд із міжпульсним інтервалом у 200мс, як описано далі в Прикладі 64. Зрізи гіпокампу зберігали в камері, що реєструє, що безперервно перефуз ується штучною цереброспинальной) рідиною (ШЦСР). Протягом 1530 хвилинних інтервалів, перфузійне середовище переключали на інше середовище, що містить тестуємі сполуки різної концентрації. Відповіді, зібрані відразу до перфузії лікарського препарату і наприкінці, накладали, для обчислення відсотка збільшення в амплітуді ЕПСП. Сполука 1А відповідно до винаходу (самий активний ізомер продукту за Прикладом 1, як показано на Фіг.), і еталона сполука СХ516, описана в [патенті США №5,747,492], були протестовані в системі фізіологічного тестування, описаній вище. Перший стовпчик даних Таблиці 1, нижче, показує оцінку концентрації кожної тестуємої сполуки, що повинна було б знадобитися для збільшення амплітуди області ЕПСП до значення на 10% вище основного рівня. 19 79940 Таблиця 1 Сполуки № Amp1 (мкм) ЕС2х2 (мкм) МЕДС3 (мг/кг) СХ516* 80 830 12,5 Приклад 1А 0,3 0,12 0,05† *[Приклад №XIII з патенту США №5,747,492]. 1. Концентрація сполуки, що викликає 10%-е збільшення амплітуди області ЕПСП в області СА1 зрізу гіпокампу пацюка. 2. Концентрація сполуки, що викликає щонайменше подвоєння стаціонарного струму, індукованого в коркових нейронах у первинній культурі за допомогою 300мкМ глутамату. 3. Мінімальна ефективна доза (МЕД), що приводить до статистично істотного поліпшення роботи в лабіринті з 8 відгалуженнями для підвищення пізнання/пам'яті. † Для цього тесту використовували нерозчинений продукт за Прикладом 1. ND = Не визначено Як свідчать дані в Таблиці 1, сполука згідно із даним винаходом сприяє збільшенню амплітуди fЕПСП у гіпокампі й ефективно при таких низьких концентраціях, як 0,3мкм. Ефективність даної сполуки для клітинних стр умів, опосередкованих АМРА рецепторами, також оцінювали в первинній культурі нейронів, у яких концентрації знижені до 0,12мкм, викликали подвоєння стаціонарного струму в культурах нейронів, що генеруються 500мкм глутамату. Більшість тестуємих сполук показували однакову або більшу ефективність у посиленні функції АМРА рецептора у порівнянні з еталонними сполуками, СХ516 і СХ559, в якій бензоксазин заміщений гетероатомом, як показано в Таблиці 2. Таблиця 2 Приклад СХ516* СХ559 ** 1А† 1В†† 2 5 6 11 18 21 22 27 28 38 46 1 AMP1 (мкМ) 80 300 0,3 30 >10 10 100 1 100 10 10 10 10 30 3 ЕС2х2 (мкМ) 830 >10 0,12 >10 2,6 2 1,4 0,09 4 1,8 0,2 1 6 15 2,4 концентрація модулятора, що збільшує амплітуду fЕПСП на 10%. 2 концентрація модулятора, необхідна для подвоєння стійкого рівня потоку, індукованого 300мкМ глутамату на культуральних нейронах. *[Приклад №ХІІІ Патенту США № 5,747,492]. 20 **[Приклад №4 Патенти США №5,962,447 (показаний на Малюнку 1)]. † Більш активний енантіомер Прикладу 1. †† Менш активний енантіомер Прикладу 1. Дослідження, у яких порівнювали вплив АМРА модуляторів на моносинаптичний (як описано тут) і полісинаптичні відповіді, продемонстрували, що 10%-е збільшення амплітуди моносинаптичного поля ЕПСП давало 300% збільшення на трисинаптичних відповідях [Servio et al., Neuroscience 74: 1025-1035 (1996)]. Крім того, виявлено, що концентрація модулятора, що викликав ці відповіді, є присутньою у плазмі, починаючи з поведінковорелевантних доз [Granger et al., Synapse, вище]. Таким чином, концентрація сполуки, достатньої з одержанням 10% збільшення амплітуди моносинаптичних поля ЕПСП, як показано в Таблиці 1 і Таблиці 2, імовірно, являє собою поведінковорелевантну концентрацію в плазмі. В. Поведінкове тестування Сполуки відповідно до винаходу є ефективними при поведінковому тестуванні релевантних тварин, при лікуванні різних захворювань, таких, як шизофренія, а також у моделях когнітивної діяльності, такої як діяльність в радіальному лабіринті з 8-відгалуженнями. Третій стовпчик даних показує МЕД з одержанням ефективного поліпшення виконання задачі з радіальним лабіринтом з вісьма відгалуженнями, в якій тестується поліпшення пам'яті і пізнання (МЕДС). Ця задача була описана раніше [Staubli et al., PNAS 91: 777-781 (1994)], а також [Lynch and Rogers, PCT публікація міжнародної заявки WO94/02475]. У цьому тесті сполука за Прикладом 1 була в 250 разів більш активною, ніж СХ516. У. Введення, дозування і рецептура Як відзначено вище, сполуки і спосіб відповідно до винаходу підвищують опосередковані АМРА рецептором відповіді, і застосовуються для лікування гіпоглутаматергічних станів. їх також застосовують для лікування таких порушень, як погіршення пам'яті або інших пізнавальних функцій, викликаних дефіцитом кількості або інтенсивності ексцитатних синапсів, або кількості АМРА рецепторів. їх також можна використовувати для лікування шизофренії або шизофренічної поведінки, викликаної кортикально/стриарним дисбалансом, а також для полегшення вивчення поведінки, залежної від АМРА рецепторів. У суб'єктів, що піддають лікуванню даними сполуками, фармацевтичними композиціями і способом відповідно до винаходу, може бути пошкодження пам'я ті або інших пізнавальних функції, або може виникнути кортикально/стриарний дисбаланс, що приводить до втрати пам'яті, слабоумства, депресії, порушенням уваги, сексуальної дисфункції, порушенням руху, шизофренії або шизофренічної поведінки. Порушення пам'яті і порушення поведінки, що піддаються лікуванню згідно із даним винаходом, включають порушення, що є наслідком старіння, травми, удару і нейродегенеративних розладів. Приклади нейродегенеративних розладів включають, але не обмежуються, станами, викликаними лікарськими препаратами, 21 79940 нейротоксичними агентами, хворобою Альцгеймера і старінням. Ці стани відразу розпізнають і діагностують фа хівці в даній області те хніки і проводять лікування шляхом введення пацієнтові ефективної кількості однієї або більшої кількості сполук згідно з даним винаходом. У цілому, дозування і шляхи введення сполуки визначаються в залежності від розміру суб'єкта і його стану відповідно до стандартних фармацевтичних методів. Використовувані рівні доз можуть широко варіюватися, і можуть бути легко визначені фа хівцями в даній області техніки. Як правило, використовуються кількості, вимірювані від міліграмів до грамів. Сполуки можна вводити суб'єктові різними шляхами, тобто перорально, трансдермально, періневрально або парентерально, тобто шляхом вн утрішньовенної, підшкірної, внутрішньочеревинної або внутрішньом'язової ін'єкції, також включаючи трансбукальне, ректальне і трансдермальне введення. Суб'єкти, що підлягають лікуванню способом відповідно до винаходу, включають людей, домашніх тварин, лабораторних тварин, і т.і. Рецептури, що містять сполуки згідно із даним винаходом, можуть мати форму твердої речовини, напівтвердої речовини, ліофілизованого порошку, або рідких форм дозування, як, наприклад, таблетки, капсули, порошки, композиції з затриманим вивільненням, розчини, суспензії, емульсії, супозиторії, креми, мазі, лосьйони, аерозолі, пластирі або т.і., переважно у одиничних дозованих формах, прийнятних для простого введення точних дозувань. Фармацевтичні композиції згідно із даним винаходом, як правило, включають звичайний фармацевтичний носій або наповнювач і можуть додатково включати інші лікарські засоби, наприклад носії, ад'юванти, добавки і т.і.. Переважно, композиція повинна містити приблизно від 0,5 до 75ваг.% сполуки або сполук відповідно до винаходу, із залишком, що складається в основному з прийнятних фармацевтичних наповнювачів. Для перорального введення, такі наповнювачи включають фармацевтично чистий маніт, лактозу, крохмаль, стеарат магнію, сахарин натрію, тальк, целюлозу, глюкозу, желатин, сахарозу, карбонат магнію, і т.і. За бажанням композиція може також містити незначні кількості нетоксичних допоміжних речовин, таких, як змочувальні речовини, емульгатори або буфери. Рідкі композиції можна одержувати розчиненням або диспергуванням сполук (приблизно від 0,5ваг.% до 20ваг.% або більш), і додаткових фармацевтичних ад'ювантів, у носії, як, наприклад, водний соляний розчин, водна декстроза, гліцерин або етанол, з одержанням розчину або суспензії. Для застосування в пероральному рідкому лікарському засобі композицію можна одержувати у вигляді розчину, суспензії, емульсії або сиропу, що поставляється як у рідкій, так і в сухій формі, що підходить для гідратації у водному або нормальному саліні. Коли композиція використовується у формі твердих рецептур для перорального введення, рецептури можуть бути таблетками, гранулами, 22 порошками, капсулами або т.і. Для формування таблетки, композицію зазвичай виготовляють з добавками, наприклад, наповнювачами, такими як рецептури цукрів або целюлози, зв'язувальною речовиною, наприклад пастою крохмалю або метилцелюлозою, наповнювачем, дезінтегратором і іншими добавками, звичайно використовуваними при виготовлені медичних препаратів. Композиція для ін'єкції для парентерального введення, як правило, містить сполуку у вигляді прийнятного внутрішньовенного розчину, наприклад стерильного фізіологічного розчину солі. Композицію можна також одержати у вигляді суспензії в ліпідній або фосфоліпідній або в ліпосомальній суспензії, або у водній емульсії. Способи одержання подібних форм дозування відомі або очевидні фахівцям у даній області техніки; наприклад, [див. ReMington's Pharmaceutical Sciences (17th Ed., Mack Pub. Co, 1985)]. Композиція, що вводиться, буде містити вибрану сполуку у фармацевтично ефективній кількості з одержанням у суб'єкта підвищення струмів АМРА рецепторів. Наступні далі приклади ілюструють, але ніяким чином не обмежують винахід. Якщо не згадано інше, усі температури приводяться в градусах Цельсія. Якщо не згадано інше, усі спектри ЯМР представляють спектри 1Н ЯМР і отримані в дейтерохлороформі або дейтерованому диметилсульфоксиді як розчиннику, тетраметилсилані як внутрішній стандарт. Інфрачервоні (ІЧ) спектри знімали як тонкі плівки на кристалі Френеля, на кристалах NaCI або таблетці KВr в ATI Mattson Gemini серії ФІЧ. Усі назви сполук відповідають IUPAC класифікації, як передбачено [програмним забезпеченням Chemistry 4-D DrawÔ Рrо3.0 від ChemInnovation Software, Inc]. Приклад 1 (R,S),(R,S)-3aH,9aH-піролідино[2,1b]піролідино[2",1"-2',3'](1,3-оксазино)[5',6'2,1]бензо[4,5-е]3-оксапергідроїн-6,12-діон Метод А: 2,5-Дигідрокситерефталеву кислоту (3,75г, 18,9ммоль) додавали до розчину карбонілдіімідазолу (6,20г, 38,2ммоль) в 50мл безводного диметилформаміду. Розчин перемішували при кімнатній температурі протягом 24 годин, протягом цього часу додавали 4амінобутиральдегіддіетилацеталь (6,30г, 39,0ммоль). Розчин додатково перемішували протягом 24 годин при кімнатній температурі, і потім швидко нагрівали до 80°С. Розчинник видаляли вакуумною дистиляцією і залишок очищали флешхроматографією (гексан:етилацетат 2:1) на силікагелі з одержанням 4,0г неочищеного бісацеталь/аміду. Проміжний продукт розчиняли в 125мл метиленхлориду, до якого додавали 2,0мл три 23 79940 фтороцтової кислоти, 20мг камфорсульфонової кислоти й активовані 4А молекулярні сита. Як показала тонкошарова хроматографія, реакція швидко завершувалася. Неочищений продукт хроматографували на силікагелі (гексан:етилацетат 95:5) з одержанням 1,9г твердої речовини, що розчиняли в метиленхлориді (250мл) і фільтрували. Концентрували розчин до 50мл, розчиняли в діетиловому етері, промотуючи кристалізацію. Розчин охолоджували до 0°С и збирали фільтруванням 1,06г (19%) білої твердої речовини. Т.пл.=270271°С. ІЧ: 2977, 2880, 1667, 1453, 1422, 1335, 1181, 1073, і 780 см-1. 1Н ЯМР (500МГц) d 7,55 (1Н, с) 7,53 (1Н, с), 5,47 (2Н, м) 3,86 (2Н, м), 3,62 (2Н, м), 2,44 (2Н, м), 2,27 (2Н, м), 2,12 (2Н, м) і 1,96м.ч. (2Н, м). Метод Б: Діетил 2,5-дигідрокситерефталат (500мг, 1,97ммоль) і 4-амінобутилальдегіддіетилацеталь (³90 %) (1,30г, ³7,2ммоль) об'єднували і нагрівали із зворотнім холодильником протягом 90 секунд. Реакційну суміш охолоджували до температури навколишнього середовища і потім розчиняли 10мл СН 2СІ2. До реакційної суміші додавали трифтороцтову кислоту (2,0мл) і 5А молекулярні сита, що швидко нагрівали із зворотнім холодильником і залишали на 2 години. Цю суміш концентрували на силікагелі при пониженому тиску і елюювали етилацетатом. Фракції концентрували при пониженому тиску з одержанням 420мг (71%) продукту у вигляді білої твердої речовини з фізичними і спектроскопічними характеристиками, в основному ідентичними описаним для продукту, о триманого Методом А, ви ще. Приклад 2 (R,S),(R,S)-3аН,6аН-піролідино[2,1b]піролідино[2",1"-3',2'](1,3-оксазино)[6',512,1]бензо[4,5-е]1,3-оксапергідроїн-10,12-діон До гарячої (40°С) суспензії 2,4дигідроксиізофталевої кислоти (500мг, 2,5ммоль) у розчині SOCI2 (8,0мол, 100ммоль) і 2мл сухого СНСІ3 додавали 3 краплі ДМФА. Реакційну суміш нагрівали протягом 1,5 годин, протягом цього часу вона ставала прозорою. Розчин концентрували при пониженому тиску, розчиняли з СН2СІ2 і концентрували при пониженому тиску. Залишок розчиняли в 10мл сухого СНСІ3, до якого додавали по краплях 4-амінобутиральдегіддіетилацеталь (1,00г, 6,2ммоль). Після охолодження розчину до 0°С до суміші додавали 2,0мл триетиламіну, що залишали нагріватися до температури навколишнього середовища. Через 1 годину розчин розбавляли СН 2СІ2, промивали послідовно 10% НСІ, насиченим NaHCO3, насиченим NaCI, і потім висушували над Na2SO4. Одержане масло концентрували при пониженому тиску і повторно розчиняли в 10мл сухого СНСІ3, до якого додавали 30мг камфорсульфонової кислоти. Реакційну суміш 24 перемішували протягом 12 годин і потім концентрували на силікагелі при пониженому тиску. Після елюювання EtOAc/МеОН (99:1) одержали 270мг (36%) білого прозорого порошку з наступними властивостями: Т.пл.=248-252°С. ІЧ:1673, 1432, 1356 і 1138 см -1. 1Н ЯМР (500МГц) d 8,58 (0,5Н, с), 8,52 (0,5Н, с), 6,51 (1Н, м), 5,50 (2Н, м) 3,80-3,85 (2Н, м), 3,60-3,65 (2Н, м), 2,40-2,45 (2Н, м), 2,202,30 (2Н, м), 2,05-2,15 (2Н, м) і 1,90-2,00 м.ч. (2Н, м). Приклад 3 (R,S)-Метил-9-оксо-3аНбензо[е]піролідино[2,1-b]1,3-оксазапергідроїн-6карбоксилат Триметилалюміній (2,0мл 2Μ в толуолі, 4,0ммоль) додавали до розчину 810мг диметил гідрокситерефталату (3,85ммоль) у 15мл сухого СНСІ3, що перемішували протягом 20 хвилин. Додавали 4-амінобутиральдегіддіетилацеталь (750мг, 4,65ммоль), і реакційну суміш нагрівали із зворотнім холодильником протягом 6 годин. Трифтороцтову кислоту (2,0мл) і 5А молекулярні сита додавали до охолодженого розчину, що швидко нагрівали із зворотнім холодильником і витримували протягом 30 хвилин. Реакційну суміш концентрували на силікагелі при пониженому тиску і елюювали гексан/EtOAc (1:1) з одержанням 387мг згаданого бензоксазину у вигляді білої твердої речовини з Т.пл.=76-78°С. ІЧ: 1725, 1672, 1439,1291, 1212 і 1088 см -1. 1Н ЯМР (200МГц) d 8,01 (1Н, д, J=8,0Гц), 7,77 (1Н, дд, J=8,0, 1,5 Гц), 7,64 (1Н, д, J=1,5Гц), 5,53 (1Н, т, J=5,7Гц), 3,94 (3Н, с), 3,80-3,92 (3Н, м) і 1,80-2,60м.ч. (3Н, м). Приклад 4 (R,S)-MeTMn 9-оксо-3аН-бензо[3,4е]піролідино[2,1-b]1,3-оксапергідроїн-7карбоксилат Диметил 4-гідроксиизофталат (1,00г, 4,8ммоль) і 4-амінобутиральдегіддіетилацеталь (1,60г, 10ммоль) об'єднували і нагрівали із зворотнім холодильником протягом 90 секунд. Суміш охолоджували до температури навколишнього середовища і розчиняли в 10мл СНСІ3. До розчину додавали трифтороцтову кислоту (1,0мл) і 5А молекулярні сита, що перемішували протягом 2 годин. Після концентрації на силікагелі при пониженому тиску і елюювання гексан/EtOAc (2:1) одержали 500мг (42%) білої твердої речовини з Т.пл.=164-166°С. ІЧ: 1711, 1669, 1615, 1445 і 1285 см -1. 1Н ЯМР (200МГц) d 8,62 (1Н, д, J=2,2Гц), 8,12 25 79940 (1Н, дд, J=8,7 d 2,2 Гц), 7,02 (1Н, д, J=8,6Гц), 5,55 (1Н, т, J=5,66Гц), 3,92 (3Н, с), 3,50-3,90 (3Н, м) і 1,80-2,60м.ч. (3Н, м). Приклад 5 (R,S)-6-(Піперидилкарбоніл)-3аНбензо[е]піролідино[2,1-b]1,3-оксапергідроїн-9-он (R,S)-Метил-9-оксо-3аНбензо[е]піролідино[2,1-b]1,3-оксазапергідроїн-6карбоксилат (Приклад 3, вище) (387мг, 1,56ммоль) розчиняли в 10мл сухого СНСІ3, до якого додавали триметилалюміній (2,0мл 2М в толуолі, 4,0ммоль), потім 400мг піперидину (4,7ммоль). Реакційну суміш нагрівали із зворотнім холодильником протягом 3 годин, охолоджували до температури навколишнього середовища і гасили оцтовою кислотою. Після концентрації на силікагелі при пониженому тиску і елюювання EtOAc/МеОН (99:1) одержали 300мг білої прозорої твердої речовини з Т.пл.=149151°С. ІЧ: 1670, 1632 і 1440 см -1. 1Н ЯМР (200МГц) d 7,96 (1Н, д, J=7,9Гц), 7,12 (1Н, д, J=7,9Гц), 7,00 (1Н, с), 5,51 (1Н, т, J=5,6Гц), 3,50-4,00 (4Н, м), 3,15-3,40 (2Н, м), 1,80-2,60 (4Н, м) і 1,40-1,60м.ч. (6Н, м). Приклад 6 (R,S)-6а-гідро-3аН-піролідино[2,1b]піролідино[2',1'3]хіназоліно[7,6-е]1,3оксазапергідроїн-6,12-діон Гідрокситерефталеву кислоту (4,0г, 22ммоль) розчиняли в 200мл тетрагідрофурану, до якого додавали надлишок діазометану в діетиловому етері. Реакційну суміш гасили оцтовою кислотою, розчиняли СН 2СІ2, концентрували на силікагелі при пониженому тиску, і елюювали гексан/EtOAc (4:1) з одержанням 4,40г продукту у вигляді воскоподібної твердої речовини з Тпл.=69-75°С. ІЧ: 1720, 1678, 1436, 1319, 1212 і 1109 см -1. Диметил гідрокситерефталат (3,00г, 14,3ммоль) охолоджували до 5°С и перемішували з 7мл азотної кислоти, що димить, протягом 40 хвилин. Реакційну суміш виливали на лід і екстрагували етилацетатом. Органічний шар промивали рН 7 фосфатним буфером, насиченим NaCI і висушували над безводним Na2SO4. Розчинник видаляли при пониженому тиску з одержанням 3,0г неочищеного диметил-2-гідрокси-4нітротерефталату. ІЧ: 1739, 1688, 1549, 1442, 1338 і 1254 см -1. Диметил-2-гідрокси-4-нітротерефталат (3,0г, 11,8ммоль) відновлювали в 25мл МеОН у пляшці 26 для гідрування Парра p 90мг 10% Pd-C під воднем (70псі) протягом 3 годин. Каталізатор видаляли фільтруванням, і розчин концентрували на силікагелі при пониженому тиску. Після елюювання гексан/EtOAc (2:1) одержували 1,20г диметил 2 аміно4-гідрокситерефталату у вигляді жовтої речовини, що використовували без подальшого очищення. РОСl3 (0,95г, 6,2ммоль) додавали до розчину, що перемішується, 2-піролідинону (1,00г, 11,8ммоль) у 10мл сухого бензолу. Через 2 години додавали 1,20г диметил 2-аміно-4гідрокситерефталату (5,3ммоль), і суміш нагрівали із зворотнім холодильником протягом 5 годин. Реакційну суміш розчиняли в СН2СІ2, промивали насиченим NaHCO3 і концентрували при пониженому тиску на силікагелі. Після елюювання EtOAc/МеОН (99:1) одержували 537мг 9-карбоксиметил-8гідрокси-2,3-дигідро-1Н-піроло[2,1-b][1,3]-хіназолін6-ону у вигляді білої речовини. ІЧ: 1691, 1678, 1471,1440 і 1249 см'1. ЯМР (200 МГц) δ 10,60 (1Н, с), 8,21 (1Н, с), 7,80 (1Н, с), 4,19 (2Н, т, J=7,2Гц), 4,02 (3Н, с), 3,15 (2Н, т, J=7,9Гц) і 2,20-2,40м.ч. (2Н, м). 9-карбоксиметил-8-гідрокси-2,3-дигідро-1Нпіроло[2,1-b][1,3]хіназолін-6-он (530мг, 2,0ммоль) і 4-амінобутиральдегіддіетилацеталь (1,00г, 6,2ммоль) об'єднували і нагрівали із зворотнім холодильником протягом 90 секунд. Охолоджену реакційну суміш розчиняли в СН 2СІ2, до якого додавали 2,0мл трифтороцтової кислоти і 5А молекулярні сита. Суміш перемішували протягом 1 години, концентрували на силікагелі при пониженому тиску, і елюювали EtOAc/МеОН (90:10). У результаті знебарвлення розчину деревним вугіллям у СНСІ3/МеОН і видалення розчинників при пониженому тиску одержували 600мг продукту (99%) у вигляді білої речовини з Т.пл.=245-250°С. ІЧ: 1681, 1660, 1464, 1209 і 1137 см -1. 1Н ЯМР (200МГц) d 8,21 (1Н, с), 7,80 (1Н, с), 5,58 (1Н, т, J=5,8Гц), 4,20 (2Н, т, J=7,3Гц), 3,753,95 (1Н, м), 3,55-3,70 (1Н, м), 3,19 (2Н, т; J= 8,0Гц) і 1,90-2,60м.ч. (6Н, м). Приклад 7 (R,S)-етил 7-гідрокси-9-оксо-3аНбензо[е]піролідино[2,1-b]1,3-оксазин-6-карбоксилат Діетил 2,5-дигідрокситерефталат (7,00г, 27,5ммоль) і 4-амінобутиральдегіддіетилацеталт (7,00г, 43,4ммоль) поміщали у велику пробірку і збезводнювали протягом 5 хвилин. Реакційну суміш виливали у воронку для розділення і перемішували з 800мл EtOAc і 100мл 6N НСІ. Через 30 хвилин органічний шар висушували над Na2SO4 і розчинник випарювали до одержання жовтого масла, що очищали на силікагелі до одержання 4,90г (64%) безбарвних, пухких кристалів згаданої сполуки з Т.пл.=139-141°С. ІЧ: 1676, 1454, 1240 і 1200 см -1. 1Н (200МГц) d 10,48, (1Н, с), 7,54 (1Н, с), 7,47 27 79940 (1Н, с), 5,46 (1Н, т, J=5,6Гц), 4,42 (2Н, к, J=7,2Гц), 3,75-3,95 (1Н, м), 3,50-3,70 (1Н, м), 1,80-2,60 (4Н, м) і 1,42м.ч. (3Н, т, J=7,2Гц) Приклад 8 (R,S)-7-(Піперидилкарбоніл)-3аНбензо[е]піролідино[2,1-b]1,3-оксазапергідроїн-9-он Триметилалюміній (1,1мл 2М в толуолі, 2,2ммоль) і 400мг піперидину (4,7ммоль) додавали до розчину 500мг метил 9-оксо-3аН-бензо[3,4е]піролідино[2,1-b]1,3-оксазин-7-карбоксилату (2,0ммоль) у 10мл сухого СНСІ3. Реакційну суміш нагрівали із зворотнім холодильником протягом 4 годин, охолоджували до температури навколишнього середовища, і гасили оцтовою кислотою. Суміш концентрували на силікагелі при пониженому тиску і елюювали гексан/EtOAc (1:1), з одержанням 537мг (90%) білої твердої речовини з Т.пл.=34-136°С. ІЧ: 1673, 1626, 1434 і 1255 см -1. 1Н ЯМР (200МГц) d 7,96 (1Н, д, J=2,0Гц), 7,53 (1Н, дд, J=8,4, 2,2 Гц), 7,00 (1Н, д, J=8,4Гц), 5,52 (1Н, т, J=5,7Гц), 3,20-4,00 (6Н, м) і 1,40-2,60м.ч. (10Н, м). Приклад 9 (R,S)-(7-метокси-9-оксо(3аНбензо[е]піролідино[2,1-b]1,3-оксазин-6-іл))-N,Nдиметилкарбоксамід До 1,6г (5ммоль) гідрохлориду диметиламіну в 60мл сухого СН 2СІ2 додавали 10мл 2,0Μ АІМе3 у толуолі при перемішуванні під Аr. Потім додавали п'ять ммоль (1,4г) естеру за Прикладом 7 у 40мл СН2СІ2 і кип'ятили із зворотнім холодильником протягом 0,5 годин, протягом цього часу СН 2СІ2 дистилювали і заміщали 40мл сухого толуолу. Після кип'ятіння протягом наступної години реакційну суміш змішували з 50мл 3Μ НСІ. Після розділення шарів водний шар екстрагували з 3´50мл СН2СІ2. Об'єднані органічні шари висушували над NaSO4, і розчинник видаляли у вакуумі з одержанням 810мг неочищеного феноламіду (58% вихід). ІЧ: 1652см -1. ХІ-МС 277,2 amu (M+H). До продукту аміду, отриманому вище, (810мг, 2,9ммоль) у 40мл безводного диметилформаміду під аргоном, відразу додавали 174мг (4,35ммоль) 60% Na, при гарному перемішуванні. Через 10 хвилин при кімнатній температурі, температуру ванни підвищували до 65°С, і відразу додавали 0,25мл Mel (11,6ммоль). Через 2 години реакційну суміш о холоджували до температури навколишнього середовища і гасили 5мл води. Потім воду і диметилформамід видаляли під вакуумом, і залишок хроматографували на 150г силікагелю EtOAc. Об'єднані фракції дали 600мг (71%). ІЧ: 1666 і 28 1620 см-1. ХІ-МС 291,2 (М+Н). 1Н ЯМР (500МГц) d 7,43 (1Н, с), 6,88 (1Н, с), 5,49 (1Н, м), 3,86 (3Н, с), 3,84 (1Н, м), 3,68 (1Н, м), 3,11 (3Н, с), 2,84 (3Н, с), 2,49 (1Н, м), 2,24 (1Н, м), 2,16 (1Н, м) і 1,95м.ч. (1Н, м). Приклад 10 (R,S)-N-(2-гідроксиетил) (7-гідрокси-9оксо(3аН-бензо[е]піролідино[2,1-b]1,3оксазапергідроїн-6-іл))карбоксамід Етил 7-гідрокси-9-оксо-3аНбензо[е]піролідино[2,1-b]1,3-оксазин-6-карбоксилат (Приклад 7 вище) (1,20г, 4,83ммоль) і етаноламін (1,00г, 16,3ммоль) об'єднували і нагрівали із зворотнім холодильником протягом 90 секунд. Охолоджену реакційну суміш розбавляли СНСІ3, підкислювали оцтовою кислотою і концентрували на силікагелі при пониженому тиску. Після елюювання СН2СІ2/МеОН (95:5) одержували 1,50г гідроксиетиламіду у вигляді воскоподібної твердої речовини. ІЧ: 3000-3500, 1650,1562, 1470, 1344, 1264, 1211 і 1066 см -1. Приклад 11 (R,S),(R,S)-2Н,3Н,12аН,6аН-1,3оксазолідино[2,3-b]піролідино[2",1"-2',3'](1,3оксазино)[5',6'-2,1]бензо[4,5-е]1,3-оксапергідроїн4,10-діон N-(2-Гідроксиетил) (7-гідрокси-9-оксо(3аНбензо[е]піролідино[2,1-b]1,3-оксазапергідроїн-6іл))карбоксамід (продукт із Прикладу 10) (1,50г, 5,13ммоль) суспендували в 20мл сухого СНСІ3 разом з 4,6мл триметилортоформіату (43ммоль) і 1,0мл 96% мурашиної кислоти (21ммоль) і нагрівали із зворотнімхолодильником протягом 6 годин. Охолоджену реакційну суміш нейтралізували карбонатом калію і концентрували на силікагелі при пониженому тиску. Після елюювання гексан/EtOAc (1:1) і перекристалізації з етилацетату одержували 430мг білої речовини з Т.пл.=285287°С. ІЧ: 1675, 1458 і 1421 см -1. 1Н ЯМР (200МГц) d 7,66 (0,5Н, с), 7,64 (0,5Н, с), 7,54 (0,5Н, с), 7,51 (0,5Н, с), 6,22 (0,5Н, с), 6,21 (0,5Н, с), 5,45-5,53 (1Н, м), 4,20-4,40 (3Н, м), 3,75-3,95 (1Н, м), 3,553,70 (2Н, м) і 1,90-2,58м.ч. (4Н, м). Приклад 12 (R,S),(R,S)-2H,3H,8H,9H,12aH,6aH-1,3оксазолідино[2,3-b]1,3-оксазолідино[2",3"-2',3'](1,3оксазино)[5',6'-2,1]бензо[4,5-е]1,3-оксапергідроїн4,10-діон 29 79940 Діетил 2,5-дигідрокситерефталат і етаноламін змішували і нагрівали із зворотнім холодильником протягом 90 годин. Охолоджену суміш розчиняли в хлороформі, метанолі і оцтовій кислоті і концентрували на силікагелі при пониженому тиску. Елюювання СН2СІ2/МеОН (90:10) дало 1,20г неочищеного бісаміду. Неочищений амід суспендували в 20мл сухого СНСІ3 разом з 4,6мл триметилортоформіату (43ммоль) і 1,0мл 96% мурашиної кислоти (21ммоль) і кип'ятили із зворотнім холодильником протягом 6 годин. Охолоджену суміш нейтралізували з карбонатом калію і концентрували на силікагелі при пониженому тиску. Продукт елюювали і кристалізували з етилацетату з одержанням 88мг білого порошку (3,5%) з Т.пл.=305306°С. ІЧ: 1675, 1458 і 1421 см -1. 1Н ЯМР (200МГц) d 7,62, (0,5Η, с), 7,60 (0,5Η, с), 6,24 (0,5Η, с), 6,23 (0,5Η, с), 4,20-4,42 (6Н, м) і 3,50-3,70м.ч. (2Н, м). Приклад 13 (R,S),(R,S)-1aH,4aH-піперидино[2,1b]піперидино[2",1"-2',3'](1,3-оксапергідроїно)[5',6'4,5]бензо[е]1,3-оксазин-7,14-діон Синтез проводили в основному, як у Прикладі 1, Метод А, за винятком заміни 5амінопентанальдіетилацеталем 41 амінобутиральдегіддіетилацеталю. Н ЯМР (200МГц) d 7,502 (с), 7,493 (с), 5,19 (2Н, дд, J=4,18 і 9,6 Гц), 4,47 (2Н, дм, J=14Гц), 2,78 (2Н, тм, J=13Гц), 2,24 (2Н, м), 1,85 (6Н, м) і 1,51м.ч. (4Н, м). Приклад 14 Одержання (R,S)-6-(морфолін-4-ілкарбоніл)3аН-бензо[е]піролідино[2,1-b]1,3-оксазин-9-ону До розчину метил 9-оксо-3аНбензо[е]піролідино[2,1-b]1,3-оксазапергідроїн-6карбоксилату (сполука Прикладу 3) у 20мл метанолу в колбі Ерленмеєра об'ємом 125мл додавали 20мл 1N NaOH. Після енергійного перемішування протягом 30 хвилин розчин окисляли до рН 2 використовуючи 1N НСІ. Отриманий білий осад відфільтровували і промивали 25мл води. Цю тверду речовину повторно розчиняли в етилацетат/метанол (1/1) і висушували над безводним Na2SO4. Розчин концентрували з одержанням 30 703мг (81%) білої твердої речовини. ІЧ: 1712 і 1637 см -1. До суспензії 9-оксо-3аНбензо[е]піролідино[2,1-b]1,3-оксазин-6-карбонової кислоти (300мг, 1,29ммоль) у СН 2СІ2 додавали 1,1'-карбонілдіімідазол (209мг, 1,29ммоль) у колбу грушовидної форми об'ємом 25мл. Через 2 години додавали морфолін через шприц. Отриману реакційну суміш перемішували протягом 30хв і потім промивали 1N НСІ, насиченим NaHCO3 і соляним розчином. Потім органічний шар висушували над Na2SO4, відфільтровували і концентрували з одержанням 375мг піни. Продукт очищали хроматографією на силікагелі після елюювання етилацетатом з одержанням 330мг сірувато-білих кристалів (85%) з Т.пл.=184-186°С. ІЧ: 1669 і 1636 см-1.1Н ЯМР d 7,98 (1Н, д, J=7,5Гц), 7,10 (1Н, д, J=8,9Гц), 6,99 (1Н, д, J=1,4Гц), 5,51 (1Н, т, J=6Гц), 3,85 (1Н, м), 3,78 (4Н, шс), 3,60 (1Н, м), 3,60 (2Н, шс), 3,40 (2Н, шс), 2,45 (1Н, м), 2,27 (1Н; м), 2,13 (1H, м) i 1,98м.ч. (1Н, м). Приклад 15 Одержання (R,S)-6-[(4гідроксипіперидил)карбоніл]-3аНбензо[е]піролідино[2,1-b]1,3-оксазин-9-ону До суспензії 9-оксо-3аНбензо[е]піролідино[2,1-b]1,3-оксазин-6-карбоновой кислоти (160мг, 0,689ммоль) у 2мл дихлорметану в колбі грушовидної форми об'ємом 25мл додавали 1,1'-карбонілдіімідазол (112мг, 0,689ммоль). Перемішування проводили при позитивному тиску аргону, і протягом 1 години досягали повного розчинення. Розчин перемішували ще 2 години і потім повільно додавали до розчину, що перемішується, через шприц 4-гідроксипіперидин (148мг, 3,44ммоль) у 5мл СН 2СІ2. Отриману реакційну суміш промивали 1Ν НСІ, насиченим NaHCO3 і соляним розчином. Органічний шар висушували над безводним Na2SO4, відфільтровували і концентрували з одержанням 174мг білої піни. Піну кристалізували з CH2CI2/Et2 O з одержанням 158мг білої твердої речовини (72%) з Т.пл.=130-135°С. ІЧ: 3400,1657 і 1619 см -1. 1Н ЯМР d 7,96 (1Н, д, J=7,6Гц), 7,10 (1Н, д, J=7,6Гц), 7,00 (1Н, с), 5,51 (1Н, т, J=6,0Гц), 4,16 (1Н, шс), 3,99 (1Н, м), 3,86 (1Н, м), 3,63 (1Н, м), 3,60 (1Н, шс), 3,42 (1Н, шс), 3,17 (1Н, шс), 2,45 (1Н, м), 2,27 (1Н, м), 2,13 (1Н, м), 2,0 (1Н, шс), 1,99 (1Н, м), 1,61 (2Н, шс) і 1,49м.ч. (1Н, шс). Приклад 16 Одержання (R,S)-6-[(4метилпіперазиніл)карбоніл-3аНбензо[е]піролідино[2,1-b]1,3-оксазин-9-ону 31 79940 Слідуючи методиці одержання сполуки за прикладом 14, заміняли 1-метилпіперазином морфолін з одержанням 378мг (94%). ІЧ: 1666 і 1633 см -1. 1 Н ЯМР d 7,97 (1Н, д), 7,10 (1Н, д), 7,00 (1Н, с), 5,51 (1Н, т), 3,86 (1Н, м), 3,79 (2Н, шс), 3,62 (1Н, м), 3,39 (1Н, шс), 2,48 (4Н, м), 2,32 (3Н, с), 2,25 (2Н, м), 2,13 (1Н, м) і 1,96 м.ч. (1Н, м). Приклад 17 Одержання (R,S)-6-[(4амінопіперидил)карбоніл]-3аНбензо[е]піролідино[2,1-b]1,3-оксазин-9-ону У 3-горлукруглодонну колбу, споряджену термометром завантажували азид натрію (3,25г, 50,0ммоль) і теплу Н 2О (3,25мл). Отриману пасту енергійно перемішували і додавали 20мл бензолу. Отриманий гетерогенний розчин охолоджували до 5°С и потім по краплях додавали H2SO4 (1,34мол, 25,0ммоль). Температуру розчину підтримували нижче 10°С, і перемішування продовжували протягом ще 5хв. Органічний шар фільтрували в колбу Ерленмеєра, висушували над безводним Na2SO4, і використовували в наступній реакції. Діізопропілазодикарбоксилат додавали через шприц до розчину 4-гідроксипіперидину (2,0г, 20ммоль) і трифенілфосфіну (6,75г, 25,7ммоль) у СН2СІ2. Спочатку додавали частина розчину гідразойної кислоти з вищезгаданого отриманого киплячого розчину і тому розчин охолоджували на бані з льодом під час додавання залишку. Перемішування продовжували на бані з льодом, що залишали нагріватися до температури навколишнього середовища. Після перемішування при температурі навколишнього середовища протягом 16 годин розчин промивали Н 2О, далі 1N НСІ. Кислий розчин промивали Et2O/EtOAc (2/1), і потім робили основним рН 9 використовуючи 1N NaOH. Отриманий мутний водний розчин екстрагували СН 2СІ2. Органічний шар висушували над Na2SO4, фільтрували і концентрували з одержанням 1,05г жовтого масла (42%). ІЧ: 2092см-1. Неочищений продукт використовували без подальшого очищення на наступній стадії, що відповідала методиці за Прикладом 14 вище з заміною 4-азидопіперидином морфоліну. Неочищений продукт очищали хроматографією на силікагелі елюювали 3/1 гексан/етилацетат, одержуючи 304мг 6-[(4азидопіперидил)карбоніл]-3аНбензо[е]піролідино[2,1-b]1,3-оксазин-9-ону у вигляді піни (73 %). ІЧ: 2095,1670 і 1636 см -1. 32 У колбу Парра об'ємом 50мл, попередньо промиту аргоном, додавали 10% Pd/C (90мг), потім розчин 304мг 6-[(4-азидопіперидил)карбоніл]3аН-бензо[е]піролідино[2,1-b]1,3-оксазин-9-ону (0,891ммоль) у 5мл МеОН. Отриманий розчин обробляли воднем при 25псі протягом 2 годин, фільтрували через целіт і концентрували у вакуумі. Залишок очищали хроматографією на силікагелі, використовуючи як елюент 15/1 СН2СІ2/МеОН (1% NH4OH) з одержанням 220мг чистого продукту. 1Н ЯМР (500МГц) d 7,96 (1Н, д, J=7,7Гц), 7,09 (1Н, д, J=8,5Гц), 6,99 (1Н, с), 5,51 (1Н, т, J=5,9Гц), 4,57 (1Н, шд), 3,85 (1Н, м), 3,67 (1Н, шс), 3,63 (1Н, м), 3,04 (1Н, шс), 2,98 (1Н, м), 2,94 (1Н, шс), 2,45 (1Н, м), 2,27 (1Н, м), 2,13 (1Н, м), 1,95 (1Н, м), 1,95 (1Н, шс), 1,77 (1Н, шс), 1,39 (1Н, шс) і 1,26м.ч. (1Н, шс). Приклад 18 Одержання (R,S)-6-[(4метилпіперидил)карбоніл]-3аНбензо[е]піролідино[2,1-b]1,3-оксазин-9-ону У 2-горлу 100мл круглодонну колбу, споряджену зворотнім холодильником, додавали етил 9оксо-3аН-бензо[е]піролідино[2,1-b]1,3оксапергідроїн-6-карбоксилат (343мг, 1,41ммоль) і 20мл СН 2СІ2 під атмосферою аргону. У розчин, що перемішується, додавали триметилалюміній (1,5мол, 3,0ммоль) і через 30 хвилин додавали через шприц 4-метилпіперидин (0,19мол, 2,9ммоль). Після того, як розчин нагрівали із зворотнім холодильником протягом 24 годин, залишали при температурі навколишнього середовища на ще 72 години, його гасили Н2О, потім повільно додавали 6N НСІ. Органічний шар ізолювали, а водний шар екстрагували трьома 50мл частинами СН2СІ2, що об'єднували з органічним шаром і промивали водою, соляним розчином, висушували над Na2SO4, відфільтровували і концентрували. Отримане масло очищали хроматографією на силікагелі, використовуючи як елюент 1:1 гексан/етилацетат. Чисті фракції концентрували з одержанням 323мг піни (54%) ІЧ: 1668 і 1625 см -1. 1 Н ЯМР (500МГц) d 7,96 (1Н, д, J=7,5Гц), 7,09 (1Н, д), 6,99 (1Н, с), 5,51 (1Н, т, J=6,0Гц), 4,66 (1Н, шд), 3,86 (1Н, м), 3,62 (2Н, м), 2,96 (1Н, шт), 2,76 (1Н, шт), 2,44 (1Н, м), 2,27 (1Н, м), 2,12 (1Н, м), 1,94 (1Н, м), 1,77 (1Н, шд), 1,65 (2Н, м), 1,22 (1Н, м), 1,08 (1Н, м) і 0,98 м.ч. (3Н, д, J=6,3Гц). Приклад 19 Одержання (R,S)-1-[(9-оксо-ЗаНбензо[е]піролідино[2,1-b]1,3-оксазин-6іл)карбоніл]піперидин-4-карбонітрилу 33 79940 Слідуючи методиці одержання сполуки з Прикладу 14, за винятком заміни 4-ціанопіперидином морфоліну, одержували 1-[(9-оксо-3аНбензо[е]піролідино[2,1-b]1,3-оксазин-6іл)карбоніл]піперидин-4-карбонітрил у вигляді білої кристалічної речовини (61%). Т.пл.=154-156°С. ІЧ: 1667 і 1633 см-1. 1Н Я МР d 7,98 (1Н, д, J=7,5Гц), 7,08 (1Н, д, J=7,4Гц), 6,98 (1Н, с), 5,52 (1Н, т, J=5,96Гц), 3,92 (1Н, шс), 3,86 (1Н, м), 2,27 (1Н, м), 2,14 (1Н, м), 1,96 (1Н, м) і 1,85 м.ч. (4Н, шс). Приклад 20 Одержання (R,S),(R,S)-3-(гідроксиметил)-6аНхромано[7,6-е]піролідино[2,1-b]1,3-оксазин-4,10діону Ізоксазолин відповідно до Прикладу 18 (570мг, 2,00ммоль) розчиняли в 100мл метанолу. Додавали розчин борної кислоти (1,00г) у 20мл води і 1,00г нікелю Ренея, і отриману суміш обробляли воднем при 1атм протягом 2 годин при кімнатній температурі. Метанол випарювали, і залишок екстрагували 200мл EtOAc, що висушували над Na2SO4. Випарювання розчинника дало 420мг масла, що очи щали на силікагелі елююванням 20% гексан/EtOAc. У результаті кристалізації з розчинника елюювання одержали 202мг кетону у вигляді жовтої твердої речовини з Т.пл.=189-190°С. МС: 290,1 (М+1). ІЧ: 1667 і 1450 см -1. 1Н ЯМР (500МГц) d 7,57 (1Н, с), 7,56 (1Н, с), 7,47, (2Н, с), 5,43-5,46 (2Н, м), 4,39-4,62 (4Н, м), 3,99-4,06 (4Н, м), 3,603,88 (4Н, м), 3,00-3,05 (2Н, м) і 1,92-2,47м.ч. (8Н, м), що підтверджують стр уктур у сполуки. Приклад 21 Одержання 3,8-діетил-2Н,7Н-1,3оксазапергідроїно[5',6'-4,5]бензо[е]1,3-оксазин-4,9діону До 840мг (3,0ммоль) діетил 2,5дигідрокситерефталату в 100мл безводного СНСІ3 під аргоном при 0°С додавали при перемішуванні 10мл (20ммоль) 2,0Μ АІМе3 у толуолі. Потім також додавали 5,0мл (77ммоль) безводного етиламіну. Під час обох додавань відбувалося виділення великої кількості газу. Реакційну суміш повільно на 34 грівали із зворотнім холодильником і потім кип'я тили із зворотнім холодильником під аргоном протягом 3 годин. У цій точці не було виявлено за допомогою тонкошарової хроматографії (1:1 EtOAc/гексан) ніякого вихідного матеріалу. Реакційну суміш охолоджували до температури навколишнього середовища і виливали в 200мл 3Μ НСІ. Шари відокремлювали, а водний шар екстрагували 3´100мл EtOAc. Об'єднані органічні шари висушували над Na2SO4 і розчинник видаляли у вакуумі з одержанням 600мг діаміду (79% вихід). 1Н ЯМР (500МГц) d 11,61 (2Н, с), 6,94 (2Н, с), 6,28 (2Н, шс), 3,51 (4Н, к) і 1,28м.ч. (6Н, т). До 4,9г (19,4ммоль) накопиченого діаміду 5,0г (56ммоль) триоксану і 4,6г (20ммоль) камфорсульфонової кислоти в 340мл розчинника (17% тетрагідрофуран/ССl4) додавали 10 крапель концентрованої H2SO4. Потім безбарвну реакційну суміш кип'ятили із зворотнім холодильником під аргоном при перемішуванні. Воду видаляли азеотропно з реакційної суміші під час кип'ятіння, при включенні 250мл додаткової трубки з бічним відгалуженням з 3А молекулярними ситами (100г) у паровому каналі. Через 18 годин молекулярні сита заміняли, додавали додаткову порцію 3,6г (40ммоль) триоксану, і кип'ятили із зворотнім холодильником протягом ночі. Наступного дня сита знову заміняли, додавали 3,8г (42ммоль) триоксану, і реакційну суміш кип'ятили із зворотнім холодильником протягом наступних 4 годин. В реакційній суміші кавового кольору не залишалась вихідна речовина, її охолоджували до 10-15°С на бані з льодом і потім змішували з 200мл крижаного 0,5Μ NaOH. Відділений органічний шар промивали 100мл Н 2О и висушували над Na2SO4. Після видалення розчинника у вакуумі одержали 2,5г неочищеного матеріалу, що хроматографували на 150г силікагелю, використовуючи 2л EtOAc, з одержанням 1,5г (28%) продукту з Т.пл.=236-237°С. Після перекристалізації з 3:1 Et2O/CH2Cl2 одержали 1,09г (20%) 3,8-діетил-1Н,7Н-1,3-оксапергідроїно[5',6'4,5]бензо[е]1,3-оксазин-4,9-дioне. ХІМС m/z = 220,1 і 277,2 amu. 1H ЯМР (500МГц) d 7,57 (1 Η, с), 5,16 (2Н, с), 3,60 (2Н, к, J=7,23Гц) і 1,25 (3Н, т, J=7,23Гц). Приклад 22 Одержання (R,S)-3-метил-2H,6аНпіролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[е]1,3-оксазапергідроїн-4,10-діону До 1,4г (5,1ммоль) етил 7-гідрокси-9-оксо-3аНбензо[е]піролідино[2,1-b]1,3-оксазин-6карбоксилату (продукт із Приклада 7) у 120мл сухого СНСІ3 (0°С водна баня) додавали 5,0мл (10ммоль) 2,0Μ АІМe 3 у СН2СІ2 і 6,0мл (12ммоль) 2,0Μ розчину метиламіну в тетрагідрофурані. Через 15 хвилин стабільного виділення газу водну баню заміняли масляною баньою, і реакційну су 35 79940 міш кип'ятили із зворотнім холодильником протягом 1,5 годин, потім швидко перемішували при кімнатній температурі. Після того, як додавали ще 6,0мл (12ммоль) розчину АІМе 3 і 6,0мл (12ммоль) метиламіну в тетрагідрофурані, реакційну суміш кип'ятили із зворотнім холодильником протягом 2 годин і виливали в 200мл 3Μ НСІ з повним перемішуванням. Відокремлений водний шар екстрагували 3´100мл СНСІ3, а об'єднані органічні шари висушували над MgSO4. Розчинники видаляли у вакуумі з одержанням 1,2г феноламіду з 91% виходом у вигляді воскоподібної твердої речовини. ХІМС: 263,3amu (М+1). ІЧ: 3319, 1652, 1608 і 1455 см -1. До 1,0г (3,8ммоль) вищезгаданого феноламіду в 300мл безводного СНСІ3 під аргоном при перемішуванні додавали 900мг (10,0ммоль) sтриоксану, потім 2,0г H2SO4. Реакційну суміш швидко кип'ятили із зворотнім холодильником, охолоджували до кімнатної температури і потім промивали 200мл насиченого NaHCO3. Водний шар екстрагували 4´100мл СН 2СІ2, а об'єднані органічні шари висушували над MgSO4. Розчинник видаляли у вакуумі з одержанням 900мг блідо-жовтого залишку, що хроматографували на 400г силікагелю (EtOAc), з одержанням 800мг (77%) безбарвного порошку. Т.пл.=195-196°С. ІЧ 1672 і 1454 см -1. ХІ-МС 275,3amu (Μ +1). 1Н-ЯМР (500МГц) d 7,57 (1Н, с), 7,54 (1Н, с), 5,47 (1Н, т, J=5,7Гц), 5,16 (2H, м), 3,83 (1Н, м), 3,65 (1Н, м), 3,12 (3Н, с), 2,45 (1Н, м), 2,26 (1Н, м), 2,14 (1Н, м) і 1,96м.ч. (1Н, м). Приклад 23 Одержання (R,S)-3-етил-2Н,6аНпіролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[е]1,3-оксапергідроїн-4,10-діону Синтез 3-етил-2Н,6аН-піролідино[2",1"3',2']1,3-оксазино[5',6'-4,5]бензо[е]1,3оксазапергідроїн-4,10-діону проводили в основному, як описано вище для Прикладу 22 із заміненням безводним етиламіном розчину метиламіну. Неочищений матеріал наносили на 50г силікагелю і елюювали EtOAc з одержанням чистого продукту з 61% виходом з Т.пл.=197-198°С. ІЧ: 1667 і 1451 см -1. ХІ-МС 289,2amu (М+Н). 1Н ЯМР (500МГц) d 7,57 (1Н, с), 7,54 (1Н, с), 5,47 (1Н, т, J=6,0Гц), 5,18 (2Н, м), 3,66 (1Н, м), 3,65 (2Н, м), 2,48 (1Н, м), 2,26 (1Н, м), 2,17 (1Н, м), 1,94 (1Н, м) і 1,22 м.ч. (3Н, т, J=7,2Гц). Приклад 24 Одержання (R,S)-3-пропіл-2Н,6аНпіролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[е]1,3-оксазапергідроїн-4,10-діону 36 Синтез 3-пропіл-2Н,6аН-піролідино[2",1"3',2']1,3-оксазино[5',6'-4,5]бензо[е]1,3оксазапергідроїн-4,10-діону проводили в основному, як описано вище для Прикладу 22 із заміненням н-пропіламіном розчину метиламіну з одержанням воскоподібного залишку, що хроматографували на силікагелі з одержанням безбарвної твердої речовини з Т.пл.=153-154°С. ІЧ (NaCI) 1667 і 1454 см-1. ХІ-МС 303,1amu (Μ+1). 1Н ЯМР d 7,58 (1Н, с), 7,54 (1Н, с), 5,45 (1Н, т, J=6,1Гц), 5,17 (2Н, м), 3,87 (1Н, м), 3,65 (1Н, м), 3,52 (2Н, м), 2,48 (1Н, м), 2,30 (1Η, м), 2,15 (1Η, м), 1,97 (1Н, м), 1,69 (1Н, м), 1,68 (2Н, м) і 0,99м.ч. (3Н, т, J=7,5Гц). Приклад 25 Одержання (R,S)-3-(метилетил)-2Н,6аНпіролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[е]1,3-оксазапергідроїн-4,10-діону Синтез 3-(метилетил)-2Н,6аН-піролідино[2",1"3',2']1,3-оксазино[5',6'-4,5]бензо[е]1,3оксазапергідроїн-4,10-діону проводили в основному як описано вище для Прикладу 22 із заміненням ізопропіламіном розчину метиламіну. Заключне очищення проводили колонковою хроматографією на силікагелі (35% вихід). Т.пл.= 04-205°С. ІЧ: 1664 і 1452 см -1. ХІ-МС 303,3аmu (М+1). 1Н ЯМР (500МГц) d 7,58 (1Н, с), 7,53 (1Η, с), 5,49 (1Н, т, J=5,9Гц), 5,14 (2Н, м), 4,87 (1Н, септ, J=4,9Гц), 3,88 (1Н, дт, J=11,6 і 7,3 Гц), 3,65 (1Н, м), 2,45 (1Н, м), 2,27 (1Н, м), 2,13 (1Н, м), 1,96 (1Н, м) і 1,26м.ч. (6Н, м). Приклад 26 Одержання (R,S)-3-циклопентил-2Н,6аНпіролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[е]1,3-оксапергідроїн-4,10-діону Синтез (R,S)-3-цикорпентил-2Н,6аНпіролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[е]1,3-оксазапергідроїн-4,10-діону проводили в основному як описано вище для Прикладу 22 з наступними виключеннями: нерозбавленим циклопентиламіном заміняли розчин метиламіну в тетрагідрофурані; толуол використовували як розчинник для реакції; замість кип'ятіння розчин шви 37 79940 дко нагрівали до 80°С. Остаточне очищення проводили хроматографією на колонці з силікагелем (56% вихід). Т.пл.=184-188°С. ХІ-МС 329,1amu (Μ+1). 1Н-ЯМР (500МГц) d 7,58 (1Н, с), 7,53 (1Н, с), 5,47 (1Н, т, J=6Гц), 5,14 (2H, с), 4,94 (1Н, п, J=8,5Гц) 3,85 (1Н, м), 3,63 (1Н, м), 2,45 (1Н, м), 2,26 (1Н, м), 2,13 (1Н, м), 1,99 (1Н, м), 1,75 (1Н, м), 1,66 (1Н, м) і 1,53м.ч. (1Н, м). Приклад 27 Одержання (R,S)-3-[3-(2оксопіролідинил)пропіл]-2Н,6аН-піролідино[2",1"3',2']1,3-оксазино[5',6'-4,5]бензо[е]1,3оксапергідроїн-4,10-діону Синтез проводили в основному, як описано для сполуки в Прикладі 22 за винятком того, що на заключній стадії циклізації використовували п'ять еквівалентів камфорсульфонової кислоти. Т.пл.=189-190°С. ІЧ: 1667см -1. ХІ-МС 386,3amu (M+1). 1Н ЯМР (500МГц) d 7,5 (2Н, с), 5,47 (1Н, т, J=6,0Гц), 5,22 (2Н, с), 3,85 (1Н, м), 3,64 (1Н, м), 3,52 (2Н, м), 3,42 (2Н, м), 3,37 (2Н, м), 2,46 (1Н, м), 2,41 (2Н, м), 2,26 (1Н, м), 2,14 (1Н, м), 2,05 (2Н, м) і 1,87-2,0м.ч. (3Н, м). Приклад 28 Одержання (R,S)-3-(2H-бензо[d]1,3-діоксолен5-ілметил)-2Н,6аН-піролідино[2",1"-3',2']1,3оксазино[5',6'-4,5]бензо[e]1,3-оксазапергідроїн4,10-діону Синтез 3-(2Н-бензо[d]1,3-діоксолен-5-ілметил)2Н,6аН-піролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[е]1,3-оксазапергідроїн-4,10-діону проводили в основному тим же способом, як описано вище для Прикладу 22, за винятком того, що піпероніламіном замінювали метиламін. ІЧ спектроскопія (NaCI) 1680 і 1445 см-1. ХІ-МС 395,3amu, (M+H). 1Н Я МР (500МГц): d 7,62 (1Н, с), 7,53 (1Н, с), 6,87 (1Н, с), 6,78 (1Н, с), 6,79 (1Н, с), 5,96 (2Н, с), 5,49 (1Н, м), 5,14 (2Н, м), 4,70 (2Н, дд), 3,88 (1Н, м), 3,65 (1Н, м), 2,48 (1Н, м), 2,24 (1Н, м), 2,15 (1Н, м) і 1,97м.ч. (1Н, м). Приклад 29 Одержання (R,S)-3-(2,2,2-трифтороетил)2Н,6аН-піролідино[2",1",-3',2']1,3-оксазино[5',6'4,5]бензо[е]1,3-оксазапергідроїн-4,10-діону 38 Методика для синтезу 3-(2,2,2-трифтороетил)2Н,6аН-піролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[e]1,3-оксазапергідроїн-4,10-діону була в основному такою ж, як для Прикладу 22, за винятком того, що трифтороетиламіном замінили метиламін. Процедуру з триоксаном проводили в розмірі 5ммоль з одержанням 1,2г очищеного трифтороетилбензоксазину, 70% ви хід з Тпл. 179180°С. ІЧ спектроскопія (NaCI) 1672 і 1454 см-1. ХІМС, 343,1 (М+Н). 1Н ЯМР (500МГц) d 7,58 (1Н, с), 7,57 (1Н, с), 5,48 (1Н, м), 5,29 (2Н, м), 4,21 (2Н, м), 3,84 (1Н, м), 3,67 (1Н, м), 2,52 (1Н, м), 2,30 (1Н, м), 2,18 (1Н, м) і 2,00м.ч. (1Н, м). Приклад 30 Одержання (R,S)-4-етил-2Н,3Н,7аНпіролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[f]1,4-оксазапергидроепін-5,11-діону Комерційно доступний діетиловьій етер 2,5дигідрокситерефталевої кислоти (7,00м; 27,5ммоль) і 4-амінобутиральдегіддіетилацеталь (7,00м; 43,4ммоль) поміщали в пробірку і нагрівали із зворотнім холодильником протягом 5 хвилин. Реакційну суміш виливали у воронку для розділення з 800мл EtOAc і 100мл 6N НСІ. Через 30 хвилин органічний шар відокремлювали, висушували над Na2SO4, і розчинник випарювали з одержанням жовтого масла. Флеш-хроматографією (силікагель, етилацетат/гексан 80/20) одержували 4,90г (64%) безбарвних пухких кристалів з наступними властивостями: Т.пл.=139-141°С. 1Н ЯМР (300МГц, CDCI3) d 10,41 (1Н, с), 7,49 (1Н, с), 7,44 (1Н, с), 5,41 (1Н, т, J=5,7Гц), 4,38 (2H, к, J=7,2Гц), 3,86-3,76 (1Н, м), 3,64-3. 53 (1Н, м), 2,46-2,33 (1Н, м), 2,25-2,02 (2Н, м), 1,99-1,82 (1Н, м), 1,38м.ч. (3Н, т, J=7,2Гц). До розчину 2,0г (7,21ммоль) проміжного фенолу в 50мл толуолу додавали 15мл 1,2диброметану і 2,4г (17,4ммоль) К2СО3. Суміш кип'ятили із зворотнім холодильником протягом 48 годин, до повного використання вихідного матеріалу. Розчинник випарювали, і додавали 200мл EtOAc і 100мл води. Органічну фазу висушували над Na2SO4, і розчинник випарювали. Флешхроматографією на силікагелі (EtOAc/гексан 60/40) одержували безбарвне масло, що кристалізувалося через 1 годину (2,1г, 76 %). Т.пл.=98-99°С. 1Н ЯМР (300МГц, CDCI3) d 7,47 (1Н, с) 7,36 (1Н, с), 5,46 (1Н, т, J=5,9Гц), 4,45-4,30 (4Н, м), 3,89-3,79 (1Н, м), 3,66 (2Н, т, J=6,0Гц), 3,69-3,57 (1Н, м), 39 79940 2,50-2,38 (1Н, м), 2,31-2,06 (2Н, м), 2,05-1,87 (1Н, м), 1,39м.ч. (3Н, т, J=7,1Гц). 720мг (1,87ммоль) проміжного броміду розчиняли в 30мл етанолу. Додавали розчин 350мг KОН (6,25ммоль) у 10мл води. Реакція завершувалася через 10 хвилин. Додавали 100мл води на і 200мл EtOAc, і суміш підкисляли НСІ до рН 2. Органічну фазу висушували над Na2SO4, і розчинник випарювали, одержуючи безбарвне масло (700мг). Масло розчиняли в 50мл тетрагідрофурану і додавали 1мл H2NEt, і суміш перемішували протягом 72 годин при кімнатній температурі. Розчинник випарювали, і залишок повторно розчиняли в 50мл тетрагідрофурану. До розчину додавали 253мг (1,87ммоль) НОВТ, 228мг (1,87ммоль) DMAP, 189мг (1,87моль) NEt3 і 1,08г (5,61ммоль) EDCI і суміш перемішували протягом 24 годин. Розчинник випарювали і додавали 100мл EtOAc і 100мл водної НСІ (рН=2). Органічну фазу висушували над Na2SO4 і випарювали. Флешхроматографією на силікагелі (EtOAc/гексан 75/25) одержували 335мг безбарвного масла (59%). Кристалізацією з EtOAc/гексан одержували 283мг білих кристалів з наступними властивостями: Т.пл.=180-181°С. ІЧ: 1670, 1631, 1475, 1443, 1034 см -1. 1Н ЯМР (500МГц, CDCI3) d 7,58 (1Н, с), 7,36 (1Н, с), 5,47 (1Н, т, J=6Ηц), 4,36 (1Н, ддд, J=10,9; 8,5 і 4,1 Гц), 4,29 (1Н, ддд, J=10,9; 4,6 і 4,2 Гц), 3,88-3. 81 (1Н, м), 3,66 (2Н, к, J=7,1Гц), 3,65-3,58 (1Н, м), 3,52 (1Н, ддд, J=15,8; 8,5 і 4,2 Гц), 3,40 (1Н, ддд, J=15,8; 4,6 і 4,1 Гц), 2,48-2,41 (1Н, м), 2,30-2,22 (1Н, м), 2,17-2,08 (1Н, м), 2,00-1,90 (1Н, м), 1,26м.ч. (3Н, т, J=7,1Гц). Приклад 31 Одержання (R,S)-3-(4-оксо-піролідинилбутил)2Н,6аН-піролідино[2'',1"-3',2']1,3-оксазино[5',6'4,5]бензо[е]1,3-оксазапергідроїн-4,10-діону До 4,8г (20ммоль) CBZ-GABA [Org. Syn. Vol. Ill, Pg. # 167] у 50мл CHCI3 додавали 3,5г (22ммоль) CDI під атмосферою аргону при перемішуванні. Через 1 годину додавали 5мл (надлишок) піролідину. Реакційну суміш перемішували протягом наступної години, потім її промивали 100мл 1М водного НСІ, 100мл насиченого водного NaHCO3, і висушували над Na2SO4. Концентрацією у вакуумі одержували 6,0г проміжного аміду (одна пляма на тонкошаровій хроматографії, EtOAc). Амід розчиняли в 50мл EtOH і відразу гідрували при 30псі із 800мг 10% Pd/C. Після видалення розчинника одержували до 3,5г проміжного аміну у вигляді блідо-жовтої воскоподібної рідини. До 1,3г (5,22ммоль) проміжного продукту саліцилової кислоти (див., Приклад 33 нижче для його синтезу), суспендированного в 40мл диметилформаміду, додавали 930мг (5,74ммоль) CDI. Через 10 хвилин суспензія ставала прозорим коричневим розчином, і його нагрівали при 60-80°С протягом 4 40 годин. Потім розчин охолоджували до кімнатної температури перед додаванням 1,5г (10ммоль) проміжного аміну. Реакційну суміш відразу перемішували перед видаленням розчинника при тиску масляного насоса (40°). Залишок розчиняли в 200мл СН 2СІ2, промивали 50мл 1М НСІ і 50мл насиченого NaHCO3, висушували над Na2SO4, ι концентрували у вакуумі з одержанням 1,1г проміжного аміду (одна пляма на тонкошаровій хроматографії). До 1,1г (2,9ммоль) проміжного аміду в 150мл 33% СН2СІ2/СНСІ3 додавали 5,4г (60ммоль) триоксану, 2,3г (100ммоль) камфорсульфоновой кислоти і 10 крапель H2SO4, при перемішуванні в атмосфері аргону. Отриману двофазну систему нагрівали із зворотнім холодильником, і воду видаляли за допомогою 50г 4Å молекулярних сит, що знаходиться в 125мл додатковій воронці з бічним відгалуженням. Після того, як суміш швидко кип'ятили із зворотнім холодильником, сита заміняли, і кип'ятіння продовжували наступні 3 години. Реакційну суміш охолоджували до кімнатної температури і струшували з 100мл 1М NaOH. Водний шар екстрагували 3´100мл СН 2СІ2. Об'єднані органічні шари промивали 200мл води, висушували над Na2SO4, і концентрували у вакуумі з одержанням 1,5г неочищеного продукту. Флешхроматографією на 150г силікагелю з 20% EtOH у EtOAc одержували 750мг продукту (63%) у вигляді блідо-зеленої прозорої речовини, 98% чистоти за РХ-МС (М+Н)=400amu з наступними властивостями: ІЧ: 1666, 1638, 1454, 1428 см-1. 1Н ЯМР (300МГц, CDCI3), d 7,54 (1Н, с), 7,53 (1Н, с), 5,46 (1Н, т, J=5,6Гц),5,21 (2H, с), 3,85 (1Н, м), 3,62 (1Н, м), 3,61 (2Н, т, J=7,0Гц), 3,40 (4Н, м), 2,44 (1Н, м), 2,33 (2Н, т, J=6,9Гц), 2,26 (1Н, м), 2,13 (1Н, м), 2,0 (4Н, м), 1,96 (1Н, м) і 1,85м.ч. (2Н, м). Приклад 32 Одержання (R,S)-3-(3-морфолін-4-ілпропіл)2Н,6аН-піролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[е]1,3-оксазапергідроїн-4,10-діону Синтез 3-(3-морфолін-4-ілпропіл)-2Н,6аНпіролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[е]1,3-оксазапергідроїн-4,10-діону проводили в цілому як згадано вище для Прикладу 22. Зокрема, до 1,15г (4,0ммоль) етил 7-гідрокси-9оксо-3аН-бензо[е]піролідино[2,1-b]1,3-оксазин-6карбоксилату (продукт із Прикладу 7) у 30мл СН2СІ2 під аргоном додавали 3,0мл (6,0ммоль) АІМе3 при перемішуванні. Додавали 1-(3амінопропіл)морфолін (0,45мол; 3,0ммоль), і отриману суміш відразу перемішували при кімнатній температурі. Ще додавали 0,6мл з 1-(3амінопропіл)морфоліну протягом 3,5 годин, після чого суміш кип'ятили із зворотнім холодильником. Оскільки, як показала тонкошарова хроматографія, реакція не завершувалася, реакційну суміш 41 79940 охолоджували до кімнатної температури і додавали 1,0мл (2,0ммоль) 2,0Μ АІМе3 у толуолі. С уміш кип'ятили із зворотнім холодильником протягом наступних 2 годин, після чого тонкошарова хроматографія показувала завершення реакції. Реакційну суміш охолоджували до 5°С и потім гасили обережним додаванням 12Μ НСІ при перемішуванні. рН суміші доводили до 7 за допомогою 10Μ NaOH і екстрагували 2´250мл тетрагідрофурану. Розчин висушували над Na2SO4, і після випарювання розчинника одержували 1,8г неочищеного феноламіду тільки зі слідами первинного аміну. До 1,8г неочищеного проміжного продукту в 75мл 88% мурашиної кислоти додавали 400мл бензолу і отриману дво фазну систему кип'ятили із зворотнім холодильником під аргоном. Після видалення 350мл бензолу дистиляцією, додавали ще 400мл бензолу, і реакційну суміш відразу кип'я тили із зворотнім холодильником при перемішуванні під аргоном. Весь бензол видаляли дистиляцією при атмосферному тиску, і потім додавали 2´200мл бензолу і згодом видаляли у вакуумі з одержанням 2,2г масляного залишку. Залишок обробляли 50мл триетиламіну, що потім видаляли у вакуумі. Залишок з цієї операції пропускали через коротку колонку (50г кремнезему, 50% EtOH/EtAc) для видалення будь-якого первинного аміну. Після видалення розчинника з хроматографічних фракцій у вакуумі, поміщали 1,5г залишку в 1,0л EtOAc і потім промивали 2´50мл 1,0Μ NaOH, 2´50мл соляного розчину і потім висушували над Na2SO4. Розчинник видаляли у вакуумі з одержанням 700мг густо го коричневого залишку, що хроматографували на 75г силікагелю (EtOH/EtOAc, 2:3) з одержанням безбарвної твердої речовини з Т.пл.=153-155°С. ІЧ спектроскопія (NaCI): 1665 і 1454 см-1. ХІ-МС 388amu (М+1). 1Н ЯМР (500МГц) d 7,56 (1Н, с); 7,54 (1Н, с); 5,47 (1Н, м); 5,22 (2Н, дд); 3,85 (1Н, с), 3,71 (5Н, м), 3,66 (3Н, м), 2,50 (6Н, м), 2,28 (1Н, м), 2,18 (1Н, м), 2,01 (1Н, м) i 1,87м.ч. (2Н, м). Приклад 33 Одержання (R,S)-метил 2-(4,10-діоксо-2Н,6аНпіролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[е]оксазапергідроїн-3-іл)ацетату До 2,5г (9,0ммоль) естеру (продукт з Прикладу 7) у 50мл тетрагідрофуран/МеОН 1:1 додавали 50мл 1,0Μ водного NaOH. Отриманий жовтий розчин нагрівали до 40°С протягом 1 години під аргоном, при перемішуванні. Тонкошарова хроматографія показала відсутність вихідного естеру. Реакційну суміш концентрували до 20мл у вакуумі, потім охолоджували до 4°С на бані з льодом і доводили рН до 4 за допомогою концентрованої НCІ. Зразки білого осаду збирали в воронці Бухнера, промивали декількома невеликими порціями холодної води і відразу висушували під вакуумом. 42 Вихід становив 1,3г (54%) проміжного продукту саліцилової кислоти у вигляді мілкодисперсної безбарвної твердої речовини. Вищезгадану саліцилову кислоту суспендували в 20мл сухого диметилформаміду при перемішуванні під атмосферою аргону. До сухої суспензії додавали 0,92г (5,7ммоль) CDI і суміш, що перемішується, нагрівали до 50°С протягом 1 години, у цьому проміжку часу утворювався жовтий розчин. До цього розчину додавали 1,0г (8,0ммоль) гідрохлорид метилового естеру гліцину, потім 5мл (28,7ммоль) діізопропілетиламіну при 42°С при перемішуванні. Реакційну суміш швидко перемішували при 40-45°С під аргоном. Концентрацією розчину одержували залишок, що поміщали під вакуумом на 16 годин при 0,1мм Hg. Сухий залишок (5,8г) розчиняли в 500мл EtOAc, промивали 100мл 3Μ НСІ, 2 ´100мл води, висушували над Na2SO4 і потім фільтрували через 200г силікагелю. Силікагель промивали 1500мл EtOAc. Випарюванням EtOAc з очищеного проміжного продукту феноламіду одержуючи 1,2г (72%) білої твердої речовини. ХІ-МС 321, (М+1); 362amu, (M+CH 3CN+H). До 2,0г феноламіду (комбінований вихід дво х завантажень) у 300мл 33% СН2СІ2/СНСІ3 додавали 4,6г (20ммоль) камфорсульфонової кислоти і 2,0г (22ммоль) триоксану. Отриманий розчин кип'я тили із зворотнім холодильником протягом 3 годин. До реакційної суміші додавали п'ять крапель концентрованої H2SO4, після чого його кип'ятили із зворотнім холодильником протягом наступних 2 годин. Реакційну суміш о холоджували до 10°С використовуючи льодяну баню, потім виливали в 100мл 1М NaOH при перемішуванні. Водний шар відокремлювали й екстрагували 3´50мл СН 2СІ2. Потім об'єднані органічні шари промивали 100мл води, висушували над MgSO4, і розчинник видаляли у вакуумі, одержуючи 1,1г неочищеного бісбензоксазину у вигляді воскоподібної твердої речовини. Неочищений продукт хроматографували на 150г силікагелю EtOAc як элюентом з одержанням 650мг (31%) прозорої речовини з Т. пл.=161-162°С. ІЧ (NaCI) 1748, карбоніл; 1665, амідкарбоніл і 1453 см -1 С-О. ХІ-МС 333amu, (М+1). 1Н ЯМР (CDCI3) d 7,60 (1Н, с), 7,58 (1Н, с), 5,5 (1Н, м), 5,30 (2Н, м), 4,35 (2Н, м), 4,89 (1Н, м), 3,78 (3Н, с), 3,68 (1Н, с), 2,50 (1Н, м), 2,39 (1Н, м), 2,15 (1Н, м) і 1,90м.ч. (1Н, м). Приклад 34 Одержання (R,S)-3-(2-оксо-2-піролідинилетил)2Н,6аН-піролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[e]1,3-оксазапергідроїн-4,10-діону До 450мг (1,2ммоль) (R,S)-метил 2-(4,10діоксо-2Н,6аН-піролідино[2",1"-3',2']-оксазино[5',6'4,5]бензо[е]1,3-оксазапергідроїн-3-іл)ацетату (Приклад 33) у 80мл сухого СНСІ3 додавали 0,15мл (1,8ммоль) піролідину, потім 0,9мл (1,8ммоль) 43 79940 2,0М АІМе3 у толуолі. Додавання проводили при кімнатній температурі під атмосферою аргону при енергійному перемішуванні. Реакційну суміш кип'ятили із зворотнім холодильником протягом 1 години, потім відразу перемішували при кімнатній температурі. Додавали піролідин (0,3мол; 3,6ммоль), потім 1,8мл (3,6ммоль) 2,0Μ АІМе3 у толуолі. Реакційну суміш кип'ятили із зворотнім холодильником протягом 5 годин, після цього проміжку часу тонкошарова хроматографія не виявила вихідної речовини. Реакційну суміш о холоджували до 5°С и потім перемішували з 50мл 1Μ НСІ. Водний шар відокремлювали й екстрагували 3´50мл СН 2СІ2. Об'єднані органічні шари промивали 50мл насиченого водного NaHCO3, висушували над Na2SO4 і концентрували у вакуумі. Неочищений амід (600мг) хроматографували на 150г силікагелю використовуючи як елюент 10% EtOH у EtOAc, потім проводили кристалізацію з 10мл EtOAc, з одержанням 458мг (99%) прозорого порошку з Т.пл.=257-259°С. ІЧ (NaCI) 1748 карбоніл, 1665, амід карбоніл і 1453 см -1 С-О. ХІ-МС 372, (М+Н); 394, (M+Na), 435amu, (M+Na+CH 3CH). 1НЯМР (500МГц, CDCI3), d 7,56 (1H, с), 7,55 (1Н, с), 5,50 (1Н, м), 5,41 (2Н, м), 4,38 (2Н, м), 3,87 (1Н, м), 3,68 (1Н, м), 3,52 (4Н, м), 2,49 (1Н, м), 2,28 (1Н, м), 2,18 (1Н, м), 2,08 (2Н, м), 2,03 (1Н, м) i 1,95м.ч. (1Н, м). Приклад 35 Одержання 7-(циклогексилкарбоніл)-3-(2метоксиетил)-2Н-бензо[е]1,3-оксазапергідроїн-4ону Комерційно доступний 3-гідроксибензальдегід (10,0м; 81,9ммоль) розчиняли в 40мл СН 2СІ2 і 40мл HC(OEt)3 при кімнатній температурі, потім додавали 3,0мл 1М розчину ВСІ3 у гексані. Після того, як суміш перемішували протягом 30 хвилин, її фільтрували через 3см силікагелю і силікагель промивали сумішшю 150мл гексану і 250мл EtOAc. Отриману оранжеве масло, що одержували після видалення розчинника, розчиняли в 40мл тетрагідрофурану і порціями додавали 3,5г NaH (~87ммоль, ~60% у мінеральному маслі). Суміш нагрівали до 170°С в сталевому циліндрі в присутності СО2 (600псі) протягом 2 годин. Після охолодження і видалення надлишку СО2 суміш розподіляли між 150мл EtOAc і 200мл води. Водну фазу обробляли H2SO4 (pH 2), екстрагували з 250мл EtOAc і висушували над Na2SO4. Розчинник випарювали до одержання 9,2г темно-коричневого масла. Темно-коричневе масло (9,2г; ~38ммоль) розчиняли в 80мл СН2СІ2, і порціями додавали 9,2г (56,7ммоль) CDI. Після активного перемішування протягом 90 хвилин при кімнатній температурі додавали 6,8г (90,5ммоль) H2N(CH2)2OMe, і суміш 44 перемішували протягом ще 10 годин. Суміш розподіляли між 200мл води і 200мл EtOAc. Органічну фазу висушували над Na2SO4, і після видалення розчинника одержали темно-коричневе масло. Після флеш-хроматографії на силікагелі (EtOAc/гексан 30/70) одержували 5,0г (21%) майже безбарвного масла. 1Н ЯМР (300МГц, CDCI3) d 12,30 (1Н, с), 7,35 (1Н, д, J=8,3Гц), 7,10 (1Н, д, J=1,5Гц), 6,97 (1Н, дд, J=8,3 і 1,5 Гц), 6,67 (1Н, шс), 5,44 (1Н, с), 3,69-3,35 (8Н, м), 3,40 (3Н, с) і 1,281,20м.ч. (6Н, м). Захи щений альдегід (5,0г/16,8ммоль) розчиняли в 100мл етанолу. Додавали 40мл води і 1мл 12N НСІ. Розчинник повністю видаляли через 30 хвилин, одержуючи в результаті альдегід у вигляді червонувато/бежевої твердої речовини (3,6г). Неочищений альдегід розчиняли в 60мл СН 2СІ2, потім додавали 10г (111ммоль) триоксану і 10г CuSO4. При енергійному перемішуванні додавали по краплях 1,3мл концентрованої H2SO4. Через 30 хвилин суміш продуктів фільтрували через силікагель, далі промивали 300мл EtOAc. Комбінований органічний розчин промивали 30мл 1Μ NaOH і висушували над Na2SO4. Видалення розчинника проводили флеш-хроматографією на силікагелі (EtOAc/гексан 40/60®60/40), одержуючи 1,7г (43%) безбарвних кристалів з наступними властивостями: Т.пл.=71-73°С. 1Н ЯМР (300МГц, CDCI3) d 10,01 (1Н, с), 8,12 (1Н, д, J=8,1Гц), 7,61 (1Н, дд, J=8,1 і 1,5 Гц), 7,46 (1Н, д, J=1,5Гц), 5,31 (2Н, с), 3,76 (2Н, т, J=4,8Гц), 3,60 (2Н, т, J= 4,8Гц) і 3,36м.ч. (3Н, с). До 500мг (20,6ммоль) магнію в 10мл тетрагідрофурану під атмосферою азоту додавали кристал І2, 0,2мл 1,2-диброметан і 1мл розчину 2,45г (15ммоль) бромоциклогексану в 10мл тетрагідрофурану. Зали шок розчину бромциклогексану додавали порціями протягом 5 хвилин після початку реакції Грін'яра. Реакційну суміш зберігали при кімнатній температурі і перемішували протягом 45 хвилин, після чого в осад випадали кілька солей магнію. Розчин надосадкової рідини додавали до розчину проміжного альдегіду (1,7г; 7,22ммоль) у 20мл тетрагідрофурану. Одержаний жовтий розчин, який перемішували протягом ще 5 хвилин. Додавали двадцять мл води, потім повільно 200мл EtOAc і невелику кількість НСІ (достатнього для розчинення солей магнію). Органічну фазу висушували над Na2SO4 і концентрували з одержанням жовтого масла. Флеш-хроматографією на силікагелі (ацетон/толуол 20/80) одержували 1,3г (56%) злегка жовтуватого масла (яке кристалізувалося через кілька днів) з наступними властивостями: Т.пл.=78-79°С. ІЧ: 3431, 2926, 2852,1657, 1620, 1438, 1117, 780 см -1. 1Н ЯМР (300МГц, CDCI3) d 7,85 (1Η, д, J=7,8Гц), 7,00 (1Η, дд, J=7,8 і 1,5 Гц), 6,91 (1Η, д, J=1,5Гц), 5,24 (2Н, с), 4,39 (1Н, д, J=6,6Гц), 3,74-3,68 (2Н, м), 3,58 (2Н, т, J=4,8Гц), 3,35 (3Н, с), 2,28 (1Н, шс), 1,94-0,90м.ч. (11Н, м). Проміжний спирт (1,0г/ 3,1ммоль) розчиняли в 50мл СН2СІ2, до якого додавали 1,6г (7,4ммоль) РСС. Після перемішування 50хв суміш фільтрували крізь 3см шар силікагелю, що промивали сумішшю 175мл EtOAc/75мл гексану. Концентрацією і флеш-хроматографією на силікагелі (EtOAc/гексан 45 79940 46 40/60®50/50) одержували 700мг (70%) безбарвного масла з наступними властивостями: ІЧ: 2930, 2854, 1677, 1449, 1427, 1314 986 см -1. 1Н ЯМР (300МГц, CDCI3) d 8,03 (1Н, д, J=7,8Гц), 7,62 (1Н, дд, J=7,8 і 1,5 Гц), 7,49 (1Н, д, J=1,5Гц), 5,28 (2Н, с), 3,75 (2Н, т, J=5,0Гц), 3,59 (2Н, т, J=5,0Гц), 3,35 (3Н, с), 3,27-3,15 (1Н, м) і 1,95-1,25м.ч. (10Н, м). Приклад 36 Одержання 7-(циклопентилкарбоніл)-3-етил2Н-бензо[е]1,3-оксазапергідроін-4-ону EtOAc/гексана одержували білі кристали з наступними властивостями: Т. пл.=69-70°С. ІЧ: 2932, 1678, 1667,1427, 1316 см-1. 1Н ЯМР (300МГц, CDCI3) d 8,04 (1Н, д, J=8,1Гц), 7,63 (1Н, дд, J=8,1 і 1,8 Гц), 7,49 (1H, д, J=1,8Гц), 5,22 (2Н, с), 3,62 (2Н, к, J=7,2Гц), 3,25-3,14 (1Н, м), 1,94-1,25 (10Н, м) і 1,26м.ч. (3Н, т, J=7,2Гц). Приклад 39 Одержання 7-(2-циклогексилацетил)-3-етил2Н-бензо[е]1,3-оксазапергідроїн-4-ону Синтез проводили в основному як для Прикладу 35 з наступними виключеннями: етиламіном замінювали 2-метоксиетиламін, а бромциклопентаном замінювали бромоциклогексан. Флешхроматографією на силікагелі (EtOAc/гексан 40/60) одержували безбарвне масло, що кристалізували з МТВЕ/гексан, з одержанням білих кристалів з наступними властивостями: Т.пл.=53-54°С. ІЧ: 1677,1664, 1491,1427, 1316 см -1. ЯМР (300МГц, CDCI3) d 8,04 (1Η, д, J=8,3Гц), 7,66 (1Η, дд, J=8,3 і 1,5 Гц), 7,53 (1Η, д, J=1,5Гц), 5,23 (2Н, с), 3,72-3,58 (1Н, м), 3,62 (2Н, к, J=7,2Гц), 1,98-1,60 (8Н, м) і 1,26м.ч. (3Н, т, J=7,2Гц). Приклад 37 Одержання 3-етил-7-(пергидро-2Н-піран-4ілкарбоніл)-2Н-бензо[е]1,3-оксапергідроїн-4-ону Синтез виконували в основному, як для Прикладу 36, за винятком заміни бромметилциклогексаном бромциклопентану. Кристалізацією з МТВЕ/гексан одержували білі кристали з наступними властивостями: Т. пл.=55-58°С. ІЧ: 2924, 2851, 1670, 1667, 1428, 1317, 894 см -1. 1Н ЯМР (300МГц, CDCI3) d 8,04 (1Н, д, J=8,1Гц), 7,63 (1Н, дд, J=8,1 і 1,5 Гц), 7,50 (1Н, д, J=1,5Гц), 5,22 (2Н, с), 3,62 (2Н, к, J=7,5Гц), 2,80 (2Н, д, J=6,6Гц), 2,031,88 (1Н, м), 1,80-0,92 (10Н, м) i 1,26м.ч. (3Н, т, J= 7,5Гц). Приклад 40 Одержання (R,S),(R,S)-3-етил-7-[(2гідроксициклогексил)карбоніл]-2Н-бензо[е]1,3оксазапергідроін-4-ону Синтез проводили в основному як для Прикладу 36, за винятком заміни 4хлоротетрагідропіраном бромциклопентану. Т.пл.=93-94°С. ІЧ: 1682,1663, 1430, 1311 см-1. 1Н ЯМР (300МГц, CDCI3) d 8,06 (1Н, д, J=8,1Гц), 7,63 (1Н, дд, J=8,1 і 1,5 Гц), 7,50 (1Н, д, J=1,5Гц), 5,23 (2Н, с), 4,10-4,00 (2Н, м), 3,62 (2Н, к, J=7,2Гц), 3,60-3,38 (3Н, м), 1,94-1,73 (4Н, м) i 1,26м.ч. (3Н, т, J=7,2Гц). Приклад 38 Одержання 7-(циклогексилкарбоніл)-3-етил2Н-бензо[е]1,3-оксазапергідроїн-4-ону Синтез проводили в основному як для Прикладу 36, за винятком заміни бромциклогексаном бромциклопентану. Кристалізацією з Проміжний альдегід синтезували як у Прикладі 36. До 1,2г (5,85ммоль) альдегіду в 40мл етанолу додавали розчин 1,04г (15ммоль) H2NOH·HCI і 1,59г Na2CO3 (15ммоль) у 50мл води. Розчин перемішували протягом 30 хвилин при кімнатній температурі, а білий отриманий осад повторно розчиняли, нагріваючи розчин до 50°С. Через ще 30 хвилин водний етанол видаляли випарюванням при кімнатній температурі, і додавали 50мл води. Суміш екстрагували 1´200мл і 1´100мл EtOAc. Органічну фазу висушували над Na2SO4, і випарюванням розчинника одержували оксим у вигляді злегка жовтої твердої речовини. Оксим (1,2г; 5,45ммоль) розчиняли в 30мл диметилформаміду, до якого додавали 800мг (6,0ммоль) NCS і 30мл НСІ газу. Суміш перемішували протягом 60 хвилин при кімнатній температурі, до повного використання вихідної речовини. Суміш розбавляли 300мл EtOAc і екстрагували 2´150мл води. Органічну фазу висушували над Na2SO4, і об'єм зменшували до 100мл. До цієї суміші додавали 5мл диметилформаміду, 25мл цик 47 79940 логексану і розчин 1,5мл NEt3 у 25мл СН 2СН2 (по краплям протягом ночі). Розчинник випарювали і додавали 150мл води. Суміш екстрагували 250мл EtOAc і органічну фазу концентрували після висушування над Na2SO4. Флеш-хроматографією на силікагелі (EtOAc/гексан 50/50) одержували безбарвне масло (800мг, 49%), що кристалізували з EtOAc/гексан. Т.пл.=102-104°С. ІЧ: 2934, 1664, 1621, 1432, 1314, 838 см-1. 1Н ЯМР (300МГц, CDCI3) d 7,98 (1Н, д, J=8,1Гц), 7,42 (1Н, дд, J=8,1 і 1,5 Гц), 7,31 (1Н, д, J=1,5Гц), 5,21 (2Н, с), 4,55-4,50 (1Н, м), 3,61 (2Н, к, J=6,9Гц), 3,27-3,20 (1Н, м), 2,31-1,20 (8Н, м) і 1,25м.ч. (3Н, т, J=6,9Гц). До вищезгаданого розчину ізоксазоліну (749мг; 2,49ммоль) у метанолі 100мл додавали 1,2г В(ОН)3 у 70мл води і 1г нікелю Ранея. Після гідрування протягом 4 годин суміш фільтрували, концентрували і розподіляли між 50мл соляного розчину і 200мл EtOAc. Дві фази розділяли і водний шар екстрагували ще 200мл EtOAc. Об'єднані органічні шари висушували над Na2SO4 і концентрували. Флеш-хроматографією на силікагелі EtOAc/гексан (50/50) одержували 522мг (69%) безбарвної олії. Кристалізацією з EtOAc/гексан одержували 250мг білої твердої речовини з наступними властивостями: Т.пл.=106-108°С. ІЧ: 3460, 2933, 1661,1431, 1319, 988 см-1. 1Н Я МР (300МГц, CDCI3) d 8,06 (1Н, д, J=8,1Гц), 7,61 (1Н, дд, J=8,1 і 1,5 Гц), 7,48 (1Н, д, J=1,5Гц), 5,23 (2Н, с), 4,30-4,25 (1Н, м), 3,62 (2Н, к, J=7,2Гц), 4,33-4,27 (1Н, м), 2,05-1,35 (8Н, м) і 1,26м.ч. (3Н, т, J=7,2Гц). Приклад 41 Одержання 7(циклогексилкарбоніл)-3-метил-2Н-бензо[е]1,3оксапергідроїн-4-ону Синтез проводили в основному, як для Прикладу 38, за винятком заміни метиламіном етиламіну. Т.пл.=99-101°С. ІЧ: 2934, 2855, 1676, 1665, 1574, 1497, 1426, 1350, 1263, 984 см -1. 1Н ЯМР (300МГц, CDCI3) d 8,04 (1Н, CDCI3) d 8,04 (1Н, д, J=8,1Гц), 7,63 (1Н, дд, J=8,1 i 1,5 Гц), 7,49 (1Н, д, J=1,5Гц), 5,21 (2Н, с), 3,23-3,15 (1Н, м), 3,15 (3Н, с) і 1,93-1,20м.ч. (10Н, м). Приклад 42 Одержання 7-(циклогексилкарбоніл)-3(метилетил)-2Н-бензо[е]1,3оксазапергідроїн-4-ону Синтез проводили в основному, як для Прикладу 38, за винятком заміни ізопропіламіном етиламіну. Кристалізацією з МТВЕ/гексан одержували 48 білі кристали з наступними властивостями: Т.пл.=88-90°С. ІЧ: 2931, 2854, 1676, 1654, 1450, 1427, 1335, 1218, 991 см-1. 1Н ЯМР (300МГц, CDCI3) d 8,04 (1Н, д, J=8,1Гц), 7,62 (1Н, дд, J=8,1 і 1,5 Гц), 7,49 (1Н, д, J=1,5Гц), 5,19 (2Н, с), 4,96-4,82 (1Н, м), 3,25-3,14 (1Н, м), 1,95-1,20 (10Н, м) і 1,26м.ч. (6Н, д, J=6,9Гц). Приклад 43 Одержання (R,S)-6-(циклогексилкарбоніл)3аН-бензо[е]піролідино[2,1-b]1,3-оксазапергідроїн9-ону Синтез проводили в основному, як для Прикладу 38, з наступними виключеннями: 4амінобутиральдегідом замінювали етиламін, одержуючи масло, що обробляли НВr/НОАс у метиленхлориді з одержанням проміжного альдегіду. Кінцевий продукт мав наступні властивості: Т.пл.=110-111°С. ІЧ: 2927, 2855, 1676, 1665, 1439, 1078 см -1. 1Н ЯМР (300МГц, CDCI3) d 8,00 (1Η, д, J=7,8Гц), 7,63 (1Η, дд, J=7,8 і 1,5 Гц), 7,50 (1 Η, д, J=1,5Гц), 5,52 (1Н, т, J=6,0Гц), 3,91-3,82 (1Н, м), 3,67-3,59 (1Н, м), 3,23-3,13 (1Н, м), 2,53-2,42 (1Н, м), 2,35-2,22 (1Н, м), 2,20-2,07 (1Н, м) і 2,051,20м.ч. (12Н, м). Приклад 44 Одержання 6-(циклогексилкарбоніл)-3-етил2Н-бензо[е]1,3-оксазапергідроїн-4-ону 5-формілсаліцилову кислоту (2,8г; 16,8ммоль) розчиняли в 150мл метанолу, і додавали по краплях 10мл тіонилхлориду. Після перемішування розчину протягом 18 годин при кімнатній температурі додавали по краплях ще 5мл тіонилхлориду, і суміш кип'ятили із зворотнім холодильником протягом 5 годин. Розчинник випарювали, і суміш, що залишилася, фільтрували крізь силікагель, що промивали 300мл EtOAc/гексан (1:1). Концентрацією відповідних фракцій одержували 3,0г жовтогарячої твердої речовини, що розчиняли в 30мл СН2СІ2. Додавали етиламін (5,0г), і розчин перемішували протягом 3 днів при кімнатній температурі. Розчинник випарювали і додавали 100мл водної НСІ до рН=1. Суміш екстрагували EtOAc (250мл і 100мл), висушували над Na2SO4 і концентрували з одержанням 1,4г жовтого аміду. Неочищений амід розчиняли в 40мл СН 2СІ2, що містить 6,0г триоксану (67ммоль), і 5,0 CuSO4. Отриману суміш енергійно перемішували додаючи по краплях 1,0мл концентрованої H2SO4. Через 30 хвилин суміш відфільтровували крізь силікагель, що промивали 250мл EtOAc. Органічну фазу кон 49 79940 центрували, одержуючи бежеву тверду речовину. Флеш-хроматографією на силікагелі (EtOAc/гексан 50/50) одержували 550мг безбарвного масла, що тверділо через 1 годину. Проміжний альдегід мав наступні властивості: Т.пл.=47-50°С . 1Н ЯМР (300МГц, CDCI3) d 9,97 (1Н, с), 8,47 (1Н, д, J=1,8Гц), 8,00 (1Η, дд, J=8,4 і 1,8 Гц), 7,09 (1Η, д, J=1,8Гц), 5,28 (2Н, с), 3,63 (2Н, к, J=7,2Гц) і 1,27м.ч. (3Н, т, J=7,2Гц). Перетворення альдегіду в циклогексилкетон проводили в основному відповідно до методики за Прикладом 38. ІЧ: 2933, 2855, 1683, 1614, 1494, 1463, 1372, 1311, 1247, 1209, 978 см -1. 1Н ЯМР (300МГц, CDCI3) d 8,53 (1Н, д, J=2,1Гц), 8,09 (1Н, дд, J=8,7 і 2,1 Гц), 7,03 (1Н, д, J=8,7Гц), 5,25 (2Н, с), 3,63 (2Н, к, J=7,2Гц), 3,37-3,25 (1Н, м), 1,92-1,20 (10Н, м) і 1,27м.ч. (3Н, т, J=7,2Γц). Приклад 45 Одержання (3S)-3-бензил-(R,S)-2Н,3Н,4Н,7аНпіролідино[2",1"-2',3']-оксазапергідроїно[5',6'5,4]бензо[f]1,4-оксазепін-5,11-діону Комерційно доступний карбонілбензилоксифенілаланін (10,0г; 33,4ммоль) розчиняли в 150мл СН2СІ2. Додавали CDI (8,0г 49,3ммоль), і перемішували суміш протягом 60 хвилин при кімнатній температурі. Додавали метанол (25мл), і перемішували суміш протягом ще 60 хвилин при кімнатній температурі. Розчинник випарювали, додавали 150мл води, а суміш екстрагували 250мл EtOAc. Органічну фазу висушували над Na2SO4 і концентрували, одержуючи безбарвне масло (10,1г). Метиловий естер карбонілбензилоксифенілаланіну розчиняли в 120мл тетрагідрофурану і додавали 1,2г (55ммоль) LіВН4, викликаючи нагрівання суміші до 60°С. Суміш кип'я тили із зворотнім холодильником протягом 5 хвилин до повного використання вихідної речовини. Реакцію гасили повільним додаванням 25мл 2N НСІ, потім 100мл метанолу. Після концентрації розчину додавали 100мл соляного розчину і суміш екстрагували 2´200мл EtOAc/гексан (1:1). Органічну фазу висушували над Na2SO4 і концентрували, одержуючи 9,1г (31,9ммоль) білої твердої речовини з наступними властивостями: Т.пл.: 85-87°С. 1Н ЯМР (300МГц, CDCI3) d 7,35-7,15 (10Н, м), 5,07 (2Н, с), 5,02-4,93 (1Н, м), 4,00-3,89 (1Н, м), 3,74-3,54 (2Н, м) і 2,86м.ч. (2Н, д, J=6,9Гц). Вищезгаданий спирт розчиняли в 80мл піридину і потім додавали 400мг DMAP і 4,6г (40,1ммоль) CH3SO2CI при 0°С. Після перемішування суміші протягом 18 годин при кімнатній температурі додавали 700мл EtOAc і розчин екстрагували 3´200мл 2N НСІ. Органічну фазу висушували над Na2SO4 і концентрували, одержуючи 9,7г бежевої твердої речовини з наступними властивостями: Т.пл.: 82-85°С. 1Н ЯМР (300МГц, CDCI3) d 50 7,35-7,18 (10Н, м), 5,08 (2Н, с), 5,00-4,94 (1Н, м), 4,29-4,10 (3Н, м), 2,96 (3Н, с) і 2,95-2,84м.ч. (2Н, м). До розчину 1,5г (5,4ммоль) фенолу (синтезованого як у Прикладі 30) в 100мл толуолу додавали 2,0г K2СО3 і 1,0г метилсульфонату. Суміш кип'ятили із зворотнім холодильником протягом 7 годин, потім додавали 2,0г K2СО3 і 2,5г метилсульфонату. С уміш кип'ятили із зворотнім холодильником протягом 18 годин, потім додавали 2,0г K2СО3 і 5,0г метилсульфонату і потім кип'я тили із зворотнім холодильником суміш протягом 24 годин. Додавали воду (100мл) і екстрагували суміш EtOAc (250мл і 150мл). Органічну фазу висушували над Na2SO4 і розчинник випарювали. Після флеш-хроматографії на силікагелі (EtOAc/гексан 45/55, потім 66/34) одержували 1,6г злегка жовтуватого масла з наступними властивостями: 1Н ЯМР (300МГц, CDCI3) d 7,44-7,18 (12Н, м), 5,885,80 (1Н, м), 5,46 (0,5Н, т, J=6Гц), 5,44 (0,5Н, т, J=6Гц), 5,10 (2Н, с), 4,39 (2Н, к, J=6,9Гц), 4,29-4,00 (2Н, м), 3,96-3,77 (2Н, м), 3,65-3,56 (1Н, 96 (2Н, м), 2,50-2,37 (1Н, м), 2,30-1,86 (3Н, м) і 1,38м.ч. (3Н, т, J=6,9Гц). Це масло розчиняли в 100мл метанолу. Додавали Pd/C (600мг) і гідрували суміш протягом 2 годин. Суміш фільтрували і розчинник випарювали. Отримане масло нагрівали при 150°С протягом 5 хвилин. Після флеш-хроматографії отриманого масла на силікагелі (EtOAc/гексан 85/15) одержували жовтува те масло (250мг). Кристалізацією з EtOAc/МТВЕ одержували 175мг білих кристалів з наступними властивостями: Т.пл.=159-162°С. ІЧ: 1670, 1442 см -1. 1Н ЯМР (300МГц, CDCI3) d 7,647,13 (7Н, м), 6,28-6,20 (1Н, м), 5,46 (1Н, т, J=6Гц), 4,29-4,14 (2Н, м), 3,90-3,77 (2Н, м), 3,66-3,58 (1Н, м), 2,96-2,76 (2Н, м), 2,50-2,39 (1Н, м), 2,31-2,06 (2Н, м) і 2,03-1,87м.ч. (1Н, м). Приклад 46 Одержання (R,S),(R,S)-2H,3H,3a,9aH-1,2оксазолідино[3,2-b]піролідино[2",1"-3',2'](1,3оксазино)[5',6'-4,5]бензо[e]1,3-оксазапергідроїн6,12-діону До розчину N-гідроксифталіміду (7,5г, 44,6ммоль) у 200мл диметилформаміду, що промивали аргоном, порціями протягом 1 години додавали 2,14г 60% гідриду натрію (53,5ммоль). Отриманий розчин нагрівали при 80°С протягом 3 годин і потім охолоджували до кімнатної температури. До цього розчину додавали хлоропропіональальдегіддіетилацеталь (11,2мол, 66,9мммоль) і йодид натрію (10,0г, 66,9ммоль). Отриману суспензію нагрівали при 80°С протягом 4 годин. Розчин охолоджували до кімнатної температури і потім розділяли між 1,5л Н2О/0,5л Et2O. Органічний шар промивали соляним розчином, висушували над Na2SO4, відфільтровували і випарювали у ва 51 79940 куумі. Після флеш-хроматографії залишку (EtOAcтексан 1:4) одержували 9,3г (71%) білої твердої речовини. Проміжний продукт розчиняли в 250мл безводного етилового спирту, до якого додавали безводний гідразин (1,99мол, 63,4ммоль). Спостерігалося негайне осадження пухкої білої твердої речовини. Через 2 години суміш фільтрували для видалення осаду, що промивали етиловим спиртом. Об'єднані розчини етилового спирту випарювали у вакуумі й отриманий залишок розділяли між СН2СІ2/Н2О. Органічний шар промивали соляним розчином, висушували над Na2SO4, фільтрували і випарювали у вакуумі. Отримане масло дистилювали під вакуумом (2мм Hg, 65°С), одержуючи 3,25г (63%) проміжного аміну. ІЧ: 2974, 2930, 2876, 1126 і 1059 см-1. 1Н Я МР (500МГц) d 5,37 (2Н, с), 4,63 (1Н, т, J=6,0Гц), 3,74 (2Н, т, J=6,5Гц), 3,65 (2Н, м), 3,51 (2Н, м), 1,91 (2Н, к, J=6,2Гц) і 1,21м.ч. (6Н, т, J=7,1Гц). Аргон барботували в розчин 7,5г (27ммоль) етил 7-гідрокси-9-оксо-3аН-бензо[е]піролідино[2,1b]1,3-оксазин-6-карбоксилату (сполука Прикладу 7) в 75мл 1:1 МеОН:1Μ NaOH. Отриманий розчин відразу перемішували і потім видаляли МеОН у вакуумі. рН розчину яскраво-жовтого кольору доводили до 4,0 концентрованою соляною кислотою. Важкий білий осад збирали на воронці Бухнера і промивали невеликими порціями води, одержуючи 6,6г проміжної саліцилової кислоти (98%) після висушування протягом декількох годин при 0,2мм Hg. До суспензії проміжної саліцилової кислоти (400мг, 1,59ммоль) у 10мл сухого диметилформаміду додавали 1,1'-карбонілдіімідазол (257мг, 1,59ммоль). Реакційну суміш ставала гомогенною через 5 хвилин. Після перемішування при кімнатній температурі протягом 18 годин, до розчину додавали амін (0,45мл, 2,7ммоль). Далі реакційну суміш перемішували протягом 1 години при кімнатній температурі і потім промивали EtOAc/Н2О. Органічний шар промивали п'ятьма 50мл порціями EtOAc. Об'єднані органічні фази промивали 1N НСІ, насиченим NaHCO3 і соляним розчином, висушували над Na2SO4, фільтрували ι концентрували у вакуумі. Після висушування при пониженому тиску протягом 1 години, флеш-хроматографія залишку (EtOAc:гексан, 1:1) давала чисту речовину. Цей проміжний продукт розчиняли в 5 мл СН2СІ2 і обробляли 3 краплями H2SO4 і перемішували при кімнатній температурі протягом 2 годин. Потім реакційну суміш промивали насиченим NaHCO3, висушували над Na2SO4, фільтрували і випарювали у вакуумі. Тверду речовину кристалізували з CH2CI2/Et2 О, з одержанням 240мг (32%) майже-білого порошку. Т.пл.: 245-250°С. ІЧ: 1666 і 1458 см -1. 1Н ЯМР (500МГц) d 7,58 (0,5Н, с), 7,56 (0,5Н, с), 7,54 (0,5Н, с), 7,52 (0,5Н, м), 5,76 (1Н, м), 5,47 (1Н, к, J=5,7Гц), 4,31 (1Н, м), 4,24 (1Н, м), 3,85 (1Н, м), 3,62 (1Н, м), 2,80 (1Н, м), 2,71 (1Н, м), 2,45 (1Н, м), 2,27 (1Н, м), 2,14 (1Н, м) і 1,96м.ч. (1Н, м). Приклад 47 Одержання (R,S),(R,S)-6-[(2етоксипіролідиніл)карбоніл]-7-гідрокси-3aHбензо[е]піролідино[2,1-b]1,3-оксазапергідроїн-9ону 52 До суспензії проміжної саліцилової кислоти (див. Приклад 46) (411мг, 1,65ммоль) у 10мл сухого диметилформаміду додавали 1,1'карбонілдіімідазол (267мг, 1,65ммоль). Реакційна суміш відразу ставала гомогенною. Після перемішування при кімнатній температурі протягом 16 годин, до розчину додавали O-3,3діетоксипропілгідроксиамін (344мкл, 2,06ммоль). Через 1 годину реакційну суміш промивали 1N НСІ, насиченим Na2HCO3 і соляним розчином, висушували над Na2SO4, фільтрували і концентрували у вакуумі. Проміжний продукт розчиняли в 15мл сухого СН2СІ2 і обробляли камфорсульфоновою кислотою (100мг, 0,430ммоль). Через 0,5 годин, реакційну суміш промивали насиченим NaHCO3, висушували над Na2SO4, фільтрували і концентрували. Після флеш-хроматографії масляного залишку (СН2СІ2:МеОН, 50:1) одержували 220мг (38%) жовтої твердої речовини. Т.пл.: 138-140°С. ІЧ: 1667 і 1451 см -1. 1Н ЯМР (500МГц) d 10,83 (0,5Н, с), 10,79 (0,5Н, с), 7,78 (0,5Н, с), 7,76 (0,5Н, с), 7,52 (0,5Н, с), 7,50 (0,5Н, м), 6,02 (1Н, м), 5,46 (1Н, м), 4,34 (1Н, м), 3,99 (0,5Н, м), 3,93 (0,5Н, м), 3,84 (1Н, м), 3,78 (1Н, м), 3,70 (1Н, м), 3,63 (1Н, м), 2,51 (1Н, м), 2,43 (1Н, м), 2,38 (1Н, м), 2,23 (1Н, м), 2,12 (1Н, м), 1,93 (1Н, м) і 1,25м.ч. (3Н, м). Приклад 48 Одержання (R,S),(R,S)-6-[(3гідроксипіролідинил)карбоніл]-3аНбензо[е]піролідино[2,1-b]1,3-оксапергідроїн-9-ону Розчин 3-гідроксипіролідину (1,0г, 11,5ммоль) і імідазолу (1,72г, 25,2ммоль) у 20мл СН 2СІ2 одержували в 100мл 3-горлій колбі, що споряджена термометром, і потім охолоджували до 0°С. через шприц з насосом протягом 1 години додавали розчин трет-бутилдиметилсилілхлориду (3,80г, 25,2ммоль) у 15мл СН2СІ2. Розчин перемішували при кімнатній температурі, відзначаючи повільне осадження білої твердої речовини (гідрохлорид імідазолу). Через 18 годин осад відфільтровували і промивали СН 2СІ2. Потім розчин концентрували у вакуумі, і отримане жовтогаряче масло повторно розчиняли в метанолі. Після перемішування спиртового розчину протягом 2 годин розчин знову випарювали у вакуумі і потім розподіляли між СН2СІ2/Н2О. Органічний шар промивали соляним розчином, висушували над Na2SO4l фільтрували і концентрували. Залишок висушували під вакуумом протягом декількох годин, одержуючи 1,9г (83%) 3 53 79940 гідроксипіролідин-трет-бутил-диметилсилілового етеру у вигляді в'язкого оранжевого масла. ІЧ: 3150, 2953, 2928, 2888,1413 і 1255 см-1. До суспензії проміжної саліцилової кислоти (див. Приклад 46 для його синтезу) (430мг, 1,84ммоль) у 10мл сухого СН 2СІ 2 додавали 1,1'карбонілдіімідазол (373мг, 2,30ммоль). Реакційну суміш ста вала гомогенною дуже повільно і також відбувалось повільне виділення СО2. Через 1 годину при кімнатній температурі додавали розчин 3-гідроксипіролідин-трет-бутил-диметилсилілового етеру (556мг, 2,76ммоль) у 3мл СН 2СІ2. Через 16 годин реакційну суміш концентрували у вакуумі при кімнатній температурі. Залишок розподіляли між EtOAc/1N НСІ, і органічний шар промивали насиченим NaHCO3, соляним розчином, висушували над Na2SO4, фільтрували і концентрували у вакуумі. Флеш-хроматографією неочищеної твердої речовини (EtOAc:гексан 1:1-1,5) одержували 648мг (84%) силілового етеру у вигляді чистого масла. ІЧ: 1671, 1630 і 1434 см -1. До розчину силілового етеру (598мг, 1,43ммоль) у 10мл тетрагідрофурану додавали гідрат фториду тетраетиламонію (321мг, 2,15ммоль). Через 1 годину реакційну суміш випарювали у вакуумі і отриманий залишок розділяли між СН 2СІ2/Н2О. Органічний шар промивали соляним розчином, висушували над Na2SO4, фільтрували і концентрували у вакуумі. Після флешхроматографії залишку (СНСІ2:МеОН, 30:1) одержували 323мг (75%) спирту у вигляді білої твердої речовини. Т.пл.: 187-188°С. ІЧ: 3400,1668,1620 і 1430 см-1. 1Н ЯМР: 7,98 (1Н, м), 7,20 (1Н, м), 7,10 (1Н, м), 5,50 (1Н, м), 4,60 (0,5Н, с), 4,47 (0,5Н, с), 3,86-3,38 (7Н, м), 2,45 (1Н, м), 2,27 (1Н, м) і 2,151,92м.ч. (4Н, м). Приклад 49 Одержання (R,S),(R,S)-2-метил-13aH,7aHпіперазоно[2,1-b][2",1"-3',2’](оксазапергідроїно[5',6'4,5]бензо[e]1,3-оксазин-3,5,11-триону Суміш етилового естеру саліцилової кислоти (Приклад 7) (632мг, 2,28ммоль) і N-2,2диметоксиметил-N-метилгліцинаміду (2,0г, 11,3ммоль) нагрівали до 130°С. Із суміші утворювався гомогенний розплав, що нагрівали протягом 10 хвилин. Залишок хроматографували (EtOAc), а проміжний продукт розчиняли в 20мл СН 2СІ2 і обробляли 6 краплями концентрованої H2SO4. Через 6 годин реакційну суміш нейтралізували насиченим NaHСО3, екстрагували з СН 2СІ2, висушували над Na2SO4, фільтр ували і випарювали. Після флеш-хроматографії залишку (EtOAc) одержували 325мг (42%) білої твердої речовини. Т.пл.: 253256°С. ІЧ: 1660 11459 см -1. 1Н ЯМР (500МГц) d 7,57 (0,5Η, с), 7,56 (0,5Η, с), 7,56 (0,5Η, с), 7,54 (0,5Η, м), 5,57 (1Н, дд, J=4,2/6,8Гц), 5,48 (1Н, к, J=6,1Гц), 4,45 (1Н, дд, J=6,1/17Гц), 4,26 (1Н, д, J=17Гц), 4,23 54 (1Н, д, J=17Гц), 3,86 (2Н, м), 3,76 (1Н, м), 3,62 (1Н, м), 3,10 (1,5Н, с), 3,10 (1,5Н, с), 2,45 (1Н, м), 2,27 (1Н, м), 2,14 (1Н, м) і 1,96м.ч. (1Н, м). Приклад 50 Одержання (R,S),(R,S)-5-нітро-3а,9аНпіролідино[2,1-b]піролідино[2",1"-3',2'](1,3оксазапергідроїно)[5',6'-2,1]бензо[4,5-е]1,3оксазин-6,12-діону Метод А: До 300мг (1ммоль) (R,S),(R,S)-3а,9аНпіролідино[2,1-b]піролідино[2",1"-3',2'](1,3оксазино)[5',6'-2,1]бензо[4,5-е]1,3оксазапергідроїн-6,12-діону (продукт з Прикладу 1) у 30мл оцтового ангідриду додавали по краплях 3,5мл (43ммоль) 90% азотної кислоти, більш ніж протягом 10 хвилин при кімнатній температурі. Через 30 хвилин реакційну суміш розподіляли між 100мл СН 2СІ2 і 200мл насиченого водного NaHCO3. Водну фаз у екстрагували 3´100мл СН2СІ2 і об'єднані органічні шари висушували з MgSO4 . Концентрацією розчину у вакуумі протягом 4 годин під вакуумом 0,1мм Hg одержували 408мг коричневої піни. Хроматографією на 200г кремнезему (елюювали EtOAc) одержували 220мг продукту, що повторно розчиняли в двох плямах з подібними значеннями Rf при експериментах тонкошарової хроматографії з використанням EtOAc. Аналіз РХ/МС (С-18) показав два піки, що містять 95,5% речовини: 346 (М+1). ІЧ: 1778, 1548, 1463 і 1426 см -1. Метод Б: До 900мг (3,0ммоль) продукту з Прикладу 1 в 20мл 0°С H2SO4 додавали по краплях протягом 10 хвилин, 2мл 90% HNO3. Через 30 хвилин, реакційну суміш виливали в 200мл холодної води, а органічні продукти екстрагували 3´50мл СН 2СІ2. Об'єднані органічні шари промивали 100мл води і висушували над MgSO4. Розчинник видаляли у вакуумі з одержанням 1,1г 5-нітро-3а,9аНпіролідино[2,1-b]піролідино[2",1"-3',2'](1,3оксазапергідроїно)[5',6'-2,1]бензо[4,5-е]1,3оксазин-6,12-діону. У результаті такої нітрування з використанням сірчаної кислоти одержували продукт нітрування, що складається головним чином з менш рухомої плями тонкошарової хроматографії, тобто, більш два полярні з чотирьох можливих діастереомерів. Вищеописаний процес повторювали з 800мг (2,7ммоль) вихідної речовини, одержуючи додатково 1,0г продукту. Об'єднану неочищену нітросполуку (2,1г) фільтрували крізь 40г силікагелю в 50мл EtOAc, потім 300мл EtOAc, з одержанням 1,9г безбарвної речовини, що давало піну при висушуванні. Кристалізацією з мінімального об'єму EtOAc одержували 450мг очищеного більш полярного ізомеру (86%), на основі ЯМР. Матковий розчин давав менш полярний ізомер (2:1) у вигляді 55 79940 безбарвної твердої речовини після його витримуванням протягом ночі. Приклад 51 Одержання (R,S),(R,S)-5-аміно-3а,9аНпіролідино[2,1-b]піролідино[2",1"-3',2'](1,3оксазино)[5',6'-4,5]бензо[е]1,3-оксазапергідроїн6,12-діону До 400мг (1,15ммоль) (R,S),(R,S)-5-нітро3а,9аН-піролідино[2,1-b]піролідино[2",1"-3',2'](1,3оксазапергідроїно)[5',6'-2,1]бензо[4,5-е]1,3оксазин-6,12-діону (продукт з Прикладу 50, Метод А) у 40мл EtOAc, додавали 200мг 10% Pd/C, при. промиванні аргоном. Отриману суспензію відразу обробляли воднем при 50-60псі у гідрогенаторі Парра. Каталізатор видаляли вакуумним фільтруванням за допомогою целіту, а фільтрат концентрували до твердої речовини у вакуумі. Після хроматографії залишку на силікагелі з 25% EtOAc у СН2СІ2 одержували 253мг (70% вихід) безбарвної твердої речовини з наступними властивостями: ІЧ: 3447, 3333, 1670, 1654, 1595, 1431, 1388, 1341, 1079 і 775 см -1. 1Н ЯМР (300МГц, CDCI3) d 6,73 (1Н, с), 6,72 (1Н, с), 6,04 (2Н, ш с), 5,46 (1Н, т, J=6,0Гц), 5,38 (1Н, т, J=6,0), 3,81 (2Н, м), 3,58 (2Н, м), 2,43 (2Н, м), 2,29 (2Н, м) 2,15 (2Н, м) і 1,94м.ч. (2Н, м). Приклад 52 Одержання (R,S),(R,S)-5-аміно-3а,9аНпіролідино[2,1-b]піролідино[2",1"-3',2'](1,3оксазино)[5',6'-4,5]бензо[е]1,3-оксазапергідроїн6,12-діону До 450мг (1,30ммоль) продукту з Прикладу 50, Метод В, у 80мл СН 2СІ2 додавали 180мг 10% Pd/C, під аргоном. Отриману суспензію відразу гідрували при 50-60псі у гідрогенаторі Парра. Каталізатор видаляли фільтруванням крізь шар целіту і розчин концентрували з одержанням 470мг неочищеного продукту. Після хроматографії на силікагелі, використовуючи 25% EtOAc у СН 2СІ2і одержували 380мг (93%) у вигляді безбарвної твердої речовини з наступними властивостями. ІЧ: 3470, 3329, 1673, 1650, 1592, 1542, 1429, 1388, 1340,1224, 1098, 1079 і 775 см -1. 1Н ЯМР (300МГц, CDCI3) d 6,72 (1Н, с), 6,05 (2Н, ш с), 5 ,46 (1Н, т, J=6,0Гц), 5,38 (1Н, т, J=6,0Гц), 3,80 (2Н, м), 3,61 (2Н, м), 2,42 (2Н, м), 2,23 (2Н, м), 2,10 (2Н, м) і 1,96м.ч. (2Н, м). Приклад 53 56 Одержання (R,S),(R,S)-5-аміно-11-бром3а,9аН-піролідино[2,1-b]піролідино[2'',1"-3',2'](1,3оксазино)[5',6'-4,5]бензо[е]1,3-оксазапергідроїн6,12-діону До 450мг (1,5ммоль) продукту з Прикладу 50 у 60мл EtOAc додавали 200мг Pd/C під аргоном, ι отриману суспензію гідрували в гідрогенаторі Парра протягом 18 годин при тиску 50-60псі. Реакційну суміш фільтрували і розчинник видаляли у вакуумі з одержанням 212мг (0,67ммоль, 45%) анілінового проміжного продукту у вигляді прозорої жовтої твердої речовини. Тонкошарова хроматографія (EtOAc) вказує на повне перетворення. ЯМР вказує (1:1:1:1) на наявність суміші діастереомерів. Аналіз РХ-МС вказує на 98,2% чистоту при загальному потоці іонів з (М+Н)=315,9 як домінуючого піку і узгоджується з структурою. Анілін розчиняли в 25мл СН 2СІ2 (безводний) і при 0°С під аргоном додавали 450мг (2,8ммоль) Вr2. Перша крапля Вr2 негайно знебарвлювалась. Через 15 хвилин при 0-5°С реакційну суміш розчиняли в 50мл СН2СІ2. Органічну фазу промивали 20мл 10% водного бісульфіту натрію і 30мл насиченого водного NaHCO3, висушеного над Na2SO4 і концентрували у вакуумі з одержанням 240мг (91%) блідо-зеленої твердої речовини, що мало наступні властивості: ІЧ: 3473, 3333, 2977, 2883, 1652, 1591, 1527, 1451 і 1386 см -1. 1Н ЯМР (300МГц, CDCI3) d 6,1 (2Н, ш с), 3,94 (1Н, м), 3,83 (1Н, м), 3,53 (2Н, м), 2,42 (2Н, м), 2,28 (2Н, м), 2,11 (2Н, м) і 1,99м.ч. (2Н, м). Приклад 54 Одержання (R,S),(R,S)-N-(6,12-діоксо-3а,9аНпіролідино[2,1-b]піролідино[2",1"-3',2'](1,3оксазино)[5',6'-4,5]бензо[е]1,3-оксазапергідроїн-5іл]ацетаміду До 850мг аніліну (проміжний продукт Прикладу 53) у 20мл Ас2О додавали 1 краплю H2SO4. Через 1 годину реакційну суміш перемішували з 50мл льодяної води. Отримані тверді речовини виділяли фільтруванням, промивали декількома невеликими порціями води і висушували на повітрі з одержанням 700мг неочищеного ацетаміду. Цю неочищену речовина кристалізували з 10% EtOH у EtOAc з одержанням 400мг безбарвної твердої речовини (1:1 ізомерна композиція РХ-МС), з на 57 79940 ступними властивостями: ІЧ: 3279, 2983, 1651,1464, 1428, 1391, 1246,1080 ι 777 см-1. 1Н ЯМР (300МГц, CDCI3) d 9,76 (0,5Н, с), 9,67 (0,5Н, с), 7,40 (0,5Н, с), 7,38 (0,5Н, с), 5,63 (0,5Н, т, J=6,0Гц), 5,46 (1H, м), 5,40 (0,5Н, т, J=6,0Гц), 3,84 (2H, м), 3,60 (2Н, м), 2,41 (2Н, м), 2,22 (2Н, м), 2,20 (3Н, с), 2,15 (2Н, м) і 1,96м.ч. (2Н, м). Матковий розчин кристалізації з етилацетату концентрували у вакуумі, а залишок хроматографували на 100г силікагелю з 10% EtOH у EtOAc, з одержанням 160мг більш рухли вого ізомеру. Ця речовина мала наступні властивості: Чистота: 98,8% з ізомерним складом 50:1 використовуючи С-18 LC/MS; (М+Н)=357,9. ІЧ: 3272, 1656, 1466, 1421, 1367,1243, 1080 і 779 см -1. 1Н ЯМР (300МГц, CDCI3) d 9,76 (1Н, с), 7,38 (1Н, с), 5,63 (1Н, т, J=5,4Гц), 5,46 (1H, т, J=6,0Гц), 3,86 (2H, м), 3,60 (2Н, м), 2,46 (2Н, м), 2,27 (2Н, м), 2,20 (3Н, с), 2,05 (2Н, м) і 1,91м.ч. (2Н, м). Приклад 55 Одержання (R,S),(R,S)-N-(11-хлор-6,12-діоксо3a,9aH-піролідино[2,1-b]піролідино[2",1"-3',2'](1,3оксазино)[5',6'-4,5]бензо[е]1,3-оксазапергідроїн-5іл)ацетаміду У розчин 250мг (0,70ммоль) продукту з Прикладу 54 в 50мл СН 2СІ2 барботували СІ2 з колби протягом 2 секунд. Реакційну суміш промивали 50мл 20% водного NaHSO3, і 50мл насиченого водного NaHCO3, висушували над MgSO4 і концентрували у вакуумі. Після перекристалізації з EtOAc, ви хід становив 250мг (64%) безбарвної твердої речовини з наступними властивостями: РХ-МС (С-18) вказують на чистоту 96,3% (М(35СІ)+Н)=391,8, (М( 37СІ)+Н)=393,8. ІЧ: 3272, 1673, 1458, 1422, 1246, 1064 і 732 см -1. Приклад 56 Одержання (R,S)-3-(3-оксо-3піролідинилпропіл)-2Н,6аН-піролідино[2",1"3',2']1,3-оксазино[5',6'-4,5]бензо[е]1,3оксазапергідроїн-4,10-діону До 2,5г (10ммоль) проміжної саліцилової кислоти (див. Приклад 46 для гідролізу етилового естеру саліцилової кислоти з Прикладу 7) у 40мл диметилформаміду додавали 1,8г (11ммоль) CDI під атмосферою аргону при перемішуванні. Отриману суспензію нагрівали до 85-100°С, при цьому вона ставала гомогенним коричневим розчином. 58 Через 5 годин при тій же температурі додавали 3,0г b-аланін НСІ, далі 5мл діізопропілетиламіну, і отриманий розчин відразу перемішували при кімнатній температурі. Реакційну суміш концентрували при 1мм Hg/40°C, а залишок розділяли між 200мл СН 2СІ2 і 100мл 1Μ водного НСІ. Водний шар промивали 3´50мл СН 2СІ2. Об'єднані органічні шари промивали 100мл води, висушували над Na2SO4 і концентрували у вакуумі з одержанням 3,8г коричневого масла. Хроматографією на 75г силікагелю 1л EtOAc одержували 1,2г (34%) проміжного естеру у вигляді безбарвної твердої речовини з наступними властивостями: ХІ-МС, М+1=390amu. До 1,2г (3,5ммоль) естеру, суспендованого в 90мл EtOH додавали 10мл EtOH, потім 10мл води і 1,0мл (10ммоль) 10N NaOH. Через 5 хвилин одержували яскраво-жовтий розчин, а через 30 хвилин вихідний матеріал зникав (тонкошарова хроматографія, EtOAc). Реакційну суміш концентрували у вакуумі, i водний залишок екстрагували 100мл EtOAc, підкислювали до рН 3,0 за допомогою 6N НСІ, і потім екстрагували 3´100мл EtOAc. Ор ганічні шари об'єднували, висушували над MgSO4, і концентрували у вакуумі з одержанням 1,0г проміжного продукту карбонової кислоти (91%). До 1,0г (3,1ммоль) карбонової кислоти в 20мл диметилформаміду додавали 0,55г (3,4ммоль) CDI, потім 12мг (0,1ммоль) DMAP, під атмосферою аргону при перемішуванні. Через 4 години додавали 2мл піролідину і реакцію залишали на ніч. Диметилформамід видаляли у вакуумі, а залишок розділяли між 100мл СН 2СІ2 і 50мл 1Μ НСІ. Після висушування над MgSO4, розчинник видаляли у вакуумі з одержанням 1,2г неочищеного проміжного аміду. Колонковою хроматографією на 50г силікагелю (EtOAc) одержували 700мг чистого проміжного аміду (54%). До 0,60г (1,9ммоль) аміду в 200мл 40% СН2СІ2/СНСІ3 (безводний) додавали 11г триоксану (122ммоль), потім 4,6г (20ммоль) камфорсульфонової кислоти і 18 крапель H2SO4. Реакційну суміш перемішували із зворотнім холодильником під атмосферою аргону. Воду, що утворюється в ході реакції, видаляли 100г 3А молекулярними ситами, що знаходиться в бічному відгалуженні додаткової воронки. Через 4 години реакція завершувалася (тонкошарова хроматографія, 10% EtOH у EtOAc). Реакційну суміш охолоджували до кімнатної температури і промивали 100мл охолодженої 1Μ NaOH. Водний шар промивали 2´100мл СНСІ3. Об'єднані органічні шари промивали 100мл води, висушували над Na2SO4 і концентрували у вакуумі. Після швидкого висушування зразка під вакуумом (0,1мм Hg) одержували 600мг неочищеного бісбензоксазину. Хроматографією на 75г силікагелю з EtOAc одержували 360мг безбарвної твердої речовини. Тверду речовину повторно кристалізували, розчиняючи його в 1мл СНСІ3 і повільно додаючи 30мл естеру. Вихід становив 260мг (36%) безбарвних кристалів з наступними властивостями: Т.пл.=170-171°С. ІЧ (тонка плівка): 1665, 1638 і 1453, см -1. 1Н ЯМР (500МГц, CDCI3) d 7,53 (с, 1Н) 7,52 (1Н, с), 5,34 (1Н, т, J=6,0Гц), 5,33 (2Н, м), 3,84 59 79940 (1Н, м) 3,85 (2Н, м) 3,63 (1Н, м) 3,45 (2Н, т, J=6,7Гц) 3,38 (2Н, т, J=6,6Гц) 2,71 (2Н, м) 2,42 (1Н, м) 2,23 (1Н, м) 2,14 (1Н, м) 1,97 (2Н, м), 1,95 (1Н, м) і 1,85м.ч. (2Н, м). Приклад 57 Одержання (R,S)-3-(гідроксиметил)-2Н,6аНпіролідино[2",1"-3',2']1,3-оксазино[5',6'4,5]бензо[е]1,3-оксазапергідроїн-4,10-діону Продукт (2,7г; 10ммоль) із Прикладу 7 нагрівали під атмосферою аргону при перемішуванні до 180-200°С протягом 3 хвилин з 8,0г (48,4ммоль) 2,4-диметоксибензиламіну. Після охолодження реакційної суміші до 100°С, її розчиняли в 100мл СНСІ3 і промивали 100мл 3М НСІ і 100мл води. Органічний розчин висушували над MgSO4 і концентрували у вакуумі з одержанням 10г неочищеного проміжного продукту (одна пляма на тонкошаровій хроматографії з EtOAc). Неочищений проміжний продукт розчиняли в 50мл TFA під атмосферою аргону. Через 2 години тонкошарова хроматографія не показувала наявність вихідної речовини. Розчин TFA виливали повільно в 300мл насиченого водного NaHCO, а осад збирали фільтруванням. Після швидкого висушування на вакуумній лінії, вихід проміжного саліциламіду становив 3,0г. До 3,0г саліциламіду в 20мл 37% водного формальдегіду додавали 20мл мурашиної кислоти й отриману суспензію кип'ятили із зворотнім холодильником під атмосферою аргону. Отриманий розчин кип'ятили із зворотнім холодильником протягом 3 годин, після чого більшу частин у розчинника дистилювали. Після того, як отриманий залишок охолоджували до кімнатної температури, його суспендували в 200мл холодного 1Μ NaOH. Продукт екстрагували з водного розчину 5´150мл СНСІ3. Об'єднані органічні фракції висушували над Na2SO4 і концентрували у вакуумі з одержанням 1,7г неочищеного продукту (головним чином одна пляма на тонкошаровій хроматографії з EtOAc). Хроматографією 1:1 СНСІ3/EtOAc на 200г силікагелю одержували 1,1г продукту (одна пляма на тонкошаровій хроматографії), що кристалізували з СНСІ3/діетиловий етер з одержанням 900мг продукту з наступними властивостями: Т.пл.=194196°С. ІЧ (KВr) 3373, 1677, 1485, 1454 і 1291 см -1. 1 Н ЯМР (500МГц CDCI3), d 7,49 (1Н, с) 7,45 (1Н, с) 5,46 (1Н, т, J=6,0) 5,32 (2H, с) 5,04 (2Н, с) 4,05 (1Н, ш с) 3,84 (1Н, м) 3,62 (1Н, м), 2,44 (1Н, м), 2,26 (1Н, м), 2,14(1Н, м) і 1,95 (1Н, м) м.ч. Приклад 58 Одержання (R,S)-2H,3H,6aH-піролідино[2",1"3',2']1,3-оксазино[5',6'-4,5]бензо[е]1,3оксазапергідроїн-4,10-діону 60 У 40мл сухого толуолу суспендували 158мг (0,54ммоль) продукту з Прикладу 58 під атмосферою аргону при перемішуванні. Після кип'ятіння протягом 1 години реакційну суміш охолоджували і концентрували у вакуумі. Залишок суспендували в 20мл гексану і відновлювали вакуумним фільтруванням з одержанням 135мг (95%) продукту, що мав наступні властивості: Т.пл.=270-275°С роз. ІЧ: (KВr) 3183, 3055, 1695,1677, 1664,1454 і 1069 см -1. 1 Н ЯМР (300МГц, CDCI3), d 7,57 (1Н, с), 7,56, (1Н, с), 6,42 (1Н, ш с), 5,47 (1Н, т, J=6,0Гц), 5,22 (1Н, с), 5,21 (1Н, с), 3,83 (1Н, м) 3,63 (1Н, м) 2,45 (1Н, с) 2,25 (1Н, с) 2,14 (1Н, с) і 1,96м.ч. (1Н, с). РХ-МС: (С-18) показує окремий пік (М+Н) 261. Приклад 59 Одержання 3,8-біс(2-гідроксиетил)-2Н,7Н-1,3оксазапергідроїно[5',6'-4,5]бензо[е]1,3-оксазин-4,9діону До 40мл безводного етаноламіну додавали 4,0г (15,7ммоль) діетил-(2,5)дигідрокситерефталат. Отриманий розчин кип'ятили із зворотнім холодильником протягом 18 годин під атмосферою аргону. Реакційну суміш охолоджували до 100°С и потім виливали в 200мл 3N НСІ. Гарячий кислий розчин повільно охолоджували до кімнатної температури з утворенням великої кількості блідо-жовтих кристалів. Тверді речовини збирали вакуумним фільтруванням, промивали 3´50мл холодної води, і потім відразу висушували у вакуумі (200мкм Нg), з одержанням 2,5г (56%) проміжного діаміду у вигляді блідо-жовтої твердої речовини, з наступними властивостями: ХІ-МС (m+1), 285,1аmu; РХ-МС (TIC) показують 100% чистоту. Діамід розчиняли в 20мл безводного НСО2Н, що кипить, і розчин обробляли 40мл безводного СН2СІ2, 6,0г (66,7ммоль) триоксану, 1,0г CuSO4 і 5 краплями H2SO4. Отриману суспензію зберігали і кип'ятили із зворотнім холодильником протягом ночі під атмосферою аргону. Після охолодження до кімнатної температури реакційну суміш обробляли целітом, розчиняли 300мл СН 2СІ2 і потім фільтрували. Фільтрат промивали 3´100мл насиченого водного NaHCO3, висушували над Na2SO4, і висушували у вакуумі з одержанням залишку, що твердіє. Хроматографією на силікагелі залишку в EtOAc одержували 1,9 грамів (33%) диформіату вищезгаданого бісбензоксазину у вигляді безбарвної кристалічної речовини з наступними властивостями: ХІ-МС (m+1) 364,9аmu.
ДивитисяДодаткова інформація
Назва патенту англійськоюCarbonylbenzoxazine compounds for enhancing of glutamatergic synaptic responses
Автори англійськоюRogers Gary A., Mueller, Rudolf
Назва патенту російськоюСоединения карбонилбензоксазина для усиления глутаматергических синаптических ответов
Автори російськоюРоджерс Гери А.
МПК / Мітки
МПК: A61P 9/00, A61P 25/28, C07D 498/22, A61P 15/10, A61K 31/536, A61K 31/5365, A61P 25/18, C07D 498/04, A61P 25/16, A61K 31/553, A61P 25/24, C07D 413/06, C07D 265/22, A61K 31/5377, C07D 498/14
Мітки: сполуки, карбонілбензоксазину, відповідей, підсилення, глутаматергічних, синаптичних
Код посилання
<a href="https://ua.patents.su/35-79940-spoluki-karbonilbenzoksazinu-dlya-pidsilennya-glutamatergichnikh-sinaptichnikh-vidpovidejj.html" target="_blank" rel="follow" title="База патентів України">Сполуки карбонілбензоксазину для підсилення глутаматергічних синаптичних відповідей</a>
Попередній патент: Інтегрована комбінована термоенергетична мікросистема
Наступний патент: Дискова пила
Випадковий патент: Спосіб і пристрій для відновлення акумуляторної батереї












