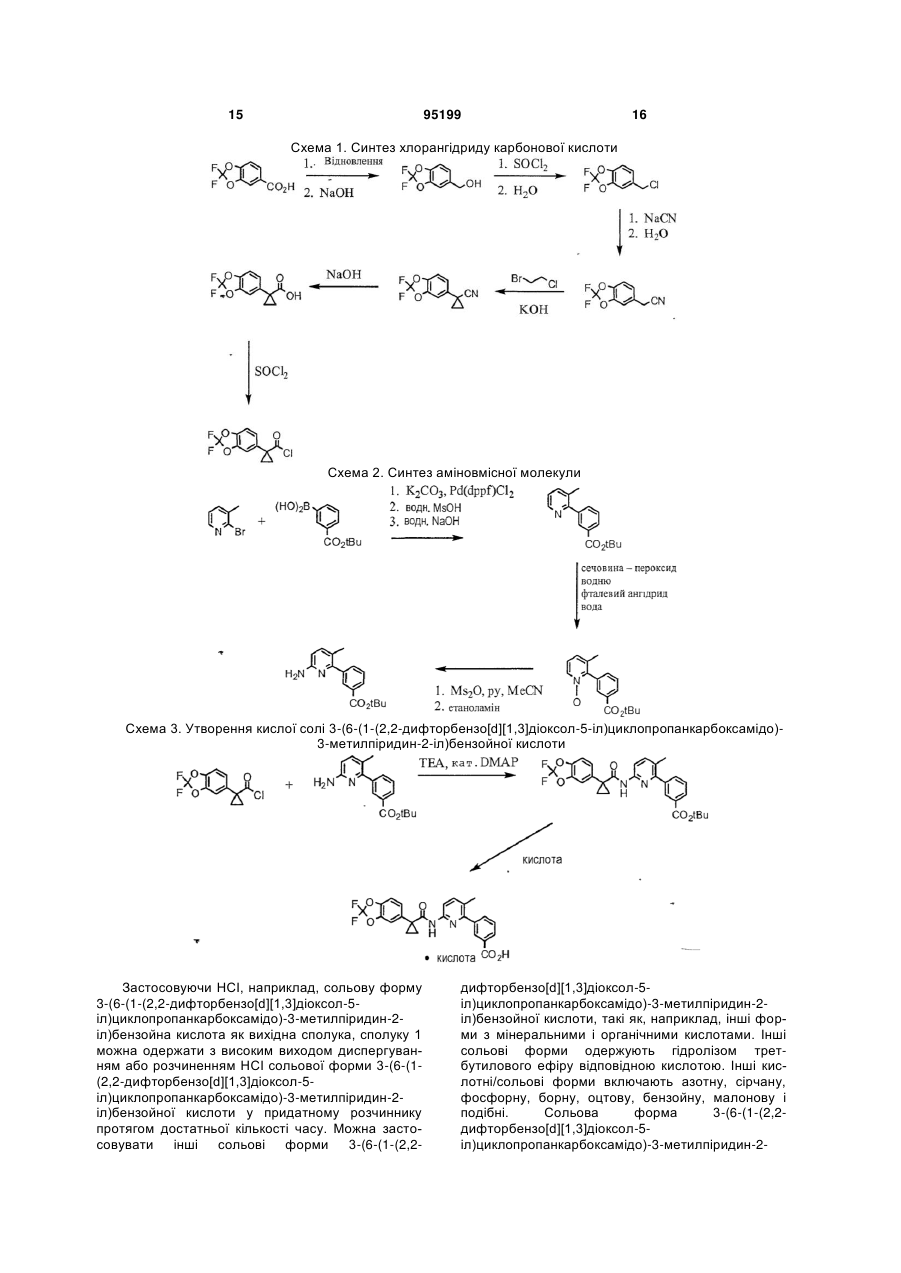
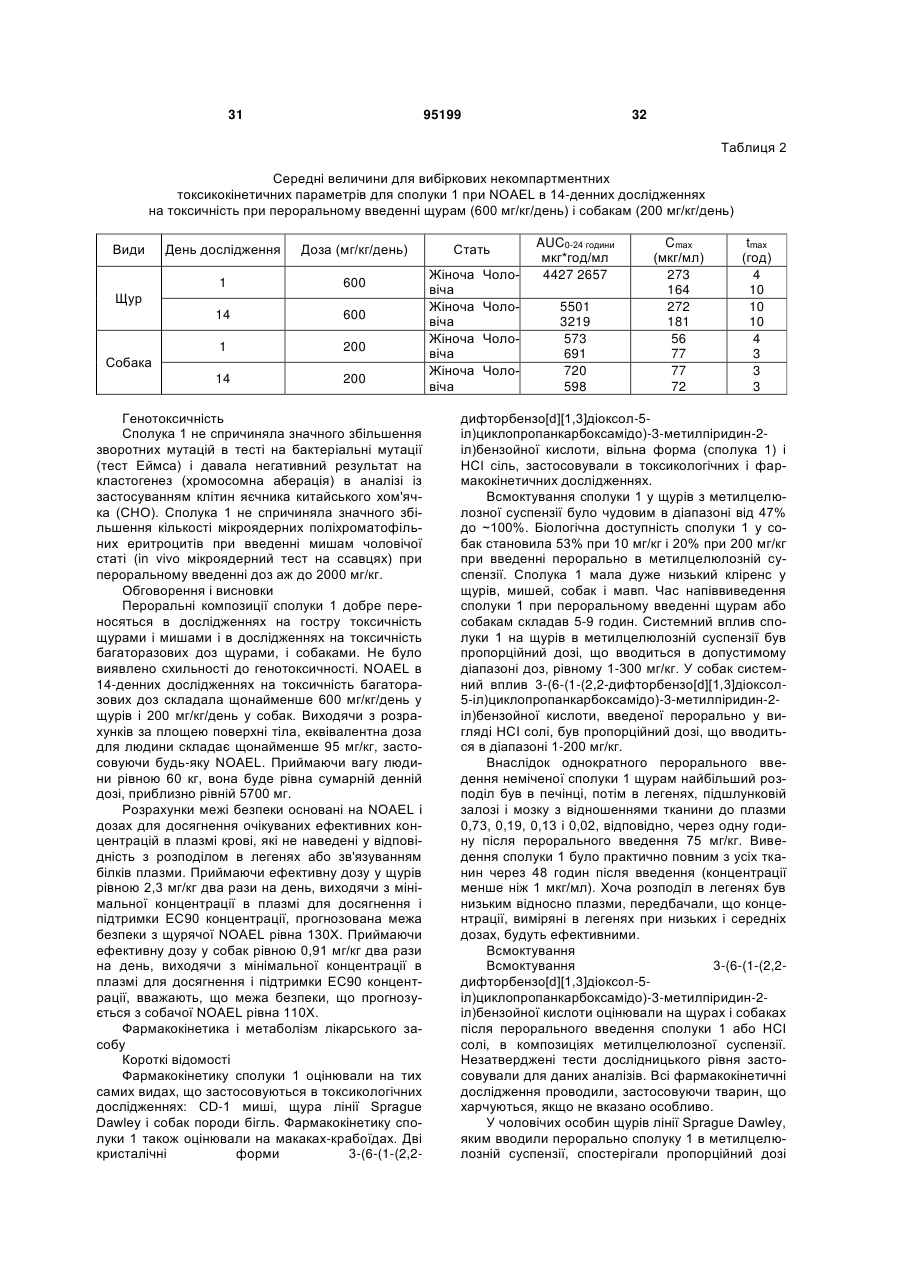
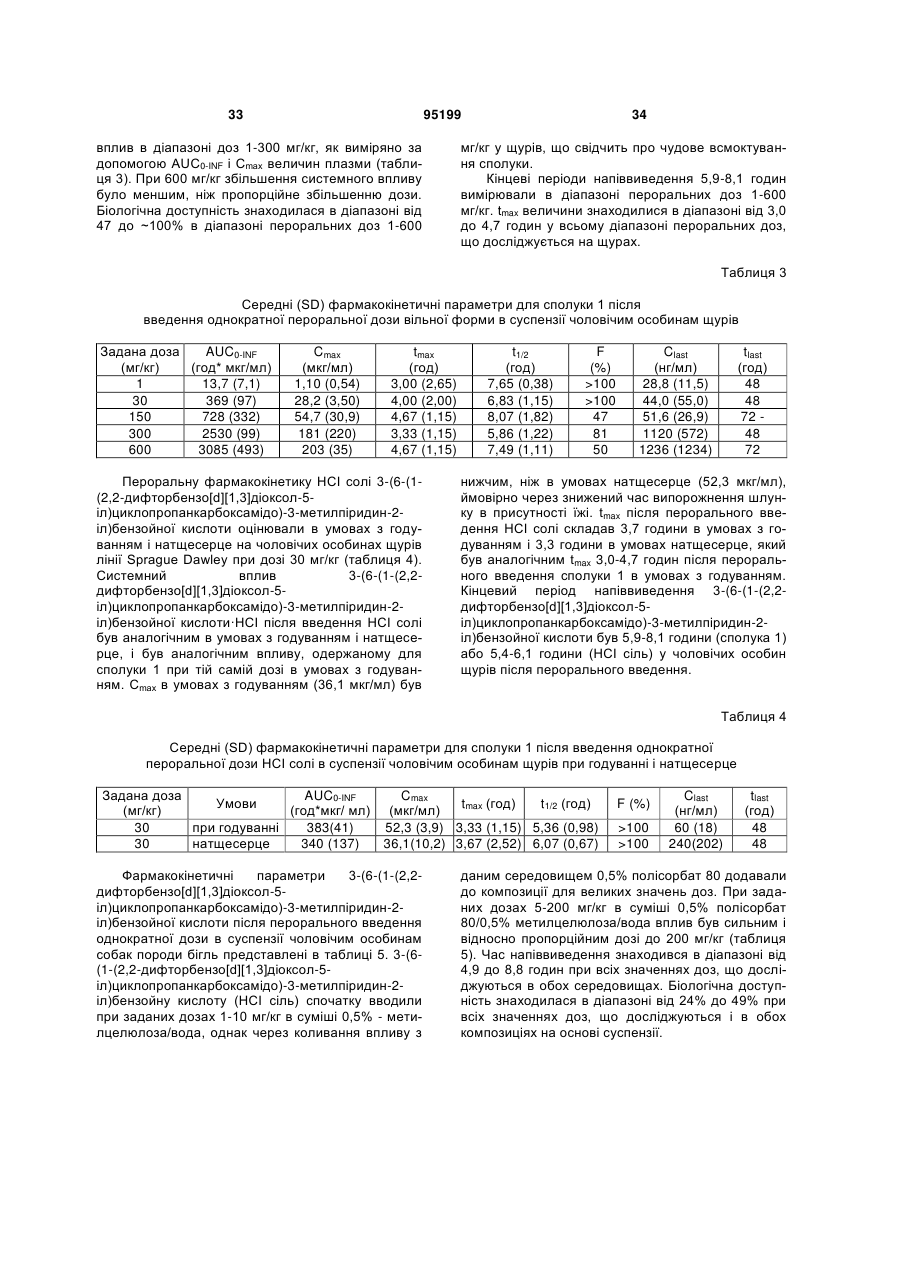
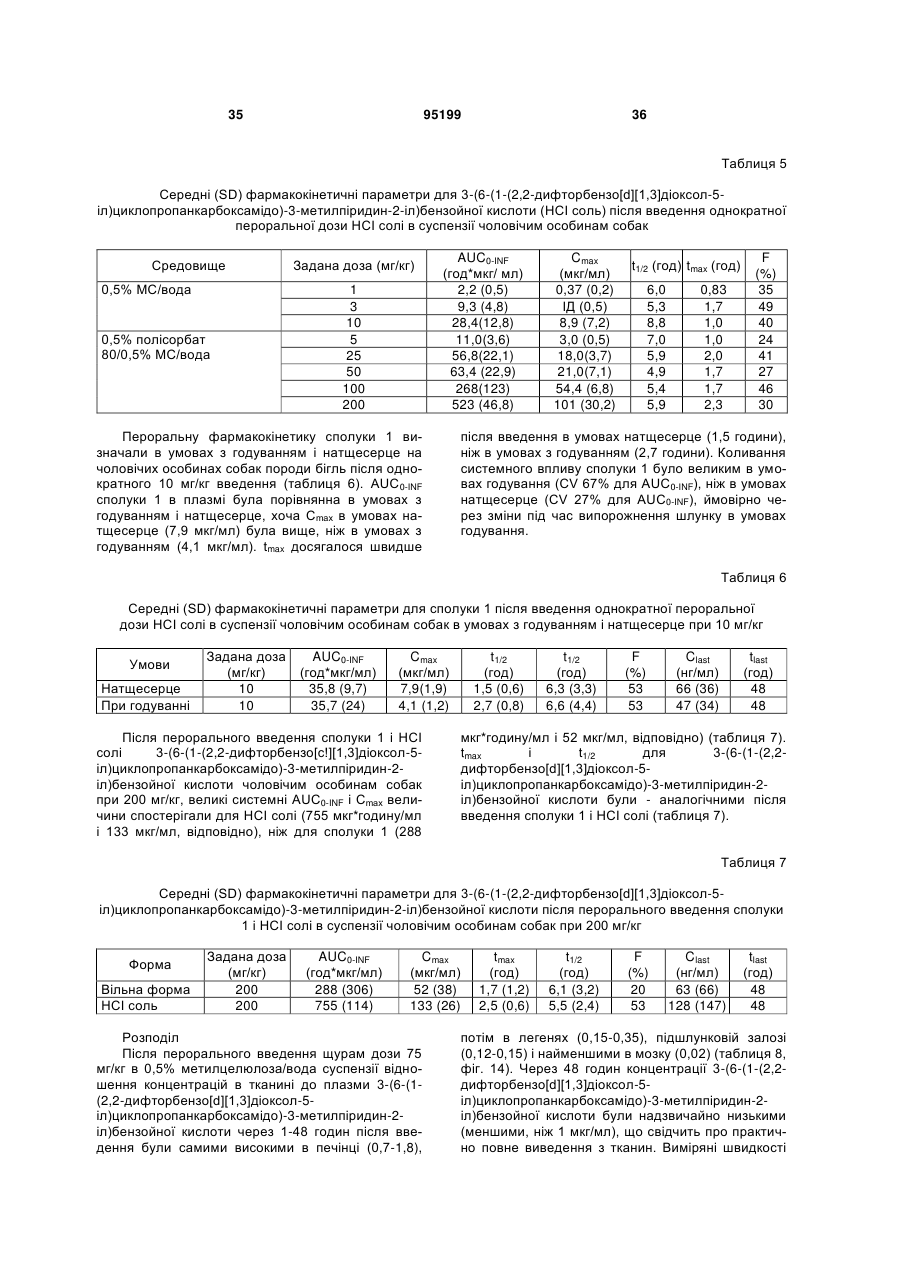
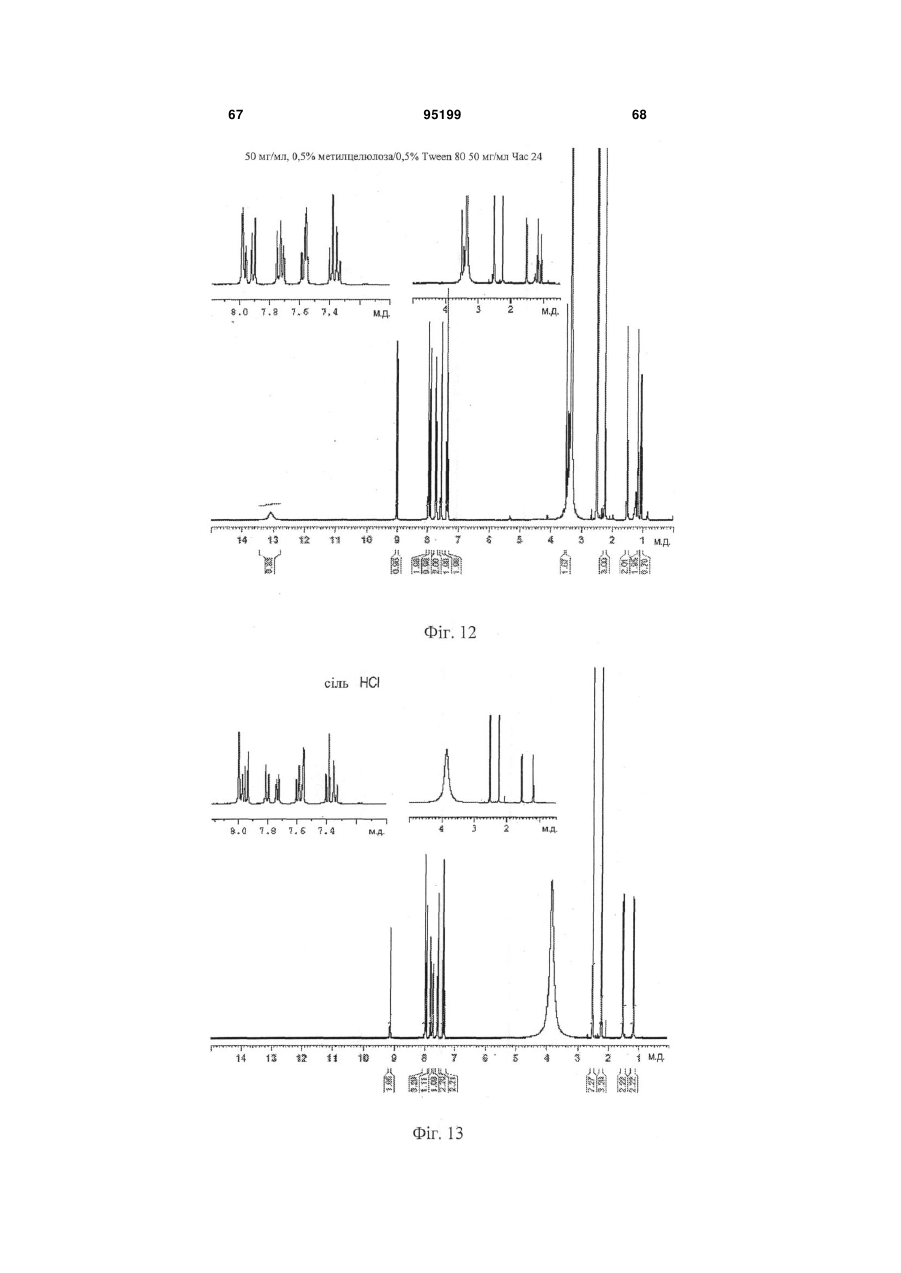
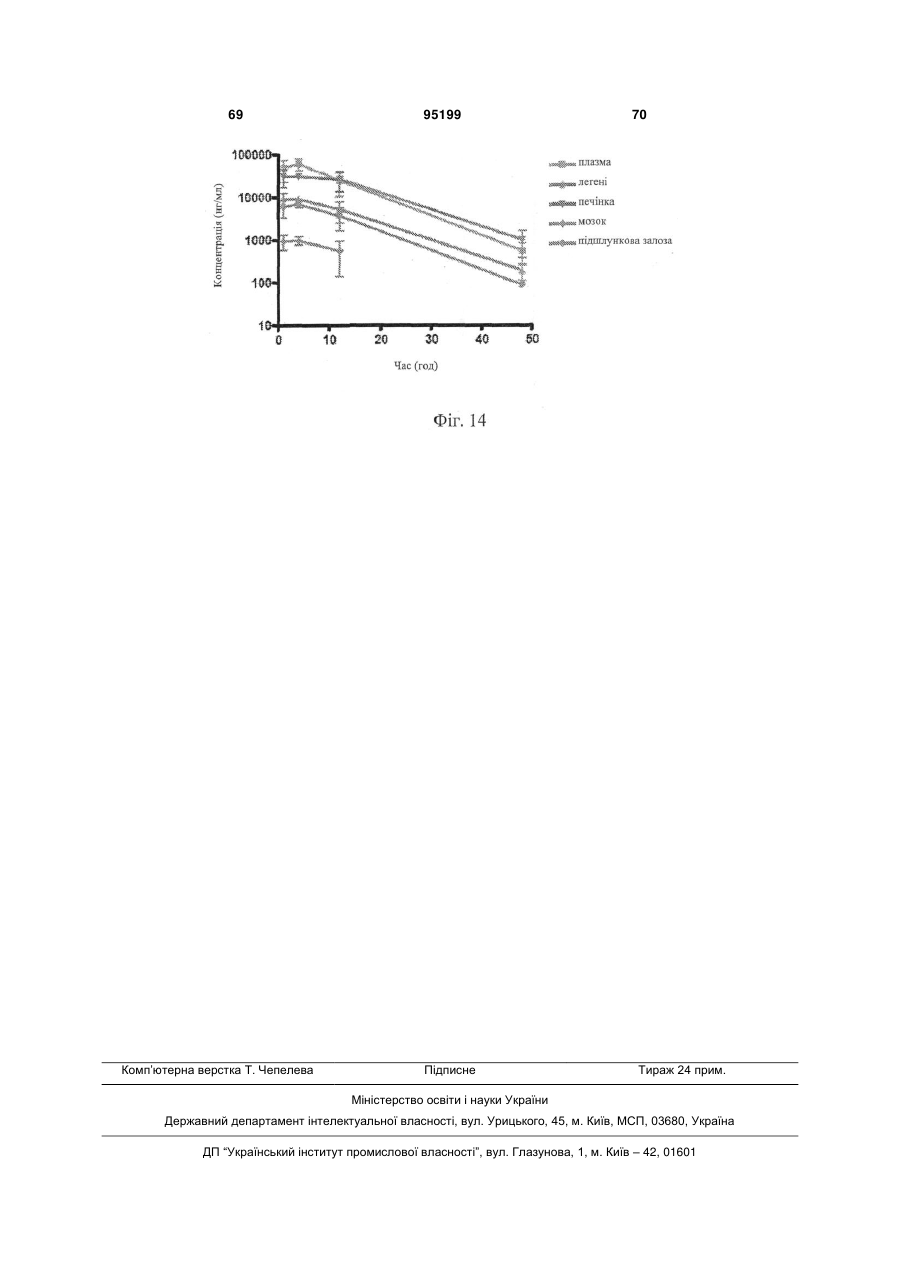
Водна композиція 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти
Формула / Реферат
1. Водна композиція, яка містить по суті кристалічну і безсольову форму 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти, воду і агент, який сприяє регулюванню в'язкості.
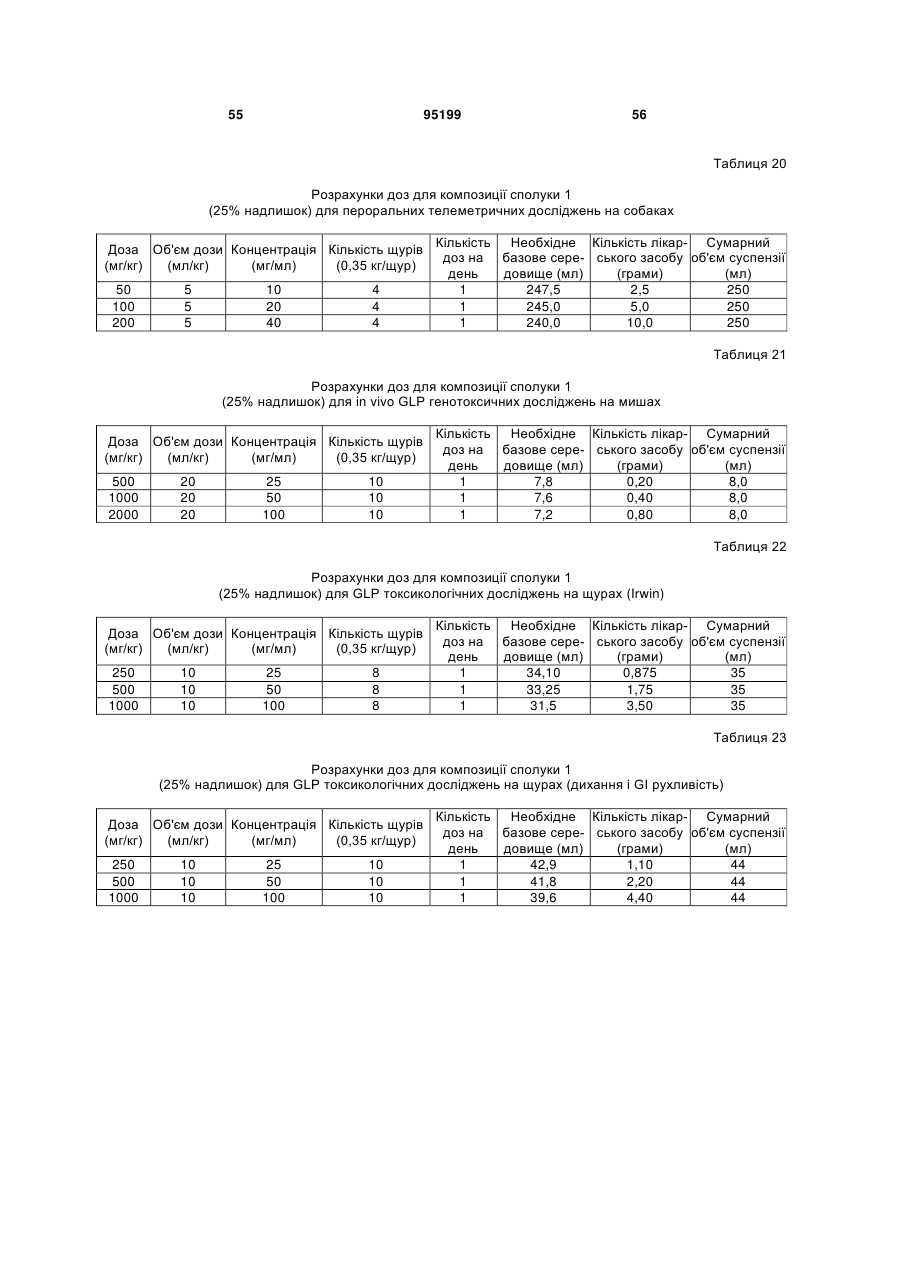
2. Композиція за п. 1, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота характеризується одним або більше піками при 15,2-15,6 градусах, 16,1-16,5 градусах і 14,3-14,7 градусах при рентгенівській порошковій дифрактометрії, яка здійснюється, застосовуючи Сu К альфа-випромінювання.
3. Композиція за п. 2, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота характеризується одним або більше піками при 15,4, 16,3 і 14,5 градусах.
4. Композиція за п. 2, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 14,6-15,0 градусах.
5. Композиція за п. 4, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 14,8 градусах.
6. Композиція за п. 4, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 17,6-18,0 градусах.
7. Композиція за п. 6, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 17,8 градусах.
8. Композиція за п. 6, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 16,4-16,8 градусах.
9. Композиція за п. 8. в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 16,4-16,8 градусах.
10. Композиція за п. 9, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 16,6 градусах.
11. Композиція за п. 9, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 7,6-8,0 градусах.
12. Композиція за п. 11, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 7,8 градусах.
13. Композиція за п. 11, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 25,8-26,2 градусах.
14. Композиція за п. 13, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 26,0 градусах.
15. Композиція за п. 13, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 21,4-21,8 градусах.
16. Композиція за п. 15, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 21,6 градусах.
17. Композиція за п. 15, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 23,1-23,5 градусах.
18. Композиція за п. 17, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота додатково характеризується піком при 23,3 градусах.
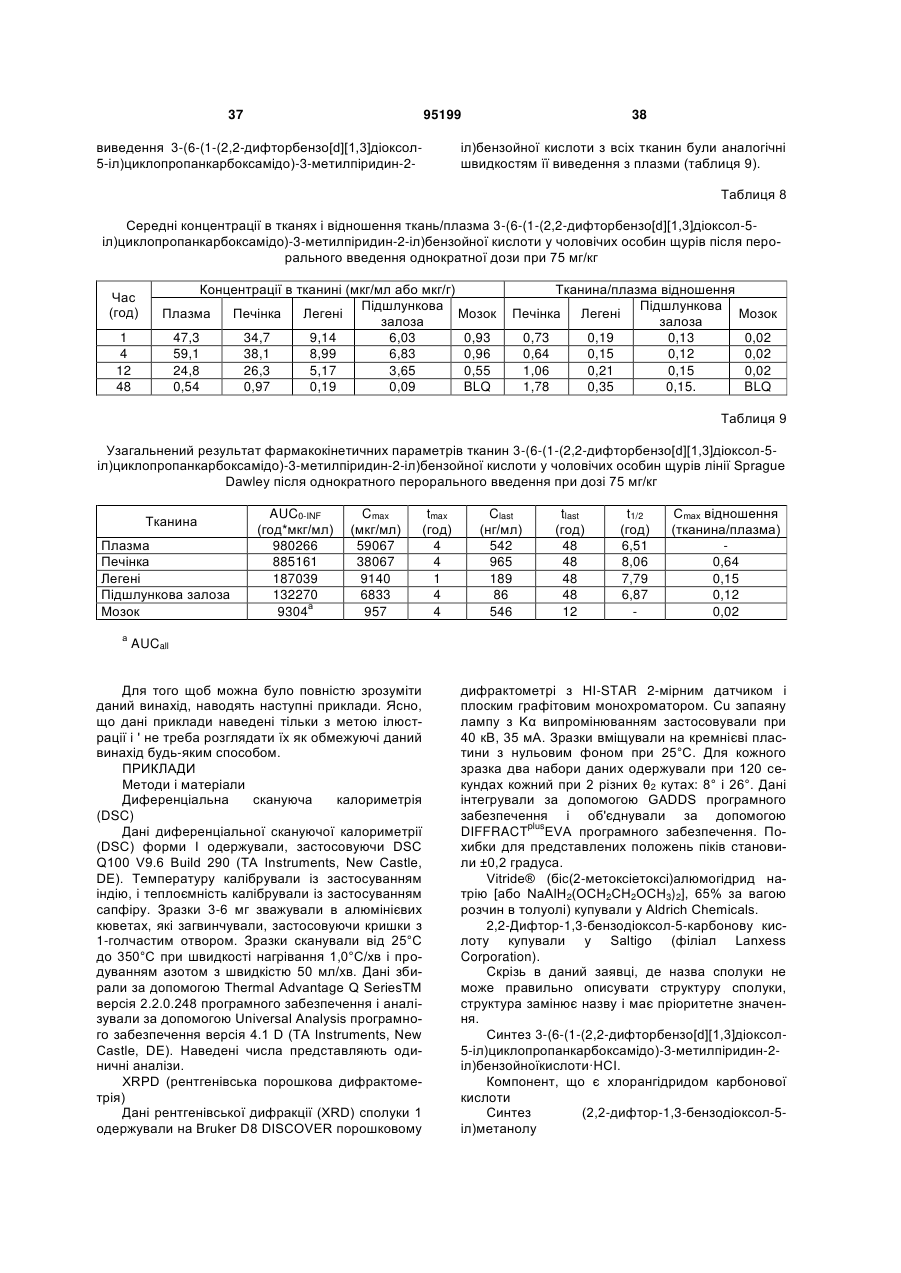
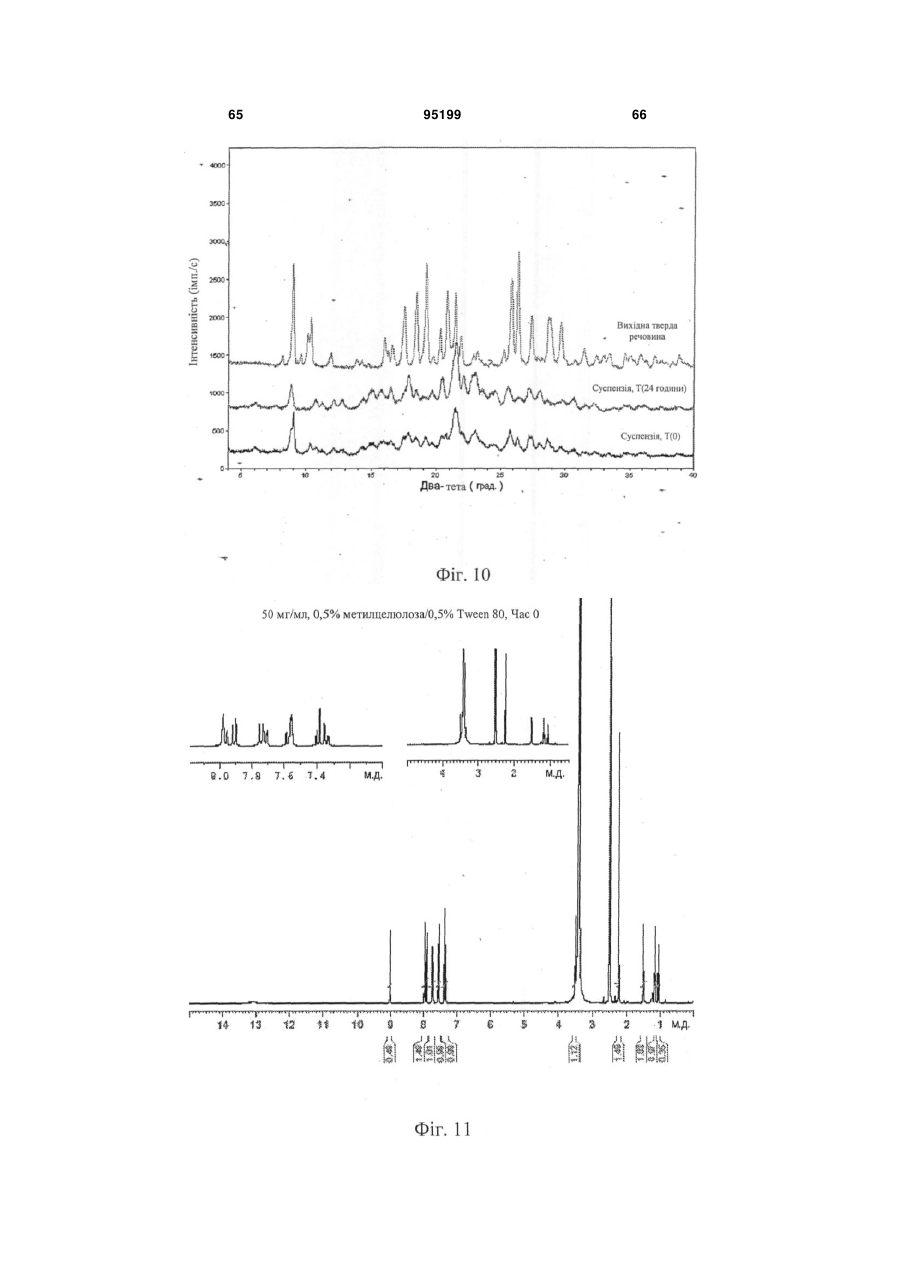
19. Композиція за п. 1, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота характеризується рентгенограмою, в основному аналогічною рентгенограмі фіг.1.
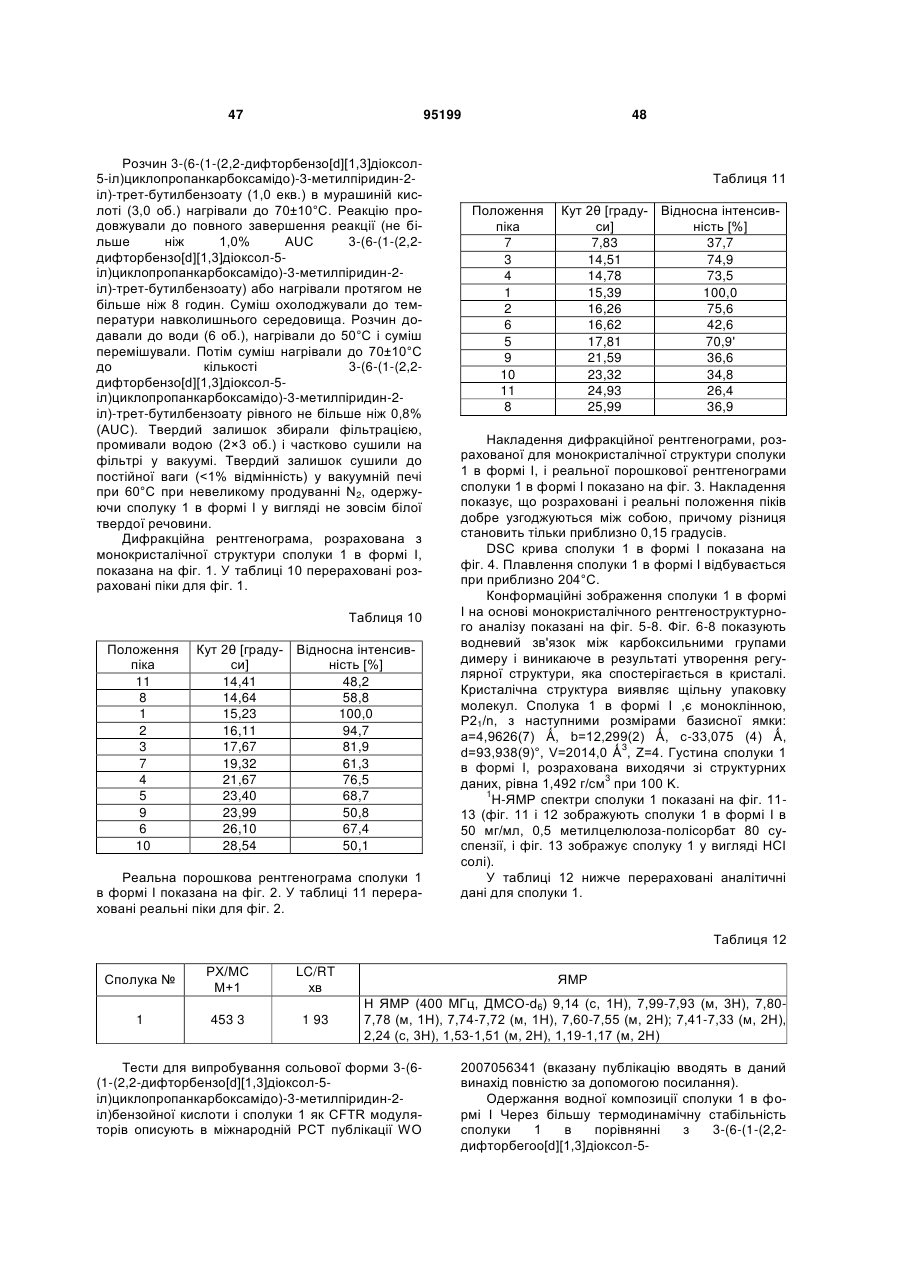
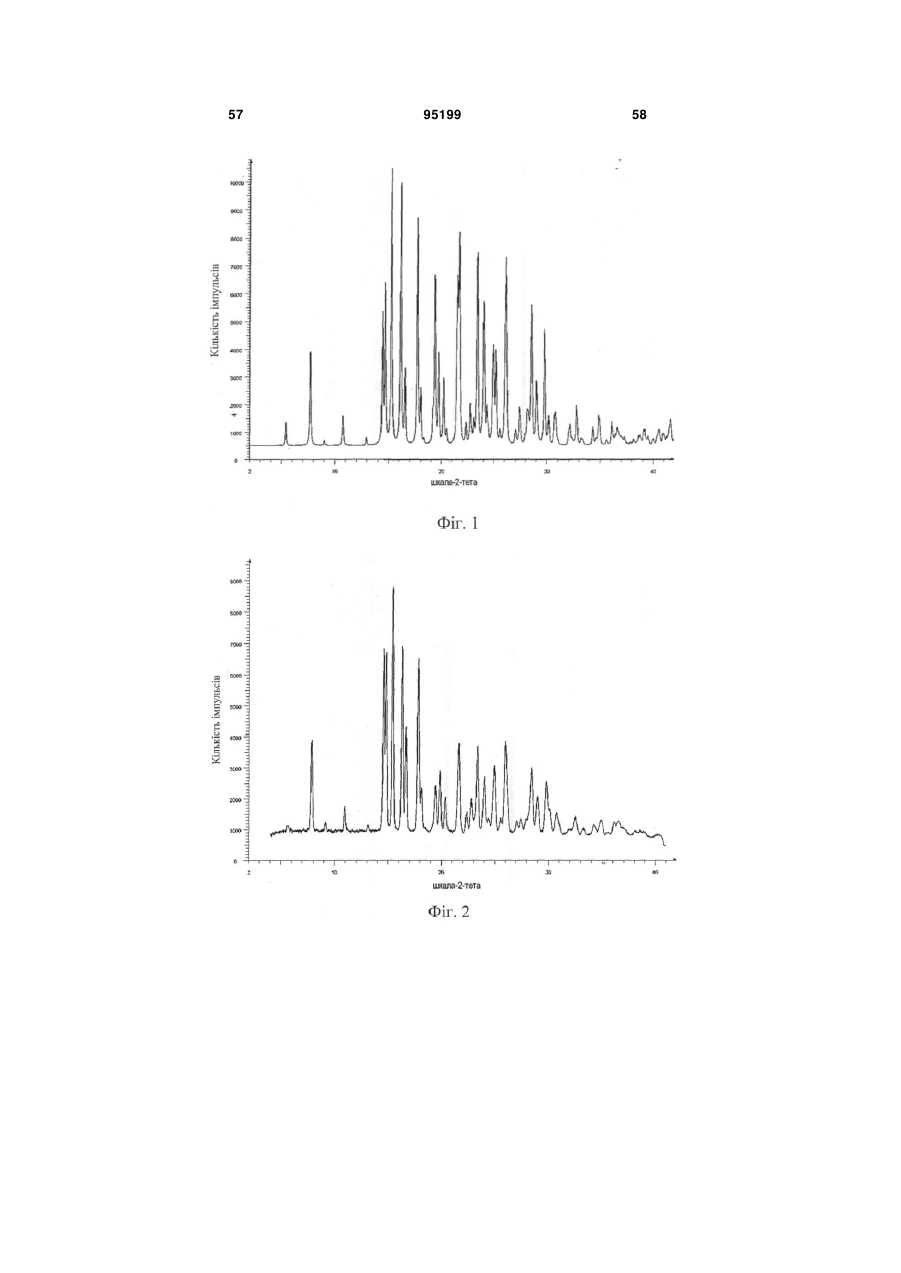
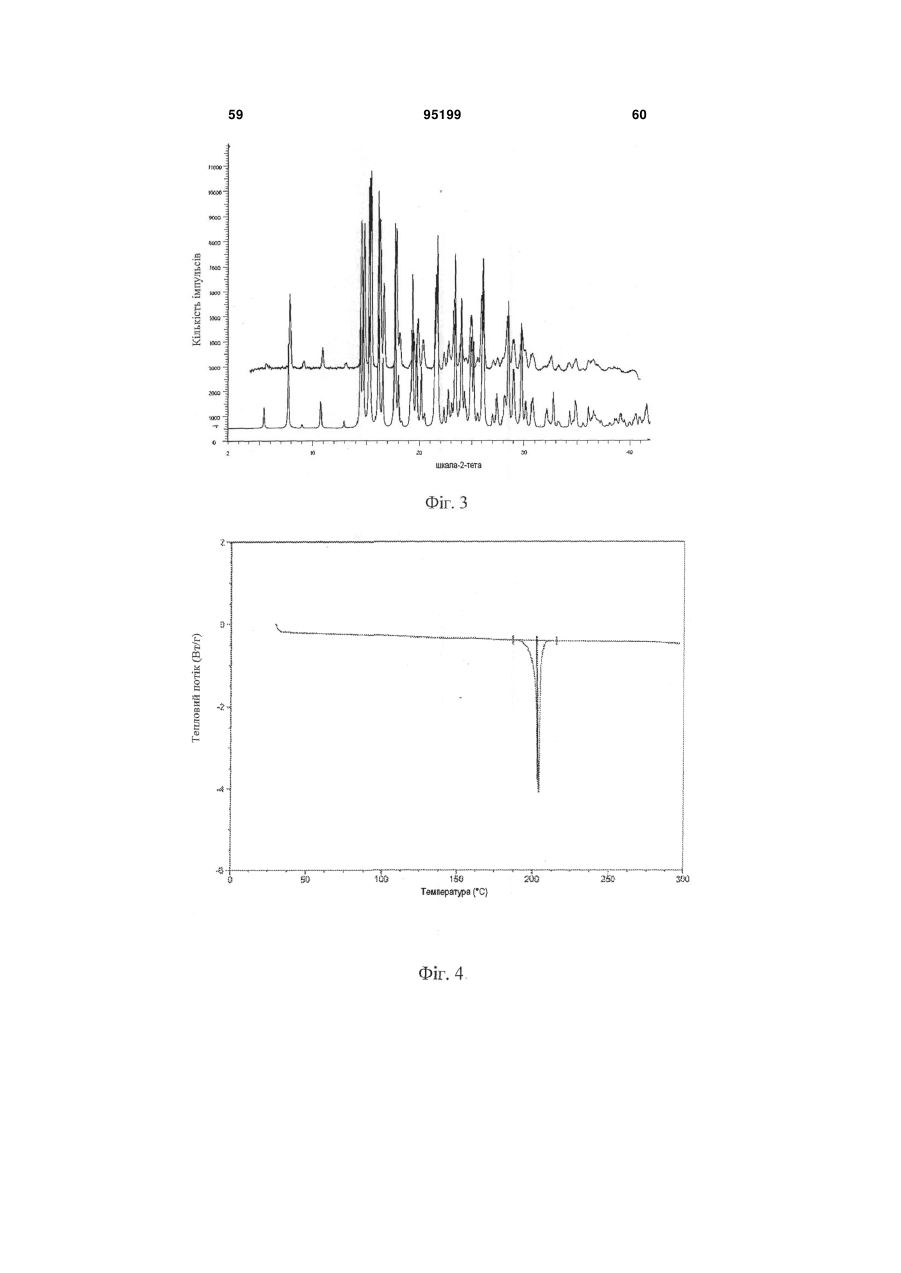
20. Композиція за п. 1, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота характеризується рентгенограмою, в основному аналогічною рентгенограмі фіг.2.
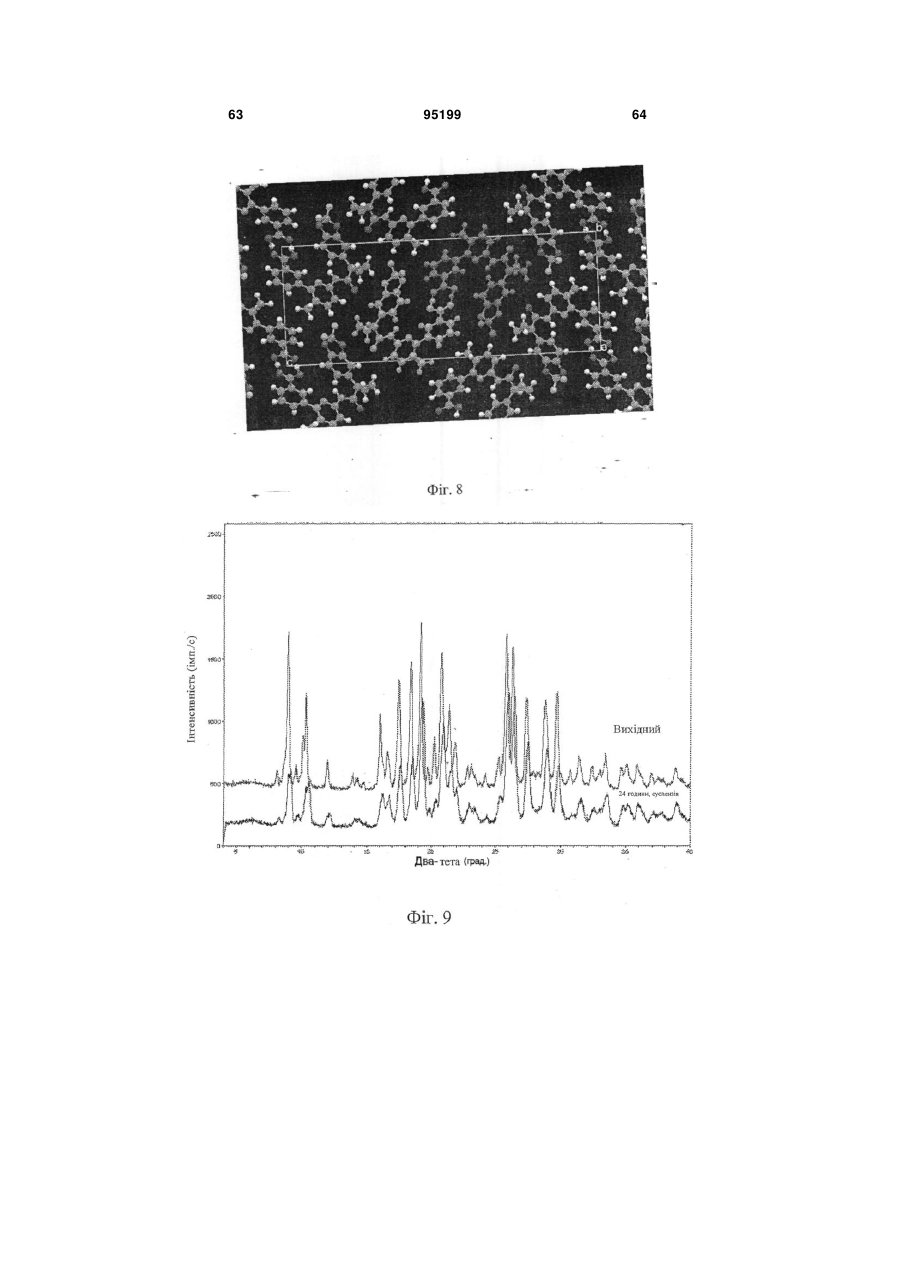
21. Композиція за п. 1, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота має моноклінну систему кристалів, Р21/n групу симетрії, і наступні розміри базисної клітини:
a=4,9626 (7) Å, a=90°
b=12,2994 (18) Å, b=93,938 (9)°
с=33,075(4) Å g=90°.
22. Композиція за п. 1, в якій агент, сприяючий регулюванню в'язкості, вибирають з групи, що складається з метилцелюлози, карбоксиметилцелюлози натрію, гідроксипропілметилцелюлози, гідроксипропілцелюлози, альгінату натрію, поліакрилату, повідону, аравійської камеді, гуарової камеді, ксантанової камеді, трагаканту і силікату магнію алюмінію.
23. Композиція за п. 1, в якій агент, сприяючий регулюванню в'язкості, являє собою метилцелюлозу.
24. Композиція за п. 1, в якій концентрація 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти складає від 0,5 до 20 % за вагою.
25. Композиція за п. 1, в якій концентрація 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти складає від 2,5 до 3,5 % за вагою.
26. Композиція за п. 1, в якій концентрація агента, сприяючого регулюванню в'язкості, складає від 0,1 до 2 % за вагою.
27. Композиція за п. 1, в якій концентрація агента, сприяючого регулюванню в'язкості, становить 0,5 % за вагою.
28. Композиція за п. 1. в якій концентрація 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти складає від 0,5 до 20 % за вагою; і концентрація агента, сприяючого регулюванню в'язкості, складає від 0,1 до 2 % за вагою.
29. Композиція за п. 1, в якій концентрація 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти складає від 2,5 до 3,5 % за вагою; і концентрація агента, сприяючого регулюванню в'язкості, становить 0,5 % за вагою.
30. Композиція за п. 1, що додатково містить поверхнево-активну речовину.
31. Композиція за п. 30, в якій поверхнево-активна речовина являє собою аніонну, катіонну або неіонну поверхнево-активну речовину.
32. Композиція за п. 31, в якій поверхнево-активна речовина являє собою аніонну поверхнево-активну речовину, вибрану з групи, що складається з солей додецилсульфату, лаурилсульфату, лауретсульфату, алкілбензолсульфонатів, бутанової кислоти, гексанової кислоти, октанової кислоти, деканової кислоти, лаурилової кислоти, міристинової кислоти, пальмітинової кислоти, стеаринової кислоти, арахідонової кислоти, бегенової кислоти, міристоленової кислоти, пальмітолеїнової кислоти, олеїнової кислоти, лінолевої кислоти, альфа-ліноленової кислоти, арахідонової кислоти, ейкозапентаєнової кислоти, ерукової кислоти і докозагексаєнової кислоти.
33. Композиція за п. 31, в якій поверхнево-активна речовина являє собою катіонну поверхнево-активну речовину, вибрану з групи, що складається з броміду цетилтриметиламонію, хлориду цетилпіридинію, поліетоксильованого жирного аміну, хлориду бензалконію і хлориду бензетонію.
34. Композиція за п. 31, в якій поверхнево-активна речовина являє собою неіонну поверхнево-активну речовину, вибрану з групи, що складається з полісорбату 20, полісорбату 40, полісорбату 60, полісорбату 65, полісорбату 80, алкілполі(етиленоксиду), полоксаміну, алкілполіглікозидів, октилглікозиду, децилмальтозиду, жирного спирту, цетилового спирту, олеїлового спирту, кокаміду МЕА, кокаміду DEА і кокаміду TEA.
35. Композиція за п. 30, в якій поверхнево-активна речовина являє собою полісорбат 80.
36. Композиція за п. 30, в якій концентрація поверхнево-активної речовини складає від 0,1 до 10 % за вагою.
37. Композиція за п. 30, в якій концентрація поверхнево-активної речовини становить 0,5 % за вагою.
38. Композиція за п. 30, в якій поверхнево-активна речовина являє собою полісорбат 80 при 0,5 % за вагою.
39. Композиція за п. 1, що додатково містить протиспінювальну речовину.
40. Композиція за п. 39, в якій протиспінювальна речовина містить полідиметилсилоксан.
41. Композиція за п. 40, в якій протиспінювальна речовина являє собою симетикон.
42. Композиція за п. 39, в якій концентрація протиспінювальної речовини складає від 0,01 до 0,2 % за вагою.
43. Композиція за п. 39, в якій концентрація протиспінювальної речовини становить 0,05 % за вагою.
44. Композиція за п. 1, яка додатково містить буфер.
45. Композиція за п. 44, в якій буфер включає натрієву, калієву або амонієву сіль оцтової, борної, вугільної, фосфорної, бурштинової, яблучної, винної, лимонної, оцтової, бензойної, молочної, гліцеринової, глюконової, глутарової або глутамінової кислот.
46. Композиція за п. 44, в якій буфер включає натрієву, калієву або амонієву сіль лимонної кислоти.
47. Композиція за п. 1, яка додатково містить регулятор смаку і/або ароматизатор.
48. Пероральна композиція, яка містить 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойну кислоту, воду, метилцелюлозу, полісорбат 80 і симетикон.
49. Пероральна композиція за п. 48, в якій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойна кислота присутня в концентрації 2,5-3,5 % за вагою.
50. Пероральна композиція за п. 49, в якій метилцелюлоза присутня в концентрації 0,5 % за вагою.
51. Пероральна композиція за п. 50, в якій полісорбат 80 присутній в концентрації 0,5 % за вагою.
52. Пероральна композиція за п. 51, в якій симетикон присутній в концентрації 0,05 % за вагою.
53. Спосіб лікування кістозного фіброзу у ссавця, що включає введення композиції за п. 1.
54. Спосіб за п. 53, що включає введення додаткового терапевтичного агента.
55. Спосіб за п. 54, в якому додатковий терапевтичний агент вибирають з групи, що складається з муколітичного агента, бронхолітичного засобу, антибіотика, протиінфекційного засобу, протизапального засобу, CFTR модулятора, відмінного від сполуки даного винаходу, і поживної речовини.
56. Набір, що містить композицію за п. 1 і інструкцію для її застосування.
Текст
1. Водна композиція, яка містить по суті кристалічну і безсольову форму 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти, воду і агент, який сприяє регулюванню в'язкості. 2. Композиція за п. 1, в якій 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота характеризується одним або більше піками при 15,2-15,6 градусах, 16,1-16,5 градусах і 14,3-14,7 градусах при рентгенівській порошковій дифрактометрії, яка здійснюється, застосовуючи Сu К альфа-випромінювання. 3. Композиція за п. 2, в якій 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота характеризується одним або більше піками при 15,4, 16,3 і 14,5 градусах. 4. Композиція за п. 2, в якій 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота додатково характеризується піком при 14,6-15,0 градусах. 5. Композиція за п. 4, в якій 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота додатково характеризується піком при 14,8 градусах. 6. Композиція за п. 4, в якій 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2 2 (19) 1 3 іл)бензойна кислота додатково характеризується піком при 21,4-21,8 градусах. 16. Композиція за п. 15, в якій 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота додатково характеризується піком при 21,6 градусах. 17. Композиція за п. 15, в якій 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота додатково характеризується піком при 23,1-23,5 градусах. 18. Композиція за п. 17, в якій 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота додатково характеризується піком при 23,3 градусах. 19. Композиція за п. 1, в якій 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота характеризується рентгенограмою, в основному аналогічною рентгенограмі фіг.1. 20. Композиція за п. 1, в якій 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота характеризується рентгенограмою, в основному аналогічною рентгенограмі фіг.2. 21. Композиція за п. 1, в якій 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота має моноклінну систему кристалів, Р21/n групу симетрії, і наступні розміри базисної клітини: a=4,9626 (7) Å, =90° b=12,2994 (18) Å, =93,938 (9)° с=33,075(4) Å =90°. 22. Композиція за п. 1, в якій агент, сприяючий регулюванню в'язкості, вибирають з групи, що складається з метилцелюлози, карбоксиметилцелюлози натрію, гідроксипропілметилцелюлози, гідроксипропілцелюлози, альгінату натрію, поліакрилату, повідону, аравійської камеді, гуарової камеді, ксантанової камеді, трагаканту і силікату магнію алюмінію. 23. Композиція за п. 1, в якій агент, сприяючий регулюванню в'язкості, являє собою метилцелюлозу. 24. Композиція за п. 1, в якій концентрація 3-(6-(1(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти складає від 0,5 до 20 % за вагою. 25. Композиція за п. 1, в якій концентрація 3-(6-(1(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти складає від 2,5 до 3,5 % за вагою. 26. Композиція за п. 1, в якій концентрація агента, сприяючого регулюванню в'язкості, складає від 0,1 до 2 % за вагою. 27. Композиція за п. 1, в якій концентрація агента, сприяючого регулюванню в'язкості, становить 0,5 % за вагою. 95199 4 28. Композиція за п. 1. в якій концентрація 3-(6-(1(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти складає від 0,5 до 20 % за вагою; і концентрація агента, сприяючого регулюванню в'язкості, складає від 0,1 до 2 % за вагою. 29. Композиція за п. 1, в якій концентрація 3-(6-(1(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти складає від 2,5 до 3,5 % за вагою; і концентрація агента, сприяючого регулюванню в'язкості, становить 0,5 % за вагою. 30. Композиція за п. 1, що додатково містить поверхнево-активну речовину. 31. Композиція за п. 30, в якій поверхнево-активна речовина являє собою аніонну, катіонну або неіонну поверхнево-активну речовину. 32. Композиція за п. 31, в якій поверхнево-активна речовина являє собою аніонну поверхневоактивну речовину, вибрану з групи, що складається з солей додецилсульфату, лаурилсульфату, лауретсульфату, алкілбензолсульфонатів, бутанової кислоти, гексанової кислоти, октанової кислоти, деканової кислоти, лаурилової кислоти, міристинової кислоти, пальмітинової кислоти, стеаринової кислоти, арахідонової кислоти, бегенової кислоти, міристоленової кислоти, пальмітолеїнової кислоти, олеїнової кислоти, лінолевої кислоти, альфа-ліноленової кислоти, арахідонової кислоти, ейкозапентаєнової кислоти, ерукової кислоти і докозагексаєнової кислоти. 33. Композиція за п. 31, в якій поверхнево-активна речовина являє собою катіонну поверхневоактивну речовину, вибрану з групи, що складається з броміду цетилтриметиламонію, хлориду цетилпіридинію, поліетоксильованого жирного аміну, хлориду бензалконію і хлориду бензетонію. 34. Композиція за п. 31, в якій поверхнево-активна речовина являє собою неіонну поверхневоактивну речовину, вибрану з групи, що складається з полісорбату 20, полісорбату 40, полісорбату 60, полісорбату 65, полісорбату 80, алкілполі(етиленоксиду), полоксаміну, алкілполіглікозидів, октилглікозиду, децилмальтозиду, жирного спирту, цетилового спирту, олеїлового спирту, кокаміду МЕА, кокаміду DEА і кокаміду TEA. 35. Композиція за п. 30, в якій поверхнево-активна речовина являє собою полісорбат 80. 36. Композиція за п. 30, в якій концентрація поверхнево-активної речовини складає від 0,1 до 10 % за вагою. 37. Композиція за п. 30, в якій концентрація поверхнево-активної речовини становить 0,5 % за вагою. 38. Композиція за п. 30, в якій поверхнево-активна речовина являє собою полісорбат 80 при 0,5 % за вагою. 39. Композиція за п. 1, що додатково містить протиспінювальну речовину. 40. Композиція за п. 39, в якій протиспінювальна речовина містить полідиметилсилоксан. 41. Композиція за п. 40, в якій протиспінювальна речовина являє собою симетикон. 5 95199 6 42. Композиція за п. 39, в якій концентрація протиспінювальної речовини складає від 0,01 до 0,2 % за вагою. 43. Композиція за п. 39, в якій концентрація протиспінювальної речовини становить 0,05 % за вагою. 44. Композиція за п. 1, яка додатково містить буфер. 45. Композиція за п. 44, в якій буфер включає натрієву, калієву або амонієву сіль оцтової, борної, вугільної, фосфорної, бурштинової, яблучної, винної, лимонної, оцтової, бензойної, молочної, гліцеринової, глюконової, глутарової або глутамінової кислот. 46. Композиція за п. 44, в якій буфер включає натрієву, калієву або амонієву сіль лимонної кислоти. 47. Композиція за п. 1, яка додатково містить регулятор смаку і/або ароматизатор. 48. Пероральна композиція, яка містить 3-(6-(1(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойну кислоту, воду, метилцелюлозу, полісорбат 80 і симетикон. 49. Пероральна композиція за п. 48, в якій 3-(6-(1(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота присутня в концентрації 2,53,5 % за вагою. 50. Пероральна композиція за п. 49, в якій метилцелюлоза присутня в концентрації 0,5 % за вагою. 51. Пероральна композиція за п. 50, в якій полісорбат 80 присутній в концентрації 0,5 % за вагою. 52. Пероральна композиція за п. 51, в якій симетикон присутній в концентрації 0,05 % за вагою. 53. Спосіб лікування кістозного фіброзу у ссавця, що включає введення композиції за п. 1. 54. Спосіб за п. 53, що включає введення додаткового терапевтичного агента. 55. Спосіб за п. 54, в якому додатковий терапевтичний агент вибирають з групи, що складається з муколітичного агента, бронхолітичного засобу, антибіотика, протиінфекційного засобу, протизапального засобу, CFTR модулятора, відмінного від сполуки даного винаходу, і поживної речовини. 56. Набір, що містить композицію за п. 1 і інструкцію для її застосування. Дана заявка заявляє пріоритет за 35 U.S.C. з 119 до попередньої патентної заявки США серійний номер 61/012168, внесеної в реєстр 7 грудня 2007 року, повний зміст якої вводиться в даний винахід за допомогою посилання. Даний винахід належить до пероральної композиції, що містить практично чисту 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойну кислоту (Сполука 1), як описано в даному винаході, воду і агент, сприяючий регулюванню в'язкості. Пероральна композиція може додатково містити поверхнево-активну - речовину, протиспінювальну речовину, буфер і стабілізатор смаку. Крім того, даний винахід належить до способу лікування CFTR-опосередкованого захворювання, такого як кістозний фіброз, застосовуючи дану композицію. CFTR являє собою цАМФ/АТФопосередкований аніонний канал, який експресується в багатьох типах клітин, включаючи абсорбуючі і секреторні епітеліальні клітини, де він регулює потік аніонів через мембрану, а також активність інших іонних каналів і білків. В епітеліальних клітинах нормальне функціонування CFTR є важливим для підтримки в тілі транспорту електролітів, включаючи повітроносні тканини і тканини кишечнику. CFTR складається з приблизно 1480 амінокислот, які кодують білок, що складається з послідовно розташованих трансмембранних доменів, що повторюються, причому кожний містить шість трансмембранних спіралей і нуклеотидзв'язуючий домен. Два трансмембранні домени з'єднані великим, полярним, регуляторним (R)доменом з множиною сайтів фосфорилування, які регулюють активність каналу і транспорт через клітину. Ген, що кодує CFTR, був виявлений і секвенований (див. Gregory, R. J. et al. (1990) Nature 347: 382-386; Rich, D. P. et al. (1990) Nature 347: 358362), (Riordan, J. R. et al. (1989) Science 245: 10661073). Порушення в даному гені викликає мутації CFTR, які призводять в результаті до кістозного фіброзу ("CF"), найпоширенішого летального генетичного захворювання у людей. У Сполучених Штатах Америки від кістозного фіброзу страждає приблизно один з кожних 2500 дітей молодшого віку. У загальній популяції США аж до 10 мільйонів людей несуть одну копію дефектного гена без вираженої патологічної дії. На відміну від цього, індивіди з двома копіями CF асоційованого гена, страждають від послаблюючої і летальної дії CF, включаючи хронічне захворювання легень. У пацієнтів з кістозним фіброзом мутації в CFTR, що ендогенно експресується в респіраторному епітелії, призводять до зниженої апікальної аніонної секреції, викликаючи дисбаланс в транспорті іонів і рідин. Послаблення транспорту аніонів, що виникло в результаті, призводить до підвищеного накопичення слизу в легенях і супроводжуючої його мікробної інфекції, які, зрештою, призводять до смерті CF пацієнтів. На додаток до респіраторного захворювання CF пацієнти зазвичай страждають від шлунково-кишкових захворювань і недостатності підшлункової залози, які, за відсутності лікування, призводять до смерті. Крім того, більшість чоловіків з кістозним фіброзом є безплідними, і у жінок з кістозним фіброзом знижена фертильність. На відміну від серйозних наслідків двох списів CF асоційованого гена, індивіди з однією копією CF асоційованого гена мають підвищену стійкість до холери і зневоднення, що є результатом діареї - можливо, цим пояснюється відносно висока частота CF гена в популяції. 7 Секвенування CFTR гена CF хромосом виявило ряд мутацій, що викликають захворювання (Cutting, G. R. et al. (1990) Nature 346: 366-369; Dean, Μ. et al. (1990) Cell 61:863:870; і Kerem, B-S. et al. (1989) Science 245: 1073-1080; Kerem, B-S et al. (1990) Proc. Natl. Acad. Sci. USA 87: 8447-8451). Ha сьогоднішній день в CF гені виявлено >1000 мутацій, що викликають захворювання (http://www.genet.sickkids.on.ca/cftr/). Найбільш поширеною мутацією є делеція фенілаланіну в положенні 508 CFTR амінокислотної послідовності, і її зазвичай називають AF508-CFTR. Дана мутація спостерігається приблизно у 70% випадків кістозного фіброзу, і вона пов'язана з важкою хворобою. Делеція залишку 508 в AF508-CFTR перешкоджає правильному згортанню білка, що утворюється. Це призводить до нездатності мутантного білка покинути ER і переміститися до цитоплазматичної мембрани. Як результат кількість каналів, присутніх в мембрані, є набагато меншою, ніж спостерігається в клітинах, що експресують CFTR дикого типу. На додаток до порушеного транспорту мутація призводить в результаті до порушення правильного відкриття іонних каналів. Разом, знижена кількість каналів в мембрані і порушення правильного відкриття іонних каналів призводить до послабленого транспорту аніонів через епітелій, призводячи до порушення транспорту іонів і рідин. (Quinton, P. Μ. (1990), FASEB J. 4: 27092727). Однак дослідження показали, що знижена кількість AF5O8-CFTR в мембрані є функціонуючою, хоча і менше ніж CFTR дикого типу. (Dalemans et al. (1991), Nature Lond. 354: 526-528; Denning et al., supra; Pasyk and Foskett (1995), J. Cell. Biochem. 270: 12347-50). Ha додаток до AF508-CFTR, інші мутації в CFTR, що викликають захворювання, які призводять в результаті до порушення транспорту, синтезу і/або порушенню функціонування іонних каналів, можна активувати або пригнічувати для зміни аніонної секреції і зміни розвитку і/або тяжкості захворювання. Хоча на додаток до аніонів CFTR транспортує ряд молекул, ясно, що дана роль (транспорт аніонів) являє собою один елемент у важливому механізмі транспорту іонів і води через епітелій. Інші + елементи включають епітеліальний Na канал, + - + + + ENaC, Na /2Cl /K котранспортер, Na -K + АТФазний насос і K канали базолатеральної мембрани, які відповідальні за поглинання клітиною хлорид-іонів. Дані елементи працюють разом для здійснення направленого транспорту через епітелій за допомогою їх селективної експресії і локалізації в клітині. Поглинання хлорид-іонів здійснюється за рахунок координованої діяльності ENaC і CFTR, + + присутньої на апікальній мембрані, і Na -K АТФазнoгo насоса і Сl каналів, експресованих на базолатеральній поверхні клітини. Повторний активний транспорт хлорид-іонів через люмінальну сторону призводить до накопичення внутрішньоклітинних хлорид-іонів, які потім можуть пасивно покидати клітину через СГ канали, призводячи в результаті до векторного транспорту. Розміщення + + + + № /2С17К котранспортера, Na -K - АТФазний на+ соса і K каналів базолатеральної мембрани на 95199 8 базолатеральній поверхні і CFTR на люмінальній стороні координує секрецію хлорид-іонів через CFTR на люмінальній стороні. Оскільки вода, очевидно, сама ніколи не переноситься за допомогою активного транспорту, її потік через епітелій залежить від малих трансепітеліальних осмотичних градієнтів, що генеруються об'ємним потоком натрію і хлориду. Як обговорювалося вище, вважають, .що делеція залишку 508 в AF508-CFTR перешкоджає правильному згортанню білка, що утворюється, призводячи в результаті до нездатності мутантного білка покинути ER і переміститися до цитоплазматичної мембрани. Як результат, недостатня кількість доспілого білка присутня на цитоплазматичній мембрані і транспорт хлорид-іонів в епітеліальних тканинах значно послаблений. Дійсно, було показано, що даний клітинний феномен порушення ER процессинга ABC транспортерів ER апаратом є вихідною основою не тільки для CF захворювання, але і для великого набору інших окремих і успадкованих захворювань. Два способи, при яких ER апарат може функціонувати неправильно, полягають або в послабленні зв'язування з ER експортних білків, що призводить до деградації, або в накопиченні в ER даних дефектних/неправильних згорнених білків [Aridor Μ., et al., Nature Med., 5(7), pp 745-751 (1999); Shastry, B.S., et al., Neurochem. International, 43, pp 1-7 (2003); Rutishauser, J., et al., Swiss Med Wkly, 132, pp 211222 (2002); Morello, JP et al., TIPS, 21, pp. 466-469 (2000); Bross P., et al., Human Mut., 14, pp. 186-198 (1999)]. 3-(6-(1-(2,2-Дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойну кислоту в сольовій формі описують в міжнародній РСТ публікації WO 2007056341 (причому вказана публікація вводиться в даний винахід повністю за допомогою посилання) як модулятор CFTR активності і, таким чином, вона є придатною для лікування CFTR-опосередкованого захворювань, такого як кістозний фіброз. Однак, існує необхідність в стабільних формах модуляторів CFTR активності, таких як сполука 1, які можна застосовувати для модулювання активності CFTR в клітинній мембрані ссавців. Для простоти застосування і комфорту пацієнта існує також необхідність в стабільних, пероральних композиціях сполуки 1, які можна застосовувати для введення ефективних доз сполуки 1 пацієнту. Даний винахід належить до пероральних композицій 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти, які мають структуру, показану нижче: Сполука 1 є придатною для лікування або послаблення тяжкості ряду CFTR опосередкованих захворювань. Сполука 1 може існувати в практич 9 но кристалічній і безсольовій формі, званій форма І, як описують і характеризують в даному винаході. Важкість зі змочуванням фармацевтично прийнятних сполук може бути проблематичною в галузі фармацевтики з точки зору одержання композицій. Наприклад, сполука 1, на додаток до того, що вона має низьку розчинність, важко змочується водними середовищами, і, внаслідок цього, існують певні проблеми з одержанням водних дисперсій. Внаслідок складностей зі змочуванням сполуки 1 речовина важко в достатній мірі суспендувати у водному середовищі без того, щоб не вдаватися до застосування тривалих періодів перемішування з великими зсувовими зусиллями. Один підхід до поліпшення властивостей, перешкоджаючих розшаруванню суспензії, полягає в застосуванні агента, сприяючого регулюванню в'язкості, такого як будь-який з природних смол або целюлозних полімерів, таких як метилцелюлоза, для збільшення в'язкості, і внаслідок цього уповільнюючого швидкість повторного розшарування змочених частинок в суспензії. Для стабільності і простоти обробки може бути також бажаним додавати інші компоненти, такі як поверхнево-активна речовина, протиспінювальна речовина і буфер. Для комфорту пацієнта також бажано додавати регулятор смаку для того, щоб приховати неприємний смак, пов'язаний зі сполукою 1. Таким чином, хороша суспензія сполуки 1, яка забезпечує більш тривалий термін зберігання (тобто яка забезпечує більш тривалий період існування суспензії до повторного розшарування), могла б являти собою цінне доповнення до області техніки композицій. Суспензія з поліпшеним смаком могла б робити ,. додатковий цінний внесок. Під "хорошою суспензією" розуміють (1), що в пероральній композиції згідно з даним винаходом не відбувається видимого розшарування протягом більше ніж 24 годин при кімнатній температурі (RT, зазвичай 25°С), переважно протягом більше ніж одного тижня, і (2) що коли видиме розшарування не спостерігається, повторне суспендування легко здійснити простим фізичним змішуванням, таким як легке перемішування руками або помірне струшування руками, причому перемішування з великими зсувовими зусиллями не потрібне. Фіг. 1 являє собою дифракційну рентгенограму, розраховану з монокристалічної структури сполуки 1 в формі І. Фіг. 2 являє собою реальну порошкову рентгенограму сполуки 1 в формі І. Фіг. З являє собою накладення дифракційної рентгенограми, розрахованої з монокристалічної структури сполуки 1 в формі І, і реальної порошкової рентгенограми сполуки 1 в формі І. Фіг. 4 являє собою (DSC) криву диференціальної скануючої калориметрії сполуки 1 в формі І. Фіг. 5 являє собою конформаційну картину сполуки 1 в формі І на основі монокристалічного рентгеноструктурного аналізу. Фіг. 6 являє собою конформаційну картину сполуки 1 в формі І на основі монокристалічного рентгеноструктурного аналізу у вигляді димеру, утвореного за допомогою карбоксильних груп. 95199 10 Фіг. 7 являє собою конформаційну картину сполуки 1 в формі І на основі монокристалічного рентгеноструктурного аналізу, який показує, що молекули - мають регулярне укладання одна відносно одної. Фіг. 8 являє собою конформаційну картину сполуки 1 в формі І на основі монокристалічного рентгеноструктурного аналізу, що показує інший ракурс (нижнє а). Фіг. 9 являє собою накладення порошкових рентгенограм 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти·НСІ і тієї ж сполуки після суспендування у водній метилцелюлозній композиції протягом 24 годин при кімнатній температурі. Фіг. 10 являє собою накладення DSC 3-(6-(1(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти·НСІ і тієї ж сполуки після суспендування у водній метилцелюлоза-полісорбат 80 композиції протягом 0 і 24 годин при кімнатній температурі. 1 Фіг. 11 являє собою Н-ЯМР аналіз суспензії сполуки 1 при Т(0). 1 Фіг. 12 являє собою Н-ЯМР аналіз суспензії сполуки 1, витриманої при кімнатній температурі протягом 24 годин. 1 Фіг. 13 являє собою Н-ЯМР аналіз стандарту 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти·НСl. Фіг. 14 являє собою графік розподілу в тканині сполуки 1 в формі І у чоловічих особин щурів через 1-48 годин після однократного перорального введення з дозою 75 мг/кг. Визначення Як застосовують в даному винаході, будуть застосовувати наступні визначення, якщо не вказано особливо. Термін "CFTR", як застосовують в даному винаході, означає трансмембранний регулятор муковісцидозу або його мутацію, що має регуляторну активність, включаючи, але не обмежуючись, AF508 CFTR і G551D CFTR (див., наприклад, http://www.genet.sickldds.on.ca/cftr/, для CFTR мутацій). Як застосовують в даному винаході, "кристалічний" належить до сполук або композицій, де структурні елементи розташовуються в фіксовані геометричні форми або грати, так що кристалічні тверді речовини мають жорсткий далекий порядок. Структурні елементи, які утворюють кристалічну структуру, можуть бути атомами, молекулами або іонами. Кристалічні тверді речовини мають певну температуру плавлення. Як застосовують в даному винаході, "дисперсія" належить до дисперсної системи, в якій одна речовина, дисперсна фаза, розподіляється, дискретними компонентами, у другій речовині (безперервна фаза або середовище). Розмір дисперсної фази може змінюватися значною мірою (наприклад, від колоїдних частинок нанометрових розмірів до декількох мікрон). В одному варіанті здійс 11 нення водні композиції даного винаходу являють собою дисперсію сполуки 1 у воді. Термін "модулювання", як застосовують в даному винаході, належить до збільшення або зниження, наприклад, активності, виміряною кількістю. В одному аспекті даний винахід належить до водної композиції, що містить 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойну кислоту (сполука 1), воду і агент, сприяючий регулюванню в'язкості. В іншому варіанті здійснення сполука 1 характеризується одним або більше піками при 15,2 15,6 градусах, 16,1 16,5 градусах і 14,3 14,7 градусах на порошковій рентгенограмі, одержаній, застосовуючи Сu K альфа-випромінювання. В іншому варіанті здійснення сполука 1 характеризується одним або більше піками при 15,4, 16,3 і 14,5 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 14,6-15,0 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 14,8 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 17,6-18,0 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 17,8 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 16,4-16,8 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 16,4-16,8 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 16,6 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 7,6-8,0 градусах. В іншому варіанті здійснення сполука 1 додатково характеризується піком при 7,8 градусах. В іншому варіанті здійснення, сполука 1, крім того, характеризується піком при 25,8-26,2 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 26,0 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 21,4-21,8 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 21,6 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 23,1-23,5 градусах. В іншому варіанті здійснення сполука 1, крім того, характеризується піком при 23,3 градусах. У деяких варіантах здійснення сполука 1 характеризується рентгенограмою, практично аналогічною рентгенограмі фіг. 1. У деяких варіантах здійснення сполука 1 характеризується рентгенограмою, практично аналогічною рентгенограмі фіг. 2. В іншому варіанті здійснення сполука 1 має моноклінальну систему кристалів, Р2і/п групу си 95199 12 метрії, і наступні розміри базисної клітини: а=4,9626 (7) Ǻ; b=12,2994 (18) Ǻ; с=33,075 (4) Ǻ; α=90°; β=93,938 (9)°; і =90°. В іншому варіанті здійснення агент, сприяючий регулюванню в'язкості, вибирають з групи, що складається з метилцелюлози, карбоксиметилцелюлози натрію, гідроксипропілметилцелюлози, гідроксипропілцелюлози, альгінату натрію, поліакрилату, повідону, камеді, гуарової камеді, ксантанової камеді, трагаканту і силікату алюмінію і магнію. В іншому варіанті здійснення агент, сприяючий регулюванню в'язкості, являє собою метилцелюлозу. В іншому варіанті здійснення концентрація сполуки 1 складає від приблизно 0,5 до приблизно 20% за вагою. В іншому варіанті здійснення концентрація сполуки 1 складає від приблизно 1 до приблизно 10% за вагою. В іншому варіанті здійснення концентрація сполуки 1 складає від приблизно 2,5 до приблизно 3,5% за вагою. В іншому варіанті. здійснення концентрація агента, сприяючого регулюванню в'язкості, складає від приблизно 0,1 до приблизно 2% за вагою. В іншому варіанті здійснення концентрація агента, сприяючого регулюванню в'язкості, складає від приблизно 0,1 до приблизно 1% за вагою. В іншому варіанті здійснення концентрація агента, сприяючого регулюванню в'язкості, становить приблизно 0,5% за вагою. В іншому варіанті здійснення концентрація сполуки 1 складає від приблизно 0,5 до приблизно 20% за вагою; і концентрація агента, сприяючого регулюванню в'язкості, складає від приблизно 0,1 до приблизно 2% за вагою. В іншому варіанті здійснення концентрація сполуки 1 складає від приблизно 1 до приблизно 10% за вагою; і концентрація агента, сприяючого регулюванню " в'язкості, складає від приблизно 0,5 до приблизно 1% за вагою. В іншому варіанті здійснення концентрація сполуки 1 складає від приблизно 2,5 до приблизно 3,5% за вагою; і концентрація агента, сприяючого регулюванню в'язкості, становить приблизно 0,5% за вагою. В іншому варіанті здійснення концентрація сполуки 1 складає від приблизно 0,5 до приблизно 20% за вагою; і агент, сприяючий регулюванню в'язкості, являє собою метилцелюлозу при приблизно 0,5% за вагою/ В іншому варіанті здійснення будь-яка з вищезгаданих композицій додатково містить поверхнево-активну речовину. В іншому варіанті здійснення поверхнево-активна речовина являє собою аніонну, катіонну або неіонну поверхнево-активну речовину. В іншому варіанті здійснення поверхневоактивна речовина являє собою аніонну поверхнево-активну речовину, вибрану з групи, що складається з солей додецилсульфату, лаурилсульфату, лауретсульфату, алкілбензолсульфонатів, бутанової кислоти, гексанової кислоти, октанової кислоти, деканової кислоти, лаурилової кислоти, міристинової кислоти, пальмітинової кислоти, стеаринової кислоти, арахідонової кислоти, бегенової кислоти, міристоленової кислоти, пальмітолеїнової кислоти, олеїнової кислоти, лінолевої кислоти, альфа-ліноленової кислоти, арахідонової кислоти, ейкозапентаєнової кислоти, ерукової кис 13 лоти і докозагексаєнової кислоти. В іншому варіанті здійснення поверхнево-активна речовина являє собою катіонну поверхнево-активну речовину, вибрану з групи, що складається з броміду цетилтриметиламонію, хлориду цетилпіридинію, поліетоксильованого жирного аміну, хлориду бензалконію і хлориду бензетонію. В іншому варіанті здійснення поверхнево-активна речовина являє собою неіонну поверхнево-активну речовину, вибрану з групи, що складається з полісорбату 20, полісорбату 40, полісорбату 60, полісорбату 65, полісорбату 80, алкіл полі(етиленоксиду), полоксаміну, алкілполіглікозидів, октилглікозидів, децилмальтозидів, жирних спиртів, цетилового спирту, олеїлового спирту, кокаміду МЕА, кокаміду DEA і кокаміду TEA. В іншому варіанті здійснення поверхнево-активна речовина являє собою полісорбат 80. В іншому варіанті здійснення концентрація поверхнево-активної речовини складає від приблизно 0,1 до приблизно 10% за вагою. В іншому варіанті * здійснення концентрація поверхневоактивної речовини складає від приблизно 0,1 до приблизно 1% за вагою. В іншому варіанті здійснення концентрація поверхнево-активної речовини становить приблизно 0,5% за вагою. В іншому варіанті здійснення поверхнево-активна речовина являє собою полісорбат 80 при приблизно 0,5% за вагою. В іншому варіанті здійснення будь-яка з вищезгаданих композицій додатково містить протиспінювальну речовину. В іншому варіанті здійснення протиспінювальна речовина включає полідиметилсилоксан. В іншому варіанті здійснення протиспінювальна речовина являє собою симетикон. В іншому варіанті здійснення концентрація протиспінювальної речовини складає від приблизно 0,01 до приблизно 0,2% за вагою. В іншому варіанті здійснення концентрація протиспінювальної речовини складає від приблизно 0,01% до приблизно 0,1% за вагою. В іншому варіанті здійснення концентрація протиспінювальної речовини становить приблизно 0,05% за вагою. В іншому варіанті здійснення будь-яка з вищезгаданих композицій додатково містить буфер. В іншому варіанті здійснення буфер включає натрієву, калієву або амонієву сіль оцтової, борної, вугільної, фосфорної, бурштинової, яблучної, винної, лимонної, оцтової, бензойної, молочної, гліцеринової, глюконової, глутарової або глутамінової кислот. В іншому варіанті здійснення буфер включає натрієву, калієву або амонієву сіль лимонної кислоти. В іншому варіанті здійснення будь-яка з вищезгаданих композицій додатково містить регулюючий смак і/або ароматизуючий агент. В іншому аспекті даний винахід належить до способу лікування кістозного фіброзу у ссавця, що включає введення будь-якої з вищезгаданих композицій сполуки 1. В іншому варіанті здійснення спосіб включає введення додаткового терапевтич 95199 14 ного агента. В іншому варіанті здійснення додатковий терапевтичний агент вибирають з групи, що складається з муколітичного агента, бронхолітичного засобу, антибіотика, протиінфекційного засобу, протизапального засобу, CFTR модулятора, що відрізняється від сполуки даного винаходу, і поживної речовини. В іншому варіанті здійснення розмір дози сполуки 1 в стандартній лікарській формі складає від приблизно 100 мг до приблизно 1000 мг. В іншому ^ варіанті здійснення розмір дози сполуки 1 складає від приблизно 200 мг до приблизно 900 мг. В іншому варіанті здійснення розмір дози сполуки 1 складає від приблизно 300 мг до приблизно 800 мг. В іншому варіанті здійснення розмір дози сполуки 1 складає від приблизно 400 мг до приблизно 700 мг. В іншому варіанті здійснення розмір дози сполуки 1 складає від приблизно 500 мг до приблизно 600 мг. В іншому аспекті даний винахід належить до фармацевтичної упаковки або набору, що містить будь-яку з вищезгаданих композицій сполуки 1 і інструкцію для її застосування. В іншому аспекті даний винахід належить до пероральної композиції, що містить сполуку 1, воду, метилцелюлозу, полісорбат 80 і симетикон. В іншому варіанті здійснення сполука 1 присутня в концентрації від приблизно 2,5% до приблизно 3,5% за вагою. В іншому варіанті здійснення метилцелюлоза is присутня в концентрації приблизно 0,5% за вагою. В іншому варіанті здійснення полісорбат 80 присутній в концентрації приблизно 0,5% за вагою. В іншому варіанті здійснення симетикон присутній в концентрації приблизно 0,05% за вагою. Способи, описані в даному винаході, можна застосовувати для одержання композицій даного винаходу. Кількості і властивості компонентів, що застосовуються в даних способах, могли б бути, як описано в даному винаході. Способи одержання сполуки 1 Сполука 1 являє собою 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойну кислоту і в одному варіанті здійснення її можна одержати конденсацією хлоридвмісної молекули з аміновмісною молекулою згідно зі схемами 1-3. В одному варіанті здійснення сполуку 1 в формі І одержують диспергуванням або розчиненням сольової форми, такої як НСl, 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)цйклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти у придатному розчиннику протягом достатньої кількості часу. В іншому варіанті здійснення сполуку 1 в формі І одержують безпосередньо з 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)-трет-бутилбензоату і відповідної кислоти, такої як мурашина кислота. 15 95199 16 Схема 1. Синтез хлорангідриду карбонової кислоти Схема 2. Синтез аміновмісної молекули Схема 3. Утворення кислої солі 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)3-метилпіридин-2-іл)бензойної кислоти Застосовуючи НСI, наприклад, сольову форму 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойна кислота як вихідна сполука, сполуку 1 можна одержати з високим виходом диспергуванням або розчиненням НСI сольової форми 3-(6-(1(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти у придатному розчиннику протягом достатньої кількості часу. Можна застосовувати інші сольові форми 3-(6-(1-(2,2 дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти, такі як, наприклад, інші форми з мінеральними і органічними кислотами. Інші сольові форми одержують гідролізом третбутилового ефіру відповідною кислотою. Інші кислотні/сольові форми включають азотну, сірчану, фосфорну, борну, оцтову, бензойну, малонову і подібні. Сольова форма 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2 17 іл)бензойної кислоти може бути розчинна або ні, залежно від розчинника, що застосовується, але відсутність розчинності не перешкоджає утворенню сполуки 1. Наприклад, в одному варіанті здійснення придатний розчинник може бути водою або сумішшю спирт/вода, такою як приблизно 50% сумішшю метанол/вода, навіть якщо НСI сольова форма 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти дуже мало розчинна у воді. В одному варіанті здійснення придатний розчинник являє собою воду. Достатня кількість часу для утворення сполуки 1 з сольової форми 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти може бути будь-яким періодом часу від приблизно 1 до 24 годин. Зазвичай більше ніж 24 години не потрібно для одержання високих виходів (-98%), але певні розчинники можуть вимагати більш тривалого періоду часу. Також ясно, що кількість необхідного часу є зазвичай зворотно пропорційною температурі. Тобто чим вище температура, тим менший період часу потрібен для дисоціації кислоти для утворення сполуки 1. Коли розчинником є вода, перемішування дисперсії протягом приблизно 24 годин при кімнатній температурі дає сполуку 1 з приблизно 98% виходом. Якщо розчин сольової форми 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти потрібен з технологічних потреб, можна застосовувати підвищені температури і органічний розчинник. Після перемішування розчинника протягом достатнього періоду часу при підвищеній температурі перекристалізація при охолоджуванні дає практично чисті форми сполуки 1. В одному варіанті здійснення практично чиста належить до більше ніж приблизно 90% чистоти. В іншому варіанті здійснення практично чиста належить до більше ніж приблизно 95% чистоти. В іншому варіанті здійснення практично чиста належить до більше ніж приблизно 98% чистоти. В іншому варіанті здійснення практично чиста належить до більше ніж приблизно 99% чистоти. Вибрана температура частково залежить від розчинника, що застосовується, і фахівці в даній галузі техніки здатні її визначити. В одному варіанті здійснення температура складає від кімнатної температури і до приблизно 80°С. В іншому варіанті здійснення температура складає від кімнатної температури до приблизно 40°С. В іншому варіанті здійснення температура складає від приблизно 40°С до приблизно 60°С. В іншому варіанті здійснення температура складає від приблизно 60°С до приблизно 80°С. У деяких варіантах здійснення сполуку 1 можна додатково очистити перекристалізацією з органічного розчинника. Приклади органічних розфакторів включають, але не обмежуються, толуол, кумол, анізол, 1-бутанол, ізопропілацетат, бутилацетат, ізобутилацетат, метил-трет-бутиловий ефір, метилізобутилкетон або 1-пропанол/вода (в різних співвідношеннях). Температуру можна застосовувати, як описано вище. Наприклад, в одному варі 95199 18 анті здійснення сполуку 1 розчиняють в 1-бутанолі при приблизно 75°С до її повного розчинення. Охолоджування до приблизно 10°С при швидкості приблизно 0,2°С/хв дає кристали сполуки 1, які можна виділити фільтрацією. Застосування, склад і введення Водні композиції В одному аспекті даного винаходу забезпечують водними композиціями, де дані композиції містять сполуку 1, як описано в даному-винаході, воду, і агент, сприяючий регулюванню в'язкості, і необов'язково містять інші агенти, такі як поверхнево-активна речовина, протиспінювальна речовина, стабілізатор смаку і/або ароматизатор, і додаткові фармацевтично прийнятні носії, допоміжні речовини або середовища. У певних варіантах здійснення дані композиції необов'язково додатково містять один або більше додаткових терапевтичних агентів. Також ясно, що сполука 1 може існувати у вигляді її фармацевтично прийнятного похідного або проліків. Згідно з даним винаходом фармацевтично прийнятне похідне або проліки включає, але не обмежується, складний ефір, солі даного ефіру або будь-який інший продукт приєднання, або похідне, яке при введенні потребуючому його пацієнту здатне давати, прямо або непрямо, сполуку, як в інших випадках описують в даному винаході, або його метаболіт, або продукт. 1. Агенти, сприяючі регулюванню в'язкості Агент, сприяючий регулюванню в'язкості, вибирають з фармацевтично прийнятних агентів, сприяючих регулюванню в'язкості, наприклад, ксантанової камеді, гідроксипропілцелюлози, гідроксипропілметилцелюлози, метилцелюлози, карагенану, карбоксиметилцелюлози, мікрокристалічної целюлози, полівінілпіролідону, альгінату натрію, повідону, аравійської камеді, гуарової камеді, трагаканту, силікату алюмінію і магнію і поліакрилатів. Перевалені агенти, сприяючі регулюванню в'язкості, включають метилцелюлозу, карбоксиметилцелюлозу натрію, гідроксипропілметилцелюлозу, гідроксипропілцелюлозу, альгінат натрію, поліакрилат, повідон, аравійську камедь, гуарову камедь, ксантанову камедь, силікат алюмінію і магнію і трагакант. Особливо переважні агенти, сприяючі регулюванню в'язкості, являють собою метилцелюлозу, поліакрилат, ксантанову камедь, гуарову камедь, повідон, карбоксиметилцелюлозу натрію і силікат алюмінію і магнію. Особливо переважний агент, сприяючий регулюванню в'язкості, являє собою метилцелюлозу. Пероральні композиції даного винаходу зазвичай містять від приблизно 0,1 до приблизно 20% за вагою агента, сприяючого регулюванню в'язкості. У переважному варіанті здійснення концентрація агента, сприяючого регулюванню в'язкості, складає від приблизно 0,1 до приблизно 1% за вагою. В особливо переважному варіанті здійснення концентрація агента, сприяючого регулюванню в'язкості, становить приблизно 0,5% за вагою. 2. Поверхнево-активні речовини Поверхнево-активні речовини знижують поверхневий натяг між водою і органічною сполукою, 19 такою як сполука 1, при абсорбції на поверхні розділення вода-сполука 1. Поверхнево-активні речовини збільшують змочувальну здатність сполуки 1 і сприяють стабілізації водної суспензії. Поверхнево-активні речовини часто розділяють на чотири групи; аніонні, катіонні, неіонні і цвітеріонні (двозарядні). У переважному варіанті здійснення поверхнево-активна речовина являє собою аніонну, катіонні або неіонні поверхнево-активну речовину. Аніонні поверхнево-активні речовини можна вибрати з солей додецилсульфату, лаурилсульфату, лауретсульфату, алкілбензолсульфонатів, бутанової кислоти, гексанової кислоти, октанової кислоти, деканової кислоти, лаурилової кислоти, міристинової кислоти, пальмітинової кислоти, стеаринової кислоти, арахідонової кислоти, бегенової кислоти, міристоленової кислоти, пальмітолеїнової кислоти, олеїнової кислоти, лінолевої кислоти, альфа-ліноленової кислоти, арахідонової кислоти, ейкозапентаєнової кислоти, ерукової кислоти і докозагексаєнової кислоти. Катіонні поверхнево-активні речовини можна вибрати з броміду цетилтриметиламонію, хлориду цетилпіридинію, поліетоксильованого жирного аміну, хлориду бензалконію і хлориду бензетонію. Неіонні поверхнево-активні речовини можна вибрати з полісорбатів, алкіл полі(етиленоксиду), полоксаміну, алкілполіглікозидів, октилглікозиду, децилмальтозиду, жирного спирту, цетилового спирту, олеїлового спирту, кокамід МЕА, кокамід DEA і кокамід TEA. Термін "полісорбат" застосовують в його відомому в даній галузі техніки значенні, тобто ефірів поліоксіетиленсорбітану і жирних кислот, як описують і визначають в Handbook Of Pharmaceutical Excipients, під редакцією Ainley Wade and Paul Weller, The Pharmaceutical Press, London, 1994. Придатні полісорбати включають полісорбат 20, 21, 40, 60, 61, 65, 80, 81, 85 і 120. Полісорбат 80 є переважним. Полісорбат 80 також зазвичай називають назвою його комерційної торгової марки "Tween80". Пероральні композиції даного винаходу зазвичай містять від приблизно 0,1 до приблизно 10% за вагою поверхнево-активної речовини. У переважному варіанті здійснення концентрація поверхнево-активної речовини складає від приблизно 0,1 до приблизно 1% за вагою. В особливо переважному варіанті здійснення концентрація поверхнево-активної речовини становить приблизно 0,5% за вагою. 3. Протиспінювальна речовина Як видно з назви, протиспінювальна речовина являє собою хімічну добавку, яка інгібує утворення піни. Протиспінювальні речовини застосовують в медичних цілях в фармацевтичних композиціях для послаблення розбухання, оскільки вони викликають злиття маленьких пухирців у великі пухирці, які проходять більш легко. Багато які протиспінювальні речовини містять полідиметилсилоксан. Відомим прикладом є лікарський симетикон, який являє собою активний інгредієнт в лікарських засобах, таких як Gas-X™. Симетикон являє собою суміш полідиметилсилокеану і силікагелю. 95199 20 Пероральні композиції даного винаходу зазвичай містять від приблизно 0,01 до приблизно 0,2% за вагою протиспінювальної речовини. У переважному варіанті здійснення концентрація протиспінювальної речовини складає від приблизно 0,01% до приблизно 0,1% за вагою. В особливо переважному варіанті здійснення концентрація протиспінювальної речовини становить приблизно 0,05% за вагою. 4. Буфер Буферні речовини можуть являти собою або слабку кислоту або слабку основу, які могли б включати буферний розчин. Дані агенти додають до речовин, які повинні поміщуватися в кислі або основні умови, для того, щоб стабілізувати речовину. Придатні буфери для пероральних композицій даного винаходу можна вибрати з натрієвих, калієвих або амонієвих солей оцтової, борної, вугільної, фосфорної, бурштинової, яблучної, винної, лимонної, оцтової, бензойної, молочної, гліцеринової, глюконової, глутарової або глютамінової кислоти. У переважному варіанті здійснення буфер містить натрієву, калієву або амонієву солі лимонної кислоти. 5. Регулятор смаку і/або ароматизатор Як відмічалося раніше, в пероральні композиції сполуки 1 корисно включати регулятор смаку. Такі регулятори смаку являють собою хлориди лужних і лужноземельних металів, включаючи хлорид натрію, хлорид літію, хлорид калію, хлорид магнію і хлорид кальцію. Хлорид натрію є переважним. Регулятор смаку зазвичай міститься в суспензії в регулюючій смак кількості, зазвичай в кількості, рівній від приблизно 0,5 до приблизно 2,0% за вагою, оскільки регулятор смаку береться з розрахунку ваги суспензії. Що стосується інших солей, можна розрахувати еквівалентні молярні кількості. Інші регулятори смаку включають цукор, в присутності або за відсутності інших підсолоджувачів і/або ароматизаторів. При застосуванні ароматизатори можна вибирати з синтетичних ароматизованих масел і запашних ароматичних сполук і/або природних олій, екстрактів з листя рослин, квітів, плодів і т.д. і їх комбінацій. Вони можуть включати коричну олію, олію вінтергрена, олію перцевої м'яти, гвоздичну олію, лаврову олію, анісову олію, евкаліптову олію, чебрецеву олію, олію листя кедра, олію мускатного горіха, олію шавлії, олію гіркого мигдалю і олію акації. Також придатними як ароматизатори є ванільна, цитрусова олія, включаючи лимонну, апельсинову, виноградну, лаймову і грейпфрутову олію, і фруктові есенції, включаючи яблучну, бананову, грушеву, персикову, полуничну, малинову, вишневу, сливову, ананасову, абрикосову есенцію і т.д. Кількість ароматизатора може залежати від ряду факторів, включаючи необхідний органолептичний ефект. Зазвичай ароматизатор буде присутнім в кількості від приблизно 0,01 до приблизно 1,0 процентів за вагою відносно сумарної ваги суспензії. Як описано вище, композиції даного винаходу можуть містити фармацевтично прийнятний носій, допоміжну речовину або середовище, на додаток до води, яка, як застосовують в даному винаході, включає будь-які і всі розчинники, розріджувачі 21 або інші рідкі середовища, допоміжні речовини для утворення дисперсії або суспензії, поверхневоактивні речовини, ізотонічні агенти, загусники або емульгатори, консерванти, тверді зв'язуючі матеріали, що мастять речовини і подібні, як придатні для конкретної необхідної лікарської форми. Remington's Pharmaceutical Sciences, Sixteenth Edition, Ε. W. Martin (Mack Publishing Co., Easton, Pa., 1980) описує різні носії, що застосовуються для створення фармацевтично прийнятних композицій і відомі методики їх одержання. За винятком випадків, коли будь-яке загальноприйняте середовище є несумісним із сполукою даного винаходу, таких як надання будь-якого несприятливого біологічного ефекту або, інакше, несприятливої взаємодії з будь-яким іншим компонентом (компонентами) фармацевтично прийнятної композиції, передбачається, що її застосування включене в обсяг даного винаходу. Деякі приклади речовин, які можуть служити як фармацевтично прийнятні носії, включають, але не обмежуються, іонообмінну смолу, оксид алюмінію, стеарат алюмінію, лецитину, сироваткові білки, такі як людський сироватковий альбумін, суміші частково етерифікованого гліцерину з насиченими рослинними жирними кислотами, солі або електроліти, такі як сульфат протаміну, гідрофосфат динатрію, гідрофосфат калію, хлорид натрію, солі цинку, колоїдний оксид кремнію, трисилікат магнію, полівінілпіролідон, поліакрилати, віск, поліетиленполіоксипропіленові блокові співполімери, шерстяний жир, цукор, такі як лактоза, глюкоза і сукроза; крохмаль, такий як кукурудзяний крохмаль і картопляний крохмаль; солод; желатин; тальк; допоміжні речовини, такі як олія какао і віск для супозиторіїв; олії, такі як кокосова олія, бавовняна олія; соняшникова олія; кунжутна олія; оливкова олія; кукурудзяна олія і соєва олія; гліколі; такі як пропіленгліколь або поліетиленгліколь; складний ефір, такий як етилолеат і етиллаурат; агар; альгінову кислоту; апірогенну воду; ізотонічний сольовий розчин; розчин Рінгера; і етиловий спирт, також як нетоксичні сумісні мастильні речовини, такі як лаурилсульфат натрію і стеарат магнію, а також барвники, антиадгезиви, покривні речовини, підсолоджувачі, ароматизуючі добавки, консерванти і антиоксиданти можуть також бути присутніми в композиції, згідно з рішенням розробника рецептур. Застосування сполук і фармацевтично прийнятних композицій У ще іншому аспекті даний винахід належить до способу лікування стану, захворювання або розладу, в якому бере участь CFTR. У певних варіантах здійснення даний винахід належить до способу лікування стану, захворювання або розладу, викликаного недостатньою CFTR активністю, причому спосіб включає введення пероральної композиції, що містить сполуку 1, описану в даному винаході, потребуючому цього пацієнту суб'єкту, переважно ссавцеві. "CFTR-опосередковане захворювання", як застосовують в даному винаході, являє собою захворювання, вибране з кістозного фіброзу, спадкової емфіземи, спадкового гемохроматозу, дефіциту коагулювання-фібринолізу, такого як 95199 22 нестача протеїну С, спадкового ангіоневротичного набряку типу 1, недостатньої переробки ліпідів, такої як сімейна гіперхолестеринемія, хіломікронемії 1 типу, абеталіпопротеїнемії, лізосомної хвороби накопичення, такої як хвороба "Іклітин"/Псевдо-Хурлер, мукополісахаридозу, хвороби Сандхоффа/Тея-Сакс, синдрому КриглераНайяра 2 типу, поліендокринопатії/гіперінсулінемії, цукрового діабету, карликовості Ларона. нестачі мієлопероксидази, первинного гіпопаратиреозу, меланоми, гліканолізу CDG типу 1, спадкової емфіземи, природженого гіпертиреозу, незавершеного остеогенезу, спадкової гіпофібриногенемії, ACT недостатності, нецукрового діабету (DI), нейрофізіологічного DI, DI нервового походження, хвороби Шарко-Марітута, хвороби Перліцеуса-Мерцбахера, нейродегенеративних захворювань, таких як хвороба Альцгеймера, хвороба Паркінсона, бічний аміотрофічний склероз, прогресуючого над'ядерного паралічу, хвороби Піка, декількох поліглутамінових неврологічних захворювань, такого як хвороба Хантінгтона, спінально-церебелярна атаксія 1 типу, спінальна і бульбарна м'язова атрофія, дентаторубал-палідолуізіанова атрофія і міотонічна дистрофія, а також енцефалопатії губчастої, такої як спадкова хвороба Крейтцфельда-Якоба, хвороби Фабрі, синдрому Штройслера-Шейнкера, COPD, сухість очей і хвороби Шегрена. У певних варіантах здійснення даний винахід належить до способу лікування CFTRопосередкованого захворювання у ссавця, що включає стадію введення згаданого ссавця ефективної кількості композиції, що містить сполуку 1, описаної в даному винаході. Згідно з альтернативним переважним варіантом здійснення даний винахід належить до способу лікування кістозного фіброзу у людини, що включає стадію введення згаданої людини пероральної композиції, що містить сполуку 1, описаної в даному винаході. Згідно з даним винаходом "ефективна кількість" пероральної композиції сполуки 1 є кількістю, ефективною для лікування або послаблення тяжкості будь-якого із захворювань, перерахованих вище. У певних варіантах здійснення пероральна композиція сполуки 1, описана в даному винаході, є придатною для лікування або послаблення тяжкості кістозного фіброзу у пацієнтів, які мають залишкову CFTR активність в апікальній мембрані респіраторного і нереспіраторного епітелію. Наявність залишкової CFTR активності на епітеліальній поверхні можна легко виявити, . застосовуючи способи, відому в даній галузі техніки, наприклад, стандартні електрофізіологічні, біохімічні або гістохімічні методики. Дані способи визначають CFTR активність, застосовуючи in vivo або ex vivo електрофізіологічні методики, вимірювання СІ концентрацій в поті або слині, або ex vivo біохімічні або гістохімічні методики для контролю щільності клітинної поверхні. Застосовуючи дані способи, залишкову CFTR активність можна легко визначити у пацієнтів, гетерозиготних або гомозиготних для ряду різних мутацій, включаючи пацієнтів, гомози 23 готних або гетерозиготних для найбільш поширеної мутації, AF508. В одному варіанті здійснення пероральна композиція сполуки 1, описана в даному винаході, є придатною для лікування або послаблення тяжкості кістозного фіброзу у пацієнтів з певними генотипами, що виявляють залишкову CFTR активність, наприклад, мутацією класу III (порушене регулювання або функціонування каналів), мутацією класу IV (змінена провідність) або мутацією класу V (знижений синтез) (Lee R. Choo-Kang, Pamela L., Zeitlin, Type I, II, III, IV and V cystic fibrosis Tansmembrane Conductance Regulator Defects and Opportunities of Therapy; Current Opinion in Pulmonary Medicine 6: 521-529, 2000). Інші генотипи пацієнтів, які виявляють залишкову CFTR активність, включають пацієнтів, гомозиготних для одного з даних класів або гетерозиготних для будь-якого іншого класу мутацій, включаючи мутації класу І, мутації класу II або мутацію, яка не класифікована. В одному варіанті здійснення пероральна композиція сполуки 1, описана в даному винаході, є придатною для лікування або послаблення тяжкості кістозного фіброзу у пацієнтів з певними клінічними фенотипами, наприклад, Від помірного до м'якого клінічного фенотипу, який зазвичай пов'язаний із залишковою CFTR активністю в апікальній мембрані епітелію. Дані фенотипи включають пацієнтів, що мають недостатність підшлункової залози або пацієнтів, яким поставлений діагноз ідіопатичний панкреатит і природжена двостороння відсутність сім'явиносного протоку або помірні захворювання легень. Точна необхідна кількість буде змінюватися від суб'єкта до суб'єкта залежно від виду, віку і загального стану суб'єкта, тяжкості інфекції, конкретного агента, способу його введення і подібних. Сполуки даного винаходу переважно формулюють в стандартну лікарську форму для простоти введення і рівномірності дозування. Вираз "стандартна лікарська форма", як застосовують в даному винаході, належить до фізично дискретної одиниці агента, придатної для пацієнта, якого треба лікувати. Однак ясно, що сумарна денна доза сполук і композицій даного винаходу буде підбиратися лікуючим лікарем за результатами ретельної медичної оцінки. Конкретні величини ефективної дози для конкретного пацієнта або організму будуть залежати від ряду факторів, включаючи захворювання, яке треба лікувати, і тяжкість захворювання; активність конкретної сполуки, що застосовується; конкретної композиції, що застосовується; віку, ваги тіла, загального стану здоров'я, статі і харчування пацієнта; часу введення, способу введення і швидкості екскреції конкретної сполуки, що застосовується; тривалості лікування; лікарських засобів, що застосовуються в комбінації або спільно з конкретною сполукою, що застосовується, і подібних факторів, добре відомих в галузі медицини. Термін "пацієнт", як застосовують в даному винаході, належить до тварини, переважно ссавця і найбільш переважно до людини. У певних варіантах здійснення сполуку даного винаходу можна вводити перорально в дозах, рів 95199 24 них від приблизно 0,01 мг/кг до приблизно 50 мг/кг і переважно від приблизно 1 мг/кг до приблизно 25 мг/кг ваги тіла суб'єкта на день, один або більше разів на день для одержання необхідного терапевтичного ефекту. У певних варіантах здійснення розмір дози сполуки 1 в стандартній лікарській формі складає від приблизно 100 мг до приблизно 1000 мг. В іншому варіанті здійснення розмір дози сполуки 1 складає від приблизно 200 мг до приблизно 900 мг. В іншому варіанті здійснення розмір дози сполуки 1 складає від приблизно 300 мг до приблизно 800 мг. В іншому варіанті здійснення розмір дози» сполуки 1 складає від приблизно 400 мг до приблизно 700 мг. В іншому варіанті здійснення розмір дози сполуки 1 складає від приблизно 500 мг до приблизно 600 мг. Також ясно, що пероральні композиції сполуки 1, описані в даному винаході, можна застосовувати в комбінаційних терапіях, тобто пероральні композиції сполуки 1 можна вводити одночасно, перед або після одного або більше інших необхідних терапевтичних засобів або медичних процедур. Конкретна комбінація терапій (терапевтичні засоби або процедури) для застосування в комбінованому режимі повинна враховувати сумісність необхідних терапевтичних засобів і/або процедур і необхідний терапевтичний ефект, який треба досягнути. Також ясно, що терапії, які застосовуються можуть надавати необхідний ефект для одного захворювання (наприклад, сполуку даного винаходу можна вводити одночасно з іншим агентом, що застосовується для лікування одного захворювання), або вони можуть надавати різні ефекти (наприклад, контроль будь-яких побічних ефектів). Як застосовують в даному винаході, додаткові терапевтичні агенти, які зазвичай вводять для лікування або запобігання конкретному захворюванню або стану, є відомими, як "придатні для захворювання або стану, який зазнає лікування". В одному варіанті здійснення додатковий агент вибирають з муколітичного агента, бронхолітичного засобу, антибіотика, антимікробної речовини, протизапального агента, CFTR модулятора, відмінного від сполуки даного винаходу або поживної речовини. В іншому варіанті здійснення додатковий агент являє собою сполуку, вибрану з гентаміцину, куркуміну, циклофосфаміду, 4-фенілбутирату, міглустату, фелодипіну, німодипіну, філоксину В, геністеїну, апігеніну, цАМФ/цГМФ модуляторів, таких як роліпрам, силденафіл, мілринон, тадалафіл, амринон, ізопротеренол, альбутерол і альметерол, дезоксиспергуаліну, HSP 90 інгібіторів, HSP 70 інгібіторів, інгібіторів протеосом, таких як епоксоміцин, лактацистин і т.д. В іншому варіанті здійснення додатковий агент являє собою сполуку, описану в WO 2004028480, WO 2004110352, WO 2005094374, WO 2005120497 або WO 2006101740. В іншому варіанті здійснення додатковий агент являє собою бензо(с)хінолізинієве похідне, яке має CFTR модулюючу активність або бензопіранове похідне, яке має CFTR модулюючу активність. 25 В іншому варіанті здійснення додатковий агент являє собою сполуку, описану в US7202262, US6992096, US20060148864, US20060148863, US20060035943, US20050164973, WO2006110483, WO2006044456, WO2006044682, WO2006044505, WO2006044503, WO2006044502 або WO2004091502. В іншому варіанті здійснення додатковий агент являє собою сполуку, описану в WO2004080972, WO2004111014, WO2005035514, WO2005049018, WO2006002421, WO2006099256, WO2006127588 або WO2007044560. В іншому варіанті здійснення додатковий агент вибирають із сполук, описаних в патентній заявці СІЛА серійний № 11/165818, опублікованій, як опублікована патентна заявка США № 2006/0074075, внесена в реєстр 24 червня 2005 року, і вона вводиться в даний винахід повністю за допомогою посилання. В іншому варіанті здійснення додатковий агент являє собою N-(5гідрокси-2,4-ди-трет-бутилфеніл)-4-оксо-1Нхінолін-3-карбоксамід. Дані комбінації є придатними для лікування захворювання, описаного в даному винаході, включаючи кістозний фіброз. Дані комбінації є придатними у вигляді наборів, описаних в даному винаході. Кількість додаткового терапевтичного агента, присутнього в композиції даного винаходу, буде не великою кількістю, яку зазвичай вводять в композицію, що містить даний терапевтичний агент як єдиний активний агент. Переважно кількість додаткового терапевтичного агента в описаній в даному винаході композиції буде змінюватися від приблизно 50% до 100% кількості, зазвичай присутньої в композиції, що містить даний агент як єдиний терапевтично активний агент. Токсикологія Короткий виклад Передбачуваний клінічний спосіб введення є пероральним, таким чином, на мишах, щурах і собаках проводили вивчення токсичності при пероральному введенні. Параграф Вивчення токсичності одиничної дози нижче узагальнює проведені дослідження з токсичності: гостру токсичність при пероральному введенні композиції сполуки 1 оцінювали на мишах і щурах, яким давали однократну дозу сполуки 1 з подальшим 14-денним періодом спостереження. Ефекти багаторазового перорального дозування оцінювали на щурах і собаках в попередніх 7-денних дослідженнях токсичності, з подальшим 14-денним GLP1 дослідженням токсичності. Щури переносили аж до 600 мг/кг/день без токсичних ефектів. Собаки переносили аж до 200 мг/кг/день без токсичних ефектів. Однократні пероральні дози для пероральних композицій сполуки 1 аж до 2000 мг/кг у щурів і мишей (сумарний об'єм дози 20 мл/кг, одержаний у вигляді суспензії в 0,5% Tween80+0,5% MC у воді) не призводили до позапланових смертей і помітних клінічних спостережень протягом 14денного спостереження після введення дози і вважалися такими, що добре переносяться. Не було впливу на вагу органів і макроскопічних спостережень (макроскопічні дослідження), поміченого при некропсії. 95199 26 Пероральні композиції сполуки 1 добре переносилися і в 7- і в 14-денних дослідженнях токсичності при пероральному введенні доз, що повторюється. І у щурів (дози аж до 600 мг/кг/день) і у собак (аж до 200 мг/кг/день) єдиним результатом був слабкий вплив на деякі параметри клінічної хімії і гематології при самих високих випробуваних дозах. Жодну з даних змін не вважали несприятливим, і не було помітних уражень при спостереженні через світловий мікроскоп, пов'язаних зі сполукою 1, у обох видів. Крім того, ECG криві (собаки) і офтальмологічні дослідження (обидва види) всі були в нормальних межах. Низькі співвідношення простата:вага тіла і простата:вага мозку (52-62% при всіх рівнях доз) були зареєстровані у чоловічих особин собак, яким вводили сполуку 1, відносно відповідної контрольної групи з пустушкою в 14-денному дослідженні. Однак при відсутності змін, що спостерігаються за допомогою світлового мікроскопа, в даному органі, це не вважають прямим ефектом сполуки 1 і це може бути випадковим результатом через статеву незрілість молодих тварин в даному дослідженні. Таким чином, рівень, що не викликає шкідливого впливу (NOAEL), вважають найвищою дозою, випробуваною для обох видів: 600 мг/кг/день для щурів і 200 мг/кг/день для собак. Потенціал для клінічної токсикології випробовували, застосовуючи стандартну GLP бактеріальну мутацію (Ames), хромосомну аберацію яєчника китайського хом'ячка (СНО), і in vivo мікроядерний тест на мишах: сполука 1 була негативною у всіх випробуваннях. Дані з фармакологічних досліджень безпеки (ІСН S7A/S7B набір) передбачають, що пероральні композиції сполуки 1 ймовірно не будуть викликати побічних ефектів на шлунково-кишкову, респіраторну, ЦНС або серцево-судинну системи при лікуванні CF пацієнтів. За винятком попередніх 7-денних досліджень на токсичність всі дослідження проводили згідно з GLP вимогами. Дослідження in vitro Для сполуки 1 проводили зворотний скринінг відносно великої групи ферментів і рецепторів, застосовуючи дослідження на зв'язування із застосуванням радіоактивної мітки (див. MDS Pharma Services, LeadProfiling and SpectramScreen, MDSPS PT#: 1083321). Зв'язуючу активність спостерігали тільки для тромбоксанового А2 (ТХА2) рецептора (ТР рецептор) з Kі, що дорівнює ~3 мкм. В in vitro функціональному аналізі ТР рецепторної функції, застосовуючи аорту щурів, сполука 1 показала, що вона є антагоністом ТР рецептора з ІС50 1-10 мкм. Однак в фармакологічних дослідженнях безпеки серцево-судинні або респіраторні зміни не спостерігали, що передбачає, що сполука 1 не має антагоністичний ефект відносно ТР рецептора in vivo, незважаючи на досягнення дуже сильного системного впливу при пероральних дозах аж до 1000 мг/кг у щурів і 200 мг/кг у собак. У CF пацієнтів підвисилася здатність до агрегації тромбоцитів і ТХА2 вивільнення, що може сприяти патогенезу бронхостенозу (O'Sullivan et al., (2005) Blood 105: 4635, Stead et al., (1987) 27 95199 Prostaglandins Leukot Med 26: 91). Потужний ТР рецепторний антагонізм сполуки 1 може надавати терапевтичний позитивний ефекту CF пацієнтів запобіганням бронхостенозу, викликаного ТХА2. + Ефект сполуки 1 на hERG, серцевий K канал, відповідальний за реполяризацію мембрани, аналізували, застосовуючи ряд електрофізіологічних методик. Не було даних про hERG IC50 величину нижче 30 мкм в будь-якому з даних аналізів, що узгоджується з відсутністю hERG канального конкурентного зв'язування (4% інгібування зв'язування 3Н-астемізолу при 10 мкм). Дані результати передбачають низьку імовірність hERG інгібування і пов'язаного з ним подовження QT інтервалу in vivo. Дослідження на токсичність однократної дози 28 Однократні пероральні дози 500, 1000 або 2000 мг/кг сполуки 1 у мишей і щурів (сумарний об'єм дози 20 мл/кг, одержаний у вигляді суспензії в 0,5% Tween 80+0,5% МС у воді) не призводили до позапланових смертей і помітних клінічних спостережень протягом 14-денного спостереження після введення дози і вважалися добре переносимими. Не було ефектів на вагу органів і макроскопічних спостережень (макроскопічні дослідження), помічених при некропсії. Вважали, що і максимальна переносима доза (MTD) і недіюча негативна доза (NOAEL) при вивченні безпосередніх ефектів на щурах і мишах є >2000 мг/кг. Середні токсикокінетичні параметри при MTD/NOAEL для обох видів зведені в таблицю 1. Таблиця 1 Середні величини для вибіркових некомпартментних токсикокінетичних параметрів для сполуки 1 при MTD/NOAEL для дослідження гострої токсичності при пероральному введенні мишам і щурам при 2000 мг/кг Види Доза (мг/кг) Миша 2000 Щур 2000 Стать Жіноча Чоловіча Жіноча Чоловіча Сполука 1 добре абсорбувалася у мишей з часом для досягнення максимальних концентрацій в плазмі (tmax) в діапазоні від 0,5 до 2,0 годин. Максимальні концентрації в плазмі крові (Сmах) і AUC024 години збільшувалися зі збільшенням дози, але менше, ніж пропорційним дозі способом. Сmах знаходилося в діапазоні від 142 мг/мл у чоловічих особин при 500 мг/кг до 325 мг/мл у жіночих особин 2000 мг/кг, тоді як AUC0-24 години знаходилася в діапазоні 1837 мг*год/мл у жіночих особин при 500 мг/кг до 2899 мг*год/мл у жіночих особин при 2000 мг/кг. Після досягнення С mах величин концентрації сполуки 1 рівномірно зменшуються в плазмі, і величини, що спостерігаються, періоду напіввиведення (t1/2) сполуки 1 знаходяться в діапазоні від 4,1 до 8,6 годин. Видимих розбіжностей між статями в t1/2 не було, і t1/2 збільшувалося зі збільшенням дози від 500 до 1000 мг/кг. Додаткове збільшення дози до 2000 мг/кг не змінювало періоду напіввиведення, що припускає насичення обмеженого абсорбцією процесу виведення. Не було помітних пов'язаних зі статтю ефектів при згаданих впливах сполукою 1. Сполука 1 добре абсорбувалася у щурів з часом для досягнення максимальних концентрацій в плазмі (tmax) в діапазоні від 4,0 до 24,0 годин. Максимальні концентрації в плазмі крові (Сmах) і AUC024 години збільшуються зі збільшенням дози, але менше, ніж пропорційним дозі способом, за винятком AUC0-24 години величин, що спостерігаються у чоловічих особин щурів. Сmах знаходилася в діапазоні від 135 мг/мл у чоловічих особин при 500 мг/кг до 306 мг/мл у чоловічих особин при 2000 мг/кг, тоді як AUC0-24 години знаходилася в діапазоні від 1389 мг*год/мл у чоловічих особин при 500 мг/кг до AUC0-24 години мкг*год/мл 2899 2678 6750 6106 Cmах (мкг/мл) 325 264 305 306 tmax (год) 1 1 10 24 6750 мг*год/мл у жіночих особин при 2000 мг/кг. Після досягнення Сmах величин концентрації сполука 1 рівномірно зменшується в плазмі і величини, що спостерігаються, періоду напіввиведення (t1/2) сполуки 1 знаходяться в діапазоні від 9,4 до 10,8 годин. Період напіввиведення не можна було вирахувати при 1000 і 2000 мг/кг дозах сполуки 1. Не було помітних пов'язаних зі статтю ефектів при згаданих впливах сполукою 1, за винятком AUC0-24 годи™ величин в групі з 500 мг/кг дозою, де спостерігалися більше ніж в 2 рази більші величини у жіночих особин у порівнянні з чоловічими особинами. Дослідження токсичності багатократних доз Дослідження токсичності багатократних доз при пероральному введенні з 7- і 14-денною тривалістю проводили на щурах (але до 600 мг/кг/день) і собаках (аж до 200 мг/кг/день). Сполука 1 добре переносилася при 7-денному дослідженні по знаходженню діапазону доз щурами при значеннях доз аж до 300 мг/кг/день. Тваринам вводили дозу перорально з пустушкою (0,5% метилцелюлози в воді), або 15, 75 або 150 мг/кг сполуки 1 двічі на день протягом 7 наступних днів. Дві денні дози вводили приблизно через 10 годин, і об'єм дози був 5 мг/кг/двічі на день для всіх груп дозування. В конці періоду дозування всіх тварин умертвлювали і розтинали. Допоміжним тваринам (6/стать/групи 2-4) вводили дози тим самим способом, як тваринам при дослідженні токсичності і зразки плазми крові збирали на 1 і 7 день для токсикокінетичного (ТК) аналізу. Параметрами, оціненими протягом дослідження, були життєздатність, клінічні спостереження, вага тіла, споживання корму, клінічна патологія (закінчення), 29 вага органів, макроскопічні спостереження і мікроскопічна патологія. Всi тварини дожили до закінчення дослідження. Дані АUС0-24часа плазми крові на 1 день відповідали проведеним раніше дослідженням токсичності однократної дози сполуки 1 на щурах. Приблизно пропорційний дозі вплив спостерігали в обох статей при всіх значеннях доз на обидва дня дослідження, і не було помітних вказаних впливів статі. При найвищій дозі (300 мг/кг/день) середні концентрації в плазмі крові були приблизно 260 мм у чоловічих особин (Cmax ~430 мм) і 190 мм у жіночих особин (Сmах~280мм). Показники даного дослідження обмежувалися більш низькою концентрацією сироваткового калію при дозі 300 мг/кг/день у жіночих особин, і незначним впливом на вагу тіла у тварин при дозі 300 мг/кг/день (обох статей). Крім того, чоловічі особини з дозою 300 мг/кг/день сполуки 1 мали невелике підвищення рН сечі і великою вагою надниркових залоз. Дані зміни не вважають шкідливими, і не було макроскопічних ушкоджень, пов'язаних з досліджуваним препаратом, або гістопатологічних результатів аналізу в будь-якій з досліджуваних тканин. Таким чином, в умовах даного дослідження NOAEL складала 300 мг/кг/день. Аналогічно, єдиним результатом в 14-денному дослідженні на щурах при дозах 150, 300 і 600 мг/кг/день (сумарний об'єм доз 5 мл/кг, одержаний у вигляді суспензії в 0,5% Tween 80+0,5% МС в воді, що вводиться перорально один раз на день), був слабкий ефект на концентрації ALT (23-46% збільшення), загальний білірубін (0-54% збільшення), загальний холестерин (21-45% збільшення), параметри червоних кров'яних тілець (RBC) (загальний гемоглобін, гематокрит і кількість червоних кров'яних тілець знизилася на 4-8%), кількості білих кров'яних тілець і лімфоцитів (27-64% збільшення) і кількість ретикулоцитів (23-32% збільшення) тільки при найвищій дозі. Жодну з даних змін не вважали шкідливою, і не було помітних пов'язаних зі сполукою 1 результатів в будь-якому з більше ніж 40 органів і тканин, досліджуваних за допомогою світлового мікроскопа. Таким чином, в результаті 14-денного щоденного перорального введення сполуки 1 щурам вважали, що NOAEL складає 600 мг/кг/день, найвищу досліджувану дозу. Сполука 1 також добре переносилася в 7денному дослідженні по знаходженню діапазону доз на собаках при значеннях доз аж до 100 мг/кг/день. Одній собаці кожної статі вводили перорально пустушку (0,5% метилцелюлози + 0,5% Tween 80 в воді) або 25, 50, або 100 мг/кг/день сполуки 1 протягом 7 наступних днів. Об'єм дози був 5 мл/кг/день для всіх груп дозування. Зразки плазми крові збирали на 1 і 7 день для (ТК) аналізу і оцінювали життєздатність, клінічні спостереження, вага тіла, споживання корму, клінічна патологія (закінчення), вага органів, макроскопічні спостереження і мікроскопічну патологію. Всі тварини дожили до закінчення дослідження. Дані AUC0-24 години плазми крові на 1 день відповідали проведеним раніше дослідженням токси 95199 30 чності однократної дози сполуки 1 на собаках. Вплив зазвичай збільшувався зі збільшенням дози в обох статей, але збільшення було меншим, ніж пропорційне дозі збільшення, і не було помітних вказаних різниць між статями. При найвищій дозі (100 мг/кг/день) середні концентрації в плазмі крові були приблизно 16 мМ у чоловічих особин (С mах ~110 мм) і 38 мМ у жіночих особин (Сmах ~130 мм). Результати дослідження обмежувалися невеликими змінами в параметрах клінічної хімії і незначним впливом (0,3 кг втрата) на вагу тіла при дозі 100 мг/кг/день у чоловічих особин. Дані зміни не вважають шкідливими, і не було впливу на споживання корму, гематологію, параметри коагуляції або ECG показники, і не було макроскопічних ушкоджень, пов'язаних з досліджуваним препаратом або гістопатологічних результатів аналізу в будь-якій з досліджуваних тканин. Таким чином, в умовах даного дослідження NOAEL складала 100 мг/кг/день. Аналогічно, єдиним результатом в 14-денному дослідженні на собаках при дозах 150, 300 і 600 мг/кг/день (сумарний об'єм доз 5 мл/кг, одержаний у вигляді суспензії в 0,5% Tween 80+0,5% МС в воді, що вводиться перорально один раз на день), був слабкий ефект на загальний холестерин (2129% зниження), тригліцериди (44-46% зниження) і RBC параметри (7-14% зниження). Як і в дослідженнях на щурах дані зміни не вважали шкідливими, і не було помітних результатів, пов'язаних зі сполукою 1, одержаних за допомогою світлового мікроскопа. Крім того, ECG криві і офтальмологічне дослідження всі були в нормальних межах. Низькі співвідношення вага простати:вага тіла і вага простати:вага мозку (52-62% при всіх значеннях дози) були зафіксовані для всіх чоловічих особин, якім вводили сполуку 1, відносно відповідної контрольної групи, якій вводили пустушку, в 14денному дослідженні на собаках. Однак при відсутності змін в органах, що спостерігаються за допомогою світлового мікроскопа, це не можна розглядати, як прямий ефект сполуки 1, і він може бути випадковим результатом через статеву незрілість молодих тварин, що застосовуються в даному дослідженні. Не було помітних, пов'язаних з досліджуваним сполукою результатів в будь-якому з досліджуваних за допомогою світлового мікроскопа органів і тканин в обох 14-денних дослідженнях на собаках або щурах. Таким чином, в результаті 14-денного щоденного перорального введення сполуки 1 собакам вважали, що NOAEL складала 200 мг/кг/день, найвищу досліджувану дозу. Середні токсикокінетичні параметри при NOAEL для обох видів зведені в таблицю 2. Системний вплив в дослідженнях на токсичність з багатократними дозами був високим і стійким протягом всього періоду дозування: при відповідних NOAEL, середні величини Сmах і AUC0-24 години були 222 мкг/мл і 3951 мкг*год/мл у щурів, і 75 мг/мл і 645 мкг*год/мл у собак. Не було великих різниць, зареєстрованих для ТK параметрів між чоловічими особинами і жіночими особинами, або при порівнянні 1 дня дослідження з 14-днем дослідження. 31 95199 32 Таблиця 2 Середні величини для вибіркових некомпартментних токсикокінетичних параметрів для сполуки 1 при NOAEL в 14-денних дослідженнях на токсичність при пероральному введенні щурам (600 мг/кг/день) і собакам (200 мг/кг/день) Види День дослідження Доза (мг/кг/день) 1 600 14 600 1 200 14 200 Щур Собака Генотоксичність Сполука 1 не спричиняла значного збільшення зворотних мутацій в тесті на бактеріальні мутації (тест Еймса) і давала негативний результат на кластогенез (хромосомна аберація) в аналізі із застосуванням клітин яєчника китайського хом'ячка (СНО). Сполука 1 не спричиняла значного збільшення кількості мікроядерних поліхроматофільних еритроцитів при введенні мишам чоловічої статі (in vivo мікроядерний тест на ссавцях) при пероральному введенні доз аж до 2000 мг/кг. Обговорення і висновки Пероральні композиції сполуки 1 добре переносяться в дослідженнях на гостру токсичність щурами і мишами і в дослідженнях на токсичність багаторазових доз щурами, і собаками. Не було виявлено схильності до генотоксичності. NOAEL в 14-денних дослідженнях на токсичність багаторазових доз складала щонайменше 600 мг/кг/день у щурів і 200 мг/кг/день у собак. Виходячи з розрахунків за площею поверхні тіла, еквівалентна доза для людини складає щонайменше 95 мг/кг, застосовуючи будь-яку NOAEL. Приймаючи вагу людини рівною 60 кг, вона буде рівна сумарній денній дозі, приблизно рівній 5700 мг. Розрахунки межі безпеки основані на NOAEL і дозах для досягнення очікуваних ефективних концентрацій в плазмі крові, які не наведені у відповідність з розподілом в легенях або зв'язуванням білків плазми. Приймаючи ефективну дозу у щурів рівною 2,3 мг/кг два рази на день, виходячи з мінімальної концентрації в плазмі для досягнення і підтримки ЕС90 концентрації, прогнозована межа безпеки з щурячої NOAEL рівна 130Х. Приймаючи ефективну дозу у собак рівною 0,91 мг/кг два рази на день, виходячи з мінімальної концентрації в плазмі для досягнення і підтримки ЕС90 концентрації, вважають, що межа безпеки, що прогнозується з собачої NOAEL рівна 110Х. Фармакокінетика і метаболізм лікарського засобу Короткі відомості Фармакокінетику сполуки 1 оцінювали на тих самих видах, що застосовуються в токсикологічних дослідженнях: CD-1 миші, щура лінії Sprague Dawley і собак породи бігль. Фармакокінетику сполуки 1 також оцінювали на макаках-крабоїдах. Дві кристалічні форми 3-(6-(1-(2,2 Стать Жіноча віча Жіноча віча Жіноча віча Жіноча віча ЧолоЧолоЧолоЧоло AUC0-24 години мкг*год/мл 4427 2657 5501 3219 573 691 720 598 Cmах (мкг/мл) 273 164 272 181 56 77 77 72 tmах (год) 4 10 10 10 4 3 3 3 дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти, вільна форма (сполука 1) і НСI сіль, застосовували в токсикологічних і фармакокінетичних дослідженнях. Всмоктування сполуки 1 у щурів з метилцелюлозної суспензії було чудовим в діапазоні від 47% до ~100%. Біологічна доступність сполуки 1 у собак становила 53% при 10 мг/кг і 20% при 200 мг/кг при введенні перорально в метилцелюлозній суспензії. Сполука 1 мала дуже низький кліренс у щурів, мишей, собак і мавп. Час напіввиведення сполуки 1 при пероральному введенні щурам або собакам складав 5-9 годин. Системний вплив сполуки 1 на щурів в метилцелюлозній суспензії був пропорційний дозі, що вводиться в допустимому діапазоні доз, рівному 1-300 мг/кг. У собак системний вплив 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти, введеної перорально у вигляді НСI солі, був пропорційний дозі, що вводиться в діапазоні 1-200 мг/кг. Внаслідок однократного перорального введення неміченої сполуки 1 щурам найбільший розподіл був в печінці, потім в легенях, підшлунковій залозі і мозку з відношеннями тканини до плазми 0,73, 0,19, 0,13 і 0,02, відповідно, через одну годину після перорального введення 75 мг/кг. Виведення сполуки 1 було практично повним з усіх тканин через 48 годин після введення (концентрації менше ніж 1 мкг/мл). Хоча розподіл в легенях був низьким відносно плазми, передбачали, що концентрації, виміряні в легенях при низьких і середніх дозах, будуть ефективними. Всмоктування Всмоктування 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти оцінювали на щурах і собаках після перорального введення сполуки 1 або НСI солі, в композиціях метилцелюлозної суспензії. Незатверджені тести дослідницького рівня застосовували для даних аналізів. Всі фармакокінетичні дослідження проводили, застосовуючи тварин, що харчуються, якщо не вказано особливо. У чоловічих особин щурів лінії Sprague Dawley, яким вводили перорально сполуку 1 в метилцелюлозній суспензії, спостерігали пропорційний дозі 33 95199 вплив в діапазоні доз 1-300 мг/кг, як виміряно за допомогою AUC0-INF і Сmах величин плазми (таблиця 3). При 600 мг/кг збільшення системного впливу було меншим, ніж пропорційне збільшенню дози. Біологічна доступність знаходилася в діапазоні від 47 до ~100% в діапазоні пероральних доз 1-600 34 мг/кг у щурів, що свідчить про чудове всмоктування сполуки. Кінцеві періоди напіввиведення 5,9-8,1 годин вимірювали в діапазоні пероральних доз 1-600 мг/кг. tmax величини знаходилися в діапазоні від 3,0 до 4,7 годин у всьому діапазоні пероральних доз, що досліджується на щурах. Таблиця 3 Середні (SD) фармакокінетичні параметри для сполуки 1 після введення однократної пероральної дози вільної форми в суспензії чоловічим особинам щурів Задана доза AUC0-INF (мг/кг) (год* мкг/мл) 1 13,7 (7,1) 30 369 (97) 150 728 (332) 300 2530 (99) 600 3085 (493) Cmax (мкг/мл) 1,10 (0,54) 28,2 (3,50) 54,7 (30,9) 181 (220) 203 (35) tmax (год) 3,00 (2,65) 4,00 (2,00) 4,67 (1,15) 3,33 (1,15) 4,67 (1,15) Пероральну фармакокінетику НСI солі 3-(6-(1(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти оцінювали в умовах з годуванням і натщесерце на чоловічих особинах щурів лінії Sprague Dawley при дозі 30 мг/кг (таблиця 4). Системний вплив 3-(6-(1-(2,2дифторбензо[d][1,3]дioксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти·НСI після введення НСI солі був аналогічним в умовах з годуванням і натщесерце, і був аналогічним впливу, одержаному для сполуки 1 при тій самій дозі в умовах з годуванням. Сmах в умовах з годуванням (36,1 мкг/мл) був t1/2 (год) 7,65 (0,38) 6,83 (1,15) 8,07 (1,82) 5,86 (1,22) 7,49 (1,11) F (%) >100 >100 47 81 50 Clast (нг/мл) 28,8 (11,5) 44,0 (55,0) 51,6 (26,9) 1120 (572) 1236 (1234) tlast (год) 48 48 72 48 72 нижчим, ніж в умовах натщесерце (52,3 мкг/мл), ймовірно через знижений час випорожнення шлунку в присутності їжі. tmax після перорального введення НСI солі складав 3,7 години в умовах з годуванням і 3,3 години в умовах натщесерце, який був аналогічним tmax 3,0-4,7 годин після перорального введення сполуки 1 в умовах з годуванням. Кінцевий період напіввиведення 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти був 5,9-8,1 години (сполука 1) або 5,4-6,1 години (НСI сіль) у чоловічих особин щурів після перорального введення. Таблиця 4 Середні (SD) фармакокінетичні параметри для сполуки 1 після введення однократної пероральної дози НСI солі в суспензії чоловічим особинам щурів при годуванні і натщесерце Задана доза AUC0-INF Cmax Умови tmax (год) t1/2 (год) (мг/кг) (год*мкг/ мл) (мкг/мл) 30 при годуванні 383(41) 52,3 (3,9) 3,33 (1,15) 5,36 (0,98) 30 натщесерце 340 (137) 36,1(10,2) 3,67 (2,52) 6,07 (0,67) Фармакокінетичні параметри 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти після перорального введення однократної дози в суспензії чоловічим особинам собак породи бігль представлені в таблиці 5. 3-(6(1-(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойну кислоту (НСI сіль) спочатку вводили при заданих дозах 1-10 мг/кг в суміші 0,5% - метилцелюлоза/вода, однак через коливання впливу з F (%) >100 >100 Clast (нг/мл) 60 (18) 240(202) tlast (год) 48 48 даним середовищем 0,5% полісорбат 80 додавали до композиції для великих значень доз. При заданих дозах 5-200 мг/кг в суміші 0,5% полісорбат 80/0,5% метилцелюлоза/вода вплив був сильним і відносно пропорційним дозі до 200 мг/кг (таблиця 5). Час напіввиведення знаходився в діапазоні від 4,9 до 8,8 годин при всіх значеннях доз, що досліджуються в обох середовищах. Біологічна доступність знаходилася в діапазоні від 24% до 49% при всіх значеннях доз, що досліджуються і в обох композиціях на основі суспензії. 35 95199 36 Таблиця 5 Середні (SD) фармакокінетичні параметри для 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти (НСI соль) після введення однократної пероральної дози НСI солі в суспензії чоловічим особинам собак Средовище 0,5% МС/вода 0,5% полісорбат 80/0,5% МС/вода Задана доза (мг/кг) 1 3 10 5 25 50 100 200 AUC0-INF (год*мкг/ мл) 2,2 (0,5) 9,3 (4,8) 28,4(12,8) 11,0(3,6) 56,8(22,1) 63,4 (22,9) 268(123) 523 (46,8) Пероральну фармакокінетику сполуки 1 визначали в умовах з годуванням і натщесерце на чоловічих особинах собак породи бігль після однократного 10 мг/кг введення (таблиця 6). AUC0-INF сполуки 1 в плазмі була порівнянна в умовах з годуванням і натщесерце, хоча Сmах в умовах натщесерце (7,9 мкг/мл) була вище, ніж в умовах з годуванням (4,1 мкг/мл). tmax досягалося швидше Cmax (мкг/мл) 0,37 (0,2) ІД (0,5) 8,9 (7,2) 3,0 (0,5) 18,0(3,7) 21,0(7,1) 54,4 (6,8) 101 (30,2) t1/2 (год) tmax (год) 6,0 5,3 8,8 7,0 5,9 4,9 5,4 5,9 0,83 1,7 1,0 1,0 2,0 1,7 1,7 2,3 F (%) 35 49 40 24 41 27 46 30 після введення в умовах натщесерце (1,5 години), ніж в умовах з годуванням (2,7 години). Коливання системного впливу сполуки 1 було великим в умовах годування (CV 67% для AUC0-INF), ніж в умовах натщесерце (CV 27% для AUC0-INF), ймовірно через зміни під час випорожнення шлунку в умовах годування. Таблиця 6 Середні (SD) фармакокінетичні параметри для сполуки 1 після введення однократної пероральної дози НСI солі в суспензії чоловічим особинам собак в умовах з годуванням і натщесерце при 10 мг/кг Умови Натщесерце При годуванні Задана доза (мг/кг) 10 10 AUC0-INF (год*мкг/мл) 35,8 (9,7) 35,7 (24) Cmax (мкг/мл) 7,9(1,9) 4,1 (1,2) Після перорального введення сполуки 1 і НСI солі 3-(6-(1-(2,2-дифторбензо[с!][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти чоловічим особинам собак при 200 мг/кг, великі системні AUC0-INF і Сmах величини спостерігали для НСI солі (755 мкг*годину/мл і 133 мкг/мл, відповідно), ніж для сполуки 1 (288 t1/2 (год) 1,5 (0,6) 2,7 (0,8) t1/2 (год) 6,3 (3,3) 6,6 (4,4) F (%) 53 53 Clast (нг/мл) 66 (36) 47 (34) tlast (год) 48 48 мкг*годину/мл і 52 мкг/мл, відповідно) (таблиця 7). tmax і t1/2 для 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти були - аналогічними після введення сполуки 1 і НСI солі (таблиця 7). Таблиця 7 Середні (SD) фармакокінетичні параметри для 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти після перорального введення сполуки 1 і НСI солі в суспензії чоловічим особинам собак при 200 мг/кг Форма Вільна форма НСI соль Задана доза (мг/кг) 200 200 AUC0-INF (год*мкг/мл) 288 (306) 755 (114) Cmax (мкг/мл) 52 (38) 133 (26) Розподіл Після перорального введення щурам дози 75 мг/кг в 0,5% метилцелюлоза/вода суспензії відношення концентрацій в тканині до плазми 3-(6-(1(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти через 1-48 годин після введення були самими високими в печінці (0,7-1,8), tmax (год) 1,7 (1,2) 2,5 (0,6) t1/2 (год) 6,1 (3,2) 5,5 (2,4) F (%) 20 53 Clast (нг/мл) 63 (66) 128 (147) tlast (год) 48 48 потім в легенях (0,15-0,35), підшлунковій залозі (0,12-0,15) і найменшими в мозку (0,02) (таблиця 8, фіг. 14). Через 48 годин концентрації 3-(6-(1-(2,2дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойної кислоти були надзвичайно низькими (меншими, ніж 1 мкг/мл), що свідчить про практично повне виведення з тканин. Виміряні швидкості 37 95199 виведення 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2 38 іл)бензойної кислоти з всіх тканин були аналогічні швидкостям її виведення з плазми (таблиця 9). Таблиця 8 Середні концентрації в тканях і відношення ткань/плазма 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти у чоловічих особин щурів після перорального введення однократної дози при 75 мг/кг Час (год) 1 4 12 48 Концентрації в тканині (мкг/мл або мкг/г) Підшлункова Плазма Печінка Легені Мозок залоза 47,3 34,7 9,14 6,03 0,93 59,1 38,1 8,99 6,83 0,96 24,8 26,3 5,17 3,65 0,55 0,54 0,97 0,19 0,09 BLQ Тканина/плазма відношення Підшлункова Печінка Легені Мозок залоза 0,73 0,19 0,13 0,02 0,64 0,15 0,12 0,02 1,06 0,21 0,15 0,02 1,78 0,35 0,15. BLQ Таблиця 9 Узагальнений результат фармакокінетичних параметрів тканин 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти у чоловічих особин щурів лінії Sprague Dawley після однократного перорального введення при дозі 75 мг/кг Тканина Плазма Печінка Легені Підшлункова залоза Мозок а AUC0-INF (год*мкг/мл) 980266 885161 187039 132270 а 9304 Cmax (мкг/мл) 59067 38067 9140 6833 957 tmax (год) 4 4 1 4 4 Clast (нг/мл) 542 965 189 86 546 tlast (год) 48 48 48 48 12 t1/2 (год) 6,51 8,06 7,79 6,87 Сmах відношення (тканина/плазма) 0,64 0,15 0,12 0,02 AUCall Для того щоб можна було повністю зрозуміти даний винахід, наводять наступні приклади. Ясно, що дані приклади наведені тільки з метою ілюстрації і ' не треба розглядати їх як обмежуючі даний винахід будь-яким способом. ПРИКЛАДИ Методи і матеріали Диференціальна скануюча калориметрія (DSC) Дані диференціальної скануючої калориметрії (DSC) форми І одержували, застосовуючи DSC Q100 V9.6 Build 290 (ТА Instruments, New Castle, DE). Температуру калібрували із застосуванням індію, і теплоємність калібрували із застосуванням сапфіру. Зразки 3-6 мг зважували в алюмінієвих кюветах, які загвинчували, застосовуючи кришки з 1-голчастим отвором. Зразки сканували від 25°С до 350°С при швидкості нагрівання 1,0°С/хв і продуванням азотом з швидкістю 50 мл/хв. Дані збирали за допомогою Thermal Advantage Q SeriesTM версія 2.2.0.248 програмного забезпечення і аналізували за допомогою Universal Analysis програмного забезпечення версія 4.1 D (ТА Instruments, New Castle, DE). Наведені числа представляють одиничні аналізи. XRPD (рентгенівська порошкова дифрактометрія) Дані рентгенівської дифракції (XRD) сполуки 1 одержували на Bruker D8 DISCOVER порошковому дифрактометрі з HI-STAR 2-мірним датчиком і плоским графітовим монохроматором. Сu запаяну лампу з Κα випромінюванням застосовували при 40 кВ, 35 мА. Зразки вміщували на кремнієві пластини з нульовим фоном при 25°С. Для кожного зразка два набори даних одержували при 120 секундах кожний при 2 різних θ2 кутах: 8° і 26°. Дані інтегрували за допомогою GADDS програмного забезпечення і об'єднували за допомогою plus DIFFRACT EVA програмного забезпечення. Похибки для представлених положень піків становили ±0,2 градуса. Vitride® (біс(2-метоксіетоксі)алюмогідрид натрію [або NaAlH2(ОСН2СН2ОСН3)2], 65% за вагою розчин в толуолі) купували у Aldrich Chemicals. 2,2-Дифтор-1,3-бензодіоксол-5-карбонову кислоту купували у Saltigo (філіал Lanxess Corporation). Скрізь в даний заявці, де назва сполуки не може правильно описувати структуру сполуки, структура замінює назву і має пріоритетне значення. Синтез 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2іл)бензойноїкислоти·НСI. Компонент, що є хлорангідридом карбонової кислоти Синтез (2,2-дифтор-1,3-бензодіоксол-5іл)метанолу 39 Наявну в продажу 2,2-дифтор-1,3бензодіоксол-5-карбонову кислоту (1,0 екв.) суспендували в толуолі (10 об.). Додавали через краплинну лійку Vitride® (2 екв.) з такою швидкістю, щоб підтримувати температуру рівною 1525°С. Після завершення додавання температуру підвищували до 40°С протягом 2 годин, потім акуратно додавали через краплинну лійку 10% (ваг./ваг.) водний NaOH (4,0 екв.), підтримуючи температуру рівною 40-50°С. Після перемішування протягом додаткових 30 хвилин шари розділяли при 40°С. Органічну фазу охолоджували до 20°С, потім промивали водою (2×1,5 об.), сушили (Na2SO4), фільтрували і концентрували, одержуючи неочищений (2.2-дифтор-1,3-бензодіоксол-5іл)метанол, який застосовували безпосередньо в наступній стадії. Синтез 5-хлорметил-2,2-дифтор-1,3бензодіоксолу (2,2-дифтор-1,3-бензодіоксол-5-іл)метанол (1,0 екв.) розчиняли в МТВЕ (5 об.). Додавали каталітичну кількість DMAP (1% моль) і додавали через краплинну лійку SOCl2 (1,2 екв.). SOCl2 додавали при такій швидкості, щоб підтримувати температуру в колбі рівною 15-25°С. Температуру підвищували до 30°С протягом 1 години, потім охолоджували до 20°С, потім додавали через краплинну лійку воду (4 об.), підтримуючи температу 95199 40 ру меншої ніж 30°С. Після перемішування протягом додаткових 30 хвилин шари розділяли. Органічний шар перемішували і додавали 10% (ваг./об.) водний NaOH (4,4 об.). Після перемішування протягом 15-20 хвилин, шари розділяли. Потім органічну фазу сушили (Na2SO4), фільтрували і концентрували, одержуючи неочищений 5хлорметил-2,2-дифтор-1,3-бензодіоксол, який застосовували безпосередньо в наступній стадії. Синтез (2,2-дифтор-1,3-бензодіоксол-5іл)ацетонітрилу Розчин 5-хлорметил-2,2-дифтор-1,3бензодіоксолу (1 екв.) в DMSO (1,25 об.) додавали до суспензії NaCN (1,4 екв.) в DMSO (3 об.), підтримуючи температуру в діапазоні 30-40°С. Суміш перемішували протягом 1 години, потім додавали воду (6 об.), з подальшим додаванням МТВЕ (4 об.). Після перемішування протягом 30 хвилин шари розділяли. Водний шар екстрагували МТВЕ (1,8 об.). Об'єднані органічні шари промивали водою (1,8 об.), сушили (Na2SO4), фільтрували і концентрували, одержуючи неочищений (2,2-дифтор1,3-бензодіоксол-5-іл)ацетонітрил (95%), який застосовували безпосередньо в наступній стадії. Синтез (2,2-дифтор-1,3-бензодіоксол-5іл)циклопропанкарбонітрилу Суміш (2,2-дифтор-1,3-бензодіоксол-5іл)ацетонітрилу (1,0 екв.), 50% за вагою водного КОН (5,0 екв.), 1-бром-2-хлоретану (1,5 екв.) і Oct4NBr (0,02 екв.) гріли при 70°С протягом 1 години. Потім реакційну суміш охолоджували, обробляли МТВЕ і водою. Органічну фазу промивали водою і соляним розчином, потім розчинник видаляли, одержуючи (2,2-дифтор-1,3-бензодіоксол-5іл)циклопропанкарбонітрил. Синтез 1-(2,2-дифтор-1,3-бензодіоксол-5іл)циклопропанкарбонової кислоти (2,2-дифтор-1,3-бензодіоксол-5іл)циклопропанкарбонітрил гідролізували, засто совуючи 6М NaOH (8 екв.) в етанолі (5 об.) при 80°С протягом ночі. Суміш охолоджували до кім 41 95199 42 натної температури і етанол упарювали у вакуумі. Залишок розчиняли у воді і МТВЕ, додавали 1М НСI і шари розділяли. Потім МТВЕ шар обробляли дициклогексиламіном (0,97 екв.). Суспензію охолоджували до 0°С, фільтрували і промивали гептаном, одержуючи відповідну DCHA сіль. Сіль розчиняли в МТВЕ і 10% лимонній кислоті і перемішували до розчинення твердого залишку. Шари розділяли і МТВЕ шар промивали водою і соляним розчином. Розчинник замінювали гептаном, з подальшою фільтрацією, одержуючи 1-(2,2дифтор-1,3-бензодіоксол-5іл)циклопропанкарбонову кислоту після висушування у вакуумній печі при 50°С протягом ночі. Синтез 1-(2,2-дифтор-1,3-бензодіоксол-5-іл)циклопропанкарбонілхлориду 1-(2,2-дифтор-1,3-бензодіоксол-5іл)циклопропанкарбонову кислоту (1,2 екв.) суспендували в толуолі (2,5 об.), і суміш нагрівали до 60°С. Додавали через краплинну лійку SOCl2 (1,4 екв.). Толуол і SOCl2 відганяли з реакційної суміші через 30 хвилин. Додавали додаткову кількість толуолу (2,5 об.) і відганяли знов. Амінвмісний компонент Синтез трели-бутил-3-(3-метилпіридин-2іл)бензоату 2-Бром-3-метилпіридин (1,0 екв.) розчиняли в толуолі (12 об.). Додавали K2СО3 (4,8 екв.), з подальшим додаванням води (3,5 об.), і суміш гріли при 65°С в потоку N2 протягом 1 години. Потім додавали 3-(трет-бутоксикарбоніл)фенілборну кислоту (1,05 екв.) iPd(dppf)Cl2·CH2Cl2 (0,015 екв.) і суміш нагрівали до 80°С. Через 2 години нагрівання припиняли, додавали воду (3,5 об.) і шари розділяли. Потім органічну фазу промивали водою (3,5 об.) і екстрагували 10% водною метансульфоновою кислотою (2 екв. MsOH, 7,7 об.). Водну фазу робили основною 50% водним NaOH (2 екв.) і екстрагували ЕtOАс (8 об.). Органічний шар концентрували, одержуючи неочищений трет-бутил-3(3-метилпіридин-2-іл)бензоат (82%), який застосовували безпосередньо в наступній стадії. Синтез 2-(3-(трет-бутоксикарбоніл)феніл)-3метилпіридин-1-оксиду трет-Бутил-3-(3-метилпіридин-2-іл)бензоат (1,0 екв.) розчиняли-в ЕtOАс (6 об.). Додавали воду (0,3 об.), з подальшим додаванням суміші сечовина-пероксид водню (3 екв.). Додавали порціями фталевий ангідрид (3 екв.) у вигляді - твердої речовини, підтримуючи температуру в колбі нижче за 45°С. Після завершення додавання фталевого ангідриду суміш нагрівали до 45°С. Після перемішування протягом додаткових 4 годин нагрівання припиняли. Додавали через краплинну лійку 10% ваг./ваг. водний Na2SO3 (1,5 екв.). Після завершення додавання Na2SO3 суміш перемішу вали протягом додаткових 30 хвилин і шари розділяли. Органічний шар перемішували і додавали 10% ваг./ваг. водний №2СО3 (2 екв.). Після перемішування протягом 30 хвилин шари розділяли. Органічну фазу промивали 13% ваг./об. водним NaCl. Потім органічну фазу фільтрували і концентрували, одержуючи неочищений 2-(3-(третбутоксикарбоніл)феніл)-3-метилпіридин-1-оксид (95%), який застосовували безпосередньо в наступній стадії. Синтез/трет-бутил-3-(6-аміно-3-метилпіридин2-іл)бензоату 43 95199 44 Розчин 2-(3-(трет-бутоксикарбоніл)феніл)-3метилпіридин-1-оксиду (1 екв.) і піридин (4 екв.) в MeCN (8 об.) нагрівали до 70°С. Додавали протягом 50 хвилин через краплинну лійку розчин ангідриду метансульфонової кислоти (1,5 екв.) в MeCN (2 об.), підтримуючи температуру меншою ніж 75°С. Суміш перемішували протягом додаткового 0,5 години перед завершенням додавання. Потім суміш охолоджували до температури навколишнього середовища. Додавали через краплинну лійку етаноламін (10 екв.). Після перемішування протягом 2 годин додавали воду (6 об.), і суміш охолоджували до 10°С. Після перемішування протягом не більше 3 годин твердий залишок збирали фільтрацією і промивали водою (3 об.), 2:1 MeCN/вода (3 об.) і MeCN (2×1,5 об.). Твердий залишок сушили до постійної ваги (
ДивитисяДодаткова інформація
Назва патенту англійськоюAqueous formulation of 3-(6-(1-(2,2-difluorobenzo[d][1,3]dioxol-5-yl) cyclopropanecarboxamido)-3-methylpyridin-2-yl)benzoic acid
Автори англійськоюKeshavarz-Shokri, Ali, Young, Christopher
Назва патенту російськоюВодная композиция 3-(6-(1-(2,2-дифторбензо[d][1,3]диоксол-5-ил)циклопропанкарбоксамидо)-3-метилпиридин-2-ил)бензойной кислоты
Автори російськоюКесхаварз-Схокри Али, Янг Кристофер
МПК / Мітки
МПК: A61K 31/443, A61P 3/00
Мітки: водна, композиція, 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної, кислоти
Код посилання
<a href="https://ua.patents.su/35-95199-vodna-kompoziciya-3-6-1-22-diftorbenzod13dioksol-5-ilciklopropankarboksamido-3-metilpiridin-2-ilbenzojjno-kisloti.html" target="_blank" rel="follow" title="База патентів України">Водна композиція 3-(6-(1-(2,2-дифторбензо[d][1,3]діоксол-5-іл)циклопропанкарбоксамідо)-3-метилпіридин-2-іл)бензойної кислоти</a>
Попередній патент: Розподільний механізм
Наступний патент: Установка безперервного лиття довгих сталевих виробів та спосіб їх безперервного лиття
Випадковий патент: Тренувальний пояс рятівника і пожежника