Кон’югати жирних кислот і ніацину та їх застосування
Номер патенту: 110329
Опубліковано: 25.12.2015
Автори: Ву Чі Б., Мілн Джилл К., Беміс Джин Е., Джіроусек Майкл Р.
Формула / Реферат
1. Сполука Формули І
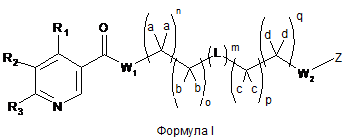
або її фармацевтично прийнятна сіль або стереоізомер;
де
кожен з R1 R2 та R3 незалежно вибраний з групи, що складається з -Н, -D, -Сl, -F і С1-С3алкілу;
кожен з W1 та W2 являє собою NR, або W1 та W2 разом можуть утворювати імідазолідинову або піперазинову групу;
кожен а, b, с та d незалежно являє собою -Н, -D, -СН3 або -C(O)OR, або два із а, b, с та d, разом з одинарним атомом вуглецю, до якого вони приєднані, можуть утворювати циклоалкіл;
кожен n, о, р та q незалежно дорівнює 0 або 1;
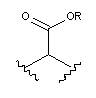
кожен L незалежно являє собою -О-, -S-S-,
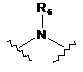 ,
,  ,
, 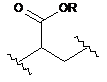 ,
, 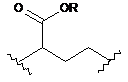 ,
, 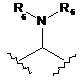 або
або
 ;
;
m дорівнює 0 або 1;
кожен R6 незалежно являє собою Н або С1-С6алкіл;
кожен R7 незалежно являє собою Н або нерозгалужений або розгалужений С1-С10алкіл;
кожен Z незалежно являє собою
 або
або 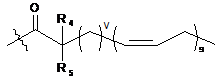 ;
;
кожен r незалежно дорівнює 2 або 3;
кожен s незалежно дорівнює 5 або 6;
t дорівнює 1;
кожен v незалежно дорівнює 1 або 2;
кожен з R4 та R5 незалежно являє собою водень, дейтерій або -С1-С4алкіл; і
кожен R незалежно являє собою -Н або -С1-С3алкіл.
2. Сполука за п. 1, де Z являє собою
 .
.
3. Сполука за п. 2, де t дорівнює1.
4. Сполука за п. 3, де r дорівнює 2, і s дорівнює 6.
5. Сполука за п. 3, де r дорівнює 3, і s дорівнює 5.
6. Сполука за п. 4, де L являє собою -S-S-.
7. Сполука за п. 4, де L являє собою -О-.
8. Сполука за п. 4, де L являє собою
 .
.
9. Сполука за п. 4, де L являє собою
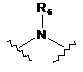 .
.
10. Сполука за п. 4, де L являє собою
 ,
, 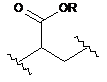 або
або 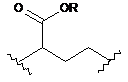 .
.
11. Сполука за п. 4, де кожен із n, о, р та q дорівнює 1.
12. Сполука за п. 4, де два із n, о, р та q дорівнюють 1.
13. Сполука за п. 4, де кожен з W1 та W2 являє собою NH.
14. Сполука за п. 4, де m дорівнює 1, кожен із n, о, р та q дорівнює 1, та L являє собою О.
15. Сполука за п. 4, де m дорівнює 1, кожен із n, о, р та q дорівнює 1, та L являє собою -S-S-.
16. Сполука за п. 4, де кожен із m, n та о дорівнює 0, і кожен із р та q дорівнює 1.
17. Сполука за п. 4, де m дорівнює 1, кожен із n та о дорівнює 0, кожен із р та q дорівнює 1, та L являє собою
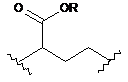 .
.
18. Сполука за п. 4, де m дорівнює 1, кожен із n та о дорівнює 1, кожен із р та q дорівнює 0, та L являє собою
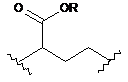 .
.
19. Сполука за п. 4, де m дорівнює 1, кожен із n, о, р та q дорівнює 1, та L являє собою NR6.
20. Сполука за п. 4, де m дорівнює 1, кожен із n та о дорівнює 1, кожен із р та q дорівнює 0, та L являє собою
 .
.
21. Сполука за п. 1, де сполука вибрана з групи, що складається із
N-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетоксі)етил)нікотинаміду і
N-(2-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетил)дисульфаніл)етил)нікотинаміду.
22. Сполука за п. 1, де сполука вибрана з групи, що складається з
N-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетил)нікотинаміду і
N-(2-(5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнамідоетил)нікотинаміду.
23. Сполука за п. 1, де сполука вибрана з групи, що складається з (S)-6-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-2-(нікотинамідо)гексанової кислоти і
(S)-2-((5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнамідо)-6-(нікотинамідо)гексанової кислоти.
24. Сполука за п. 1, яка являє собою
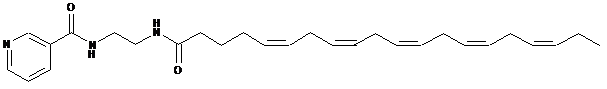 .
.
25. Сполука за п. 1, де m дорівнює 0.
26. Сполука за п. 1, де кожний з n, о, р і q дорівнює 1.
27. Сполука за п. 1, де кожні два з n, о, р і q дорівнюють 1.
28. Сполука за п. 1, де r дорівнює 3, s дорівнює 5 і кожні два з n, о, р і q дорівнюють 1.
29. Сполука за п. 1, де r дорівнює 3, s дорівнює 5 і кожний з W1 і W2 являє собою NH.
30. Сполука за п. 5, де L являє собою -S-S-.
31. Сполука за п. 5, де L являє собою -О-.
32. Сполука за п. 5, де L являє собою  .
.
33. Сполука за п. 5, де L являє собою NR6.
34. Сполука за п. 5, де L являє собою  ,
, 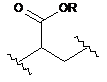 або
або  .
.
35. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-34 і фармацевтично прийнятний носій.
36. Спосіб лікування метаболічного розладу, за яким пацієнту, який потребує такого лікування, вводять ефективну кількість сполуки за будь-яким з пп. 1-34.
37. Спосіб за п. 36, де метаболічний розлад вибирають з гіпертригліцеридемії, гіперхолестеринемії, жирового захворювання печінки, атеросклерозу, захворювання коронарних судин серця, діабету 2 типу, діабетичної нефропатії, діабетичної невропатії, діабетичної ретинопатії, метаболічного синдрому або серцево-судинного захворювання.
38. Спосіб за п. 37, де метаболічний розлад являє собою гіпертригліцеридемію або гіперхолестеринемію.
Текст
Реферат: Винахід стосується кон'югатів жирних кислот та ніацину; композицій, що містять ефективну кількість кон'югата жирної кислоти та ніацину; і способів лікування або профілактики метаболічного розладу, які включають введення ефективної кількості кон'югата жирної кислоти та ніацину. UA 110329 C2 (12) UA 110329 C2 UA 110329 C2 5 10 15 20 25 30 35 40 45 50 55 ПРІОРИТЕТ [0001] Дана заявка претендує на пріоритет Тимчасової Заявки США № 61/238,903, поданої 1 вересня 2009 р., Тимчасової Заявки США № 61/308,524, поданої 26 лютого 2010 р., і Тимчасової Заявки США № 61/310,952, поданої 10 березня 2010 р. Даний опис базується на повному вмісті зазначених заявок, що включений до даної заявки шляхом посилання. ГАЛУЗЬ ТЕХНІКИ [0002] Винахід стосується кон'югатів жирних кислот і ніацину; композицій, що містять ефективну кількість кон'югатів жирних кислот і ніацину; та способів лікування або профілактики метаболічних захворювань, що включають введення ефективної кількості кон'югату жирної кислоти і ніацину. РІВЕНЬ ТЕХНІКИ [0003] Жир холодноводих риб, таких як лосось, форель, оселедець і тунець, є джерелом харчових омега-3 жирних кислот морського походження - ейкозапентаєнової кислоти (ЕПК) і докозагексаєнової кислоти (ДГК), що являють собою ключові омега-3 жирні кислоти морського походження. Як ніацин, так і омега-3 жирні кислоти морського походження (ЕПК і ДГК) продемонстрували здатність зменшувати зустрічальність серцево-судинних захворювань, захворювань коронарних судин серця, атеросклерозу, а також зменшувати смертність серед хворих на дисліпідемію, гіперхолестеринемію або діабет типу 2, а також метаболічні захворювання. Показано, що ніацин у високій дозі (1,5–4 г на добу) знижує рівні ліпопротеїнів дуже низької щільності ("ЛПДНЩ") шляхом зниження рівня Аполіпопротеїну B ("ApoB") та підвищує рівні ліпопротеїнів високої щільності ("ЛПВЩ") шляхом підвищення рівня Аполіпопротеїну A1 ("ApoA1") в печінці. Ніацин також може інгібувати діацилгліцеринацилтрансферазу-2, ключовий фермент для синтезу тригліцеридів (ТГ) (Kamanna, V. S.; Kashyap, M. L. Am. J. Cardiol. 2008, 101 (8A), 20B-26B). На жаль, ніацин спричиняє численні ефекти поза межами печінки, які знижують його терапевтичну користь. Найбільш розповсюдженим побічним ефектом ніацину є припливи, які можуть обмежити переносиму дозу для хворого. Вважається, що припливи є наслідком наявності рецептора GPR109 в судинах. [0004] Показано, що омега-3 жирні кислоти покращують чутливість до дії інсуліну і толерантність глюкози у нормоглікемічних чоловіків та осіб з ожирінням. Також показано, що омега-3 жирні кислоти зменшують інсулінорезистентність у хворих на ожиріння та осіб з нормальною масою тіла і запальним фенотипом. Показано, що метаболізм ліпідів, глюкози та інсуліну покращується у гіпертонічних суб’єктів з надмірною масою тіла в результаті лікування омега-3 жирними кислотами. Також показано, що омега-3 жирні кислоти (ЕПК/ДГК) зменшують рівні тригліцеридів і знижують ризик раптової смерті, спричиненої серцевими аритміями, а також зменшують смертність серед хворих, у яких присутній ризик серцево-судинних катастроф. Омега-3 жирні кислоти як частина дієти у вигляді біологічно активних добавок доповнюють лікування дисліпідемії. [0005] Здатність ніацину та омега-3 жирної кислоти діяти синергічно могла б забезпечити велику користь в лікуванні вищезазначених захворювань. КОРОТКИЙ ОПИС ВИНАХОДУ [0006] Винахід частково базується на відкритті кон’югатів ніацину та жирних кислот та їх продемонстрованому впливі для забезпечення більш ефективного лікування, яке не може бути забезпечене введенням ніацину або жирних кислот, окремо або в комбінації. Вказані нові кон’югати є придатними для лікування або профілактики атеросклерозу, в тому числі метаболічних захворювань, дисліпідемії, захворювання коронарних судин серця, гіперхолестеринемії, діабету 2 типу, підвищеного рівня холестерину, метаболічного синдрому і серцево-судинного захворювання. [0007] Відповідно, в одному з аспектів описаний молекулярний кон’югат, який включає ніацин, ковалентно зв'язаний з жирною кислотою, де жирна кислота вибрана з групи, що складається з омега-3 жирних кислот і жирних кислот, які метаболізуються in vivo з утворенням омега-3 жирних кислот, де кон’югат включає як мінімум один амід, і кон’югат здатний гідролізуватися з утворенням вільного ніацину і вільної жирної кислоти. [0008] В іншому аспекті описані сполуки Формули I: Формула I 1 UA 110329 C2 5 10 15 20 25 та їх фармацевтично прийнятні солі, гідрати, сольвати, проліки, енантіомери та стереоізомери; де кожен з R1, R2 та R3 незалежно вибраний з групи, що складається з: -H, -D, -Cl, -F, -CN, -NH2, -NH(C1-C3 алкіл), -N(C1-C3 алкіл)2, -NH(C(O)C1-C3 алкіл), -N(C(O)C1-C3 алкіл)2, -C(O)H, -C(O)C1-C3 алкіл, -C(O)OC1-C3 алкіл, -C(O)NH2, -C(O)NH(C1-C3 алкіл), -C(O)N(C1-C3 алкіл)2, -C1-C3 алкілу, -OC1-C3 алкілу, -S(O)C1-C3 алкілу та -S(O)2C1-C3 алкілу; кожен з W 1 та W 2 незалежно являє собою нуль, O, S, NH, NR, або W 1 і W 2 разом можуть утворювати імідазолідинову або піперазинову групу, за умови, що W 1 та W 2 не можуть одночасно являти собою O; кожен із a, b, c та d незалежно являє собою -H, -D, -CH3, -OCH3, -OCH2CH3, -C(O)OR, або -OZ, або бензил, або два із a, b, c та d, разом з одинарним атомом вуглецю, до якого вони приєднані, можуть утворювати циклоалкіл або гетероцикл; кожен із n, o, p та q незалежно дорівнює 0 або 1; кожен L незалежно являє собою -O-, -S-, -S(O)-, -S(O)2-, -S-S-, або де представлення L не обмежено зображеним спрямуванням зліва направо, скоріше, ліва сторона або права сторона L може бути приєднана до сторони W 1 сполуки Формули I; кожен g незалежно дорівнює 2, 3 або 4; кожен h незалежно дорівнює 1, 2, 3 або 4; m дорівнює 0, 1, 2, або 3; кожен R6 незалежно являє собою H або C1-C6 алкіл, або обидві групи разом з атомом азоту, до якого вони приєднані, можуть утворювати гетероцикл; кожен R7 незалежно являє собою e, H, або нерозгалужений або розгалужений C 1-C10 алкіл, що може бути необов’язково заміщений OH, NH2, CO2R, CONH2, фенілом, C6H4OH, імідазолом або аргініном; кожен e незалежно являє собою H або будь-який з бічних ланцюгів природних амінокислот; кожен Z незалежно являє собою -H, або 2 UA 110329 C2 або за умови, що в сполуці присутній щонайменше один або ; 5 10 15 20 25 кожен r незалежно дорівнює 2, 3, або 7; кожен s незалежно дорівнює 3, 5, або 6; кожен t незалежно дорівнює 0 або 1 ; кожен v незалежно дорівнює 1, 2, або 6; кожен з R4 та R5 незалежно являє собою -H, -D, -C1-C4 алкіл, -галоген, -OH, -C(O)C1-C4 алкіл, -O-арил, -O-бензил, -OC(O)C1-C4 алкіл, -C1-C3 алкен, -C1-C3 алкін, -C(O)C1-C4 алкіл, -NH2, NH(C1-C3 алкіл), -N(C1-C3 алкіл)2, -NH(C(O)C1-C3 алкіл), -N(C(O)C1-C3 алкіл)2, -SH, -S(C1-C3 алкіл), -S(O)C1-C3 алкіл, -S(O)2C1-C3 алкіл; та кожен R незалежно являє собою -H, -C(O)-C1-C3 алкіл, або нерозгалужений або розгалужений C1-C4 алкіл, необов’язково заміщений OR, NR2 або галогеном; за умови, що якщо кожен із m, n, o, p та q дорівнює 0, кожен із W 1 та W 2 являє собою нуль, та Z являє собою то t повинно дорівнювати 0; та якщо кожен із m, n, o, p та q дорівнює 0, та кожен із W 1 та W 2 являє собою нуль, то Z не повинен являти собою [0009] У Формулі I, будь-який один або більше із H може бути заміщений дейтерієм. Також слід розуміти, що у Формулі I метиловий замісник може бути замінений C 1-C6 алкілом. 3 UA 110329 C2 5 10 15 20 25 30 35 40 45 50 55 [0010] Також описані фармацевтичні композиції, що містять як мінімум одне ніацинове похідне жирної кислоти. [0011] Також описані способи лікування захворювання, що піддається лікуванню ніациновим похідним жирної кислоти, у пацієнта, який потребує такого лікування, шляхом введення пацієнту ефективної кількості ніацинового похідного жирної кислоти. [0012] Також в даному описі описані способи лікування метаболічних захворювань шляхом введення пацієнту, який потребує такого лікування, ефективної кількості ніацинового похідного жирної кислоти. [0013] Винахід також включає фармацевтичні композиції, що містять ефективну кількість ніацинового похідного жирної кислоти і фармацевтично прийнятний носій. Композиції придатні для лікування або профілактики метаболічного захворювання. Винахід включає ніацинове похідне жирної кислоти у формі фармацевтично прийнятних проліків, гідрату, солі, енантіомеру, стереоізомеру або їх суміші. [0014] Детальний опис винаходу наведений нижче. Хоча способи і матеріали, подібні або еквівалентні описаним в даному описі, можуть використовуватися в практиці або тестуванні даного винаходу, в даному описі описані ілюстративні способи і матеріали. Інші ознаки, об'єкти і переваги винаходу будуть очевидними з опису та формули винаходу. В описі та доданій формулі винаходу, форма однини також включає множину, якщо контекст не вказує чітко на протилежне. Якщо не вказано інше, всі технічні і наукові терміни, використані в даному описі, мають таке ж значення, якого їм звичайно надає середній фахівець в галузі техніки, до якої належить даний винахід. Всі патенти і публікації, процитовані в даному описі, включені до даного опису шляхом посилання в повному обсязі. КОРОТКИЙ ОПИС ФІГУР На Фіг. 1 зображений вплив сполуки 1–7 на секрецію ApoB в клітинах HepG2. На Фіг. 2 зображений вплив ніацинових похідних жирних кислот на цільові гени SREBP-lc. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ [0015] Метаболічні захворювання - це широкий спектр медичних розладів, які перешкоджають метаболізму в організмі суб’єкта. Метаболізм - це спосіб, яким організм суб’єкта перетворює їжу на енергію. Метаболізм в організмі суб’єкта з метаболічним захворюванням певним чином порушений. Ніацинові похідні жирних кислот володіють здатністю лікувати або попереджати метаболічні захворювання. [0016] Ніацинові похідні жирних кислот розроблені таким чином, щоб вводити разом аналоги ніацину та омега-3 жирні кислоти в єдиному молекулярному кон'югаті. Активність ніацинових похідних жирних кислот значно вища, ніж сумарна активність індивідуальних компонентів молекулярних кон'югатів, вказуючи на те, що активність, індукована ніациновими похідними жирних кислот, є синергічном. ВИЗНАЧЕННЯ [0017] Наступні визначення використовуються у зв'язку з ніациновими похідними жирних кислот: [0018] Термін "ніацинові похідні жирних кислот" включає будь-які і всі можливі ізомери, стереоізомери, енантіомери, діастереомери, таутомери, фармацевтично прийнятні солі, гідрати, сольвати і проліки ніацинових похідних жирних кислот, описаних в даному описі. [0019] Невизначені артиклі використовуються в даному описі для позначення одного або більше граматичних об'єктів (тобто, як мінімум одного). Наприклад, "елемент" позначає один елемент або більше, ніж один елемент. [0020] Термін "і/або (та/або)" використовується в даному описі для позначення будь-якого "і (та)" або, "або" якщо не вказано інше. [0021] Якщо конкретно не визначено інше, термін "арил" позначає циклічні, ароматичні вуглеводневі групи, що включають 1–2 ароматичних кільця, в тому числі моноциклічні або біциклічні групи, такі як феніл, біфеніл або нафтил. У випадках двох ароматичних кілець (біциклічні, і т.п.), ароматичні кільця арильної групи можуть бути з’єднані в одинарній точці (наприклад, біфеніл), або можуть бути конденсованими (наприклад, нафтил). Арильна група необов’язково може бути заміщена одним або більше замісниками, наприклад, може містити 1– 5 замісників, приєднаних у будь-якому положенні. Замісники самі по собі можуть бути необов’язково заміщеними. [0022] "C1-C3 алкіл" позначає нерозгалужений або розгалужений насичений вуглеводневий ланцюг, що містить 1–3 атоми вуглецю. Приклади групи C1-C3 алкіл включають, не обмежуючись ними, метил, етил, пропіл та ізопропіл. 4 UA 110329 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0023] "C1-C4 алкіл" позначає нерозгалужений або розгалужений насичений вуглеводневий ланцюг, що містить 1–4 атоми вуглецю. Приклади групи C1-C4 алкіл включають, не обмежуючись ними, метил, етил, пропіл, бутил, ізопропіл, ізобутил, втор-бутил- і трет-бутил. [0024] "C1-C5 алкіл" позначає нерозгалужений або розгалужений насичений вуглеводневий ланцюг, що містить 1–5 атомів вуглецю. Приклади групи C1-C5 алкіл включають, не обмежуючись ними, метил, етил, пропіл, бутил, пентил, ізопропіл, ізобутил, втор-бутил-і третбутил, ізопентил і неопентил. [0025] "C1-C6 алкіл" позначає нерозгалужений або розгалужений насичений вуглеводневий ланцюг, що містить 1–6 атомів вуглецю. Приклади групи C1-C6 алкіл включають, не обмежуючись ними, метил, етил, пропіл, бутил, пентил, гексил, ізопропіл, ізобутил, втор-бутил, трет-бутил, ізопентил, і неопентил. [0026] Термін "циклоалкіл" позначає циклічний вуглеводень, що містить 3–6 атомів вуглецю. Приклади циклоалкільних груп включають, не обмежуючись ними, циклопропіл, циклобутил, циклопентил і циклогексил. Слід розуміти, що будь-який з придатних для заміщення атомів водню в циклоалкілі може бути заміщений з групами галоген, C 1-C3 алкіл, гідроксил, алкокси та ціано. [0027] Термін "гетероцикл" в даному описі позначає циклічний вуглеводень, що містить 3–6 атомів вуглецю, де як мінімум один з атомів являє собою O, N або S. Приклади гетероциклів включають, не обмежуючись ними, азиридин, оксиран, тіїран, азетидин, оксетан, тіетан, піролідин, тетрагідрофуран, тетрагідротіофен, піперидин, тетрагідропіран, тіан, імідазолідин, оксазолідин, тіазолідин, діоксолан, дитіолан, піперазин, оксазин, дитіан та діоксан. [0028] Термін "будь-який з бічних ланцюгів природних амінокислот" в даному описі позначає бічний ланцюг будь-якої з наступних амінокислот: ізолейцин, аланін, лейцин, аспарагін, лізин, аспартат, метіонін, цистеїн, фенілаланін, глютамат, треонін, глютамін, триптофан, гліцин, валін, пролін, аргінін, серин, гістидин і тирозин. [0029] Термін "жирна кислота" в даному описі позначає омега-3 жирну кислоту і жирні кислоти, які in vivo метаболізуються до омега-3 жирних кислот. Необмежуючі приклади - це всіцис-7,10,13-гексадекатриєнова кислота, -ліноленова кислота (АЛК або всі-цис-9,12,15октадекатриєнова кислота), стеаридонова кислота (СТД або всі-цис-6,9,12,15октадекатетраєнова кислота), ейкозатриєнова кислота (ЕТЄК або всі-цис-11,14,17ейкозатриєнова кислота), ейкозатетраєнова кислота (ЕТК або всі-цис-8,11,14,17ейкозатетраєнова кислота), ейкозапентаєнова кислота (ЕПК або всі-цис-5,8,11,14,17ейкозапентаєнова кислота), докозапентаєнова кислота (ДПК, клупанодонова кислота або всіцис-7,10,13,16,19-докозапентаєнова кислота), докозагексаєнова кислота (ДГК або всі-цис4,7,10,13,16,19-докозагексаєнова кислота), тетракозапентаєнова кислота (всі-цис-9,12,15,18,21докозагексаєнова кислота) або тетракозагексаєнова кислота (нізинова [nisinic] кислота або всіцис-6,9,12,15,18,21-тетракозеноєва кислота). [0030] Термін "ніацин" в даному описі позначає молекулу, відому як ніацин, а також будь-яке її похідне. [0031] "Суб’єкт" - це ссавець, наприклад, людина, миша, щур, морська свинка, собака, кіт, кінь, корова, свиня, або негуманоїдний примат, такий як мавпа, шимпанзе, бабуїн або макака резус, і терміни "суб’єкт" і "хворий (пацієнт)" використовуються в даному описі рівнозначним чином. [0032] Винахід також включає фармацевтичні композиції, що містять ефективну кількість ніацинового похідного жирної кислоти і фармацевтично прийнятний носій. Винахід включає ніацинове похідне жирної кислоти у формі фармацевтично прийнятних проліків, гідрату, солі, наприклад, фармацевтично прийнятної солі, енантіомерів, стереоізомерів або суміші вказаних компонентів. [0033] Характерні "фармацевтично прийнятні солі" включають, наприклад, розчинні і нерозчинні у воді солі, такі як ацетат, амзонат (4,4-диаміностільбен-2,2-дисульфонат), бензолсульфонат, бензоат, бікарбонат, бісульфат, бітартрат, борат, бромід, бутират, кальцій, кальцію едетат, камзилат, карбонат, хлорид, цитрат, клавуланат, дигідрохлорид, едетат, едизилат, естолат, езилат, фумарат, глюцептат, глюконат, глутамат, гліколіларсанілат, гексафторфосфат, гексилрезорцинат, гідрабамін, гідробромід, гідрохлорид, гідроксинафтоат, йодид, ізетіонат, лактат, лактобіонат, лаурат, магній, малат, малеат, манделат, мезилат, метилбромід, метилнітрат, метилсульфат, муцат, напзилат, нітрат, N-метилглюкаміну амонієву сіль, 3-гідрокси-2-нафтоат, олеат, оксалат, пальмітат, памоат (1,1-метен-біс-2-гідрокси-3нафтоат, ейнбонат), пантотенат, фосфат/дифосфат, пікрат, полігалактуронат, пропіонат, птолуолсульфонат, саліцилат, стеарат, субацетат, сукцинат, сульфат, субсаліцилат, сурамат, танат, тартрат, теоклат, тозилат, триeтійодид і валерат. 5 UA 110329 C2 5 10 15 20 25 30 35 40 45 50 55 [0034] Термін "метаболічне захворювання" в даному описі позначає розлади, захворювання і синдроми, що включають дисліпідемію; при цьому вирази «метаболічний розлад», «метаболічне захворювання» і «метаболічний синдром» використовується в даному описі рівнозначним чином. [0035] "Ефективна кількість" у зв'язку з ніациновим похідним жирної кислоти позначає кількість, ефективну для лікування або профілактики метаболічного захворювання. [0036] Термін "носій" в даному описі охоплює носії, допоміжні речовини і розбавлювачі та позначає матеріал, композицію або носій, наприклад, рідкий або твердий наповнювач, розбавлювач, допоміжна речовина, розчинник або інкапсулювальний матеріал, залучений до переносу або транспортування фармацевтичного агента від одного органу або частини тіла до іншого органу або частини тіла. [0037] Термін "лікування" в зв’язку із суб’єктом означає покращення як мінімум одного симптому розладу у суб’єкта. Лікування може виліковувати, покращувати або як мінімум частково покращувати стан хворого при розладі. [0038] Термін "розлад", якщо не вказано інше, використовується в даному описі для позначення захворювання, патологічного стану або хвороби, і використовується рівнозначним чином з останніми. [0039] Терміни "вводити" або "введення" в даному описі позначають або безпосереднє введення сполуки або фармацевтично прийнятної солі сполуки або композиції суб’єкту, або введення похідного у формі проліків або аналога сполуки або фармацевтично прийнятної солі сполуки або композиції суб’єкту, які можуть утворювати еквівалентну кількість активної сполуки в організмі суб’єкта. [0040] Термін "проліки" в даному описі позначає сполуку, що перетворюється in vivo метаболічними засобами (наприклад, гідролізом) на ніацинове похідне жирної кислоти. [0041] Наступні скорочення використовуються в даному описі і мають наступні визначення: Boc і BOC - трет-бутоксикарбоніл, Boc2O - ди-трет-бутил-дикарбонат, АТС - альбумін телячої сироватки, КДІ - 1,1’-карбонілдіімідазол, ДЦК - N,N-дициклогексилкарбодіімід, ДІЕА - N,Nдіізопропілетиламін, ДМАП - 4-диметиламінопіридин, МДСІ - модифіковане Дульбекко середовище Ігла, ДМФ - N,N-диметилформамід, ДОСН - діоктилсульфосукцинат натрій, ЕДК та ЕДКІ - 1-етил-3-(3-диметиламінопропіл)карбодііміду гідрохлорид, ELISA - імуносорбентний аналіз з використанням ферментів, EtOAc - етилацетат, СТЕ - сироватка телячого ембріону, год - година, ГАТУ - 2-(7-аза-1H-бензотриазол-1-іл)-1,1,3,3-тетраметилуронію гексафторфосфат, ВІЛ - вірус імунодефіциту людини, ГПМЦ - гідроксипропілметилцелюлоза, оксон - калію пероксимоносульфат, Pd/C - паладій на вугіллі, ТФО - трифтороцтова кислота, ТПГС токоферол пропіленглікольсукцинат, і ТГФ - тетрагідрофуран. СПОЛУКИ [0042] Відповідно, в одному з аспектів даного винаходу пропонується молекулярний кон’югат, який включає ніацин і ковалентно зв'язану з ним жирну кислоту, де жирна кислота вибрана з групи, що складається з омега-3 жирних кислот і жирних кислот, які метаболізуються in vivo до омега-3 жирних кислот, де кон’югат включає як мінімум один амід, і кон’югат здатний гідролізуватися з утворенням вільного ніацину та вільної жирної кислоти. [0043] У деяких варіантах, жирна кислота вибрана з групи, що складається з всі-цис-7,10,13гексадекатриєнової кислоти, α-ліноленової кислоти, стеаридонової кислоти, ейкозатриєнової кислоти, ейкозатетраєнової кислоти, ейкозапентаєнової кислоти (ЕПК), докозапентаєнової кислоти, докозагексаєнової кислоти (ДГК), тетракозапентаєнової кислоти і тетракозапентаєнової кислоти. В інших варіантах, жирна кислота вибрана з ейкозапентаєнової кислоти і докозагексаєнової кислоти. У деяких варіантах, гідроліз є ферментним. [0044] В іншому аспекті даного винаходу пропонуються ніацинові похідні жирних кислот у відповідності до Формули I: Формула I та їх фармацевтично прийнятні солі, гідрати, сольвати, проліки, єнантіомери та стереоізомери; де R1, R2, R3, R4, R5, R6, R7, R, W 1, W 2, L, a, c, b, d, e, g, h, m, n, o, p, q, Z, r, s, t та v є такими, як визначено вище для` Формули I, за умови, що в сполуці присутній щонайменше один 6 UA 110329 C2 5 10 15 або . [0045] В деяких варіантах R3 являє собою Cl, F або CN. [0046] В деяких варіантах R3 являє собою -CH3 або -CH2CH3. [0047] В деяких варіантах W 1 являє собою NH. [0048] В деяких варіантах W 2 являє собою NH. [0049] В деяких варіантах W 1 являє собою O. [0050] В деяких варіантах W 2 являє собою O. [0051] В деяких варіантах кожен із a та c незалежно являє собою H або CH 3. [0052] В деяких варіантах m дорівнює 0. [0053] В інших варіантах m дорівнює 1. [0054] В деяких варіантах L являє собою -S, або -S-S-. [0055] В деяких варіантах L являє собою -O-, [0056] В деяких варіантах L являє собою [0057] В деяких варіантах L являє собою [0058] В деяких варіантах L являє собою 20 [0059] В деяких варіантах L являє собою або [0060] В деяких варіантах L являє собою або [0061] В деяких варіантах L являє собою 25 або [0062] В деяких варіантах один із b являє собою O-Z, Z являє собою 7 UA 110329 C2 5 10 і t дорівнює 1. [0063] В деяких варіантах один із d являє собою C(O)OR. [0064] В деяких варіантах кожен із n, o, p та q дорівнює 1. [0065] В деяких варіантах два із n, o, p та q дорівнюють 1. [0066] В інших варіантах три із n, o, p та q дорівнюють 1. [0067] В деяких варіантах один із Z являє собою та r дорівнює 2. [0068] В деяких варіантах один із Z являє собою та r дорівнює 3. [0069] В деяких варіантах один із Z являє собою 15 та r дорівнює 7. [0070] В інших варіантах один із Z являє собою та s дорівнює 3. [0071] В деяких варіантах один із Z являє собою 20 25 та s дорівнює 5. [0072] В деяких варіантах один із Z являє собою та s дорівнює 6. [0073] В деяких варіантах один із Z являє собою 8 UA 110329 C2 та v дорівнює 1. [0074] В інших варіантах один із Z являє собою 5 та v дорівнює 2. [0075] В деяких варіантах один із Z являє собою та v дорівнює 6. [0076] В деяких варіантах один із Z являє собою 10 15 20 та s дорівнює 3. [0077] В деяких варіантах один із Z являє собою та s дорівнює 5. [0078] В інших варіантах один із Z являє собою та s дорівнює 6. [0079] В деяких варіантах t дорівнює 1. [0080] В деяких варіантах r дорівнює 2, s дорівнює 6, кожен із W 1 та W 2 являє собою NH, m дорівнює 1, кожен із n, o, p та q дорівнює 1, та L являє собою O. [0081] В деяких варіантах r дорівнює 2, s дорівнює 6, кожен із W 1 та W 2 являє собою NH, m дорівнює 1, кожен із n, o, p та q дорівнює 1, та L являє собою -S-S-. [0082] В деяких варіантах r дорівнює 2, s дорівнює 6, кожен із W 1 та W 2 являє собою NH, m дорівнює 1, кожен із n та o дорівнює 0, кожен із p та q дорівнює 1, та L являє собою 9 UA 110329 C2 [0083] В деяких варіантах r дорівнює 2, s дорівнює 6, кожен із W 1 та W 2 являє собою NH, m дорівнює 1, кожен із n, o, p та q дорівнює 0, та L являє собою 5 [0084] В деяких варіантах r дорівнює 2, s дорівнює 6, кожен із W 1 та W 2 являє собою NH, кожен із m, n та o дорівнює 0, та кожен із p та q дорівнює 1. [0085] В деяких варіантах r дорівнює 2, s дорівнює 6, кожен із W 1 та W 2 являє собою NH, m дорівнює 1, кожен із n та o дорівнює 0, кожен із p та q дорівнює 1, та L являє собою 10 [0086] В деяких варіантах r дорівнює 2, s дорівнює 6, кожен із W1 та W 2 являє собою NH, m дорівнює 1, кожен із n та o дорівнює 1, кожен із p та q дорівнює 0, та L являє собою [0087] В деяких варіантах r дорівнює 2, s дорівнює 6, m дорівнює 1, кожен із n та o дорівнює 0, кожен із p та q дорівнює 1, та L являє собою 15 20 25 30 [0088] В деяких варіантах r дорівнює 2, s дорівнює 6, m дорівнює 1, кожен із n та o дорівнює 1, кожен із p та q дорівнює 0, та L являє собою [0089] В деяких варіантах r дорівнює 2, s дорівнює 6, кожен із W 1 та W 2 являє собою NH, m дорівнює 1, кожен із n, o, p та q дорівнює 1, та L являє собою [0090] В деяких варіантах r дорівнює 2, s дорівнює 6, кожен із W 1 та W 2 являє собою NH, m дорівнює 1, кожен із n, o, p та q дорівнює 1, та L являє собою NR6. [0091] В деяких варіантах r дорівнює 2, s дорівнює 6, кожен із W 1 та W 2 являє собою NH, кожен із m, n та o дорівнює 0, кожен із p та q дорівнює 1, та один із c являє собою -CH3, та інший c являє собою -CH3. [0092] В деяких варіантах r дорівнює 2, s дорівнює 6, кожен із W 1 та W 2 являє собою NH, m дорівнює 1, кожен із n та o дорівнює 1, кожен із p та q дорівнює 0, та L являє собою . [0093] В деяких варіантах r дорівнює 3, s дорівнює 5, та L являє собою –S-S-. [0094] В деяких варіантах r дорівнює 3, s дорівнює 5, та L являє собою –O-. [0095] В деяких варіантах r дорівнює 3, s дорівнює 5, та L являє собою 10 UA 110329 C2 [0096] В деяких варіантах r дорівнює 3, s дорівнює 5, та L являє собою [0097] В деяких варіантах r дорівнює 3, s дорівнює 5, та L являє собою 5 10 15 або [0098] В деяких варіантах r дорівнює 3, s дорівнює 5, та L являє собою або [0099] В деяких варіантах r дорівнює 3, s дорівнює 5, і кожен із n, o, p та q дорівнює 1. [0100] В деяких варіантах r дорівнює 3, s дорівнює 5, і два із n, o, p та q дорівнюють 1. [0101] В деяких варіантах r дорівнює 3, s дорівнює 5, і кожен з W 1 та W 2 являє собою NH. [0102] В деяких варіантах r дорівнює 3, s дорівнює 5, m дорівнює 1, кожен із n, o, p та q дорівнює 1, та L являє собою O. [0103] В деяких варіантах r дорівнює 3, s дорівнює 5, m дорівнює 1, кожен із n, o, p та q дорівнює 1, та L являє собою - S-S-. [0104] В деяких варіантах r дорівнює 3, s дорівнює 5, m дорівнює 1, кожен із n та o дорівнює 0, кожен із p та q дорівнює 1, та L являє собою [0105] В деяких варіантах r дорівнює 3, s дорівнює 5, m дорівнює 1, кожен із n, o, p та q дорівнює 0, та L являє собою 20 25 [0106] В деяких варіантах r дорівнює 3, s дорівнює 5, кожен із m, n та o дорівнює 0, і кожен із p та q дорівнює 1. [0107] В деяких варіантах r дорівнює 3, s дорівнює 5, m дорівнює 1, кожен із n та o дорівнює 1, кожен із p та q дорівнює 0, та L являє собою [0108] В деяких варіантах r дорівнює 3, s дорівнює 5, m дорівнює 1, кожен із n та o дорівнює 0, кожен із p та q дорівнює 1, та L являє собою 11 UA 110329 C2 [0109] В деяких варіантах r дорівнює 3, s дорівнює 5, m дорівнює 1, кожен із n та o дорівнює 0, кожен із p та q дорівнює 1, та L являє собою 5 10 15 20 25 30 35 40 45 50 [0110] В деяких варіантах r дорівнює 3, s дорівнює 5, m дорівнює 1, кожен із n та o дорівнює 1, кожен із p та q дорівнює 0, та L являє собою [0111] В деяких варіантах r дорівнює 3, s дорівнює 5, m дорівнює 1, кожен із n, o, p та q дорівнює 1, та L являє собою NR6. [0112] В деяких варіантах r дорівнює 3, s дорівнює 5, кожен із m, n та o дорівнює 0, кожен із p та q дорівнює 1, один із c являє собою -CH3, та інший c являє собою -CH3. [0113] В деяких варіантах r дорівнює 3, s дорівнює 5, m дорівнює 1, кожен із n та o дорівнює 1, кожен із p та q дорівнює 0, та L являє собою [0114] У Формулі I, будь-який один або більше із H можуть бути замінені на дейтерій. Також слід розуміти, що у Формулі I метиловий замісник може бути замінений на C 1-C6 алкіл. [0115] В інших альтернативних варіантах, сполуки Формули I є такими, як визначено нижче: [0116] N-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетокси)етил)нікотинамід (I-1); [0117] N-(2-((2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)(метил)аміно)етил)нікотинамід (I-2); [0118] N-(2-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)дисульфаніл)етил)нікотинамід (I-3); [0119] N-(2-(1-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетил)-2,5діоксопіролідин-3-ілтіо)етил)нікотинамід (I-4); [0120] метил-3-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоацетокси)-2(нікотинамідо)бутаноат (I-5); [0121] 1,3-дигідроксипропан-2-іл-6-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо-2-(нікотинамідо)гексаноат (I-6); [0122] N-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетил)нікотинамід (I7); [0123] N-(2-(5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнамідоетил)нікотинамід (I-8); [0124] (2S,3R)-метил-3-((S)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо)пропаноїлокси)-2-(нікотинамідо)бутаноат (I-9); [0125] (2S,3R)-метил-3-((S)-2-((5Z,8Z,11Z,14Z,17Z)-ікоза-5,8,11,14,17пентаєнамідо)пропаноїлокси)-2-(нікотинамідо)бутаноат (I-10); [0126] (S)-метил-6-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-2(нікотинамідо)гексаноат (I-11); [0127] (S)-6-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-2(нікотинамідо)гексанова кислота (I-12); [0128] (S)-метил-2-((5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнамідо)-6(нікотинамідо)гексаноат (I-13); [0129] (S)-2-((5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнамідо)-6(нікотинамідо)гексанова кислота (I-14); [0130] (S)-метил-6-((5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнамідо)-2(нікотинамідо)гексаноат (I-15); [0131] (S)-6-((5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнамідо)-2(нікотинамідо)гексанова кислота (I-16); [0132] (S)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-6(нікотинамідо)гексанова кислота (I-17); [0133] (S)-5-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-2(нікотинамідо)пентанова кислота (I-18); [0134] (S)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-5(нікотинамідо)пентанова кислота (I-19); 12 UA 110329 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0135] 4-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-2(нікотинамідо)бутанова кислота (I-20); [0136] 2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-4(нікотинамідо)бутанова кислота (I-21); [0137] 3-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-2(нікотинамідо)пропанова кислота (I-22); [0138] 2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-3(нікотинамідо)пропанова кислота (I-23); [0139] 2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетил)-4(нікотинамідо)бутанова кислота (I-24); [0140] (S)- 1,3-дигідроксипропан-2-іл 2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза- 4,7,10,13,16,19гексаєнамідо)-6-(нікотинамідо)гексаноат (I-25); [0141] (S)-1,3-дигідроксипропан-2-іл-5-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза4,7,10,13,16,19гексаєнамідо)-2-(нікотинамідо)пентаноат (I-26); [0142] (S)- 1,3-дигідроксипропан-2-іл-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза- 4,7,10,13,16,19гексаєнамідо)-5-(нікотинамідо)пентаноат (I-27); [0143] 1,3-дигідроксипропан-2-іл-4-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо-2-(нікотинамідо)бутаноат (I-28); [0144] 1,3-дигідроксипропан-2-іл-2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо-4-(нікотинамідо)бутаноат (I-29); [0145] 1,3-дигідроксипропан-2-іл-3-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо-2-(нікотинамідо)пропаноат (I-30); [0146] 1,3-дигідроксипропан-2-іл-2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо-3-(нікотинамідо)пропаноат (I-31); [0147] 1,3-дигідроксипропан-2-іл-2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)-4-(нікотинамідо)бутаноат (I-32); [0148] N-(4-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідобутил)нікотинамід (I33) ; [0149] N-(3-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідопропіл)нікотинамід (I-34) ; [0150] N-(1-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-2-метилпропан-2іл)нікотинамід (I-35); [0151] N-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-2метилпропіл)нікотинамід (I-36); [0152] N-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетиламіно)етил)нікотинамід (I-37); [0153] N-(3-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетиламіно)пропіл)нікотинамід (I-38); [0154] N-(2-(3-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідопропіламіно)етил)нікотинамід (I-39); [0155] N-(2-((3-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідопропіл)(етил)аміно)етил)нікотинамід (I-40) ; [0156] N-(2-((2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)(ізобутил)аміно)етил)нікотинамід (I-41); [0157] N-(2-(N-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)ацетамідо)етил)нікотинамід (I-42); [0158] N-(2-((2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетил)(2морфолінoетил)аміно)етил)нікотинамід (I-43); [0159] N-(2-((2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетил)(3(піперазин-1-іл)пропіл)аміно)етил)нікотинамід (I-44); [0160] N-(3-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-2оксопропіл)нікотинамід (I-45); [0161] N-(3-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-2морфолінoпропіл)нікотинамід (I-46); [0162] N-(3-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-2-(піперазин-1іл)пропіл)нікотинамід (I-47); [0163] N-(3-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-2-(4метилпіперазин-1-іл)пропіл)нікотинамід (I-48); [0164] N-(5-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-3гідроксипентил)нікотинамід (I-49); 13 UA 110329 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0165] N-(5-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-3морфолінoпентил)нікотинамід (I-50) ; [0166] N-(5-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо-3-(піперазин-1іл)пентил)нікотинамід (I-51); [0167] (S)-((R)-1-(нікотинамідо)пропан-2-іл)-2-((5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14, 17пентаєнамідо)пропаноат (I-52); [0168] (S)-((R)-1-(нікотинамідо)пропан-2-іл)-2-((5Z,8Z,11Z,14Z,17Z)-ейкоза- 5,8,11,14, 17пентаєнамідо)-3-метилбутаноат (I-53); [0169] N-(2-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетокси)етокси)етил)нікотинамід (I-54); [0170] N-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетилтіо)етил)нікотинамід (I-55); [0171] (4Z,7Z,10Z,13Z,16Z,19Z)-1-(нікотинамідо)пропан-2-іл-докоза-4,7,10,13,16,19гексаєноат (I-56); [0172] (4Z,7Z,10Z,13Z,16Z,19Z)-4-метокси-3-(нікотинамідо)-4-оксобутан-2-іл докоза4,7,10,13,16,19-гексаєноат (I-57); [0173] N-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетил)-6метилнікотинамід (I-58); [0174] N-(2-(5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнамідоетил)-6-метилнікотинамід (I-59); [0175] N-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетил)-6етилнікотинамід (I-60); [0176] 6-етил-N-(2-(5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнамідоетил)нікотинамід (I61); [0177] 6-хлор-N-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)нікотинамід (I-62); [0178] 6-хлор-N-(2-(5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнамідоетил)нікотинамід (I63); [0179] N-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетил)-6фторнікотинамід (I-64); [0180] 6-фтор-N-(2-(5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнамідоетил)нікотинамід (I65); [0181] 6-ціано-N-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)нікотинамід (I-66); [0182] 6-ціано-N-(2-(5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнамідоетил)нікотинамід (I67); [0183] (S)-6-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-2-(2метилнікотинамідо)гексанова кислота (I-68); [0184] (S)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-6-(2метилнікотинамідо)гексанова кислота (I-69); [0185] (S)-6-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-2-(2етилнікотинамідо)гексанова кислота (I-70); [0186] (S)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-6-(2етилнікотинамідо)гексанова кислота (I-71); [0187] (S)-2-(2-хлорнікотинамідо)-6-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо)гексанова кислота (I-72); [0188] (S)-6-(2-хлорнікотинамідо)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо)гексанова кислота (I-73); [0189] (S)-6-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-2-(2фторнікотинамідо)гексанова кислота (I-74); [0190] (S)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-6-(2фторнікотинамідо)гексанова кислота (I-75); [0191] (S)-2-(2-ціанонікотинамідо)-6-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо)гексанова кислота (I-76); [0192] (S)-6-(2-ціанонікотинамідо)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза4,7,10,13,16,19гексаєнамідо)гексанова кислота (I-77); [0193] N-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетокси)етил)-6метилнікотинамід (I-78) ; [0194] N-(2-((2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)(метил)аміно)етил)-6-метилнікотинамід (I-79); 14 UA 110329 C2 5 10 15 20 25 30 35 40 45 50 55 [0195] N-(2-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)дисульфаніл)етил)-6-метилнікотинамід (I-80); [0196] N-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетокси)етил)-6етилнікотинамід (I-81); [0197] N-(2-((2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)(метил)аміно)етил)-6-етилнікотинамід (I-82); [0198] N-(2-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)дисульфаніл)етил)-6-етилнікотинамід (I-83); [0199] 6-хлор-N-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетокси)етил)нікотинамід (I-84); [0200] 6-хлор-N-(2-((2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)(метил)аміно)етил)нікотинамід (I-85); [0201] 6-хлор-N-(2-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)дисульфаніл)етил)нікотинамід (I-86); [0202] 6-ціано-N-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетокси)етил)нікотинамід (I-87); [0203] 6-ціано-N-(2-((2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)(метил)аміно)етил)нікотинамід (I-88); [0204] 6-ціано-N-(2-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)дисульфаніл)етил)нікотинамід (I-89). Способи із застосуванням ніацинових похідних жирних кислот [0205] Винахід також включає способи лікування метаболічних захворювань, наприклад, лікування або профілактику атеросклерозу, в тому числі метаболічних захворювань, дисліпідемії, захворювання коронарних судин серця, гіперхолестеринемії, діабету 2 типу, підвищеного рівня холестерину, метаболічного синдрому і серцево-судинного захворювання. [0206] В одному з варіантів, спосіб включає забезпечення контакту клітини з ніациновим похідним жирної кислоти в кількості, достатній для зменшення вивільнення тригліцеридів або ЛПДНЩ або ЛПНЩ або збільшення зворотного транспорту холестерину, або збільшення рівня ЛПВЩ. [0207] Також у винаході запропонований спосіб інгібування, профілактики або лікування метаболічного захворювання або симптомів метаболічного захворювання у суб’єкта. Приклади таких розладів включають, не обмежуючись ними, атеросклероз, дисліпідемію, гіпертригліцеридемію, підвищений артеріальний тиск, серцеву недостатність, серцеві аритмії, низькі рівні ЛПВЩ, високі рівні ЛПНЩ, раптову смерть, стабільну стенокардію, захворювання коронарних судин серця, гострий інфаркт міокарду, вторинну профілактику інфаркту міокарду, кардіоміопатію, ендокардит, діабет 2 типу, інсулінорезистентність, знижену переносимість глюкози, гиперхолестеринемію, інсульт, гіперліпідемію, гіперліпопротехнемію, хронічне захворювання нирок, переміжну хромоту, гіперфосфатемію, атеросклероз сонної артерії, захворювання периферичних артерій, діабетичну нефропатію, гіперхолестеринемію у ВІЛінфікованих, гострий коронарний синдром (ГКС), неалкогольне жирове захворювання печінки, оклюзійне захворювання артерій, мозковий артеріосклероз, серцево-судинні розлади, ішемію міокарду та автономну діабетичну невропатію. [0208] У деяких варіантах, суб’єкту вводять ефективну кількість ніацинового похідного жирної кислоти. [0209] Винахід також включає фармацевтичні композиції, придатні для лікування або профілактики метаболічного захворювання, або для пригнічення метаболічного захворювання, або для більш ніж одного з вказаного. Композиції можуть бути придатними для прийому всередину і містити ефективну кількість ніацинового похідного жирної кислоти та фармацевтично прийнятний носій. Ніацинові похідні жирних кислот є особливо придатними, оскільки вони демонструють найнижчу периферичну токсичність або навіть відсутність периферичної токсичності. [0210] Кожне з ніацинових похідних жирних кислот можна вводити в кількостях, достатніх для лікування або попередження метаболічного захворювання або попередження розвитку вказаних станів у суб’єктів. [0211] Введення ніацинових похідних жирних кислот може бути здійснене будь-яким способом введення терапевтичних агентів. Вказані способи включають системне введення або місцеве застосування, наприклад, пероральний, назальний, парентеральний, трансдермальний, підшкірний, вагінальний, букальний, ректальний способи введення або місцеве застосування. 15 UA 110329 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0212] В залежності від передбаченого способу введення, композиції можуть бути виготовлені в твердій, напівтвердій або рідкій лікарській формі, наприклад, ін’єкційні препарати, таблетки, супозиторії, пігулки, капсули з уповільненим вивільненням, еліксири, настоянки, емульсії, сиропи, порошки, рідини, суспензії, тощо, іноді у вигляді дозованих лікарських форм, у відповідності до традиційних фармацевтичних способів. Також, вони можуть бути введені у формі для внутрішньовенного (як болюс так і інфузія), внутрішньочеревинного, підшкірного або внутрішньом’язового введення; всі використовувані форми добре відомих фахівцям в галузі фармації. [0213] Ілюстративні фармацевтичні композиції - це таблетки і желатинові капсули, що містять ніацинове похідне жирної кислоти і фармацевтично прийнятний носій, такий як: а) розбавлювач, наприклад, вода очищена, тригліцеридні масла, в тому числі гідрогенізована або частково гідрогенізована олія, або їх суміші, кукурудзяна олія, оливкова олія, соняшникова олія, сафлорова олія, риб’ячий жир, в тому числі ЕПК або ДГК, або їх естери або тригліцериди, або суміші вказаних компонентів, омега-3 жирні кислоти або їх похідні, лактоза, глюкоза, сахароза, маніт, сорбіт, целюлоза, натрію сахаринат, глюкоза та/або гліцин; б) змащувач, наприклад, кремнію діоксид, тальк, стеаринова кислота, її магнієва або кальцієва сіль, натрію олеат, натрію стеарат, магнію стеарат, натрію бензоат, натрію ацетат, натрію хлорид та/або поліетиленгліколь; зокрема, для таблеток; в) зв'язувальний засіб, наприклад, алюмінію магнію силікат, крохмальний клейстер, желатин, трагакантова камедь, метилцелюлоза, натрій карбоксиметилцелюлоза, магнію карбонат, природні цукри, наприклад, глюкоза або беталактоза, кукурудзяні підсолоджувачі, природна і синтетична камедь, наприклад, акацієва, трагакантова камедь або натрію альгінат, віск та/або полівінілпіролідон, за бажанням; г) дезінтегрант, наприклад, різні види крохмалю, агар, метилцелюлоза, бентоніт, ксантанова камедь, альгінова кислота або її натрієва сіль, або шипучі суміші; д) абсорбент, барвник, ароматизатор і підсолоджувач; е) емульгатор або диспергувальний засіб, наприклад, Твін 80, Лабразол, ГПМЦ, ДОСН, капроїл 909, лабрафак, лабрафіл, пецеол, транскутол, капмул MCM, капмул PG-12, катекст 355, гелюцир, вітамін E ТГПС або інший прийнятний емульгатор; та/або ж) агент, який збільшує абсорбцію сполуки, наприклад, циклодекстрин, гідроксипропілциклодекстрин, PEG400, PEG200. [0214] Рідка композиція, зокрема, для ін'єкцій, може, наприклад, бути одержана розчиненням, диспергуванням, тощо. Наприклад, ніацинове похідне жирної кислоти розчиняють або змішують з фармацевтично прийнятним розчинником, таким як вода, розчин солі, водний розчин глюкози, гліцерин, етанол, тощо, з одержанням в такий спосіб ізотонічного ін'єкційного розчину або суспензії. Білки, такі як альбумін, хіломікронні частинки або білки сироватки, можуть бути використані для солюбілізації ніацинових похідних жирних кислот. [0215] Ніацинові похідні жирних кислот також можуть бути введені в супозиторій, який може бути одержаний на базі жирових емульсій або суспензій; з використанням як носія поліалкіленгліколю, такого як пропіленгліколь. [0216] Ніацинові похідні жирних кислот можуть також бути введені у формі ліпосомальних систем доставки, таких як маленькі одношарові міхурці, великі одношарові міхурці і багатошарові міхурці. Ліпосоми можуть бути утворені з різноманітних фосфоліпідів, що містять холестерин, стеариламін або фосфатидилхоліни. У деяких варіантах, плівку ліпідних компонентів гідратують водним розчином лікарського засобу з утворенням ліпідного шару, в якому інкапсульований лікарський засіб, як описано в патенті США 5262564, вміст якого включений до даного опису шляхом посилання в повному обсязі. [0217] Ніацинові похідні жирних кислот можуть також бути введені з використанням моноклональних антитіл як індивідуальних носіїв, до яких приєднані ніацинові похідні жирних кислот. Ніацинові похідні жирних кислот можуть також бути з’єднані з розчинними полімерами як придатними для націлювання носіями лікарських засобів. Такі полімери можуть включати полівінілпіролідон, співполімер пірану, полігідроксипропілметилакриламід-фенол, полігідроксиетиласпанамідфенол або поліетиленоксидполілізин, заміщений пальмітоїльними залишками. Крім того, ніацинові похідні жирних кислот можуть бути приєднані до класу біорозкладаних полімерів, придатних для забезпечення контрольованого вивільнення лікарського засобу, таких як полімолочна кислота, поліепсилон капролактон, полігідроксимасляна кислота, поліортоестери, поліацеталь, полідигідропірани, поліціаноакрилати і поперечно-зшиті або амфіпатичні блок-співполімери гідрогелів. В одному з варіантів, ніацинові похідні жирних кислот не з’єднані ковалентно з полімером, наприклад, полімером полікарбонової кислоти або поліакрилатом. [0218] Парентеральне ін'єкційне введення загалом використовують для підшкірної, внутрішньом’язової або внутрішньовенної ін'єкції та інфузії. Ін’єкційні препарати можуть бути 16 UA 110329 C2 5 10 15 20 25 30 35 40 одержані в традиційних формах, як рідкі розчини або суспензії, або як тверді форми, придатні для розчинення в рідині перед ін'єкцією. [0219] Композиції можуть бути одержані у відповідності до традиційних способів змішування, грануляції або нанесення покриття, відповідно, і такі фармацевтичні композиції можуть містити від приблизно 0,1% до приблизно 80%, від приблизно 5% до приблизно 60%, або від приблизно 1% до приблизно 20% ніацинового похідного жирної кислоти (мас. або об.). [0220] Схему лікування з використанням ніацинового похідного жирної кислоти вибирають відповідно до різноманітних факторів, в тому числі, тип, вид, вік, маса тіла, стать і медичний стан хворого; тяжкість стану, який підлягає лікуванню; спосіб введення; функція нирок або печінки у хворого; і конкретне ніацинове похідне жирної кислоти, яке застосовують. Середній лікар або ветеринар може легко визначити і призначити ефективну кількість лікарського засобу, необхідну для попередження, протидії або зупинки прогресування стану. [0221] Ефективні дози за даним винаходом, при застосування у відповідності до інструкції, варіюють від приблизно 20 мг до приблизно 5000 мг ніацинового похідного жирної кислоти на добу. Композиції для застосування in vivo або in vitro можуть містити приблизно 20, 50, 75, 100, 150, 250, 500, 750, 1000, 1250, 2500, 3500 або 5000 мг ніацинового похідного жирної кислоти. В одному з варіантів, композиції знаходяться собою у формі таблетки, на яку може бути нанесена риска. Ефективні рівні в плазмі ніацинового похідного жирної кислоти можуть варіювати від приблизно 0,002 мг до приблизно 100 мг на кг маси тіла на добу. Відповідні дози ніацинових похідних жирних кислот можуть бути визначені, як показано у Goodman, L. S.; Gilman, A. The Pharmacological Basis of Therapeutics, 5th ed.; MacMillan: New York, 1975, pp. 201-226. [0222] Ніацинові похідні жирних кислот можна вводити один раз на добу, або загальну добову дозу можна вводити за декілька прийомів, тобто 2, 3 або 4 рази на добу. Крім того, ніацинові похідні жирних кислот можна вводити в інтраназальній формі шляхом місцевого застосування придатного для інтраназального введення носія, або трансдермальним шляхом, з використанням трансдермальних пластирів, добре відомих середньому фахівцю в даній галузі. При введенні за допомогою форми для трансдермальної доставки, доза може вводитися безперервна замість переміжного введення в ході схеми лікування. Інший ілюстративні препарати для місцевого застосування включають креми, мазі, лосьйони, аерозоль для розпилення і гелі, де концентрація ніацинового похідного жирної кислоти варіює від приблизно 0,1% до приблизно 15%, мас/мас або мас/об. СПОСОБИ ОДЕРЖАННЯ Способи одержання ніацинових похідних жирних кислот [0223] Приклади шляхів синтезу, придатних для одержання ніацинових похідних жирних кислот Формули I, наведені в Прикладах нижче та узагальнені на Схемах 1–9. Схема 1 Де R6 r та s є такими, як визначено вище. [0224] Моно-BOC-захищений амін формули B може бути одержаний з комерційних джерел або виготовлений у відповідності до методик, описаних в Krapcho et al. Synthetic Communications 1990, 20, 2559-2564. Сполука A може бути амідована аміном B з використанням реагенту сполучення, такого як ДЦК, КДІ, ЕДК, або, необов’язково, основи та/або каталізатору 17 UA 110329 C2 5 на базі третинного аміну, наприклад, ДМАП, з наступним видаленням захисної групи BOC з використанням кислот, таких як ТФО або HC1, в розчиннику, такому як CH 2Cl2 або діоксан, з утворенням сполученої Сполуки C. Активація Сполуки C з використанням агенту сполучення, такого як ГАТУ, в присутності аміну, такого як ДІЕА, з наступним додаванням жирної кислоти формули D, дає сполуки формули E. Схема 2 10 15 20 25 де R, r та s є такими, як визначено вище. [0225] Ацильований амін формули F може бути одержаний з використанням методик, описаних в Andruszkiewicz et al. Synthetic Communications 2008, 38, 905-913. Сполука A може бути амідована аміном F з використанням реагенту сполучення, такого як ДЦК, КДІ, ЕДК, або, необов’язково, основи та/або каталізатору на базі третинного аміну, наприклад, ДМАП, з наступним видаленням захисної групи BOC за допомогою кислот, таких як ТФО або HCl, в розчиннику, такому як CH2Cl2 або діоксан, з утворенням сполученої Сполуки G. Активація сполуки G з використанням агенту сполучення, такого як ГАТУ, в присутності аміну, такого як ДІЕА, з наступним додаванням жирної кислоти формули D дає сполуки формули H. Схема 3 де r та s є такими, як визначено вище. [0226] Сполука A може бути амідована відповідним аміном I (де i = 0, 1, 2 або 3) з використанням реагенту сполучення, такого як ДЦК, КДІ, ЕДК, або, необов’язково, основи та/або каталізатору на базі третинного аміну, наприклад, ДМАП, з наступним видаленням захисної групи BOC за допомогою кислот, таких як ТФО або HC1, в розчиннику, такому як CH 2Cl2 або діоксан, з утворенням сполученої Сполуки J. Активація сполуки J з використанням агенту 18 UA 110329 C2 5 10 15 20 25 сполучення, такого як ГАТУ, в присутності аміну, такого як ДІЕА, з наступним додаванням жирної кислоти формули D дає сполуки формули K. Гідроліз естеру в основних умовах, які забезпечуються, наприклад, NaOH або LiOH, дає відповідну кислоту, що може бути сполучена з гліцидолом з одержанням сполук формули L. Схема 4 де r та s є такими, як визначено вище. [0227] Амін M може бути одержаний у відповідності до методик, описаних в Dahan et al. J. Org. Chem. 2007, 72, 2289-2296. Сполука A може бути сполучена з аміном M з використанням реагенту сполучення, такого як ДЦК, КДІ, ЕДК, або, необов’язково, основи та/або каталізатору на базі третинного аміну, наприклад, ДМАП, з наступним видаленням захисної групи BOC за допомогою кислот, таких як ТФО або HCl, в розчиннику, такому як CH 2Cl2 або діоксан, з утворенням сполученої Сполуки N. Активація Сполуки N з використанням агенту сполучення, такого як ГАТУ, в присутності аміну, такого як ДІЕА, з наступним додаванням жирної кислоти формули D дає сполуки формули O. Схема 5 [0228] Сполука A може бути амідована комерційно доступним аміном P з використанням реагенту сполучення, такого як ДЦК, КДІ, ЕДК, або, необов’язково, основи та/або каталізатору на базі третинного аміну, наприклад, ДМАП, з одержанням Сполуки Q. Захисна група BOC може бути видалена із Сполуки Q за допомогою кислот, таких як ТФО або HCl, в розчиннику, такому як CH2Cl2 або діоксан, та одержаний амін може бути сполучений з жирною кислотою формули D з використанням агенту сполучення, такого як ГАТУ, в присутності аміну, такого як ДІЕА, з 19 UA 110329 C2 одержанням сполук формули R. Фахівці в даній галузі можуть здійснити окиснення сірковмісної групи у формулі Q до відповідного сульфоксиду або сульфону з використанням окиснювача, такого H2O2 або оксон. Схема 6 5 10 15 20 де R6 r та s є такими, як визначено вище. [0229] Амін T може бути одержаний з комерційно доступного діаміну у відповідності до методик, описаних в Dahan et al. J. Org. Chem. 2007, 72, 2289-2296. Сполука A може бути амідована аміном T з використанням реагенту сполучення, такого як ДЦК, КДІ, ЕДК, або, необов’язково, основи та/або каталізатору на базі третинного аміну, наприклад, ДМАП, з одержанням Сполуки U. Захисна група BOC із сполуки U може бути видалена за допомогою кислот, таких як ТФО або HCl, в розчиннику, такому як CH2Cl2 або діоксан, та одержаний амін може бути сполучений з жирною кислотою формули D з використанням ГАТУ, в присутності аміну, такого як ДІЕА, з одержанням сполук формули V. Фахівці в даній галузі можуть додатково здійснити ацилювання гідроксильної групи в Сполуці U або перетворення її на аміногрупу стандартною реакцією мезилування з наступним витісненням з використанням натрію азиду та гідрогенізацією над каталізатором, таким як Pd/C. Амін може бути додатково ацильований або алкілований, з наступним видаленням групи BOC. Одержаний амін може бути сполучений з жирною кислотою формули D з одержанням сполук формули W. Схема 7 20 UA 110329 C2 5 10 15 20 де r та s є такими, як визначено вище. [0230] Сполука A може бути амідована комерційно доступним аміном X з використанням реагенту сполучення, такого як ДЦК, КДІ, ЕДК, необов’язково з використанням основи та/або каталізатору на базі третинного аміну, наприклад, ДМАП, з одержанням Сполуки Y. Захисна група BOC в Сполуці Y може бути видалена за допомогою кислот, таких як ТФО або HCl, в розчиннику, такому як CH2Cl2 або діоксан. Одержаний амін може бути сполучений з жирною кислотою формули D з використанням реагенту сполучення, такого як ГАТУ, в присутності аміну, такого як ДІЕА, з одержанням сполук формули Z. Схема 8 де r та s є такими, як визначено вище. [0231] Сполука A може бути амідована комерційно доступним метиловим естером цистеїну з використанням реагенту сполучення, такого як ДЦК, КДІ, ЕДК, або, необов’язково, основи та/або каталізатору на базі третинного аміну, наприклад, ДМАП, з одержанням Сполуки AA. Комерційно доступне похідне малеїніміду BB може бути сполучене з жирною кислотою формули D з використанням агенту сполучення, такого як ГАТУ або ЕДКІ, з одержанням сполук формули CC. Сполука AA може бути сполучена із сполуками формули CC в розчиннику, такому як ацетонітрил, з одержанням сполук формули DD. Схема 9 21 UA 110329 C2 5 10 15 20 25 30 35 де R7, a, r та s є такими, як визначено вище. [0232] Комерційно доступні естери амінокислот EE можуть бути сполучені з жирною кислотою формули D з використанням агенту сполучення, такого як ЕДКІ або ГАТУ, з наступним лужним гідролізом метилового естеру з одержанням сполук формули FF. Сполуки формули FF можуть бути сполучені з комерційно доступними похідними BOC-амінокислоти GG з використанням агенту сполучення, такого як ЕДКІ або ГАТУ. Захисна група BOC може бути видалена шляхом обробки кислотами, такими як ТФО або HCl, з одержанням сполук формули HH, які далі можуть бути сполучені із Сполукою A з одержанням сполук формули II. ПРИКЛАДИ [0233] Опис додатково проілюстрований наступними прикладами, які не повинні інтерпретуватися як обмежуючі контекст або дух даного винаходу конкретними методиками, описаними в даному описі. Слід розуміти, що приклади наведені для ілюстрації деяких варіантів та не призначені для обмеження меж винаходу. Також слід розуміти, що може бути здійснене пересортування з одержанням різноманітних інших варіантів, модифікацій та еквівалентів винаходу, які можуть спасти на думку фахівцям в даній галузі без відходу від духу даного опису та/або меж, визначених доданою формулою винаходу. Приклад 1 Вплив ніацинових похідних жирних кислот на секрецію ApoB в клітинах HepG2 [0234] Повідомлялося, що ніацин in vivo підвищує рівні в сироватці ЛПВЩ порівняно з рівнями ЛПНЩ. Подібним чином, повідомлялося, що ніацин підвищує секрецію ApoA1 (Jin, F-Y. et al. Arterioscler. Thromb. Vase. Biol. 1997, 17 (10), 2020-2028), при цьому інгібуючи секрецію ApoB (Jin, F-Y. et al. Arterioscler. Thromb. Vase. Biol. 1999, 19, 1051-1059) в супернатантах середовищ культур HepG2. Незалежно, ДГК також продемонструвала здатність до зниження рівнів ApoB (Pan, M. et al. J. Clin. Invest. 2004, 113, 1277-1287) за зовсім іншим механізмом. Таким чином, секреція ApoB клітинами HepG2 є потенційною моделлю для клітинного аналізу впливу кон’югатів ніацин-ДГК, а також їх похідних. [0235] Клітини HepG2 (ATCC) висівали із щільністю 10 000 клітин/лунку на 96-лункові планшети. Після прикріплення протягом ночі, середовище культивування (10% СТЕ в МДСІ) видаляли, і клітини позбавляли сироватки на 24 год в МДСІ, що містило 0,1% вільного від жирних кислот альбуміну телячої сироватки (АТС, Sigma). Далі клітини обробляли сполукою. Ніацин в концентрації 5 мМ використовували як позитивний контроль. Всі види обробки здійснювали в трьох повтореннях. Одночасно з обробкою сполукою, секрецію ApoB стимулювали додаванням 0,1 олеату в комплексі з вільною від жирних кислот АТС, в 22 UA 110329 C2 5 10 15 20 25 30 35 40 45 50 молярному співвідношенні 5:1. Інкубацію із сполукою та олеатом здійснювали протягом 24 год. Супернатанти середовища видаляли, та концентрацію ApoB вимірювали з використанням наборів ELISA (Mabtech AB). Відсоток інгібування секреції ApoB визначали, нормалізуючи дані до результатів оброблених розчинником клітин. Для даної сполуки, значення IC 50 (концентрація, при якій секреція ApoB інгібується на 50%) визначали з використанням моделі 4хпараметричної апроксимації кривої інгібування (Graph Pad Prism®). В ході кожного експерименту визначали життєздатність клітин з використанням набору ATPlite 1-Step (Perkin Elmer) для контролю цитотоксичного впливу сполуки. Кон’югат ніацину та жирної кислоти I-7 оцінювали на клітинах HepG2 в 3-х концентраціях (50, 100 і 200 мкМ). Рівень секреції ApoB порівнювали з рівнем секреції при додаванні ніацину в концентрації 5 мМ. В порівнянні з ніацином, кон’югат ніацину та жирної кислоти 1-7 продемонстрував виражене інгібування ApoB при набагато нижчій концентрації лікарського засобу. Приклад 2 Вплив ніацинових похідних жирних кислот на цільові гени SREBP-lc Клітини HepG2 (ATCC) висівали із щільністю 20 000 клітин/лунку на 96-лункові планшети. Після прикріплення протягом ночі, середовище культивування (10% СТЕ в МДСІ) видаляли, і клітини позбавляли сироватки на 24 год в МДСІ, що містило 0,1% вільного від жирних кислот альбуміну телячої сироватки (АТС, Sigma). Далі клітини обробляли однією з 4-х речовин в кінцевій концентрації 50 мкМ в 1% розчині АТС або 0,1% олеату в комплексі з вільним від жирних кислот АТС у молярному співвідношенні 5:1 (4 речовини являли собою: сполуку I-7, сполуку I-8, комбінацію вільного ніацину та вільної ДГК, або комбінацію вільного ніацину та вільної ЕПК). Клітини інкубували протягом 6 год, і потім промивали фосфатним буферним розчином (ФБР). З використанням клітин здійснювали зворотну транскрипцію РНК до реагентів кДНК у відповідності до стандартних протоколів (зображені у протоколах ПЛР в реальному часі Applied Biosystem StepOne). ПЛР транскриптів у реальному часі здійснювали в аналізах Taqman для 4-х специфічних генів FASN (синтетаза жирної кислоти), SCD (стероїл-КоА-десатураза) та ApoA1 (аполіпопротеїн A1). У всіх 3-х випадках використовували 18S-VIC® як контроль для нормалізації. Як показано на фіг. 2, статистично значуще інгібування експресії генів FASN та SCD та збільшення експресії гену ApoA1 спостерігалися при стимуляції клітин HepG2 олеатом в присутності 50 мкМ сполуки I-7 та сполуки I-8. Дві групи, що містили комбінацію вільного ніацину та вільної ДГК або ніацину та вільної ЕПК, не продемонстрували значних змін експресії вказаних 3-х специфічних генів в кінцевій концентрації 50 мкМ. Сполуки [0236] Наступні необмежуючі приклади сполук служать для ілюстрації додаткових варіантів ніацинових похідних жирних кислот. Слід розуміти, що будь-які варіанти, наведені в розділі «Приклади» є варіантами ніацинових похідних жирних кислот, і, таким чином, придатні для застосування в описаних вище способах і композиціях. Приклад 3 Одержання N-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)нікотинаміду (I-7) [0237] У типовому випадку, нікотинову кислоту (2,0 г, 16,2 ммоль) переносять в CH2Cl2 (20 мл) разом з оксалілхлоридом (1,4 мл, 16,2 ммоль). Після цього додають декілька крапель ДМФА, реакційну суміш перемішують при кімнатній температурі до повного розчинення твердих речовин та припинення виділення газу (1 год). Одержаний свіже приготований розчин хлорангідриду кислоти додають по краплях при температурі 0° C до розчину, що містить третбутил-2-аміноетилкарбамат (2,6 г, 16,2 ммоль) та Et3N (3,4 мл, 24,2 ммоль) в CH2Cl2 (200 мл). Одержану реакційну суміш нагрівають до кімнатної температури та перемішують протягом 2 год. Далі її промивають сольовим розчином, сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску. Очищення хроматографією на силікагелі (CH 2Cl2) дає третбутил-2-(нікотинамідо)етилкарбамат (3,1 г, 74%). [0238] трет-Бутил-2-(нікотинамідо)етилкарбамат (3,1 г, 11,7 ммоль) переносять в 25% ТФО в CH2Cl2 (10 мл). Одержану реакційну суміш залишають при кімнатній температурі на 1 год. В 23 UA 110329 C2 5 10 15 20 25 30 35 40 цій точці утворюється значна кількість осаду, після чого прозорий фільтрат видаляють. Залишок твердої речовини сушать з одержанням солі ТФО N-(2-аміноетил)нікотинаміду (1,6 г) . [0239] Сіль ТФО N-(2-аміноетил)нікотинаміду (5,0 ммоль) переносять в CH3CN (20 мл) разом з (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєновою кислотою (5,0 ммоль), ГАТУ (5,5 ммоль) та ДІЕА (15 ммоль). Одержану реакційну суміш перемішують при кімнатній температурі протягом 2 год і розбавляють етилацетатом. Органічну фракцію промивають насиченим водним розчином NaHCO3, сольовим розчином, сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску. Очищення хроматографією на силікагелі (5% MeOH/CH 2Cl2) дає N-(2(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідоетил)нікотинамід. МС: обчислено + для C30H41N3O2 475,32; знайдено [M+H] 476. Приклад 4 Одержання N-(2-(5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,l1,14,17-пентаєнамідоетил)нікотинаміду (I-8) [0240] Сіль ТФО N-(2-аміноетил)нікотинаміду (1,6 г, 5,7 ммоль) переносять в CH 3CN (15 мл) разом з (5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєновою кислотою (1,7 г, 5,7 ммоль), ГАТУ (2,4 г, 6,3 ммоль) та ДІЕА (3 мл, 17 ммоль). Одержану реакційну суміш перемішують при кімнатній температурі протягом 2 год і розбавляють етилацетатом. Органічну фракцію промивають насиченим водним розчином NaHCO3, сольовим розчином, сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску. Очищення хроматографією на силікагелі (5% MeOH/CH2Cl2) дає N-(2-(5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17пентаєнамідоетил)нікотинамід (1,6 г, 62%). МС: обчислено для C28H39N3O2: 449,3; знайдено + [M+H] 450. Приклад 5 Одержання N-(2-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)дисульфаніл)етил)нікотинаміду (I-3) [0241] Цистаміну дигідрохлорид (1,0 г, 4,44 ммоль) розчиняють в метанолі (50 мл). Триетиламін (1,85 мл, 3 екв.) додають при кімнатній температурі, з наступним додаванням по краплях Boc2O (0,97 г, 4,44 ммоль) у вигляді розчину в метанолі (5 мл). Одержану реакційну суміш перемішують при кімнатній температурі протягом 3 год. Далі її упарюють при зниженому тиску, та одержаний залишок переносять в 1М водний розчин NaH 2PO4 (20 мл). Водну фракцію промивають сумішшю пентан/EtOAc (1:1, 10 мл), підлужують до pH 9 за допомогою 1М водного розчину NaOH та екстрагують етилацетатом. Об’єднані органічні фракції промивають сольовим розчином, сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску з одержанням трет-бутил-2-(2-(2-аміноетил)дисульфаніл)етилкарбамату (500 мг, 44%). [0242] Окремо, нікотинову кислоту (246 мг, 2,0 ммоль) переносять в CH3CN (10 мл) разом з трет-бутил-2-(2-(2-аміноетил)дисульфаніл)етилкарбаматом (503 мг, 2,0 ммоль), ЕДКІ (422 мг, 2,2 ммоль). Одержану реакційну суміш перемішують при кімнатній температурі протягом 4 год, і далі розбавляють етилацетатом. Органічну фракцію промивають розбавленим водним розчином NaHCO3, сольовим розчином, сушать над натрію сульфатом, фільтрують та упарюють 24 UA 110329 C2 5 10 15 20 25 30 35 40 45 при зниженому тиску. Очищення хроматографією на силікагелі (CH 2Cl2) дає трет-бутил-2-(2-(2(нікотинамідо)етил)дисульфаніл)етилкарбамат (400 мг, 56%). [0243] трет-Бутил-2-(2-(2-(нікотинамідо)етил)дисульфаніл)етилкарбамат (200 мг, 0,56 ммоль) переносять в 25% розчин ТФО в CH2Cl2 (5 мл) та залишають при кімнатній температурі на 4 год. Реакційну суміш далі упарюють при зниженому тиску з одержанням солі ТФО N-(2-(2(2-аміноетил)дисульфаніл)етил)нікотинаміду. Одержаний матеріал переносять в CH 3CN (10 мл) разом з (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13, 16,19-гексаєновою кислотою (184 мг, 0,56 ммоль), ГАТУ (234 мг, 0,62 ммоль) та ДІЕА (0,30 мл). Одержану реакційну суміш перемішують при кімнатній температурі протягом 2 год. Далі її розбавляють етилацетатом і промивають послідовно насиченим водним розчином NaHCO3 та сольовим розчином. Органічну фракцію сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску. Очищення хроматографією на силікагелі (5% MeOH/CH2Cl2) дає (N-(2-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза4,7,10,13,16,19-гексаєнамідоетил)дисульфаніл)етил)нікотинамід (300 мг, 86%). МС: обчислено + для C32H45N3O2S2: 567,3; знайдено [M+H] 568. Приклад 6 Одержання N-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетокси)етил)нікотинамиду (I-1) [0244] В типовому випадку, натрію гідроксид (400 мг, 10 ммоль) розчиняють в метанолі (70 мл), і додають 2-(2-аміноетокси)етанаміну дигідрохлорид (1,0 г, 5,65 ммоль). Одержану реакційну суміш перемішують при кімнатній температурі протягом 30 хв. Потім розчин, що містить Boc2O (740 мг, 3,40 ммоль) в ТГФ (15 мл) додають по краплях при кімнатній температурі протягом 15 хв. Одержану реакційну суміш перемішують при кімнатній температурі протягом 18 год. Далі її упарюють при зниженому тиску. Одержаний залишок переносять в CH 2Cl2 (200 мл) та енергійно перемішують при кімнатній температурі протягом 4 год. Суміш фільтрують, і фільтрат упарюють при зниженому тиску з одержанням трет-бутил-2-(2аміноетокси)етилкарбамату (850 мг, 74%). [0245] трет-Бутил-2-(2-аміноетокси)етилкарбамат (420, 2,06 ммоль) далі переносять в CH3CN (20 мл) разом з нікотиновою кислотою (253 мг, 2,06 ммоль) та ЕДКІ (434 мг, 2,3 ммоль). Одержану реакційну суміш перемішують при кімнатній температурі протягом 18 год. Далі її розбавляють етилацетатом (20 мл), промивають насиченим водним розчином NaHCO 3, сольовим розчином, сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску. Одержаний залишок очищують хроматографією на силікагелі (CH 2Cl2/MeOH, 9:1) з одержанням трет-бутил-2-(2-(нікотинамідо)етокси)етилкарбамату (280 мг, 44%). МС: + обчислено для C15H23N3O4: 309,17; знайдено [M+H] 310. [0246] трет-Бутил-2-(2-(нікотинамідо)етокси)етилкарбамат (140 мг, 0,453 ммоль) переносять в 25% ТФО в CH2Cl2 (10 мл). Реакційну суміш залишають при кімнатній температурі на 2 год, після чого упарюють при зниженому тиску з одержанням солі ТФО N-(2-(2аміноетокси)етил)нікотинаміду. Одержаний матеріал далі переносять в CH 3CN (10 мл) разом з (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєновою кислотою (148 мг, 0,453 ммоль), ГАТУ (190 мг, 0,498 ммоль) та ДІЕА (0,24 мл). Одержану реакційну суміш перемішують при кімнатній температурі протягом 2 год. Далі її розбавляють етилацетатом і промивають послідовно насиченим водним розчином NaHCO3 і сольовим розчином. Органічну фракцію сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску. Очищення 25 UA 110329 C2 хроматографією на силікагелі (CH2Cl2/MeOH, 9:1) дає N-(2-(2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза4,7,10,13,16,19-гексаєнамідоетокси)етил)нікотинамід (75 мг, 31%). МС: обчислено для + C31H46N2O5: 526,34; знайдено [M+H] 527. 5 Приклад 7 Одержання N-(2-((2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідоетил)(метил)аміно)етил)нікотинаміду (I-2) 10 15 20 25 30 35 40 [0247] N1-(2-Аміноетил)-N1-метилетан-1,2-діамін (5,0 г, 42,7 ммоль) розчиняють в CH2Cl2 (100 мл) та охолоджують до 0° C. Далі розчин Boc2O (0,93 г, 4,27 ммоль) в CH2Cl2 (10 мл) додають по краплях при температурі 0° C протягом 15 хв. Одержану реакційну суміш перемішують при 0° C, витримуючи при цій температурі протягом 30 хв, і потім нагрівають до кімнатної температури. Після перемішування при кімнатній температурі протягом 2 год, реакційну суміш розбавляють CH 2Cl2 (100 мл). Органічну фракцію промивають сольовим розчином (3 x 25 мл), сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску з одержанням трет-бутил-2-((2-аміноетил)(метил)аміно)етилкарбамату (1,1 г) . [0248] трет-Бутил-2-((2-аміноетил)(метил)аміно)етилкарбамат (400 мг, 1,84 ммоль) переносять в CH3CN (10 мл) разом з нікотиновою кислотою (227 мг, 1,84 ммоль) та ЕДКІ (353 мг, 2,02 ммоль). Одержану реакційну суміш перемішують при кімнатній температурі протягом 18 год, і потім розбавляють етилацетатом. Органічну фракцію промивають насиченим водним розчином NaHCO3, сольовим розчином, сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску. Одержаний залишок очищують хроматографією на силікагелі (5% MeOH/CH2Cl2) з одержанням трет-бутил-2-(метил(2-(нікотинамідо)етил)аміно)етилкарбамату + (180 мг, 30%). МС: обчислено для C16Η26Ν4O3: 322,2; знайдено [M+H] 323. [0249] трет-Бутил-2-(метил-(2-(нікотинамідо)етил)аміно)етилкарбамат (90 мг, 0,279 ммоль) переносять в 25% розчин ТФО в CH2Cl2 (5 мл) та залишають при кімнатній температурі протягом 3 год. Реакційну суміш упарюють при зниженому тиску з одержанням солі ТФО N-(2((2-аміноетил)(метил)аміно)етил)нікотинаміду. Одержаний матеріал переносять в CH3CN (10 мл) разом з (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєновою кислотою (90 мг, 0,279 ммоль), ГАТУ (117 мг, 0,31 ммоль) та ДІЕА (0,15 мл). Одержану реакційну суміш перемішують при кімнатній температурі протягом 2 год. Далі її розбавляють етилацетатом і промивають послідовно насиченим водним розчином NaHCO3 і сольовим розчином. Органічну фракцію сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску. Очищення хроматографією на силікагелі (5% MeOH/CH2Cl2) дає N-(2-((2-(4Z,7Z,10Z,13Z,16Z,19Z)-докоза4,7,10,13,16,19-гексаєнамідоетил)(метил)аміно)етил)нікотинамід (30 мг, 20%). МС: обчислено + для C33H48N4O2: 532,38; знайдено [M+H] 533. Приклад 8 Одержання (2S,3R)-метил-3-((S)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо)пропаноїлокси)-2-(нікотинамідо)бутаноату (I-9) 26 UA 110329 C2 5 10 15 20 25 30 35 [0250] Гідрохлорид метилового естеру L-аланіну (0,85 г, 6,1 ммоль) переносять в CH3CN (20 мл) разом з (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнoвою кислотою (2,0 г, 6,1 ммоль), ЕДКІ (1,3 г, 6,72 ммоль) та ДІЕА (1,3 мл). Одержану реакційну суміш перемішують при кімнатній температурі протягом 2 год. Далі її розбавляють етилацетатом, промивають розбавленим водним розчином NaHCO3 і сольовим розчином. Органічну фракцію сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску з одержанням (5)-метил-2((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)пропаноату (2,0 г, 79%). [0251] (S)-Метил-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)пропаноат (2,0 г, 4,8 ммоль) переносять в ТГФ (8 мл) разом з 5 М водним розчином NaOH (5 мл), та енергійно перемішують при кімнатній температурі протягом 3 год. Реакційну суміш розбавляють водою та упарюють при зниженому тиску. Далі додають достатню кількість 6 н HCl до pH 2. Одержану суміш екстрагують етилацетатом. Об’єднані органічні фракції сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску з одержанням (S)-2((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)пропанової кислоти, яку переносять в CH3CN (15 мл) разом з метиловим естером N-Boc-L-треоніну (1,11 г, 4,78 ммоль), ГАТУ (2,0 г, 5,3 ммоль) та ДІЕА (1,2 мл). Одержану реакційну суміш перемішують при кімнатній температурі протягом 6 год і розбавляють EtOAc. Органічну фракцію промивають NaHCO3, сольовим розчином, сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску. Очищення хроматографією на силікагелі (CH 2Cl2) дає (2S,3R)-метил-2-(третбутоксикарбоніл)-3-((S)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо)пропаноїлокси)бутаноат ( 1,0 г) . [0252] (2S,3R)-Метил-2-(трет-бутоксикарбоніл)-3-((S)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза4,7,10,13,16,19-гексаєнамідо)пропаноїлокси)бутаноат (300 мг, 0,488 ммоль) переносять в 4 М HC1 в діоксані (2 мл) та залишають при кімнатній температурі на 10 хв. Реакційну суміш далі розбавляють етилацетатом та упарюють при зниженому тиску з одержанням солі (2S,3R)метил-2-аміно-3-((S)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо)пропаноїлокси)бутаноату HC1. Одержаний матеріал переносять в CH 3CN (5 мл) разом з нікотиновою кислотою (60 мг, 0,488 ммоль), ГАТУ (204 мг, 0,54 ммоль) та ДІЕА (0,25 мл, 1,46 ммоль). Одержану реакційну суміш перемішують при кімнатній температурі протягом 1 год та упарюють при зниженому тиску. Одержаний маслянистий залишок очищують хроматографією на силікагелі (CH2Cl2/MeOH, 9:1) з одержанням (2S,3R)-метил-3-((S)-2((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)пропаноїлокси)-2+ (нікотинамідо)бутаноату (120 мг, 40%). МС: обчислено для C36H49N3O6: 619,36; знайдено [M+H] 620. Приклад 9 Одержання (2S,3R)-метил-3-((S)-2-((5Z,8Z,llZ,14Z,17Z)-ікоза-5,8,11,14,17пентаєнамідо)пропаноїлокси)-2-(нікотинамідо)бутаноату (I-10) 27 UA 110329 C2 5 10 15 20 25 30 35 [0253] Застосовують послідовність синтезу, ідентичну описаній вище для одержання (2S,3R)-метил-3-((S)-2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19гексаєнамідо)пропаноїлокси)-2-(нікотинамідо)бутаноату, за винятком використання (5Z,8Z,11Z,14Z,17Z)-ейкоза-5,8,11,14,17-пентаєнової кислоти (ЕПК) замість ДГК. МС: обчислено + для C34H47N3O6: 593,35; знайдено [M+H] 594. Приклад 10 Одержання (S)-метил-6-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-2(нікотинамідо)гексаноату (I-11) [0254] H-Лізин-(BOC)-OMe гідрохлорид (500 мг, 1,68 ммоль) переносять в CH3CN (10 мл) разом з нікотиновою кислотою (207 мг, 1,68 ммоль), ЕДКІ (354 мг, 1,85 ммоль) та ДІЕА (0,90 мл). Одержану реакційну суміш перемішують при кімнатній температурі протягом 18 год і розбавляють етилацетатом. Органічну фракцію промивають розбавленим водним розчином NaHCO3, сольовим розчином, сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску. Очищення хроматографією на силікагелі (CH 2Cl2) дає (S)-метил-6-(третбутоксикарбоніл)-2-(нікотинамідо)гексаноат (520 мг, 85%). [0255] (S)-Mетил-6-(трет-бутоксикарбоніл)-2-(нікотинамідо)гексаноат (260 мг, 0,71 ммоль) переносять в 4 М HC1 в діоксані (2 мл) та залишають при кімнатній температурі на 1 год. Реакційну суміш розбавляють етилацетатом та упарюють при зниженому тиску з одержанням солі (5)-метил-6-аміно-2-(нікотинамідо)гексаноату HC1. Одержаний матеріал переносять в CH3CN (5 мл) разом з (4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєновою кислотою (233 мг, 0,71 ммоль), ГАТУ (297 мг, 0,78 ммоль) та ДІЕА (0,4 мл). Одержану реакційну суміш перемішують при кімнатній температурі протягом 2 год і розбавляють етилацетатом. Органічну фракцію промивають розбавленим водним розчином NaHCO 3, сольовим розчином, сушать над натрію сульфатом, фільтрують та упарюють при зниженому тиску. Очищення хроматографією на силікагелі (CH2Cl2/MeOH, 9:1) дає (S)-метил-6-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза4,7,10,13,16,19-гексаєнамідо)-2-(нікотинамідо)гексаноат (280 мг, 72%). МС: обчислено для + C35H49N3O4: 575,37; знайдено [M+H] 576. Приклад 11 Одержання (S)-6-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаєнамідо)-2(нікотинамідо)гексанової кислоти (1-12) 28
ДивитисяДодаткова інформація
Назва патенту англійськоюFatty acid niacin conjugates and their uses
Автори російськоюMilne, Jill, C., Jirousek, Michael, R., Bemis, Jean E., Vu, Chi, B.
МПК / Мітки
МПК: A01N 43/40, A61K 31/44
Мітки: застосування, кон'югати, ніацину, кислот, жирних
Код посилання
<a href="https://ua.patents.su/36-110329-konyugati-zhirnikh-kislot-i-niacinu-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Кон’югати жирних кислот і ніацину та їх застосування</a>
Попередній патент: Рекомбінантна вакцина на основі параміксовірусів птахів і спосіб її приготування та застосування
Наступний патент: Виріб для перорального вживання зі зволоженого бездимного тютюну та спосіб його виготовлення
Випадковий патент: Пристрій вимірювання біоелектричних потенціалів рослин












