Сполуки дигідроіндолону, спосіб їх одержання і фармацевтичні композиції, які їх містять
Номер патенту: 105357
Опубліковано: 12.05.2014
Автори: Ікман Джон, Ортюно Жан-Клод, Бюрбрідж Мікаель, Лакост Жан-Мішель, Феже Імр, Пьєр Ален, Корді Алексіс
Формула / Реферат
1. Сполука формули (І):
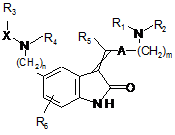 , (I)
, (I)
в якій:
- m являє собою 1 або 2,
- n являє собою 1 або 2,
- А являє собою піролільну групу, яка є незаміщеною або заміщеною 1-3 лінійними або розгалуженими (С1-С6)алкільними групами,
- X являє собою С(О), S(O) або SO2 групу,
- R1 і R2, які є однаковими або відрізняються, кожний являє собою лінійну або розгалужену (С1-С6)алкільну групу,
або R1 і R2, разом з атомом азоту, до якого вони приєднані, утворюють гетероциклічну групу,
- R3 і R4, разом з атомами, до яких вони приєднані, утворюють гетероциклічну групу,
- R5 являє собою атом водню або лінійну, або розгалужену (С1-С6)алкільну групу,
- R6 являє собою атом водню або атом галогену, при цьому мається на увазі, що:
- "гетероциклічна група" являє собою моно- або біциклічну групу, яка може містити від 5 до 8 піків, які можуть містити від одного до трьох гетероатомів, які вибирають з азоту, кисню і сірки, і які можуть містити один або більше ненасичених зв'язків, визначена таким чином гетероциклічна група може бути незаміщеною або заміщеною однією або більше групами, які вибирають з лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)алкенілу, оксо, гідрокси, лінійного або розгалуженого (С1-С6)алкокси, арилу, арилалкілу і арилалкенілу,
- "арил" означає фенільну групу, незаміщену або заміщену однією або більше групами, які вибирають з атомів галогену і лінійних або розгалужених (С1-С6)алкільних груп,
- позначення ![]() означає, що подвійний зв'язок має конфігурацію Z або Е,
означає, що подвійний зв'язок має конфігурацію Z або Е,
її оптичні і геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
2. Сполука формули (І) за п. 1, в якій n являє собою 1, її оптичні і геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
3. Сполука формули (І) за п. 1, в якій m являє собою 1, її оптичні і геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
4. Сполука формули (І) за п. 1, в якій R1 і R2 являють собою алкільну групу, її оптичніі геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
5. Сполука формули (І) за п. 1, в якій F1 і R2, разом з атомом азоту, до якого вони приєднані, утворюють 5- або 6-членну моноциклічну групу, її оптичні і геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
6. Сполука формули (І) за п. 1, в якій R1 і R2, разом з атомом азоту, до якого вони приєднані, утворюють морфолінільну групу, її оптичні і геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
7. Сполука формули (І) за п. 1, в якій R3 і R4, разом з групою X і атомом азоту, до якого вони приєднані, утворюють тіазолідиндіонільну групу, її оптичні і геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
8. Сполука формули (І) за п. 1, в якій R5 являє собою атом водню, її оптичні і геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
9. Сполука формули (І) за п. 1, в якій R6 являє собою атом водню, її оптичні і геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
10. Сполука формули (І) за п. 1, в якій X являє собою С=О-групу, її оптичні і геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
11. Сполука формули (І) за п. 1, в якій А являє собою 1Н-пірол-2,4-ільну групу, її оптичні і геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
12. Сполука формули (І) за п. 1, в якій F1 і R2, разом з атомом азоту, до якого вони приєднані, утворюють морфолінільну групу, m і n мають значення 1, R5 і R6 являють собою атом водню і А являє собою 1Н-пірол-2,4-ільну групу, її оптичні і геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
13. Сполука формули (І) за п. 1, яка являє собою 3-[(3-{[4-(4-морфолінілметил)-1Н-пірол-2-іл]метилен}-2-оксо-2,3-дигідро-1Н-індол-5-іл)метил]-1,3-тіазолідин-2,4-діон, її геометричні ізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
14. Сполука формули (І) за п. 1, яка являє собою 3-[((3Z)-3-{[4-(4-морфолінілметил)-1Н-пірол-2-іл]метилен}-2-оксо-2,3-дигідро-1Н-індол-5-іл)метил]-1,3-тіазолідин-2,4-діон, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
15. Спосіб одержання сполуки формули (І), вказаної у п. 1, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II):
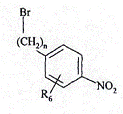 , (II)
, (II)
в якій n і R6 є такими ж, як визначено для формули (І),
з якою конденсують, у присутності основи, сполуку формули (III):
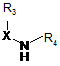 , (III)
, (III)
в якій X, R3 і R4 є такими ж, як визначено для формули (І), для одержання сполуки формули 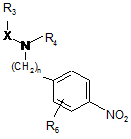 , (IV)
, (IV)
в якій n, X, R3, R4 і R6 є такими ж, як визначено тут вище, яку піддають хімічному або каталітичному гідрогенуванню для одержання сполуки формули (V):
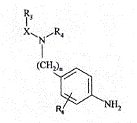 , (V)
, (V)
в якій n, X, R3, R4 і R6 є такими ж, як визначено тут вище,
яку піддають дії tBuOCl у присутності етил (метилсульфаніл)ацетату, з наступною послідовною дією триетиламіну і хлористоводневої кислоти, для одержання сполуки формули (VI):
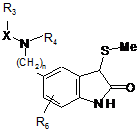 , (VI)
, (VI)
в якій n, X, R3, R4 і R6 є такими ж, як визначено тут вище, яку піддають дії порошкового цинку для одержання сполуки формули (VII):
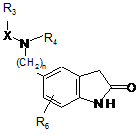 , (VII).
, (VII).
в якій n, X, R3, R4 і R6 є такими ж, як визначено тут вище,
з якою конденсують, у присутності піперидину, сполуку формули (VIII):
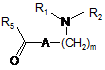 , (VIII)
, (VIII)
в якій m, A, R1, R2 і R5 є такими ж, як визначено для формули (І), для одержання, після обробки кислотою, сполуки формули (І), яку очищують, якщо необхідно, відповідно до звичайної методики розділення, перетворюють, якщо бажано, в її адитивні солі з фармацевтично прийнятною кислотою або основою, і розділяють, якщо необхідно, на її оптичні ізомери відповідно до звичайної методики розділення.
16. Спосіб одержання сполуки формули (І), вказаної у п. 1, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (IX):
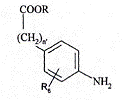 , (IX)
, (IX)
в якій n' являє собою 0 або 1, і R являє собою лінійну або розгалужену (С1-С6)алкільну групу, і R6 є таким же, як визначено для формули (І),
яку піддають дії tBuOCl у присутності етил (метилсульфаніл)ацетату, з наступною послідовною дією триетиламіну і хлористоводневої кислоти, для одержання сполуки формули (X):
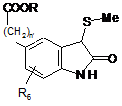 , (X)
, (X)
в якій n', R і R6 є такими ж, як визначено тут вище, яку піддають дії порошкового цинку для одержання сполуки формули (XI):
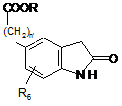 , (XI)
, (XI)
в якій n', R і R6 є такими ж, як визначено тут вище, яку вміщують у відновлювальне середовище для одержання сполуки формули (XII):
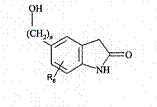 , (XII)
, (XII)
в якій n і R6 є такими ж, як визначено тут вище,
з якою конденсують, у присутності піперидину, сполуку формули (VIII):
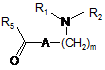 , (VIII)
, (VIII)
в якій m, A, R1, R2 і R5 є такими ж, як визначено для формули (І), для одержання, після обробки кислотою, сполуки (XIII):
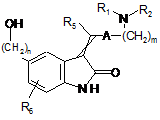 , (XIII)
, (XIII)
в якій m, A, R1, R2, R5 і R6 є такими ж, як визначено тут вище, з якою конденсують безпосередньо у присутності трифенілфосіну і, наприклад, етилазодикарбоксилату сполуку формули (III):
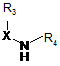 , (III)
, (III)
в якій X, R3 і R4 є такими ж, як визначено для формули (І), для одержання сполуки формули (І), яку очищують, якщо необхідно, відповідно до звичайної методики розділення, перетворюють, якщо бажано, в її адитивні солі з фармацевтично прийнятною кислотою або основою, і розділяють, якщо необхідно, на її оптичні ізомери відповідно до звичайної методики розділення.
17. Фармацевтична композиція, яка містить щонайменше одну сполуку формули (І), вказану у будь-якому з пп. 1-14, або її адитивну сіль з фармацевтично прийнятною кислотою або основою у поєднані з одним або більше фармацевтично прийнятними наповнювачами.
18. Фармацевтична композиція за п. 17 для застосування у виробництві лікарських засобів як агентів, які інгібують міграцію ракових клітин.
19. Фармацевтична композиція за п. 17 для застосування у виробництві лікарських засобів для використання у лікуванні метастатичного раку.
20. Фармацевтична композиція за п. 17 для застосування у виробництві лікарських засобів для використання у лікуванні раку товстої кишки, молочної залози, печінки, нирок, мозку, стравоходу, меланоми, мієломи, раку яєчників, недрібноклітинного раку легені, дрібноклітинного раку легені, раку простати і підшлункової залози і саркоми.
21. Комбінація сполуки формули (І), вказаної у будь-якому з пп. 1-14, з протираковим агентом, який вибирають з генотоксичних речовин, мітотичних отрут, антиметаболітів, інгібіторів протеасоми та інгібіторів кінази.
22. Застосування комбінації, вказаної у п. 21, у виробництві лікарських засобів для використання у лікуванні раку.
23. Застосування сполуки формули (І), вказаної у будь-якому з пп. 1-14, у комбінації з радіотерапією у лікуванні раку.
Текст
Реферат: Сполука формули (І): R3 X N R4 R5 R1 R2 N A (CH2)m (CH2)n O NH R6 , (I) в якій: - m і n являють собою 1 або 2, - А являє собою піролільну групу, - X являє собою С(О), S(O) або SO2 групу, - R1 і R2 являють собою алкільну групу, UA 105357 C2 (12) UA 105357 C2 або разом з атомом азоту, до якого вони приєднані, утворюють гетероциклічну групу, - R3 і R4, разом з атомами, до яких вони приєднані, утворюють гетероциклічну групу, - R5 являє собою атом водню або алкільну групу, - R6 являє собою атом водню або атом галогену. UA 105357 C2 5 10 15 20 Даний винахід стосується нових сполук дигідроіндолону, способу їх одержання і фармацевтичних композицій, які їх містять. Сполуки за даним винаходом є новими і мають дуже цінні фармакологічні властивості у сфері онкології. Потреби протиракової терапії вимагають постійної розробки нових протипухлинних агентів з метою одержання лікарських засобів, які є одночасно більш активними і такими, що краще переносяться. Причиною однієї з головних проблем в онкології є здатність ракових клітин мігрувати в інші ділянки з первинної пухлини, яка утворилась. Клітинна міграція являє собою фізіологічний процес, який є вирішальним для ембріонального розвитку і для підтримання гомеостазу тканин. Міграція викликає суттєві морфологічні зміни і залучає пригнічення внутрішньоклітинних сигнальних шляхів. Порушення регуляції клітинної міграції сильно залучене у ракові патології і більш конкретно у спосіб формування метастаз (Hanahan D. et al., 2000, Cell, 100, 57-70). Таким чином, особливо важливим є контролювати цей процес, який неминуче веде до генералізованого раку і неминучої смерті пацієнта. Окрім того, що вони є новими, сполуки за даним винаходом мають несподівану in vitro активність в інгібуванні міграції ракових клітин і, відповідно, прогресування пухлини. Сполуки за даним винаходом, відповідно, мають властивості, які роблять їх особливо корисними у лікуванні раків і, головним чином, метастатичних щільних пухлин. Більш конкретно, даний винахід стосується сполуки формули (І): R3 X N R4 R5 R1 R2 N A (CH2)m (CH2)n O NH R6 25 30 35 40 45 50 , (I) в якій: - m являє собою 1 або 2, - n являє собою 1 або 2, - А являє собою піролільну групу, яка є незаміщеною або заміщеною 1-3 лінійними або розгалуженими (С1-С6)алкільними групами, - X являє собою С(О), S(O) або SO2 групу, - R1 і R2, які є однаковими або відрізняються, кожний являє собою лінійну або розгалужену (С1-С6)алкільну групу, або R1 і R2, разом з атомом азоту, до якого вони приєднані, утворюють гетероциклічну групу, - R3 і R4, разом з атомами, до яких вони приєднані, утворюють гетероциклічну групу, - R5 являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, - R6 являє собою атом водню або атом галогену, при цьому мається на увазі, що: - "гетероциклічна група" являє собою моно- або біциклічну групу, яка може містити від 5 до 8 піків, які можуть містити від одного до трьох гетероатомів, які вибирають з азоту, кисню і сірки, і які можуть містити один або більше ненасичених зв'язків, визначена таким чином гетероциклічна група може бути незаміщеною або заміщеною однією або більше групами, які вибирають з лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1С6)алкенілу, оксо, гідрокси, лінійного або розгалуженого (С 1-С6)алкокси, арилу, арилалкілу і арилалкенілу, - "арил" означає фенільну групу, незаміщену або заміщену однією або більше групами, які вибирають з атомів галогену і лінійних або розгалужених (С1-С6)алкільних груп, - позначення означає, що подвійний зв'язок має конфігурацію Z або Е, їх оптичних і геометричних ізомерів, а також їх адитивних солей з фармацевтично прийнятною кислотою або основою. Серед фармацевтично прийнятних кислот можуть бути згадані, без будь-якого обмеження, хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, фосфорна кислота, оцтова кислота, трифтороцтова кислота, молочна кислота, піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарова кислота, винна кислота, малеїнова кислота, лимонна кислота, аскорбінова кислота, щавлева кислота, метансульфонова кислота, камфорна кислота. 1 UA 105357 C2 5 10 15 20 25 30 35 40 45 50 Серед фармацевтично прийнятних основ можуть бути згадані, без будь-якого обмеження, гідроксид натрію, гідроксид калію, триетиламін, третбутиламін і т.д. Перевага надається значенню n і m, що дорівнює 1. R1 і R2, переважно, являють собою алкільну групу, таку як, наприклад, етильну групу або, разом з атомом азоту, до якого вони приєднані, утворюють 5- або 6-членну моноциклічну групу, таку як, наприклад, піперидильна, морфолінільна, піролідинільна, піперазинільна або метилпіперазинільна група, або біциклічну групу, яка має від 6 до 8 членів, таку як, наприклад, октагідроциклопентапіролільна або азабіцикло[3.1.0]гексанільна група. Переважно, R1 і R2, разом з атомом азоту, до якого вони приєднані, утворюють морфолінільну групу. Переважно, R3 і R4, разом з X групою і атомом азоту, до якого вони приєднані, утворюють 5або 6-членну моноциклічну групу, таку як, наприклад, піролідинонільна, піролідиндіонільна, оксалідинонільна, оксазолідиндіонільна, диметилоксазолідиндіонільна, тіазолідинонільна, тіазолідиндіонільна, диметилтіазолідиндіонільна, імідазолідинонільна, імідазолідиндіонільна, тіадіазинонільна або дигідротіадіазинонільна група, або 6-членну біциклічну групу, таку як, наприклад, азабіцикло[3.1.0]гексанонільна або азабіцикло[3.1.0]гександіонільна група. Перевага надається R3 і R4, разом з X групою і атомом азоту, до якого вони приєднані, які утворюють 2,4діоксо-1,3-тіазолідин-3-ільну, 2,4-діоксо-1,3-оксазолідин-3-ільну, 2-оксо-1,3-тіазолідин-З-ільну, 2оксо-1,3-оксазолідин-З-ільну, 4-гідрокси-2-оксо-1,3-тіазолідин-3-ільну або 2,4-діоксо-Зазабіцикло[3.1.0]гекс-3-ильну групу. R5 переважно являє собою атом водню або метильну або етильну групу. X переважно являє собою С(О) групу. Перевага надається А, який являє собою незаміщену піролільну групу і, більш конкретно, 1Н-піроліл-2,4-ільну групу. Винахід стосується сполук формули (І), в якій R1 і R2, разом з атомом азоту, до якого вони приєднані, утворюють морфолінільну групу, m і n мають значення 1, R5 і R6 являють собою атом водню і А являє собою 1Н-пірол-2,4-ільну групу. Екзоциклічний подвійний зв'язок сполук формули (І) є конфігурації Z або Е, більш конкретно, конфігурації Z. Навіть більш конкретно, даний винахід стосується сполук формули (І), які являють собою: 3-[(3-{[4-(4-морфолінілметил)-1Н-пірол-2-іл]метилен}-2-оксо-2,3-дигідро-1Н-індол-5іл)метил]-1,3-тіазолідин-2,4-діон, 3-[3-(4-морфол ін-4-іл метил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро-1Н-індол-5-ілметил]оксазолідин-2,4-діон, 3-(4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксо-оксазолідин-3-ілметил)-1,3дигідро-індол-2-он, 5-(4-гідрокси-2-оксо-тіазолідин-3-ілметил)-3-(4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)1,3-дигідро-індол-2-он, (1R, 5S)-3-[3-(4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро-1Н-індол-5ілметил]-3-азабіцикло[3.1.0]гексан-2,4-діон, 3-(4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксо-тіазолідин-3-ілметил)-1,3-дигідроіндол-2-он, 3-{3-[1-(4-морфолін-4-ілметил-1Н-пірол-2-іл)-пропіліден]-2-оксо-2,3-дигідро-1Н-індол-5ілметил}-тіазолідин-2,4-діон, 3-{3-[1-(4-морфолін-4-ілметил-1Н-пірол-2-іл)-етиліден]-2-оксо-2,3-дигідро-1Н-індол-5ілметил}-тіазолідин-2,4-діон. Оптичні і геометричні ізомери переважних сполук даного винаходу, а також їх адитивні солі з фармацевтично прийнятною кислотою або основою, утворюють невід'ємну частину даного винаходу. Винахід також стосується способу одержання сполук формули (І), який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II): N (CH2)n R6 NO2 , (II) в якій n і R6 є такими ж, як визначено для формули (І), з якою конденсують, у присутності основи, сполуку формули (III): 2 UA 105357 C2 R3 X R4 N H , (III) в якій X, R3 і R4 є такими ж, як визначено для формули (І), для одержання сполуки формули (IV): R3 X R4 N (CH2)n NO2 R6 5 , (IV) в якій n, X, R3, R4 і R6 є такими ж, як визначено тут вище, яку піддають хімічному або каталітичному гідрогенуванню для одержання сполуки формули (V): R3 X R4 N (CH2)n NH2 R6 10 , (V) в якій n, X, R3, R4 і R6 є такими ж, як визначено тут вище, яку піддають дії tBuOCl у присутності етил (метилсульфаніл)ацетату, з наступною послідовною дією триетиламіну і хлористоводневої кислоти, для одержання сполуки формули (VI): R3 X N R4 S Me (CH2)n O NH R6 , (VI) в якій n, X, R3, R4 і R6 є такими ж, як визначено тут вище, яку піддають дії порошкового цинку для одержання сполуки формули (VII): R3 X N R4 (CH2)n O NH 15 R6 , (VII) в якій n, X, R3, R4 і R6 є такими ж, як визначено тут вище, з якою конденсують, у присутності піперидину, сполуку формули (VIII): R5 R1 N R2 A (CH2)m O 20 , (VIII) в якій m, A, R1, R2 і R5 є такими ж, як визначено для формули (І), для одержання, після обробки кислотою, сполуки формули (І), яку очищують, якщо необхідно, відповідно до звичайної методики розділення, перетворюють, якщо бажано, в її 3 UA 105357 C2 5 адитивні солі з фармацевтично прийнятною кислотою або основою, і розділяють, якщо необхідно, на її оптичні ізомери відповідно до звичайної методики розділення. Сполуки формул (II), (III) і (VIII) є або комерційно доступними, або можуть бути одержані кваліфікованим у даній галузі фахівцем за допомогою звичайних хімічних реакцій або хімічних реакцій, розкритих в літературі. Переважний варіант стосується способу одержання сполук формули (І), якийвідрізняється тим, що як вихідний матеріал використовують сполуку формули (IX): COOR (CH2)n NH2 R6 10 , (IX) в якій n являє собою 0 або 1, і R являє собою лінійну або розгалужену (С1-С6)алкільну групу, і R6 є таким же, як визначено для формули (І), яку піддають дії tBuOCl у присутності етил (метилсульфаніл)ацетату, з наступною послідовною дією триетиламіну і хлористоводневої кислоти, для одержання сполуки формули (X): COOR S Me (CH2)n' O NH R6 15 , (X) в якій n', R і R6 є такими ж, як визначено тут вище, яку піддають дії порошкового цинку для одержання сполуки формули (XI): COOR (CH2)n' O NH R6 (XІ), в якій n', R і R6 є такими ж, як визначено тут вище, яку вміщують у відновлювальне середовище для одержання сполуки формули (XII): OH (CH2)n' O NH 20 R6 , (XII) в якій n' і R6 є такими ж, як визначено тут вище, з якою конденсують, у присутності піперидину, сполуку формули (VIII): R5 R1 N R2 A (CH2)m O 25 , (VII) в якій m, A, R1, R2 і R5 є такими ж, як визначено для формули (І), для одержання, після обробки кислотою, сполуки (XIII): 4 UA 105357 C2 R5 OH R1 R2 N A (CH2)m (CH2)n O NH R6 , (VIII) в якій m, A, R1 R2, R5 і R6 є такими ж, як визначено тут вище, з якою конденсують безпосередньо у присутності трифенілфосіну і, наприклад, етил азодикарбоксилату сполуку формули (III): R3 X 5 10 15 20 25 30 35 40 45 N H R4 , (III) в якій X, R3 і R4 є такими ж, як визначено для формули (І), для одержання сполуки формули (І), яку очищують, якщо необхідно, відповідно до звичайної методики розділення, перетворюють, якщо бажано, в її адитивні солі з фармацевтично прийнятною кислотою або основою, і розділяють, якщо необхідно, на її оптичні ізомери відповідно до звичайної методики розділення. Сполуки формул (III), (VIII) і (IX) є або комерційно доступними, або можуть бути одержані кваліфікованим у даній галузі фахівцем за допомогою звичайних хімічних реакцій або хімічних реакцій, розкритих в літературі. Фармакологічні дослідження сполук за даним винаходом довели, що вони мають здатність інгібувати міграцію ракових клітин. Ця властивість, таким чином, має найбільш цінне терапевтичне значення у лікуванні раку, більш конкретно, у лікуванні метастатичного раку. Серед видів раку, які передбачають лікувати, можуть бути згадані, без будь-якого обмеження, рак товстої кишки, молочної залози, печінки, нирок, мозку, стравоходу, меланоми, мієломи, рак яєчників, недрібноклітинний рак легені, дрібноклітинний рак легені, рак простати і підшлункової залози і саркоми. Винахід також стосується фармацевтичних композицій, які містять щонайменше одну сполуку формули (І) саму по собі або в поєднанні з одним або більше фармацевтично прийнятними наповнювачами. Серед фармацевтичних композицій відповідно до даного винаходу можуть бути згадані особливо ті, які придатні для орального, парентерального, назального, під- або черезшкірного, ректального, під'язикового, очного або респіраторного введення, і особливо таблетки або драже, під'язикові таблетки, саше, пакетики, капсули, таблетки для повільного розчинення під язиком, коржики, супозиторії, креми, мазі, шкірні гелі, ампули, придатні для ін'єкцій і пиття. Корисне дозування змінюється в залежності від статі, віку і ваги пацієнта, шляху введення, природи терапевтичного призначення і будь-якого асоційованого лікування і знаходиться в межах від 0,01 мг до 1 г на 24 години за одне або більше введень. Окрім того, даний винахід стосується також поєднання сполуки формули (І) з протираковим агентом, який вибирають з генотоксичних речовин, мітотичних отрут, антиметаболітів, інгібіторів протеасоми та інгібіторів кінази, а також застосування цього типу поєднання у виробництві лікарських засобів для використання при лікуванні раку. Сполуки за даним винаходом можуть також бути застосовані у поєднанні з радіотерапією у лікуванні раку. Наступні Приготування і Приклади ілюструють винахід, але жодним чином не обмежують його. Точки плавлення вимірюють у капілярному пристрої. Приготування 1: 4-Морфолін-4-ілметил-1Н-пірол-2-карбальдегід До розчину морфоліну (0,38 моль) в оцтовій кислоті (120 мл) при 0 °C додають розчин 1Нпірол-2-карбальдегіду (0,32 моль) в оцтовій кислоті (100 мл). Потім краплями додають формальдегід (37 % водн., 26 мл). Реакційну суміш потім перемішують протягом 65 годин при температурі навколишнього середовища. Суміш концентрують (близько 50 мл) і охолоджують на льодяній бані. pH розчину підлуговують (pH=12), використовуючи 20 % водний розчин гідроксиду натрію. Продукт екстрагують дихлорметаном (DCM) (3 × 250 мл). Органічні фази об'єднують. Одержану органічну фазу промивають насиченим водним розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха. Одержаний залишок 5 UA 105357 C2 5 10 15 20 25 30 35 40 45 50 55 60 (олію) очищують на силікагелі (SiO2, градієнт DCM/МеОН) для одержання вказаного у заголовку продукту. + Mac-спектрометрія (ES+, m/z): 195, 1124 (М+Н) Приготування 2: 1-(4-Морфолін-4-ілметил-1Н-пірол-2-іл)етанон До розчину морфоліну (22 ммоль) в оцтовій кислоті (60 мл) при 0 °C додають 1-(1Н-пірол-2іл)-етанон (20 ммоль) і формальдегід (20 ммоль) 37 % у воді. Реакційну суміш перемішують протягом ночі при температурі навколишнього середовища. При 0 °C, розчин підлуговують pH (10-12), використовуючи 20 % водний розчин NaOH і потім екстрагують DCM. Органічну фазу промивають водою і насиченим водним розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха. Очищення за допомогою хроматографії на силікагелі (SiO2; градієнт DCM/МеОН) дає вказаний у заголовку продукт. + Mac-спектрометрія (ES+, m/z): 209, 1289 (М+Н) Приготування 3: 4-[(1R, 5S)-3-аза-біцикло[3.1.0]гекс-3-илметил]-3,5-диметил-1Н-пірол-2карбальдегід До розчину (1R, 5S)-3-аза-біцикло[3.1.0]гексану (10 ммоль) в оцтовій кислоті (10 мл) додають 10 ммоль 3,5-диметил-1Н-пірол-2-карбальдегіду і формальдегід (11 ммоль) 37 % у воді. Реакційну суміш перемішують протягом ночі при температурі навколишнього середовища і потім випаровують досуха. Очищення за допомогою хроматографії на силікагелі (SiO2; гептан/AcOEt) і потім порошкування у гептані дає вказаний у заголовку продукт. + Mac-спектрометрія (ES+, m/z): 219, 1503 (М+Н) Приготування 4: 4-((1R, 5S)-3-аза-біцикло[3.1.0]гекс-3-илметил)-1Н-пірол-2-карбальдегід Методика є такою ж як і у Приготуванні 1, із заміною морфоліну на (1R, 5S)-3-азабіцикло[3.1.0]гексан. + Mac-спектрометрія (ES+, m/z): 191, 1179 (М+Н) Приготування 5: 1-(4-Морфолін-4-ілметил-1Н-пірол-2-іл)-пропан-1-он До розчину морфоліну (89,3 ммоль) в оцтовій кислоті (50 мл) при 0 °C додають 1-(1Н-пірол2-іл)-пропан-1-он (81,2 ммоль) і формальдегід (89,3 ммоль) 37 % у воді. Реакційну суміш перемішують протягом ночі при температурі навколишнього середовища. Після концентрування суміші, розчин підлуговують pH (10-12), використовуючи 20 % водний розчин NaOH при 0 °C і потім екстрагують DCM. Органічну фазу промивають водою і насиченим водним розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха і очищують флешхроматографією на силікагелі (SiO2; градієнт 100 % AcOEt до AcOEt/MeOH 9/1) для одержання вказаного у заголовку продукту. + Mac-спектрометрія (ES+, m/z): 223, 1444 (М+Н) Приготування 6: 1-Метил-4-морфолін-4-ілметил-1Н-пірол-2-карбальдегід і 1-метил-5морфолін-4-ілметил-1Н-пірол-2-карбальдегід До розчину морфоліну (130 ммоль) в оцтовій кислоті (60 мл) при 0 °C додають 1-метил-1Нпірол-2-карбальдегід (110 ммоль) і формальдегід (110 ммоль) 37 % у воді. Реакційну суміш перемішують протягом 16 годин при 50 °C. Після випаровування досуха, додають близько 100 мл 25 % водного розчину гідроксиду натрію. Після екстрагування DCM, органічну фазу промивають водою і насиченим водним розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха. Залишок очищують за допомогою флеш-хроматографії на силікагелі (SiO2; градієнт AcOEt/МеОН) для одержання вказаних у заголовку продуктів 1-метил4-морфолін-4-ілметил-1Н-пірол-2-карбальдегіду і 1-метил-5-морфолін-4-ілметил-1Н-пірол-2карбальдегіду у співвідношенні 1/5. 1-Метил-4-морфолін-4-ілметил-1Н-пірол-2-карбальдегід + Mac-спектрометрія (ES+, m/z): 209, 1282 (М+Н) 1-Метил-5-морфолін-4-ілметил-1Н-пірол-2-карбальдегід + Mac-спектрометрія (ES+, m/z): 209, 1286 (М+Н) Приготування 7: 5-Морфолін-4-ілметил-1Н-пірол-2-карбальдегід Стадія А: 4-(1Н-Пірол-2-ілметил)-морфолін До розчину морфоліну (22 ммоль) в оцтовій кислоті (10 мл) додають краплями пірол (20 ммоль) при 0 °C. Потім краплями додають формальдегід (37 % водн., 20 ммоль). Реакційну суміш перемішують протягом 2 годин при температурі навколишнього середовища. Розчин охолоджують до 0 °C і підлуговують до pH (10-11), використовуючи 20 % водний розчин NaOH. Після екстрагування DCM, органічні фази промивають водою і насиченим водним розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха для одержання вказаного у заголовку продукту у формі твердої речовини білого кольору, яку використовують безпосередньо на наступній cтадії. 6 UA 105357 C2 5 10 15 20 25 30 35 40 45 50 55 60 Стадія В: 5-Морфолін-4-ілметил-1Н-пірол-2-карбальдегід До розчину DMF (18,04 ммоль) в DCM (10 мл) додають РОСl3, краплями, при 0 °C. Після перемішування протягом 5 хвилин, краплями додають розчин сполуки, одержаної на Стадії А, (9,02 ммоль). Після перемішування протягом 3 годин при 0 °C, реакційну суміш нагрівають при 40 °C протягом 30 хвилин. При температурі навколишнього середовища додають водний розчин ацетату калію (32 ммоль) і потім реакційну суміш перемішують при 40 °C протягом 30 хвилин. При температурі навколишнього середовища розчин підлуговують pH, використовуючи 2М NaOH розчин і потім екстрагують DCM. Органічну фазу промивають водою і насиченим розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха. Одержаний залишок очищують на силікагелі (SiO2; градієнт DCM I AcOEt) для одержання вказаного у заголовку продукту. + Mac-спектрометрія (ES+, m/z): 195, 1150 (М+Н) Приготування 8: 3-Морфолін-4-ілметил-1Н-пірол-2-карбальдегід Стадія А: 4-(1-Триізопропілсиланіл-1Н-пірол-3-ілметил)-морфолін До розчину морфоліну (98,5 ммоль) в оцтовій кислоті (100 мл) при 0 °C додають 1триізопропілсиланіл-1Н-пірол (89,5 ммоль) і формальдегід (89,5 ммоль) 37 % у воді. Реакційну суміш перемішують протягом ночі при температурі навколишнього середовища. Розчин підлуговують pH (10-12), використовуючи 20 % водний розчин NaOH і потім екстрагують DCM. Органічну фазу промивають водою і насиченим водним розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха. Одержаний залишок очищують за допомогою флеш-хроматографії на силікагелі (SiO2; градієнт DCM/AcOEt) для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній стадії. Стадія В: 4-(1Н-Пірол-3-ілметил)-морфолін До розчину сполуки, одержаної на Стадії А, (75 ммоль) в THF (100 мл) додають, краплями, при 0 °C, Bu4NF 1,0М у THF (75,0 ммоль). Після перемішування при 0 °C протягом однієї години, розчин виливають на лід і потім екстрагують DCM. Органічні фази об'єднують і потім промивають насиченим водним розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній стадії. Стадія С: 3-Морфолін-4-ілметил-1Н-пірол-2-карбальдегід До розчину DMF (66 ммоль) в DCM додають, краплями, при 0 °C, РОСl3. Після перемішування протягом 5 хвилин, краплями додають розчин сполуки, одержаної на Стадії В, (33 ммоль) у DCM (60 мл). Після перемішування протягом 4 годин при 0 °C і протягом 30 хвилин при нагріванні зі зворотним холодильником додають водний розчин ацетату натрію (110 ммоль). Через ще 30 хвилин при нагріванні зі зворотним холодильником, додають водний розчин 2М гідроксиду натрію при температурі навколишнього середовища доти, доки pH не стане лужним (9-10). Розчин перемішують протягом 2 годин при температурі навколишнього середовища, і потім додають 300 мл DCM. Після екстрагування DCM, органічну фазу промивають водою і насиченим водним розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха. Одержаний залишок очищують за допомогою флеш-хроматографії на силікагелі (SiO2, градієнт DCM/AcOEt) для одержання вказаного у заголовку продукту. + Mac-спектрометрія (ES+, m/z): 195, 1134 (М+Н) Приготування 9: 5-Діетиламінометил-1Н-пірол-2-карбальдегід Методика є такою ж, як і у Приготуванні 7, замінюючи морфолін на діетиламін. + Mac-спектрометрія (ES+, m/z): 181, 1340 (М+Н) Приготування 10: 4-(4-Метил-піперазин-1-ілметил)-1Н-пірол-2-карбальдегід Методика є такою ж, як і у Приготуванні 1, замінюючи морфолін на 1-метил-піперазин. + Mac-спектрометрія (ES+, m/z): 208, 1436 (М+Н) Приготування 11: 4-Піролідин-1 -ілметил-1Н-пірол-2-карбальдегід Методика є такою ж, як і у Приготуванні 1, замінюючи морфолін на піролідин. + Mac-спектрометрія (ES+, m/z): 179, 1183 (М+Н) Приготування 12: 4-((3aR, 6аS)-Гексагідро-циклопента[с]пірол-2-(1Н)-ілметил)-1Н-пірол-2карбальдегід Методика є такою ж, як і у Приготуванні 1, замінюючи морфолін на (3аR, 6аS)-гексагідроциклопента[с]пірол. + Mac-спектрометрія (ES+, m/z): 219, 1481 (М+Н) Приготування 13: 4-Піперидин-1-ілметил-1Н-пірол-2-карбальдегід Методика є такою ж, як і у Приготуванні 1, замінюючи морфолін на (3aR, 6аS)-гексагідроциклопента[с]пірол. + Mac-спектрометрія (ES+, m/z): 193, 1349 (М+Н) 7 UA 105357 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приготування 14: 4-Діетиламінометил-1Н-пірол-2-карбальдегід Методика є такою ж, як і у Приготуванні 1, замінюючи морфолін на діетиламін. + Mac-спектрометрія (ES+, m/z): 181, 1342 (М+Н) Приготування 15: 4-((3aR, 6аS)-Гексагідро-циклопента[с]пірол-2(1Н)-ілметил)-3,5-диметил1Н-пірол-2-карбальдегід Методика є такою ж, як і у Приготуванні 3, замінюючи (1R, 5S)-3-азабіцикло[3.1.0]гексан на (3аR, 6аS)-гексагідро-циклопента[с]пірол. + Mac-спектрометрія (ES+, m/z): 247, 1785 (М+Н) Приготування 16: 5-Морфолін-4-ілметил-1Н-пірол-3-карбальдегід Методика є такою ж, як і у Приготуванні 1, замінюючи 1Н-пірол-2-карбальдегід на 1Н-пірол3-карбальдегід. + Mac-спектрометрія (ES+, m/z): 195, 1133 (М+Н) Приготування 17: 5-((1R, 5S)-3-аза-біцикло[3.1.0]гекс-3-илметил)-1Н-пірол-3-карбальдегід Методика є такою ж, як і у Приготуванні 1, замінюючи 1Н-пірол-2-карбальдегід на 1Н-пірол3-карбальдегід і замінюючи морфолін на (1R, 5S)-3-аза-біцикло[3.1.0]гексан. + Mac-спектрометрія (ES+, m/z): 191, 1175 (М+Н) Приготування. 18: 4-[2-(Піролідин-1-іл)етил]-1Н-пірол-2-карбальдегід Стадія А: 2,2,2-Трихлор-1-(1Н-пірол-2-іл)етанон До розчину трихлорацетил хлориду (160,7 ммоль) в етиловому ефірі (26 мл) додають, краплями, протягом 3 годин, розчин піролу (149 ммоль) в етиловому ефірі (83 мл). Після перемішування протягом наступної години, краплями додають розчин карбонату калію (94 ммоль) у воді (39 мл). Фази розділяють і органічну фазу висушують над сульфатом натрію і фільтрують. До органічної фази додають активоване вугілля. Після перемішування протягом 5 хвилин, органічну фазу фільтрують і випаровують досуха для одержання вказаного у заголовку продукту. Стадія В: 5-(Трихлорацетил)-1Н-пірол-3-карбальдегід До розчину сполуки, одержаної на Стадії А, (87 ммоль) і АlСl3 в суміші DCM/нітрометан (80 мл/80 мл) додають, краплями, при 30 °C, дихлор-метоксиметан (130,5 ммоль). Після перемішування протягом двох годин, реакційну суміш вливають у 800 мл льодяної води. Водну фазу екстрагують AcOEt, і потім органічні фази об'єднують. Органічну фазу промивають насиченим водним розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха для одержання вказаного у заголовку продукту (кристали коричневого кольору), який використовують безпосередньо на наступній Стадії. Стадія С: Етил 4-форміл-1Н-пірол-2-карбоксилат До розчину сполуки, одержаної на Стадії В, (83,7 ммоль) в етанолі (200 мл) додають, краплями і протягом 20 хвилин, розчин етанолату натрію (13,4 ммоль) в етанолі (45 мл) при температурі навколишнього середовища. Після перемішування протягом 3 годин, суміш випаровують досуха і потім повертають в етиловий ефір (200 мл). До цієї органічної фази додають водний 2N розчин НСl (150 мл) і одержану суміш перемішують; фази потім розділяють і водну фазу екстрагують етиловим ефіром. Органічну фазу промивають насиченим водним розчином NaHCO3 і насиченим водним розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха для одержання вказаного у заголовку продукту (кристали коричневого кольору), який використовують безпосередньо на наступній Стадії. Стадія D: Етил 4-[(диметиламіно)метил]-1 Н-пірол-2-карбоксилат До розчину сполуки, одержаної на Стадії С, диметиламіну (1,1 екв.) додають, порціями, NaBH(OAc)3 (952 мг). Суміш перемішують протягом ночі при температурі навколишнього середовища. Після випаровування досуха, залишок повертають у СН2Сl2 і воду. Водну фазу екстрагують СН2Сl2. Органічні фази об'єднують і потім екстрагують водним 1N розчином НСl. Водну фазу підлуговують і потім екстрагують СН2Сl2. Органічну фазу висушують над сульфатом магнію, фільтрують і випаровують досуха для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія. Е: [5-(Етоксикарбоніл)-1Н-пірол-3-іл]-N, N,N-триметил-метанамініййодид До розчину продукту, одержаного на Стадії D, (0,3 г) в суміші тетрагідрофурану (2,2 мл) і СН2Сl2 (2,2 мл) додають метилйодид (0,350 мл). Випадає осад. Реакційну суміш перемішують протягом однієї години при температурі навколишнього середовища і потім залишають при 4 °C протягом ночі. Реакційну суміш випаровують досуха і одержаний залишок використовують безпосередньо на наступній Стадії. Стадія F: Етил 4-(ціанометил)-1Н-пірол-2-карбоксилат Розчин продукту, одержаного на Стадії Е, і ціаніду натрію (0,225 г) в етанолі нагрівають зі зворотним холодильником протягом 72 годин. Після випаровування досуха, залишок 8 UA 105357 C2 5 10 15 20 25 30 35 40 45 50 55 60 повертають в суміш СН2Сl2/вода. Водну фазу екстрагують тричі СН2Сl2. Органічні фази об'єднують. Органічну фазу висушують над сульфатом магнію, фільтрують і випаровують досуха для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Step G: Етил 4-(2-аміноетил)-1Н-пірол-2-карбоксилат До розчину продукту, одержаного на Стадії F, (7,45 г) у МеОН (1,5 л) додають 223 мл 1,4N розчину NH3 в МеОН і РO2 (5,2 г). Реакційну суміш вміщують в атмосферу водню і потім перемішують протягом 20 годин при температурі навколишнього середовища. Після фільтрування і випаровування досуха, одержаний залишок очищують на силікагелі (SiO2: градієнт СН2Сl2/МеОН з додаванням 1,4N NH3 у МеОН) для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія Н: Етил 4-[2-(піролідин-1-іл)етил)-1Н-пірол-2-карбоксилат До розчину продукту, одержаного на Стадії G, (1,3 г) в DMF (134 мл) додають 2,6-лютидин (4,15 мл) і 1,4-дибром-бутан (4,68 мл). Реакційну суміш перемішують при 80 °C протягом 12 годин і при температурі навколишнього середовища протягом ночі. Реакційну суміш розбавляють 600 мл етилацетату. Органічну фазу промивають насиченим водним розчином NaHCO3, водою і насиченим водним розчиномNaCl, висушують над сульфатом магнію, фільтрують і випаровують досуха. Одержаний залишок очищують на силікагелі (SiO2: градієнт СН2Сl2/МеОН з додаванням 1,4N NH3 у МеОН) для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія І: {4-[2-(Піролідин-1-іл)етил)-1Н-пірол-2-іл}метанол До розчину продукту, одержаного на Стадії Н, (0,2 г) у THF (10 мл) при 0 °C додають, порціями, алюмогідрид літію. Після перемішування протягом 3 годин при температурі навколишнього середовища, реакційну суміш гідролізують при 0 °C водним розчином NaOH і водою. Після фільтрування, фільтрат випаровують досуха і одержаний залишок очищують на силікагелі (SiO2: градієнт СН2Сl2/МеОН з додаванням 1,4N NH3 у МеОН) для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія J: 4-[2-(Піролідин-1-іл)етил)-1Н-пірол-2-карбальдегід До розчину продукту, одержаного на Стадії І, (0,09 г) в THF (3,8 мл) додають активований МnО2 (0,315 г). Після перемішування протягом 20 годин при температурі навколишнього середовища, суміш фільтрують і фільтрат випаровують досуха для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Приготування. 19: 4-[2-(Морфолін-4-іл)етил)-1Н-пірол-2-карбальдегід Вказаний у заголовку продукт одержують, як описано у Приготуванні 18, замінюючи 1,4дибром-бутан на Стадії Н на 1-бром-2-(2-брометокси)етан. Приготування 20: 5-[(3аR, 6аS)-Гексагідроциклопента[с]пірол-2(1Н)-ілметил)-1Н-пірол-2карбальдегід Методика є такою ж, як і у Приготуванні 1, замінюючи морфолін на (3аR, 6аS)гексагідроциклопента[с]пірол. Mac-спектрометрія (ES+, m/z): 219, 1494 (М+Н) Приготування 21: 4-[(4-Метоксипіперидин-1-іл)метил)-1H-пірол-2-карбальдегід Методика є такою ж, як і у Приготуванні 1, замінюючи морфолін на 4-метокси-піперидин. Приготування 22: 4-(Морфолін-4-ілметил)-1Н-пірол-3-карбальдегід Стадія А: Метил 4-(морфолін-4-ілкарбоніл)-1Н-пірол-3-карбоксилат До розчину 4-(метоксикарбоніл)-1Н-пірол-3-карбонової кислоти (2,35 г) в DMF (49 мл) додають діізопропілетиламін (2,11 мл) і HATU (4,9 мл). Після перемішування протягом 15 хвилин при 40 °C, додають морфолін (1,35 мл). Після перемішування протягом 9 годин при 60 °C і при температурі навколишнього середовища протягом вихідних, суміш розбавляють СН2Сl2 і 1N розчином гідроксиду натрію. Водну фазу екстрагують 3 рази СН 2Сl2 і органічні фази об'єднують. Органічну фазу висушують над сульфатом магнію, фільтрують і випаровують досуха для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Step В: [4-(Морфолін-4-ілметил)-1Н-пірол-3-іл)метанол Вказаний у заголовку продукт одержують, використовуючи методику, розкриту на Стадії І Приготування 18, і починаючи з продукту, одержаного на Стадії А. Стадія С: 4-Морфолін-4-ілметил-1Н-пірол-3-карбальдегід Вказаний у заголовку продукт одержують, використовуючи методику, розкриту на Стадії J Приготування 18, і починаючи з продукту, одержаного на Стадії В. Слідуючи методиці Приготування 1, починаючи з відповідних реагентів, одержують наступне Приготування: 9 UA 105357 C2 5 10 15 20 25 30 35 40 45 50 55 Приготування 23: 4-[(2-Метил-4-морфолініл)метил]-1Н-пірол-2-карбальдегід Приклад 1: 3-[(3-{[4-(4-Морфолінілметил)-1Н-пірол-2-іл]метилен}-2-оксо-2,3-дигідро-1Ніндол-5-іл)метил]-1,3-тіазолідин-2,4-діону гідрохлорид Стадія А: Етил 3-метилсульфаніл-2-оксо-2,3-дигідро-1Н-індол-5-карбоксилат До розчину етил 4-аміно-бензоату (40,0 г) в DCM (900 мл) при -60 °C додають, краплями, етил (метилсульфаніл)ацетат (34,5 мл) в атмосфері азоту. Потім до реакційної суміші краплями додають 29,0 г tBuOCl протягом 25 хвилин, підтримуючи температуру між -60 °C і -55 °C. Після перемішування протягом однієї години при -50 °C, краплями додають триетиламін (15,4 мл). Реакційну суміш доводять до 0 °C і потім краплями додають водний 3М НСІ розчин (485 мл). Після перемішування протягом 12 годин при температурі навколишнього середовища, фази розділяють і органічну фазу промивають послідовно водним 2М розчином НСl, водою і потім насиченим водним розчином NaCl. Органічну фазу висушують над сульфатом натрію, фільтрують і випаровують досуха. Одержаний залишок повертають в ефір. Одержані кристали відфільтровують, промивають ефіром і висушують у вакуумі для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія В: Етил 2-оксо-2,3-дигідро-1Н-індол-5-карбоксилат До розчину сполуки, одержаної на Стадії, А (0,1448 моль) в льодяній оцтовій кислоти (700 мл) додають порошковий цинк (0,8690 моль). Двофазну суміш перемішують при 40 °C протягом 8 годин. Реакційну суміш фільтрують і фільтрат потім випаровують досуха. Залишок перемішують у воді протягом ночі і фільтрують і одержаний осад промивають водою. Продукт повертають в толуол і потім випаровують досуха, і потім повертають в ефір, фільтрують, промивають ефіром і потім висушують у вакуумі при 40 °C під P2OS для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія С: 5-Гідроксиметил-1,3-дигідро-індол-2-он До розчину/суспензії сполуки, одержаної на Стадії В, (66,8 ммоль) у THF (850 мл) при -65 °C додають, краплями, 1М DIBAL-H розчин (546 ммоль) протягом однієї години і в інертній атмосфері. Реакційну суміш доводять до -30 °C протягом 1 години 30 хвилин. Додають 22 мл води краплями і потім 22 мл 15 % водного розчину гідроксиду натрію при 0 °C і потім 55 мл води. До реакційної суміші додають MgSO4 (300 г) і перемішування проводять протягом 30 хвилин. Суспензію фільтрують над целітом і промивають THF. Фільтрат випаровують досуха для одержання в'язкої твердої речовини коричневого кольору. Залишок порошкують в метанолі, і одержаний порошок відфільтровують і висушують у вакуумі для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія D: 5-Гідроксиметил-3-(4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-1,3-дигідроіндол-2-он Розчин сполуки, одержаної на Стадії С, (18 ммоль), і сполуки, одержаної у Приготуванні 1, (19 ммоль) і піперидину (18 ммоль) в етанолі нагрівають зі зворотним холодильником. Через 40 хвилин, реакційну суміш охолоджують на льодяній бані. Утворений осад відфільтровують і промивають холодним етанолом. Одержаний продукт повертають в толуол, нагрівають зі зворотним холодильником протягом 5 хвилин і потім випаровують досуха і висушують у вакуумі для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98/2). + + Mac-спектрометрія (ES+, m/z): 340, 1657 (М+Н) і 340,1668 (М+Н) Стадія Е: 3-[(3-{[4-(4-Морфолінілметил)-1Н-пірол-2-іл)метилен}-2-оксо-2,3-дигідро-1Н-індол5-іл)метил)-1,3-тіазолідин-2,4-діону гідрохлорид 15,4 ммоль тіазолідин-2,4-діону і трифенілфосфіну, що підтримується на смолі, (3 ммоль/г, 30,8 ммоль) перемішують в інертній атмосфері протягом 10 хвилин при температурі навколишнього середовища в безводному THF. Суміш охолоджують на льодяній бані, і додають третбутил азодикарбоксилат (15,4 ммоль). Після перемішування протягом 10 хвилин при 0 °C, додають сполуку, одержану на Стадії D, (10,2 ммоль). Після перемішування протягом 1 години 30 хвилин при 0 °C, суміш фільтрують і смолу промивають THF. Фільтрат випаровують досуха і потім хроматографують на силікагелі. Одержаний продукт повертають в суміш DCM/метанол (4/1) (150 мл), і потім додають 1,25М розчин НСl в етанолі (10 мл). Розчин концентрують до близько 15 мл і потім охолоджують на льодяній бані. Утворені кристали відфільтровують під азотом, промивають холодним етанолом і висушують у вакуумі при 40 °C для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99/1). + + Mac-спектрометрія (ES+, m/z): 439, 1439 (М+Н) і 439,1431 (М+Н) Точка плавлення: 211 °C Елементний мікроаналіз: 10 UA 105357 C2 Теоретично % Експериментально % 5 10 20 25 30 35 40 50 N 11,80 11,78 S 6,75 6,72 Сl 7,46 7,84 С 55,63 56,06 Н 4,88 4,81 N 11,80 11,84 S 6,75 6,99 Сl 7,46 7,48 Приклад 1b: 3-[(3-{[4-(4-Морфолінілметил)-1Н-пірол-2-іл]метилен}-2-оксо-2,3-дигідро-1Ніндол-5-іл)метил]-1,3-тіазолідин-2,4-діон 15,4 ммоль тіазолідин-2,4-діону і трифенілфосфіну, що підтримується на смолі, (3 ммоль/г, 30,8 ммоль) перемішують в інертній атмосфері протягом 10 хвилин при температурі навколишнього середовища в безводному THF. Суміш охолоджують на льодяній бані, і додають третбутил азодикарбоксилат (15,4 ммоль). Після перемішування протягом 10 хвилин при 0 °C, додають сполуку, одержану на Стадії D Прикладу 1 (10,2 ммоль). Після перемішування протягом 1 години 30 хвилин при 0 °C, суміш фільтрують і смолу промивають THF. Фільтрат випаровують досуха і потім хроматографують на силікагелі. + Mac-спектрометрія (ES+, m/z): 439, 1435 (М+Н) Приклад 2: 3-{3-[1-(4-Морфолін-4-ілметил-1Н-пірол-2-іл)-етиліден]-2-оксо-2,3-дигідро-1Ніндол-5-ілметил}-тіазолідин-2,4-діону гідрохлорид Стадія А: 5-Гідроксиметил-3-[1-(4-морфолін-4-ілметил-1Н-пірол-2-іл)-етиліден]-1,3-дигідроіндол-2-он Розчин сполуки, одержаної на Стадії С Прикладу 1, (2,5 ммоль), сполуки, одержаної у Приготуванні 2, (2,9 ммоль) і ацетату амонію (5,2 ммоль) в етанолі (4 мл) нагрівають при 120 °C під мікрохвилями протягом 20 хвилин. Одержаний осад відфільтровують, промивають етанолом і етиловим ефіром і потім висушують у вакуумі для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99 /1). + + Mac-спектрометрія (ES+, m/z): 354, 1799 (М+Н) і 354,1793 (М+Н) Стадія В: 3-{3-[1-(4-Морфолін-4-ілметил-1Н-пірол-2-іл)-етиліден]-2-оксо-2,3-дигідро-1Ніндол-5-ілметил}-тіазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, шляхом конденсування сполуки, одержаної на Стадії А, (1,3 ммоль) і тіазолідин-2,4діону (1,7 ммоль). Продукт, одержаний після обробки, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99/1). + + Mac-спектрометрія (ES+, m/z): 453, 1586 (М+Н) і 453,1600 (М+Н) Точка плавлення: 225 °C Елементний мікроаналіз: Теоретично % Експериментально % 45 Н 4,88 4,73 Приклад 1а: 3-[(3-{[4-(4-Морфолінілметил)-1Н-пірол-2-іл]метилен}-2-оксо-2,3-дигідро-1Ніндол-5-іл)метил]-1,3-тіазолідин-2,4-діону гідрохлорид Вказану у заголовку сполуку одержують шляхом очищення на силікагелі (SiO2; градієнт СН2Сl2/МеОН) сполуки, одержаної на Стадії Е Прикладу 1 перед перетворенням в сіль, і потім перетворюючи гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (1,5/98,5). + + Mac-спектрометрія (ES+, m/z): 439, 1422 (М+Н) і 439,1448 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % 15 С 55,63 55,36 С 56,49 55,90 Н 5,15 5,00 N 11,46 11,06 S 6,56 6,25 Сl 7,25 8,29 Приклад 3: 3-[3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро-1Н-індол-5ілметил)-оксазолідин-2,4-діону гідрохлорид Стадія А: Оксазолідин-2,4-діон До розчину NaOMe (1,05 ммоль) в МеОН (21 мл) додають 2-гідроксіацетамід (1 ммоль) і діетил карбонат (1,15 ммоль), і реакційну суміш потім нагрівають зі зворотним холодильником протягом 1,5 годин. Реакційну суміш випаровують досуха і потім повертають у воді. Водну фазу екстрагують діетиловим ефіром. Водну фазу окислюють (pH 2) і потім випаровують досуха. 11 UA 105357 C2 5 10 Залишок порошкують в AcOEt і фільтрують. Одержаний продукт очищують на силікагелі (сГексан/AcOEt; 1/1) для одержання вказаного у заголовку продукту у формі порошку білого кольору. Стадія В: 3-[3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро-1Н-індол-5ілметил)-оксазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, шляхом конденсування сполуки, одержаної на Стадії D Прикладу 1 (4,8 ммоль), і сполуки, одержаної на Стадії А (7,31 ммоль). Продукт, одержаний після фільтрування реакційної суміші, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії А Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (97/3). + + Mac-спектрометрія (ES+, m/z): 423, 1670 (М+Н) і 423,1697 (М+Н) Точка плавлення: 216 °C Елементний мікроаналіз: 15 Теоретично % Експериментально % 20 25 35 40 45 Н 5,05 4,80 N 12,21 12,21 Сl 7,73 7,96 Приклад 4: 3-{3-[1-(4-Морфолін-4-ілметил-1Н-пірол-2-іл)-етиліден]-2-оксо-2,3-дигідро-1Ніндол-5-ілметил}-оксазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, шляхом конденсування продукту, одержаного на Стадії А Прикладу 2, (1,54 ммоль) і сполуки, одержаної на Стадії А Прикладу 3, (2,31 ммоль). Продукт, одержаний після обробки реакційної суміші, очищують на силікагелі (SiO2; градієнт AcOEt до AcOEt/МеОН, 9/1) і потім перетворюють у гідрохлорид, як описано на Стадії Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99/1). + + Mac-спектрометрія (ES+, m/z): 437, 1816 (М+Н) і 437,1837 (М+Н) Точка плавлення: 220 °C Елементний мікроаналіз: Теоретично % Експериментально % 30 С 57,58 57,55 С 58,41 57,51 Н 5,33 4,84 N 11,85 12,07 Сl 7,50 8,51 Приклад 5: 3-{3-[4-((1R, 5S)-3-аза-біцикло[3.1.0]гекс-3-илметил)-3,5-диметил-1Н-пірол-2ілметилен]-2-оксо-2,3-дигідро-1 Н-індол-5-ілметил}оксазолідин-2,4-діону гідрохлорид Стадія А: 3-[4-((1R, 5S)-3-аза-біцикло[3.1.0]гекс-3-илметил)-3,5-диметил-1Н-пірол-2ілметилен]-5-гідроксиметил-1,3-дигідро-індол-2-он Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії D Прикладу 1, шляхом конденсування сполуки, одержаної на Стадії С Прикладу 1, (0,92 ммоль) і сполуки, одержаної у Приготуванні 3 (1 ммоль), у присутності піперидину в етанолі при 105 °C під дією мікрохвиль. Після фільтрування, одержану тверду речовину очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98/2). + + Mac-спектрометрія (ES+, m/z): 362, 1875 (М-Н) і 362,1883 (М-Н) Стадія В: 3-{3-[4-((1R, 5S)-3-азa-біцикло[3.1.0]гекс-3-илметил)-3,5-диметил-1Н-пірол-2ілметилен]-2-оксо-2,3-дигідро-1Н-індол-5-ілметил}-оксазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, шляхом конденсування сполуки, одержаної на Стадії А, (0,63 ммоль) і оксазолідин2,4-діону (0,95 ммоль). Продукт, одержаний після обробки реакційної суміші, очищують на силікаті (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99 /1). + + Mac-спектрометрія (ES+, m/z): 445, 1865 (М-Н) і 445,1846 (М-Н) Елементний мікроаналіз: 50 Теоретично % Експериментально % С 62,17 61,98 12 Н 5,63 6,28 N 11,60 11,55 Сl 7,34 7,44 UA 105357 C2 5 10 Приклад 6: 1-[3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро-1Н-індол-5ілметил]-піролідин-2,5-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, замінюючи тіазолідин-2,4-діон на піролідин-2,5-діон. Продукт, одержаний після фільтрування реакційної суміші, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (97/3). + + Mac-спектрометрія (ES+, m/z): 421, 1863 (М+Н) і 421,1881 (М+Н) Точка плавлення: 212 °C Елементний мікроаналіз: Теоретично % Експериментально % 15 20 30 Н 5,51 5,37 N 12,26 12,67 Сl 7,76 8,20 Приклад 7: 5,5-Диметил-3-[3-(4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3дигідро-1Н-індол-5-ілметил]-оксазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, замінюючи тіазолідин-2,4-діон на 5,5-диметил-оксазолідин-2,4-діон. Продукт, одержаний після фільтрування реакційної суміші, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (96/4). + + Mac-спектрометрія (ES+, m/z): 451, 1981 (М+Н) і 451,1981 (М+Н) Точка плавлення: 191 °C Елементний мікроаналіз: Теоретично % Експериментально % 25 С 60,46 60,75 С 59,20 59,37 Н 5,59 5,41 N 11,51 11,42 Сl 7,28 7,44 Приклад 8: 1-Метил-3-[3-(4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро1Н-індол-5-ілметил]-імідазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, замінюючи тіазолідин-2,4-діон на 1-метил-імідазолідин-2,4-діон. Продукт, одержаний після фільтрування реакційної суміші, очищують на силікагелі (SiO2; градієнт 20 AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (97,5/2,5). + + Mac-спектрометрія (ES+, m/z): 436, 1981 (М+Н) і 436,2001 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % С 58,54 57,74 Н 5,55 5,28 N 14,84 14,60 Сl 7,51 7,24 35 40 45 50 Приклад 9: 5-(4-Хлор-бензиліден)-3-[3-(4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо2,3-дигідро-1Н-індол-5-ілметил]-тіазолідин-2,4-діону гідрохлорид Стадія А: 5-(4-Хлор-бензиліден)-тіазолідин-2,4-діон Розчин 4-хлор-бензальдегіду (3 ммоль), тіазолідин-2,4-діону (3 ммоль) і піперидину (3 ммоль) в етанолі нагрівають зі зворотним холодильником протягом ночі. Реакційну суміш охолоджують на льодяній бані. Утворені кристали відфільтровують, промивають холодним етанолом і висушують у вакуумі (40 °C) для одержання вказаного у заголовку продукту. + Mac-спектрометрія (ES+, m/z): 237, 9732 (М-Н) Стадія В: 5-(4-Хлор-бензиліден)-3-[3-(4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо2,3-дигідро-1Н-індол-5-ілметил]-тіазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, замінюючи тіазолідин-2,4-діон на сполуку, одержану на Стадії А. Продукт, одержаний після фільтрування реакційної суміші, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98,5/1,5). + + Mac-спектрометрія (ES+, m/z): 561, 1377 (М+Н) і 561,1383 (М+Н) 13 UA 105357 C2 Елементний мікроаналіз: Теоретично % Експериментально % 5 10 15 20 С 58,29 57,79 Н 4,39 4,30 N 9,38 9,25 S 5,37 5,19 Сl 7,51 7,24 Приклад 10: 3-{3-[4-((1R, 5S)-3-аза-біцикло[3.1.0]гекс-3-илметил)-1Н-пірол-2-ілметилен]-2оксо-2,3-дигідро-1Н-індол-5-ілметил}-тіазолідин-2,4-діону гідрохлорид Стадія А: 3-[4-((1R, 5S)-3-аза-біцикло[3.1.0]гекс-3-илметил)-1Н-пірол-2-ілметилен]-5гідроксиметил-1,3-дигідро-індол-2-он Розчин 5-гідроксиметил-1,3-дигідроіндол-2-ону (2,75 ммоль), сполуки, одержаної у Приготуванні 4, (3,30 ммоль) і піперидину (2,75 ммоль) в етанолі нагрівають зі зворотним холодильником. Через 2 години, реакційну суміш випаровують і залишок порошкують в AcOEt. Утворений осад відфільтровують для одержання вказаного у заголовку продукту у формі суміші Z/Е ізомерів (96/4). + + Mac-спектрометрія (ES+, m/z): 336, 1706 (М+Н) і 336,1733 (М+Н) Стадія В: 3-{3-[4-((1R, 5S)-3-аза-біцикло[3.1.0]гекс-3-илметил)-1Н-пірол-2-ілметилен]-2-оксо2,3-дигідро-1Н-індол-5-ілметил}-тіазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, шляхом конденсування сполуки, одержаної на Стадії В, (2,02 ммоль) і 5-(4хлорбензиліден)-тіазолідин-2,4-діону (3,04 ммоль). Продукт, одержаний після фільтрування реакційної суміші, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (97/3). + + Mac-спектрометрія (ES+, m/z): 435, 1486 (М+Н) і 435,1493 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % С 58,66 57,82 Н 4,92 4,84 N 11,90 11,58 S 6,81 6,60 Сl 7,53 7,59 25 30 Приклад 11: 3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксо-[1,3,4]тіадіазол-3ілметил)-1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, замінюючи тіазолідин-2,4-діон на 3Н-[1,3,4]тіадіазол-2-он. Продукт, одержаний після фільтрування реакційної суміші, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (97/3). + + Mac-спектрометрія (ES+, m/z): 424, 1437 (М+Н) і 424,1459 (М+Н) Елементний мікроаналіз: 35 Теоретично % Експериментально % 40 45 50 С 54,84 54,60 Н 4,82 4,65 N 15,23 15,07 S 6,97 6,89 Сl 7,71 7,72 Приклад 12: 5,5-Диметил-3-[3-(4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3дигідро-1Н-індол-5-ілметил]-тіазолідин-2,4-діону гідрохлорид Стадія А: 5,5-Диметил-тіазолідин-2,4-діон 41,4 ммоль метил 2-бром-2-метил-пропіонату і 4,56 ммоль тіосечовини розчиняють в n-бутанолі (90 мл) і перемішують при 110 °C протягом 5 годин. Розчинник випаровують досуха і залишок повертають в етанол (120 мл) і НСl (2N, 120 мл) і потім нагрівають зі зворотним холодильником протягом 16 годин. Етанол випаровують і суміш розбавляють водою (120 мл) і потім екстрагують AcOEt. Органічну фазу промивають насиченим розчином NaCl, висушують над сульфатом магнію, фільтрують і випаровують досуха. Одержані кристали промивають пентаном, відфільтровують і висушують у вакуумі для одержання вказаного у заголовку продукту. Точка плавлення: 76,6 °C Стадія В: 5,5-Диметил-3-[3-(4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро1Н-індол-5-ілметил]-тіазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, замінюючи тіазолідин-2,4-діон на сполуку, одержану на Стадії А. Продукт, 14 UA 105357 C2 5 одержаний після фільтрування реакційної суміші, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (95/5). + + Mac-спектрометрія (ES+, m/z): 467, 1754 (М+Н) і 467,1750 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % 10 15 25 30 35 Н 5,41 5,27 N 11,14 11,58 S 6,37 6,30 СI 7,05 7,48 Приклад 13: 5-Ізопропіліден-3-[3-(4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3дигідро-1Н-індол-5-ілметил]-тіазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, замінюючи тіазолідин-2,4-діон на 5-ізопропіліден-тіазолідин-2,4-діон. Продукт, одержаний після фільтрування реакційної суміші, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99/1). + + Mac-спектрометрія (ES+, m/z): 479, 1739 (М+Н) і 479,1744 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % 20 С 57,31 56,99 С 58,30 58,09 Н 5,28 5,19 N 10,88 10,81 S 6,23 6,35 Сl" 6,88 6,58 Приклад 14: 3-[3-(1-Метил-4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-окос-2,3-дигідро1Н-індол-5-ілметил]-тіазолідин-2,4-діону гідрохлорид Стадія А: 5-Гідроксиметил-3-(1 -метил-4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-1,3дигідро-індол-2-он Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії D Прикладу 1, шляхом конденсування 5-гідроксиметил-1,3-дигідро-індол-2-он (1,31 ммоль) і сполуки, одержаної у Приготуванні 6 (1,44 ммоль) у присутності піперидину в етанолі при 105 °C під дією мікрохвиль. Після випаровування досуха, залишок очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (65/35). + + Мас-спектометрія (ES+, m/z): 354,1791 (M+H) і 354,1802 (М+Н) Стадія В: 3-[3-(1-Метил-4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро-1Ніндол-5-ілметил]тіазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, шляхом конденсування сполуки, одержаної на Стадії А, (0,88 ммоль) і тіазолідин2,4-діону (1,32 ммоль). Продукт, одержаний після фільтрування реакційної суміші, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (30/70). + + Mac-спектрометрія (ES+, m/z): 453, 1607 (М+Н) і 453,1585 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % С 56,49 56,29 Н 5,15 4,96 N 11,46 11,01 S 6,56 6,68 Сl 7,25 7,23 40 45 50 Приклад. 15: 3-{3-[1-(4-Морфолін-4-ілметил-1Н-пірол-2-іл)-пропіліден]-2-оксо-2,3-дигідро-1Ніндол-5-ілметил}-тіазолідин-2,4-діону гідрохлорид Стадія А: 5-Гідроксиметил-3-[1-(4-морфолін-4-ілметил-1Н-пірол-2-іл)пропіліден]-1,3-дигідроіндол-2-он Розчин 5-гідроксиметил-1,3-дигідро-індол-2-ону (0,22 ммоль), сполуки, одержаної у Приготуванні 5, (0,44 ммоль) і ацетату амонію (0,44 ммоль) у n-бутанолі (4 мл) нагрівають при 150 °C під дією мікрохвиль протягом 1 години. Продукт, одержаний після випаровування реакційної суміші досуха, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (92/8). + + Mac-спектрометрія (ES+, m/z): 368, 1941 (М+Н) і 368,1970 (М+Н) 15 UA 105357 C2 5 10 15 20 Стадія В: 3-{3-[1-(4-Морфолін-4-ілметил-1Н-пірол-2-іл)-пропіліден]-2-оксо-2,3-дигідро-1Ніндол-5-ілметил}-тіазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, шляхом конденсування сполуки, одержаної на Стадії А, (0,96 ммоль) і тіазолідин2,4-діону (1,44 ммоль). Продукт, одержаний після фільтрування реакційної суміші, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98,5 /1,5). + + Mac-спектрометрія (ES+, m/z): 467, 1762 (М+Н) і 467,1782 (М+Н) Приклад 16: 5-(4-Гідроксі-2-оксо-тіазолідин-3-ілметил)-3-(4-морфолін-4-ілметил-1Н-пірол-2ілметилен)-1,3-дигідро-індол-2-он До розчину сполуки, одержаної у Прикладі 1, (1,37 ммоль) в суміші МеОН/діоксан (42 мл/55 мл) додають NaBH4 (2,75 ммоль) при 0 °C. Реакційну суміш перемішують при температурі навколишнього середовища протягом 5 годин. Реакційну суміш випаровують досуха і повертають у воду (20 мл) і потім екстрагують AcOEt (4 × 40 мл). Органічні фази об'єднують. Органічну фазу висушують над сульфатом натрію, фільтрують і випаровують досуха. Залишок очищують на силікагелі (SiO2; градієнт DCM/МеОН) для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (94,5/5,5). + + Mac-спектрометрія (ES+, m/z): 441, 1608 (М+Н) і 441,1621 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % 25 30 35 40 45 50 55 С 59,98 59,86 Н 5,49 5,58 N 12,72 12,56 S 7,28 6,93 Приклад 17: 3-[3-(1-Метил-5-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро1Н-індол-5-ілметил]-тіазолідин-2,4-діону гідрохлорид Стадія А: 5-Гідроксиметил-3-(1-метил-5-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-1,3дигідро-індол-2-он Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії D Прикладу 1, шляхом конденсування 5-гідроксиметил-1,3-дигідро-індол-2-он (1,84 ммоль) і сполуки, одержаної у Приготуванні 6, (2,02 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником протягом 4 годин. Продукт, одержаний після випаровування реакційної суміші досуха, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (22/78). + + Mac-спектрометрія (ES+, m/z): 354, 1860 (М+Н) і 376,1577 (М+Н) Стадія В: 3-[3-(1-Метил-5-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро-1Ніндол-5-ілметил]-тіазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, шляхом конденсування сполуки, одержаної на Стадії А, (1,63 ммоль) і тіазолідин2,4-діону (2,69 ммоль). Продукт, одержаний після обробки, очищують на силікагелі (SiO2; градієнт DCM/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (30/70). + + Mac-спектрометрія (ES+, m/z): 453, 1600 (М+Н) і 453,1559 (М+Н) Приклад 18: 3-[3-(5-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро-1Н-індол5-ілметил]-тіазолідин-2,4-діону гідрохлорид Стадія А: 5-Гідроксиметил-3-(5-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-1,3-дигідро-індол2-он Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії D Прикладу 1, шляхом конденсування 5-гідроксиметил-1,3-дигідро-індол-2-ону (1,53 ммоль) і сполуки, одержаної у Приготуванні 7 (1,53 ммоль), у присутності піперидину в етанолі при нагріванні зі зворотним холодильником протягом 3 годин. Утворений осад відфільтровують і промивають етанолом. Одержаний продукт висушують у вакуумі для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів 10 (99,8/0,2). Стадія В: 3-[3-(5-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро-1Н-індол-5ілметил]-тіазолідин-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 1, шляхом конденсування сполуки, одержаної на Стадії А (1,21 ммоль) і тіазолідин2,4-діону (1,82 ммоль). 16 UA 105357 C2 Продукт, одержаний після обробки, очищують на силікагелі (SiO2; градієнт DCM/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 1, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99,5/0,5). Елементний мікроаналіз: 5 Теоретично % Експериментально % 10 15 20 25 30 35 40 45 50 55 С 55,63 55,05 Н 4,88 4,81 N 11,80 11,93 S 6,75 6,65 Сl 7,46 7,65 Приклад 19: 3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксо-оксазолідин-3ілметил)-1,3-дигідро-індол-2-ону гідрохлорид Стадія А: 3-(4-Нітро-бензил)-оксазолідин-2-он До суспензії NaH (60 % як дисперсії в олії, 0,34 моль) у безводному THF (60 мл) при 0 °C додають, краплями, розчин оксазолідин-2-ону (0,31 мол) в інертній атмосфері. Реакційну суміш доводять до температури навколишнього середовища і перемішують протягом однієї години. Розчин 1-бромметил-4-нітро-бензолу (0,35 моль) в суміші THF/DMF (10/1) (250 мл) додають краплями при 0 °C. Реакційну суміш потім перемішують протягом ночі при температурі навколишнього середовища. Розчин потім охолоджують до 0 °C. До нього потім додають, послідовно, 20 мл МеОН і 20 мл води. Одержану суспензію потім концентрують і пізніше виливають у 500 мл води. Розчин потім екстрагують DCM і органічні фази об'єднують. Одержану органічну фазу промивають водою і насиченим водним розчином NaCl, висушують над сульфатом натрію і потім фільтрують. Одержаний фільтрат концентрують і утворену тверду речовину відфільтровують, промивають етиловим ефіром і потім висушують у вакуумі для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія В: 3-(4-Аміно-бензил)-оксазолідин-2-он Розчин сполуки, одержаної на Стадії А, (0,244 моль) і SnCl2-2H2O (1,0 моль) в етанолі (300 мл) перемішують при нагріванні зі зворотним холодильником протягом 20 хвилин. Розчин доводять до 0 °C і підлуговують при pH=10-12 водним розчином гідроксиду натрію; додають 500 мл DCM і одержану емульсію фільтрують над целітом. Фільтрат потім екстрагують DCM (2 × 300 мл); органічні фази об'єднують. Одержану органічну фазу промивають водою і насиченим водним розчином NaCl, висушують над сульфатом натрію і потім фільтрують. Одержаний фільтрат випаровують досуха для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія С: 3-Метилсульфаніл-5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-он До розчину сполуки, одержаної на Стадії В, (0,113 моль) в суміші CH3CN (200 мл) і THF (200 мл) при -60 °C додають, краплями, етил (метилсульфаніл)ацетат (0,136 моль) в атмосфері азоту. tBuOCl (0,136 моль) додають краплями до реакційної суміші протягом 20 хвилин, підтримуючи температуру між -60 °C і -55 °C. Після перемішування протягом однієї години при 50 °C, краплями додають триетиламін (0,152 моль). Реакційну суміш доводять до 0 °C і потім краплями додають водний ЗМ розчин НСl (580 мл). Після перемішування протягом 12 годин при температурі навколишнього середовища, органічні фази випаровують у вакуумі і потім водну фазу екстрагують DCM і органічні фази об'єднують. Одержані органічні фази промивають водою і потім насиченим водним розчином NaCl. Органічну фазу висушують над сульфатом натрію, фільтрують і випаровують досуха. Одержаний продукт перекристалізовують з суміші етиловий ефір/етанол. Одержані кристали відфільтровують, промивають ефіром і висушують у вакуумі при 40 °C для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія D: 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-он До розчину сполуки, одержаної на Стадії С, в льодяній оцтовій кислоті (320 мл) додають порошковий цинк (1 моль). Реакційну суміш перемішують протягом ночі при температурі навколишнього середовища і потім фільтрують. Фільтрат концентрують, і потім додають 100 мл води. Утворену тверду речовину відфільтровують і потім перекристалізовують з етанолу для одержання вказаного у заголовку продукту. + Mac-спектрометрія (ES+, m/z): 233, 0905 (М+Н) Стадія Е: 3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксо-оксазолідин-3-ілметил)1,3-дигідро-індол-2-ону гідрохлорид Розчин сполуки, одержаної на Стадії D, (18,8 ммоль), сполуки, одержаної у Приготуванні 1, (20,7 ммоль) і піперидину (13,2 ммоль) в ЕtOН (100 мл) перемішують при нагріванні зі зворотним холодильником протягом 3 годин і потім при температурі навколишнього 17 UA 105357 C2 5 середовища протягом 12 годин. Одержану тверду речовину жовтого кольору фільтрують водою і етанолом. Одержаний продукт розчиняють в гарячому стані у 300 мл суміші DCM/МеОН (1/1). Розчин доводять до температури навколишнього середовища і додають 40 мл розчину НСl (1,25М) в етанолі. Утворену тверду речовину жовтого кольору відфільтровують під азотом, промивають етиловим ефіром і висушують при 40 °C у вакуумі протягом 12 годин для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99 /1). + + Mac-спектрометрія (ES+, m/z): 409, 1863 (М+Н) і 409,1886 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % С 59,39 60,02 Н 5,66 5,56 N 12,59 12,79 Сl 7,97 8,10 10 15 20 Приклад 20: 3-(5-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксо-оксазолідин-3ілметил)-1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-он (1,5 ммоль) і сполуки, одержаної у Приготуванні 7, (1,65 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Після випаровування реакційної суміші досуха, одержаний залишок очищують за допомогою флеш-хроматографії на силікагелі (SiO2; градієнт с-Гексан/AcOEt). Одержаний продукт перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98,3/1,7). + + Mac-спектрометрія (ES+, m/z): 409, 1881 (М+Н) і 409,1892 (М+Н) Точка плавлення: 195 °C Елементний мікроаналіз: Теоретично % Експериментально % С 59,39 60,03 Н 5,66 5,39 N 12,59 12,65 Сl 7,97 8,14 25 30 35 Приклад 21: 3-(3-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксо-оксазолідин-3ілметил)-1,3-дигідро-індол-2-он Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-он (1,4 ммоль) і сполуки, одержаної у Приготуванні 8, (1,7 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після випаровування досуха, очищують за допомогою хроматографії на силікагелі (SiO2; градієнт DCM до DCM/МеОН 9/1) для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (90/10). + + Mac-спектрометрія (ES+, m/z): 409, 1856 (М+Н) і 409,1867 (М+Н) Точка плавлення: 192 °C Елементний мікроаналіз: С 64,69 64,37 Теоретично % Експериментально % 40 45 50 Н 5,92 5,73 N 13,72 13,73 Приклад 22: 3-[1-(4-Морфолін-4-ілметил-1Н-пірол-2-іл)-етиліден]-5-(2-оксо-оксазолідин-3ілметил)-1,3-дигідро-індол-2-ону гідрохлорид Суміш сполуки, одержаної у Приготуванні 2, (3,22 ммоль), 5-(2-оксо-оксазолідин-3-ілметил)1,3-дигідро-індол-2-ону (2,15 ммоль) і NH4OAc (9,73 ммоль) в етанолі нагрівають під дією мікрохвиль при 110 °C протягом 45 хвилин. Утворений осад відфільтровують і потім суспендують у воді і нагрівають знову протягом 10 хвилин при 110 °C під дією мікрохвиль. Одержану тверду речовину відфільтровують, суспендують в етанолі і нагрівають знову протягом 10 хвилин при 110 °C під дією мікрохвиль. Одержаний продукт перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99,5/0,5). + + Mac-спектрометрія (ES+, m/z): 423, 2012 (М+Н) і 423,2056 (М+Н) Точка плавлення: 212 °C Елементний мікроаналіз: 18 UA 105357 C2 Теоретично % Експериментально % 5 10 15 25 30 35 40 45 50 Н 5,93 5,73 N 12,21 11,82 Сl 7,72 8,00 Приклад 23: 3-(5-Діетиламінометил-1Н-пірол-2-ілметилен)-5-(2-оксо-оксазолідин-3-ілметил)1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону (1,72 ммоль) і сполуки, одержаної у Приготуванні 9, (1,9 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після фільтрування реакційної суміші, очищують за допомогою флеш-хроматографії на силікагелі (SiO2; градієнт 100 % DCM до DCM/МеОН 9/1). Одержаний продукт перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99,5/0,5). + + Mac-спектрометрія (ES+, m/z): 393, 1933 (М+Н) і 393,1933 (М+Н) Точка плавлення: 238 °C Елементний мікроаналіз: Теоретично % Експериментально % 20 С 60,19 59,88 С 61,32 61,44 Н 6,31 6,31 N 13,00 13,37 Сl 8,23 8,33 Приклад 24: (1R, 5S)-3-[3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро1Н-індол-5-ілметил]-3-аза-біцикло[3.1.0]гексан-2,4-діону гідрохлорид Стадія А: 3-Метилсульфаніл-2-оксо-2,3-дигідро-1Н-індол-5-карбонітрил До розчину 4-аміно-бензонітрилу (84,64 ммоль) у DCM (200 мл) в атмосфері азоту, при 78 °C, додають, краплями, tBuOCl (84,64 ммоль), розчинений у 20 мл DCM, і потім, через 10 хвилин, до реакційної суміші краплями додають етил (метилсульфаніл)ацетат (84,64 ммоль), розчинений у 20 мл DCM. Після перемішування протягом однієї години при -78 °C, краплями додають триетиламін (0,152 моль). Реакційну суміш перемішують при температурі навколишнього середовища протягом однієї години. Додають воду і фази розділяють. Органічну фазу промивають водою і потім насиченим водним розчином NaCl. Органічну фазу висушують над сульфатом натрію, фільтрують і випаровують досуха. Залишок додають в етиловий ефір і додають водний 2М розчин НСl. Після перемішування протягом ночі, осад жовтого кольору відфільтровують і висушують у вакуумі для одержання вказаного у заголовку продукту, який використовують безпосередньо у наступній реакції. Стадія В: 2-Оксо-2,3-дигідро-1Н-індол-5-карбонітрил До суспензії нікелю Ренея в THF (100 мл) додають сполуку, одержану на Стадії А, (20 ммоль), розчинену в THF (400 мл). Реакційну суміш перемішують при температурі навколишнього середовища доти, доки вихідний матеріал повністю не зникне. Реакційну суміш потім фільтрують над подушкою целіту і потім випаровують досуха для одержання вказаного у заголовку продукту, який використовують безпосередньо у наступній реакції. Стадія С: 5-Амінометил-1,3-дигідро-індол-2-он Розчин сполуки, одержаної на Стадії В, (35 ммоль) у МеОН (500 мл) додають до 6 мл концентрованої НСl. Реакційну суміш перемішують протягом 3 днів під тиском водню 10 бар. Після фільтрування над целітом, фільтрат випаровують досуха для одержання вказаного у заголовку продукту у формі порошку білого кольору, який використовують безпосередньо у наступній реакції. Стадія Р: (1R, 5S)-3-(2-оксо-2,3-дигідро-1Н-індол-5-ілметил)-3-аза-біцикло[3.1.0]-гексан-2,4діон Розчин сполуки, одержаної на Стадії С, (15 ммоль) і 3-окса-біцикло[3.1.0]гексан-2,4-діону (22,5 ммоль) в оцтовій кислоті (60 мл) нагрівають зі зворотним холодильником протягом 48 годин. Суміш доводять до температури навколишнього середовища і утворену тверду речовину відфільтровують для одержання вказаного у заголовку продукту, який використовують безпосередньо у наступній реакції. + Mac-спектрометрія (ES+, m/z): 257, 0913 (М+Н) Стадія Е: (1R, 5S)-3-[3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-2-оксо-2,3-дигідро-1Ніндол-5-ілметил]-3-аза-біцикло[3.1.0]гексан-2,4-діону гідрохлорид 19 UA 105357 C2 5 Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування сполуки, одержаної на Стадії D, (1,54 ммоль) і сполуки, одержаної у Приготуванні 1, (1,7 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після фільтрування реакційної суміші, перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98,5/1,5). + + Mac-спектрометрія (ES+, m/z): 433, 1857 (М+Н) і 433,1861 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % С 61,47 61,01 Н 5,37 5,50 N 11,95 12,03 Сl 7,56 7,21 10 15 20 25 Приклад 25: 3-(3,5-Диметил-4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксооксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону гідрохлорид Стадія А: 3-(3,5-Диметил-1Н-пірол-2-ілметилен)-5-(2-оксо-оксазолідин-3-ілметил)-1,3дигідро-індол-2-он Розчин 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону (4,3 ммоль), 3,5-диметил-1Н-пірол-2-карбальдегіду (5,17 ммоль) і піперидину (3 ммоль) в етанолі (30 мл) нагрівають зі зворотним холодильником протягом 24 годин. Утворену тверду речовину відфільтровують, промивають етанолом, водою і потім етанолом і висушують у вакуумі для одержання вказаного у заголовку продукту. + Mac-спектрометрія (ES+, m/z): 338, 1485 (М+Н) Стадія В: 3-(3,5-Диметил-4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксооксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону гідрохлорид До розчину сполуки, одержаної на Стадії А, (1,3 ммоль) в оцтовій кислоті (20 мл) додають при 0 °C морфолін (1,43 ммоль) і формальдегід (37 % водн., 1,3 ммоль). Реакційну суміш перемішують протягом ночі при температурі навколишнього середовища. Суміш випаровують досуха і залишок очищують на силікагелі (SiO2; градієнт 100 % DCM до DCM/МеОН 9/1). Одержаний продукт перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99,5/0,5). + + Mac-спектрометрія (ES+, m/z): 435, 2036 (М+Н) і 435,2035 (М+Н) Елементний мікроаналіз: 30 Теоретично % Експериментально % 35 40 45 50 С 60,95 60,13 Н 6,18 5,88 N 11,85 11,81 Сl 7,50 7,70 Приклад 26: 3-[3,5-Диметил-4-(4-метил-піперазин-1-ілметил)-1 Н-пірол-2-ілметилен]-5-(2оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-он дигідрохлорид До розчину сполуки, одержаної на Стадії А Прикладу 25, (1,18 ммоль) в оцтовій кислоті (20 мл) додають при 0 °C 1-метил-піперазин (1,18 ммоль) і формальдегід (37 % водн., 1,18 ммоль). Реакційну суміш перемішують протягом ночі при температурі навколишнього середовища. Після кислотно-лужного екстрагування, одержаний продукт перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Z ізомер. + Mac-спектрометрія (ES+, m/z): 448, 2377 (М+Н) Точка плавлення: 230 °C (розкладання) Приклад 27: 3-(3,5-Диметил-4-піперидин-1-ілметил-1 Н-пірол-2-ілметилен)-5-(2-оксооксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону гідрохлорид До розчину сполуки, одержаної на Стадії А Прикладу 25, (1,48 ммоль) в оцтовій кислоті (20 мл) додають, при 0 °C, піперидин (1,48 ммоль) і формальдегід (37 % водн., 1,48 ммоль). Реакційну суміш перемішують протягом ночі при температурі навколишнього середовища. Після кислотно-лужного екстрагування, одержаний продукт очищують на силікагелі (SiO2; градієнт 100 % DCM до DCM/МеОН 9/1) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98,5 /1,5). + + Mac-спектрометрія (ES+, m/z): 435, 2367 (М+Н) і 435,2382 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % С 63,75 63,79 20 Н 6,63 6,36 N 11,90 11,87 Сl 7,53 7,82 UA 105357 C2 5 10 15 Приклад 28: 3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксо-тіазолідин-3-ілметил)1,3-дигідро-індол-2-ону гідрохлорид Стадія А: 5-(2-Оксо-тіазолідин-3-ілметил)-1,3-дигідро-індол-2-он Вказаний у заголовку продукт одержують як описано на Стадіях А - D Прикладу 19, замінюючи оксазолідин-2-он на тіазолідин-2-он на Стадії А. Стадія В: 3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксо-тіазолідин-3-ілметил)1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування сполуки, одержаної на Стадії А, (1,54 ммоль) і сполуки, одержаної у Приготуванні 1, (1,7 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після фільтрування реакційної суміші, очищують на силікагелі (SiO2; градієнт 100 % DCM до DCM/МеОН 9/1) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99/1). + + Mac-спектрометрія (ES+, m/z): 425, 1633 (М+Н) і 425,1679 (М+Н) Точка плавлення: 244 °C Елементний мікроаналіз: Теоретично % Експериментально % С 57,32 56,55 Н 5,47 5,30 N 12,15 11,80 S 6,96 6,74 Сl 7,69 8,13 20 25 30 Приклад 29: 3-[4-(4-Метил-піперазин-1-ілметил)-1Н-пірол-2-ілметилен]-5-(2-оксооксазолідин-3-ілметил)-1,3-дигідро-індол-2-он дигідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону (1,66 ммоль) і сполуки, одержаної у Приготуванні 10, (2,07 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після випаровування реакційної суміші досуха, очищують на силікагелі (SiO2; градієнт 100 % DCM до DCM/МеОН 9/1) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98/2). + + Mac-спектрометрія (ES+, m/z): 422, 2183 (М+Н) і 422,2198 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % 35 40 45 50 С 55,87 56,15 Н 5,91 5,65 N 14,17 14,30 Сl 14,34 14,22 Приклад 30: 5-[5-(4-Хлор-феніл)-2-оксо-6Н-[1,3,4]тіадіазин-3-ілметил]-3-(4-морфолін-4ілметил-1Н-пірол-2-ілметилен)-1,3-дигідроіндол-2-ону гідрохлорид Стадія А: 5-(4-Хлор-феніл)-3,6-дигідро-[1,3,4]тіадіазин-2-он Суміш 2-бром-1-(4-хлор-феніл)-етанону (90,71 ммоль) і О-етилового ефіру гідразинкарботіокислоти (90,71 ммоль) в ацетонітрилі (84 мл) перемішують при температурі навколишнього середовища протягом 3 годин. Утворену тверду речовину відфільтровують, промивають ацетонітрилом і етиловим ефіром і потім висушують у вакуумі для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія. В: 5-(4-Хлор-феніл)-3-(4-нітро-бензил)-3,6-дигідро-[1,3,4]тіадіазин-2-он До розчину сполуки, одержаної на Стадії А, (57,83 ммоль) в ацетонітрилі (260 мл) додають 1-бромметил-4-нітро-бензол (63,61 ммоль) і карбонат калію (231,32 ммоль). Реакційну суміш перемішують при 80 °C протягом 1 години в атмосфері азоту. Реакційну суміш доводять до температури навколишнього середовища і додають 100 мл води. Проводять екстрагування етиловим ефіром (3 × 350 мл) і органічні фази об'єднують. Одержану органічну фазу висушують над сульфатом натрію, фільтрують і випаровують досуха. Тверду речовину порошкують в етиловому ефірі, відфільтровують і висушують у вакуумі для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія. С: 3-(4-Аміно-бензил)-5-(4-хлор-феніл)-3,6-дигідро-[1,3,4]тіадіазин-2-он Сполуку, одержану на Стадії В, відновлюють в умовах, розкритих тут вище на Стадії В Прикладу 19, для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. 21 UA 105357 C2 5 10 15 20 Стадія D: 5-[5-(4-Хлор-феніл)-2-оксо-6Н-[1,3,4]тіадіазин-3-ілметил]-3-метилсульфаніл-1,3дигідро-індол-2-он До розчину сполуки, одержаної на Стадії С, (38,27 ммоль), в суміші CH3CN (115 мл) і THF (115 мл) при -60 °C, краплями в атмосфері азоту додають етил (метилсульфаніл)ацетат (45,92 ммоль). До реакційної суміші додають краплями tВuОСl (45,92 ммоль) протягом 20 хвилин, підтримуючи температуру між -60 °C і -55 °C. Після перемішування протягом 1 години при 60 °C, краплями додають триетиламін (51,66 ммоль). Реакційну суміш доводять до температури навколишнього середовища. Додають 240 мл DCM і потім водний ЗМ розчин НСl (340 мл). Після перемішування протягом 12 годин при температурі навколишнього середовища, реакційну суміш підлуговують (pH 10-11), використовуючи 20 % водний розчин гідроксиду натрію. Після екстрагування DCM, органічну фазу промивають насиченим водним розчином NaCl. Органічну фазу висушують над сульфатом натрію, фільтрують і випаровують досуха. Одержаний продукт порошкують в етиловому ефірі, фільтрують і висушують у вакуумі для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія Е: 5-[5-(4-Хлор-феніл)-2-оксо-6Н-[1,3,4]тіадіазин-3-ілметил]-1,3-дигідро-індол-2-он Порошковий цинк (18,09 ммоль) додають до розчину сполуки, одержаної на Стадії D, (27,68 ммоль) в льодяній оцтовій кислоті (350 мл). Реакційну суміш перемішують протягом ночі при температурі навколишнього середовища і потім фільтрують. Фільтрат концентрують і потім доводять до pH 8-9 насиченим водним розчином бікарбонату натрію і диспергують за допомогою ультразвуку протягом 5 хвилин. Утворену тверду речовину відфільтровують і потім перекристалізовують з етанолу для одержання вказаного у заголовку продукту. + Mac-спектрометрія (ES+, m/z): 372, 0561 (М+Н) Елементний мікроаналіз: С 58,14 57,38 Теоретично % Експериментально % Н 3,79 3,54 N 11,30 11,12 S 8,62 8,18 25 30 35 Стадія F: 5-[5-(4-Хлор-феніл)-2-оксо-6Н-[1,3,4]тіадіазин-3-ілметил]-3-(4-морфолін-4-ілметил1Н-пірол-2-ілметилен)-1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування сполуки, одержаної на Стадії Е, (1,34 ммоль) і сполуки, одержаної у Приготуванні 1, (1,5 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після фільтрування реакційної суміші, перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98/2). + + Mac-спектрометрія (ES+, m/z): 548, 1517 (М+Н) і 548,1540 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % 40 45 С 57,54 56,56 Н 4,66 4,76 N 11,98 11,61 S 5,49 5,25 Сl 6,07 5,73 Приклад 31: 5-(2-Оксо-оксазолідин-3-ілметил)-3-(4-піролідин-1 -ілметил-1 Н-пірол-2ілметилен)-1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону (1,08 ммоль) і сполуки, одержаної у Приготуванні 11 (1,08 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Після фільтрування, одержану тверду речовину очищують на силікагелі (SiO2; AcOEt/МеОН 7/3) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (97/3). + + Mac-спектрометрія (ES+, m/z): 393, 1899 (М+Н) і 393,1896 (М+Н) Точка плавлення: 204 °C Елементний мікроаналіз: 50 Теоретично % Експериментально % С 61,61 61,33 22 Н 5,87 5,83 N 13,06 13,01 Сl 8,27 8,61 UA 105357 C2 5 10 Приклад 32: 3-[4-((3аR, 6аS)-Гексагідро-циклопента[с]пірол-2-(1Н)-ілметил)-1Н-пірол-2ілметилен]-5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідроіндол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону (1,08 ммоль) і сполуки, одержаної у Приготуванні 12, (1,13 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Після фільтрування, одержану тверду речовину перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (96/4). + + Mac-спектрометрія (ES+, m/z): 433, 2212 (М+Н) і 433,2217 (М+Н) Точка плавлення: 237 °C Елементний мікроаналіз: 15 20 С Н N Сl Теоретично % 64,03 6,23 11,95 7,56 Експериментально % 63,57 6,11 11,92 7,42 Приклад 33: 5-(2-Оксо-оксазолідин-3-ілметил)-3-(4-піперидин-1-ілметил-1Н-пірол-2ілметилен)-1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону (1,08 ммоль) і сполуки, одержаної у Приготуванні 13, (1,13 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Після фільтрування, одержану тверду речовину перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (97/3). + + Mac-спектрометрія (ES+, m/z): 407, 2047 (М+Н) і 407,2053 (М+Н) Точка плавлення: 256 °C Елементний мікроаналіз: Теоретично % Експериментально % С 62,37 62,36 Н 6,14 6,04 N 12,65 12,78 Сl 8,00 7,99 25 30 35 Приклад 34: 3-(4-Діетиламінометил-1Н-пірол-2-ілметилен)-5-(2-оксо-оксазолідин-3-ілметил)1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону (1,08 ммоль) і сполуки, одержаної у Приготуванні 14, (1,08 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Після фільтрування, одержану тверду речовину очищують на силікагелі (SiO2; градієнт AcOEt до AcOEt/МеОН 7/3) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (93/7). + + Mac-спектрометрія (ES+, m/z): 395, 2066 (М+Н) і 395,2082 (М+Н) Точка плавлення: 192 °C Елементний мікроаналіз: Теоретично % Експериментально % 40 45 С 61,61 61,33 н 5,87 5,83 N 13,06 13,01 Сl 8,27 8,61 Приклад 35: 5-[5-(4-Хлор-феніл)-2-оксо-6Н-[1,3,4]тіадіазин-3-ілметил]-3-[1-(4-морфолін-4ілметил-1Н-пірол-2-іл)-етиліден]-1,3-дигідроіндол-2-ону гідрохлорид Суміш сполуки, одержаної на Стадії Е Прикладу 30, (1 ммоль), сполуки, одержаної у Приготуванні 2, (1,5 ммоль) і NH4OAc (4,5 ммоль) в етанолі нагрівають під дією мікрохвиль при 110 °C протягом 20 хвилин. Після фільтрування, одержану тверду речовину очищують на силікагелі (SiO2; градієнт AcOEt до AcOEt/МеОН 9/1) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98/2). + + Mac-спектрометрія (ES+, m/z): 562, 1647 (М+Н) і 562,1666 (М+Н) Елементний мікроаналіз: 50 23 UA 105357 C2 Теоретично % Експериментально % 5 10 С 57,76 57,65 Н 5,47 5,56 N 10,86 10,86 S 4,97 4,88 Приклад 36: 3-[4-((1R, 5S)-3-Аза-біцикло[3.1.0]гекс-3-илметил)-3,5-диметил-1Н-пірол-2ілметилен]-5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідроіндол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону (0,63 ммоль) і сполуки, одержаної у Приготуванні 3, (0,69 ммоль) у присутності піперидину в етанолі при 110 °C під дією мікрохвиль. Після фільтрування, одержану тверду речовину очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (93/7). + + Mac-спектрометрія (ES+, m/z): 431, 2070 (М+Н) і 431,2074 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % С 64,03 64,21 Н 6,23 6,27 N 11,95 12,18 Сl 7,56 7,82 15 20 25 Приклад 37: (1R, 5S)-3-[2-Оксо-3-(4-піперидин-1-ілметил-1Н-пірол-2-ілметилен)-2,3-дигідро1Н-індол-5-ілметил]-3-аза-біцикло[3.1.0]гексан-2,4-діону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії 5 Прикладу 19, шляхом конденсування (1R, 5S)-3-(2-Оксо-2,3-дигідро-1Н-індол-5-ілметил)-3-азабіцикло[3.1.0]гексан-2,4-діону (0,62 ммоль) і сполуки, одержаної у Приготуванні 13, (0,65 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після фільтрування реакційної суміші, перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98,5/1,5). + + Mac-спектрометрія (ES+, m/z): 431, 2056 (М+Н) і 431,2077 (М+Н) Точка плавлення: 198 °C Елементний мікроаналіз: Теоретично % Експериментально % 30 35 40 Н 5,83 5,80 N 12,00 12,16 Сl 7,59 8,18 Приклад 38: 3-[4-((1R, 5S)-3-аза-біцикло[3.1.0]гекс-3-илметил)-1Н-пірол-2-ілметилен]-5-(2оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 3-(5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2ону (1,5 ммоль) і сполуки, одержаної у Приготуванні 4, (1,9 ммоль) у присутності піперидину при нагріванні зі зворотним холодильником етанолу протягом ночі. Продукт, одержаний після фільтрування реакційної суміші, перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (94,5/5,5). + + Mac-спектрометрія (ES+, m/z): 405, 1923 (М+Н) і 405,1926 (М+Н) Точка плавлення: 179 °C Елементний мікроаналіз: Теоретично % Експериментально % 45 С 64,30 63,52 С 62,65 62,45 Н 5,71 5,73 N 12,71 12,88 Сl 8,04 8,75 Приклад 39: 3-[4-((3аR, 6аS)-Гексагідро-циклопента[с)пірол-2(1Н)-ілметил)-3,5-диметил-1Нпірол-2-ілметилен)-5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону (1,72 ммоль) і сполуки, одержаної у Приготуванні 15, (2,06 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Після фільтрування, одержану тверду 24 UA 105357 C2 5 речовину перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (96,5/3,5). + + Mac-спектрометрія (ES+, m/z): 461, 2549 (М+Н) і 461,2566 (М+Н) Точка плавлення: 204 °C Елементний мікроаналіз: С 65,25 64,82 Теоретично % Експериментально % 10 15 20 Н 6,69 6,32 N 11,27 11,21 Сl 7,13 7,24 Приклад 40: 3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксопіперидин-1-ілметил)1,3-дигідро-індол-2-ону гідрохлорид Стадія А: 5-(2-Оксо-піперидин-1-ілметил)-1,3-дигідро-індол-2-он Вказаний у заголовку продукт одержують відповідно до методики Стадій А - D Прикладу 19, використовуючи піперидин-2-он на Стадії А. + Mac-спектрометрія (ES+, m/z): 245, 1275 (М+Н) Стадія В: 3-(4-Морфолін-4-ілметил-1 Н-пірол-2-ілметилен)-5-(2-оксо-піперидин-1-ілметил)1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування сполуки, одержаної на Стадії А, (1,3 ммоль) і сполуки, одержаної у Приготуванні 1, (1,3 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Після фільтрування, одержану тверду речовину перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98,5/1,5). + + Mac-спектрометрія (ES+, m/z): 421, 2222 (М+Н) і 421,2245 (М+Н) Елементний мікроаналіз: С 63,08 63,15 Теоретично % Експериментального Н 6,40 6,25 N 12,26 12,12 Сl 7,76 7,87 25 30 35 40 Приклад 41: 3-{(4-Морфолінілметил)-1Н-пірол-2-іл]метилен}-5-[(1,1-діоксидо-2ізотіазолідиніл)метил]-1,3-дигідро-2Н-індол-2-ону гідрохлорид Стадія А: 5-[(1,1-Діоксидо-2-ізотіазолідиніл)метил]-1,3-дигідро-2Н-індол-2-он Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадіях А - D Прикладу 19, використовуючи ізотіазолідин 1,1-діоксид на Стадії А. + Mac-спектрометрія (ES+, m/z): 267, 0796 (М+Н) Стадія В: 3-{[(4-Морфолінілметил)-1Н-пірол-2-іл]метилен}-5-[(1,1-діоксидо-2ізотіазолідиніл)метил]-1,3-дигідро-2Н-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування сполуки, одержаної на Стадії А, (1,32 ммоль) і сполуки, одержаної у Приготуванні 1, (1,65 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після випаровування реакційної суміші досуха, очищують на силікагелі (SiO2; градієнт AcOEt/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99,5/0,5). + + Mac-спектрометрія (ES+, m/z): 443, 1746 (М+Н) і 443,1758 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % 45 50 С 55,17 54,42 Н 5,68 5,64 N 11,70 11,58 S 6,69 6,55 Сl 7,40 7,50 Приклад 42: 3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксо-піролідин-1-ілметил)1,3-дигідро-індол-2-ону гідрохлорид Стадія А: 5-(2-Оксо-піролідин-1-ілметил)-1,3-дигідро-індол-2-он Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадіях А - D Прикладу 19, використовуючи піролідин-2-он на Стадії А. + Mac-спектрометрія (ES+, m/z): 231, 1120 (М+Н) 25 UA 105357 C2 5 10 15 20 Стадія В: 3-(4-Морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксо-піролідин-1-ілметил)-1,3дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування сполуки, одержаної на Стадії А, (1,63 ммоль) і сполуки, одержаної у Приготуванні 1 (1,95 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після фільтрування, очищують на силікагелі (SiO2; градієнт DCM/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (99,5/0,5). + + Mac-спектрометрія (ES+, m/z): 407, 2056 (М+Н) і 407,2065 (М+Н) Приклад. 43: 3-(1-Метил-4-морфолін-4-ілметил-1Н-пірол-2-ілметилен)-5-(2-оксо-оксазолідин3-ілметил)-1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону (1,31 ммоль) і сполуки, одержаної у Приготуванні 6, (1,44 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після випаровування реакційної суміші досуха, очищують на силікагелі (SiO2; градієнт AcOEt / МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (33/66). + Mac-спектрометрія (ES+, m/z): 423, 2034 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % 25 30 35 40 45 50 55 С 60,19 59,54 Н 5,93 5,73 N 12,21 12,09 Сl 7,72 8,10 Приклад 44: 3-[4-((1R, 5S)-3-азa-біциклo[3.1.0]гекс-3-илметил)-1Н-пірол-2-ілметилен]-5-[5-(4хлор-феніл)-2-оксо-6Н-[1,3,4]оксадіазин-3-ілметил]-1,3-дигідро-індол-2-ону гідрохлорид Стадія А: 1-(4-Хлор-феніл)-2-гідроксі-етанон Суміш 2-бром-1-(4-хлор-феніл)-етанону (100 ммоль) і форміату калію (130 ммоль) у МеОН (100 мл) перемішують при нагріванні зі зворотним холодильником протягом 3 годин. Реакційну суміш виливають на подрібнений лід. Утворену тверду речовину відфільтровують, промивають холодним МеОН і потім висушують у вакуумі для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія. В; Етил N’-[1-(4-хлор-феніл)-2-гідроксі-етиліден]-гідразинкарбоксилат Суміш сполуки, одержаної на Стадії А, (195 ммоль) і етил гідразинкарбоксилату (224 ммоль) в етанолі перемішують при нагріванні зі зворотним холодильником протягом 18 годин. Реакційну суміш охолоджують до 0 °C і утворений осад відфільтровують, промивають етиловим ефіром і висушують у вакуумі для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія С: 5-(4-Хлор-феніл)-3,6-дигідро-[1,3,4]оксадіазин-2-он Додають гідрид натрію (60 % в олії, 16 ммоль), невеликими порціями і при температурі навколишнього середовища, до розчину сполуки, одержаної на Стадії В, (100,5 ммоль) в етанолі (800 мл). Після проходження реакції протягом 2 годин, реакційну суміш охолоджують до 0 °C і перемішування продовжують протягом 30 хвилин. Утворений осад відфільтровують, промивають холодним етанолом і потім висушують у вакуумі для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. + Mac-спектрометрія (ES+, m/z): 211, 0277 (М+Н) Стадія. D: 5-(4-Хлор-феніл)-3-(4-нітро-бензил)-3,6-дигідро-[1,3,4]оксадіазин-2-он До розчину сполуки, одержаної на Стадії С, (47,48 ммоль) в ацетонітрилі (260 мл) додають 1-бромметил-4-нітро-бензол (52,23 ммоль) і карбонат калію (189,92 ммоль). Реакційну суміш перемішують при нагріванні зі зворотним холодильником протягом 4 годин в атмосфері азоту. Реакційну суміш доводять до температури навколишнього середовища і потім розбавляють 500 мл DCM і 100 мл води. Проводять екстрагування DCM (2 × 200 мл) і потім органічні фази об'єднують. Одержану органічну фазу промивають насиченим розчином NaCl і потім висушують над сульфатом натрію, фільтрують і концентрують до близько 75 мл. Після утворення осаду в суспензії, додають етиловий ефір (150 мл), і перемішування проводять протягом ночі при температурі навколишнього середовища. Осад відфільтровують, промивають етиловим ефіром і висушують у вакуумі для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія. Е: 3-(4-Аміно-бензил)-5-(4-хлор-феніл)-3,6-дигідро-[1,3,4]оксадіазин-2-он 26 UA 105357 C2 5 10 15 20 25 30 35 40 45 Суспензію сполуки, одержаної на Стадії D, (42,02 ммоль) в суміші ЕtOН (350 мл) і оцтової кислоти (26 мл) нагрівають зі зворотним холодильником протягом 5 хвилин. Порошкове залізо (309 ммоль) і FeCl3.6H2O (2,1 ммоль) додають до утвореного в результаті розчину. Реакційну суміш перемішують при нагріванні зі зворотним холодильником протягом ночі. Після випаровування, до залишку додають воду (250 мл) і потім диспергують ультразвуком протягом 2 хвилин. Суміш підлуговують (pH 12), використовуючи водний 2М розчин гідроксиду натрію, потім розбавляють AcOEt (500 мл) і потім фільтрують над целітом. Фази розділяють і водну фазу екстрагують AcOEt. Органічні фази об'єднують. Одержану органічну фазу промивають водою і потім насиченим розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха. Залишок порошкують в етиловому ефірі, фільтрують і висушують у вакуумі для одержання вказаного у заголовку продукту у формі порошку білого кольору, який використовують безпосередньо на наступній Стадії. Стадія F: 5-[5-(4-Хлор-феніл)-2-оксо-6Н-[1,3,4]оксадіазин-3-ілметил]-3-метил-сульфаніл-1,3дигідро-індол-2-он Етил (метилсульфаніл)ацетат (27,31 ммоль) додають краплями до розчину сполуки, одержаної на Стадії Е (23,75 ммоль) в THF (200 мл) при -60 °C в атмосфері азоту. tBuOCl (27,31 ммоль) додають краплями до реакційної суміші протягом 20 хвилин, підтримуючи температуру між -60 °C і -55 °C. Після перемішування протягом 3 годин при -60 °C, краплями додають триетиламін (29,68 ммоль). Реакційну суміш доводять до температури навколишнього середовища; потім додають водний 3М розчин НСl (340 мл) і перемішування проводять протягом наступних 2 годин. Органічну фазу випаровують і водну суспензію екстрагують DCM. Органічні фази об'єднують, потім промивають 2М розчином НСl і потім насиченим розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха. Залишок порошкують в етиловому ефірі, фільтрують і висушують у вакуумі для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія G: 5-[5-(4-Хлор-феніл)-2-оксо-6Н-[1,3,4]оксадіазин-3-ілметил]-1,3-дигідроіндол-2-он Порошковий Zn (157,3 ммоль) додають до розчину сполуки, одержаної на Стадії F, (15,73 ммоль) в льодяній оцтовій кислоті (150 мл). Реакційну суміш перемішують протягом 6 годин і потім фільтрують. Фільтрат випаровують досуха і потім повертають у воду (200 мл) і DCM (400 мл). Фази розділяють і водну фазу екстрагують DCM; органічні фази об'єднують. Одержану органічну фазу промивають водою і потім насиченим розчином NaCl, висушують над сульфатом натрію, фільтрують і випаровують досуха. Одержаний залишок перекристалізовують з етанолу для одержання вказаного у заголовку продукту. + Mac-спектрометрія (ES+, m/z): 356, 0796 (М+Н) Стадія Н: 3-[4-((1R, 5S)-3-аза-біцикло[3.1.0]гекс-3-илметил)-1 Н-пірол-2-ілметилен]5-[5-(4хлор-феніл)-2-оксо-6Н-[1,3,4]оксадіазин-3-ілметил]-1,3-дигідроіндол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування сполуки, одержаної на Стадії G, (1,2 ммоль) і сполуки, одержаної у Приготуванні 4, (1,38 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після випаровування реакційної суміші досуха, очищують на силікагелі (SiO2; градієнт DCM/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (94,5/5,5). + + Mac-спектрометрія (ES+, m/z): 528, 1808 (М+Н) і 528,1803 (М+Н) Елементний мікроаналіз: Теоретично % Експериментально % 50 55 С 61,71 61,91 Н 4,82 4,43 N 12,41 12,51 Сl 6,28 7,52 Приклад 45: 5-[5-(4-Хлор-феніл)-2-оксо-6Н-[1,3,4]оксадіазин-3-ілметил]-3-(4-морфолін-4ілметил-1Н-пірол-2-ілметилен)-1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-[5-(4-хлор-феніл)-2-оксо-6Н-[1,3,4]оксадіазин-3-ілметил]1,3-дигідро-індол-2-ону (1,2 ммоль) і сполуки, одержаної у Приготуванні 1, (1,38 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після випаровування реакційної суміші досуха, очищують на силікагелі (SiO2; градієнт DCM/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (98/2). + + Mac-спектрометрія (ES+, m/z): 532, 1721 (М+Н) і 532,1749 (М+Н) 27 UA 105357 C2 Елементний мікроаналіз: Теоретично % Експериментально % 5 10 15 20 25 30 35 40 45 50 55 С 59,16 58,71 Н 4,79 4,73 N 12,32 12,33 Сl 6,24 6,37 Приклад 46: 3-(5-Морфолін-4-ілметил-1Н-пірол-3-ілметилен)-5-(2-оксо-оксазолідин-3ілметил)-1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону (0,86 ммоль) і сполуки, одержаної у Приготуванні 16, (0,91 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після випаровування реакційної суміші досуха, очищують на силікагелі (SiO2; градієнт DCM/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (78/22). + + Mac-спектрометрія (ES+, m/z): 409, 1883 (М+Н) і 409,1865 (М+Н) Приклад 47: 3-[5-((1R, 5S)-3-азa-біцикло[3.1.0]гекс-3-илметил)-1Н-пірол-3-ілметилен]-5-(2оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону гідрохлорид Вказаний у заголовку продукт одержують відповідно до методики, розкритої на Стадії Е Прикладу 19, шляхом конденсування 5-(2-оксо-оксазолідин-3-ілметил)-1,3-дигідро-індол-2-ону (0,95 ммоль) і сполуки, одержаної у Приготуванні 17, (0,95 ммоль) у присутності піперидину в етанолі при нагріванні зі зворотним холодильником. Продукт, одержаний після випаровування реакційної суміші досуха, очищують на силікагелі (SiO2; градієнт DCM/МеОН) і потім перетворюють у гідрохлорид, як описано на Стадії Е Прикладу 19, для одержання вказаного у заголовку продукту. Суміш Z/Е ізомерів (82/18). + + Mac-спектрометрія (ES+, m/z): 405, 1931 (М+Н) і 405,1931 (М+Н) Приклад 48: 3-(4Морфолін-4-ілметил-1 Н-пірол-2-ілметилен)-5-[2-(2-оксооксазолідин-3-іл)-етил]-1,3-дигідроіндол-2-ону гідрохлорид Стадія А: 2-[2-(4-Нітро-феніл)-етиламіно]-етанол Суміш 1-(2-бром-етил)-4-нітро-бензолу (86,9 ммоль) і 2-аміно-етанолу (869 ммоль) нагрівають при 150 °C під дією мікрохвиль протягом 10 хвилин. Реакційну суміш випаровують досуха і одержаний залишок очищують на силікагелі (SiO2; градієнт DCM/МеОН) для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія В: 3-[2-(4-Нітро-феніл)- етил]-оксазолідин-2-он CDI (89 ммоль) додають до розчину сполуки, одержаної на Стадії А, (44,5 ммоль) і DMAP (44,5 ммоль) у DCM (250 мл). Після перемішування протягом 4 годин при температурі навколишнього середовища, реакційну суміш розбавляють 300 мл DCM і потім промивають 2М розчином НСl (5 × 200 мл). Органічну фазу висушують над сульфатом магнію, фільтрують і випаровують досуха для одержання вказаного у заголовку продукту у формі твердої речовини оранжевого кольору, який використовують безпосередньо на наступній Стадії. Стадія С: 3-[2-(4-Аміно-феніл)етил]-оксазолідин-2-он Pd/C 10 % (500 мг) додають до розчину сполуки, одержаної на Стадії В, (16,6 ммоль) у МеОН (100 мл). Реакційну суміш перемішують при 50 °C під тиском водню 4,5 бар протягом 4 годин. Каталізатор відфільтровують і потім промивають МеОН. Фільтрат випаровують досуха і одержаний продукт порошкують у 10 мл МеОН. Одержану тверду речовину відфільтровують і висушують у вакуумі при 40 °C протягом ночі для одержання вказаного у заголовку продукту у формі твердої речовини білого кольору, який використовують безпосередньо на наступній Стадії. Стадія. D: 2-Гідроксііміно-N-{4-[2-(2-оксо-оксазолідин-3-іл)етил]феніл}ацетамід Сульфат натрію (78,3 г) додають до розчину гідрату трихлорацетальдегіду (32,5 ммоль) у воді (100 мл). До одержаної в результаті суспензії додають розчин 3-[2-(4-амінофеніл)етил]оксазолідин-2-ону у воді (20 мл) і концентрований розчин НСl (2,83 мл). Потім додають розчин гідрохлорид гідроксиламіну (95 ммоль) у воді (50 мл). Реакційну суміш нагрівають зі зворотним холодильником протягом двох годин. Суміш потім охолоджують до температури навколишнього середовища. Утворену тверду речовину потім відфільтровують, промивають водою і висушують у вакуумі у присутності Р2О5 і при 40 °C протягом ночі для одержання вказаного у заголовку продукту, який використовують безпосередньо на наступній Стадії. Стадія Е: 5-[2-(2-Око-оксазолідин-3-іл)-етил]-1Н-індол-2,3-діон 28
ДивитисяДодаткова інформація
Автори англійськоюORTUNO Jean-Claude, Cordi, Alexis, LACOSTE Jean-Michel, FEJES Imre, BURBRIDGE Michael, HICKMAN John, PIERRE Alain
Автори російськоюКорди Алексис, Икман Джон
МПК / Мітки
МПК: C07D 413/14, C07D 403/12, C07D 403/14, A61K 31/404, A61P 35/00, C07D 401/12, C07D 401/14, C07D 417/14
Мітки: одержання, спосіб, містять, композиції, сполуки, фармацевтичні, дигідроіндолону
Код посилання
<a href="https://ua.patents.su/41-105357-spoluki-digidroindolonu-sposib-kh-oderzhannya-i-farmacevtichni-kompozici-yaki-kh-mistyat.html" target="_blank" rel="follow" title="База патентів України">Сполуки дигідроіндолону, спосіб їх одержання і фармацевтичні композиції, які їх містять</a>
Попередній патент: Акустооптичний модулятор
Наступний патент: Газовий інжектор з низьким вмістом nox
Випадковий патент: Спосіб одержання апоміктичного насіння капусти білоголової












