Дигідрооксазолобензодіазепінонові сполуки, спосіб їх одержання та фармацевтичні композиції, що їх містять
Номер патенту: 112153
Опубліковано: 10.08.2016
Автори: Ласло Харсінг, Йожеф Баркоці, Майкл Спеддінг, Дьйордь Левай, Ференц Ентоні, Іштван Лінг, Іштван Гачальї
Формула / Реферат
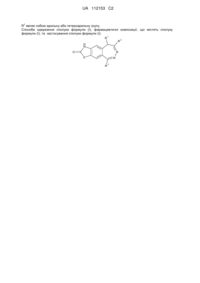
1. Сполука формули (І):
 , (І)
, (І)
де:
R1 являє собою атом водню або нерозгалужену або розгалужену (С1-С4)алкільну групу;
R2 являє собою нерозгалужену або розгалужену (С1-С4)алкільну групу;
R3 являє собою арильну або гетероарильну групу;
або їх ізомери положення, їх енантіомери, їх діастереоізомери, а також їх адитивні солі з фармацевтично прийнятною кислотою та їх сольвати,
при цьому мається на увазі, що:
арильна група являє собою нафтильну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену; нерозгалуженої або розгалуженої (С1-С6)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену; нерозгалуженої або розгалуженої (С1-С6)алкоксигрупи; нерозгалуженої або розгалуженої (С1-С6)алкілкарбонільної групи; карбоксильної групи; нерозгалуженої або розгалуженої (С1-С6)алкоксикарбонільної групи; гідроксильної групи; ціаногрупи; нітрогрупи; амінокарбонільної групи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С1-С6)алкільними групами; або аміногрупи, що є не заміщеною або заміщеною однією або двома нерозгалуженими або розгалуженими (С1-С6)алкільними групами;
гетероарильна група являє собою біциклічну або трициклічну групу, в якій щонайменше одне з кілець є ароматичним, та яка містить від 1 до 3 однакових або різних гетероатомів, вибраних з азоту, кисню та сірки, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену; нерозгалуженої або розгалуженої (С1-С6)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену; нерозгалуженої або розгалуженої (С1-С6)алкоксигрупи; нерозгалуженої або розгалуженої (С1-С6)алкілкарбонільної групи; карбоксильної групи; нерозгалуженої або розгалуженої (С1-С6)алкоксикарбонільної групи; гідроксильної групи; ціаногрупи; нітрогрупи; амінокарбонільної групи, що є не заміщеною або заміщеною однією або більшенерозгалуженими або розгалуженими (С1-С6)алкільними групами; або аміногрупи, що є не заміщеною або заміщеною однією або двома нерозгалуженими або розгалуженими (С1-С6)алкільними групами.
2. Сполука формули (І) за п. 1, де R1 являє собою атом водню.
3. Сполука формули (І) за п. 1, де R2 являє собою метильну групу.
4. Сполука формули (І) за п. 1, де R3 являє собою гетероарильну групу.
5. Сполука формули (І) за п. 1, де R3 являє собою біциклічну ароматичну групу, що містить від 1 до 3 однакових або різних гетероатомів, вибраних з азоту, кисню та сірки, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену; нерозгалуженої або розгалуженої (С1-С6)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену; нерозгалуженої або розгалуженої (С1-С6)алкоксигрупи; нерозгалуженої або розгалуженої (С1-С6)алкілкарбонільної групи; карбоксильної групи; нерозгалуженої або розгалуженої (С1-С6)алкоксикарбонільної групи; гідроксильної групи; ціаногрупи; нітрогрупи; амінокарбонільної групи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С1-С6)алкільними групами; або аміногрупи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С1-С6)алкільними групами.
6. Сполука формули (І) за п. 1, де R3 являє собою бензотієнільну або хінолільну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену та нерозгалуженої або розгалуженої (С1-С4)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену.
7. Сполука формули (І) за п. 1, де R3 являє собою 1-бензотієнільну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену та нерозгалуженої або розгалуженої (С1-С4)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену.
8. Сполука формули (І) за п. 1, де R3 являє собою 1-бензотієн-2-ільну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену та нерозгалуженої або розгалуженої (С1-С4)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену.
9. Сполука формули (І) за п. 1, де R3 являє собою 1-бензотієн-2-ільну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома фтору, атома хлору, трифторметильної групи та метильної групи.
10. Сполука формули (І) за п. 1, яка вибрана з групи:
• 5-(4-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5-h][2,3]-бензодіазепін-2-он;
• 8-метил-5-(6-хіноліл)-1,9-дигідро-2H-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он;
• 5-(1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он;
• 5-(5-хлор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]-бензодіазепін-2-он;
• 5-[3-хлор-4-(трифторметил)-1-бензотієн-2-іл]-8-метил-1,9-дигідро-2Н-[1,3]-оксазоло[4,5-h][2,3]бензодіазепін-2-он;
• 8-метил-5-[4-(трифторметил)-1-бензотієн-2-іл]-1,9-дигідро-2H-[1,3]оксазоло-[4,5-h][2,3]бензодіазепін-2-он;
• 5-(6-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]-бензодіазепін-2-он;
• 5-(7-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]-бензодіазепін-2-он.
11. Спосіб одержання сполуки формули (І) за п. 1, який відрізняється тим, що як початковий матеріал використовують сполуку формули (II):
 , (II)
, (II)
де R1 та R2 є такими, як визначено для формули (І),
де сполуку формули (II), у вільній формі або у формі солі, далі піддають реакції циклізації в присутності 1,1'-карбонілдіімідазолу з одержанням сполуки формули (III):
 , (III)
, (III)
де R1 та R2 є такими, як визначено для формули (І),
яку піддають реакції з відновлювальним реагентом з утворенням сполуки формули (IV):
 , (IV)
, (IV)
де R1 та R2 є такими, як визначено для формули (І),
яку далі обробляють сполукою формули (V):
R3—СНО (V),
де R3 є таким, як визначено для формули (І),
з одержанням сполуки формули (VI):
 , (VI)
, (VI)
де R1, R2 та R3 є такими, як визначено для формули (І),
яку далі обробляють окиснювачем, з наступним утворенням солі, з одержанням сполуки формули (VII):
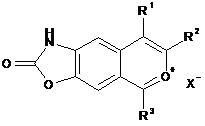 , (VII)
, (VII)
де R1, R2 та R3 є такими, як визначено для формули (І), та X являє собою протиіон, такий як СlO4-, Сl-, Br-, HSO4-,
яку далі обробляють гідразином з одержанням сполуки формули (І),
де сполука формули (І) далі може бути очищена відповідно до стандартної методики розділення, перетворена, забажанням, на адитивні солі з фармацевтично прийнятною кислотою, та за необхідності розділена на ізомери, якщо такі існують, відповідно до стандартної методики розділення.
12. Спосіб одержання сполук формули (І) за п. 1, який відрізняється тим, що як початковий матеріал використовують сполуку формули (VIII):
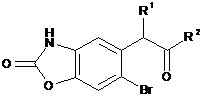 , (VIII)
, (VIII)
де R1 та R2 є такими, як визначено для формули (І),
для якої здійснюють стадію введення захисної групи для карбонільної групи, з одержанням сполуки формули (IX):
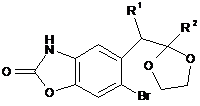 , (IX)
, (IX)
де R1 та R2 є такими, як визначено вище,
яку далі обробляють сполукою формули (X):
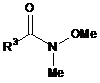 , (X)
, (X)
де R3 є таким, як визначено для формули (І),
з одержанням сполуки формули (XI):
 , (XI)
, (XI)
де R1, R2 та R3 є такими, як визначено для формули (І),
яку далі піддають реакції циклізації з одержанням сполуки формули (VII):
 , (VII)
, (VII)
де R1, R2 та R3 є такими, як визначено для формули (І), та X являє собою протиіон, такий як СlO4-, Сl-, Br-, HSO4-,
яку далі обробляють гідразином з одержанням сполуки формули (І),
де сполука формули (І) далі може бути очищена відповідно до стандартної методики розділення, перетворена, за бажанням, на адитивні солі з фармацевтично прийнятною кислотою, та за необхідності розділена на ізомери, якщо такі існують, відповідно до стандартної методики розділення.
13. Фармацевтична композиція, що містить як активний інгредієнт сполуку за будь-яким з пп. 1-10 у сполученні з одним або більше інертними, нетоксичними, фармацевтично прийнятними носіями.
14. Фармацевтична композиція за п. 13 для застосування в лікуванні або профілактиці шизофренії, монополярної депресії, хвороби Альцгеймера, судинної деменції, розладів аутистичного спектра, синдрому Дауна, синдрому Мартіна-Белл, хвороби Паркінсона, хвороби Хантінгтона, генералізованої тривожності, панічного розладу з агорафобією або без неї, обсесивно-компульсивного розладу, посттравматичних стресових розладів, біполярних розладів, наслідків мозково-судинної катастрофи та наслідків травми головного мозку, спинного мозку або довгастого мозку.
15. Застосування сполук формули (І) за будь-яким з пп. 1-10 у виробництві лікарських засобів для застосування в лікуванні або профілактиці шизофренії, монополярної депресії, хвороби Альцгеймера, судинної деменції, розладів аутистичного спектра, синдрому Дауна, синдрому Мартіна-Белл, хвороби Паркінсона, хвороби Хантінгтона, генералізованої тривожності, панічного розладу з агорафобією або без неї, обсесивно-компульсивного розладу, посттравматичних стресових розладів, біполярних розладів, наслідків мозково-судинної катастрофи та наслідків травми головного мозку, спинного мозку або довгастого мозку.
16. Сполука формули (І) за будь-яким з пп. 1-10 для застосування в лікуванні або профілактиці шизофренії, монополярної депресії, хвороби Альцгеймера, судинної деменції, розладів аутистичного спектра, синдрому Дауна, синдрому Мартіна-Белл, хвороби Паркінсона, хвороби Хантінгтона, генералізованої тривожності, панічного розладу з агорафобією або без неї, обсесивно-компульсивного розладу, посттравматичних стресових розладів, біполярних розладів, наслідків мозково-судинної катастрофи та наслідків травми головного мозку, спинного мозку або довгастого мозку.
Текст
Реферат: Сполуки формули (І): R 1 R H N 2 N O O N R 3 , (І) де: 1 R являє собою атом водню або алкільну групу; 2 R являє собою алкільну групу; (72) Винахідник(и): Іштван Лінг (HU), Йожеф Баркоці (HU), Майкл Спеддінг (FR), Ференц Ентоні (GB), Іштван Гачальї (HU), Дьйордь Левай (HU), Ласло Харсінг (HU) (73) Власник(и): ЛЕ ЛАБОРАТУАР СЕРВЬЄ, 35, rue de Verdun, 92284 Suresnes Cedex, France (FR), ЕГІШ ДЬЙОДЬСЕРДЬЯР НІРТ, Kereszturi Ut 30-38, H-1106 Budapest, Hungary (HU) (74) Представник: Петошевіч Діна Анатоліївна, реєстр. №284 (56) Перелік документів, взятих до уваги експертизою: WO 01/04122 A2 (EGYT GYOGYSZERVEGYESZETI GYAR [HU]; GREFF ZOLTAN [HU]; SZABO GEZA [HU]), 18.01.2001 WO 99/07708 A1 (EGYT GYOGYSZERVEGYESZETI GYAR [HU]; BARKOCZY JOZSEF [HU]; CSELENYAK), 18.02.1999 СПОЛУКИ, СПОСІБ ЇХ ОДЕРЖАННЯ UA 112153 C2 (12) ТА UA 112153 C2 3 R являє собою арильну або гетероарильну групу. Способи одержання сполуки формули (І), фармацевтичні композиції, що містять сполуку формули (І), та застосування сполуки формули (І). R 1 R H N N O O N R 3 2 UA 112153 C2 5 10 15 20 25 30 35 Даний винахід стосується нових 1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2онових сполук, способу їх одержання та фармацевтичних композицій, що їх містять. γ-Аміномасляна кислота (або ГАМК) є домінуючим інгібувальним нейромедіатором в центральній нервовій системі ссавців. У прозенцефалоні ГАМК синтезується, в основному, проміжними нейронами, які координують складні нейронні ланцюги за допомогою рецепторів ГАМКА та ГАМКВ. Рецептори ГАМКА являють собою іонотропні гетеропентамерні канали хлоридів, що містять білкові субодиниці α (6 генів), β (3 гени) та γ (3 гени) у співвідношенні 2:2:1. Бензодіазепіни підсилюють дію ГАМК на рецептори ГАМКА шляхом взаємодії із сайтами зв'язування з модулятором. Неселективні бензодіазепінові агоністи здійснюють седативну, снодійну, анксіолітичну, протисудомну, амнестичну, антиноцицептивну та міорелаксантну дію. Генетичні експерименти з активацією показали, що субодиниця α1 відповідає за седативну дію, тоді як субодиниці α2 і, можливо, α3 відповідають за анксіолітичну дію бензодіазепінових агоністів. Ліганди сайтів зв'язування з бензодіазепінами, які здійснюють протилежну дію засобами зменшення активації рецептора ГАМКА, спричиненої ГАМК, називають «зворотними агоністами». Такі сполуки демонструють сприятливу дію при когнітивних розладах; однак, побічні проконвульсивні та анксіогенні ефекти перешкодили проведенню додаткових, більш детальних клінічних випробувань вказаних сполук. Функції рецептора ГАМКА, що містить субодиницю α5, визначені не так добре. У миші видалення або зменшення кількості рецепторів ГАМКА, що містять субодиницю α5, супроводжується покращенням когнітивних функцій. Більше того, лікування селективним відносно α5 зворотним агоністом здійснює покращений прокогнітивний вплив на деякі моделі гризунів, тоді як у людини спостерігався прокогнітивний вплив на погіршення пам'яті, спричинене алкоголем. Існує велика незадоволена потреба у лікуванні когнітивних дефіцитів, що супроводжують різноманітні, пов'язані з віком захворювання, нейродегенеративні або судинні розлади, а також шизофренію. Існуючі засоби лікування хвороби Альцгеймера, найбільш розповсюдженої патології, базуються або на інгібуванні холінестерази (наприклад, донепезил) або на антагонізмі N-метил-D-аспартату (мемантин). Однак, інгібітори холінестерази спричиняють велику кількість побічних ефектів, пов'язаних з їх механізмом дії, а справжня ефективність мемантину обмежена. Таким чином, особливо цінним було б створення нових засобів лікування з більш високою ефективністю та кращою переносимістю. Окрім того факту, що вони є новими, сполуки за даним винаходом володіють особливо цінними властивостями в результаті селективного зв'язування з підтипом рецептора ГАМКА та зменшення впливу ГАМК. Зокрема, даний винахід стосується сполук формули (І): R 1 R H N N O O N R 40 45 50 2 3 , (І) де: 1 - R являє собою атом водню або нерозгалужену або розгалужену (С 1-С4)алкільну групу; 2 - R являє собою нерозгалужену або розгалужену (С1-С4)алкільну групу; 3 - R являє собою арильну або гетероарильну групу; їх позиційних ізомерів, їх енантіомерів, їх діастереоізомерів, а також їх адитивних солей з фармацевтично прийнятною кислотою, їх сольватів, їх комплексів та їх аддуктів. Серед фармацевтично прийнятних кислот можна згадати, не обмежуючись ними, хлористоводневу кислоту, бромистоводневу кислоту, сірчану кислоту, оцтову кислоту, трифтороцтову кислоту, молочну кислоту, малонову кислоту, бурштинову кислоту, глютамінову кислоту, фумарову кислоту, малеїнову кислоту, фосфорну кислоту, лимонну кислоту, щавлеву кислоту, метансульфонову кислоту,бензолсульфонову кислоту, пара-толуолсульфонову кислоту, камфорну кислоту, тощо. Під арильною групою розуміють нафтильну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену; нерозгалуженої або розгалуженої (С1-С6)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену; нерозгалуженої або розгалуженої (С1-С6)алкоксигрупи; нерозгалуженої або розгалуженої (С1-С6)алкілкарбонільної групи; карбоксильної групи; нерозгалуженої або 1 UA 112153 C2 5 10 15 20 25 30 35 40 45 50 55 розгалуженої (С1-С6)алкоксикарбонільної групи; гідроксильної групи; ціаногрупи; нітрогрупи; амінокарбонільної групи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С1-С6)алкільними групами; або аміногрупи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С 1С6)алкільними групами. Під гетероарильною групою розуміють біциклічну або трициклічну групу, в якій щонайменше одне з кілець є ароматичним, та яка містить від 1 до 3 однакових або різних гетероатомів, вибраних з азоту, кисню та сірки, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену; нерозгалуженої або розгалуженої (С1С6)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену; нерозгалуженої або розгалуженої (С1-С6)алкоксигрупи; нерозгалуженої або розгалуженої (С 1С6)алкілкарбонільної групи; карбоксильної групи; нерозгалуженої або розгалуженої (С1С6)алкоксикарбонільної групи; гідроксильної групи; ціаногрупи; нітрогрупи; амінокарбонільної групи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С1-С6)алкільними групами; або аміногрупи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С1-С6)алкільними групами. 1 У сполуках формули (І), R переважно являє собою атом водню. 2 Переважно, сполуки формули (І) являють собою сполуки, де R являє собою метильну групу. 3 Група R переважно являє собою гетероарильну групу. 3 Зокрема, переважні сполуки формули (І), являють собою сполуки, де R являє собою біциклічну ароматичну групу, що містить від 1 до 3 однакових або різних гетероатомів, вибраних з азоту, кисню та сірки, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену; нерозгалуженої або розгалуженої (С 1-С6)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену; нерозгалуженої або розгалуженої (С1-С6)алкоксигрупи; нерозгалуженої або розгалуженої (С 1-С6)алкілкарбонільної групи; карбоксильної групи; нерозгалуженої або розгалуженої (С 1-С6)алкоксикарбонільної групи; гідроксильної групи; ціаногрупи; нітрогрупи; амінокарбонільної групи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С 1-С6)алкільними групами; або аміногрупи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С1-С6)алкільними групами. 3 Переважні сполуки формули (І) являють собою сполуки, де R являє собою бензотієнільну, бензофурильну або хінолільну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену та нерозгалуженої або розгалуженої (С 1С4)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену. 3 Інші переважні сполуки за винаходом являють собою сполуки, де R являє собою 1бензотієнільну або 6-хінолільну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену та нерозгалуженої або розгалуженої (С 1С4)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену. 3 Інша перевага полягає в тому, що R являє собою 1-бензотієнільну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену та нерозгалуженої або розгалуженої (С1-С4)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену. 3 Група R являє собою 1-бензотієн-2-ільну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену та нерозгалуженої або розгалуженої (С1-С4)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену. Переважні замісники в гетероарильній групі являють собою атом галогену, такий як фтор, хлор, бром або йод, більш конкретно, фтор або хлор; трифторметильну групу; або метильну групу. Переважні сполуки за винаходом: -5-(4-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2он; - 8-метил-5-(6-хіноліл)-1,9-дигідро-2H-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он; - 5-(1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5-h[2,3]бензодіазепін-2-он; -5-(5-хлор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2он; -5-[3-хлор-4-(трифторметил)-1-бензотієн-2-іл]-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он; 2 UA 112153 C2 5 10 -8-метил-5-[4-(трифторметил)-1-бензотієн-2-іл]-1,9-дигідро-2Н-[1,3]оксазоло[4,5h]][2,3]бензодіазепін-2-он; -5-(6-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2он; -5-(7-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2он. Адитивні солі з фармацевтично прийнятною кислотою, а також сольвати, комплекси та аддукти переважних сполук за винаходом утворюють невід'ємну частину винаходу. Винахід також стосується способу одержання сполук формули (І), який відрізняється тим, що в ролі початкового матеріалу використовують сполуку формули (II): R 1 R H2 N 2 O HO , (II) 1 2 де R та R є такими, як визначено для формули (І), де сполуку формули (II), у вільній формі або у формі солі, далі піддають реакції циклізації в присутності 1,1'-карбонілдіімідазолу з одержанням сполуки формули (III): R 1 H N R O 15 O O , (III) 1 2 де R та R є такими, як визначено для формули (І), яку піддають реакції з відновлювальним реагентом з утворенням сполуки формули (IV): R 1 H N R O 2 OH O 20 2 (IV), 1 2 де R та R є такими, як визначено для формули (І), яку далі обробляють сполукою формули (V): R3 3 CHO , (V) де R є таким, як визначено для формули (І), з одержанням сполуки формули (VI): R 1 H N R O O O R 25 2 3 R 1 , (VI) де R , R та R є такими, як визначено для формули (І), яку далі обробляють окиснювачем, з наступним утворенням солі, з одержанням сполуки формули (VII): 1 2 3 H N R O + O O R 2 X 3 , (VII) 3 UA 112153 C2 1 5 2 3 де R , R та R є такими, як визначено для формули (І), та X являє собою протиіон, такий як СlO4 , Сl , Вr , HSO4 , яку далі обробляють гідразином з одержанням сполуки формули (І), де сполука формули (І) далі може бути очищена відповідно до стандартної методики розділення, перетворена, за бажанням, на адитивні солі з фармацевтично прийнятною кислотою, та за необхідності розділена на ізомери, якщо такі існують, відповідно до стандартної методики розділення. Переважний варіант стосується способу одержання сполук формули (І), який відрізняється тим, що в ролі початкового матеріалу використовують сполуку формули (III): 1 R H N O 10 O O , (III) 1 2 де R та R є такими, як визначено для формули (І), яку піддають реакції бромування з одержанням сполуки формули (VIII): R 1 H N R O O 15 2 R Br 2 O , (VIII) 1 2 де R та R є такими, як визначено для формули (І), для якої здійснюють стадію введення захисної групи для карбонільної групи, з одержанням сполуки формули (IX): R 1 R H N O O O O 2 Br , (IX) де R та R є такими, як визначено для формули (І), яку далі обробляють сполукою формули (X): 1 2 O R 20 3 N OMe Me , (X) 3 де R є таким, як визначено для формули (І), з одержанням сполуки формули (XI): R 1 R H N O O R 25 O O O 2 3 , (XI) 1 2 3 де R , R та R є такими, як визначено для формули (І), яку далі піддають реакції циклізації з одержанням сполуки формули (VII): 4 UA 112153 C2 R 1 H N R O + O O R 10 15 20 25 30 35 40 45 50 X 3 , (VII) де R , R та R є такими, як визначено для формули (І), та X являє собою протиіон, такий як СlО4 , Сl , Br , HSO4 , яку далі обробляють гідразином з одержанням сполуки формули (І), де сполука формули (І) далі може бути очищена відповідно до стандартної методики розділення, перетворена, за бажанням, на адитивні солі з фармацевтично прийнятною кислотою, та за необхідності розділена на ізомери, якщо такі існують, відповідно до стандартної методики розділення. Сполуки формул (II), (V) та (X) є комерційно доступними або легко доступними фахівцю в даній галузі з використанням традиційних хімічних реакцій або хімічних реакцій, описаних в літературі. Сполуки за даним винаходом є селективними по відношенню до субодиниці α 5 рецептора ГАМКА та зменшують вплив нейромедіатора ГАМК, що робить їх придатними для лікування або профілактики психіатричних та неврологічних розладів, які характеризуються когнітивними дефіцитами, наприклад, шизофренії, монополярної депресії, хвороби Альцгеймера, судинної деменції, розладів аутистичного спектра, синдрому Дауна, синдрому Мартіна-Белл, хвороби Паркінсона, хвороби Хантінгтона. Інші можливі терапевтичні показання стосуються різноманітних тривожних станів, наприклад, генералізованої тривожності, панічного розладу з агорафобією або без неї, обсесивно-компульсивного розладу, посттравматичних стресових розладів та біполярних розладів. Сполуки за винаходом можуть бути застосовані для лікування наслідків мозково-судинної катастрофи та наслідків травми головного, спинного мозку або довгастого мозку. Переважно, сполуки будуть застосовуватися для лікування або профілактики хвороби Альцгеймера, судинної деменції, такої як деменція в результаті наслідків мозково-судинної катастрофи, хвороби Хантінгтона та синдрому Дауна. Винахід також стосується фармацевтичних композицій, що містять як активний інгредієнт щонайменше одну сполуку формули (І), окремо або в сполученні з однією або більше інертними, нетоксичними допоміжними речовинами або носіями. Серед фармацевтичних композицій відповідно до винаходу, зокрема, можна згадати композиції, придатні для перорального, парентерального (внутрішньовенного або підшкірного) або інтраназального введення, таблетки або драже, сублінгвальні таблетки, капсули, таблетки для розсмоктування, супозиторії, креми, мазі, гелі для застосування на шкірі, ін'єкційні препарати та питні суспензії. Придатні дози варіюють відповідно до віку та маси тіла пацієнта, природи і тяжкості розладу, а також способу введення, що може бути інтраназальним, ректальним, парентеральним або пероральним. Загалом, величина однієї дози варіює від 0,1 до 1000 мг/добу для лікування протягом 1-3 прийомів. Результати фармакологічного дослідження даного винаходу будуть розкриті, в тому числі, з посиланням на супроводжувальні графічні зображення, на яких: Фіг. 1 - Прокогнітивний вплив сполуки Прикладу 21 на моделі розпізнавання об'єкта мишами після внутрішньочеревинного введення (приблизно при піковій концентрації); Фіг. 2 - Прокогнітивний вплив сполуки Прикладу 31 на моделі розпізнавання об'єкта мишами після внутрішньочеревинного введення (приблизно при піковій концентрації); Фіг. 3 - Прокогнітивний вплив сполуки Прикладу 36 на моделі розпізнавання об'єкта мишами після внутрішньочеревинного введення (приблизно при піковій концентрації); Фіг. 4 - Зменшення вираженості індукованого кетаміном дефіциту оперативної пам'яті внаслідок введення сполуки Прикладу 21 у щурів після перорального введення; Фіг. 5 - Нейропротекторний вплив сполуки Прикладу 21 на моделі перманентної оклюзії СМА у мишей після внутрішньочеревинного введення. Наведені нижче Приклади ілюструють винахід, не обмежуючи його жодним чином. Структура описаних сполук підтверджена стандартними спектроскопічними методиками (в тому числі протонним ЯМР: вс = великий синглет; с = синглет; д = дублет; т = триплет; дд = дублет дублетів; м = мультиплет). 1 5 2 2 3 5 UA 112153 C2 5 10 15 20 25 30 35 40 45 50 55 60 В описаних нижче Препаративних прикладах одержують початкові сполуки, які використовують для синтезу сполук за винаходом. Препаративний приклад 1: 5-(2-гідроксипропіл)-1,3-бензоксазол-2(3Н)-он Стадія А: 5-(2-оксопропіл)-1,3-бензоксазол-2(3Н)-он До розчину (3-аміно-4-гідроксифеніл)ацетону гідрохлориду (одержаний відповідно до ЕР 101 223; Chemistry Letters 1980, і, 85-88; або J. Org. Chem. 1951, 16, 221-224) (250 ммоль) в тетрагідрофурані (509 мл) додають 1,1'-карбонілдіімідазол (48,25 г; 290 ммоль), і суміш кип'ятять із зворотним холодильником протягом 2 год. Після охолодження до кімнатної температури, осад відфільтровують, а фільтрат упарюють під вакуумом. Залишок розчиняють в етилацетаті (400 мл), розчин промивають 5 % водним розчином НСІ (2 × 200 мл) та сольовим розчином (2 × 200 мл), потім органічну фракцію упарюють під вакуумом з одержанням названого в заголовку продукту у вигляді твердої речовини. Температура плавлення: 115-116 °C. Стадія В: 5-(2-зідроксипропіл)-1,3-бензоксазол-2(3H)-он До розчину продукту з попередньої стадії (180 ммоль) в суміші етилацетату (352 мл) та води (120 мл) додають декілька разів натрію боргідрид (2,1 г; 550 ммоль) протягом 20 хв при 0-10 °C. Реакційну суміш перемішують при кімнатній температурі до закінчення реакції. Далі суміш обробляють 10 % водним розчином НСІ до рН2 та, після розділення фаз, водну фракцію екстрагують етилацетатом (3 × 90 мл). Органічні фракції збирають, сушать над натрію сульфатом та упарюють під вакуумом. Залишок твердої речовини суспендують в діізопропіловому ефірі, а далі відфільтровують з одержанням названого в заголовку продукту у вигляді твердої речовини. Температура плавлення: 133-134 °C. Препаративний приклад 2: 5-(1-етил-2-гідроксипропіл)-1,3-бензоксазол-2(3Н)-он Названий в заголовку продукт одержують відповідно до методики, описаної в Препаративному прикладі 1, з використанням в ролі початкового реагенту 3-(3-аміно-4гідроксифеніл)-2-пентанону гідрохлориду замість 1-(3-аміно-4-гідроксифеніл)ацетону гідрохлориду. Температура плавлення: 107-109 °C. Препаративний приклад 3: 5-[1-(1-гідроксіетил)бутил]-1,3-бензоксазол-2(3Н)-он Названий в заголовку продукт одержують у вигляді масла відповідно до методики, описаної у Препаративному прикладі 1, з використанням в ролі початкового реагенту 2-аміно-4-[1-(1гідроксіетил)бутил]фенолу гідрохлориду замість 1-(3-аміно-4-гідроксифеніл)ацетону гідрохлориду. Препаративний приклад 4: 5-(2-гідроксибутил)-1,3-бензоксазол-2(3Н)-он Названий в заголовку продукт одержують відповідно до методики, описаної у Препаративному прикладі 1, з використанням в ролі початкового реагенту 1-(3-аміно-4гідроксифеніл)-2-бутанону гідрохлориду замість 1-(3-аміно-4-гідроксифеніл)ацетону гідрохлориду. Температура плавлення: 117-119 °C. Приклад 1: 8-метил-5-(2-нафтил)-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он Стадія А: 7-метил-5-(2-нафтил)-1,5,7,8-тетрагідро-2H-ізохромено[6,7-d][1,3]оксазол-2-он До суспензії сполуки з Препаративного прикладу 1 (97,0 ммоль) та 2-нафтальдегіду (94,3 ммоль) в етилацетаті (180 мл) додають 15 % безводний розчин НСІ в етилацетаті (90 мл). Реакційну суміш перемішують протягом 20 год. при кімнатній температурі. Спостерігається виділення осаду, після чого цільовий продукт у вигляді порошку відокремлюють фільтрацією. Температура плавлення: 220-222 °C. Стадія В: 7-метил-5-(2-нафтил)-2-оксо-1Н,2Н-ізохромено[6,7-d][1,3]оксазол-6-ію перхлорат До розчину продукту з попередньої стадії (67,5 ммоль) в ацетоні (490 мл) додають краплями реагент Джонса (88,63 мл; 236 ммоль) при 0-10 °C протягом 40 хв. Суміш перемішують при кімнатній температурі до припинення реакції, після чого виливають в льодяну воду (2200 мл). Залишок відфільтровують, промивають водою (5 × 50 мл), сушать і потім безпосередньо використовують на наступній стадії. До суспензії сухого продукту в етилацетаті (460 мл) при кип'ятінні із зворотним холодильником додають 70 % перхлорну кислоту (5,87 мл; 67,5 ммоль). Кип'ятіння із зворотним холодильником продовжують ще протягом 60 хв з одночасним енергійним перемішуванням. Після охолодження до кімнатної температури утворені кристали відфільтровують та сушать з одержанням цільового продукту. Температура плавлення: 304-307 °C. Стадія С: 8-метил-5-(2-нафтил)-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он 6 UA 112153 C2 5 10 15 20 25 30 35 40 45 50 55 До розчину продукту з попередньої стадії (51 ммоль) в 2-пропанолі (468 мл) додають гідразингідрат (6,68 мл; 133 ммоль), енергійно перемішуючи при кімнатній температурі. Реакційну суміш перемішують протягом 20 год при кімнатній температурі. Далі утворені кристали відфільтровують та перемішують в теплій воді (1900 мл) протягом 30 хв. Після фільтрації та висушування, тверду речовину очищують в ацетонітрилі при кип'ятінні зі зворотним холодильником. Температура плавлення: 304-306 °C. Приклад 2: 5-(1-бензофуран-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Стадія А: 6-бром-5-(2-оксопропіл)-1,3-бензоксазол-2(3H)-он До розчину сполуки з Препаративного прикладу 1 (52 ммоль) в метанолі (150 мл) додають N-бромсукцинімід (9,8 г; 55 ммоль) маленькими порціями при 0-10 °C. Суміш перемішують ще протягом 1 год., після чого упарюють під вакуумом. Одержаний залишок розчиняють в етилацетаті (250 мл), та органічну фракцію промивають 5 % водним розчином натрію гідрокарбонату (4 × 50 мл), сушать над магнію сульфатом та упарюють під вакуумом з одержанням цільового продукту у вигляді твердої речовини. Температура плавлення: 160-162 °C. Стадія В: 6-бром-5-[(2-метил-1,3-діоксолан-2-іл)метил]-1,3-бензоксазол-2(3H)-он Суміш продукту з попередньої стадії (14,7 г; 54 ммоль), етиленгліколю (13,6 мл; 243 ммоль), пара-толуолсульфонової кислоти (1 г; 5 ммоль) і толуолу (300 мл) кип'ятять зі зворотним холодильником з використанням апарату Діна-Старка протягом 6 год. Розчин охолоджують до кімнатної температури, після чого виливають у етилацетат (300 мл). Органічну фракцію промивають 5 % водним розчином натрію гідрокарбонату (100 мл), сольовим розчином (100 мл), потім сушать над магнію сульфатом та упарюють під вакуумом. Залишок очищують хроматографією на колонці з силікагелем (елюент: дихлорметан/етилацетат) з одержанням названого в заголовку продукту у вигляді твердої речовини. Температура плавлення: 117-119 °C. Стадія С: 6-(1-бензофуран-2-ілкарбоніл)-5-[(2-метил-1,3-діоксолан-2-іл)метил]-1,3бензоксазол-2(3Н)-он 2,5 М розчин н-бутиллітію в гексані (10,5 мл; 2,6 ммоль) додають краплями до розчину продукту з попередньої стадії (3,1 г; 10 ммоль) в тетрагідрофурані (120 мл) при -78 °C. Реакційну суміш далі нагрівають до -35 °C, перемішують протягом 30 хв, і потім додають Nметокси-N-метил-1-бензофуран-2-карбоксамід (16,5 ммоль). Далі реакційну суміш перемішують при -35 °C, витримуючи при цій температурі ще протягом 1,5 год., після чого виливають у насичений розчин амонію хлориду (150 мл). Після додавання етилацетату (150 мл) органічну фракцію промивають сольовим розчином (100 мл), сушать над магнію сульфатом та упарюють під вакуумом. Залишок очищують хроматографією на колонці з силікагелем (елюент: гексан/етилацетат) з одержанням названого в заголовку продукту. Температура плавлення: 213-215 °C. Стадія D: 5-(1-бензофуран-2-іл)-7-метил-2-оксо-1Н,2Н-ізохромено[6,7-d][1,3]оксазол-6-ію перхлорат До суспензії продукту з попередньої стадії в етилацетаті (460 мл) при кип'ятінні зі зворотним холодильником додають перхлорну кислоту 70 % (5,87 мл; 67,5 ммоль). Кип'ятять зі зворотним холодильником ще протягом 60 хв з енергійним перемішуванням. Після охолодження до кімнатної температури одержані кристали відфільтровують та сушать з одержанням цільового продукту. Температура плавлення: 318-320 °C. Стадія Е: 5-(1-бензофуран-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он До розчину продукту з попередньої стадії (51 ммоль) в 2-пропанолі (468 мл) додають гідразингідрат (6,68 мл; 133 ммоль) при енергійному перемішуванні та кімнатній температурі. Реакційну суміш перемішують протягом 20 год при кімнатній температурі. Одержані кристали далі відфільтровують, і потім перемішують в теплій воді (1900 мл) протягом 30 хв. Після фільтрації та висушування, тверду речовину очищують в ацетонітрилі при кип'ятінні із зворотним холодильником. Температура плавлення: 290-292 °C. Приклад 3: 5-(5-хлор-3-метил-1-бензофуран-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он 7 UA 112153 C2 5 10 15 20 25 30 35 40 45 50 55 60 Названий в заголовку продукт одержують відповідно до методики, описаної у Прикладі 2, з використанням 5-хлор-N-метокси-N,3-диметил-1-бензофуран-2-карбоксаміду замість N-метоксиN-метил-1-бензофуран-2-карбоксаміду. Температура плавлення: 297-298 °C. Приклад 4: 8-метил-5-(2-хіноліл)-1,9-дигідро-2H-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он До розчину 7-метил-2-оксо-5-(2-хіноліл)-1Н,2Н-ізохромено[6,7-d][1,3]оксазол-6-ію перхлорату (51 ммоль) (одержаний в ході Стадій A-D Прикладу 2, з використанням N-метокси-N-метил-2хінолінкарбоксаміду замість N-метокси-N-метил-1-бензофуран-2-карбоксаміду) в 2-пропанолі (468 мл) додають гідразингідрат (6,68 мл; 133 ммоль) при енергійному перемішуванні та кімнатній температурі. Реакційну суміш перемішують протягом 20 год. при кімнатній температурі. Далі утворені кристали відфільтровують, після чого перемішують в теплій воді (1900 мл) протягом 30 хв. Після фільтрації та висушування тверду речовину очищують хроматографією на колонці з силікагелем (елюент: дихлорметан/метанол) з одержанням названого в заголовку продукту. Температура плавлення: 304-306 °C. Приклад 5: 8-метил-5-(6-хіноліл)-1,9-дигідро-2H-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он До суспензії 7-метил-2-оксо-5-(6-хіноліл)-1Н,2Н-ізохромено[6,7-d][1,3]оксазол-6-ію перхлорату (51 ммоль) (одержаний відповідно до Стадій A-D Прикладу 2, з використанням Nметокси-N-метил-6-хінолінкарбоксаміду замість N-метокси-N-метил-1-бензофуран-2карбоксаміду) в 2-пропанолі (468 мл) додають гідразингідрат (6,68 мл; 133 ммоль) при енергійному перемішуванні та кімнатній температурі. Реакційну суміш перемішують протягом 20 год при кімнатній температурі. Далі утворені кристали відфільтровують, і потім перемішують в теплій воді (1900 мл) протягом 30 хв. Після фільтрації та висушування, тверду речовину очищують кристалізацією з суміші диметилформамід/метанол. Температура плавлення: 302-304 °C. 1 H ЯМР спектроскопічний аналіз (500 MГц, ДМСО, δ в проміле): 12,05 (вс, 1Н); 8,95 (дд, 1Н, J=4,2 та 1,7 Гц); 8,44 (дд, 1Н, J=8,3 та 1,7 Гц); 8,09 (м, 3Н); 7,57 (дд, 1Н, J=8,3 та 4,2 Гц); 7,29 (с, 1Н); 7,24 (с, 1Н); 3,64 (д, 1Н, J=12,3 Гц); 2,89 (д, 1Н, J=12,2 Гц); 2,10 (с, 3Н). Приклад 6: 5-(1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодіазепін2-он До розчину 5-(1-бензотієн-2-іл)-7-метил-1,5,7,8-тетрагідро-2Н-ізохромено-[6,7-d][1,3]оксазол2-ону (67,5 ммоль), одержаного відповідно до Стадії А Прикладу 1, з використанням 1бензотіофен-2-карбальдегіду замість 2-нафтальдегіду, в ацетоні (490 мл), додають краплями реагент Джонса (88,63 мл; 236 ммоль) при 0-10 °C протягом 40 хв. Суміш перемішують при кімнатній температурі до закінчення реакції, і потім виливають в льодяну воду (2200 мл). Залишок відфільтровують, промивають водою (5 × 50 мл), сушать і використовують безпосередньо на наступній стадії. До суспензії сухого продукту в етилацетаті (460 мл) при кип'ятінні із зворотним холодильником додають перхлорну кислоту 70 % (5,87 мл; 67,5 ммоль). Кип'ятіння із зворотним холодильником продовжують ще протягом 60 хв при енергійному перемішуванні. Після охолодження до кімнатної температури, неочищений продукт виділяють, і далі суспендують в 2-пропанолі (434 мл), і потім додають гідразингідрат (6,17 мл; 127 ммоль) при енергійному перемішуванні та кімнатній температурі. Реакційну суміш перемішують протягом 20 год. при кімнатній температурі. Далі утворені кристали відфільтровують та перемішують в теплій воді (1900 мл) протягом 30 хв. Після фільтрації та висушування, тверду речовину кип'ятять із зворотним холодильником в ацетонітрилі протягом 30 хв. Після виділення та висушування одержують названий у заголовку продукт. Температура плавлення: 338-340 °C. 1 H ЯМР спектроскопічний аналіз (500 MГц, ДМСО, δ в проміле): 12,10 (вс, 1Н); 7,99 (м, 1Н); 7,86 (м, 1Н); 7,69 (с, 1Н); 7,53 (с, 1Н); 7,39 (м, 2Н); 7,28 (с, 1Н); 3,61 (д, 1Н, J=12,3 Гц); 2,86 (д, 1Н, J=12,2 Гц); 2,08 (с, 3Н). Приклад 7: 5-(3-хлор-4-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 3-хлор-4-фтор-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 295-297 °C. Приклад 8: 5-(3-хлор-6-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он До суспензії 5-(3-хлор-6-фтор-1-бензотієн-2-іл)-7-метил-2-оксо-1H,2Н-ізохромено[6,7d][1,3]оксазол-6-ію перхлорату (51 ммоль) (одержаного відповідно до Стадій А та В Прикладу 1, з використанням 3-хлор-6-фтор-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду) в 2 8 UA 112153 C2 5 10 15 20 25 30 35 40 45 50 55 60 пропанолі (468 мл) додають гідразингідрат (6,68 мл; 133 ммоль) при енергійному перемішуванні та кімнатній температурі. Реакційну суміш перемішують протягом 20 год при кімнатній температурі. Далі утворені кристали відфільтровують, і потім перемішують в теплій воді (1900 мл) протягом 30 хв. Після фільтрації та висушування тверду речовину очищують перекристалізацією із суміші диметилформамід/метанол. Температура плавлення: 276-278 °C. Приклад 9: 5-[3-хлор-4-(трифторметил)-1-бензотієн-2-іл]-8-метил-1,9-дигідро-2Н[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 3-хлор-4-(трифторметил)-1-6ензотіофен-2-карбальдегіду замість 2нафтальдегіду. Температура плавлення: 322-323 °C. 1 H ЯМР спектроскопічний аналіз (500 MГц, ДМСО, δ в проміле): 12,02 (вс, 1Н); 8,52 (д, 1Н, J=8,1 Гц); 7,99 (д, 1Н, J=7,5 Гц); 7,72 (m, 1H, J=7,9 Гц); 7,31 (с, 1Н); 7,30 (с, 1Н); 3,77 (д, 1Н, J=12,5 Гц); 2,85 (д, 1Н, J=12,3 Гц); 2,13 (с, 3Н). Приклад 10: 8-метил-5-(3-метил-1-бензотієн-2-іл)-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий в заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 3-метил-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 301-303 °C. Приклад 11: 8-метил-5-[3-метил-4-(трифторметил)-1-бензотієн-2-іл]-1,9-дигідро-2Н[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 3-метил-4-(трифторметил)-1-бензотіофен-2-карбальдегіду замість 2нафтальдегіду. Температура плавлення: 313-315 °C. Приклад 12: 8-метил-5-[3-метил-5-(трифторметил)-1-бензотієн-2-іл]-1,9-дигідро-2Н[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 3-метил-5-(трифторметил)-1-бензотіофен-2-карбальдегіду замість 2нафтальдегіду. Температура плавлення: 301-303 °C. Приклад 13: 8-метил-5-[3-метил-6-(трифторметил)-1-бензотієн-2-іл]-1,9-дигідро-2Н[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он Названий в заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 3-метил-6-(трифторметил)-1-бензотіофен-2-карбальдегіду замість 2нафтальдегіду. Температура плавлення: 303-305 °C. Приклад 14: 8-метил-5-[3-метил-7-(трифторметил)-1-бензотієн-2-іл]-1,9-дигідро-2Н[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он Названий в заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 3-метил-7-(трифторметил)-1-бензотіофен-2-карбальдегіду замість 2нафтальдегіду. Температура плавлення: 292-294 °C. Приклад 15: 5-(3-етил-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 3-етил-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 293-295 °C. Приклад 16: 5-(3-етил-4-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он До суспензії 5-(3-етил-4-фтор-1-бензотієн-2-іл)-7-метил-2-оксо-1Н,2Н-ізохромено[6,7d][1,3]оксазол-6-ію перхлорату (51 ммоль) (одержаного відповідно до Стадій А та В Прикладу 1, з використанням 3-етил-4-фтор-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду) в 2пропанолі (468 мл) додають гідразингідрат (6,68 мл; 133 ммоль) при енергійному перемішуванні та кімнатній температурі. Реакційну суміш перемішують протягом 20 год при кімнатній температурі. Далі утворені кристали відфільтровують, і потім перемішують в теплій воді (1900 мл) протягом 30 хв. Після фільтрації та висушування тверду речовину очищують хроматографією на колонці з силікагелем (елюент: дихлорметан/ацетонітрил) з одержанням названого в заголовку продукту. 9 UA 112153 C2 5 10 15 20 25 30 35 40 45 50 55 60 Температура плавлення: 297-299 °C. Приклад 17: 5-(3-етил-4,7-дифтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 8, з використанням 3-етил-4,7-дифтор-1-бензотіофен-2-карбальдегіду замість 3-хлор-6-фтор-1бензотіофен-2-карбальдегіду. Температура плавлення: 270-272 °C. Приклад 18: 8-метил-5-(3-пропіл-1-бензотієн-2-іл)-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он До суспензії 5-(3-пропіл-1-бензотієн-2-іл)-7-метил-2-оксо-1H,2Н-ізохромено-[6,7d][1,3]оксазол-6-ію перхлорату (51 ммоль) (одержаний відповідно до Стадій А та В Прикладу 1, з використанням 3-пропіл-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду) в 2-пропанолі (468 мл) додають гідразингідрат (6,68 мл; 133 ммоль) при енергійному перемішуванні та кімнатній температурі. Реакційну суміш перемішують протягом 20 год при кімнатній температурі. Далі утворені кристали відфільтровують, і потім перемішують в теплій воді (1900 мл) протягом 30 хв. Після фільтрації та висушування тверду речовину очищують хроматографією на колонці з силікагелем (елюент: дихлорметан/етилацетат) з одержанням названого в заголовку продукту. Температура плавлення: 307-308 °C. Приклад 19: 5-(3-бутил-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 18, з використанням 3-бутил-1-бензотіофен-2-карбальдегіду замість 3-пропіл-1-бензотіофен-2карбальдегіду. Температура плавлення: 278-280 °C. Приклад 20: 8-метил-5-[3-(трифторметил)-1-бензотієн-2-іл]-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 3-(трифторметил)-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 260-262 °C. Приклад 21: 5-(4-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Стадія А: 5-(4-фтор-1-бензотієн-2-іл)-7-метил-2-оксо-1Н,2Н-ізохромено[6,7-d][1,3]оксазол-6ію перхлорат Цільовий продукт одержують відповідно до методики, описаної для Стадій А та В Прикладу 1, з використанням 4-фтор-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду, або відповідно до методики, описаної для Стадій A-D Прикладу 2, з використанням 4-фтор-Nметокси-N-метил-1-бензотіофен-2-карбоксаміду замість N-метокси-N-метил-1-бензофуран-2карбоксаміду. Температура плавлення: 278-280 °C. Стадія В: 5-(4-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Цільовий продукт одержують, розпочинаючи із сполуки з попередньої стадії, відповідно до методики, описаної для Стадії С Прикладу 1. Температура плавлення: 394-396 °C. 1 H ЯМР спектроскопічний аналіз (500 MГц, ДМСО, δ в проміле): 12,06 (вс, 1Н); 7,86 (д, 1Н, J=8,1 Гц); 7,74 (с, 1Н); 7,45 (м, 1Н); 7,45 (с, 1Н); 7,28 (с, 1Н); 7,21 (дд, 1Н, J1=8,1 Гц, J2=10,4 Гц); 3,62 (д, 1Н, J=12,3 Гц); 2,85 (д, 1Н, J=12,2 Гц); 2,08 (с, 3Н). Приклад 22: 5-(4-фтор-3-метил-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 4-фтор-3-метил-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 321-323 °C. Приклад 23: 9-етил-5-(4-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 4-фтор-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду та сполуки з Препаративного прикладу 2 замість сполуки з Препаративного прикладу 1. Температура плавлення: 291-292 °C. Приклад 24: 5-(4-фтор-1-бензотієн-2-іл)-8-метил-9-пропіл-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он 10 UA 112153 C2 5 10 15 20 25 30 35 40 45 50 55 60 Названий у заголовку продукт одержують відповідно до методики, описаної для Стадій А та В Прикладу 1, з використанням 4-фтор-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду, та сполуки з Препаративного прикладу 3 замість сполуки з Препаративного прикладу 1, з наступним застосуванням методики, описаної у Прикладі 18. Температура плавлення: 299-300 °C. Приклад 25: 5-(4-фтор-3-метил-1-бензотієн-2-іл)-8-метил-9-пропіл-1,9-дигідро-2Н[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 4-фтор-3-метил-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду, та сполуки з Препаративного прикладу 3 замість сполуки з Препаративного прикладу 1. Температура плавлення: 269-271 °C. Приклад 26: 5-(4-фтор-7-йод-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 4-фтор-7-йод-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 324-326 °C. Приклад 27: 5-(4-хлор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]-оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 6, з використанням 4-хлор-1-бензотіофен-2-карбальдегіду замість 1-бензотіофен-2-карбальдегіду. Температура плавлення: 333-335 °C. Приклад 28: 5-(4-хлор-3-метил-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 4-хлор-3-метил-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 305-307 °C. Приклад 29: 5-(4-бром-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]-оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 4-бром-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 336-338 °C. Приклад 30: 5-(4-йод-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 4-йод-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 326-328 °C. Приклад 31: 8-метил-5-[4-(трифторметил)-1-бензотієн-2-іл]-1,9-дигідро-2H-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 4-(трифторметил)-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 343-345 °C. 1 H ЯМР спектроскопічний аналіз (500 MГц, ДМСО, δ в проміле): 12,12 (вс, 1Н); 8,38 (д, 1Н, J=8,1 Гц); 7,80 (д, 1Н, J=7,4 Гц); 7,70 (с, 1Н); 7,61 (m, 1H, J=7,8 Гц); 7,45 (с, 1Н); 7,29 (с, 1Н); 3,64 (д, 1Н, J=12,3 Гц); 2,88 (д, 1Н, J =12,3 Гц); 2,09 (с, 3Н). Приклад 32: 5-(5-хлор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]-оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 6, з використанням 5-хлор-1-бензотіофен-2-карбальдегіду замість 1-бензотіофен-2-карбальдегіду. Температура плавлення: 322-324 °C. 1 H ЯМР спектроскопічний аналіз (500 MГц, ДМСО, δ в проміле): 12,11 (вс, 1Н); 8,03 (д, 1Н, J=8,7 Гц); 7,95 (д, 1Н, J=2,1 Гц); 7,68 (с, 1Н); 7,52 (с, 1Н); 7,44 (дд, 1Н, J1=2,1 Гц, J2=8,5 Гц); 7,38 (с, 1Н); 3,62 (д, 1Н, J=12,5 Гц); 2,86 (д, 1Н, J=12,2 Гц); 2,08 (с, 3Н). Приклад 33: 5-(5-хлор-3-метил-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 6, з використанням 5-хлор-3-метил-1-бензотіофен-2-карбальдегіду замість 1-бензотіофен-2карбальдегіду. Температура плавлення: 310-312 °C Приклад 34: 5-(5-фтор-3-метил-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он 11 UA 112153 C2 5 10 15 20 25 30 35 40 45 50 55 Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 6, з використанням 5-фтор-3-метил-1-бензотіофен-2-карбальдегіду замість 1-бензотіофен-2карбальдегіду. Температура плавлення: 291-292 °C. Приклад 35: 8-метил-5-[5-(трифторметил)-1-бензотієн-2-іл]-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 5-(трифторметил)-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 282-284 °C. Приклад 36: 5-(6-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий в заголовку продукт одержують відповідно до методики, описаної у Прикладі 6, з використанням 6-фтор-1-бензотіофен-2-карбальдегіду замість 1-бензотіофен-2-карбальдегіду. Температура плавлення: 345-347 °C. Приклад 37: 5-(6-фтор-3-метил-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 6-фтор-3-метил-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 286-288 °C. Приклад 38: 8-метил-5-[6-(трифторметил)-1-бензотієн-2-іл]-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 6, з використанням 6-(трифторметил)-1-бензотіофен-2-карбальдегіду замість 1-бензотіофен-2карбальдегіду. Температура плавлення: 329-331 °C. Приклад 39: 2-(8-метил-2-оксо-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-5-іл)-1бензотіофен-6-карбонітрил Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 6, з використанням 2-форміл-1-бензофуран-6-карбонітрилу замість 1-бензотіофен-2-карбальдегіду. Температура плавлення: 388-390 °C. Приклад 40: 5-(7-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]-оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 7-фтор-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 324-326 °C. 1 H ЯМР спектроскопічний аналіз (500 MГц, ДМСО, δ в проміле): 12,09 (шс, 1Н); 7,73 (м, 1Н); 7,70 (с, 1Н); 7,63 (д, 1Н, J=3,7 Гц); 7,42 (м, 1Н); 7,29 (м, 1Н); 7,27 (с, 1Н); 3,62 (д, 1Н, J=12,5 Гц); 2,86 (д, 1Н, J=12,3 Гц); 2,08 (с, 3Н). Приклад 41: 5-(7-фтор-3-метил-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 7-фтор-3-метил-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 307-309 °C. Приклад 42: 5-(7-хлор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]-оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 7-хлор-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 333-335 °C. Приклад 43: 5-(7-хлор-4-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 7-хлор-4-фтор-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 364-366 °C. Приклад 44: 5-(7-хлор-4-фтор-3-метил-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 8, з використанням 7-хлор-4-фтор-3-метил-1-бензотіофен-2-карбальдегіду замість 3-хлор-6-фтор-1бензотіофен-2-карбальдегіду. Температура плавлення: 319-320 °C. 12 UA 112153 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 45: 5-[7-хлор-4-(трифторметил)-1-бензотієн-2-іл]-8-метил-1,9-дигідро-2Н[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 7-хлор-4-(трифторметил)-1-бензотіофен-2-карбальдегіду замість 2нафтальдегіду. Температура плавлення: 340-342 °C. Приклад 46: 5-(7-бром-4-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 7-бром-4-фтор-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 345-347 °C. Приклад 47: 8-метил-5-[7-(трифторметил)-1-бензотієн-2-іл]-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 7-(трифторметил)-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 336-338 °C. Приклад 48: 8-метил-5-(1-метилнафто[2,1-b]тієн-2-іл)-1,9-дитідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 8, з використанням 1-метилнафто[2,1-b]тіофен-2-карбальдегіду замість 3-хлор-6-фтор-1бензотіофен-2-карбальдегіду. Температура плавлення: 318-320 °C. Приклад 49: 8-етил-5-(4-фтор-1-бензотієн-2-іл)-1,5-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 4-фтор-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду, та сполуки з Препаративного прикладу 4 замість сполуки з Препаративного прикладу 1. Температура плавлення: 295-297 °C. Приклад 50: 8-етил-5-[4-(трифторметил)-1-бензотіен-2-іл]-1,5-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 4-(трифторметил)-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду, та сполуки з Препаративного прикладу 4 замість сполуки з Препаративного прикладу 1. Температура плавлення: 301-303 °C. Приклад 51: 8-етил-5-[4-фтор-3-метил-1-бензотієн-2-іл]-1,5-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 4-фтор-3-метил-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду, та сполуки з Препаративного прикладу 4 замість сполуки з Препаративного прикладу 1. Температура плавлення: 289-291 °C. Приклад 52: 5-(5-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5h][2,3]бензодіазепін-2-он Названий у заголовку продукт одержують відповідно до методики, описаної у Прикладі 1, з використанням 5-фтор-1-бензотіофен-2-карбальдегіду замість 2-нафтальдегіду. Температура плавлення: 291-293 °C. ФАРМАКОЛОГІЧНЕ ДОСЛІДЖЕННЯ Приклад А: дослідження активності рецептора ГАМКА Сполуки досліджували на клітинах НЕК-293 (нирки людського ембріону), що стабільно експресували субодиницю α5 рецептора ГАМКА людини, а також субодиниці бета2 (коротку) та гама2 (довгу). Клітини утримували в умовах селекції трьома антибіотиками - неоміцином, зеоцином та пуроміцином - в середовищі Дульбекко (МДСІ), що містило 10 % (об./об.) сироватки телячого ембріону. За день до експерименту клітини переносили на 96-ямкові планшети (з щільністю 50 000 клітин/ямку). Після цього клітини попередньо інкубували протягом 40 хв з досліджуваними сполуками та обробляли ГАМК. Мембранний потенціал контролювали з використанням блакитного маркера FMP (Molecular Devices) відповідно до інструкцій виробника. Відповідь реєстрували протягом 120 с на пристрої для зчитування планшетів FlexStation3 (Molecular Devices, США). Значення ІС 50 для досліджуваних сполук визначали за регулюванням кривої методом нелінійної регресії з використанням програмного забезпечення SoftMax Pro (Molecular Devices, США). 60 13 UA 112153 C2 Приклад 5 Приклад 6 Приклад 9 Приклад 21 Приклад 31 Приклад 32 Приклад 36 Приклад 40 5 10 15 20 25 30 35 40 45 50 альфа 5 IC50 [нМ] 430 130 250 200 500 172 100 227 Таким чином, сполуки за винаходом демонструють чудову спорідненість та є селективними по відношенню до рецептора альфа 5. Приклад В: Тест на розпізнавання нових об'єктів, на мишах В даному тесті вимірюють непросторову оперативну пам'ять гризунів. Тест базується на природній тенденції тварини витрачати більше часу на дослідження нового об'єкта в порівнянні із добре знайомим об'єктом. Бажання дослідити новий об'єкт демонструє використання процесу навчання та розпізнавальної пам'яті. В 0-й день (фаза ознайомлення) мишей-самців NMRI вміщували у чорну ПВХ коробку (32×45×27 см) без об'єкту, на 2,5 хв. В 1-й день мишам дозволяли вільно досліджувати 2 ідентичних об'єкти протягом 3 хв (фаза збирання даних). На 2-й день один з об'єктів замінювали новим об'єктом та вимірювали тривалість періоду дослідження для кожного об'єкта протягом 4 хв (фаза утримання). Попередню обробку сполуками за винаходом здійснювали внутрішньочеревинно в день фази збирання даних. Тривалість періоду дослідження вимірювали за допомогою програмного забезпечення TSE System (TSE System GmbH, Bad Homburg, Німеччина). Результати дивіться на Фіг. 1-3. Результати показують, що сполуки за винаходом демонструють прокогнітивний вплив на моделі розпізнавання об'єкта мишами. Зокрема, сполука Прикладу 21 здійснює значний прокогнітивний вплив в дозах 0,01, 0,03 та 0,1 мг/кг внутрішньочеревинно. Більше того, сполука Прикладу 31 здійснює значний прокогнітивний вплив у дозі 1 мг/кг внутрішньочеревинно, та сполука Прикладу 36 здійснює значний прокогнітивний вплив у дозі 10 мг/кг внутрішньочеревинно. Приклад С: Тест радіального лабіринту на щурах Даний тест широко застосовують для оцінки оперативної та референтної пам'яті у гризунів. Прилад складається з невеликої центральної восьмикутної платформи, від якої радіально, з рівними проміжками розходяться вісім різних коридорів. В кінці кожного коридору знаходиться їжа, яку не можна побачити із центральної платформи. В експерименті у всіх коридорах розташована винагорода і тварина має відвідати кожен коридор тільки один раз. Кожне додаткове відвідування розцінюється як помилка. В 1-й день експерименту щурів позбавляли їжі на 24 год. Навчання розпочиналось наступного дня. Щурів розміщували на центральну платформу лабіринту, в кожен з восьми коридорів клали їжу. Тваринам дозволяли вільно з'їдати їжу у восьми коридорах. Якщо щур не з'їв усю їжу в межах 20 хв, його виймали з лабіринту. Експерименти продовжували один раз на день до тих пір, поки тварини досягали визначеної мети, а саме, загальної кількості помилок - тобто, додаткових відвідувань коридору, як було вказано вище - менше 3. Таких тварин включали в іншу частину дослідження. В останній день відібраним щурам вводили перорально кетамін (10 мг/кг внутрішньочеревинно) разом з носієм або сполукою за винаходом. Тести розпочинали через 120 хв після введення. Кожен тест тривав не більше 5 хв. Результати дивіться на Фіг. 4. Результати показують, що сполуки за винаходом демонструють значне покращення пам'яті дослідних тварин. Конкретно, сполука Прикладу 21 значною мірою усуває індукований кетаміном дефіцит референтної пам'яті дозозалежним чином (від 0,3 до 3 мг/кг перорально). Приклад D: Оклюзія середньої мозкової артерії (СМА) у мишей Перманентну ішемію центрального мозку викликали шляхом електрокоагуляції лівої СМА (відповідно до методу Welsh FA et at., J. Neurochem. 1987, 49, 846-851). Мишей-самців NMRI піддавали анестезії з використанням 2,2,2-триброметанолу (500 мг/кг внутрішньочеревинно, 20 мл/кг). Здійснювали розтин у лівій скронево-тім'яній ділянці голови між орбітою та вухом. Далі скроневий м'яз розтинали та загинали назад для контакту із черепом. Просвердлювали 14 UA 112153 C2 5 10 15 невеликий трепанаційний отвір в зовнішній латеральній частині черепа точно на рівні СМА, і далі здійснювали оклюзію стовбуру СМА шляхом електрокоагуляції. Сполуки за винаходом вводили внутрішньочеревинно через 30 хв після оклюзії СМА. Через 2 дні тваринам здійснювали глибоку анестезію з використанням натрію пентобарбіталу (60 мг/кг внутрішньочеревинно, 10 мл/кг), та здійснювали перфузію крізь серце 4 % розчину 2,3,5трифенілтетразолію хлориду. В кінці тварин умертвляли відтинанням голови, мозок витягували та розміщували щонайменше на 24 год в розчин солі, що містив 8 % формальдегіду. Вимірювання некротизованої площі поверхні здійснювали з використанням системи аналізу зображень (DigiCell для Windows 4.0). Результати дивіться на Фіг. 5. Результати показали, що сполуки за винаходом демонструють значний нейропротекторний вплив. Конкретно, сполука Прикладу 21 значно зменшує пошкодження мозку в дозах 1, 3 та 10 мг/кг внутрішньочеревинно на моделі оклюзії СМА у мишей. Приклад Е: Фармацевтична композиція Формула для одержання 1000 таблеток, кожна з яких містить 10 мг 5-(4-фтор-1-бензотієн-2іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-ону (Приклад 21) Гідроксипропілцелюлоза Пшеничний крохмаль Лактоза Магнію стеарат Тальк 10 г 2г 10 г 100 г 3г 3 г. ФОРМУЛА ВИНАХОДУ 20 1. Сполука формули (І): R 1 R H N N O O N R 25 30 35 40 45 2 3 , (І) де: 1 R являє собою атом водню або нерозгалужену або розгалужену (С 1-С4)алкільну групу; 2 R являє собою нерозгалужену або розгалужену (С 1-С4)алкільну групу; 3 R являє собою арильну або гетероарильну групу; або їх ізомери положення, їх енантіомери, їх діастереоізомери, а також їх адитивні солі з фармацевтично прийнятною кислотою та їх сольвати, при цьому мається на увазі, що: арильна група являє собою нафтильну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену; нерозгалуженої або розгалуженої (С1-С6)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену; нерозгалуженої або розгалуженої (С1-С6)алкоксигрупи; нерозгалуженої або розгалуженої (С1-С6)алкілкарбонільної групи; карбоксильної групи; нерозгалуженої або розгалуженої (С1-С6)алкоксикарбонільної групи; гідроксильної групи; ціаногрупи; нітрогрупи; амінокарбонільної групи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С1-С6)алкільними групами; або аміногрупи, що є не заміщеною або заміщеною однією або двома нерозгалуженими або розгалуженими (С 1С6)алкільними групами; гетероарильна група являє собою біциклічну або трициклічну групу, в якій щонайменше одне з кілець є ароматичним, та яка містить від 1 до 3 однакових або різних гетероатомів, вибраних з азоту, кисню та сірки, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену; нерозгалуженої або розгалуженої (С 1-С6)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену; нерозгалуженої або розгалуженої (С1-С6)алкоксигрупи; нерозгалуженої або розгалуженої (С 1-С6)алкілкарбонільної групи; карбоксильної групи; нерозгалуженої або розгалуженої (С 1-С6)алкоксикарбонільної групи; 15 UA 112153 C2 5 10 15 20 25 30 35 40 45 гідроксильної групи; ціаногрупи; нітрогрупи; амінокарбонільної групи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С 1-С6)алкільними групами; або аміногрупи, що є не заміщеною або заміщеною однією або двома нерозгалуженими або розгалуженими (С1-С6)алкільними групами. 1 2. Сполука формули (І) за п. 1, де R являє собою атом водню. 2 3. Сполука формули (І) за п. 1, де R являє собою метильну групу. 3 4. Сполука формули (І) за п. 1, де R являє собою гетероарильну групу. 3 5. Сполука формули (І) за п. 1, де R являє собою біциклічну ароматичну групу, що містить від 1 до 3 однакових або різних гетероатомів, вибраних з азоту, кисню та сірки, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену; нерозгалуженої або розгалуженої (С1-С6)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену; нерозгалуженої або розгалуженої (С 1-С6)алкоксигрупи; нерозгалуженої або розгалуженої (С1-С6)алкілкарбонільної групи; карбоксильної групи; нерозгалуженої або розгалуженої (С1-С6)алкоксикарбонільної групи; гідроксильної групи; ціаногрупи; нітрогрупи; амінокарбонільної групи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С1-С6)алкільними групами; або аміногрупи, що є не заміщеною або заміщеною однією або більше нерозгалуженими або розгалуженими (С 1С6)алкільними групами. 3 6. Сполука формули (І) за п. 1, де R являє собою бензотієнільну або хінолільну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену та нерозгалуженої або розгалуженої (С1-С4)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену. 3 7. Сполука формули (І) за п. 1, де R являє собою 1-бензотієнільну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену та нерозгалуженої або розгалуженої (С1-С4)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену. 3 8. Сполука формули (І) за п. 1, де R являє собою 1-бензотієн-2-ільну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома галогену та нерозгалуженої або розгалуженої (С1-С4)алкільної групи, що є не заміщеною або заміщеною одним або більше атомами галогену. 3 9. Сполука формули (І) за п. 1, де R являє собою 1-бензотієн-2-ільну групу, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з атома фтору, атома хлору, трифторметильної групи та метильної групи. 10. Сполука формули (І) за п. 1, яка вибрана з групи: • 5-(4-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2H-[1,3]оксазоло[4,5-h][2,3]-бензодіазепін-2-он; • 8-метил-5-(6-хіноліл)-1,9-дигідро-2H-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он; • 5-(1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]бензодіазепін-2-он; • 5-(5-хлор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]-бензодіазепін-2-он; • 5-[3-хлор-4-(трифторметил)-1-бензотієн-2-іл]-8-метил-1,9-дигідро-2Н-[1,3]-оксазоло[4,5h][2,3]бензодіазепін-2-он; • 8-метил-5-[4-(трифторметил)-1-бензотієн-2-іл]-1,9-дигідро-2H-[1,3]оксазоло-[4,5h][2,3]бензодіазепін-2-он; • 5-(6-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]-бензодіазепін-2-он; • 5-(7-фтор-1-бензотієн-2-іл)-8-метил-1,9-дигідро-2Н-[1,3]оксазоло[4,5-h][2,3]-бензодіазепін-2-он. 11. Спосіб одержання сполуки формули (І) за п. 1, який відрізняється тим, що як початковий матеріал використовують сполуку формули (II): R 1 R H2 N 2 O HO 50 , (II) 1 2 де R та R є такими, як визначено для формули (І), де сполуку формули (II), у вільній формі або у формі солі, далі піддають реакції циклізації в присутності 1,1'-карбонілдіімідазолу з одержанням сполуки формули (III): 16 UA 112153 C2 R 1 H N R O 2 O O , (III) 1 2 де R та R є такими, як визначено для формули (І), яку піддають реакції з відновлювальним реагентом з утворенням сполуки формули (IV): R 1 H N R O OH O 5 , (IV) 1 2 де R та R є такими, як визначено для формули (І), яку далі обробляють сполукою формули (V): 3 R —СНО (V), 3 де R є таким, як визначено для формули (І), з одержанням сполуки формули (VI): R 1 H N R O R 3 R 1 , (VI) 1 2 3 де R , R та R є такими, як визначено для формули (І), яку далі обробляють окиснювачем, з наступним утворенням солі, з одержанням сполуки формули (VII): H N R O O O R 20 + X 1 , (VII) 1 2 3 де R , R та R є такими, як визначено для формули (І), та X являє собою протиіон, такий як СlO4 , Сl , Br , HSO4 , яку далі обробляють гідразином з одержанням сполуки формули (І), де сполука формули (І) далі може бути очищена відповідно до стандартної методики розділення, перетворена, за бажанням, на адитивні солі з фармацевтично прийнятною кислотою, та за необхідності розділена на ізомери, якщо такі існують, відповідно до стандартної методики розділення. 12. Спосіб одержання сполук формули (І) за п. 1, який відрізняється тим, що як початковий матеріал використовують сполуку формули (VIII): H N R O O 25 2 3 R 15 2 O O 10 2 Br 2 O , (VIII) 1 2 де R та R є такими, як визначено для формули (І), для якої здійснюють стадію введення захисної групи для карбонільної групи, з одержанням сполуки формули (IX): 17 UA 112153 C2 R 1 R H N O O O O 2 Br , (IX) де R та R є такими, як визначено вище, яку далі обробляють сполукою формули (X): 1 2 O R 3 N OMe Me 5 , (X) де R є таким, як визначено для формули (І), з одержанням сполуки формули (XI): 3 R 1 R H N O O O O 2 O R 3 , (XI) 1 2 3 де R , R та R є такими, як визначено для формули (І), яку далі піддають реакції циклізації з одержанням сполуки формули (VII): R 1 H N R O O O 10 15 20 25 30 R 2 + X 3 , (VII) 1 2 3 де R , R та R є такими, як визначено для формули (І), та X являє собою протиіон, такий як СlO4 , Сl , Br , HSO4 , яку далі обробляють гідразином з одержанням сполуки формули (І), де сполука формули (І) далі може бути очищена відповідно до стандартної методики розділення, перетворена, за бажанням, на адитивні солі з фармацевтично прийнятною кислотою, та за необхідності розділена на ізомери, якщо такі існують, відповідно до стандартної методики розділення. 13. Фармацевтична композиція, що містить як активний інгредієнт сполуку за будь-яким з пп. 110 у сполученні з одним або більше інертними, нетоксичними, фармацевтично прийнятними носіями. 14. Фармацевтична композиція за п. 13 для застосування в лікуванні або профілактиці шизофренії, монополярної депресії, хвороби Альцгеймера, судинної деменції, розладів аутистичного спектра, синдрому Дауна, синдрому Мартіна-Белл, хвороби Паркінсона, хвороби Хантінгтона, генералізованої тривожності, панічного розладу з агорафобією або без неї, обсесивно-компульсивного розладу, посттравматичних стресових розладів, біполярних розладів, наслідків мозково-судинної катастрофи та наслідків травми головного мозку, спинного мозку або довгастого мозку. 15. Застосування сполук формули (І) за будь-яким з пп. 1-10 у виробництві лікарських засобів для застосування в лікуванні або профілактиці шизофренії, монополярної депресії, хвороби Альцгеймера, судинної деменції, розладів аутистичного спектра, синдрому Дауна, синдрому Мартіна-Белл, хвороби Паркінсона, хвороби Хантінгтона, генералізованої тривожності, панічного розладу з агорафобією або без неї, обсесивно-компульсивного розладу, посттравматичних стресових розладів, біполярних розладів, наслідків мозково-судинної катастрофи та наслідків травми головного мозку, спинного мозку або довгастого мозку. 18 UA 112153 C2 5 16. Сполука формули (І) за будь-яким з пп. 1-10 для застосування в лікуванні або профілактиці шизофренії, монополярної депресії, хвороби Альцгеймера, судинної деменції, розладів аутистичного спектра, синдрому Дауна, синдрому Мартіна-Белл, хвороби Паркінсона, хвороби Хантінгтона, генералізованої тривожності, панічного розладу з агорафобією або без неї, обсесивно-компульсивного розладу, посттравматичних стресових розладів, біполярних розладів, наслідків мозково-судинної катастрофи та наслідків травми головного мозку, спинного мозку або довгастого мозку. 19 UA 112153 C2 20 UA 112153 C2 Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 21
ДивитисяДодаткова інформація
Автори російськоюIstvan Ling, Jozsef Barkoczy, Michael Spedding, Ferenc Antoni, Istvan Gacsalyi, Gyorgy Levay, Laszlo Harsing
МПК / Мітки
МПК: A61P 25/00, A61K 31/4162, C07D 491/056
Мітки: фармацевтичні, спосіб, композиції, сполуки, містять, дигідрооксазолобензодіазепінонові, одержання
Код посилання
<a href="https://ua.patents.su/23-112153-digidrooksazolobenzodiazepinonovi-spoluki-sposib-kh-oderzhannya-ta-farmacevtichni-kompozici-shho-kh-mistyat.html" target="_blank" rel="follow" title="База патентів України">Дигідрооксазолобензодіазепінонові сполуки, спосіб їх одержання та фармацевтичні композиції, що їх містять</a>