Істотно чистий білок, що є тромболітиком, виділена днк, що його кодує, культура яйцеклітин xenopus laevis, трансформованих вектором, спосіб одержання активатора плазміногена, лікарський тромболітичний засіб
Номер патенту: 34415
Опубліковано: 15.03.2001
Автори: Алагон Алехандро, Хендлер Бернард Жак, Шлойнінг Вольф-Дітер, Доннер Петер, Лангер Гернот, Йєрн Вернер Бойдол, Кретцшмар Йєрн Райнер, Бальдус Бертольд
Текст
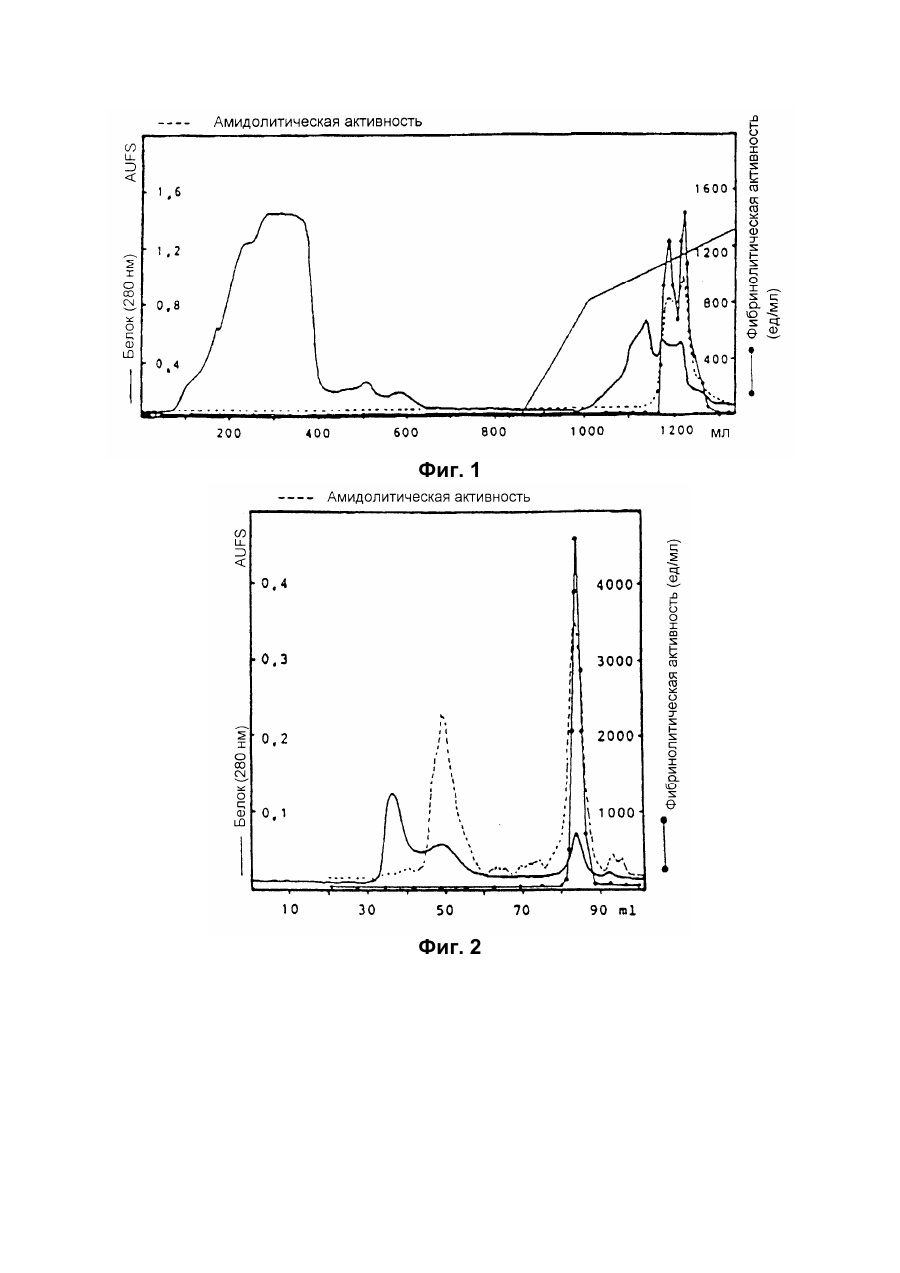
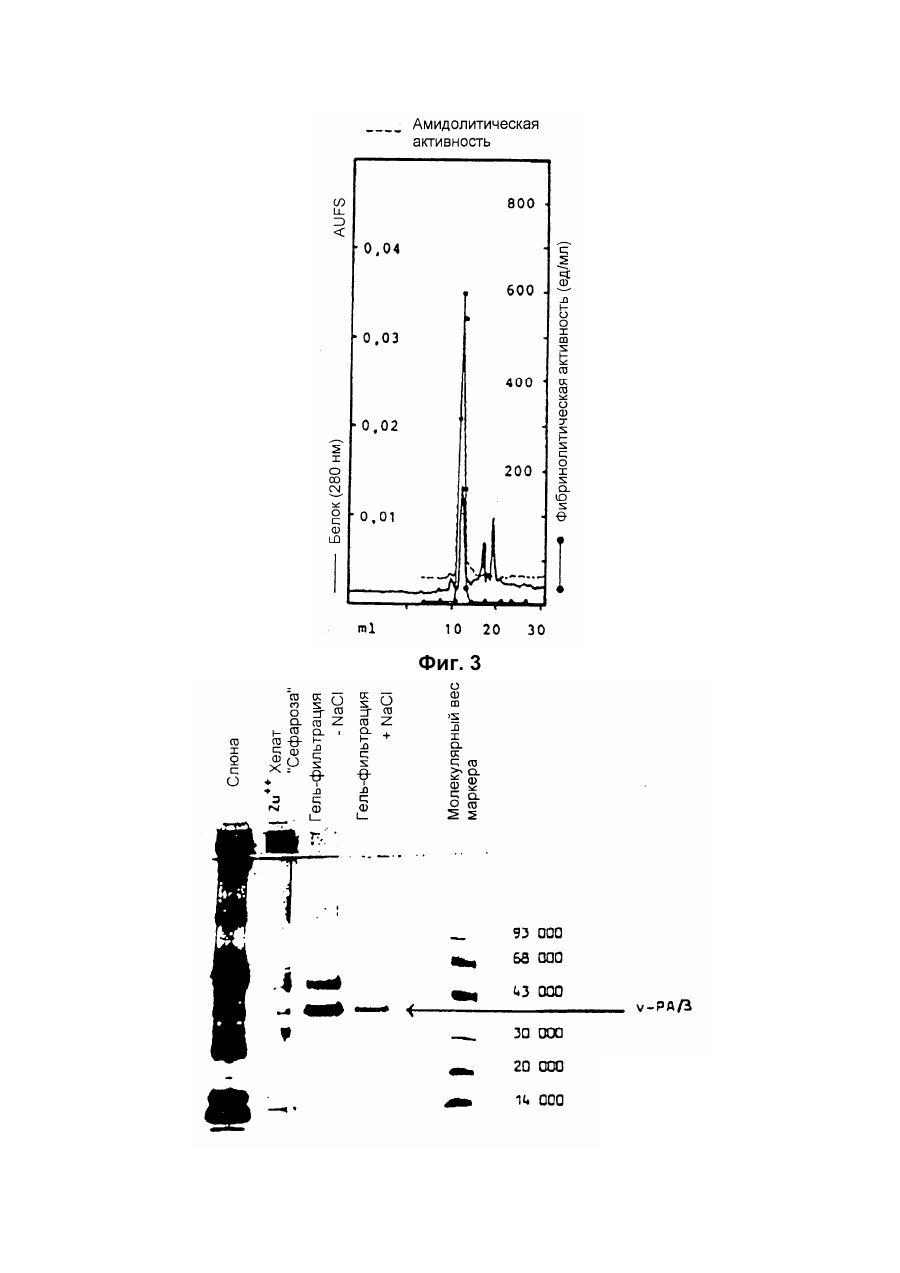
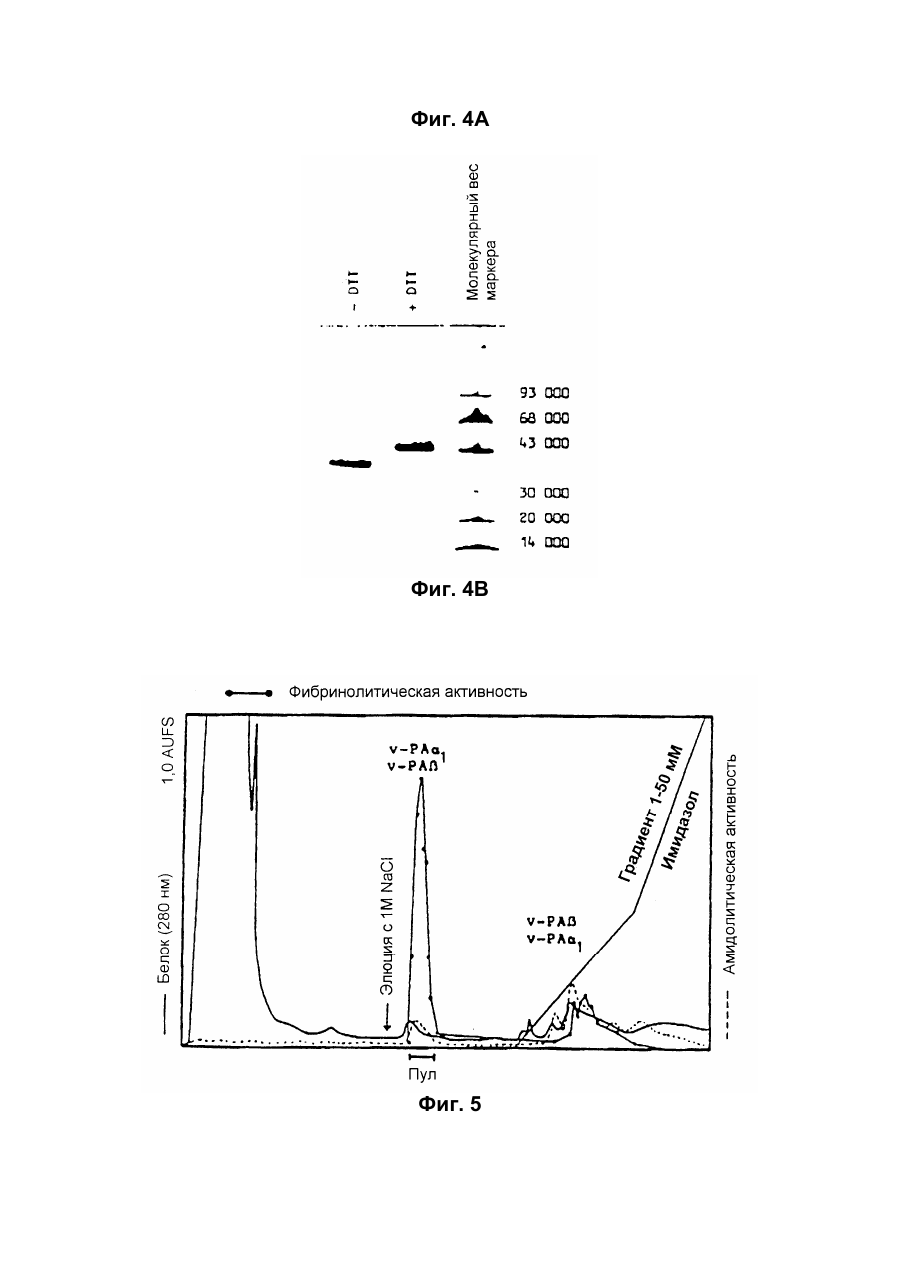
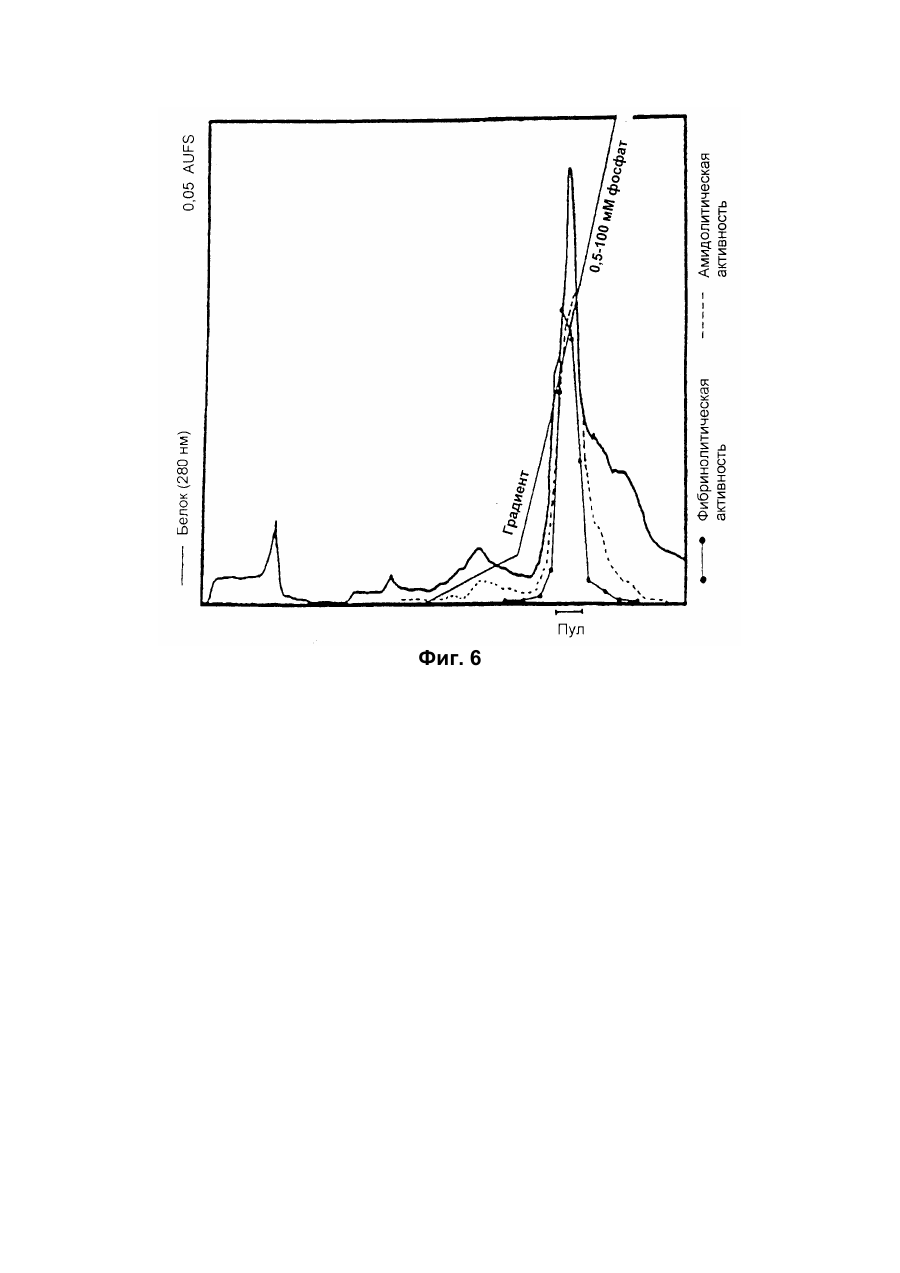
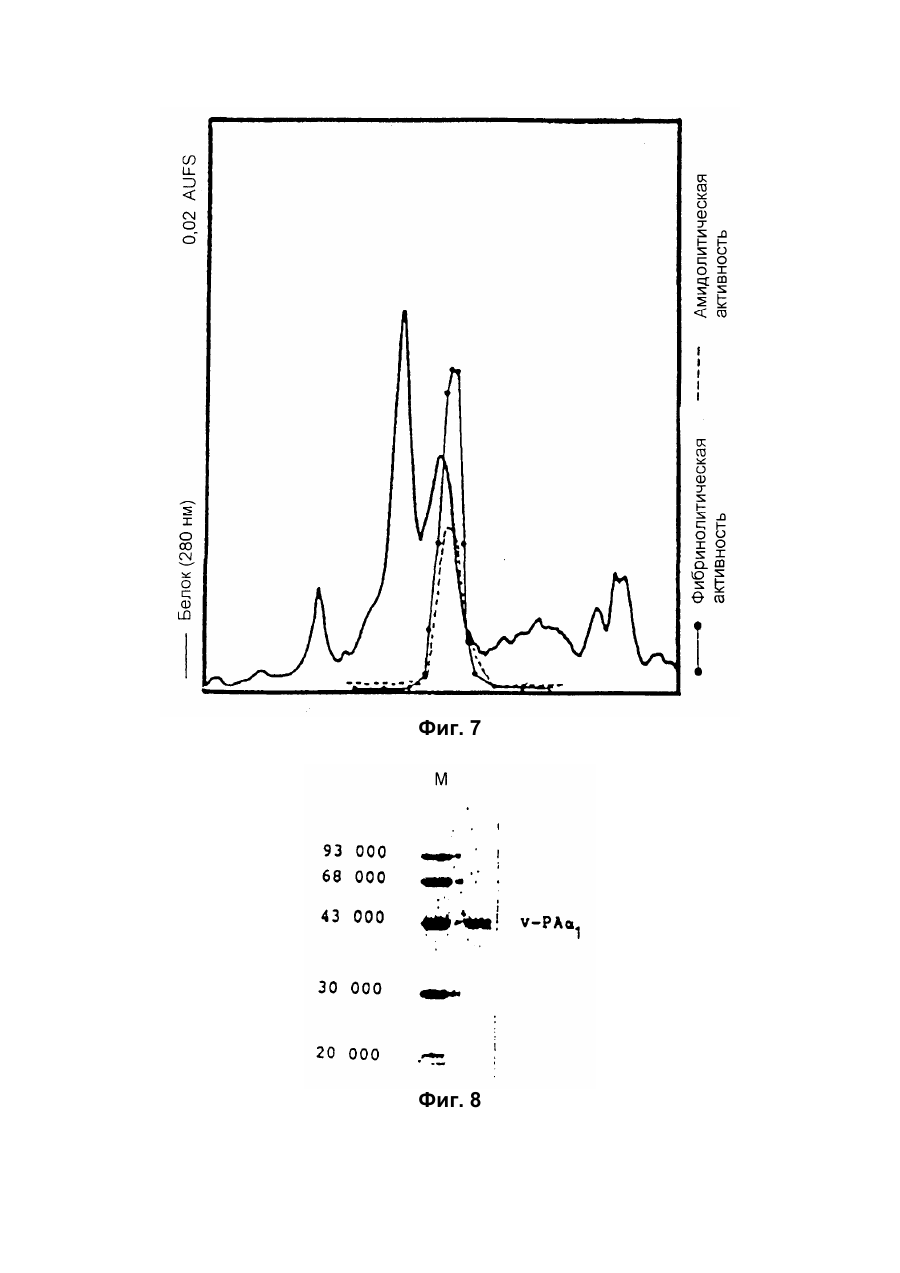
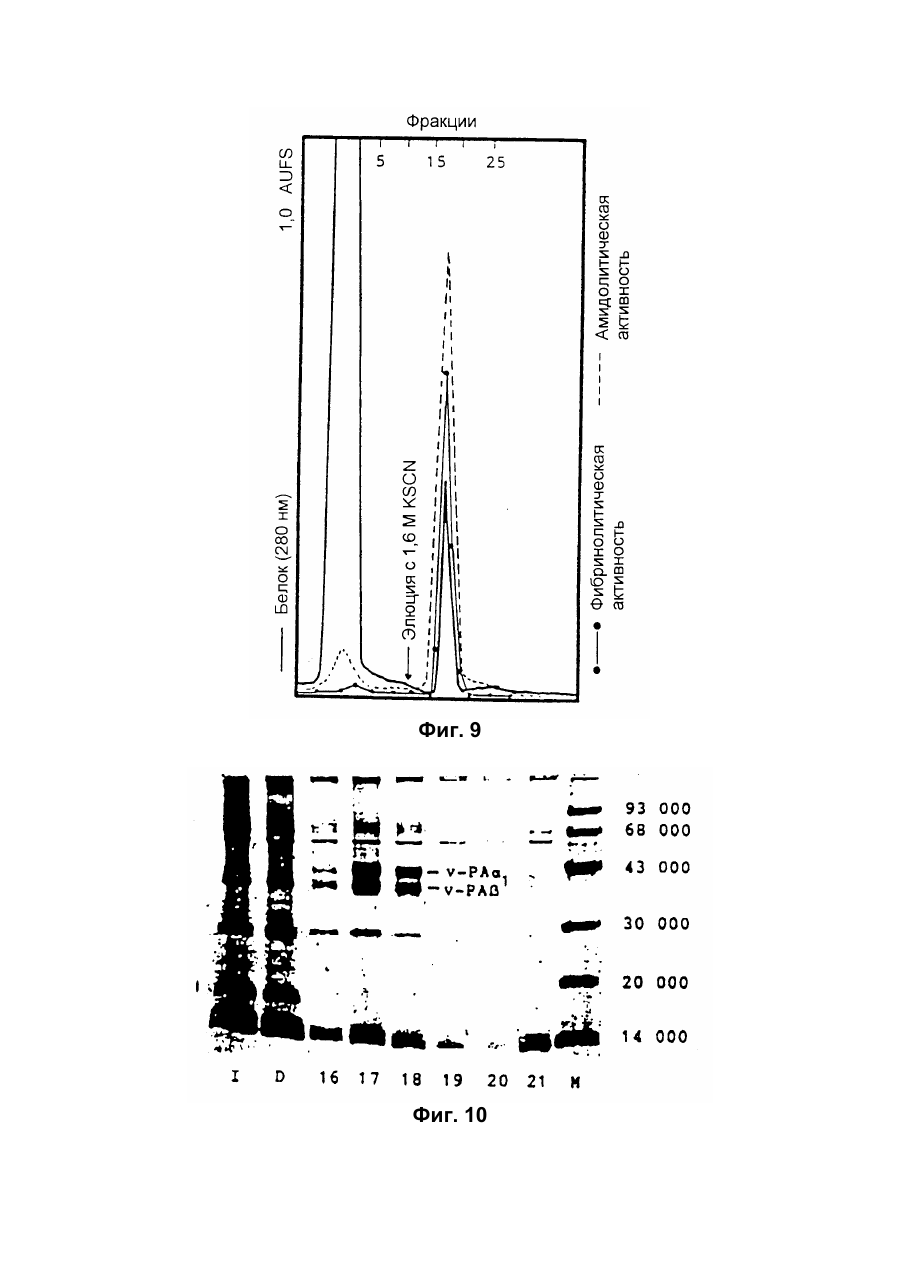
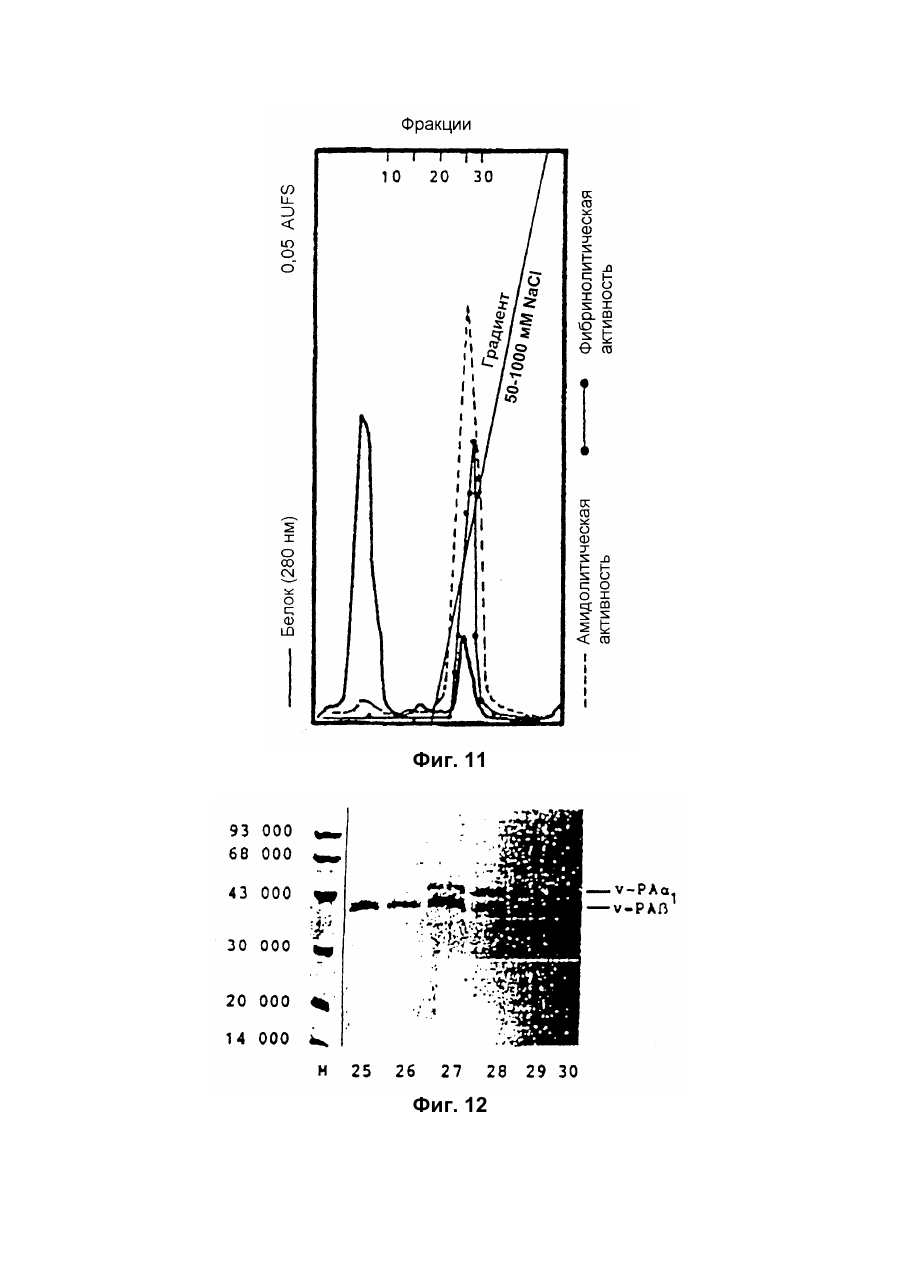
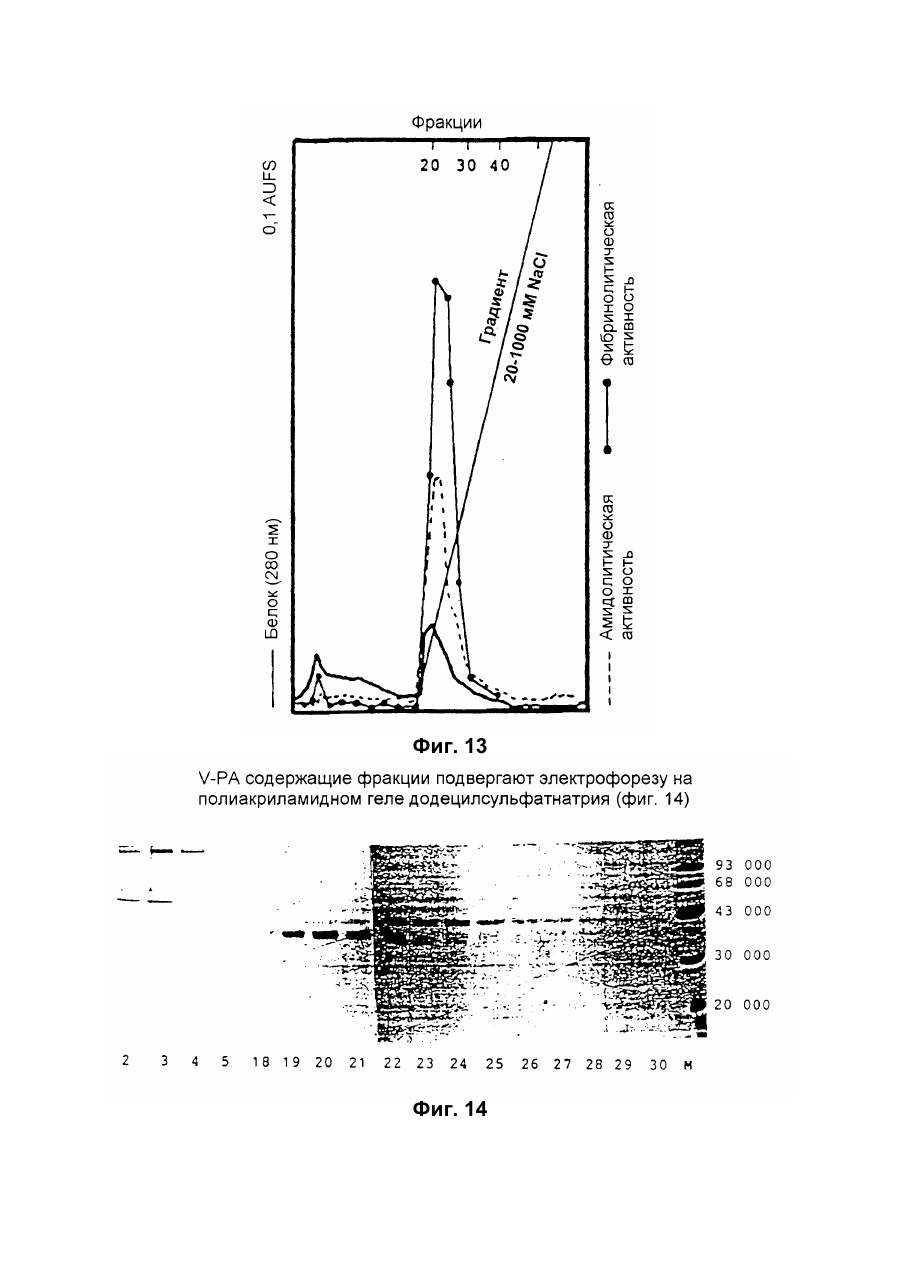
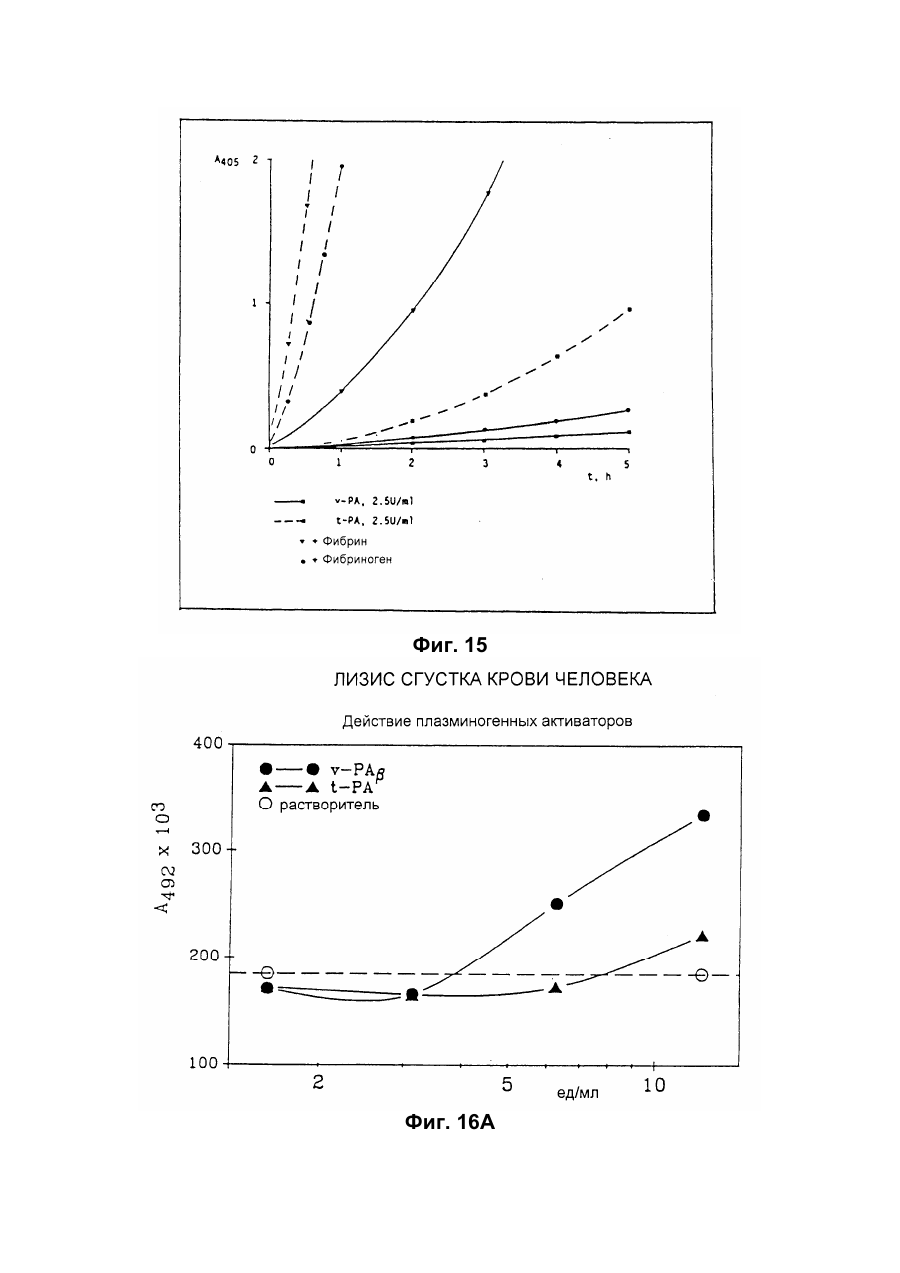
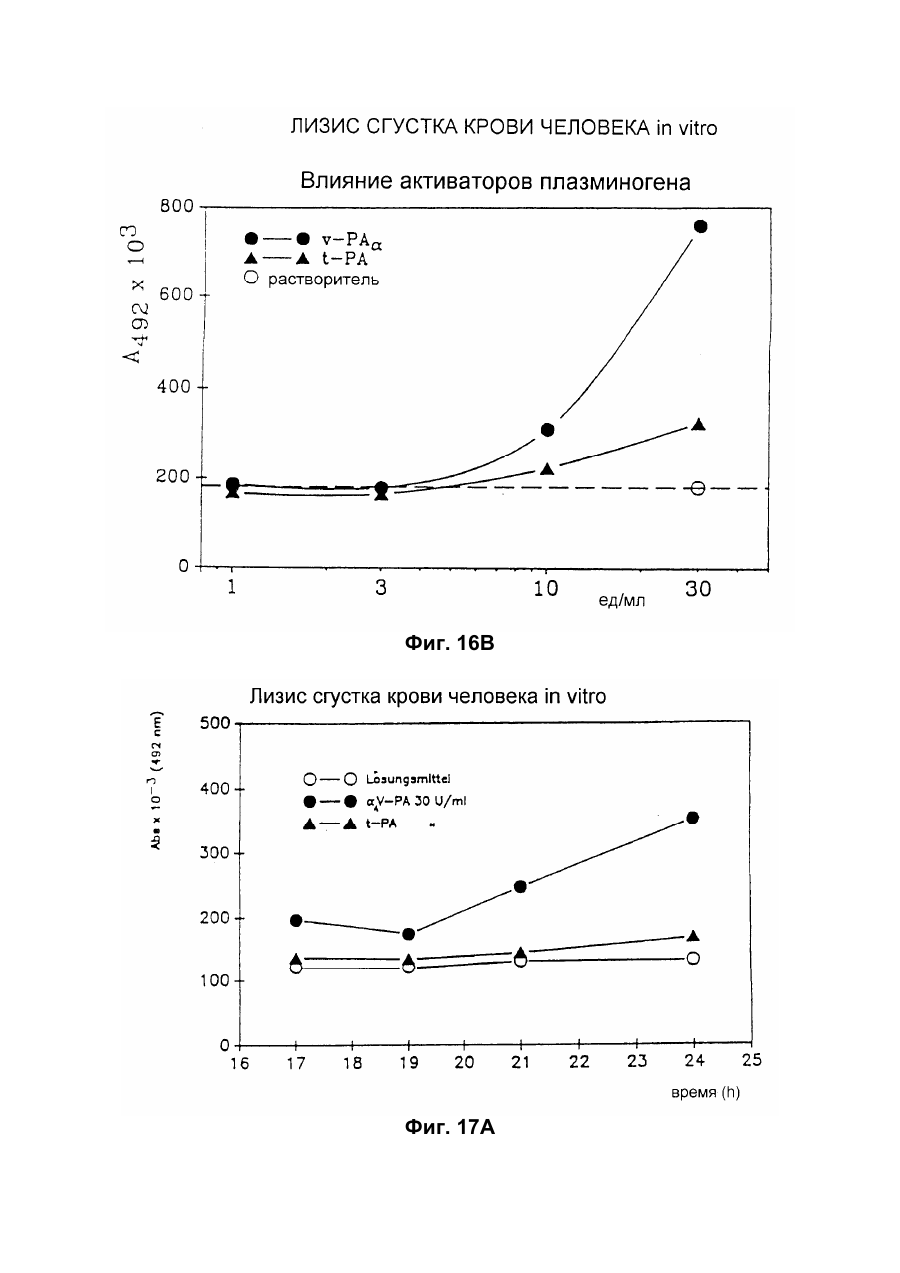
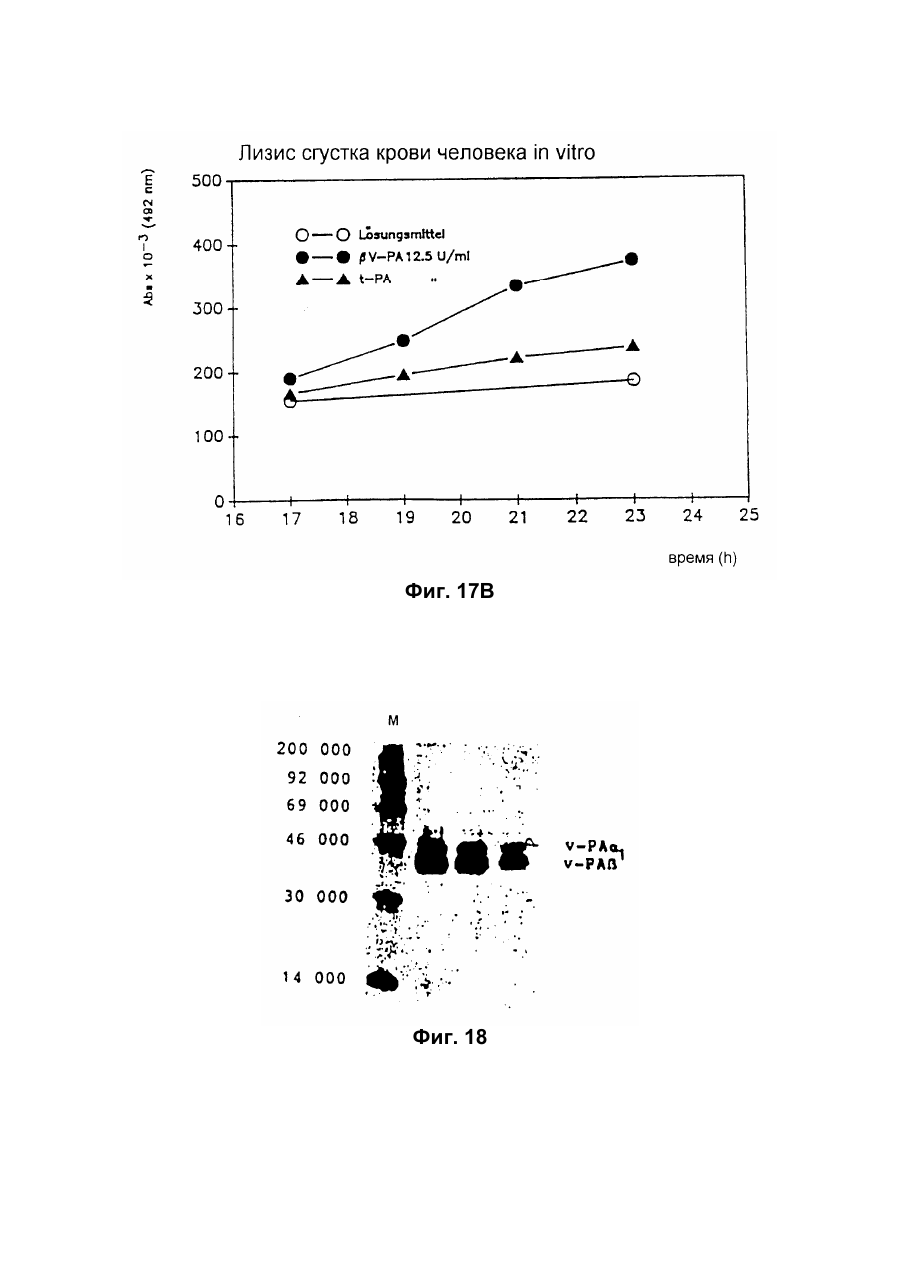
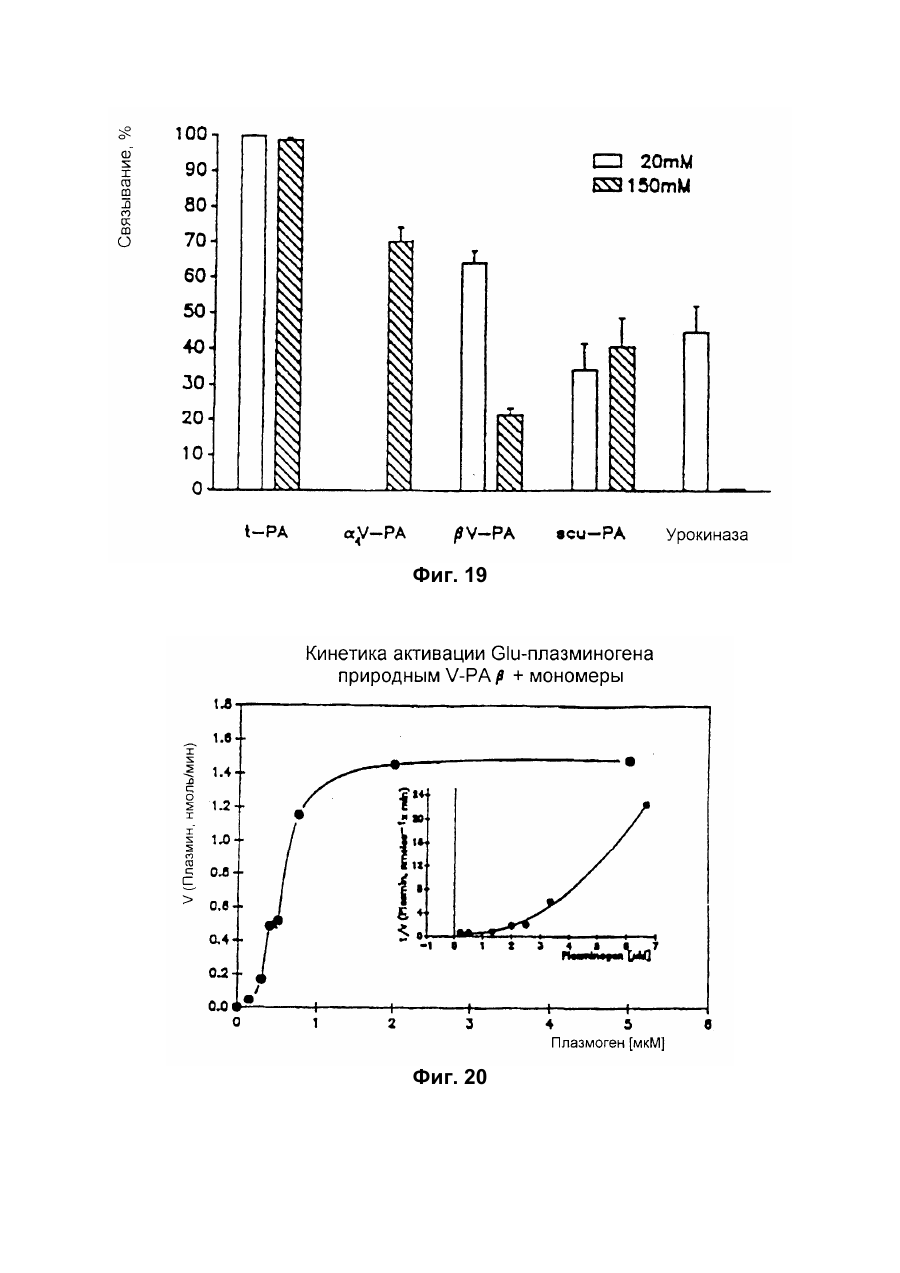
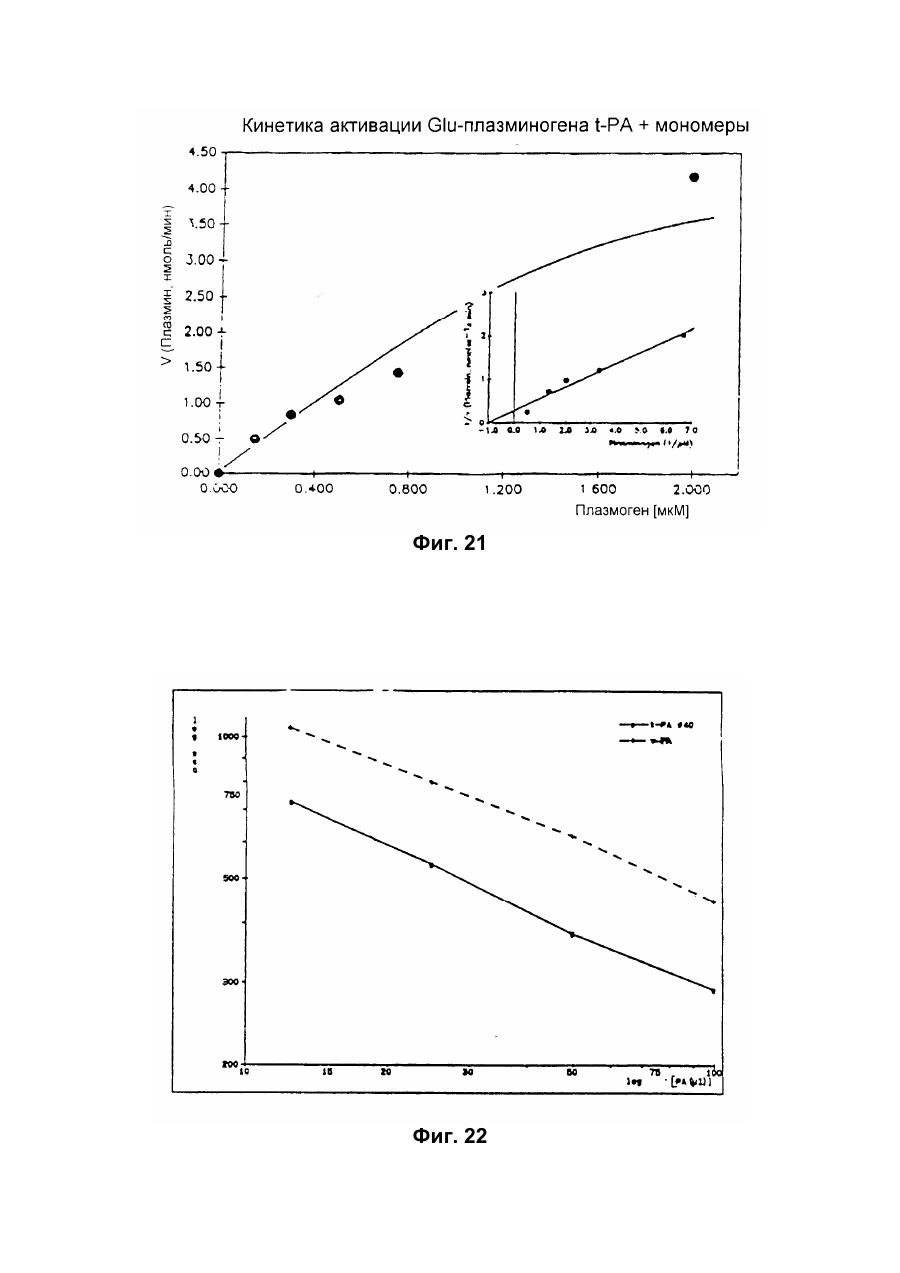
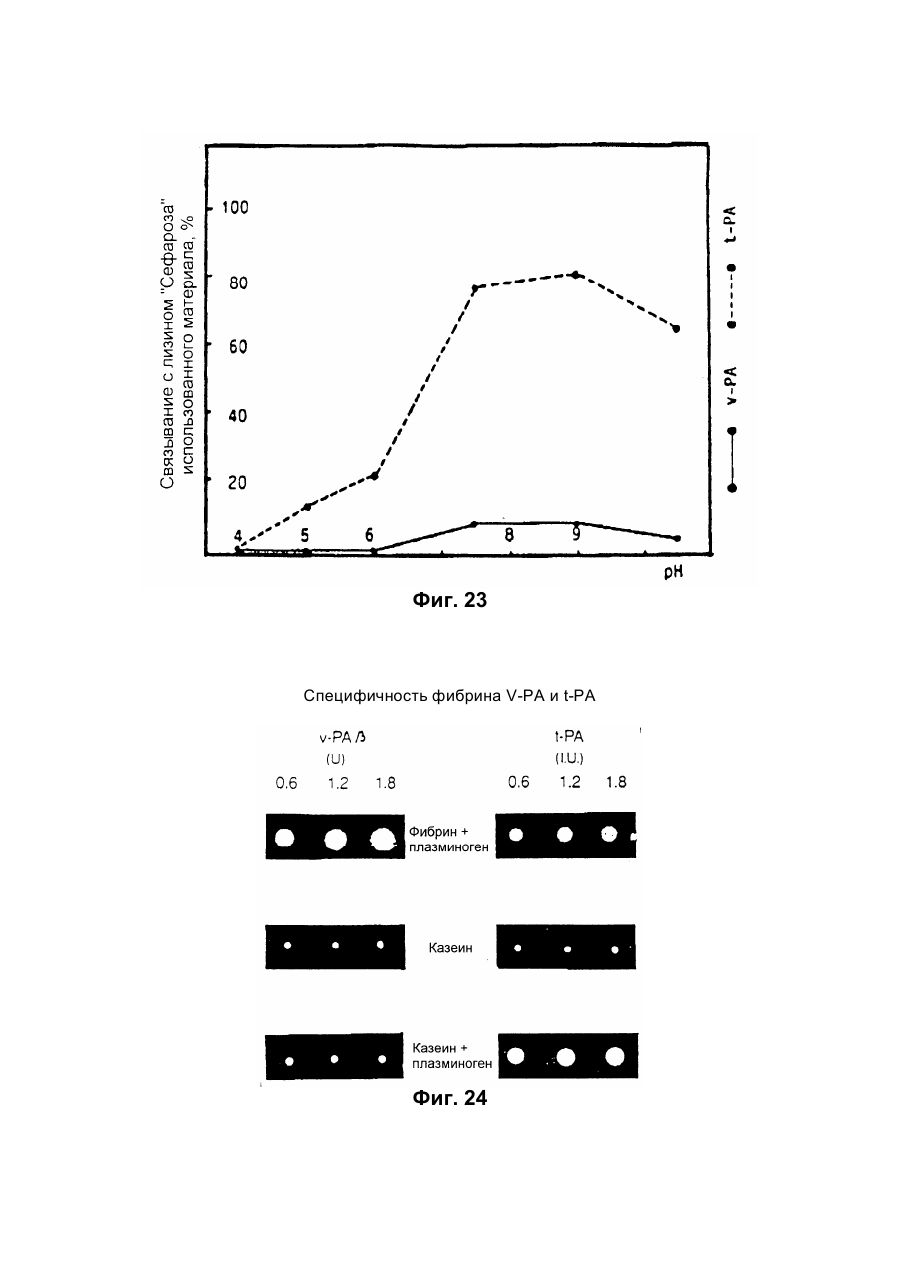
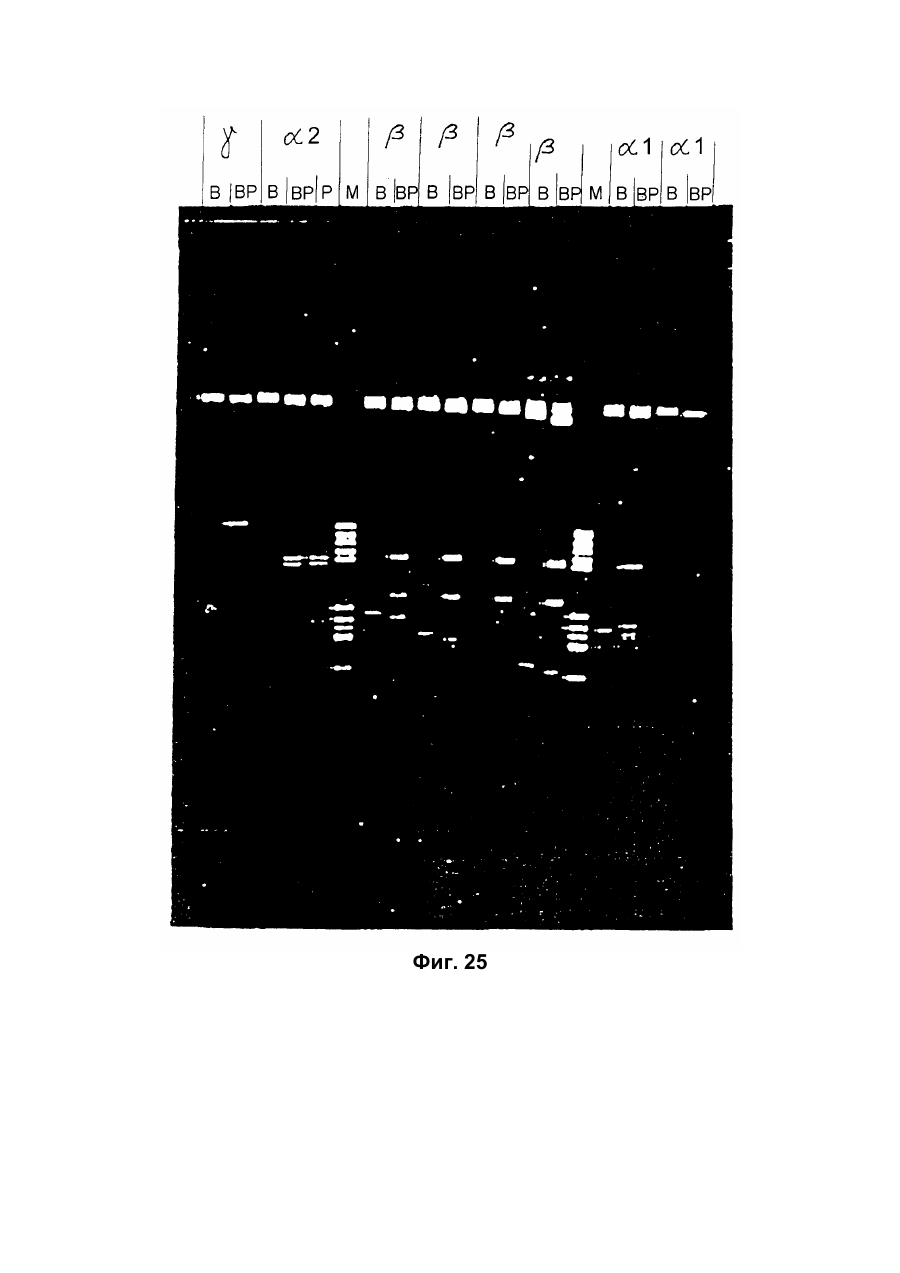
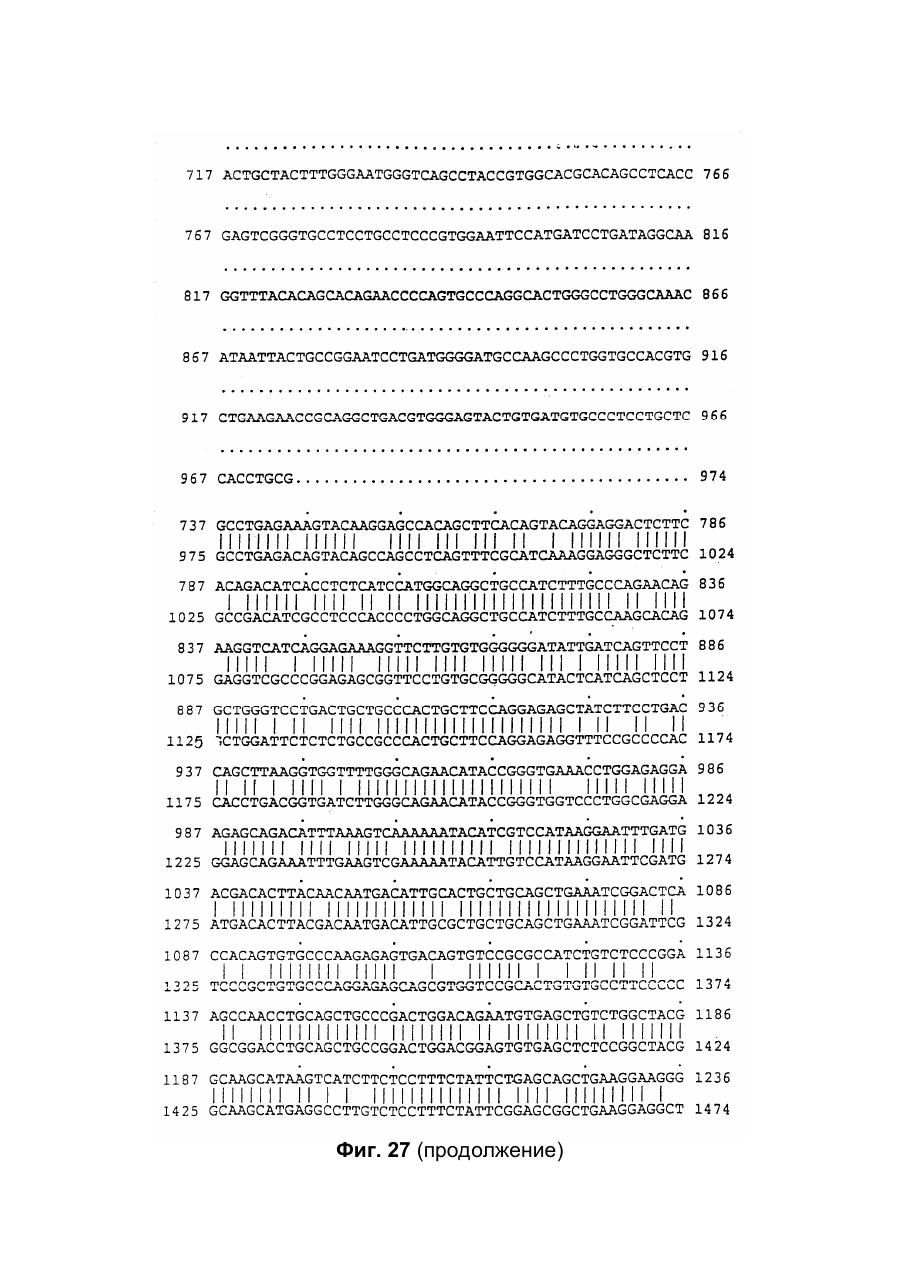
Настоящее изобретение относится к новому тромболитическому средству, способам его выделения и фармацевтического применения. Тромбозы обусловлены образованием сгустка крови в кровеносных сосудах. Различают венозные тромбозы, включая эмболию легочной артерии, и артериальные тромбозы, включая острый инфаркт миокарда. Эмболия легких и сердечный инфаркт являются опасными для жизни заболеваниями, требующими неотложного медицинского вмешательства. Кроме различных инвазивных способов, в последние годы развивается популярная форма терапии артериальных и венозных тромбозов, а именно ферментный тромболиз с плазминогенными активаторами. Эти вещества (названные тромболитиками) превращают плазминоген, неактивный профермент системы фибринолиза в крови, в активный протеолитический фермент, плазмин. Плазмин, в свою очередь, растворяет волокнистое вещество, фибрин, которое является основным компонентом кровяного сгустка; это приводит к открытию заблокированных сосудов и восстановлению кровяного потока. Однако плазмин является относительно неспецифической протеазой, т.е. однажды образовавшись в крови, она разрушает путем протеолиза компоненты крови, необходимые для интактного гемостаза (например, фибриноген) и в связи с этим при определенных обстоятельствах вызывает риск появления токсина, вызывающего кровоточивость тканей. Тромболитики первого поколения, стрептокиназа и урокиназа, являются соединениями, которые, будучи однажды введенными в систему кровообращения, систематически превращают плазминоген в плазмин и вызывают общий протеолиз. Поэтому терапевтическое лечение тромболиза с помощью этих веществ часто сопровождается осложнениями, обусловленными кровотечением. Для решения этой дилеммы был предложен фибрин-специфичный тромболиз, в котором применяются рекомбинантные плазминогенные активаторы тканевого типа, названные в целях краткости t-PA. В кровообращении t-PA имеет только низкое сходство с плазминогеном. Однако в присутствии волокнистого вещества, фибрина, с которым t-PA взаимодействует специфичными местами связывания, это сходство возрастает за счет многочисленного, результирующего в плазмине образования на поверхности тромба. Эта концепция может быть проверена in vitro и в экспериментах с животными. Клинические исследования тем не менее показывают, что для достижения быстрого растворения коронарного тромбоза требуются большие количества t-PA. Однако, если введены дозы t-PA такой величины, то это приведет к общему протеолизу, сопровождаемому относительным риском кровотечения, подобно тому, как это происходит в случае со стрептокиназой и урокиназой. Следовательно, сегодня речь идет об относительной фибринной специфичности t-PA. Причина этого заключается в основной характеристике t-PA: эта молекула является активной протеазой, которая при благоприятных условиях (высокая ферментная концентрация, длительная выдержка по времени, высокая концентрация субстрата, оптимальное значение рН и ионного окружения) будет превращать плазминоген в плазмин даже в отсутствии фибрина. Все эти условия имеются при проведении клинической стандартной терапии с t-PA. Во время исследований, для более специфичных плазминогенных активаторов, удовлетворяющих критерию специфичности фибрина, было найдено новое природное соединение, проявляющее фибринолитическую активность, называемое V-PA. Изобретение касается тромболитически активного вещества V-PA, полученного из слюны летучих мышей рода Desmodus spec., отличающегося следующими характерными свойствами: были открыты четыре различных кДНК из банка кДНК, полученных из слюнных желез, которые кодируют четыре различных V-PA белка: (1) V-PA a1: высокомолекулярная форма, состоящая из пальцевой области, области эпидермального фактора роста (EGF) , области Крингеля и области протеазы (пример 18). (2) V-PA a2: высокомолекулярная форма с теми же областями, что и V-PA a1, но отличная от V-PA a1 в нуклеотидной, также как и в аминокислотной последовательности. (3) V-PA b: молекулярная форма, состоящая из области EGF, области Крингеля и области протеазы (пример 18). (4) V-PA g: низкомолекулярная форма, состоящая из области Крингеля и области протеазы. Основная белковая полоска активного вещества V-PA a1 демонстрирует молекулярний вес порядка 43000±2000 (пример 2) при электрофорезе в геле додецилсульфат натрия при невосстановительных условиях. Основная белковая полоска активного вещества V-РА b демонстрирует молекулярный вес порядка 39000±3000 при электрофорезе на геле додецилсульфатнатрия при невосстановительных условиях и молекулярный вес порядка 43000±2000 – при восстановительных условиях (пример 1). – Активность активного вещества V–РА b элюирована из гелевой фильтрационной колонны ("Супероза" 12) с молекулярным весом порядка 40000±3000 (пример 1). – Изоэлектрические точки (рI) активного вещества V–РА b находятся между 6,8 и 8,5. – Активное вещество взаимодействует с 3Н-диизопропил-фторфосфатом и таким образом является протеазой серина (пример 9) . – Активные вещества V–РА a1 и V–РА b гидролизуют хромогенные пептиды: S-2288 (Н-D-Іlе-Рго-АгgpNA) и S-2444 (300 сек. В противоположность этому, признаки разложения фибриногена отсутствуют и в контрольных дозах и в дозах, соединенных с новым активным веществом. Этот опыт показывает значительно более высокую, если не абсолютную, фибринную специфичность нового активного вещества VPA b по сравнению с t-PA. При анализе аликват, проведенном путем гель-электрофореза, можно утверждать, что фибриноген в дозах с активным веществом нельзя отличить от фибриногена в контрольных дозах даже после 6 часов инкубации, поскольку может быть обнаружен только расщепленный фибриноген в дозах с t-PA после периода, равного только 2 часам. Пример 11 Связывание фибрина различных плазмино-генных активаторов и V-PA a1 и V-PA b В препаровальной кювете инкубируют при 37°С в течение 10 минут 100 л не содержащего плазминогена фибриноген (2 мг/мл) в РВS/0,01% "Твин" 80, 10 мл соответствующих плазминогенных активаторов в различных концентрациях и 10 мл тромбина (0,3 ед) . Затем образованный таким образом фибрин удаляют путем центрифугирования в течение 5 минут при 10000 г, а активность остаточного плазминогенного активатора определяют в супернатанте посредством метода чашечного (пластинчатого) тестирования фибрина и приводят в соответствие с исходным объемом. Параллельно с этим, при тех же условиях, готовят растворы плазминогенных активаторов без фибрина (контрольный; нет связывания). Фиг.19. Связывание РА с не содержащим плазминоген фибрином. V-PA a1 демонстрирует похожее хорошее связывание фибрина как и t-PA (фиг.19) . В противоположность этому, V-PA b проявляет существенно более слабое фибринное родство, чем V-PA a1. Это фибринное родство, проявляемое V-PA b, является, кроме того, сильно зависящим от концентрации NaCl (фиг. 19 см. в приложении). Пример 12. Сравнительные кинетики Glu-плазминогенной активации с помощью t-РА и V-PA b (A) В сосуде инкубируют в 20 мМ Трис рН 7,4 и 170 мл 20 мМ Трис рН 7,4/0,01% Твин 80 при 37°С и помешивании 20 мл плазминогенного активатора, 10 мл мономера в фибрине (60 мг/мл) в 20 мМ Трис рН 7,4/600 мМ мочевины, 50 мл плазмин не содержащего плазминогена (возможные концентрации от 0 до 6 мМ в полной реакционной дозе) . (B) В дополнительных трубках при 37°С содержат соответственно 100 мл хромогенного, плазмин-специфичного субстрата S 2251 (3 мМ) в воде и 400 мл 20 мМ Трис рН 7,4/180 мМ NaCl. В различные моменты времени отбирают 20 мл из (А) и переносят в трубку (В), инкубируют в течение следующего часа при 37°С и реакцию останавливают 300 мл 1М лимонной кислоты. Плазмин, образовавшийся в инкубационной дозе, расщепляет пептидную группу хромогенного субстрата S 2251 с высвобождением р-нитроанилина. Указанный р-нитроанилин измеряют фотометрически при 405 нм. Аналогично описанной выше схеме получают градуировочную кривую с чистым плазмином, на основании которой можно непосредственно рассчитать концентрацию образованного плазмина. На фиг.20 (V-PA b и фиг.21 (t-PA) - нанесены полученные данные. Для этой цели скорость образования плазмина нанесена напротив концентрации плазмина. В случае с t-PA получена типичная кинетика Михаэлиса-Ментена. При перенесении указанных данных t-PA на график Лайнвэйвера-Барка (вставка на фиг. 21) получают прямую линию. Совершенно отличная картина получается при нанесении на график данных V-PA b. Плазминогенный активатор V-PA b демонстрирует отличное кинетическое поведение от t-PA. Полученная кривая не следует кинетике Михаэлиса-Ментена, но демонстрирует типичное поведение аллостерического фермента; график Лайнвэйвера-Барка также дает типичную кривую для аллостерического фермента (фиг. 20) . Плазминогенный активатор V-PA b в отличие от t-PA является аллостерическим ферментом. Пример 13 Действие V-PA b на восстановленную систему растворения сгустка (International Clot-Lysis Assay) Очищенный фибриноген человека получен для свертывания с тромбином в присутствии постоянного количества плазминогена человека и различных концентраций плазминогенного активатора. В образованном таким образом сгустке плазминоген затем превращается в плазмин с помощью плазминогенных активаторов. Этот плазмин, в свою очередь, растворяет волокнистое вещество фибрин в сгустке. Замеряют время между добавлением тромбина и полным растворением сгустка и наносят двойным логарифмированием на концентрацию плазминогенного активатора. В соответствии с описанным выше правилом, 12,5100 мл забуференного раствора очищенного активного вещества тестируют и сравнивают с 12,5-100 Иед. t-PA. Результаты приведены на фиг. 22. Новое активное вещество V-PA b, по сравнению с t-PA, дает параллельную кривую концентрация эффект. 100 мл раствора очищенного активного вещества содержат, в соответствии с данными теста, около 40 единиц t-PA - сравнимой активности. Более детальное описание теста: Лиофилизованный контрольный тромбин (Behring, Марбург) растворяют в 1 мл дистиллированной воды. Это составляет 30 ед/мл активности. Плазминоген человека (Kabi, Мюнхен) растворяют в 2 мМ НС1+50% глицерина+5 г/л PEG 6000. Активность в результате составляет 10 Ед/мл. Фибриноген человека (Kabi, Мюнхен) доводят до концентрации 2 мг/мл свертываемого белка в фосфатном буфере, имеющем следующий состав: 1,605 г/л КН2РO4; 8,58 г/л Na2HPO4 x x 2H2O; 100 л/л Твин 80; 500 мг/л сывороточного альбумина человека. Стандартный t-PA разбавляют до активности 1000 Иед/мл. 20 мл плазминогена+100 мл тромбина вносят пипеткой в контрольную трубку и инкубируют при 37°С. 1 мл фибриногена и 12,5-100 мл плазминогенного активатора добавляют одновременно и включают секундомер. Через 2 минуты на сгусток помещают стеклянный шарик (диаметром 6 мм). Как только стеклянный шарик достигнет дна контрольной трубки, секундомер останавливают и записывают время. Пример 14 Связывание V-PA b и t-PA с лизином "Сефароза" 4В Плазминные активаторы доведены до соответствующих значений рН и обработаны при этих условиях лизином "Сефароза". Лизин "Сефароза" тщательно промывают, а активность определяют в комбинированных супернатантах. Опыты по элюции с малыми количествами V-PA можно не проводить. Пример 15 Казеинолизис V-РА b и t-PA Активность плазминогенных активаторов может быть определена с помощью так называемого теста фибриновых пластинок (Astrup Т and Mullertz in Arch Biochem.Biophys. 40:346-351, 1952). Плазминогенные активаторы инкубируют в предварительно пробитых отверстиях при 37°С. В случае присутствия плазминогена образованный таким путем плазмин будет лизировать фибрин, и образуется ореол лизиса, диаметр которого зависит от концентрации примененного плазминогенного активатора. Ожидается, что фибриноспецифичный плазминогенный активатор не будет взаимодействовать с другими белками, а только с фиб рином. Это может быть проверено описанными выше способами, заменяя фибрин казеином с плазминогеном (фиг. 24 ). Как видно из фиг. 24, V-PA b, по сравнению с t-PA, не демонстрирует появление ореолов лизиса гделибо на плазминогенсодержащих казеиновых пластинках. Эти точки подтверждают абсолютную фибринную специфичность V-PA b. Пример 16 Определение Кm значения различных амидолитических субстратов с плазминогенными активаторами t-PA, урокиназой и активных форм V-PA a1 и V-PA b В чашечке (пластинке) с 96 отверстиями инкубируют соответственно 90 мл 100 мМ Трис рН 8,0 (100 мл NaCl) 0,01% Твин 80 и 50 мл соответствующего хромогенного субстрата (все из Стокгольма, Швеция) с конечной концентрацией, равной 0,03/0,06/0,1/0,3/0,6 и 1 мМ с 10 л (3 единицы на отверстие) соответствующего плазминогенного активатора при 37°С, а высвобождаемый таким образом р-нитроанилин определяют фотометрически при 405 нм в различных точках в период времени от 1 до 7 часов. Результирующие данные были обработаны с помощью графика Лайнвэйвера-Барка, а значение Кm определено (Segel, I.M. Enzyme Kinetics, John Weley and Sons, New York). Были использованы следующие хромогенные субстраты: H-D-Val-Leu-Lys-pNa (S-2251) H-D-Ile-Pro-Arg-pNa (S-2288) 80%). Последовательности выделенных белков также демонстрируют высокую идентичность последовательности с частями t-PA человека (>70%). Ни один из клонов не содержит кДНК для полного гена плазминогенного активатора летучей мышивампира. Парциальные последовательности одного из этих клонов служат в качестве пробы для скрининга дополнительного банка генов кДНК из слюнных желез. (Пример 18). Пример 18 Выделение, идентификация и секвенирование полных клонов кДНК плазминогенных активаторов из слюнных желез Desmodus rotundus 1. Получение банка генов кДНК из РНК слюнных желез Desmodus rotundus Выделяют целую РНК из слюнных желез летучих мышей-вампиров (D.rotundus) путем разложения изотиоцианатом гуанидина и последующим ультрацентрифугированием посредством хлоридцезиевой прокладки (I). Из трех миллиграмм лиофилизованной целой РНК получают 80 мг поли А+ РНК путем дважды проведенной аффинной хроматографии на олигодеокситимидиновой целлюлозе (2,3). Пять микрограмм этого препарата использовано для синтеза кДНК согласно методу Габлера и Хоффмана (4) с некоторыми модификациями "LAP-cDNA" Synthesis Kit, Stra-tagene (5,6). Синтез первой нити начинают с помощью олигонуклеотида, содержащего олиго-деокситимидиновую пропорцию и узнавание последовательности рестрикционной эндонуклеазы XhoI (6), и проводят путем обратной транскриптазы вируса лейкемии Moloney mirine с использованием 5-метилдеоксицитина. Вторую нить синтезируют с помощью E.coli ДНК полимеразы I в присутствии E.coli рибонуклеазы Н. Концы образованной таким путем двойной нити кДНК сглаживают Т4 ДНК полимеразой и затем связывают с EcoRI адаптерами с использованием Т4 ДНК липазы. Результирующие концы ДНК фосфолируют с помощью Т4 полинуклеотидной киназы. После гидролиза кДНК с рестрикционным ферментом XhoI, проводят гель-фильтрацию на "Сефарозе" CL-4B (Pharmacia). Комбинируют фракции, содержащие кДНК с минимальным размером 500 пар оснований; масса составляет около 1,2 мг кДНК. Одну треть этого количества получают для связывания с 3 мг EcoRI-XhoI гидролизованными рестрикцией и дефосфолированными ветвями вектора UniLAP(ТМ)ХР бактериофага (дополнительный патент) фирмы Stratagene (La Jolla, USA) (5,7). Дозу лигирования упаковывают в семь отдельных доз с использованием "Gigapack" II Cold Packaging экстрактов (Stratagene) (8). Таким путем получают первичный банк генов кДНК с более чем 4х106 рекомбинантных лямбда-бактериофагов. 2. Идентификация клонов кДНК плазминогенных активаторов из слюны летучей мыши-вампира Desmodus rotundus Пробой, используемой для идентификации клонов полной кДНК, является фрагмент ДНК, полученный рестрикционным разложением AluI-BamHI, длиной 76 пар оснований (нуклеотид 141-216 на рисунке 26с) из 5'-конца клона, выделенного из первого банка гена кДНК (см.пример 17). Этот фрагмент метят радиоактивно никтрансляцией (9) в присутствии [a-32p] трифосфата деоксиаденозина и используют для гибридизации "реплика" фильтров, на которых иммобилизуют ДНК из, общей сложностью, 1,2х105 рекомбинантных бактериофагов первичного банкгенов кДНК. (10). Температура гибридизации и промывания составляет 50°С. Окончательная промывка проводится в буфере 2xSSC (10) . Более чем 200 клонов испускают сигнал при ауторадиографии на "Replika" фильтрах, 50 клонов очищены путем раздельного засева на планшетах и повтора гибридизации на планшетах-фильтрах. Таким путем выделяют 38 клонов, которые при повторном скрининге дают четкий позитивный сигнал. 3. Идентификация и секвенирование клонов кДНК Плазмиду pBluescript SK, содержащуюся в изолированных позитивных клонах бактериофага UnitLAP(ТМ)ХР, являющуюся составной частью фрагмента кДНК, интегрированного в том же сегменте бактериофага, выделяют из бактериофага так называемым "иссечением in vivo" (7,14), получая таким образом в общем 35 различных клонов плазмид pBluescript SK, происходящими из позитивных клонов бактериофага. Плазмиды изолируют в соответствии с методом Бирнбойма и Долли (II), а их кДНК пропорцию делят на четыре различных класса a1, a2, b, g в соответствии с анализом рестрикции с ферментами BamHI и PstI (фиг.25) и ДНК секвенированием 5'-концов. Пропорции кДНК самых длинных кДНК клонов из всех четырех классов субклонируют в векторах М13 mp19 бактериофага (12) и секвенируют дидеоксинуклеотидным методом Зангера (набор "Секвеназа", United States Biochemical Corporation, Кливленд, США). (13, 15) используя, частично, олигонуклеотидные праймеры, которые специально синтезируют для этой цели и которые являются комплементарными последовательностями кДНК пропорций. Полные последовательности кДНК (включая короткий сегмент полиА цепочек, присутствующих на 3'-конце) с выделенными таким путем дебелковыми последовательностями представлены на фиг. 26 а, b, с, d. Фиг.25. Образец рестрикции отобранных клонов плазмиды pBluescript с соответственно самыми длинными пропорциями кДНК из четырех групп альфа I (2 плазмидных клона), альфа 2 (1 плазмидный клон), бета (4 плазмидных клона) и гамма (1 плазмидный клон). Плазмидные ДНК препараты, гидролизованные рестрикционными ферментами BamHI ("В"), PstI ("P") или смесью двух рестрикционных ферментов ("ВР"), были разделены на 1,8% гель-агарозе. Критерий размера представлен плазмидой рВР322 ("М", марке молекулярного веса ДНК 5 фирмы Boehringer-Mannheim), гидролизованной ферментом рестрикции HaeIII. Размер четко видимых фрагментов составляет 587, 540, 504, 458, 434, 267, 234, 213, 192 до 184 и 123 пар оснований (от вершины до основания) . После электрофоретического разделения гель-агароза был окрашен этилиумбромидом и сфотографирован. Из групп альфа I и бета левые наиболее окрашенные клоны были, соответственно, секвенированы. Рис.26а: полная ДНК последовательность встройки кДНК наиболее длинного плазмидного клона в группе альфа-1 с выделенной аминокислотной последовательностью. Кодирующая последовательность начинается с нуклеотида 94 (ATG...) и заканчивается терминирующим кодоном на нуклеотиде 1527 (...ТАА). Выделенная аминокислотная последовательность указана в однобуквенном коде, каждая аминокислота расположена под первым нуклеотидом триплета, которым она кодируется. Фиг.26b: полная ДНК последовательность встройки кДНК плазмидного клона типа альфа-2 с выделенной аминокислотной последовательностью. Кодирующая последовательность начинается нуклеотидом 85 (ATG...) и заканчивается терминирующим кодоном на нуклеотиде 1518 (...ТАА). Выделенная аминокислотная последовательность указана в однобуквенном коде, каждая аминокислота расположена под первым нуклеотидом триплета, которым она кодируется. Фиг.26с: полная последовательность ДНК встройки кДНК наиболее длинного обнаруженного плазмидного клона в группе бета с выделенной аминокислотной последовательностью. Кодирующая последовательность начинается нуклеотидом 117(ATG...) и заканчивается терминирующим кодоном на нуклеотиде 1412 (...ТАА). Выделенная аминокислотная последовательность указана в однобуквенном коде, каждая аминокислота расположена под первым нуклеотидом триплета, который ее кодирует. Фиг. 26d: полная ДНК последовательность встройки кДНК плазмидного клона типа гамма с выделенной аминокислотной последовательностью. Кодирующая последовательность начинается нуклеотидом 180 (ATG...) и заканчивается терминирующим кодоном на нуклеотиде 1364 (...ТАА). Выделенная аминокислотная последовательность указана в однобуквенном коде, каждая аминокислота расположена под первым нуклеотидом триплета, который ее кодирует. Пример 19 Конструирование векторов экспрессии, содержащих последовательности, кодирующие активное вещество V-PA, и тестирование их путем микроинъекции в ооциты Кодирующие последовательности из кДНК клонов форм V-PA a1, a2, b,, и получены путем гидролиза с рестрикционной эндонуклеазой EcoRI, и после обработки фрагментом Кленова E.coli ДНК полимеразы I, а также выделения из агароза-гелей с низкой температурой плавления, вшиты в сайт Xbal вектора pSVLEcoRI, наполненный фрагментом Кленова E.coli ДНК полимеразы I и обработаны фосфатазой кишечника теленка (Boehringer Mannheim). Правильная ориентация проверена BamHI. pSVL-EcoRI поражает производную коммерчески доступной SV40 эксперсионной плазмиды pSVL (Pharmacia) (см. приложение). Полученные таким путем векторы экспрессии очищают на градиенте хлорида цезия и используют для микроинъекции в ооциты. Инъекция ооцитов осуществляется согласно следующим перечисленным статьям. После внедрения культуры ткани в среду ооцитов, инъектированных векторами экспрессии V-PA, на фибриновом планшете, полученном с помощью среды Барта (см. литературу по п.2), образуются ореолы лизиса. Если вместо фибрин-планшета использовать казеин-планшет, то лизис не происходит (a1, a2, b) . Ооциты, инъектированные вектором, не содержащим последовательность V-PA, не дают ореола лизиса. кДНК последовательности V-PA содержат функциональную сигнальную пептидную последовательность, ответственную за вынос белка V-РА за пределы клетки. Эти результаты ясно показывают, что полученные таким путем клоны кДНК V-РА являются полными и после встройки в подходящий вектор экспрессии вырабатывают активное эффективное вещество, которое является абсолютно фибрин-специфичным. Фиг. 1 Фиг. 2 Фиг. 3 Фиг. 4А Фиг. 4В Фиг. 5 Фиг. 6 Фиг. 7 Фиг. 8 Фиг. 9 Фиг. 10 Фиг. 11 Фиг. 12 Фиг. 13 Фиг. 14 Фиг. 15 Фиг. 16А Фиг. 16B Фиг. 17А Фиг. 17В Фиг. 18 Фиг. 19 Фиг. 20 Фиг. 21 Фиг. 22 Фиг. 23 Специфичность фибрина V-PA и t-PA Фиг. 24 Фиг. 25 Фиг. 26а Фиг. 26а (продолжение) Фиг. 26b Фиг. 26b (продолжение) Фиг. 26с Фиг. 26с (продолжение) Фиг. 26d
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstantially pure protein, which is thrombolytic, isolated dna encoding thereof, xenopus laevis oocyte culture, process for the preparation of plasminogen activator, medicinal trombolytic agent
Автори англійськоюBaldus Berthold, Donner Peter, Shchleuning Wolf-Dieter, Alagon Alejandro, Yern Werner Boidol, Kraetzshchmar Joern Reiner, Handler Bernard Jacques, Langer Gernot
Назва патенту російськоюСущественно чистый белок, который является тромболитиком, выделенная днк, которая его кодирует, культура яйцеклеток xenopus laevis, трансформированных вектором, способ полученния активатора плазминогена, лекарственное тромболитическое средство
Автори російськоюБальдус Бертольд, Доннер Петер, Шлойнинг Вольф-Дитер, Алагон Алехандро, Йерн Вернер Бойдол, Кретцшмар Йерн Райнер, Хендлер Бернард Жак, Лангер Гернот
МПК / Мітки
МПК: C12N 9/64, C12N 9/72, C12N 1/21, A61K 35/24, C12N 15/58, C12N 15/09, A61P 7/02, A61K 38/46
Мітки: одержання, виділена, засіб, чистий, білок, тромболітичний, вектором, плазміногена, xenopus, активатора, laevis, кодує, істотно, днк, спосіб, культура, яйцеклітин, лікарський, трансформованих, тромболітиком
Код посилання
<a href="https://ua.patents.su/36-34415-istotno-chistijj-bilok-shho-eh-trombolitikom-vidilena-dnk-shho-jjogo-kodueh-kultura-yajjceklitin-xenopus-laevis-transformovanikh-vektorom-sposib-oderzhannya-aktivatora-plazminogena.html" target="_blank" rel="follow" title="База патентів України">Істотно чистий білок, що є тромболітиком, виділена днк, що його кодує, культура яйцеклітин xenopus laevis, трансформованих вектором, спосіб одержання активатора плазміногена, лікарський тромболітичний засіб</a>
Попередній патент: Похідні хроману, активні стосовно 5-нт рецептора, спосіб їх одержання та проміжні сполуки
Наступний патент: Ефіри циклогексеноноксимів та гербіцидний засіб
Випадковий патент: Спосіб консервативного лікування вузлів та кіст щитоподібної залози