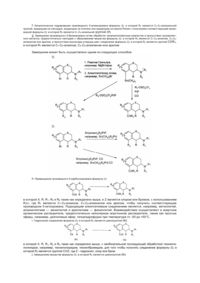
Похідні хроману, активні стосовно 5-нт рецептора, спосіб їх одержання та проміжні сполуки
Номер патенту: 34416
Опубліковано: 15.03.2001
Автори: Рені Люсі Анна, ТОРБЕРГ Сет-Олов, Росс Сванте Бертіл, Сонн Даніель Дунган, Свенссон Бьорн Ерік, Норен Рольф, Ларссон Ларс-Гюннар
Текст
Настоящее изобретение относится к замещенным 3-аминохроманам, их энантиомерам и солям, способу их получения, фармацевтическим композициям, содержащим такие соединения, а также к новым промежуточным соединениям. Целью этого изобретения является предоставление соединений, имеющих селективное действие на 5-гидрокситриптаминовые рецепторы у млекопитающих, включая человека. Терапевтически полезные 3-амино-дигидро(1)-бензопиран и бензотиопиран, обладающие эффектом в отношении 5-гидрокситриптаминовых неронов у млекопитающих, раскрыты в патенте ЕР 0222 996. Это соединения формулы: где Z является атомом кислорода или серы; R - атом водорода, или низший алкил; R1 - атом водорода, низший алкил или арил-низший алкил; R2 - атом водорода, низший алкил или арил-низший алкил; или R1 и R2 вместе образуют кольцо из 4-6 атомов углерода; R3 - атом водорода, гидрокси-, низший алкокси-, арил-низший алкокси-, ацилокси- или арилокси-группа, когда является атомом серы, и R3 является гидрокси-, низший алкокси-, арилнизший алкокси-; ацилокси-или арилокси-, когда Z - это атом кислорода, причем R3 находится в положении 5- или 8-, когда Z - атом кислорода; R4 и R5 независимо являются атомом водорода, низшим алкилом или галогеном, и их моно- или ди-Sоксидами, когда Z является атомом серы, и фармацевтически приемлемыми их солями. Гидрохлориды 3-хроманамина с двумя алкильными группами в ароматическом кольце, стимулирующие центральную нервную систему, описаны в журнале J. Med. Chem. 1972, том 15, с. 863-865. Целью настоящего изобретения является получение новых соединений, которые обладают высоким средством к 5-гидрокситриптаминовым рецепторам в центральной нервной системе и в то же время они действуют как агонисты, парциальные агонисты или антагонисты в отношении серотониновых рецепторов. Таким образом, группа новых веществ формулы (I) настоящего изобретения, а также их энантиомеры и соли, используются при терапевтическом лечении состояний, которые лечатся 5-гидрокситриптамином, и нарушений, таких как депрессия, беспокойство, потеря аппетита, старческое слабоумие, мигрень, заболевание Альцгеймера, гипертония, нарушений терморегуляции и сексуальных нарушений. Дополнительные аспекты этого изобретения связаны с использованием указанных веществ их энантиомеров и солей для подавления болевых ощущений и регулирования сердечно-сосудистой системы. Таким образом объектом данного изобретения являются соединения формулы (I): в которой Х является 0; R является водородом; R1 является водородом, C1-С6-алкилом или С2-С6-алкенилом; R2 является водородом, C1-С6-алкилом, С2-С6-алкенилом, С1-С4-алкилфенилом; R3 является группой NR5R6, COR7, фенилом, тиенилом, фурилом, пиридилом, пиримидилом, пиразинилом, пиридазинилом, тиазолилом, изотиазолилом, оксазолилом, изоксазолилом или пиразолилом; R4 является водородом или галогеном; R5 является водородом, C1-С6-алкилом или С2-С6-алкенилом; R6 является C1-С6-алкилом или С2-С6-алкенилом, или R5 и R6 могут вместе образовать морфолинил; R7 является С1-С4-алкоксигруппой, NR8R9, фенилом, фурилом, тиенилом, оксазолилом, изоксазолилом и, возможно, замещен галогеном или C1-С6-алкилом; R8 и R9 являются независимо водородом, C1-С6-алкилом, С2-С6-алкенилом, фенилом, тиазолилом, оксазолилом и, возможно, замещен C1-С6-алкилом; или их энантиомеры или их соли. Другим объектом данного изобретения является фармацевтическая композиция, содержащая в качестве активного компонента соединение формулы (I): в которой X является 0; R является водородом; R1 является водородом, C1-С6-алкилом или С2-С6-алкенилом; R2 является водородом, C1-С6-алкилом, С2-С6-алкенилом, С1-С4-алкилфенилом; R3 является группой NR5R6, COR7, фенилом, тиенилом, фурилом, пиридилом, пиримидилом, пиразинилом, пиридазинилом, тиазолилом, изотиазолилом, оксазолилом, изоксазолилом или пиразолилом; R4 является водородом или галогеном; R5 является водородом, C1-С6-алкилом или С2-С6-алкенилом; R6 является C1-С6-алкилом или С2-С6-алкенилом, или R5 и R6 могут вместе образовать морфолинил; R7 является С1-С4-алкоксигруппой, NR8R9, фенилом, фурилом, тиенилом, оксазолилом, изоксазолилом и, возможно, замещен галогеном или C1-С6-алкилом; R8 и R9 являются независимо водородом, C1-С6-алкилом, С2-С6-алкенилом, фенилом, тиазолилом, оксазолилом и, возможно, замещен C1-С6-алкилом; или их энантиомеры или их соли. Предпочтительной группой активных веществ формулы (I) являются те, в которых R1 и R2, каждый независимо является атомом водорода, н-пропилом, изопропилом или циклопропилом и R3 является группой COR7. R7 представляет собой алкил, аминоалкил, например, метил, этил, н-пропил, изопропил, циклопропил, н-бутил, изобутил, трет-бутил и пиклобутил или арил, аминоарил, например, фенил, тиенил, фторфенил и фуранил. Другой предпочтительной группой является такая, когда R3 является арилом, например фенилом, тиенилом, фторфенилом или фуранилом. Другой предпочтительной группой является такая, когда R3 является алкилом, например, н-пропилом, изопропилом или алкенилом, например, изопропенилом и аллилом. Другой предпочтительной группой активных соединений являются такие, в которых R4 является атомом галогена в положении-8, а также их энантиомеры. Соединения формулы (I), в которых R3 является СООН, СОСl, СОВr, N3, SО3СF3, являются новыми промежуточными соединениями для получения терапевтически активных соединений формулы (I). C1-С6-алкил в формуле (I) представляет собой нормальные, разветвленные и циклические алкильные группы, имеющие от 1 до 6 атомов углерода, например, метил, этил, н-пропил, изопропил, циклопропил, н-бутил, изобутил, трет-бутил, циклобутил, н-пентил, изопентил, трет-пентил, нео-пентил, циклопентил, н-гексил, изогексил, циклогексил, метилциклопропил, этилциклопропил, метилциклобутил. Предпочтительные алкильные группы имеют от 1 до 4 атомов углерода. С2-С6-алкенил в формуле (I) представляет собой нормальные или разветвленные алкенильные группы, имеющие от 2 до 6 атомов углерода, и содержащие одну или две двойных связи, например, алкил, пропенил, изопропенил, бутенил,изобутенил, пентенил,изопентенил. Предпочтительные алкенильные группы имеют от 2 до 4 атомов углерода и одну двойную связь. С1-С4-алкоксигруппы в формуле (I) представляет собой нормальные алкоксигруппы, имеющие от 1 до 4 атомов углерода, например, метокси, этокси, пропокси, бутокси, предпочтительно метокси и этокси. В С1-С4-алкилфенильных группах алкильная группа является нормальным или разветвленным алкилом, имеющим от 1 до 4 атомов углерода, а фенильное кольцо может быть замещено одной или несколькими группами, такими как фтор, хлор, бром, йод, нитрил, трифторметил, метил или этил в мета- и/или пара-положении. Например, бензил, фенетил и фенилпропил, особенно предпочтительным является фенилпропил. Атом галогена в формуле (I) представляет собой фтор, хлор, бром, йод, предпочтительно фтор, хлор и бром. Соединения данного изобретения могут иметь один или два асимметричных атома углерода. Когда R является атомом водорода, соединения имеют один асимметричный атом углерода, смежный с атомом азота, то есть С3, а когда R является C1-С6-алкилом соединения имеют асимметричный атом углерода, смежный с атомом азота, и асимметричный атом углерода, смежный с алкильной группой, то есть С4. Таким образом, эти вещества существуют в виде двух или четырех оптических изомеров, т.е. энантиомеров. В объем защиты этого изобретения входят как чистые энантиомеры, так и рацемические смеси. Терапевтические свойства этих веществ могут в большей или меньшей степени быть приписаны рацемату или имеющимся энантиомерам. Для образования нетоксичных, фармацевтически приемлемых солей соединений данного изобретения, могут использоваться как органические, так и неорганические кислоты. Примерами кислот являются серная, азотная, фосфорная, щавелевая, соляная, муравьиная, бромистоводородная, лимонная, уксусная, молочная, винная, памовая, этандисульфокислота, сульфаминовая, янтарная, метилсульфоновая, пропионовая, гликолиевая, яблочная, глюконовая, пировиноградная, фенилуксусная, 4-аминобензойная, антраниловая, салициловая, 4-аминосалициловая, 4-гидроксибензойная, никотиновая, метансульфоновая, этан сульфоновая, гидроксиэтансульфоновая, бензолсульфокислота, пара-толуолсульфокислота, фульфениловая, нафталинсульфокислота, аскорбиновая, циклогексилсульфаминовая, фумаровая, малеиновая и бензойная кислоты. Эти соли легко получаются методами, которые известны в этой области химии. Соединения формулы (I) могут быть получены следующими способами, которые являются еще одним объектом данного изобретения. а. Превращение вещества формулы (II) где Y является уходящей группой, такой как трифторметансульфонат (OSО2CF3), атом галогена, например, хлор или бром, и X, R, R1, R2 и R4 такие как определено выше, в результате замещения группы Y в карбоксигруппе COZ, в которой Z является хлором, бромом, гидроксилом, группой ORp, где Rp является C1-С6-алкилом, с образованием вещества формулы (I), в которой R3 является группой COZ (Iа). Соединение формулы (II) может быть превращено в вещество формулы (Iа) в результате следующего каталитического цикла. Металл М° должен быть переходным металлом (M), со степенью окисления равной нулю, таким как палладий или никель, который способен подвергаться окислительному присоединению по связям арил-Y, например, по связям арил-SО 3СF3. Этот металл может генерироваться in situ, из двухвалентного металла M". Арил-CO-M''-Y образуется за счет обработки монооксидом углерода (СО). Дополнительными реагентами являются спирт, например, такой как метанол, этанол; аминное основание, такое как триалкиламин, например, триэтиламин; в инертном органическом растворителе, предпочтительно в полярном апротонном растворителе, таком как диметилформамид (ДМФ), диметилсульфоксид (ДМСО), ацетон, ацетонитрил и др. Обычно реакцию проводят при температуре от +40 до + 120°С и давлении от 100 и 500 кПа. Затем необязательно следует гидролиз и обработка тионилгалогенидом, например, тионилхлоридом, для того чтобы получить соответствующий галогенид кислоты. b. Вещество формулы (I), в которой R3 является группой COZ (Iа), также может быть получено другим способом. Взаимодействие в виде каталитического цикла с использованием переходного металла М° со степенью окисления равной нулю, таким как палладий или никель, который способен подвергаться окислительному присоединению по связям Z-Y, где Z является атомом хлора, брома, группой ОН, ORp, причем Rp является C1-С6-алкилом и Y – уходящей группой, такой как OSO2CF3, атом галогена. Далее проводится обработка монооксидом углерода с последующим добавлением соединения формулы (II), в которой X, R, R1, R2 и R4 такие как определено в формуле (I). Соединение Z-CO-M"-Y также может быть образовано непосредственно из Z-CO-Cl. Условия реакции и реагенты - такие же самые, как описано выше в методе а). Гидролиз подходящего сложного эфира кабоновой кислоты дает свободную кислоту, которая может быть превращена в галогенид кислоты. с. Превращение соединения формулы (II) где X, R, R1, R2 и R4 такие как определено выше, и Y является уходящей группой, такой как OSO2CF3, хлор или бром, путем обработки цианидным реагентом, таким как цианид меди, с образованием соединения формулы (I), в которой R3 является группой CN (Ib). Взаимодействие с цианидным реагентом осуществляют в инертном органическом растворителе, таком как диметилформамид, гексаметилентриамид фосфорной киcлоты и др. при температуре от +20 до +200°С, предпочтительно от 50 до 150°С и нормальном давлении. d. Аминирование соединения формулы (Iа) в которой X, R, R1, R2 и R4, такие как определено выше, и Z является атомом хлора, брома, группой ОН или ORp, причем Rp является С1-С6-алкилом. Если соединение формулы (Iа) является сложным эфиром карбоновой кислоты, то его необходимо сначала подвергнуть гидролизу до свободной кислоты. Затем свободную кислоту переводят в амид формулы (Iс) через хлорангидрид кислоты, посредством взаимодействия с соответствующим амином NHR8R9, где R8 и R9 такие, как определено в формуле (I), в неполярном апротонном растворителе, например, толуоле, бензоле с обратным холодильником при температуре от 0 до 100°С. е. По реакции Виттига с образованием соединения формулы (I), в которой R3 является С2-C6-алкенильной группой (Ie) Производное 5-карбокси-хромана, где X, R, R1, R2 и R4, такие как определено в формуле (I), и R7 является алкилом, определенным выше (Id), превращают с использованием диполярного реагента, такого как галогенид алкилтрифенилфосфония, с образованием соответствующей алкенильной группы (Ie). f. Каталитическое гидрирование производного 5-алкенхромана формулы (I), в которой R3 является С2-С6-алкенильной группой, водородом на палладие, водородом на платине или водородом на никеле Ренея с получением соответствующей производной формулы (I), в которой R3 является С1-С6-алкильной гpуппой (If). g. Замещение производного 5-бромхромана путем обработки триалкилоловянным реагентом в присутствии нульвалентного металла, предпочтительно палладия с образованием вещества формулы (I), в которой R3 является С1-С6-алкилом, С2-С6алкенилом или арилом, в присутствии моноксида углерода дает соединение формулы (I), в которой R3 является группой COR7, в которой R7 является C1-С6-алкилом, С2-С6-алкиленом или арилом. Замещение может быть осуществлено одним из следующих способов: h. Превращение производного 5-карбоксихромана формулы (I) в которой X, R, R1, R2 и R4 такие как определено выше, и Z является хлором или бромом, с использованием R7Li, где R7 является C1-С6-алкилом, С2-С6-алкенилом или арилом, чтобы получить соответствующее производное 5-кетохромана. Подходящим алкиллитиевым соединением является, например, метиллитий, алкениллитием — виниллитий и ариллитием — фениллитий. Взаимодействие осуществляют в инертном органическом растворителе, предпочтительно неполярном апротонном растворителе, таком как простые эфиры, например, диэтиловый эфир, тетрагидрофуран при температуре от -50 до +50°С. i. Гидролизом соединения формулы (I), в которой R3 является цианогруппой (Ib) в которой X, R, R1, R2 и R4 такие как определено выше, с необязательной последующей обработкой тионилгалогенидом, например, тионилхлоридом, тионилбромидом, для того чтобы получить соединение формулы (I), в которой R3 является группой COZ, где Z - гидроксил, хлор или бром. j. Замещением вещества формулы (I), в которой R3 является цианогруппой (Ib) в которой X, R, R1, R2 и R4 такие как определено выше, посредством обработки подходящим металлоорганическим реагентом, предпочтительно литийорганическим, таким как R7Li или реактив Гриньяра, такой как R7Mg-галогенид, в инертном органическом растворителе, предпочтительно неполярном апротонном растворителе, таком как бензол, простые эфиры, например диэтиловый эфир, тетрагидрофуран, с последующим гидролизом промежуточного комплекса, чтобы получить соединение формулы (I), в которой R3 является группой COR7, где R7 является C1-С6-алкилом, С2-С6 алкенилом или арилом. k. Гидрирование производного 5-алканхромана формулы (I), в которой R3 является С2С6-алкенильной группой, водородом на палладие, водородом на платине или водородом на никеле Ренея или азодикарбоксилатом калия, с образованием соответствующего производного хромана формулы (I), в которой R3 является C1-С6-алкилом. 1. Превращение соединения формулы (II) в которой Y является уходящей группой, такой как трифторметансульфонат, фосфонат, галогенид, такой как бром или йод, и R, R1, R2 такие как определено выше, путем замещения группы Y на R3, которая является С2-С6-алкенильной группой (Ie). Соединение (II) может быть превращено в (Ie) путем взаимодействия с переходным металлом, таким как палладий или никель, которые могут образовывать лигандный комплекс и подвергаться окислительному присоединению. Подходящий алкенильный заместитель может быть введен в результате обработки триалкилалкенилстаннаном. Дополнительными реагентами являются амин, такой как триэтиламин, и литиевая соль, например, хлорид лития. Взаимодействие предпочтительно проводят в полярном апротонном растворителе, таком как диметилформамид, диоксан, ацетонитрил или диметилсульфоксид при температуре от +40 до 120°С. m. Превращение соединения формулы II в которой Y является уходящей группой, такой как трифторметансульфонат, фосфонат, галогенид, такой как бром или йод, и R, R1, R2 такие как определено выше, путем замещения группы Y на пяти- или шестичленный арил, который может содержать 1 или 2 гетероматом, выбранных из азота, кислорода или серы и который или замещен, или сконденсирован по двум соседним атомам углерода с арильным кольцом, которое определено выше, с образованием вещества формулы (If). Соединение (II) может быть превращено в (If) путем взаимодействия с переходным металлом, таким как палладий или никель, которые способны образовать лигандный комплекс и подвергаться окислительному присоединению. Подходящий арильный заместитель может быть введен в результате обработки триалкиларилстаннаном или арилборной кислотой. Дополнительными реагентами являются амин, такой как триэтиламин, и литиевая соль, например хлорид лития. Взаимодействие предпочтительно проводят в поляpном апротонном растворителе, таком как диметилформамид, диоксан, ацетонитрил или диметилсульфоксид при температуре от +40 до 120°С. Следующий метод описывает один из путей получения промежуточного соединения формулы (Ib), в которой R1, R2 и R4 такие как определено в формуле (I). Фармацевтические препараты. В соответствии с настоящим изобретением соединения формулы I обычно назначаются пероралъно, ректально или посредством инъекции в виде фармацевтических препаратов, включающих активный компонент или в виде свободного основания, или фармацевтически приемлемой нетоксичной аддитивной кислотной соли, например, гидрохлорида, гидробромида, лактата, ацетата, фосфата, сульфата, сульфомата, цитрата, тертрата, оксалата и тому подобных, в фармацевтически приемлемых формах дозировки. Форма дозировки может быть твердой, полутвердой или жидким препаратом. Обычно активное вещество может составлять от 0,1 до 99 вес.% от веса препарата, более конкретно между 0,5 и 20% от веса препарата, предназначенного для инъекции, и между 0,2 и 50% от веса препарата, пригодного для перорального назначения. Для того чтобы получить фармацевтические препараты, содержащие вещество формулы I в единичной форме дозировки для перорального использования, выбранное вещество может быть смешано с твердой средой для лекарства, например, лактозой, сахарозой, сорбитолом, маннитолом, крахмалами, такими как картофельный крахмал, кукурузный крахмал или амидопектин, производными целлюлозы, связующим, таким как желатин или поливинилпирролидон, и смазывающим веществом, таким как стеарат магния, стеарат кальция, полиэтиленгликоль, воски, парафин и тому подобные, и затем смесь прессуют в таблетки. Если требуются таблетки с покрытием, то основа, приготовленная как описано выше, может быть покрыта концентрированным раствором сахара, который может содержать арабскую камедь, желатин, тальк, диоксид титана и т.п. Альтернативно, таблетка может быть покрыта полимером, который известен специалистам в этой области химии, растворенным в легко испаряющемся органическом растворе или смеси органических растворителей. В эти покрытия могут быть добавлены красящие вещества, для того чтобы легко различать таблетки, содержащие различные активные вещества или различные количества активных веществ. Для приготовления мягких желатиновых капсул активное вещество может быть смешано, например, с растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы активного вещества с использованием либо вышеупомянутых сред для таблеток, например, лактозы, сахарозы, сорбита, маннитола, крахмалов (например картофельного, кукурузного или амилопектина), производных целлюлозы или желатина. Кроме того, твердые желатиновые капсулы могут быть заполнены жидкими или полутвердыми лекарствами. Единичные дозировки для ректального применения могут быть растворами или суспензиями, или могут быть приготовлены в форме свеч, включающих активное вещество в смеси с нейтральным жидким основанием, или желатиновые ректальные капсулы, включающие активное вещество в смеси с растительным или парафиновым маслом. Жидкие препараты для перорального применения могут быть в форме сиропов или суспензий, например, растворов, содержащих приблизительно от 0,2% до 20% от веса активного вещества, описанного здесь, остальное приходится на сахар и смесь этилового спирта, воды, глицерина и пропиленгликоля. Такие жидкие препараты необязательно могут содержать красящие агенты, вкусовые вещества, сахарин и карбоксиметилцеллюлозу в качестве загущающего агента или другие среды для лекарств, которые известны специалисту в этой области. Растворы для парентеральных применений посредством инъекций могут быть приготовлены в водном растворе водорастворимой фармацевтически приемлемой соли активного вещества, предпочтительно в концентрации примерно от 0,5% до 10 вес.%. Эти растворы также могут содержать стабилизирующие агенты и/или буферные агенты, причем они могут быть удобно предоставлены в различных ампулах единичной дозировки. Подходящие суточные дозы веществ этого изобретения при терапевтическом лечении людей составляют примерно от 0,01 до 100 мг/кг веса тела при пероральном назначении и от 0,001 до 100 мг/кг веса тела при парентеральном назначении. Следующие примеры дополнительно иллюстрируют изобретение. Пример 1. 3-дипропиламино-5-трифторметансульфонилхроман. 3-дипропиламино-5-гидроксихроман (Торберг и сотр. Aeta Pharm. Succ. 1987, 24) /1,4 г, 4,0 ммоль/ и 0,1 г (0,75 ммоль) N,N-диметиламинопиридина растворяют в 50 мл хлористого метилена и охлаждают до 30°С. Добавляют 0,75 мл (5,7 ммоль) 2,4,6-коллидина и затем 1,0 мл (6,0 ммоль) ангидрида трифторметансульфокислоты. Раствор перемешивают 3 часа при -20°С и затем дают ему нагреться до комнатной температуры. Этот раствор промывают водным раствором кислого карбоната натрия, сушат над сульфатом натрия и выпаривают досуха. Светло-желтое масло окончательно очищают методом флэш-хроматографии (силикагель) посредством элюирования смесью этилацетат/гексан 1:9. Выход равен 55%. Т.пл. 125-127°С (оксалат). Пример 2. 3-дипропиламино-5-метилоксикарбонилхроман. 3-дипропиламино-5-трифторметансульфонилхроман (пример 1; 4,43 г, 11,6 ммоль) растворяют в 80 мл смеси диметилформамид/метанол 6:2, и раствор дегазируют 15 минут при 20°С при давлении 10 тор. Затем добавляют ацетат палладия (76 мг, 0,34 ммоль), 141 мг (0,34 ммоль) 1,3-бис-дифенилфосфинопропана и 3,5 мл (25 ммоль) триэтиламина. Смесь нагревают до 70°С в атмосфере СО и перемешивают в течение 5 часов. Раствор охлаждают, разбавляют 200 мл толуола, промывают водным раствором бикарбоната натрия, сушат сульфатом натрия и выпаривают досуха, масло очищают методом флэш-хроматографии на силикагеле при элюировании смесью этилацетат/гексан 1:8. Выход равен 76%. Т. пл. 150-152°С (гидрохлорид). Пример 3. 3-дипропиламино-5-карбамоилхроман. 3-дипропиламино-5-метилоксихроман (пример 2; 400 мг, 1,37 ммоль) растворяют в 10 мл метанола и добавляют 60 мг (1,5 ммоль) гидроксида натрия в 2 мл воды. Смесь кипятят с обратным холодильником 5 часов, охлаждают, фильтруют через Целит и выпаривают досуха. Остаток кипятят с хлористым сульфуридом SoCl2 (5 мл, 68 ммоль) в течение 30 мин. Избыток хлористого сульфурида затем удаляют в вакууме, чтобы получить гидрохлорид 3-дипропиламино-5-хлорформилхромана в виде смолы. Эту светло-коричневую смолу растворяют в 50 мл хлористого метилена, и пропускают через раствор поток газообразного аммиака в течение 2 минут. Раствор промывают водным раствором гидрокарбоната натрия, сушат сульфатом натрия и выпаривают досуха. Масло очищают методом флэш-хроматографии (на силикагеле) путем элюирования смесью этилацетат/гексан 1:4. Выход 80%. Спектр ЯМР 13С; 172,0; 154,9; 136,5; 126,9; 120,4; 119,1; 118,6; 67,8; 53,0; 52,6; 26,1; 22,4; 21,9; 14,1; 11,7. Пример 4. 3-дипропиламино-5-N,N-диметилкарбамоил-хроман. Указанное в заголовке вещество было приготовлено по методике, аналогичной использованной в примере 3, исходя из 3-дипропиламино-5-метилоксикарбонилхроман и используя вместо аммиака газообразный диметиламин. Спектр ЯМР-С13 189,3; 170,3; 149,9; 137,4; 126,7; 126,1; 124,9; 65,8; 64,7; 48,2; 47,7; 30,7; 26,0; 15,1; 10,9. Пример 5. 3-дипропиламино-5-N,N-диизопропилкарбамоилхроман. Указанное в заголовке вещество было приготовлено по методике, аналогичной использованной в примере 3, исходя из 3-дипропиламино-5-метилоксихромана. Т. пл. 228-230°С (гидрохлорид). Пример 6. 3-дипропиламино-5-N-метилкарбамоилхроман. Указанное в заголовке вещество было приготовлено аналогично методике, использованной в примере 3, исходя из 3-дипропиламино-5-метилоксикарбонилхромана и используя вместо аммиака газообразный метиламин. Т. пл. 95-97°С (оксалат). Пример 7. 3-дипропиламино-5-ацетилхроман. Гидрохлорид 3-дипропиламино-5-хлорформилхромана (4,42 г, 13,4 ммоль), приготовленный из 3-дипропиламино-5-метилоксикарбонилхрома-на (пример 2) по методике, аналогичной использованной в примере 3, в 20 мл сухого тетрагидрофурана, добавляют к предварительно полученному раствору диметилкупрата лития, полученного из метиллития и йодистой меди, в 200 мл тетрагидрофурана при -78°С. Этот раствор перемешивают в течение 15 минут при -78°С и затем дают ему нагреться до комнатной температуры в течение 10 минут. Затем медленно добавляют 30 мл воды. Органическую фазу декантируют, сушат сульфатом натрия и выпаривают досуха. Остаток очищают методом флэш-хроматографии (на силикагеле) путем элюирования смесью этилаце-тат/гексан 1:8. Указанное в заголовке соединение кристаллизуется в виде соли из этилацетата. Т. пл. 106-108°С (оксалат). Пример 8. 3-дипропиламино-5-циклопропилкарбонилхроман. Указанное в заголовке соединение приготовлено по методике, аналогичной использованной в примере 7, используя вместо диметилкупрата лития дициклопропилкупрат лития (I.Org.Chem., том 41, с.22, 1976). Т. пл. 100-102°С (оксалат). Пример 9. 3-дипропиламино-5-трет-бутилкарбонилхроман. Указанное в заголовке соединение было приготовлено по методике, аналогичной использованной в примере 7, используя вместо диметилкупрата лития, ди-трет-бутилкупрат лития (из третбутиллития и комплекса бромид меди/диметилсулъфид). Т. пл. 118-120°С (оксалат). Пример 10. 3-дипропиламино-5-изопропилкарбонилхроман. Указанное в заголовке соединение было приготовлено по методике, аналогичной использованной в примере 7, используя вместо диметилкупрата лития, дизопропилкупрата магния (из пропилмагний хлорида и комплекса CuBr* диметилсульфид). Т. пл. 60-62°С (оксалат). Пример 11. 3-дипропиламино-5-(4-фтор фенилкарбонил)хроман. Указанное в заголовке соединение было приготовлено по методике, аналогичной использованной в примере 7, с использованием, вместо диметилкупрата лития, ди-(4-фторфенил)купрата магния (из 4-фторфенилмагний бромида и йодида меди). Т. пл. 98,3-98,4°С (оксалат). Пример 12. 3-дипропиламино-5-(тиенилкарбонил)хроман. Указанное в заголовке соединение было приготовлено по методике, аналогичной использованной в примере 7, с использованием, вместо диметилкупрата лития, ди-(2-тиенил)купрата лития (из 2-тиениллития и йодистой меди). Т. пл. 78-88,5°С (оксалат). Пример 13. 3-дипропиламино-5-изопропенилкарбонилхроман. Растворяют 0,62 г (1,74 ммоль) метилтрифенилфосфонийбромида в осушенном диэтиловом эфире (20 мл) в атмосфере азота при комнатной температуре, добавляют 1,74 ммолъ н-бутиллития (0,7 мл 2,5 молярного раствора), и раствор перемешивают 4 часа. Растворяют 0,4 г (1,45 ммоль) 3-дипропиламино-5ацетилхромана (пример 7) в 2,0 мл осушенного диэтилового эфира, и этот раствор добавляют к предварительно приготовленному реактиву Биттига. Смесь перемешивают при комнатной температуре в течение ночи. Раствор разбавляют толуолом и промывают водой. Высушивание органической фазы сульфатом натрия и выпаривание ее досуха дает твердое вещество, которое окончательно было очищено методом флэш-хроматографии при элюировании смесью этилацетат/гексан 1:4. Собранные фракции были выпарены и дали указанное в заголовке соединение в виде бесцветного масла. Спектр ЯМР-13С: 11,82; 21,94; 24,28; 26,69; 52,79; 53,64; 67,70; 115,03; 118,73; 120,07; 126,83; 144,88; 145,27; 154,03. Пример 14. 3-дипропиламино-5-аминохроман. Растворяют 1,0 г (3,4 ммоль) 3-дипропиламино-5-метилоксикарбонилхромана (пример 2) в метаноле (20 мл). Добавляют 0,16 г (4,1 ммоль) гидроксида натрия в 1,0 мл воды, и этот раствор кипятят с обратным холодильником в азоте в течение ночи. Раствор выпаривают досуха, добавляют 20 мл толуола и снова выпаривают досуха. Остаток растворяют в 20 мл толуола, добавляют 1,87 г (6,8 ммоль) дифенилфосфорилазида, и раствор кипятят с обратным холодильником в течение 2 часов. Добавляют 2 мл метанола и кипячение продолжают еще 4 часа. Раствор охлаждают, промывают водой и эстрагируют разбавленной соляной кислотой. Кислую водную фазу нейтрализуют водным раствором гидроксида натрия и экстрагируют толуолом. Высушивают толуольную фазу сульфатом натрия и выпаривают ее досуха. Остаток растворяют в этаноле, содержащем 10%-ный гидроксид натрия (20 мл), и раствор кипятят с обратным холодильником в течение ночи. Этот раствор охлаждают и разбавляют толуолом. Промывка водой, высушивание органической фазы и выпаривание ее досуха дает указанное в заголовке вещество в виде масла, которое превращается в дихлористоводородную соль. Т. пл. 173-174°С. Пример 15. 3-дипропиламино-5-нитрохроман. 3-дипропиламино-5-аминохроман (пример 14, 0,05 г, 0,2 ммоль) растворяют в смеси 0,08 мл (1 ммоль) трифторуксусной кислоты и 5 мл воды. Прозрачный раствор охлаждают до 0-4°С. При хорошем перемешивании по каплям добавляют нитрит натрия (0,017 г, 2,5 ммоль) в 1 мл воды. Раствор перемешивают 15 минут и нейтрализуют карбонатом кальция. Добавляют раствор нитрита натрия (0,5 г, 7,2 ммоль) в 1 мл воды и затем смесь сульфата меди (0,1 г, 0,62 ммоль) и закиси меди в 1 мл воды. Раствор перемешивают при 0°С в течение 20 минут и затем при комнатной температуре 2 часа. Раствор экстрагируют диэтиловым эфиром. Органическую фазу сушат сульфатом натрия и выпаривают досуха. Остаток очищают методом флэш-хроматографии на силикагеле при элюировании смесью этилацетат/гексан 1:9. Получают указанное в заголовке соединение с т.пл. 150-151°С (гидрохлорид). Пример 16. 3-дипропиламино-5-азидохроман. 3-дипропиламино-5-аминохроман (пример 14, 0,05 г, 0,2 ммоль) диазотируют по методике примера 15. После перемешивания в течение 15 минут добавляют 0,026 г (0,4 ммоль) азида натрия в 1 мл воды. После перемешивания при 5°С в течение ночи раствор обрабатывают и очищают по методике примера 15, получая указанное в заголовке соединение с т.пл. 167-168°С (оксалат). Пример 17. 3-дипропиламино-5-(пиррол-1-ил)хроман. 3-дипропиламино-5-аминохроман (пример 14, 0,6 г, 2,42 ммоль) растворяют в 10 мл уксусной кислоты и добавляют 0,4 г (3 ммоль) 2,5-диметокситетрагидрофурана. Раствор кипятят с обратным холодильником в течение 1 часа. Этот раствор нейтрализуют водным гидроксидом натрия и экстрагируют толуолом. Органическую фазу сушат сульфатом натрия и выпаривают досуха. Остаток очищают методом флэш-хроматографии на силикагеле при элюировании смесью этилацетат/гексан 1:9 и получают указанное в заголовке соединение. Спектр ЯМР 13С: 75; 21,89; 24,81; 52,69; 53,15; 67,94; 108,93; 115,67; 118,22; 118,44; 121,87; 127,22; 141,47; 155,27. Пример 18. 3-(метил-3-фенилпропил)амино-5-гидрокси-хроман. 3-амино-5-метоксихроман (Торберг и сотр. Aeta Pharm Snec, 1987, p.24) /2 г, 9,28 ммоль/ растворяют в 50 мл метанола и подкисляют уксусной кислотой до рН равного 6,0. Раствор охлаждают до 0°С и добавляют 0,87 г (13,8 ммоль) цианоборгидрида натрия вместе с 3-фенилпропаналем (1,22 мл, 9,28 ммоль). Удаляют охлаждение, и раствор перемешивают при комнатной температуре 4 часа. Добавляют 0,42 г (14 ммоль) параформальдегида и 0,87 г (13,8 ммоль) цианоборгидрида натрия, и перемешивание продолжают в течение ночи при комнатной температуре. Раствор разбавляют толуолом и промывают водой. Высушивание сульфатом натрия и выпаривание досуха дает масло. Это масло очищают методом флэш-хроматографии на силикагеле при элюировании смесью этилацетат/гексан 1:4. Отобранные фракции выпаривают и получают масло, которое обрабатывают водным бромистым водородом (47%) при 120°С, 1 час. Раствор охлаждают и нейтрализуют гидроксидом натрия и экстрагируют толуолом. Органическую фазу сушат сульфатом натрия и выпаривают, получая указанное в заголовке соединение в виде масла. Спектр ЯМР 13 С:22,502; 29,09; 33,47; 38,19; 53,66; 67,76; 102,004; 109,2; 110,46; 125,78; 127,05; 128,36; 142,2; 155,29; 158,28. Пример 19. 3-(метил-3-фенилпропил)амино-5-метилоксикарбонилхроман. 3-(метил-3-фенилпропил)амино-5-гидрокси-хроман (пример 18,1 г, 3,37 ммоль) растворяют в 20 мл хлористого метилена при 20°С. Добавляют 0,32 мл (4 ммоль) пиридина, 0,65 мл (5,9 ммоль) ангидрида трифторметансульфокислоты и 0,041 г (0,59 ммоль) диметиламинопиридина (ДМАП) при -20°С и в атмосфере азота. Раствор перемешивают 3 часа при -20°С. Удаляют охлаждение, и раствор разбавляют толуолом, промывают водным раствором бикарбоната натрия, сушат сульфатом натрия, фильтруют через силикагель и выпаривают досуха. Оставшееся масло растворяют в 13 мл дегазированной смеси метанол/диметилформамид 3:10. Добавляют 0,056 г (0,25 ммоль) ацетата палладия, 0,103 г (0,25 ммоль) 1,3-дис(дифенилфосфино)пропана и 0,76 мл (5 ммоль) триэтиламина, и раствор продувают газообразным оксидом углерода при интенсивном перемешивании. Давление в реакционном сосуде повышают до 20,2 кПа с помощью баллона с оксидом углерода, снабженного регулятором. Перемешивание продолжают в течение ночи при 75°С. Давление и температуру доводят до нормальных значений, и раствор разбавляют толуолом и промывают водой. Высушивают органическую фазу и выпаривают досуха. Оставшееся масло очищают методом флэш-хроматографии на силикагеле при элюировании смесью этилацетат/гексан 1:4. Отобранные фракции выпаривают и получают указанное в заголовке соединение в виде бесцветного масла. Спектр ЯМР-13С: 26,88; 29,0; 33,2; 37,85; 51,64; 53,37; 55,44; 67,24; 120,6; 123,06; 123,4; 125,59; 126,47; 128,17; 128,17; 128,24; 130,3; 142,01; 154,93; 167,29. Пример 20. 3-(метил-3-фенилпропил)амино-5-N-метилкарбамоил-хроман. 3-(метил-3-фенилпропил)амино-5-метилоксикарбонилхроман (пример 19, 0,32 г, 0,94 ммоль) растворяют в 10 мл метанола. Добавляют 0,08 г гидроксида натрия (2 ммоль) в 1 мл воды, и раствор кипятят в течение ночи в атмосфере азота. Раствор выпаривают досуха и снова выпаривают досуха совместно с толуолом (10 мл). Оставшееся твердое вещество кипятят с обратным холодильником в хлористом сульфуриле в течение 30 минут и выпаривают досуха. Светло-коричневую смолу растворяют в 20 мл тетрагидрофурана, обрабатывают газообразным метиламином 1 минуту при интенсивном перемешивании. Раствор разбавляют толуолом и промывают водным раствором бикарбоната натрия. Высушивание и выпаривание дает смолу, которую окончательно очищают методом флэш-хроматографии на силикагеле при элюировании смесью этилацетат/гексан 1:2. Собранные фракции выпаривают и получают указанное в заголовке соединение в виде беcцветной смолы. При кристаллизации из этилацетата щавелекислая соль образует белые иголочки. Т.пл. 150-151°С (оксалат). Пример 21. 3-дипропиламино-5-трифторметансульфонилтиохроман. 3-дипропиламино-5-гидроксибензотиопиран (Европейский патент 0222 996; 420 мг, 1,58 ммоль) и 0,27 г (0,29 мл) коллидина растворяют в 15 мл хлористого метилена и охлаждают до -30°С. По каплям добавляют 0,54 г (0,32 мл) ангидрида трифторметансульфокислоты, и дают смеси нагреться до комнатной температуры. Спустя 20 минут разбавляют смесь хлористым метиленом. Раствор промывают насыщенным раствором бикарбоната натрия, сушат сульфатом натрия и выпаривают в вакууме. Хроматография на силикагеле посредством элюирования хлороформом дает 0,62 г указанного в заголовке соединения в виде основания. Выход равен 98%, Т.пл. 37-38°С. Спектр ЯМР 13С (200 МГц - СДСl3), м.д.: 148,3; 136,7; 128,4; 127,2; 126,3; 122,0; 117,1; 115,2; 55,6; 52,5; 28,0; 26,6-22,6; 11,8. Пример 22. 3-дипропиламино-5-метилоксикарбонилтиохроман. 3-дипропиламино-5-гидроксибензотиопиран (Европатент 0222 996,620 мг, 1,6 ммоль) растворяют в 11 мл смеси (6:2) диметилформамид/метанол, и раствор дегазируют при 10 торах при 22°С, 15 минут. В реакционную смесь добавляют 11 мг ацетата палладия, 19 мг 1,3-бис-дифенилфосфинопропана и 0,48 мл (0,35 г) триэтиламина. Смесь нагревают до 70°С в атмосфере монооксида углерода и перемешивают 5 часов. Раствор охлаждают, разбавляют 30 мл толуола, промывают насыщенным раствором бикарбоната натрия, сушат сульфатом натрия и выпаривают в вакууме. Хроматографирование на силикагеле посредством элюирования с использованием градиента хлороформа от 10% этилацетата в хлороформе, дает 310 мг указанного в заголовке соединения (основание) в виде светло-желтого масла. Выход 64%. Спектр ЯМР 13 С (200 МГц -СДСl3), м.д.: 168,2; 136,6; 134,8; 131,6; 130,1; 126,5; 125,7; 56,7; 52,5; 52,1; 30,4; 28,0; 22,3; 11,9. Пример 23. 3-дипропиламино-5-ацетилтиохроман. 3-дипропиламино-5-метилоксикарбонилтиохроман (пример 22, 310 мг, 1,01 ммоль) растворяют в 8 мл метанола и добавляют 60 мг гидроксида натрия в 2 мл воды. После кипячения в течение 5 часов смесь охлаждают и выпаривают в вакууме. Остаток растворяют в тионилхлориде (5 мл) и повторно кипятят в течение 1 часа. Избыток тионилхлорида выпаривают в вакууме, получая смолу. Остаточную смолу растворяют в минимальном количестве тетрагидрофурана и по каплям добавляют к охлажденному до -78°С раствору диметилкупрата лития (2,02 ммоль) в 20 мл тетрагидрофурана. Реакционную смесь перемешивают 15 минут при -78°С, затем ей дают нагреться до комнатной температуры и спустя 10 минут реакцию прерывают, добавляя 0,9 мл воды. Реакционную смесь фильтруют через "Пелит" и выпаривают досуха. Остаток растворяют в эфире, промывают насыщенным раствором бикарбоната натрия, обрабатывают рассолом, сушат сульфатом натрия и выпаривают в вакууме, получая неочищенное основание в виде масла. Сырой остаток подвергают хроматографии на силикагеле посредством элюирования с использованием градиента от хлороформа до 5 % этилацетата в хлороформе. Хлористоводородная соль была получена путем растворения чистого основания в эфире и прикапывания избытка эфирного раствора НСl. Перекристализация в смеси трихлорметан/диэтиловый эфир дает 92 мг указанного в заголовке соединения в виде белого твердого вещества. Выход 27 %, т.пл. 141-142°С. Спектр ЯМР 13С (200 МГц - СДСl3), м.д.: 201,9; 138,4; 135,9; 131,7; 131,2; 127,2; 127,0; 59,9; 54,1; 51,8; 29,9; 27,9; 26,1; 18,6; 18,2; 11,6. Пример 24. 5-аллил-3-(дипропиламино)тиохроман К раствору 3-(дипропиламино)-5-трифторметансульфонилтиохромана (пример 21, 1,28 г, 3,22 ммоль), 76 мг (0,064 ммоль) тетракис-(трифенилфосфин) палладия (0) и нескольких кристаллов 2,6-ди-трет-бутил-4-метилфенола в 10 мл безводного толуола добавляют 1,17 г (1,1 мл, 3,53 ммоль) чистого трибутилаллилолова. Образовавшийся раствор кипятят с обратным холодильником 4 часа, затем добавляют 1 мл пиридина к охлажденному раствору и после этого 2,1 мл комплекса фтористый водород пиридин (Стилл и сотр. J. Org. Chem. 1987, т. 52, с. 422). После перемешивания 1 час при комнатной температуре, реакционную смесь добавляют 50 мл диэтилового этила и последовательно обрабатывают 50 мл 1-молярного раствора гидроксида натрия, водой (2 раза), промывают насыщенным раствором хлористого натрия и сушат сульфатом натрия. После фильтрации и удаления растворителя в вакууме, получают неочищенное вещество в виде темного масла. Хроматографирование на силикагеле посредством элюирования с использованием градиента от гексана до 5 % этилацетата в гексане, дает 0,85 г указанного в заголовке вещества в виде (основание) светложелтого масла. Выход 91%. Спектр ЯМР 13С (200 МГц - СДСl3), м.д.: 139,0; 136,5; 134,0; 133,0; 126,1; 125,9; 125,0; 116,0; 57,0; 52,6; 37,7; 29,5; 27,7; 22,5; 11,9. Часть основания отбирают и переводят в хлористоводородную соль посредством растворения числового основания в эфире и прикапывания избытка эфирного раствора НСl. Перекристаллизация их смеси ацетонитрила-эфира-гексана дает белое твердое вещество с т. пл. 164-165°С. Пример 25. 3-(дипропиламин)-5-пропилтиохроман-гидрохлорид. К перемешиваемой суспензии азодикарбоксилата калия (0,76 г, 3,9 ммоль) [свежеприготовлен из диэтилазодикарбоксилата и гидроксида калия] и 5-аллил-3-(N,N-дипропиламино)тиохромана (пример 24, 0,4 г, 1,4 ммоль) в 10 мл безводного метанола добавляют раствор ледяной уксусной кислоты в метаноле (1:4) до тех поp, пока не исчезнет желтое окрашивание. Спустя 30 минут перемешивания при комнатной температуре добавляют еще 200 мг азодикарбоксилата калия и снова разлагают, как описано выше. Этот процесс продолжают до тех пор, пока по данным анализа (газовая хроматография) не останется исходного материала в смеси. По завершении реакции (2 часа и 4 добавления соли калия) растворитель удаляют в вакууме. К остатку добавляют двухмолярный раствор гидроксида натрия, который дважды экстрагируют диэтиловым эфиром, и объединенные органические экстракты обрабатывают насыщенным раствором хлористого натрия и сушат сульфатом натрия. Неочищенное основание получают в виде легко окрашенного масла после удаления растворителя в вакууме. Хроматографирование на силикагеле посредством элюирования с использованием градиента от гексана до 5% этилацетата в гексане, дает указанное в заголовке вещество (основание) в виде прозрачного масла. Хлористоводородную соль получают путем растворения чистого основания в эфире и прикапывания избытка эфирного раствора НСl. Перекристаллизация (хлороформдиэтиловый эфир) дает 0,3 г белого твердого вещества, выход 66%. Т.пл. 150-151°С. Спектр ЯМР - 13С (основания; 200 МГц - СДСl3), м.д.: 141,6; 133,7; 132,8; 125,8; 125,6; 124,5; 57,1; 52,6; 35,3; 29,5; 27,6; 23,6; 22,4; 14,3; 11,9. Фармакология. Фармакологические испытания депрессии у людей. Имеются свидетельства, что у пациентов с депрессией может быть нарушена трансмиссия в центральной нервной системе. Эти нарушения, как оказалось, включают нейротрансмиттеры норадреналина и 5-гидрокситриптамина (5-ГТ). Считается, что медикаменты, которые наиболее часто используются при лечении депрессии, действуют посредством улучшения нейротрансмиссии или одного или обоих указанных физиологических агонистов. Имеющиеся данные позволяют предположить, что увеличение трансмиссии 5гидрокситриптамина может главным образом улучшить депрессивное настроение и беспокойство, тогда как увеличение нейротрансмиссии норадреналина скорее дает улучшение симптомов торможения, возникающих у пациентов с депрессией. В последние годы были предприняты многочисленные усилия для того, чтобы разработать новые медикаменты с высокой селективностью для улучшения нейротрансмиссии 5-ГТ в центральной нервной системе (ЦНС). Механизм действия для медикаментов, которые обычно используются сегодня при терапии мозговой депрессии, является косвенным, то есть они действуют посредством блокирования повторного поглощения нейротрансмиттеров (норадреналина или/и 5-гидрокситриптамина), выделяющихся из нервных окончаний в ЦНС. Таким образом, увеличивается концентрация этих трансмиттеров в синаптических разветвлениях и в результате восстанавливается соответствующая нейротрансмиссия. Совершенно другим способом улучшения нейротрансмиссии в центральных 5-ГТ-нейронах было бы использование непосредственного агониста 5-ГТ-рецепторов. Тогда для того, чтобы минимизировать побочные эффекты, была бы предпочтительна высокая селективность для рецепторов такого типа. Антагонизм ингибирующих авторецепторов, расположенных на клеточных телах 5-ГТ-нейронов, был бы другим фундаментально отличающимся способом улучшения нейротрансмиссии 5-гидрокситриптамина. Неoжиданно мы обнаружили, что группа веществ формулы 1 обладает селективным, непосредственно стимулирующим или ингибирующим эффектом на подгруппу центральных 5-ГТ-рецепторов. Другое наблюдение состоит в том, что некоторые из этих веществ обладают особенно хорошей оральной биодоступностью. Для того, чтобы оценить стимулирующий эффект и селективность 5-ГТ-рецептора была изметена аффинность для различных рецепторов в мозгу крысы (вне организма), с использованием рецепторных испытаний (Ki нМ). Испытание вне организма. Анализ связывания 5-ГТIA. Кору головного мозга + гипокамп от каждой крысы рассекают и гомогенизируют в 15 мл охлажденного до 0°С 0,05-молярного буферного раствора Трис-HCl, 0,004-молярного хлорида кальция и 0,0057-молярного раствора аскорбиновой кислоты, рН 7,5 с помощью "Ультра-Турракс" (фирма Янко и Кункель, г. Штауфен, ФРГ) в течение 10 сек. После центрифугирования в течение 12,5 мин при скорости 17 000 об/мин (39 800 в Бекмановской центрифуге с охлажденным IA-17 ротором /фирма Бекман, г.Пало-Альто, США/) таблетки повторно суспендируют в том же самом буферном растворе и повторяют гомогенизирование и центрифугирование. К каждой таблетке добавляют 5 мл 0,32-молярного раствора сахарозы, охлажденного до 0°С и гомогенизируют в течение 5 сек. Эти образцы хранятся замороженными при -70°С. При использовании они разбавляются буферным раствором до концентрации 8 мг ткани/мл и гомогенизируются в течение 10 сек. Гомогенизаты ткани выдерживаются в течение 10 минут при 37°С и затем в них добавляют 10 мкмоль паргилина, с последующим повторным инкубированием в течение 10 минут. Анализ связывания проводят, как описано Перуоткой в I.Neurochem. 1986, т.47, с.529-340. Смесь после инкубации (2 мл), содержит ЗН-8-ОН-DPAT (от 0,25 до 8 наномоль), 5 мг/мл тканевого гомогенизата в 50 ммоль/д буферного раствора Трис-HCl, содержащего 4 ммоль/л хлорида кальция и 5,7 ммоль/л аскорбиновой кислоты, рН 7,5. Шесть различных концентраций 3H-8-OH-DPAT были проанализированы. Эксперименты по связыванию начинались с добавления гомогенизата ткани с последующим инкубированием при 37°С в течение 10 минут. Инкубационные смеси фильтровались через стеклянные фильтры "Ватман Джи-Эф/Би" с устройством для сбора урожая клеток Бранделя (Гайтеробург, шт. Мериленд, США). Эти фильтры дважды промывали 5 мл буфера 50 ммоль/л Трис-HCl, охлажденного до 0°С, с рН 7,5 и проводили счет импульсов в 5 мл "Реди-солв Эйч-Пи" (фирма Бекман) в бекмановской сцинтиляционной камере Эл-Эс 3801. Неспецифическое связывание измеряли посредством добавления 10 мкмоль/л 5-гидрокситриптамина к реакционной смеси. Данные связывания обрабатывали посредством компьютерного анализа методом наименьших квадратов (нелинейный) /Мунсон и Родбард. Anal. Biochem. 1980, т. 107, с.220-239). Результаты испытания выражены в виде Ki и даны в наномоль/л. Например, 3-дипропиламино-5-ацетилхроман имеет значение Ki 1,0 (наномоль/л), 3-дипропиламин-5-карбамоилхроман имеет Ki 3,1 нмоль/л, 3-дипропиламино-5-N-метилкарбамоилхроман - Ki 3,3 нмоль/л и 3-дипропиламино-5-(2-тиенилкарбонилхроман) имеет Ki=1,7 нмоль/л. Пример 26. 5-метокси-3-циклопропиламино-хроман хлоргидрат. Целевое соединение получалось согласно известным методам восстановительного аминирования (Clinton F. Lane Synthesis 1975, том 146, стр.135) из метокси-3-хроманона и циклопропиламина. Т.пл. 188189°С. Пример 27. 3-(N-циклопропиламино)-5-гидроксихроман. 3-(N-циклопропиламино)-5-метоксихроман хлоргидрат (5,6 г, 22 ммоля) суспендировался в метиленхлориде (140 мл) в атмосфере азота. Смесь охлаждалась на бане из смеси сухой лед/этанол до -20°С. К перемешиваемой смеси в течение получаса добавлялся ВВr3 (4,1 мл, 44 моля), растворенный в метиленхлориде (60 мл). Желтый прозрачный раствор медленно подогревался до 0°С и хранился при этой температуре до тех пор, пока ГХ не указала на завершение реакции (через 3-5 часов). Затем раствор выливался на раздробленный лед (200 г) и добавлялся достаточно конц. аммиак (водн.) для достижения рН порядка 8-9. Смесь экстрагировалась простым эфиром (3х200 мл). Собранные эфирные фазы сушились (сульфатом магния), фильтровались и концентрировались в вакууме, давая белое твердое вещество. Кристаллизация из абсолютного этанола давала 3-(N-циклопропиламино)-5-гидроксихроман (3,9 г, 88% выход) в виде бесцветных игл. Т.пл. 147-148°С. Пример 28. 3-(N-циклопропиламино)-5-трифторметансу-льфонилоксихроман. Целевое соединение получалось по аналогии с процедурой, используемой в примере 1, исходя из продукта, образованного в примере 27. Основание характеризовалось в виде хлоргидратной соли. Т.пл. 207-209°С (разложение). Пример 29. 3-(N-циклопропиламино)-5-( N-циклопропил)карбамоилхроман. 3-(N-циклопропиламино)-5-трифторметансульфонилоксихроман (0,51 г, 1,5 ммоля) и триэтиламин (0,46 мл, 3,3 ммоля) растворялись в ДМФ (7,5 мл) в 200 мл сосуде для гидрирования. Сосуд вакуумировался с последующим вводом моноокиси углерода (повторно три раза). Добавлялись циклопропиламин (2,9 мл, 42 ммоля), 1,3-бис(дифенилфосфино)пропан (0,023 г, 55 мкмолей) и ацетат палладия(II) (0,12 г, 55 мкмолей), а затем смесь встряхивалась при 70°С в течение 3 часов при давлении СО 2-2,5 бар. После охлаждения до комнатной температуры реакционная смесь распределялась между насыщенным бикарбонатом натрия и эфиром (5х30 мл). Собранные эфирные фазы сушились (сульфатом магния), фильтровались и концентрировались в вакууме. Мгновенная хроматография неочищенного продукта на двуокиси кремния с использованием ТГФ-этилацетат (8:92) в качестве элюента давала 0,32 г белого твердого вещества. Перекристаллизация из смеси ТГФ-эфир давала 3-(N-циклопропиламино)-5-(N-циклопропил)карбамоилхроман 0,17 г, 42% выход в виде бесцветных игл. Т.пл. 126-127°С. Пример 30. Хлоргидрат 3-циклопропиламино-5-[N-(2,6-ксилидино) карбамоил]хромана. Натриевая соль 3-(N-циклопропил-N-трифторацетил)аминохроман-5-карбоновой кислоты (2,1 ммоля), полученная в примере 28, после N-трифторацетилзащиты, сложной этерификации (согласно примеру 2) и последующего гидролиза, и тионилхлорид (10 мл) в атмосфере азота нагревалась с обратным холодильником в течение 2 часов. Избыток тионилхлорида выпаривался совместно с сухим толуолом несколько раз на роторном испарителе. Полученный таким образом хлорангидрид кислоты растворялся в метиленхлориде (10 мл) и добавлялся по каплям к перемешиваемому раствору 2,6-диметиланилина (0,52 г, 4,3 ммоля) и сухого пиридина (6 мл) в атмосфере азота при комнатной температуре. Когда реакция завершалась (в пределах двух часов согласно данным ТСХ и капиллярной ГХ), летучие вещества выпаривались на роторном испарителе. Остаток повторно растворялся в сухом толуоле и концентрировался в вакууме повторно (четыре раза). Очистка с помощью флэш-хроматографии на двуокиси кремния с использованием смеси ТГФ-н-гексан (1:4) в качестве элюента давала 0,72 г 3-(N-циклопропил-N-трифторацетиламино)-5-[N(2,6-ксилидино)карбамоил]хромана (72% выход) в виде бесцветного твердого вещества. Т. пл. 146-149°С (кристаллизованное из смеси СНСl3-н-гексан). Часть данного амида (0,44 г, 0,95 ммоля) добавлялась небольшими порциями в течение 15 минут к перемешиваемой суспензии тетрагидридоалюмината лития (0,072 г, 1,9 ммоля) в 20 мл сухого ТГФ (перегнанного из бензофенон-кетил натрия) в атмосфере азота. Смесь перемешивалась при 45°С до тех пор, пока ТСХ и капиллярная ГХ не показывала завершение реакции (через сорок часов) и затем гасилась осторожным добавлением водного натрий-калиевого тартрата (0,5 М) . После доведения рН до 10 (концентрированным аммиаком) раствор экстрагировался простым эфиром (2х50 мл). Собранные эфирные фазы сушились (карбонатом калия), фильтровались и концентрировались в вакууме. Получающееся в результате масло хроматографировалось на двуокисно-кремниевой колонке, элюируемой смесью CHCl3-EtOAc (1:1), давая 3-циклопропиламино-5-[N-(2,6-ксилидино)карбамоил]хроман 0,071 г, 22% общий выход) в виде масла. Небольшой избыток НСІ (приблизительно 3 М в эфире) добавлялся по каплям к перемешиваемому и охлажденному (+4°С) раствору основания из описанной выше стадии и метанола (2-4 мл). Растворители затем роторно выпаривались, добавлялся эфир и повторно осуществлялось выпаривание для отгонки следов НСІ. Когда колба, заполненная эфиром, оставлялась в холодильнике на ночь, масло затвердевало. Кристаллизация из абсолютного этанола давала хлоргидрат 3-циклопропиламино-5-[N-(2,6-ксилидино)карбамоил]хромана в виде бесцветных игл. Т.пл. 189191°С (разложение). Пример 31. 3-(N,N-диаллиламино)-5-метоксихроман и 3- (N-аллиламино-5-метоксихроман. Хлоргидрат 3-амино-5-метоксихромана (Acta Pharm. Suec. 24 (1987)) (5,0 г, 23 ммоля), аллилбромид (3,4 мл, 39 ммоля), безводный карбонат калия (9,6 г, 69 ммолей) и ДМФ (8,0 мл) перемешивались в атмосфере азота при комнатной температуре в течение 72 часов. Добавлялся эфир (150 мл), соли отфильтровывались с помощью отсасывания и прозрачный фильтрат концентрировался в вакууме. Остаток очищался на кремнеземной колонке, элюируемой 1000 мл ТГФ-н-гексан (1:9) и 1000 мл ТГФ-гексан (1:3), давая 3(N-аллиламино)-5-метоксихроман (1,7 г, 33% выход) и 3-(N,N-диаллиламино)-5-метоксихроман (3,4 г, 56% выход) в виде масел. Диаллиламино производное, указанное выше, выделялось в виде хлоргидратной соли с помощью добавления небольшого избытка НСl (приблизительно 3 М в эфире) к эфирному раствору амина. Неочищенная НСl соль кристаллизовалась при стоянии эфиром, на холоде. Т.пл. 139-140°С. Пример 32. 3-(N-аллил-N-н-пропиламино)-5-метоксихроман. 3-(N-аллиламино)-5-метоксихроман (1,3 г, 5,9 ммоля), полученный аналогично описанному в примере 26, н-пропилиодид (2,1 мл, 21 ммоль), безводный карбонат калия (3,0 г, 21 ммоль) и ацетонитрил (5,5 мл) перемешивались в атмосфере азота при 47°С (температура масляной бани) в течение пяти дней до тех пор, пока ГХ не показывала завершенную реакцию. Добавлялся эфир (40 мл), соли отфильтровывались отсасыванием, и прозрачный фильтрат концентрировался в вакууме, давая 3-(N-аллил-N-н-пропиламино)-5метоксихроман (1,24 г, 81% выход) в виде масла. Основание осаждалось из эфирного раствора добавлением легкого избытка НСІ (приблизительно 3 М в эфире). Кристаллизация неочищенной НСІ соли давала бесцветные иглы. Т.пл. 117-118°С. Пример 33. 3-(N-аллил-N-н-пропиламино)-5-гидроксихроман. Целевое соединение получалось по аналогии с процедурой, используемой в примере 27, с использованием продукта, полученного в примере 32. Кристаллизация из смеси СНСl3-н-гексан давала бесцветные иглы. Т.пл. 78-80°С. Пример 34. 3-(N-аллил-N-н-пропиламино)-5-трифторметан-сульфонил-оксихроман. Целевое соединение получалось по аналогии с процедурой примера 1 с использованием продукта из примера 33 в качестве исходного материал.MC/EI; 70 ev/m/z 379 (М+, 8%), 350 (100%), 246 (10%). Пример 35. 5-ацетил-3-(N-аллил-N-н-пропиламино)хроман. 3-(N-Аллил-N-н-пропиламино)-5-трифторметансульфонилоксихроман (0,28 г, 0,74 ммоля), хлорид лития (0,097 г, 2,3 ммоля), PdCl2 (dppf)* (0,031 г, 0,04 ммоля) и 2,6-ди-трет.-бутил-4-метилфенол (0,005 г) растворялись в ДМФ (5,0 мл) в трехгорлой круглодонной колбе (50 мл) с магнитной мешалкой. Колба вакуумировалась с последующим вводом СО (три раза). Добавлялось тетраметилолово (0,12 мл, 0,89 ммоля), а затем смесь перемешивалась в атмосфере СО (1 атм.) при 120°С (темп. масляной бани) в течение 4 часов. Растворитель выпаривался, остаток распределялся между водным аммиаком (2 М) и метиленхлоридом (3х15 мл) и органические фазы сушились (сульфатом натрия), фильтровались и концентрировались в вакууме. Хроматография на колонке из кремнезема с использованием ТГФ-н-гексана (1:9) в качестве элюента давала 5-ацетил-3-(N-аллил-N-н-пропиламино)хроман (0,078 г, 39% выход) в виде масла. Основание осаждалось из эфирного раствора добавлением небольшого избытка НСІ (приблизительно 3 М в эфире). Неочищенная соль собиралась и сушилась в вакууме при 40°С, давая белый аморфный порошок. Т.пл. 125127°С. * PdCl2 (dppf)= дихлор [1,1'-бис(дифенилфосфино)ферроцен] палладий(II). Пример 36. Хлоргидрат 3-изопропиламино-5-метоксихромана. Целевое соединение получалось аналогично процедуре, используемой в примере 26, исходя из 5метокси-3-хромана и изопропиламина. Т.пл. 255°С. Пример 37. 3-(N,N-изопpoпил-н-пpoпил)амино-5-метоксихроман. Смесь продукта, полученного в примере 36 (14 г), 0,06 моля, 1-иодпропана (15 г, 0,08 моля), карбоната калия и ацетонитрила (250 мл) перемешивалась в условиях дефлегмации в течение 4 дней. После хроматографии целевой продукт выделялся в виде бесцветного масла. ГХ-МС (CI-mode) M+l=264 (100%). Пример 38. 3-(N,N-изопропил-н-пропил)амино-5-гидроксихроман. Продукт из примера 37 (10 г, 0,038 моля) диметилировался с использованием трехбромистого бора в дихлорметане. ГХ-МС (CI-mode) М+1=250 (100%). Пример 39. 3-(N,N-изопропил-н-пропиламино)-5-трифторметансульфоноксихроман. Целевое соединение получалось аналогично процедуре, используемой в примере 1, с использованием продукта из примера 38 в качестве исходного материала ГХ-МС (CI-mode) М+1=381 (100%). Пример 40. Хлоргидрат 5-ацетил-3-(N-изопропил-N-н-пропиламино)хромана. Целевое соединение получалось аналогично примеру 35 исходя из продукта, полученного в примере 39 и с добавлением СО в аппарате Парра при 2 бар. Т.пл. 170°С. Пример 41. 3-(N-иэопропил-N-н-пропиламино)-5-мети-локсикарбонилхроман. Целевое соединение получалось аналогично процедуре, используемой в примере 2, исходя из продукта, полученного в примере 39 (3 г, 0,016 моля), Pd (OAc)2 (75 мг) , 1,3-бис(ди-фенилфосфин)пропана (150 мг) , ДМФ (50 мл) и метанола (25 мл) в аппарате Парра под давлением СО (2 бар) при 70°С в течение 6 часов, ГХ-МС (CI-mode) M+l=292 (100%). Пример 42. Хлоргидрат 3-(N-изопропил-N-н-пропилами-но)-5-(N-метил) карбамоилхромана. Продукт, полученный из примера 41 (1 г, 0,0034 моля), NaCN (50 мг) , метанол (30 мл) и насыщенный водный раствор СН3NН2 (5 мл) подвергались реакции в стальном сосуде при 80°С на протяжении ночи. После обработки бесцветное масло превращалось в хлоргидратную соль. Т.пл.123°С. Пример 43. Хлоргидрат 3-(N-изопропил-N-н-пропилами-но)-5-(N-этил) карбамоилхромана. Целевое соединение получалось аналогично процедуре, используемой в примере 42, исходя из продукта, полученного в примере 41 (1 г, 0,0034 моля), KCN (50 мг), метанола (40 мл) и этиламина (5 мл, 70% водный раствор) в стальном сосуде при 80°С в течение 4 дней. Хроматографическая обработка давала бесцветное масло, которое превращалось в HCl-соль. Т.пл. 198°С. Пример 44. 3-(N-циклопропилметил-N-н-пропиламино)-5-(N-циклопропилметил) карбамоилхроман. Целевое соединение получалось из 3-(N-циклопропилметил-N-н-пропиламино)-5-трифторметансульфонилоксихромана (1,08 г, 0,0026 моля), полученного аналогично описанному в примерах 36-39, 1,3бис(дифенилфосфин)пропана (40 г), ацетата палладия (II) (22 мг) и циклопропилметиламина (2,3 г, 0,0264 моля) в 30 мл ДМФ, которые помещались в стеклянный сосуд Парра. Добавлялась СО при 2 бар и смесь встряхивалась при 60°С в течение 4 часов. После обработки и хроматографической очистки получалось целевое соединение в виде белых кристаллов с т.пл. 124°С (основание) в виде игл. Т.пл. 94-95°С. Пример 45. Хлоргидрат 3-(N-циклопропил-N-н-пропиламино)-5-фенилхромана. Целевое соединение получалось из смеси 3-(N-циклопропил-N-н-пропиламино)-5-трифторметилсульфонилоксихромана, полученного аналогично примеру 36-39 (2 г, 5,1 ммоля), триметилфе-нилстаннана (1,8 г, 4,8 ммоля), тетракис(трифенилфосфин)палладия(0) (280 мг, 0,24 ммоля). Хлорид лития (600 мг, 14,4 ммоля) и 2,6-ди-трет.-бутил-4-метилфенол в 60 мл диоксана и 6 мл ДМФ перемешивался при 105°С в стальном сосуде в течение 3 дней. Смесь фильтровалась и экстрагировалась. Хроматографическая очистка на окисно-алюминиевой колонке давала целевое соединение с выходом 55%. Соединение выделялось в виде хлоргидратной соли. Т.пл. 160°С. Пример 46. 3-(N,N-дипр оп илам ин о)- 5-( N-циклопропил)карбамоилтиохроман. 3-(N,N-дипропиламино)-5-трифторметансу-льфонилокситиохроман (0,70 г, 1,76 ммоля), триэтиламин (0,39 г, 0,54 мл, 3,9 ммоля) и ДМФ (5 мл) смешивались вместе и раствор дегазировался (10 мм рт.ст., комн. темп. 15 минут), затем подвергался действию СО атмосферы (х3). Затем добавлялись ацетат палладия(II) (12 мг), 1,3-бис-дифенилфосфинопропан (22 мг) и циклопропиламин (3,0 г, 3,7 мл, 52,8 ммоля). Получающаяся смесь снова подвергалась действию атмосферы СО и нагревалась до 70°С при перемешивании в течение 4 часов. Раствор охлаждался, выпаривался в вакууме (вакуумный насос), затем разбавлялся этилацетатом. Смесь промывалась раствором бикарбоната (три раза), обрабатывалась насыщенным солевым раствором, сушилась (сульфатом натрия) и выпаривалась в вакууме, давая сырой продукт. Хроматография на двуокиси кремния (кремнеземе) (элюент: 50% этилацетат/гексан) давала 0,38 г вещества в виде белых твердых кристаллов (64% выход). Т.пл. 109-110°С. 13С ЯМР: (200 МГц CDCl3) млн. дол. 171,1, 137,8, 134,5, 133,2, 128,0, 126,0, 122,7, 56,5, 52,5, 29,9, 28,1, 23,0, 22,4, 11,9, 7,0. Пример 47. 3-(N,N-дипропиламино)-5-метилоксикарбонилтиохроман. 3-(N,N-дипропиламино)-5-трифторметансу-льфонилтиохроман (620 мг, 1,6 ммоля) растворялся в 11 мл смеси ДМФ/метанол 6:2, и раствор дегазировался в течение 15 минут. К реакционной смеси добавлялись Pd(OAc)2 (11 мг) , 1,3-бис-дифенил-фосфинопропан (19 мг) и триэтиламин (0,48 мл, 0,35 г). Смесь нагревалась до 70°С в атмосфере моноокиси углерода и перемешивалась в течение 5 часов. Раствор охлаждался, разбавлялся 30 мл толуола, промывался насыщенным бикарбонатом натрия, сушился (сульфатом натрия) и выпаривался в вакууме. Хроматография на двуокиси кремния (элюент: градиент СНСl3 ->10% EtOAc/CHCl3) давала 310 мг (64% выход) целевого соединения (основание) в виде слегка желтого масла. 13 С ЯМР: (200 МГц, CDCl3) млн.дол. 168,2, 136,6, 134,8, 131,6, 130,1, 126,5, 125,7, 56,7, 52,5, 52,1, 30,4, 28,0, 22,3, 11,9. Пример 48. 3-(N-Изопропил-N-н-пропиламино)-5-фенил-1-оксотиохроман. Хлоргидрат 3-(N-изопропил-N-н-пропиламино)-5-фенилтио-хромана (310 мг, 0,86 ммоля) растворялся в 6 мл хлороформа и к охлажденному раствору (ледяная баня) добавлялась м-хлорнадбензойная кислота (348 мг, 1,72 ммоля) в виде одной порции. Реакционной смеси давали возможность перемешиваться при комнатной температуре в течение 18 часов. Растворитель удалялся в вакууме и остатки экстрагировались смесью эфир/2 М NaOH, обрабатывались насыщенным солевым раствором и сушились (натрием). Растворитель выпаривался в вакууме, давая сырую смесь. Хроматография на двуокиси кремния (элюент: 25% этил-ацетат/метиленхлорид) дала 79 мг (27% выход) желаемого сульфоксида в виде диастереомерной смеси (18:82 по данным ГХ), получаемой в виде не совсем белого твердого вещества. Т.пл. 109-112°С. Пример 49. 5-(2-фуранил)-3-(N-изопропил-N-н-пропиламино)-1-оксотиохроман. Хлоргидрат 5-(2-фуранил)-3-(N-изопропил-N-н-пропиламино)тиохромана (341 мг, 0,97 ммоля) растворялся в 7 мл метиленхлорида и охлаждался до -20°С. Добавлялась м-хлорнадбензойная кислота (258 мг, 1,27 ммоля) одной порцией и реакционная смесь оставлялась перемешиваться при комнатной температуре в течение 18 часов. Растворитель удалялся в вакууме и остатки экстрагировались смесью эфир/2 М гидроокись натрия, обрабатывались насыщенным солевым раствором и сушились (сульфатом натрия). Растворитель выпаривался в вакууме, давая сырую смесь. Хроматография на двуокиси кремния (элюент: 25% этилацетат/метиленхлорид) давала 35 мг неполярного диастереомера целевого соединения, 75 мг полярного (основного) диастереомера целевого соединения и 92 мг диастереомерной смеси (25:75 по ГХ), давая объединенный выход 63%. Неполярный (второстепенный) изомер (не совсем белое твердое вещество): т.пл.63-65°С. Полярный (главный) изомер (не совсем белое твердое вещество): т.пл. 83-85°С. Пример 50. 5-(2-фуранил)-3-(N-изопропил-N-н-пропиламино)-1,1-диоксотиохроман. 5-(2-фуранил)-3-(N-изопропил-N-н-пропиламино)-1-оксотиохроман (в виде диастереомерной смеси (25:75 по ГХ)) (92 мг, 0,29 ммоля) растворялся в эфире и по каплям добавлялся НСl в эфире до тех пор, пока раствор не становился кислым. Растворитель удалялся в вакууме. Полученное белое твердое вещество растворялось в 3 мл метиленхлорида и раствор охлаждался до -15°С. Добавлялась м-хлорнадбензойная кислота (118 мг, 0,58 ммоля) одной порцией и реакционная смесь оставлялась перемешиваться при комнатной температуре в течение 18 часов. Реагировал только второстепенный диастереомер, давая желаемый сульфон вследствие стерических причин. Растворитель удалялся в вакууме, а остатки экстрагировались смесью эфир/2 М гидроокись натрия, обрабатывались насыщенным солевым раствором и сушились (сульфатом натрия), растворитель выпаривался в вакууме, давая сырую смесь. Препаративная ТСХ (элюент: 20% этилацетат/метиленхлорид) давала 5 мг (5% выход) целевого соединения. МС 347. 13С ЯМР: (200 МГц, СDСl3) млн.дол. 151,7, 143,0, 139,3, 132,3, 131,6, 127,5, 125,6, 123,5, 111,7, 110,5, 54,3, 51,3, 49,4, 47,4, 34,4, 23,3, 21,7, 20,0, 11,8. Пример 51. Хлоргидрат 5-(2-фуранил)-3-(N-изопропил-N-н-пропиламино) тиохромана. К раствору 3-(N-изопропил-N-н-пропиламино)-5-трифторметансульфонилтиохромана (0,92 г, 2,31 ммоля), этанола (10,2 мл), хлористого лития (0,20 г, 4,8 ммоля), 2 М карбоната натрия (3,4 мл) и тетракис(трифенилфосфин)палладия(0) (49,0 мг, 0,042 ммоля), растворенных в толуоле (23 мл) добавлялась 2-фуранилбороновая кислота (0,62 г, 4,6 ммоля) в виде одной порции в атмосфере азота. Получающийся в результате раствор нагревался до 95°С в течение 2 часов, затем реакционная смесь оставлялась охлаждаться. Реакционная смесь фильтровалась и растворитель выпаривался в вакууме. Остаток брался в эфир, промывался 2 М аммиаком, обрабатывался насыщенным солевым раствором и сушился (сульфатом натрия). Удаление растворителя в вакууме давало неочищенное соединение. Хроматография на двуокиси кремния (элюент: 3% этилацетат/хлороформ) давала 0,68 г (выход 93%) целевого соединения (основание) в виде слегка желтого масла. Хлоргидратная соль получалась с помощью растворения чистого основания вэфире и добавления по каплям избытка эфирного раствора НСl, затем перекристаллизации (этилацетат/эфир), давая бесцветные кристаллы. Т.пл. 145-147°С. Пример 52. 5-изопропиламидо-3-(N-иэопропил-N-н-пропиламино)тиохроман. 3-(N-изопропил-N-н-пропиламино)-5-трифторметансульфонилтиохроман (0,99 г, 2,49 ммоля) растворялся в диоксане (15 мл) и раствор дегазировался (10 мм рт.ст., комн. темп.), затем подвергался действию СО атмосферы (х3). Добавлялись изопропиламин (1,1 мл, 12,5 ммолей), ацетат палладия (15 мг) и 1,3-бисдифенилфосфинопропан (29 мг). Получающаяся смесь снова подвергалась действию атмосферы СО и нагревалась до 80°С при перемешивании в течение 4 часов. Раствор охлаждался, выпаривался в вакууме (вакуумный насос), затем разбавлялся эфиром. Смесь промывалась 2 М раствором аммиака (х2), обрабатывалась насыщенным солевым раствором, сушилась (сульфатом натрия) и выпаривалась в вакууме, давая сырое вещество. Хроматография на двуокиси кремния (элюент: 30% этилацетат/гексан) давала 0,76 г масла (выход 87%), которое кристаллизовалось и перекристаллизовывалось (из гексана), давая белое твердое вещество. Т.пл. 90-91°С. Пример 53. 3-(N-изопропил-N-н-пропиламино(-5-трифторметансульфонилтиохроман. 5-гидрокси-3-(N-изопропил-N-н-пропилами-но)тиохроман (3,13 г, 11,9 ммоля) и коллидин (2,02 г, 2,2 мл, 16,7 ммоля) растворяли в 100 мл метиленхлорида и охлаждали до -30°С. По каплям добавлялся трифторметансульфоновый ангидрид (4,03 г, 2,4 мл, 14,3 ммоля), и смесь оставлялась подогреваться до температуры окружающей среды, а спустя 20 минут разбавлялась метиленхлоридом. Раствор промывался насыщенным бикарбонатом натрия, сушился (сульфатом натрия) и выпаривался в вакууме. Хроматография на двуокиси кремния (элюент: 3% этилацетат/гексан) давала 3,9 г (83% выход) целевого соединения в виде слегка желтого масла. МС: 397, 13С ЯМР: (200 МГц CDCl3) млн. дол. 148,3, 136,7, 128,8, 127,2, 126,3, 121,9, 117,0, 115,5, 52,8, 48,8, 47,1, 30,2, 28,8, 23,7, 21,2, 20,9, 11,7. Пример 54. 3-(N-изопропил-N-н-пропиламино)-5-метило-ксикарбонилтиохроман. 3-(N-изопропил-N-н-пропиламино)-5-трифто-рметансульфонилтиохроман (0,97 г, 2,44 ммоля) растворялся в 17 мл смеси ДМФ/метанол 6:2 и раствор дегазировался в течение 15 минут. К реакционной смеси добавлялись Pd(OAc)2 (17 мг), 1,3-бис-дифенилфосфинопропан (29 мг)и триэтиламин (0,54 г, 0,75 мл, 5,4 ммоля). Смесь нагревалась до 70°С в атмосфере моноокиси углерода и перемешивалась в течение 4 часов. Раствор охлаждался, разбавлялся толуолом, промывался насыщенным бикарбонатом натрия, сушился (сульфатом натрия) и выпаривался в вакууме. Хроматография на двуокиси кремния (элюент:5% этилацетат/гексан) давала 0,69 г (выход 92%) целевого соединения (основание) в виде прозрачного масла. МС 307. 13С ЯМР: (200 МГц, CDCl3) млн. дол. 168,3, 137,0, 134,8, 131,6, 130,1, 126,5, 125,7, 53,9, 52,2, 48,9, 47,3, 32,7, 30,1, 23,8, 21,1, 11,8. Пример 55. Хлоргидрат 3-(N-изопропил-N-н-пропилами-но)-5-фенилтиохромана К раствору 3-(N-изопропил-N-н-пропилами-но)-5-трифторметансульфонилтиохромана (0,95 г, 2,39 ммоля), этанола (10,5 мл), хлорида лития (0,20 г, 4,8 ммоля), 2 М карбоната натрия (3,5 мл) и тетракис(трифенилфосфин)палладия(0) (50 г, 0,043 ммоля), растворенному в толуоле (23 мл), добавлялась фенилбороновая кислота (0,35 г, 2,9 ммоля) в виде одной порции в атмосфере азота. Получающийся в результате раствор нагревался до 95°С в течение 5 часов, затем реакционная смесь оставлялась охлаждаться. Реакционная смесь фильтровалась, и растворитель выпаривался в вакууме. Остаток брался в эфир, промывался 2 М аммиаком, обрабатывался насыщенным солевым раствором и сушился (сульфатом натрия). Удаление растворителя в вакууме давало сырое соединение. Хроматография на двуокиси кремния (элюент: метиленхлорид) давала 0,73 г (выход 94%) целевого соединения (основание) в виде масла. Хлоргидратная соль получалась с помощью растворения чистого основания в эфире и добавления по каплям избытка эфирного раствора НСl, затем перекристаллизовывалась (этилацетат/эфир), давая слегка желтое твердое вещество. Т.пл. 110-112°С. Пример 56. (R)-3-(N-изопропил-N-н-пропиламино)-5-(3-тиофен)хроман. (R)-3-(N-изопропил-N-н-пропиламино)-5-три-фторметансульфонилоксихроман (0,3 г, 0,8 ммоля), 3тиофенбороновая кислота (0,2 г, 1,6 ммоля), хлористый литий (0,07 г, 1,6 ммоля), карбонат натрия (2 М, 3 мл), этанол (7 мл) и толуол (15 мл) смешивалась в трехгорлой круглодонной колбе в атмосфере азота. Добавлялся катализатор Рd(РРh3)4 и реакционная смесь перемешивалась при 90°С в течение 4 часов. Растворитель удалялся в вакууме до тех пор, пока не оставалось примерно 15 мл перед тем, как разбавлялся диэтиловым эфиром, смесь промывалась (NН3, 2 М) и сушилась (сульфатом магния). Растворитель удалялся в вакууме, давая коричневатый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 10:1), давая целевое соединение с выходом 80% (0,2 г), a (основание) =-40° (МеОН, 0,1 М, 22°С). Хлоргидратная соль осаждалась из диэтилового эфира при 0°С. Т.пл. 174-175°С. Пример 57. (R)-3-(N-изопропил-N-н-пропиламино)-5-(2-тиофен)хроман. (R)-3-(N-изопропил-N-н-пропиламино)-5-три-фторметансульфонилоксихроман (0,4 г, 1,1 ммоля), 2тиофенбороновая кислота (0,27 г, 2,1 ммоля), хлорид лития (0,09 г, 2,1 ммоля), карбонат натрия (2 М, 3 мл), этанол (7 мл) и толуол смешивались в атмосфере азота, затем добавлялся Рd(РРН3)4 (0,03 г, каталитическое количество). Смесь затем перемешивалась в течение 8 часов при 90°С. Растворитель удалялся в вакууме до тех пор, пока не оставалось 10 мл. Остаток разбавлялся диэтиловым эфиром, промывался аммиаком (2 М) и сушился сульфатом магния. Растворитель удалялся в вакууме, давая коричневатый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 10:1), давая целевое соединение с выходом 94% (0,3 г), a (основание)=-36° (метанол, 0,1 М, 22°С). Хлоргидратная соль осаждалась из диэтилового эфира при 0°С. Т.пл. 189-191°С. Пример 58. (R)-5-изопропоксикарбонил-3-(N-изопропил-N-н-пропил-амино)хроман. (R)-3-(N-изопропил-N-н-пропиламино)-5-три-фторметансульфонилоксихроман (0,4 г, 1,1 ммоля), триэтиламин (0,2 г, 2,2 ммоля), ДМФ (6 мл) и изопропанол (2 мл) смешивались в трехгорлой 50 мл круглодонной колбе. Колба вакуумировалась с последующим вводом СО газа (повторялось три раза, СО в бюретке с водой), затем добавлялись 1,3-бис(трифенилфосфин)пропан (0,02 г, каталитическое количество) и ацетат палладия(II) (0,08 г, каталитическое количество). Смесь перемешивалась при 80°С в течение 7 часов. Растворитель удалялся в вакууме и остаток растворялся в диэтиловом эфире, промывался аммиаком (2 М) и сушился (сульфатом магния). Растворитель удалялся в вакууме, давая желтоватый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 10:1), давая целевое соединение с выходом 66% (0,2 г), a (основание) =-110,5° (метанол, 0,1 М, 22°С). Хлоргидративная соль осаждалась из диэтилового эфира при 0°С и перекристаллизовывалась из смеси этилацетат/диэтиловый эфир. Т.пл. 153-155°С. Пример 59. (R)-3-(N-изопропил-N-н-пропиламино)-5-(2-N-тиазоламинокарбонил)хроман. (R)-5-хлоркарбонил-3-(N-изопропил-N-н-пропиламино)хроман (0,65 г, 2,3 ммоля) и 2-аминотиазол (0,68 г, 6,8 ммоля), растворенные в метиленхлориде (50 мл), перемешивались при комнатной температуре в течение 2 часов. Удаление растворителя в вакууме коричневатый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхло-рид/этилацетат, 10:1), давая целевое соединение с выходом 43% (0,35 г). Хлоргидратная соль осаждалась из диэтилового эфира при 0°С, а затем перекристаллизовывалась из смеси этилацетат/диэтиловый эфир. a (НСl-соль)=-20,0°С. Спекается при менее 140°С. Пример 60. (R)-3-(N-изопропил-N-н-пропиламино)-5-(3-пиридин)хроман. (R)-3-(N-изопропил-N-н-пропиламино)-5-три-фторметансульфонилоксихроман (0,37 г, 0,96 ммоля) растворялся в толуоле в атмосфере азота. Добавлялись этанол (7 мл), 2 М карбонат натрия (3 мл), хлористый литий (0,08 г, 1,9 ммоля), 3-пиридинбороновая кислота (0,7 г, 0,5 ммоля) и наконец Pd(PPh3)4 (0,04 г) и реакционная смесь нагревалась с обратным холодильником в течение 6 часов. Растворитель удалялся в вакууме до тех пор, пока не оставалось 10 мл. Остаток разбавлялся диэтиловым эфиром, промывался 2 М аммиаком и сушился (сульфатом магния). Удаление растворителя давало желтоватый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 5:1), давая целевое соединение с выходом 94% (0,28 г). a (основание)=-47,6° (метанол, 0,1 М, 21°С). Диоксалат осаждался с помощью добавления щавелевой кислоты (2,2 экв.), растворенной в диэтиловом эфире, к раствору основания в диэтиловом эфире. Затем соль перекристаллизовывалась из смеси этанол/диэтиловый эфир. Спекается при менее 135°C. Пример 61. (R)-3-(N-изопропил-N-н-пропиламино)-5-фенилхроман. (R)-3-(N-изопропил-N-н-пропиламино)-5-три-фторметансульфонилоксихроман (1 г, 2,6 ммоля) растворялся в толуоле (25 мл) в атмосфере азота. Добавлялись этанол (11,5 мл, хлористый литий (0,22 г, 5,2 ммоля), карбонат натрия (2 М, 3,8 мл), Pd (PPh3)4 (0,054 г, 0,047 ммоля) и фенилбороновая кислота (0,38 г, 3,1 ммоля) и реакционная смесь перемешивалась при 90°С в течение 7 часов. Растворитель удалялся в вакууме до тех пор, пока не оставалось 15 мл. Остаток разбавлялся диэтиловым эфиром, промывался аммиаком (2 М) дважды и сушился (сульфатом магния). Удаление растворителя в вакууме давало желтоватокоричневый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид), давая целевое соединение с выходом 86% (0,7 г). a=-50,7° (МеОН, 0,1 М, 22°С). HCl-соль осаждалась из эфира медленным добавлением НСl в эфире к охлажденном льдом раствору основания. Сырая соль перекристаллизовывалась из смеси этилацетат/диэтиловый эфир, давая 650 мг иглообразных кристаллов. Т.пл. 141-142°С. Пример 62. (R)-5-аминокарбонил-3-(N-изопропил-N-н-пропиламино)хроман. Раствор (R)-5-хлоркарбонил-3-(N-изопропил-N-н-пропиламино)хромана (0,37 г, 1,3 ммоля) в метиленхлориде (30 мл) осторожно продувался аммиаком в течение 30 секунд. Немедленно образовывался белый осадок. Реакционная смесь затем перемешивалась в течение 30 минут при комнатной температуре, затем она промывалась водой и сушилась (сульфатом магния). Растворитель удалялся в вакууме, давая сырое масло, которое очищалось с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 10:1). Целевое соединение получалось с выходом 58% (0,21 г) в виде бесцветных кристаллов из смеси диэтиловый эфир/гексан. a =-115,8° (МеОН, 0,1 М, 21°С). Т.пл. 120,6-122°С. Пример 63. (R)-3-(N-Изопропил-N-н-пропиламино)-5-N-фениламинокарбонилхроман. (R)-5-хлоркарбонил-3-(N-изопропил-N-н-пропиламино)хроман (0,65 г, 2,3 ммоля) и анилин (0,86 г, 9,2 ммоля), растворенные в метиленхлориде (30 мл), перемешивались при комнатной температуре в течение 1 часа. Реакционная смесь затем промывалась 2 М аммиаком и сушилась (сульфатом натрия). Растворитель удалялся в вакууме, давая коричневатый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 5:1), давая чистое целевое соединение с выходом 91% (0,75 г). a (основание)=-91,3° (МеОН, 0,1 М, 21°С). Хлоргидратная соль осаждалась из диэтилового эфира при 0°С, а затем перекристаллизовывалась из смеси этилацетат/диэтиловый эфир. Спекается при менее 120°С. Пример 64. (R)-5-(2-фурил)-3-N-изопропил-N-н-пропиламинохроман. (R)-3-(N-изопроил-N-н-пропиламино)-5-три-фторметансульфонилоксихроман (0,4 г, 1 ммоль), 2-фурилбороновая кислота (0,3 г, 2,6 ммоля), хлористый литий (0,09 г, 2 ммоля), карбонат натрия (2 М, 3 мл), этанол (7 мл) и толуол (15 мл) смешивались в атмосфере азота в трехгорлой 100 мл-вой круглодонной колбе, снабженной конденсатором. Наконец добавлялся Рd(РРh3)4 (0,03 г, каталитическое количество) и реакционная смесь нагревалась с обратным холодильником в течение 2 часов, затем она разбавлялась диэтиловым эфиром, промывалась (2 М аммиаком) и сушилась (сульфатом натрия). Растворитель удалялся в вакууме, давая коричневатый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 10:1), давая чистое целевое соединение с выходом 95% (0,3 г). a (основание)=-57,4° (MeOH, 0,1 М, 21°С). Хлоргидратная соль осаждалась из диэтилового эфира при 0°С, затем перекристаллизовывалась из смеси этилацетат/диэтиловый эфир. Т.пл. 151-152°С. Пример 65. 5-формил-З-(N-изопропил-N-пропиламино)хроман. а) 5-Гидроксиметил-3-(N-изопропил-N-пропиламино)хроман. 5-Метоксикарбонил-3-(N-изопропил-N-пропиламино) хроман (0,69 г, 2,36 ммоля) растворялся в 25 мл сухого метиленхлорида и охлаждался до -78°С. По каплям добавлялся 1 М раствор диизобутилалюминийгидрида в гексане (6,6 мл) и реакционная смесь оставлялась подогреваться до комнатной температуры в течение 50 минут. По каплям добавлялся 1 М раствор КОН, а затем реакционная смесь помещалась в холодильник на ночь. Раствор выливался через слой сульфата натрия, сушился (сульфатом натрия), фильтровался и растворитель удалялся в вакууме, давая 0,60 г (97% выход) целевого соединения в виде прозрачного масла. 13С ЯМР: (200 МГц CDCl3) млн. дол. 154,6, 140,1, 127,0, 120,5, 119,8, 116,3, 69,0, 62,9, 50,9, 48,9, 47,8, 27,2, 24,3, 21,0, 20,1, 11,7. b) 5-формил-3-(N-изопропил-N-пропилами-но)хроман. 5-гидроксиметил-3-(N-изопропил-N-пропиламино)хроман (0,60 г, 2,27 ммоля) растворялся в 50 мл метиленхлорида и к раствору добавлялась в виде одной порции двуокись марганца (1,98 г, 22,7 ммоля) и реакционная смесь оставлялась перемешиваться при комнатной температуре в течение 8 дней. Реакционная смесь фильтровалась через слой целита, промывалась теплым метиленхлоридом и растворитель удалялся в вакууме. Хроматография на двуокиси кремния (элюент: 5% этилацетат/гексан) давала 0,33 г (56% выход) целевого соединения (основание) в виде слегка желтого масла. 13 С ЯМР: (200 МГц, CDCl3) млн. дол. 193,0, 155,1, 135,0, 127,0, 126,8, 124,0, 69,2, 50,3, 48,9, 47,7, 28,1, 24,3, 21,1, 19,9, 11,6. Пример 66. (R)-3-(N-изобутил)амино-5-(N-метил)карбамоилхроман. К перемешиваемому раствору (R)-3-амино-5-(N-метил)карбамоилхромана в метаноле (25 мл) добавлялся изомасляный альдегид (0,33 г, 4,60 ммоля). Смесь охлаждалась до 0°С и порциями добавлялся цианоборгидрид натрия (0,34 г, 5,44 ммоля). Величина рН доводилась приблизительно до рН 5 с помощью уксусной кислоты. Смесь перемешивалась при комнатной температуре в течение 3,5 часов. Добавлялось небольшое количество изобутиральдегида (15 мг, 0,21 ммоля) вследствие неполной реакции и смесь перемешивалась в течение еще 20 минут. Растворитель выпаривался и остаток распределялся между эфиром (100 мл) и 1 М раствором аммиака (20 мл). Слои разделялись и водная фаза экстрагировалась эфиром (3х50 мл). Объединенные органические слои промывались 1 М раствором аммиака (20 мл), сушились (сульфатом магния), фильтровались и выпаривались. Остаток хроматографировался на короткой колонке из силикагеля (элюент:этилацетат + 0,5% конц. аммиак). Чистые фракции сливались и выпаривались, давая 0,81 г (74%) целевого соединения в виде белого твердого вещества: т.пл 111-112,8°С [a]21: -33,1 (с=2,6, МеОН). Пример 67. Хлоргидрат (R)-3-(N-изобутил-N-пропил)амино-5-(N-метил)карбамоилхромана. Пропионовый альдегид (0,11 г, 131 мкл, 1,82 ммоля) добавлялся к перемешиваемому охлажденному льдом раствору (R)-3-(N-изобутил)амино-5-(N-метил)карбамоилхромана (0,43 г, 1,65 ммоля) в метаноле (10 мл). Добавлялся порциями цианоборгидрид натрия (0,14 г, 2,15 ммоля) и величина рН доводилась до 5 с помощью уксусной кислоты. Реакционная смесь перемешивалась при комнатной температуре. Для завершения реакции необходимо было несколько раз добавить пропиональдегид. Всего к реакционной смеси добавлялось 0,20 г, 248 мкл, 3,44 ммоля. Растворитель удалялся в вакууме и остаток распределялся между эфиром (100 мл) и 1 М раствором аммиака (20 мл). Слои разделялись и водный слой экстрагировался эфиром (50 мл). Объединенные органические слои промывались насыщенным солевым раствором (20 мл), сушились (сульфатом магния), фильтровались и выпаривались. Неочищенный продукт фильтровался через короткую колонку из силикагеля (элюент: этилацетат/гексан 1:1 + 0,5% конц. аммиак). Элюент удалялся в вакууме, давая неокрашенное масло, которое превращалось в хлоргидрат в смеси HCl/эфир. Пример 68. (R)-3-(N-(2-пиридил)метил)амино-5-(N-метил)карбамоилхроман. (R)-3-амино-5-(N-метил)карбамоилхроман (1,02 г, 4,96 ммоля) растворялся в метаноле (30 мл). Реакционный сосуд накрывался алюминиевой фольгой для предотвращения подвержения воздействию света. Раствор охлаждался до 0°С и добавлялся пиколинальдегид (0,69 г, 617 мкл, 6,45 ммоля). Затем добавлялся цианоборгидрид натрия (0,53 г, 8,44 ммоля) порциями и величина рН доводилась до 5,5 с помощью уксусной кислоты. Реакционная смесь перемешивалась при комнатной температуре в течение 2 часов. Добавлялось еще 50 мкл, 0,52 ммоля пиколинальдегида для того, чтобы завершить реакцию, и смесь перемешивалась в течение 1 часа. Растворитель удалялся в вакууме и остаток распределялся между эфиром (100 мл) и 1 М раствором аммиака (25 мл). Слои разделялись и водный слой экстрагировался эфиром (2х50 мл). Объединенные эфирные экстракты не содержали какого-либо существенного количества желаемого продукта. Поэтому водная фаза с дополнительным количеством NaCl экстрагировалась этилацетатом (4х100 мл). Объединенные органические слои сушились (сульфатом натрия), фильтровались и выпаривались, давая желтое твердое вещество. Перекристаллизация из смеси этилацетат:гексан (35:65) давала белое твердое вещество, которое необходимо было далее очищать с помощью хроматографии на колонке (этилацетат:этанол, 1:1 + 1% конц. аммиак), давая 0,64 г (43%) целевого соединения в виде белого твердого вещества. Т.пл. 141,2-141,6°С; [a]21=-26,2 (с=3,0, МеОН). Пример 69. Хлоргидрат (R)-3-(N-гексил)амино-5-фенилхромана. К раствору (R)-3-амино-5-фенилхромана (1,00 г, 4,44 ммоля) в метаноле (25 мл), добавлялся при перемешивании гексанол (0,49 г, 0,60 мл, 4,91 ммоля). Смесь охлаждалась до 0°С и порциями добавлялся цианоборгидрид натрия (0,36 г, 5,78 ммоля). Величина рН доводилась до 5,5 с помощью уксусной кислоты. Реакционная смесь перемешивалась при комнатной температуре в течение 2,5 часов. Вследствие неполного превращения исходного материала добавлялось порциями еще 300 мкл (2,46 ммоля) гексаналя. Растворитель удалялся при пониженном давлении и остаток распределялся между эфиром (100 мл) и 1 М раствором аммиака (25 мл). Слои разделялись и эфирный экстракт промывался 1 М раствором аммиака (25 мл). Водная фаза удалялась, а эфирная фаза встряхивалась с 1 М раствором НСl (10 мл). Хлоргидратная соль кристаллизовалась непосредственно в разделительной воронке и отфильтровывалась и промывалась охлажденным льдом гексаном. После сушки получалось 0,86 г (56%) целевого соединения в виде белых кристаллов: т.пл. 171,6-174,2°С; [a ]21=+82,8 (с=1, МеОН). Пример 70. Хлоргидрат (R)-3-(N-метил-N-пропил)амино-5-фенилхромана. (R)-3-(N-пропил)амино-5-фенилхроман (0,46 г, 1,74 ммоля) растворялся в метаноле (15 мл). Добавлялся формальдегид (0,70 г, 8,70 ммоля) и реакционный сосуд охлаждался на ледяной бане. Порциями добавлялся цианоборгидрид натрия (0,58 г, 9,23 ммоля), который после этого доводился до рН 6 с помощью нескольких капель концентрированной уксусной кислоты. Реакционная смесь перемешивалась при комнатной температуре в течение 3 часов. Растворитель выпаривался, а остаток распределялся между эфиром (50 мл) и 1 М раствором аммиака (10 мл). Слои разделялись и водная фаза экстрагировалась эфиром (50 мл). Объединенные органические слои промывались 1 М раствором аммиака (10 мл), сушились (сульфатом магния), фильтровались и выпаривались. Остаток очищался с помощью колоночной хроматографии (элюент:гексан:этилацетат 70:30 + 0,1% конц. NН3), давая 0,40 г (81%) соответствующего основания - целевого соединения в виде неокрашенного масла, которое затвердевало после стояния: [a]21=-35,9 (с=1,0, МеОН). Превращение в хлоргидрат осуществлялось в смеси HCl/эфир, давая 0,4 г (общий выход: 75%) целевого соединения. Т.пл.162-164°С. Пример 71. Хлоргидрат (R)-3 [N-2-(2-тиенил)этил]амино-5-фенилхромана. К раствору (R)-3-амино-5-фенилхромана (0,41 г, 1,83 ммоля) в сухом ДМФ (2,0 мл) добавлялся карбонат калия (0,28 г, 2,02 ммоля) и 2-(2-тиенил)этилбромид (0,36 г, 1,80 ммоля). Реакционная смесь перемешивалась в атмосфере азота при 65°С в течение 6 часов. Растворитель удалялся в вакууме, а остаток распределялся между эфиром (50 мл) и 1 М раствором аммиака (10 мл). Слои разделялись и водная фаза насыщалась NaCl и экстрагировалась дополнительным количеством эфира (25 мл). Органические слои объединялись, сушились (сульфатом магния), фильтровались и концентрировались. Остаток очищался с помощью хроматографии на колонке (элюент: этилацетат:гексан 35:65+0,2% конц. NНз), давая 0,19 г (31%) соответствующего основания (целевого соединения) в виде светло-желтого масла: [a]21 = 8,2 (с=1,0, МеОН), превращение в хлоргидрат осуществляли в смеси HCl/эфир, давая 0,20 г (общий выход: 29% целевого соединения) т.пл. 191,6-193,2°С. Пример 72. 3-Дипропиламино- 8-фтор-5-трифторметансульфонилоксихроман. а) 2-фтор-5-метоксибензойная кислота. Целевое соединение приготавливалось согласно методу, описанному авторами Hay и Blanchard (Canad. J. Chem. 43, 1306 (1965)). В трехгорлой круглодонной колбе (1000 мл), оборудованной магнитной мешалкой, термометром, обратным холодильником и трубкой для газа, растворялся тетрагидрат ацетата кобальта (II) (12,6 г, 51 ммоль) в ледяной уксусной кислоте (404 мл) при перемешивании. Добавлялись промышленный 4-фтор-3-метиланизол (35,4 г, 252 ммоля) и 33% НВr в уксусной кислоте (10,1 мл, 51 ммоль) и затем смесь нагревалась на масляной бане до 90-95°С. Все время через раствор пропускался поток кислорода со скоростью примерно 660 мл/мин. Спустя 3 часа, реакционная смесь охлаждалась до комнатной температуры, а затем выпаривалась в роторных условиях досуха. Окрашенное в фиолетовый цвет твердое вещество, полученное таким образом, переносилось в колбу Эрлен-Мейера, растворялось в кипящей воде (350 мл), содержащей концентрированную соляную кислоту (5-10 мл), а затем оставлялось кристаллизоваться в холодном месте в течение ночи. Неочищенная кислота отфильтровывалась путем отсасывания, промывалась небольшими порциями ледяной воды до тех пор, пока промывная жидкость не становилась бледно-желтой, растворялась в 2 М гидроокиси натрия (120 мл) и промывалась толуолом (2х100 мл). Органические экстракты отбрасывались. Водная фаза фильтровалась отсосом, охлаждалась в химическом стакане на ледяной бане и осторожно подкислялась концентрированной соляной кислотой до тех пор, пока вся кислота не осаждалась. Содержимое химического стакана нагревалось до точки кипения, посредством чего наибольшая часть кислоты растворялась. Раствор охлаждался при комнатной температуре и наконец в холодильнике. Маточная жидкость отсасывалась. Кристаллическая масса промывалась ледяной водой (3х50 мл), а затем сушилась в вакуумной печи при 40°С, давая 31,5 г целевого соединения в виде серо-белого твердого вещества. Т.пл. 146-148°С. b) 2-Фтор-5-метоксибензамид. В трехгорлой круглодонной колбе (500 мл), снабженной магнитной мешалкой и обратным холодильником, нагревались в условиях дефлегмации в атмосфере азота в течение 2 часов 2-фтор-5-метоксибензойная кислота (33,8 г, 189 ммоля) и тионилхлорид (200 мл), избыток тионилхлорида выпаривался, оставляя маслянистый остаток, который растворялся в метиленхлориде (100 мл) и выпаривался. Данная процедура повторялась три раза. Неочищенный хлорангидрид кислоты, полученный таким образом, растворялся в метиленхлориде (100 мл) и добавлялся по каплям в течение 10 минут к холодному (-40:-50°С) и механически перемешиваемому раствору сухого ТГФ (300 мл) и жидкого аммиака (100 мл) в трехгорлой круглодонной колбе (1000 мл) в атмосфере азота. Когда добавление завершалось, охлаждающая баня удалялась и смесь медленно нагревалась до комнатной температуры, при этом перемешивание продолжа лось. Добавлялась вода (50 мл) для растворения выпавшей в осадок соли и полученный двухфазный раствор концентрировался досуха с помощью роторного испарения. Неочищенный амид промывался повторно небольшими порциями разбавленного водного аммиака, а затем водой до тех пор, пока промывные жидкости не были бесцветными. Сушка при пониженном давлении на протяжении ночи давала 32,0 г целевого соединения в виде светло-коричневых кристаллов. Т.пл. 122-124°С. c) 2-фтор-5-метоксианилин. В круглодонной колбе (500 мл), снабженной обратным холодильником и магнитной мешалкой, бром (11,4 мл, 223 ммоля) добавлялся по каплям к холодному (+4°С) и перемешиваемому раствору гидроокиси натрия (35,5 г, 887 ммолей) и воды (322 мл). Затем порциями добавлялся 2-фтор-5-метоксибензамид (31,9 г, 189 ммолей). Смесь нагревалась на масляной бане, нагревалась с обратным холодильником в течение 1 часа, охлаждалась до комнатной температуры и экстрагировалась простым эфиром (3х300 мл). Сушка объединенных эфирных фаз (карбонатом калия), фильтрование, выпаривание растворителя и вакуумная перегонка маслянистого остатка давала 20,1 г целевого соединения в виде бледно-желтого масла (т. кип. 113-114°С) 14 мм рт. ст.), которое затвердевало на холоде (т.пл. 27-28°С). d) 2-Фтор-5-метоксифенол. Способ, используемый для получения фенола, представляет собой в основном процедуру, описанную авторами Claudi и др. (Med. Chem. 33, 2408-2421 (1990) с видоизменением согласно методике Lambooy (J. Amer. Chem. Soc.72, 5327-5328 (1950)). В трехгорлой круглодонной колбе (1000 мл), снабженной капельной воронкой и магнитной мешалкой, смешивались 2-фторметоксианилин (11,3 г, 80 ммолей), концентрированная серная кислота и (35 мл) и вода (200 мл), а затем охлаждались до 3-5°С. К перемешиваемой смеси по каплям при температуре выше 2-4°С добавлялся раствор нитрита натрия (6,07 г, 88 ммолей) в воде (20 мл). Когда добавление завершалось, раствор перемешивался в течение пяти минут, а затем добавлялась мочевина (0,48 г) с последующим добавлением воды (100 мл). Между тем подготавливался аппарат, состоящий из трехгорлой круглодонной колбы (1000 мл), термометра, электрического нагревательного кожуха, устройства для паровой отгонки и длинного (40 см) водяного холодильника, наверху которого была присоединена капельная воронка (500 мл). В колбу помещались CuSO4x5H2O (56 г), концентрированная серная кислота (160 мл) и вода (160 мл). Смесь нагревалась до 150°С, по каплям из капельной воронки добавлялся раствор диазониевой соли, охлаждаемый все время путем добавления к ней мелких кусочков льда, и через систему пропускался поток пара для удаления фенола. Дистиллят экстрагировался эфиром (3х400 мл) и объединенные эфирные экстракты сушились (сульфатом магния), фильтровались и концентрировались в вакууме. Неочищенный фенол очищался на колонке из двуокиси кремния, элюируемой смесью эфир/н-гексан (15:85), давая 4,03 г целевого соединения в виде кристаллического твердого вещества. Т.пл. 25-26°С. е) 3-Циано-8-фтор-5-метокси-2-Н-хроман. Синтез названного в заголовке соединения основан на методе, описанном авторами Thorberg и др. в Acta Chem. Scand. 24, 169-182 (1987). Трихлоруксусная кислота (приблизительно 0,04 г) добавлялась к перемешиваемому раствору 2-фтор-5-метоксифенола (6,8 г, 48 ммолей) и этилвинилового эфира (9,1 мл, 95 ммолей) в атмосфере азота в круглодонной колбе (50 мл) при +4°С. Смесь перемешивалась при комнатной температуре на протяжении ночи. Избыток этилвинилового эфира подвергался роторному испарению, а остаток растворялся в эфире (100 мл). Эфирный раствор промывался насыщенным карбонатом натрия (2х5 мл), сушился (карбонатом калия), фильтровался и концентрировался в вакууме. Маслянистый остаток растворялся в сухом толуоле (100 мл), и раствор концентрировался сначала с использованием роторного испарителя, а затем вакуумного насоса (0,1 мм рт.ст.), давая 10,0 г защищенного фенола в виде желтого масла. В сухой трехгорлой круглодонной колбе (100 мл), снабженной магнитной мешалкой и каучуковой пробкой, 8,8 г (41 ммоль) защищенного фенола, полученного выше, растворялось в сухом ТГФ (30 мл) в атмосфере азота. Раствор охлаждался до -25°С на бане из сухого льда, затем в течение 15 минут к перемешиваемому раствору с помощью шприца по каплям добавлялся 1,6 М н-бутиллитий в гексане (32 мл, 51 ммоль). Когда добавление завершалось, смесь подогревалась до -15°С за 1 час, затем охлаждалась до 20°С. Сухой диметилформамид (4,7 мл, 60 ммолей) добавлялся по каплям в течение 5 минут при поддержании температуры при -25:-20°С (реакция экзотермическая). Когда добавление завершалось, раствор подогревался до -5°С на протяжении 2 часов, а затем выливался в охлажденную льдом 2 М соляную кислоту (200 мл). После перемешивания в течение 40 минут гидролиз завершался, как можно было видеть по данным ТСХ. Получающаяся смесь промывалась эфиром (3х250 мл). Объединенные эфирные фазы сушились (сульфатом магния), фильтровались и концентрировались в вакууме. Желтый твердый остаток растворялся в эфире (50 мл) и концентрировался, давая 7,12 г неочищенного 3-фтор-2-гидроки-6-метокси бензальдегида в виде желтого кристаллического твердого вещества. Неочищенный 3-фтор-гидрокси-6-метоксибензальдегид (8,0 г), полученный выше, акрилонитрил (13 мл, 193 ммоля) и 1,4-диазобицикло[2,2,2]октан (0,66 г, 5,9 ммоля) нагревались с обратным холодильником в трехгорлой круглодонной колбе (50 мл) в атмосфере азота в течение 4 часов. Роторное испарение летучих веществ оставляло густое красное масло, которое подвергалось флэш-хроматографии на колонке из двуокиси кремния, элюируемой смесью метиленхлорида и н-гексана (4:5). Концентрирование соответствующих фракций давало неочищенный продукт (91% ГХ), который кристаллизовался из этилацетата, давая 1,31 г целевого соединения в виде бесцветных палочек. Т. пл. 133–135оС. f) 8-фтор-5-метоксихроман-3-ил-карбоновая кислота 3-циано-8-фтор-5-метокси-2-Н-хроман (1,23 г, 6,0 ммолей) и 2 М раствор гидроокиси натрия (25 мл) нагревались с обратным холодильником в атмосфере азота в течение 7,5 часов, а затем перемешивался при комнатной температуре на протяжении ночи. К раствору добавлялся избыток концентрированной соляной кислоты при перемешивании. После охлаждения суспензии на ледяной бане осажденная карбоновая кислота отсасывалась насухо, переносилась в 250 мл колбу для гидрирования (Парра) и растворялась в ледяной уксусной кислоте (110 мл). Добавлялся палладий (5%) на активированном угле (0,104 г). Гидрирование в аппарате Парра при 1 атм. давлении водорода и 40–50оС (ИК-лампа) в течение 10 часов завершало реакцию. Суспензия фильтровалась через целит, и фильтрат концентрировался в вакууме. Остаток растворялся в толуоле (25 мл), и раствор концентрировался с помощью роторного испарения. Данная процедура повторялась один раз. Выпаривание с помощью вакуумного насоса (0,05 мм рт.ст.) давало 1,12 г целевого соединения в виде серо-белого твердого вещества. Т.пл. 140-145°С (разлож.). g) Бензиловый эфир 8-фтор-5-метоксихроман-3-ил-карбаминовой кислоты. 8-Фтор-5-метоксихроманил-3-ил-карбоновая кислота (1,12 г, 85 ммолей), дифенилфосфорилазид (1,3 мл, 5,9 ммоля) и толуол (10 мл) смешивались в трехгорлой круглодонной колбе (50 мл) в атмосфере азота. Добавлялся триэтиламин (0,83 мл, 5,9 ммоля) и прозрачный раствор перемешивался при 100°С в течение 2 часов. Добавлялся бензиловый спирт (0,61 мл, 5,9 ммоля) в виде одной порции и перемешивание продолжалось при 90°С в течение 17 часов. Летучие вещества выпаривались и остаток брался в толуол (25 мл). После промывки 10% уксусной кислотой (1х30 мл) и 2 М аммиаком (1х30 мл) раствор сушился (сульфатом магния), фильтровался и концентрировался в вакууме, давая коричневое масло. Флэш-хроматография неочищенного продукта на колонке из двуокиси кремния, элюируемой смесью этилацетата и толуола (3:97) давала соединение в виде масла (загрязненного 2%-ми непрореагировавшего изоцианата по данным ГХ). h) 3-Амино-8-фтор-5-метоксихроман. Бензиловый эфир 8-фтор-5-метоксихроман-3-ил-карбаминовой кислоты (1,37 г, 4,0 ммоля), абсолютный этанол (90 мл), ледяная уксусная кислота (10 мл) и 5% палладий на активированном угле (0,090 г) смешивались в 250 мл колбе гидрирования (Пар-ра). Гидрирование в аппарате Парра при давлении водорода 1 атм. и 45°С (ИК-лампа) на протяжении ночи завершало реакцию (потребление водорода 80 мл при 20°С). Суспензия фильтровалась через целит и фильтрат концентрировался с помощью роторного испарения. Остаток растворялся в толуоле (25 мл) и снова концентрировался. Данная процедура повторялась один раз. Выпаривание с помощью вакуумного насоса (0,05 мм рт. ст.) давало 1,20 г влажной кристаллической массы, состоящей главным образом (93% ГХ) из названного в заголовке соединения (в виде ацетата). i) 3-Дипропиламино-8-фтор-5-метоксихроман. В круглодонную колбу, снабженную магнитной мешалкой, помещались неочищенный ацетат 3-амино-8-фтор-5-метоксихромана (1,18 г, приблизительно 3,9 ммоля), полученный на предыдущей стадии, сухой метанол (10 мл), пропаналь (2,8 мл, 39 ммолей), ледяная уксусная кислота (рН 3-4) и боргидрид натрия (0,25 г, 3,9 ммоля), но без молекулярных сит. Реакционная смесь перемешивалась в атмосфере азота при комнатной температуре в течение 1 часа. Раствор фильтровался через Целит и растворитель выпаривался, оставляя жидкий остаток, который разбавлялся водой (25 мл) и экстрагировался эфиром (2х100 мл), после доведения рН до 10-11 с помощью 5 М гидроокиси натрия. Собранные эфирные фазы сушились (К2СО3), фильтровались и концентрировались в вакууме. Флэш-хроматография сырого вещества на двуокисно-кремниевой колонке, элюируемой этилацетатом (2% и 10%) в н-гексане давала 0,235 г целевого соединения в виде бесцветного масла. j) Хлоргидрат 3-дипропиламино-8-фтор-5-гидроксихромана. Хлоргидратная соль 3-дипропиламино-8-фтор-5-метоксихромана получалась с помощью добавления избытка хлоргидрата в эфире к перемешиваемому и охлажденному (+4°С) раствору основания (0,235 г, 0,84 ммоля) в эфире (10 мл), затем выделения осажденной соли и сушки ее в вакуумной печи при 50°. В трехгорлой круглодонной колбе (25 мл), снабженной магнитной мешалкой и каучуковой пробкой, полученная выше соль растворялась в метиленхлориде (7 мл) в атмосфере азота. Раствор охлаждался на бане из сухого льда до -40°С, затем медленно добавлялся трехбромистый бор (0,158 г, 1,7 ммоля) в метиленхлориде (1 мл) к перемешиваемому раствору с помощью шприца. Когда добавление завершалось (2 мин), температура раствора медленно поднималась до +4°С и поддерживалась на данном уровне с помощью ледяной бани. По истечении всего периода реакции из 7 часов раствор выливался в насыщенный бикарбонат натрия (20 мл). Смесь экстрагировалась эфиром (3х30 мл), и собранные эфирные фазы промывались насыщенным солевым раствором, сушились (сульфатом натрия), фильтровались и концентрировались в вакууме. Флэш-хроматография неочищенного продукта на колонке из двуокиси кремния, элюируемой смесью этилацетата и н-гексана (15:85) давала 0,195 г 3-дипропиламино-8-фтор-5-гидроксихромана в виде масла. Целевое соединение получалось с помощью осаждения основания избытком хлоргидрата в эфире и сушки полученной таким образом соли в вакуумной печи при 50°С в течение 5 часов. Выход 0,220 г (99% из основания), белое аморфное твердое вещество. Т.пл. 190-192°С. k) 3-Дипропиламино-8-фтор-5-трифторметансульфонилоксихроман. В сухой трехгорлой круглодонной колбе (25 мл), оборудованной магнитной мешалкой и каучуковой пробкой, 3-дипропиламино-8-фтор-5-гидроксихроман хлоргидрат (0,211 г, 0,70 ммоля), 2,4,6-коллидин (0,110 мл, 0,84 ммоля) и метиленхлорид (7,3 мл) смешивались в атмосфере азота. Светлый раствор охлаждался до -40°С на сухой ледяной бане, затем медленно (5 минут) к перемешиваемой смеси с помощью шприца добавлялся трифторметансульфоновый ангидрид (0,230 мл, 1,37 ммоля) в метиленхлориде (0,3 мл). Когда добавление заканчивалось, раствор перемешивался в течение 1 часа (температура увеличивалась до 0°С), затем выливался в холодный (+4°С) насыщенный бикарбонат натрия (20 мл) и экстрагировался эфиром (2х40 мл). Собранные эфирные фазы промывались водой (1х30 мл), сушились (сульфатом натрия), фильтровались и концентрировались в вакууме. Сырой продукт подвергался мгновенной хроматографии на колонке из двуокиси кремния, элюируемой смесью этилацетат/н-гексан (1:19), давая 0,213 г названного в заголовке соединения в виде масла. Пример 73. Хлоргидрат 3-дипропиламино-8-фтор-5-(2-фурил)хромана. В трехгорлой круглодонной колбе емкостью 25 мл, снабженной магнитной мешалкой и обратным холодильником, в атмосфере азота смешивались следующие реагенты: 3-дипропиламино-8-фтор-5-трифторметансульфонилхроман (0,104 г, 0,205 ммоля), абсолютный этанол (1,7 мл), толуол (3,6 мл), 2-фурилбороновая кислота (0,071 г, 0,64 ммоля), хлористый литий (0,022 г, 0,51 ммоля), 2 М карбонат натрия (0,7 мл) и тетракис(трифенилфосфин палладий(0) (0,0073 г). Смесь нагревалась на масляной бане до температуры дефлегмации (75-80°С). Спустя 3 часа ГХ-анализ показал частичную реакцию (20% продукта и 66% исходного материала). Поэтому добавлялись еще 2-фурилбороновая кислота (0,031 г, 0,28 ммоля), абсолютный этанол (0,2 мл) и тетракис(трифенилфосфин)палладия (0) (0,009 г). Смесь перемешивалась при 75-80°С на протяжении ночи, затем выливалась в 2 М аммиак (40 мл) и экстрагировалась эфиром (2х40 мл). Собранные эфирные фазы сушились сульфатом натрия, фильтровались и концентрировались в вакууме. Неочищенный продукт очищался с помощью флэш-хроматографии на колонке из двуокиси алюминия, элюируемой смесью этилацетата и н-гексана (2:98). Соответствующие фракции сливались и концентрировались, давая масло, состоящее из нечистого продукта (72% ГХ). Данный материал очищался с помощью еще одного цикла флэш-хроматографии на колонке из двуокиси кремния, элюируемой смесью этилацетата и метиленхлорида (1:99), давая 0,042 г (51% выход) 3-дипропиламино-8-фтор-5-(2-фурил)хромана в виде масла. Целевое соединение получалось из основания, как описано для хлоргидрата 3-дипропиламино-8-фтор-5-гидроксихромана выше. Белое кристаллическое твердое вещество. Т.пл. 162-164°С. Пример 74. Хлоргидрат 3-дипропиламино-8-фтор-5-N-изопропил-карбамоилхромана. В трехгорлой круглодонной колбе (25 мл), снабженной магнитной мешалкой и вводом для моноокиси углерода от бюретки для гидрирования, смешивались диоксан (1,3 мл), 3-дипропиламино-8-фтор-5-трифторметансульфонилхроман (пример 63 К) (0,110 г, 0,20 ммоля) и изопропиламин (0,118 мл, 1,4 ммоля). Колба вакуумировалась и заполнялась моноокисью углерода. Данная процедура повторялась дважды. Добавлялись 1,3-бис(дифенилфосфино)пропан (0,0032 г) и ацетат палладия(II) (0,0016 г), а затем смесь перемешивалась при 75°С в атмосфере моноокиси углерода при 1 атм. ГХ-анализ показал, что реакция оказалась неожиданно медленной. Перемешивание на протяжении ночи не улучшило выход желаемого продукта (59% ГХ), и все еще оставалось много трифлата (27% ГХ). Соответственно добавлялись еще 1,3бис(дифенилфосфино)пропан (0,0065 г) и ацетат палладия (0,0032 г). К сожалению, перемешивание на протяжении ночи не улучшило выход, а привело в результате к некоторому разложению продукта, о чем свидетельствовал ГХ. В данный момент реакционная смесь обрабатывалась путем добавления насыщенного бикарбоната натрия (5 мл) и экстрагирования смеси этилацетатом (2х10 мл). Объединенные органические фазы сушились (сульфатом натрия), фильтровались и концентрировались в вакууме. Сырой продукт подвергался флэш-хроматографии на колонке из двуокиси кремния, элюируемой этилацетатом (15 и 33%) в н-гексане, давая 0,021 г исходного материала (трифлата) и 0,030 г (40% выход в расчете на регенерированный трифлат) 3-дипропиламино-8-фтор-5-N-изопропилкарбамо-илхромана в виде масла. Целевое соединение получалось из основания, как описано для 3-дипропиламино-8-фтор-5-гидроксихроман хлоргидрата выше. Белое твердое вещество. Т.пл. (70 eV); m/z (отн. инт.), 337 (4,4, M+1), 336 (17, М), 308 (21), 307 (100), 236 (36), 194 (6), 177 (6), 43 (19). Пример 75. (R) -8-Фтор-3-(N-изопропил-N-пропиламино)-5-трифторметансульфонилхроман. (R)-8-фтор-3-(N-изопропил-N-пропиламино)-5-гидроксихроман (0,71 г, 2,66 ммоля) и коллидин (0,49 мл, 3,72 ммоля) растворялись в 25 мл метиленхлорида и охлаждались до -40°С. По каплям добавлялся трифторметансульфоновый ангидрид (0,54 мл, 3,2 ммоля) и смесь оставлялась подогреваться до температуры окружающей среды, и после достижения 0°С проходила реакция. Реакционная смесь разбавлялась метиленхлоридом и промывалась насыщенным бикарбонатом натрия, сушилась (сульфатом натрия), фильтровалась и выпаривалась в вакууме, давая сырое вещество. Хроматография на двуокиси кремния (элюент:метиленхлорид) давала 0,82 г (77% выход) целевого соединения в виде светлого масла. [a]21-81,5o (с=0,1, СНСl3). Пример 76. Хлоргидрат (R)-5-ацетил-8-фтор-3-(N-изопропил-N-пропиламино) хромана. (R)-8-фтор-3-(N-изопропил-N-пропиламино)-5-трифторметансульфонилхроман (403 мг, 1,01 ммоля) растворялся в 3 мл ДМФ, а затем добавлялись триэтиламин (0,28 мл, 2,02 ммоля), бутилвиниловый эфир (0,78 мл, 6,06 ммоля), ацетат палладия (7 мг) и 1,3-бис-дифенилфосфинопропан (14 мг). Получающаяся в результате смесь нагревалась до 80-90°С при перемешивании в течение 3,5 часов. Раствор охлаждался и добавлялось 5 мл 2 М НСl раствора и реакционная смесь перемешивалась при комнатной температуре в течение 1 часа. Смесь разбавлялась эфиром и промывалась 2 М раствором аммиака. Водная фаза повторно экстрагировалась эфиром, и объединенные эфирные фазы обрабатывались насыщенным солевым раствором, сушились (сульфатом магния), фильтровались и выпаривались в вакууме, давая коричнево-оранжевое масло в виде сырого вещества. Хроматография на двуокиси кремния (элюент: 15% этилацетат/гексан) давала 201 мг в виде желтого масла (68% выход), [a]21 -165,1 (с=0,1, СНСl3). HCl-соль осаждалась из эфира и перекристаллизовывалась из смеси этилацетат/эфир, давая белое твердое вещество. Т.пл. 148°С. Пример 77. Хлоргидрат (R)-5-фенил-8-фтор-3-(N-изопропил-N-пропиламино) хромана. К раствору (R)-8-фтор-3-(N-изопропил-N-пропиламино)-5-трифторметансульфонилхромана (0,58 г, 1,45 ммоля), этанола (7 мл), хлорида лития (124 мг, 2,9 ммоля), 2 М карбоната натрия (2,2 мл) и тетракис(трифенилфосфин)палладия(0) (31 мг, 0,026 ммоля), растворенного в толуоле (15 мл) добавлялась фенилбороновая кислота (0,22 г, 1,74 ммоля) в виде одной порции в атмосфере азота. Получающийся в результате раствор нагревался до 95°С в течение 5 часов, затем реакционная смесь оставлялась охлаждаться. Реакционная смесь фильтровалась, и растворитель выпаривался в вакууме. Остатки брались в эфир, промывались 2 М аммиаком, обрабатывались насыщенным солевым раствором и сушились (сульфатом магния). Удаление растворителя в вакууме давало неочищенное соединение. Хроматография на двуокиси кремния (элюент:метиленхлорид + метиленхлорид + аммиак) давала 0,42 г (89% выход) целевого соединения (основания) в виде масла, [a]21-45,0 (С=0,1, СНСl3). Хлоргидратная соль получалась путем растворения чистого основания в эфире и добавления по каплям избытка эфирного раствора НСl, давая белое твердое вещество. Т.пл. 202-203°С. Пример 78. Хлоргидрат (R)-5-[карбонил(2,6-диметилфенил)]-8-фтор-3-(N,N-дипропиламино)хромана. 2-Бром-м-ксилол (0,5 мл, 3,6 ммоля) растворялся в 4 мл безводного ТГФ в атмосфере азота и охлаждался до -78°С. Добавлялся по каплям н-бутиллитий (1,6 М в гексане, 2,0 мл, 3,2 ммоля) и реакционная смесь оставлялась перемешиваться при -78°С в течение 1 часа. (R) -8-фтор-5-формил-3-(N,N-дипропиламино)хроман (0,30 г, 1,07 ммоля) растворялся в 5 мл безводного ТГФ и добавлялся по каплям к реакционной смеси, а затем она оставлялась перемешиваться при -78°С в течение 1 часа. Реакционная смесь гасилась добавлением 2 мл воды и оставлялась подогреваться до комнатной температуры. Растворитель удалялся в вакууме, остатки брались в 2 М раствор аммиака, а затем экстрагировались трижды эфиром. Объединенные эфирные порции обрабатывались насыщенным солевым раствором, сушились (сульфатом магния), фильтровались и растворитель удалялся в вакууме, давая неочищенный спирт в виде белого твердого вещества. Неочищенное твердое вещество на протяжении ночи подвергалось мягкому продуванию струeй азота для удаления избытка 2-бром-м-ксилола. Неочищенный спирт окислялся непосредственно на следующей стадии реакции без дальнейшей очистки. Оксалилхлорид (122 мкл, 1,4 ммоля) растворялся в 5 мл безводного метиленхлорида в атмосфере азота и охлаждался до -78°С. На протяжении 5 минут добавлялся ДМСО (0,24 мл, 3,4 ммоля), затем реакционная смесь оставлялась перемешиваться при -78°С в течение 5 минут. Неочищенный спирт (из предыдущей стадии) растворялся в 10 мл безводного метиленхлорида и добавлялся на протяжении 10 минут к реакционной смеси. После перемешивания при -78°С в течение 25 минут, добавлялся триэтиламин (0,75 мл, 5,4 ммоля) и, спустя 5 минут, реакционная смесь оставлялась подогреваться до комнатной температуры. К реакционной смеси добавлялся 2 М раствор аммиака в воде и смесь экстрагировалась трижды метиленхлоридом. Объединенные метиленхлоридные фазы сушились (сульфатом магния), фильтровались и растворитель удалялся в вакууме, давая неочищенный кетон. Хроматография на двуокиси кремния (элюент: 8,7% этилацетат/гексан) давала 345 мг (84% выход) целевого соединения в виде слегка желтого масла, [a]21 -57,0 (С=0,1, СНСl3). Масс-спектр (70 eV) m/z (относительная интенсивность) 383 (56М+), 354 (100), 283 (26), 355 (36). Хлоргидратная соль приготавливалась путем растворения чистого основания в эфире и добавления по каплям избытка эфирного НСl. Соль сушилась в вакуумной печи при 50°С, давая белое твердое вещество в виде полугидрата, который спекается при 80°С. Пример 79. Хлоргидрат (R)-8-фтор-3-(N-изопропил-N-н-пропиламино)-5-(5-оксазолил)хромана. (R)-8-фтор-5-формил-3-(N-изопропил-N-н-пропиламино)хроман (0,48 г, 1,7 ммоля), тозилметилизоцианид (0,37 г, 1,9 ммоля) и карбонат калия (0,28 г, 2,0 ммоля) суспендировались в метаноле (50 мл, высушенный ЗÅ) в атмосфере азота. Реакционная смесь нагревалась с обратным холодильником в течение 1 часа. Добавлялись диэтиловый эфир и 2 М аммиак. Слои разделялись и водная фаза экстрагировалась дважды диэтиловым эфиром. Органические слои объединялись и сушились (сульфатом натрия). Растворитель удалялся в вакууме, давая бесцветный маслянистый остаток, который очищался с помощью флэшхроматографии (двуокись кремния, метиленхлорид/этилацетат, 10:1), давая целевое соединение с выходом 60% (320 мг). [a]22D-55 (с 5 мг/мл, МеОН). Масс-спектр (70 eV) m/z (относительная интенсивность) 318 (14, М+), 303 (20), 290 (12), 289 (81), 191 (11), 149 (12), 112 (17), 85 (23), 70 (20), 56 (20), 44 (16), 43 (100), 42 (24), 41 (58), 30 (11). HCl-соль осаждалась из диэтилового эфира и спекается она при температуре от 80°С. Пример 80. (R)-8-фтор-5-метоксикарбонил-3-(N,N-ди-н-пропиламино)хроман. (R)-8-фтор-3-(N,N-ди-н-пропиламино)-5-три-фторметансульфонилоксихроман (0,95 г, 2,4 ммоля), триэтиламин (0,53 г, 5,2 ммоля), 1,3-бис(дифенилфосфино)пропан (100 мг, каталитическое количество), ацетат палладия(II) (50 мг, каталитическое количество) и ДМФ/МеОН (18 мл, 6:2) смешивались в 50 мл трехгорлой круглодонной колбе. Колба вакуумировалась с последующим вводом СО (повторялось три раза). Реакционная смесь перемешивалась при 70°С в течение 7 часов. Растворитель удалялся в вакууме и остаток растворялся в диэтиловом эфире/2 М аммиака. Слои разделялись, и водная фаза экстрагировалась один раз эфиром. Объединенные эфирные слои сушились (сульфатом магния) и растворитель удалялся в вакууме, давая коричневый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 20:1), давая 650 мг целевого соединения в виде светлого масла (87% выход). [a]21D92 (с 10 мг/мл, МеОН). Масс-спектр (70 eV) m/z (относительная интенсивность) 309 (20, М+), 281 (18), 280 (100), 56 (10), 43 (22), 42 (12), 41 (16). Пример 81. (R)-8-фтор-5-формил-3-(N,N-ди-н-пропиламино)хроман. (R)-8-фтор-5-метоксикарбонил-3-(N,N-ди-н-пропиламино)-хроман (0,65 г, 2,1 ммоля) растворялся в ТГФ (30 мл, высушенный натрием) в атмосфере азота. Раствор охлаждался до -78°С, затем на протяжении 10 минут добавлялся диизобутилалюминийгидрид (DIBAL-H, 1,0 М, 8,4 мл, 8,4 ммоля). Охлаждающая баня удалялась и температуре реакционной смеси давали возможность медленно подниматься до комнатной (20°С). Реакционная смесь перемешивалась в течение 3 часов перед тем, как реакционная смесь гасилась добавлением 2 М гидроокиси натрия (2 мл). Добавлялись насыщенный тартрат натрия и диэтиловый эфир и смесь перемешивалась до тех пор, пока "гель" не растворялся. Слои разделялись и водная фаза экстрагировалась дважды эфиром. Объединенные органические слои сушились (сульфатом магния) и растворитель удалялся в вакууме, давая спирт. Оксалилхлорид (0,30 г, 2,3 ммоля) растворялся в метиленхлориде в атмосфере азота. Раствор охлаждался до -78°С, затем к нему по каплям на протяжении 5 минут добавлялся ДМСО (0,4 г, 5,0 ммолей). После перемешивания в течение 5 минут добавлялся спирт, растворенный в метиленхлориде, на протяжении 30 минутного периода. Реакционная смесь перемешивалась в течение 30 минут, затем на протяжении 5-минутного периода добавлялся триэтиламин (1,1 г, 10,5 ммолей). Спустя 30 минут, охлаждающая баня удалялась и реакционная смесь медленно подогревалась до комнатной температуры, а затем перемешивалась в течение дополнительных 30 минут перед тем, как добавлялся бикарбонат натрия. Слои разделялись и водная фаза экстрагировалась дважды эфиром. Объединенные органические слои сушились (сульфатом магния). и растворитель удалялся в вакууме, давая маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 20:1), давая 350 мг целевого соединения (60% выход), [a]21D-86 (с 10 мг/мл, МеОН). Масс-спектр (70 eV) m/z (относительная интенсивность) 279 (5, М+), 250 (56), 179 (48), 151 (13), 149 (10), 123 (31), 103 (28), 98 (24), 77 (11), 72 (26), 70 (44), 57 (15), 56 (54), 55 (18), 54 (16), 44 (11), 43 (100), 42 (64), 41 (79). Пример 82. Хлоргидрат (R)-5-[Карбонил-(3,5-диметили-зоксазол)]-8-фтор-3-(N,N-ди-н-пропиламино)хромана. 4-бром-3,5-диметилизоксазол (1,9 г, 10,7 ммолей) растворялся в ТГФ (20, мл, высушенном натрием) в атмосфере азота. Раствор охлаждался до -90°С перед тем, как на протяжении 10 минут добавлялся н-бутиллитий (1,6 М в гексане, 9,7 мл, 9,7 ммоля). Реакционная смесь перемешивалась в течение 15 минут, затем на протяжении 10 минут добавлялся (R)-8-фтор-5-формил-3-(N,N-ди-н-пропиламино)хроман (0,6 г, 2,2 ммоля), растворенный в ТГФ (10 мл). Реакционная смесь перемешивалась при -90°С в течение дополнительных 20 минут, а затем при -78°С в течение 15 минут перед тем, как она гасилась добавлением хлористого аммония. Добавлялись диэтиловый эфир и 2 М аммиак. Слои разделялись и водная фаза экстрагировалась один раз эфиром. Объединенные органические слои сушились (сульфатом натрия). Растворитель удалялся в вакууме, давая желтый маслянистый остаток, который продувался на протяжении ночи струeй азота. Оксалилхлорид (0,28 г, 2,2 ммоля) растворялся в метиленхлориде в атмосфере азота. Раствор охлаждался до -78°С. По каплям на протяжении 5-минутного периода добавлялся ДМСО (0,38 г, 4,8 ммоля). Реакционная смесь перемешивалась в течение 20 минут, затем в течение 15 минут добавлялся неочищенный спирт, растворенный в метиленхлориде. Реакционная смесь перемешивалась в течение 30 минут. Добавлялся триэтиламин (1,01 г, 10 ммолей). Перемешивание продолжалось в течение 1 часа, охлаждающая баня удалялась и реакционная смесь оставлялась подогреваться до комнатной температуры (21°С). Добавлялись диэтиловый эфир и бикарбонат натрия. Слои разделялись и водная фаза экстрагировалась один раз эфиром, объединенные органические слои сушились (сульфатом натрия) и растворитель удалялся в вакууме, давая желтый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/гексан/этилацетат, 10:10:1), давая 340 мг целевого соединения (выход 42%). Масс-спектр (70 EV) m/z (относительная интенсивность) 374 (11, М+), 346 (21), 345 (100), 274 (15), 43 (11). HCl-соль осаждалась из диэтилового эфира при 0°С, а затем перекристаллизовывалась из смеси метиленхлорид/диэтиловый эфир. Т.пл. 202-205°С. Пример 83. Хлоргидрат (R)-5-N-морфолинил-3-(N-изопропил-N-н-пропиламино) хромана. Дигликолевая кислота (0,15 г, 1,1 ммоля) и N,N-карбонилдиимидазол (CDI, 0,28 г, 1,8 ммоля) растворялись в ТГФ (высушенном над натрием) в атмосфере азота. Смесь нагревалась с обратным холодильником в течение 15 минут и добавлялся (R)-5-амино-3-(N-изопропил-N-н-пропиламино)хроман (NAE 277) (0,2 г, 0,8 ммоля). Нагревание с обратным холодильником продолжалось в течение 18 часов. Реакционная смесь затем объединялась с аналогичной реакционной смесью от идентичной реакции (исходящей из 0,1 г анилина). Добавлялись диэтиловый эфир и 2 М аммиак. Слои разделялись, и водная фаза экстрагировалась один раз эфиром. Объединенные органические слои сушились (сульфатом натрия) и растворитель удалялся в вакууме, давая маслянистый остаток. Остаток растворялся в диэтиловом эфире в атмосфере азота. Добавлялся литийалюминийгидрид (0,23 г, 6 ммолей) и смесь нагревалась с обратным холодильником в течение 18 часов. При энергичном перемешивании добавлялась вода (0,3 мл) с последующим добавлением 0,3 мл 15% гидроокиси натрия и, наконец, 1 мл воды. Раствор декантировался с белого твердого остатка и остаток промывался дважды эфиром. Органические слои объединялись и растворитель удалялся в вакууме, давая неочищенный остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 5:1, содержащая также 0,5% аммиака), давая 180 мг целевого соединения (47% выход). [a]21D-39 (с 5 мг/мл, МеОН). Масс-спектр (70 eV) m/z (относительная интенсивность) 318 (8, М+), 133 (14), 130 (13), 117 (10), 114 (32), 112 (45), 85 (28), 43 (100), 42 (27), 41 (44), 39 (23). HCl-соль осаждалась из диэтилового эфира и перекристаллизовывалась из смеси этилацетат/диэтиловый эфир. Кристаллы спекаются при 70°С. Пример 84. (R)-5-Карбамоил-2-аминохроман. a) (R)-5-карбамоил-2-N-трифторацетиламинохроман. (R)-2-N-Трифторацетиламино-5-трифторметансульфонилоксихроман (2,0 г, 5,0 ммолей) растворялся в ДМФ (20 мл) в трехгорлой круглодонной колбе. Колба вакуумировалась с последующим вводом СО-газа (повторялось три раза). Добавлялись 1,3-бис(дифенилфосфино)пропан (0,2 г, каталитическое количество), ацетат палладия(II) (0,1 г, каталитическое количество) и диоксан, насыщенный аммиаком (20 мл), а затем реакционная смесь перемешивалась при 70°С в течение 8 часов. Растворитель удалялся в вакууме. Остаток растворялся в смеси диэтиловый эфир/аммиак (2 М). Слои разделялись и водная фаза экстрагировалась два раза диэтиловым эфиром. Объединенные органические слои сушились (сульфатом магния). Растворитель удалялся в вакууме, давая оранжевый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокиси кремния, метиленхлорид:этилацетат, 4:1 (+0,5% аммиака)), давая целевое соединение с выходом 21% (0,30 г). Т.пл.178-180°С. Масс-спектр (70 eV) m/z (относительная интенсивность) 288 (%. М+), 176 (11), 175 (100), 174 (22), 158 (13), 131 (25), 130 (42), 51 (19), 44 (16). b) (R)-5-карбамоил-2-аминохроман. (R)-5-карбамоил-2-N-трифторацетиламинохроман (0,30 г, 1,04 ммоля) растворялся в метиленхлориде (50 мл). Добавлялся гидроксид натрия (5 мл 15% раствора в воде), и смесь перемешивалась в течение 4 часов. Слои разделялись и водная фаза экстрагировалась метиленхлоридом четыре раза. Органические слои объединялись и растворитель удалялся в вакууме, давая твердый остаток, который суспендировался в диэтиловом эфире (300 мл) и фильтровался. Эфир удалялся в вакууме, давая целевое соединение с выходом 90% (180 мг) . Т.пл. 194-196°С. [a]21D-36 (МеОН, с 10 мг/мл). Масс-спектр (70 eV) m/z (относительная интенсивность) 192 (1, М+), 176 (26), 175 (100), 160 (13), 130 (14), 51 (22), 44 (13), 43 (83), 42 (15). Пример 85. (R)-2-N,N-Дибензиламино-5-метоксикарбонилхроман. a) (R)-2-N,N-дибензиламино-5-метокси-хроман. (R)-5-метокси-2-аминохроман (2,6 г, 14 ммолей), карбонат калия (7,0 г, 51 ммоль) , бензилбромид (6,0 г, 35 ммолей) и каталитическое количество йодистого калия смешивались в ацетонитриле (100 мл) в атмосфере азота. Реакционная смесь перемешивалась при 85°С в течение примерно 72 часов. Растворитель удалялся в вакууме и остаток растворялся в смеси диэтилового эфира и аммиака (2 М). Слои разделялись, и водная фаза экстрагировалась дважды диэтиловым эфиром. Эфирные слои объединялись и сушились (сульфатом магния). Растворитель удалялся в вакууме, давая желтый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид), давая целевое соединение с выходом 64% (3,2 г). НСl соль осаждалась из диэтилового эфира при 0°С, а затем перекристаллизовывалась из смеси этанол/диэтиловый эфир. Кристаллы являются гигроскопичными и начинают плавиться очень медленно, начиная со 100°С и плавятся наконец между 118 и 120°С. [ a]21D-20o (с 33 мг/мл, НСl соль в МеОН). Масс-спектр (70 eV) m/z (относительная интенсивность) 360 (19), 359 (91, М+), 268 (16), 223 (11), 210 (15), 132 (72), 91 (100). b) (R)-2-N,N-Дибензиламино-5-гидрокси-хроман. Хлоргидрат (R)-2-N,N-дибензиламино-5-метоксихромана (1,6 г, 4,0 ммоля) растворялся в метиленхлориде (40 мл) в атмосфере азота. Раствор затем охлаждался до -70°С. Добавлялся по каплям на протяжении 5 минутного периода трехбромистый бор, растворенный в метиленхлориде (25 мл). Реакционная смесь затем подогревалась медленно до 0°С и перемешивалась при этой температуре на протяжении ночи. Реакционная смесь медленно выливалась в перемешиваемый насыщенный раствор бикарбоната натрия. Слои разделялись и водная фаза экстрагировалась три раза метиленхлоридом. Органические слои объединялись и сушились (сульфатом магния). Растворитель удалялся в вакууме, давая коричневатый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид), давая целевое соединение с выходом 98% (135 мг). [ a]21D-94 (с 10 мг/мл, МеОН). Масс-спектр (70 eV) m/z (относительная интенсивность) 346 (26), 345 (100), 132 (13), 91 (11). c) (R)-2-N,N-Дибензил-5-трифторметансульфонилоксихроман. (R)-2-N,N-Дибензиламино-5-гидроксихроман (1,5 г, 4,3 ммоля) и коллидин (0,6 г, 5,2 ммоля) растворялись в метиленхлориде (30 мл) в атмосфере азота. Раствор охлаждался до -70°С и в течение 10 минутного периода по каплям добавлялся трифторметансульфоновый ангидрид (1,3 г, 4,7 ммоля), растворенный в метиленхлориде (20 мл). Охлаждающая баня удалялась и реакционная смесь медленно подогревалась до комнатной температуры (21°С). Реакционная смесь промывалась аммиаком (2 М) и сушилась (сульфатом магния). Растворитель удалялся в вакууме, давая оранжевый твердый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид), давая целевое соединение с выходом 90% (1,85 г). [ a]21D-83 (с 20 мг/мл, МеОН). Масс-спектр (70 eV) m/z (относительная интенсивность) 477 (16, М+), 345 (25), 344 (100), 132 (31), 91 (78). d) (R)-2-N,N-Дибензиламино-5-метоксикарбонилхроман. (R)-2-N,N-Дибензиламино-5-трифторметансульфонилоксихроман (1,8 г, 3,8 ммоля) и триэтиламин (0,8 г, 8,3 ммоля) растворялись в растворе ДМФ/МеОН (20 мл, 6:2) в трехгорлой круглодонной колбе. Колба откачивалась с последующим вводом СО газа (повторялось три раза). Добавлялись ацетат палладия(II) (28 мг, каталитическое количество) и 1,3-бис(дифенилфосфи-но)пропан (60 мг, каталитическое количество) и реакционная смесь перемешивалась при 75°С в течение 6 часов. Растворитель удалялся в вакууме, давая коричневатый маслянистый остаток. Масло растворялось в смеси диэтиловый эфир/аммиак (2 М). Слои разделялись и водная фаза экстрагировалась один раз диэтиловым эфиром. Объединенные эфирные слои сушились (сульфатом магния). Растворитель удалялся в вакууме, давая коричневый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/гексан, 1:1), давая целевое соединение с выходом 95% (1,4 г), [a ]21D-147o (с 5 мг/мл, МеОН). Масс-спектр (70 eV) m/z (относительная интенсивность) 388 (25), 387 (100, М+), 297 (10), 296 (62), 264 (27), 132 (40), 91 (79). Пример 86. (R)-5-Карбамоил-2-N,N-бензилхроман. (R)-2-N,N-Дибензиламино-5-метоксикарбонилхроман (1,4 г, 3,6 ммоля) растворялся в метаноле (20 мл). Добавлялся раствор гидроокиси натрия (0,16 г, 4,0 ммоля) в воде (6 мл) и реакционная смесь нагревалась с обратным холодильником на протяжении ночи. Растворитель удалялся в вакууме. Добавлялся толуол и растворитель удалялся снова (повторялось дважды для того, чтобы удалить воду). Остаток растворялся в SOCl2 (6 мл) и нагревался с обратным холодильником в течение 1 часа. Растворитель удалялся в вакууме. Остаток растворялся в метиленхлориде (20 мл и через раствор продувался аммиак-газ в течение 2 минут. Реакционная смесь перемешивалась при комнатной температуре в течение 1 часа перед промывкой (2 М аммиаком) и сушилась (сульфатом магния). Растворитель удалялся в вакууме, давая неочищенный коричневатый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 5:1 (+0,5% аммиака)), давая целевое соединение с выходом 41% (0,55 г). [a ]21D-129 (с 10 мг/мл, МеОН) . Масс-спектр (70 eV) m/z (относительная интенсивность) 372 (2, М+), 281 (43), 264 (27), 132 (19), 106 (12), 105 (18), 91 (100), 77 (12), 65 (25), 32 (22). Пример 87. (R)-5-[1-метил-(5-имидазолил)]-3-(N-изопропил-N-н-пропиламино)хроман. (R)-5-Формил-3-(N-изопропил-N-н-пропиламинол)хроман (0,4 г, 1,5 ммоля) растворялся в метаноле (15 мл), насыщенным метиламином. Добавлялось некоторое количество молекулярных сит (ЗА). Растворитель удалялся в вакууме. Остаток растворялсяв метаноле (30 мл) в атмосфере азота. Добавлялись тозилметилизоцианид (0,36 г, 1,8 ммоля) и карбонат калия (0,25 г, 1,8 ммоля) и реакционная смесь нагревалась с обратным холодильником в течение 1 часа. Добавлялись дополнительно тозилметилизоцианид (0,36 г, 1,8 ммоля) и карбонат калия (0,25 г, 1,8 ммоля) и нагревание с обратным холодильником продолжалось в течение 3 часов. Добавлялся еще раз тозилметилизоцианид (0,1 г, 5,2 ммоля) и нагревание с обратным холодильником продолжалось в течение 12 часов. Растворитель удалялся в вакууме. Остаток растворялся в смеси диэтиловый эфир/2 М аммиак. Слои разделялись и водная фаза экстрагировалась еще раз эфиром. Органические слои объединялись и сушились (сульфатом натрия). Растворитель удалялся в вакууме, давая коричневый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, сначала метиленхлорид/ацетат, 5:1, содержащая также 0,5% аммиака, а затем этилацетат/этанол, 50:1 + 0,5% аммиака), давая 200 мг целевого соединения (42% выход). [a]21D-37 (с 30 мг/мл, МеОН). HCl-соль осаждалась из диэтило-вого эфира при 0°С и перекристаллизовывалась из смеси этанол/диэтиловый эфир. Т.пл. 159-161°С (разлож.). Пример 88. а) (R)-3-(N-изопропил-N-н-пропиламино)-5-метоксикарбонилхроман. (R)-3(N-изопропил-N-н-пропиламино)-5-трифторметилсульфонилоксихроман (4,0 г, 10,5 ммолей), триэтиламин (2,3 г, 23,1 ммоля) и смесь ДМФ/метанол (18 мл, 6:2) смешивались в трех-горлой круглодонной колбе. Колба откачивалась с последующим вводом газа СО (повторялось два раза). Наконец добавлялся 1,3-бис(дифенилфосфино)пропан (0,11 г, каталитическое количество) и ацетат палладия(II) (0,07 г, каталитическое количество) и смесь перемешивалась при 70°С в течение 17 часов. Реакционная смесь разбавлялась диэтиловым эфиром, промывалась 2 М аммиаком и сушилась (сульфатом магния). Удаление растворителя в вакууме давало коричневый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 10:1), давая целевое соединение с выходом 82% (2,5 г). [a]=-131,6° (МеОН, 0,1 М, 21°С). Анализ для C17H25O3N: Вычислено: С 70,1, Н 8,6, N 4,8. Найдено: С 70,2, Н 8,6, N 5,1. 13 С ЯМР (CDCl3) 300 МГц, d167,6, 155,0, 130,5, 126,5, 124,2, 123,0, 120,6, 69,1, 51,8, 50,6, 48,8, 47,6, 29,3, 24,3, 21,0, 19,9, 11,5. Масс-спектр (70 eV) (относительная интенсивность) 291 (48, М+), 276 (34), 262 (100), 191 (18), 188 (27), 70 (15), 56 (23), 43 (24). HCl-соль осаждалась из диэтилового эфира при 0°С, а затем перекристаллизовывалась из смеси этанол/диэтиловый эфир. Т.пл. 125,5-127,4°С. Анализ для С17Н26O3NCl: Вычислено: С 62,3, Н 8,0, N 4,3. Найдено: С 62,5, Н 7,9, N 4,4. b) (R)-3-(N-изопропил-N-н-пропиламино)-5-(N-изопропил) карбамоилхроман. (R)-3-(N-изопропил-N-н-пропиламино)-5-метоксикарбонилхроман (0,46 г, 1,6 ммоля), растворенный в метаноле (10 мл), смешивался с раствором гидроокиси натрия (0,06 г, 1,6 ммоля) в воде (3 мл). Реакционная смесь затем нагревалась с обратным холодильником 3,5 часа, а затем растворитель удалялся в вакууме. Остаток растворялся в толуоле. Толуол удалялся в вакууме (повторялось два раза) для того, чтобы образовать азео-троп для удаления воды, карбоновая кислота затем растворялась в сульфонилхлориде (5 мл) и нагревалась с обратным холодильником в течение 1 часа. Избыток SOCl2 удалялся в вакууме. Хлорангидрид кислоты затем растворялся в метиленхлориде (20 мл, высушенном молекулярными ситами 3Å) и затем добавлялось 4 мл изопропиламина. Реакционная смесь перемешивалась в течение 1 часа при комнатной температуре (21°С), разбавлялась диэтиловым эфиром, промывалась (2 М аммиак) и сушилась (сульфатом магния). Удаление растворителя в вакууме давало желтый маслянистый остаток, который очищался с помощью флэш-хроматографии (двуокись кремния, метиленхлорид/этилацетат, 5:2), давая чистое целевое соединение с выходом 88% (0,46 г). [a]= -90,4° (МеОН, 0,1 М, 21°С) . Т.пл.=92,5-94°. Таблица 1 Действие различных аминохроманов на связывание in vitro (3H)-8-OH-DPAT с гомогенатами из коры головного мозга крыс – величины Кi в нМ. R3 R1 R2 R4 СОСН3 СОСН3 СОСН3 СО-О-СН3 СONH2 СONH2 СONH2 СONH2 СONH2 СONH2 СONH2 CONHCH3 CONHC2H5 CONH-изо-C3H7 CONH-изо-C3H7 CONH-изо-C3H7 фенил 3-тиенил 2-фуран 3-изоксазол н-пропил изо-пропил изо-пропил изо-пропил н-пропил изо-пропил изо-пропил втор-бутил изо-пропил втор-бутил н-пропил н-пропил изо-пропил изо-пропил изо-пропил аллил н-пропил изо-пропил изо-пропил изо-пропил н-пропил н-пропил н-пропил н-пропил н-пропил н-пропил н-пропил втор-бутил втор-бутил втор-пентил втор-пентил н-пропил н-пропил н-пропил н-пропил изо-пропил н-пропил н-пропил н-пропил н-пропил Н Н Н Н Н Н F F F F F H H H H H H H H H Ki (нМ) 1,0 1,6 0,3 (R) 0,32 (R) 3,1 1,7 (R) 5,45 (R) 0,6 (R) 1,75 (R) 1,52 (R) 1,5 (R) 3,3 12 24,5 4,5 (R) 0,32 (R) 1,63 (R) 3 (R) 3 (R) 0,15 (R) (R) означает, что соединение испытывали как (R)-этантиомер, в остальных случаях испытывали рацемат. Таблица 2 Изучение биодоступности на собаках АМИНОХРОМАНЫ R3 R1 R2 R4 биодоступность, % CONH2 CONHCH3 CONH-изо-Pr Фенил Pr Pr Pr Pr Pr Pr изо -Pr изо -Pr H H H 8-F 5–15 11–12 16–27 14–21 Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03
ДивитисяДодаткова інформація
Назва патенту англійськоюChroman derivatives active relative to 5-ht receptors, processes for their preparation and intermediates
Автори англійськоюLarsson Lars Gunnar, Noreen Rolf, Renyi Luc Anna, Ross Suante Bertil, Sohn Daniel Dougan, Svensson Bjorn Eric, Thorberg Seth Olov
Назва патенту російськоюПроизводные хромана, активные по отношению к 5-нт рецептору, способ их получения и промежуточные соединения
Автори російськоюЛарссон Ларс-Гюннар, Норен Рольф, Рени Люси Анна, Росс Сванте Бертил, Сонн Даниэль Дунган, Свенссон Бьорн Ерик, Торберг Сет Олов
МПК / Мітки
МПК: A61K 31/40, C07D 407/04, C07D 409/06, C07D 409/12, A61P 25/00, C07D 417/12, C07D 405/12, A61K 31/382, C07D 311/58, A61P 25/28, A61K 31/35, A61K 31/4025, A61K 31/352, C07D 405/04, C07D 413/06, C07D 413/04, A61P 25/26, A61P 25/20, A61K 31/38, A61P 25/24, C07D 335/00, C07D 409/04
Мітки: рецептора, спосіб, одержання, сполуки, 5-нт, проміжні, хроману, похідні, стосовно, активні
Код посилання
<a href="https://ua.patents.su/30-34416-pokhidni-khromanu-aktivni-stosovno-5-nt-receptora-sposib-kh-oderzhannya-ta-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Похідні хроману, активні стосовно 5-нт рецептора, спосіб їх одержання та проміжні сполуки</a>