Похідні бензімідазолу, як інгібітори ангіотензину іі, їх фармацевтично придатні солі, стабільний кристал та композиція на їх основі
Формула / Реферат
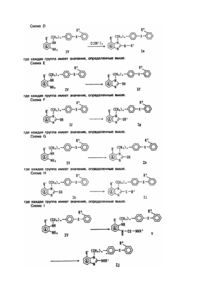
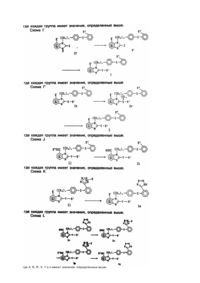
1. Производные бензимидазола общей формулы l
где A является бензольным кольцом, которое, необязательно, в дополнение к R1 группе может содержать заместитель, выбранный из галогена, низшего алкила, необязательно замещенного галоидом, алкоксигруппы или аминогруппы, замещенной алкилом;
R1 представляет алкил необязательно замещенный галоидом или алкенил;
R2 является тетразолилом или карбоксилом;
R' является карбоксилом или его сложным эфиром;
Y является -O-, -S(O)m- или -N(R4)-, где m равно 0 - 2 и R4 является водородом или необязательно замещенным алкилом;
и их фармацевтически приемлемые соли, в качестве антагонистов ангиотензина ll.
2. Стабильный кристалл 1-(циклогексилоксикарбонилокси)-этил-2-этокси-1-((2'(1Н-тетразол-5-ил)-бифенил-4-ил)-метил)бензимидазол-7-карбоксилата, который имеет следующие параметры решетки:
3,5 ангстрема, средний,
3,7 ангстрема, слабый,
3,8 ангстрема, средний,
4,0 ангстрема, средний,
4,1 ангстрема, слабый,
4,3 ангстрема, слабый,
4,4 ангстрема, средний,
4,6 ангстрема, средний,
4,8 ангстрема, средний,
5,1 ангстрема, средний,
5,2 ангстрема слабый,
6,9 ангстрема, слабый,
7,8 ангстрема, слабый,
8,8 ангстрема, средний,
9,0 ангстрема, средний,
15,9 ангстрема, слабый,
и имеет следующие 2q, d-расстояния и величины i/i0:
3. Композиция для ингибирования ангиотензина ll, включающая активный ингредиент в сочетании с носителем, эксципиентом или разбавителем, отличающаяся тем, что в качестве активного ингредиента она содержит соединение общей формулы l, в количестве от 0,5 до 15% мас./мас.
Приоритет по признакам:
1 пункт от 27.04.90.
2 пункт от 30.05.90.
3 пункт от 06.08.90.
Текст
Настоящее изобретение относится к новым производным бензимидазола, обладающим сильным фармакологическим действием, а также к промежуточным соединениям для их получения. В частности, настоящее изобретение относится к соединениям, обладающим сильной гипотензивной активностью и являющимся сильными антагонистами к ангиотензину ll, которые могут быть использованы в качестве лекарственных средств для лечения заболеваний, протекающих с расстройствами кровообращения, таких, как гипертоническая болезнь, болезни сердца (например, кардиомегалия, сердечная недостаточность, инфаркты и т.п.), шоки, кровоизлияние в мозг, нефриты и т.п. Ренин-ангиотензинная система осуществляет гомеостатическую функцию в организме, регулируя системное кровяное давление, содержание жидкости в организме, ионный баланс, и другие важные состояния организма, связанные с секрецией альдестерона. Исследования по разработке ингибиторов ферментов, стимулирующих образование ангиотензина ll, (ACE-ингибиторов), т.е. ферментов, катализующих продуцирование ангиотензина ll, обладающего сильным сосудосуживающим действием, ясно выявили соотношение между ренин-ангиотензинной системой и гипертензией. Поскольку ангиотензин ll посредством его рецепторов на клеточных мембранах способствует сужению кровеносных сосудов, повышая тем самым кровяное давление, то для лечения гипертензии, вызванной ангиотензином, следует использовать соединения, являющиеся антагонистами к ангиотензину ll, например, ингибиторы ACE. Известно, что различные аналоги ангиотензина ll, такие, как саралазин, [Sar1, Ile8] A ll, и т.п., обладают сильной антагонистической активностью к ангиотензину ll. Однако, известно также, что при парентеральном введении пептидных антагонистов, их действие является непродолжительным, а при пероральном введении они и вовсе являются неэффективными (M.A. Ondetti and D.W. Cushman. Anual Reports in Medicinal Chemistry, 13, 82 - 91 (1978)). Поэтому, во избежание указанных недостатков, было бы желательно использовать непептидные антагонисты к ангиотензину ll. В наиболее ранних работах, посвященных исследованиям в данной области, были описаны производные имидазола, обладающие антагонистической активностью к ангиотензину ll, например, в выкладках японских патентов №71073/1981; №71074/1981; №92270/1982; №157768/1983; США №4355040 и т.д. Позднее, например, в выкладках европатента №0253310, №0291969, японского патента №23868/1988 и №117876/1989, были раскрыты улучшенные производные имидазола. Кроме того, в выкладках европатента №0323841 и японского патента №287071/1989 в качестве антагонистов ангиотензина ll описываются производные пирола, пиразола и триазола. В патенте США №4880804 описываются производные бензимидазола, обладающие антагонистическим действием по отношению к рецептору ангиотензина ll, и которые обнаруживают in vivo-активность при внутривенном введении крысам с почечной гипертензией. Примерами указанных производных бензимидазола являются соединения формулы (A): где заместителями, например, в 5- и/или 6-положениях являются гидроксиметил, метокси, формил, хлоро или карбокси. В основном, большинство из указанных соединений являются неактивными при пероральном введении, и только 6-гидроксиметил и 6-хлоро-соединения являются эффективными при пероральном введении (100мг/кг или менее). Однако эта активность является недостаточной для клинического использования указанных соединений. Настоящее изобретение относится к производным бензимидазола, обладающим сильным гипотензивным действием и высокой ингибирующей ангиотензин ll активностью, что дает возможность использовать указанные соединения в качестве лекарственных средств. Авторы настоящего изобретения считают, что для осуществления регулирования ренин-ангиотензинной системы и лечения связанных с ней заболеваний с расстройствами кровообращения, такими, как гипертоническая болезнь, болезни сердца (например, кардиомегания, сердечная недостаточность, инфаркты и т.п.), шоки, инсульт и т.п., необходимо использовать соединения, обладающие высокой антагонистической активностью против рецептора ангиотензина ll, и являющиеся сильными и длительно действующими ангибиторами ангиотензина ll при пероральном введении. Указанное утверждение было основано на интенсивных исследованиях, проведенных авторами настоящего изобретения. В результате этих исследований были успешно синтезированы новые 2-замещенные производные бензимидазола (l), обладающие высокой антагонистической активностью против рецептора ангиотензина ll, а также оказывающие сильное и продолжительное гипотензивное действие при пероральном введении. Настоящее изобретение относится к производным бензимидазола формулы (l): где кольцо A является бензольным кольцом, которое в дополнение к R-группе может необязательно содержать замещение; R1 является водородом или необязательно замещенным углеводородным остатком; R2 является группой, способной к образованию аниона, или группой, конвертируемой в него; X является прямой связью или промежуточной группой между фениленовой или фенильной группами, длиной 2 атома или менее; R' является карбоксилом, его сложным эфиром, его амидом, или группой, способной образовывать анион или превращаться в анион; Y является -O-, -S(O)m- или -N(R4)-, где m целое число, равное 1 или 2, a R4 - водород или необязательно замещенная алкильная группа; и n целое число, равное 1 или 2; или к их фармацевтически приемлемым солям. Описанные соединения являются неожиданно сильными антагонистами к ангиотензину, и поэтому могут с успехом использоваться для лечения заболеваний, связанных с нарушением системы кровообращения, таких, как гипертоническая болезнь, сердечно-сосудистые болезни, шоки, нефриты и т.п. Другим предметом настоящего изобретения являются фармацевтические композиции, содержащие эффективное количество производного бензимидазола, имеющего формулу l, и фармацевтически приемлемый носитель, и которые могут быть использованы в качестве лекарственного средства для лечения заболеваний, связанных с нарушением системы кровообращения, таких, как гипертоническая болезнь, сердечно-сосудистые заболевания, шоки, почечная недостаточность, нефриты и т.п. Настоящее изобретение также относится к способу получения указанных соединений и композиций. Кроме того, настоящее изобретение относится к способу лечения указанных выше заболеваний системы кровообращения путем введения в организм эффективного количества производных бензимидазола формулы l или фармацевтическую композицию, содержащую указанное производное. На фиг.1 изображена диаграмма рассеяния рентгеновских лучей, полученная в экспериментальном примере 1; на фиг.2 - ИК-диаграмма, полученная в экспериментальном примере 1; на фиг.3 - диаграмма, получения в экспериментальном примере 1 с помощью дифференциальной сканирующей калориметрии. Настоящее изобретение относится к производным бензимидазола (l) и к их фармацевтически приемлемым солям, которые обладают высокой активностью, ингибирующей ангиотензин ll, и могут быть использованы для лечения заболеваний, связанных с расстройствами системы кровообращения, таких, как гипертоническая болезнь, сердечно-сосудистые заболевания, шоки, нефриты и т.п., а также к фармацевтическим композициям, содержащим эффективное количество производного бензммидазола формулы l в сочетании с фармацевтически приемлемым носителем, и предназначенным для лечения вышеуказанных заболеваний, и способам получения указанных соединений и композиций. Кроме того, настоящее изобретение относится к методу лечения вышеуказанных расстройств системы кровообращения, который заключается во введении живому организму эффективного количества производного бензимидазола (l) или его фармацевтической композиции. Важной группой соединений настоящего изобретения являются соединения формулы (l"): где A является бензольным кольцом, который в дополнение к группе R может необязательно содержать замещение; R1 является водородом или необязательно замещенным углеводородным остатком; R2 является группой, способной образовывать анион, или группой, способной превращаться в анион; X является простой связью или промежуточной группой, длиной в два или менее атомов, находящейся между фениленовой и фенильной группами; R' является карбоксилом, его сложным эфиром или амидом; Y является -O-, -S(O)m- или -N(R4)-, где m - целое число, равное 0, 1 или 2, a R4 - водород или необязательно замещенная алкильная группа; и n является целым числом, равным 1 или 2; и их фармацевтически приемлемые соли. Что касается вышеуказанной формулы (l), то углеводородные остатки, представленные R1, могут быть, например, алкилом, алкенилом, алкинилом, циклоалкилом, арилом и аралкилом. Из них предпочтительными являются алкил, алкенил и циклоалкил. При этом, алкилы, представленные R1, являются низшими алкильными группами, имеющими от 1 до около 8 атомов углерода, и могут быть как с прямой, так и с разветвленной цепью, например, такие, как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, т-бутил, пентил, i-пентил, гексил, гептил, октил и т.п. Алкенилы, представленные R1, являются низшими алкенильными группами с прямой или разветвленной цепью, имеющими от 2 до около 8 атомов углерода, например, такими, как винил, пропенил, 2-бутенил, 3бутенил, изобутенил, октенил и т.п. Алкинилы, представленные R1, являются низшими алкиниловыми группами с прямой или разветвленной цепью, имеющими от 2 до около 8 атомов углерода, например, такими, как этинил, 2-пропинил, 2-бутинил, 2пентинил, 2-октинил и т.п. Циклоалкилы, представленные R1, являются низшими циклоалкильными группами, имеющими от 3 до около 6 атомов углерода, например, такими, как циклопропил, циклобутил, циклопентил и т.п. Вышеуказанные алкилы, алкенилы, алкинилы и циклоалкилы могут быть замещенными гидрокоилом, необязательно замещенной аминогруппой (например, амино, метиламино и т.п), галогеном, низшей (C1 - 4) алкокси-группой или т.п. Аралкилами, представленными R1, могут быть, например, фенил-низший (C1 - 4) алкил, такой, как бензил, фенетил и т.п.; при этом указанные аралкилы могут быть замещенными, например, галогеном (F, Cl, Br и т.д.), нитро, низшей (C1 - 4) алкокси (метокси, этокси и т.п.) - группой; низшей (C1 - 4) алкильной (метильной, этильной и т.п.) - группой; или аналогичными группами в различных положениях бензольного кольца. Арильные группы, представленные R1, например, могут быть фенилом, и замещеными, например, галогеном (F, Cl, Br и т.п.), нитро, низшей (C1 - 4) алкокси-группой (такой, как метокси, этокси и т.п.), низшей C1 - 4 алкильной группой (такой, как метил, этил и т.п.), или аналогичными группами в различных положениях бензольного кольца. Из вышеупомянутых групп, представленных R1, предпочтительными являются необязательно замещенные алкильные или алкенильные группы (например, низшие (C1 - 5) алкильные и низшие (C2 - 5) алкенильные группы, необязательно замещенные гидроксильной группой, аминогруппой, галогеном или низшей (C1 - 4 ) алкоксигруппой). Примерами групп, способных образовывать анион или превращаться в анион, которые представлены радикалом R2, являются карбоксил, тетразолил, трифторметансульфонамид (-NHSO2CF3), фосфорная кислота, сульфоновая кислота, циано, низший (C1 - 4) алкоксикарбонил и т.п. Указанные группы могут быть замещенными, например, необязательно замещенной низшей алкильной группой (такой, как низший (C1 - 4) алкоксиметил, необязательно замещенный арилметил и т.п.) или ацильной группой (такой, как низший (С2 - 5) алканоил, необязательно замещенный бензоил и т.п). Указанные группы могут быть группами, способными образовывать анионы или превращаться в них при определенных химических или биологических и/или физиологических условиях (например, при in vivo реакции, такой, как окислительно-восстановительная реакция или гидролиз, катализуемый ферментами). Соединения, в котрых R2 является группой, способной образовывать анион или превращаться в него при химических реакциях (таких, как окисление, восстановление или гидролиз) [например, необязательно защищенной тетразолильной группой (например, группой формулы: где R является метилом, трифенилметилом, 2-тетрагидропиранилом, трет-бутилом, метоксиметилом, этоксиметилом, или необязательно замещенным бензилом, таким, как п-метоксибензил и п-нитробензил), циано и т.п.] могут быть использованы в качестве синтетических промежуточных соединений. Из вышеупомянутых групп, представленных R2, предпочтительными являются, тетразолильные группы, необязательно защищенные низшим алкилом или ацилом; карбоксильные группы, необязательно защищенные необязательно замещенным алкилом; и амид трифторметансульфоновой кислоты. Примерами карбоксила, его сложных эфиров или его амидов, представленных R1, являются группы, имеющие формулу: -CO-D', где D' является гидроксилом, необязательно замещенной аминогруппой (например, амино, N-низшей C1 - 4 алкиламино, N,N-динизшей (C1 - 4) алкиламино и т.п., или необязательно замещенной алкокси-группой [например, низшей (C1 - 6) алкокси-группой, необязательно замещенной гидроксилом; необязательно замещенной аминогруппой (например, амино, диметиламино, диэтиламино, пиперидино, морфолино и т.п.), галогеном, низшей (C1 - 6) алкокси-группой, низшей (C1 - 6) алкилтио или необязательно замещенным диоксоленилом (например, 5-метил-2-оксо-1,3-диоксолен-4-илом, и т.п.) на алкильной части; и группой, имеющей формулу: -OCH(R7)OCOR8, где R7 является водородом, прямым или разветвленным низшим алкилом с 1 - 6 атомами углерода (например, метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом, н-пентилом, изопентилом, неопентилом и т.п.); или циклоалкилом с 5 - 7 атомами углерода (например, циклопентилом, циклогексилом, циклогептилом и т.п.), a R8 является прямым или разветвленным низшим алкилом с 1 - 6 атомами углерода (например, метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом, т-бутилом, н-гептилом, изопентилом, неопентилом и т.п.), прямым или разветвленным низшим алкенилом, имеющим от 2 до около 8 атомов углерода (например, винилом, пропенилом, 2-бутенилом, 3бутенилом, изобутенилом, октенилом и т.п.), циклоалкилом с 5 - 7 атомами углерода (например, циклопентилом, циклогексилом, циклогептилом и т.п.), низшим (C1 - 3) алкилом (например, метилом, этилом, н-пропилом, изопропилом и т.п.), который является замещенным необязательно замещенным арилом или циклоалкилом с 5 7 атомами углерода (например, циннамилом и т.п.), необязательно замещенным арилом (например, фенилом, птолуолом, нафтилом и т.п.), прямой или разветвленной низшей алкокси-группой с 1 - 6 атомами углерода (например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, т-бутокси, нпентилокси, изопентилокси, неопентилокси и т.п.), прямой или разветвленной низшей алкенилокси-группой, имеющей от 2 до около 8 атомов углерода (например, аллилокси, изобутенилокси и т.п.), циклоалкилокси с 5 - 7 атомами углерода (например, циклопентилокси циклогексилокси, циклогептилокси и т.п.), низшей (C1 - 3) алкокси (например, метокси, этокси, н-пропокси, изопропокси и т.п.), которая является замещенной необязательно замещенным арилом или циклоалкилом с 5 - 7 атомами углерода (например, бензилокси, фенетилокси, циклопентилметилокси, циклогексилметилокси, и т.п.), низшей (C2 - 3) алкенилокси (например, винилокси, пропенилокси, аллилокси, изопропенилокси и т.п.), которая является замещенной необязательно замещенным арилом или циклоалкилом с 5 - 7 атомами углерода (например, циннамилокси и т.п.), необязательно замещенной арилокси-группой (например, фенокси, п-нитрофенокси, нафтокси и т.п.)]. Примерами групп, способных образовывать анион, или групп, способных превращаться в анион, представленных R', являются, например, тетразолильные группы, необязательно защищенные необязательно замещенным низшим алкилом, таким, как низший (C1 - 4) алкил и низший (C1 - 4) алкокси-низший (C1 - 4) алкил, или ацилом, таким, как низший (С2 - 5) алканоил; и необязательно замещенный бензоил, трифторметансульфонамид, фосфорная кислота, сульфоновая кислота и т.п. Примерами заместителей для R' являются -COOH или их соли, -COOMe, -COOEt, -COOtBu, COOPr, пивалоилоксиметоксикарбонил, 1-(циклогексилоксикарбонилокси)этоксикарбонил, 1(циклогексилоксикарбонилокси) этоксикарбонил, 5-метил-2-оксо-1,3-диоксолен-4-илметилоксикарбонил, ацетоксиметилоксикарбонил, пропионилоксиметоксикарбонил, н-бутирилоксиметоксикарбонил, изобутирилоксиметоксикарбонил, 1-(этоксикарбонилокси)этоксикарбонил, 1-(ацетилокси)этоксикарбонил, 1(изобутирилокси)этоксикарбонил, циклогексилкарбонилоксиметоксикарбонил, бензоилоксиметоксикарбонил, циннамилоксикарбонил, циклопентилкарбонилокоиметоксикарбонил и т.п. Указанные группы могут также включать группы, способные образовывать анионы (например, -COO-, ее производные и т.п.) или группы, способные превращаться в анионы при определенных химических или биологических и/или физиологических условиях (например, при in vivo реакциях, таких, как окислительно-восстановительная реакция или гидролиз, катализуемый in vivo-ферментами). Бензольное кольцо A необязательно может содержать помимо R-группы также заместители, среди которых являются галоген (например, F, Cl, Br и т.п.); нитро; циано; необязательно замещенную аминогруппу [например, амино, N-низшую (C1 - 4) алкиламино такую, как метиламино и этиламино, N,N-ди-низшую (C1 - 4) алкиламино, такую, как диметиламино и диэтиламино; N-ариламино, такую, как фениламино и нафтиламино, N-аралкиламино, такую, как бензиламино и нафтилметиламино, алициклическую аминогруппу, такую, как морфолино, пиперидино, пиперазино и N-фенилпиперазино]; группы формулы: -W-R13, где W является химической связью, -O-, -S-, или является водородом или необязательно низшей алкильной группой (например, низшим (C1 - 4) алкилом, необязательно замещенным гидроксилом; необязательно замещеннной амино (например, амино, диметиламино, диэтиламино, пиперидино, морфолино и т.п.), галогеном или низшим C1 - 4 алколкси, и т.п.); группы формулы: -(CH2)p-CO-D, где D является водородом, гидроксилом, необязательно замещенной аминогруппой (например, амино, N-низшей C1 - 4 алкиламино, N,N-динизшей C1 - 4 алкиламино и т.п.), или необязательно замещенным алкокси (например, низшей (C1 - 4) алкокси-группой, необязательно замещенной гидроксилом, необязательно замещенной аминогруппой (например, амино, диметиламино, диэтиламино, пиперидино, морфолино и т.п.), галогеном, низшей (C1 - 6) алкокси-группой, низшим (C1 - 6) алкилтио или необязательно замещенным диоколинилом (например, 5-метил-2-оксо-1,3-диоксолен-4-ил и т.п.) на алкильной части; и группы формулы: -OCH(R9)OCOR10, где R9 является водородом, прямым или разветвленным низшим алкилом с 1 - 6 атомами углерода (например, метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом, т-бутилом, н-пентилом, изопентилом, неопентилом и т.п.), или циклоалкилом с 5 - 7 атомами углерода (например, циклопентилом, циклогексилом, циклогептилом и т.п.), a R10 является прямым или разветвленным низшим алкилом с 1 - 6 атомами углерода (например, метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом, т-бутилом, н-пентилом, изопентилом, неопентилом и т.п.), прямым или разветвленным низшим алкенилом, имеющим от 2 до около 8 атомов углерода (например, винилом, пропенилом, 2-бутенилом, 3-бутенилом, изобутенилом, октенилом и т.п.), циклоалкилом с 5 - 7 атомами углерода (например, циклопентилом, циклогексилом, циклогептилом и т.п.), низшим (C1 - 3) алкилом (например, метилом, этилом, н-пропилом, изопропилом и т.п.), который является замещенным необязательно замещенным арилом или циклоалкилом с 5 - 7 атомами углерода (например, бензилом, п-хлорбензилом, фенетилом, циклопентилметилом, циклогексилметилом и т.п.), низшим (C2 - 3) алкенилом (например, винилом, пропенилом, аллилом, изопропенилом и т.п.), который является замещенным необязательно замещенным арилом или циклоалкилом с 5 - 7 атомами углерода (например, циннамилом и т.п.), необязательно замещенным арилом (например, фенилом, п-толуилом, нафтилом и т.п.), прямой или разветвленной алкокси-группой с 1 - 6 атомами углерода (например, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, т-бутокси, нпентилокси, изопентилокси, неопентилокси и т.п.), прямой или разветвленной низшей алкенилокси-группой, имеющей от 2 до около 8 атомов углерода (например, аллилокси, изобутенилокси и т.п.), циклоалкилокси с 5 - 7 атомами углерода (например, циклопентилокси, циклогексилокси, циклогептилокси и т.п.), низшей (C1 - 3) алкокси (например, метокси, этокси, н-пропокси, изопропокси и т.п.), которая является замещенной необязательно замещенным арилом или циклоалкилом с 5 - 7 атомами углерода (например, бензилокси, фенетилокси, циклопентилметилокси, циклогексилметилокси и т.п.), низшей (C2 - 3) алкенилокси (например, винилокси, пропенилокси, аллилокси, изопропенилокси и т.п.), которая является замещенной необязательно замещенным арилом или циклоалкилом с 5 - 7 атомами углерода (например, циннамилокси и т.п.), необязательно замещенной арилоксигруппой (например, фенокси, п-нитрофенокси, нафтокси и т.п.) и p является 0 или 1; тетразолил, необязательно защищенный, например, необязательно замещенным низшим алкилом (например, низшим (C1 - 4) алкоксиметилом, необязательно замещенным арилметилом и т.п.) или ацилом (например, низшим (C2 - 5) алканоилом, необязательно замещенным бензоилом и т.п.); амид трифторметансульфоновой кислоты, фосфорная кислота; сульфоновая кислота и т.п. Один или два из указанных заместителей могут быть замещенными в различных положениях бензольного кольца. Если на кольце A присутствуют два заместителя в 4- и 5- или в 5- и 6-положениях, то вместе они могут образовывать кольцо (например, бензол и т.п.). Указанные кольца могут быть замещенными группами, аналогичными заместителям для кольца A. X означает, что смежные фениленовая и фенильная группы связаны между собой либо непосредственно, либо посредством промежуточной группы с цепью, состоящей из 2 атомов или менее. Промежуточной группой может быть любая двухвалентная цепь, в которой число атомов, составляющих прямую цепь, равно 1 или 2; причем эта группа может иметь и боковую цепью. Примерами указанных промежуточных групп являются низший (C1 - 4) алкилен, Предпочтительно, если X является химической связью между фениленовой и фенильной группами. Y означает, что R' связан со 2-положением бензимидазола посредством гетероатома. Примерами Y являются -O-, -SOm-, где m = 0, 1 или 2; -N(R4) - где R4 является водородом или необязательно замещенной низшей (C1 - 4) алкильной группой, и т.п., предпочтительно -O-, и -S-, и -NH-, а более предпочтительно -O- и -S-, а особенно предпочтительно, -O-, R1 и R4, взятые вместе со связанным с ними атомом N, образует гетероциклическое кольцо (например, пиперидино, морфолино и т.п.). Если R1 = Н, то соединения, имеющие формулы (l) [Соединение (l)], могут существовать в двух таутомерных формах. Если соединения настоящего изобретения имеют несколько асимметрических атомов углерода, то они могут существовать в нескольких стереохимических формах. Настоящее изобретение также включает смесь изомеров и отдельные стереоизомеры. Настоящее изобретение включает в себя геометрические изомеры, изомеры вращения, энантиомеры, рацематы и диастереомеры. Соединения настоящего изобретения могут существовать в виде пролекарства, где R' является карбоксилом или происходящим от него анионом. Из соединений, представленных формулой (l), предпочтительным соединением настоящего изобретения является соединение формулы: где R1 является низшим (C1 - 5) алкилом необязательно замещенным гидроксилом, амино, галогеном или низшей (C1 - 4) алкокси-группой (например, низшим (C2 - 3) алкилом); R' является -CO-D', где D' представляет собой гидроксил, амино, N - низший (C1 - 4) алкиламино, N,N-динизший (C1 - 4 ) алкиламино, или низший (C1 - 4) алкокси, необязательно замещенный гидроксилом; амино, галоген, низший (C1 - 4) алкокси, низший (С2 - 5) алканоилокси (например, ацетилокси, пивалоилокси и т.п.), или 1-низший (C1 - 5) алкоксикарбонилокси (например, метоксикарбонилокси, этоксикарбонилокси, циклогексилоксикарбонилокси и т.п.) на алкильной части; или тетразолил, необязательно защищенный необязательно замещенным низшим (C1 - 4) алкилом или ацильной группой (например, низшим C2 - 6 алканоилом, бензоилом и т.п.); R2 является тетразолилом, необязательно защищенным необязательно замещенным низшим (C1 - 4) алкилом (например, метилом, трифенилметилом, тритилом, метоксиметилом, этоксиметилом, п-метоксибензилом, п-нитробензилом и т.п.) или ацилом (например, низшим (C2 - 5) алканоилом, бензоилом и т.п.), или карбоксилом, необязательно защищенным необязательно замещенным низшим (C1 - 4) алкилом (например, метилом, трифенилметилом тритилом, метоксиметилом, этоксиметилом, п-метоксибензилом, п-нитробензилом и т.п.); R" является водородом, галогеном, низшим C1 - 4 алкилом, низшим C1 - 4 алкокси, нитро или -CO-D", где D" является гидроксилом или низшим (C1 - -2) алкокси, необязательно замещенным гидроксилом, низшим (C1 - 4) алкокси, низшим (C2 - 5) алканоилокси (например, ацетилокси, пивалоилокси и т.п.) или 1-низшим (C1 - 4) алкоксикарбонилокси (например, метоксикарбонилокси, этоксикарбонилокси, циклогексилоксикарбонилокси и т.п.) на алкильной части; или аминогруппой, необязательно замещенной низшим C1 - 4 алкилом (i.a, водородом, низшим C1 - 4 алкилом, или галогеном, а более предпочтительно водородом); Y является -O-, -S-, или -N(R4)-, где R4 является водородом или низшим (C1 - 4) алкилом; и его фармацевтически приемлемые соли. Соединения (l) настоящего изобретения могут быть получены с помощью реакций, представленных ниже несколькими схемами для предпочтительного соединения. где R1, R2, R', A, X, Y и n имеют значения, определенные выше; Z является галогеном. где каждая группа имеет значения, определенные выше. где R1, R', A, X, Y и n имеют значения, определенные выше, R6 является необязательно замещенным низшим (C1 6) алкилом. где A, R, R', X, Y и n имеют значения, определенные выше, R5 является низшим (C1 - 6) алкилом, необязательно замещенным низшей C2 - 6 алканоилокси-группой, I низшей (C1 - 6) алкокси карбонилокси-группой или группой, определенной для R'. Реакция, показанная на схеме A, является алкилированием с использованием алкилирующего агента в присутствии основания. На одну молярную часть соединения (ll) используется приблизительно 1 - 3М основания и 1 - 3 алкилирующего агента. Обычно реакция протекает в растворителях, таких, как диметилформамид, диметилацетамид, диметилсульфоксид, ацетонитрил, тетрагидрофуран, ацетон, этилметил кетон и т.п. Примерами оснований могут служить гидрид натрия, т-бутоксид калия, карбонат калия, карбонат натрия и т.п. Примерами алкилирующих агентов являются замещенные галиды (например, хлориды, бромиды, иодиды и т.п.), замещенные сложные эфиры сульфокислоты (например, сложные эфиры толуолсульфоновой кислоты и т.п.) и т.д. Реакционные условия могут варьироваться в зависимости от комбинации основания и алкилирующего агента. Предпочтительно, если реакция протекает в течение приблизительно 1 - 10 часов и при температуре в условиях охлаждения льдом до комнатной температуры. В указанной реакции алкилирования, смесь двух изомеров (l) и (l'") может быть получена в соотношении, зависящем от положения алкилированного атома N. Поскольку соотношение полученных соединений (l) и (l'") варьируется в зависимости от реакционных условий и заместителей на бензимидазольном кольце, то эти два соединения могут быть легко получены в качестве чистых продуктов путем стандартной техники выделения и/или очистки (например, с помощью перекристаллизации, колоночной хроматографии и т.п.). Как показано на схеме B, нитриловое соединение (la) взаимодействует с различными азидами, образуя тетразольное соединение (ld). На 1 - 5М азида используют 1М соединения (la). Реакция, в основном, протекает в растворителях, таких, как диметилформамид, диметилацетамид, толуол, бензол и т.п. Примерами азидов являются азид триалкилолова (например, азид триметилолова, азид трибутилолова, азид трифенилолова и т.п.), водородазид и его аммониевые соли и т.д. В случав использования азида оловоорганического соединения, то на соединение (la) приходится 1 - 4М азида, и указанная реакция протекает в толуоле или бензоле при нагревании в сосуде с обратным холодильником в течение 1 - 4 дней. При использовании водород-азида или его аммониевых солей, на соединение (la) приходится 1-M азида натрия и хлорида аммония или третичного амина (например, триэтиламина, трибутиламина и т.п.), а реакцию проводят в диметилформамиде приблизительно при 100 - 120°C в течение 1 - 4 дней. Для облегчения реакции, во время ее осуществления предпочтительно добавлять соответствующее количество азида натрия и хлорида аммония. В этом случае, улучшение выхода иногда наблюдается при добавлении соответствующих фракций азидного соединения. Как показано на схеме C, сложный эфир (lc) гидролизуют в присутствии щелочи, в результате чего получают карбоновую кислоту (ld). Указанную реакцию проводят обычно в растворителе, таком, как водный спирт (например, этанол, метанол, метилцеллозольв и т.п.) при использовании щелочи в количестве около 1 - 3М на 1М соединения (lc). Примерами щелочей могут служить гидроксид натрия, гадроксид калия и т.п. Указанная реакция протекает при температуре от комнатной температуры до около 100°C в течение примерно от 1 до 10ч, а предпочтительно при температуре кипения растворителя в течение 2 - 5ч. На схеме D проиллюстрировано получение 2-алкокси-производного (le) с помощью реакции взаимодействия фенилендиамина (lV) с алкилортокарбонатом. Реакцию проводят в присутствии кислоты и при использовании алкилортокарбоната в количестве около 1 - 3М на 1М соединения (lV). Примерами указанных алкилортокарбонатов являются ортокарбонаты метила, этила, пропила, изопропила, бутила и т.п. А при использовании, например, уксусной кислоты или п-толуолсульфоновой кислоты, реакция ускоряется и получение соединения с замкнутым кольцом осуществляют с хорошим выходом. В качестве растворителя могут быть использованы галогенированные углеводороды и простые эфиры, но обычно реакцию проводят без растворителя. Как правило, реакция протекает приблизительно при температуре от 70 до 100°C в течение 1 - 5ч. В указанной реакции диалкоксиимино-соедиение получают в качестве промежуточного соединения, которое тут же в присутствии кислоты подвергают реакции замыкания кольца с получением 2-алкокси-соединения (le). Можно также выделить промежуточное соединение реакции, которое затем подвергают реакции замыкания кольца в присутствии кислоты с образованием 2-алкокси-соединения (le). На схеме E показана реакция фенилендиаминосоединения (lV) с различными реагентами с получением 2-кетосоединения (или 2гидроксисоединения, lf). Указанную реакцию проводят с использованием карбонилирующего реагента (например, мочевины, диэтилкарбоната, бис-(I-имидазолил)кетона и т.п.) в количестве от около 1 до 5М на 1М соединения (lV) и с использованием, например, галогенированных углеводородов (таких, как метиленхлорид, хлороформ и т.п.), спиртов (таких, как метанол, этанол и т.п.) или амидов (таких, как диметилформамид, диметилацетамид и т.п.). На схеме F проиллюстрировано избирательное O-алкилирование 2-гидроксисоединения (lf) с использованием реагента Меервейна, в результате которого получают 2-алкоксисоединение (lg). Указанную реакцию осуществляют с использованием реагента Меервейна в количестве от около 1 до 3М на 1М соединения (lf), а также, как правило, с использованием в качестве галогенированных углеводородов (например, метиленхлорида, хлороформа и т.п.) или простых эфиров (например, метилового эфира, этилового эфира и т.п.). Примерами реагентов Меервейна среди прочих являются фторборат триметилоксония (Me3O+BF4-), фторборат триэтилоксония (Et3O+BF4) и т.п. При получении in situ предпочтительно использовать способ, описанный в литературе (H. Meerwin, Org. Syn. 46, 113 и 120 (1966)). Реакцию предпочтительно проводить при температурах приблизительно от комнатной температуры до точки кипения растворителя от около 2 до 20ч. На схеме G проиллюстрирована реакция фенилендиаминосоединения (lV) с различными реагентами в органическом растворителе с получением 2-меркаптосоединения (lh). На 1М фенилендиаминосоединения (lV) используют около 1 - 3М тиокарбонилирующего агента (например, сероуглерод, тиомочевину, ксантат калия и т.п.) или изотиоцианата (например, метилизотиоцианата, этилизотиоцианата и т.п.). В качестве реакционного растворителя могут быть использованы спирты (например, метанол, этанол и т.п.), амиды (например, диметилформамид, диметилацетамид и др.) или т.п. Предпочтительно, реакцию проводят при температурах от комнатной температуры до температуры кипения растворителя в течение от около 5 до 20ч. На схеме H проиллюстрировано алкилирование 2-меркаптосоединения (lh) в присутствии органического растворителя, содержащего основание, с получением алкилтиосоединения (li). Реакцию проводят при использовании на 1М соединения (lh) около 1 - 3М основания и около 1 - 3М алкилирующего агента в растворителе, таком, как диметилформамид, диметилацетамид, диметилсульфоксид, ацетонитрил, ацетон, этилметилкетон, этанол, метанол и вода. В качестве основания может быть использован гидроксид натрия, карбонат калия, карбонат натрия, гидрид натрия, т-бутоксид калия, гидроксид калия или т.п. В качестве алкилирующего агента может быть использован, например, галид (такой, как метииодид, этилиодид, пропилиодид, бутилиодид, или их бромид и хлорид). Указанную реакцию обычно проводят при температуре от температуры в условиях охлаждения льдом до точки кипения растворителя, при этом реакционные условия вирьируются в зависимости от используемых основания, алкилирующего агента и растворителя. На схеме l проиллюстрирована реакция фенилендиамина (lV) с изотиоцианатом с образованием соединения тиомочевины (V), которое затем подвергали десульфуризации-циклизации с получением 2-замещенного аминосоединения (lj). Указанную реакцию проводят с использованием около 1 - 3М изотиоцианата на 1М соединения (lV) в растворителе, таком, как галогенированные углеводороды (например, хлороформ, метиленхлорид и т.п.), простые эфиры (например, тетрагидрофуран, диоксан и др.), ароматические углеводороды (например, бензол, толуол и др.), спирты (например, метанол, этанол и др.), ацетонитрил, диметилформамид и т.п. Реакция может также протекать и в отсутствие растворителя. Примерами указанных изотиоцианатов являются изотиоцианаты метила, этила, пропила, изопропила, бутила и т.п. Предпочтительно, реакцию проводят при температурах в пределах от комнатной температуры до около 50°C в течение 10 - 60ч. Десульфуризация-циклизация может быть проведена способом, описанным ниже. Реакцию проводят в галогенированных углеводородах (например, HgCl2) при использовании около 1 - 3М галида металла (например HgCl2) на 1М тиомочевины (V), полученной вышеуказанным способом. Предпочтительно, реакцию осуществляют в пределах от комнатной температуры до точки кипения растворителя в течение приблизительно 3 - 10 часов. Реакция также может быть проведена при использовании около 1 - 3М метилиодида на 1М тиомочевины (V) в спирте (например, в метаноле или этаноле), предпочтительно в пределах от комнатной температуры до точки кипения растворителя в течение около 3 - 15ч. Как показано на схеме 1', 2-галогеновое соединение может быть легко получено из соединения (lf) с помощью реакции этого соединения с различными нуклеофильными реагентами с образованием соединения (l). Указанная реакция может быть проведена в соответствии со стандартным способом [например, D. Harrison и J.J. Ralph, J. Chem. Soc. (1965), 236). Соединение (lf) взаимодействует с галогенирующим агентом (например, оксихлоридом фосфора, трихлоридом фосфора и т.п.) с образованием 2-галогеносоединения (V'), которое реагирует с различными нуклеофильными реагентами (например, спиртами, меркаптанами, аминами и т.п.) в соответствующем органическом растворителе с образованием соединения (l). Реакционные условия могут варьироваться в зависимости от используемого нуклеофильного реагента. При проведении реакции предпочтительно использовать спирты, алкоголяты (например, метоксид натрия, этоксид натрия, пропоксид натрия и т.п.), происходящие от спиртов и металлического натрия. В качестве растворителя для нуклеофильных реагентов могут быть затем использованы спирты. На 1М соединении (V') обычно используют около 2 - 5 алкоголята. Реакцию предпочтительно проводить приблизительно при температуре кипения растворителя, примерно, около 1 - 3ч. При реакции с аминами на 1М соединения (V') используют около 3 - 10М амина. В качестве растворителя могут быть использованы спирты, однако, при этом, амины должны быть в избыточном количестве. Реакцию предпочтительно проводить при температурах в пределах приблизительно от точки кипения растворителя до 150°C, примерно в течение 1 - 10ч. При реакции с меркаптанами, на 1М соединения (V') используют около 2 - 5М меркаптана. Реакцию проводят предпочтительно в присутствии около 1 - 3М основания (например, карбоната натрия, карбоната калия и т.п.) на 1М соединения (lV). Примерами растворителей являются ацетонитрип, спирты, галогенированные углеводороды (например, хлороформ, дихлорэтан и т.п.), простые эфиры (например, тетрагидрофуран, диоксан и т.п.), или амиды (например, диметилформамид, диметилацетамид и т.п.). Реакцию предпочтительно проводить при температурах в пределах от 50°C до приблизительно точки кипения растворителя в течение около 1 - 5ч. На схеме l" показана реакция соединения (lh) с окисляющим реагентом (например, м-хлорпербензойной кислотой и т.п.) с образованием сульфоксида или сульфонового соединения (lh'), благодаря реакции которого с различными нуклеофильными реагентами (например, спиртами, аминами, меркаптанами и т.п.) получают соединение (l). Окисление соединения (lh) до сульфоксидного или сульфонового соединения (lh') проводят предпочтительно в растворителях, таких, как галогенированные углеводороды (например, дихлорметан, хлороформ, хлорэтан и т.п.), простые эфиры (например, тетрагидрофуран, диоксан и т.п.) и т.п. Примерами указанных окисляющих реагентов являются органические перкислоты, такие, как м-хлорпербензойная кислота, Nгалогенсукцинимиды, например, N-бромосукцинамид и т.п. Обычно, окисляющий реагент используют в равном или слегка избыточном количестве по отношению к соединению (lh). Сульфоксид может быть получен при использовании 1М окисляющего агента, а сульфоновое соединение (ln') - при использовании 2М окисляющего агента. Реакцию предпочтительно проводят при температурах в пределах примерно от температуры в условиях охлаждения льдом до комнатной температуры, приблизительно в течение 3 - 10ч. Реакцию соединения (lh') с получением соединения (l) проводят, в основном, способом, аналогичным использованию в реакции, показанной на схеме l'. На схеме J показано получение карбоновой кислоты (lk) путем основного гидролиза соединения (lj) сложного эфира карбоновой кислоты. Реакцию проводят с использованием около 1 - 3М щелочи на 1М соединения (lj), обычно в растворителе, таком, как водный спирт (например, метанол, этанол, метилцеллозольв, и т.п.). Примерами указанных щелочей могут быть гидроокись натрия, гидроокись калия и т.п. Реакцию проводят предпочтительно при температурах в пределах от комнатной температуры до около 100°C примерно в течение 1 - 10ч, а более предпочтительно примерно при температуре кипения растворителя, в течение около 3 - 5ч. На схеме K показана реакция разблокирования защитного тетразолового производного (ll) с получением соединения (lm). Условия указанной реакции разблокирования зависят от используемой затем защитной группы (R). Если R является трифенилметилом 2-тетрагидропиранил м метоксиметил м этоксиметилом или др., то реакцию проводят в водном спирте (например, метаноле, этаноле и т.п.), содержащем около 0,5н - 2н хлористоводородной кислоты или уксусной кислоты, приблизительно при комнатной температуре, примерно в течение 1 - 10ч. На схеме L проиллюстрировано получение соединения (lq) путем защиты тетразольной группы в присутствии основания, а затем карбоксильной группы с получением соединения (lp) сложного эфира и последующим удалением защитной группы в кислотных условиях. В реакции получения соединения (lo) из соединения (ln) алкилирующий агент использовался в количестве приблизительно от 1 до 1,5М на 1М соединения (ln). Примерами растворителей, используемых в реакции, являются галогенированные углеводороды, такие, как хлороформ, метиленхлорид и этиленхлорид; простые эфиры, такие, как диоксан и тетрагидрофуран, ацетонитрил, пиридин и т.п. Примерами оснований могут служить карбонат калия, карбонат натрия, триэтиламин, пиридин и т.п. Примерами алкилирующих агентов являются галиды, такие, как трифенилметилхлорид и метоксиметилхлорид и т.п. Поскольку реакционные условия варьируются в зависимости от сочетаний используемых основания и алкилирующего агента, то предпочтительно осуществлять реакцию с использованием трифенилметилхлорида при температурах в пределах от температуры в условиях охлаждения льдом до комнатной температуры, приблизительно в течение 1 - 3 часов, в метиленхлориде в присутствии триэтиламина. При реакции получения соединения (lp) из полученного таким образом соединения (lo), алкилирующий агент используют в количестве около 1 - 3М на 1М соединения (lq). Примерами реакционного растворителя являются амиды, такие, как диметилформамид и диметилацетамид, ацетонитрил, диметилсульфоксид, ацетон, этилметилкетон и т.п. Примерами основания являются карбонат калия, карбонат натрия, гидрид натрия, тбутоксид калия и т.п. Примерами указанных алкилирующих агентов являются галиды, такие, как циклогексил 1иодоэтилкарбонат, этил 1-иодоэтилкарбонат, пиваилоксиметилиодид и т.п. Поскольку реакционные условия варьируются з зависимости от сочетания используемых основания и алкилирующего агента, то соединение (lo) предпочтительно подвергать реакции в ДМФ, добавляя алкилирующий агент в присутствии карбоната калия в условиях комнатной температуры, и в течение примерно от 30мин до 1ч. Реакцию разблокирования полученного таким образом соединения (lp) проводят предпочтительно способом, аналогичным способу, описанному при осуществлении реакции (K). Если в качестве защитной для тетразольной группы используют тритильную группу, то реакцию предпочтительно проводить в метаноле или этаноле, добавляя при этом 1н - HCl, приблизительно при комнатной температуре в течение около 30мин - 1ч. Полученные с помощью описанных выше реакционных процессов (A) - (L) продукты могут быть легко выделены и/или очищены стандартными способами, например, такими, как выпаривание растворителей, экстрагирование водой или органическими растворителями, концентрирование, нейтрализация, перекристаллизация, дистилляция, колоночная хроматография и т.д. Соединения (l), полученные с помощью реакций, описанных схемами (A) - (L), могут быть выделены и/или очищены из реакционной смеси стандартными способами, такими, как перекристаллизация или колоночная хроматография, в целях получения кристаллического продукта. Соединения, полученные с помощью реакций, описанных схемами (A) - (L), могут быть в виде сольватов или солей (включая аддитивные соли) происходящих от фармацевтически или физиологически приемлемых кислот или оснований. Примерами таких солей являются соли с неорганическими кислотами, такими, как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, а также с органическими кислотами, такими, как уксусная кислота, щавелевая кислота, янтарная кислота, лимонная кислота, аскорбиновая кислота, молочная кислота, птолуоловая кислота, метансульфоновая кислота, фумаровая кислота, винная кислота и малеиновая кислота. Другими примерами солей могут быть также соли аммония, щелочных металлов или щелочно-земельных металлов, таких, как натрий, калий, кальций или магний, или соли с органическими основаниями, например, триалкиламинами, дибензиламином, этаноламином, триэтаноламином, метилморфолином и т.п С помощью стандартных способов, соединения (l) могут быть получены в виде солей с нетоксичными, физиологически или фармацевтически приемлемыми кислотами или основаниями, например, в виде солей с неорганической кислотой, таких, как гидрохлорид, сульфат или нитрат, и в зависимости от соединения, в виде солей с органической кислотой, таких, как ацетат, оксалат, сукцинат или малеат; солей щелочных металлов, таких, как соли натрия или калия; или солей, щелочноземельных металлов, таких, как соли кальция. Для синтеза указанных соединений (l) используются исходные соединения (ll) и (lV), которые могут быть получены способами, например, способами, описанными в указанной ниже литературе, или способами аналогичными способам, проиллюстрированным в приведенных ниже схемах (M), (N), (O) и (P). 1) Preston P.N. The Chemistry of Heterocyclic Compounds, Vol.40, ed. by P.N. Preston, John Wiley & Sons Inc., New York (1981), pp.1 - 286. 2) Schipper E.S. and Day A.R. Heterocyclic Compounds. Vol.5, ed. by R.C. Elderfield, John Willey & Sons Inc., New York (1965), pp.194 - 297. 3) Leonard N.J., Curtin D.Y. & Beck K.M. // J. Am. Chem. Soc. 69, 2459 (1947). 4) Weiss S., Michaud H., Prietzel H. & Kromer H. // Angew. Chem. 85, 866 (1973). 5) Wright W.B. // J. Heterocycl. Chem., 2, 41 (1965). 6) Omar A.M.E. // Synthesis, 1974, 41. 7) Brown D.J. & Lynn R.K. // J. Chem. Soc.(Perkin l), 1974, 349. 8) Van Allan J.A. & Deacon B.D. // Org. Syn., 30, 56 (1950). 9) Singh S.P., Parmar S.S. & Pandey B.R. // J. Heterocycl. Chem., 14, 1093 (1977). 10) Nakajima S., Tanaka I., Seki T. & Anmo T. // Yakugaku Zasshi, 78, 1378 (1959). 11) Seno K., Hagishita S., Sato. T. & Kuriyama R. // J. Chem. Soc., Perkin Trans. 1984, 2013. 12) Buckle D.R. et al. // J. Med. Chem., 30, 2216 (1987). 13) Gupta R.P., Larroquette C.A. & Agrawal R.C. // J. Med.Chem., 25, 1342 (1982), etc. где R2, R3, R', A, Z, X и n определены выше. Схемы M и M' иллюстрируют способ получения важных промежуточных соединений, используемых для синтеза соединения (l) настоящего изобретения. Эти соединения могут быть получены способами, описанными в вышеуказанных ссылках. Соединение (Vl) с помощью реакции Курциуса превращают в карбаминовую кислоту (X) с последующим алкилированием, а затем восстановлением нитросоединения до получения диаминосоединения (lV). В реакции перегруппировки соединения (Vl) в соединение (X), указанное соединение (X) получают с высоким выходом в соответствии со стандартным способом перегруппировки Курциуса: хл оран гидрид (Vll) ® азид кислоты (Vlll) ® изоцианат (lX) ® соединение (X). Соединение (Vl) обычно нагревают с дифенилфосфорилазидом (DPPA) в присутствии триэтиламина в ДМФ, в результате чего изоцианат (lX) образуется посредством азида кислоты (Vlll) с последующей реакцией со спиртом, что дает, наконец, соединение (X) с высоким выходом. Полученное таким образом соединение (X) подвергают алкилированию способом, аналогичным способу, представленному схемой A, с образованием соединением (Xl). В указанной реакции, реакционную смесь нагревают в сосуде с обратным холодильником примерно, в течение 4 - 6ч в присутствии основания, а именно, карбоната калия в ацетонитриле. Соединение (Xl) нагревают в сосуде с обратным холодильником в спирте, содержащем минеральную кислоту (например, соляную кислоту, серную кислоту и т.п.) или органическую кислоту (например, трифторуксусную кислоту и т.п.), примерно в течение 1 - 2ч, в результате чего получают соединение (Xll). Для восстановления нитросоединения (Xll) в диаминосоединение (lV) могут быть использованы различные восстанавливающие агенты (например, скелетный никелевый катализатор гидрирования, хлористое олово и т.п.). При этом, наиболее предпочтительно использовать хлористое железо и гидразингидрат в спирте. Кроме того, соединение (lV) может быть получено и другими способами, отличающимися от указанных выше. Соединение (X'), которое является коммерчески доступным или может быть легко получено известными способами, предпочтительно взаимодействует с амином (lllb) в присутствии основания (например, карбоната калия, карбоната натрия, аминов и т.п.) в органическом растворителе (например, спиртах, простых эфирах, галогенированных углеводородах, амидах и т.п.) при температурах приблизительно от точки кипения растворителя до 100°C примерно в течение 5 - 20ч. Соединение (X"), которое может быть получено путем обработки соединения (X) кислотой, подвергают конденсации в условиях дегидратации, заключающихся в азеотропном удалении воды (или в присутствии дегидратирующих агентов) в органическом растворителе (например, простых эфирах, галогенированных углеводородах, ароматических углеводородах и т.п.) с последующей реакцией с восстанавливающим реагентом (например, NaCNBH3 и т.п.), в результате чего получают соединение (Xll). Указанная конденсация в условиях дегидратации может быть ускорена путем использования соответствующих кислотных или основных катализаторов. Соединение (X") взаимодействует с хлорангидридом (llld), предпочтительно, в присутствии основания (например, пиридина, триэтиламина, диметиламинопиридина и т.п.) в органическом растворителе (например, галогенированных углеводородах, пиридине и т.п.) при температурах в пределах от комнатной температуры до приблизительно точки кипения растворителя, примерно, в течение 2 - 20ч, в результате чего образуется амид (Xl). Полученный таким образом амид (Xl') подвергают взаимодействию с восстанавливающим реагентом (например, алюмогидридом натрия, бис(2-метоксиэтокси)алюмогидридом натрия и т.п.), и получают диаминовое соединение (lV). где каждая группа имеет значения, определенные выше. Из исходных соединений (lll), соединение, в котором n = 1, т.е. соединение (llla) является коммерчески доступным, или может быть легко получено путем галогенметилирования соединения (XV) способами, описанными в литературе, например: 1) Hoover J.R.E., Chow A.W., Stedman R.J., Hall N.M., Greenberg H.S., Dolan M.M. and Feriauto R.J. // J. Med. Chem., 7, 245 (1964). 2) Stedman R.J., Hoover J.R. E, Chow A.W., Dolan M.M., Hall N.M. and Feriauto R.J. // J. Med. Chem., 7, 251 (1964). 3) Gilman H. and Gorsich R.D. // J. Am. Chem. Soc., 78, 2217 (1956). 4) Orchin M. and Oscar Woolfolk E. // J. Am. Chem. Soc. 67, 122 (1945) и т.д. где каждая группа имеет значения, определенные выше. Соединение (llla') также может быть легко получено способами, описанными в работе Tridgen L.N., Suyoler L. and Prol J., Jr. // J. Org. Chem., 54, 1523 (1989), как показано ниже на схеме R, с последующим галогенированием (R12 = Me) или галогенметилированием (R12 = H). Далее, из исходных соединений (lll), соединение, в котором n = 2, т.е соединение (lllb), может быть получено из соединения (llla) в соответствии с реакцией, показанной на схеме (S). Полученные таким образом соединения и их соли являются менее токсичными и сильными ингибиторами сосудосуживающего и гипертензивного действия ангиотензина ll, которые могут быть использованы для введения животным, в частности, млекопитающим (например, человеку, собакам, кроликам, крысам и т.п.) в качестве лекарственных средств при лечении не только гипертензии, но и также заболеваний, связанных с нарушением кровообращения, таких, как сердечная недостаточность (гипертрофия сердца, инфаркт или т.п.), шоки, инсульты, нефропатия и нефриты. Соединения (l) и их соли, полученные в соответствии с настоящим изобретением, являются сильными ингибиторами сосудосуживающего и гипертензивного действия ангиотензина ll, и поэтому обладают сильной гипотензивной активностью при введении животным, в частности, млекопитающим (например, человеку, собакам, свиньям, кроликам, крысам и т.п.). Кроме того, соединения (l) настоящего изобретения и его соли имеют чрезвычайно низкую токсичность, и поэтому являются клинически ценным лекарственным средством для лечения не только гипертензии, но и также заболеваний сердечно-сосудистой системы, таких, как нарушения функций сердца и мозга, шоки, почечная недостаточность, нефриты и т.д. Для терапевтических целей соединения (l) и их соли могут быть введены перорально, парентерально, ректально, путем ингаляции или путем наружного применения в виде фармацевтических композиций или препаратов (например, порошков, гранул, таблеток, драже, капсул, растворов для инъекций, сиропов, эмульсий, эликсиров, суспензий, растворов и т.п.), содержащих, по крайней мере, одно соединение, взятое отдельно или в смеси с фармацевтически приемлемыми носителями, адъювантами, наполнителями, и/или разбавителями. Указанные фармацевтические композиции могут быть составлены в соответствии со стандартной фармацевтической техникой. Используемый в настоящем описании термин "парентеральное введение" означает способ введения путем подкожной инъекции, внутривенной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции, или путем инфузии. Препараты для инъекций, например, стерильные водные или маслянистые суспензии могут быть изготовлены стандартными способами с использованием соответствующих диспергирующих или смачивающих и суспендирующих агентов. Стерильные инъецируемые препараты могут быть также изготовлены в виде стерильных растворов или суспензий для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в воде. В качестве приемлемых наполнителей или растворителей могут быть использованы вода, раствор Рингера, и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды могут быть использованы стерильные жирные масла. Для этих целей могут быть использованы любые мягкие жирные масла или жирные кислоты, включая натуральные, синтетические или полусинтетические жирные масла или кислоты, и натуральные, синтетические или полусинтетические моно-, ди- или триглицериды. Суппозитории для ректального введения лекарственного средства могут быть получены путем смешивания активного компонента с соответствующим нераздражающим наполнителем, таким, как какао-масло и полиэтиленгликоли, которые при комнатных температурах яляются твердыми, а при введении их в прямую кишку плавятся до жидкого состояния, высвобождая тем самым лекарственное средство. В качестве твердых разовых лекарственных форм для перорального введения могут быть использованы препараты, изготовленные в виде порошков, гранул, таблеток, драже и капсул. В указанных твердых дозированных формах активный компонент может присутствовать в виде смеси, по крайней мере, с одной добавкой, такой, как сахароза, лактоза, целлюлоза, маннит, мальтит, декстран, крахмалы, агары, альгинаты, хитины, хитозаны, пиктины, трагакантовая камедь, аравийская камедь, желатины, коллагены, казеин, альбумин и синтетические или полусинтетические полимеры или глицериды. Указанные дозированные лекарственные формы могут также содержать помимо инертных разбавителей и другие добавки, такие, как замасливающие агенты, например, стеарат магния; консерванты, например, парабены и сорбиновая кислота; антиоксиданты, например, аскорбиновая кислота, a-токоферол и цистеин; дизинтегрирующие агенты, связующие, буферы, подслащивающие агенты, ароматизаторы и отдушки. Таблетки и драже могут быть, кроме того, покрыты энтеросолюбильным покрытием. Жидкие дозированные формы для перорального введения могут быть изготовлены в виде фармацевтически приемлемых эмульсий, сиропов, эликсиров, суспензий и растворов, содержащих инертные разбавители, обычно используемые в фармацевтической практике, например, такие, как вода. Конкретные дозы для каждого пациента зависят от многих факторов, например, таких, как активность конкретного соединения, возраст, вес тела, состояния здоровья, пол и питание пациента, способ и время введения, скорость выделения, сочетание лекарственных средств и тяжесть заболевания. Доза может варьироваться в зависимости от конкретного заболевания, симптомов, способов введения, и конкретного пациента, но, в основном, предпочтительная дневная доза составляет 1 - 50мг для перорального введения или 1 - 30мг для внутривенной инъекции, и может быть разделена на 2 - 3 приема для взрослого организма, Например, при использовании для лечения гипертензии взрослого человека, активный ингредиент предпочтительно вводят в количестве около 10 - 100мг в день перорально, и около 5 - 50мг в день внутривенно. Активный ингредиент, предпочтительно, вводят в равных дозах 2 или 3 раза в день. Примеры. Приведенные ниже примеры составления композиций, рабочие примеры, экспериментальные примеры и сравнительные примеры более подробно иллюстрируют настоящее изобретение, однако при этом возможны варианты и модификации, не выходящие за рамки существа настоящего изобретения. В описании настоящего изобретения используются следующие аббревиатуры: Me: метил; Et: этил; Tet: тетразолил; cycl: цикло-; Pr: пропил; Bu: бутил; Pen: пентил; Hex: гексил; Hep: гептил; Ph: фенил; (DMF) ДМФ: диметилформамид и (THF) ТГФ: тетрагидрофуран. Примеры композиций. Если соединение (l) настоящего изобретения используется в качестве терапевтического средства для лечения расстройств кровообращения, таких, как гипертензия, сердечно-сосудистые заболевания, шоки, заболевания почек и т.п., то оно может быть введено в виде следующих препаратов: 1. Капсулы. (1) 2-Этокси-1-[[2'-(1Н-тетразол-5ил)бифенил-4ил]метил]бензимидазол-7карбоновая кислота 10мг (2) Лактоза 90мг (3) Тонко измельченная 70мг кристаллическая целлюлоза (4) Стеарат магния 10мг Одна капсула 180мг Компоненты (1), (2), (3) и половину (4) смешивают и гранулируют. К полученным гранулам добавляют оставшуюся половину (4) и всю смесь вводят в желатиновую капсулу. 2. Таблетки. (1) 2-Этокси-1-[[2'-(1Н-тетразол-5ил)бифенил-4ил]метил]бензимидазол-7-карбоновая кислота 10мг (2) Лактоза 35мг (3) Кукурузный крахмал 150мг (4) Тонко измельченная кристаллическая целлюлоза 30мг (5) Стеарат магния 5мг Одна таблетка 230мг Компоненты (1), (2), (3), две трети компонента (4), и половину компонента (5) смешивают и гранулируют. К полученным гранулам добавляют оставшиеся части компонентов (4) и (5) и гранулы подвергают прямому прессованию. 3. Инъекции. (1) 2-Метилтио-1-[2'-(1Н-тетразол-5ил)бифенил-4ил]метил]бензимидазол-7-карбоновой кислоты динатриевая соль 10мг (2) Инозит 100мг (3) Бензиловый спирт 20мг Одна ампула 130мг Компоненты (1), (2) и (3) растворяли в дистиллированной воде для инъекций, в результате чего получали объем раствора 2мл, которым заполняли ампулы. Процесс изготовления раствора проводят в стерильных условиях. 4. Капсулы. (1) 1-(Циклогексилоксикарбонилокси)этил-2-этокси-1-[[2'-(1Н-тетразол-5ил)бифенил-4ил]метил]бензимидазол-710мг карбоксилат (2) Лактоза 90мг (3) Тонко измельченная кристаллическая целлюлоза 70мг (4) Стеарат магния 10мг Одна капсула 180мг Компоненты (1), (2), (3) и половину компонента (4) смешивали и гранулировали. К гранулам добавляли оставшуюся половину (4), и полученными гранулами наполняли желатиновые капсулы. 5. Таблетки. (1) 1-(Циклогексилоксикарбонилокси)этил-2-этокси-1-[[2'-(1Н-тетразол-5ил)бифенил-4-ил]метил]бензимидазол-7-карбоксилат 10мг (2) Лактоза 35мг (3) Кукурузный крахмал 150мг (4) Тонко измельченная кристаллическая целлюлоза 30мг (5) Стеарат магния 5мг Одна таблетка 230мг Компоненты (1), (2), (3), две трети компонента (4) и половину компонента (5) смешивали и гранулировали. К гранулам добавляли оставшиеся части (4) и (5), и поученные гранулы подвергали прямому прессованию. 6. Инъекции. (1) 2-Этокси-1-[[2'-(1Н-тетразол-5ил)бифенил-4ил]метил]бензимидазол-7-карбоновой кислоты динатриевая соль 10мг (2) Инозит 100мг (3) Бензиловый спирт 20мг Одна ампула 130мг Компоненты (1), (2) и (3) растворяли в дистиллированной воде для инъекций, в результате чего получали объем раствора 2мл, которым заполняли ампулы. Процесс изготовления раствора проводили в стерильных условиях. Сравнительный пример 1. 2-Пропоксибензиимидазол. К раствору о-фенилендиамина (2г) в пропилортокарбонате (5мл) добавляли уксусную кислоту (1,1мл) и полученный раствор размешивали в течение 3 часов при 80°C. К реакционной смеси добавляли этилацетат и раствор промывали водным раствором бикарбоната натрия и водой, затем высушивали сульфатом натрия и концентрировали досуха. Концентрат очищали с помощью колоночной хроматографии на силикагеле и получали кристаллический продукт. После перекристаллизации указанного продукта из смеси этилацетата и бензола получали бесцветные кристаллы (1,54г, 47%), т.пл. 163 - 164°C. Сравнительный пример 2. Этил-2-карбокси-3-нитробензоат. Смесь 3-нитрофталевой кислоты (35г) в этаноле (300мл), содержащем конц. серную кислоту (20мл) нагревали в сосуде с обратным холодильником в течение 24ч. Растворитель выпаривали в вакууме, а остаток выливали в холодную воду (700мл). Смесь экстрагировали этилацетатом. Органический слой промывали водой и взбалтывали с водным раствором карбоната калия. Водный слой подкисляли соляной кислотой и полученную смесь экстрагировали метиленхлоридом. Органический слой промывали водой, осушали, а растворитель выпаривали. Полученный твердый продукт (29г), 74% использовали в следующей реакции без очистки. 1 Н-ЯМР (90МГц, CDCl3) d: 1,43 (3Н, т); 4,47 (2Н, кв); 7,70 (1Н, т); 8,40 (2Н, д); 9,37 (1Н, шир.с.). ИК (Hujol), см-1: 1725, 1535, 1350,1300, 1270. Сравнительный пример 3. Этил-2-т-бутоксикарбониламино-3-нитробензоат. Смесь этил-2-карбокси-3-нитробензоата (23,9г) и тионилхлорида (12мл) в бензоле (150мл) нагревали в колбе с обратным холодильником в течение 3ч. После чего реакционную смесь концентрировали досуха. Полученный в результате хлорангидрид (26г, количественный) растворяли в метиленхлориде (20мл). Раствор по капле добавляли к смеси азида натрия (9,75г) в ДМФ (20мл), при этом энергично размешивая. Реакционную смесь выливали в смесь простого эфира и гексана (3 : 1, 200мл) и воду для отделения двух слоев. Органический слой промывали водой, осушали и растворитель выпаривали. Остаток растворяли в т-бутаноле (200мл), и раствор постепенно нагревали, перемешивая, после чего этот раствор нагревали с обратным холодильником в течение 2ч. Реакционную смесь концентрировали в вакууме и получали в результате маслянистый продукт (30г). 1 Н-ЯМР (90МГц, CDCl3) d: 1,40 ((3Н, т); 1,53 (9Н, с); 4,43 (2Н, кв); 7,23 (1Н, т); 8,03 - 8,27 (2Н, м); 9,70 (1Н, шир.с.). ИК (чистый), см-1: 3320, 2980, 1740, 1585, 1535, 1500, 1440, 1375, 1265, 1155. Рабочий пример 1. Этил 2-[[2'-цианобифенил)]амино]-3-нитробензоат. К раствору этил 2-т-бутоксикарбониламино-3-нитробензоата (20г) в тетрагидрофуране (50мл) добавляли, перемешивая при охлаждении льдом, гидрид натрия (60% - ная дисперсия в минеральном масле, 2,8г). Смесь размешивали 20мин при комнатной температуре, после чего к этой смеси добавляли 4-2-цианофенил бензил бромид (18г) и иодид калия (360мг), и полученную смесь нагревали в сосуде с обратным холодильником в течение 10ч. После чего растворитель выпаривали досуха, а остаток распределяли между водой (250мл) и простым эфиром (200мл). Органический слой промывали водой, осушали и концентрировали, в результате чего получали желтый сироп. Этот сироп растворяли в смеси трифторуксусной кислоты (60мл) и метиленхлориде (40мл) и полученный раствор размешивали 1ч при комнатной температуре. Реакционную смесь концентрировали досуха, а в остаток добавляли простой эфир (200мл), в результате чего получали кристаллы. Эти кристаллы собирали фильтрацией, промывали простым эфиром и получали бледно-желтые кристаллы (22,1г, 85%), т.пл, 118 - 119°C. 1 Н-ЯМР (90МГц, CDCl3) d: 1,37 (3Н, т), 4,23 (2Н, с); 4,37 (2Н, кв),6,37 (1Н, т); 7,33 - 7,83 (9Н, м); 7,97 - 8,20 (2Н, м). ИК (Hujol), см-1: 3280, 2220, 1690,1575, 1530, 1430, 1450, 1255, 1105, 755. Рабочий пример 2. Этил 3-амино-2-[[(2'-цианобифенил-4-ил)метил]амино]бензоат. К раствору этил 2-[[(2'-цианобифенил-4-ил)метил]-амино]нитробензоата (10,4г) в этаноле (50мл) добавляли дигидрат двуххлористого олова (28,1г) и полученную смесь размешивали при 80°C в течение 2ч. Растворитель выпаривали досуха. К охлажденной льдом смеси остатка в етилацетате (300мл) по капле добавляли 2н NaOH (500мл), размешивая при этом. Водный слой экстрагировали этилацетатом (200мл ´ 2). Органические слои объединяли, промывали водой и осушали. Растворитель выпаривали досуха, а остаток очищали с помощью колоночной хроматографии на силикагеле, в результате чего получали кристаллы. После перекристаллизации этих кристаллов из смеси ацетата и гексана получали бесцветные кристаллы (7,3г, 79%), т.пл. 104 - 105°C. 1 Н-ЯМР (200МГц, COCl3) d: 1,33 (3Н, т), 4,23 (2Н, с); 4,27 (2Н, кв); 6,83/6,93 (2Н, м); 7,35 - 7,55 (7Н, с); 7,64 (1Н, дт); 7,76 (дд). ИК (KBr), см-1: 3445, 3350, 2220, 1680, 1470, 1280, 1240, 1185, 1160, 1070, 1050, 1020, 805, 750. Рабочий пример 3. Этил 1-[(2'-цианобифенил-4-ил)метил]-2-метоксибензимидазол-7-карбоксилат. Уксусную кислоту (0,2г) добавляли к раствору этил 3-амино-2-[[(2'-цианобифенил-4-ил)метил]амино]бензоата (1,1г) в метилортокарбонате (5мл). Смесь размешивали 1ч при 80°C. Реакционную смесь концентрировали, а концентрат экстрагировали этил ацетатом. Органический слой промывали водным раствором бикарбоната натрия и водой. Растворитель выпаривали в вакууме и получали кристаллы, после перекристаллизации которых из этилацетатабензоата получали бесцветные кристаллы (1,09г, 90%), т.пл. 160 - 16ГС. 1 ЯМР (200МГц; CDCl3) d: 1,23 (3Н, т); 4,23 (2Н, кв); 4,26 (3Н, с); 5,72 (2Н, с); 7,09 (2Н, д); 7,20 (1Н, т); 7,38 - 7,48 (4Н, м); 7,58 - 7,66 (2Н, м); 7,73 - 7,79 (2Н, м). ИК (KBr), см-1: 3000, 2220, 1725, 1560, 1465, 1440, 1415, 1285, 1250, 1220, 1040, 760, 750, 740. Рабочий пример 4. Этил 1-[(2'-цианобифенил-4-ил)метил]-2-этоксибензимидазол-7-карбоксилат. Уксусную кислоту (0,2г) добавляли к раствору этил 3-амино-2-н-[[(2'-цианобифенил-4ил)метил]амино]бензоата (1,0г) в этилортокарбонате (5мл). Смесь размешивали при 80°C в течение 1ч. Реакционную смесь концентрировали, а концентрат растворяли в этилацетате. Раствор промывали водным раствором бикарбоната натрия и водой. После выпаривания растворителя получали кристаллы. В результате перекристаллизации из смеси этилацетата и бензола получали бесцветные кристаллы (0,79г, 69%), т.пл. 131 132°C. Элементный анализ для C26H23 N3O3 Вычислено, %: C 73,39; H 5,45; N 9,88 Найдено, %: C 73,36; H 5,42; N 9,83 1 H-ЯМР (200МГц, CDCl3) d: 1,24 (3Н, т); 1,49 (3Н, т); 4,24 (2Н, кв); 4,68 (2Н, кв); 5,72 (2Н, с); 7,10 (2Н, д); 7,19 (1Н, т); 7,38 - 7,46 (4Н, м); 7,56 - 7,66 (2Н, м); 7,73 - 7,77 (2Н, м). ИК (KBr), см-1: 2220, 1720, 1550, 1480, 1430, 1280, 1245, 1215, 1040, 760, 740. Рабочий пример 5. Этил 1-[(2'-цианобифенил-4-ил)метил]-2-пропоксибензимидазол-7-карбоксилат. Уксусную кислоту (0,2г) добавляли к раствору этил-3-амино-2-н-[[(2'-цианобифенил-4ил)метил]амино)бензоата (0,9г) в пропилортокарбонате (5мл). Смесь размешивали 1ч при 80°C. Реакционную смесь концентрировали, а концентрат растворяли в этилацетате. Раствор промывали водным раствором бикарбоната натрия. Растворитель выпаривали и получали кристаллы. После перекристаллизации из смеси этилацетата и бензола получали бесцветные кристаллы (0,72г, 68%), т.пл. 90 - 92°C. Элементный анализ для C27H25 N3О3 Вычислено, %: C 73,79; H 5,73; N 9,56 Найдено, %: C 73,84; H 5,79; N 9,54 1 Н-ЯМР (200МГц, CDCl3) d: 1,01 (3Н, т); 1,25 (3Н, т); 1,80 - 1,97 (2Н, м); 4,24 (2Н, кв); 4,57 (2Н, кв); 5,72 (2Н, с); 7,11. (2Н, д); 7,19 (ІН, т); 7,38 - 7,46 (4Н, м); 7,56 - 7,66 (2Н, м); 7,73 - 7,77 (2Н, м). ИК (KBr), см-1: 2220, 1725, 1550, 1480, 1460, 1430, 1370, 1280, 1245, 1210, 1115, 1040, 760, 750, 740. Рабочий пример 6. Этил 1-[(2'-цианобифенил-4-ил)метил]-2-меркаптобензимидазол 7-карбоксилат. Смесь этил 3-амино-2-N-[[(2'-цианобифенил-4-ил)метил]амино]бензоата (5,6г) и O-этилдитиокарбоната натрия (7,3г) в этаноле (50мл) нагревали в сосуде с обратным холодильником в течение 8ч. Реакционную смесь концентрировали, а остаток растворяли в воде. pH раствора доводили до 3 - 4 с помощью соляной кислоты. Осаждающиеся кристаллы собирали фильтрацией и получали желтые кристаллы (5,0г, 80%), т.пл. 225 -227°C. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 1,08 (3Н, т); 4,12 (2Н, кв); 5,90 (2Н, шир.с); 7,08 (2Н, д); 7,27 (1Н, т); 7,38 - 7,59 (6Н, м); 7,76 (1Н, дт); 7,92 (1Н, дд). ИК (KBr), см-1: 2210, 1720, 1460, 1440, 1420, 1375, 1335, 1265, 1180, 1135, 1115, 1100, 985, 760, 740. Сравнительный пример 4. Метил 2-[[(2'-цианобифенил)метил]амино]-3-нитробензоат. Смесь этил 2-[[(2'-цианобифенил)метил]амино]-3-нитробензоата (5г) и гидрида натрия (60% дисперсия в минеральном масле, 1,62г) в метаноле (50мл) размешивали при комнатной температуре в течение 1 дня. Реакционную смесь концентрировали, а остаток выливали в насыщенный водный раствор бикарбоната натрия (100мл), после чего экстрагировали хлороформом. Органический слой промывали водой, осушали и концентрировали досуха, в результате чего получали кристаллы, после перекристаллизации которых из смеси этилацетата и гексана получали бледно-желтые кристаллы (2,01г, 86%), т.пл. 168,5 - 169,5°C. Элементный анализ. Вычислено, %: C 72,98; H 5,14; N 10,21. Найдено, %: C 72,71; H 5,12; N 9,97. 1 Н-ЯМР (200МГц, CDCl3) d: 1,42 (3н, т, J = 7,1Гц); 3,71 (3Н, с); 4,63 (2Н, кв, J = 7,1Гц); 5,59 (2Н, с); 7,09 (2Н, д, J = 8,4Гц); 7,20 (1Н, т, J = 7,9Гц); 7,45 - 7,59 (5Н, м); 7,69 - 7,80 (2Н, м); 7,92 (1Н, дд, J = 1,4; 7,8Гц). ИК (KBr), см-1: 2225, 1725, 1550, 1480, 1430, 1350, 1280, 1250, 1040, 760, 750. Сравнительный пример 5. Этил 2-([(2'-цианобифенил-4-ил)метил]амино]-3-(3-этилтиоуреидо)бензоат. Смесь этил 3-амино-2-[[(2'-цианобифенил-4-ил)метил]амино]бензоата (1,6г), этилизотиоцианата (1,5мл) и этанола (1мл) размешивали при комнатной температуре в течение 3 дней. Реакционную смесь растворяли в этилацетате и раствор промывали водой, осушали и концентрировали досуха, в результате чего получали кристаллы После перекристаллизации из смеси этилацетата и гексана получали светло-желтые кристаллы (1,92г, 91%), т.пл. 108 - 110°C. 1 Н-ЯМР (200МГц, CDCl3) d: 1,15 (3Н, т); 1,40 (3Н, т); 3,50 - 3,70 (2Н, шир.с); 4,37 (2Н, кв); 4,56 (2Н, д); 6,07 (1Н, т); 6,78 (1Н, т); 7,19 - 7,24 (1Н, м); 7,38 - 7,53 (6Н, м); 7,63 (1Н, дт); 7,72 - 7,76 (1Н, м); 7,99 (1Н, дд); 8,29 (1Н, шир.с). ИК (KBr), см-1: 3375, 3320, 3150, 2975, 2220. 1740, 1680, 1540, 1510, 1450, 1300, 1225, 1180, 1150, 760, 750. Сравнительный пример 6. Этил 2-[((2'-цианобифенил-4-ил)метил]амино]-3-3-пропилтиоуреидо)бензоат. Способом, в основном, аналогичным описанному в сравнительном примере 5, получали целевое соединение в виде бледно-желтого сиропа (2,0г, 98%) из этил 3-амино-2-[[(2'-цианобифенил-4-ил-метил]амино]бензоата (1,6г), пропилизотиоцианата (1,5мл) и этанола (1мл). 1 Н-ЯМР (200МГц, CDCl3) d: 0,88 (3Н, т); 1,40 (3Н, т): 1,48 - 1,67 (2Н, м); 3,42 - 3,68 (2Н, шир.с.); 4,37 (2Н, кв); 4,56 (2Н, д); 6,13 (1Н, т); 6,78 (1Н,т); 7,21 - 7,25 (1Н, м); 7,36 - 7,53 (6Н, м); 7,64 (1Н, дт); 7,73 - 7,77 (1Н, м); 7,99 (1Н, дд); 8,20 - 8,40 (1Н, шир.с). ИК (чистый), см-1: 3325, 3175, 2960, 2030, 2875, 2220, 1710, 1690, 1590, 1475, 1360, 1175, 1140, 1090, 1020, 760. Рабочий пример 8. Этил 1-[2'-цианобифенил-4-ил)метил]-2-этиламинобензимидазол 7-карбоксилат. Метилиодид (4,5г) добавляли к раствору этил 2-[[(2'-цианобифенил-4-ил)метил]амино]-3(этилтиоуреидо)бензоата (1,8г) в этаноле (50мл), и смесь нагревали в сосуде с обратным холодильником в течение 12ч. К полученной реакционной смеси добавляли 1н. HCl (60мл) и смесь размешивали 30мин при комнатной температуре. Реакционную смесь концентрировали досуха, а концентрат растворяли в этилацетате. Раствор промывали водным раствором бикарбоната натрия и водой и осушали. Растворитель выпаривали досуха, а остаток очищали с помощью колоночной хроматографии на силикагеле, в результате чего получали желтый сироп (0,96г, 58%). 1 Н-ЯМР (200МГц, CDCl3) d: 1,23 (6Н, т); 3,48 - 3,62 (2Н, м); 4,09 (1Н, т); 4,23 (2Н, кв.); 5,57 (2Н, с); 7,15 (1Н, т); 7,25 (2Н, д); 7,40 - 7,77 (8Н, м). ИК (чистый), см-1: 3400, 3225, 2975, 2930, 2210, 1710, 1610, 1570,1480, 1425, 1365, 1320, 1270, 1250, 1210, 1130, 1100, 1060, 770, 750. Рабочий пример 9. Этил 1-[(2'-цианобифенил-4-ил)метил]-2-пропиламинобензимидазол-7-карбоксилат. Способом, в основном, аналогичным описанному в рабочем примере 8, из раствора этил 2-[((2'цианобифенил-4-ил)метил)амино]-3-(3-пропилтиоуреидо) бензоата (2,0г) и метилиодида (4,8г) в этаноле (50мл) получали целевое соединение в виде желтого сиропа (1,2г, 65%). 1 Н-ЯМР (200МГц, CDCl3) d: 0,87 (3Н, т), 1,25 (6Н, т); 1,52 - 1,70 (2Н, м); 3,42 - 3,52 (2Н, м); 4,12 (1Н, т); 4,25 (2Н, кв); 5,58 (2Н, с); 7,16 (1Н, т); 7,29 (2Н, д); 7,41 - 7,78 (8Н, м). ИК (чистый), см-1: 3400, 3250, 2975, 2950, 2890, 2225, 1715, 1620, 1590, 1570, 1480, 1430, 1370, 1285, 1220, 1135, 1070, 760. Рабочий пример 10. Метил 1-[(2'-цианобифенил-4-ил)метил]-2-метоксибензимидазол-7-карбоксилат. Раствор 5,2М метоксида натрия в метаноле (0,5мл) добавляли к раствору этил 1-[[(2'-цианобифенил-4ил)метил]-2-метоксибензимидазол-7-карбоксилата (1,3г) в метаноле (50мл). Смесь нагревали в сосуде с обратным холодильником в течение 4 часов. Затем реакционную смесь концентрировали, а осажденные кристаллы собирали фильтрацией. После перекристаллизации из метанола получали призмообразные бесцветные кристаллы (1,1г, 85%), т.пл. 149 - 150°C. Элементный анализ для C24H19 N3O3 Вычислено, %: C 72,53; H 4,82; N 10,57. Найдено, %: C 72,38; H 4,93; N 10,44. 1 Н-ЯМР (200МГц, CDCl3) d: 3,75 (3Н, с); 4,26 (3Н, с); 5,69 (2Н, с); 7,09 (2Н, д); 7,23 (1Н, т); 7,37 - 7,46 (3Н, м); 7,55 - 7,65 (2Н, м); 7,72 - 7,78 (2Н, м). Сравнительный пример 7. Метил 2-[[(2'-цианобифенил-4-ил)метил]амино]-3-(3-метилтиоуреидо) бензоат. Вышеуказанное соединение синтезировали с выходом (36%) в основном, способом, аналогичным описанному в сравнительном примере 5, т.пл, 152 - 155°C. 1 Н-ЯМР (200МГц, CDCl3) d: 3,05 - 3,07 (3Н, шир.с); 3,92 (3Н, с); 4,58 (2Н, д); 6,04 - 6,08 (1Н, шир.с.); 6,77 (1Н, т); 7,22 - 7,26 (1Н, м); 7,39 - 7,52 (6Н, м); 7,63 (1Н, дт); 7,75 (1Н, дд); 7,97 (1Н, дд); 8,28 (1Н, шир.с). ИК (KBr), см-1: 3375, 3325, 3175, 2220, 1680, 1590, 1540, 1500, 1480, 1450, 1435, 1265, 1230, 1190, 1145, 1050, 830, 760, 740. Рабочий пример 11. Метил 1-[(2'-цианобифенил-4-ил)метил]-2-метиламинобензимидазол 7-карбоксилат. Вышеуказанное соединение получали в виде сиропа (с выходом 42%) способом, в основном, аналогичным способу, описанному в рабочем примере 8. 1 Н-ЯМР (200МГц, CDCl3) d: 3,11 (3Н, д); 3,73 (3Н, с); 4,22 (1Н, кв); 5,54 (2Н, с); 7,17 (1Н, т); 7,27 (2Н, д); 7,41 7,79 (8Н, м). ИК (чистый), см-1: 3400, 3250, 3025, 2950, 2220, 1720, 1625, 1610, 1580, 1480, 1410, 1340, 1280, 1240, 1210, 1130, 1060, 750. Сравнительный пример 8. 2-Пропокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил)метил]бензимидазол. Гидрид натрия (60% дисперсия в минеральном мзсле, 0,24г) добавляли к размешанному раствору 2пропоксибензимидазола (0,71г) в ДМФ (10мл) в условиях охлаждения льдом. Смесь размешивали 20мин, после чего к ней добавляли N-трифенилметил-5-[2-(4-бромметилбифенил)]тетразол (2,3г) и полученную смесь размешивали 5 часов при комнатной температуре. Затем к реакционной смеси добавляли ледяную воду, и смесь экстрагировали этилацетатом. Органический слой промывали водой, осушали и концентрировали досуха. Концентрат растворяли в метаноле (50мл), к раствору добавляли 1н. HCl (15мл), и смесь размешивали 2 часа при 60°C. Реакционную смесь концентрировали, затем добавляли воду (15мл) и этилацетат (15мл). Смесь подщелачивали с помощью 1н. NaOH и взбалтывали. Водный слой доводили до pH 3 - 4 с использованием 1н. HCl, а затем экстрагировали хлороформом. Органический слой промывали водой, осушали и концентрировали досуха. Концентрат очищали с помощью колоночной хроматографии на силикагеле и получали кристаллы. После перекристаллизации из смеси этилацетата и метанола получали бесцветные кристаллы (0,58г, 35%), т.пл. 177 179°C (разл.). Элементный анализ для C24H22 N6O Вычислено, %: C 70,23; H 5,40; N 20,47 Найдено, %: C 69,93; H 5,43; N 20,22 1 Н-ЯМР (200МГц, ДМСО-d6) d: 0,95 (3Н, т); 1,70 - 1,88 (2Н, м); 4,46 (2Н, т); 5,23 (2Н, с); 7,04 - 7,10 (4Н, м); 7,20 (2Н, д), 7,38 - 7,43 (2Н, м); 7,48 - 7,70 (4Н, м). ИК (KBr), см-1: 1540, 1535, 1485, 1450, 1425, 1385, 1285, 1270, 1040, 980, 7556, 745. Рабочий пример 12. Метил 2-бутиламино-1-[(2'-цианобифенил-4-ил)метил]бензимидазол-7-карбоксилат. Целевое соединение получали из метил[1(2'-цманобифенил-4-ил)метил)амино)-3-(бутилуреидо) бензоата способом, в основном, аналогичным способу, описанному в рабочем примере 8. Выход был количественным. 1 Н-ЯМР (200МГц, СОСl3) d: 0,89 (3Н, т); 1,21 - 1,39 (2Н, м); 1,45 - 1,60 (2Н, м); 3,50 - 3,65 (3Н, шир.с); 3,92 (3Н, с); 4,56 (2Н, д); 6,08 (1Н, т); 6,78 (1Н, т); 7,21 - 7,30 (1Н, м); 7,39 - 7,54 (6Н, м); 7,64 (1Н, дт); 7,75 (1Н, дд); 7,98 (1Н, дд); 8,26 (1Н, шир.с). Рабочий пример 13. Метил 2-(N-этилметиламино)-1-[(2'-цианобифенил-4-ил)метил)бензимидазол-7карбоксилат. Смесь гидрида натрия (60% дисперсия в минеральном масле, 0,13г) в ДМФ (5мл) размешивали при охлаждении льдом 5мин, и после добавления к этой смеси метил 2-этиламино-1-[(2'-цианобифенил-4ил)метил]бензимидазол-7-карбоксилата (0,95г) смесь размешивали еще 10мин. После чего к смеси добавляли метилиодид (0,2мл), и размешивали 10мин. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Экстракт разбавляли водой, осушали и выпаривали досуха. Остаток очищали колоночной хроматографией на силикагеле и получали сырые кристаллы, после перекристаллизации которых из этилацетата-гексана получали бесцветные иглообразные кристаллы (0,83г, 82%), т.пл. 66 - 69°C. 1 Н-ЯМР (200МГц, CDCl3) d: 1,25 (3Н, т); 3,03 (3Н, с); 3,36 (2Н, кв); 3,73 (3Н, с); 5,60 (2Н, с); 6,88 (2Н, д); 7,16 (1Н, т); 7,34 - 7,49 (5Н, м); 7,59 (1Н, дт); 7,73 (1Н, дд); 7,78 (1Н, дд). ИК (KBr), см-1: 2210, 1710, 1540, 1530, 1435, 1420, 1385, 1300, 1275, 1250, 1005, 760. Сравнительный пример 9. Метил 1-[(2'-цианобифенил-4-ил)метил]-2-оксо-2,3-дигидробензимидазол-7карбоксилат. К раствору метил 2-[(2'-цианобифенил-4-ил)метиламино]-3-метоксикарбониламинобензоата (10,5г) в метаноле (100мл) добавляли NaOMe (10г), и смесь нагревали в сосуде с обратным холодильником 20ч. Реакционную смесь нейтрализовали с использованием 1н. HCl и концентрировали досуха. Остаток экстрагировали смесью хлороформа и воды и получали бесцветные иглоообразные кристаллы (8,67г, 89%), т.пл. 250 - 253°C. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 3,65 (3Н, с); 5,35 (2Н, с); 7,04 - 7,16 (3Н, м); 7,24 - 7,28 (2Н, м); 7,48 - 7,59 (4Н, м); 7,76 (1Н, дт); 7,92 (1Н, дд). ИК (KBr), см-1: 2210, 1720, 1690, 1635, 1430, 1390, 1270, 1255, 760, 750, 730, 690. Сравнительный пример 10. Метил 2-хлоро-1-[(2'-цианобифенил-4-ил)метил]бензимидазол-7-7-карбоксилат. Смесь метил 1-[(2'-цианобифенил-4-ил)метил]-2-оксо-2,3-дигидробензимидазол-7-карбоксилата (8,02г) в оксихлориде фосфора (30мл) нагревали в сосуде с обратным холодильником в течение 8ч. Реакционную смесь концентрировали и полученный остаток выливали в ледяную воду. Смесь экстрагировали хлороформом. Экстракт промывали водой, осушали и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле, в результате чего получали кристаллы, а после их перекристаллизации из смеси хлороформа и метанола получали бесцветные иглобразные кристаллы (2,2г, 28%), т.пл. 154-157°C. 1 Н-ЯМР (200МГц, CDCl3) d: 3,78 (3Н, с); 5,95 (2Н, с); 7,06 (2Н, д); 7,31 (1Н, т); 7,39 - 7,48 (4Н, м); 7,58 - 7,66 (1Н, м); 7,71 - 7,77 (2Н, м); 7,93 (1Н, дд). ИК (KBr), см-1: 2240, 1720, 1480, 1440, 1425, 1370, 1350, 1290, 1270, 1200, 1150, 1120, 1000, 775, 760, 750. Сравнительный пример 11. Метил 2-[(2'-цианобифенил-4-ил)метиламино]-3-метоксикарбониламинобензоат. К размешанному раствору метил 3-амино-2-[(2'-цианобифенил-4-ил) метиламино]бензоата (10г) в пиридине (50мл) по капле добавляли метилхлороформат (9,0мл) при охлаждении льдом. Смесь размешивали при комнатной температуре в течение 3ч, а затем концентрировали. Остаток экстрагировали этилацетатом. Экстракт промывали водой, осушали и выпаривали. После чего остаток перекристаллизовывали из смеси этилацетата и гексана и получали бледно-желтые иглообразные кристаллы (10,5г, 90%), т.пл. 113 - 115°C. 1 Н-ЯМР (200МГц, CDCl3) d: 3,80 (3Н, с); 3,83 (3Н, с); 4,11 (2Н, д); 6,29 (1Н, шир.с); 7,09 (1Н, т); 7,40 - 7,80 (10Н, м); 8,19 (1Н, д). Рабочий пример 14. Метил 1-[(2'-цианобифенил-4-ил)метил]-2-морфолинобензимидазол-7-карбоксилат. Смесь метил 2-хлоро-1-[(2'-цианобифенил-4 ил)метил]бемзимидазол-7-карбоксилата (0,8г) в морфолине (15мл) размешивали 2 часа при 100°C и полученную реакционную смесь концентрировали досуха. Остаток экстрагировали этилацетатом. Экстракт промывали водой, осушали и выпаривали. Полученные кристаллы перекристаллизовывали из смеси этилацетата и гексана и получали в результате бесцветные призмообразные кристаллы (0,69г, 77%). 1 Н-ЯМР (200МГц, CDCl3) d: 3,33 (4Н, т); 3,72 (3Н, с); 3,90 (4Н, т); 5,63 (2Н, с); 6,89 (2Н, д); 7,20 (1Н, т); 7,37 7,65 (6Н, м); 7,74 (1Н, дд); 7,82 (1Н, дд). ИК (KBr), см-1: 2225, 1715, 1520, 1440, 1415, 1280, 1260, 1220, 1130, 1120, 1010, 860, 770, 760, 750. Рабочий пример 15. Метил 1-[(2'-цианобифенил-4-ил)метил]-2-пиперидинобензимидазол-7-карбоксилат. Целевое соединение получали способом, аналогичным способу, описанному в рабочем примере 14. Выход: 81%, 119 - 121°C. 1 Н-ЯМР (200МГц, CDCl3) d: 1,62 - 1,77 (6Н, м); 3,31 - 3,36 (4Н, м); 3,73 (3Н, с); 5,58 (2Н, с); 6,88 (2Н, д); 7,15 (1Н, т); 7,35 - 7,49 (5Н, м); 7,56 - 7,64 (1Н, м); 7,73 (1Н, дц); 7,79 (1Н, дд). ИК (KBr), см-1: 2225, 1720, 1530, 1445, 1410, 1385, 1305, 1285, 1265, 1250, 1130, 1110, 770, 750. Сравнительный пример 12. Метил 2-[(2'-метоксикарбонилбифенил-4-ил)метиламино]-3-нитробензоат. К раствору метил 2-трет-бутоксикарбониламино-3-нитробензоата (1,84г) в ацетонитриле (10мл) добавляли раствор 4-(2'-метоксикарбонилбифенил-4-ил) метилбромида (1,9г) в ацетонитриле (5мл) и карбоната калия (0,86г), после чего реакционную смесь нагревали в сосуде с обратным холодильником в течение 20ч. Реакционную смесь концентрировали досуха и полученный остаток экстрагировали этилацетатом и водой. Органический слой промывали водой, осушали и выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле и получали бледно-желтый сироп. Этот сироп растворяли в этаноле (10мл) и к раствору добавляли 20% соляную кислоту в этаноле (4мл). Реакционную смесь размешивали 22ч при комнатной температуре и концентрировали досуха. Остаток растворяли в этилацетате, и ратвор промывали насыщенным водным бикарбонатом натрия, осушали и выпаривали, в результате чего получали желтый сироп (1,39г, 53%). 1 Н-ЯМР (200МГц, CHCl3) d: 3,61 (3Н, с); 3,89 (3Н, с); 4,21 (2Н, д); 6,72 (1Н, т); 7,30 (4Н, д); 7,36 (1Н, дд); 7,42 (1Н, дд); 7,53 (1Н, дд); 7,82 (1Н, дд); 8,00 (1Н, дд); 8,10 (1Н, дд). Сравнительный пример 13. Метил-3-амино-2-[(2'-метоксикарбонилбифенил-4-ил)метиламино]-бензоат. Целевое соединение получали в виде бледно-желтого сиропа из метил 2-[(2'-метоксикарбонилбифенил-4ил)метиламино]-3-нитробензоата способом, в основном, аналогичным способу, описанному в рабочем примере 2. Выход 79%. 1 Н-ЯМР (200МГц, CHCl3) d: 3,63 (3Н, с); 3,80 (3Н, с); 3,97 (2Н, шир.с); 4,22 (2Н, д); 6,40 (1Н, шир.с); 6,82 - 6,92 (2Н, м); 7,23 - 7,44 (7Н, м); 7,53 (1Н, дт); 7,79 - 7,83 91Н, м). ИК (чистый), см-1: 3450, 3360, 2970, 1730,1700, 1470, 1460, 1450, 1440, 1290, 1250, 1200, 770, 750. Рабочий пример 16. Метил 2-этокси-1-[(2'-метоксикарбонилбифенил-4-ил)метил]бензимидазол-7-карбоксилат. Целевое соединение получали в виде бесцветных пластинчатых кристаллов из метил 3-амино-2-[(2'метоксикарбонилбифенил-4-ил)метиламино] бензоата способом, в основном, аналогичным способу, описанному в рабочем примере 4. Выход 72%, т.пл. 112 - 113°C. 1 Н-ЯМР (200МГц, СНСl3) d: 1,50 (3Н, т); 3,55 (3Н, с); 3,77 (3Н, с); 4,68 (2Н, кв); 5,65 (2Н, с); 6,99 (2Н, д); 7,17 (2Н, д); 7,17 (1Н, т); 7,31 - 7,55 (4Н, м); 7,73 (1Н, дд); 7,77 (1Н, дд). ИК (чистый), см-1: 1730, 1710, 1545, 1470, 1430, 1380, 1340, 1320, 1270, 1250, 1235, 1210, 1120, 1080, 1030, 750, 740, 710. Рабочий пример 17. Метил 2-бутокси-1-[(2'-цианобифенил-4-ил)метил]бензимидазол-7-карбоксилат. Целевое соединение получали в виде бесцветных иглообразных кристаллов способом, в основном, аналогичным способу, описанному в рабочем примере 7. Выход 75%, т.пл. 74 - 75°C. 1 Н-ЯМР (200МГц, CDCl3) d: 0,95 (3Н, т); 1,35 - 1,54 (2Н, м); 1,77 - 1,90 (2Н, м); 3,76 (3Н, с); 4,60 (2Н, т); 5,69 (2Н, с); 7,10 (2Н, д); 7,17 (1Н, т); 7,43 (4Н, д); 7,54 - 7,65 (2Н, м); 7,74 (2Н, дд). ИК (KBr), см-1: 2220, 1725, 1560, 1490, 1470,1395, 1320, 1295, 1265, 1245, 1120, 1050, 1020, 770. Рабочий пример 18. Метил 2-аллилокси-1-[(2'-цианобифенил-4-ил)метил] бензимидазол-7-карбоксилат. Целевое соединение получали в виде бесцветных игольчатых кристаллов в соответствии с процедурой рабочего примера 7. Выход 73%, т.пл. 118 - 119°. 1 Н-ЯМР (200МГц, CDCl3) d: 3,76 (3Н, с); 5,12 (2Н, м); 5,33 (1Н, м); 5,43 (1Н, м); 5,72 (2Н, с); 6,02 - 6,21 (1Н, м); 7,11 (2H, д); 7,19 (1Н, т); 7,44 (4Н, д); 7,56 - 7,66 (2Н, м); 7,75 (2Н, дд). ИК (KBr), см-1: 2220, 1705, 1540, 1470, 1460, 1425, 1410, 1400, 1330, 1300, 1270, 1250, 1225, 1205, 1100, 1015, 995, 760, 750, 740, 730. Рабочий пример 19. Метил-2-этиламино-1-[(2'-цианобифенил-4-ил)метил]бензимидазол 7-карбоксилат. Целевое соединение получали в виде бесцветных кристаллов (3,2г, 32%) в соответствии с процедурой рабочего примера 8 из метил 2-[[(2'-цианофенил-4-ил)метил]амино]-3-(3-этилтиоуреидобензоата (10,5г), который, в свою очередь, получали в соответствии с процедурой сравнительного примера 5 из метил 3-амино-2-[[(2'цианобифенил-4-ил]метил] амино]бензоата. 1 Н-ЯМР (200МГц, CDCl3) d: 1,24 (3Н, т); 3,49 - 3,63 (2Н, м); 4,06 (1Н, т); 5,55 (2Н, с); 7,16 (1Н, т); 7,27 (2Н, д); 7,41 - 7,79 (8Н, м); ИК (KBr), см-1: 3275, 2225, 1720, 1620, 1610, 1580, 1570, 1480, 1350, 1275, 1240, 1215, 1100, 1070, 770, 760. Рабочий пример 20. 2-Циано-4'-метилбифенил. 20a): N-(2-Метоксифенил)метилиденциклогексиламин. Раствор аниазальдегида (21г) и циклогексиламина (15г) в хлороформе (100мл) размешивали при комнатной температуре в течение 2ч, а затем выпаривали, получая в результате коричневый сироп (35г, колич.). 1 Н-ЯМР (200МГц, CDCl3) d: 1,21 - 1,87 (10Н, м); 3,14 - 3,28 (1Н, м); 3,86 (3Н, с); 6,88 - 7,00 (2Н, м); 7,36 (1Н, м); 7,95 (2Н, дд); 8,75 (1Н, с). 20b): 4'-Метил-2-бифенилкарбальдегид. К суспензии металлического магния (1,1г) в ТГФ (3мл) по капле добавляли раствор 4-бромтолуола (7,5г) в ТГФ (10мл) в условиях мягкого орошения. Полученный раствор реактива Гриньяра по капле добавляли в охлажденный льдом размешанный раствор N(-2-метоксифенил) метилиденциклогексиламина (4,3г) в ТГФ (30мл). Реакционную смесь размешивали 1,5ч при комнатной температуре, а затем нагревали при орошении в течение 7ч. После добавления холодной воды реакционную смесь подкисляли с использованием конц. соляной кислоты. После чего реакционную смесь экстрагировали этилацетатом, и экстракт промывали 1н. HCl и водой, осушали и выпаривали досуха. Остаток очищали с помощью колоночной хроматографии на силикагеле и получали бледножелтый сироп (2,0г, 51%). 1 Н-ЯМР (200МГц, CDCl3) d: 2,43 (3Н, с); 7,28 (4Н, с); 7,42 - 7,51 (2Н, м); 7,63 (1Н, т); 8,02 (1Н, д); 10,00 (1Н, с). 20c): 2-Циано-4'-метилбифенил. Смесь 4-метил-2-бифенилкарбальдегида (2,0г) и гидрохлорида гидроксиамина (1,0г) в пиридине (10мл) размешивали 15мин при комнатной температуре, после чего добавляли ангидрид уксусной кислоты (4,1г). Реакционную смесь размешивали 1ч при 90 - 100°C и концентрировали досуха. К остатку добавляли воду, а осажденные кристаллы собирали фильтрацией. После перекристаллизации из гексана получали бесцветные игольчатые кристаллы (1,5г, 79%). 1 Н-ЯМР (90МГц, CDCl3) d: 2,40 (3Н, с); 7,2 - 7,8 (8Н, м). Целевое соединение может быть легко превращено в соединение (llla') в соответствии со способами, описанными в указанных выше ссылках. Рабочий пример 21. Метил 2-карбокси-3-нитробензоат. К суспензии 3-нитрофталевой кислоты (211г) и метилортоформата (127г) в метаноле (420мл) добавляли по капле конц. серную кислоту (20мл), размешивая при этом. Реакционную смесь нагревали при орошении в течение 18 часов, а затем концентрировали досуха. После добавления к остатку воды (30мл), смесь размешивали 1ч при 3 - 10°C. Осажденные кристаллы перекристаллизовывали из смеси этилацетата и гексана и получали бледножелтые призмообразные кристаллы (185г, 82%), т.пл. 166 - 168°C. 1 Н-ЯМР (200МГц, CDCl3) d: 4,03 (3Н, с); 7,74 (1Н, т); 8,39 (1Н, дд); 8,42 (1Н, дд). Рабочий пример 22. Метил 2-карбокси-3-нитробензоат. К раствору метил 2-карбокси-3-нитробензоата (7,23г) в ДМФ (50мл) добавляли дифенилфосфорилазид (11,3г) при комнатной температуре, а затем к размешанной реакционной смеси по капле добавляли триэтиламин (6,7мл). После размешивали при комнатной температуре в течение 3ч, к размешанной реакционной смеси добавляли трет-бутанол (54мл). После перемешивания при комнатной температуре 30мин, реакционную смесь постепенно нагревали при орошении в течение 1ч и выпаривали досуха. Полученный остаток растворяли в этилацетате, промывали разбавленной соляной кислотой, водным бикарбонатом натрия, и водой, а затем осушали. После выпаривания растворителя, к полученному остатку добавляли метанол и смесь охлаждали, в результате чего получали бесцветные кристаллы (6г, 7,0%). 1 Н-ЯМР (200МГц, CDCl3) d: 1,50 (9Н, с); 3,96 (3Н, с); 7,23 (1Н, т); 8,10 (1Н, дд); 8,17 (1Н, дд). ИК (KBr), см-1: 3360, 1730, 1705, 1580, 1520, 1490, 1440, 1365, 1355, 1310, 1270, 1240, 1150, 870, 835, 770, 725, 705. Рабочий пример 23. Метил 2-[[N-трет-бутоксикарбонил-N'-цианобифенил-4-ил)метил]амино]-3-нитробензоат. Раствор метил 2-трет-бутоксикарбониламино-3-нитробензоата (0,6г), 2-(4-бромометилфенил) бензонитрила (0,54г) и K2CO3 (0,28г) в ацетонитриле (10мл) нагревали в сосуде с обратным холодильником в течение 4ч и концентрировали досуха. К полученному остатку добавляли воду, и смесь экстрагировали этилацетатом. Экстракт промывали водой, осушали и выпаривали досуха. Остаток очищали с помощью колоночной хроматографии на силикагеле и получали кристаллы. После перекристаллизации из смеси этилацетата и гексана получали бесцветные призмообразные кристаллы (0,83г, 85%), т.пл. 153 - 154°C. 1 Н-ЯМР (200МГц, CDCl3) d: 1,35 (9Н, с); 3,70 (3Н, с); 4,63 (1Н, д); 4,80 (1Н, д); 7,23 - 7,29 (3Н, м); 7,39 - 7,53 (6Н, м); 7,59 - 7,67 (1Н, м); 7,75 (1Н, дд); 7,93 (1Н, дд); 7,99 (1Н, дд); 8,05 (1Н, дд); 8,11 (1Н, дд). ИК (KBr), см-1: 2220, 1700, 1530, 1390, 1360, 1315, 1290, 765. Рабочий пример 24. Метил 2-[[(2'-цианобифенил-4-ил)метил)амино]-3-нитробензоат. Смесь метил 2-[[N-трет-бутоксикарбонил-N-(2'-цианобифенил-4-ил)метил] амино]-3-нитробензоата (0,49г) в 20% HCl-этаноле (3мл) и этилацетата (3мл) размешивали 1ч при комнатной температуре. После выпаривания растворителя, к остатку добавляли метанол и насыщенный водный бикарбонат натрия, в результате чего получали кристаллическое вещество. Кристаллы собирали фильтрацией и после перекристаллизации их из смеси хлороформа и метанола получали бледно-желтые кристаллы (0,3г, 77%)%, т.пл. 140 - 141°C. 1 Н-ЯМР (200МГц, ДMCO-d6) d: 3,84 (3Н, с); 4,26 (2Н, м); 6,86 (1Н, т); 7,46 (2Н, д); 7,54 - 7,65 (4Н, м); 7,79 (1Н, д); 7,95 дд); 8,05 - 8,11 (2Н, м); 8,67 (1Н, т). Рабочий пример 25. Метил 3-амино-2-[[(2'-цианобифенил-4-ил)метил]амино] бензоат. Смесь метил 2-[[(2'-цианобифенил-4-ил]метил)амино]-3-нитробензоата (10г, FeCl3×6H2O) (0,1г), активированного угля (1г), в смеси метанола (100мл) и ТГФ (50мл) нагревали в сосуде с обратным холодильником 30мин. К реакционной смеси по капле добавляли гидрат гидразина (7,2мл), после чего смесь нагревали в сосуде с обратным холодильником в течение 14ч. Нерастворимый продукт удаляли из реакционной смеси путем фильтрации и полученный фильтрат концентрировали досуха. К остатку добавляли водный бикарбонат натрия и смесь экстрагировали этилацетатом. Экстракт промывали водой, осушали и выпаривали досуха. Остаток очищали с помощью колоночной хроматографии на силикагеле и получали кристаллы. После перекристаллизации из изопропилового эфира получали бледно-желтые игольчатые кристаллы (6,0г, 64%), т.пл. 110 - 111°C. 1 Н-ЯМР (200МГц, CDCl3) d: 3,81 (3Н, с); 3,97 (2Н, шир.с.); 4,23 (2Н, д); 6,39 (1Н, т); 6,84 - 6,93 (2Н, м); 7,26 7,55 (8Н, м); 7,64 (1Н, дт); 7,77 (1Н, дд). Рабочий пример 26. Метил 1-[[2'-цианобифенил-4-ил]метил]-2-(2,2,2-трифторэтокси) бензимидазол-7карбоксилат. Целевое соединение получали в виде бледно-желтых кристаллов из метил 3-амино-2-[[2-цианобифенил-4ил]метил] амино бензоата и 2,2,2-трифторэтилортокарбоната в соответствии с процедурой рабочего примера 3. Выход 25%, т.пл. 143 - 145°C. Элементный анализ для C24H18F3N3O3 Вычислено, %: C 64,52; H 3,90; N 9,05. Найдено, %: C 64,35; H 3,95; N 8,98. 1 Н-ЯМР (200МГц, CDCl3) d: 3,80 (3Н, с); 6,01 (2Н, кв); 5,74 (2Н, с); 7,13 (2Н, д); 7,23 (1Н, т); 7,38 - 7,47 (4Н, м); 7,58 - 7,66 (2Н, м); 7,72 - 7,78 (2Н, м). ИК (KBr), см-1: 2225, 1735, 1550, 1465, 1430, 1305, 1280, 1270, 1250, 1170, 1060, 770, 750, 745. Рабочий пример 27. Этил 1-[(2'-цианобифенил-4-ил)метил1-2-этоксибензимидазол-7-карбоксилат. К раствору этил 2-хлоро-1-[2'-цианобифенил-4-ил)метил]бензимидазол-7-карбоксилата (1,0г) в этаноле (30мл) добавляли NaOEt (0,17г) и смесь нагревали в сосуде с обратным холодильником в течение 1ч. Реакционную смесь концентрировали досуха. Остаток растворяли в этилацетате и раствор промывали водой, а затем высушивали. После выпаривания растворителя, остаток очищали с помощью колоночной хроматографии на силикагеле, в результате чего получали целевое соединение в виде бесцветных кристаллов (0,37г, 70%). 1 Н-ЯМР и ИК-спектр указывают, что продукт, полученный в соответствии с описанной процедурой, полностью идентичен продукту, полученному в рабочем примере 4. Сравнительный пример 14. 2-(4-Формилфенил) бензонитрил. Смесь 2-(4-бромометилфенил)бензонитрила (12г) и бикарбоната натрия (26г) в диметилсульфоксиде (150мл) нагревали при 120°C в течение 5ч, перемешивая. После добавления воды смесь экстрагировали этилацетатом. Экстракт промывали водой, осушали и концентрировали досуха. Остаток очищали с помощью хроматографии на силикагеле и получали кристаллы. После перекристаллизации из смеси хороформа и изопропилового эфира получали бесцветные игольчатые кристаллы (5,77г, 63%). 1 Н-ЯМР (200МГц, CDCl3) d: 7,49 - 7,58 (2Н, м); 7,67 - 7,84 (2Н, м); 8,00 - 8,05 (2Н, м); 10,10 (1Н, с). Сравнительный пример 15. 2-(4-Аминометилфенил)бензонитрил. Смесь 2-(4бромометилфенил)бензонитрила (12г) и фталимид калия (15г) в ДМФ (200мл) размешивали 5ч при 70°C. После добавления воды смесь экстрагировали метиленхлоридом. Экстракт промывали водой, осушали и концентрировали досуха, получая в результате кристаллы. После перекристаллизации из смеси этилацетата и изопропилового эфира получали бесцветные кристаллы. К суспензии кристаллов в метаноле (500мл) добавляли гидрат гидразина (10мл) и смесь нагревали в сосуде с обратным холодильником в течение 12 часов. Растворитель выпаривали, остаток растворяли в этилацетате, а раствор промывали 1н. NaOH и водой. Органический слой осушали и концентрировали досуха, в результате чего получали кристаллы (14,2г, 93%). 1 Н-ЯМР (200МГц, CDCl3) d: 1,56 (2Н, шир.с.); 3,88 (2Н, с); 7,27 - 7,78 (8Н, м). Рабочий пример 28. Этил 2-этокси-1-[(2'-(1Н-тетразол-5-ил)бифенил-4-ил)метил]бензимидазол-7-карбоксилат. Смесь этил 1-[(2'-цианобифенил-4-ил)метил]-2-этоксибензимидазол-7-карбоксилата (0,7г) и азида триметилолова (0,7г) в толуоле (15мл) нагревали в сосуде с обратным холодильником в течение 4 дней. Реакционную смесь концентрировали досуха и к остатку добавляли метанол (20мл) и 1н. HCl (10мл). Смесь размешивали 30мин при комнатной температуре и pH доводили до 3 - 4 с использованием 1н. NaOH. После удаления растворителя, остаток распределяли между хлороформом и водой. Органический слой промывали водой и осушали, а растворитель выпаривали досуха и получали сироп. Сироп очищали с помощью колоночной хроматографии на силикагеле и получали кристаллы. После перекристаллизации из смеси этилацетата и бензола получали бесцветные кристаллы (0,35г, 45%), т.пл. 158 - 159°C. Элементный анализ для C26H24 N6O3. Выделено, %: C 66,65; H 5,16; N 1794. Найдено, %: C 66,61; H 5,05; N 17,84. 1 Н-ЯМР (200МГц, CDCl3) d: 1,09 (3Н, т); 1,43 (3Н, т); 4,02 (2Н, кв), 4,30 (2Н, кв); 5,57 (2Н, с); 6,71 (2Н, д); 6,83 6,96 (4Н, м); 7,27 - 7,31 (1Н, м); 7,40 (1Н, дд); 7,55 - 7,66 (2Н, м); 8,04 - 8,09 (1Н, м). ИК (KBr), см-1: 1720, 1605, 1540, 1470, 1430, 1250, 1040, 750. Рабочий пример 29. 2-Этокси-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоновая кислота. Раствор этил 2-этокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоксилата (0,24г) и 1н. NaOH (1,5мл) в этаноле (4мл) размешивали 1ч при 80°C. Реакционную смесь концентрировали, а концентрат экстрагировали водой и этилацетатом. Водный слой доводили до pH 3 - 4 с использованием 1н. HCl и получали кристаллы. После перекристаллизации этих кристаллов из смеси этилацетата и метанола получали бесцветные кристаллы (0,15г, 67%), т.пл. 183 - 185°C. Элементный анализ для C24H20 N6O3 ´ 1/5 H2O. Вычислено, %: C 64,91; H 4,63; N 18,93. Найдено, %: C 65,04; H 4,51; N 18,77. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 1,38 (3Н, т); 4,58 (2Н, кв); 5,63 (2Н, с); 6,97 (4Н, кв); 7,17 (1Н, т); 7,47 - 7,68 (6Н, м). ИК (KBr), см-1: 1710, 1550, 1480, 1430, 1280, 1240, 1040, 760. Рабочий пример 30. Этил-2-пропокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. Смесь этил 1-[(2'-цианобифенил-4-ил)метил]-2-пропоксибензимидазол-7-карбоксилата (0,69г) и азида триметилолова (0,7г) в толуоле (15мл) нагревали при орошении в течение 4 дней. Реакционную смесь концентрировали досуха, после чего к смеси добавляли метанол (20мл) и 1н. HCl (10мл). После 30 - минутного размешивания при комнатной температуре, смесь доводили до pH 3 - 4 с использованием 1н. NaOH. После удаления ратвори-теля остаток экстрагировали смесью хлороформа и воды. Органический слой промывали водой и высушивали, а растворитель выпаривали досуха, в результате чего получали сироп. Этот сироп очищали с помощью колоночной хроматографии на силикагеле и получали кристаллы После перекристаллизации из смеси этилацетата и бензола получали бесцветные кристаллы (0,31г, 43%), т.пл. 157 - 159°C. Элементный анализ для C27H6O3. Вычислено, %: C 67,21; H 5,43; N 17,42. Найдено, %: C 67,26; H 5,45; N 17,28. 1 Н-ЯМР (200МГц, CDCl3) d: 1,03 (3Н, т); 1,13 (3Н, т); 1,75 - 1,92 (2Н, м); 4,05 (2Н, кв); 4,23 (2Н, кв); 5,57 (2Н, с); 6,75 (2Н, д); 6,90 (2Н, д); 6,96 (2Н, д); 7,28 - 7,33 (1Н, м); 7,39 - 7,44 (2Н, м); 7,57 - 7,62 (2Н, м); 8,07 - 8,11 (1Н, м). ИК (KBr), см-1: 1720, 1540, 1470, 1430, 1280, 1250, 1130, 1020, 750. Рабочий пример 31. 2-Пропокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] бензимидазол-7-карбоновая кислота. Раствор этил 2-пропокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоксилата (0,23г) в этаноле (4мл), содержащем 1н. NaOH (1,5мл), нагревали 2ч при 80°C. Реакционную смесь концентрировали досуха и остаток экстрагировали водой и этилацетатом. Водный слой доводили до pH 3 - 4 с использованием 1н. HCl, и получали кристаллы. После перекристаллизации из смеси этилацетата и метанола получали бесцветные кристаллы (0,15г, 69%), т.пл. 174 - 175°C. Элементный анализ для C25H22 N6O3 ´ 0,3H2O Вычислено, %: C 65,29; H 4,95; N 18,27. Найдено, %: C 65,41; H 4,92; N 18,20. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 0,92 (3Н, т); 1,70 - 1,87 (2Н, м); 4,47 (2Н, кв); 5,63 (2Н, с); 6,96 (4Н, дд); 7,16 (1Н, т); 7,42 - 7,67 (6Н, м). ИК (KBr), см-1: 1700, 1550, 1430,1290, 1240, 765. Рабочий пример 32. Этил 2-меркапто-1[[2'-(1Н-тетразол-5-ил)бифенил-4-ил] метил]бензимидазол-7карбоксилат. Смесь этил [1-(2'-цианобифенил-4-ил)метил]2-меркаптобензимидазол-7-карбоксилата (4,1г) и азида триметилолова (8,0г) в толуоле (100мл) нагревали в сосуде с обратным холодильником в течение 4ч. Растворитель выпаривали досуха, а остаток размешивали в смеси конц. соляной кислоты (2мл) и метаноле (20мл) в течение 20мин при комнатной температуре. Затем к реакционной смеси добавляли 1н. NaOH для доведения pH до 4, после чего смесь экстрагировали этилацетатом. Органический слой промывали водой, осушали и концентрировали досуха, в результате чего получали кристаллический продукт. После его перекристаллизации получали бесцветные кристаллы (5,0г, 89%), т.пл. 262 - 264°C (разл.). Элементный анализ для C24H20 N6O2S ´ 12H2O Вычислено, %: C 61,92; H 4,55; N 18,05. Найдено, %: C 61,99; H 4,30; N 17,86. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 1,10 (3Н, т); 4,09 (2Н, кв.); 5,82 (2Н, шир.с.); 6,87 (2Н, д); 7,00 (2Н, д); 7,26 (1Н, т); 7,37 - 7,69 (6Н, м). ИК (KBr), см-1: 1720, 1460, 1440, 1365, 1340, 1260, 1180, 1145, 1150, 1110, 990, 745. Рабочий пример 33. Этил 2-метилтио-1-[[2'-(1Н тетразол-5-ил)бифенил-4-ил] метил]бензимидазол-7карбоксилат. К раствору этил 2-меркапто-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]бензимидазол-7-карбоксилата (0,68г) в этаноле (10мл), содержащем 1н. NaOH (3,0мл), добавляли метилиодид (0,24г), и полученную смесь размешивали 2ч при комнатной температуре. После чего реакционную смесь нейтрализовали разбавленной соляной кислотой и получали кристаллы. Эти кристаллы очищали с помощью колоночной хроматографии на силикагеле. После перекристаллизации из зтилацетата получали бесцветные призмообразные кристаллы (0,3 i г, 44%), т.пл. 207 208 (разл.). Элементный анализ для C25H22 N6O2S. Вычислено, %: C 63,81; H 4,71; N 17,86. Найдено, %: C 63,55; H 4,81; N 17,50. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 1.13 (3Н, т); 2,77 (3Н, с); 4,14 (2Н, кв); 5,62 (2Н, с); 6,64 (2Н, д); 7,26 (1Н, т); 7,46 - 7,70 (5Н, м). ИК (KBr), см-1: 1705, 1480, 1450, 1420, 1360, 1340, 1275, 1255, 1190, 1140, 1100, 1025, 990, 770, 750. Рабочий пример 34. Этил 2-этилтио-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил] метил)бензимидазол-7карбоксилат. К раствору этил 2-меркапто-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоксилата (0,91г) в этаноле (13мл), содержащем 1н. NaOH (4мл), добавляли по капле этилиодид (0,34г), и полученную смесь размешивали 4ч при комнатной температуре. Реакционную смесь доводили до pH 4, используя разбавленную соляную кислоту и получали кристаллы. Эти кристаллы собирали фильтрацией и очищали с помощью колоночной хроматографии на силикагеле. После перекристаллизации из этилацетата получали бесцветные призмообразные кристаллы (0,55г, 57%), т.пл. 153 - 154°C (разл.). Элементный анализ для C26H24 N6O2S. Вычислено, %: C 64,44; H 4,99; N 17,34. Найдено, %: C 64,37; H 5,05; N 17,20. 1 Н-ЯМР (200МГц, CDCl3) d: 1,19 (3Н, т); 1,37 (3Н, т); 3,20 (2Н, кв.); 4,12 (2Н, кв); 5,67 (2Н, с); 6,75 (2Н, д); 6,92 (2Н, д); 7,05 (1Н, т); 7,26 - 7,34 (2Н, м); 7,50 (1Н, дд); 7,53 - 7,63 (2Н, м); 8,05 - 8,11 (1Н, м). ИК (KBr), см-1: 1715, 1450, 1420, 1365, 1345, 1280, 1195, 1145, 1110, 1035, 1015, 990, 760, 745. Рабочий пример 35. Этил 2-пропилтио-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. К раствору этил 2-меркапто-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоксилат (0,91г) в этаноле (13мл), содержащем 1н. NaOH (4,0мл), добавляли пропилиодид, и полученную смесь размешивали 5 часов при комнатной температуре. После чего реакционную смесь доводили до pH 4 разбавленной соляной кислотой и получали кристаллы. Эти кристаллы собирали фильтрацией и очищали с помощью колоночной хроматографии на силикагеле. После перекристаллизации из смеси этилацетата и гексана получали бесцветные призмообразные кристаллы (0,4г, 40%), т.пл. 177 - 178°C (разл.). Элементный анализ для C27H26 N6O2S. Вычислено, %: C 65,04; H 5,26; N 16,85. Найдено, %: C 64,88; H 5,25; N 17,78. 1 Н-ЯМР (200МГц, CDCl3) d: 1,04 (3Н, т); 1,19 (3Н, т); 1,76 (2Н, м); 3,18 (2Н, т); 4,12 (2Н, кв.); 5,69 (2Н,с); 6,75 (2Н, д); 6,93 (2Н, д); 7,05 (1Н, т); 7,27 - 7,34 (2Н, м); 7,50 (1Н, дд); 7,54 - 7,63 (2Н, м); 8,07 - 8,12 (Н, м). ИК (KBr), см-1: 1715, 1450, 1420, 1380, 1365, 1350, 1280, 1260, 1190, 1145, 1035, 1020, 990, 760, 745. Рабочий пример 36. 2-Метилтио-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил) бензимидазол-7-карбоновая кислота. Раствор этил 2-метилтио-1-[[(2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоксилата (0,2г) в метаноле (5мл), содержащем 1н. NaOH (1,3мл) нагревали с обратным холодильником в течение 2ч. Реакционную смесь доводили до около pH 4 разбавленной соляной кислотой и получали кристаллы. Эти кристаллы собирали фильтрацией и после перекристаллизации из смеси этилацетата и гексана получали бесцветные кристаллы (0,17г, 81%), т.пл. 223 - 225°C (с разлож.). Элементный анализ для C23H18 N6O2S ´ 1/2 C4HвO2. Вычислено, %: C 61,72; H 4,56; N 17,27. Найдено, %: C 61, 59; H 4,54; N 17,54. 1 Н ЯМР (200МГц, ДМСО-d6) d: 2,75 (3Н, с); 5,76 (2Н, с); 6,88 (2Н, д); 7,01 (2Н, д); 7,25 (1Н, т); 7,47 - 7,66 (5Н, м); 7,82 (1Н/Д). ИК (KBr), см-1: 1710, 1485, 1450, 1420, 1370, 1345, 1320, 1280, 1245, 1195, 1150, 990, 780, 760. Рабочий пример 37. Этилтио-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]-бензимидазол-7-карбоновая кислота. Раствор этил 2-этилтио-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазолил-7-карбоксилата (0,35г) в метаноле (7мл), содержащем 1н. NaOH (2,2мл) нагревали 2ч в сосуде с обратным холодильником. После выпаривания растворителя водный остаток доводили до pH 3 - 4 с использованием 1н. HCl, в результате чего получали кристаллы, которые собирали фильтрацией. После перекристаллизации из смеси этилацетата и метанола получали бесцветные кристаллы (0,21г, 64%), т.пл. 209 - 210°C (с разлож.). Элементный анализ для C24H20 N6O2S. Вычислено, %: C 63,14; H 4,42; N 18,41. Найдено, %: C 63,89; H 4,35; N 18,15. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 1,39 (3Н, т); 3,36 (2Н, кв); 5,76 - 6,87 (2Н, д); 7,01 (2Н, д); 7,25 (1Н, т); 7,47 - 7,69 (5Н, м); 7,82 (1Н, дд). ИК (KBr), см-1: 1695, 1450, 1415, 1350, 1275, 1225, 1190, 1180, 755, 740. Рабочий пример 38. 2-Пропилтио-1-([2'-(1Н-тетразол-5-ил)бифекил-4-ил] метил]бензимидазол-7-карбоновая кислота. Раствор этил-2-пропилтио-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоксилата (0,25г) в метаноле (5мл), содержащем 1н. NaOH (1,5мл) нагревали в сосуде с обратным холодильником в течение 2ч. После удаления растворителя, водный остаток доводили до pH 3 - 4 с использованием 1н. HCl и получали кристаллы, которые собирали фильтрацией. После перекристаллизации из смеси этилацетата и гексана получали бесцветные кристаллы (0,21г, 91%), т.пл. 222 - 223°C (разл.). Элементный анализ для C25H21 N6O2S. Вычислено, %: C 63,95; H 4,51; N 17,90. Найдено, %: C 63,78; H 4,85; N 17,59. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 0,99 (3Н, т); 1,67 - 1,35 (2Н, м); 3,35 (2Н, т); 5,77 (2Н, с); 6,87 (2Н, д); 7,01 (2Н, д); 7,25 (1Н, т); 7,46 - 7,70 (5Н, м); 7,32 (1Н, дд). ИК (KBr), см-1: 1700, 1450, 1280, 1240, 1195, 1145, 755, 740. Рабочий пример 39. Метил 2-этокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. Смесь метил 1-[(2'-цианобифенил-4-ил)метил]-2-этоксибензимидазол-7-карбоксилата (1,85г) и азида триметилолова (2,80г) в толуоле (15мл) нагревали в сосуде с обратным холодильником в течение 1 дня. После чего реакционную смесь концентрировали досуха. К остатку добавляли метанол (50мл) и 1н. HCl (20мл) и смесь размешивали 30мин при комнатной температуре. Реакционную смесь доводили до pH 3 - 4 с помощью 1н. NaOH. После удаления растворителя, остаток в виде сиропа очищали с помощью колоночной хроматографии на силикагеле, и получали кристаллы. После перекристаллизации из смеси этилацетата и бензола получали бесцветные кристаллы (1,16г, 56%), т.пл. 191 - 193°C (разл.). Элементный анализ для C25H22 N6O3 ´ 1/5 H2O. Вычислено, %: C 65,58; H 4,75; N 18,53. Найдено, %: C 65,55; H 4,93; N 18,35. 1 Н-ЯМР (200МГц, CDCl3) d: 1,43 (3Н, т); (J = 7,0Гц); 3,57 (3Н, с); 4,30 (2Н, кв., J = 7,0Гц); 5,54 (2Н, с); 6,72 (2Н, д, J = 8,2), 6,84 - 6,97 (4Н, м); 7,28 - 7,33 (1Н, м); 7,40 (1Н, дд, J = 1,8; 7,0Гц); 7,57 - 7,62 (2Н, м); 8,03 - 8,07 (1Н, м). ИК (KBr), см-1: 1720, 1550, 1475, 1430, 1280, 1250, 1040, 755, 735. Рабочий пример 40. Этил 2-этиламино-1-[[2'-(1Н-тетразол-5-ил)бифенил-4ил]метил]бензимидазолкарбоксилат. Смесь этил 1-[2'-цианобифенил-4-ил)метил]-2-этиламинобензимидазол-7-карбоксилата (1,23г) и азида триметилолова (2,80г) в толуоле (15мл) нагревали 40ч в сосуде с обратным холодильником. Осадок собирали фильтрацией и суспендировали в метаноле (50мл). К суспензии добавляли 1н. HCl (15мл), и смесь размешивали 10мин при комнатной температуре. Реакционную смесь доводили до pH около 5 с использованием 1н. NaOH, а затем экстрагировали хлороформом. Органический слой промывали водой, осушали и концентрировали досуха. Остаток очищали с помощью колоночной хроматографии на силикагеле и получали кристаллы, после перекристаллизации которых из смеси метанола и этилацетата получали бесцветные кристаллы (0,83г, 61%), т.пл. 166 - 168°C. 1 Н-ЯМР (200МГц, CDCl3) d: 1,13 (3Н, т); 1,21 (3Н, т); 3,43 (2Н, кв); 4,13 (2Н, кв); 5,48 (2Н, с); 6,78 (2Н, д); 6,99 (2Н, д); 7,07 (1Н, т); 7,22 (1Н, яд); 7,42 - 7,49 (2Н, м); 7,54 - 7,69 (3Н, м). ИК (KBr), см-1: 1720, 1650, 1310, 1285, 765, 755, 750. Рабочий пример 41. Этил 2-пропиламино-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. Раствор этил 1-[(2'-цианобифенил-4-ил]метил-2-пропиламинобензимидазол-7-карбоксилата (1,20г) и азида триметилолова (2,7г) в толуоле (15мл) нагревали 50ч в сосуде с обратным холодильником. Осадок собирали фильтрацией и суспендировали в метаноле (20мл). После добавления 1н. HCl (15мл), реакционную смесь размешивали 10мин при комнатной температуре. Смесь доводили до pH около 5 с помощью 1н. NaOH, а затем экстрагировали хлороформом. Органический слой промывали водой, осушали и концентрировали досуха. Концентрат очищали с помощью колоночной хроматографии на силикагеле и получали кристаллы. После перекристаллизации из смеси метанола и этилацетата получали бесцветные кристаллы (10г, 77%), т.пл. 170 172°C. 1 Н-ЯМР (200МГц, CDCl3) d: 0,89 (3Н, т); 1,14 (3Н, т); 1,52 - 1,70 (2Н, м); 3,35 (2Н, т); 4,14 (2Н, кв); 5,49 (2Н, с); 6,77 (2Н, д); 6,99 (2Н, д); 7,05 (1Н, т); 7,21 (1Н, дд); 7,39 - 7,47 (2Н, м); 7,50 - 7,65 (3Н, м). ИК (KBr), см-1: 1720, 1670, 1660, 1290, 1270, 760. Рабочий пример 42. 2-Этокси-1-[[2'-(N-трифенилметилтетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоновая кислота. К раствору 2-этокси-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоновой кислоты (2,07г) в метиленхлориде (10мл) добавляли тритилхлорид (1,59г) и триэтиламин (0,8мл). Смесь размешивали 1ч при комнатной температуре. Реакционную смесь промывали водой, осушали и концентрировали досуха. Остаток очищали с помощью колоночной хроматографии на силикагеле и получали кристаллы. После перекристаллизации из смеси этилацетата и бензола получали бесцветные кристаллы (2,12г, 66%), т.пл. 168 170°C. Элементный анализ для C43H34 N6O3S. Вычислено, %: C 75, 64; H 5,02; N 12,31. Найдено, %: C 75,37; H 4,96; N 12,30. 1 Н-ЯМР (200МГц, CDCl3) d: 1,40 (3Н, т); 4,61 (2Н, кв); 5,58 (2Н, с); 6,76 (2Н, д); 6,91 - 6,96 (8Н, м); 7,12 (1Н, т); 7,17 - 7,41 (12Н, м); 7,60 (1Н, дд); 7,73 - 7,82 (2Н, м). Рабочий пример 43. Пивалоилоксиметил 2-этокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]бензимидазол]-7карбоксилат. К раствору 2-этокси-1-[[2'-(N-трифенилметилтетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоновой кислоты (2,2г) в ДМФ (10мл) добавляли карбонат калия (0,53г) и пивалоилоксиметилиодид (0,94г), и полученную смесь размешивали 30мин при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали водой и осушали. После удаления ратворителя, остаток растворяли в метаноле (30мл) и 1н. HCl 6мл. Смесь размешивали 1ч при комнатной температуре. Реакционную смесь концентрировали досуха и остаток распределяли между водой и этилацетатом. Органический слой промывали водой и высушивали. После удаления растворителя, остаток очищали с помощью колоночной хроматографии на силикагеле и получали кристаллы, после перекристаллизации которых из смеси этилацетата и гексана получали бесцветные кристаллы (1,13г, 63%), т.пл. 104 - 106°C. Элементный анализ для C30H30 N6O5 × 1/5 C4H8O2 ×1/5 C6H14 Вычислено, %: C 65,06; H 5,90; N 14,32. Найдено, %: C 64,79; H 5,85; N 14,43. 1 Н-ЯМР (200МГц, с; CDCl3) d: 1,13 (9Н, с); 1,44 (3Н, т); 4,37 (2Н, кв); 5,61 (2Н, с); 5,68 (2Н, с); 6,80 (2Н, д); 6,93 (2Н, д); 6,99 - 7,11 (2Н, м); 7,33 - 7,37 (1Н, м); 7,49 - 7,54 (1Н, м); 7,59 - 7,62 (2Н, м); 8,03 - 8,07 (1Н, м). Рабочий пример 44. 1-(Циклогексилоксикарбонилокси) этил 2-этокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4ил]метил]бензимидазол-7-карбоксилат. К раствору 2-этокси-1-[[2'-(N-трифенилметилтетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоновой кислоты (0,5г) в ДМФ (5мл) добавляли карбонат калия (0,12г) и циклогексил-1-иодоэтилкарбонат(0,26г). Смесь размешивали 1ч при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали водой и осушали. После удаления растворителя, остаток растворяли в метаноле (10мл) и к раствору добавляли 1н. HCl. Смесь размешивали 1ч при комнатной температуре. Затем реакционную смесь концентри ровали досуха, а остаток распределяли между этилацетатом и водой. Органический слой промывали водой и осушали. После удаления растворителя, остаток очищали с помощью колоночной хроматографии на силикагеле и получали в результате бесцветный порошок (0,21г, 47%), т.пл. 103 - 106°C. Элементный анализ для C33H34 N6O6. Вычислено, %: C 64,91; H 5,61; N 13,76. Найдено, %: C 64,94; H 5,71; N 13,66. К полученному порошку (1г) добавляли этанол (6мл). Смесь размешивали 3ч при комнатной температуре и оставляли в условиях охлаждения льдом. Затем смесь размешивали 1ч при комнатной температуре, не превышающей 10°C. Полученные кристаллы собирали фильтрацией и промывали холодным этанолом. Кристаллы осушали при 25°C в течение 9ч при пониженном давлении, а затем при 35°C еще 18ч, в результате чего получали белый кристаллический порошок (0,94г), т.пл. 158 - 166°C (разл.). Элементный анализ для C33H34 N6O6. Вычислено, %: C 64,91; H 5,61; N 13,76. Найдено, %: C 64,73; H 5,66; N 13,64. 1 Н-ЯМР (200МГц) d: 1,13 - 1,84 (16Н, м); 4,28 - 4,55 (3Н, м); 5,65 (2Н, д); 6,72 (1Н, кв); 6,81 (2Н, д); 6,93 (2Н, д); 7,03 (1Н, т); 7,22 - 7,23 (1Н, м); 7,31 - 7,36 (1Н, м); 7,52 - 7,60 (3Н, м); 8,02 - 8,07 (1Н, м). ИК (KBr), см-1: 2942, 1754, 1717, 1549, 1476, 1431, 1076, 1034, 750. МС (m/z): 611 [М + Н]+. Рабочий пример 45. Метил 2-метокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. Метил [1-(2'-цианобифенил-4-ил)метил]-2-метокси-бензимидазол-7-карбоксилат (0,60г) и азид триметилолова (1,5г) в толуоле (15мл) нагревали 40ч в сосуде с обратным холодильником. Осажденные кристаллы растворяли в метаноле (10мл) и к раствору добавляли 1н. HCl (3мл). Смесь размешивали 10мин при комнатной температуре, а метанол выпаривали. Водный остаток доводили до pH 3 - 4 с использованием 1н. NaOH, а затем экстрагировали этилацетатом. Органический слой промывали водой и осушали. После удаления растворителя, остаток очищали с помощью колоночной хроматографии на силикагеле и получали кристаллы. После перекристаллизации их из этилацетата получали бесцветные кристаллы в виде призм (0,65г, 65%), т.пл. 165 - 166°C. Элементный анализ для C24H20 N6O3 × 1/10H2O. Вычислено, %: C 65,18; H 4,60; N 19,00. Найдено, %: C 84,91; H 4,49; N 18,99. 1 Н-ЯМР (200МГц, CDCl3) d: 3,64 (3Н, с); 3,93 (3Н, с); 5,55 (2Н, с); 6,75 (2Н, д); 6,90 - 7,01 (4Н, м); 7,31 - 7,36 (1Н, м); 7,49 (1Н, дд); 7,55 - 7,64 (2Н, м); 8,03 - 8,07 (1Н, м). Рабочий пример 46. 2-Метокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил] бензимидазол-7-карбоновая кислота. К раствору метил 2-метокси-1[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоксилата (0,22г) в метаноле (10мл) добавляли 1н. NaOH (1,5мл). Смесь нагревали 6ч в сосуде с обратным холодильником. Затем реакционную смесь концентрировали досуха и к остатку добавляли воду. Смесь доводили до pH 3 - 4 с использованием 1н. HCl и получали в результате кристаллы. После перекристаллизации из смеси метанола и хлороформа получали бесцветные игольчатые кристаллы (0,17г, 77%), т.пл. 208 - 209°C. Элементный анализ для C23H18 N6O3 × 0,7 H2O. Вычислено, %: C 62,92; H 4,45; N 19,14. Найдено, %: C 62,81; H 4,08; N 19,19. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 4,15 (3Н, с); 5,63 (2Н, с); 6,90 (2Н, д); 7,00 (2Н, д); 7,13 (1Н, т); 7,46 - 7,70 (6Н, м). Рабочий пример 47. 2-Этиламино-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоновая кислота. К раствору этил 2-этиламино-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]бензимидазол-7-карбоксилата (0,52г) в этаноле (5мл) добавляли 1н. NaOH (4мл), и смесь размешивали 2ч при 80°C. Реакционную смесь концентрировали досуха, а водный остаток доводили до pH 4 - 5 с использованием 1н. HCl, в результате чего получали кристаллы. Кристаллы собирали путем фильтрации, перекристаллизовывали из смеси метанола и хлороформа и получали бесцветные кристаллы (0,3г, 63,4%), т.пл. 240 - 242°C. Элементный анализ для C24H21 N7O2 × 1,1 H2O. Вычислено, %: C 62,76; H 5,09; N 21,35. Найдено, %: C 62,65; H 5,15; N 21,23. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 1,20 (3Н, т); 3,43 (2Н, кв); 5,62 (2Н, с); 6,85 (2Н, д); 6,99 (2Н, д); 7,10 (1Н, т); 7,34 (1Н, д); 7,44 - 7,68 (5Н, м). Рабочий пример 48. 2-Пропмламино-1-2'-(1Н-тетразол-5-ил)бифенил-4-ил-метилбензимидазол-7-карбоновая кислота. Это соединение было получено с выходом 73% (т.пл. 244 - 246°C) способом, описанным в рабочем примере 47. Элементный анализ для C25H23 N7O2 × 1/2 H2O. Вычислено, %: C 64,92; H 5,23; N 21,20. Найдено, %: C 64,79; H 5,27; N 21,08. Приведенные ниже соединения (рабочие примеры 49 - 53) были получены, в основном, способом, описанным в рабочем примере 43. Рабочий пример 49. (5-Метил-2-оксо-1,3-диоксолен-4-ил)метил 2-этокси-1-[[2'-(1Н-тетразол-5-ил) бифенил-4ил]метил] бензимидазол-7-карбоксилат. Выход, 55%, т.пл. 122 - 125°C (разл.). Элементный анализ для C29H24 N6O6 × CHCl3. Вычислено, %: C 53,63; H 3,75; N 12,51. Найдено, %: C 53,32; H 3,58; N 12,24. 1 Н-ЯМР (200МГц, CDCl3) d: 1,43 (3Н, т); 2,11 (3Н, с); 4,40 (2Н, кв); 4,80 (2Н, с); 5,58 (2Н, с); 6,79 (2Н, д); 6,94 (2Н, д); 7,02 (1Н, т); 7,15 (1Н, дд); 7,35 - 7,39 (1H, м); 7,49 - 7,63 (3Н, м); 8,00 - 8,04 (1Н, м). Рабочий пример 50. Ацетоксиметил 2-этокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. Выход 38%, т.пл. 152 - 154°C (разл.). Элементный анализ для C27H24 N6O5. Вычислено, %: C 63,27; H 4,72; N 16,40. Найдено, %: C 63,55; H 4,70; N 16,18. 1 Н-ЯМР (200МГц, CDCl3) d: 1,43 (3Н, т); 2,01 (3Н, с); 4,33 (2Н, кв); 5,61 (2Н, с); 5,69 (2Н, с); 6,81 (2Н, д); 6,93 (2Н, д); 7,01 (1Н, т); 7,13 (1Н, д); 7,33 - 7,38 (1Н, м); 7,53 - 7,62 (3Н, м); 8,03 - 8,07 (1Н, м). Рабочий пример 51. Пропионилоксиметил 2-этокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4ил]метил]бензимидазол-7-карбоксилат. Выход 60%, т.пл. 145 - 150°C. Элементный анализ для C28H25 N6O5 × 0,2 C7H8. Вычислено, %: C 64,79; H 5,10; N 15,42. Найдено, %: C 64,70; H 5,10; N 15,44. 1 Н-ЯМР (200 МГц, CDCl3) d: 1,04 (3Н, т); 1,44 (3Н, т); 2,29 (2Н, кв); 4,40 (2Н, кв); 5,61 (2Н, с); 5,71 (2Н, с); 6,82 (2Н, д); 6,92 - 7,14 (3Н, м); 7,20 (1Н, м); 7,33 - 7,38 (1Н, м); 7,53 - 7,61 (3Н, м); 8,03 - 8,08 (1Н, м). Рабочий пример 52. Бутирилоксиметил 2-этокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол7-карбоксилат. Выход 36%, т.пл. 96 - 100°C. Элементный анализ для C29H28N6O5 × 0,4 C7Н8. Вычислено, %: C 66,15; H 5,45; N 14,55. Найдено, %: C 66,11; H 5,44; N 14,65. 1 Н-ЯМР (200МГц, CDCl3) d: 0,85 (3Н, т); 1,44 (3Н, т); 1,55 (2Н, м); 2,24 (2Н, кв); 4,38 (2Н, кв); 5,61 (2Н, с); 5,70 (2Н, с); 6,81 (2Н, д); 6,93 (2Н, д); 7,00 (1Н, т); 7,20 (1Н, м); 7,33 - 7,38 (1Н, м); 7,52 - 7,61 (3Н, м); 8,01 - 8,10 (1Н, м). Рабочий пример 53. Изобутирилоксиметил 2-этокси-1-[[2'-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. Выход 53%, т.пл. 143 - 145°C. Элементный анализ для C28H28 N6O5 × 0,1 C7H8. Вычислено, %: C 64, 88; H 5,28; N 15,29. Найдено, %: C 65,04; H 5,25; Н 15,18. 1 Н-ЯМР (200МГц, CDCl3) d:1,09 (6Н, д); 1,44 (3Н, т); 2,50 (1 Н, м); 4,38 (2Н, кв); 5,61 (2Н, с); 5,70 (2Н, с); 6,81 (2Н, д); 6,91 - 7,00 (3Н, м); 7,19 (1Н, м); 7,33 - 7,37 (1Н, м); 7,51 - 7,63 (3Н, м); 8,02 - 8,07 (1Н, м). Приведенные ниже соединения (рабочие примеры 54 - 56) были синтезированы способом, в основном описанным в рабочем примере 44. Рабочий пример 54. 1-(Этоксикарбонилокси) этил 2-этокси-1-[[2'-1Н-тетразол-5-ил)-бифенил-4ил]метил]бензимидазол-7-карбоксилат. Выход 44%, т.пл. 85 - 87°C. Элементный анализ для C29H28 N6O6 × 0,3 H2O. Вычислено, %: C 61,98; H 5,13; N 14,95. Найдено, %: C 62,11; H 5,02; N 14,69. 1 Н-ЯМР (200МГц, CDCl3) d: 1,20 (3Н, т); 1,30 (3Н, д); 1,41 (3Н, т); 4,03 - 4,22 (3Н, м); 4,31 - 4,47 (1Н, м); 5,61 (2Н, с); 6,62 - 6,72 (3Н, м); 6,80 - 6,95 (4Н, м); 7,29 - 7,32 (1Н, м); 7,47 (1Н, дд); 7,54 - 7,64 (2Н, м); 7,97 - 8,01 (1Н, м). Рабочий пример 55. 1-Ацетокси 2-этокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. Выход 31%, т.пл. 105 - 107°C. Элементный анализ для C28H26 N6O5 × 0,5 H2O. Вычислено, %: C 62,80; H 5,08; N 15,69. Найдено, %: C 62,77; H 4,69; N 15,85. 1 Н-ЯМР (200МГц, CDCl3) d: 1,46 (3Н, т); 1,49 (3Н, д); 4,47 - 4,62 (2Н, м); 5,59 (1Н, д); 5,83 (1Н, д); 6,84 (1Н, кв); 6,90 (2Н, д); 7,03 (2Н, д); 7,11 (1Н, т); 7,34 - 7,39 (1Н, м); 7,49 (1Н, д); 7,53 - 7,61 (3Н, м); 8,07 - 8,11 (1Н, м). Рабочий пример 56. 1-(Изопропоксикарбонилокси) этил 2-этокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4ил]метилбензимидазол-7-карбоксилат. Выход 33%, т.пл. 74 - 76°C. Элементный анализ для C30H30 N6O5 × 1,5 H2O. Вычислено, %: C 61,95; H 5,72; N 14,45. Найдено, %: C 62,02; H 5,43; N 14,20. 1 Н-ЯМР (200МГц, CDCl3) d: 1,20 (3Н, д); 1,21 (3Н, д); 1,30 (3Н, д); 1,42 (3Н, т); 4,08 - 4,24 (1Н, м); 4,34 - 4,50 (1Н, м); 4,79 (1Н, м); 5,61 (2Н, с); 6,62 - 6,75 (3Н, м); 7,27 - 7,32 (1Н, м); 7,48 (1Н, дд); 7,54 - 7,64 (2Н, м); 7,98 - 8,03 (1Н, м). Рабочий пример 57. 2-Метиламино-1[[2'-(1Н-тетразол-5-ил)бифенил-4-бифенил-4-ил]метил]бензимидазол-7карбоновая кислота. Вышеуказанное соединение было получено способом, в основном, аналогичным способам, описанным в рабочих примерах 40 и 47. Выход 40%, т.пл. 247 - 250°C (разл.). Элементный анализ для C23H19 N7O2 × 2,0 H2O. Вычислено, %: C 59,86; H 5,02; N 21,25. Найдено, %: C 59,99; H 4,89; N 21,36. 1 Н-ЯМР (200МГц, CDCl3) d: 2,94 (3Н, с); 5,64 (2Н, с); 6,82 (2Н, д); 6,99 (2Н, д); 7,02 (1Н, т); 7,31 (1Н, д); 7,42 7,63 (5Н, м). Описанные ниже соединения (рабочие примеры 58 - 60) были получены в соответствии с процедурой рабочего примера 43. Рабочий пример 58. Циклогексилкарбонилоксиметил 2-этокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4ил]метил]бензимидазол-7-карбоксилат. Выход 54%, т.пл. 140 - 142°C. Элементный анализ для C32H32 N6O5. Вычислено, %: C 66,19; H 5,55; N 14,47. Найдено, %: C 65,93; H 5,46; N 14,39. 1 Н-ЯМР (200МГц; CDCl3) d: 1,21 - 1,87 (13Н, м); 2,20 - 2,32 (1Н, м); 4,47 (2Н, кв); 5,60 (2Н, м); 5,73 (2Н, с); 6,86 (2Н, д); 7,07 (1Н, т); 7,27 - 7,40 (3Н, м); 7,54 - 7,61 (2Н, м); 8,05 - 8,09 (1Н, м). Рабочий пример 59. Бензоилоксиметил 2-этокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол7-карбоксилат. Выход, 47%, т.пл. 138 - 142°C. Элементный анализ для C32H29 N6O5 × 0,5 H2O × 0,1 C4H6O2. Вычислено, %: C 65,67; H 4,76; N 14,18. Найдено, %: C 65,71; H 4,66; N 13,96. 1 Н-ЯМР (200МГц; CDCl3) d: 1,43 (3Н, т); 4,36 (2Н, кв); 5,10 (2H, с); 5,98 (2Н, с); 6,74 (4Н, с); 6,99 (1Н, т); 7,09 7,14 (1Н, м); 7,21 - 7,36 (3Н, м); 7,50 - 7,59 (4Н, м); 7,90 (2Н, д); 8,02 - 8,06 (1Н, м). Рабочий пример 60. (E)-Циннамоилоксиметил 2-этокси-1-[[2'-1Н-тетразол-5-ил)бифенил-4ил]метил]бензимидазол-7-карбоксилат. Выход 56%, т.пл. 146 - 147°C. Элементный анализ для C34H28 N6O5 × 0,4 C4H8O2. Вычислено, %: C 67,16; H 5,07; N 13,20. Найдено, %: C 66,97; H 4,86; N 13,28. 1 Н-ЯМР (200МГц, CDCl3) d: 1,44 (3Н, т); 4,45 (2Н, кв); 5,61 (2Н, с); 5,87 (2Н, с); 6,33 (1Н, д); 6,84 (2Н, д); 6,96 (2Н, д); 7,05 (1Н, т); 7,31 - 7,57 (10Н, м); 7,65 (1Н, д); 8,00 - 8,04 (1Н, м). Приведенные ниже соединения(рабочие примеры 61 - 63) были синтезированы в соответствии с процедурой, описанной в рабочем примере 43. Рабочий пример 61. Циклопентилкарбонилоксиметил 2-этокси-1-[[2'-(1Н-тетразол-5-ил)-бифенил-4ил]метил]бензимидазол-7-карбоксилат. Выход 54%, т.пл. 136 - 138°C. Элементный анализ для C31H30 N6O5. Вычислено, %: C 65,71; H 5,34; N 14,83. Найдено, %: C 65,59; H 5,33; N 14,67. 1 Н-ЯМР (200МГц, CDCl3) d: 1,41 - 1,84 (11Н, м); 2,61 - 2,76 (1Н, м); 4,43 (2Н, кв); 5,61 (2Н, с); 5,72 (2Н, с); 6,84 (2Н, д); 6,96 (2Н, д); 7,05 (1Н, т); 7,22 - 7,26 (1Н, м); 7,35 - 7,39 (1Н, м); 7,53 - 7,61 (3Н, м); 8,03 - 8,08 (1Н, м). Рабочий пример 62. Пивалоилоксиметил 2-этиламино-1-[[2'-(1Н-тетразол-5-ил)бифенил-4ил]метил]бензимидазол-7-карбоксилат. Выход 59%, т.пл. 130 - 135°C. Элементный анализ для C30H31 N7O4 × 0,4 CHCl3 × 0,2 H2O. Вычислено, %: C 60,36; H 5,30; N 16,21. Найдено, %: C 60,20; H 5,20; N 16,08. 1 Н-ЯМР (200МГц, CDCl3) d: 1,12 (9Н, с); 1,20 (3Н, т); 3,43 (2Н, кв); 5,52 (2Н, с); 5,81 (2Н, с); 6,80 (2H, д); 6,99 (2Н, д); 7,08 (1Н, т); 7,24 (1Н, дд); 7,43 - 7,68 (5Н, м). Рабочий пример 63. 1-(Циклогексилоксикарбонилокси) этил 2-этиламино-1-[[2'-(1Н-тетразол-5-ил)бифенил-4ил]метил] бензимидазол-7-карбоксилат. Выход 76%, т.пл. 149 - 152°C. Элементный анализ для C33H35 N7O5 × 0,5 H2O. Вычислено, %: C 64,06; H 5,86; N 15,85. Найдено, %: C 64,27; H 6,02; N 15,86. 1 Н-ЯМР (200МГц, CDCl3) d: 1,12 - 1,83 (16Н, м); 3,38 - 3,47 (2Н, м); 4,48 - 4,49 (1Н, м); 5,51 (2Н, с); 6,75 - 6,88 (5Н, м); 7,04 (1Н, т); 7,29 - 7,40 (2Н, м); 7,47 - 7,51 (3Н, м); 7,91 - 7,95 (1Н, м). Рабочий пример 64. Метил 2-аллилокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. Указанное соединение получали в виде бесцветных кристаллов из 2-аллилокси-1-[[2'-цианобифенил-4ил)метил)бензимидазол-7-карбоксилата в соответствии с процедурой, описанной в рабочем примере 23. Выход 30%, т.пл. 154 - 156°C. Элементный анализ для C26H22 N6O3 × 0,5 H2O. Вычислено, %: C 65,67; H 4,88; N 17,67. Найдено, %: C 65,63; H 4,71; N 17,68. 1 ЯМР (200МГц, CDCl3) d: 3,75 (3Н, д); 4,58 - 4,61 (1Н, м); 4,92 - 4,95 (1Н, м); 5,18 - 5,48 (2Н, м); 5,52 (2Н, д); 5,83 - 6,15 (1Н, м); 6,98 - 7,15 (2Н, м); 7,09 - 7,17 (2Н, м); 7,35 - 7,44 (2Н, м); 7,47 - 7,60 (3Н, м); 8,09 - 8,19 (1Н, м). ИК (KBr), см-1: 1720, 1670, 1550, 1470, 1430, 1280, 1250, 1025, 760, 735. Рабочий пример 65. Метил 2-бутокси-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. Целевое соединение получали в виде бесцветных игольчатых кристаллов из метил 2-бутокси-1-[(2'цианобифенил-4-ил)метил]бензимидазол-7-карбоксилата в соответствии с процедурой, описанной в рабочем примере 28. Выход 91%, т.пл. 146 - 148°C. Элементный анализ для C27H26 N6O3. Вычислено, %: C 67,21; H 5,43; N 17,42. Найдено, %: C 67,00; H 5,45; N 17,49. 1 Н-ЯМР (200МГц, CDCl3) d: 0,99 (3Н, т); 1,37 - 1,56 (2Н, м); 1,74 - 1,88 (2Н, м); 5,61 (3Н, с); 4,27 (2Н, т); 5,53 (2Н, с); 6,75 (2Н, д); 6,90 (2Н, д); 6,97 (2Н, д); 7,30 - 7,34 (1Н, м); 7,41 (2Н, дд); 7,57 - 7,61 (2Н, м); 8,04 - 8,09 (1Н, м). ИК (KBr), см-1: 1720, 1600, 1540, 1470, 1430, 1270, 1250, 1020, 750. Рабочий пример 66. Метил 2-бутиламино-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. Целевое соединение было получено в виде бесцветных кристаллов из метил 2-бутиламино-1[2'цианобифенил-4-ил)метил]бензимидазол-7-карбоксилата в соответствии с процедурой, описанной в рабочем примере 41. Выход 42%, т.пл. 216 - 218°C. Элементный анализ для C27H27 N7O2 × H2O. Вычислено, %: C 64,91; H 5,85; N 19,63. Найдено, %: C 64,86; H 5,68; N 19,41. 1 Н-ЯМР (200МГц; ДМСО-d6) d: 0,91 (3Н, т); 1,25 - 1,43 (2Н, м); 1,52 - 1,67 (2Н, м); 3,65 (3Н, с); 5,47 (2Н, с); 6,79 (2Н, д); 6,98 - 7,05 (3Н, м); 7,18 (1Н, дд); 7,42 - 7,64 (5Н, м). ИК (KBr), см-1: 1720, 1665, 1660, 1650, 1430, 1260, 745. Рабочий пример 67. Метил 1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]-2-морфолинобензимидазол-7карбоксилат. Целевое соединение получали в виде бесцветных кристаллов из метил 1-[(2'-цианобифенил-4-ил)метил]-2морфолинобензимидазол-7-карбоксилата в соответствии с процедурой, описанной в рабочем примере 41. Выход 62%, т.пл. 163 - 167°C. Элементный анализ для C27H25 N7O3 × 0,6 CHCl3. Вычислено, %: C 58,45; H 4,55; N 17,29. Найдено, %: C 58,66; H 4,36; N 17,54. 1 Н-ЯМР (200МГц, CDCl3) d: 3,33 (4Н, т); 3,73 (3Н, с); 3,90 (4Н, т); 5,44 (2Н, с); 6,62 (2Н, д); 6,97 (2Н, д); 7,17 (1Н, т); 7,33 - 7,38 (1Н, м); 7,43 - 7,50 (2Н, м); 7,55 - 7,61 (2Н, м); 8,08 - 8,13 (1Н, м.). ИК (ЛИк), см-1: 1730, 1600, 1530, 1455, 1420, 1405, 1280, 1260, 1120, 1110, 1000, 760, 750, 740. Рабочий пример 68. Метил 1-[(2-(1Н-тетразол-5-ил)бифенил-4-ил]метил]2-пиперидинобензимидазол-7карбоксилат. Целевое соединение получали в виде бесцветных кристаллов из метил 1-[(2'-цианобифенил-4-ил)метил]-2пиперидинобензимидазол-7-карбоксилата в соответствии с процедурой рабочего примера 41. Выход 47%, т.пл. 146 - 150°C. Элементный анализ для C26H27 N7O2 × 0,8 CHCl3. Вычислено, %: C 58,72; H 4,76; N 16,64. Найдено, %: C 58,69; H 4,66; N 16,75. 1 Н-ЯМР (200МГц, CDCl3) d: 1,72 (6Н, шир.с); 3,11 (4Н, м); 3,61 (3Н, с); 5,38 (2Н, с); 6,45 (2Н, д); 6,80 (2Н, д); 6,89 - 6,96 (2Н, м); 7,28 - 7,37 (2Н, м); 7,56 - 7,64 (2Н, м); 8,01 - 8,06 (1Н, м). ИК (KBr), см-1: 1715, 1600, 1530, 1450, 1420, 1415, 1405, 1300, 1280, 1260, 1240, 1215, 1130, 770, 760, 750. Рабочий пример 69. Метил 2-этилметиламино-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. Целевое соединение получали в виде бесцветных кристаллов из метил 2-этиламино-1-[(2'-цианобифенил-4ил)метил]бензимидазол-7-карбоксилата в соответствии с процедурой, описанной в рабочем примере 41. Выход 54%, т.пл. 130 - 136°C. Элементный анализ для C26H25 N7O2 × 0,6 H2O. Вычислено, %: C 59,26; H 4,79; N 18,19. Найдено, %: C 59,04; H 4,95; N 18,05. 1 Н-ЯМР (200МГц, CDCl3) d: 1,19 (3Н, т); 2,57 (3Н, с); 3,22 (2Н, м); 3,62 (3Н, с); 5,40 (2Н, с); 6,43 (2Н, д); 6,78 6,94 (4Н, м); 7,30 - 7,34 (1Н, м); 7,57 (1Н, дд); 7,59 - 7,63 (2Н, м); 7,99 - 8,04 (1Н, м). ИК (KBr), см-1: 1720, 1600, 1540, 1435, 1400, 1300, 1280, 1255, 1015, 750, 740. Рабочий пример 70. 2-Пиперидино-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоновая кислота. Целевое соединение получали в виде бесцветных кристаллов из метил 1-[[2'-(1Н-тетразол-5-ил)бифенил-4ил]метил]-2-пиперидинобензимидазол-7-карбоксилата в соответствии с процедурой, описанной в рабочем примере 29. Выход 91%, т.пл. 215 - 218°C (разл.). Элементный анализ для C27H25 N7O2 × 0,5 CHCl3. Вычислено, %: C 61,25; H 4,77; N 18,18. Найдено, %: C 60,95; H 4,70; N 17,90. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 1,65 (6Н, шир.с); 3,24 (4Н, шир.с); 5,48 (2Н, с); 6,71 (2Н, д); 6,92 (2Н, д); 7,17 (1Н, т); 7,42 - 7,48 (2Н, м); 7,54 - 7,67 (2Н, м). ИК (KBr), см-1: 1685, 1530, 1450, 1440, 1420, 1400, 1285, 1270, 1245, 750, 730. Рабочий пример 71. 2-Морфолино-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоновая кислота. Целевое соединение получали в виде бесцветных кристаллов из метил 2-морфолино-1-[[2'-(1Н-тетразол-5ил)бифенил-4-ил]метил]бензимидазол-7-карбоксилата в соответствии с процедурой, описанной в рабочем примере 29. Выход 59%, т.пл. 202 - 206°C (разлож.). Элементный анализ для C26H23 N7O3 × 0,6 CHCl3. Вычислено, %: C 57,76; H 4,30; N 17,73. Найдено, %: C 57,55; H 4,25; N 17,66. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 3,24 (4Н, шир., с); 3,76 (4Н, шир., с); 5,56 (2Н, с); 6,72 (2Н, д); 6,93 (2Н, д); 7,16 (1Н, т); 7,41 - 7,70 (6Н, м). ИК (KBr), см-1: 1690,1535, 1460, 1450, 1420, 1410, 1290, 1260, 1245, 1120, 760, 740. Рабочий пример 72. 2-(N-Этлметиламино)-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоновая кислота. Целевое соединение получали в виде бесцветных кристаллов из метил 2-(N-этилметиламино)-1-[[2'-1Нтетразол-5-ил)фенил-4-ил]метил]бензимидазол-7-карбоксилата в соответствии с процедурой, описанной в рабочем примере 47. Выход 66%, т.пл. 204 - 206°C (разлож.). Элементный анализ для C25H23 N7O2 × 0,5 H2O. Вычислено, %: C 64,92; H 5,23; N 21,20. Найдено, %: C 65,22; H 5,31; N 21,11. 1 Н-ЯМР (200МГц, CDCl3) d: 1,13 (3Н, т); 2,93 (3Н, с); 3,27 (2Н, м); 5,54 (2Н, с); 6,68 (2Н, д); 6,92 (2Н, д); 7,13 (1Н, т); 7,43 - 7,48 (2Н, м); 7,53 - 7,67 (2Н, м). ИК (KBr), см-1: 1725, 1620, 1550, 1540, 1460, 1440, 1420, 1300, 1250, 775. Рабочий пример 73. 2-Бутиламино-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7-карбоновая кислота. Целевое соединение получали в виде бесцветных кристаллов из метил 2-бутиламино-1-[[2'-(1Н-тетразол-5ил)бифенил-4-ил-]метил]бензимидазол-7-карбоксилата в соответствии с процедурой, описанной в рабочем примере 47. Выход 67%, т.пл. 213 - 216°C (разлож.). Элементный анализ для C26H25 N7O2 × H2O. Вычислено, %: C 64,32; H 5,60; N 20,19. Найдено, %: C 64,07; H 5,77; N 20,16. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 0,89 (3Н, т); 1,22 - 1,41 (2Н, м); 1,51 - 1,66 (2Н, м); 3,34 - 3,43 (2Н, м); 5,65 (2Н, с); 6,83 (2Н, д); 6,97 - 7,05 (3Н, м); 7,29 (1Н, дд); 7,40 - 7,67 (5Н, м). ИК (KBr), см-1: 1660, 1580, 1540, 1485, 1440, 1380, 1340, 1215, 850, 810, 780, 760, 750. Рабочий пример 74. 2-Этокси-1-[(2'-карбоксибифенил-4-ил]метил]бензимидазол-7-карбоновая кислота. К раствору метил 2-этокси-1-[(2'-метоксикарбонилбифенил-4-ил)метил]бензимидазол-7-карбоксилата (0,7г), в метаноле (10мл) добавляли 1н. NaOH (5мл) и полученную смесь размешивали при 80°C в течение 3ч. После выпаривания метанола, водный остаток нейтрализовали с помощью 1н. HCl и получали кристаллы. После перекристаллизации этих кристаллов из смеси метанола и хлороформа получали бесцветные кристаллы (0,54г, 83%), т.пл. 213 - 215°C. Элементный анализ для C24H20 N2O5. Вычислено, %: C 69,22; H 4,84; N 6,73. Найдено, %: C 68,98; H 4,89; N 6,71. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 1,42 (3Н, т); 4,61 (2Н, кв); 5,68 (2Н, с); 7,01 (2Н, д); 7,13 - 7,56 (7Н, м); 7,64 - 7,71 (2Н, м). ИК (чистый), см-1: 1725, 1545, 1460, 1420, 1380, 1280, 1260, 1230, 1205, 1120, 1030, 760. Рабочий пример 75. Метил 2-этиламино-1-[[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]бензимидазол-7карбоксилат. Целевое соединение получали в виде бесцветных кристаллов из метил 2-этиламино-1-[(2'-цианофенил-4ил)метил]бензимидазол-7-карбоксилата в соответствии с процедурой, описанной в рабочем примере 41. Выход 63%, т.пл. 256 - 258°C. Элементный анализ для C25H23 N7O2 × H2O. Вычислено, %: C 63,68; H 5,34; N 20,79. Найдено, %: C 63,99; H 5,09; N 20,68. 1 Н-ЯМР (200МГц, ДМСО-d6) d: 1,21 (3Н, т); 3,40 - 3,60 (2Н, м); 3,63 (3Н, с); 5,47 (2Н, с); 6,78 (2Н, д); 6,98 - 7,05 (3Н, м); 7,18 (1Н, дд); 7,42 - 7,66 (5Н, м). ИК (чистый), см-1: 1710, 1660, 1645, 1430, 1340, 1300, 1280, 1250, 1050, 740. Рабочий пример 76. Метил 1-[2'-(1Н-тетразол-5-ил)бифенил-4-ил]метил]2-(2,2,2трифторэтокси)бензимидазол-7-карбоксилат. Целевое соединение получали в виде бесцветных кристаллов (игольчатой формы, 0,37г, 77%) из метил 1-[(2'цианобифенил-4-ил)метил]-2-(2,2,2-трифторэтоксибензимидазол-7-карбоксилата (0,48г) в соответствии с процедурой, описанной в рабочем примере 28; т.пл. 210 - 212°C. Элементный анализ для C25H19F3N6O3. Вычислено, %: C 59,06; H 3,77; N 16,53. Найдено, %: C 59,02; H 3,71; N 16,36. 1 Н-ЯМР (200МГц, CDCl3) d: 3,82 (3Н, с); 5,01 (2Н, кв); 5,64 (2Н, с); 6,99 (2Н, д); 7t14 (2Н, д); 7,25 (1Н, т); 7,37
ДивитисяДодаткова інформація
Автори англійськоюKATO TAKESHI
Автори російськоюКато Такеси
МПК / Мітки
МПК: C07D 405/14, C07D 403/10, C07D 235/30, C07D 235/26, A61K 31/415, C07D 235/18
Мітки: бензимідазолу, інгібітори, іі, ангіотензину, фармацевтично, солі, кристал, придатні, стабільний, похідні, композиція, основі
Код посилання
<a href="https://ua.patents.su/38-26570-pokhidni-benzimidazolu-yak-ingibitori-angiotenzinu-ii-kh-farmacevtichno-pridatni-soli-stabilnijj-kristal-ta-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні бензімідазолу, як інгібітори ангіотензину іі, їх фармацевтично придатні солі, стабільний кристал та композиція на їх основі</a>
Попередній патент: Способ виділення рекомбінантного соматотропіну
Наступний патент: Спосіб отримання високощільних спечених виробів
Випадковий патент: Похідні індолу, композиція на їх основі (варіанти) та їх застосування