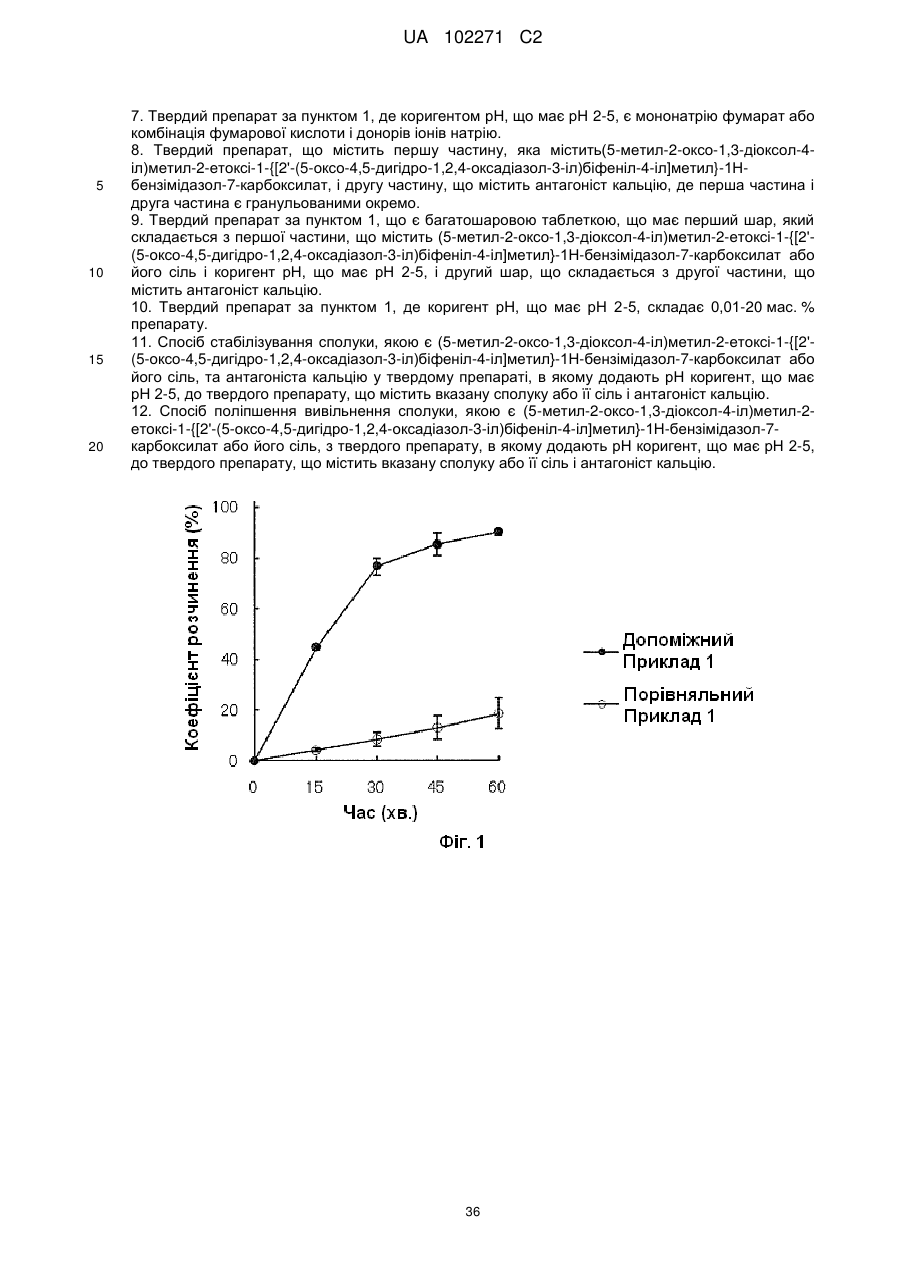
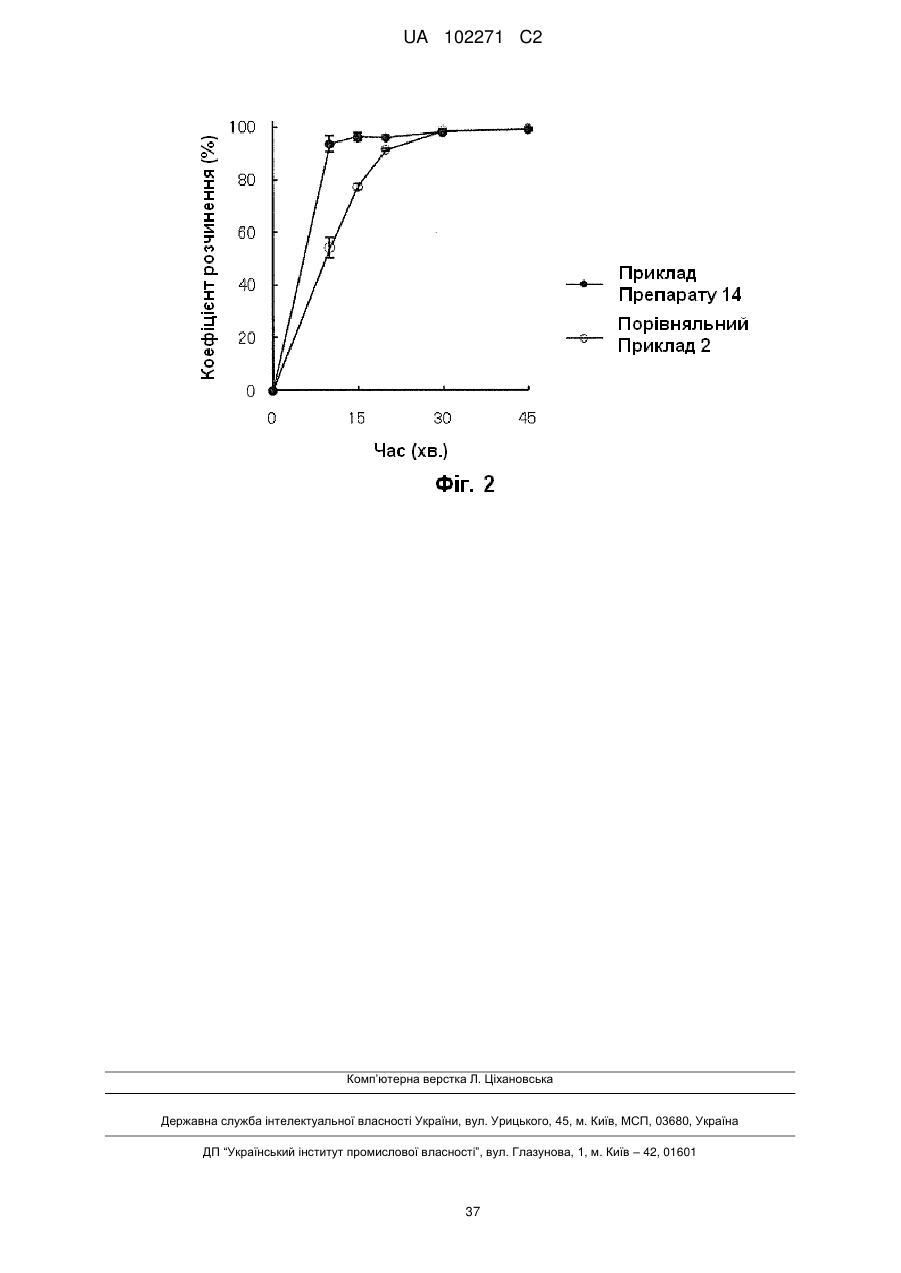
Тверда фармацевтична композиція (5-метил-2-оксо-1,3-діоксол-4-іл)метил-2-етоксі-1-{[2′-(5-оксо-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1н-бензімідазол-7-карбоксилату
Формула / Реферат
1. Твердий препарат, що містить (5-метил-2-оксо-1,3-діоксол-4-іл)метил-2-етокси-1-{[2'-(5-оксо-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1Н-6ензімідазол-7-карбоксилат або його сіль, коригент рН, що має рН 2-5, і антагоніст кальцію.
2. Твердий препарат за пунктом 1, де сполукою або її сіллю є калієва сіль (5-метил-2-оксо-1,3-діоксол-4-іл)метил-2-етокси-1-{[2'-(5-оксо-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1Н-6ензімідазол-7-карбоксилату.
3. Твердий препарат за пунктом 1 або 2, де антагоністом кальцію є амлодипін або його кислотноадитивна сіль.
4. Твердий препарат за пунктом 1 або 2, де антагоністом кальцію є амлодипіну бесилат.
5. Твердий препарат за пунктом 1, де сполукою або її сіллю є калієва сіль (5-метил-2-оксо-1,3-діоксол-4-іл)метил-2-етокси-1-{[2'-(5-оксо-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1Н-6ензімідазол-7-карбоксилату і антагоністом кальцію є амлодипіну бесилат.
6. Твердий препарат за пунктом 1, де коригентом рН, що має рН 2-5, є кисла речовина,
вибрана з винної кислоти, лимонної кислоти, молочної кислоти, фумарової кислоти, бурштинової кислоти, фосфорної кислоти, яблучної кислоти, аскорбінової кислоти, оцтової кислоти і кислої амінокислоти або їх солей, або сольватів.
7. Твердий препарат за пунктом 1, де коригентом рН, що має рН 2-5, є мононатрію фумарат або комбінація фумарової кислоти і донорів іонів натрію.
8. Твердий препарат, що містить першу частину, яка містить(5-метил-2-оксо-1,3-діоксол-4-іл)метил-2-етокси-1-{[2'-(5-оксо-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1Н-6ензімідазол-7-карбоксилат, і другу частину, що містить антагоніст кальцію, де перша частина і друга частина є гранульованими окремо.
9. Твердий препарат за пунктом 1, що є багатошаровою таблеткою, що має перший шар, який складається з першої частини, що містить (5-метил-2-оксо-1,3-діоксол-4-іл)метил-2-етокси-1-{[2'-(5-оксо-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1Н-6ензімідазол-7-карбоксилат або його сіль і коригент рН, що має рН 2-5, і другий шар, що складається з другої частини, що містить антагоніст кальцію.
10. Твердий препарат за пунктом 1, де коригент рН, що має рН 2-5, складає 0,01-20 мас. %
препарату.
11. Спосіб стабілізування сполуки, якою є (5-метил-2-оксо-1,3-діоксол-4-іл)метил-2-етокси-1-{[2'-(5-оксо-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1Н-6ензімідазол-7-карбоксилат або його сіль, та антагоніста кальцію у твердому препараті, в якому додають рН коригент, що має рН 2-5, до твердого препарату, що містить вказану сполуку або її сіль і антагоніст кальцію.
12. Спосіб поліпшення вивільнення сполуки, якою є (5-метил-2-оксо-1,3-діоксол-4-іл)метил-2-етокси-1-{[2'-(5-оксо-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1Н-6ензімідазол-7-карбоксилат або його сіль, з твердого препарату, в якому додають рН коригент, що має рН 2-5, до твердого препарату, що містить вказану сполуку або її сіль і антагоніст кальцію.
Текст
Реферат: Даний винахід стосується твердого препарату, який містить (5-метил-2-оксо-1,3-діоксол-4іл)метил-2-етоксі-1-{[2'-(5-оксо-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1н UA 102271 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 102271 C2 бензімідазол-7-карбоксилат або його сіль, коригент рН та антагоніст кальцію, що має кращу розчинність, стабільність і т. п. UA 102271 C2 5 10 15 20 25 ГАЛУЗЬ ВИНАХОДУ Даний винахід відноситься до твердого препарату, що включає сполуку, представлену формулою (I), показаною нижче, коригент рН та антагоніст кальцію, що має кращу стабільність і розчинність сполуки (I), представленої формулою (I), і антагоністу кальцію. Попередній рівень техніки Важливо, щоб фармацевтичні продукти були ефективними й безпечними. Хоча фармацевтичний продукт є ефективним і безпечним безпосередньо після виробництва, але якщо препарат легко розкладається або змінює властивості під час розповсюдження фармацевтичного продукту, він, як вважають, не є ефективним й безпечним фармацевтичним продуктом. Тому стабільність препарату надзвичайно важлива для фармацевтичних продуктів. Щоб забезпечити ефективність і безпечність фармацевтичного продукту, надзвичайно важливими є не тільки ефективність і безпечність самого активного інгредієнта, але також і властивості фармацевтичного препарату, такі як розчинність препарату в організмі й т.п. Наприклад, коли вивільнення активної речовини з фармацевтичного препарату занадто повільне, концентрація препарату у крові не досягає ефективного рівня, і очікувана ефективність не може бути досягнена. З іншого боку, коли вивільнення активної речовини з фармацевтичного препарату занадто швидке, концентрація препарату у крові різко збільшується, викликаючи високий ризик побічних ефектів. Інакше кажучи, фармацевтичні продукти зобов'язані гарантувати стабільність препарату й певний рівень розчинення препарату, на додаток до ефективності й безпеки. В той же час, розчинність препарату, як відомо, корелює з його солюбільністю. Взагалі, більш низька солюбільність препарату, як відомо, викликає більше повільну розчинність препарату. Випадково було виявлено, похідна бензімідазолу (I), що має сильну антагоністичну активність щодо рецепторів ангіотензину ІІ R1 CH2 R2 N O R3 N (I) 1 30 35 40 45 50 в якій R - моноциклічна азотмістка гетероциклічна група, що має атом водню, що може бути 2 3 депротонізований, R - естерифікована карбоксильна група, і R довільно заміщений нижчим алкілом, або її сіль (надалі іноді згадувана як сполука (I), зокрема, сіль (5-метил-2-oксo-1,3діоксол-4-іл)метил 2-етоксі-1-{[2'-(5-oксo-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}1H-бензімідазол-7-карбоксилат (патентний документ 1) є багатообіцяючим терапевтичним препаратом для лікування гіпертензії й т.п. Однак, властивості фармацевтичного препарату повинні бути відрегульовані, щоб стабілізувати сполуку (I), оскільки сполука (I) нестабільна у нейтральному діапазоні рН, в якому взагалі одержують фармацевтичні препарати. Тим не менш, солюбільність сполуки (I) низька в діапазоні рН, в якому сполука (I) є стабільною. Крім того, комбінований препарат, що складається із сполуки (I) та активних інгредієнтів, таких як антагоніст кальцію й т.п., не може бути легко утворений у фармацевтичний препарат, що має кращу стабільність й розчинність внаслідок різних хімічних властивостей. Як комбінований лікарський продукт відомі комбінація сполуки, що має ангіотензин II антагоністичну активність, та сполуки, що має кальцієву антагоністичну активність (патентний документ2) і пероральний твердий препарат, що містить ацетамінофен, отриманий способом роздільного гранулювання, щоб інгібувати небажаний смак ацетамінофену та запобігти його знебарвленню (патентний документ3). Однак, комбінований препарат сполуки (I) та антагоністу кальцію, що одночасно досягає стабільності й солюбільності, тобто, розчинності, не був відомий. ПЕРЕЛІК ПРОТИСТАВЛЕНИХ МАТЕРІАЛІВ ПАТЕНТНА ЛІТЕРАТУРА [патентний документ1] WO2005/080384 [патентний документ2] US-B-5721263 [патентний документ3] JP-A-2001-294524 1 UA 102271 C2 5 10 15 20 КОРОТКИЙ ЗМІСТ ВИНАХОДУ ПРОБЛЕМИ, ЯКІ ВИРІШУЮТЬСЯ ВИНАХОДОМ Препарат, що включає сполуку (I) і антагоніст кальцію, є ефективним для профілактики або лікування захворювань органів кровообігу, таких як гіпертензія, серцева недостатність, діабетична нефропaтія, артеріосклероз і т.п., і має надзвичайно високо клінічну корисність. Задачею даного винаходу є одержання твердого препарату, що має покращену стабільність сполуки (I) і антагоністу кальцію, а також само їх розчинність. ЗАСОБИ ВИРІШЕННЯ ПРОБЛЕМ Винахідники провели інтенсивні дослідження в спробі одночасно досягти стабільності сполуки (I) у препараті й вивільнення її з препарату, і виявили, що задача може бути несподівано вирішена співприсутністю рН коригента і сполуки (I), і додатково шляхом регулювання рН коригентом, пристосовуючи діапазон рН твердого препарату до діапазону рН, в якому солюбільність сполуки (I) стає низькою. Вони також виявили, що навіть, коли сполука (I) і антагоніст кальцію використовуються в комбінації, вони обоє показують кращу стабільність. Крім того, вони виявили, що сполука (I) і антагоніст кальцію можуть бути додатково стабілізовані окремим гранулюванням сполуки (I) з додаванням рН коригенту та антагоністу кальцію, і препарат має більшу розчинність сполуки (I) у порівнянні із загальними гранульованими препаратами, що приводить до завершення даного винаходу. Відповідно, даний винахід охоплює наступне. (1) Твердий препарат, що включає сполуку, представлену формулою (I) R1 CH2 R2 N O R3 N (I) 1 25 30 35 40 45 в якій R є моноциклічна азотмістка гетероциклічна група, що має атом водню, що може бути 2 3 депротонізований, R - естерифікована карбоксильна група, і R довільно заміщений нижчим алкілом або її сіль, коригент рН й антагоніст кальцію. (2) Твердий препарат вищезгаданого (1), де сполукою, представленою формулою (I), або її сіллю є (5-метил-2-oксo-1,3-діоксол-4-іл)метил2-етоксі-1-{[2'-(5-oксo-4,5-дигідро-1,2,4оксадіазол-3-іл)біфеніл-4-іл]метил}-1H-бензімідазол-7-карбоксилатом калію. (3) Твердий препарат вищезгаданих (1) або (2), де антагоністом кальцію є амлодипін або його кислотно-адитивна сіль. (4) Твердий препарат вищезгаданих (1) або (2), де антагоністом кальцію є амлодипіну бесилат. (5) Твердий препарат вищезгаданого (1), де сполукою, представленою формулою (I), або її сіллю є (5-метил-2-oксo-1,3-діоксол-4-іл)метил2-етоксі-1-{[2'-(5-oксo-4,5-дигідро-1,2,4оксадіазол-3-іл)біфеніл-4-іл]метил}-1H-бензімідазол-7-карбоксилат калію, а антагоністом кальцію є амлодипіну бесилат. (6) Твердий препарат вищезгаданого (1), де рН коригент має рН 2-5. (7) Твердий препарат вищезгаданого (1), де коригентом рН є кислотна речовина, вибрана з винної кислоти, лимонної кислоти, молочної кислоти, фумарової кислоти, бурштинової кислоти, фосфорної кислоти, яблучної кислоти, аскорбінової кислоти, оцтової кислоти й кислої амінокислоти або їх солей, або сольватів. (8) Твердий препарат вищезгаданого (1), де коригентом рН є монофумарат натрію або комбінація фумарової кислоти та донора іонів натрію. (9) Твердий препарат, що включає першу частину, яка містить сполуку, представлену формулою (I): 2 UA 102271 C2 R1 R2 CH2 N O R3 N (I), 1 5 де R - моноциклічна азотмістка гетероциклічна група, що має атом водню, що може бути 2 3 депротонізований, R - естерифікована карбоксильна група, і R є довільно заміщений нижчим алкілом, або її сіль та рН коригент, і другу частину, що включає антагоніст кальцію, де перша частина і друга частина індивідуально гранульовані. (10) Твердий препарат вищезгаданого (1), що є багатошаровою таблеткою, яка має перший шар, що складається з першої частини, яка містить сполуку, представлену формулою (I): 10 R1 R2 CH2 N O R3 N (I), 1 15 20 де R - моноциклічна азотмістка гетероциклічна група, що має атом водню, який може бути 2 3 депротонізований, R - естерифікована карбоксильна група, і R є довільно заміщений нижчим алкілом, або її сіль та рН коригент, і другий шар, що складається із другої частини, яка містить антагоніст кальцію. (11) Твердий препарат вищезгаданого (1), де коригент рН міститься в кількості 0,01-20 ваг. % препарату. (12) Спосіб стабілізування сполуки, представленої формулою (I): R1 R2 CH2 N O R3 N (I), 1 25 30 де R - моноциклічна азотмістка гетероциклічна група, що має атом водню, який може бути 2 3 депротонізований, R - естерифікована карбоксильна група, і R є довільно заміщений нижчим алкілом, або її солі та антагоністу кальцію у твердому препараті, який включає додавання рН коригента до твердого препарату, що містить сполуку, представлену формулою (I), або її сіль, і антагоніст кальцію. (13) Спосіб покращення вивільнення сполуки, представленої формулою (I), або її солі із твердого препарату, який включає додавання рН коригента до твердого препарату, що містить сполуку, представлену формулою (I): 3 UA 102271 C2 R1 CH2 R2 N O R3 N (I), 1 5 10 15 де R - моноциклічна азотмістка гетероциклічна група, що має атом водню, що може бути 2 3 депротонізований, R - естерифікована карбоксильна група, і R є довільно заміщений нижчим алкілом, або її солі, і антагоністу кальцію; і т.п. КОРОТКИЙ ОПИС ФІГУР Фіг. 1 показує коефіцієнт розчинення таблеток, отриманих у Прикладі 1 та Порівняльному Прикладі 1. Фіг. 2 показує коефіцієнт розчинення таблеток, отриманих у Прикладі Композиції 14 і Порівняльному Прикладі 2. Детальний Опис Винаходу Твердий препарат даного винаходу описується детально нижче. Твердий препарат даного винаходу включає сполуку (I), коригент рН й антагоніст кальцію. Твердий препарат даного винаходу має кращу стабільність сполуки (I), а також кращу розчинність сполуки. Крім того, кращу стабільність має антагоніст кальцію. 1 У вищезгаданій формулі (I), в якій R - моноциклічна азотмістка гетероциклічна група, що має атом водню, що може бути депротонізований, переважними є тетразолільна група або група, представлена формулою 20 25 де і є -O- або -S-, j є >C=O, >C=S або >S(O)m, де m є 0, 1 або 2 (наприклад, 4,5-дигідро-5oксo-1,2,4-оксадіазол-3-ільна група і т.д.) та подібні. 4,5-Дигідро-5-oксo-1,2,4-оксадіазол-3-ільна група включає три таутомери (а', b' та c'), представлені формулами: N O N O HN O O OH N H a' 30 35 40 O N N b' c' і група 4,5-дигідро-5-oксo-1,2,4-оксадіазол-3-іл включає всі вищезгадані а', b' та c'. 2 У вищезгаданій формулі (I) R - естерифікована карбоксильна група, наприклад, переважно карбоксильна група, естерифікована нижчим (C1-4)алкілом, довільно заміщеним замісником, вибраним із гідроксильної групи, аміногрупи, атома галогену, нижчої (C 2-6) алканоїлоксигрупи (наприклад, ацетилокси, півалоїлокси, і т.д.), нижчої (C 4-7) циклоалканоїлоксигрупи (нижчої (C1-6) алкокси)карбонілоксигрупи (наприклад, метоксикарбонілокси, етоксикарбонілокси, і т.д.), (нижчої (C3-7) циклоалкокси)карбонілоксигрупи (наприклад, циклогексилоксикарбонілокси, і т.д.), нижчої (C1-4)алкоксигрупи та 5-метил-2-oксo-1,3-діоксолен-4-ілу (наприклад (5-метил-2-oксo-1,3діоксолен-4-іл)метоксикарбонільної групи, 1-(циклогексилоксикарбонілокси) етоксикарбонільної групи) і т.п. 3 У вищезгаданій формулі (I), R є довільно заміщений нижчий алкіл і переважно нижчий (C 15)алкіл, довільно заміщений замісником, вибраним з гідроксильної групи, аміногрупи, атома галогену та нижчої (C1-4) алкоксигрупи (переважно нижчий (C2-3) алкіл; особливо переважно, 4 UA 102271 C2 5 10 15 20 25 30 35 40 45 50 55 60 етил). Як сіль сполуки, представленої формулою (I), може бути згадана фармацевтично прийнятна сіль і можуть бути згадані, наприклад, сіль сполуки, представленої формулою (I) з неорганічною основою, її сіль з органічною основою, її сіль з неорганічною кислотою, її сіль з органічною кислотою, її сіль з основною або кислою амінокислотою й т.п. Переважні приклади солей з неорганічною основою включають сіль лужного металу, таку як натрієва сіль, калієва сіль і т.п.; сіль лужно-земельного металу, таку як сіль кальцію, сіль магнію і т.п.; алюмінієва сіль, сіль амонію й т.п. Переважні приклади солей з органічною основою включають солі з триметиламіном, триетиламіном, піридином, піколіном, етаноламіном, диетаноламіном, триетаноламіном, дициклогексиламіном, N, N'-дибензилетилендіаміном і т.п. Переважні приклади солей з неорганічною кислотою включають солі із соляною кислотою, бромоводневою кислотою, азотною кислотою, сірчаною кислотою, фосфорною кислотою і т.п. Переважні приклади солей з органічною кислотою включають солі з мурашиною кислотою, оцтовою кислотою, трифтороцтовою кислотою, фумаровою кислотою, щавлевою кислотою, винною кислотою, малеїновою кислотою, лимонною кислотою, бурштиновою кислотою, яблучною кислотою, метансульфоновою кислотою, бензолсульфоновою кислотою, п-толуолсульфоновою кислотою і т.п. Переважні приклади солей з основною амінокислотою включають солі з аргініном, лізином, орнітином і т.п. Переважні приклади солей з кислою амінокислотою включають солі з аспарагіновою кислотою, глутаміновою кислотою і т.п. Як сполука, представлена формулою (I) або її сіль переважною є сіль (5-метил-2-oксo-1,3діоксол-4-іл)метил 2-етоксі-1-{[2'-(5-oксo-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}1H-бензімідазол-7-карбоксилат, і особливо переважною (5-метил-2-oксo-1,3-діоксол-4іл)метил2-етоксі-1-{[2'-(5-oксo-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1Hбензімідазол-7-карбоксилат калію. Сіль сполуки, представленої формулою (I), може бути гідратом або негідратом. Крім того, сполука (I) може бути сольватом, включаючи гідрат або несольват. Сполука (I) переважно є кристалічною, і переважно має температуру плавлення 100-250 °C, переважно 120-200 °С, переважно 130-180 °С. Сполука (I) міститься у твердому препараті даного винаходу в пропорції 0,1-60 ваг. %, переважно 1-40 ваг. %, більш переважно 5-30 ваг. %. Як коригент рН, що буде використовуватися в даному винаході, може використовуватися будь-який рН коригент, що дозволяє одночасно досягти стабільності сполуки (I) у препараті та вивільнення її з препарату, і є придатним для фармацевтичних продуктів. Безліч рН коригентів можуть використовуватися в комбінації. Як коригент рН, що буде використовуватися в даному винаході, переважно використовується коригент рН, що показує рН від приблизно 2 до приблизно 5, переважно від приблизно 3 до приблизно 5, більш переважно, від приблизно 3 до приблизно 4. Наприклад, кислотна речовина, така як винна кислота, лимонна кислота, молочна кислота, фумарова кислота, фосфорна кислота, яблучна кислота, бурштинова кислота, аскорбінова кислота, оцтова кислота, кисла амінокислота (наприклад, глутаміновая кислота, аспарагінова кислота) і т.п., неорганічні солі цих кислотних речовин (наприклад, сіль лужного металу, сіль лужно-земельного металу, сіль амонію, і т.д.). солі цих кислотних речовин з органічною основою (наприклад, основна амінокислота, така як лізин, аргінін, і т.д., меглумін, і т.д.), і їх сольват (наприклад, гідрат),і т.п. використовуються. Крім того, коригент рН одночасно надає стабільності антагоністам кальцію в препараті та сприяє вивільненню з препарату. Тут, рН коригента рН визначали за наступних умов. Щоб бути точним, це є рН розчину або суспензії, отриманих розчиненням або суспендуванням рН коригента у воді у концентрації 1 % ваг./об. при 25 °С. Як коригент рН, що буде використовуватися в даному винаході, кислотну речовину й основну речовину комбінують, і отриманий коригент рН може бути пристосований таким чином, що рН розчину або суспензії становить приблизно від 2 до приблизно 5, переважно від приблизно 3 до приблизно 5, більш переважно від приблизно 3 до приблизно 4, коли комбінований коригент рН розчинений або суспендований у воді в 25C у концентрації 1 % ваг./об. Приклади кислотної речовини, що буде використовуватися в комбінації, включають, крім кислотних речовин, що мають згаданий вище рН від приблизно 2 до приблизно 5, та їх солей, сильні кислоти, такі як соляна кислота, сірчана кислота, фосфорна кислота й т.п. Приклади основної речовини, що буде використовуватися в комбінації, включають неорганічні основи (наприклад, гідроксид натрію, гідроксид калію, карбонат натрію, гідрокарбонат натрію, карбонат магнію, карбонат кальцію, оксид магнію, аміак, синтетичний гідротальцит), органічні основи (наприклад, основна амінокислота, така як лізин, аргінін, і т.д., меглумін, і т.п.) і т.п. 5 UA 102271 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, переважні приклади рН коригента, що буде використовуватися в даному винаході, включають рН коригенти, у розчинів яких є буферна здатність при згаданому рН, такі як дигідрофосфат натрію, фумарат мононатрію, комбінація фумарової кислоти та донора іона натрію й т.п. Як коригент рН, що буде використовуватися в даному винаході, особливо переважним є монофумарат натрію або комбінація фумарової кислоти і донора іона натрію, і фумарова кислота і гідроксид натрію можуть використовуватися в комбінації. Твердий препарат даного винаходу містить рН коригент у пропорції 0,01-20 ваг. %, переважно 0,05-10 ваг. %, більш переважно 0,1-5 ваг. %. Приклади антагоніста кальцію в даному винаході включають: манідипін, ніфедипін, амлодипін, ефлонідипін, нікардипін і т.п. Антагоніст кальцію в даному винаході також включає солі сполук, наведених як вищезгадані антагоністи кальцію. Як антагоніст кальцію в даному винаході переважним э амлодипін або його солі, більш переважними є амлодипін або його кислотно-адитивна сіль, і сіль амлодипіну є додатково переважною. Як сіль амлодипіну переважними є амлодипіну бесилат, амлодипіну малеат і т.п. і більш переважним є амлодипіну бесилат Антагоніст кальцію в даному винаході загалом міститься у твердому препараті в кількості 0,05-60 ваг. % (відповідно відрегульовано так, щоб загальна кількість сполуки (I) і коригента рН не буде перевищувати 100 %), переважно 0,1-40 ваг. %, більш переважно 0,5-20 ваг. %. Зокрема, амлодипін (базуючись на вільній формі) загалом міститься в кількості 0,05-60 ваг. %, переважно 0,1-40 ваг. %, більш переважно 0,5-20 ваг. %. Переважною формою твердого препарату даного винаходу є, наприклад, препарат, в якому сполукою (I) є (5-метил-2-oксo-1,3-діоксол-4-іл)метил2-етоксі-1-{[2'-(5-oксo-4,5-дигідро-1,2,4оксадіазол-3-іл)біфеніл-4-іл]метил}-1H-бензімідазол-7-карбоксилат калію і антагоністом кальцію - амлодипіну бесилат. Приклади твердого препарату даного винаходу включають тверду дозовану форму, що прийнятна для перорального призначення, таку як таблетки, гранули, тонкі гранули, капсули, пігулки й т.п. Відповідно, варіанти реалізації твердого препарату даного винаходу включають наступні препарати й т.п. (1) Твердий препарат, одержуваний гранулюванням суміші сполуки (I), коригента рН та антагоністу кальцію (єдиний грануляційний препарат). (2) Твердий препарат, що включає першу частину, яка містить сполуку (I) і pН коригент, і другу частину, яка містить антагоніст кальцію, одержаний окремим гранулюванням першої частини і другої частини (препарат відокремленого гранулювання - одношарова таблетка). (3a) Твердий препарат, одержаний компресійним формуванням першої частини й другої частини, кожна незалежно гранульована (препарат відокремленого гранулювання багатошарова таблетка). (3b) Твердий препарат, одержаний покриттям однієї частини іншою частиною в індивідуально гранульованій першій частині й другій частині (препарат окремого гранулювання оболонкова таблетка). Твердий препарат вищезгаданого (1) (єдиний грануляційний препарат), що одночасно досягає вивільнення сполуки (I) і антагоністу кальцію з препарату та його стабільності внаслідок додавання рН коригента. У твердих препаратах вищезгаданих (2), (3a) і (3b) (препарати відокремленого гранулювання) більш поліпшена розчинність й стабільність сполуки (I) і антагоністу кальцію. Твердий препарат вищезгаданого (1) може бути одержаний відповідно до способу, відомому per se (наприклад, спосіб, описаний у General Rules for Preparations, The Japanese Pharmacopoeia 14th Edition). Наприклад, для одержання таблеток сполуку (I), коригент рН, антагоніст кальцію, добавки й т.п. змішували, додавали зв'язуючий компонент, щоб одержати гранули, додавали до гранул лубрикант й т.п., і суміш таблетували, щоб одержати таблетку. Гранули й мікрогранули можуть також бути одержані способом, подібним для таблеток. Капсули можуть бути одержані наповненням вищезгаданими гранулами або мікрогранулами капсул, що містять желатин, гідроксипропілметилцелюлозу і т.п. або заповненням активним інгредієнтом разом з наповнювачем капсул, що містить желатин, гідроксипропілметилцелюлозу і т.п. Для виробництва твердого препарату можуть бути додані добавки, традиційно використовувані в галузі фармацевтичних препаратів. Приклади добавок включають наповнювач, дезінтегрант, зв'язуючий компонент, лубрикант, барвник, коригент рН, поверхневоактивну речовину, стабілізатор, підкислювач, ароматизатор, агент ковзання і т.п. Ці добавки 6 UA 102271 C2 5 10 15 20 25 30 35 40 45 50 55 60 використовуються в кількості, традиційно використовуваній в галузі фармацевтичних препаратів. Приклади наповнювача включають крохмалі, такі як кукурудзяний крохмаль, картопляний крохмаль, пшеничний крохмаль, рисовий крохмаль, частково пептизований крохмаль, пептизований крохмаль, пористий крохмаль і т.п.; цукор або цукрові спирти, такі як лактоза, фруктоза, глюкоза, маніт (наприклад, D-маніт), сорбіт (наприклад, D-сорбіт), еритрит (наприклад, D-еритрит), сахароза й т.п.:безводний фосфат кальцію, кристалічна целюлоза, мікрокристалічна целюлоза, Glycyrrhiza uralensis, гідрокарбонат натрію, фосфат кальцію, сульфат кальцію, карбонат кальцію, осаджений карбонат кальцію, силікат кальцію і т.п. Приклади дезінтегрантів включають наступні: амінокислота, крохмаль, кукурудзяний крохмаль, карбоксиметилцелюлоза, кальцій карбоксиметилцелюлоза, натрій карбоксиметил крохмаль, кармелоза натрій, кармелоза кальцій, кроскармелоза натрій, кросповідон, низько заміщена гідроксипропілцелюлоза, гідроксипропілкрохмаль, натрій карбоксиметил крохмаль і т.п. Приклади сполучного компонента включають кристалічну целюлозу (наприклад, мікрокристалічну целюлозу), гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, полівінілпіролідон, желатин, крохмаль, порошок аравійської камеді, трагакант, карбоксиметилцелюлозу, альгінат натрію, пулулан, гліцерин і т.п. Переважні приклади лубрикантів включають стеарат магнію, стеаринову кислоту, стеарат кальцію, тальк (очищений тальк), сахарозні естери жирних кислот, стеарилфумарат натрію і т.п. Приклади барвників включають харчові барвники, такі як As Food Color Yellow No.5, Food Color Red No. 2, Food Color Blue No. 2 і т.п., харчові краплаки, червоний оксид заліза і т.п. Приклади поверхнево-активних речовин включають лаурилсульфат натрію, полісорбат 80, поліетиленоксид(160) поліоксипропілен(30)гліколь і т.п. Приклади стабілізатора включають токоферол, едетат тетранатрію, нікотинамід, циклодекстрини і т.п. Приклади підкислювачів включають аскорбінову кислоту, лимонну кислоту, винну кислоту, яблучну кислоту й т.п. Приклади ароматизаторів включають ментол, м'ятне масло, лимонне масло, ванілін і т.п. Приклади агентів ковзання включають безводну кремнієву кислоту, гідратований діоксид кремнію і т.п. Вищезгадані добавки можуть використовуватися в суміші двох або більше їх видів у відповідному співвідношенні. Твердий препарат вищезгаданого (2) включає першу частину й другу частину, які індивідуально гранульовані, і можуть бути одержані способом, відомим, per se. У твердому препараті вищезгаданого (2), перша частина даного винаходу - частина (композиція), що включає сполуку (I) і рН коригент. В даному винаході рН коригент використовується в кількості переважно 0,01-20 вагових частин, більш переважно 0,05-10 вагових частин, додатково переважно 0,1-5 вагових частин на 100 вагових частин вищезгаданої першої частини. Вагове співвідношення сполуки (I) до рН коригента (сполука (I):рН коригент), переважно 0,150:1, більш переважно 1-30:1, додатково переважно 5-25:1. Вищезгадана перша частина не обмежена, поки в неї є форма й розмір, що дозволяє утворенню твердого препарату разом з нижче згаданою другою частиною. Вищезгадана перша частина може додатково містити добавки, традиційно використовувані в галузі фармацевтичних препаратів. Як добавки, використовуються подібні вищезгаданим. Вищезгадана перша частина може бути одержана, змішуючи і гранулюючи сполуку (I), і рН коригент, разом з вищезгаданими добавками в міру необхідності відповідно до способу, відомому per se. Вищезгадана перша частина переважно містить сполуку (I) (переважно, (5-метил-2-oксo-1,3діоксол-4-іл)метил2-етоксі-1-{[2'-(5-oксo-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1Hбензімідазол-7-карбоксилат калію, надалі сполука A); коригент рН (переважно фумарову кислоту і гідроксид натрію); наповнювач (переважно маніт і кристалічну целюлозу); і сполучний компонент (переважно гідроксипропілцелюлозу). В даному винаході друга частина (композиція) містить антагоніст кальцію. Вищезгадана друга частина не обмежена, поки в неї є форма й розмір, що дозволяє утворенню твердого препарату разом з вищезгаданою першою частиною. Вищезгадана друга частина може додатково містити добавки, традиційно використовувані в галузі фармацевтичних препаратів. Як добавки, використовуються добавки, подібні вищезгаданим. 7 UA 102271 C2 5 10 15 20 25 30 35 40 45 50 55 60 Зокрема, вона містить антагоніст кальцію (переважно амлодипіну бесилат); наповнювач (переважно маніт і кристалічну целюлозу); і сполучний компонент (переважно гідроксипропілцелюлозу). Вищезгадана друга частина може бути одержана, змішуючи і гранулюючи антагоніст кальцію разом з вищезгаданими добавками в міру необхідності відповідно до способу, відомому per se. Антагоніст кальцію використовується в кількості переважно 0,1-60 вагових частин, більш переважно 0,5-40 вагових частин, додатково переважно 1-30 вагових частин на 100 вагових частин вищезгаданої другої частини. Вагове співвідношення другої частини до першої частини (друга частина: перша частина) у твердому препараті даного винаходу переважно 0,03-10:1, більш переважно 0,1-5:1, додатково переважно 0,3-3:1. Одношарову таблетку одержували, змішуючи індивідуально гранульовану першу і другу частину з добавками, традиційно використовуваними в галузі фармацевтичних препаратів, і потім пресуючи суміш, що також включено у твердий препарат даного винаходу. Капсулу одержували, наповнюючи капсулу вищезгаданою одношаровою таблеткою (наприклад, капсула з гідроксипропілметилцелюлози), що також охоплено твердим препаратом даного винаходу. Крім того, капсулу одержують безпосередньо наповнюючи капсулу першою частиною й другою частиною, які окремо гранульовані, або разом з вищезгаданими добавками (наприклад, капсула з гідроксипропілметилцелюлози), що також охоплено твердим препаратом даного винаходу. Твердий препарат вищезгаданого (3a) може бути одержаний, індивідуально гранулюючи першу частину й другу частину й компресійним формуванням цих частин. Твердий препарат вищезгаданого (3b) може бути одержаний, індивідуально гранулюючи першу частину й другу частину й вкриваючи одну з них іншою. Певні приклади вищезгаданого твердого препарату (3b) включають: [1] оболонкову таблетку (A), що включає внутрішнє ядро, що складається з першої частини й зовнішнього шару, що складається із другої частини; і [2] оболонкову таблетку (B), що включає внутрішнє ядро, що складається із другої частини й зовнішнього шару, що включає першу частину. Певні приклади вищезгаданого твердого препарату (3a) включають [3] багатошарову таблетку, що має перший шар, що складається з першої частини і другий шар, що складається із другої частини. Внутрішнє ядро, що cкладається з першої частини, може бути одержано, наприклад, гранулюючи сполуку (I) і рН коригент разом з добавками в міру необхідності. Крім того, операція, така як висушування, просівання, пресування і т.п. може бути виконана, де необхідно після грануляції. Зовнішній шар, що складається із другої частини, може бути одержаний, гранулюючи антагоніст кальцію (наприклад, амлодипін або його сіль) разом з добавками в міру необхідності. Покриття здійснюють, наприклад, пресуванням, покриттям й т.п. Крім того, добавка - переважно сполучний компонент і т.п. Під час продукування покритої таблетки (A), неактивний проміжний шар можна утворити між внутрішнім ядром і зовнішнім шаром, щоб запобігти прямому контакту між ними. Проміжний шар містить, наприклад, основу покриття й добавки покриття. Проміжний шар переважно містить розчинну у воді плівкову основу покриття й агент ковзання. Вищезгадана оболонкова таблетка (B) може бути одержана тим же самим способом як таблетка (A) за винятком того, що друга частина використовується як внутрішнє ядро, і перша частина використовується як зовнішній шар. Багатошарова таблетка в даному винаході - твердий препарат, що складається з першої частини, яка включає сполуку, представлену формулою (I) або її сіль й рН коригент, і другої частини, що включає антагоніст кальцію, що має перший шар, який складається з першої частини й другий шар, що складається із другої частини. Багатошарова таблетка в даному винаході особливо не обмежений, поки перший шар, що складається з першої частини й другий шар, що складається із другої частини, утворені інтегрально. Крім того, у багатошарової таблетки в даному винаході може бути неактивний проміжний шар між першим шаром і другим шаром. Коли в багатошарової таблетки даного винаходу є такий проміжний шар, несприятливі впливи (зменшена стабільність при зберіганні, такі як період розкладання активних інгредієнтів, знижена ефективність і т.п., зменшена стабільність розчинення, така як періодичні зміни в розчинності активних інгредієнтів і т.п., і так далі), спричинені взаємодією між активними інгредієнтами можуть бути більш ефективно пригнічені. Багатошарова таблетка може бути одержана, наприклад, відповідно до наступних стадій 8 UA 102271 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержання. Сполука (I) і коригент рН змішували з добавками в міру необхідності, одержану суміш гранулювали, щоб одержати першу частину. Операції, такі як висушування, просівання й т.п. можуть бути здійснені за необхідністю після грануляції. Потім, першу частину змішували з добавками в міру необхідності, щоб одержати перший шар. Після того, антагоніст кальцію гранулювали з добавками в міру необхідності, щоб одержати другу частину. Другу частину змішували з добавками в міру необхідності, щоб одержати другий шар. Другий шар поміщали у вищезгаданий перший шар і пресували (переважно таблетували). У цьому випадку, неактивний проміжний шар можна утворити між відповідними шарами, щоб уникнути прямого контакту між ними. Проміжний шар містить, наприклад, вищезгаданий наповнювач, дезінтегрант, зв'язуючий компонент, лубрикант, барвник і т.п. Капсулу одержували, наповнюючи вищезгадану покриту таблетку (A) або (B) або багатошарову таблетку у капсулу (наприклад, капсулу з гідроксипропілметилцелюлози), що також охоплено твердим препаратом даного винаходу. Крім того, вкритий оболонкою препарат, одержаний покриттям оболонкою твердого препарату вищезгаданого (1), (2), (3a) і (3b) з наступною основою покриття й добавками до покриття також охоплений твердим препаратом даного винаходу. Переважні приклади основ для покриття включають цукрову основу покриття, розчинну у воді плівкову основу покриття, ентеральну плівкову основу покриття, пролонгованого вивільнення основу для покриття й т.п. Як цукрова основа покриття, використовується сахароза. Крім того, один або більше видів, вибраних з наступних: тальк, осаджений карбонат кальцію, желатин, аравійська камедь, пулулан, карнаубский віск і т.п. можуть використовуватися в комбінації. Приклади гідросолюбільної плівкової основи для покриття включають полімери целюлози, такі як гідроксипропілцелюлоза [наприклад, марки: L, SL, SL-T, SSL (торговельна марка); Nippon Soda Co., Ltd.], гідроксипропілметилцелюлоза [наприклад, TC-5 (марки: МВТ, E, EW, R, RW) (торговельна марка); Shin-Etsu Chemical Co., Ltd.], гідроксиетилцелюлоза, метилгідроксиетилцелюлоза і т.п.; синтетичні полімери, такі як полівінілацеталь діетиламіноацетат, аміноалкілакрилатний співполімер E [Eudragit E (торговельна марка)], полівінілпіролідон і т.п.; полісахариди, такі як пулулан і т.п.; і так далі. Приклади ентеральної плівкової основи для покриття включають полімери целюлози, такі як фталатгідроксипропілметилцелюлози, гідроксипропілметилцелюлози ацетат сукцинат, карбоксиметилетилцелюлоза, фталат ацетилцеллюлози й т.п.; полімери акрилової кислоти, такі як співполімер L метакрилової кислоти [Eudragit L (торговельна марка)], співполімер LD метакрилової кислоти [Eudragit L-30D55 (торговельна марка)], співполімер S метакрилової кислоти [S Eudragit (торговельна марка)] і т.п.; природні речовини, такі як шелак і т.п.; і так далі. Приклади основ для плівкового покриття пролонгованого вивільнення включають полімери целюлози, такі як етилцеллюлоза й т.п.; полімери акрилової кислоти, такі як аміноалкілметакрилатний співполімер RS [Eudragit RS (торговельна марка)], етил акрилатметил метакрилатна співполімерна суспензія [Eudragit NE (торговельна марка)] і т.п.; і так далі. Переважні приклади добавок для покриття включають фотозахисні агенти, такі як оксид титану й т.п., агенти ковзання, такі як тальк і т.п., і/або барвники, такі як червоний оксид заліза, жовтий оксид заліза й т.п.; пластифікатори, такі як поліетиленгліколь [наприклад, макроголь 6000 (торговельна марка)], триетил цитрат, касторове масло, полісорбати й т.п.; органічні кислоти, такі як лимонна кислота, винна кислота, яблучна кислота, аскорбінова кислота й т.п.; і так далі. Крім того, твердий препарат даного винаходу може мати помітне тиснення або надруковані літери, або рифлену лінію для розділу. Твердий препарат даного винаходу переважно покритий плівкою, виходячи з аспектів легкості введення, механічної міцності й т.п. Операції, такі як змішування, пресування, покриття й т.п. у вищезгаданій стадії одержання здійснювали відповідно до способів, традиційно використовуваним у фармацевтичній галузі. Для змішування використовується, наприклад, змішувальні машини, такі як міксер V-типу, тумблерний міксер й т.п.; і гранулятор, такий як високошвидкісний міксерний гранулятор, гранулятор псевдозрідженого шару, екструзійний гранулятор, ролерний компактор й т.п. Пресування виконують, використовуючи, наприклад, ударну таблетувальну машину, роторну таблетувальну машину і т.п. Коли виконують пресування, використовуючи ударну таблетувальну машину, роторну 2 таблетувальну машину і т.п., взагалі переважно використовувати тиск таблетування 1-20 кН/см 2 (переважно 5-15 кН/см ), і додатково обробляючи конуси, щоб запобігти закупорюванню. 9 UA 102271 C2 5 10 15 20 25 30 35 40 45 50 55 60 Покриття здійснюють, використовуючи, наприклад, апарат для нанесення плівкового покриття й т.п. Твердий препарат даного винаходу може безпечно використовуватися як медикамент для ссавців (наприклад, людина, собака, кролик, пацюк, миша, і т.д.). Твердий препарат даного винаходу можна безпечно призначати перорально або перентерально (наприклад, ректально). У той час як доза сполуки (I) пацієнтам визначена з урахуванням віку, маси тіла, загального стану здоров'я, статі, дієти, часу введення, кліренсу, комбінації препаратів і т.п., так само як серйозності захворювання, від якого лікують пацієнта, щоденна доза - приблизно 0,05-500 мг, переважно 0,1-100 мг, для дорослого (масою тіла 60 кг). У той час як доза антагоніста кальцію пацієнтам визначена з урахуванням віку, маси тіла, загального стану здоров'я, статі, дієти, часу введення, кліренсу, комбінації препаратів і т.п., так само як серйозності захворювання, від якого лікують пацієнта, щоденна доза амлодипіну (базуючись на вільній формі) є приблизно 1-50 мг, переважно 2,5-10 мг, для дорослого (маса тіла 60 кг). Починаючи із сполуки (I), яка нормалізує внутрішньоклітинний інформаційний механізм трансдукції інсуліну, що є головною причиною інсулінорезистентності, зменшує інсулінорезистентність й підсилює дію інсуліну, і забезпечує ефект поліпшення глюкозотолерантності, це може використовуватися як агент для поліпшення або профілактики та/або лікування захворювань, що супроводжуються інсулінорезистентністю у ссавців (наприклад, людина, мавпа, кішка, свиня, кінь, бик, миша, пацюк, морська свинка, собака, кролик і т.п.). Приклади таких захворювань включають: інсулінорезистентність, погіршену глюкозотолерантність; діабет, такий як інсулін незалежний діабет, діабет ІІ типу, діабет ІІ типу, пов'язаний з інсулінорезистентністю, діабет ІІ типу, пов'язаний з погіршеною глюкозотолерантністю й т.п.; різні ускладнення, такі як гіперінсулінемія, гіпертензія пов'язана з інсулінорезистентністю, гіпертензія, пов'язана з погіршеною глюкозотолерантністю, гіпертензія, пов'язана з діабетом (наприклад, діабет ІІ типу й т.п.), гіпертензія, пов'язана з гіперінсулінемією, інсулінорезистентність, пов'язана з гіпертензією, погіршена глюкозотолерантність, пов'язана з гіпертензією, діабет, пов'язаний з гіпертензією, і гіперінсулінемія, пов'язана з гіпертензією, діабетичні ускладнення [наприклад, мікроангіопатія, діабетична нейропатія, діабетична нефропaтія, діабетична ретинопатія, діабетична катаракта, макроангіопатія, остеопенія, діабетична гіперосмолярна кома, інфекційні захворювання (наприклад, респіраторна інфекція, інфекція сечових шляхів, шлунково-кишкова інфекція, інфекція шкіри та м'яких тканин, інфекції нижніх кінцівок й т.д.), діабетична гангрена, ксеростомія, знижений слух, діабетичне цереброваскулярне захворювання, діабетичні дисциркуляційні розлади, діабетична гіпертензія й т.п.], діабетична кахексія й т.п. можуть бути згадані. Крім того, сполука (I) може також використовуватися для лікування пацієнтів з діабетичною гіпертензією. Хоча сполука (I) має потужну антагоністичну активність щодо ангіотензину ІІ, однак, вона корисна як препарат для профілактики або лікування захворювання, спричиненого (або захворювання, що ініціюється), констрикцією і васкуляризацією або розладу, пов'язаного з рецепторами ангіотензину II, присутністю ангіотензину II, або фактором, індукованим присутністю ангіотензину II у ссавців (наприклад, людина, мавпа, кішка, свиня, кінь, бик, миша, пацюк, морська свинка, собака, кролик і т.п.). Приклади таких захворювань включають гіпертензію, циркадне порушення кров'яного тиску, серцеві захворювання (наприклад, гіпертрофія серця, гостра серцева недостатність, хронічна серцева недостатність, включаючи застійну серцеву недостатність, кардіоміопатію, стенокардію, міокардит, фібріляцію предсердя, аритмію, тахікардію, інфаркт міокарда й т.д.), цереброваскулярні розлади (наприклад, безсимптомний цереброваскулярний розлад, транзиторна церебральна ішемічна атака, церебральна апоплексія, цереброваскулярну деменцію, гіпертензивну енцефалопатія, церебральний інфаркт, субарахноїдальний крововилив і т.д.), набряк мозку, церебральну дисциркуляцію, рекурентні й ускладнені цереброваскулярні розлади (наприклад, невротичний симптом, психічний симптом, суб'єктивний симптом, розлад щоденної активності і т.д.), ішемічний периферичний циркуляційний розлад, міокардіальну ішемію, венозну недостатність, прогресуючу серцеву недостатність після інфаркту міокарда, захворювання нирок (наприклад, нефрити, гломерулонефрити, гломерулосклероз, хронічна ниркова недостатність, гостра ниркова недостатність, тромботична васкулопатія, ускладнення діалізу, розлад органа, включаючи променеву нефропaтію й т.д.), артеріосклероз, включаючи атеросклероз (наприклад, аневризма, коронарний атеросклероз, церебральний артеріальний склероз, периферичний артеріальний склероз і т.д.), васкулярну гіпертрофію, васкулярну гіпертрофію або оклюзію й розлад після втручання (наприклад, черезшкірна коронарна 10 UA 102271 C2 5 10 15 20 25 30 35 40 45 50 55 60 ангіопластика, стентування, коронарна ангіоскопія, інтраваскулярний ультразвук, інтракоронарний тромболізис і т.д.), судинну реоклюзію й рестеноз після шунтування, поліцитемію, гіпертензію, розлад й васкулярну гіпертрофію після трансплантації, відторгнення після трансплантації, очні захворювання (наприклад, глаукома, очна гіпертензія й т.д.), тромбоз, полідисфунцію органу, розлад ендотеліальної функції, гіпертензивний тиніт, інші серцевосудинні захворювання (наприклад, глибокий тромбоз вен, обструктивний периферичний циркуляційний розлад, облітеруючий артеріосклероз, облітеруючий тромбангіїт, ішемічна церебральна дисциркуляція, хвороба Рейно, хвороба Бергераі т.д.), метаболичні та/або аліментарні розлади(наприклад, тучність, гіперліпідемія, гіперхолестеринемія, гіперурикемія, гіперкаліємія, гіпернатріємія і т.д.), нейродегенеративні захворювання (наприклад, Хвороба Альцгеймера, Хвороба Паркінсона, латеральний аміотрофічний склероз, ВІЛ-енцефалопатія й т.д.), розлади центральної нервової системи (наприклад, пошкодження, такі як церебральний крововилив і церебральний інфаркт, і їх ускладнення, ушкодження голови, ушкодження хребта, набряк мозку, сенсорна дисфункція, сенсорний функціональний розлад, розлад вегетативної нервової системи, дисфункція вегетативної нервової системи, розсіяний склероз і т.д.), деменцію, дефекти пам'яті, розлад свідомості, амнезії, тривожний симптом, кататонічний симптом, психічний дискомфорт, психопатії (наприклад, депресія, епілепсія, алкоголізм і т.д.), запальні захворювання (наприклад, артрит, такий як хронічний ревматоїдний артрит, остеоартрит, ревматоїдний мієліт, періостит і т.д.; запалення після операції або ушкодження; ремісія набряку; фарингіт; цистит; пневмонія; атопічний дерматит; запальні кишкові захворювання, такі як хвороба Крона, виразковий коліт і т.д.; менінгіт; запальні захворювання очей; легеневий саркоїдоз, такий як пневмонія, легеневий силікоз, легеневий саркоїдоз, легеневий туберкульоз і т.д.), алергійні захворювання (наприклад, алергійний риніт, конъюнктивіт, шлунково-кишкова алергія, полінози, анафілаксія й т.д.), хронічне обструктивне легеневе захворювання, інтерстиціальну пневмонію, пневмоцистну пневмонію, колагенози (наприклад, системний червоний вовчак, склеродермія, поліартеріїт і т.д.), захворювання печінки (наприклад, не-алкогольний стеатогепатит (NASH), не-алкогольна жирова інфільтрація печінки (NAFLD), гепатит, включаючи хронічний гепатит, цироз печінки й т.д.), портальну гіпертензію, шлунково-кишкові розлади (наприклад, гастрит, шлункова виразка, шлунковий рак, шлунковий розлад після операції, диспепсія, рак стравоходу, панкреатит, поліпи товстого кишечника, холелітіаз, геморой, варикоз стравоходу й шлунка й т.д.), захворювання крові й мієлопоезу (наприклад, еритроцитоз, геморагічний васкуліт, аутоімунна гемолітична анемія, синдром дисемінованої інтраваскулярної коагуляції, множинна мієлопатія і т.д.), захворювання кісток (наприклад, перелом, повторний перелом, остеопороз, остеомаляція, захворювання Педжета кістки, склерозуючий мієліт, хронічний ревматоїдний артрит, дисфункція суставних тканин, і т.п. викликана колінним остеоартритом й подібними захворюваннями), солідну пухлину, пухлини (наприклад, злоякісна меланома, злоякісна лімфома, рак шлунково-кишкового тракту (наприклад, шлунку, кишечника і т.д.), рак і кахексія внаслідок раку, метастази раку, ендокринопатії (наприклад, захворювання Адисона, синдром Кушинга, феохромоцитома, первинний альдостеронізм і т.д.), захворювання Крейтцфельда-Якоба, захворювання сечових шляхів та/або чоловічих статевих органів (наприклад, цистит, гіпертрофія простати, рак простати, статеві інфекційні захворювання й т.д.), жіночі розлади (наприклад, клімактеричний розлад, гестози, ендометріоз, гістероміома, захворювання яєчників, захворювання молочних залоз, статеві інфекційні захворювання й т.д.) захворювання, пов'язані з впливом навколишнього середовища й професійних факторів (наприклад, радіаційна небезпека, ультрафіолетова, інфрачервона або лазерна небезпека, висотне захворювання й т.д.), респіраторні захворювання (наприклад, переохолодження, пневмонія, астма, легенева гіпертензія, легеневий тромбоз й легенева емболія й т.д.), інфекційні захворювання (наприклад, вірусні інфекційні захворювання, викликані цитомегаловірусом, вірусом грипу, вірусом герпеса й т.д., рикетсіози, бактеріальне інфекційне захворювання й т.д.), токсемії (наприклад, сепсис, септичний шок, ендотоксиновий шок, Грам-негативний сепсис, токсично-шоковий синдром і т.д.), оториноларингологічні захворювання(наприклад, синдром Меньєра, тиніт, дисгевзія, запаморочення, порушення рівноваги, дисфагія й т.д.), шкірні захворювання (наприклад, келоїд, гемангіома, псоріаз і т.д.), інтрадіалізна гіпотонія, міастенія gravis, системні захворювання, такі як синдром хронічної втоми й і т.п. Хоча сполука (I) може підтримувати певну гіпотензивну дію протягом дня й ночі, доза й частота можуть бути зменшені, і крім того, підвищення кров'яного тиску перед і після пробудження, що є особливо проблематичним у пацієнтів з гіпертензією, може бути пригнічене більш ефективно. Крім того, безперервне довгострокове пригнічення активності ангіотензину II сполукою (I) 11 UA 102271 C2 5 10 15 20 25 30 35 40 45 50 55 60 приведе до поліпшення або пригнічення розвитку розладу або патології в біофункції і фізіологічній дії, що викликає розлади у дорослих й різні захворювання, пов'язані із старінням і т.п., що у свою чергу приводить до первинної й вторинної профілактики захворювань або клінічних станів, спричинених таким чином або пригніченням їх прогресування. Як розлад або патологія в біофункції і фізіологічній дії, наприклад, розлад або патологія в здатності автоматичного керування церебральною циркуляцією й/або нирковою циркуляцією, циркуляційний розлад (наприклад, периферичний, церебральний, мікроциркуляція і т.д.), розлад гематоенцефалічного бар'єра, чутливості до солей, патологічний стан коагуляційної й фібринолітичної системи, патологічний стан крові й клітинних компонентів крові (наприклад, акцент на активності агрегації тромбоцитів, дисфункція деформації еритроцитів, адгезії лейкоцитів, підвищення в'язкості крові й т.д.), продукування і фунціонування фактора росту й цитокинів (наприклад, PDGF, VEGF, FGF, інтерлейкін, TNF-α, MCP 1 і т.д.), продукування й інфільтрація запальних клітин, продукування вільного радикала, ліпостеатоз, розлад ендотеліальної функції, дисфункція ендотелію, клітини і органу, набряк, зміна морфогенезу клітин гладких м'язів й т.д. (морфогенез до проліферації й т.д.), продукування й функціонування вазоактивної субстанції й індукторів тромбозу (наприклад, ендотелін, Тромбоксан A2 і т.д.), патологічна вазоконстрикція й т.д., метаболічний розлад (наприклад, патологія ліпідів сироватки, дисглікемія і т.д.), патологічний ріст клітин й т.д., ангіогенез (включаючи патологічний васкулогенез під час патологічного утворення капілярної сітки в адвентиції артеріосклеротичного ушкодження) і т.п. можуть бути згадані. Серед них сполука (I) може використовуватися як агент для первинної й вторинної профілактики або лікування розладів органа, пов'язаних з різними захворюваннями (наприклад, цереброваскулярні розлади й й пов'язані розлади, розлади органа, пов'язані із серцево-судинним захворюванням, розлад органа, пов'язаний з діабетом, розлад органа після втручання й т.д.). Зокрема, сполука (I) має активність інгібування протеїнурії, сполука може використовуватися як агент для того, щоб захистити нирку. Тому, сполука (I) може переважно використовуватися у пацієнтів з інсулінорезистентністю, погіршеною глюкозотолерантністю, діабетом або гіперінсулінемією, які мають одночасно розвинені захворювання або клінічні стани. Хоча сполука (I) має активність інгібування збільшення ваги, вона може використовуватися як інгібітор збільшення ваги у ссавців. Ссавці можуть бути будь-якими ссавцями, у яких потрібно уникнути збільшення ваги. Ссавці можуть мати ризик збільшення ваги генетично або можуть страждати від пов'язаних зі способом життя захворювань, таких як діабет, гіпертензія й/або гіперліпідемія і т.п. Збільшення ваги може бути викликано надмірним харчуванням або дієтою без живильного балансу, або може бути внаслідок вжвання комбінованого препарату (наприклад, агенти підсилення чутливості до інсуліну, що мають PPARγ-агоністичну активність, такі як троглітазон, розиглітазон, енглітазон, циглітазон, піоглітазон і т.п.). Крім того, збільшення ваги може передувати ожирінню, або може давати приріст ваги у пацієнтів з ожирінням. Тут, 2) ожиріння визначено BMI (індекс маси тіла; маса тіла (кг)/[ріст (м)] є не менше, ніж 25 для Японії (критерій Japan Society for the Study of Obesity), або не менше, ніж 30 для західного жителя (критерій WHO). Крім того, сполука (I) може використовуватися як агент для профілактики або лікування гіпертензії, пов'язаної з тучністю або як агент для профілактики або лікування тучності, пов'язаної з гіпертензією. Що стосується діагностичних критеріїв діабету, Japan Diabetes Society повідомляло нові діагностичні критерії в 1999. Відповідно до звіту, діабет - стан, що показує будь-який рівень глюкози крові натщесерце (концентрація глюкози внутрішньовенної плазми) не менше, ніж 126 мг/дл, 75 г пероральний тест глюкозотолерантності (75 м OGTT) 2 год. рівень (концентрація глюкози внутрішньовенної плазми) не менше, ніж 200 мг/дл, і рівень глюкози крові не натщесерце (концентрація глюкози внутрішньовенної плазми) не менше, ніж 200 мг/дл. Стан, що не підпадає під вищезгадані діабети і відрізняється від "стану, що показує рівень глюкози крові натщесерце (концентрація глюкози внутрішньовенної плазми) менше, ніж 110 мг/дл або 75 гр. пероральний тест глюкозотолерантності (75 гр. OGTT) 2 год. рівні (концентрація глюкози внутрішньовенної плазми) менше, ніж 140 мг/дл" (нормальний тип), називають "граничним типом". Крім того, АДА (Американська Асоціація Діабету) повідомляла нові діагностичні критерії діабету в 1997 і WHO в 1998. Згідно із цими звітами, діабет - стан, що показує рівень глюкози крові натщесерце (концентрація глюкози внутрішньовенної плазми) не менше, ніж 126 мг/дл, або 75 гр. пероральний тест глюкозотолерантності 2 год. рівні (концентрація глюкози внутрішньовенної плазми) не менше, ніж 200 мг/дл. 12 UA 102271 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до вищезгаданих звітів, погіршена глюкозотолерантність - стан, що показує рівень глюкози крові натщесерце (концентрація глюкози внутрішньовенної плазми) менше, ніж 126 мг/дл й 75 гр. пероральний тест глюкозотолерантності 2 год. рівні (концентрація глюкози внутрішньовенної плазми) не менше, ніж 140 мг/дл і менше, ніж 200 мг/дл. Відповідно до звіту АДA, стан, що показує рівень глюкози крові натщесерце (концентрація глюкози внутрішньовенної плазми) не менше, ніж 110 мг/дл і менше, ніж 126 мг/дл називають IFG (Погіршена глюкоза натщесерце). Відповідно до звіту WHO, серед IFG (погіршена гліюкоза натщесерце) стан, що показує 75 гр. пероральний тест глюкозотолерантності 2 год. рівні (концентрація глюкози внутрішньовенної плазми) менше, ніж 140 мг/дл називають IFG (погіршена глікемія натщесерце). Сполука (I) може також використовуватися як агент для поліпшення або агент для профілактики, або лікування діабету, граничного типу, патологічної порушеної глюкозотолерантності, IFG (Погіршена глюкоза натщесерце) і IFG (Погіршена глікемія натщесерце), як визначено відповідно до вищезгаданих діагностичних критеріїв, і додатково як терапевтичний агент для гіпертензії у пацієнтів з гіпертензією рівнем не менше, ніж у вищезгаданих діагностичних критеріях (наприклад, рівень цукру в крові натщесерце 126 мг/дл). Крім того, сполука (I) може запобігти прогресуванню граничного типу, порушеної глюкозотолерантності, IFG (Погіршена глюкоза натщесерце) або IFG (Погіршена глікемія натщесерце) при діабеті Сполука (I) корисна як агент для профілактики або лікування метаболічного синдрому. Оскільки у пацієнтів з метаболічним синдромом є надзвичайно високий інцидент серцевосудинних захворювань у порівнянні з пацієнтами з єдиним, пов'язаним зі способом життя захворюванням, профілактика або лікування метаболічного синдрому досить важливі, щоб запобігти серцево-судинним захворюванням. Про критерії для діагнозу метаболічного синдрому повідомляла WHO в 1999, і NCEP в 2001. Відповідно до критеріїв WHO, пацієнтів із принаймні двома: абдомінальне ожиріння, дисліпідемія (високі TG або низькі HDL) і гіпертензія на додаток до гіперінсулінемії або порушеної глюкозотолерантності діагностували як метаболічний синдром (World Health Organization: Definition, Diagnosis and Classification of Diabetes Mellitus and Its Complications. Part I: Diagnosis and Classification of Diabetes Mellitus, World Health Organization, Geneva, 1999). Відповідно до критерію Adult Treatment Panel III of National Cholesterol Education Program, що є індикатором для того, щоб призначатиішемічними серцевими захворюваннями в Америці, пацієнтів із принаймні трьома з: абдомінальне ожиріння, високі тригліцериди, низький холестерин ЛПВЩ, гіпертензія й погіршена глюкозотолерантність, діагностували як метаболічний синдром (National Cholesterol Education Program: Executive Summary of the Third Report of National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adults Treatment Panel III). The Journal of the American Medical Association, Vol. 285, 2486-2497, 2001). Сполука (I) може використовуватися для лікування гіпертензії у пацієнтів з метаболічним синдромом. Хоча сполука (I) має протизапальну активність, вона може використовуватися як протизапальний агент для профілактики або лікування запальних захворювань. Приклади запальних захворювань включають запальні захворювання внаслідок різних захворювань, таких як артрит (наприклад, хронічний ревматичний артрит, остеоартрит, ревматоїдний мієліт, подагричний артрит, синовіт), астма, алергійні захворювання, артеріосклероз, включаючи атеросклероз (аневризма, коронарний атеросклероз, церебральний артеріальний склероз, периферичний артеріальний склероз і т.д.) Захворювання шлунково-кишкового тракту, такі як запальні захворювання товстого кишечника (наприклад, хвороба Крона, виразковий коліт), діабетичні ускладнення (діабетична невропатія, діабетична вазопатія), атопічний дерматит, хронічне обструктивне легеневе захворювання, системний червоний вовчак, вісцеральні запальні захворювання (нефрити, гепатит), аутоімунна гемолітична анемія, псоріаз, неврологічні дегенеративні захворювання (наприклад, Хвороба Альцгеймера, Хвороба Паркінсона, латеральний аміотрофічний склероз, ВІЛ-енцефалопатія), центральні нервові розлади (наприклад, цереброваскулярний розлад, такий як церебральний крововилив і церебральний інфаркт, травма голови, спинальне ушкодження, набряк мозку, розсіяний склероз), менінгіт, ангіна, інфаркт міокарда, застійна серцева недостатність, васкулярна гіпертрофія або оклюзія й розлад орану після втручання (черезшкірна коронарна ангіопластика, стентування, коронарна ангіоскопія, інтраваскулярний ультразвук, інтракоронарний тромболізис і т.д.) судинна реоклюзія й рестеноз після шунтування, розлад ендотеліальної функції, інші циркуляторні захворювання (інтермітуюча кульгавість, обструктивний периферичний 13 UA 102271 C2 5 10 15 20 25 30 35 40 45 50 55 60 циркуляційний розлад, облітеруючий артеріосклероз, облітеруючий тромбангіїт, ішемічна церебральна дисциркуляція, хвороба Рейно, хвороба Бергера), запальні захворювання очей, легеневий саркоїдоз (наприклад, хронічна пневмонія, легеневий силікоз, легеневий саркоїдоз, легеневий туберкульоз), ендометрит, токсемія (наприклад, сепсис, септичний шок, ендотоксиновий шок, грам-негативний сепсис, синдром токсичного шоку), кахексія (наприклад, кахексія внаслідок інфекції, ракова кахексія, кахексія внаслідок синдрому набутої імунної недостатності), рак, захворювання Адисона, захворювання Крейтцфельда-Якоба, вірусна інфекція (наприклад, інфікування вірусом, таким як цитомегаловірус, вірус грипу, вірус герпеса й т.д.), дисемінована інтраваскулярна коагуляція й т.п. Оскільки сполука (I) має аналгетичну дію, вона може також використовуватися як аналгетичний агент для профілактики або лікування болю. Приклади больових захворювань включають гострий біль внаслідок запалення, біль пов'язаний із хронічним запаленням, біль, пов'язаний з гострим запаленням, біль після операції (інцизійний біль, глибокий біль, біль органа, хронічний біль після операції й т.д.), м'язовий біль (м'язовий біль, пов'язаний із хронічним больовим захворюванням, ригідність плеча й т.д.), артралгія, зубний біль, щелепна артралгія, головний біль (мігрень, кататонічний головний біль, головний біль, пов'язаний з лихоманкою, головний біль, пов'язаний з гіпертензією), біль органа (серцевий біль, біль при ангіні, абдомінальний біль, нирковий біль, біль у сечоводах, біль у сечовому міхурі), гінекологічний біль (менструально-подібний біль, біль при дисменореї, родові перейми), невралгія (дискова грижа, біль кореня нерва, невралгія після herpes zoster, невралгія трійчастого нерва), раковий біль, рефлекторна симпатична атрофія, комплексний локальний больовий синдром, і т.п. Сполука (I) ефективна для полегшення різного болю, такі як нервовий біль, раковий біль і запальний біль безпосередньо й швидко, і показує особливо переважаючий аналгетичний ефект при патологіях (наприклад, гіпертензія, діабет, і т.д. й їх ускладнення й т.п.), при яких знижений больовий поріг. Сполука (I) особливо корисна як аналгетичний агент для болю, пов'язаного із хронічним запаленням або головним болем, пов'язаним з гіпертензією, або як профілактичний або терапевтичний препарат для запальних захворювань або болю, спричиненого: (1) артеріосклероз, включаючи атеросклероз, (2) васкулярна гіпертрофія, судинна оклюзія й розлад орану після втручання, (3) судинна реоклюзія й рестеноз після шунтування, розлад ендотеліальної функції, (4) інтермітуюча кульгавість, (5) обструктивний периферичний циркуляторний розлад або (6) облітеруючий артеріосклероз. Коли сполука (I) скомбінована з антагоністом кальцію, твердий препарат даного винаходу корисний як препарат для профілактики або лікування вищезгаданих захворювань (переважно, профілактичний або терапевтичний препарат для гіпертензії, серцевої недостатності, діабетичної нефропaтії або артеріосклерозу, більш переважно, профілактичний або терапевтичний препарат для гіпертензії), уможливлює зменшення дози сполуки (I) і антагоністу кальцію, коли використовується самостійно, і пригнічує побічні ефекти. Сполука (I) може використовуватися в комбінації з одним або більше різними видами медикаментів (надалі іноді, щоб бути спрощеним як "супутній препарат"). У певному прикладі сполука (I) може використовуватися в комбінації з одним або більше видами препаратів (супутній препарат), вибраних з терапевтичних агентів для діабету, терапевтичних агентів для діабетичних ускладнень, терапевтичних агентів для гіперліпідемії, антигіпертензивних агентів, агентів проти ожиріння, сечогінних засобів, антитромбічних агентів й т.п. Тут, як терапевтичний агент для діабету, наприклад, інсулінові препарати (наприклад, препарати інсуліну тварин, екстраговані з підшлункової залози корів або свиней; людські інсулінові препарати, генетично синтезовані, використовуючи Escherichia coli або дріжджі; цинкінсулін; цинк-інсулін протамін; фрагмент або похідна інсуліну (наприклад, INS-1), оральний інсуліновий препарат), сенсибілізатори інсуліну (наприклад, піоглітазон або його сіль (переважно, хлоргідрат), розиглітазон або його сіль(переважно, малеат), Метаглідасен, AМГ131, Балаглітазон, MBX-2044, Ривоглітазон, Алеглітазар, Чиглітазар, Лобеглітазон, PLX-204, PN-2034, GFT-505, THR-0921, сполуки, описані в WO2007/013694, WO2007/018314, WO2008/093639 або WO2008/099794), інгібітори α – глюкозидази (наприклад, воглібоза, акарбоза, міглітол, еміглітат), бігуаніди (наприклад, метформін, буформін або їх солі (наприклад, хлоргідрат, фумарат, сукцинат)), стимулятори секреції інсуліну (наприклад, сульфонілсечовина (наприклад, толбутамід, глібенкламід, гліклазид, хлорпропамід, толазамід, ацетогексамід, глікопірамід, глімепірид, гліпізид, глібузол), репаглінід, натеглінід, мітиглінід або гідрати їх кальцієвих солей), інгібітори дипептидил пептидази IV (наприклад, Алогліптин або його сіль (переважно, бензоат), Вілдагліптин, Ситагліптин, Саксагліптин, BI1356, GRC8200, Т. ПЛ. 513, PF-00734200, PHX1149, SK-0403, ALS2-0426, TA-6666, TS-021, KRP-104, 2-[[6-[(3R)-3 14 UA 102271 C2 5 10 15 20 25 30 35 40 45 50 55 60 аміно-1-піперидиніл]-3,4-дигідро-3-метил-2,4-діоксо-1 (2H)-піримідиніл] метил] 4фторбензонітрил або його сіль), β3-агоністи (наприклад, N-5984), агоністи GPR40 (наприклад, сполуки, описані WO2004/041266, WO2004/106276, WO2005/063729, WO2005/063725, WO2005/087710, WO2005/095338, WO2007/013689 або WO2008/001931), агоністи рецептора GLP-1 (наприклад, GLP-1, агент GLP-1MR, Ліраглутид, Екзенатид, AVE-0010, BIM-51077, Aib (8,35) hGLP-1 (7,37) NH2, CJC-1131, Альбіглутид), агоністи аміліну (наприклад, прамлінтид), інгібітори фосфотирозин-фосфатази (наприклад, ванадат натрію), інгібітори глюконеогенезу (наприклад, інгібітори глікогенфосфорилази, інгібітори глюкозо-6-фосфатази, антагоністи глюкагона, інгібітори FBPази), SGLT2 (натрій-глюкоза котранспортер 2) інгібітори (наприклад, Депагліфлозин, AVE2268, TS-033, YM543, TA-7284, Ремогліфлозин, ASP1941), інгібітори SGLT1, інгібітори 11 β-гідроксистероїд дегідрогенази (наприклад, BVT-3498, INCB-13739), адипонектин або його агоніст, інгібітори IKK (наприклад, AS-2868), препарати, що поліпшують лептинорезистентність, агоністи соматостатинових рецепторів, активатори глюкокінази (наприклад, Пірагліатин, AZD1656, AZD6370, TTP-355, сполуки, описані в WO2006/112549, WO2007/028135, WO2008/047821, WO2008/050821, WO2008/136428 або WO2008/156757), GIP (Глюкозо-залежний інсулінотропний пептид), агоністи GPR119 (наприклад, PSN821), FGF21, аналог FGF і т.п. можуть бути згадані. Як терапевтичний агент для діабетичних ускладнень, інгібітори альдозоредуктази (наприклад, толрестат, епалрестат, зополрестат, фідарестат, CT-112, ранірестат (AS-3201), лідорестат), нейротрофічний фактор і агенти, що збільшують його (наприклад, NGF, NT-3, BDNF, нейротрофічний промотор продукування/секреції, описаний в WO01/14372 (наприклад, 4(4-хлорфеніл)-2-(2-метил-1-імідазоліл)-5-[3-(2-метилфенокси)пропіл] оксазол), сполуки, описані в WO2004/039365), інгібітори PKC (наприклад, рубоксистаурину мезилат), інгібітори AGE(наприклад, ALT946, бромід N-фенацилтіазолію (ALT766), EXO-226, піридорин, піридоксамін), агоністи GABA рецепторів (наприклад, габапентин, прегабалін), серотонін й інгібітори зворотного захвату норадреналіну (наприклад, дулоксетин), інгібітори натрієвих каналів (наприклад, лакозамід), акцептори активного кисню (наприклад, тіоктова кислота), церебральні вазодилятатори (наприклад, тіапурид, мексилетин), агоністи соматостатинових рецепторів (наприклад, BIM23190), інгібітори апоптозно сигнально-регулювальної кінази-1(ASK1) й т.п. можуть бути згадані. Як терапевтичний агент для гіперліпідемії, інгібітори HМГ-CoА редуктази(наприклад, правастатин, симвастатин, ловастатин, аторвастатин, флувастатин, розувастатин, пітавастатин або їх солі (наприклад, натрієва сіль, кальцієва сіль)), інгібітори скваленсинтази (наприклад, сполуки, описані в WO97/10224, наприклад, N-[[(3R, 5 S)-1-(3-ацетокси-2,2-диметилпропіл)-7хлор-5-(2,3-диметоксифеніл)-2-oксo-1,2,3,5-тетрагідро-4,1-бензоксазепін-3-іл] ацетил] піперидин-4-оцтова кислота), фібрати (наприклад, безафібрат, клофібрат, симфібрат, клинофібрат), аніонобмінні смоли (наприклад, колестирамін), пробукол, препарати нікотинової кислоти (наприклад, нікомол, ніцеритрол, ніаспан), етилікозапентат, фітостерин (наприклад, соєвий стерол, гама оризанол (γ-оризанол)), інгібітори абсорбції холестерину (наприклад, zechia), інгібітори CETP (наприклад, далцетрапіб, анацетрапіб), препарати ω-3 жирної кислоти (наприклад, ω-3 жирної кислоти етилові естери 90), і т.п. можуть бути згадані. Як антигіпертензивний агент, інігібітори ангіотензин конвертуючого ензиму (наприклад, каптоприл, еналаприл, делаприл і т.п.), антагоністи ангіотензину II (наприклад, кандезартан цилексетил, кандезартан, лозартан, лозартан калій, епрозартан, валзартан, телмізартан, ірбезартан, тазозартан, олмезарт, олмезартан медоксоміл, азилзартан і т.п.), антагоністи кальцію (наприклад, манідипін, ніфедипін, амлодипін, ефлонідипін, нікардипін, амлодипін, цилнідипіні т.п.), β-блокатори (наприклад, метопролол, атенолол, пропранолол, карведілол, піндолол і т.п.), клонідин і т.п. можуть бути згадані. Як агент проти ожиріння, інгібітори захвату моноаміну(наприклад, фентермін, сибутрамін, мазиндол, флуоксетин, тезофензин), агоністи рецепторів серотоніну 2C (наприклад, лорказерин), агоністи серотонін 6 рецепторів, H3 гістаміновий рецептор, GABA-регулювальні препарати (наприклад, топірамат), антагоністи нейропептиду Y (наприклад, велнеперит), антагоністи канабіноїдних рецепторів (наприклад, римонабант, таранабант), грелінантні агоністи, антагоністи грелінових рецепторів, інгібітори грелін ацилувального ензиму, антагоністи опіоїдних рецепторів (наприклад, GSK-1521498), антагоністи орексинових рецепторів, агоністи рецепторів меланокортину 4, інгібітори 11 β-гідроксистероїд дегідрогенази (наприклад, AZD4017), інгібітори панкреатичної ліпази (наприклад, орлістат, цетилістат), β3 агоністи (наприклад, N-5984), діацилгліцероацилрансферази 1 інгібітор (DGAT1), ацетил CoА карбоксилази (ACC) інгібітори, стеарил-CoА дезатурази інгібітори, інгібітори мікросомальних тригліцерид трансферних протеїнів (наприклад, R-256918), Інгібітори Na-глюкоза котранспортерів 15 UA 102271 C2 5 10 15 20 25 30 35 40 45 50 55 60 (наприклад, JNJ-28431754, ремогліфлозин), інгібітори NFκB (наприклад, HE-3286), агоністи PPAR (наприклад, GFT-505, DRF-11605), інгібітори фосфотирозин-фосфатази (наприклад, ванадат натрію, Тродусквемін), агоністи GPR119 (наприклад, PSN-821), активатори глюкокінази (наприклад, AZD-1656), лептин, лептинові похідні (наприклад, метрелептин), CNTF (ціліарний нейротрофічний фактор), BDNF (церебрально-похідний нейротрофічний фактор), агоністи холецистокініну, глюкагоноподібні пептид-1(GLP-1) препарати (наприклад, тваринні GLP-1 препарати екстраговані з підшлункової залози корів або свиней;людські препарати GLP-1 генетично синтезовані, використовуючи Escherichia coli або дріжджі; фрагмент або похідна GLP1 (наприклад, екзенатид, ліраглутид)), препарати аміліну (наприклад, прамлінтид, AC-2307), нейропептиду Y агоністи (наприклад, PYY3-36, похідна PYY3-36, обінепитид, ТМ 30339, ТМ 30335), препарати оксинтомодуліну; препарати FGF21 (наприклад, тваринні препарати FGF21, екстраговані з підшлункової залози корів або свиней; людські препарати FGF21, генетично синтезовані, використовуючи Escherichia coli або дріжджі; фрагмент або похідна FGF21)), інгібітори живлення (наприклад, P-57) і т.п. можуть бути згадані. Як сечогінний засіб, наприклад, похідні ксантину (наприклад, саліцилат теоброміну натрію, саліцилат кальцію теоброміну й т.п.), тіазидні препарати (наприклад, етіазид, циклопентіазид, трихлорметіазид, гидрохлоротіазид, гідрофлуметіазид, бензилгідрохлортіазид, пенфлутіазид, полі5тіазид, метиклотіазид і т.п.), антиальдостеронові препарати (наприклад, спіронолактон, триамтерен і т.п.), інгібітори карбоангідрази (наприклад, ацетазоламід й т.п.), хлорбензолсульфонамідні агенти (наприклад, хлорталідон, мефрузид, індапамід і т.п.), азосемід, ізосорбід, етакринова кислота, піретанід, буметанід, фуросемід і т.п. можуть бути згадані. Як антитромботичні агенти, наприклад, гепарини (наприклад, гепарин натрій, кальцій гепарина, еноксапарин натрій, дальтепарин натрій), варфарин (наприклад, варфарин калій), антитромбінові препарати (наприклад, арагатробан, дабігатран), інгібітори FXa (наприклад, ривароксабан, апіксабан, едоксабан, YM150, сполуки, описані в WO02/06234, WO2004/048363, WO2005/030740, WO2005/058823 або WO2005/113504), тромболітичні агенти (наприклад, урокіназа, тизокіназа, альтеплаза, натеплаза, монтеплаза, памітеплаза), і т.п. можуть бути згадані інгібітори агрегації тромбоцитів (наприклад, тиклодипіну хлоргідрат, клопідрогель, празугрель, E5555, SHC530348, цилостазол, етилікозапентат, берапрост натрій, сарпогрелату хлоргідрат). Коли твердий препарат даного винаходу й супутній препарат використовується в комбінації, період їх введення не обмежений, і їх можна призначати одночасно або диференційно суб'єкту призначення. Крім того, твердий препарат даного винаходу й супутній препарат можна призначати як окремі препарати, або як єдиний препарат, що містить твердий препарат даного винаходу й супутній препарат. Доза супутнього препарату може бути відповідно визначена на основі дози, використовуваній в клінічних ситуаціях кожного препарату. Співвідношення змішування твердого препарату даного винаходу й супутнього препарату може бути відповідно визначене залежно від суб'єкта призначення, шляху введення, захворювання, симптому, комбінації й т.п. Коли суб'єктом призначення є людина, наприклад, супутній препарат може використовуватися 0,01-100 вагових частин відносно 1 вагової частини твердого препарату даного винаходу. Використовуючи супутній препарат таким чином, можуть бути отримані наступні переважні ефекти: 1) ефект підсилення активності сполуки (I) або супутнього препарату (синергічний ефект активності препаратів); 2) ефект зменшення дози сполуки (I) або супутнього препарату (ефект зменшення дози медикаментів у порівнянні з одиничним призначенням); 3) ефект зменшення вторинної активності сполуки (I) або супутнього препарату; і т.п. Даний винахід забезпечує спосіб стабілізування сполуки, представленої формулою (I) або її солі й антагоністу кальцію у твердому препараті, що включає сполуку, представлену формулою (I) або її сіль, і антагоніст кальцію, який відрізняється тим, що включає додавання рН коригента. Відповідно до способу стабілізування даного винаходу, сполука (I) у твердому препараті може бути суттєво стабілізована. Крім того, даний винахід також забезпечує спосіб поліпшення вивільнення сполуки, представленої формулою (I) або її солі із твердого препарату, що включає сполуку, представлену формулою (I) або її сіль, і антагоніст кальцію, де спосіб включає додавання рН коригента. Відповідно до способу поліпшення розчинності в даному винаході, може бути значно поліпшено вивільнення сполуки (I) з твердого препарату. Даний винахід пояснений більш детально нижче, посилаючись на Приклади Одержання, 16 UA 102271 C2 5 10 15 20 25 30 35 40 Приклади Посилання, Порівняльні Приклади й Експериментальні Приклади, які не повинні розглядатися як обмежувальні. Як інгредієнти (добавки), крім активного інгредієнта у фармацевтичних препаратах, описаних у Прикладах Одержання, Прикладах Посилання й Порівняльних Прикладах, використовували сумісні продукти японської Фармакопеї, японського Фармацевтичного Кодексу або японських Фармацевтичних Екціпієнтів. ПРИКЛАДИ Приклад Композиції 1 (1) Гідроксипропілцелюлозу (5124 г) розчиняли в очищеній воді (80280 г), щоб одержати зв'язувальну рідину I. Амлодипіну бесилат (2984 г), маніт (55840 г) і кристалічну целюлозу (3870 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX), і гранулювали розпиленням зв'язувальної рідини I (38700 г) і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули. Кристалічну целюлозу (7200 г), кросповідон (3600 г), стеарат магнію (720 г) і розмелені гранули (60480 г) змішували в тумблерному міксері (ТМ-400S, Showa Chemical Machinery), щоб одержати змішані гранули A. (2) Гідроксид натрію (405,8 г) і фумарову кислоту (1176 г) розчиняли в очищеній воді (38230 г), щоб одержати буферний розчин. Гідроксипропілцелюлозу (3018 г) розчиняли в очищеній воді (47280 г), щоб одержати зв'язувальну рідину II. Сполуку А (20060 г), маніт (40860 г), кристалічну целюлозу (4230 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX), і гранулювали, розпилюючи буферний розчин (31810 г) і додатково зв'язувальну рідину II (42300 г), і висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули. Кристалічну целюлозу (7380 г), кросповідон (5535 г), стеарат магнію (738 г) і розмелені гранули (60150 г) змішували в тумблерному міксері (ТМ-400S, Showa Chemical Machinery), щоб одержати змішані гранули B. (3) Змішані гранули А (180 мг) і змішані гранули B (90 мг) таблетували у формі подвійного шару роторною таблетувальною машиною (AQUA 08242L2JI, Kikusui Seisakusho, Ltd) з 8,5 мм пуансоном (тиск таблетування 8 KN, вага таблетки 270 мг), щоб одержати прості таблетки. (4) Гідроксипропілметилцелюлозу (468 г) і тальк (72 г) розчиняли й диспергували в очищеній воді (4320 г), щоб одержати дисперсійну рідину I. Оксид титану (54 г) і оксид заліза (6 г) диспергували в очищеній воді (900 г), щоб одержати дисперсійну рідину II. Дисперсійну рідину І змішували з дисперсійною рідиною II й очищеною водою (180 г), щоб одержати дисперсію покриття. Використовуючи машину для нанесення покриття (DRC-650, КОРПОРАЦІЯ POWREX), дисперсію покриття розпилювали на прості таблетки, отримані в (3), збільшуючи вагу таблетки на 10 мг, за допомогою чого покриті оболонкою таблетки, що мають наступну композицію, були отримані. Потім, покриті оболонкою таблетки висушували під зниженим тиском при 40 °С протягом 18 годин. композиція препарату (280 мг) амлодипіну бесилат 6,94 мг маніт 129,86 мг кристалічна целюлоза 9 мг гідроксипропілцелюлоза 5,4 мг кристалічна целюлоза 18 мг кросповідон 9 мг стеарат магнію 1,8 мг сполука А 21,34 мг маніт 43,465 мг кристалічна целюлоза 4,5 мг гідроксид натрію 0,345 мг фумарова кислота 1 мг гідроксипропілцелюлоза 2,7 мг кристалічна целюлоза 9 мг кросповідон 6,75 мг стеарат магнію 0,9 мг гідроксипропілметилцелюлоза 7,8 мг тальк 1,2 мг оксид титану 0,9 мг 17 UA 102271 C2 5 10 15 20 25 30 35 оксид заліза 0,1 мг загалом 280 мг Приклад Композиції 2 (1) Гідроксипропілцелюлозу (5124 г) розчиняли в очищеній воді (80280 г), щоб одержати зв'язувальну рідину I. Амлодипіну бесилат (5964 г), маніт (52860 г) і кристалічну целюлозу (3870 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX), і гранулювали розпиленням зв'язувальної рідини I (38700 г) і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули. Кристалічну целюлозу (7200 г), кросповідон (3600 г), стеарат магнію (720 г) і розмелені гранули (60480 г) змішували в тумблерному міксері (ТМ-400S, Showa Chemical Machinery), щоб одержати змішані гранули A. (2) Гідроксид натрію (405,8 г) і фумарову кислоту (1176 г) розчиняли в очищеній воді (38230 г), щоб одержати буферний розчин. Гідроксипропілцелюлозу (3018 г) розчиняли в очищеній воді (47280 г), щоб одержати зв'язувальну рідину II. Сполуку А (20060 г), маніт (40860 г) і кристалічну целюлозу (4230 г) однорідно змішували у грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX) і гранулювали розпиленням буферного розчину (31810 г) і потім зв'язувальної рідини II (42300 г), і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули. Кристалічну целюлозу (7380 г), кросповідон (5535 г), стеарат магнію (738 г) і розмелені гранули (58680 г) змішували в тумблерному міксері (ТМ-400S, Showa Chemical Machinery), щоб одержати змішані гранули B. (3) Змішані гранули А (180 мг) і змішані гранули B (90 мг) таблетували у формі подвійного шару роторною таблетувальною машиною (AQUA 08242L2JI, Kikusui Seisakusho, Ltd) з 8,5 мм пуансоном (тиск таблетування 8 KN, вага таблетки 270 мг), щоб одержати прості таблетки. (4) Гідроксипропілметилцелюлозу (468 г) і тальк (72 г) розчиняли й диспергували в очищеній воді (4320 г), щоб одержати дисперсійну рідину I. Оксид титану (54 г) і оксид заліза (6 г) диспергували в очищеній воді (900 г), щоб одержати дисперсійну рідину II. Дисперсійну рідину І змішували з дисперсійною рідиною II й очищеною водою (180 г), щоб одержати дисперсію покриття. Використовуючи машину для нанесення покриття (DRC-650, КОРПОРАЦІЯ POWREX), дисперсію покриття розпилювали на прості таблетки, отримані в (3), збільшуючи вагу таблетки на 10 мг, за допомогою чого покриті оболонкою таблетки, що мають наступну композицію, були отримані. Потім, покриті оболонкою таблетки висушували під зниженим тиском при 40 °С протягом 18 годин. композиція препарату (280 мг) амлодипіну бесилат 13,87 мг маніт 122,93 мг кристалічна целюлоза 9 мг гідроксипропілцелюлоза 5,4 мг кристалічна целюлоза 18 мг кросповідон 9 мг стеарат магнію 1,8 мг сполука А 21,34 мг маніт 43,465 мг кристалічна целюлоза 4,5 мг гідроксид натрію 0,345 мг фумарова кислота 1 мг гідроксипропілцелюлоза 2,7 мг кристалічна целюлоза 9 мг кросповідон 6,75 мг стеарат магнію 0,9 мг гідроксипропілметилцелюлоза 7,8 мг тальк 1,2 мг оксид титану 0,9 мг оксид заліза 0,1 мг загалом 280 мг Приклад Композиції 3 (1) Гідроксипропілцелюлозу (5124 г) розчиняли в очищеній воді (80280 г), щоб одержати зв'язувальну рідину I. Амлодипіну бесилат (2984 г), маніт (55840 г) і кристалічну целюлозу (3870 18 UA 102271 C2 5 10 15 20 25 30 35 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX), і гранулювали розпиленням зв'язувальної рідини I (38700 г) і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули. Кристалічну целюлозу (7200 г), кросповідон (3600 г), стеарат магнію (720 г) і розмелені гранули (60480 г) змішували в тумблерному міксері (ТМ-400S, Showa Chemical Machinery), щоб одержати змішані гранули A. (2) Гідроксид натрію (405,8 г) і фумарову кислоту (1176 г) розчиняли в очищеній воді (38230 г), щоб одержати буферний розчин. Гідроксипропілцелюлозу (3018 г) розчиняли в очищеній воді (47280 г), щоб одержати зв'язувальну рідину II. Сполуку А (20060 г), маніт (40860 г) і кристалічну целюлозу (4230 г) однорідно змішували у грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX), і гранулювали, розпилюючи буферний розчин (31810 г) і потім зв'язувальну рідину II (42300 г), і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули. Кристалічну целюлозу (7380 г), кросповідон (5535 г), стеарат магнію (738 г) і розмелені гранули (60150 г) змішували в тумблерному міксері (ТМ-400S, Showa Chemical Machinery), щоб одержати змішані гранули B. (3) Змішані гранули А (180 мг) і змішані гранули B (360 мг) таблетували у формі подвійного шару роторною таблетувальною машиною (AQUA 08242L2JI, Kikusui Seisakusho, Ltd) з пуансоном, що має головну вісь 14 мм, допоміжну вісь 8 мм (тиск таблетування 9 KN, вага таблетки 540 мг), щоб одержати прості таблетки. (4) Гідроксипропілметилцелюлозу (468 г) і тальк (72 г) розчиняли й диспергували в очищеній воді (4320 г), щоб одержати дисперсійну рідину I. Оксид титану (54 г) і оксид заліза (6 г) диспергували в очищеній воді (900 г), щоб одержати дисперсійну рідину II. Дисперсійну рідину І змішували з дисперсійною рідиною II й очищеною водою (180 г), щоб одержати дисперсію покриття. Використовуючи машину для нанесення покриття (DRC-650, КОРПОРАЦІЯ POWREX), дисперсію покриття розпилювали на прості таблетки, отримані в (3), збільшуючи вагу таблетки на 20 мг, за допомогою чого покриті оболонкою таблетки, що мають наступну композицію, були отримані. Потім, покриті оболонкою таблетки висушували під зниженим тиском при 40 °С протягом 18 годин. композиція препарату(560 мг) амлодипіну бесилат 6,94 мг маніт 129,86 мг кристалічна целюлоза 9 мг гідроксипропілцелюлоза 5,4 мг кристалічна целюлоза 18 мг кросповідон 9 мг стеарат магнію 1,8 мг сполука А 85,36 мг маніт 173,86 мг кристалічна целюлоза 18 мг гідроксид натрію 1,38 мг фумарова кислота 4 мг гідроксипропілцелюлоза 10,8 мг кристалічна целюлоза 36 мг кросповідон 27 мг стеарат магнію 3,6 мг гідроксипропілметилцелюлоза 15,6 мг тальк 2,4 мг оксид титану 1,8 мг оксид заліза 0,2 мг загалом 560 мг Приклад Композиції 4 (1) Гідроксипропілцелюлозу (5124 г) розчиняли в очищеній воді (80280 г), щоб одержати зв'язувальну рідину I. Амлодипіну бесилат (5964 г), маніт (52860 г) і кристалічну целюлозу (3870 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX), і гранулювали розпиленням зв'язувальної рідини I (38700 г) і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб 19 UA 102271 C2 5 10 15 20 25 30 35 одержати розмелені гранули. Кристалічну целюлозу (7200 г), кросповідон (3600 г), стеарат магнію (720 г) і розмелені гранули (60480 г) змішували в тумблерному міксері (ТМ-400S, Showa Chemical Machinery), щоб одержати змішані гранули A. (2) Гідроксид натрію (405,8 г) і фумарову кислоту (1176 г) розчиняли в очищеній воді (38230 г), щоб одержати буферний розчин. Гідроксипропілцелюлозу (3018 г) розчиняли в очищеній воді (47280 г), щоб одержати зв'язувальну рідину II. Сполуку А (20060 г), маніт (40860 г) і кристалічну целюлозу (4230 г) однорідно змішували у грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX), і гранулювали, розпилюючи буферний розчин (31810 г) і потім зв'язувальну рідину II (42300 г), і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули. Кристалічну целюлозу (7380 г), кросповідон (5535 г), стеарат магнію (738 г) і розмелені гранули (60150 г) змішували в тумблерному міксері (ТМ-400S, Showa Chemical Machinery), щоб одержати змішані гранули B. (3) Змішані гранули А (180 мг) і змішані гранули B (360 мг) таблетували у формі подвійного шару роторною таблетувальною машиною (AQUA 08242L2JI, Kikusui Seisakusho, Ltd) з пуансоном, що має головну вісь 14 мм, допоміжну вісь 8 мм (тиск таблетування 9 kN, вага таблетки 540 мг), щоб одержати прості таблетки. (4) Гідроксипропілметилцелюлозу (468 г) і тальк (72 г) розчиняли й диспергували в очищеній воді (4320 г), щоб одержати дисперсійну рідину I. Оксид титану (54 г) і оксид заліза (6 г) диспергували в очищеній воді (900 г), щоб одержати дисперсійну рідину II. Дисперсійну рідину І змішували з дисперсійною рідиною II й очищеною водою (180 г), щоб одержати дисперсію покриття. Використовуючи машину для нанесення покриття (DRC-650, КОРПОРАЦІЯ POWREX), дисперсію покриття розпилювали на прості таблетки, отримані в (3), збільшуючи вагу таблетки на 20 мг, за допомогою чого покриті оболонкою таблетки, що мають наступну композицію, були отримані. Потім, покриті оболонкою таблетки висушували під зниженим тиском при 40 °С протягом 18 годин. композиція препарату (560 мг) амлодипіну бесилат 13,87 мг маніт 122,93 мг кристалічна целюлоза 9 мг гідроксипропілцелюлоза 5,4 мг кристалічна целюлоза 18 мг кросповідон 9 мг стеарат магнію 1,8 мг сполука А 85,36 мг манітол 173,86 мг кристалічна целюлоза 18 мг гідроксид натрію 1,38 мг фумарова кислота 4 мг гідроксипропілцелюлоза 10,8 мг кристалічна целюлоза 36 мг кросповідон 27 мг стеарат магнію 3,6 мг гідроксипропілметилцелюлоза 15,6 мг тальк 2,4 мг оксид титану 1,8 мг оксид заліза 0,2 мг загалом 560 мг Приклад Композиції 5 (1) Гідроксипропілцелюлозу (5124 г) розчиняли в очищеній воді (80280 г), щоб одержати зв'язувальну рідину I. Амлодипіну бесилат (2984 г), маніт (55840 г) і кристалічну целюлозу (3870 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX), і гранулювали розпиленням зв'язувальної рідини I (38700 г) і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули A. (2) Гідроксид натрію (405,8 г) і фумарову кислоту (1176 г) розчиняли в очищеній воді (38230 г), щоб одержати буферний розчин. Гідроксипропілцелюлозу (3018 г) розчиняли в очищеній воді (47280 г), щоб одержати зв'язувальну рідину II. Сполуку А (20060 г), маніт (40860 г) і кристалічну 20 UA 102271 C2 5 10 15 20 25 30 35 40 целюлозу (4230 г) однорідно змішували у грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX) і гранулювали розпиленням буферного розчину (31810 г) і потім зв'язувальної рідини II (42300 г), і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули B. (3) Кристалічну целюлозу (1620 г), кросповідон (945 г), стеарат магнію (162 г), розмелені гранули А (9072 г) і розмелені гранули B (4401 г) змішували в тумблерному міксері (ТМ-100, Showa Chemical Machinery), щоб одержати змішані гранули. (4) Змішані гранули таблетували роторною таблетувальною машиною (AQUA 512SS2AI, Kikusui Seisakusho, Ltd) з 8,5 мм пуансоном (тиск таблетування: 7 KN, вага таблетки 270 мг), щоб одержати прості таблетки. (5) Гідроксипропілметилцелюлозу (468 г) і тальк (72 г) розчиняли й диспергували в очищеній воді (4320 г), щоб одержати дисперсійну рідину I. Оксид титану (54 г) і оксид заліза (6 г) диспергували в очищеній воді (900 г), щоб одержати дисперсійну рідину II. Дисперсійну рідину І змішували з дисперсійною рідиною II й очищеною водою (180 г), щоб одержати дисперсію покриття. Використовуючи машину для нанесення покриття (DRC-650, КОРПОРАЦІЯ POWREX), дисперсію покриття розпилювали на прості таблетки, отримані в (4), збільшуючи вагу таблетки на 10 мг, за допомогою чого покриті оболонкою таблетки, що мають наступну композицію, були отримані. Потім, покриті оболонкою таблетки висушували під зниженим тиском при 40 °С протягом 18 годин. композиція препарату (280 мг) амлодипіну бесилат 6,94 мг маніт 129,86 мг кристалічна целюлоза 9 мг гідроксипропілцелюлоза 5,4 мг сполука А 21,34 мг маніт 43,465 мг кристалічна целюлоза 4,5 мг гідроксид натрію 0,345 мг фумарова кислота 1 мг гідроксипропілцелюлоза 2,7 мг кристалічна целюлоза 27 мг кросповідон 15,75 мг стеарат магнію 2,7 мг гідроксипропілметилцелюлоза 7,8 мг тальк 1,2 мг оксид титану 0,9 мг оксид заліза 0,1 мг загалом 280 мг Приклад Композиції 6 (1) Гідроксипропілцелюлозу (5124 г) розчиняли в очищеній воді (80280 г), щоб одержати зв'язувальну рідину I. Амлодипіну бесилат (5964 г), маніт (52860 г) і кристалічну целюлозу (3870 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX), і гранулювали розпиленням зв'язувальної рідини I (38700 г) і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули A. (2) Гідроксид натрію (405,8 г) і фумарову кислоту (1176 г) розчиняли в очищеній воді (38230 г), щоб одержати буферний розчин. Гідроксипропілцелюлозу (3018 г) розчиняли в очищеній воді (47280 г), щоб одержати зв'язувальну рідину II. Сполуку А (20060 г), маніт (40860 г) і кристалічну целюлозу (4230 г) однорідно змішували у грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX) і гранулювали розпиленням буферного розчину (31810 г) і потім зв'язувальної рідини II (42300 г), і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули B. (3) Кристалічну целюлозу (1620 г), кросповідон (945 г), стеарат магнію (162 г), розмелені гранули А (9072 г) і розмелені гранули B (4401 г) змішували в тумблерному міксері (TM-60S, Showa Chemical Machinery), щоб одержати змішані гранули. (4) Змішані гранули таблетували роторною таблетувальною машиною (AQUA 512SS2AI, Kikusui Seisakusho, Ltd) з 8,5 мм пуансоном (тиск таблетування: 7 KN, вага таблетки 270 мг), 21 UA 102271 C2 5 10 15 20 25 30 35 40 щоб одержати прості таблетки. (5) Гідроксипропілметилцелюлозу (468 г) і тальк (72 г) розчиняли й диспергували в очищеній воді (4320 г), щоб одержати дисперсійну рідину I. Оксид титану (54 г) і оксид заліза (6 г) диспергували в очищеній воді (900 г), щоб одержати дисперсійну рідину II. Дисперсійну рідину І змішували з дисперсійною рідиною II й очищеною водою (180 г), щоб одержати дисперсію покриття. Використовуючи машину для нанесення покриття (DRC-650, КОРПОРАЦІЯ POWREX), дисперсію покриття розпилювали на прості таблетки, отримані в (4), збільшуючи вагу таблетки на 10 мг, за допомогою чого покриті оболонкою таблетки, що мають наступну композицію, були отримані. Потім, покриті оболонкою таблетки висушували під зниженим тиском при 40 °С протягом 18 годин. композиція препарату (280 мг) амлодипіну бесилат 13,87 мг маніт 122,93 мг кристалічна целюлоза 9 мг гідроксипропілцелюлоза 5,4 мг сполука А 21,34 мг маніт 43,465 мг кристалічна целюлоза 4,5 мг гідроксид натрію 0,345 мг фумарова кислота 1 мг гідроксипропілцелюлоза 2,7 мг кристалічна целюлоза 27 мг кросповідон 15,75 мг стеарат магнію 2,7 мг гідроксипропілметилцелюлоза 7,8 мг тальк 1,2 мг оксид титану 0,9 мг оксид заліза 0,1 мг загалом 280 мг Приклад Композиції 7 (1) Гідроксипропілцелюлозу (5124 г) розчиняли в очищеній воді (80280 г), щоб одержати зв'язувальну рідину I. Амлодипіну бесилат (2984 г), маніт (55840 г) і кристалічну целюлозу (3870 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX), і гранулювали розпиленням зв'язувальної рідини I (38700 г) і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули A. (2) Гідроксид натрію (405,8 г) і фумарову кислоту (1176 г) розчиняли в очищеній воді (38230 г), щоб одержати буферний розчин. Гідроксипропілцелюлозу (3018 г) розчиняли в очищеній воді (47280 г), щоб одержати зв'язувальну рідину II. Сполуку А (20060 г), маніт (40860 г) і кристалічну целюлозу (4230 г) однорідно змішували у грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX) і гранулювали розпиленням буферного розчину (31810 г) і потім зв'язувальної рідини II (42300 г), і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули B. (3) Кристалічна целюлоза (1620 г), кросповідон (1080 г), стеарат магнію (162 г), розмелені гранули А (4536 г) і розмелені гранули B (8802 г) змішували в тумблерному міксері (TM-60S, Showa Chemical Machinery), щоб одержати змішані гранули. (4) Змішані гранули таблетували роторною таблетувальною машиною (AQUA 512SS2AI, Kikusui Seisakusho, Ltd) з пуансоном, що має головну вісь 14 мм, допоміжну вісь 8 мм (тиск таблетування: 9 KN, вага таблетки 540 мг), щоб одержати прості таблетки. (5) Гідроксипропілметилцелюлозу (468 г) і тальк (72 г) розчиняли й диспергували в очищеній воді (4320 г), щоб одержати дисперсійну рідину I. Оксид титану (54 г) і оксид заліза (6 г) диспергували в очищеній воді (900 г), щоб одержати дисперсійну рідину II. Дисперсійну рідину І змішували з дисперсійною рідиною II й очищеною водою (180 г), щоб одержати дисперсію покриття. Використовуючи машину для нанесення покриття (DRC-650, КОРПОРАЦІЯ POWREX), дисперсію покриття розпилювали на прості таблетки, отримані в (4), збільшуючи вагу таблетки на 20 мг, за допомогою чого покриті оболонкою таблетки, що мають наступну композицію, були отримані. Потім, покриті оболонкою таблетки висушували під зниженим тиском при 40 °С протягом 18 годин. 22 UA 102271 C2 5 10 15 20 25 30 композиція препарату (560 мг) амлодипіну бесилат 6,94 мг маніт 129,86 мг кристалічна целюлоза 9 мг гідроксипропілцелюлоза 5,4 мг сполука А 85,36 мг манітол 173,86 мг кристалічна целюлоза 18 мг гідроксид натрію 1,38 мг фумарова кислота 4 мг гідроксипропілцелюлоза 10,8 мг кристалічна целюлоза 54 мг кросповідон 36 мг стеарат магнію 5,4 мг гідроксипропілметилцелюлоза 15,6 мг тальк 2,4 мг оксид титану 1,8 мг оксид заліза 0,2 мг загалом 560 мг Приклад Композиції 8 (1) Гідроксипропілцелюлозу (5124 г) розчиняли в очищеній воді (80280 г), щоб одержати зв'язувальну рідину I. Амлодипіну бесилат (5964 г), маніт (52860 г) і кристалічну целюлозу (3870 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX), і гранулювали розпиленням зв'язувальної рідини I (38700 г) і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули A. (2) Гідроксид натрію (405,8 г) і фумарову кислоту (1176 г) розчиняли в очищеній воді (38230 г), щоб одержати буферний розчин. Гідроксипропілцелюлозу (3018 г) розчиняли в очищеній воді (47280 г), щоб одержати зв'язувальну рідину II. Сполуку А (20060 г), маніт (40860 г), кристалічну целюлозу (4230 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX) і гранулювали, розпилюючи буферний розчин (31810 г) і потім зв'язувальну рідину II (42300 г), і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули B. (3) Кристалічну целюлозу (1620 г), кросповідон (1080 г), стеарат магнію (162 г), розмелені гранули А (4536 г) і розмелені гранули B (8802 г) змішували в тумблерному міксері (TM-60S, Showa Chemical Machinery), щоб одержати змішані гранули. (4) Змішані гранули таблетували роторною таблетувальною машиною (AQUA 512SS2AI, Kikusui Seisakusho, Ltd) з пуансоном, що має головну вісь 14 мм, допоміжну вісь 8 мм (тиск таблетування: 9 KN, вага таблетки 540 мг), щоб одержати прості таблетки. (5) Гідроксипропілметилцелюлозу (468 г) і тальк (72 г) розчиняли й диспергували в очищеній воді (4320 г), щоб одержати дисперсійну рідину I. Оксид титану (54 г) і оксид заліза (6 г) диспергували в очищеній воді (900 г), щоб одержати дисперсійну рідину II. Дисперсійну рідину І змішували з дисперсійною рідиною II й очищеною водою (180 г), щоб одержати дисперсію покриття. Використовуючи машину для нанесення покриття (DRC-650, КОРПОРАЦІЯ POWREX), дисперсію покриття розпилювали на прості таблетки, отримані в (4), збільшуючи вагу таблетки на 20 мг, за допомогою чого покриті оболонкою таблетки, що мають наступну композицію, були отримані. Потім, покриті оболонкою таблетки висушували під зниженим тиском при 40 °С протягом 18 годин. композиція препарату (560 мг) амлодипіну бесилат 13,87 мг маніт 122,93 мг кристалічна целюлоза 9 мг гідроксипропілцелюлоза 5,4 мг сполука А 85,36 мг манітол 173,86 мг кристалічна целюлоза 18 мг гідроксид натрію 1,38 мг фумарова кислота 4 мг 23 UA 102271 C2 5 10 15 20 25 30 35 гідроксипропілцелюлоза 10,8 мг кристалічна целюлоза 54 мг кросповідон 36 мг стеарат магнію 5,4 мг гідроксипропілметилцелюлоза 15,6 мг тальк 2,4 мг оксид титану 1,8 мг оксид заліза 0,2 мг загалом 560 мг Приклад Композиції 9 (1) Гідроксипропілцелюлозу (162 г) розчиняли в очищеній воді (2538 г), щоб одержати зв'язувальну рідину I. Амлодипіну бесилат (416,9 г), маніт (3687 г) і кристалічну целюлозу (270 г) однорідно змішували в грануляторі псевдозрідженого шару (FD-5S, КОРПОРАЦІЯ POWREX), і гранулювали розпиленням зв'язувальної рідини I і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-3, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули. Кристалічну целюлозу (396 г), кросповідон (198 г), стеарат магнію (39,6 г) і розмелені гранули (3326 г) змішували в тумблерному міксері (TM-60S, Showa Chemical Machinery), щоб одержати змішані гранули A. (2) Гідроксид натрію (62,1 г) і фумарову кислоту (180 г) розчиняли в очищеній воді (5850 г), щоб одержати буферний розчин. Гідроксипропілцелюлозу (486 г) розчиняли в очищеній воді (7614 г), щоб одержати зв'язувальну рідину II. Сполуку А (1196 г), маніт (2433 г) і кристалічну целюлозу (252 г) однорідно змішували у грануляторі псевдозрідженого шару (FD-5S, КОРПОРАЦІЯ POWREX), і гранулювали, розпилюючи буферний розчин (1895 г) і потім зв'язувальну рідину II (2520 г), і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-3, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули. Кристалічну целюлозу (792 г), кросповідон (594 г), стеарат магнію (79,2 г) і розмелені гранули (6455 г) змішували в тумблерному міксері (TM-60S, Showa Chemical Machinery), щоб одержати змішані гранули B. (3) Змішані гранули А (180 мг) і змішані гранули B (360 мг) таблетували у формі подвійного шару роторною таблетувальною машиною (AQUA 08242L2JI, Kikusui Seisakusho, Ltd) з пуансоном, що має головну вісь 14,8 мм, допоміжну вісь 8 мм (тиск таблетування 11KN, вага таблетки 540 мг), щоб одержати прості таблетки. (4) Гідроксипропілметилцелюлозу (390 г) і тальк (60 г) розчиняли й диспергували в очищеній воді (3500 г), щоб одержати дисперсійну рідину I. Оксид титану (45 г) і оксид заліза (5 г) диспергували в очищеній воді (750 г), щоб одержати дисперсійну рідину II. Дисперсійну рідину І змішували з дисперсійною рідиною II й очищеною водою (250 г), щоб одержати суспензію покриття. Використовуючи машину для нанесення покриття (DRC-500, КОРПОРАЦІЯ POWREX), дисперсію покриття розпилювали на прості таблетки, отримані в (3), збільшуючи вагу таблетки на 20 мг, за допомогою чого покриті оболонкою таблетки, що мають наступну композицію, були отримані. Потім, покриті оболонкою таблетки висушували під зниженим тиском при 40 °С протягом 16 годин. композиція препарату (560 мг) амлодипіну бесилат 13,87 мг маніт 122,93 мг кристалічна целюлоза 9 мг гідроксипропілцелюлоза 5,4 мг кристалічна целюлоза 18 мг кросповідон 9 мг стеарат магнію 1,8 мг сполука А 85,36 мг маніт 173,86 мг кристалічна целюлоза 18 мг гідроксид натрію 1,38 мг фумарова кислота 4 мг гідроксипропілцелюлоза 10,8 мг кристалічна целюлоза 36 мг кросповідон 27мг стеарат магнію 3,6 мг 24 UA 102271 C2 5 10 15 20 25 30 35 гідроксипропілметилцелюлоза 15,6 мг тальк 2,4 мг оксид титану 1,8 мг оксид заліза 0,2 мг загалом 560 мг Допоміжний Приклад 1 Сполуку А (42,68 г), лактозу (217,32 г), кристалічну целюлозу (32 г) і монофумарат натрію (10 г) однорідно змішували в грануляторі псевдозрідженого шару (Lab-1, КОРПОРАЦІЯ POWREX), і гранулювали, розпилюючи водний розчин гідроксипропілцелюлози (12 г) і монофумарат натрію (10 г), і потім висушували в грануляторі псевдозрідженого шару. Отримані гранули пропускали через сито 16 (апертура 1.0 мм), щоб одержати просіяні гранули. Низько заміщену гідроксипропілцелюлозу (0,8 г) і просіяні гранули (16,2 г) змішували в скляному балоні. Отримані змішані гранули таблетували на Autograph (виробництво корпорації Shimadzu, AG5000B), використовуючи 9, 5 мм пуансон (тиск таблетування: 7,5 KN/пуансон, вага таблетки 398,3 мг), щоб одержати прості таблетки, що мають наступну композицію. Потім прості таблетки висушували під зниженим тиском при 40 °С протягом 16 годин. композиція препарату (398,3 мг) сполука А 50 мг лактоза 254,6 мг кристалічна целюлоза 37,5 мг гідроксипропілцелюлоза 14,1 мг монофумарат натрію 23,4 мг низько заміщена 18,7 мг гідроксипропілцелюлоза загалом 398,3 мг Приклад композиції 11 (1) Сполуку А (85,36 г), амлодипіну бесилат (13,87 г), маніт (184,89 г) і кристалічну целюлозу (22,5 г) однорідно змішували у грануляторі псевдозрідженого шару (Lab-1, КОРПОРАЦІЯ POWREX) і гранулювали, розпилюючи водний розчин гідроксипропілцелюлози (12,0 г), фумарову кислоту (4,0 г) і гідроксид натрію (1,38 г), і потім висушували у грануляторі псевдозрідженого шару. Отримані гранули пропускали через сито 16 (апертура 1.0 мм), щоб одержати просіяні гранули A. Натрій-кроскармелозу (25,6 г), кристалічну целюлозу (32,0 г), стеарат магнію (3,2 г) і просіяні гранули змішували у поліетиленовому мішку. (2) Отримані змішані гранули таблетували роторною таблетувальною машиною (VEL50306SS2MZ, Kikusui Seisakusho, Ltd), використовуючи 9, 5 мм пуансон (тиск таблетування: 7 KN/пуансон, вага таблетки 400 мг), щоб одержати прості таблетки, що мають наступну композицію. Потім прості таблетки висушували під зниженим тиском при 40 °С протягом 16 годин. Композиція препарату (400 мг) сполука А 85,36 мг амлодипіну бесилат 13,87 мг маніт 184,89 мг кристалічна целюлоза 22,5 мг гідроксипропілметилцелюлоза 12 мг фумарова кислота 4 мг гідроксид натрію 1,38 мг натрій-кроскармелоза 40 мг кристалічна целюлоза 32 мг стеарат магнію 4 мг загалом 400 мг Приклад композиції 12 (1) Амлодипіну бесилат (41.61 г), кристалічну целюлозу (35,1 г) і маніт (349.89 г) однорідно змішували в грануляторі псевдозрідженого шару (Lab-1, КОРПОРАЦІЯ POWREX) і гранулювали, розпилюючи водний розчин гідроксипропілметилцелюлози (16,2 г), і потім висушували в грануляторі псевдозрідженого шару. Отримані гранули пропускали через сито 16 (апертура 1.0 мм), щоб одержати просіяні гранули A. Натрій-кроскармелозу (15,12 г), кристалічну целюлозу (21.6 г), стеарат магнію (2,16 г) і просіяні гранули (177,12 г) змішували у поліетиленовому мішку, щоб одержати змішані гранули A. (2) Сполуку А (136,58 г) і маніт (306,98 г) однорідно змішували в грануляторі псевдозрідженого шару (Lab-1, КОРПОРАЦІЯ POWREX) і гранулювали, розпилюючи водний 25 UA 102271 C2 5 10 15 20 25 30 35 40 розчин гідроксипропілцелюлози (17,3 г), фумарову кислоту (6,4 г) і гідроксид натрію (2,21 г), і потім висушували у грануляторі псевдозрідженого шару. Отримані гранули пропускали через сито 16 (апертура 1.0 мм), щоб одержати просіяні гранули B. Натрій-кроскармелозу (32,4 г), кристалічну целюлозу (43,2 г), стеарат магнію (4,3 г) і просіяні гранули (352,1 г) змішували у поліетиленовому мішку, щоб одержати змішані гранули B. (3) Отримані змішані гранули А (180 мг) і B (360 мг) таблетували на Autograph (виробництво корпорації Shimadzu, AG-5000B), використовуючи 11мм пуансон (тиск таблетування: 9 KN/пуансон, вага таблетки 540 мг), щоб одержати прості таблетки, що мають наступну композицію. Потім прості таблетки висушували під зниженим тиском при 40 °С протягом 16 годин. композиція препарату (540 мг) сполука А 85,36 мг амлодипіну бесилат 13,87 мг маніт 308,49 мг кристалічна целюлоза 11,7 мг гідроксипропілцелюлоза 10,8 мг гідроксипропілметилцелюлоза 5,4 мг фумарова кислота 4 мг гідроксид натрію 1,38 мг натрій-кроскармелоза 39,6 мг кристалічна целюлоза 54 мг стеарат магнію 5,4 мг загалом 540 мг Порівняльний Приклад 1 Сполуку А (42,68 г), лактозу (217,32 г) і кристалічну целюлозозу (32 г) однорідно змішували в грануляторі псевдозрідженого шару (Lab-1, КОРПОРАЦІЯ POWREX) і гранулювали, розпилюючи водний розчин гідроксипропілцелюлози (12 г) і потім висушували в грануляторі псевдозрідженого шару. Отримані гранули пропускали через сито 16 (апертура 1.0 мм), щоб одержати просіяні гранули. Низько заміщену гідроксипропілцелюлозу (0,8 г) і просіяні гранули (15,2 г) змішували у скляному балоні. Отримані змішані гранули таблетували на Autograph (виробництво корпорації Shimadzu, AG-5000B), використовуючи 9, 5 мм пуансон (тиск таблетування: 7,5 KN/пуансон, вага таблетки 374,9 мг), щоб одержати прості таблетки, що мають наступну композицію. Потім прості таблетки висушували під зниженим тиском при 40 °С протягом 16 годин. Композиція препарату (374,9 мг) сполука А 50 мг лактоза 254,6 мг кристалічна целюлоза 37,5 мг гідроксипропілцелюлоза 14,1 мг низько заміщена 18,7 мг гідроксипропілцелюлоза загалом 374,9 мг Приклад композиції 13 (1) Сполуку А (136,58 г) і маніт (306,98 г) однорідно змішували в грануляторі псевдозрідженого шару (Lab-1, КОРПОРАЦІЯ POWREX) і гранулювали, розпилюючи водний розчин гідроксипропілцелюлози (17,3 г), фумарову кислоту (6,4 г) і гідроксид натрію (2,21 г), і потім висушували у грануляторі псевдозрідженого шару. Отримані гранули пропускали через сито 16 (апертура 1.0 мм), щоб одержати просіяні гранули A. Натрій-кроскармелозу (32,4 г), кристалічну целюлозу (43,2 г), стеарат магнію (4,3 г) і просіяні гранули (352,1 г) змішували у поліетиленовому мішку, щоб одержати змішані гранули A. (2) Кристалічну целюлозу (гранули) (212,5 г) завантажували в роторний гранулятор (SPIR-AFLOW, Корпорація Freund), рідку суспензію амлодипіну бесилату (34,675 г), кристалічну целюлозу (7,825 г), низько заміщену гідроксипропілцелюлозу (15 г) і гідроксипропілметилцелюлозу (30 г) розпилювали на гранули для нашаровування, і нашаровані гранули висушували в роторному грануляторі. Отримані тонкі гранули пропускали через сита, щоб одержати 150-350 μм тонкі гранули B. (3) Низько заміщену гідроксипропілцелюлозу (18 г), гідроксипропілметилцелюлозу (25,2 г), тальк (10,8 г), оксид титану (10,8 г) і маніт (25,2 г) розчиняли й диспергували в очищеній воді (810 г), щоб одержати рідку дисперсію. Отримані тонкі гранули B (180 г) покривали в роторному грануляторі (SPIR-A-FLOW, Корпорація Freund), поки загальна вага не збільшилася на 50 %, і 26 UA 102271 C2 5 10 15 20 25 30 висушували в роторному грануляторі. Отримані тонкі гранули пропускали через сита, щоб одержати 150-425 мкм тонкі гранули C. (4) Змішані гранули (126 г) і тонкі гранули C (63 г) змішували в поліетиленовому мішку. Отримані змішані гранули таблетували роторною таблетувальною машиною (VEL50306SS2MZ, Kikusui Seisakusho, Ltd) з 10,5мм пуансоном (тиск таблетування: 8,5 KN/пуансон, вага таблетки - 540 мг), щоб одержати прості таблетки з наступною композицією. Потім прості таблетки висушували під зниженим тиском при 40 °С протягом 16 годин. композиція препарату (540 мг) сполука А 85,36 мг маніт 191,86 мг гідроксипропілцелюлоза 10,8 мг фумарова кислота 4 мг гідроксид натрію 1,38 мг амлодипіну бесилат 13,87 мг кристалічна целюлоза(гранули) 85 мг кристалічна целюлоза 3,13 мг низько заміщена 18 мг гідроксипропілцелюлоза гідроксипропілметилцелюлоза 28,8 мг тальк 7,2 мг оксид титану 7,2 мг маніт 16,8 мг натрій-кроскармелоза 27 мг кристалічна целюлоза 36 мг стеарат магнію 3,6 мг загалом 540 мг Приклад композиції 14 (1) Гідроксипропілцелюлозу (2802 г) розчиняли в очищеній воді (43900 г), щоб одержати зв'язувальну рідину I. Амлодипіну бесилат (5464 г), маніт (52860 г) і кристалічну целюлозу (3870 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX) і гранулювали розпиленням зв'язувальної рідини I (38700 г) і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули. Кристалічну целюлозу (7290 г), кросповідон (3645 г), стеарат магнію (729 г) і розмелені гранули, змішували в тумблерному міксері (ТМ-400S, Showa Chemical Machinery), щоб одержати змішані гранули A. (2) Гідроксид натрію (2,76 г) і фумарову кислоту (8 г) розчиняли в очищеній воді (260 г), щоб одержати буферний розчин. Гідроксипропілцелюлозу (16,2 г) розчиняли у частині цього (203,1 г), щоб одержати зв'язувальну рідину II. Сполуку А (128 г), маніт (260,8 г) і кристалічну целюлозу (27 г) однорідно змішували у грануляторі псевдозрідженого шару (Lab-1, КОРПОРАЦІЯ POWREX) і гранулювали, розпилюючи зв'язувальну рідину II, і потім висушували, щоб одержати гранули. Частину отриманих гранул пропускали через сито 16 (апертура 1.0 мм), щоб одержати просіяні гранули. Кристалічну целюлозу (36 г), кросповідон (27 г), стеарат магнію (3,6 г) і просіяні гранули (293,4 г) змішували в поліетиленовому мішку, щоб одержати змішані гранули B. (3) Змішані гранули А (180 мг) і змішані гранули B (360 мг) таблетували у формі подвійного шару, використовуючи Autograph (AG-500B, виробництво корпорації Shimadzu) з головною віссю 14 мм, допоміжною віссю 8 мм пуансона (тиск таблетування 8 KN, вага таблетки 540 мг), щоб одержати прості таблетки. Потім прості таблетки висушували під зниженим тиском при 40 °С протягом 15 годин. композиція препарату (540 мг) амлодипіну бесилат 13,87 мг маніт 122,93 мг кристалічна целюлоза 9 мг гідроксипропілцелюлоза 5,4 мг кристалічна целюлоза 18 мг кросповідон 9 мг стеарат магнію 1,8 мг сполука А 85,36 мг манітол 173,86 мг кристалічна целюлоза 18 мг 27 UA 102271 C2 5 10 15 20 25 30 35 гідроксид натрію 1,38 мг фумарова кислота 4 мг гідроксипропілцелюлоза 10,8 мг кристалічна целюлоза 36 мг кросповідон 27 мг стеарат магнію 3,6 мг загалом 540 мг Порівняльний Приклад 2 (1) Гідроксипропілцелюлозу (2802 г) розчиняли в очищеній воді (43900 г), щоб одержати зв'язувальну рідину I. Амлодипіну бесилат (5464 г), маніт (52860 г) і кристалічну целюлозу (3870 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX) і гранулювали розпиленням зв'язувальної рідини I (38700 г) і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули. Кристалічну целюлозу (7290 г), кросповідон (3645 г), стеарат магнію (729 г) і розмелені гранули (61240 г) змішували в тумблерному міксері (ТМ-400S, Showa Chemical Machinery), щоб одержати змішані гранули A. (2) Гідроксипропілцелюлозу (16,2 г) розчиняли в очищеній воді (253,8 г), щоб одержати зв'язувальну рідину II. Сполуку А (128 г), маніт (268,9 г) і кристалічна целюлоза (27 г) однорідно змішували у грануляторі псевдозрідженого шару (Lab-1, КОРПОРАЦІЯ POWREX) і гранулювали, розпилюючи зв'язувальну рідину II, і потім висушували, щоб одержати гранули. Частину отриманих гранул пропускали через сито 16 (апертура 1.0 мм), щоб одержати просіяні гранули. Кристалічну целюлозу (36 г), кросповідон (27 г), стеарат магнію (3,6 г) і просіяні гранули (293,4 г) змішували в поліетиленовому мішку, щоб одержати змішані гранули B. (3) Змішані гранули А (180 мг) і змішані гранули B (360 мг) таблетували у формі подвійного шару, використовуючи Autograph (AG-500B, виробництво корпорації Shimadzu) із пуансоном, що має головну вісь 14 мм, допоміжну вісь 8 мм ((тиск таблетування 8 KN, вага таблетки 540 мг), щоб одержати прості таблетки. Потім прості таблетки висушували під зниженим тиском при 40 °С протягом 15 годин. композиція препарату (540 мг) амлодипіну бесилат 13,87 мг маніт 122,93 мг кристалічна целюлоза 9 мг гідроксипропілцелюлоза 5,4 мг кристалічна целюлоза 18 мг кросповідон 9 мг стеарат магнію 1,8 мг сполука А 85,36 мг маніт 179,24 мг кристалічна целюлоза 18 мг гідроксипропілцелюлоза 10,8 мг кристалічна целюлоза 36 мг кросповідон 27 мг стеарат магнію 3,6 мг загалом 540 мг Приклад композиції 15 (1) Гідроксипропілцелюлозу (2802 г) розчиняли в очищеній воді (43900 г), щоб одержати зв'язувальну рідину I. Амлодипіну бесилат (2982 г), маніт (55840 г) і кристалічну целюлозу (3870 г) однорідно змішували в грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX) і гранулювали розпиленням зв'язувальної рідини I (38700 г) і потім висушували, щоб одержати гранули. Частину отриманих гранул розмелювали у потужній дробарці (P-7S, Showa Chemical Machinery), використовуючи 1,5 мм решето із штампованими отворами, щоб одержати розмелені гранули. Кристалічну целюлозу (7290 г), кросповідон (3645 г), стеарат магнію (729 г) і розмелені гранули (61240 г) змішували в тумблерному міксері (ТМ-400S, Showa Chemical Machinery), щоб одержати змішані гранули A. (2) Гідроксид натрію (405,8 г) і фумарову кислоту (1176 г) розчиняли в очищеній воді (38230 г), щоб одержати буферний розчин. Гідроксипропілцелюлозу (3018 г) розчиняли в очищеній воді (47280 г), щоб одержати зв'язувальну рідину II. Сполуку А (20060 г), маніт (40860 г) і кристалічну целюлозу (4230 г) однорідно змішували у грануляторі псевдозрідженого шару (WSG-60, КОРПОРАЦІЯ POWREX) і гранулювали розпиленням буферного розчину (31810 г) і потім 28
ДивитисяДодаткова інформація
Назва патенту англійськоюSolid pharmaceutical composition (5-methyl-2-oxo-1,3-dioxol-4-yl)methyl-2-ethoxy-1-{[2'-(5-oxo-4,5-dihydro-1,2,4- oxadiazole -3-yl)biphenyl-4-yl]methyl}-1h-benzimidazole-7-carboxylate
Автори англійськоюHirata, Kazuhiro, Nomura, Junya, Tanoue, Yutaka
Назва патенту російськоюТвердая фармацевтическая композиция (5-метил-2-оксо-1,3-диоксол-4-ил)метил-2-этокси-1-{[2'-(5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил}-1н-бензимидазол-7-карбоксилата
Автори російськоюХирата Казухиро, Номура Юния, Таноуе Ютака
МПК / Мітки
МПК: A61P 25/00, A61P 5/50, A61P 15/12, A61K 47/12, A61P 19/00, A61P 9/00, A61K 31/4184, A61K 31/4422, A61P 1/00, A61P 11/00, A61K 47/22, A61P 3/00, A61P 17/00, A61P 21/00, A61P 13/00
Мітки: фармацевтична, 5-метил-2-оксо-1,3-діоксол-4-іл)метил-2-етоксі-1-{[2'-(5-оксо-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1н-бензімідазол-7-карбоксилату, композиція, тверда
Код посилання
<a href="https://ua.patents.su/39-102271-tverda-farmacevtichna-kompoziciya-5-metil-2-okso-13-dioksol-4-ilmetil-2-etoksi-1-2-5-okso-45-digidro-124-oksadiazol-3-ilbifenil-4-ilmetil-1n-benzimidazol-7-karboksilatu.html" target="_blank" rel="follow" title="База патентів України">Тверда фармацевтична композиція (5-метил-2-оксо-1,3-діоксол-4-іл)метил-2-етоксі-1-{[2′-(5-оксо-4,5-дигідро-1,2,4-оксадіазол-3-іл)біфеніл-4-іл]метил}-1н-бензімідазол-7-карбоксилату</a>
Попередній патент: Феромагнітна фільтруюча насадка для магнітного осадження
Наступний патент: Спосіб культивування одноклітинної зеленої мікроводорості dunaliella salina для отримання біомаси
Випадковий патент: Спосіб електричного бокового каротажу комбінацією прямих вимірів