Спосіб кількісного визначення перекису водню та субстратів оксидаз у біологічних об’єктах
Номер патенту: 10752
Опубліковано: 25.12.1996
Автори: Сибірний Андрій Андрійович, Майдан Микола Миколайович, Гончар Михайло Васильович
Формула / Реферат
Спосіб кількісного визначення перекису водню та субстратів оксидаз у біологічних об'єктах за допомогою ферментативної реакції пероксидазного окислення 3,3',5,5'-тетрамстилбензидину до кольорового продукту з наступним фотометруванням, який відрізняється тим, що при його проведенні концентрацію тетраметилбензидину в реакційній суміші знижують до 0,05-0,1 мМ і фотометрування проводять при рН 1,4-2,1 при 450 мм.
Текст
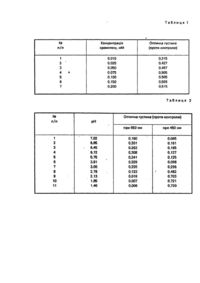
Винахід відноситься до медицини, а саме, до біохімічних засобів діагностики, І може бути використаний для кількісного визначення як вільного перекису водню, так І ряду органічних речовин (наприклад, глюкози, етанолу), здатних при ферментативному окисленні під дією специфічних оксидаз генерувати перекис водню. Відомо багато способів визначення вільного та генерованого перекису водню. їх можна розділити на дві великі групи: хімічні та ферментативні. Ферментативні методи аналізу Н 2О2 з використанням перслссидази характеризуються високою чутливістю, експресністю та специфічністю. До цієї групи методів відноситься І пропонований спосіб. У відомих способах ферментативного визначення перекису водню використовуються різні хромогени, які дають при окисленні перекисом водню в присутності пероксидази хрону забарвлені або флуоресціюючі продукти. Хромогеном може служити або одна сполука, звичайно окси- або амінопохідна ароматичної природи, або суміш двох речовин, здатних при пероксидазному окисному сполученні генерувати барвник Із високим коефіцієнтом молярного поглинання. Найближчим за технічною суттю до розв'язуваного завдання (прототипом) є спосіб визначення пероксидази та ряду гемо-вих білків, що володіють пероксидазною активністю (зокрема, гемоглобіну), із використанням в якості хромогена неканцерогенного дигідрохлориду 3,3".5,5'-тетраметилбензидину (ТМВ). Суть методу полягає у генеруванні в процесі пероксидазного окислення даної сполуки кольорового продукту, фотометрування якого дозволяє визначити лімітуючі концентрації пероксидази. Недоліком даного способу ε недостатня чутливість, відсутність операції зупинки реакції, неадаптованість методики для кількісного визначення вільного та генерованого перекису водню та велика витрата дорогого реагента (ТМВ) у ході аналізу. Задачею винаходу є підви щення чутливості, точності аналізу, розширення сфери використання методики та здешевлення матеріальних витрат при аналізі. Поставлена задача досягаєтся тим, що в ході пероксидазного аналізу використовується знижена у 10-20 разів (порівняно Із прототипом) кількість хромогена - дигідрохлориду 3,3',5,5’-тетраметилбензидину (ТМВ), і реакція зупиняється додаванням до реакційної суміші розчину соляної кислоти до рН 1.4-2,1. Розширення функціональних можливостей способу (аналіз глюкози, етанолу тощо) досягається шляхом введення в реакційну суміш відповідних оксидаз (глюкозооксидази, алкогольоксидази та ін.) І вимірюванням генерованого перекису водню за допомогою пероксидазної реакції. Спосіб здійснюється таким чином. До розчину дигідрохлориду 3,3',5,5'-тетраметилбензидину (з кінцевою концентрацією 0,05-0,1 мМ) у буферній системі з певним значенням рН вносять надлишок пероксидази хрону і досліджувану пробу, що містить вільний перекис водню у лімітуючій концентрації. При визначенні пероксидази, навпаки, використовують надлишок перекису водню І вносять лімітуючі кількості фермента. У випадку аналізу субстратів оксидаз (глюкози, етанолу тощо) до реакційної суміші вносять також відповідну оксидазу (глюкозооксидазу, алкогольоксидазу). Суміш Інкубують фіксований інтервал часу, І реакцію зупиняють додаванням розчину соляної кислоти до рН 1,4-2,1. Проби фото-метрують при 450 нм, і за величиною оптичної густини визначають концентрацію перекису водню або субстрату оксидази, використовуючи метод калібрування. Зменшення кінцевої концентрації хромогена ТМВ дозволяє зекономити матеріальні затрати без суттєвої зміни чутливості аналізу, а використання термінуючого кислотного реагента І фотометрування суміші при 450 нм дає можливість як збільшити чутливість аналізу, так і підвищити його точність у зв'язку з зупинкою реакції І припиненням росту оптичної густини. Реалізація способу Ілюструється такими прикладами. Прикладі. Аналіз вільного перекису водню. 10-200 мкл досліджуваної проби, що містить 3-50 нмоль перекису водню, доводять водою до об'єму 0,2 мл, додають 3 мл 0,083 мМ розчину солянокислого 3,3',5,5'-тетраметилбензидину в 0,05 Μ фосфа тному буфері, рН 7,0,1 реакцію запускають внесенням 0,3 мл водного розчину пероксидази хрону(RZ = 0,5) із концентрацією 0,67 мг/мл. Через 5 хв інкубації при кімнатній температурі реакцію зупиняють додаванням 0,5 мл 0,8 Μ соляної кислоти. Проби фото-метрують у 1 - см кюветах при 450 нм на фото-електроколориметрі або спектрофотометрі проти контролю, що містить усі компоненти реакційної суміші, крім досліджуваної проби (замість неї вноситься вода). Вміст Н 2О2 у ви хідній пробі (у ммоль/л) визначають за калібрувальним графіком або наступною формулою: де D - оптична густина розчину при 450 нм; k - розрахунковий коефіцієнт, визначений у калібрувальному досліді (для описаних умов та спектрофотометрами рівний 0,0489, що відповідає коефіцієнту молярного поглинання εΜ = 81,74х103 моль"1 л см"1); n - розведення вихідної проби перед введенням в інкубовану суміш; V - об'єм внесеної проби, мл. Наприклад, досліджувану пробу розвели у 100 разів і для аналізу взяли 0,1 мл. Оптична густина склала 0,509. Розрахунок дає величину концентрації перекису водню, рівну 24,9 мМ. Приклад 2. Аналіз перекису водню, генерованого в глюкозооксидазній реакції (метод визначення глюкози). 10-200 мкл досліджуваної проби, що містить 4-100 нмоль глюкози, доводять до об'єму 0,2 мл, додають 3 мл 0,083 мМ водного солянокислого З,З',5,5'-тетраметилбензидину в 0,05 Μ фосфатному буфері, рН 7,0, і реакцію запускають внесенням 0,3 мл водного розчину суміші двох ферментів - пероксидази хрону (RZ = 0,5) Із концентрацією 0,67 мг/мл та глюкозооксидази (питома активність 100-125 од.акт./мг) Із концентрацією 1,67 мг/мл. Через 10 хв Інкубації при кімнатній температурі до реакційної суміші додають 0,5 мл 0,8 Μ соляної кислоти. Проби фотометрують у 1- см кюветах при 450 нм на фото-електроколориметрі або спектрофотометрі проти контролю, що містить усі компоненти реакційної суміші, крім досліджуваної проби (замість неї вноситься вода). Вміст глюкози у вихідній пробі (у ммоль/л) визначають за калібрувальним графіком або наступною формулою: де D - оптична густина розчину при 450 нм; к - розрахунковий коефіцієнт, визначений у калібрувальному досліді (для описаних умов та спектрофотометра він рівний 0,0721); n - розведення вихідної проби перед введенням в інкубовану суміш; V - об'єм внесеної проби, мл. Наприклад, досліджувану пробу (сироватку крові) розвели у 10 разів І для аналізу взяли 0,1 мл. Оптична густина склала 0,770. Розрахунок концентрації глюкози у ви хідній сироватці крові дає величину, рівн у 5,55 мМ. Приклад 3. Аналіз перекису водню, генерованого в алкогольоксидазній реакції (метод визначення етанолу). 10-200 мкл розведеної досліджуваної проби, що містить 2,5-50 мкг етанолу, доводять до об'єму 0,2 мл, додають 3 мл 0,083 мМ водного солянокислого 3,3',5,5'-тетраметилбензидину в 0,05 Μ фосфатному буфері, рН 7,0, і реакцію запускають внесенням 0,3 мл водного розчину суміші двох ферментів - пероксидази хрону (RZ = 0,5) із концентрацією 0,67 мг/мл та алкогольокаси-дази (питома активність 1-4 од.акт./мг) у кількості )0,25 од.акт. Через 20 хв Інкубації при кімнатній температурі до реакційної суміші додають 0,5 мл 0,8 Μ соляної кислоти. Проби фотометрують у 1 - см кюветах при 450 нм на фотоелектроколориметрі або спектрофотометрі проти контролю, що містить усі компоненти реакційної суміші, крім досліджуваної проби (замість неї вноситься вода). Вміст етанолу у ви хідній пробі (у г/л) визначають за калібрувальним графіком або наступною формулою: де D - оптична густина розчину при 450 нм; • k - розрахунковий коефіцієнт, визначений у калібрувальному досліді (для описаних умов та спектрофотометра він рівний 0,0434); n - розведення вихідної проби перед введенням в Інкубовану суміш; V - об'єм внесеної проби, мл. Наприклад, досліджувану пробу (бродильну рідину при спиртовому виробництві) розвели у 1000 разів І для аналізу взяли 0,1 мл. Оптична густина склала 0,194. Розрахунок концентрації етанолу у вихідній пробі дає величину, рівну 84.2 г/л (у перерахунку на абсолютний спирт) або 10,9 об'єм% (у перерахунку на 96,5% спирт). Перерахунок між цими величинами здійснюється за формулою: об'ємна конц. (V%)-Cr/n x0,13. Ще один приклад. 0,1 мл цільної крові водія, що знаходився за клінічними ознаками в стані алкогольного оп'яніння, обробили 0,9 мл 4% трихлороцтової кислоти (для депротеїнізації) І для аналізу взяли 0,1 мл супернатанту після центрифугування. Алiквоту нейтралізували до нейтральної реакції і проводили реакцію, як описано вище. Оптична густина реакційної суміші після проведення реакції склала 0,642. Розрахунок вмісту алкоголю у крові суб'єкта дає величину, рівну 2,79 г/л, що перевищує юридично допустимий рівень І підтверджує стан алкогольного оп'яніння. Приклад 4. Аналіз пероксидази хрону. 20-200 мкл досліджуваної проби, що містить 0,25-1,5 нг пероксидази (у перерахунку на чистий фермент), доводять водою до об'єму 0,5 мл І реакцію запускають додаванням 3 мл свіжоприготовленої суміші 0,1 мМ розчину солянокислого 3,3',5,5'-тетрамегилбензидину в 0,05 Μ ацетатному буфері, рН 5,0 І 0,15 мМ Н2О2. Через 10 хв Інкубації при 25°С реакцію зупиняють додаванням 0,5 мл 0,8 Μ соляної кислоти. Проби фотометрують у 1 - см кюветах при 450 нм на фотоелектрокрлориметрі або спектрофотометрі проти контролю, що містить усі компоненти реакційної суміші, крім досліджуваної проби (замість неї вноситься вода). Вміст пероксидази у вихідній пробі (у нг/мл) визначають за калібрувальним графіком або наступною формулою: де D - оптична густина розчину при 450 нм; k - розрахунковий коефіцієнт, визначений у калібрувальному досліді, для препарата пероксидази фірми "Sigma", type VI, RZ = 3,2 (для описаних умов та спектрофотометра він рівний 1,808); n - розведення вихідної проби перед введенням в Інкубовану суміш; V - об'єм внесеної проби, мл. Наприклад, досліджувану пробу фермента розвели у 10 раів і для аналізу взяли 0,1 мл. Оптична густина реакційної суміші склала 0,322. Розрахунок концентрації пероксидази у вихідній пробі дає величину, рівну 53,2 нг/мл. Питому активність препарату фермента (мкмоль хв*1 мг ) розраховують за формулою: де D - оптична густина розчину при 450 нм; кант - розрахунковий коефіцієнт, визначений у калібрувальному досліді за коефіцієнтом молярного поглинання продукту пероксидазної реакції (див. приклад 1); для описаних умов та спектрофотометра він рівний 0,0489); n - розедення вихідної проби перед введенням в інкубовану суміш; V - об'єм внесеноТ проби, мл; χ - час реакції, хв; с - ви хідна концентрація аналізованого препарату фермента, мг/мл. Наприклад, досліджувану пробу препарата пероксидази фірми "Sigma" (type VI, RZ - 3,2) при вихідній концентрації 1 мг/мл розвели у 100.000 разів І для аналізу взяли 0,1 мл. Оптична густина реакційно] ! суміші при 10-хвилиннІй Інкубації склала 0,554. Розрахунок питомої активності препарату фермента дає величину, рівну 2710 мкмоль хв-1 мг-1. Приклад 5. Аналіз гемоглобіну за його : пероксидазною активністю. 20-500 мкл досліджуваної проби, що містить 0,5-6,0 мкг гемоглобіну, доводять водою до об'єму 0,5 мл І реакцію запускають додаванням 3 мл свіжоприготовленої суміші 0,1 мМ розчину солянокислого 3,3',5,5'тетраметилбензидину в 0,05 Μ ацетатному буфері, рН 5,0 і 2,5 мМ Н2О2. Через 10 хв Інкубації при 25°С реакцію зупиняють додаванням 0,5 мл 0,8 Μ соляної кислоти. Проби фотометрують у 1 - см кюветах при 450 нм на фотоелектроколориметрі або спектрофотометрі проти контролю, що містить усі компоненти реакційної суміші, крім досліджуваної проби (замість неї вноситься вода). Вміст гемоглобіну у ви хідній пробі (у мкг/мл) визначають за калібрувальним графіком або наступною формулою: де D - оптична густина розчину при 450 нм; k - розрахунковий коефіцієнт, визначений у калібрувальному досліді для препарата гемоглобіну людини, концентрація якого попередньо тестувалась у ціанметформі (для описаних умов та спектрофотометра він рівний 5,203); n - розведення вихідної проби перед внесенням в інкубовану суміш; V - об'єм внесеної проби, мл. Наприклад, для тестування придатності консервованої донорської крові (за рівнем гемолізу еритроцитів) аліквоту плазми крові (супернатанту після осадження еритроцитів) розвели у 10 разів І для аналізу взяли 0,1 мл. Оптична густина реакційної суміші склала 0,158. Розрахунок концентрації гемоглобіну у ви хідній плазмі дає величину, рівну 82,2 мкг/мл або 0,082 r/л, що нижче допустимого рівня (0,2 tin). Отже, даний препарат консервованої крові за рівнем гемолізу придатний для переливання пацієнтам. Аналогічно можна проводити і якісний скрінінг слідів гемоглобіну в тестах на "скриту кров", змочуючи реакційною сумішшю досліджувану пляму, голку від шприца І т.п. І спостерігаючи у випадку позитивної реакції появу блакитного забарвлення, яке з часом може переходити в оранжеве. При потребі "зафіксувати" результат тестування до реакційної суміші додають 0,8 Μ соляну кислоту у співвідношенні 7:1 для зупинки реакції та стабілізації забарвлення. Приклади на підтвердження граничних значень концентрації 3,3',5,5'-тетраметилбензидину у4 реакційній суміші при здійсненні способу у варіанті аналізу перекису водню зведені в табл. 1.Умови при Інкубації: 50 мМ ацетатний буфер, рН 5,0; 20°С; 25 нмоль Н 2О2 на пробу об'ємом 4 мл; надлишок (0,2 мг) пероксидази хрону (RZ -0,5). Умови фотометрування: рН 1,4 (після додавання соляної кислоти); спектрофотометр СФ-46,450 нм; 1 см кювети. Як видно Із табл.1, при зниженні концентрації хромогена у реакційній суміші нижче 0,05 мМ падає оптична густина фотометрованого розчину, тобто знижується чутливість аналізу. При збільшенні концентрації хромогена више 0,1 мМ оптична густина розчину залишається незмінною, Іншими словами, виграшу у чутливості не досягається, проте при цьому збільшується витрата дорогого хромогена на один аналіз, що не економічно. Отже, найбільш оптимальним для пропонованого методу є діапазон концентрацій хромогена в Інкубованій суміші в межах 0,05-0,10 мМ. Приклади на підтвердження граничних значень рН фотометрованої суміші при здісненні способу у варіанті аналізу глюкози приведені в табл.2.Умови при інкубації: 50 фосфатний буфер, рН 7,0; 0,0625 мМ хромоген ТМВ; 20 С; 50 нмоль глюкози на пробу об'ємом 4 мл; надлишок глюкозооксидази (0,5 мг) та пероксидази хрону (0.2 мг). Умови фотометрування (після доведення інкубаційної суміші до певного значення рН соляною кислотою): спектрофотометр СФ-46,6501450 нм; 1 см-кювети. Як видно Із табл.2, максимальна чутливість аналізу досягається при 450 нм та рН нижче 2. Крім того, операція підкислення реакційної суміші (після повного закінчення реакції або Інкубації певний час) до рН нижче 2,1 сприяє кларифікації (освітленню) реакційноТ суміші, що важливо у зв'язку з низькою розчинністю хромогена та мутністю у деяких випадках аналізованих препаратів, та стабілізує результати фото-метрування завдяки зупинці ферментативних реакцій. Дальше зниження рН нижче 1,4 не дає позитивного ефекту, а лише викликає необхідність використання більш концентрованих розчинів соляної кислоти. Отже, граничними (І оптимальними) значення значеннями рН фотометрованої суміші є величини в діапазоні 2,1-1,4. Порівняно з прототипом та аналогами пропонований спосіб має такі техніко-економічні переваги: , 1. Підвищується чутливість аналізу: перекису водню - у 7 разів [18], субстратів окасидаз (зокрема, глюкози) у 7 10 разів перокасидази - до 0,1 нг фермента в пробі об'ємом 4 мл; гемоглобіну - до 0,3 мкг, що відповідає приблизно 2,5 нл крові, на 4 мл проби (у 200 разів порівнянно з прототипом[11]). 2. Завдяки операції зупинки реакції підкисленням реакційної суміші до рН 1,4-2,1 збільшується точність та зручність проведення аналізу. 3. Зменшуються матеріальні затрати при проведенні аналізу у зв'язку з використанням мінімальних концентрацій хромогена (0,05-0,1 мМ замість 1,1 мМ у прототипі [11}) та зменшенням об'єму реакційної суміші (з 250 мл до 4 мл). 4. Розширюються функціональні можливості способу: крім гемоглобіну, метод дозволяє кількісно визначати перекис водню, субстрати оксидаз (наприклад, глюкозу, етанол), пероксидазу хрону, оксидази.
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for quantitative determination of hydrogen peroxide and substations of oxidases in biological objects
Автори англійськоюHonchar Mykhailo Vasyliovych, Maidan Mykola Mykolaiovych, Sybirnyi Andrii Andriiovych
Назва патенту російськоюСпособ количественного определения перекиси водорода и субстратов оксидаз в биологических объектах
Автори російськоюГончар Михаил Васильевич, Майдан Николай Николаевич, Сибирный Андрей Андреевич
МПК / Мітки
МПК: C12Q 1/26, G01N 33/84, G01N 33/52, C12Q 1/28
Мітки: водню, субстратів, біологічних, спосіб, визначення, перекису, кількісного, оксидаз, об'єктах
Код посилання
<a href="https://ua.patents.su/4-10752-sposib-kilkisnogo-viznachennya-perekisu-vodnyu-ta-substrativ-oksidaz-u-biologichnikh-obehktakh.html" target="_blank" rel="follow" title="База патентів України">Спосіб кількісного визначення перекису водню та субстратів оксидаз у біологічних об’єктах</a>
Попередній патент: Спосіб одержання композиційних сульфіднохромових покриттів
Наступний патент: Льонобральний апарат
Випадковий патент: Cпосіб діагностики затримки внутрішньоутробного розвитку