Спосіб одержання заміщених 3,4-дигідроізокумаринів
Номер патенту: 24545
Опубліковано: 10.07.2007
Автори: Обушак Микола Дмитрович, Туриця Віктор Володимирович, Матійчук Василь Степанович
Формула / Реферат
Спосіб одержання заміщених 3,4-дигідроізокумаринів, що включає діазотування похідних антранілової кислоти та подальшу взаємодію одержаних арендіазонієвих солей з ненасиченими сполуками у присутності каталізатора СuСl2, який відрізняється тим, що естери антранілової кислоти діазотують натрій нітритом у водному НВr, одержані броміди 2-алкоксикарбонілбензолдіазонію вводять у реакцію з ненасиченими сполуками у водно-ацетоновому середовищі, а як каталізатор використовують CuBr, і отримують заміщені 3,4-дигідроізокумарини загальної формули:
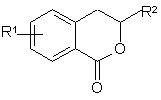 ,
,
де R1=Н, 5-СН3, 6-СООСН3, 7-СН3, 7-С1, 7-Вr;
R2=СООСН3, СОСН3, С6Н5, 4-СН3С6Н4, 4-СН3ОС6Н4, 4-СlС6Н4.
Текст
Спосіб одержання заміщених 3,4-дигідроізокумаринів, що включає діазотування похідних антранілової кислоти та подальшу взаємодію одержаних арендіазонієвих солей з ненасиченими сполуками у присутності каталізатора СuСl2, який відрізняє ться тим, що естери антранілової кислоти діазотують натрій нітритом у водному НВr, одержані броміди 2-алкоксикарбонілбензолдіазонію вводять у реакцію з ненасиченими сполуками у водно-ацетоновому середовищі, а як каталізатор використовують CuBr, і отримують заміщені 3,4дигідроізокумарини загальної формули: Корисна модель стосується органічної хімії, а саме корисних органічних сполук, таких як заміщені 3,4-дигідроізокумарини, які можуть бути використані як реагенти для органічного і комбінаторного синтезу біологічно активних сполук. 3,4-дигідроізокумарини є важливим класом природних сполук [Hill R.A. Naturally occurring isocoumarins //Forschr. Chem. Naturst. -1986. Vol.49. -P.1-78]. Вони виявляють широкий спектр біологічної дії [Hill R.A. Naturally occurring isocoumarins //Forschr. Chem. Naturst. -1986. Vol.49. -P.1-78; Barry R.D. Isocoumarins. Development since 1950 //Chem. Rev. -1964. Vol.64, №3 -P.229-260], зокрема діуретичну та антигіпертензивну [Haulihan W.J., Nadelson J. Aminoalkylisochromans and isocoumarins //Англ. патент кл. С2С (C07D7/40 A61K27/00) №1674337; цит. за РЖ Хим 1975, 21О136П Haulihan W.J., Nadelson J. Tertiary aminoethylisochromans and isocoumarins //Патент США кл.260-343.2R (C07d7/24) №3880885; цит. за РЖ Хим 1976, 7О164П], транквілізуючу [Haulihan W.J., Nadelson J. 3-(4-Halophenyl)-3-(2-pyridyl)-3,4-dihydroisocoumarins //Патент США кл.260-295.F (C07D71/34) №3824244; цит. за РЖ Хим 1975, 4О103П], антимікробну та антивірусн у [Hill R.A. Naturally occurring isocoumarins //Forschr. Chem. Naturst. -1986. Vol.49. -P.1-78; Antosz F.J., Nelson D.B. The structure and chemistry of actinobolin //J. Am. Chem. Soc. -1970. -Vol.92, №16. -P.4933-4942] активність. У зв'язку з цим інтенсивно досліджуються дигідроізокумарини природного походження та методи їх синтезу [Bovicelli P., Sanetti A., Bernini R., Lupattelli P. Oxifunctionalization of activated methylenes by dimethyldioxirane: an easy conversion of isochromans into isocoumarins //Tetrahedron -1997. Vol.53, №28. -P.9755-9760; Bovicelli P., Lupattelli P., Crescenzi В., Sanetti A., Bernini R. Oxidation of 3arylisochromans by dimethyldioxirane. An easy route to substituted 3-arylisocoumarins //Tetrahedron 1999. -Vol.55. -P.14719-14728; Yoshikawa M, Shimada H, Yagi N, Murakami N, Shimoda H. Development of bioactive functions in Hydrangeae Dulcis Folium. VI. Syntheses of thunberginols A and F and their 3'-deoxy-derivati ves using regiospecific lactonization ofstilbene carboxylic acid. Structures and inhibitory acti vity on histamine release of hydramacrophyllols A and B. //Chem. Pharm. Bull. 1996. -Vol.44, №10. -P.1890-1898]. Відомий спосіб одержання похідних 3,4дигідроізокумарину з похідних гомофталевої кислоти, її ангідридів та естерів [El-Rayyes N.R., Ali A.H.A. The Stobbe condensation with dimethyl homophthalate. Part I //J. Prakt. Chem. -1975 -Bd. 317, №6. -S.1040-1048; El-Rayyes N.R., Ali A.H.A. The Stobbe Condensation with Dimethyl R2 R1 O O , де R =Н, 5-СН3, 6-СООСН 3, 7-СН3, 7-С1, 7-Вr; R2=СООСН3, СОСН 3, С 6Н5, 4-СН3С6Н4, 4-СН3ОС6Н4, 4-СlС6Н4. (19) UA (11) 24545 (13) U 1 3 24545 Homophthalate. II. //J. Heterocycl. Chem. -1976. Vol.13, №1. -P.83-88]. Завдяки активній метиленовій групі похідні гомофталевої кислоти на першій стадії конденсують з карбонільними сполуками в присутності сильних основ (натрій гідрид, третбутилат калію). На другій стадії отримані продукти конденсації циклізують під дією ацетату натрію в оцтовій кислоті чи мінеральної кислоти до похідних 3,4-дигідроізокумарину за схемою: O O R1 COOR 2 R2 + COOR2 O NaH R1 R2 COOMe COOR3 (t-BuOK) COOMe R1 O R2 O R1 R2 R1,R2алкіл , арил, аралкіл, гетарил, цикл; = R3=Н, СН3 Недоліком способу є складність отримання вихідних реагентів (похідних гомофталевої кислоти), двостадійність і невисокий вихід кінцевих продуктів у розрахунку на комерційно доступні вихідні сполуки. Відомий спосіб одержання похідних 3,4дигідроізокумарину паладій-каталітичними реакціями орто-галогенбензойних кислот з функціоналізованими олефінами або алкінами, одно- чи двостадійним синтезом [Larock R.C., Doty M.J., Han X. Synthesis of isocoumarins and α-pyrones via palladium-catalyzed annulation of internal alkynes //J. Org. Chem. -1999. -Vol.64, №24. -P.8770-8779; Larock R.C., Harrison L.W. Mercury in organic chemistry. 26. Synthesis of heterocycles via intramolecular solvomercuration of aryl acetylenes //J. Am. Chem. Soc. -1984. -Vol.106, №15. -P.42184227; Yao Т., Larock R.C. Synthesis of isocoumarins and α-pyrones via electrophilic cyclization //J. Org. Chem. -2003. -Vol.68, №15. -P.5936-5942]. За цим способом отримують 3-заміщені ізокумарини, наприклад: O O OEt Br R Pd(PPh)3 Cl 2,Et3 N,Cul O OEt R HgII H+ O R R=Hal, Alk, Ar Недоліком цього способу є застосування дорогих каталізаторів, органічних лігандів для Pdкаталізу (трифенілфосфін, то що). До того ж, за цим способом синтезують похідні ізокумарину, з яких відповідні 3,4-дигідроізокумарини можна одержувати додатковою процедурою відновлення. Найбільш близьким до запропонованого - прототипом - є спосіб одержання 3-ціано-3,4дагідроізокумарину [Маlinowski S. О pewnych reakcjach zwiqzkow dwuazowych ze zwiqzkami nienasyconymi. I //Roczniki Chem. -1952. -T.26, №1. -S.85-97], який полягає в тому, що, спочатку антранілову кислоту діазотують і одержаний 2 4 карбоксибензолдіазоній хлорид вводять в реакцію з акрилонітрилом у присутності каталізатора СuСl2 у водно-ацетоновому середовищі. Після цього одержану 2-(2-хлоро-2-ціаноетил)бензойну кислоту нагрівають з натрієм у бензолі, у результаті чого відбувається циклізація. 3-ціано-3,4дигідроізокумарин одержують з виходом 12%, рахуючи на антранілову кислоту. Недоліком способу є двостадійність, невеликий вихід цільового продукту, застосування металічного натрію, для якого потрібні додаткові операції висушування та заходи безпеки, варіативна обмеженість замісника у положенні 3 3,4дигідроізокумарину. В основу корисної моделі поставлено задачу удосконалити спосіб одержання заміщених 3,4дигідроізокумаринів шляхом використання взаємодії діазотованих естерів антранілової кислоти з ненасиченими сполуками, що забезпечить спрощення процесу та збільшить вихід цільового продукту. Поставлена задача досягається тим, що у способі одержання заміщених 3,4-дигідроізокумаринів, який включає діазотування похідних антранілової кислоти та подальшу взаємодію одержаних арендіазонієвих солей з ненасиченими сполуками у присутності каталізатора СuСl2, естери антранілової кислоти діазотують натрій нітритом у водному НВг, одержані броміди 2алкоксикарбонілбензендіазонію вводять у реакцію з ненасиченими сполуками у водно-ацетоновому середовищі, а як каталізатор використовують CuBr, внаслідок чого отримують заміщені 3,4дигідроізокумарини загальної формули: R2 R1 O O де R1=Н, 5-СН3, 6-СООСН 3, 7-СН3, 7-Сl, 7-Вг; R2=СООСН3, СОСН3, С6Н5, 4-СН3С6Н4, 4СН3ОС6Н4, 4-СlС6Н4 Авторами використано для одержання заміщених 3,4-дигідроізокумаринів реакцію 2алкоксикарбонілдіазоній бромідів, одержаних діазотуванням естерів антранілової кислоти, з ненасиченими сполуками у водно-ацетоновому середовищі в присутності каталізатора - CuBr при кімнатній температурі. Спосіб одержання заміщених 3,4дигідроізокумаринів можна проілюструвати наведеним прикладом: де R1=Н, 5-СН3, 6-СООСН 3, 7-СН3, 7-Сl, 7-Вг; R2=СООСН3, СОСН3, С6Н5, 4-СН3С6Н4, 4СН3ОС6Н4, 4-СlС6Н4 Приклад. Змішують 60,4г (52мл) метилового естеру антранілової кислоти, 160мл води і 160мл бромоводневої кислоти (40%) і поступово прикапують розчин 33г NaNO2 у 150мл води при температурі -5-0°С. Приготований за такою процедурою діазорозчин прикапують до суміші 400мл ацетону, 36,2мл метилакрилату і 7г CuBr протягом 0,51,0год при температурі 15-30°С. Після додавання всього діазорозчину суміш перемішують ще 1-2год 5 24545 до закінчення виділення азоту. До реакційної суміші додають 600мл води. Якщо продукт реакції випадає в осад, то його відфільтровують, а якщо ні, то органічний шар відділяють, осушують, відганяють розчинник і переганяють у вакуумі. Розшифровка замісників R1 і R2 та приклади сполук, одержаних за цим способом та їхні виходи 6 після перекристалізації наведено у таблиці 1. Їхня будова підтверджується даними ЯМР 1Н спектроскопії, записаними на приладах Bruker DRX 500 (500Мгц) та Mercury 400 (400МГц) у ДМСО-d6 (табл.2). Таблиця 1 Заміщені 3,4-дигідроізокумарини 1-12 Номер сполуки R1 R2 Вихід*, % 1 2 3 4 5 6 7 8 9 10 11 12 Н Н Н 5-СН3 6-СООСН3 6-СООСН3 6-СООСН3 6-СООСН3 6-СООСН3 7-СН3 7-СІ 7-Вг СООСН3 СОСН3 С6Н5 СООСН3 СООСН3 С6Н5 4-СН3С6Н4 4-СН3ОС6Н4 4-СІС6Н4 СООСН3 СООСН3 СООСН3 56 31 34 35 35 60 48 45 50 34 36 40 Тпл, °С/ розчинник для кристалізації (Ткип.,°С/мм рт.ст.) 73-74/ЕtОН(175-180/1) 121-122/EtOH(180-185/2) 90-91/EtOH(204-205/2) 74-75/EtOH(195-198/2) 105-106/EtOH(235-240/3) 129-130/EtOH 160-161/EtOH - ДМФА 155-156/EtOH - ДМФА 170-171/EtOH - ДМФА 85-86/EtOH(192-196/2) 100-101/EtOH(184-188/1) 144-145/EtOH(195-200/2) Таблиця 2 Дані спектрів ЯМР 1Н заміщені 3,4-дигідроізокумаринів 1-12 Номер сполуки 1 1 2 3 4 5 6 7 8 Хімічні зсуви у спектрах ЯМР 1Н, d , м.ч.* 2 3,25 (дд; 1Н, HСН, Jаb 16,5Гц, Jax 5,7Гц), 3,49 (дд; 1Н, НСН, Jаb 16,5Гц, Jbx 5,7Гц), 3,69 (с; 1Н, ОСН3), 5,34 (т; 1Н, СН, J 5,1Гц), 7,46-7,35 (м; 2Н, Аr), 7,60 (т; 1H, 6-Н, J 7,5Гц), 7,96 (д; 1Н, 8-Н, J 7,8Гц). 2,29 (с, 3Н, СН3), 3,23 (дд; 1Н, НСН, Jаb 15,0Гц, Jax 6,7Гц), 3,34 (дд; 1Н, НСН, Jab 15,0Гц, Jbx 6,7Гц), 5,14 (т; 1Н, СН, J 5,0Гц), 7,35 (д; 1Н, 5-Н, J 7,7Гц), 7,40 (т; 1Н, 7-Н, J 7,7Гц) 7,55 (т; 1Н, 6-Н, J 7,7Гц), 7,95 (д; 1Н, 8-Н, J 8,1Гц) 3,21 (дд; 1Н, НСН, Jab 16,5Гц, Jax 3,6Гц), 3,24 (дд; 1Н, НСН, Jab 16,5Гц, Jbx5,lГц), 5,65 (дд; 1Н, СН, J1 11,9Гц, J2 4,5Гц), 7,64-7,35 (м; 8Н, Аr), 7,96 (д; 1Н, 8-Н, J 8,3Гц) 2,29 (с; 3Н, СН3), 3,19 (дд; 1Н, НСН, Jab 17,1Гц, Jax 5,7Гц), 3,36 (дд; 1Н, НСН, Jab 17,1Гц, Jbx 5,4Гц), 2,94 (с; ЗН, ОСН3), 5,47 (т; 1Н, СН, J 5,7Гц), 7,34 (т; 1Н, 7-Н, J 7,5Гц), 7,51 (д; 1Н, 6-Н, J 7,5Гц), 7,79 (д; 1Н, 8-Н, J 7,8Гц) 1,13 (т; 3Н, ОСН2СН3, J 7,2Гц), 3,32 (дд; 1Н, НСН, Jab 16,8Гц, Jax 3,3Гц), 3,57 (дд; 1Н, НСН, Jab 16,8Гц, Jbx 4,2Гц), 3,90 (с; 3Н, ОСН3), 4,09 (кв; 2Н, ОСН2СН3), 5,41 (т; 1Н, СН, J 5,6Гц), 7,97 (д; 2Н, Аr, J 7,2Гц), 8,03 (д; 1Н, 8-Н, J 8,0Гц) 3,34 (дд; 1Н, НСН, Jab 16,4Гц), 3,40 (дд; 1Н, НСН, Jab 16,4Гц), 3,91 (с; 3Н, ОСН3), 5,68 (дд; 1Н, СН, J 1 10,0Гц, J2 4,0Гц), 7,35-7,45 (м; 4Н, Аr), 7,51 (д; 2Н, Аr, J 7,2Гц), 7,99 (с; 1Н, 5-Н), 8,08 (д; 1Н, 8-Н, J 8,4Гц) 2,37 (с; 3Н, СН3), 3,30 (дд 1Н, НСН, Jab 16,6Гц, Jax 3,9Гц), 3,37 (дд; 1Н, НСН, Jab 15,6Гц, Jbx10,7Гц), 3,91 (с; 3Н, ОСН3), 5,63 (дд; 1Н, СН, J1 11,7Гц, J2 3,9Гц), 7,21 (д; 2Н, Аr, J 7,8Гц), 7,37 (д; 2Н, Аr, J 7,8Гц), 7,99 (д; 2Н, Аr, J 6,8Гц), 8,08 (д; 1Н, Аr, J 8,8Гц) 3,27 (дд; 1Н, НСН, Jab 16,6Гц, Jax 3,9Гц, 3,40 (дд; 1Н, НСН, Jab 15,6Гц, Jbx10,7Гц), 3,80 (с; 3Н, ОСН3), 3,92 (с; 3Н, ОСН3), 5,60 (дд; 1Н, СН, J1 11,7Гц, J2 3,9Гц), 6,94 (д; 2Н, Аr, J 7,8Гц), 7,42 (д; 2Н, Аr, J 7,8Гц), 7,99 (д; 2Н, Аr, J 6,8Гц), 8,18 (д; 1Н, Аr, J 8,8Гц) 7 24545 8 Продовження таблиці 2 1 10 11 2 2,32 (с; 3Н, СН3), 3,18 (дд; 1Н, НСН, Jab 16,8Гц, Jax4,7Гц), 3,74 (дд; 1Н, НСН, Jab 16,8Гц, Jbx 5,6Гц), 3,61 (с; 3Н, ОСН3), 5,44 (т; 1Н, СН, J 4,4Гц), 7,28 (д; 1Н, 5-Н, J 7,6Гц), 7,42 (д; 1Н, 6-Н, J 7,8Гц), 7,72 (с; 1Н, 8-Н) 3,26 (дд; 1Н, СН2, Jab 17,0Гц, Jax4,9Гц), 3,51 (дд; 1Н, СН2, Jab 16,9Гц, Jbx 5,7Гц), 3,67 (с; 3Н, ОСН3), 5,53 (т; 1Н, СН, J 5,2Гц), 7,44 (д; 1Н, 5-Н, J 8,2Гц), 7,86 (д; 1Н, 6-Н, J 8,3Гц), 8,20 (с; 1Н, 8-Н) Мас-спектри деяких синтезованих сполук одержано на хромато-мас-спектрометрі Finnigan MAT INKOS-50 при 70 еВ 1: 206 ([М+], 5), 147 (100), 119 (93,5), 91 (61); 2: 190 ([М+], 10), 156 (100), 128 (24), 91 (25), 50 (31); 10: 220 ([М+], 9,7), 175 (12,1), 162 (11,4), 161 (100), 133 (62,1), 105 (30,4), 77 (16,3), 51 (5,4); 12: 284 ([М+], 11,7), 239 (10,0), 227 (100), 225 Комп’ютерна в ерстка Л.Литв иненко (88,6), 197 (50,05), 171 (23,2), 169 (33,2), 118 (13,9), 89 (49,0), 75 (6,0), 63 (22,3), 50 (6,9), 44 (9,4). Запропонований спосіб дозволяє за одну стадію одержувати заміщені 3,4-дигідроізокумарини, використовуючи комерційно доступні вихідні речовини, що вигідно відрізняє його від відомих способів, що підтверджує передбачуваний технічний результат. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for obtaining substituted 3,4-dihydroisocumarines
Автори англійськоюMatiichuk Vasyl Stepanovych, Obushak Mykola Dmytrovych
Назва патенту російськоюСпособ получения замещенных 3,4-дигидроизокумаринов
Автори російськоюМатийчук Василий Степанович, Обушак Николай Дмитриевич
МПК / Мітки
МПК: C07D 311/76
Мітки: спосіб, одержання, заміщених, 3,4-дигідроізокумаринів
Код посилання
<a href="https://ua.patents.su/4-24545-sposib-oderzhannya-zamishhenikh-34-digidroizokumariniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання заміщених 3,4-дигідроізокумаринів</a>
Попередній патент: Динатрієва сіль акридин-9-ілгідразону a-кетоглутарової кислоти, що проявляє антирадикальну та антиоксидантну активність
Наступний патент: Резервуар для текучого середовища під тиском, зокрема для стиснутого газу, використовуваного в автомобілі
Випадковий патент: Пристрій для забезпечення тварин кормом та водою








