Спосіб моделювання остеоартрозу
Номер патенту: 24689
Опубліковано: 04.08.1998
Автори: Бондаренко Надія Миколаївна, Баринов Едуард Федорович, Ігнатенко Григорій Анатольович
Формула / Реферат
Спосіб моделювання остеоартрозу шляхом пошкодження суглобового хряща, який відрізняється тим, що пошкодження здійснюють порушенням адаптаційних процесів в тканинах суглоба, для чого впливають УВЧ на скронево-тім'яну область по 12 - 15хв щодобово 10 - 15 діб, після чого підвищують одночасно фізичне навантаження на локомоторний апарат, наприклад, біг у тредбані, і температуру навколишнього середовища, наприклад, до +38 - 39°C протягом 2 - 3 годин.
Текст
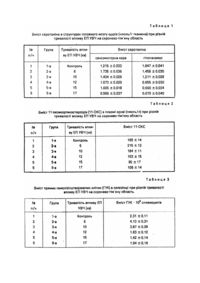
Заявлений спосіб моделювання остеоартрозу (ОА) відноситься до галузі експериментальної медицини та біології, а також, ревматології, травматології і ортопедії, і може бути використованим для моделювання захворювань, які супроводжуються дистрофічними і деструктивними порушеннями в тканинах суглоба, зокрема, ОА у шахтарів. Відомий спосіб моделювання дистрофічного процесу в хрящі суглоба (Дедух Н.В. и соавт. Остеоартрозы. Пути фармакологической коррекции. - Харьков, 1992. - С.126) шляхом руйнування суглобового хряща, для чого в порожнину суглоба вводять різні хімічні речовини. Спосіб виконують, наприклад, однократним введенням Кортизона в дозі 0,1мг/кг в порожнину суглоба нестатевозрілих кроликів. При цьому виникає порушення організації матрикса і розволокнення суглобового хряща, а також необоротні зміни в епіфізарній зоні росту кістки. Такі ж зміни в суглобах контралатеральної кінцівки вказують на присутність системної дії. Недоліком відомого способа є те, що Кортизон надходить до судинного русла і чинить системну дію, зокрема, на клітини хряща суглоба другої кінцівки. Проте, при цьому пошкоджуються і інші клітини, які мають рецептори до стероїдних гормонів (наприклад, лімфоцити, гепатоцити, аденоцити гіпофіза та ін.), в результаті чого можливо зниження функціональної повноцінності різних органів і систем і, як наслідок, доводиться зустрічатися з непередвіщеними ускладненнями, які розвиваються при моделюванні остеоартрозу. Так, за нашими даними, в 30 - 37% випадків виникає лімфопенія, змінюється рівень гормонів у циркулюючій крові та ін. Найбільш близьким за технічною суттю до способу, який заявляється, є спосіб моделювання деструктивно-дистрофічного процесу в суглобі (А.с. СССР №951368, кл. G09B23/28, Бюл. №30, 1982) шляхом пошкодження суглобового хряща однократним прямим впливом струменя парорідинного азоту під тиском 0,2 - 0,6атм протягом 4 - 8с. Реалізують спосіб-прототип таким чином. Під наркозом у тварини пошарово розтинають кульшовий суглоб; розрізають капсулу суглоба і оголяють передню поверхню головки стегна, при цьому анатомічне співвідношення в суглобі та форма суглобової поверхні не порушується; подають парорідинний струмень азоту на суглобовий хрящ апаратом "Х-34" з відстані 2см під тиском 0,4атм, час експозиції - 8с, при цьому кріовплив розповсюджується на всю глибину суглобового хряща з захопленням замикальної пластинки. При мікроскопічному дослідженні на 28 - у добу і через 2 місяці після моделювання патологічного процесу морфологічні зміни в суглобі відповідали тим, що спостерігаються при деформуючому артрозі. Недоліком відомого способу є те, що відома модель ОА у тварини патогенетично не відповідає аналогічному захворюванню, яке розгортається у людини в процесі інтенсивної професійної діяльності, наприклад, у шахтарів, оскільки відтворюється тільки місцевий патологічний процес - пошкодження клітин хряща, тоді як у людини розвиток ОА є наслідком зниження адаптаційних процесів в тканинах суглоба, які виникають при первинному порушенні регулюючих систем (насамперед ЦНС, а також імунної та ендокринної). Описане моделювання в експерименті ОА, за суттю, є відтворенням наслідків захворювання, яке розвивається у людини, і не дозволяє коректно переносити отримані результати в клініку для розробки відповідних методів діагностики, профілактики чи лікування. Описаний підхід базується на припущенні про первинну зміну співвідношення рівня медіаторів (зниження вмісту серотоніну) в нейронах різних структур мозку, як пускового механізму виникнення ОА у людини, наслідком чого є активація гуморального імунітету, оскільки зменшується рівень Т-супресорів, падає рівень стероїдних гормонів, насамперед глюкокортикоідів, і понижується нейротрофічний вплив на тканини суглоба. Наслідком цих змін (вторинний процес) є порушення адаптаційних процесів в суглобовому хрящі при підвищенні функціонального навантаження на суглоб і розвиток дистрофічних і деструктивних змін в тканинах суглоба. Спроба моделювання патологічного процесу тільки в хрящі суглоба не буде супроводжуватися змінами в системах регуляції гомеостазу, які відповідні таким у людини при виникненні ОА. Таким чином, спосібпрототип не відтворює картину патогенезу захворювання, аналогічну тій, що є у людини, хворої на ОА, а дозволяє проаналізувати механізми відновлення хряща (репаративної регенерації) у інтактних тварин. В основу винаходу поставлена задача відтворити на тваринах патогенез остеоартрозу, в т.ч. професійного (який розвивається у шахтарів), шляхом впливу УВЧ на скронево-тім'яну область по 12 - 15хв щодобово 10 - 15 діб, після чого підвищують одночасно фізичне навантаження на локомоторний апарат, наприклад, біг у тредбані, та температуру навколишнього середовища, наприклад, до +38 - 39°C протягом 2 - 3 годин, що приводить до зниження вмісту серотоніна в нейронах гіпоталамо-гіпофізарної системи і, як наслідок, запускаються механізми патогенезу ОА. Суть винаходу заключається в тому, що пошкодження суглоба здійснюють впливом УВЧ на скронево-тім'яну область по 12 - 15хв щодобово 10 - 15 діб, після чого підвищують фізичне навантаження на локомоторний апарат, наприклад, біг у тредбані, і одночасно температуру навколишнього середовища, наприклад, до +38 39°C протягом 2 - 3 годин. Новим в способі, що заявляється, є те, що порушення репаративних процесів у суглобовому хрящі здійснюють впливом УВЧ на скронево-тім'яну область на 12 - 15хв щодобово 10 - 15 діб, після чого підвищують одночасно фізичне навантаження на локомоторний апарат, наприклад, біг у тредбані, і температуру навколишнього середовища, наприклад, до +38 - 39°C протягом 2 - 3 годин. Зниження вмісту серотоніну в нейронах гіпоталамо-гіпофізарної системи дозволить відтворити один із клінічних варіантів патогенезу ОА, який найбільш часто зустрічається і розвивається, наприклад, у шахтарів, при якому можливий наступний ланцюг причинно-наслідкових зв'язків: зміни метаболізму біогенних амінів в нейронах різних структур мозку - зниження вмісту серотоніна в нейронах гіпоталамуса - активація гуморального імунітету і зменшення рівня гормонів (в т.ч. глюкокортикоїдів) в циркулюючій крові порушення адаптаційних процесів в тканинах суглоба - розвиток дистрофічних і деструктивних змін в суглобовому хрящі. Отже, спосіб, що пропонується, відкриває можливість відтворити картину виникнення і розвитку ОА у хворої людини. Крім того, виникнення остеоартрозу буде відображувати міцність компенсаторнопристосовних, метаболічних процесів гіпоталамогіпофізарно-наднирникової системи, яка є основою прогресування патологічного процесу і формування механізмів одужування (саногенеза). Внаслідок активації компенсаторно-пристосованих механізмів в структурах головного мозку вдається стандартизувати умови проведення функціонального навантаження на локомоторний апарат в умовах загальної гіпертермії організму, а значить - добитися зіставлення результатів дослідження у різних тварин, скоротити час дослідження і зменшити матеріальні витрати на проведення експериментів. Розробка способу, який заявляється, стала можливою завдяки вперше встановленому авторами наступному науковому факту. Було показано, що при місцевому пошкодженні суглобового хряща у інтактних тварин (за способом-прототипом) морфологічна картина компенсаторно-пристосованих механізмів, які розвиваються в синовіальній оболонці, хрящі та субхондральній кістці, всього на 10 - 15% відповідає певній за клінічним перебігом ОА у шахтарів. Така ситуація приводила до безперспективної розробки методів діагностики, профілактики і лікування патології, що вивчається. Це спонукало провести клініко-експериментальні зіставлення (з використанням біохімічних, морфологічних і імунологічних досліджень), на підставі яких потрібно було встановити основні механізми патогенезу ОА у шахтарів. В результаті такого аналізу встановлено, що розвиток ОА у шахтарів супроводжується зниженням активності Т-супресорів, що приводить до активації Тхелперів, зростанням синтезу антитіл, посиленню цитолітичних і цитотоксичних реакцій, утворенню імунних комплексів. При цьому на 20 - 30% в крові знижується концентрація кортизолу і трийодтироніну. З літератури [3] відомо, по-перше, що однією з причин зменшення кількості Т-супресорів може бути зниження рівня серотоніна в нейронах мозку. Причому, стресс-реакція, а такою є робота шахтарів в підземних умовах, може супроводжуватися зміною обміну біогенних амінів в різних органах і тканинах, в т.ч. в мозку [4]. Це дозволило припустити існування взаємозв'язку між стрес-реакцією організму, з однієї сторони, і зменшення кількості Т-супресорів, з другої. Подруге, зниження вмісту серотоніна в нейронах ядер гіпоталамуса може супроводжуватися гальмуванням гіпоталамо-гіпофізарно-надниркової системи, що проявляється спадом концентрації в крові стероїдних гормонів, насамперед, глюкокортикоідів, наслідком чого є порушення адаптаційних процесів в тканинах суглоба. Потретє, зменшення кількості Т-супресорів і рівня глюкокортикоідів в крові створюютьумови для активації реакції гуморального імунітету і формування запальнево-дегенеративних змін в суглобовому хрящі при інтенсивному фізичному навантаженні на локомоторний апарат. З метою перевірки цієї гіпотези, експериментальні тварини (12 щурів) підлягали протягом 10 - 15 діб впливу електричним полем УВЧ на скронево-тім'яну область (частота 40,68МГц, міцність потоку 30Вт), тривалість одного сеансу 12 - 15хв). При цьому в 75% випадків в нейронах гіпоталамуса і гіпокампа зменшувався вміст серотоніну і, як наслідок, знижувалась кількість Т-супресорів і рівень глюкокортикоідів в крові, тобто дійсно змінювалась імунореактивність організму. У 88,7% цих тварин інтенсивне фізичне навантаження на локомоторний апарат в умовах загального перегрівання організму приводило через 10 - 15 діб до розвитку в суглобовому хрящі кінцівок дистрофічних і деструктивних змін, схожих на ті, що є у шахтарів при ОА. Якщо у тварин модель ОА відтворювалась не в повному об'ємі (не виникали деструктивні зміни в суглобовому хрящі), чи не відтворювалась зовсім, то в нейронах гіпоталамуса і гиппокампа внутрішньоклітинний рівень серотоніна статистичне значуще не змінювався. Отже, високий рівень серотоніна в нейронах мозку є основною причиною низького відтворення ОА у цих тварин. В контрольній групі аналогічне фізичне навантаження в умовах загального перегрівання організму без дії електричного поля УВЧ пише в 45% випадків супроводжується виникненням ОА через 1,5 - 2 місяці, отже, вибраний режим впливу електричним полем УВЧ на скронево-тім'яну область знижує вміст серотоніна в нейронах гіпоталамо-гіпофізарної системи. Як наслідок, зменшується рівень рилізінг-гормонів, а значить і стероїдних гормонів у циркулюючій крові, що знижує міцність адаптаційних механізмів в тканинах суглоба. При цьому активізуються реакції гуморального імунітету, що викликають дистрофічні та деструктивні зміни в тканинах суглоба. Таким чином, сукупність істотних ознак формули дає можливість знизити вміст серотоніну в нейронах гіпоталамогіпофізарної системи, що приводить до відтворення механізмів патогенезу ОА як системного захворювання. Досягнення технічного результату способу, що пропонується, базується на тому, що пошкодження здійснюють впливом УВЧ на скронево-тім'яну область по 12 - 15хв щодобово 10 - 15 діб, після чого підвищують фізичне навантаження на локомоторний апарат, наприклад, біг у тредбані, і одночасно температуру навколишнього середовища, наприклад, до +38 - 39°C протягом 2 3 годин. Наші дослідження показали, що у 88,7% тварин через 10 - 15 діб розвивались дистрофічні та деструктивні зміни в суглобовому хрящі кінцівок. Реалізують спосіб наступним чином. Беруть із віварія тварин, які тримають в однакових умовах, однакових за статтю і віком і адаптують їх до середовища лабораторії. В день дослідження на тварину впливають електричним полем УВЧ на скронево-тім'яну область (апарат УВЧ-66, частота 40,68 ± 2МГц, міцність 30Вт за допомогою конденсаторних пластин діаметром 0,02м на скронево-тім'яну область із зазором 0,02м щодобово протягом 10 - 15 діб по 12 - 15 хвилин). Потім інтенсифікують фізичне навантаження на локомоторний апарат тварини бігом протягом 120 180 хвилин на тредбані при температурі навколишнього середовища +38 - 39°C. Наводимо конкретні приклади реалізації способу моделювання остеоартрозу, що заявляється. Приклад 1. Пошук оптимальної тривалості впливу електричним полем УВЧ на скроневотім'яну область проведено на 6 групах рівноцінних тварин (за вагою, статтю, умовами тримання). 1 - а група є контрольною (тварин утримували на станку, розміщували електроди, але вплив ЕП УВЧ не проводили). У тварин 2 - 6 - ї груп вплив ЕП УВЧ (частота 40,68 ± 2МГц) здійснювали від апарату УВЧ-66 міцністю 30Вт за допомогою конденсаторних пластин діаметром 0,02м на скронево-тім'яну область із зазором 0,02м, щодобово протягом 12 діб і відповідно тривалістю 6, 10, 12, 15 і 17 хвилин. Після останнього сеансу УВЧ-терапії тварин виводили з експерименту (шляхом введення тиопенталу натрію), виділяли сенсомоторну кору, гіпоталамус і заморожували в рідкому азоті. Тканини мозку, що виділили, зважували і гомогенізували при охолодженні в скляних гомогенізаторах протягом 2хв в 0,3 - 0,5мл (для зразків масою менше 10мг) і в 0,5 - 0,7мл (для зразків масою 10 - 40мг) 0,02N CH3COOH в CH3OH. Гомогенати центрифугували при 4°C, 12000g протягом 20хв. Супернатанти переносили в пробірки з оргскла (висотою 0,5 - 1см) і витримували в потоці теплого повітря протягом декількох хвилин для випаровування рідини, потім до вмісту пробірок добавляли 50 - 100мкл 0,1N HCl, отримували концентрований розчин, який містив біогенні аміни та їх метаболіти. Катехоламіни визначали методом високоефективної рідинної хроматографії (ВРХ) з електрохімічною детекцією ("LKB", Швеція). Умови хроматографії були наступні: колонка із нержавіючої сталі розміром 250 ´ 4 мм, яка упакована сорбентом для обернуто-фазової хроматографії Lichrosorb RP-18 с розміром часточок 5мкм ("LKB"), рухлива фаза, що виготовлена на бідистильованій воді, містила 0,1М NaH2PO4, 1мМ ЭДТА, 10мМ NaCl, 5мг/л натрія октилсульфоната (SOS) і 10% (по об'єму) метилового спирту pH 4,0. Швидкість елюції складала 1мл/хв. Потенціал скловуглеродного електроду встановлювали рівним +0,65В. Розчин, що містив катехоламіни, проводили через інжектор ("Rheodyne", Inc., США) з петлею об'ємом 20мкл в колонку для ВРХ. В циркулюючій крові визначали рівень глюкокортикоїдів, вимірюючи в плазмі крові флюориметричним методом концентрацію сумарних 11-оксикортикостероідів (11-ОКС). В селезінці досліджували кількість гемолізінутворюючих клітин (ГУК) методом локального гемолізу в гелі. Про інтенсивність проліферативних процесів в лімфоідній тканині судили по загальній кількості ядерних клітин селезінки. Статистичну обробку результатів проводили за t-критерієм Ст'юдента. Отримані дані наведені в табл.1, 2, 3. Таким чином, тільки в інтервалі 12 - 15 хвилин впливу ЕП УВЧ на скронево-тім'яну область відбувається статистично значуще зниження вмісту серотоніну в структурах головного мозку. Приклад 2. Моделювали остеоартроз у щура з шифром НБ004, масою 185г шляхом впливу ЕП УВЧ (частота 40,68 ± 2МГц) від апарату УВЧ-66 міцністю 30Вт за допомогою конденсаторних пластин діаметром 0,02м на скронево-тім'яну область із зазором 0,02м, щодобово протягом 10 діб і тривалістю 12 - 15 хвилин. Щодобово після сеансу впливу ЕП УВЧ підвищували фізичне навантаження на локомоторний апарат бігом в тредбані протягом 2 - х годин при температурі навколишнього середовища +38 - 39°C. На 11 - у добу тварин виводили із експерименту, в структурах головного мозку досліджували вміст серотоніну, в циркулюючій крові - рівень глюкокортикоідів (11-ОКС), в селезінці - кількість гемолізіноутворюючих клітин (ГУК). Встановлено, що вміст серотоніну в гіпоталамусі досягав 6,3нмоль/г тканини, вміст 11-ОКС складав 98пмоль/л і кількість ГУК в селезінці - 1,47 ´ 106 клітин. Суглобовий хрящ кінцівок досліджували за допомогою світлооптичних, гістохімічних і електронно-мікроскопічних методів вивчення цитоархітектоніки структурних елементів суглобових тканин, ензиматичного профіля, а також морфометричних показників стану біосинтетичної функції та енергоутворення в клітинах суглобових тканин. Ознаки локальної деструкції суглобових тканин, що відображують порушення адаптаційних механізмів, проявлялись зменшенням товщини середньої зони хряща і фрагментацією його базофільної смужки, потоншенням трабекул субхондральної кістки. В середній зоні суглобового хряща спостерігали зниження на 42,7 ± 2,1% (p < 0,01) оптичної щільності вмісту глікозаміногліканів (ГАГ), зменшення в 2 рази удільного об'єму цистерн гладенької та гранулярної ендоплазматичної сітки, різке (в 3,8 рази) зниження значень коефіцієнта енергетичної ефективності мітохондрій хондроцитів. В глубокій зоні хряща зменшилась на 37,6 ± 1,2% (p < 0,01) удільна вага гіпертрофічних клітин, пікнотично змінені хондроцити склали 22,0 ± 1,0%. Лабораторні випробування способу, що заявляється, проведені на 42 щурах. Приведені дані свідчать про виникнення остеоартрозу в суглобах кінцівок і підтверджують вірогідність і швидкість моделювання остеоартрозу. Таким чином, заявлений спосіб дозволяє відтворювати остеоартроз, за рахунок чого відкривається можливість розробки патогенетично обгрунтованої терапії у шахтарів, скорочується час моделювання патологічного процесу і зменшуються матеріальні витрати на проведення експериментів. Перевага способу, який заявляється, полягає в тому, що він є універсальним, технічно простим, економічним, інформативним, скорочує час і матеріальні витрати на проведення експериментів, підвищує вірогідність результатів дослідження і забезпечує високе відтворення остеозртрозу 88,7%. Перераховані переваги визначають перспективність застосування методу в експериментальній біології та медицині для моделювання остеоартрозу, підвищення ефективності відтворення цієї патології та вибраковки тварин. Крім того, спосіб може бути покладений в основу розробки патогенетичне обгрунтованої терапії професійного остеоартрозу у шахтарів, а також змін метаболізму біогенних амінів в нейронах мозку, перевірки імуномодулюючого ефекту різних впливів на організм.
ДивитисяДодаткова інформація
Автори англійськоюBarinov Eduard Fedorovych
Автори російськоюБаринов Эдуард Федорович
МПК / Мітки
МПК: G09B 23/28
Мітки: спосіб, остеоартрозу, моделювання
Код посилання
<a href="https://ua.patents.su/4-24689-sposib-modelyuvannya-osteoartrozu.html" target="_blank" rel="follow" title="База патентів України">Спосіб моделювання остеоартрозу</a>
Попередній патент: Спосіб виготовлення суцільнолитої культевої штифтової вкладки
Наступний патент: Доплеровський пеленгатор
Випадковий патент: Спосіб отримання ондасетрону та його фармацевтично прийнятних солей