Спосіб одержання суміші ізомерів циперметрину або цифлутрину
Формула / Реферат
1. Способ получения смеси изомеров циперметрина или цифлутрина с повышенным содержанием энантиомерных пар IR, цис S, IS, цис R и IR, транс S, IS, транс R, по отношению к энантиомерным парам IS, цис S, IR, цис R и IS, транс R, взаимодействием соответствующего a-оксифенилфеноксиацетонитрила или его 4-фтораналога с 3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбонилхлоридом в среде углеводородного растворителя при атмосферном давлении с использованием основания, отличающийся тем, что процесс ведут в инертной среде при добавлении со скоростью, поддерживающей температуру процесса, соответствующего ацетонитрила к кипящей жидкости, представляющей собой раствор 3-(2,3-дихлорэтенил)-2,3-диметилциклопропанхлорида или его 4-фтораналога в углеводородном растворителе с температурой кипения 75 - 115°C с последующей промывкой реакционной массы основанием в виде водного раствора, используемого только на этой стадии.
2. Способ по п.1, отличающийся тем, что a-окси-3-феноксифенилацетонитрил имеет R,S-конфигурацию, а хлорангидрид кислоты имеет R,S-цис/трансконфигурацию.
3. Способ по п.1, отличающийся тем, что a-окси-3-феноксифенилацетонитрил имеет S-конфигурацию, а хлорангидрид кислоты имеет R,S-цис/трансконфигурацию.
Текст
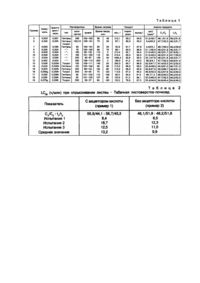
Изобретение касается получения (R,S) (циано)(3-феноксифенил) метила или (R,S)-(циано)-(4-фтор-3феноксифенил)метил-цис/транс-3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбоксилата, обогащенного цис(C2)транс(t2)-изомерами с более высокими инсектицидными свойствами путем ввода (R,S)-a-окси-3феноксифенилацетонитрила или (Р,S)-a-окси-4-фтор-3-феноксифенилацетонитрила в цис/транс-хлорангидрид в кипящем гептане в инертной среде. Затем эта реакционная смесь промывается водным основанием и извлекается сложным эфиром. Настоящее изобретение заключается в усовершенствовании химического способа. В частности, оно касается усовершенствованного способа этерефикации, обеспечивающего получение энантиомерно обогащенного (R,S)(циано)(3-феноксифенил)метил-цис/транс-3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбоксилата (циперметрина) или (R,S)-(циано)(4-фтор-3-феноксифенил)метил-цис/транс-3-(2,2-дихлорэтенил)-2,2диметилциклопропанкарбоксилата (цифлутрина). Оно касается также получения обогащенных аналогичным образом смесей диастереоизомеров. Для данного усовершенствования способа требуется этерефикация замещенного циклопропанкарбонилхлорида подходящим цианогидрином без использования акцептора кислоты. Получаемый сложный эфир обогащается более инсектицидно активными энантиомерами или диастереоизомерами по сравнению с продуктом, получаемым той же самой реакцией в присутствии акцептора кислоты. Как циперметрин (патент США №4024163), так и цифлутрин (патент США №4218469) являются хорошо известными пиретроидными инсектицидами и составляют объект торговли во многих странах. Каждый из них может заключать в себе восемь изомеров. Для рацемического циперметрина эти восемь изомеров, обозначенные l-Vlll, представляют собой следующие продукты; Цис-изомеры (c) l. (S)-(циано)(3-феноксифенил)метил-1R, цис-3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбоксилат (сокращенное название 1R, цис S). ll. (R)-(циано)(3-феноксифенил)метил-1S, цис-3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбоксилат (сокращенное название 1S, цис R). lll. (S)-(циано)(3-феноксифенил)метил-1S, цис-3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбоксилат (сокращенное название 1S, цис S). lV. (R)-(циано)(3-феноксифенил)метил-1R, цис-3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбоксилат (сокращенное название 1R, цис R) Транс-изомеры (t) V. (1R, транс S), транс-изомер соединения l. Vl. (1S, транс R), транс-изомер соединения ll. Vll. (1S, транс S) транс-изомер соединения lll. Vlll. (1R, транс R), транс-изомер соединения lV. Обозначения 1R, цис: 1R, транс; 1S, цис; и 1S, транс относятся к пространственному расположению атомов водорода в положениях 1 и 3 циклопропанового кольца; одиночные буквенные обозначения R и S относятся к пространственной конфигурации цианогруппы у альфа-углеродного атома спиртовой части данной молекулы. Те же самые обозначения относятся к соответствующим изомерам цифлутрина. Хорошо известно, что большинство инсектицидно активных изомеров представляют собой соединения l и V. Хорошо известно также, что энантиомерные пары l/ll, относящиеся к C2 энантиомерной паре, и V/Vl, относящиеся к t2-энантиомерной паре, более инсектицидно активные, чем энантиомерные пары lll/lV, относящиеся к C1энантиомерной паре, и Vll/Vlll, относящиеся к t1-энантиомерной паре. Чрезвычайно трудно и практически невозможно выделить более активные изомеры из комплексной смеси изомеров, получаемых путем обычного синтеза пиретроидов. Ввиду этого большая работа была проведена для выявления способов увеличения содержания активных изомеров в продуктах, состоящих из смесей изомеров, например, путем превращения менее активных изомеров в таких смесях в более активные изомеры. Такие способы описываются в патентах США №№4427598 и 4782174, наряду с другими публикациями. Хотя повышенные расходы, связанные с разработкой таких способов обогащения изомерами, могут быть оправданы для некоторых областей их использования в качестве пестицидов, процесс этерефикации, обеспечивающий возможность непосредственного получения смеси, обогащенной более активными изомерами, является очень желательным как для увеличенной инсектицидной активности продукта этерефикации как такового, так и для увеличения количества исходного сырья для конверсии. Согласно настоящему изобретению реакция a-оксифеноксифенилацетонитрила с раствором соответствующего циклопропанкарбонилхлорида при отсутствии акцептора кислоты обеспечивает получение продукта, обогащенного более активными изомерами по сравнению с продуктом, полученным в случае присутствия акцептора. Обычный способ, заключающийся в реакции хлорангидрида со спиртом, требует присутствия стехиометрического количества акцептора кислоты, обычно пиридина или какого-либо другого третичного амина, для осуществления реакции с хлористым водородом, выделившемся в ходе реакции. Сравнительно в японском патенте (Koxal 60 - 202843 (Sumitomo Chemical Industries KK) был описан способ получения сложных эфиров, включая пиретроидные сложные эфиры, из хлорангидридов и спиртов без применения акцептора кислоты. Этот способ осуществляется либо путем протекания реакции при пониженном давлении для удаления газообразного галоидангидрида, либо путем барботирования реакционной смеси вместе с инертным газом, азотом или гелием и удаления галоидангидрида путем улавливания его в газовом потоке. Согласно примеру 9 патента осуществляется получение (S)-a-циано-3-феноксибензил (1R, цис)-2,2-диметил3-(2,2-дибромвинил)-циклопропан-1-карбоксилата из (S)-a-окси-3-феноксифенилацетонитрила. Хотя в данной публикации описывается процесс этерефикации при отсутствии акцептора кислоты, в нем не описывается и не может быть описано положительное действие циперметриновых или цифлутриновых смесей на соотношения C1/C2 или t1/t2, поскольку получается лишь один изомер. Кроме того, в то время как согласно способу по патенту Kokal предпочтителен либо вакуум 500мм рт. ст. или менее, либо поток инертного газа, по объему более чем в 5 раз превышающий объем хлористого водорода, выделяющегося в ходе реакции, согласно данному способу требуется лишь, чтобы он осуществлялся в присутствии инертного газа. Наиболее, практическим подходом к решению данной проблемы является создание слабого потока инертного газа с направлением хлористого водорода в скруббер (с целью удаления загрязнений, которые могут быть вызваны выбросом хлористого водорода в атмосферу), но, как будет показано выше, положительное влияние на соотношение мономеров имеет место даже в том случае, если реакция протекает в реакционном сосуде, промытом струей инертного газа. При осуществлении способа данного изобретения равномолярные количества a-окси-3феноксифенилацетонитрила (или его 4-фтороаналога) и цис/транс-3-(2,2-дихлорэтенил)-2,2диметилциклопропанкарбонилхлорида реагируют друг с другом в углеводородном растворителе при температуре флегмообразования при отсутствии рецептора кислоты. При получении циперметрина в ходе данного процесса обычно получается продукт, в котором соотношения C1/C2 и t1/t2 изомеров составляет 48/52. В результате почти идентичного процесса с использованием тех же химических реагентов в присутствии акцептора кислоты, например пиридина, получается циперметрин, обычно имеющий соотношение C1/C2 и t1/t2, равное 55/45. Так, количества C2 и t2 энантиомерных пар увеличиваются по отношению к парам C1, и t1, что дает в результате циперметрин соответственно с повышенной инсектицидной активностью. Следует также отметить, что реакции как с акцептором кислоты, так и без него осуществляются при различных температурах. Причина этого заключается в том, что в случае присутствия пиридина реакция должна осуществляться при более низких температурах, поскольку при высоких температурах пиридин взаимодействует с цианогидрином, снижая при этом выход продукта реакции. В случае отсутствия пиридина реакция должна осуществляться при более высоких температурах, предпочтительно при температуре флегмообразования с предпочтительным использованием в качестве растворителя гептана, с удалением получаемого хлористого водорода. Таким образом, сопоставление процессов при одинаковой температуре не имеет значения. Единственным параметром процесса, являющимся критически важным, является температура реакции, которая должна быть несколько выше для удаления образующегося хлористого водорода, но не должна быть настолько высокой, чтобы происходило разложение реагентов или продукта. Температура процесса предпочтительно регулируется путем выбора растворителя, кипящего в интервале температур примерно от 75 до 115°C. Тип углеводородного растворителя не имеет существенного значения, он может быть как ароматическим, так и алифатическим. Продолжительность реакции не является критическим фактором, она находится в пределах значений, которые может легко выбрать сам специалист. Скорость ввода цианогидрина в кипящий раствор хлорангидрида кислоты должна быть такой, чтобы реакция на выходила за пределы контроля. После прекращения реакции должно прекращаться выделение хлористого водорода. Пример 1. Известный ранее способ. Получение (R,S)-(циано)(3-фенокси-фенил)метил-цис/транс-3-(2,2-дихлорэтенил)-2,2диметилциклопропанкарбоксилата в присутствии пиридина как акцептора кислоты. В колбу помещают 61,1г (0,252моль) (R,S-a-циано-3-феноксифемилацетонитрила (со степенью чистоти 93%), 22,3г (0,280моль) пиридина и 500мл толуола в атмосфере азота с осуществлением одновременного перемешивания. При поддержании температуры реакционной среды в пределах от 25 до 43°C в смесь вводят по каплям в течение 100мин раствор, содержащий 61,6г (0,253моль) 3-(2,2-дихлорэтенил)-2,2диметилциклопропанкарбонилхлорида (со степенью чистоты 93,7%) в 50мл толуола. Реакционную смесь перемешивают в течение 2ч и затем вводят дополнительно 1,89г (0,008моль) 3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбонилхлорида (со степенью чистоты 93%). Реакционную смесь перемешивают еще в течение 138мин, после чего вводят 75мл воды для гашения реакции. Водную фазу отделяют и удаляют. Органическая фаза промывается последовательно 75мл порциями 2н. соляной кислоты, 10% - ным раствором карбоната натрия в воде и чистой водой. После отделения конечного раствора промывки растворитель удаляют из органической фазы при пониженном давлении, в результате остается жидкость в количестве 109,0г. Анализ этой остаточной жидкости методом жидкостной хроматографии показал, что 89,3% этой жидкости представляет собой (R,S)-(циано)(3-феноксифенил)метил-цис/транс-3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкар-боксилат. Эта цис/транс композиция имеет соотношение цис/транс 48,8/51,2 и соотношение C1/C2, и t1/t2 энантиомерных пар, равное 55,9/41,1 и 56,7/43,3 соответственно. Выход продукта составляет 92,8%, исходя из количества a-окси-3фенокси-фенилацетонитрила, используемого в данной реакции. Пример 2. Полученние (R,S)-(циано)-(3-феноксифенил)метил-цис/транс-3-(2,2-дихлорэтенил)-2,2диметилциклопропанкарбоксилата при отсутствии акцептора кислоты. В колбу при перемешивании помещают 733,2 (1,505моль) раствора, содержащего 46,7% цис/транс-3-(2,2дихлорэтенил)-2,2-диметилциклопропанкарбонилхлорида и 175мл смешанных гептанов. Раствор, в котором поддерживают атмосферу азота, нагревают до температуры флегмообразования. В кипящий раствор вводят по каплям в течение 104мин 354,1г (1,462моль) (R,S)-a-окси-1-феноксифенилацетонитрила (со степенью чистоты 93%). После прекращения ввода реакционную смесь нагревают с обратным холодильником в течение 1ч, затем охлаждают и гашение реакции осуществляют путем ввода 375мл 10% - ного раствора карбоната натрия в воде. После перемешивания в течение 30мин водную фазу отделяют от органической, а органическую фазу промывают 375мл воды. После отделения от водной фазы растворитель удаляют из органической фазы при пониженном давлении. Количество оставшейся жидкости составляет 631,1г. Анализ этой остаточной жидкости методом жидкостной хроматографии показал, что 92,4% ее состава представляет собой (R,S)-(циано)(3феноксифенил)-метил-цис/транс-3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбоксилат. Эта цис/транс композиция имеет отношение цис/транс, равное 53,2/46,8, и соотношение энантиомерных пар C1/C2 и t1/t2, соответственно 48,2/51,8 и 47,9/52,1. Выход продукта составляет 95,8% в расчете на количество a-окси-3феноксифенилацетонитрила, используемого в данной реакции. Пример 3. Получение (R,S)-(циано)(3-феноксифенил)метил-цис/транс-3-(2,2-дихлорэтенил)-2,2диметилциклопропанкарбоксилата при отсутствии акцептора кислоты и со струей аргона. В колбу помещают 68,1г (0,200моль) цис/транс-3-(2,2-дихлорэтенил)-2,2диметилциклопропанкарбонилхлорида (со степенью чистоты 66,8%) и 100мл гептана. Под поверхностным слоем жидкости находится аргоновый барботер, который обеспечивает в течение всего периода реакции аргоновую струю. Реакционную смесь нагревают до температуры флегмообразования, а затем вводят по каплям в течение 110мин 49,2г (0,205моль) R,S-a-окси-3-феноксифенилацетонитрила (со степенью чистоты 93%). Нагревание с обратным холодильником продолжают еще в течение 4ч после завершения ввода. Температуру реакционной смеси снижают до 60°C, и в нее вводят 55мл 10% - ного водного раствора карбоната натрия. Смесь интенсивно перемешивают в течение 10мин, после чего водную фазу отделяют и удаляют. Отогнанную воду затем вводят в реакционную смесь, которую затем перемешивают при 50°C в течение 30мин. Эти фазы разделяют в растворитель органической фазы выпаривают при пониженном давлении. В остатке получают жидкость в количестве 87,2г. Анализ этой остаточной жидкости методом жидкостной хроматографии показывает, что 90,5% данного состава представляет собой (R,S)-(циано)(3-феноксифенил)метил цис/транс-3-(2,2-дихлорэтенил)-2,2диметилциклопропанкарбоксилат. Соотношение цис/транс в данной композиции составляет 51,4/48,6 и соотношение энантиомерных пари С1/С2 и t1/t2 в композиции составляет 48,6/51,4 и 48,4/51,6 соответственно. Выход продукта реакции 94,8% в расчете на количество цис/транс-3-(2,2-дихлорэтенил)-2,2диметилциклопропанкарбонилхлорида, присутствующего в реакционной смеси. Пример 4. Получение (R,S)-(циано)(3-феноксифенил)метил-цис/транс-3-(2,2-дихлорэтенил)-2,2диметилциклопропанкарбоксилата при отсутствии акцептора кислоты и без струи инертного газа. Колбу продувают азотом, после чего помещают 170,2г (0,500моль) цис/транс-(2,2-дихлорэтенил)-2,2диметилциклопропанкарбонилхлорида (со степенью чистоты 66,8%) и 185мл гептана. После начала нагрева колбы ввод азота прекращают. Реакционную смесь интенсивно перемешивают и после того, как начинается интенсивное флегмообразование, в нее вводят по каплям 122,0г (0,504моль) (R,S-a-циано-3феноксифенилацетонитрила (93%) в течение 130мин. После прекращения этого ввода нагревание продолжают еще в течение 70мин, после чего реакционную смесь охлаждают до 75°C, а затем добавляют 125мл 10% - ного водного раствора карбоната натрия. Полученную смесь перемешивают при 45 - 50°C в течение 30мин. Затем водную фазу отделяют и сливают. В реакционную смесь вводят дистиллированную воду (125мл) и перемешивают при 45 - 50°C в течение 30мин. Затем образующиеся фазы разделяют и растворитель удаляют из органической фазы путем выпаривания при пониженном давлении, получая в результате 215,1г остаточного продукта выпаривания. Анализ этого остаточного продукта методом жидкостной хроматографии показал, что он содержит 92,5% (R,S)-(циано)(3-феноксифенил)метил-цис/транс-3-(2,2-дихлорэтенил)-2,2диметилциклопропанкарбоксилата. Соотношение цис/транс изомеров в данном продукте составляет 51,8/48,2, а соотношение энантиомерных пар C1/C2 и t1/t2 соответственно 48,9/51,1 и 47,8/52,2. Выход продукта в расчете на количество цис/транс-3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбонилхлорида, используемого в данной реакции, составляет 95,6%. В изложенных ниже примерах описывается получение восьми изомерных смесей циперметрина. Данный способ применим в равной степени для реакций, в которых хлорангидрид кислоты является как предпочтительным цис-, так и предпочтительным транс-изомером, а также для получения смесей цифлутрина с повышенным содержанием изомеров. В табл.1 показаны типичные реакции цис(> 90% цис), цис/транс- или транс-3-2,2-дихлорэтенил)-2,2диметилциклопропанкарбонилхлорида (> 90% транс) с рацемическим (S)-a-окси-3-феноксифенилацетонитрилом или с рацемическим a-окси-(4-фтор-3-феноксифенил)-ацетонитрилом. Во всех случаях соотношение цис/транс в исходном материале сохраняется и в конечном продукте. Обычно получают выход продукта 93 - 97% и он никак не зависит от реагентов, ни от других компонентов, присутствующих в небольшом избыточном количестве. Во всех случаях реакции протекают в среде инертного газа, как в аргоне, так и в азоте, обычно в слабом потоке газа над поверхностью реакционной смеси, реже с барботированием через эту смесь. Нет никаких показаний относительно того, что прием, обеспечивающий поддержание инертной среды в реакционном сосуде, является наименее важным критерием. a) 3-(2,2-дихлорэтенил)-2,2-диметилциклопропилкарбонилхлорид; b) a-окси-3-феноксифенилацетонитрил; c) в расчете на количество реагентов (ДVAC) или цианогидрина, вводимого в реакционную смесь в небольшом молярном количестве; d) соотношение цис- и транс-циклопропильных групп, присутствующих в реакционной смеси; e) C1 = 18, цис S и 1R, цис R - энантиомерная пара изомеров, C2 = 1R, цис S и 1S, цис R - энантиомерная пара изомеров; f) t1 = 1S, транс S и 1R, транс R энантиомерная пара изомеров; g) в качестве акцептора кислоты используется более чем 1 молярный эквивалент пиридина, присутствующего в реакционной смеси; h) (S)-a-окси-3-феноксифенилацетонитрил: C1 = 1S, цис S; C2 = 1R, цис S; t1 = 1S, транс S; t2 = 1R, транс S. l) a-окси-4-фтор-3-феноксифенилацетонитрил. Хотя отклонение значения соотношений C1/C2 и t1/t2 от 56/44 может быть относительно небольшим, происходит неизменное увеличение инсектицидной активности, и в результате происходит более эффективное образование продукта без существенного увеличения стоимости способов разделения. Это повышение активности иллюстрируется в табл.2, в которой испытываемым вредным насекомым является табачная листовертка-почкоед, приносящая больший экономический ущерб.
ДивитисяДодаткова інформація
Автори англійськоюGlenn Michael Stephen
Автори російськоюГленн Майкл Стефен
МПК / Мітки
МПК: C07C 253/34, A01N 53/00, C07C 255/39, C07C 253/30, C07B 53/00
Мітки: ізомерів, ціперметрину, суміші, спосіб, одержання, цифлутрину
Код посилання
<a href="https://ua.patents.su/4-26524-sposib-oderzhannya-sumishi-izomeriv-cipermetrinu-abo-ciflutrinu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання суміші ізомерів циперметрину або цифлутрину</a>
Попередній патент: Спосіб регулювання струму трифазної дугової електропечі та установка трифазної електродугової печі прямого нагрівання
Наступний патент: Засіб, що зменшує м’язову ригідність, та засіб для лікування хвороби паркінсона
Випадковий патент: Перевантажувальний пристрій (пк-30)