Спосіб отримання метилового ефіру delta-2-дігідромуконової кислоти
Формула / Реферат
Способ получения метилового эфира D-2-дигидромуконовой кислоты каталитической димеризацией метилакрилата в среде органического раствврителя при 50-190 С в присутствии палладийсодержащего катализатора, отличающийся тем, что, с целью упрощения технологии процесса, используют каталитическую систему, состоящую из дибензилиденацетоната палладия (II) или ди-бензилиденацетоната палладия (III) или их смеси, или ацетилацетоната палладия (II), или ацетата палладия (II) и трибутилфосфония с тетрафтор-борной кислотой, или гидротрибутилфосфоний-тетрафторбората при необходимости с добавкой тетрафторборной кислоты, а процесс проводят при молярном соотношении фосфор: палладий = 1 : 1-4 и при молярном соотношении ион водорода : ион палладия = 1 : 1-10, при этом каталитическую систему растворяют в диэтиловом эфире.
Текст
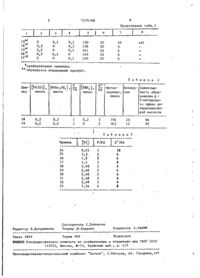
Изобретение относится к эфирам карбоновых кислот, в частности к получению метилового эфира Д-2-днгидронуконовой кислоты, которая используется в производстве адипиновой ки~ слоты. Цепь - упрощение технологии процесса. Получение ведут каталитической димеризацией метилакрилата в среде органического растворителя при 50-!90°С в присутствии катализатора. В качестве последнего используют каталитическую систему, состоящую из дибензилиденацетоната Pd(Il) или дибензилиденацетоната Pd(III) или их смеси, или ацетилацетоната Pd(II). или ацетата Pd(II) и трибутилфосфония с тетрафторборной кислотой, или гидротрибутилфосфонийтетрафторбората при необходимости с добавкой тетрафторборной кислоты. Процесс проводят при молярном соотношении P:Pd=1:1-4 и при молярном соотношении ион Н;ион Pd=l:l-10, при этом каталитическую систему растворяют в диэтиловом эфире. Продолжительность процесса сокращается с 10-30 ч до ї * ч. 3 табл. -5 Изобретение относится к усовершенствованному способу получения метилового эфира Л-2-дигидромуконовой кислоты, который является ценным промежуточным продуктом для получения производных адилиновой кислоты. Целью изобретения является упрощение технологии процесса,. П р и м е р ы 1-17. Эти примеры иллюстрируют днмериэацию метилакрнлата при работе по следующей методике. Б трубку Шленка, снабженную магнитной мешалкой и устройством для продувки аргона, последовательно вводят; эквивалент 0,2 ммоль палладия в смеси 1:3 комплексов дибензилиденацетоната палладия (II) и дибензилиденацетоната палладия (III) - Pd (dba)2 и PdsCdba)?, дегазированный иетилакрилат; перегнанный в аргоне трибутилфосфин -(РВи)з, раствор, в диэтиловом эфире 'тетрафторборной кислоты, титр которого заранее определен. Трубку закрывают, перемешивают ее содержимое при S0 С в течение необходимого времени. Затем понижают темппратуру до комнатной и нейтрализуют (21) (22) (31) (32) (33) (46) (71) Рон Пуленк Шими (FR) (72) Пьер Гренуйе, Дени Нейбекер и Игорь Ткаченко (FR) (53) 547.391.5.26.07(088.8) (56) Патент Франции h> 2079319, кл. С 07 С 69/653, опублик. 1974, Патент Франции h 2524341, " кл. С 07 С 69/653, опублик. 1979. 4 1574168 реакционную смесь добавлением 0,5 г бикарбоната натрия. Перегоняют при пониженном давлении (3 Торр) и соби- I рагот жидкую фракцию. » Полученный таким образом дистиллят анализируют на газовом хроматографе, используя в качестве внутреннего стандарта метилмалонат, колонка 2 x 1 / 8 м, Карбовакс 20 М (10%) на 1 0 Хромосорбе P W 60-80, температура A инжектора 250 С»,температура печи 150 С, температура пламенно-ионизационного детектора 250°С, в к а ч е с т в е газа-носителя используют азот 15 (25 мл/мин). Конкретные условия и полученные результаты приведены в табл. 1, 1 Как видно из т а б л . 1» в отсутствии 20 палладия образуется только полимер (пример 1 3 ) ; в отсутствии соединения фосфора ( I I I ) не наблюдается никакого превращения акрилата (пример 1 4 ) ; в отсутствии соединения фосфора ( I I I ) 25 и в присутствии возрастающего количества водородной кислоты не наблюдается никакого превращения акрилата (пример І 5 ) ; в отсутствии водородной кислоты не наблюдается никакого п р е - ^0 вращения акрилата (пример 1 6 ) ; н а личие только водородной кислоты н е достаточно, чтобы обеспечить любое превращение акрилата (пример 17). П р и м е р ы 18 и 19. Эти приме- ^$ ры показывают предварительное образование соли (HPBuj)BF^, В трубку Шленка, снабженную магнитной мешалкой и устройством для продувки а р г о н а , последовательно з а - до гружают: эквивалент 0,2 ммоль палладия в смеси указанных в примерах 1-17 комплексов; дегазированный метилакрилат', водородтрибутилфосфонийтетрафторборат, полученный при взаимодей- 45 ствии эквивалентных количеств трибутилфосфина и тетрафторборной кислоты в растворе диэтилового эфира и , в н е которых случаях, тетрафторборной к и слоты в растворе диэтилового эфира, CQ Трубку Шленка закрывают, потом перемешивают ее содержимое при 80 С в течение 20 ч . Обработка реакционных смесей согласно описанным выше методикам приводит к результатам, приведенным в т а б л . 2. П р и м е р 20. В трубку Шленка, снабженную магнитной мешалкой и подводом аргона, последовательно загружа + ют (P/Pd=2; Н /Ра=4): эквивалент 0,1 миллиатом-грамма палладия в смеси указанных в примерах 1-17 комплексов; дегазированный метилакрилат (13,8 мл,' 153 ммоль); трибутилфосфин (РВи)» (40 мг, 0,2 ммоль); тетрафторборную кислоту в виде 9,3 н . раствора в д и этиловом эфире (0,05 мл или 0,4 ммоль) Трубку Шленка закрывают, потом перемешивают при 80 С в течение 20 ч . Обработка реакционной смеси по описанной методике приводит к конверсии 41% метллакрилата. Получают следующие продукты: Д -метиловый эфир д и гидромуконовой кислоты (более 95%); метиловый эфир 2-метиленглутаровой кислоты (1%); £> -метиловый эфир дигидромуконовой кислоты (следы); н е идентифицированные димеры (3%). П р и м е р 21.. Этот пример иллюстрирует применение ацетата палладия для димеризации метилакрилата. В трубку Шленка, снабженную магнитной мешалкой и продувкой аргоном, последовательно загружают (P/Pd=3; Н /Pd=6); ацетат палладия (22,5 мг, 0,1 ммоль); дегазированный метилакри- • лат (13,8 мл, 153 ммоль); трибутилфосфин (60 мг, 0,3 ммоль), тетрафторборную кислоту в виде 9,.3 н . раствора в диэтиловом эфире (0,075 мл, 0,6 ммоль). Трубку Шленка закрывают, потом перемешивают при 80 С 5 ч . Обработка реакционной смеси по описанной методике приводит к конверсии 52% метилакрилата (частота вращения 76 ч " ' ) . Селективность Д -метилового эфира дигидромуконовой кислоты выше 95%, П р и м е р 22. Этот пример иллюстрирует применение ацетилацетоната палладия при димеризации метилакрилата. В трубку Шленка, снабженную магнитной мешалкой и продувом аргона, последовательно загружают: ацетилацетонат палладия (30,5 мг, 0,1ммоль) дегазированный метилакрилат (14 мл, 155 ммоль); трибутилфосфин (40 мг, 0,2 ммоль); тетрафторборную кислоту в виде 9,3 н, раствора в этиловом эфире (0,125 мл, 1 ммоль). Трубку Шленка закрывают, потом перемешивают при 80°С в течение 5 ч . Обработка реакционной смеси по описанной методике приводит к конверсии 67% метилакрилата (частота вращения 88 ч * ) . Селективность А^-метилового 5 15741 68 6 эфира дигидромуконовой кислоты выше Во всех случаях получают целевой про95%. ї |дукт с селективностью 95£ и выше. П р и м е р 23. В реактор из неПредлагаемый способ существенно упржавеющей стали емкостью 50 см , пророцает технологию процесса по сравдутой аргоном, вводят последовательнению с известным способом за счет но ацетилацетонат палладия (II), использования доступной каталитичесрастворенный в отогнанном метилакрикой системы и сокращает продолжительлате в количестве 0,6 ммоль палладия ность процесса с 10-30 ч до 1-5 ч. на моль акрилата; тетрафторборат во- jg дородтрибутилфосфония в количестве Ф о р м у л а и з о б р е т е н и я 6 ммоль на моль акрилата (?/Pd=10); и тетрафторборную кислоту, образуюСпособ получения метилового эфищую комплекс с этиловым эфиром в кора й -2-дигидромуконовой кислоты калі .естве 2,5 ммоль на моль акрилата 15 талитической димеризацией метилакрн+ лата в среде органического раствори(H /Pd=l4). теля при 50~190°С в присутствии палладийсодержащего катализатора, о т~ После закрытия реактора и перемел и ч а ю щ и й с я тем, что, с цешивания температуру реакционной срелью упрощения технологии процесса, 20 ды доводят до П 0 ° С . используют каталитическую систему, / За ходом реакции наблюдают путем состоявшую из дибензилиденацетоната отбора образцов в течение времени палладия (II) или дибензилиденацетопроведения хроматографического аналината палладия (III) или их смеси, за в газовой фазе. 25 или ацетилацетоната палладия (II), Получены следующие результаты, или ацетата палладия (II) и трибутилПосле 55 мин реакции степень префосфония с тетрафторборной кислотой, вращения акрилата составляет 22% и или гидротрибутилфосфонийтетрафторбората при необходимости с добавкой селективность метилового эфира дитетрафторборной кислоты, а процесс гидромуконовой кислоты выше 98%. проводят при молярном соотношении После 4 ч 25 мин реакции степень фосфор:палладий =1:1-4 и при молярпревращения акрилата составляет 79% ном соотношении ион водорода:ион пали селективность метилового эфира диладия =1:1-10, при этом каталитичесгидромуконовой кислоты выше 95%. кую систему растворяют в диэтиловом П р и м е р ы 24-33. Процесс проэфире, • *' • |водят как и в примере 23. Условия ведения процесса приведены в табл. 3. I Т а б л и ц а Пример 1 [Pd(O)], [РВи3], [HBF 4 ] , Метилммоль ммоль ммоль Время, Конвер- Селективность образования акрилат, ч сия й-2-метилового эфира дигид ммоль ромуконовой ки слоты 1 1 2 3 4 5 6 7 8 9 10 П 12 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 0,2 э 4 0,2 0,2 0,2 0,2 0,2 0,2 0,4 0,4 0,4 0,4 0,6 0,6 0,4 і 5 0,4 157 152 0,6 0,8 2 0,4 0,6 0,3 1 0,8 157 J47 153 156 152 154 149 136 I 0,8 145 153 6 20 20 20 20 20 20 20 20 20 20 20 5 & 7 4 53 , . 40 21 12 • 55 87 87 55 53 64 94 • 39 • 95 95 94 95 94 95 96 96 95 95 96 574168 Продолжение табл.1 8 ІЗ 14 15 0 0>2 0,2 0,2 0 If? 17 0,2 0 0 0,2 0 0,2 0,2 0,4 0 0,2 150 136 141 140 150 20 20 20 20 20 95 0 0 0 0 *-*•} сравнительные примеры; образуется полимерный продукт. Т а б л и ц Пример 0d(0)], [HPBu,BF4] , ммоль ммоль Р Pd [HBF 4 ] , ММОЛЬ Конвер- СелективМетилакрилат, сия ность обраммоль зования / ~ V 2-метилового эфира дигидромуконо Pd ВОЙ 18 19 0,2 0,2 0,2 0,4 1 2 0,2 0 І - Пример 24 25 26 " 27 1 28 29 30 31 32 33 Редактор В.Бугренкова Заказ 1649 2 2 156 163 P/Pd 0,65 2 2 2 2 2 2 2 2 2 4 2,48 2,48 2,48 2,48 2,48 1,24 96 95 1 а б л и ц а 3 [м] | *|3 1,3 1,3 23 12 КИСЛОТЫ \ H+/Pd 10 4 4 4 4 4 4 4 4 8 Составитель С.Полякова Техред М.Ходанич Корректор С.Черни Тираж 340 Подписное В И П Государственного комитета по изобретениям и открытиям при Г Н СССР Н И И К Т 113035, Москва, Ж-35, Раушская н а б . , д . 4/5 Производственно-издательский комбинат "Патент", г.Ужгород, ул. Гагарина,101
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of methyl ester of delta-2-dyhidromuconic acid
Автори англійськоюGrenuje Per, Tkachenko Igor
Назва патенту російською?????? ????????? ?????????? ????? delta-2-???????????????? ???????
Автори російськоюПьер Гренуйе, Игорь Ткаченко
МПК / Мітки
МПК: B01J 31/00, C07F 15/00, C07B 61/00, C07C 67/465, B01J 31/16, B01J 31/26, C07C 69/593
Мітки: кислоти, спосіб, delta-2-дігідромуконової, отримання, метилового, ефіру
Код посилання
<a href="https://ua.patents.su/4-3632-sposib-otrimannya-metilovogo-efiru-delta-2-digidromukonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання метилового ефіру delta-2-дігідромуконової кислоти</a>
Попередній патент: Спосіб отримання 1,2-біс-(никотінамідо)-пропану чи його солей з фармацевтичноприйнятною кислотою
Наступний патент: Спосіб одержання похідних пірідіна (його варіанти)
Випадковий патент: Спосіб одержання світловипромінювального матеріалу на основі кремнію