Похідні 3-ціано- та 3-етоксикарбоніл-8(4н)-оксо-9-арил-5,6,7,9-гексагідропіразоло[5,1-b]-хіназолінів
Номер патенту: 47477
Опубліковано: 10.02.2010
Автори: Бородіна Вікторія Василівна, ЛІПСОН ВІКТОРІЯ ВІКТОРІВНА, Широбокова Марія Георгіївна, Світлична Наталія Володимирівна
Формула / Реферат
Похідні 3-ціано- та 3-етоксикарбоніл-8(4H)-оксо-9-арил-5,6,7,9-гексагідропіразоло[5,1-b]хіназолінів загальної формули
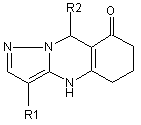 ,
,
де R1 = CN або СООС2Н5,
R2 = С6Н5, С6Н4-4-Сl, С6Н4-4-СН3, C6H4-4-NO2.
Текст
Похідні 3-ціано- та 3-етоксикарбоніл-8(4H)оксо-9-арил-5,6,7,9-гексагідропіразоло[5,1b]хіназолінів загальної формули R2 O Корисна модель відноситься до галузі органічної хімії та стосується нових сполук - похідних 3ціанота 3-етоксикарбоніл-8(4H)-оксо-9-арил5,6,7,9-гексагідропіразоло[5,1-b]хіназолінів. Ці похідні можуть бути напівпродуктами синтезу біологічно активних сполук (БАС), які утворюються в результаті трансформації ціано- або етоксикарбонільної груп. Відомо, що гексагідропіразоло[5,1-b]хіназоліни є ізостерами азолохіназолінів, які виступають агоністами АТФ-залежних К+-каналів (потенційні гіпотензивні засоби та міорелаксанти) [1, 2], інгібіторами захвату клітинами аденозину (потенційні вазодилататори та антиагреганти) [3, 4] або гальмують фосфатидилінозіт-3-кіназу і у такий спосіб змінюють передачу сигналу у клітинах [5], або виявляють властивості антиметаболітів [6], що може знайти використання при лікуванні онкологічних, імунних та запальних захворювань. Відомо дві принципові схеми синтезу частково гідрогенізованих 8(4H)-оксо-9-арилпіразоло[5,1b]хіназолінів: формування хіназолінової системи на основі амінопіразольної та добудова азольного фрагмента до вже існуючого хіназолінового. Перша схема, яка є найбільш поширеною, базується a -амінопіразолів на реакціях з 1,3біелектрофільними сполуками або їх синтетичними попередниками чи еквівалентами [2, 6, 7]. Ос новним недоліками такого підходу є обмежений набір 1,3-біелектрофільних компонентів конденсації, за участю яких утворюється саме частково гідрогенізований піримідиновий цикл у складі хіназолінової системи. До того ж, спостерігається низька селективність процесу при відсутності замісника у орто-положенні до аміногрупи у a -амінопіразолі або за умов слабкої диференційованості електрофільних центрів у С3-синтоні, що призводить до утворення суміші ізомерних продуктів [2, 7, 8]. Альтернативний шлях пов'язаний із добудовою азольного фрагмента до вже існуючого хіназолінового є синтетично значно більш обмеженим з причин низької доступності придатних для цього дигідро-N-амінохіназолінів [9]. Задачею корисної моделі є одержання похідних 3-ціано- та 3-етоксикарбоніл-8(4Н)-оксо-9арил-5,6,7,9-гексагідропіразоло[5,1-b]-хіназолінів як напівпродуктів синтезу БАС та розробка технологічного способу синтезу, який характеризується високою селективністю, тобто виключає утворення суміші ізомерних продуктів. Поставлена задача вирішується тим, що синтезують похідні загальної формули: N N N H R1 (19) UA (11) 47477 (13) U , де R1 = CN або СООС2Н5, R2 = С6Н5, С6Н4-4-Сl, С6Н4-4-СН3, C6H4-4-NO2. 3 R2 N 47477 4 циклогексан-1,3-діоном як одностадійний процес без виділення проміжних продуктів - арилметиліденпохідних циклогенсан-1,3-діону. Реакція здійснюється при нагріванні в органічних розчинниках, зокрема 2-пропанолі або диметилформаміді (ДМФА). Технічний результат - розширення спектру сполук, які можуть бути використані у створенні ліків. Спосіб одержання 9-арилпохідних 3-ціано- або 3-етоксикарбоніл-8(4H)-оксо-5,6,7,9гексагідропіразоло[5,1-b]хіназолінів ілюструється схемою: O N N H R1 де R1 = CN або СООС2Н5, R2 = С6Н5, С6Н4-4-Сl, С6Н4-4-СН3, C6H4-4-NO2 Зазначені сполуки одержують шляхом трьохкомпонентної каскадної циклоконденсації 5амінопіразол-4-карбонітрилу або 4-карбетокси-5аміно-піразолу з ароматичними альдегідами та R2 O O NH N O + 1,2 N H NH2 R1 N + R2 N H O 3a-d 1,5 R1=CN, 2,6R1=COOC2H5; 3,5,6 R2: a - C6H5, b - C6H4-4CH3, c - C6H4-4Cl, d C6H4-4NO2 Хімічну будову синтезованих сполук доведено спектральними методами (ЯМР 1Н, ІЧ). Приклад 1. Одержання 8(4Н)-оксо-9-феніл5,6,7,9-гексагідропіразоло-[5,1-b]хіназолін-3карбонітрилу (5а). Суміш 0.22г (2ммоль) 5амінопіразол-4-карбонітрилу (1), 0.21г (2ммоль) бензальдегіду (3а) і 0.22г (2ммоль) циклогексан1,3-діону (4) в 5мл 2-пропанолу кип'ятять 1 год до появи кристалічного осаду, охолоджують, відфільтровують 0.41г (1.4ммоль), (71%) сполуки (5а) з т. пл. 350-353°С. C17H14N4O. Визначено С, %: 70.37; Н, %: 4.80; N, %: 19.36. Розраховано С, %: 70.34; Н, %: 4.83; N, %: 19.31. ІЧ спектр (в КВr): 3228 (NH Н-зв'язана), 2940, 2904, 2856 (СН2), 2228 (CN), 1644 (С=О ). Спектр ЯМР 1Н (ДМСО-d6, 200МГц): 11.22 (р.с, 1Н, NH), 7.84 (с, 1Н, С2Н), 7.26-7.14 (м., 5Н, С6Н5), 6.17 (с, 1Н, С9Н), 2.68 (м., 2Н, СН2), 2.25 (м., 2Н, СН2), 1.93 (м., 2Н, СН2). Приклад 2. Одержання 8(4H)-оксо-9-феніл5,6,7,9-гексагідропіразоло-[5,1-b]хіназолін-3карбонітрилу (5а). Суміш 0.22г (2ммоль) 5амінопіразол-4-карбонітрилу (1), 0.21г (2 ммоль) бензальдегіду (3а) і 0.22г (2ммоль) циклогексан1,3-діону (4) в 1мл ДМФА кип'ятять 20хв., охолоджують, додають 5мл 2-пропанолу, відфільтровують 0.32г (1.1ммоль), (56%) сполуки (5а) з т. пл. 350-352°С. Приклад 3. Одержання 8(4Н)-оксо-9-(4метилфеніл)-5,6,7,9-гексагідропіразоло[5,1b]хіназолін-3-карбонітрилу (5b). Сполуку синтезовано способом, що наведено у п. 1. Вихід продукту 0.44г (72%), т. пл. 310-313°С. Вихід сполуки (5b) за способом, що описано в п. 2. - 0.36г (59%). C18H16N4O. Визначено С, %: 71.10; Н, %: 5.22; N, %: 18.45. Розраховано С, %: 71.05; Н, %: 5.26; N, %: 18.42. ІЧ спектр (в КВr): 3232 (NH Н-зв'язана), 4 R1 5a-d 6a-d 2972, 2940, 2856 (СН2), 2228 (CN), 1648 (С=О ). Спектр ЯМР 1Н (ДМСО-d6, 200МГц): 11.18 (р.с, 1H, NH), 7.82 (с.,1Н, С2Н), 7.04 (м., 4Н, С6Н4), 6.13 (с, 1Н, С9Н), 2.64 (м., 2Н, СН2), 2.27 (м., 2Н, СН2), 1.93 (м., 2Н, СН2), 2.20 (с, 3Н, СН3). Приклад 4. Одержання 8(4H)-оксо-9-(4хлорфеніл)-5,6,7,9-гексагідропіразоло[5,1b]хіназолін-3-карбонітрилу (5с). Сполуку синтезовано способом, що наведено у п. 1. Вихід продукту 0.43г (67%), т. пл. 313-315°С. Вихід сполуки (5с) за способом, що описано в п. 2. - 0.29г (44%). C17H13N4ClO. Визначено С, %: 62.90; Н, %: 3.98; N, %: 17.23; Сl, %: 10.93 . Розраховано С, %: 62.87; Н, %: 4.01; N, %: 17.26; Сl, %: 10.94. ІЧ спектр (в КВr): 3232 (NH Н-зв'язана), 2968, 2940, 2856 (СН2), 2232 (CN), 1644 (С=О ). Спектр ЯМР 1Н (ДМСО-d6, 200МГц): 11.29 (р.с, 1Н, NH), 7.85 (с, 1Н, С2Н), 7.34-7.17 (д.д., 4Н, С6Н4, КССВ J=8.6Гц), 6.18 (с, 1Н, C9H), 2.67 (м., 2Н, СН2), 2.27 (м., 2Н, СН2), 1.92 (м., 2Н, СН2). Приклад 5. Одержання 8(4H)-оксо-9-(4нітрофеніл)-5,6,7,9-гексагідро-піразоло[5,1b]хіназолін-3-карбонітрилу (5d). Сполуку синтезовано способом, що наведено у п. 1. Вихід продукту 0.56г (83%), т. пл. 307-309°С. Вихід сполуки (5d) за способом, що описано в п. 2. - 0.36г (54%). C17H13N5O3. Визначено С, %: 60.86; Н, %: 3.85; N, %: 20.87. Розраховано С, %: 60.90; Н,%: 3.88; N, %: 20.90.14 спектр (в КВr): 3116 (NH Н-зв'язана), 2936, 2900, 2842 (СН2), 2232 (CN), 1648 (С=О ), 1520, 1348 (NO2). Спектр ЯМР 1Н (ДМСO-d6, 200МГц): 11.43 (р.с, 1Н, NH), 7.88 (с, 1Н, С2Н), 8.11-7.45 (д.д, 5Н, С6Н4, КССВ J=8.6Гц), 6.32 (с, 1H, С9Н), 2.68 (м., 2Н, СН2), 2.24 (м., 2Н, СН2), 1.93 (м., 2Н, СН2). Приклад 6. Одержання 3-етоксикарбоніл-9феніл-5,6,7,9-гексагідропіразоло[5,1-b]хіназолін8(4H)-он (6а). Суміш 0.31г (2 ммоль) 4-етоксикарбоніл-5-амінопіразолу (2), 0.21г (2ммоль) бен 5 зальдегіду (3а) і 0.22г (2ммоль) циклогексан-1,3діону (4) в 5мл 2-пропанолу кип'ятять 1 год. до появи кристалічного осаду, охолоджують, відфільтровують 0.51г (1.5ммоль), (76%) сполуки (6а) з т. пл. 202-204°С. C19H19N3O3. Визначено С, %: 67.70; Н, %: 5.62; N, %: 12.48. Розраховано С, %: 67.66; Н, %: 5.64; N, %: 12.46. ІЧ спектр (в КВr): 3220 (NH Н-зв'язана), 2988, 2956 (СН2, СН3), 1700, 1648 (С=O). Спектр ЯМР 1Н (ДМСО-d6, 200МГц): 9.77 (р.с, 1Н, NH), 7.66 (с, 1Н, С2Н), 7.30-7.12 (м., 5Н, С6Н5), 6.17 (с, 1Н, С9Н), 4.25 (кв., 2Н, СН2, КССВ J=6.8Гц) 2.98-2.84 (м., 2Н, СН2), 2.25 (м., 2Н, СН2), 1.99-1.87 (м., 2Н, СН2), 1.26 (т., 3Н, СН3). Приклад 7. Одержання 3-етоксикарбоніл-9феніл-5,6,7,9-гексагідро-піразоло[5,1-b]хіназолін8(4H)-он (6а). Суміш 0.31г (2ммоль) 4-етоксикарбоніл-5-амінопіразолу (2), 0.21г (2ммоль) бензальдегіду (3а) і 0.22г (2ммоль) циклогексан-1,3діону (4) в 1мл ДМФА кип'ятять 30хв., охолоджують, додають 5мл 2-пропанолу, відфільтровують 0.27г (0.8ммоль), (40%) сполуки (6а) з т. пл. 202204°С. Приклад 8. Одержання 3-етоксикарбоніл-9-(4метилфеніл)-5,6,7,9-гексагідропіразоло[5,1b]хіназолін-8(4H)-он (6b). Сполуку синтезовано способом, що наведено у п. 6. Вихід продукту 0.51г (73%), т. пл. 229-232°С. Вихід сполуки (6b) за способом, що описано в п.7. - 0.46г (66%). C20H21N3O3. Визначено С, %: 68.41; Н, %: 5.95; N, %: 11.95. Розраховано С, %: 68.38; Н, %: 5.98; N, %: 11.97. ІЧ спектр (в КВr): 3196 (NH Н-зв'язана), 2944, 2900 (СН2, СН3), 1676, 1624 (С=О ). Спектр ЯМР 1Н (ДМСО-d6, 200МГц): 9.79 (р.с, 1Н, NH), 7.65 (с, 1H, С2Н), 6.98 (м., 4Н, С6Н4), 6.13 (с, 1H, С9Н), 4.24 (кв., 2Н, СН2, КССВ J=6.8Гц) 2.97-2.66 (м., 2Н, СН2), 2.26 (м., 2Н, СН2), 2.19 (с, 3Н, СН3) 1.98-1.73 (м., 2Н, СН2), 1.25 (т., 3Н, СН3). Приклад 9. Одержання 3-етоксикарбоніл-9-(4хлорфеніл)-5,6,7,9-гексагідропіразоло[5,1b]хіназолін-8(4H)-он (6с). Сполуку синтезовано способом, що наведено у п. 6. Вихід продукту 0.51г (69%), т. пл. 229-232°С. Вихід сполуки (6с) за способом, що описано в п. 7. - 0.33г (45%). C19H18N3ClO3. Визначено С, %: 61.35; Н, %: 4.83; N, %: 11.34; Сl, %: 9.53. Розраховано С, %: 61.37; Н, %: 4.85; N, %: 11.37; Сl, %: 9.56. ІЧ спектр (в КВr): 3248 (NH Н-зв'язана), 2952, 2924 (СН2, СН3), 1676, 1624 (С=О ). Спектр ЯМР 1Н (ДМСО-d6, 200МГц): 9.90 (р.с, 1Н, NH), 7.67 (с, 1Н, С2Н), 7.33-7.14 (д.д., 4Н, С6Н4, КССВ J=8.4Гц), 6.18 (с, 1Н, С9Н), 4.25 (кв., 2Н, СН2, КССВ J=6.8Гц) 2.96-2.58 (м., 2Н, СН2), 2.27 (м., 2Н, СН2), 1.94-1.89 (м., 2Н, СН2), 1.25 (т., 3Н, СН3). Приклад 10. Одержання 3-етоксикарбоніл-9-(4нітрофеніл)-5,6,7,9-гексагідропіразоло[5,1b]хіназолін-8(4H)-он (6d). Сполуку синтезовано способом, що наведено у п. 6. Вихід продукту 0.48г (63%), т. пл. 185-188°С. Вихід сполуки (6d) за способом, що описано в п.7. - 0.34г (45%). C19H18N4O5. Визначено С, %: 59.70; Н, %: 4.69; N, %: 14.63. Розраховано С, %: 59.69; Н, %: 4.71; N, %: 14.66. ІЧ спектр (в КВr): 3368 (NH Н-зв'язана), 2952 (СН2, СН3), 1688, 1640 (С=О ), 1520,1344 (NO2). Спектр ЯМР 1Н (ДМСО-d6, 200МГц): 10.01 (р.с, 1Н, NH), 8.13-7.39 (д.д., 4Н, С6Н4, КССВ J=8.8Гц), 7.69 (с, 47477 6 1Н, C2H), 6.31 (с, 1Н, С9Н), 4.25 (кв., 2Н, СН2, КССВ J=6.8Гц) 2.96-2.62 (м., 2Н, СН2), 2.24 (м., 2Н, СН2), 1.91 (м., 2Н, СН2), 1.26 (т., 3Н, СН3). Таким чином, запропоновані нові сполуки - похідні 3-ціано- та 3-етоксикарбоніл-8(4H)-оксо-9арил-5,6,7,9-гексагідропіразоло[5,1-b]хіназолінів та селективний одностадійний спосіб їх одержання з використанням простих, комерційно доступних реагентів та розчинників. Джерела інформації: 1. Пат. 6191140 US, МПК7 А61К31/44; C07D513/00. Pyrano, piperidine, and thiopyrano compounds and methods of use [Електронний ресурс] / W.A. Carroll, K.A. Agrios, R.J. Altenbach [et al.] (US); заявник Abbott Laboratories (US). №09/421862; заявл. 20.10.99; опубл. 20.02.01. Режим доступу:www.ep.esp@cenet.com. 2. Structure - activity studies for a novel series of tricyclic dihydropyrimidines as KATP channel openers (KCOs) [Текст] / I. Drizin, M.W. Holladay, Lin Yi [et al.] // Bioorg. Med. Chem. Lett. - 2002. - № 12. - P. 1481-1484. 3. Пат. 9833792 WO, МПК6 C07D401/14. Preparation of 1-oxo-2-(4-piperidinyl)quinazoline and 1-oxo-2-(4-piperidinylalkyl)quinazoline derivatives inhibiting cellular uptake of adenosine [Електронний ресурс] / Fujiwara Shigeki, Okamura Yuko, Takai Haruki [et al.] (JP); заявник Kyowa Hakko Kogyo Co., Ltd (JP). - №97/18256; заявл. 31.01.97; опубл. 06.08.98. - Режим доступу : www.ep.espacenet.com. 4. Quantification of extracellular and intracellular adenosine production. Understanding the transmembranous concentration gradient [Текст] / A. Deussen, M. Stappert, S. Schafer, M. Kelm // Circulation. - 1999. - Vol. 99. - P. 2041-2047. 5. Заявка 2006100484 RU, МПК C07D471/04(2006.01). Соединения, обладающие ингибирующей активностью в отношении фосфатидилинозит-3-киназы, фармацевтическая композиция, способ определения эффективности этих соединений, способ лечения нарушений (варианты) и способ изменения передачи сигнала в клетках [Електронний ресурс] / Ф. Дарваш (HU), Д. Дорман (HU), Б. Э. Дрис (US) [и др.]; заявник Центарис Гмбх (DE); пат. повірений Н.К. Попеленский. - № 2006100484/04 ; заявл. 14.06.04; опубл. 10.06.06. - Режим доступу : www.fips.ru. 6. Elgemeie, G.H. Antimetabolites: a novel synthesis of nonclassical condensed carbocyclic purine analogues [Текст] / G.H. Elgemeie, N.M. Fathy, D.A. Farrag // Egypt J. Pharm. Science. 1997. - Vol. 38. - P. 351-361. 7. Dihydropyridine KAТР channel openers [Text] / C.A. Frank, J.M. Forst, T. Grant [et al.] // Bioorg. Med. Chem. Lett. - 1993. - № 12. - P. 2725-2726. 8. Десенко, С.М. Конденсация аминоазолов с бензоциклоалканонами и диметилформамидом [Текст] /С.М. Десенко, В.Д. Орлов, X. Эстрада // Химия гетероцикл. соед. - 1991. - № 5. - С. 694695. 9. Хачатрян, Д.С. Синтезы и свойства 1,2дигидро-4-хиназолинонов [Текст] / Д.С. Хачатрян, К.Р. Матевосян // Азотистые гетероциклы и алкалоиды / под ред. В.Г. Карцева и Г.А. Толстикова. М.: Иридиум-пресс, 2001. - С. 558-562. 7 Комп’ютерна верстка А. Крулевський 47477 8 Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською3-cyano- and 3-ethoxycarbonyl-8(4h)-oxo-9-aryl-5,6,7,9-hexahydropyrazolo[5,1-b]quinazoline derivatives
Автори англійськоюLipson Viktoria Viktorivna, Borodina Viktoria Vasylivna, Shyrobokova Maria Heorhiivna, Svitlychna Natalia Volodymyrivna
Назва патенту російськоюПроизводные 3-циано- и 3-этоксикарбонил-8(4н)-оксо-9-арил-5,6,7,9-гексагидропиразоло[5,1-b]-хиназолинов
Автори російськоюЛипсон Виктория Викторовна, Бородина Виктория Васильевна, Широбокова Мария Георгиевна, Светличная Наталья Владимировна
МПК / Мітки
МПК: C07D 401/00, C07D 403/00
Мітки: похідні, 3-ціано, 3-етоксикарбоніл-8(4н)-оксо-9-арил-5,6,7,9-гексагідропіразоло[5,1-b]-хіназолінів
Код посилання
<a href="https://ua.patents.su/4-47477-pokhidni-3-ciano-ta-3-etoksikarbonil-84n-okso-9-aril-5679-geksagidropirazolo51-b-khinazoliniv.html" target="_blank" rel="follow" title="База патентів України">Похідні 3-ціано- та 3-етоксикарбоніл-8(4н)-оксо-9-арил-5,6,7,9-гексагідропіразоло[5,1-b]-хіназолінів</a>
Попередній патент: Препарат “полімікровет” для корекції обміну речовин у лактуючих корів за умов дисбалансу мікроелементів
Наступний патент: Спосіб комплексного лікування пре- та перинатальних уражень центральної нервової системи з епілептичними нападами у новонароджених і дітей раннього віку
Випадковий патент: Антитіла, специфічні для кадгерину-17








