Застосування 5,11,17,23-тетракис[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідроксикалікс[4]арену як інгібітора протеїнтирозинфосфатази
Номер патенту: 48049
Опубліковано: 10.03.2010
Автори: Кальченко Віталій Іванович, Драпайло Андрій Богданович, Кухар Валерій Павлович, Вовк Андрій Іванович, Танчук Всеволод Юлійович, Кононець Людмила Анатоліївна
Формула / Реферат
Застосування 5,11,17,23-тетракис[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідроксикалікс[4]арену як інгібітора протеїнтирозинфосфатази:
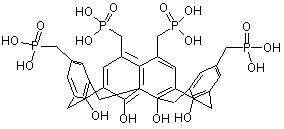 .
.
Текст
Застосування 5,11,17,23-тетракис[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідроксикалікс[4]арену як інгібітора протеїнтирозинфосфатази: O OH HO O P P O O OH HO HO P P OH HO OH UA (21) u200907036 (22) 06.07.2009 (24) 10.03.2010 (46) 10.03.2010, Бюл.№ 5, 2010 р. (72) КОНОНЕЦЬ ЛЮДМИЛА АНАТОЛІЇВНА, ВОВК АНДРІЙ ІВАНОВИЧ, ТАНЧУК ВСЕВОЛОД ЮЛІЙОВИЧ, ДРАПАЙЛО АНДРІЙ БОГДАНОВИЧ, КАЛЬЧЕНКО ВІТАЛІЙ ІВАНОВИЧ, КУХАР ВАЛЕРІЙ ПАВЛОВИЧ (73) ІНСТИТУТ БІООРГАНІЧНОЇ ХІМІЇ ТА НАФТОХІМІЇ НАН УКРАЇНИ, ІНСТИТУТ ОРГАНІЧНОЇ ХІМІЇ НАН УКРАЇНИ 2 (19) 1 3 48049 фосфонової кислоти (фосфонат) здатна облаштуватися в активний центр ферменту, спричиняючи його інгібування. Встановлено, що деякі фторовані похідні фосфонових кислот є ефективними інгібіторами протеїнтирозинфосфатази 1В [21, 23, 24]. Серед вивчених фосфороорганічних інгібіторів протеїнтирозинфосфатази з Йерсинії слід відзначити бензилфосфонову кислоту [25] та ряд арилоксиметано- і арилоксиетанофосфонових кислот [23]. Однак вплив похідних фосфонових кислот [23, 25] на активність цього ферменту був незначним і характеризувався константами інгібування, що знаходяться в мілімолярному діапазоні. Інгібуючий вплив 5,11,17,23-тетракіс[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідроксикалікс[4]арену (калікс[4]арентетракісметилфосфонової кислоти) (А) на активність протеїнтирозинфосфатаз раніше не досліджувався. Структурно подібною до калікс [4] арентетракісметилфосфонової кислоти (А) є бензилфосфонова кислота (Б). Ця подібність обумовлена наявністю як метиленфосфонатних, так і фенільних фрагментів в стуктурі сполук (А) і (Б). Проте у випадку сполуки (А) метиленфосфонатний фрагмент закріплено на макроциклічній платформі, що дозволяло очікувати покращення її інгібуючої здатності стосовно протеїнтирозинфосфатази, оскільки відомо, що бісметиленбісфосфонатні макроциклічні інгібітори були досить ефективними по відношенню до лужної фосфатази [26, 27] або Na+, К+-АТР-ази [28]. O OH HO O P P O O OH HO HO P P OH HO OH OH OH OH HO (A) O OH P OH (B) Завданням корисної моделі було дослідження можливості застосування 5,11,17,23тетракіс[(дигідроксифосфорил)метил]-25,26,27,28тетрагідроксикалікс[4]арену (А) як інгібітора протеїнтирозинфосфатази. Вивчення інгібуючого впливу сполуки (А) на активність протеїнтирозинфосфатази з Йерсинії виконано у відділі механізмів біоорганічних реакцій Інституту біоорганічної хімії НАН України. Калікс[4]арентетракісметилфосфонову кислоту (А), що була необхідна для проведення досліджень, синтезовано у відділі фосфоранів Інституту органічної хімії НАН України. Поставлене завдання досягається встановленням інгібуючого впливу 5,11,17,23 4 тетракіс[(дигідроксифосфорил)метил]-25,26,27,28тетрагідроксикалікс[4]арену (А) на активність протеїнтирозинфосфатази з Yersinia enterocolitica, експресованої в Е. соlі (Yop51*) [29]. Цей фермент характеризується високою гомологічністю з еукаріотичним сімейством протеїнтирозинфосфатаз. Ідея винаходу полягає в тому, що інгібуюча дія синтетичного похідного метилфосфонової кислоти на активність протеїнтирозинфосфатази з Йерсинії значно зростає завдяки ковалентному закріпленню чотирьох метилфосфонатних фрагментів на верхньому ободі калікс[4]арену. При цьому важливими властивостями макроциклічного калікс[4]арену може бути його комплексоутворення з іонами металів або амінокислотними залишками білків [30] та здатність проникати через біологічні мембрани [31]. В результаті експериментального дослідження з'ясувалося, що 5,11,17,23-тетракіс[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідроксикалікс[4]арен (А) інгібує активність протеїнтирозинфосфатази (Yop51*) значно більшою мірою, ніж бензилфосфонова кислота (Б). Кількісна оцінка впливу калікс[4]арентетракісметилфосфонової кислоти (А) на активність протеїнтирозинфосфатази (Yop51*) базується на визначенні значення IC50 (значення концентрації інгібітора, що спричиняло 50% зниження активності ферменту). Отримані результати свідчать, що за умов експериментальних дослідів значення IC50 калікс[4]арентетракісметилфосфонової кислоти (А) складає 1,6мкМ (довірчий інтервал при Р=0,95 знаходиться в межах 1,3мкМ - 1,9мкМ). При 4мМ концентрації n-нітрофенілфосфату як субстрату і Кm=2,39мМ отримане значення ІС50 відповідає константі конкурентного інгібування, що дорівює 0,60мкМ. Значення константи інгібування протеїнтирозинфосфатази з Йерсинії бензилфосфоновою кислотою (Б) дорівнює 5мМ (це значення наведено в роботі [25]). Порівняння констант свідчить, що інгібування калікс[4]арентетракісметилфосфоновою кислотою (А) є приблизно на чотири порядки ефективнішим, ніж інгібування бензилфосфоновою кислотою (Б). Таким чином, калікс[4]арентетракісметилфосфонова кислота (А) є інгібітором протеїнтирозинфосфатази (Yop51*) з ІС50 в мікромолярному діапазоні значень. Калікс[4]арентетракісметилфосфонова кислота (А) може знайти застосування в біології, фармакології і медицині при дослідженні інгібіторів протеїнтирозинфосфатаз та створенні нових лікарських засобів. Винахід ілюструється наступним прикладом. Приклад 1. Калікс[4]арентетракісметилфосфонову кислоту (А) було синтезовано як описано раніше [32]. Препарат рекомбінантної протеїнтирозинфосфатази з Yersinia enterocolitica (Yop51*) з масою 51kDa, отриманий шляхом експресії в Е. соlі (продукт Yop51 гена, з C235R мутацією) [29], був придбаний у фірми "Sigma". Підготовлений до роботи фермент (Yop51*) зберігався при 0°С в середовищі з 50%-ним гліцерином та 50мМ HEPES-буфером (рН7,0), 100мМ NaCI, 20mM EDTA, 50mM DTT, 0,01% Brij-35. Реакційна суміш вміщувала 0,05M BISTRIS буфер 5 (рН6,5), 70mM NaCI, 0,005% Brij-35, 0,4мМ EDTA, 1,0mM DTT та 4мМ n-нітрофенілфосфат як штучний субстрат. Інгібітор (А) був попередньо розчинений в системі диметилсульфоксид - вода. Вміст диметилсульфоксиду в реакційній суміші був 0,4об.%. Суміш термостатували 5хв при 30°С. Реакцію розпочинали додаванням розчину ферменту (концентрація в реакційній суміші - 10нМ). Кінетичні експерименти проводили за умов та при концентраціях інгібітора, що дозволяють фіксувати початкову швидкість накопичення nнітрофенолу. Утворення n-нітрофенолу внаслідок ферментативного гідролізу n-нітрофенілфосфату вимірювали за зростанням оптичної густини реакційної суміші при 410nm, використовуючи молярний коефіцієнт абсорбції n-нітрофенолу 18300М-1cm -1. Залишкову активність ферменту оцінювали в процентах до активності ферменту в дослідах без інгібітора. Використовували середнє значення трьох вимірювань та обраховували стандартну похибку. Для визначення значення ІС50 калікс[4]арентетракісметилфосфонової кислоти (А) було вивчено залежність залишкової активності протеїнтирозинфосфатази з Йерсинії (Yop51*) від концентрації інгібітора (0,25мкМ, 0,5мкМ, 1,0мкМ, 5,0мкМ та 10,0мкМ). Величина ІС50 відповідала концентрації інгібітора, яка спричиняла зниження активності ферменту на 50%. Активність ферменту розраховували з початкової швидкості гідролізу nнітрофенілфосфату (початкова концентрація 4мМ) при фіксованій концентрації ферменту. Константу Міхаеліса (Кm) визначали із залежності початкової швидкості ферментативної реакції від концентрації субстрату в обернених координатах ЛайнуівераБерка. За умов дослідів Кm =2,38±0,04mM. Фіг. (Залежність залишкової активності протеїнтирозинфосфатази з Йерсинії (Yop51*) від концентрації калікс[4]арентетракісметилфосфонової кислоти) демонструє інгібування при різних концентраціях калікс[4]арентетракісметилфосфонової кислоти (А) в реакційній суміші. Видно, що зі збільшенням концентрації калікс[4]арентетракісметилфосфонової кислоти до 10мкМ інгібування складає 81%. Результати свідчать про те, що синтетичний макроцицлічний фосфонат конкурує з субстратом за зв'язування в активному центрі ферменту, а спорідненість протеїнтирозинфосфатази до інгібітора значно перевищує спорідненість до nнітрофенілфосфату. Значення ІС50 розраховано за допомогою програми GraphPad Prism 5.01 із залежності проценту інгібування від логарифму концентрації інгібітора. Згідно виконаних розрахунків lg(IC50)=0,199±0,087, що відповідає значенню IC50, рівному 1,6мкМ з довірчими інтервалами в межах від 1,3мкМ до 1,9мкМ при Р=0,95. Джерела інформації: 1. Vetter S.W., Zhang Z.-Y. Probing the Phosphopeptide Specificities of Protein Tyrosine Phosphatases, SH2 and PTB Domains with Combinatorial Library Methods // Curr. Protein and Peptide Science. - 2002. - Vol.3, N 4. - P.365-397. 2. Zhang Z.-Y. Functional studies of protein tyrosine phosphatases with chemical approaches // 48049 6 Biochim. Biophys. Acta. - 2005. - Vol.1754, N1-2. P.100-107. 3. Zhang Z.-Y. Protein tyrosine phosphatases: prospects for therapeutics // Curr. Opin. Chem. Biol. 2001. - Vol.5, N1. - P.416-423. 4. Guan K.L., Dixon J.E. Protein tyrosine phosphatase activity of an essential virulence determinant in Yersinia // Science. - 1990. - Vol. 249 (4968). - P.553-556. 5. Cornells G.R. Molecular and cell biology aspects of plague // Proc. Natl. Acad. Sci. USA. 2000. - Vol.97, N 16. - P.8778-8783. 6. Bliska J.B., Guan K.L., Dixon J.E., Falkow S. Tyrosine phosphate hydrolysis of host proteins by an essential Yersinia virulence determinant // Proc. Natl. Acad. Sci. USA. - 1991. - Vol.88, N4. - P.1187-1191. 7. Black D.S., Montagna L.G., Zitsmann S., Bliska J.B. Identification of an amino-terminal substrate-binding domain in the Yersinia tyrosine phosphatase that is required for efficient recognition of focal adhesion targets // Моl. Microbiol. - 1998. Vol.29, N5. - P.1263-1274. 8. Black D.S. Marie-Cardine A., Schraven В., Bliska J.B. The Yersinia tyrosine phosphatase YopH targets a novel adhesion-regulated signalling complex in macrophages // Cell. Microbiol. - 2000. - Vol.2, N5. - P.401-414. 9. Black D.S., Bliska J.B. Identification of p130Cas as a substrate of Yersinia YOPH (YOP51), a bacterial protein tyrosine phosphatase that translocates into mammalian cells and targets focal adhesions // EMBO J. - 1997. - Vol.16, N10. - P.2730-2744. 10. Puerta M.L., Trinidad A.G., Rodriguez M.C., Bogetz J., Crespo M.S., Mustelin Т., Alonso A., Bayon Y. Characterization of New Substrates Targeted By Yersinia Tyrosine Phosphatase YopH // PLoS ONE (www.plosone.org). - 2009. - Vol.4, N2. P.4431. 11. Jayaraman K.S. Anti-plague efforts hindered by lack of recent experience // Nature. - 1994. Vol.371 (6497). - P.467. 12. Hawley R.J., Eitzen E.M. Biological weapons a primer for microbiologists // Annu. Rev. Microbiol. 2001. - Vol.55. - P.235-253. 13. Tautz L., Mustelin T. Strategies for developing protein tyrosine phosphatase inhibitors // Methods. - 2007. - Vol.42, N3. - P.250-260. 14. Xie J., Seto C.T. A two stage click-based library of protein tyrosine phosphatase inhibitors // Bioorg. Med. Chem. - 2007. - Vol.15, N1. - P.458-473. 15. Lee K., Gao Y., Yao Z.-J., Phan J., Wu L., Liang J., Waugh D.S., Zhang Z.-Y., Burke T.R., Jr. Tripeptide inhibitors of Yersinia protein-tyrosine phosphatase // Bioorg. Med. Chem. Lett. - 2003. Vol.13, N15. - P.2577-2581. 16. Tautz L., Bruckner S., Sareth S., Alonso A., Bogetz J., Bottini N., Pellecchia M., Mustelin T. Inhibition of Yersinia tyrosine phosphatase by furanyl salicylate compounds // J. Biol. Chem. - 2005. Vol.280, N10. - P.9400-9408. 17. Maccari R., Paoli P., Ottana R., Jacomelli M., Ciurleo R., Manao G., Steindl Т., Langer Т., Vigorita M. G., Camici G. 5-Arylidene-2,4-thiazolidinediones as inhibitors of protein tyrosine phosphatases // 7 48049 Bioorg. Med. Chem. - 2007. - Vol.15, N15. - P.51375149 18. Opas E.E., Rutledge S.J., Golub E., Stern A., Zimoio Z., Rodan G.A., Schmidt A. Alendronate inhibition of protein-tyrosine-phosphatase-meg1 // Biochem. Pharmacol. - 1997. - Vol.54, N6. - P.721727. 19. Skorey K., Ly H.D., Kelly J., Hammond M., Ramachandran C, Huang Z., Gresser M.J., Wang Q. How Does Alendronate Inhibit Protein-tyrosine Phosphatases? // J. Biol. Chem. - 1997. - Vol.272, N36. - P. 22472-22480. 20. Chen Y.T., Seto C.T. Divalent and trivalent alpha-ketocarboxylic acids as inhibitors of protein tyrosine phosphatases // J. Med. Chem. - 2002. Vol.45, N18. - P.3946-3952. 21. Zhang S., Zhang Z.-Y. PTP1B as a drug target: recent developments in PTP1B inhibitor discovery // Drug Discovery Today. - 2007. - Vol.12, N. 9/10. - P.373-381. 22. Hu X., Stebbins C.E. Molecular docking and 3D-QSAR studies of Yersinia protein tyrosine phosphatase YopH inhibitors // Bioor. Med. Chem. 2005. - Vol.13, N4. - P.1101-1109. 23. Iyer S., Younker J.M., Czyryca P.G., Hengge A.C. A nonhydrolyzable analogue of phosphotyrosine, and related aryloxymethano- and aryloxyethanophosphonic acids as motifs for inhibition of phosphatases // Bioorg. Med. Chem. Lett. - 2004. Vol.14, N23. - P.5931-5935. 24. Holmes С.P., Li X., Pan Y., Xu C, Bhandari A., Moody С.M., Miguel J.A., Ferla S.W., De Francisco M.N., Frederick B.T., Zhou S., Macher N., Jang L., Irvine J.D., Grove J.R. PTP1B inhibitors: Synthesis and evaluation of difiuoromethylenephosphonate bioisosteres on a sulfonamide scaffold // Bioorg. Med. Chem. Lett. - 2008. - Vol.18, N8. - P.2719-2724. Комп’ютерна верстка Л. Ціхановська 8 25. Sun J.-P., Wu L., Fedorov A. A., Almo S. C, Zhang Z.-Y. Crystal Structure of the Yersinia Proteintyrosine Phosphatase YopH Complexed with a Specific Small Molecule Inhibitor // J. Biol. Chem. 2003. - Vol.278, N35. - P.33392-33399. 26. Vovk A., Kalchenko V., Cherenok S., Kukhar V., Muzychka O., Lozynsky M. Calix[4]arene methylenebisphosphonic acids as calf intestine alkaline phosphatase inhibitors // Org. Biomol. Chem. - 2004. - Vol.2, N21. - P.3162-3166. 27. Cherenok S., Vovk A., Muravyova I., Shivanyuk A., Kukhar V., Lipkowski J., Kalchenko V. Calix[4]arene a-aminophosphonic acids: asymmetric synthesis and enantioselective inhibition of an alkaline phosphatase // Org. Lett. - 2006. - Vol.8, N4. - P.549-552. 28. Векліч Т.О., Костерін CO., Родік Р.В., Черенок CO., Бойко В.I., Кальченко B.I. Вплив калік+ + саренфосфонових кислот на Nа ,К -АТР-азну активність у плазматичній мембрані гладеньком'язових клітин // Укр. біохім. журн. 2006. - Т.78, №1. - С.70-86. 29. Zhang Z.-Y., Clemens J.C, Schubert H.L., Stuckey J.A., Fischer M.W.F., Hume D.M., Saper M.A., Dixon J.E. Expression, purification, and physicochemical characterization of a recombinant Yersinia protein tyrosine phosphatase // J. Biol. Chem. - 1992. - Vol.267, N33. - P.23759-23766. 30. Calixarenes 2001; Asfari, Z., Bohmer, V., Harrowfield, J., Vicens, J., Eds.; Kluwer Academic Publishers: Dordrecht, 2001. 31. Lalor R., Baillie-Johnson H., Redshaw C, Matthews S. E., Mueller A. Cellular uptake of a fluorescent calix[4]arene derivative // J. Am. Chem. Soc. - 2008. - Vol.130, N 10. - P.2892-2893. 32. Almi M., Arduini A., Casnati A., Pochini A., Ungaro R. Chloromethylation of calixarenes and synthesis of new water soluble macrocyclic hosts // Tetrahedron. - 1989. - Vol.45, N7. - P.2177-2182. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of 5,11,17,23-tetrakis[(dihydroxyphosphoryl)methyl]-25,26,27,28-tetrahydroxycalix[4]arene as protein tyrosine phosphatase inhibitor
Автори англійськоюKononets Liudmyla Anatoliivna, Vovk Andrii Ivanovych, Tanchuk Vsevolod Yuliiovych, Drapailo Andrii Bohdanovych, Kalchenko Vitalii Ivanovych, Kukhar Valerii Pavlovych
Назва патенту російськоюПрименение 5,11,17,23-тетракис[(дигидроксифосфорил)метил]-25,26,27,28-тетрагидроксикаликс[4]арена как ингибитора протеинтирозинфосфатазы
Автори російськоюКононец Людмила Анатолиевна, Вовк Андрей Иванович, Танчук Всеволод Юлиевич, Драпайло Андрей Богданович, Кальченко Виталий Иванович, Кухар Валерий Павлович
МПК / Мітки
МПК: C07C 15/00, A61K 31/662, C12N 9/12
Мітки: інгібітора, застосування, протеїнтирозинфосфатази, 5,11,17,23-тетракис[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідроксикалікс[4]арену
Код посилання
<a href="https://ua.patents.su/4-48049-zastosuvannya-5111723-tetrakisdigidroksifosforilmetil-25262728-tetragidroksikaliks4arenu-yak-ingibitora-protentirozinfosfatazi.html" target="_blank" rel="follow" title="База патентів України">Застосування 5,11,17,23-тетракис[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідроксикалікс[4]арену як інгібітора протеїнтирозинфосфатази</a>
Попередній патент: Рідинна система охолодження потужного електронного компонента
Наступний патент: Застосування 5,11,17,23-тетракис[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідрокситіакалікс[4]арену як інгібітора протеїнтирозинфосфатази
Випадковий патент: Пристрій для впливу оптичного випромінювання in vitro на патогенні бактерії








