Застосування 5,17-біс[біс(дигідроксифосфорил)метил]-25,27-дипропокси-26,28-дигідроксикалікс[4]арену як інгібітора протеїнтирозинфосфатази
Номер патенту: 45551
Опубліковано: 10.11.2009
Автори: Танчук Всеволод Юлійович, Кононець Людмила Анатоліївна, Вовк Андрій Іванович, Черенок Сергій Олексійович, Кухар Валерій Павлович, Кальченко Віталій Іванович
Формула / Реферат
Застосування 5,17-біс[біс(дигідроксифосфорил)метил]-25,27-дипропокси-26,28-дигідроксикалікс[4]арену як інгібітора протеїнтирозинфосфатази:
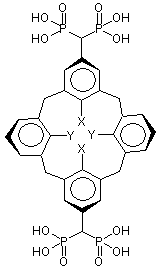 ,
,
Х=ОН, Y=OCH2CH2CH3.
Текст
Застосування 5,17біс[біс(дигідроксифосфорил)метил]-25,27дипропокси-26,28-дигідроксикалікс[4]арену як інгібітора протеїнтирозинфосфатази: 2 3 45551 4 інфекції через природні джерела [11] або внаслідок можливої терористичної атаки [12]. Встановлено, що інгібіторами протеїнтирозинфосфатаз є деякі пептидні [13], фуранільні [14] та інші сполуки [15, 16]. Дані з літературних джерел вказують на те, що інгібітори з двома або більшою кількістю аніонних груп демонструють більшу спорідненість до протеїнтирозинфосфатаз, в тому числі до ферменту з Йерсинії, порівняно з відповідними моноаніонними сполуками [15, 17]. Нами раніше було показано, що закріплення бісфосфонатних груп на платформі кал ікс [4] арену приводить до зростання інгібуючої здатності по відношенню до лужних фосфатаз [18,19]. Перевагою таких сполук може бути їх здатність утворювати комплекси з іонами металів або амінокислотними залишками білків [21] та здатність проникати через біологічні мембрани [22]. Встановлено, що 5,17біс[біс(дигідроксифосфорил)метил]-25,27Завданням корисної моделі було дослідження дипропокси-26,28-дигідроксикалікс[4]арен (А) можливості застосування 5,17виявляє високу інгібуючу здатність до лужної біс[біс(дигідроксифосфорил)метил]-25,27фосфатази з кишок теляти [18] та є селективним дипропокси-26,28-дигідроксикалікс[4]арену (А) інгібітором Na+, К+-АТР-ази плазматичної (калікс[4]аренбісметиленбісфосфонової кислоти) мембрани [20]. Проте ефекти фосфорильованих як інгібітора протеїнтирозинфосфатази з Йерсинії. макроциклів на активність Вивчення інгібуючого впливу протеїнтирозинфосфатаз раніше не вивчались. калікс[4]аренбісметиленбісфосфонової кислоти (А) Сполукою, яку можна розглядати як на активність протеїнтирозинфосфатази з Йерсинії найближчий аналог для фосфорильованого виконано у відділі механізмів біоорганічних реакцій калікс[4]арену (А), є алендронат (4-аміно-1Інституту біоорганічної хімії НАН України. гідроксибутиліден-1,1-бісфосфонова кислота Б), Необхідну для проведення досліджень який здатний інгібувати деякі калікс[4]аренбісметиленбісфосфонову кислоту протеїнтирозинфосфатази (РТРσ, РТРε,) [23]. Слід синтезовано у відділі фосфоранів Інституту зазначити, що при фізіологічних значеннях рН органічної хімії НАН України. фосфорильний залишок вихідної Поставлене завдання досягається фосфороорганічної сполуки, в тому числі встановленням інгібуючого впливу 5,17фосфонової кислоти, є іонізованим і може біс[біс(дигідроксифосфорил)метил]-25,27перебувати у формі моноаніону або діаніону, що дипропокси-26,28-дигідроксикалікс[4]арену (А) на дозволяє називати біоактивну сполуку відповідним активність протеїнтирозинфосфатази з Yersinia фосфонатом. Алендронат належить до групи enterocolitica, експресованої в Е. coli (Yop51*, лікарських речовин - синтетичних бісфосфонатів - і продукт Yop51 гену з C235R мутацією) [25]. Цей використовується як терапевтичний засіб для фермент масою 51 kDa характеризується високою лікування остеопорозу, хвороби Паджета та інших гомологічністю з еукаріотичним сімейством захворювань. В деяких випадках інгібування протеїнтирозинфосфатаз. активності протеїнтирозинфосфатаз В результаті експериментального дослідження алендронатом корелювало з інгібуванням in vitro з'ясувалося, що 5,17процесів утворення остеокластів та резорбції біс[біс(дигідроксифосфорил)метил]-25,27кісток. На прикладі ферментів РТР1В, CD45 було дипропокси-26,28-дигідроксикалікс[4]арен (А) показано, що механізм інгібуючої дії алендронату інгібує активність протеїнтирозинфосфатази може бути незворотним і супроводжується (Yop51*) значно більшою мірою, ніж подібний за окисненням залишку цистеїну а активному центрі будовою алендронат (Б). Так, залишкова ферменту з залученням іонів перехідних металів і активність протеїнтирозинфосфатази в активних форм кисню [24]. присутності 5мкМ макроциклічного метиленбісфосфонату (А) дорівнює 49±8%, тоді як алендронат (Б) за аналогічних умов в концентрації 5мкМ не впливає на активність цього ферменту. Кількісна оцінка впливу калікс[4]аренбісметиленбісфосфонової кислоти на активність протеїнтирозинфосфатази (Yop51*) базується на визначенні значення ІС50 (значення концентрації інгібітора, що спричиняє 50% зниження активності ферменту). Отримані результати свідчать, що для калікс[4]аренбісметиленбісфосфонової кислоти (А) 5 45551 6 за умов дослідів ІС50 дорівнює 4,3мкМ (довірчий без врахування подальших незворотних інтервал при Р=0,95 в межах 3,5мкМ - 5,3мкМ). окиснювальних перетворень. Таким чином, встановлено, що Утворення n-нітрофенолу внаслідок калікс[4]аренбісметиленбісфосфонова кислота (А) ферментативного гідролізу n-нітрофенілфосфату виявляє інгібуючу здатність по відношенню до вимірювали за зростанням оптичної густини протеїнтирозинфосфатази (Yop51*) з ІС50 в реакційної суміші при 410nm, використовуючи мікромолярному діапазоні значень. молярний коефіцієнт абсорбції n-нітрофенолу Калікс[4]аренбісметиленбісфосфонова кислота (А) 18300 М-1 cm-1. Залишкову активність ферменту може знайти застосування в біологи, фармакології оцінювали в процентах до активності ферменту в і медицині при дослідженні інгібіторів дослідах без інгібітора. Використовували середнє протеїнтирозинфосфатаз та створенні нових значення трьох вимірювань та обраховували лікарських засобів. стандартну похибку. Винахід ілюструється наступними прикладами. Одержані результати свідчать про те, що за Приклад 1. умов дослідів залишкова активність Калікс[4]аренбісметиленбісфосфонову кислоту протеїнтирозинфосфатази з Йерсинії в присутності (А) було синтезовано згідно раніше розробленого 5мкМ макроциклічного метиленбісфосфонату (А) методу [18]. Препарат рекомбінантної складає 49±8%, тоді як алендронат (Б) в протеїнтирозинфосфатази з Йерсинії (Yop51*) був концентрації 5мкМ не впливає на придбаний у фірми "Sigma". Підготовлений до протеїнтирозинфосфатазу (залишкова активність роботи фермент зберігався при 0°С в середовищі ферменту 101±3%). Тобто, інгібуюча здатність з 50%-ним гліцерином та 50мМ HEPES-буфером калікс[4]аренбісметиленбісфосфонової кислоти (А) (рН 7,0), 100мМ NaCI, 20mM EDTA, 50mМ DTT, перевищує інгібуючі властивості її структурного 0,01% Brij-35. Реакційна суміш вміщувала 0,05 М аналога (Б). BISTRIS буфер (рН 6,5), 70mМ NaCI, 0,005% BrijПриклад 2. 35, 0,4тМ EDTA, 1,0 тМ DTT та 4мМ nДля визначення значення IC50 нітрофенілфосфат як штучний субстрат. За умов калікс[4]аренбісметиленбісфосфонової кислоти (А) дослідів значення Кm складало 2,3±0,3mМ. було вивчено залежність залишкової активності Інгібітор (А) або (Б) був попередньо розчинений в протеїнтирозинфосфатази з Йерсинії (Yop51*) від системі диметилсульфоксид - вода і його концентрації інгібітора (0,4мкМ, 0,8мкМ, 2,0мкМ, концентрація в реакційній суміші складала 5мкМ. 2,5мкМ, 4,0мкМ 5,0мкМ та 6,0мкМ). Величина ІС50 Вміст диметилсульфоксиду в реакційній суміші був відповідала концентрації інгібітора, яка 0,4об. %. Суміш термостатували 5хв при 30°С. спричиняла зниження активності ферменту на Реакцію розпочинали додаванням розчину 50%. Активність ферменту розраховували з ферменту. початкової швидкості гідролізу nВ попередніх дослідах було встановлено, що нітрофенілфосфату (початкова концентрація 4мМ) вплив макроциклічного метиленбісфосфонату (А) при фіксованій концентрації ферменту. Константу на активність протеїнтирозинфосфатази залежить Міхаеліса (Кm) визначали із залежності початкової від концентрації EDTA і DTT і може швидкості ферментативної реакції від концентрації супроводжуватись інактивацією ферменту. Перебіг субстрату в координатах Лайнуівера-Берка. Фіг.1 необоротного інгібування залежить також від демонструє залежність інгібуючого впливу концентрації інгібітора. Такі ж особливості дії калікс[4]аренбісметиленбісфосфонової кислоти (А) інгібітора відомі у випадку інгібування від її концентрації в реакційній суміші. Видно, що зі алендронатом (Б) [24]. Припускається, що збільшенням концентрації інактивація спричинена вільнорадикальним калікс[4]аренбісметиленбісфосфонової кислоти до окисненням органічних сполук в реакційній суміші і 6мкМ інгібування ферменту складає 60%. тому може ініціюватися іонами перехідних металів Результати свідчать про те, що синтетичний або ж високою концентрацією іонів кальцію, що каліксаренбісметилбісфосфонат конкурує з витісняє іони перехідних металів з їх комплексів з субстратом за зв'язування в активному центрі, а EDTA [24]. Отже, завдяки наявності спорідненість протеїнтирозинфосфатази до метиленбісфосфонатних фрагментів інгібітора значно перевищує спорідненість калікс[4]аренбісметиленбісфосфонова кислота (А) ферменту до n-нітрофенілфосфату і алендронат (Б) характеризуються подібним (Km=2,38±0,04мМ). Значення ІС50 (4,3мкМ) механізмом дії, що включає оборотне утворення розраховано за допомогою програми GraphPad комплексу з ферментом, а також подальше Prism 5.01 із залежності проценту інгібування від окиснення залишку цистеїну за певних умов. логарифму концентрації інгібітора. При цьому З огляду на вищенаведені дані, для log(IC50)=0,63±0,09. Довірчі інтервали (в межах порівнянння інгібуючої здатності 3,5мкМ - 5,3мкМ) подано при Р=0,95. калікс[4]аренбісметиленбісфосфонової кислоти (А) Фіг. 1. Залежність залишкової активності і алендронату (Б) кінетичні експерименти протеїнтирозинфосфатази з Йерсинії (Yop51*) від проводили за умов та при концентраціях інгібітора, концентрації що дозволяли фіксувати початкову швидкість калікс[4]аренбісметиленбісфосфонової кислоти накопичення n-нітрофенолу. В цьому випадку (А). Значення ІС50 для вплив синтетичного метиленбісфосфонатного калікс[4]аренбісметиленбісфосфонової кислоти (А) інгібітора характеризує його спорідненість до складає 4,3мкМ (довірчий інтервал при Р=0,95 в ферменту, а механізм дії включає оборотне межах 3,5мкМ - 5,3мкМ). Тобто, сполука (А) комплексоутворення в активному центрі ферменту 7 45551 8 виявляє властивості інгібітора 14. Tautz L., Bruckner S., Sareth S., Alonso A., протеїнтирозинфосфатази. Bogetz J., Bottini N., Pellecchia M., Mustelin T. Література: Inhibition of Yersinia tyrosine phosphatase by furanyl 1. Zhang Z.-Y. Functional studies of protein salicylate compounds // J. Biol. Chem. - 2005. - Vol. tyrosine phosphatases with chemical approaches // 280, N 10. - P. 9400-9408. Biochim. Biophys. Acta. - 2005. - Vol. 1754, N 1-2. 15. Hu X., Stebbins C.E. Molecular docking and P. 100-107. 3D-QSAR studies of Yersinia protein tyrosine 2. Zhang Z.-Y. Protein tyrosine phosphatases: phosphatase YopH inhibitors // Bioor. Med. Chem. prospects for therapeutics // Curr. Opin. Chem. Biol. 2005. - Vol. 13, N 4. - P. 1101-1109. 2001. - Vol. 5, N 4. - P. 416-423. 16. Chen Y.T., Seto C.T. Divalent and trivalent 3. Tautz L., Mustelin T. Strategies for developing alpha-ketocarboxylic acids as inhibitors of protein protein tyrosine phosphatase inhibitors // Methods. tyrosine phosphatases // J. Med. Chem. - 2002. Vol. 2007. - Vol. 42, N 3. - P. 250-260. 45, N 18. - P. 3946-3952. 4. Xie J., Seto C.T. A two stage click-based 17. Zhang S., Zhang Z.-Y.. PTP1B as a drug library of protein tyrosine phosphatase inhibitors // target: recent developments in PTP1B inhibitor Bioorg. Med. Chem. - 2007. - Vol. 15, N 1. - P. 458discovery // Drug Discovery Today. - 2007. - Vol. 12, 473. N. 9/10. - P. 373-381. 5. Guan K.L., Dixon J.E. Protein tyrosine 18. Vovk A., Kalchenko V., Cherenok S., Kukhar phosphatase activity of an essential virulence V., Muzychka O., Lozynsky M. Calix[4]arene determinant in Yersinia // Science. - 1990. - Vol. 249 methylenebisphosphonic acids as calf intestine (4968). - P. 553-556. alkaline phosphatase inhibitors // Org. Biomol. Chem. 6. Cornelis G.R. Molecular and cell biology - 2004. - Vol. 2, N 21. - P. 3162-3166. aspects of plague // Proc. Natl. Acad. Sci. USA. 19. Cherenok S., Vovk A., Muravyova I., 2000. - Vol. 97, N 16. - P. 8778-8783. Shivanyuk A., Kukhar V., Lipkowski J., Kalchenko V. 7. Bliska J.B., Guan K.L., Dixon J.E., Falkow S. Calix[4]arene α-aminophosphonic acids: asymmetric Tyrosine phosphate hydrolysis of host proteins by an synthesis and enantioselective inhibition of an essential Yersinia virulence determinant // Proc. Natl. alkaline phosphatase // Org. Lett. - 2006. - Vol. 8, N 4. Acad. Sci. USA. - 1991. - Vol. 88, N 4. - P. 1187- P. 549-552. 1191. 20. Векліч Т.О., Костерін CO., Родік P.В., 8. Black D.S., Montagna L.G., Zitsmann S., Черенок CO., Бойко В.I., Кальченко B.I. Вплив Bliska J.B. Identification of an amino-terminal каліксаренфосфонових кислот на Ыа+,К+-АТРsubstrate-binding domain in the Yersinia tyrosine азну активність у плазматичній мембрані phosphatase that is required for efficient recognition гладеньком'язових клітин // Укр. біохім. журн. of focal adhesion targets // Моl. Microbiol. - 1998. 2006. - Т. 78, № 1. - c/ 70-86. Vol. 29, N 5. - P.1263-1274. 21. Calixarenes 2001; Asfari, Z., Bohmer, V., 9. Black D.S. Marie-Cardine A., Schraven В., Harrowfield, J., Vicens, J., Eds.; Kluwer Academic Bliska J.B. The Yersinia tyrosine phosphatase YopH Publishers: Dordrecht, 2001. targets a novel adhesion-regulated signalling complex 22. Lalor R., Baillie-Johnson H., Redshaw C, in macrophages // Cell. Microbiol. - 2000. - Vol. 2, N Matthews S.E., Mueller A. Cellular uptake of a 5. - P. 401-414. fluorescent calix[4]arene derivative // J. Am. Chem. 10. Black D.S., Bliska J.B. Identification of Soc. - 2008. - Vol. 130, N 10. - P. 2892-2893. pl30casas a substrate of Yersinia YOPH (YOP51), a 23. Opas E.E., Rutledge S.J., Golub E., Stern A., bacterial protein tyrosine phosphatase that Zimoio Z., Rodan G.A., Schmidt A. Alendronate translocates into mammalian cells and targets focal inhibition of protein-tyrosine-phosphatase-megl // adhesions // EMBO J. - 1997. - Vol. 16, N 10. - P. Biochem. Pharmacol. - 1997. - Vol. 54, N 6. - P. 7212730-2744. 727. 11. Jayaraman K.S. Anti-plague efforts hindered 24. Skorey K., Ly H.D., Kelly J., Hammond M., by lack of recent experience // Nature. - 1994. - Vol. Ramachandran C, Huang Z., Gresser M.J., Wang Q. 371 (6497). - P. 467. How Does Alendronate Inhibit Protein-tyrosine 12. Hawley R.J., Eitzen E.M. Biological weapons Phosphatases? // J. Biol. Chem. - 1997. - Vol. 272, N a primer for microbiologists // Annu. Rev. Microbiol. 36. - P. 22472-22480. 2001. - Vol. 55. - P. 235-253. 25. Zhang Z.-Y., Clemens J.C, Schubert H.L., 13. Lee K., Gao Y., Yao Z.-J., Phan J., Wu L., Stuckey J.A., Fischer M.W.F., Hume D.M., Saper Liang J., Waugh D.S., Zhang Z.-Y., Burke T.R., Jr. M.A., Dixon J.E. Expression, purification, and Tripeptide inhibitors of Yersinia protein-tyrosine physicochemical characterization of a recombinant phosphatase // Bioorg. Med. Chem. Lett. - 2003. Yersinia protein tyrosine phosphatase // J. Biol. Vol. 13, N 15. - P. 2577-2581. Chem. - 1992. - Vol. 267, N 33. - P. 23759-23766. 9 Комп’ютерна верстка М. Мацело 45551 Підписне 10 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of 5,17-bis[bis(dihydroxyphosphoryl)methyl]-25,27-dipropoxy-26,28-dihydroxycalix[4]arene as protein tyrosine phosphataze inhibitor
Автори англійськоюKononets Liudmyla Anatoliivna, Vovk Andrii Ivanovych, Tanchuk Vsevolod Yuliiovych, Cherenok Serhii Oleksiiovych, Kalchenko Vitalii Ivanovych, Kukhar Valerii Pavlovych
Назва патенту російськоюПрименение 5,17-бис[бис(дигидроксифосфорил)метил]-25,27-дипропокси-26,28-дигидроксикаликс[4]арена в качестве ингибитора протеинтирозинфосфатазы
Автори російськоюКононец Людмила Анатолиевна, Вовк Андрей Иванович, Танчук Всеволод Юлиевич, Черенок Сергей Алексеевич, Кальченко Виталий Иванович, Кухар Валерий Павлович
МПК / Мітки
МПК: C07C 15/00, C12N 9/12, A61K 31/662
Мітки: 5,17-біс[біс(дигідроксифосфорил)метил]-25,27-дипропокси-26,28-дигідроксикалікс[4]арену, застосування, інгібітора, протеїнтирозинфосфатази
Код посилання
<a href="https://ua.patents.su/5-45551-zastosuvannya-517-bisbisdigidroksifosforilmetil-2527-dipropoksi-2628-digidroksikaliks4arenu-yak-ingibitora-protentirozinfosfatazi.html" target="_blank" rel="follow" title="База патентів України">Застосування 5,17-біс[біс(дигідроксифосфорил)метил]-25,27-дипропокси-26,28-дигідроксикалікс[4]арену як інгібітора протеїнтирозинфосфатази</a>
Попередній патент: Кумулятивний перфоратор
Наступний патент: Спосіб корекції рівня базальної глікемії при алоксановому діабеті
Випадковий патент: Спосіб видобування корисних копалин









