Застосування 5,11,17,23-тетракис[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідрокситіакалікс[4]арену як інгібітора протеїнтирозинфосфатази
Номер патенту: 48050
Опубліковано: 10.03.2010
Автори: Кононець Людмила Анатоліївна, Вовк Андрій Іванович, Кухар Валерій Павлович, Драпайло Андрій Богданович, Танчук Всеволод Юлійович, Кальченко Віталій Іванович
Формула / Реферат
Застосування 5,11,17,23-тетракис[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідрокситіакалікс[4]арену як інгібітора протеїнтирозинфосфатази.
Текст
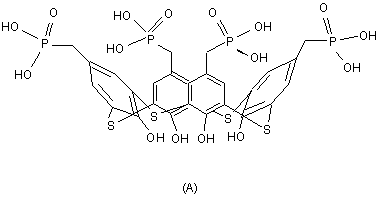
Застосування 5,11,17,23тетракис[(дигідроксифосфорил)метил] 25,26,27,28-тетрагідрокситіакалікс[4]арену як інгібітора протеїнтирозинфосфатази. Корисна модель відноситься до біоорганічної хімії, а саме до пошуку і вивчення біологічно активних сполук і може бути використана в біології, фармакології і медицині. Протеїнтирозинфосфатази забезпечують реалізацію механізмів сигналізації і можуть контролювати ріст, диференціацію, метаболізм, рухливість та інші клітинні функції [1]. В тканинах людини зміни в функціонуванні протеїнтирозинфосфатаз приводять до виникнення деяких поширених хвороб. Зокрема, підвищена активність протеїнтирозинфосфатази 1В асоціюється з розвитком ожиріння і діабету 2 типу [2, 3]. Тому останнім часом все актуальнішим є пошук інгібіторів [4, 5], придатних для можливого використання як лікарських засобів. Протеїнтирозинфосфатаза з Йерсинії характеризується високою гомологічністю з еукаріотичним сімейством протеїнтирозинфосфатаз. Разом з тим, цей фермент є головним фактором токсичності білків YopH, що продукуються патогенними для людини бактеріями Yersinia pestis, Yersinia pseudotuberculosis та Yersinia enterocolitica [6]. Бактерії Йерсинії є збудниками ряду хвороб людини, в тому числі захворювань шлунковокишкового тракту і бубонної чуми [7, 8]. Попадання YopH в люд ські клітини приводить до швидкого дефосфорилювання p130Cas та паксиліну, руйнування фокальних адгезій та інгібування інтегрінопосередкованого бактеріального фагоцитозу [912]. З огляду на це протеїнтирозинфосфатаза YopH розглядається як терапевтична мішень для потенційних антибактеріальних агентів в разі інфекції через занесення з природних джерел [13] або після можливої терористичної атаки [14]. Згідно результатів останніх досліджень; протеїнтирозинфосфатазу з Йерсинії інгібують похідні фурану [15], похідні 5-ариліден-2,4-тіазолідіндіону [16], деякі фосфонати [17, 18], бісфосфонати [19, 20] та інші сполуки [21]. При цьому інгібітори з двома або більшою кількістю аніонних груп демонструють більшу спорідненість до протеїнтирозинфосфатаз порівняно з відповідними моноаніонними сполуками [21-23]. З'ясувалося, що зручною платформою для закріплення біоізостеричних фосфонатних фрагментів можуть бути макроциклічні сполуки - калікс [4] арени. Каліксареновий фрагмент характеризується достатньою конформаційною жорсткістю і здатний забезпечити необхідну просторову орієнтацію біоізостеричних по відношенню до фосфотирозину залишків [24]. Нетоксичність каліксаренів разом зі здатністю до комплек O O O O HO HO OH P HO P P P OH HO S S S OH OH OH HO OH OH S (19) UA (11) 48050 (13) U (A) 3 48050 соутворення з іонами металів або амінокислотними залишками білків [25] та проникністю через біологічні мембрани [26] робить перспективним їх використання для створення біоактивних препаратів, зокрема, інгібіторів ферментів. Закріплення однієї або двох метиленбісфосфонатних груп на платформі калікс[4]арену може значно підвищувати дію потенційного інгібітора лужної фосфатази + + [27, 28] або Na , К -АТР-ази [29]. Тіакалікс [4] арени є новими представниками макроциклічних сполук каліксаренового ряду. Інгібуючий вплив 5,11,17,23-тетракис [(дигідроксифосфорил)метил]-25,26,27,28-тетрагідрокситіакалікс [4] арену тіакалікс [4] арентетракисметилфосфонової кислоти) (А) на активність протеїнтирозинфосфатаз раніше не досліджувався. Разом з тим, відомо, що ця сполука у вигляді натрієвої солі виявляє комплесоутворюючі властивості по відношенню до водорозчинних амінокислот [30] і є інгібітором лужної фосфатази [31]. Наявність чотирьох мостикових атомів сірки в структурі тіакаліксарену замість чотирьох метиленових груп в „класичній" структурі може надавати тіакаліксареновій молекулі нових властивостей [32, 33], в тому числі при її використанні як молекулярної платформи для конструювання функціоналізованих біоізостеричними групами похідних [31]. Тому ми передбачали підвищення інгібуючої дії похідних метилфосфонової кислоти на активність протеїнтирозинфосфатази через закріплення метилфосфонатних фрагментів на верхньому ободі тіакалікс [4] арену. O HO P HO O O O HO OH P P P OH HO S S S OH OH OH OH S HO (A) Структурно подібною до тіакалікс[4]арентетракисметилфосфонової кислоти (А) є бензилфосфонова кислота. Ця подібність обумовлена наявністю як метиленфосфонатних, так і фенільних фрагментів в структурі сполуки (А) і бензилфосфонової кислоти. Однак, інгібування бензилфосфоновою кислотою протеїнтирозинфосфатази з Йерсинії є відносно слабким з константою інгібування 5мМ [17]. Тому можна розглянути наявні в літературі дані щодо інших інгібіторів цього ферменту, базуючись на біоізостеричній відповідності бензилфосфонатного фрагменту до фосфотирозинового залишку субстрату-білка. Однією з подібних до тіакалікс [4] арентетракисметилфосфонової кислоти (А) за будовою якірного фрагменту, що облаштовується в активному центрі протеїнтирозинфосфатази, може бути дифторметиленфосфонова кислота (Б), ковалентно закріплена на оптимізованій для цього ферменту об'ємній трипептидній платформі [34]. Згідно даних літератури [34], сполука (Б) є інгібітором протеїнтирозинфосфатази з Йерсинії та протеїнтирозин 4 фосфататази 1В з IC50 в мікромолярному діапазоні значень, що приблизно в 1000 разів перевищує ефективність бензилфосфонової кислоти. HO O HO F O H2N P F O H N H O H O O N N O O ( Б) Завданням корисної моделі було дослідження можливості застосування 5,11,17,23-тетракис [(дигідроксифосфорил)метил]-25,26,27,28тетрагідрокситіакалікс [4] арену (А) як інгібітора протеїнтирозинфосфатази. Вивчення інгібуючого впливу сполуки (А) на активність протеїнтирозинфосфатази з Йерсинії було виконано у відділі механізмів біоорганічних реакцій Інституту біоорганічної хімії НАН України. Необхідну для проведення досліджень тіакалікс [4] арентетракисметилфосфонову кислоту (А) синтезовано у відділі фосфоранів Інституту органічної хімії НАН України. Поставлене завдання досягається встановленням інгібуючого впливу 5,11,17,23-тетракис [(дигідроксифосфорил)метил] -25,26,27,28тетрагідрокситіакалікс [4] арену (А) на активність протеїнтирозинфосфатази з Yersinia enterocolitica, експресованої в Е.соlі (Yop51*) [35]. За подібністю до фосфотирозинового фрагменту природного субстрату як прототип до запропонованої тіакалікс [4] арентетракисметилфосфонової кислоти (А) можна розглядати дифторметиленфосфонову кислоту (Б). В результаті експериментального дослідження з'ясувалося, що фосфорильований тіакаліксарен (А) інгібує активність протеїнтирозинфосфатази (Yop51*) більшою мірою, ніж відповідна сполука (Б). Кількісна оцінка впливу тіакалікс [4] арентетракисметилфосфонової кислоти (А) на активність протеїнтирозинфосфатази (Yop51*) базується на визначенні значення ІС50 (значення концентрації інгібітора, що спричиняло 50% зниження активності ферменту). Отримані результати свідчать, що за умов дослідів величина ІС50 тіакалікс [4] арентетракисметилфосфонової кислоти (А) складає 0,33 мкМ (довірчий інтервал при Р=0,95 знаходиться в межах 0,20мкМ - 0,54мкМ). Водночас, значення ІС50 дифторметиленфосфонової кислоти (Б) за даними літератури [34] дорівнює 5,2±2,2мкМ Порівняння констант свідчить, що інгібування сполукою (А) є більш ніж на порядок ефективнішим, ніж інгібування сполукою (Б). Таким чином, тіакалікс[4]арентетракисметилфосфонова кислота (А) є інгібітором протеїнтирозинфосфатази (Yop51*) з ІС50 в низькомікромолярному діапазоні значень. 5 Тіакалікс[4]арентетракисметилфосфонова кислота (А) може знайти застосування в галузі біології та фармакології при дослідженні інгібіторів протеїнтирозинфосфатаз та створенні нових лікарських засобів. Корисна модель ілюструється наступним прикладом. Приклад 1 Тіакалікс[4]арентетракисметилфосфонову кислоту (А) було синтезовано як описано раніше [31,33] і досліджено in vitro як інгібітор протеїнтирозинфосфатази з Йерсинії (Yop51*). Препарат рекомбінантної протеїнтирозинфосфатази з Yersinia enterocolitica (Yop51*) з масою 51kDa, отриманий шляхом експресії в Е. соli (продукт Yop51 гена, з C235R мутацією) [35], був придбаний у фірми "Sigma". Підготовлений до роботи фермент зберігався при 0°С в середовищі з 50%-ним гліцерином та 50 мМ HEPES-буфером (рН7,0), 100мМ NaCI, 20гаМ EDTA, 50гаМ DTT, 0,01% Brij-35. Реакційна суміш вміщувала 0,05М BISTRIS буфер (рН6,5), 70mM NaCI, 0,005% Brij-35, 0,4mM EDTA, 1,0mM DTT та 4мМ n-нітрофенілфосфат як штучний субстрат. Інгібітор (А) був попередньо розчинений в системі диметилсульфоксид - вода. Вміст диметилсульфоксиду в реакційній суміші був 0,4об.%. Суміш термостатували 5хв при 30°С. Реакцію розпочинали додаванням розчину ферменту. Кінетичні експерименти проводили за умов та при концентраціях інгібітора, що дозволяють фіксувати початкову швидкість накопичення nнітрофенолу. Утворення n-нітрофенолу внаслідок ферментативного гідролізу л-нітрофенілфосфату вимірювали за зростанням оптичної густини реакційної суміші при 410 nm, використовуючи молярний коефіцієнт абсорбції n-нітрофенолу 18300М-1 cm -1. Залишкову активність ферменту оцінювали в процентах до активності ферменту в дослідах без інгібітора. Використовували середнє значення трьох вимірювань та обраховували стандартну похибку. Для визначення значення ІС50 тіакалікс [4] арентетракисметилфосфонової кислоти (А) було вивчено залежність залишкової активності протеїнтирозинфосфатази з Йерсинії (Yop51*) від концентрації інгібітора (0,1мкМ, 0,2мкМ, 0,5мкМ, 1,0мкМ та 3,0мкМ). Величина ІС50 відповідала концентрації інгібітора, яка спричиняла зниження активності ферменту на 50%. Активність ферменту розраховували з початкової швидкості гідролізу nнітрофенілфосфату (початкова концентрація 4мМ) при фіксованій концентрації ферменту. Фіг.1 демонструє залежність інгібуючої дії тіакалікс[4]арентетракисметилфосфонової кислоти (А) від її концентрації в реакційній суміші. Видно, що зі збільшенням концентрації тіакалікс [4] арентетракисметилфосфонової кислоти до 3мкМ інгібування ферменту складає приблизно 85%. Значення ІС50 розраховано за допомогою програми GraphPad Prism 5.01 із залежності проценту інгібування від логарифму концентрації інгібітора. Згідно виконаних розрахунків lg(IC50)=-0,480±0,216, що відповідає значенню IC50, рівному 0,33мкМ з довірчими 48050 6 інтервалами в межах від 0,20мкМ до 0,54мкМ при Р=0,95. Фіг.1. Залежність залишкової активності протеїнтирозинфосфатази з Йерсинії (Yop51*) від концентрації тіакалікс [4] арентетракисметилфосфонової кислоти (А). Обраховане значення IC50 (0,33мкМ, довірчий інтервал при Р=0,95 в межах від 0,20мкМ до 0,54мкМ) свідчить про те, що сполука (А) виявляє властивості потужного інгібітора протеїнтирозинфосфатази. Література: 1. Vetter S.W., Zhang Z.-Y.. Probing the Phosphopeptide Specificities of Protein Tyrosine Phosphatases, SH2 and PTB Domains with Combinatorial Library Methods // Curr. Protein and Peptide Science. - 2002. - Vol.3, N4. - P.365-397. 2. Zhang Z.-Y. Functional studies of protein tyrosine phosphatases with chemical approaches // Biochim. Biophys. Acta. - 2005. -Vol.1754, N1-2. P.100-107. 3. Zhang Z.-Y. Protein tyrosine phosphatases: prospects for therapeutics // Curr. Opin. Chem. Biol. 2001.-Vol.5, N1.-P.416-423. 4. Tautz L., Mustelin T. Strategies for developing protein tyrosine phosphatase inhibitors // Methods. 2007. - Vol.42, N3. - P.250-260. 5. Xie J., Seto C.T. A two stage click-based library of protein tyrosine phosphatase inhibitors // Bioorg. Med. Chem. - 2007. - Vol.15, N1.-P.458-473. 6. Guan K.L., Dixon J.E. Protein tyrosine phosphatase activity of an essential virulence determinant in Yersinia // Science. - 1990. - Vol.249 (4968). - P.553-556. 7. Cornelis G.R. Molecular and cell biology aspects of plague // Proc. Natl. Acad. Sci. USA.-2000. - Vol.97, N16. - P.8778-8783. 8. Bliska J.B., Guan K.L., Dixon J.E., Falkow S. Tyrosine phosphate hydrolysis of host proteins by an essential Yersinia virulence determinant // Proc. Natl. Acad. Sci. USA. -1991.-Vol.88, N4.-P.1187-1191. 9. Black D.S., Montagna L.G., Zitsmann S., Bliska J.B. Identification of an amino-terminal substrate-binding domain in the Yersinia tyrosine phosphatase that is required for efficient recognition of focal adhesion targets // Мої. Microbiol. - 1998. Vol.29, N5. - P.1263-1274. 10. Black D.S. Marie-Cardine A., Schraven В., Bliska J.B. The Yersinia tyrosine phosphatase YopH targets a novel adhesion-regulated signalling complex in macrophages // Cell. Microbiol. - 2000. - Vol.2, N5. - P.401-414. 11. Black D.S., Bliska J.B. Identification of pl30Сasas a substrate of Yersinia YOPH (YOP51), a bacterial protein tyrosine phosphatase that translocates into mammalian cells and targets focal adhesions // EMBO J. - 1997. - Vol.16, N10. - P.27302744. 12. Puertal M. L., Trinidad A. G., Rodriguez M.C., Bogetz J., Crespo M. S., Mustelin Т., Alonso A., Bayon Y. Characterization of New Substrates Targeted By Yersinia Tyrosine Phosphatase YopH // PLoS ONE |(www.plosone.org). - 2009. - Vol.4, N2. e4431. 7 13. Jayaraman K.S. Anti-plague efforts hindered by lack of recent experience // Nature. - 1994. Vol.371 (6497). - P.467. 14. Hawley R.J., Eitzen E.M. Biological weapons a primer for microbiologists // Annu. Rev. Microbiol. 2001. - Vol.55. - P.235-253. 15. Tautz L., Bruckner S., Sareth S., Alonso A., Bogetz J., Bottini N., Pellecchia M., Mustelin T. Inhibition of Yersinia tyrosine phosphatase by furanyl salicylate compounds // J. Biol. Chem. - 2005. Vol.280, N10. - P.9400-9408. 16. Maccari R., Paoli P., Ottana R., Jacomelli M., Ciurleo R., Manao G., Steindl Т., Langer Т., Vigorita M. G., Camici G. 5-Arylidene-2,4-thiazolidinediones as inhibitors of protein tyrosine phosphatases // Bioorg. Med. Chem. - 2007. - Vol.15, N15. - P.51375149. 17. Sun J.-P., Wu L., Fedorov A. A., Almo S. C, Zhang Z.-Y. Crystal Structure of the Yersinia Proteintyrosine Phosphatase YopH Complexed with a Specific Small Molecule Inhibitor // J. Biol. Chem. 2003. - Vol.278, N35. - P.33392-33399. 18. Iyer S., Younker J. M., Czyryca P. G., Hengge A. C. A nonhydrolyzable analogue of phosphotyrosine, and related aryloxymethano- and aryloxyethano-phosphonic acids as motifs for inhibition of phosphatases // Bioorg. Med. Chem. Lett. - 2004. - Vol.14, N23. -P.5931-5935. 19. Skorey K., Ly H.D., Kelly J., Hammond M., Ramachandran C, Huang Z., Gresser M.J., Wang Q. How Does Alendronate Inhibit Protein-tyrosine Phosphatases? // J. Biol. Chem. -1997. - Vol.272, N36. - P.22472-22480. 20. Opas E.E., Rutledge S.J., Golub E., Stern A., Zimoio Z., Rodan G.A., Schmidt A. Alendronate inhibition of protein-tyrosine-phosphatase-megl // Biochem. Pharmacol. -1997. - Vol.54, N6. - P.721727. 21. Chen Y.T., Seto C.T. Divalent and trivalent alpha-ketocarboxylic acids as inhibitors of protein tyrosine phosphatases // J. Med. Chem. - 2002. Vol.45, N18. - P.3946-3952. 22. Zhang S., Zhang Z.-Y. PTP1B as a drug target: recent developments in PTP1B inhibitor discovery // Drug Discovery Today. - 2007. - Vol.12, N.9/10. - P.373-381. 23. Hu X., Stebbins C.E. Molecular docking and 3D-QSAR studies of Yersinia protein tyrosine phosphatase YopH inhibitors // Bioor. Med. Chem. 2005. - Vol.13, N4. - P.1101-1109. 24. Стоиков И.И., Гафиуллина Л.И., Ибрагимова Д.Ш., Антипин И.С., Коновалов А.И. Синтетические рецепторы на основе функционализированного по нижнему ободу калике[4]арена в молекулярном распознавании дикарбоновых, а 48050 8 гидрокси- и а-аминокислот // Изв. РАН, Сер. Хим. 2004. - №6. - С.1125-1133. 25. Calixarenes 2001; Asfari, Z., Bohmer, V., Harrowfield, J., Vicens, J., Eds.; Kluwer Academic Publishers: Dordrecht, 2001. 26. Lalor R., Baillie-Johnson H., Redshaw C, Matthews S. E., Mueller A.. Cellular uptake of a fluorescent calix[4]arene derivative // J. Am. Chem. Soc. - 2008. - Vol.130, N10. - P.2892-2893. 27. Vovk A., Kalchenko V., Cherenok S., Kukhar V., Muzychka O., Lozynsky M. Calix[4]arene methylenebisphosphonic acids as calf intestine alkaline phosphatase inhibitors // Org. Biomol. Chem. - 2004. - Vol.2, N21. - P.3162-3166. 28. Cherenok S., Vovk A., Muravyova I., Shivanyuk A., Kukhar V., Lipkowski J., Kalchenko V. Calix[4]arene a-aminophosphonic acids: asymmetric synthesis and enantioselective inhibition of an alkaline phosphatase // Org. Lett. - 2006. - Vol.8, N4. - P.549-552. 29. Векліч Т.О., Костерін CO., Родік Р.В., Черенок CO., Бойко В.I., Кальченко B.I. Вплив каліксаренфосфонових кислот на Nа+,К+-АТР-азну активність у плазматичній мембрані гладеньком'язових клітин // Укр. біохім. журн. - 2006. - Т.78, №1.- С.70-86. 30. Касьян О.В., Драпайло А.Б., Кальченко О.І., Кальченко В.І. Натрова сіль дигідроксифосфонілметилтіакалікс[4]арену як комплексоутворювач амінокислот. Патент України № 84626 д. р. 10.11.08. 31. Vovk А.І., Kononets L.A., Tanchuk V.Yu., Drapailo A.B., Kalchenko V.I., Kukhar V.P. Thiacalix[4]arene as Molecular Platform for Design of Alkaline Phosphatase Inhibitors II J. Inch Phenom. Macrocyclic Chem. - 2009. - DQI: 10.1007/S 10847009-9607-9. 32. Lhotak P., Himl M., Stibor I., Sykora J., Cisarova I. Upper rim substitution of thiacalix[4]arene // Tetrahtdron Lett. - 2001. - Vol.42, N40. - P.71077110. 33. Kasyan O., Swierczynski D., Drapailo A., Suwinska K., Lipkowski J., Kalchenko V. Upper rim substituted thiacalix[4]arenes // Tetrahedron Lett. 2003. - Vol.44, N38. - P.7167-7170. 34. Lee K., Gao Y., Yao Z.-J., Phan J., Wu L., Liang J., Waugh D.S., Zhang Z.-Y., Burke T.R., Jr. Tripeptide inhibitors of Yersinia protein-tyrosine phosphatase // Bioorg. Med. Chem. Lett. - 2003. Vol.13, N15. - P.2577-2581. 35. Zhang Z.-Y., Clemens J.C., Schubert H.L., Stuckey J.A., Fischer M.W.F., Hume D.M., Saper M.A., Dixon J.E. Expression, purification, and physicochemical characterization of a recombinant Yersinia protein tyrosine phosphatase // J. Biol. Chem. - 1992. - Vol.267, N33.-P.23759-23766. 9 Комп’ютерна верстка О. Рябко 48050 Підписне 10 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюUse of 5,11,17,23-tetrakis[(dihydroxyphosphoryl)methyl]-25,26,27,28-tetrahydroxythiacalix[4]arene as protein tyrosine phosphatase inhibitor
Автори англійськоюKononets Liudmyla Anatoliivna, Vovk Andrii Ivanovych, Tanchuk Vsevolod Yuliiovych, Drapailo Andrii Bohdanovych, Kalchenko Vitalii Ivanovych, Kukhar Valerii Pavlovych
Назва патенту російськоюПрименение 5,11,17,23-тетракис[(дигидроксифосфорил)метил]-25,26,27,28-тетрагидрокситиакаликс[4]арена как ингибитора протеинтирозинфосфатазы
Автори російськоюКононец Людмила Анатолиевна, Вовк Андрей Иванович, Танчук Всеволод Юлиевич, Драпайло Андрей Богданович, Кальченко Виталий Иванович, Кухар Валерий Павлович
МПК / Мітки
МПК: C07C 15/00, A61K 31/662, C12N 9/12
Мітки: застосування, інгібітора, протеїнтирозинфосфатази, 5,11,17,23-тетракис[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідрокситіакалікс[4]арену
Код посилання
<a href="https://ua.patents.su/5-48050-zastosuvannya-5111723-tetrakisdigidroksifosforilmetil-25262728-tetragidroksitiakaliks4arenu-yak-ingibitora-protentirozinfosfatazi.html" target="_blank" rel="follow" title="База патентів України">Застосування 5,11,17,23-тетракис[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідрокситіакалікс[4]арену як інгібітора протеїнтирозинфосфатази</a>
Попередній патент: Застосування 5,11,17,23-тетракис[(дигідроксифосфорил)метил]-25,26,27,28-тетрагідроксикалікс[4]арену як інгібітора протеїнтирозинфосфатази
Наступний патент: Спосіб лікування ішемічної кардіоміопатії
Випадковий патент: Спосіб препарування комах









