Спосіб отримання похідних дипептиданіліду
Формула / Реферат
Спосіб отримання похідних дипептиданіліду загальної формули 1
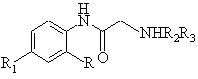 , (1)
, (1)
де R означає бензоїльну С6Н5СО або ортохлорбензоїльну о-СlС6Н4СО-групу, R1 - бром або хлор, R2 - залишки амінокислот: гліцину COCH2NH, ![]() або -аланіну СОСН(NН)СН3COCH2CH2NH,
або -аланіну СОСН(NН)СН3COCH2CH2NH, ![]() або
або ![]() -аміномасляної кислоти СОСН(NН)СН2СН3CO(CH2)3NH, валіну СОСН(NН)СН(СН3)2, лейцину СОСН(NН)СН2СН(СН3)2, глутаміну COCH(NH)CH2CH2CONH2, проліну COCHNCH2CH2CH2, фенілаланілу СОСН(NН)СН2С6Н5, R3 - карбобензилоксі-ОСОСН2С6Н5, тритильну С(С6Н5)3, фталоїльну С6Н4(СО)2 або бензоїльну С6Н5СО-групу, який включає взаємодію похідного амінобензофенону формули 2
-аміномасляної кислоти СОСН(NН)СН2СН3CO(CH2)3NH, валіну СОСН(NН)СН(СН3)2, лейцину СОСН(NН)СН2СН(СН3)2, глутаміну COCH(NH)CH2CH2CONH2, проліну COCHNCH2CH2CH2, фенілаланілу СОСН(NН)СН2С6Н5, R3 - карбобензилоксі-ОСОСН2С6Н5, тритильну С(С6Н5)3, фталоїльну С6Н4(СО)2 або бензоїльну С6Н5СО-групу, який включає взаємодію похідного амінобензофенону формули 2
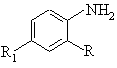 (2)
(2)
з похідним гліцину в розчиннику при нормальній температурі і наступну конденсацію отриманого гліциланіліду з похідним N-захищеної амінокислоти, який відрізняється тим, що як похідне гліцину використовують хлорангідрид хлоргідрату гліцину, як похідне амінобензофенону - сполуки формули 2, де R і R1 указані вище, і взаємодію проводять в співвідношенні 1,2:1 в хлороформі 1,5-2 години, охолоджують реакційну суміш до мінус 3-6°С, додають триетиламін і етилформіатний ангідрид N-захищеної амінокислоти формули 3, R3R2OН (3), де R2 і R3 указані вище, в співідношенні із розрахунку амінобензофенон 2 - N-захищена амінокислота 3 1:1, підвищують температуру до нормальної і перемішують 1,5-2 години.
Текст
Винахід відноситься до галузі біологічно активних похідних діпептиданіліда, конкретно до способу отримання N-(R3)-діпептид-(2-R., 4-R 1)аніліда загальної формули 1 де R означає бензоїльну С 6Н5СО або ортохлорбензоїльну груп у, R1 - бром або хлор, R2 - залишки амінокислот: гліцина COCH2NH, a- або b-аланіна СОСН(NН)СН3 COCH2CH2NH, a- або g-аміномасляної кислоти СОСН(NН)СН2СН3 COCH(CH2)3NH, валіна СОСН(NН)СН(СН3)2, лейцина СОСН(NН)СН2СН(СН3)2, глутаміна COCH(NH)CH2CH2CONH2, проліна COCHNCH2CH2CH2, фенілаланіна СОСН(NН)СН2СН2С6Н5, R3 карбобензилоксі ОСОСН 2С6Н5, тритільну С(С 6Н5)3, фталоїльну С6Н4(СО)2 або бензоїльну групу, який може бути використанним в синтезі транквілізуючих лікарських засобів пролонгірованої дії. Рівень техніки в даній галузі характеризується слідуючими аналогами. Відомий спосіб отримання похідних діпептиданіліда (Хим.- фарм. ж. 1986, №7, с.806), який заключається в слідуючому: а) На діпептид 4 (схема 1) в диметилформамід-етилацетаті (1:1) при мінус 10-13°С діють ізобутилхлорформіатом в присутності триетиламіна, а потім амінобензофеноном 2 в хлороформі при 5-7 і 1720°С і виділяють дипептиданілід 1; б) На діпептид 4 в хлороформі при мінус 17-19°С діють пятихлористим фосфором, а потім амінобензофеноном 2 в хлороформі і виділяють діпептиданілід 1. Недоліком відомого способу являється необхідність попереднього синтезу діпептида 4 (див. сх.1). Процес синтезу слідуючий (Гринштейн дж., Виниц М. Химия аминокислот и пептидов. / Под ред. М.М.Шемякина. Изд. "Мир", 1965). де R означає бензоїльну С6Н5СО або бензилоксігрупу С6H5СН2ОН, R1 - бром, R2 - залишок гліцина COCH2NH або a-аланіна СОСН(NН)СН3, R3 - карбобензилоксігрупу ОСОСН 2С6Н5 , R4 - водень або метил, R5 - метил або етил. Схема 1 На амінокислоту 5 в водно-лужному розчині діють хлоридом 6. Після виділення і підготовки (очищення і обезводнювання) кислоти 3 її вводять у взаємодію з ефіром 7, який отримують із кислоти 8 і відповідного спирту. Виділений ефір діпептида 9 гідролізують лугом і отримують діпептид 4. Якщо вихід діпептиданіліда 1 по стадії "а і б" складає 40-89% то в розрахунку, наприклад, на амінокислоту 5 ви хід складає 10-30%. Відомий спосіб (J. Med. Chem., 1981, 24, p.20) отримання похідних діпептиданіліда типу 1 (сх.1, 2) без використання діпептида типу 4 (сх.1), процес здійснення слідуючий. Карбобензилоксіамінокислоту 3 (сх.2) в ацетонітрил-гексаметилфосфотриаміді (1:3,5) при мінус 4-5°С обробляють хлористим тіонілом, потім дозованими частками амінобензофенона 2, суміш витримують при нормальній температурі 10-12 годин, нейтралізують водним бікарбонатом натрію, екстрагують етилацетатом, органічний шар обезводнюють сульфатом натрію, упарюють в вакуумі, залишок обробляють ефіром і отримують півпродукт 10. Півпродукт 10 обробляють 30% бромистим воднем в оцтовій кислоті 1,5год. при нормальній температурі, прибавляють надлишок ефіру, відфільтровують осад, промивають ефіром, висушують в вакуумі і отримують півпродукт 11. де R означає бензоїл С6Н5СО або ортохлорбензоїл о-СlС 6Н4СО, R1 - хлор або нітрогрупа, R2 - водень (Ак гліцин) або метил (Ак a-аланін), R3 - карбобензилоксігрупа С 6Н5СH2ОСО, R4 - водень (Ак гліцин) або бензил (Ак фенілаланін). Ак означає амінокислоту. Схема 2 Дальше карбобензилоксіамінокислоту 3 в гексаметилфосфотриаміді при мінус 3-5°С обробляють хлористим тіонілом, потім прибавляють дозованими частками півпродукт 11, суміш перемішують 10-12год. при нормальній температурі, прибавляють водний бікарбонат натрію, концентрують, залишок розділяють колонковою хроматографією і отримують діпептиданілід 1 з виходом по останній стадії 47-92%. При перерахунку на вихідні 2 і 3 вихід похідних діпептиданіліда 1 складає 20-60%. Недоліком відомого способу являється необхідність синтезу півпродукта 10 і стадії виділення із реакційної суміші півпродукта 11 (див. cx.2). Крім того, використовуваний в якості розчинника гексаметилфосфотриамід (т. кип. 232°С, змішується з водою) складно регенерувати і відходи не обеззаражуються. В основу винаходу поставлено задачу спрощення способу отримання похідних діпептиданіліда шляхом варіювання відповідних реакційноспроміжних вихідних продуктів і підбором оптимального технологічного режиму. Досягаємий технічний результат - це скорочення стадій синтеза похідних діпептиданіліда і проведення синтеза в однореакторному режимі. Цей технічний результат досягається описуваним способом отримання похідних діпептиданіліда загальної формули 1 де R означає бензоїльну С6Н5СО або ортохлорбензоїльну о-СІС 6H4СО групу, R1 - бром або хлор, R2 - залишки амінокислот: гліцина COCH2NH, a- або b-аланіна СОСН(NН)СН3 COCH2CH2NH, a- або g-аміномасляної кислоти COCH(NH)CH2CH3 CO(CH2)3NH, валіна COCH(NH)CH(CH3)2, лейцина СОСН(NН)СН2СН(СН3)2, глутаміна COCH(NH)CH2CH2CONH2, проліна COCHNCH2CH2CH2, фенілаланіна СОСН(NН)СН2С6Н5. R3 - карбобензилоксі ОСОСН2С6Н5, тритільну С(С 6Н5)3, фталоїльну С 6Н 4(СО)2 або бензоїльну груп у, згідно якому в якості похідного гліцина використовують хлорангідрид хлоргідрата гліцина, в якості похідного амінобензофенона сполуки формули 2 де R і R1 указані вище і взаємодію проводять в співвідношенні 1,2:1 в хлороформі протягом 1,5-2 годин, реакційну суміш охолоджують до мінус 3-6°С, прибавляють триетиламін і етилформіатний ангідрид N-захищеної амінокислоти загальної формули 3 R3R2ОН, де R2 і R3 указані вище, в співвідношенні із розрахунку амінобензофенон 2 - N-захищена амінокислота 3 1:1, температуру підвищують до нормальної і перемішують 1,5-2 години. Суттєва особливість заявлюваного способа заключається в тому, що спосіб позволяє проводити процес отримання цілевого продукта в однореакторному режимі внаслідок виключення стадії отримання півпродукту 10 (див. сх.2) по способу-прототипу і виключення стадії виділення із реакційного середовища півпродукту типа 11 (cx.2 і 3). Пояснення процесу отримання з обгрунтованням граничних значень режима і параметрів процеса: На розчин амінобензофенона 2 (cx.3) в хлороформі при нормальній температурі діють хлорангідридом хлоргідрата гліцина (12) в співвідношенні, відповідно, 1:1,2. При цьому утворюється хлоргідрат 11. Закінчення взаємодії контролюють тонкошаровою хроматографією (ТШХ). Час взаємодії складає 1,5-2год. Потім реакційну суміш о холоджують до мінус 3-6°С, прибавляють триетиламін до лужної реакції (контролюють індикаторним папером) і отримують розчин "А". При обробці реакційної суміші триетиламіном хлоргідрат аміну 11 перетворюється в амін 13. При використанні реагентів 2 і 12 в співвідношенні 1:1 або 1:1,3-1,4 зменшується вихід цілевого продукта на 8-15%, крім того в останньому випадку збільшується розхід триетиламіна пропорційно збільшенню кількості реагента 12. Для слідуючого етапу готують алкілформіатний ангідрид N-захищеної амінокислоти 3. До її розчину в хлороформі і триетиламіні в співвідношенні амінокислота 3 - триетиламін 1:1, при мінус 4-5°С прибавляють еквімолярну кількість етилхлорформіата, перемішують 15-20хв. і отримують розчин "Б". До розчину "А" при мінус 3-6°С прибавляють розчин "Б", перемішують 15-20хв., температуру підвищують до нормальної і перемішують 1,5-2год., (контроль ТШХ). Реакційну суміш промивають водою, органічний розчин обезводнюють сульфатом натрію, упарюють в вакуумі, залишок кристалізують із етанолу, етилацетату або суміші останнього з петролейним або діетиловим ефіром і отримують цілеві продукти з виходом до 90% замість виходу до 60% по способу-прототипу із розрахунку на вихідні 2 і 3 (сх.2, 3). Приклади N-(Бензилоксікарбоніл)гліцил-гліциланілід(2-бензоїл-4-бром) А. До розчину 2,76г (0,01моль) 2-аміно-5-бромбензофенона в 20мл безводного хлороформа прибавляяють 1,56г (0,012моль) хлорангідрида хлоргідрата гліцина і суміш перемішують при номальній температурі до закінчення реакції, яке контролюють тонкошаровою хроматографією (1,5-2год.). Потім до суміші при мінус 4-5°С прибавляють безводний триетиламін до лужної реакції (контролюють індикаторним папером) і отримують розчин "А". Б. До розчину 2,09г (0,01моль) N-карбобензилоксігліцину в 20мл хлороформа і 1,4мл (0,01моль) триетиламіну при мінус 4-5°С прибавляють 1мл (0,01моль) етилхлорформіата, суміш перемішують 20хв. і отримують розчин "Б". В. До розчину "А" при мінус 4-5°С прибавляють розчин "Б", суміш перемішують 20хв., температуру підвищують до нормальної і перемішують 1,5-2год. (контролюють ТШХ) Реакційну суміш промивають водою(3´10мл), органічний шар обезводнюють сульфатом натрію, упарюють в вакуумі, залишок кристалізують із етанолу і отримують 4,7г (88%) цілевого продукта. Т. пл. 162-163°С. Rf 0,23 (ацетон-гексан 2:3). Найдено, %: С 57,4 Н 4,1 N 8,1. С25H22N3 O5Вr. Розраховано, %: С 57,3 Н4,2 N 8,0. ІЧ спектр, v, см -1: 1635, 1670, 1695 (C=O); 3350 (NH). В аналогічних умовах отримують: N-(Бензилоксікарбоніл)гліцил-гліциланілід(2-ортохлорбензоїл-4-бром) Із 2-аміно-21-хлор-5-бромбензофенона, хлорангідриду хлоргідрату гліцину (ХГ) і N-карбобензилоксігліцину. Вихід 91%. Т. пл. 176-177°С (із етанола). Rf 0,21 (ацетон-гексан 2:3). Найдено, %: С 53,8 Н 4,0 N 7,6. С25Н21N3 O5ВrСl. Розраховано, %: С 53,7 Н 3,8 N 7,5. ІЧ сп., v, см -1: 1655, 1705 (C=О); 3280-3320 (NH). N-(Бензилоксікарбоніл)гліцил-гліциланілід(2-бензоїл-4-хлор) із 2-аміно-5-хлорбен-зофенона, ХГ і NKT. Ви хід 90%. Т. пл. 162-163°С (із етанола). Rf 0,24 (ацетон-гексан 2:3). Найдено, %: С 62,4 Н 4,8 N 8,9. С25Н22N3 O5Сl. Розраховано, %: С 62,5 Н 4,6 N 8,7. ІЧ сп., v, см -1: 1640, 1675, 1700 (C=О); 3340 (NH). N-(Бензилоксікарбоніл)-a-аланіл-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбензофенона, ХГ і Nкарбобензилоксі-a-аланіну. Вихід 84%. Т. пл. 139-140°С (із етанолу). Rf 0,28 (ацетон-гексан 2:3). Найдено, %: С 57,8 Н 4,5 N 7,9. C 26H24N3 О5Br. Розраховано, %: С 58,0 Н 4,6 N 7,8. ІЧ сп., v, см -1: 1655, 1685(С=О); 3300 (NH). N-(Бензилоксікарбоніл)-b-аланіл-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбензофенона, ХГ і Nкарбобензилоксі-b-аланіна. Вихід 63%. Т. пл. 129-130°С (із етанола). Rf 0,23 (ацетон-гексан 2:3). Найдено, %: С 57,9 Н 4,7 N 8,0. C26H24N3О5Br. Розраховано, %: С 58,0 Н 4,5 N 7,8. ІЧ сп., v, см -1: 1630, 1680 (С=О); 3280-3340 (NH). N-(Бензилоксікарбоніл)-a-амінобутироїл-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбензофенона, ХГ і Nкарбобензилоксі-a-аміномасляної кислоти. Вихід 78%. Т. пл. 147-148°С (із етилацетата). Rf 0,32 (ацетон-гексан 2:3). Найдено, %: С 58,9 Н 4,9 N 7,5. C27H26N3О5Br. Розраховано, %: С 58,7 Н 4,7 N 7,6. ІЧ сп., v, см -1: 1640, 1650, 1685, 1695 (С=0); 3300-3340 (NH). N-(Бензилоксікарбоніл)-g-амінобутироїл-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбензофенона, ХГ і Nкарбобензилоксі-g-аміномасляної кислоти. Вихід 66%. Т. пл. 113-114°С (із етилацетату). Rf 0,22 (ацетон-гексан 2:3). Найдено, %: С 58,8 Н 4,7 N 7,6. C 27H26N3О 5Br. Розраховано, %: С 58,7 Н 4,7 N 7,6. ІЧ сп., v, см -1: 1640, 1650, 1690 (С=О); 3320-3360 (NH). N-(Бензилоксікарбоніл)валіл-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбензофенона, ХГ і Nкарбобензилоксіваліна. Вихід 86%. Т. пл. 157-158°С (із етилацетату). Rf 0,34 (ацетон-гексан 2:3). Найдено, %: С 59,6 Н 4,8 N 7,6. C28H28N3O 5Br. Розраховано, %: С 59,4 Н 5,0 N 7,4. ІЧ сп., v, см -1: 1640, 1680, 1690, 1700 (С=О); 3280-3320. N-(Бензилоксікарбоніл)лейцил-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбензофенона, ХГ і Nкарбобензилоксілейцину. Вихід 82%. Т. пл. 96-97°С (із етилацетатпетролейного ефіра 15:1). Rf 0,37 (ацетонгексан 2:3). Найдено, %: С 59,8 Н 5,3 N 7,3. C29H30N3О5Br. Розраховано, %: С 60,0 Н 5,2 N 7,2. ІЧ сп., v, см -1: 1630, 1680,1700 (С=О); 3340-3380 (NH). N-(Бензилоксікарбоніл)глутаміл-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбензофенона, ХГ і Nкарбобензилоксіглутаміна. Вихід 61%. Т. пл. 184-185°С (із етанола) Rf 0,36 (метанол-хлороформ 1:9). Найдено, %: С 56,4 Н 4,5 N 9,6. C28H27N4О 6Br. Розраховано, %: С 56,5 Н 4,6 N 9,4. ІЧ сп., v, см -1: 1640, 1660, 1685, 1720 (С=О); 3340-3400 (NH). N-(Бензилоксікарбоніл)проліл-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбензофенона, ХГ і Nкарбобензилоксіпроліну. Вихід 83%. Т. пл. 160-161°С (із етанола). Rf 0,42 (бутанол-вода-оцтова кислота 4:1:1). Найдено, %: С 59,4 Н 4,8 N 7,5. C 28H 25N3 O5Br. Розраховано, %: С 59,6 Н 4,6 N 7,4. ІЧ cп., v, см -1: 1640, 1660 (С=О); 3250-3480 (NH). N-(Бензилоксікарбоніл)проліл-гліциланілід(2-ортохлорбензоїл-4-бром) із 2-аміно-21-xлop-5-бpoмбeнзoфeнoнa, ХГ і N-карбобензилоксіпроліна. Вихід 79%. Т. пл. 152-153°С (із діетилового ефіра). Rf 0,32 (ацетон-гексан 2:3). Найдено, %: С 56,3 Н 4,2 N 7,1. C28H25N3О5BrCl. Розраховано, %: С 56,2 Н 4,2 N 7,0. ІЧ сп., v, см -1: 1645, 1670 (С=О); 3280-3450 (NH). N-(Бензилоксікарбоніл)фенілаланіл-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбензофенона, ХГ і Nкарбобензилоксіфенілаланіна. Вихід 81%. Т. пл. 171-172°С (із етанола). Rf 0,33 (ацетон-гексан 2:3). Найдено, %: С 62,3 Н 4,5 N 6,9. C 32H28N3О5Br. Розраховано, %: С 62,5 Н 4,6 N 6,8. ІЧ сп., v, см -1: 1630, 1675, 1690, 1715 (С=О); 3340-3370 (NH). N-(Тритіл)гліцил-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбензофенона, ХГ і N-тритілгліцина. Вихід 78%. Т. пл. 199-200°С (із етанола). Rf 0,51 (бутанол-вода-оцтова кислота). Найдено, %: С 68,2 Н 4,9 N 6,7. C36H30N3 О3Br. Розраховано, %: С 68,4 Н 4,8 N 6,6. ІЧ cn.,v,cм -1: 1640, 1695 (C=О); 3250-3330 (NH). N-(Тритіл)гліцил-гліциланілід(2-ортохлорбензоїл-4-бром) із 2-аміно-21-хлор-5-бромбензофенона, ХГ і Nтритілгліцину. Вихід 74%. Т. пл. 210-212°С (із етанола). Rf 0,49 (бутанол-вода-оцтова кислота 4:1:1). Найдено, %: С 64,7 Н 4,3 N 6,3. C 36H29N3О 3BrCl. Розраховано, %: С 64,8 Н 4,4 N 6,3. ІЧ сп., v, см -1: 1640, 1680 (С=0); 3300-3400 (NH). N-(Фталоїл)гліцил-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбензофенона, ХГ і N-фталоїлгліцина. Вихід 89%. Т. пл. 221-222°С (із етанола). Rf 0,39 (бутанол-вода-оцтова кислота 4:1:1). Найдено, %: С 57,6 Н 3,6 N 8,2. С25Н18N3 O5Вr. Розраховано, %: С 57,7 Н 3,5 N 8,1. ІЧ сп., v, см -1: 1655, 1720 (C=O); 3280-3320 (NH). N-(Фталоїл)фенілаланіл-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбензофенона, ХГ і Nфталоїлфенілаланіну. Вихід 83%. Т. пл. 175-176°С (із етанолу). Rf 0,43 (бутанол-вода-оцтова кислота 4:1:1). Найдено, %: С 62,8 Н 4,1 N 7,0. C32H24N3О5Br. Розраховано, %: С 63,0 Н 4,0 N 6,9. ІЧ сп., v, см -1: 1635, 1675, 1720 (С=О); 3300-3380 (NH). N-(Бензоїл)гліцил-гліциланілід(2-бензоїл-4-бром) із 2-аміно-5-бромбенофенона, ХГ і N-бензоїлгліцина. Вихід 86%. Т. пл. 154-155°С (із етилацетат-діетилового ефіру 1:1). Rf 0,24 (ацетон-гексан 2:3). Найдено, %: С 58,2 Н 4,2 N 8,5. C 24H20N3О4Br. Розраховано, %: С 58,3 Н 4,1 N 8,5. ІЧ сп., v, см -1: 1630, 1660 (C=О); 3300-3400 (NH). Примітка: ХГ означає хлорангідрид хлоргідрата гліцина. ІЧ сп. записані в табл. КВг на приладі "Perkin-Elmer". Rf визначено на пластинках "Silyfol UV-254". NKГ - N-карбобензилоксігліцин.
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for producing dipeptidanilide derivatives
Автори англійськоюRudenko Oleh Pavlovych
Назва патенту російськоюСпособ получения производных дипептиданилида
Автори російськоюРуденко Олег Павлович
МПК / Мітки
МПК: C07K 5/06
Мітки: спосіб, похідних, дипептиданіліду, отримання
Код посилання
<a href="https://ua.patents.su/4-70452-sposib-otrimannya-pokhidnikh-dipeptidanilidu.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання похідних дипептиданіліду</a>
Попередній патент: Спосіб одержання екстракту з коренів тирличу ваточникоподібного, який проявляє гепатозахисну активність
Наступний патент: Спосіб одержання порошку титану
Випадковий патент: Пальник для дугового зварювання плавким електродом в захисних газах








