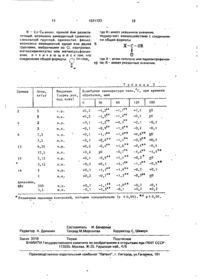
Спосіб отримання похідних оксимів 1,2,5,6,-тетрагідропірідін-3-карбоксальдегіду
Номер патенту: 5167
Опубліковано: 28.12.1994
Автори: Карла Бонетті, Джуліо Галіані, Фернандо Барцагі, Еміліо Тоя
Формула / Реферат
Способ получения производных оксимов 1,2,5,6-тетрагидропиридин-3-карбоксальдегида общей формулы
где R1 - метил или 2-пропинил;
R-С1-С4-алкил, прямой или разветвленный, возможно замещенный триметилсилильной группой, адамантил, фенил, возможно замещенный одной или двумя группами, выбранными из С1, изопропил, метоксифенилэтил или метилсульфонилэтил, отличающийся тем, что соединение общей формулы
где R1 имеет указанное значение, подвергают взаимодействию с соединением общей формулы
где X - атом галогена или паранитрофенокси; R - имеет указанные значения.
Текст
Изобретение относится к гетероциклическим соединениям, в частности к получению производных оксимоа 1,2,5,6-тетрагидропиридин-3-карбоксальдегида фцш OR(O)CC-^-CH2-CH2-CH-C(CH=NORi)-CH2, где Ri - СНз или 2-пропинил, R - Сі-С^-алкил, прямой или разветвленный, возможно замещенный триметилсилильной группой, адамантил, фенил, возможно замещенный одной или двумя группами, выбранными из СІ, иэопропил, метокси: фенилэтил или метилсульфонилэтил, обладающих холиномиметической активностью. Цель - разработка способа получения более активных соединений Получение_ведут^еакцией со_едиц£ния ф-лы NH-CH2-CH2CH-C(CH-hlORibCH2, где Ri - указанное значение с соединением ф-лы X~C(O)OR где X - атом галогена или паранитрофенокси; R - указанные значения. 3 табл. Изобретение относится к области получения новых химических биологически активных соединений, а именно производных оксима 1,2,5,6-тетрагидропиридин-З-кэрбоксальдегида, обладающих холиномиметической активностью. Указанное свойство предполагает возможность применения этих соединений в медицине. Цепь изобретения - получение новых производных 1,2,5,6-тетрагидропиридин-З-карбоксальдегидоксима, проявляющих улучшенную холиномиметическую активность в данном ряду соединений. П р и м е р 1. Метиловый эфир оксима 1-метоксикарбонил-1,2,5,6-тетрагидропиридин-3-карбоксальдегида. К раствору 1,5 г 1 2,5,6-тетрагидропиридин-3-карбоксальдегид-0- метил оксима в 40 см 3 бензола прибавляют 1,5 см триэти ламина при 10°С и медленно 0,83 см метилового эфира хлоругольной кислоты Перемешивают 30 мин при комнатной температуре, промывают с 15 см 5%-ной соляной кислоты, а затем водой Упаривают досуха под уменьшенным давлением, а затем перегоняют остаток при 140°С под 0,05 мбар. Получают 1,91 г целевого продукта. Т. пл 37°С. Вычислено, %: С 54,53, Н 7,12; N 14,13. C9H14N2O3 Найдено, %: С 54,31; Н 7,17; N 14,00. П р и м е р 2. Метиловый эфир оксима 1-этоксикарбонил-1,2,5,6- тетрагидропиридин-3-карбоксальдегида. Способ А. К раствору 3,6 г 1-бензил-1 2 5,6-тетрагидропи риди н-3-карбокса л ьдегид-0-м етил оксима в 30 см 3 дихлорэтана прибавляют (21)4356622/04 (22)19 08 88 (31)21687-А/87 (32)21 08.87 (33) IT (46)30.09.91. Бюл. №36 (71) Руссель-Юклаф (FR) (72) Джулио Галиани, Фернандо Барцаги, Карла Бонетти и Эмилио Тоя (IT) (53)547.822. '1,07(088.8) (56) Christie Г Е el al, Brit. J. Psychiatry, 1981, 138,46. з 1681723 2 см этилового эфира хлоругольной кислогоняют остаток при 200°С под 0,08 мбар. ты и выдерживают 3 ч с рефлюксом. РеакциПолучагат 2,25 г целевого продукта онную смесь охлаждают и органический Вычислено, %: С 58,91, Н 7,19; N 12,49. слой промывают при помощи 20 см 3 5%-ной соляной кислоты, а затем 2 раза 25 см 3 воды 5 Найдено, %; С 58.96; Н 7,25; N 12,41 Растворитель отгоняют и перегоняют остаП р и м е р 5. Метиловый эфир оксима точное масло при 15°С под 0,05 мбар. По1-бензилоксикарбонил-1,2,5,6-тетрагидролучают 1,5 г целевого продукта пиридин-3-карбоксальдегида. Вычислено, %: С 56,59, Н 7,60; N 13,20. Способ А. CioHieN2O3 10 К раствору 8 г 1-бензил-1,2,5,6-тетраНайдено, %: С 56,82, Н 7,66; N 13,04. гидропиридин-3-карбоксальдегида-О-метилСпособ Б. оксима в 100 см бензола прибавляют К раствору 3,75 г 1,2,5,6-тетрагидропи23 см бензилового эфира хлоругольной ридин-3-карбоксальдегид-0- метилоксимз в кислоты (50%-ный раствор в толуоле). На60 см бензола прибавляют при комнатной 15 гревают 4 ч с кипением, охлаждают, протемпературе, не превышающей 10°С, мывают 2 н.соляной кислотой, а затем 3,75 см триэтмламина и 2,7 см 3 этилового водой. Растворитель отгоняют под уменьэфира хлоругольной кислоты. Перемешивашенным давлением, а затем перегоняют ют 1 ч при комнатной температуре, прибавпри 200°С под 0,05 мбар. Получают 4,1 г ляют 20 см воды, декантируют и 20 целевого продукта. экстрагируют бензолом. Упаривают досуха Способ Б. под уменьшенным давлением ихроматограК раствору 1,5 г 1,2,5,6-гетрагидропирифируют остаток на двуокиси кремния (элюдин-3-карбоксальдегид-О-метилоксима в ент:этиловый эфир уксусной кислоты 20 см бензола и 1,08 г триэтиламина, толуол 1-1). Остаток перегоняют при 160- 25 медленна прибавляют при 10°С 3,4 см 165°С под 0,07 мбар. Получают 5,32 г целе50%-ного бензилового эфира хлоругильвого продукта. ной кислоты в толуоле. Перемешивают 1 ч при комнатной температуре, промывают Вычислено, %: С 56,59; Н 7,60, N 13,20. 5%-ной соляной кислотой в воде, отгоняют СюНієМгОз Найдено, %: С 56,41; Н 7,54; N 13,31. 30 растворитель и перегоняют остаток при 230°С под 0,06 мбар. Получают 2,1 целевого П р и м е р 3. Метиловый эфир оксима продукта. 1-н-пропилоксикарбон^л-1,2,5,6-тетрэгидропиридин-3-карбоксальдегида. Вычислено, %:С 65,54; Н 6,72; N 10,14. К раствору 1,5 г 1,2,5,6-тетрагидропиридин-3-карбоксальдегида-0- метилоксима в 35 Найдено, %: С 65,68, Н 6,61; N 10,21. 60 см бензола прибавляют 1,5 см 3 триэгиП р и м е р 6 Метиловый эфир оксима ламина и выдерживая температуру между 5 °1-фенилоксикарбонил-1,2,5,6-тетрагидрои 10°С, медленно прибавляют 1,23 см пролиридик-3-карбоксальдегида. пилового эфира хлоругольной кислоты. ПоСпособ А. сле выдержки 30 мин при комнатной 40 К раствору 3,3 г 1-метил 1,2,5,6-тетрай 3 температуре промывают с 20 см 1 н.солягидропиридин-3-карбоксальдегид-О-меток3 ной кислоты, а затем водой. Отгоняют рассима в 30 см дихлорэтана прибавляют 4,5 г творитель под уменьшенным давлением и фенилового эфира хлоругольной кислоты и перегоняют при 170°С под 0,07 мбар. Понагревают 3 ч с рефлюксом- Отфильтровылучают 2,3 г целевого продукта. 45 вают нерастворимое вещество (хлоргидрат исходного продукта), а затем упаривают Вычислено %: С 58,39; Н 6,02; N 12,38. досуха под уменьшенным давлением осC11H8N2O3 таток хроматографируют на двуокиси Найдено, %: С 58,12; Н 8,06; N 12,12. кремния (элюенгбензол-этиловый эфир П р и м е р 4. Метиловый эфир оксима 1-аллилоксикарбонил-1,2,5,6-тетрагидропи- 50 уксусной кислоты 8-2). Получают 4 г целевого продукта после перегонки при 220°С ридмн-3-карбоксальдегида. „ под 0,06 мбар. * ^ К раствору 1,2,5,6-тетрагидрогшридинЗ-карбоксальдегид-О-метил оксима в 40 см Способ Б. бензола прибавляют при 5°С 1,5 см триэК раствору 3 г 1-зтил 1,2,5,6-тетрагидротиламинаи 1,17см3 2-пропєнуілоаогозфм- 55 п&ф^дин-З-карбежсальдегид-О-метилоксима pa хлсругольной кислоты. Перемешивают в 30 см дихлорэтана прибавляют 4,7 см 30 мин при комнатной температуре, а затем фенилового эфира хлоругольной кислоты. обрабатывают при помощи 20 см 5%-ной Нагревают с рефлюксом в течение 3 ч, а соляной кислоты, а затем 2 раза с 20 см затем обрабатывают при помощи 20см 5%воды. Отгоняют растворитель, а затем переной соляной кислоты, з затем 2 раза с 20 см 16Н 1 V) З воды. Отгоняют растворитель, а затем забирают в диэтиловый эфир, отфильтровывают нерастворимое вещество и упаривают досуха фильтрат. Перегоняют остаточное масло при 210°С под 0,03 мбар. Получают 2,18 г целевого продукта. Вычислено, %: С 64,6; Н 6,20; N 10,76. C14H16N2O3 Найдено, %: С 64,72; Н 6,35; N 10,65. П р и м е р 7. Метиловый эфир оксима 1-(2-метилсульфонил)-этоксикарбонил-1(2, 5,6-тетрагидропиридин-З-карбоксальдегида. К раствору 1,5 г 1,2,5,6-тетрагидропиридин-3-карбоксальдегид-0-метилоксима в 40 см безводного бензола и 1,5 с м 3 триэтиламина, который охлаждают до 5°С, прибавляют 3,1 г карбоната (2-метилсульфонил)-этил-4-нитрофенила. Реакцию продолжают час при комнатной температуре, органический слой промывают водой, а затем упаривают досуха под уменьшенным давлением. Остаток хроматографируют на двуокиси кремния (элюент:этиловый эфир уксусной кислоты) и получают 1,6 г кристаллизованного в бензоле целевого продукта. Т. пл. 93-94°С. Вычислено, %: С 45,50; Н 6,25; N 9,65. C11H18N2O5S Найдено, %: С 45,63; Н 6,29; N 9,61. П р и м е р 8. Метиловый эфир оксима 1-адамантилоксикарбонил-1.2,5,6-тетрагидропиридин-3-карбоксальдегида. К раствору 1,5 г 1,2,5,6-тетрагидропиридин-З-карбоксальдегид-О-метилоксима в 40 см бензола и 1,5 см триэтиламина при 5°С прибавляют 2,13 г адамантилового эфира фторугольной кислоты. После 15 мин при комнатной температуре промывают 2 н.соляной кислотой, а затем водой. Упаривают досуха под уменьшенным давлением и кристаллизуют в гексане. Получают 2,6 г целевого продукта. Т. пл, 105-106°С. Вычислено, %: С 67.90; Н 8,23; Н 8,80 C18H26N2O3 Найдено, %: С 68,02, Н 8,28; N 8,76. П р и м е р 9. Метиловый эфир оксима 1-изопропилоксикарбонил- 1,2,5,6-тетрагидропиридин-3-карбоксальдегида. К смеси 1,4 г 1,2 5,6-тетрагидропиридин-3-карбоксальдегид-О-метилоксима и 1,01 г безводного триэтиламина в 30 см бензола при 10°С прибавляют 1,22 г изопропилового эфира хлоругольной кислоты в бензоловом растворе. Перемешивают 30 мин при комнатной температуре, декантируют, промывают органический слой, упаривают досуха и остаток хроматографируют на двуокиси кремния (элюент:толуол-этиловый эфир уксусной кислоты 8-2). Остаток 5 10 15 20 25 30 35 40 45 50 55 перегоняют при 180°С под 0,0Я мбар По пучают 1.35 г целевого продукта Т. пл 40 41°С. Вычислено, %: С 58,39; Н 8,02; N 12,38 C11H1BN2O3 Найдено, %: С 58,19; Н 8,13; N 12,54. П р и м е р 10. Метиловый эфир оксима- 1 -бутил оксикарбонил-1,2,5,6-тетрагидропиридин-3-карбоксальдегида. К раствору 1,5 г 1,2,5,6-тетрагидропиридин-3-карбоксальдегид-О-метил оксима в 20 см бензола и 1,2 г триэтиламина при 10°С прибавляют 1,46 г бутилового эфира хлоругольной кислоты. Перемешивают 2 ч при комнатной температуре, промывают 2 н.соляной кислотой, а затем упаривают досуха и перегоняют осадок при 220°С под 0,07 мбар. Получают 1,85 г целевого продукта. Вычислено, %; С 59,98; Н 8,39; N 11,66. C12H20N2O3 Найдено, %: С 59,72; Н 8,49; N 11,77. П р и м е р 11. Метиловый эфир оксима 1-{2-{фенил)-этилокси]-карбонил-1,2,5,6-тетрагидропиридин-3-карбоксальдегид, К смеси 1,4 г 1,2,5,6-тетрагидропиридин-3-карбоксальдегид-0-мети л оксима и 1,01 г триэтиламина в 40 см бензола прибавляют при 10°С 1,85 г[(2-фенил)- этилового эфира]хлоругольной кислоты. После 30 мин при комнатной температуре промывают разбавленной соляной киспотой и упаривают досуха. Очищают хроматографией на г и д р о о к и с и а л ю м и н и я (элюент;циклогексан-этиловый эфир уксусной кислоты 9-1), а затем перегоняют остаток под 0,07 мбар при 250°С. Получают 2,2 г целевого продукта. Вычислено, %: С 66,65; Н 6,99; N 9,72. C16H20N2O3 Найдено, %: С 66,51; Н 7,10; N 9,79. П р и м е р 12. Метиловый эфир оксима-1-парахлорфенилоксикарбонил-1,2,5,6тетрагидропиридин-3-карбоксальдегида. К смеси 1,4 г 1,2,5,6-тетрзгидропиридин-4-карбоксзльдегид-0-метилоксима и 1,01 г триэтиламина в 40 см бензола прибавляют при 10°С 1,91 г п-хлорфенилового эфира хлоругольной кислоты в 30 см бензола. После 3 ч при комнатной температуре промывают разбавленной соляной кислотой и упаривают досуха. Очищают хроматографией на гидроокиси алюминия (элюент:циклогексанэтиловый эфир уксусной кислоты 7-3). Получают 1,9 г кристаллизованного в циклогексане целевого продукта Т пл 9 6 98°С. Вычислено, %: С 57,05; Н5,13; N9,51. C14H15N2O3 Найдено, %; С 56,78; Н 4.97. И 9,37 1681723 П р и м е р 13. Метиловый эфир оксима 1-п-изопрпилфенил0'ксикарбонил-1,2,5,6тетрагидропиридин-З-карбоксальдегида. К 1,4 г 1,2,5,6-тетрагидропиридин-З-карбоксальдегид-О-метилоксима в 40 см 3 бензола и 1,01 г триэтиламина при 10°С прибавляют 1,99 г п-изопропилфенилового эфира хлоругольной кислоты а растворе в 20 см 3 бензола. После одной ночи при комнатной температуре промывают разбавленной соляной кислотой, а затем выпаривают досуха Очищают хроматографией на гидроокиси алюминия (элюент:циклогексан~ этиловый эфир уксусной кислоты 9-1). После кристаллизации в циклогексане получают2 г целевого продукта. Т. пл. 100~102°С. Вычислено, %: С 67,53, Н 7,33; N 9,27. C17H22N2O3 Найдено, %: С 67,70; Н 7,44; N9,14, П р и м е р 14. Метиловый эфир оксима 1-(3,4-диметоксифенилокси)-карбонил-1,2, 5,6-тетрагидролиридин-З-карбоксальдегида. К раствору 1,2 г 1,2,5,6-тетрагидропиридин-З-карбоксальдегид^метилоксима в 20 см 3 бензола и 1,2 см 5 триэтиламина прибавляют 1,86 г 3,4-диметоксифенилового эфира хлоругольной кислоты. Перемешивают 45 мин и промывают 10%-ной й соляной кислотой и упаривают досуха. Остаток хроматографируют на гидроокиси алюминия (злюент;циклогексан - этиловый эфир уксусной кислоты 7-3). Получают 1,85 г кристаллизованного в циклогексане целевого продукта. Т. пл. 143-145°С. Вычислено, %: С 59,99; Н 6,29; N 8,75. Найдено, %: С 60,24; Н 6,21; N 8,61. П р и м е р 15. 2-Пропиниловый эфир оксима 1-этилоксикарбонил-1,2,5,6-тетрагидропиридин-3-карбоксальдеП'Тда. К раствору 1,2,5.6-тетрагидропиридин3-карбоксальдегид-0-(2-пропмнилоксимэ) в 50 см 3 бензола прибавляют при 5°С 1,42 см 3 триэтиламина и 1,02 см 3 этилового эфира хлоругольной кислоты в 95%. Перемешивают 30 мин, а потом промывают водой и упаривают досуха под уменьшенным давлением. Очищают хроматографически на гидроокиси алюминия (элюент:бензол-диэтиловый эфир 1-1). Упаривают досуха и забирают в бензол, обрабатывают сульфатом натрия и активированным углем, фильтруют и доводят досуха под уменьшенным давлением, Получают 1,95 г целевого продукта. Т. пл. 55°С. Вычислено, %: С 61,00; Н 6,83; N 11,86. C12H16N2O3 Найдено, %: С 61,23; Н 6,66; N 11,71. 10 15 20 25 30 35 40 45 50 8 П р и м е р 16. Метиловый эфир оксима 1 -третбути л окси карбони л-1,2,5,6-тетрагидропиридин-3-карбоксальдегида. К раствору 1,5 г 1,2,5,6-тетрагидропиридин-3-карбоксальдегид-О-м етил оксима в 40 см3бензола прибавляют 1,5 см3триэтиламина. Охлаждают до 5°С и прибавляют 2,33 г карбоната тетрабутила. После 10 мин при комнатной температуре промывают 2 н.соляной кислотой, а затем водой. Упаривают под уменьшенным давлением, а затем выделяют продукт перегонкой при 150°С под 0,07 мбар. Получают 2,2 г целевого продукта. Вычислено, %: С59,83; Н 8,5; N 11,49. C12H20N2O3 Найдено, %: С 60,00; Н 8,39; N 11,66. П р и м е р 17, Метиловый эфир оксима 1-(2-триметилсилилэтоксикарбонил)1,2,5, 6-тетрашдропиридин-З-карбоксальдегида. К раствору 1,5 г 1,2,5,6-тетрагидропиридин-3~карбоксальдегид-0-метилоксима в 40 см 3 бензола и 1,5 см триэтиламина прибавляют при 5°С 3,03 г (2-триметилсилил)этилоеого эфира паранитрофенилугольной кислоты. Перемешивают 3 ч при комнатной температуре, промывают водой, а затем упаривают в вакууме. Очищают хроматографией на двуокиси кремния (элюент:бензол-диэтиловый эфир 1-1) и выделяют перегонкой целевой продукт при 220°С под 0,08 мбар. Получают 1,3 г целевого продукта. Вычислено, %: С 54,89; Н 8,50; N 9,85. C13H24N2O3S! Найдено, %: С 54,85; Н 8,59; N 9,76. Фармакологическое исследование. Острая токсичность. Опыт ведется на мышах самцах (CDi Charles Rivera) весом 22-24 г натощак 16 ч. Продукты вводят через рот при дезах 1000, 500, 250, 125 и 62 мг/кг. Отмечают смертность а течение 7 дней, следующей после обработки; Пример 2 4 6 13 12 14 55 АреколинНВг DUo. мг/кг 175 175 >50& > 1000 > 1000 175 600 Опыт на выделенном илеуме морской свинки. Взяты кусочки илеума морской свинки, умерщвленной обезглавливанием. Выделенный илеум кладется в 10 см раствора 9 1601723 10 Тирода при 37°С и проветривается смесью 4 - испражнения 6РЗ консистенции с кислорода (95%) и углекислого газа (5%) присутствием очень большого сырого кольКонтракции, вызванные продуктами, запица сываются при помощи датчика, связак-ного Для каждого продукта отмечена доза, с полиграфом Исследуемые продукты прикоторая вызывает понос у50% животных, по бавляются при концентрациях, находящихспособу Миллера и Тайнера ся между 1,10 3 и 1,10"вм/л. Гипотермическая активность Продукты, проявляющие контрактуру. Опыт ведется на мышах самцах исследуются по отношению к атропину и Charles Rivers) весом 25-30 г натощак 6 ч гексаметонию, чтобы установить, актив- 10 Пример DE50 мг/кг ность типа "мускаринового" или "никотино2 25 вого". А 3 Возможная антагонистическая деятель6 100 ность исследуемых продуктов изучается по >50 13 отношению к ацетилхолину. 1Ь >50 12 Антагонистическая активность выражаТ4 >50 ется в pD2 (отрицательный логарифм дозы, Ареколин 35 которая проявляет 50% максимального эффекта). Температура тела отмечается при помощи Антагонистическая активность выража- 20 термопары, введенной в прямую кишку на ется в DE50 (доза, которая уменьшает на 1,5 см и соединенной с электрическим дат50% максимальную реакцию, введенную чиком температуры ацетилхолином) Продукты вводятся через рот или Данные представлены в табл 1. подкожно и температура отмечается в 0 25 и 30 мин, 1 ч, 2 ч и 2,5 ч после ввода Таблица 1 продуктов. Степень гипотермии определяется кзк разница между обработанными животными Пример pD 2 DE50, мг/кг и контрольными. Определяют дозу, нужную 2 4.47 4 30 для понижения на 1°С температуру тела. 4 б.ОхЮ" 1хЮ"3 1x10"" 1хЮ~* 1х10 4
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of 1,2,5,6-tetrahydropyridin-3-carboxaldehyde oxime derivatives
Назва патенту російськоюСпособ получения производных оксимов 1,2,5,6-тетрагидропиридин-3-карбоксальдегида
МПК / Мітки
МПК: A61P 43/00, C07D 211/70, A61K 31/44, A61P 25/28, A61K 31/445
Мітки: отримання, спосіб, 1,2,5,6,-тетрагідропірідін-3-карбоксальдегіду, похідних, оксимів
Код посилання
<a href="https://ua.patents.su/6-5167-sposib-otrimannya-pokhidnikh-oksimiv-1256-tetragidropiridin-3-karboksaldegidu.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання похідних оксимів 1,2,5,6,-тетрагідропірідін-3-карбоксальдегіду</a>
Попередній патент: Спосіб опалювання подового сталеплавильного агрегату у періоди продувки ванни киснем
Наступний патент: Спосіб отримання похідних 1,3-оксазолідин-2 она чи їх кислотно-адитивних солей
Випадковий патент: Спосіб виготовлення попередньо напруженого двотаврового елементу