Спосіб одержання хіральних 4-аміно-4-арил-5,5,5-трифторопентан-2-онів
Номер патенту: 84821
Опубліковано: 25.11.2008
Автори: Піроженко Володимир Валентинович, Головач Наталія Михайлівна, Сукач Володимир Андрійович, Русанов Едуард Борисович, Вовк Михайло Володимирович
Формула / Реферат
Спосіб одержання хіральних 4-аміно-4-арил-5,5,5-трифторопентан-2-онів загальної формули І:
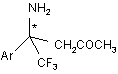 , І
, І
де Аr = Ph, 4-FC6H4, 3-MeC6H4, 4-MeC6H4, 4-МеОС6Н4,
який відрізняється тим, що арилтрифторометилкетіміни піддають взаємодії з ацетоном в розчині диметилсульфоксиду при кімнатній температурі в присутності 10%-вої каталітичної кількості L- або D-проліну з наступним виділенням цільових продуктів звичайними методами.
Текст
Спосіб одержання хіральних 4-аміно-4-арил5,5,5-трифторопентан-2-онів загальної формули І: NH 2 Винахід відноситься до органічної хімії, а саме до нових оптично активних похідних 4-аміно-4арил-5,5,5-трифторопентан-2-онів загальної формули: NH 2 Вказані сполуки, їх властивості і застосування в науковій літературі та патентних виданнях не описані. Найближчими структурними аналогами сполук, які заявляються є хіральні 1-заміщені 1-арил2,2,2-трифтороетиламіни загальної формули: NH2 CH 2COCH 3 CF3 де Аr = Ph, 4-FC6H4, 3-MeC6H4, 4-MeC6H4, 4МеОС6Н4 Сполуки даного типу можуть знайти застосування як реагенти для хроматографічного розділення енантіомерів, як ефективні мітки для ЯМР 19 F аналізу енантіо- та діастеріомерних сумішей, а також як вихідні для отримання нових фармацевтичних препаратів на основі раніше не описаних хіральних b-аміно-b-трифторометилкетонів. * R CF3 де R=Me, ізо-Рr, н-Bu, СН2= СНСН2, Ph, 4BrC6H4, 4-МеС6Н4 Завдяки унікальним стереоелектронним параметрам та високій ліпофільності трифторометильної групи, її введення в біоактивні сполуки відіграє істотну роль в процесі сорбції та транспортування молекул в середині біологічних систем [1, 2]. ОсоAr (13) 84821 (11) ,І де Аr = Ph, 4-FC 6H4, 3-MeC6H4, 4-MeC6H4, 4МеОС6Н4 , який відрізняється тим, що арилтрифторометилкетіміни піддають взаємодії з ацетоном в розчині диметилсульфоксиду при кімнатній температурі в присутності 10%-вої каталітичної кількості L- або D-проліну з наступним виділенням цільових продуктів звичайними методами. C2 CF3 UA Ar CH 2COCH 3 Ar (19) * * 3 84821 бливого значення для медико-біологічних та фармакологічних досліджень в останнє десятиріччя набули трифторометилвмісні оптично активні об’єкти. Перспективними будівельними блоками для них є хіральні аміни з трифторометильною групою, які отримуються методами асиметричного синтезу. Зокрема, для одержання хіральних 1заміщених 1-арил-2,2,2-трифтороетиламінів запропоновано два підходи. Перший з них базується на каталізованому трифлатом міді і хіральним біс(фосфін)монооксидним лігандом-(2R,5R)1{2[2R,5R)-2,5-диметилфосфолан-1-іл]феніл}-2,5диметилфосфолан-1-оксидом-асиметричному приєднанні цинкорганічних реагентів до Nфосфоноїларилтрифторометилкетімінів [3] або до амідів N-(1-етокси-2,2,2-трифтороетил-1арил)дифенілфосфінової кислоти [4] з подальшим гідролізом отриманих хіральних амідів дифенілфосфінової кислоти. Хоча метод і характеризується як високими виходами амідів N-[(lR)-l-apил2,2,2-трифторо-1-етил) дифенілфосфінової кислоти (71-89%), так і енантіоконтролем (91-99% ее), виходи проміжних продуктів набагато нижчі, а Nфосфіноїлтри фторометилфенілкетімін, наприклад, одержується з відповідного трифтороацетофенону з дуже низьким виходом. Окрім цього вагомим недоліком методу є використання відносно дорогих, і з цієї причини не завжди доступних, металоорганічних сполук (диметил- або діетилцинк, трифлат міді, тетраетоксититан), а також хірального фосфорного ліганда (2R,5R)-1{2[2R,5R)2,5диметилфосфолан-1-іл]феніл}-2,5диметилфосфолан-1-оксиду. В основі другого підходу до синтезу оптично активних 1-заміщених 1-арил-2,2,2-трифтороетил амінів лежить стереоспецифічне заміщення хіральних трифторометилвмісних 1,3-оксазолідинів під дією літійорганічних реагентів [5]. Синтезовані в результаті цієї реакції діастеріомерні 1-заміщені N(2-гідрокси-1-фенілетил)-1-феніл-2,2,трифтороетиламіни перетворюють в цільові аміни або гідрогенолізом на паладієвому каталізаторі при підвищеному тиску (4,5атм, 30год) або окисненням тетраацетатом свинцю в оцтовій кислоті впродовж 60год. З врахуванням того, що 2трифторометил-2-феніл-1,3-оксалідини одержуються конденсацією трифтороацетофенону з (R)фенілгліцином у вигляді діастереомерної суміші (1,6:1), для їх розділення на окремі діастеріомери необхідне використання колонкової хроматографії. Цільові (1R)-1-арил-2,2,2-трифтороетиламши отримуються із відповідного (2S)-діастереомера, а їх (1S)-енантіомери із відповідного (2R)діастереомера. Таким чином, препаративні труднощі поряд з використанням важкодоступних літійорганічних реагентів також значно понижують синтетичну значимість методу. Задачею винаходу є пошук нових похідних хіральних a-трифторометиламінів високої оптичної чистоти та спосіб їх одержання, що відкриває шлях до сполук, які можуть знайти застосування як хіральні реагенти, спектроскопічні мітки та вихідні для раніше не відомих трифторометилзаміщених хіральних похідних 1,3-оксазин-2-ону [6], 1,3тіазин-2-тіону [7, 8] тетрагідропіримідину [9] та ін 4 ших гетероциклічних сполук, перспективних базових систем для нових фармацевтичних препаратів. Задача досягається хіральними 4-аміно-4арил-5,5,5-трифторометилпентан-2-онами загальної формули: NH2 * Ar CH2COCH 3 CF 3 де Аr = Ph, 4-FC6H4, 3-MeC6H4, 4-МеС6Н4, 4МеОС6Н4 які легко отримуються при конденсації арилтрифторометилкетімінів з ацетоном в присутності хіральних органокаталізаторів. Спосіб одержання сполук, які заявляються, полягає в тому що арилтрифторометилкетіміни піддають дії ацетону в розчині диметилсульфоксиду при кімнатній температурі в присутності 10%ної кількості L- або D-проліну. Цільові (R)- або (S)енантіомерні продукти виділяють із реакційної суміші стандартними методами за допомогою екстракції органічним розчинником. Виходи сягають 75-86%, оптична частота - 88-96%. NH2 * L - Пролін Ar Ar ДМСО NH + CF3 O CH2COCH3 CF3 (R) 20 0С D - Пролін NH2 * Ar CH2COCH3 CF3 (S) Отриманий результат є принципово новим і оригінальним, оскільки ні в науковій, ні в патентній літературі не має даних, які б стосувалися енантіоселективного синтезу R-(+)- та S-(-)-4-аміно-4арил-5,5,5-трифтропентан-2-онів при взаємодії арилтрифторометилкетімінів з ацетоном в присутності асиметричних органокаталізаторів. Перевагою запропонованого методу є високо оптична чистота цільових продуктів, доступність як вихідних арилтрифторометилкетімінів [10], так і органокаталізатора L- або D-проліну, які широко використовуються в практиці асиметричного синтезу [11] і ле гко регенеруються, а також м’які умови проведення процесу і препаративна простота виділення сполук. Окрім цього варто відзначити, що на відміну від інших асиметричних реакцій, які при використанні асиметричних каталізаторів, як правило, приводить до одного з енантіомерів, метод ефективний для спрямованого отримання як (R)- і (S)-енантіомерів. Будова та склад 4-аміно-арил-5,5,5трифторопентан-2-онів доведені даними елементного аналізу, ІЧ-спектрів, спектрів ЯМР 1Н та ЯМР 19 F, їх оптична чистота методом ЯМР 19F з використанням лантаноїдного зсуваючого реагента тріс[3-(гептафторбутирил)-L-камфорато]европію, а абсолютна конфігурація методом рентгеноструктурного аналізу на прикладі N-[1-феніл-1(ацетилметил)-2,2,2-трифторо]етиламіду 4бромбензойної кислоти (Фіг.) 5 84821 Винахід ілюструється загальним способом одержання R(+)- та S(-)-4-аміно-4-арил-5,5,5трифтропентан-2-онів і фізико-хімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання R(+)- та S(-)-4aмінo-4-apил-5,5,5-трифтропентан-2-онів. До розчину 0,06 моль арилтрифторометилкетіміну в 50мл диметилсульфоксиду і 20мл ацетону додають 0,42гр (10%) L- або D-проліну (При використанні менших кількостей каталізатора (наприклад, 5%) час реакції зростає до 120год. Використання каталізатора в кількості більшій за 10% істотно не впливає на швидкість перебігу процесу і вихід цільових продуктів). Реакційну суміш перемішують 48 годин при 20°С, фільтрують, фільтрат розбавляють 50мл води та екстрагують хлористим метиленом (3x15мл). Органічний шар промивають 30мл 15%-ної соляної кислоти, водний шар відокремлюють, нейтралізують концентрованим розчином карбонату калію, олієподібну речовину екстрагують хлористим метиленом (2x15мл), сушать над Na2SО4, фільтрують і випарюють. Приклад 1 R(+)-4-Аміно-4-феніл-5,5,5,-трифторопентан-2он. Вихід 86%, олієподібна речовина, nD20=1,4848. Спектр ЯМР 1Н (CDC13, м.д.): 2.05с (3Н, СН3), 2.33с (2Н, NH2), 3.04д (1Н, J=28Гц, СН2), 3.42д (1H, J=27.5Гц, СН2), 7.26-7.39м (3Н, аром.), 7.54д (2Н, J=15Гц, аром.). Спектр ЯМР 19F (CDC13, м.д.): 80.29. [a]D20=+26.61 (с=1.8; МеОН). Приклад 2 R(+)-4-Аміно-4-фторофеніл-5,5,5,трифторопентан-2-он. Вихід 82%, олієподібна речовина, nD20=1.4711. Спектр ЯМР 1Н (CDC13): 2.08с (3Н, СН3), 2.31с (2Н, NH2), 3.05д (1Н, J=28Гц, СН2), 3.39д (1H, J=27.5Гц, СН2), 7.26-7.39м (2Н, аром.), 7.48-7.60м (2Н, аром.). Спектр ЯМР 19F (CDC13, м.д.): -80.42,-115.15. [a]D20=+30,13 (с=0,62; МеОН), nD20=1.4710. Приклад 3 R(+)-4-Аміно-3-метилфеніл-5,5,5,трифторопентан-2-он. Вихід 80%, олієподібна речовина, nD20=1.4852. Спектр ЯМР 1Н (CDC13, м.д.): 2.04с (3Н, СН3,), 2.25с (3Н, NH2), 2.37с (3Н, СН3,), 3.01д (1H, J=16.5Гц, СН2), 3.40д (1H, J=16Гц, СН2), 7.15д (1Н, J=7Гц, аром.), 7.24-7.27м (1Н, аром.), 7.31д (1Н, J=8Гц, аром.), 7.37с (1Н, аром.). Спектр ЯМР 19F (CDC13, м.д.): -80.13. [a]D20=+24.81 (с=0.81; МеОН). Приклад 4 R(+)-4-Аміно-4-метилфеніл-5,5,5,трифторопентан-2-он. Вихід 82%, т.пл.67-68°С (С6Н6/С6Н14). Спектр ЯМР 1Н (CDC13, м.д.): 2.05с (3Н, СН3), 2.30с (2Н, NH2), 2.34с (3Н, СН3), 3.00д (1Н, J=12Гц, СН2), 3.40 д (1H, J=16Гц, СН2), 7.19д (2Н, J=8Гц, аром.), 7.42д (2Н, J=8Гц, аром.). Спектр ЯМР 19F (CDC13, м.д.): -80.22. [a]D20=+15.43 (с=0.74; МеОН). Приклад 5 R(+)-4-Аміно-4-метоксіфеніл-5,5,5,трифторопентан-2-он. Вихід 75%, олієподібна речовина. Спектр ЯМР 1H (CDC13, м.д.): 2.06с (3Н, СН3), 2.30с (2Н, NH2) 3.01д (1Н, J=27.5Гц, СН2), 3.38д (1H, J=27.5Гц, СН2), 3.81с (3Н, ОСН3), 6.92д (2Н, J=15Гц, аром.), 7.45д (2Н, J=15Гц, аром.). 6 Спектр ЯМР 19F (CDC13, м.д.): -80.47. [a]D20=+10.32 (с=0.39; МеОН). Приклад 6 S(-)-4-Аміно-4-феніл-5,5,5,-трифторопентан-2он. Вихід 86%, олієподібна речовина, nD20=1.4848. Спектр ЯМР 1Н (CDC13, м.д.): 2.06с (3Н, СН3), 2.34с (2Н, NH2), 3.05д (1H, J=28Гц, СН2), 3.44д (1H, J=27.5Гц, СН2), Гц), 7.27-7.40м (3Н, аром.), 7.507.62м (2Н, аром.). Спектр ЯМР 19 F (CDC13, м.д.): 80.31. [a]D20=-26.61 (с=1.8; МеОН). Приклад 7 S(-)-4-Аміно--4-метилфеніл-5,5,5,трифторопентан-2-он. Вихід 82%, т.пл. 67-68°С (бензол-гексан, 2:1). Спектр ЯМР 1Н (CDC13, м.д.): 2.07с (3Н, СН3), 2.32с (2Н, NH2), 2.36с (3Н, СН3), 3.04д (1H, СН2, J=16.5Гц), 3.43д (1Н, СН2, J=16.5Гц), 7.24д (2Н аром, J=8.4Гц), 7.44 д (2Н аром, J=8.1Гц). Спектр ЯМР 19F (CDCl3, м.д.): 80.23. [a]D20=-15.44 (с=0.74; МеОН). Приклад 8 S(-)-4-Аміно-4-фторофеніл-5,5,5,трифторопентан-2-он. Вихід 82%, олієподібна речовина, nD20=1.4710. Спектр ЯМР 1H (CDC13): 2.09с (3Н, СН3), 2.33с (2Н, NH2), 3.07д (1Н, СН2, J=16.8Гц,), 3.41д (1Н, СН2, J=16.5Гц), 7.28д (2Н аром, J=9.3Гц), 7.55д (2Н аром, J=9.3Гц). Спектр ЯМР 19F (CDC13, м.д.): -80.43, -115.17. [a]D20= 30,14 (с=0,62; МеОН). Приклад 9 R(-)-N-[1-Феніл-1-(ацетилметил)-2,2,2трифторо]етиламід 4-бромбензойної кислоти. До розчину 0.5г (0.00216 моль) 4-аміно-4-феніл-5,5,5трифторопентан-2-ону в 6мл діоксану, додають 0.614г (0.00216 моль) хлорангідриду 4бромбензойної кислоти і 0.34мл (0.0024 моль) триетиламіну. Реакційну суміш кип’ятять 4год, фільтрують і випарюють. Олієподібну речовину темно-коричневого кольору промивають концентрованим розчином карбонату калію, екстрагують хлористим метиленом (2x8мл), сушать над безводним сульфатом натрію, фільтрують і випарюють. Утворену олієподібну речовину розчиняють в 5мл метанолу і додають 1мл води, утворений осад фільтрують, сушать і кристалізують із суміші бензол-гексан, 1:1. Вихід 94%, т.пл. 218°С. Спектр ЯМР 1Н (CDC13, м.д.): 2.22с (3Н, СН3), 3.40д (1H, СН2, J=18Гц), 3.69д (1Н, СН2, J=18Гц), 7.38-7.46м (5Н, аром.), 7.60с (1H, NH), 7.62д (2Н аром, J=9Гц,), 7.71д (2Н аром, J=9Гц,). Спектр ЯМР 19F (CDC13, м.д.): -73.27. [a]D20= -45.68 (с=0.74; МеОН). Література: 1. Filler R., Kobayashi Y., Yagupolski L.M. Organofluorine Compounds in Medicinal Chemistry and Biomedical Applications. - Elsevier, Amsterdam. 1993. 2. Hiyoma T. Organofluorine Compounds: Chemistry and Applications.-Springer, New York. 2000. 3. Boezo A.A. and Charette A.B. Catalytic Enantioselective Addition of Dialkylzinc to NDiphenylphosphinoylimines . A Practical Synthesis of a -Chiral Amines// J. Amer. Chem. Soc. - 2003. - Vol. 125, №7 - P. 1692 -1693. 4. Louzon C, Charette A.B. Catalytic Asymmetric Synthesis of a,a,a -Trifluoromethylamines by the 7 84821 Copper - Catalyzed Nucleophilic Addition of Diorganozinc Reagents to Imines // Org. Lett. - 2006. - Vol. 8, №13. - P. 2743-2745. 5. Stereocontrol at the Quaternary Center in 1Substituted 1 - Phenyl - 2,2,2 -Trifluoroethylamines: Stereospecific Substitution with Retention of a Chiral Cyclic Fluoral N,O-acetal with Organolithium Reagents// Tetrahedron Lett. - 1998. - Vol. 39. - P. 1199 - 1202. 6. Фисюн А.С., Рыжова Е.А., Унковский Б.В. Взаимодействие метил – N (оксоалкил)карбоматов, S - метилтиокарбоматов и дитиокарбоматов с борогидридом натрия. Синтез тетрагидро-1,3-оксазин-2-онов и -тионов// Химия гетероцикл. соед. - 2001. - №5. - С.649-662. 7. Jansen J.E., Mathes R.A. Synthesis of Thiazinethiols// J.Amer.Chem.Soc-1955. -Vol.77. - P. 5431-5432. Комп’ютерна в ерстка В. Клюкін 8 8. Jochims V.C., Alu - Taha A. Uber 5- und 4hydroxythione// Chem. Ber. -1976.-Bd.109.-S. 139153. 9. Asinder F., Thiel M., Baltz H. Uber die Umsetzung von (3-Amino-Ketonen mit Ammoniar und Oxogruppen enthultenden Verbindungen zu 2,3,4,4 Tetrahydropyrimidinen// Monatsh. Chem. - 1954. - Bd. 88., №4. - S.464-472. 10. B.H. Фетюхин, A.C. Корецкий, В.И. Горбатенко, Л.И.Самарат. 1-хлор-1-арил-2,2,2трифторэтилизоцианаты// Журн. Орган. Химии. 1977. - Т.-13, вип. 2. - С.271-275. 11. Guillena G, Najera С. and Ramon D.J. Enantioselective direct aldol reaction: the blossoming of modern organocatalysis// Tetrahedron: Asymmetry 18. - 2007. - P. 2249-2293. Підписне Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of chiral 4-amino-4-aryl-5,5,5-trifluoropentane-2-ones
Автори англійськоюVovk Mykhailo Volodymyrovych, Sukach Volodymyr Andriiovych, Holovach Natalia Mykhailivna, Pirozhenko Volodymyr Valentynovych, Rusanov Eduard Borysovych
Назва патенту російськоюСпособ получения хиральных 4-аміно-4-арил-5,5,5-трифторопентан-2-онов
Автори російськоюВовк Михаил Владимирович, Сукач Владимир Андреевич, Головач Наталия Михайловна, Пироженко Владимир Валентинович, Русанов Эдуард Борисович
МПК / Мітки
МПК: C07B 53/00, C07C 221/00, C07C 225/00
Мітки: хіральних, спосіб, 4-аміно-4-арил-5,5,5-трифторопентан-2-онів, одержання
Код посилання
<a href="https://ua.patents.su/4-84821-sposib-oderzhannya-khiralnikh-4-amino-4-aril-555-triftoropentan-2-oniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання хіральних 4-аміно-4-арил-5,5,5-трифторопентан-2-онів</a>
Попередній патент: Еластомерна оболонка полімерного ізолятора
Наступний патент: Пиловловлювач із конусним відокремлювачем
Випадковий патент: Спосіб ведення пологів при вузькому тазі по і. амро і пристрій для його здійснення








