Спосіб одержання 3-(4-піперидиніл)-2,3,4,5-тетрагідро-1,3-бензодіазепін-2(1н)-ону
Номер патенту: 87507
Опубліковано: 27.07.2009
Автори: Шнаубельт Юрген, Гутшера Лудвіг, Крюгер Томас, Зойка Райнер, Хаймрот Хайделоре, Ралль Вернер, Прьолль Армін, Бірк Норберт
Формула / Реферат
1. Спосіб одержання сполуки формули
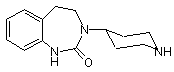 , (I)
, (I)
який відрізняється тим, що
(а) у присутності агентів конденсації 2-нітрофенілоцтову кислоту піддають взаємодії з 4-аміно-N-фенілметилпіперидином,
(б) карбонільну групу одержаного 2-нітро-N-[1-(фенілметил)-4-піперидиніл]фенілацетаміду переводять за рахунок додавання відповідного відновника в метиленову групу,
(в) одержаний проміжний N-[2-(2-нітрофеніл)етил]-1-(фенілметил)-4-амінопіперидин після відновлення нітрогрупи у присутності нікелю Ренея як каталізатора піддають циклізації за рахунок додавання агентів конденсації з одержанням 3-[1-(фенілметил)-4-піперидиніл]-2,3,4,5-тетрагідро-1,3-бензодіазепін-2(1Н)-ону, та
(г) 3-[1-(фенілметил)-4-піперидиніл]-2,3,4,5-тетрагідро-1,3-бензодіазепін-2(1Н)-он за рахунок відщеплення бензильної захисної групи переводять у сполуку формули (І).
2. Спосіб за п. 1, який відрізняється тим, що на стадії (а) 4-аміно-N-фенілметилпіперидин додають у вигляді розчину та одержаний продукт цієї реакції викристалізовують розведенням водою.
3. Спосіб за п. 1, який відрізняється тим, що на стадії (б) 2-нітро-N-[1-(фенілметил)-4-піперидиніл]фенілацетамід розчиняють у полярному апротонному органічному розчиннику та реакцію відновлення проводять при температурі в інтервалі від 20 до 70 °С, необов'язково при додаванні кислоти Льюїса, іншої кислоти або галогену.
4. Спосіб за п. 1, який відрізняється тим, що на стадії (в) вихідну сполуку попередньо додають у диметилформамід, додають каталізатор у вигляді водної суспензії та потім гідрують при температурі в інтервалі від 20 до 60 °С та надлишковому тиску водню максимум 3 бар.
5. Спосіб за п. 1, який відрізняється тим, що на стадії (г) вихідну речовину розчиняють у полярному розчиннику та після додавання агента гідрування гідрують у розрахованому на роботу під тиском реакторі при температурі в інтервалі від 40 до 80 °С та надлишковому тиску водню максимум 3 бар.
6. Спосіб за п. 1, який відрізняється тим, що одержаний на стадії (б) проміжний N-[2-(2-нітрофеніл)етил]-1-(фенілметил)-4-амінопіперидин осаджують за рахунок додавання водного розчину сильної кислоти та виділяють у вигляді солі.
7. Спосіб за п. 4, який відрізняється тим, що одержаний 3-[1-(фенілметил)-4-піперидиніл]-2,3,4,5-тетрагідро-1,3-бензодіазепін-2(1H)-он осаджують шляхом розведення водою та спиртом.
Текст
1. Спосіб одержання сполуки формули C2 2 (19) 1 3 87507 4 Даний винахід стосується способу одержання дити при температурі в інтервалі від 20 до 60°С та 3-(4-піперидиніл)-2,3,4,5-тетрагідро-1,3надлишковому тиску водню максимум 3 бар. Після бензодіазепін-2(1Н)-ону формули відфільтровування каталізатора продукт гідрування можна концентрувати за рахунок відгону розчинника. Після цього проводять реакцію циклізації, для чого одержаний описаним вище шляхом сирий продукт додають до суспензії принаймні одного еквівалента, краще 1,1-1,75 еквівалента, особливо краще 1,1 еквівалента, агента конденсації, такого, який являє собою структурний фрагмент наприклад, як карбонілдіімідазол або карбонілдитCGRP-антагоністів, (від англ. "calcitonin gene риазол. Як розчинники при цьому можна викорисrelated protein", протеїн, зв'язаний з геном кальцитати полярні апротонні розчинники, такі як тетрагітоніну), які можуть застосовуватися насамперед дрофуран, етилацетат, 2-метилтетрагідрофуран, для терапії мігрені шляхом їх прийому усередину. диметилформамід або N-метилпіролідинон. Одержаний таким шляхом 3-[1-(фенілметил)-4Приклади сполук із властивостями CGRPпіперидиніл]-2,3,4,5-тетрагідро-1,3-бензодіазепінантагоністів, які містять як їх структурний фраг2(1Н)-он можна осаджувати, наприклад, за рахумент сполуку формули (І), описані в нок розведення водою та спиртом, таким як метаРСТ/ЕР97/04862, PCT/EP00/02004, нол, етанол або ізопропанол, краще метанол, і PCT/EP00/13236, PCT/EP03/02417, після відділення речовини, яка випала в осад, PCT/EP03/11762 і PCT/EP03/11763. шляхом фільтрації або центрифугування піддаваЯк вихідна речовина для одержання сполуки ти її сушінню. формули І може використовуватися 2При необхідності проміжний N-[2-(2нітрофенілоцтова кислота. На першій стадії цю нітрофеніл)етил]-1-(фенілметил)-4-амінопіперидин кислоту піддають взаємодії з еквімолярним розчиможна осаджувати за рахунок додавання принайном 4-аміно-N-фенілметилпіперидину у присутносмні 2 еквівалентів водного розчину сильної кислоті принаймні одного еквівалента, краще 1,1-1,5 ти та виділяти у вигляді солі. Як приклади придатеквівалента, особливо краще 1,1 еквівалента, агених для використання для цього кислот можна нта конденсації, такого як карбонілдіімідазол, карназвати соляну кислоту, бромистоводневу кислоту бонілдитриазол, н-пропанфосфоновий ангідрид, або сірчану кислоту, насамперед соляну кислоту, дициклогексилкарбодіімід, тіонілхлорид, ТБТУ [тепри застосуванні якої одержують дигідрохлорид. Із трафтороборат О-(бензотриазол-1-іл)-N,N,N',N'цією метою реакційну суміш охолоджують до кімтетраметилуронію] або 1-етил-3-(3'натної температури та змішують з відповідним диметиламінопропіл)карбодіімід, з одержанням 2спиртом, таким, наприклад, як метанол, етанол нітро-N-[1-(фенілметил)-4або ізопропанол, краще метанол. Після додавання піперидиніл]фенілацетаміду. Придатними для деякого надлишку водної кислоти суміш повторно проведення зазначеної реакції розчинниками є нагрівають зі зворотним холодильником і потім полярні апротонні розчинники, такі як тетрагідрознову охолоджують. Далі суміш підлуговують водфуран, диметоксіетан, толуол, диметилформамід ним розчином відповідної основи, наприклад, гідабо N-метилпіролідинон. Продукт можна викрисроксиду літію, гідроксиду натрію, аміаку або гідроталізовувати, наприклад, розведенням реакційної ксиду калію, і після розділення фаз органічну фазу суміші водою та після відділення кристалів шлязмішують із надлишком водної кислоти, що супрохом фільтрації або центрифугування піддавати їх воджується викристалізовуванням необхідної солі. сушінню. На наступній основній стадії 2-нітро-Ν-[1Одержаний продукт можна потім відокремлювати (фенілметил)-4-піперидиніл] фенілацетамід спочашляхом фільтрації або центрифугування та піддатку розчиняють у полярному апротонному органічвати сушінню. ному розчиннику, такому, наприклад, як тетрагідНа третій стадії відщеплюють бензильну захирофуран або диметоксіетан, після чого сну групу 3-[1-(фенілметил)-4-піперидиніл]-2,3,4,5карбонільну групу додаванням принаймні одного тетрагідро-1,3-бензодіазепін-2(1Н)-ону. Із цією еквівалента, краще 2,0-4,0 еквівалентів, відповідметою вихідну речовину розчиняють у полярному ного відновника переводять у метиленову групу. розчиннику, такому, наприклад, як метанол, етаЯк відновник при цьому можна використовувати, нол, вода, ацетон, тетрагідрофуран, диметилфорнаприклад, боран, борогідрид літію або борогідрид мамід або пропанол, і гідрують у розрахованому натрію, необов'язково при додаванні принаймні 0,5 на роботу під тиском реакторі. Як агент гідрування еквівалента, краще 2,0-4,0 еквівалентів, кислоти можна використовувати, наприклад, Pd/C або Льюїса, іншої кислоти або галогену, наприклад, Pd(OH)2. Таке гідрування краще проводити при при додаванні сірчаної кислоти, хлортриметилситемпературі в інтервалі від 40 до 80°С та надлишлану або йоду. Реакцію відновлення можна провоковому тиску водню максимум 3 бар. Після відфідити при температурі в інтервалі від 20 до 70°С, льтровування каталізатора одержаний як продукт краще від 60 до 70°С. гідрування 3-(4-піперидиніл)-2,3,4,5-тетрагідро-1,3Потім нітрогрупу одержаного таким шляхом бензодіазепін-2(1Н)-он формули (І) можна кристапроміжного Ν-[2-(2-нітрофеніл)етил]-1лізувати за рахунок випарювання розчинника та (фенілметил)-4-амінопіперидину гідрують у присунаступного додавання ацетону або води й потім тності нікелю Ренея як каталізатора. Для такого відфільтровувати та сушити. гідрування вихідну речовину додають у диметилЕкспериментальна частина формамід, а потім додають каталізатор у вигляді водної суспензії. Подібне гідрування краще прово 5 Приклад 1: 2-нітропіперидиніл]фенілацетамід 87507 6 перемішують при нагріванні зі зворотним холодильником. Одержану суспензію протягом 3 год охолоджують до 0°С. Для повноти кристалізації суспензію перемішують протягом 1 год при 0°С. Після цього продукт відокремлюють центрифугуванням, промивають 20 л тетрагідрофурану та сушать у сушильній камері в струмі інертного газу при 50°С. 11,81 кг (72,87 моль, 1,1 екв.) 1,1Вихід: 7,78 кг (66,7% від теорії). карбонілдіімідазолу (КД) попередньо завантажуХімічна чистота згідно з ВЕРХ: 99,3%. ють у реактор при 20°С і потім додають 18 л тетраПриклад 3: 3-[1-(фенілметил)-4-піперидиніл]гідрофурану. Далі протягом 15 хв додають 12,00 кг 2,3,4,5-тетрагідро-1,3-бензодіазепін-2(1Н)-он (66,24 моль, 1,0 екв.) 2-нітрофенілоцтової кислоти, розчиненої в 24 л тетрагідрофурану. Живильну ємність промивають 9 л тетрагідрофурану й реакційну суміш перемішують протягом 30 хв (супроводжується виділенням газоподібного СО2). Потім для видалення надлишкового СО2 двічі вакууму10,00 кг (24,25 моль, 1,0 екв.) дигідрохлориду ють до залишкового тиску 300 мбар. N[-[2-(2-нітрофеніл)етил]-1-(фенілметил)-4До розчину при 20°С додають 12,61 кг (66,24 амінопіперидину із прикладу 2 попередньо додамоль, 1,0 екв.) 4-aміно-N-фенілметилпіперидину в ють у толуол і воду, узяті порціями по 30 л. Потім 6 л тетрагідрофурану (екзотермічна реакція). Пісдодають 5,82 кг (72,75 моль, 3,0 екв.) 50%-вого ля цього реакційну суміш перемішують ще протярозчину технічного гідроксиду натрію та двофазогом 2 год при 20°С. Далі додають 144 л води, ввову суміш протягом 1 год перемішують при 50°С. дячи в розчин після додавання 1/4 від усієї Водну фазу відокремлюють, а органічну фазу кількості використовуваної води 2-нітро-N-[1промивають 12 л води й після цього концентрують (фенілметил)-4-піперидиніл]фенілацетамід як зау вакуумі. Залишок змішують з 50 л метанолу. Чатравку. Одержану суспензію охолоджують до темстину використовуваного метанолу відганяють. ператури 0-5°С та для повноти кристалізації переРозчин, який залишається, гідрують у присутності мішування продовжують ще протягом 1 год. Потім 860 г нікелю Ренея при 50°С. Каталізатор відфільпродукт відокремлюють центрифугуванням, протровують і продукт гідрування промивають 16 л мивають холодною сумішшю з 160 л води та 9 л метанолу. Розчинник відганяють і залишок змішутетрагідрофурану і сушать у сушильній камері у ють з 30 л тетрагідрофурану. Половину викорисструмі інертного газу при 45°С. товуваного тетрагідрофурану відганяють і розчин, Вихід: 18,21 кг (77,8% від теорії). що залишився, протягом 1,5 год дозують при 20°С Хімічна чистота згідно з ВЕРХ (високоефектиу суспензію з 6,88 кг (42,44 моль, 1,75 екв.) 1,1вна рідинна хроматографія): 99,8%. карбонілдіімідазолу в 15 л тетрагідрофурану. Далі Приклад 2: Дигідрохлорид N-[2-(2протягом 1,5 год перемішують при цій температурі. нітрофеніл)етил]-1-(фенілметил)-4Потім додають 20 л води, вводять затравку і доамінопіперидину дають ще 17 л води. Одержану суспензію охолоджують до 0°С. Для повноти кристалізації суспензію перемішують протягом 1,5 год при 0°С. На завершення продукт відокремлюють шляхом центрифугування, промивають ЗО л води та сушать у сушильній камері у струмі інертного газу при 45°С. 10,00 кг (28,29 моль, 1,0 екв.) 2-нітро-N-[1Вихід: 6,38 кг (78,4% від теорії). (фенілметил)-4-піперидиніл] фенілацетаміду із Хімічна чистота згідно з ВЕРХ: 98,5%. прикладу 1 попередньо додають в 60 л тетрагідПриклад 4: 3-[1-(фенілметил)-4-піперидиніл]рофурану та нагрівають до 60°С. Потім протягом 2,3,4,5-тетрагідро-1,3-бензодіазепін-2(1Н)-он 15 хв при температурі 60-65°С додають 11,06 кг (101,84 моль, 3,6 екв.) хлортриметилсилану та 14,79 кг (67,90 моль, 2,4 екв.) 10%-вого розчину борогідриду літію в ТГФ (реакція супроводжується виділенням газу). Далі реакційну суміш перемішують протягом 4 год, потім охолоджують до 20°С та 17,00 кг (48,10 моль, 1,0 екв.) 2-нітро-N-[1змішують з 7 л метанолу. Після додавання 14,80 кг (фенілметил)-4-піперидиніл]фенілацетаміду з при(121,65 моль, 4,3 екв.) 30%-вої технічної соляної кладу 1 суспендують в 170 л диметилового ефіру кислоти суміш протягом 2,5 год перемішують при етиленгліколю й охолоджують до температури 0нагріванні зі зворотним холодильником, після чого 5°С. При цій температурі спочатку порціями додаохолоджують до 20°С та значення pH встановлюють 7,28 кг (192,40 моль, 4,0 екв.) борогідриду нають на 9,2 додаванням 8,38 кг (104,67 моль, 3,7 трію, а потім розчин 9,91 кг (101,01 моль, 2,1 екв.) екв.) 50%-вого розчину технічного гідроксиду натехнічної сірчаної кислоти в 17 л диметилового трію. Водну фазу відокремлюють, а органічну фазу ефіру етиленгліколю. Після цього промивають 6,8 змішують з 6,89 кг (56,58 моль, 2,0 екв.) 30%-вої л диметилового ефіру етиленгліколю. Далі реактехнічної соляної кислоти (pH 1,5) і протягом 1 год ційну суміш протягом 1 год нагрівають до 70°С та N-[1-(фенілметил)-4 7 87507 8 протягом 4 год перемішують при цій температурі. кристалізації при 50°С додатково додають ще 34 л Після охолодження до 55°С додають розчин з 29 л води, після чого суспензію протягом 1 год охоловоди та 11,69 кг (96,20 моль, 2,0 екв.) 30%-вої техджують до 10°С та протягом 30 хв перемішують нічної соляної кислоти. Після додавання цієї киспри цій температурі. На завершення осад відокрелоти промивають 5 л води. Перемішування продомлюють шляхом центрифугування, промивають 85 вжують ще протягом 1,5 год при 70°С. Потім л води та сушать при 50°С у сушильній камері. реакційну суміш охолоджують до 20°С та змішують Вихід: 12,73 кг (78,9% від теорії). з 30,0 кг (375,18 моль, 7,8 екв.) 50%-вого розчину Хімічна чистота згідно з ВЕРХ: 96,0%. технічного гідроксиду натрію та 17 л води. Після Приклад 5: 3-(4-піперидиніл)-2,3,4,5розділення фаз органічну фазу концентрують у тетрагідро-1,3-бензодіазепін-2(1Н)-он вакуумі до утворення маслянистого залишку, який змішують із 43 л диметилформаміду. Одержаний описаним вище шляхом розчин зливають із реактора у відповідну ємність і з неї подають у реактор гідрування. 1,35 кг суспензії нікелю Ренея як каталізатор, 10,00 кг (29,81 моль, 1,0 екв.) 3-[1що попередньо тричі змішували з диметилформа(фенілметил)-4-піперидиніл]-2,3,4,5-тетрагідро-1,3мідом, використовуваним порціями по 3 л, і роздібензодіазепін-2(1Н)-ону з прикладу 3 розчиняють в ляли декантацією, суспендують в 3 л диметилфо100 л метанолу, змішують із 1,00 кг 10%-вого Pd/C рмаміду та піддають вакуум-фільтрації. Потім і гідрують у розрахованому на роботу під тиском суміш гідрують при тиску 3 бар та внутрішній темреакторі при температурі 70°С та тиску 3 бар. Піспературі 50°С до повного припинення поглинання ля завершення поглинання водню каталізатор водню. Після цього каталізатор відфільтровують і відфільтровують і продукт гідрування промивають продукт гідрування промивають 17 л диметилфо30 л метанолу. Фільтрат концентрують у вакуумі та рмаміду. Потім у вакуумі відганяють принаймні 46 залишок суспендують в 100 л ацетону. Після цього л розчинника. Якщо вміст води в дистиляті після суспензію нагрівають зі зворотним холодильником, відгону цієї кількості перевищує 1%, то відгін варто перемішують протягом 15 хв також при нагріванні продовжувати до досягнення необхідного показнизі зворотним холодильником і потім при нормалька. ному тиску відганяють половину ацетону. Після 8,58 кг (52,91 моль, 1,1 екв.) 1,1відгону ацетону суміш охолоджують до 0°С та пекарбонілдіімідазолу попередньо завантажують у ремішування продовжують ще протягом 1 год. На реактор і змішують із 32 л диметилформаміду. завершення продукт відокремлюють вакуумПотім при температурі 20°С протягом 2 год додафільтрацією, промивають 20 л ацетону та сушать ють розчин для гідрування (з попередньої стадії при 50°С. реакції). Після 30-хвилинного перемішування пеВихід: 6,17 кг (84,3% від теорії). ревіряють повноту хімічного перетворення. Потім Хімічна чистота згідно з ВЕРХ: 99,8%. нагрівають до 50°С та протягом 35 хв додають суміш із 34 л метанолу та 136 л води. Для повноти Комп’ютерна верстка В. Мацело Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing 3-(4-piperidinyl)-2,3,4,5-tetrahydro-1,3-benzodiazepin-2(1h)-one
Автори англійськоюSchnaubelt Juergen, Rall Werner, Soyka Rainer, Birk Norbert, Gutschera Ludwig, Heimroth Heidelore, Krueger Thomas, Proell Armin
Назва патенту російськоюСпособ получения 3-( 4-пиперидинил)-2,3,4,5-тетрагидро-1,3-бензодиазепин-2(1н)-она
Автори російськоюШнаубельт Юрген, Ралль Вернер, Зойка Райнер, Бирк Норберт, Гутшера Лудвиг, Хаймрот Хайделоре, Крюгер Томас, Прьолль Армин
МПК / Мітки
МПК: C07D 243/04
Мітки: спосіб, 3-(4-піперидиніл)-2,3,4,5-тетрагідро-1,3-бензодіазепін-2(1н)-ону, одержання
Код посилання
<a href="https://ua.patents.su/4-87507-sposib-oderzhannya-3-4-piperidinil-2345-tetragidro-13-benzodiazepin-21n-onu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 3-(4-піперидиніл)-2,3,4,5-тетрагідро-1,3-бензодіазепін-2(1н)-ону</a>
Попередній патент: Застосування електроліту як стабілізатора інгібітора
Наступний патент: Пристрій та спосіб регулювання режиму роботи установки сухого гасіння коксу
Випадковий патент: Циліндро-конічний танк для зброджування пива








