Похідні піперидиніл- і піперазинілалкілкарбаматів, спосіб їх одержання (варіанти) і їх застосування в терапії
Номер патенту: 81808
Опубліковано: 11.02.2008
Автори: Женесс Жан, Бюрньє Філіпп, Пюек Фредерік, Абуабделла Ахмед, Хорнарт Крістіан
Формула / Реферат
1. Сполука, відповідна формулі (І)
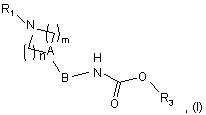
де
А являє собою атом азоту або групу CR2, в якій R2 являє собою атом водню або фтору або гідроксильну, ціано, трифторметильну, С1-6алкільну або С1-6алкоксигрупу;
n являє собою ціле число, що дорівнює 2 або 3, і m являє собою ціле число, що дорівнює 2, коли А являє собою атом азоту;
n являє собою ціле число, що дорівнює 1, 2 або 3, і m являє собою ціле число, що дорівнює 1 або 2, коли А являє собою групу CR2;
В являє собою ковалентний зв'язок або С1-8алкіленову групу;
R1 являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, триазинілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, імідазолілу, оксадіазолілу, тіадіазолілу, триазолілу, нафтилу, хінолілу, тетрагідрохінолілу, ізохінолілу, тетрагідроізохінолілу, фталазинілу, хіназолінілу, хіноксалінілу, нафтиридинілу, цинолілу, імідазопіримідинілу, тієнопіримідинілу, бензофуранілу, бензотієнілу, бензимідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, індазолілу, піролопіридилу, фуропіридилу, дигідрофуропіридилу, тієнопіридилу, дигідротієнопіридилу, імідазопіридилу, піразолопіридилу, оксазолопіридилу, ізоксазолопіридилу і тіазолопіридилу;
причому група R1 можливо заміщена однією або більше групами R' і/або R";
R' являє собою атом галогену або групу ціано, нітро, гідроксил, С1-6алкіл, С1-6алкокси, С1-6тіоалкіл, С1-6фторалкіл, С1-6фторалкокси, С1-6фтортіоалкіл, С3-7циклоалкіл, С3-7циклоалкіл-С1-6алкілен, азетидиніл, піперидил, піролідиніл, морфолініл, піперазиніл, азепініл, NH2, NHR6, NR6R7, NR6COR7, NR6SO2R7, COR6, CO2R6, SO2R6, SO2NR6R7 або -О-(С1-6алкілен)-О-;
R" являє собою феніл, імідазоліл, піридил або піримідиніл;
причому група(и) R" можливо заміщена(і) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної;
R3 являє собою групу загальної формули CHR4CONHR5, в якій
R4 являє собою атом водню або С1-6алкільну групу, і
R5 являє собою атом водню або групу С1-6алкіл, С3-7циклоалкіл або С3-7циклоалкіл-С1-6алкілен;
R6 і R7 незалежно один від одного являють собою С1-6алкільну групу;
в формі основи, солі приєднання кислоти, гідрату або сольвату.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що:
А являє собою атом азоту;
n являє собою ціле число, що дорівнює 2 або 3, і m являє собою ціле число, що дорівнює 2;
В являє собою С1-8алкіленову групу;
R1 являє собою групу, вибрану з фенілу, піридилу, піримідинілу, тіадіазолілу і нафтилу;
причому група R1 можливо заміщена однією або більше групами R' і/або R'';
R' являє собою атом галогену або групу нітро, або С1-6фторалкіл;
R" являє собою феніл, можливо заміщений однією або більше групами, які можуть бути однаковими або відмінними одна від одної, вибраними з атома галогену або групи ціано, С1-6алкокси або С1-6фторалкокси;
R3 являє собою групу загальної формули CHR4CONHR5, в якій
R4 являє собою атом водню, і
R5 являє собою атом водню або групу С1-6алкіл, С3-7циклоалкіл або С3-7циклоалкіл-С1-6алкілен;
в формі основи, солі приєднання кислоти, гідрату або сольвату.
3. Сполука формули (І) за п. 1, яка відрізняється тим, що:
А являє собою групу CR2, в якій R2 являє собою атом водню або фтору або гідроксильну групу;
m являє собою ціле число, що дорівнює 1 або 2, і
n являє собою ціле число, що дорівнює 1 або 2;
В являє собою ковалентний зв'язок або С1-4алкіленову групу;
R1 являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, тіазолілу, хінолілу, ізохінолілу, фталазинілу, хіназолінілу, хіноксалінілу, нафтиридинілу, фуропіридилу, тієнопіримідинілу, імідазопіримідинілу, бензотіазолілу, бензимідазолілу і бензоксазолілу;
причому група R1 можливо заміщена однією або більше групами R' і/або R'';
R' являє собою атом галогену або групу ціано, або С1-6алкіл, С1-6алкокси, С1-6фторалкіл, С1-6фторалкокси, С3-7циклоалкіл, піролідиніл, NH2, NR6R7 або COR6;
R" являє собою феніл, імідазоліл або піридил;
причому група(и) R'' можливо заміщена(і) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної, більш конкретно, одним або більше ніж одним атомом хлору або фтору;
R3 являє собою групу загальної формули CHR4CONHR5, в якій
R4 являє собою атом водню або С1-6алкільну групу, і
R5 являє собою атом водню або групу С1-6алкіл, С3-7циклоалкіл або С3-7циклоалкіл-С1-6алкілен;
R6 і R7 незалежно один від одного являють собою С1-6алкільну групу;
в формі основи, солі приєднання кислоти, гідрату або сольвату.
4. Сполука формули (І) за п. 1 або 3, яка відрізняється тим, що:
А являє собою групу CR2, в якій R2 являє собою атом водню;
m дорівнює 2 і
n дорівнює 2;
В являє собою етильну групу;
R1 являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, тіазолілу, хінолілу, ізохінолілу, фталазинілу, хіназолінілу, хіноксалінілу, нафтиридинілу, фуропіридилу, тієнопіримідинілу, імідазопіримідинілу, бензотіазолілу, бензимідазолілу і бензоксазолілу;
причому група R1 можливо заміщена однією або більше групами R' і/або R";
R' являє собою атом галогену або групу ціано, або С1-6алкіл, С1-6алкокси, С1-6фторалкіл, С1-6фторалкокси, С3-7циклоалкіл, піролідиніл, NH2, NR6R7 або COR6;
R" являє собою феніл, імідазоліл або піридил;
причому група(и) R" можливо заміщена(і) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної, більш конкретно, одним або більше ніж одним атомом хлору або фтору;
R3 являє собою групу загальної формули CHR4CONHR5, в якій
R4 являє собою атом водню, і
R5 являє собою атом водню або С1-6алкільну групу;
R6 і R7 незалежно один від одного являють собою С1-6алкільну групу;
в формі основи, солі приєднання кислоти, гідрату або сольвату.
5. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-4, що включає стадію перетворення карбамату загальної формули (Іа)
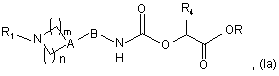
де:
n, m, А, В, R1 і R4 такі, як визначено в загальній формулі (І) згідно з п. 1, і
R являє собою метильну або етильну групу,
за допомогою амінолізу з використанням аміну загальної формули R5NH2, де R5 такий, як визначено в загальній формулі (І) згідно з п. 1.
6. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-4, що включає стадію перетворення оксазолідиндіонового похідного загальної формули (V)
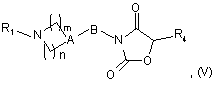
де n, m, А, В, R1 і R4 такі, як визначено в загальній формулі (І) згідно з п. 1,
за допомогою амінолізу з використанням аміну загальної формули R5NH2, де R5 такий, як визначено в загальній формулі (І) згідно з п. 1.
7. Сполука, відповідна загальній формулі (Іа)
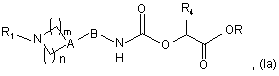
де:
А являє собою атом азоту або групу CR2, в якій R2 являє собою атом водню або фтору або гідроксильну, ціано, трифторметильну, С1-6алкільну або С1-6алкоксигрупу;
n являє собою ціле число, що дорівнює 2 або 3, і
m являє собою ціле число, що дорівнює 2, коли А являє собою атом азоту;
n являє собою ціле число, що дорівнює 1, 2 або 3, і m являє собою ціле число, що дорівнює 1 або 2, коли А являє собою групу CR2;
В являє собою ковалентний зв'язок або С1-8алкіленову групу;
R1 являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, триазинілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, імідазолілу, оксадіазолілу, тіадіазолілу, триазолілу, нафтилу, хінолілу, тетрагідрохінолілу, ізохінолілу, тетрагідроізохінолілу, фталазинілу, хіназолінілу, хіноксалінілу, нафтиридинілу, цинолілу, імідазопіримідинілу, тієнопіримідинілу, бензофуранілу, бензотієнілу, бензимідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, індазолілу, піролопіридилу, фуропіридилу, дигідрофуропіридилу, тієнопіридилу, дигідротієнопіридилу, імідазопіридилу, піразолопіридилу, оксазолопіридилу, ізоксазолопіридилу і тіазолопіридилу;
причому група R1 можливо заміщена однією або більше групами R' і/або R'';
R' являє собою атом галогену або групу ціано, нітро, гідроксил, С1-6алкіл, С1-6алкокси, С1-6тіоалкіл, С1-6фторалкіл, С1-6фторалкокси, С1-6фтортіоалкіл, С3-7циклоалкіл, С3-7циклоалкіл-С1-6алкілен, азетидиніл, піперидил, піролідиніл, морфолініл, піперазиніл, азепініл, NH2, NHR6, NR6R7, NR6COR7, NR6SO2R7, COR6, CO2R6, SO2R6, SO2NR6R7 або -О-(С1-6алкілен)-О-;
R" являє собою феніл, імідазоліл, піридил, піразиніл, піридазиніл або піримідиніл;
причому група(и) R'' можливо заміщена(і) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної;
R4 являє собою атом водню або С1-6алкільну групу;
R6 і R7 незалежно один від одного являють собою С1-6алкільну групу;
R являє собою метильну або етильну групу.
8. Сполука, відповідна загальній формулі (V)
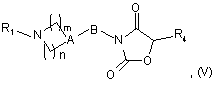
де:
А являє собою атом азоту або групу CR2, в якій R2 являє собою атом водню або фтору або гідроксильну, ціано, трифторметильну, С1-6алкільну або С1-6алкоксигрупу;
n являє собою ціле число, що дорівнює 2 або 3, і m являє собою ціле число, що дорівнює 2, коли А являє собою атом азоту;
n являє собою ціле число, що дорівнює 1, 2 або 3, і m являє собою ціле число, що дорівнює 1 або 2, коли А являє собою групу CR2;
В являє собою ковалентний зв'язок або С1-8алкіленову групу;
R1 являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, триазинілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, імідазолілу, оксадіазолілу, тіадіазолілу, триазолілу, нафтилу, хінолілу, тетрагідрохінолілу, ізохінолілу, тетрагідроізохінолілу, фталазинілу, хіназолінілу, хіноксалінілу, нафтиридинілу, цинолілу, імідазопіримідинілу, тієнопіримідинілу, бензофуранілу, бензотієнілу, бензимідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, індазолілу, піролопіридилу, фуропіридилу, дигідрофуропіридилу, тієнопіридилу, дигідротієнопіридилу, імідазопіридилу, піразолопіридилу, оксазолопіридилу, ізоксазолопіридилу і тіазолопіридилу;
причому група R1 можливо заміщена однією або більше ніж однією групою R' і/або R";
R' являє собою атом галогену або групу ціано, нітро, гідроксил, С1-6алкіл, С1-6алкокси, С1-6тіоалкіл, С1-6фторалкіл, С1-6фторалкокси, С1-6фтортіоалкіл, С3-7циклоалкіл, С3-7циклоалкіл-С1-6алкілен, азетидиніл, піперидил, піролідиніл, морфолініл, піперазиніл, азепініл, NH2, NHR6, NR6R7, NR6COR7, NR6SO2R7, COR6, CO2R6, SO2R6, SO2NR6R7 або -О-(С1-6алкілен)-О-;
R" являє собою феніл, імідазоліл, піридил, піразиніл, піридазиніл або піримідиніл;
причому група(и) R" можливо заміщена(і) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної;
R4 являє собою атом водню або С1-6алкільну групу;
R6 і R7 незалежно один від одного являють собою С1-6алкільну групу; за винятком наступних сполук:
3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)-4-піперидил]-2,4-оксазолідиндіон;
3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)-4-піперидил]-5-метил-2,4-оксазолідиндіон;
3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)-4-піперидил]-5-етил-2,4-оксазолідиндіон;
3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)-4-піперидил]-5-пропіл-2,4-оксазолідиндіон;
3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)-4-піперидил]-5-(1-метилетил)-2,4-оксазолідиндіон.
9. Сполука формули (І) за будь-яким з пп. 1-4 у формі основи або солі приєднання фармацевтично прийнятної кислоти, гідрату або сольвату для застосування як ліків.
10. Фармацевтична композиція, що містить щонайменше одну сполуку формули (І) за будь-яким з пп. 1-4 в формі основи або солі приєднання фармацевтично прийнятної кислоти, гідрату або сольвату і можливо один або більше ніж один фармацевтично прийнятний ексципієнт.
11. Застосування сполуки формули (І) за будь-яким з пп. 1-4 в формі основи або солі приєднання фармацевтично прийнятної кислоти, гідрату або сольвату для виготовлення ліків для попередження або лікування патології, в яку залучені ендогенні канабіноїди і/або будь-який інший субстрат, що метаболізується ферментом FAAH (гідролаза амідів жирних кислот).
12. Застосування сполуки формули (І) за будь-яким з пп. 1-4 в формі основи або солі приєднання фармацевтично прийнятної кислоти, гідрату або сольвату для виготовлення ліків для попередження або лікування гострого або хронічного болю, запаморочення, блювання, нудоти, порушень харчової поведінки, неврологічних і психіатричних патологій, гострих або хронічних нейродегенеративних захворювань, епілепсії, розладів сну, серцево-судинних захворювань, ниркової ішемії, раку, розладів імунної системи, алергічних захворювань, паразитарних, вірусних або бактеріальних інфекційних захворювань, запальних захворювань, остеопорозу, очних хвороб, легеневих хвороб, шлунково-кишкових захворювань або нетримання сечі.
Текст
1. Сполука, відповідна формулі (І) R1 N C2 2 (19) 1 3 81808 причому група R1 можливо заміщена однією або більше групами R' і/або R"; R' являє собою атом галогену або групу ціано, нітро, гідроксил, С1-6алкіл, С1-6алкокси, С1С1-6фторалкіл, С1-6фторалкокси, С16тіоалкіл, 6фтортіоалкіл, С 3-7циклоалкіл, С 3-7циклоалкіл-С 1азетидиніл, піперидил, піролідиніл, 6алкілен, морфолініл, піперазиніл, азепініл, NH2, NHR6, NR6R7, NR6COR7, NR6SO 2R7, COR6 , CO2R 6, SO 2R6, SO2NR6R7 або -О-(С1-6алкілен)-О-; R" являє собою феніл, імідазоліл, піридил або піримідиніл; причому гр упа(и) R" можливо заміщена(і) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної; R3 являє собою групу загальної формули CHR4CONHR5, в якій R4 являє собою атом водню або С16алкільну груп у, і R5 являє собою атом водню або групу С 1С3-7циклоалкіл або С 3-7циклоалкіл-С 16алкіл, 6алкілен; R6 і R7 незалежно один від одного являють собою С 1-6алкільну груп у; в формі основи, солі приєднання кислоти, гідрату або сольвату. 2. Сполука формули (І) за п. 1, яка відрізняє ться тим, що: А являє собою атом азоту; n являє собою ціле число, що дорівнює 2 або 3, і m являє собою ціле число, що дорівнює 2; В являє собою С 1-8алкіленову груп у; R1 являє собою груп у, вибрану з фенілу, піридилу, піримідинілу, тіадіазолілу і нафтилу; причому група R1 можливо заміщена однією або більше групами R' і/або R''; R' являє собою атом галогену або групу нітро, або С1-6фторалкіл; R" являє собою феніл, можливо заміщений однією або більше групами, які можуть бути однаковими або відмінними одна від одної, вибраними з атома галогену або групи ціано, С16алкокси або С 1-6фторалкокси; R3 являє собою групу загальної формули CHR4CONHR5, в якій R4 являє собою атом водню, і R5 являє собою атом водню або групу С 1С3-7циклоалкіл або С 3-7циклоалкіл-С 16алкіл, 6алкілен; в формі основи, солі приєднання кислоти, гідрату або сольвату. 3. Сполука формули (І) за п. 1, яка відрізняє ться тим, що: А являє собою групу CR2, в якій R2 являє собою атом водню або фтору або гідроксильну груп у; m являє собою ціле число, що дорівнює 1 або 2, і n являє собою ціле число, що дорівнює 1 або 2; В являє собою ковалентний зв'язок або С1-4алкіленову гр упу; R1 являє собою груп у, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, тіазолілу, хінолілу, ізохінолілу, фталазинілу, 4 хіназолінілу, хіноксалінілу, нафтиридинілу, фуропіридилу, тієнопіримідинілу, імідазопіримідинілу, бензотіазолілу, бензимідазолілу і бензоксазолілу; причому група R1 можливо заміщена однією або більше групами R' і/або R''; R' являє собою атом галогену або групу ціано, або С1-6алкіл, С1-6алкокси, С1-6фторалкіл, С16фторалкокси, С 3-7циклоалкіл, піролідиніл, NH 2, NR6R7 або COR6; R" являє собою феніл, імідазоліл або піридил; причому група(и) R'' можливо заміщена(і) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної, більш конкретно, одним або більше ніж одним атомом хлору або фтору; R3 являє собою групу загальної формули CHR4CONHR5, в якій R4 являє собою атом водню або С16алкільну груп у, і R5 являє собою атом водню або групу С 1С3-7циклоалкіл або С 3-7циклоалкіл-С 16алкіл, 6алкілен; R6 і R7 незалежно один від одного являють собою С 1-6алкільну груп у; в формі основи, солі приєднання кислоти, гідрату або сольвату. 4. Сполука формули (І) за п. 1 або 3, яка відрізняє ться тим, що: А являє собою групу CR2, в якій R2 являє собою атом водню; m дорівнює 2 і n дорівнює 2; В являє собою етильну групу; R1 являє собою груп у, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, тіазолілу, хінолілу, ізохінолілу, фталазинілу, хіназолінілу, хіноксалінілу, нафтиридинілу, фуропіридилу, тієнопіримідинілу, імідазопіримідинілу, бензотіазолілу, бензимідазолілу і бензоксазолілу; причому група R1 можливо заміщена однією або більше групами R' і/або R"; R' являє собою атом галогену або групу ціано, або С1-6алкіл, С1-6алкокси, С1-6фторалкіл, С16фторалкокси, С 3-7циклоалкіл, піролідиніл, NH 2, NR6R7 або COR6; R" являє собою феніл, імідазоліл або піридил; причому гр упа(и) R" можливо заміщена(і) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної, більш конкретно, одним або більше ніж одним атомом хлору або фтору; R3 являє собою групу загальної формули CHR4CONHR5, в якій R4 являє собою атом водню, і R5 являє собою атом водню або С16алкільну груп у; R6 і R7 незалежно один від одного являють собою С 1-6алкільну груп у; в формі основи, солі приєднання кислоти, гідрату або сольвату. 5 81808 5. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-4, що включає стадію перетворення карбамату загальної формули (Іа) R4 O R1 N m A B n N H OR O , (Ia) O де: n, m, А, В, R1 і R4 такі, як визначено в загальній формулі (І) згідно з п. 1, і R являє собою метильну або етильну груп у, за допомогою амінолізу з використанням аміну загальної формули R5NH2, де R5 такий, як визначено в загальній формулі (І) згідно з п. 1. 6. Спосіб одержання сполуки формули (І) за будь-яким з пп. 1-4, що включає стадію перетворення оксазолідиндіонового похідного загальної формули (V) O R1 N m A B R4 N n O , (V) O де n, m, А, В, R1 і R4 такі, як визначено в загальній формулі (І) згідно з п. 1, за допомогою амінолізу з використанням аміну загальної формули R5NH2, де R5 такий, як визначено в загальній формулі (І) згідно з п. 1. 7. Сполука, відповідна загальній формулі (Іа) R4 O R1 N m A n B N H OR O , (Ia) O де: А являє собою атом азоту або групу CR2, в якій R2 являє собою атом водню або фтору або гідроксильну, ціано, трифторметильну, С16алкільну або С 1-6алкоксигрупу; n являє собою ціле число, що дорівнює 2 або 3, і m являє собою ціле число, що дорівнює 2, коли А являє собою атом азоту; n являє собою ціле число, що дорівнює 1, 2 або 3, і m являє собою ціле число, що дорівнює 1 або 2, коли А являє собою групу CR2; В являє собою ковалентний зв'язок або С1-8алкіленову гр упу; R1 являє собою груп у, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, триазинілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, імідазолілу, оксадіазолілу, тіадіазолілу, триазолілу, нафтилу, хінолілу, тетрагідрохінолілу, ізохінолілу, тетрагідроізохінолілу, фталазинілу, хіназолінілу, хіноксалінілу, нафтиридинілу, цинолілу, імідазопіримідинілу, тієнопіримідинілу, бензофуранілу, бензотієнілу, бензимідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, індазолілу, піролопіридилу, 6 фуропіридилу, дигідрофуропіридилу, тієнопіридилу, дигідротієнопіридилу, імідазопіридилу, піразолопіридилу, оксазолопіридилу, ізоксазолопіридилу і тіазолопіридилу; причому група R1 можливо заміщена однією або більше групами R' і/або R''; R' являє собою атом галогену або групу ціано, нітро, гідроксил, С1-6алкіл, С1-6алкокси, С1С1-6фторалкіл, С1-6фторалкокси, С16тіоалкіл, 6фтортіоалкіл, С 3-7циклоалкіл, С 3-7циклоалкіл-С 1азетидиніл, піперидил, піролідиніл, 6алкілен, морфолініл, піперазиніл, азепініл, NH2, NHR6, NR6R7, NR6COR7, NR6SO 2R7, COR6 , CO2R 6, SO 2R6, SO2NR6R7 або -О-(С1-6алкілен)-О-; R" являє собою феніл, імідазоліл, піридил, піразиніл, піридазиніл або піримідиніл; причому гр упа(и) R'' можливо заміщена(і) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної; R4 являє собою атом водню або С16алкільну груп у; R6 і R7 незалежно один від одного являють собою С 1-6алкільну груп у; R являє собою метильну або етильну груп у. 8. Сполука, відповідна загальній формулі (V) O R1 N m A B R4 N n O O , (V) де: А являє собою атом азоту або групу CR2, в якій R2 являє собою атом водню або фтору або гідроксильну, ціано, трифторметильну, С16алкільну або С 1-6алкоксигрупу; n являє собою ціле число, що дорівнює 2 або 3, і m являє собою ціле число, що дорівнює 2, коли А являє собою атом азоту; n являє собою ціле число, що дорівнює 1, 2 або 3, і m являє собою ціле число, що дорівнює 1 або 2, коли А являє собою групу CR2; В являє собою ковалентний зв'язок або С1-8алкіленову гр упу; R1 являє собою груп у, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, триазинілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, імідазолілу, оксадіазолілу, тіадіазолілу, триазолілу, нафтилу, хінолілу, тетрагідрохінолілу, ізохінолілу, тетрагідроізохінолілу, фталазинілу, хіназолінілу, хіноксалінілу, нафтиридинілу, цинолілу, імідазопіримідинілу, тієнопіримідинілу, бензофуранілу, бензотієнілу, бензимідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, індазолілу, піролопіридилу, фуропіридилу, дигідрофуропіридилу, тієнопіридилу, дигідротієнопіридилу, імідазопіридилу, піразолопіридилу, оксазолопіридилу, ізоксазолопіридилу і тіазолопіридилу; 7 81808 8 причому група R1 можливо заміщена однією або більше ніж однією групою R' і/або R"; R' являє собою атом галогену або групу ціано, нітро, гідроксил, С1-6алкіл, С1-6алкокси, С1С1-6фторалкіл, С1-6фторалкокси, С16тіоалкіл, 6фтортіоалкіл, С 3-7циклоалкіл, С 3-7циклоалкіл-С 1азетидиніл, піперидил, піролідиніл, 6алкілен, морфолініл, піперазиніл, азепініл, NH2, NHR6, NR6R7, NR6COR7, NR6SO 2R7, COR6 , CO2R 6, SO 2R6, SO2NR6R7 або -О-(С1-6алкілен)-О-; R" являє собою феніл, імідазоліл, піридил, піразиніл, піридазиніл або піримідиніл; причому гр упа(и) R" можливо заміщена(і) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної; R4 являє собою атом водню або С16алкільну груп у; R6 і R7 незалежно один від одного являють собою С 1-6алкільну груп у; за винятком наступних сполук: 3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)4-піперидил]-2,4-оксазолідиндіон; 3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)4-піперидил]-5-метил-2,4-оксазолідиндіон; 3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)4-піперидил]-5-етил-2,4-оксазолідиндіон; 3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)4-піперидил]-5-пропіл-2,4-оксазолідиндіон; 3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)4-піперидил]-5-(1-метилетил)-2,4-оксазолідиндіон. 9. Сполука формули (І) за будь-яким з пп. 1-4 у формі основи або солі приєднання фармацевтично прийнятної кислоти, гідрату або сольвату для застосування як ліків. 10. Фармацевтична композиція, що містить щонайменше одну сполуку формули (І) за будь-яким з пп. 1-4 в формі основи або солі приєднання фармацевтично прийнятної кислоти, гідрату або сольвату і можливо один або більше ніж один фармацевтично прийнятний ексципієнт. 11. Застосування сполуки формули (І) за будь-яким з пп. 1-4 в формі основи або солі приєднання фармацевтично прийнятної кислоти, гідрату або сольвату для виготовлення ліків для попередження або лікування патології, в яку залучені ендогенні канабіноїди і/або будь-який інший субстрат, що метаболізується ферментом FAAH (гідролаза амідів жирних кислот). 12. Застосування сполуки формули (І) за будь-яким з пп. 1-4 в формі основи або солі приєднання фармацевтично прийнятної кислоти, гідрату або сольвату для виготовлення ліків для попередження або лікування гострого або хронічного болю, запаморочення, блювання, нудоти, порушень харчової поведінки, неврологічних і психіатричних патологій, гострих або хронічних нейродегенеративних захворювань, епілепсії, розладів сну, серцево-судинних захворювань, ниркової ішемії, раку, розладів імунної системи, алергічних захворювань, паразитарних, вірусних або бактеріальних інфекційних захворювань, запальних захворювань, остеопорозу, очних хвороб, легеневих хвороб, шлунково-кишкових захворювань або нетримання сечі. Винахід відноситься до похідних піперидиніл- і піперазинілалкілкарбаматів і до їх одержання і терапевтичного застосування. Сполуки за винаходом відповідають загальній формулі (І): ізотіазолілу, імідазолілу, оксадіазолілу, тіадіазолілу, триазолілу, нафтилу, хінолілу, тетрагідрохінолілу, ізохінолілу, тетрагідроізохінолілу, фталазинілу, хіназолінілу, хіноксалінілу, нафтиридинілу, цинолілу, імідазопіримідинілу, тієнопіримідинілу, бензофуранілу, бензотієнілу, бензимідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, індазолілу, піролопіридилу, фуропіридилу, дигідрофуропіридилу, тієнопіридилу, дигідротієнопіридилу, імідазопіридилу, піразолопіридилу, оксазолопіридилу, ізоксазолопіридилу і тіазолопіридилу; причому група R1 можливо заміщена однією або більше групами R' і/або R"; R' являє собою атом галогену або групу ціано, нітро, гідроксил, С1-6алкіл, С1-66алкокси, С1С1-6фторалкіл, С1-6фторалкокси, С16тіоалкіл, 6фтортіоалкіл, С 3-7циклоалкіл, С 3-7циклоалкіл-С 16алкілен, азетидиніл, піперидил, пірол ідиніл, морфолініл, піперазиніл, азепініл, NH2, NHR6, NR6R7, NR6COR7, NR6SO 2R7, COR6 , CO2R 6, SO 2R5, SO2NR6R7 або -О-(С1-6алкілен)-О-; R" являє собою феніл, імідазоліл, піридил, піридазиніл, піразиніл або піримідиніл; де А являє собою атом азоту або груп у CR2, в якій R2 являє собою атом водню або фтору або гідроксильну, ціано, трифторметильну, С16алкільну або С 1-6алкоксигрупу; n являє собою ціле число, що дорівнює 2 або 3, і m являє собою ціле число, що дорівнює 2, коли А являє собою атом азоту; n являє собою ціле число, що дорівнює 1, 2 або 3, і m являє собою ціле число, що дорівнює 1 або 2, коли А являє собою групу CR2; В являє собою ковалентний зв'язок або С 18алкіленову гр упу; R1 являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, триазинілу, оксазолілу, ізоксазолілу, тіазолілу, 9 81808 причому група(и) R" можливо заміщена(и) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної; R3 являє собою групу загальної формули CHR4CONHR5, в якій R4 являє собою атом водню або С 1-6алкільну груп у, і R5 являє собою атом водню або групу С 1С3-7циклоалкіл або С 3-7циклоалкіл-С 16алкіл, 6алкілен; R6 і R7 незалежно один від одного являють собою С1-6алкільну гр упу. Серед сполук загальної формули (І) перша підгрупа сполук складається із сполук, для яких А являє собою атом азоту; і/або n являє собою ціле число, що дорівнює 2 або 3, і m являє собою ціле число, що дорівнює 2; і/або В являє собою С 1-8алкіленову гр упу, більш конкретно, етил або пропіл; і/або R1 являє собою групу, вибрану з фенілу, піридилу, піримідинілу, тіадіазолілу і нафтилу; причому група R1 можливо заміщена однією або більше ніж однією групою R' і/або R"; і/або R' являє собою атом галогену, більш конкретно, хлору, або нітро, або С1групу, більш конкретно, 6фтортіоалкільну трифторметил; і/або R" являє собою феніл, можливо заміщений однією або більше групами, які можуть бути однаковими або відмінними одна від одної, вибраними з атома галогену, більш конкретно, хлору, і групи ціано, С1-6алкокси, більш конкретно, метокси, або С1-6фторалкокси, більш конкретно, трифторметокси; і/або R3 являє собою групу загальної формули CHR4CONHR5, в якій R4 являє собою атом водню, і R5 являє собою атом водню або С 1-6алкільну груп у, більш конкретно, метил або етил, С3гр упу, більш конкретно, 7циклоалкільну циклопропіл, або групу С 3-7циклоалкіл-С 1-6алкілен, більш конкретно, цилопропілметилен. Друга підгрупа сполук з числа сполук загальної формули (І) складається із сполук, для яких: А являє собою групу CR2, в якій R2 являє собою атом водню або фтору або гідроксильну груп у; і/або m являє собою ціле число, що дорівнює 1 або 2, і n являє собою ціле число, що дорівнює 1 або 2; і/або В являє собою ковалентний зв'язок або С 14алкіленову груп у, більш конкретно, метил, етил або н-пропіл; і/або R1 являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, тіазолілу, хінолілу, ізохінолілу, фталазинілу, хіназолінілу, хіноксалінілу, нафтиридинілу, фуропіридилу, тієнопіримідинілу, імідазопіримідинілу, бензотіазолілу, бензимідазолілу і бензоксазолілу; причому група R1 можливо заміщена однією або більше ніж однією групою R' і/або R"; і/або R' являє собою атом галогену, більш конкретно, фтору, хлору або брому, або ціаногрупу, С1-6алкіл, більш конкретно, метил, 10 етил, н-пропіл або ізобутил, С1-6алкокси, більш конкретно, метокси, С1-6фторалкіл, більш конкретно, трифторметил, С1-6фторалкокси, більш конкретно, трифторметокси, С3-7циклоалкіл, більш конкретно, циклопропіл або циклопентил, піролідиніл, NH2, NR6R7 або COR6; і/або R" являє собою феніл, імідазоліл або піридил; причому група(и) R" можливо заміщена(і) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної, більш конкретно, одним або більше ніж одним атомом хлору або фтору; і/або R3 являє собою групу загальної формули CHR4CONHR5, в якій R4 являє собою атом водню або С 1-6алкільну груп у, більш конкретно, метил, і R5 являє собою атом водню або С 1-6алкільну груп у, більш конкретно, метил або етил, С37циклоалкіл, більш конкретно, циклопропіл, С 3більш конкретно, 7циклоалкіл-С 1-6алкілен, циклопропілметилен; і/або R6 і R7 являють собою незалежно один від одного С1-6алкільну гр упу, більш конкретно, метил. Третя підгрупа сполук з числа сполук загальної формули (І) складається із сполук, для яких: А являє собою групу CR2, в якій R2 являє собою атом водню; і/або m дорівнює 2, і n дорівнює 2; і/або В являє собою етильну групу; і/або R1 являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, тіазолілу, хінолілу, ізохінолілу, фталазинілу, хіназолінілу, хіноксалінілу, нафтиридинілу, фуропіридилу, тієнопіримідинілу, імідазопіримідинілу, бензотіазолілу, бензимідазолілу і бензоксазолілу; причому група R1 можливо заміщена однією або більше ніж однією групою R' і/або R"; і/або R' являє собою атом галогену, більш конкретно, фтору, хлору або брому, або ціаногрупу, С1-6алкіл, більш конкретно, метил, етил, н-пропіл або ізобутил, С1-6алкокси, більш конкретно, метокси, С1-6фторалкіл, більш конкретно, трифторметил, С1-6фторалкокси, більш конкретно, трифторметокси, С3-7циклоалкіл, більш конкретно, циклопропіл або циклопентил, піролідиніл, NH2, NR6R7 або COR6; і/або R'' являє собою феніл, імідазоліл або піридил; причому група(и) R" можливо заміщена(і) однією або більше групами R', які можуть бути однаковими або відмінними одна від одної, більш конкретно, одним або більш ніж одним атомом хлору або фтору; і/або R3 являє собою групу загальної формули CHR4CONHR5, в якій R4 являє собою атом водню, і R5 являє собою атом водню або С 1-6алкільну груп у, більш конкретно, метил або етил; і/або R6 і R7 незалежно один від одного являють собою С1-6алкільну гр упу, більш конкретно, метил. З числа сполук загальної формули (І) об'єктом винаходу також є сполуки, відповідні загальній формулі (І'): 11 81808 де А являє собою атом азоту або груп у CR2, в якій R2 являє собою атом водню або фтору або гідроксильну, ціано, трифторметильну, С15алкільну або С 1-5алкоксигрупу; n являє собою ціле число, що дорівнює 2 або 3, і m являє собою ціле число, що дорівнює 2, коли А являє собою атом азоту; n являє собою ціле число, що дорівнює 1, 2 або 3, і m являє собою ціле число, що дорівнює 1 або 2, коли А являє собою групу CR2; В являє собою ковалентний зв'язок або С 18алкіленову гр упу; R1 являє собою групу, вибрану з фенілу, піридилу, піридазинілу, піримідинілу, піразинілу, триазинілу, тіазолілу, імідазолілу, оксадіазолілу, тіадіазолілу, триазолілу, нафтилу, хінолілу, тетрагідрохінолілу, ізохінолілу, тетрагідроізохінолілу, фталазинілу, хіназолінілу, хіноксалінілу, нафтиридинілу, цинолілу, імідазопіримідинілу, тієнопіримідинілу, бензофуранілу, бензотієнілу, бензимідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, індазолілу, піролопіридилу, фуропіридилу, дигідрофуропіридилу, тієнопіридилу, дигідротієнопіридилу, імідазопіридилу, піразолопіридилу, оксазолопіридилу, ізоксазолопіридилу і тіазолопіридилу; можливо заміщену одним або більше ніж одним замісником, вибраним з атома галогену і групи ціано, нітро, С1-5алкіл, С1-3алкокси, С1-5тіоалкіл, С1-5фторалкіл, С1-3фторалкокси, С13фтортіоалкіл, С 3-5циклоалкіл, С 3-5циклоалкіл-С 13алкілен, піперидил, піролідиніл, морфолініл, NH 2. NHR6, NR6R7, NHCOR6, COR6, СО2R6, SO2R6, -О(С1-3алкілен)-О-, феніл, піридил або піримідиніл; причому фенільні, піридильні і піримідинільні групи можливо заміщені одним або більше ніж одним замісником, вибраним з атома галогену і групи ціано, нітро, гідроксил, С1-5алкіл, С1-3алкокси, С1-5тіоалкіл, С1-5фторалкіл, С1-3фторалкокси, С13фтортіоалкіл, С 3-5циклоалкіл, С 3-5циклоалкіл-С 13алкілен, піперидил, піролідиніл, морфолініл, NH 2, NHR6, NR6R7, NHCOR6, COR6 , CO2R 6, SO2R6 або O-(С1-3алкілен)-О-; R3 являє собою групу загальної формули CHR4CONHR5, в якій R4 являє собою атом водню або С 1-3алкільну груп у, і R5 являє собою атом водню або групу С 1С3-5циклоалкіл або С 3-5циклоалкіл-С 1Залкіл, 3алкілен; R6 і R7 незалежно один від одного являють собою С1-3алкільну гр упу. Сполуки загальної формули (І) можуть містити один або більше ніж один асиметричний атом вуглеводу. Вони можуть існувати в формі 12 енантіомерів або діастереоізомерів. Ці енантіомери і діастереоізомери і також їх суміші, в тому числі рацемічні суміші, складають частину даного винаходу. Сполуки загальної формули (І) можуть існувати в формі основ або солей приєднання кислоти. Такі солі приєднання кислоти складають частину даного винаходу. Ці солі переважно одержують за допомогою фармацевтично прийнятних кислот, але солі інших кислот, які корисні, наприклад, для очищення або виділення сполук формули (І), також складають частину даного винаходу. Сполуки загальної формули (І) можуть бути в формі гідратів або сольватів, тобто в формі асоціатів або комбінацій з однією або більше ніж однією молекулою води або розчинника. Такі гідрати і сольвати також складають частину даного винаходу. У контексті даного винаходу застосовуються наступні визначення: - Ct-z, де t і z можуть мати значення від 1 до 8, вуглецевий ланцюг, що можливо містить від t до z атомів вуглецю, наприклад С1-3вуглецевий ланцюг, який може містити від 1 до 3 атомів вуглецю; - алкіл, насичена, лінійна або розгалужена аліфатична група, наприклад, С1-Залкільна група являє собою лінійний або розгалужений вуглецевий ланцюг з 1-3 атомів вуглецю, більш конкретно, метил, етил, пропіл або 1-метилетил; - алкілен, насичена, лінійна або розгалужена двовалентна алкільна група, наприклад, С13алкіленова група являє собою лінійний або розгалужений двовалентний вуглецевий ланцюг з 1-3 атомів вуглецю, більш конкретно, метилен, етилен, 1-метилетилен або пропілен; - циклоалкіл, циклічна алкільна група, наприклад, С3-5циклоалкільна група являє собою циклічну вуглецеву гр упу з 3-5 атомів вуглецю, більш конкретно, циклопропіл, циклобутил або циклопентил; - алкокси, група -О-алкіл, що містить насичений лінійний або розгалужений аліфатичний ланцюг; - тіоалкіл, група -S-алкіл, що містить насичений лінійний або розгалужений аліфатичний ланцюг; - фторалкіл, алкільна група, в якій один або більше ніж один атом водню заміщений атомом фтор у; - фторалкокси, алкоксигрупа, в якій один або більше ніж один атом водню заміщений атомом фтор у; - фтортіоалкіл, тіоалкільна група, в якій один або більше ніж один атом водню заміщений атомом фтору; - атом галогену, фтор, хлор, бром або йод. Сполуки за винаходом можуть бути одержані згідно з різними способами, проілюстрованими на представлених нижче схемах. Так, перший спосіб (Схема 1) полягає у взаємодії аміну загальної формули (II), де А, В, R1, n і m такі, як визначено вище, з карбонатом загальної формули (ІІІа), де Z являє собою атом водню або нітрогрупу, R4 такий, як визначено 13 81808 вище, і R являє собою метальну або етильну груп у. Карбамат загальної формули (Іа), одержаний таким чином, потім перетворюють в сполуку загальної формули (І) за допомогою амінолізу, використовуючи амін загальної формули R5NH2, де R5 такий, як визначено вище. Реакція амінолізу може бути проведена в розчиннику, такому як метанол, або суміші розчинників, таких як метанол і тетрагідрофуран або метанол і діоксан. Один з варіантів одержання сполук загальної формули (І) (Схема 1) полягає у взаємодії аміну загальної формули (II), як визначено вище, з карбонатом загальної формули (lllb), де Z являє собою атом водню або нітрогрупу, a R4 і R5 такі, як визначено вище, в розчиннику, такому як толуол або дихлоретан, при температурі між 0°С і 80°С. Карбонати загальної формули (lllа) і (lllb) можуть бути одержані будь-яким способом, описаним в літературі, наприклад шляхом взаємодії спирту загальної формули HOCHR4COOR, де R являє собою метальну або етильну групу, або HOCHR4CONHR5, де R4 і R5 такі, як визначено вище, з фенілхлорформіатом або 4-нітрофенілхлорформіатом в присутності основи, такої як триетиламін або діізопропілетиламін. Другий спосіб одержання сполук загальної формули (І) (Схема 2) полягає у взаємодії похідного загальної формули (llа), де Υ являє собою гідроксильну, мезилатну або тозилатну груп у або атом хлору, брому або йоду, і А, В, R1, n і m такі, як визначено вище, з оксазолідиндіоном загальної формули (IV), де R4 такий, як визначено вище, з одержанням оксазолідиндіонового похідного загальної формули (V). У випадку, коли Υ являє собою гідроксильну груп у, реакція може бути проведена відповідно до умов Міцунобу (Synthesis, 1981, 1-28), наприклад за допомогою дії діетилабо діізопропілазодикарбоксилату в присутності трифенілфосфіну. У випадку, коли Υ являє собою атом хлору, брому або йоду або мезилатну або тозилатну групу, реакція може бути проведена в присутності основи, такої як 1,1,3,3тетраметилгуанідин, гідрид натрію або третбутоксид натрію, в розчиннику, такому як тетрагідрофуран, ацетонітрил або диметилформамід, при температурі між 0°С і 14 температурою флегми розчинника. Оксазолідиндіонове похідне загальної формули (V), одержане таким чином, потім перетворюють в сполуку загальної формули (І) за допомогою амінолізу, використовуючи амін загальної формули R5NH2, де R5 такий, як визначено вище. Крім того, сполуки загальних формул (І), (Іа), (II), (llа) і (V), де R1 заміщений групою R", можуть бути одержані шляхом взаємодії відповідних сполук загальних формул (І), (Іа), (II), (llа) і (V), в яких R1 заміщений атомом хлору, брому або йоду або трифлатною групою по положенню, в яке потрібно ввести групу R", з похідним арил- або гетероарилборонової кислоти відповідно до умов реакції Сузуки [Chem. Rev. 1995, 95, 2457-2483] або з похідним арилабо гетероарилтриалкілстанану відповідно до умов реакції Штілле [Angew. Chem. Int. Ed. 1986, 25, 504-524]. Сполуки загальних формул (II), (llа) і (IV), якщо спосіб їх одержання не описаний, є в продажу або вони описані в літературі або, альтернативно, можуть бути одержані згідно зі способами, викладеними в даному описі або відомими фа хівцям в даній області техніки. Аміни загальної формули R5NH2 є в продажу. Відповідно до наступного з аспектів, об'єктом винаходу також є сполуки формули (Іа), де n, m, А, В, R1 і R4 такі, як визначено вище, і R являє собою метильну або етильну груп у. Сполуки формули (Іа) корисні як синтетичні проміжні сполуки для одержання сполук формули (І). Відповідно до наступного з аспектів, об'єктом винаходу також є сполуки формули (V), де n, m, А, В, R1 і R4 такі, як визначено вище, за винятком наступних сполук: *3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)-4піперидил]-2,4-оксазолідиндіон; *3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)-4піперидил]-5-метил-2,4-оксазолідиндіон; *3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)-4піперидил]-5-етил-2,4-оксазолідиндіон; *3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)-4піперидил]-5-пропіл-2,4-оксазолідиндіон; *3-[1-(4-аміно-6,7-диметокси-2-хіназолініл)-4піперидил]-5-(1-метилетил)-2,4-оксазолідиндіон. Сполуки формули (V) корисні як синтетичні проміжні сполуки для одержання сполук формули (І). Приклади, наведені далі, ілюструють одержання ряду сполук за винаходом. Ці приклади не є обмежувальними і надані головним чином для ілюстрації винаходу. Мікроаналізи і спектри ІЧ, 15 81808 ЯМР і/або РХ/МС (рідинна хроматографія в поєднанні з мас-спектроскопією) підтверджують структури і чистоту одержаних сполук. Т.пл. (°С) являє собою точку плавлення в градуса х Цельсія. Числа, вказані в круглих дужках в заголовках прикладів, відповідні числам в першій колонці таблиці, представленій в даному описі нижче. Для найменування сполук в представлених нижче прикладах використана номенклатура ШРАК (Міжнародний союз по теоретичній і прикладній хімії). Приклад 1 (Сполука 38) 2-(метиламіно)-2-оксоетил-2-[4-(1-нафтил)-1піперазиніл]етилкарбамат гідрохлорид 1.1. 2-{2-[4-(1-нафтил)-1-піперазиніл]етил}-1Нізоіндол-1,3(2Н)-діон Суспензію 1,17г (5,52ммоль) 1-(1нафтил)піперазину [Tetrahedron Letters, 1998, 39(15), 2219-2222], 0,99г (7,15моль) карбонату калію і 1,68г (6,62ммоль) 2-(2-брометил)-1Нізоіндол-1,3(2Н)-діону в 15мл Ν,Νдиметилформаміду нагрівають при 90°С протягом 2 годин. Суміш залишають охолоджуватися до кімнатної температури і концентрують при зниженому тиску. Залишок переводять в етилацетат і воду, водн у фазу відділяють і три рази екстрагують етилацетатом, об'єднані органічні фази промивають насиченим водним розчином хлориду натрію і сушать над сульфатом натрію. Після випаровування розчинника одержаний залишок очищають хроматографією на силікагелі з елююванням сумішшю етилацетату і циклогексану (40/60). Таким чином одержують 1,14г чистих продукту у вигляді масла. 1.2. 2-[4-(1-нафтил)-1-піперазиніл]етанамін 0,17мл (3,55ммоль) гідразину моногідрату повільно додають при кімнатній температурі до розчину 1,14г (2,96ммоль) 2-{2-[4-(1-нафтил)-1піперазиніл]етил}-1Н-ізоіндол-1,3(2Н)-діону, одержаного на стадії 1.1., в 15мл етанолу. Реакційну суміш потім кип'ятять із зворотним холодильником протягом 1 години. Суміш залишають охолоджуватися до кімнатної температури, матеріал, що не розчинився, відділяють фільтруванням і фільтрат концентрують при зниженому тиску. Залишок переводять в 20мл діетилового ефіру і перемішують при кімнатній температурі протягом 20 хвилин. Матеріал, що не розчинився, ще раз відділяють і фільтрат концентрують при зниженому тиску. Одержаний залишок очищають хроматографією на силікагелі, елююючи сумішшю дихлорметану, метанолу і 28%-ного водного аміаку (90/10/1). 16 Таким чином одержують 0,45г аміну у вигляді безбарвного масла. 1.3. Етил-[(фенілоксикарбоніл)оксі]ацетат 32мл (256ммоль) фенілхлорформіату повільно додають при кімнатній температурі до розчину 25г (240ммоль) етилгліколяту і 55мл (315ммоль) діізопропілетиламіну в 500мл толуолу. Перемішування при кімнатній температурі продовжують протягом 2 годин. Сіль, що утворилася, відділяють і фільтрат концентрують при зниженому тиску. Одержують 53,7г маслянистого продукту і його використовують на наступній стадії без подальшого очищення. 1.4. Етил-[({[2,4-(1-нафтил)-1піперазиніл]етил}аміно)карбоніл]оксіацетат Розчин 0,45г (1,76ммоль) 2-[4-(1-нафтил)-1піперазиніл]етанаміну, одержаного на стадії 1.2., і 0,48г (2,16ммоль) етил-[(фенілоксикарбоніл)оксі] ацетату, одержаного на стадії 1.3., в 15мл толуолу нагрівають при 50°С протягом 6 годин. Суміш залишають охолоджуватися до кімнатної температури, матеріал, що не розчинився, відділяють фільтруванням і фільтрат концентрують при зниженому тиску. Залишок переводять в дихлорметан і воду, водну фазу відділяють і три рази екстрагують дихлорметаном, об'єднані органічні фази промивають насиченим водним розчином хлориду натрію і сушать над сульфатом натрію. Після випаровування розчинника одержаний залишок очищають хроматографією на силікагелі, елююючи сумішшю дихлорметану і метанолу у відношенні 97/3 і потім 93/7. Таким чином одержують 0,49г чистого продукту у вигляді масла. 1.5. 2-(метиламіно)-2-оксоетил-2-[4-(1нафтил)-1-піперазиніл]-етилкарбамат 1,9мл (3,75ммоль) розчину (2М) метиламіну в тетрагідрофурані додають до розчину 0,48г (1,25ммоль) етил-[({[2,4-(1-нафтил)-1піперазиніл]етил}аміно)карбоніл]оксіацетату, одержаного на стадії 1.4., в 5мл метанолу. Перемішування при кімнатній температурі продовжують протягом 1 години. Після концентрування при зниженому тиску одержаний залишок очищають хроматографією на силікагелі, елююючи сумішшю ди хлорметану і метанолу (97/3). Одержують маслянистий залишок, який переводять в розчин соляної кислоти (5 н) в ізопропанолі. Суміш концентрують досуха і одержану сіль потім повторно кристалізують з суміші ацетону і діізопропілового ефіру (1/1). Таким чином одержують 0,23г чистого продукту (моногідрохлориду) у вигляді твердої речовини білого кольору. РХ-МС: М+Н=371. Т.пл. (°С): 166°С. 1 Н ЯМР (D MSO) δ (млн.-1):2.55 (d, 3Н); 3.203.75 (недозволений пік, 12Н); 4.40 (s, 2Н); 7.10 (d, 1Н); 7.35-7.70 (недозволений пік, 4Н); 7.80-8.05 (недозволений пік, 2Н); 8.15 (dd, 1H); 10.90 (уширений s, 1H). Приклад 2 (Сполука 157) 17 81808 2-(метиламіно)-2-оксоетил-3-[1-(1-ізохіноліл)-4піперидил]пропілкарбамат гідрохлорид 2.1. 2-[1-(1-ізохіноліл)-4-піперидил] етанол 4,17г (25,50ммоль) 1-хлорізохіноліну, 3,62г (28ммоль) 2-(4-піперидил)етанолу, 5,90г (61,20ммоль) трет-бутоксиду натрію і 0,476г (0,765ммоль) BINAP (2,2'-біс(дифенілфосфіно)1,1'-бінафтил), суспендовані в 50мл толуолу, переводять в атмосферу інертного газу. Додають 0,233г (0,255ммоль) трис(дибензиліденацетон)дипаладію. Потім реакційну суміш кип'ятять із зворотним холодильником протягом 12 годин. Солі відділяють фільтруванням через целіт і фільтрат далі концентрують при зниженому тиску. Залишок переводять в етилацетат і воду, водну фазу відділяють і двічі екстрагують етилацетатом, об'єднані органічні фази промивають насиченим водним розчином хлориду натрію і сушать над сульфатом натрію. Після випаровування розчинника одержаний залишок очищають хроматографією на силікагелі, елююючи сумішшю дихлорметану і метанолу (9773). Одержують 3,34г продукту у вигляді сірої пасти. 2.2. 1-[4-(2-хлоретил)-1-піперидил]ізохінолін 2,20мл (30,10ммоль) тіонілхлориду по краплях додають до розчину 3,09г (12,10ммоль) 2-[1-(1ізохіноліл)-4-піперидил]етанолу, одержаного на стадії 2.1., в 30мл дихлорметану. Реакційну суміш потім кип'ятять із зворотним холодильником протягом 5 годин. Суміш концентрують досуха при зниженому тиску. Залишок переводять в 40мл дихлорметану і 30мл водного розчину гідроксиду натрію (1М). Водну фазу відділяють і двічі екстрагують дихлорметаном, об'єднані органічні фази промивають насиченим водним розчином хлориду натрію, сушать над сульфатом натрію і фільтрат концентрують при зниженому тиску. Одержують 2,70г продукту у вигляді коричневої пасти, яку використовують без подальшого очищення на наступній стадії. 2.3. 3-[1-(1-ізохіноліл)-4-піперидил] пропаннітрил 0,63г (9,57ммоль) ціаніду калію порціями додають до суспензії 2,63г (9,57ммоль) 1-[4-(2хлоретил)-1-піперидил]ізохіноліну, одержаного на стадії 2.2., і 0,048г (0,29ммоль) йодиду калію в 30мл диметилсульфоксиду. Реакційну суміш витримують при приблизно 120°С протягом 16 годин. Суміш залишають охолоджуватися до кімнатної температури і потім додають 90мл води і етилацетату. Водну фазу відділяють і три рази екстрагують етилацетатом, об'єднані органічні фази промивають насиченим водним розчином хлориду натрію, сушать над сульфатом натрію і фільтрат концентрують при зниженому тиску. 18 Одержаний таким чином залишок очищають хроматографією на силікагелі, елююючи сумішшю етилацетату і циклогексану (30/70). Одержують 0,77г продукту у вигляді твердої речовини жовтого кольору. Т.пл. (°С):141-143°С. 2.4. 3-[1-(1-ізохіноліл)-4-піперидил]пропанамін Розчин 0,77г (2,90ммоль) 3-[1-(1-ізохіноліл)-4піперидил]пропаннітрилу, одержаного на стадії 2.3., в 16мл тетрагідрофурану по краплях додають до суспензії 0,22г (5,80ммоль) алюмогідриду літію в 8мл тетрагідрофурану. Реакційну суміш далі кип'ятять із зворотним холодильником протягом 5 годин. Реакційну середу охолоджують до приблизно 0°С і потім повільно додають 15мл водного розчину гідроксиду натрію (1М). Суміш перемішують при кімнатній температурі протягом 30 хвилин з подальшим додаванням порціями вологого сульфату натрію. Солі відділяють фільтруванням через папір і фазам далі дають можливість розділитися шляхом відстоювання. Водну фазу три рази екстрагують етилацетатом, об'єднані органічні фази сушать над сульфатом натрію і фільтрат концентрують при зниженому тиску. Одержаний таким чином залишок очищають хроматографією на силікагелі, елююючи сумішшю дихлорметану, метанолу і 28%-ного водного аміаку у відношенні 93/7/0,7. Одержують 0,329г продукту у вигляді жовтого масла, яке кристалізується при кімнатній температурі. 2.5. Етил-[({3-[1-(1-ізохіноліл)-4піперидил]пропіл}-аміно)карбоніл]оксіацетат Процес проводять як і в Прикладі 1 (стадія 1.4.)· Виходячи з 0,350г (1,30ммоль) 3-[1-(1ізохіноліл)-4-піперидил]пропанаміну, одержаного на стадії 2.4., і 0,32г (1,43ммоль) етил[(фенілоксикарбоніл)оксі]ацетату, одержаного на стадії 1.3. Прикладу 1, і після хроматографії на силікагелеі з елююванням сумішшю етилацетату і циклогексану (20/80 і потім 30/70) одержують 0,383г продукти у вигляді жовтої пасти. 2.6. 2-(метиламіно)-2-оксоетил-3-[1-(1ізохіноліл)-4-піперидил]пропілкарбамат Процес проводять, як описано в Прикладі 1 (стадія 1.5.). Виходячи з 0,380г (0,95ммоль) етил[({3-[1-(1-ізохіноліл)-4-піперидил]пропіл}аміно)карбоніл]оксіацетату, одержаного на стадії 2.5., і 4,8мл (9,51ммоль) розчину (2М) метиламіну в тетрагідрофурані, і після хроматографії на силікагелі з елююванням сумішшю ди хлорметану і метанолу (98/2 і потім 95/5) одержують 0,277г продукту у вигляді масла. Цей маслянистий залишок потім переводять в розчин соляної кислоти (5н) в ізопропанолі, сіль, що утворилася, відфільтровують і потім промивають етилацетатом. Після висушування під вакуумом при приблизно 40°С одержують 0,204г гідрохлориду у вигляді аморфної твердої речовини білого кольору. РХ-МС: М+Н=385. 1 Н ЯМР (DMSO+D 2O) δ (млн -1): 1.30 (m, 2H); 1.40-1.80 (недозволений пік, 5Н), 1.90 (уширений 19 81808 d, 2H); 2.60 (s, 3Н); 3.05 (m, 2H); 3.40 (t, 2H); 4.05 (уширений d, 2Н); 4.30 (s, 2Н); 7.50 (d, 1Н); 7.80 (m, 2Н); 7.95 (t, 1Н); 8.05 (d, 1H);8.20(d, 1H). Приклад 3 (Сполука 44) 2-аміно-2-оксоетил-2-{1-[3(трифторметил)феніл]-4-піперидил]етилкарбамат 3.1. 2-{1-[3-(трифторметил)феніл]-4піперидил}етанол Процес проводять, як описано в Прикладі 2 (стадія 2.1.). Виходячи з 25,6г (113,90ммоль) 1бром-3-(трифторметил)бензолу, 17,66г (136,60ммоль) 2-(4-піперидил)етанолу, 26,24г (273ммоль) трет-бутоксиду натрію, 2,12г (3,41ммоль) BIN АР і 1,04г (1,14ммоль) трис(дибензиліденацетон)дипаладік) і після хроматографії на силікагелі з елююванням сумішшю етилацетату і циклогексану (25/75) одержують 17,90г маслянистого залишку оранжевого забарвлення. Цей залишок переводять в 100мл метанолу потім додають розчин 4,24г гідроксиду калію в 15мл метанолу і перемішування продовжують при кімнатній температурі протягом 1 години. Суміш концентрують при зниженому тиску і залишок потім переводять в хлороформ і водний розчин соляної кислоти (1н). Органічну фазу відділяють і сушать над сульфа том натрію, а фільтрат концентрують при зниженому тиску. Одержують 14г продукту у вигляді темного жовтого масла, яке використовують без подальшого очищення на наступній стадії. 3.2. 2-{1-[3-(трифторметил)феніл]-4піперидил}етилметансульфонат Розчин 1г (8,78ммоль) мезилхлориду в 5мл дихлорметану в атмосфері інертного газу по краплях додають до розчину 2г (7,32ммоль) 2-{1-[3-(трифторметил)феніл]-4піперидил}етанолу, одержаного на стадії З.1., і 1,53мл (10,98ммоль) триетиламіну в 40мл дихлорметану, охолодженому до приблизно 0°С. Перемішування продовжують при 0°С протягом 1 години і потім при кімнатній температурі протягом 2 годин. До реакційної середи додають воду, водн у фазу відділяють і три рази екстрагують дихлорметаном, об'єднані органічні фази промивають насиченим водним розчином хлориду натрію, сушать над сульфатом натрію і фільтрат концентрують при зниженому тиску. Таким чином одержують 2,5г продукту у вигляді масла, яке використовують без подальшого очищення на наступній стадії. 3.3. 3-(2{1-[3-(трифторметил)феніл]-4піперидил}-етил)-1,3-оксазолідин-2,4-діон Розчин 2,3г (6,545ммоль) 2-{1-[3(трифторметил)феніл]-4піперидил}етилметансульфонату, одержаного на стадії 3.2., 0,694г (6,87ммоль) 1,3-оксазолідин-2,4 20 діону [J. Med. Chem., 1991, 34, 1538-1544] і 1,5г (13,09ммоль) 1,1,3,3-тетраметилгуанідину в 30мл тетрагідрофурану кип'ятять із зворотним холодильником протягом 12 годин в атмосфері інертного газу. Суміш концентрують при зниженому тиску. Залишок переводять в дихлорметан і воду, водну фазу відділяють, двічі екстрагують дихлорметаном, а об'єднані органічні фази промивають насиченим водним розчином хлориду натрію і сушать над сульфатом натрію. Після випаровування розчинника одержаний залишок очищають хроматографією на силікагелі, елююючи сумішшю етилацетату і циклогексану у відношенні 20/80 і потім 40/60. Одержують 1,61г чистого продукту у вигляді масла. 3.4. 2-аміно-2-оксоетил-2-{1-[3(трифторметил)-феніл]-4-піперидил} етилкарбамат 9,3мл (64,82ммоль) розчину водного аміаку (7н) в метанолі додають до розчину 0,77г (2,16ммоль) 3-(2-{1-[3-(трифторметил)феніл]-4піперидил}-етил)-1,3-оксазолідин-2,4-діону, одержаного на стадії 3.3., в 10мл суміші метанолу і тетрагідрофурану (1/1). Перемішування при кімнатній температурі продовжують протягом 24 годин. Після концентрування при зниженому тиску одержаний залишок очищають хроматографією на силікагелі, елююючи сумішшю ди хлорметану і метанолу у відношенні 97/3 і потім 95/5, з подальшою перекристалізацією з суміші етилацетату і діізопропілового ефіру. Одержують 0,370г чистого продукту у вигляді твердої речовини білого кольору. РХ-МС: М+Н=374. Т.пл. (°С): 140-142°С. 1 Н ЯМР (CDCI3) δ (млн -1): 1.30-1.55 (недозволений пік, 5Н); 1.90 (уширений d, 2Н); 2.80 (t, 2H); 3.35 (q, 2H); 3.80 (уширений d, 2H); 4.60 (s, 2H); 4.90 (уширений s, 1Н); 5.55 (уширений s, 1Н); 6.05 (уширений s, 1H); 7.10 (m, 3Н); 7.35(t, 1H). Приклад 4 (Сполука 47) 2-(метиламіно)-2-оксоетил-2-[1-(6-метил-2піридил)-4-піперидшфтилкарбаматгідрохлорид 4.1. 2-[1-(6-метил-2-піридил)-4піперидил]етанол 1г (7,74ммоль) 2-(4-піперидил)етанолу і 0,987г (7,74ммоль) 2-хлор-6-метилпіридину помішують в автоклав. Суміш потім нагрівають при 130°С протягом 17 годин. Реакційну суміш залишають охолоджуватися до кімнатної температури і потім переводять в хлороформ і насичений водний розчин гідрокарбонату натрію. Водну фазу відділяють і двічі екстрагують хлороформом, об'єднані органічні фази промивають насиченим водним розчином хлориду натрію, суша ть над сульфатом 21 81808 натрію і фільтрат концентрують при зниженому тиску. Таким чином одержують 1,21г продукту у вигляді рідини оранжевого забарвлення, яку використовують без подальшого очищення на наступній стадії. 4.2. 2-[1-(6-метил-2-піридил)-4піперидил]етилметансульфонат Процес проводять як і в Прикладі 3 (стадія 3.2.). Виходячи з 0,661г (3ммоль) 2-[1-(6-метил-2піридил)-4-піперидил]етанолу, одержаного на стадії 4.1.,0,378г (3,30ммоль) мезилхлориду і 0,63мл (4,50ммоль) триетиламіну одержують 0,779г продукту у вигляді масла оранжевого забарвлення, яке використовують без подальшого очищення на наступній стадії. 4.3. 3-{2-[1-(6-метил-2-піридил)-4піперидил]етил}-1,3-оксазолідин-2,4-діон Процес проводять у відповідності зі способом, описаним в Прикладі 3 (стадія 3.3.). Виходячи з 0,776г (2,60ммоль) 2-[1-(6-метил-2-піридил)-4піперидил]етилметансульфонату, одержаного на стадії 4.2., 0,315г (3,12ммоль) 1,3-оксазолідин-2,4діону і 0,65мл (5,20ммоль) 1,1,3,3тетраметилгуанідину і після хроматографії на силікагелі з елююванням сумішшю етилацетату і циклогексану (30/70) одержують 0,76г чистого продукту у вигляді жовтого масла. 4.4. 2-(метиламіно)-2-оксоетил-2-[1-(6-метил-2піридил)-4-піперидил]етилкарбамат Процес проводять відповідно до методики, описаної в Прикладі 1 (стадія 1.5.). Виходячи з 0,841г (2,77ммоль) 3-{2-[1-(6-метил-2-піридил)-4піперидил]етил}-1,3-оксазолідин-2,4-діону, одержаного на стадії 4.3., і 6,9мл (13,86ммоль) розчину (2М) метиламіну в тетрагідрофурані, одержують 0,598г чистого продукту у вигляді масла після хроматографії на силікагелі з елююванням сумішшю дихлорметану і метанолу (95/5). Цей маслянистий залишок переводять в розчин соляної кислоти (5н) в ізопропанолі, сіль, що утворилася, відфільтровують і далі послідовно промивають ацетоном і потім діетиловим ефіром. Після висушування під вакуумом при приблизно 80°С одержують 0,492г гідрохлориду у вигляді порошку білого кольору. РХ-МС: М+Н=335. Т.пл. (°С):95-100°С. 1 Н ЯМР (D MSO+D2O) δ (млн.-1): 0.95-1.45 (недозволений пік, 4Н); 1.60 (m, 1H); 1.80 (уширений d, 2Н); 2.40 (s, 3Н); 2.60 (s, 3Н); 2.903.20 (недозволений пік, 4Н); 4.10 (уширений d, 2H); 4.30 (s, 2H); 6.70 (d, 1H); 7.10 (d, 1H); 7.75 (dd, 1H). Приклад 5 (Сполука 154) 2-(метиламіно)-2-оксоетил-[1-(1-ізохіноліл)-4піперидил]метилкарбамат гідрохлорид 5.1. [1-(1-ізохіНоліл)-4-піперидил]метанол 22 Процес проводять, як описано в Прикладі 2 (стадія 2.1.)· Виходячи з 2,50г (15,28ммоль) 1хлорізохіноліну, 1,94г (136,6ммоль) 4піперидилметанолу, 3,53г (36,67ммоль) третбутоксиду натрію, 0,285г (0,46ммоль) BINAP і 0,140г (0,15ммоль) трис(дибензиліденацетон)дипаладію і після хроматографії на силікагелі з елююванням сумішшю ди хлорметану, метанолу і 28%-ного водного аміаку у відношенні 98/2/0,2 і потім 95/5/0,5 одержують 2,40г чистого продукту у вигляді в'язкого оранжевого масла. 5.2. 3-{[1-(1-ізохіноліл)-4-піперидил]метил}-1,3оксазолі дин-2,4-діон Розчин 2,01г (9,95ммоль) діізопропілазодикарбоксилату (DIAD) в 5мл тетрагідрофурану по краплях в атмосфері інертного газу додають до розчину 2,4г (9,95ммоль) [1-(1-ізохіноліл)-4піперидил]метанолу, одержаного на стадії 5.1., 2,87г (10,94ммоль) трифенілфосфіну і 1,21г (11,93ммоль) 1,3-оксазолідин-2,4-діону в 40мл тетрагідрофурану, охолодженому до приблизно 10°С, підтримуючи весь час температуру реакційної середи між -10°С і 0°С. Перемішування далі продовжують при 0°С протягом 1 години і потім при 25°С протягом 18 годин. Суміш концентрують при зниженому тиску і залишок переводять в дихлорметан і 10мл водного 5%-ного розчину гідроксиду натрію. Водну фазу відділяють і далі двічі екстрагують дихлорметаном. Органічні фази об'єднують і послідовно промивають водним розчином соляної кислоти (1н), потім насиченим водним розчином гідрокарбонату натрію і насиченим водним розчином хлориду натрію. Органічну фазу сушать над сульфатом натрію і фільтрат концентрують при зниженому тиску. Одержаний таким чином залишок очищають хроматографією на силікагелі, елююючи сумішшю дихлорметану, метанолу і 28%-ного водного аміаку у відношенні 99/1/0,1 і потім 98/2/0,2. Таким чином одержують 3,57г оксазолідиндіону у вигляді оранжевої пасти. 5.3. 2-(метиламіно)-2-оксоетил-[1-(1-ізохінолі)4-піеридил]метилкарбамат Процес проводять відповідно до методики, описаної в Прикладі 1 (стадія 1.5). Виходячи з 3,57г (10,97ммоль) 3-{[1-(1-ізохіноліл)-4піперидил]метил}-1,3-оксазолідин-2,4-діону, одержаного на стадії 5.2., і 27мл (54,86ммоль) розчину (2М) метиламіну в тетрагідрофурані і після хроматографії на силікагелі з елююванням сумішшю ди хлорметану, метанолу і 28%-ного водного аміаку (95/5/0,5) одержують 0,90г чистого продукту у вигляді жовтої пасти. Цей залишок переводять в розчин соляної кислоти (5 н) в ізопропанолі, сіль, що утворилася, відфільтровують і далі промивають ацетоном. Після висушування під вакуумом при приблизно 80°С одержують 0,728г гідрохлориду у вигляді твердої речовини блідо-жовтого забарвлення. РХ-МС: М+Н=357. Т.пл. (°С): 208-212°С (розкладання). 23 81808 1 24 H ЯМР (D2O) δ (млн -1): 1.55 (m, 2H); 1.95 (m, 3Н); 2.70 (s, 3Н); 3.20 (уширений d, 2Н); 3.45 (t, 2Н); 4.10 (уширений d, 2Н); 4.50 (s, 2Н); 7.35 (d, 1H); 7.55 (d, 1H); 7.70 (m, 1H); 7.90 (d, 2H); 8.20 (d, 1H). Приклад 6 (Сполука 158) 2-аміно-2-оксоетил-2-[1-(6-фтор-1-ізохіноліл)4-піперидил]етилкарбамат 1 Н ЯМР (DMSO) δ (млн -1): 1.20-1.70 (недозволений пік, 5Н); 1.80 (уширений d, 2Н); 2.85 (t, 2H), 3.10 (уширений d, 2H); 3.70 (уширений d, 2H); 4.30 (s, 2H); 6.95-7.20 (недозволений пік, 3Н); 7.30 (d, 1H); 7.45 (td, 1Н); 7.60 (dd, 1H); 8.10(m, 2Н). Приклад 7 (Сполука 172) 2-(метиламіно)-2-оксоетил-2-[1-(4-ізохіноліл)-4піперидил]етилкарбамат гідрохлорид 6.1. 2-[1-(6-φτορ-1-ізохіноліл)-4піперидил]етанол Процес проводять, як описано в Прикладі 4 (стадія 4.1.). Виходячи з 1,52г (8,39ммоль) 1-хлор6-фторізохіноліну і 1,20г (9,23ммоль) 2-(4піперидил)етанолу і після хроматографії на силікагелі з елююванням сумішшю дихлорметану, метанолу і 28%-ного водного аміаку (95/5/0,5) одержують 0,90г чистого продукту у вигляді жовтої пасти. 6.2. 2-[1-(6-фтор1-ізохіноліл)-4піперидил]етилметансульфонат Процес проводять, як описано в Прикладі 3 (стадія 3.2.). Виходячи з 1,47г (5,36ммоль) 2-[1-(6фтор-1-ізохіноліл)-4-піперидил]етанолу, одержаного на стадії 6.1., 0,675г (5,89ммоль) мезилхлориду і 1,13мл (8,04ммоль) триетиламіну одержують 1,80г продукту у вигляді масла, яке використовують без подальшого очищення на наступній стадії. 6.3. 3-{2-[1-(6-фтор-1-ізохіноліл)-4піперидил]етил}-1,3-оксазолідин-2,4-діон Процес проводять у відповідності зі способом, описаним в Прикладі 3 (стадія 3.3.). Виходячи з 1,8г (5,10ммоль) 2-[1-(6-фтор-1-ізохіноліл)-4піперидил]етилметансульфонату, одержаного на стадії 6.2., 0,62г (6,13ммоль) 1,3-оксазолідин-2,4діону і 1,30мл (10,21ммоль) 1,1,3,3тетраметилгуанідину і після хроматографії на силікагелі з елююванням сумішшю етилацетату і циклогексані (40/60) одержують 1,34г чистого продукту у вигляді аморфної твердої речовини білого кольору. 6.4. 2-аміно-2-оксоетил-2-[1-(6-фтор-1ізохіноліл)-4-піперидил]етилкарбамат Процес проводять відповідно до методики, описаної в Прикладі 3 (стадія 3.4.). Виходячи з 0,597г (1,67ммоль) 3-{2-[1-(6-фтор-1-ізохіноліл)-4шперидил]етил}-1,3-оксазолідин-2,4-діону, одержаного на стадії 6.3., і 14,30мл (100,20ммоль) розчину (7М) водного аміаку в метанолі і після хроматографії на силікагелі з елююванням сумішшю ди хлорметану і метанолу (95/5) з подальшою перекристалізацією з діізопропілового ефіру одержують 0,168г чистого продукту у вигляді твердої речовини білого кольору. РХ-МС: М+Н=375. Т.пл. (°С): 135-139°С. 7.1. 2-[1-(4-ізохіноліл)-4-піперидил] етанол Процес проводять згідно з протоколом, описаним в Прикладі 2 (стадія 2.1.). Виходячи з 1г (4,81ммоль) 4-бромізохіноліну, 0,683г (5,29ммоль) 2-(4-піперидил)етанолу, 1,11г (11,50ммоль)третбутоксиду натрію, 0,090г (0,144ммоль) BINAP і 0,044г (0,048ммоль) трис(дибензиліденацетон)дипаладію і після хроматографії на силікагелі з елююванням сумішшю дихлорметану і метанолу у відношенні 97/3 і потім 95/5 одержують 0,810г продукту у вигляді в'язкої зеленої рідини. 7.2. 3-{2-[1-(4-ізохіноліл)-4-піперидил]етил}-1,3оксазолідин-2,4-діон Використовують методику, описану в Прикладі 5 (стадія 5.2.). Виходячи з 0,801г (3,12ммоль) 2-[1(4-ізохіноліл)-4-піперидил]етанолу, одержаного на стадії 7.1., 0,902г (3,44ммоль) трифенілфосфіну, 0,379г (3,75ммоль) 1,3-оксазолідин-2,4-діону і 0,632г (3,12ммоль) діізопропілазодикарбоксилату (DIAD) і після хроматографії на силікагелі з елююванням сумішшю дихлорметану і метанолу (98/2) одержують 1г продукту у вигляді зеленої пасти. 7.3. 2-(метиламіно)-2-оксоетил-2-[1-(4ізохіноліл)-4-піперидил]етилкарбамат Використовують методику, описану в Прикладі 1 (стадія 1.5.). Виходячи з 1г (2,95ммоль) 3-{2-[1(4-ізохіноліл)-4-піперидил]етил}-1,3-оксазолідин2,4-діону, одержаного на стадії 7.2., і 7,40мл (14,73ммоль) розчину (2М) метиламіну в тетрагідрофурані і після хроматографії на силікагелі з елююванням сумішшю ди хлорметану і метанолу (95/5) одержують 0,410г чистого продукту у вигляді аморфної речовини білого кольору. Цей маслянистий залишок потім переводять в розчин соляної кислоти (5н) в ізопропанолі, сіль, що утворилася, відфільтровують і далі промивають послідовно ацетоном і потім діізопропіловим ефіром. Після висушування під вакуумом при приблизно 90°С одержують 0,359г гідрохлориду у вигляді твердої речовини жовтого кольору. РХ-МС: М+Н=371. Т.пл. (°С): 205-210°С. 1 Н ЯМР (DMSO) δ (млн -1): 1.30-1.70 (недозволений пік, 5Н); 1.90 (уширений d, 2Н); 2.60 (d, 3H); 2.90 (t, 2H), 3.15 (m, 2H); 3.50 (уширений d, 2H); 4.35 (s, 2H); 7.25 (уширений t, 1H); 7.80 25 81808 26 (уширений s, 1H); 8.0 (dd, 1H); 8.05-8.30 (недозволений пік, 3Н); 8.45 (d, 1H); 9.45 (s, 1H). Приклад 8 (Сполука 126) 2-(метиламіно)-2-оксоетил-2-[1-(2-хіноліл)-4піперидил]етилкарбамат 8.1. 2-[1-(2-хіноліл)-4-піперидил]етанол Процес проводять, як описано в Прикладі 4 (стадія 4.1.). Виходячи з 2г (12,20ммоль) 2хлорхіноліну і 1,58г (12,20ммоль) 2-(4піперидил)етанолу і після хроматографії на силікагелі з елююванням сумішшю дихлорметану, метанолу і 28%-ного водного аміаку у відношенні 98/2/0,2 і потім 95/5/0,5 одержують 2,36г чистого продукту у ви гляді блідо-жовтого масла, яке кристалізується при кімнатній температурі. 8.2. 3-{2-[1-(2-хіноліл)-4-піперидил]етил}-1,3оксазолідин-2,4-діон Процес проводять відповідно до методики, описаної в Прикладі 5 (стадія 5.2.). Виходячи з 2,22г (8,65ммоль) 2-[1-(2-хіноліл)-4піперидил]етанолу, одержаного на стадії 8.1., 2,50г (9,52ммоль) трифенілфосфіну, 1,05г (10,38ммоль) 1,3-оксазолідин-2,4-діону і 1,75г (8,65ммоль) діізопропілазодикарбоксилату (DIAD) і після хроматографії на силікагелі з елююванням сумішшю етилацетату і циклогексану у відношенні 30/70 і потім 40/60 одержують 2,63г продукту у вигляді аморфної твердої речовини білого кольору. 8.3. 2-(метиламіно)-2-оксоетил-2-[1-(2-хіноліл)4-піперидил]етилкарбамат Процес проводять відповідно до методики, описаної в Прикладі 1 (стадія 1.5.). Виходячи з 1,5г (4,42ммоль) 3-{2-[1-(2-хіноліл)-4-піперидил]етил}1,3-оксазолідин-2,4-діону, одержаного на стадії 8.2., і 11мл (22,10ммоль) розчину (2М) метиламіну в тетрагідрофурані і після хроматографії на силікагелі з елююванням сумішшю дихлорметанау, метанолу і 28%-ного водного аміаку у відношенні 98/2/0,2 і потім 95/5/0,5 з подальшою кристалізацією з етилацетату одержують 0,405г чистого продукту у вигляді твердої речовини білого кольору. РХ-МС: М+Н=371. Т.пл. (°С): 125-128°С. 1 Н ЯМР (CDCI3) δ (млн -1): 1.20-1.60 (недозволений пік, 5Н); 1.85 (уширений d, 2Н); 2.85 (d, 3Н); 3.0 (уширений t, 2H), 3.30 (уширений q, 2H); 4.55 (уширений d, 2Н); 4.60 (s, 2H); 4.85 (уширений s, 1H); 6.10 (уширений s, 1H); 7.0 (d, 1H); 7.20 (t, 1H); 7.55 (m, 2H); 7.70 (d, 1H); 7.90 (d, 1H). Приклад 9 (Сполука 127) 2-аміно-2-оксоетил-2-[1-(2-хіноліл)-4піперидил]-етилкарбамат Процес проводять відповідно до методики, описаної в Прикладі 3 (стадія 3.4.). Виходячи з 1,14г (3,36ммоль) 3-{2-[1-(2-хіноліл)-4піперидил]етил}-1,3-оксазолідин-2,4-діону, описаного в Прикладі 8 (стадія 8.2.), і 9,60мл (67,20ммоль) розчину (7 М) водного аміаку в метанолі і після хроматографії на силікагелі з елююванням сумішшю дихлорметану і метанолу (95/5) з подальшою перекристалізацією з етилацетату одержують 0,360г чистого продукту у вигляді твердої речовини білого кольору. PX-MC:M+H=357. Т.пл. (°С): 135-137°С. 1 Н ЯМР (CDCI3) δ (млн -1): 1.15-1.70 (недозволений пік, 5Н); 1.85 (уширений d, 2Н); 2.95 (t, 2H); 3.35 (q, 2H); 4.55 (уширений d, 2H); 4.60 (s, 2H); 4.85 (уширений s, 1Н); 5.55 (уширений s, 1H); 6.05 (уширений s, 1H); 7.0 (d, 1H); 7.20 (t, 1H); 7.55 (t, 1Н); 7.60 (d, 1H); 7.70 (d, 1H); 7.90 (d, 1H). Приклад 10 (Сполука 137) 2-аміно-2-оксоетил-2-[1-(6-хлор-2-хіноліл)-4піперидил]етилкарбамат 10.1. 2-[1-(6-хлор-2-хіноліл)-4-піперидил] етанол Процес проводять, як описано в Прикладі 4 (стадія 4.1.). Виходячи з 2г (10,10ммоль) 2,6дихлорхіноліну і 1,44г (11,10ммоль) 2-(4піперидил)етанолу і після хроматографії на силікагелі з елююванням сумішшю ди хлорметану і метанолу (98/2) одержують 2,54г чистого продукту у вигляді твердої речовини білого кольору. 10.2. 2-[1-(6-хлор-2-хіноліл)-4піперидил]етилметансульфонат Процес проводять, як описано в Прикладі 3 (стадія 3.2.). Виходячи з 2,49г (8,56ммоль) 2-[1-(6хлор-2-хіноліл)-4-піперидил]етанолу, одержаного на стадії 10.1., 1,08г (9,42ммоль) мезилхлориду і 1,81мл (12,84ммоль) триетиламіну одержують 3,10г продукту у вигляді масла, яке використовують без подальшого очищення на наступній стадії. 10.3. 3-{2-[1-(6-хлор-2-хіноліл)-4піперидил]етил}-1,3-оксазолідин-2,4-діон Процес проводять у відповідності зі способом, описаним в Прикладі 3 (стадія 3.3.). Виходячи з 3г (8,13ммоль) 2-[1-(6-хлор-2-хіноліл)-4піперидил]етилметансульфонату, одержаного на стадії 10.2., 1,09г (10,8ммоль) 1,3-оксазолідин-2,4діону і 2,30мл (18ммоль) 1,1,3,3тетраметилгуанідину і після хроматографії на 27 81808 силікагелі з елююванням сумішшю ди хлорметану і метанолу (98/2) одержують 2,57г продукту. 10.4. 2-аміно-2-оксоетил-2-[1-(6-хлор-2хіноліл)-4-піперидил]етилкарбамат Процес проводять відповідно до методики, описаної в Прикладі 3 (стадія 3.4.). Виходячи з 1,28г (3,42ммоль) 3-{2-[1-(6-хлор-2-хіноліл)-4піперидил]етил}-1,3-оксазолідин-2,4-діону, одержаного на стадії 10.3., і 22,10мл (154,08ммоль) розчину (7М) водного аміаку в метанолі і після кристалізації з етанолу одержують 0,64г чистого продукту у вигляді твердої речовини білого кольору. РХ-МС: М+Н=391. Т.пл. (°С): 189-191°С. 1 Н ЯМР (DMSO) δ (млн -1): 1.10 (m, 2Н); 1.40 (m, 2Н); 1.60 (m, 1H); 1.80 (уширений d, 2Н); 2.90 (уширений t, 2Н); 3.05 (m, 2Н); 4.30 (s, 2Н); 4.50 (уширений d, 2Н); 7.15 (m, 3Н); 7.25 (d, 1Н); 7.50 (m, 2Н); 7.75 (d, 1H); 7.95 (d, 1H). Приіслад 11 (Сполука 166) 2-(метиламіно)-2-оксоетил-2-[1-(3-ізохіноліл)-4піперидил]етилкарбамат 11.1. 2-[1-(3-ізохіноліл)-4-піперидил]етанол Процес проводять, як описано в Прикладі 4 (стадія 4.1.). Виходячи з 1г (6,11ммоль) 3хлорізохіноліну і 0,869г (6,72ммоль) 2-(4піперидил)етанолу і після хроматографії на силікагелі з елююванням сумішшю ди хлорметану і метанолу (98/2) одержують 0,34г чистого продукту у вигляді масла. 11.2. 2-[1-(3-ізохіноліл)-4піперидил]етилметансульфонат Процес проводять, як описано в Прикладі 3 (стадія 3.2.). Виходячи з 0,34г (1,33ммоль) 2-[1-(3ізохіноліл)-4-піперидил]етанолу, одержаного на стадії 11.1., 0,18г (1,59ммоль) мезилхлориду і 0,30мл (1,°9ммоль) триетиламіну одержують 0,44г продукту у вигляді масла, яке використовують без подальшого очищення на наступній стадії. 11.3. 3-{2-[1-(3-ізохіноліл)-4-піперидил]етил}1,3-оксазолідин-2,4-діон Процес проводять у відповідності зі способом, описаним в Прикладі 3 (стадія 3.3.). Виходячи з 0,44г (1,32ммоль) 2-[1-(3-ізохіноліл)-4піперидил]етилметансульфонату, одержаного на стадії 11.2., 0,16г (1,58ммоль) 1,3-оксазолідин-2,4діону і 0,30г (2,63ммоль) 1,1,3,3тетраметилгуанідину і після хроматографії на силікагелі з елююванням сумішшю ди хлорметану і метанолу (98/2) одержують 0,25г продукту. 11.4. 2-(метиламіно)-2-оксоетил-2-[1-(3ізохіноліл)-4-піперидил]етилкарбамат Процес проводять відповідно до методики, описаної в Прикладі 1 (стадія 1.5.). Виходячи з 0,24г (0,71ммоль) 3-{2-[1-(3-ізохіноліл)-4піперидил]етил}-1,3-оксазолідин-2,4-діону, одержаного на стадії 11.3., і 1,8мл (3,53ммоль) 28 розчину (2М) метиламіну в тетрагідрофурані і після хроматографії на силікагелі з елююванням сумішшю дихлорметану і метанолу у відношенні 98/2 і потім 96/4 з подальшою кристалізацією з діізопропілового ефіру одержують 0,16г чистого продукту у вигляді твердої речовини білого кольору. РХ-МС: М+Н=371. Т.пл. (°С): 156-158°С. 1 Н ЯМР (CDCI3) δ (млн -1): 1.20-1.70 (недозволений пік, 5Н); 1.85 (d, 2H); 2.90 (m, 5H); 3.30 (q, 2H); 4.40 (d, 2H); 4.60 (s, 2H); 4.85 (уширений s, 1H); 6.10 (уширений s, 1Н); 6.80 (s, 1H); 7.30 (m, 1H); 7.60 (m, 2Н); 7.80 (d, 1H); 8.95 (s, 1H). Приклад 12 (Сполука 128) 2-(метиламіно)-2-оксоетил-2-[4-фтор-1-(2хіноліл)-4-піперидил]етилкарбамат 12.1. трет-бутил-4-гідрокси-4-(2-гідроксіетил)1-піперидинкарбоксилат Розчин 31,20г (108,50ммоль) трет-бутил-4-(2етоксі-2-оксоетил)-4-гідрокси-1піперидинкарбоксилату [WO 02/16352] в 150мл тетрагідрофурану по краплях додають до суспензії 4,12г (108,50ммоль) алюмогідриду літію в 150мл тетрагідрофурану. С уміш перемішують при кімнатній температурі протягом 2 годин і потім обробляють, як описано в Прикладі 2 (стадія 2.4.)· Одержують 26г продукту у вигляді жовтого масла, яке використовують без подальшого очищення на наступній стадії. 12.2. трет-бутил-4-(2-{[третбутилди фенілсиліл]оксі}етил)-4-гідрокси-1піперидинкарбоксилат Розчин 21,50мл (82,50ммоль) третбутилди фенілсилілхлориду в 15мл дихлорметану по краплях додають в атмосфері інертного газу до розчину 18,4г (75ммоль) трет-бутил-4-гідрокси-4(2-гідроксіетил)-1-піперидинкарбоксилату, одержаного на стадії 12.1., і 11,60мл (82,50ммоль) триетиламіну в 100мл дихлорметану, охолодженому до приблизно 0°С. Суміш залишають нагріватися до кімнатної температури і потім продовжують перемішування протягом 12 годин. У реакційну середу додають насичений водний розчин хлориду амонію. Водну фазу відділяють і двічі екстрагують дихлорметаном, об'єднані органічні фази промивають насиченим водним розчином хлориду натрію і сушать над сульфатом натрію і фільтрат концентрують при зниженому тиску. Одержаний таким чином залишок очищають хроматографією на силікагелі, елююючи сумішшю етилацетату і циклогексану у відношенні 10/90 і потім 20/80. Таким чином одержують 33,48г продукту у вигляді жовтого масла. 29 81808 12.3. трет-бутил-4-(2-{[третбутил(ди феніл)силіл]оксі}етил)-4-фтор-1піперидинкарбоксилат Розчин 1,70мл (13,40ммоль) 1,1'-[(трифтор-λ4сульфаніл)іміно]діетану (DAST) в 10мл дихлорметану по краплях додають в атмосфері інертного газу до розчину 5г (10,34ммоль) третбутил-4-(2-{[трет-бутил(дифеніл)силіл]оксі}етил)-4гідрокси-1-піперидинкарбоксилату, одержаного на стадії 12.2., в 100мл дихлорметану, охолодженому до приблизно 0°С. Суміш залишають нагріватися до кімнатної температури і потім продовжують перемішування протягом 12 годин. У реакційну середу додають насичений водний розчин гідрокарбонату натрію. Водну фазу відділяють і екстрагують три рази дихлорметаном, об'єднані органічні фази промивають насиченим водним розчином хлориду натрію і сушать над сульфатом натрію. Фільтрат концентрують при зниженому тиску і одержаний таким чином залишок далі очищають хроматографією на силікагелі, елююючи сумішшю етилацетату і циклогексану (10/90). Таким чином одержують 4,65г продукти у вигляді масла оранжевого забарвлення. 0,60мл розчину тетроксиду осмію (2,5%-ного) в третбутанолі додають при кімнатній температурі до розчину 4,50г цього маслянистого залишку і 1,25г (10,7ммоль) оксиду N-метилморфоліну (NMO) в суміші 8мл ацетону і 6мл води. Перемішування продовжують протягом 21 години. Залишок переводять в етилацетат і воду, водну фазу відділяють і двічі екстрагують етилацетатом, об'єднані органічні фази промивають насиченим водним розчином хлориду натрію і сушать над сульфатом натрію. Після випаровування розчинника одержаний залишок очищають хроматографією на силікагелі, елююючи сумішшю етилацетату і циклогексану (6/94). Таким чином одержують 3,40г продукти у вигляді блідо-жовтого масла. 12.4. 4-(2{[третбутил(ди феніл)силіл]оксі}етил)-4-фторпіперидин 2,80мл (37,06ммоль) трифтороцтової кислоти повільно додають до розчину 3г (6,17ммоль) третбутил-4-(2-{[трет-бутил(дифеніл)силіл]оксі}етил)-4фтор-1-піперидинкарбоксилату, одержаного на стадії 12.3., в 20мл дихлорметану. Перемішування продовжують при кімнатній температурі протягом 5 годин. Реакційну суміш виливають в суміш води з льодом і 28%-ного водного аміаку. Фази розділяють шляхом відстоювання, водну фазу двічі екстрагують дихлорметаном, об'єднані органічні фази промивають насиченим водним розчином хлориду натрію, суша ть над сульфатом натрію і концентрують при зниженому тиску. Таким чином одержують 2,30г продукту у вигляді жовтого масла, яке використовують без подальшого очищення на наступній стадії. 12.5. 2-[4-(2-{[бутилдифенілсиліл]оксі}етил)-4фтор-1-піперидил]хінолін Процес проводять, як описано в Прикладі 2 (стадія 2.1.). Виходячи з 1,18г (5,68ммоль) 2-бромхіноліну [Eur. J. Org. Chem. 2002, 4181-4184], 2,30г (5,98ммоль) 4-(2{[трет-бутил(дифеніл)силіл]оксі}етил)-4фторпіперидину, одержаного на стадії 12.4., 0,66г 30 (6,81ммоль) трет-бутоксиду натрію, 0,149г (0,239ммоль) BINAP і 0,074г (0,081ммоль) трис(дибензиліденацетон)дипаладію і після хроматографії на силікагелі з елююванням сумішшю етилацетату і циклогексану (10/90) одержують 2,15г чистого, продукту у вигляді масла оранжевого забарвлення. 12.6. 2-[4-фтор-1-(2-хіноліл)-4піперидил]етанол 0,40г (1,26ммоль) н-тетрабутиламонію фториду тригідрату додають до розчину 2,15г (4,19ммоль) 2-[4-(2-{[третбутилди фенілсиліл]оксі}етил)-4-фтор-1піперидил]хіноліну, одержаного на стадії 12.5., в 20мл тетрагідрофурану. Перемішування продовжують при кімнатній температурі протягом 4 годин. Суміш концентрують досуха і одержаний залишок далі очищають хроматографією на силікагелі, елююючи сумішшю етилацетату і цилогексану у відношенні 35/65 і потім 40/60. Одержують 0,61г продукту у ви гляді масла оранжевого забарвлення. 12.7. 2-[4-фтор-1-(2-хіноліл)-4піперидил]етилметансульфонат Процес проводять, як описано в Прикладі 3 (стадія 3.2.). Виходячи з 0,61г (2,22ммоль) 2-[4фтор-1-(2-хіноліл)-4-піперидил]етанолу, одержаного на стадії 12.6., 0,280г (2,45ммоль) мезилхлориду і 0,35мл (2,45ммоль) триетиламіну одержують 0,80г продукту у вигляді масла оранжевого забарвлення, яке використовують без подальшого очищення на наступній стадії. 12.8. 3-{2-[4-фтор-1-(2-хіноліл)-4піперидил]етил}-1,3-оксазолідин-2,4-діон Процес проводять у відповідності зі способом, описаним в Прикладі 3 (стадія 3.3.). Виходячи з 0,780г (2,22ммоль) 2-[4-фтор-1-(2-хіноліл)-4піперидил]етилметансульфонату, одержаного на стадії 12.7., 0,27г (2,66ммоль) 1,3-оксазолідин-2,4діону і 0,51г (4,43ммоль) 1,1,3,3тетраметилгуанідину і після хроматографії на силікагелі з елююванням сумішшю ди хлорметану і метанолу (99/1) одержують 0,520г чистого продукту у ви гляді твердої речовини бежового забарвлення. 12.9. 2-(метиламіно)-2-оксоетил-2-[4-фтор-1(2-хіноліл)-4-піперидил] етилкарбамат Процес проводять відповідно до методики, описаної в Прикладі 1 (стадія 1.5.). Виходячи з 0,52г (1,46ммоль) 3-{2-[4-фтор-1-(2-хіноліл)-4піперидил]етил}-1,3-оксазолідин-2,4-діону, одержаного на стадії 12.8., і 3,6мл (7,28ммоль) розчину (2М) метиламіну в тетрагідрофурані і після хроматографії на силікагелі з елююванням сумішшю етилацетату і метанолу (99/1) з подальшою кристалізацією з діетилового ефіру одержують 0,390г чистого продукту у вигляді твердої речовини білого кольору. РХ-МС: М+Н=389. Т.пл. (°С):147-149°С. 1 Н ЯМР (CDCI3) 6 (млн-1): 1.70-2.10 (недозволений пік, 6Н); 2.90 (d, 3Н); 3.40 (уширений t, 2Н); 3.50 (q, 2Н); 4.40 (уширений d, 2Н); 4.60 (s, 2Н); 5.15 (уширений s, 1H); 6.15 31 81808 (уширений s, 1H); 7.05 (d, 1H); 7.25 (t, 1H); 7.55 (t, 1H); 7.65 (d, 1H); 7.75 (d, 1H); 7.95 (d, 1H). Приклад 13 (Сполука 49) 2-(метиламіно)-2-оксоетил-2-[1-(6-ізобутил-2піридил)-4-піперидил]етилкарбамат 13.1. 2-[1-(6-бром-2-піридил)-4-піперидил] етанол Процес проводять, як описано в Прикладі 4 (стадія 4.1.). Виходячи з 30,20г (127ммоль) 2,6дибромпіридину і 16,45г (127ммоль) 2-(4піперидил)етанолу і після хроматографії на силікагелі з елююванням сумішшю етилацетату і циклогексану (30/70) одержують 7г чистого продукту у вигляді масла. 13.2. 2-[1-(6-бром-2-піридил)-4піперидил]етилметансульфонат Процес проводять, як описано в Прикладі 3 (стадія 3.2.). Виходячи з 7г (24,50ммоль) 2-[1-(6бром-2-піридил)-4-піперидил]етанолу, одержаного на стадії 13.1., 2,50мл (26,90ммоль) мезилхлориду і 3,80мл (26,90ммоль) триетиламіну одержують 8,68г продукту у вигляді масла, яке використовують без подальшого очищення на наступній стадії. 13.3. 3-{2-[1-(6-бром-2-піридил)-4піперидил]етил}-1,3-оксазолідин-2,4-діон Процес проводять у відповідності зі способом, описаним в Прикладі 3 (стадія 3.3.). Виходячи з 8,68г (23,80ммоль) 2-[1-(6-бром-2-піридил)-4піперидил]етилметансульфонату, одержаного на стадії 13.2., 2,90г (28,60ммоль) 1,3-оксазолідин2,4-діону і 6мл (47,60ммоль) 1,1,3,3тетраметилгуанідину і після хроматографії на силікагелі з елююванням сумішшю ди хлорметану і метанолу (97/3) одержують 4,52г продукту у вигляді масла. 13.4. 3-{2-[1-(6-ізобутил-2-піридил )-4піперидил]етил}-1,3-оксазолідин-2,4-діон 2г (5,43ммоль) 3-{2-[1-(6-бром-2-піридил)-4піперидил]етил}-1,3-оксазолідин-2,4-діону, одержаного на стадії 13.3., і 0,20г (0,271ммоль) дихлорбіс(трифенілфосфін)паладію (Pd(PPh3Cl2), суспендованого в 10мл тетрагідрофурану, вводять в атмосферу інертного газу. Потім додають 22мл (10,80ммоль) розчину (0,5М) бром(ізобутил)цинку в тетрагідрофурані. Перемішування продовжують при кімнатній температурі протягом 17 годин. Реакційну суміш виливають у воду і етилацетат. Фази розділяють шляхом відстоювання, водну фазу двічі екстрагують етилацетатом, об'єднані органічні фази сушать над сульфатом натрію і фільтрат концентрують при зниженому тиску. Одержаний таким чином залишок очищають хроматографією на силікагелі, елююючи сумішшю етилацетату і циклогексану (20/80). Одержують 1,41г продукти у вигляді твердої речовини білого кольору. Т.пл. (°С):94-96°С. 32 13.5. 2-(метиламіно)-2-оксоетил-2-[1-(6ізобутил-2-піридил)-4-піперидил]етилкарбамат Процес проводять відповідно до методики, описаної в Прикладі 1 (стадія 1.5.). Виходячи з 0,72г (2,08ммоль) 3-{2-[1-(6-ізобутил-2-піридил)-4піперидил]етил}-1,3-оксазолідин-2,4-діону, одержаного на стадії 13.4., і 5,20мл (10,40ммоль) розчину (2М) метиламіну в тетрагідрофурані і після хроматографії на силікагелі з елююванням сумішшю ди хлорметану, метанолу і 28%-ного водного аміаку (95/5/0,5) з подальшою кристалізацією з діізопропілового ефіру одержують 0,540г чистого продукту у вигляді твердої речовини білого кольору. РХ-МС: М+Н=377. Т.пл. (°С):97-99°С. 1 Н ЯМР (DMSO) δ (млн -1): 0.85 (d, 6H); 1.05 (m, 2H); 1.20-1.60 (недозволений пік, 3Н); 1.70 (уширений d, 2Н); 2.0 (m, 1H); 2.40 (d, 2H); 2.55 (d, 3H); 2.70 (уширений t, 2H); 3.05 (уширений q, 2H); 4.20 (уширений d, 2H); 4.30 (s, 2H); 6.35 (d, 1H); 6.55 (d, 1H); 7.15 (уширений t, 1H); 7.40 (dd, 1H); 7.75 (уширений s, 1H). Приклад 14 (Сполука 58) 2-аміно-2-оксоетил-2-[1-(6-феніл-2-піридил)-4піперидил]метилкарбамат 14.1. 3-{2-[1-(6-феніл-2-піридил)-4піперидил]метил}-1,3-оксазолідин-2,4-діон 0,20г (0,56ммоль) 3-{2-[1-(6-бром-2-піридил)-4піперидил]метил}-1,3-оксазолідин-2,4-діону, одержаного відповідно до методики, описаної в Прикладі 13 (стадії 13.1., 13.2. і 13.3.), 0,089г (0,73ммоль) фенілборонової кислоти і 0,480г (2,25ммоль) гідратованого фосфату калію, суспендованого в 3мл 1,2-диметоксіетану, вводять в атмосферу інертного газу. Потім додають 0,040г (0,0346ммоль) тетракис(трифенілфосфін)паладію. Реакційну суміш далі підтримують при приблизно 85°С протягом 16 годин. Одержану суміш концентрують при зниженому тиску. Залишок переводять в етилацетат і воду, водну фазу відділяють і двічі екстрагують етилацетатом, об'єднані органічні фази сушать над сульфатом натрію і фільтрат концентрують при зниженому тиску. Одержаний таким чином залишок очищають хроматографією на силікагелі, елюючи сумішшю етилацетату і циклогексану (40/60). Одержують 0,175г продукту. 14.2. 2-аміно-2-оксоетил 2-[1-(6-феніл-2піридил)-4-шперидил]метилкарбамат Процес проводять відповідно до методики, описаної в Прикладі 3 (стадія 3.4.). Виходячи з 0,175г (0,499ммоль) 3-{2-[1-(6-феніл-2-піридил)-4піперидил]метил}-1,3-оксазолідин-2,4-діону, одержаного на стадії 14.1., і 2,5мл (17,45ммоль) розчину (7М) нашатирного спирту в метанолі після кристалізації з етилацетату одержують 0,070г 33 81808 чистого продукту у вигляді твердої речовини білого кольору. РХ-МС: М+Н=369. Т.пл. (°С):131-132°С. 1 Н ЯМР (CDCI3) δ (млн -1): 1.20-1.90 (недозволений пік, 5Н); 2.90 (уширений t, 2Н); 3.20 (t, 2H); 4.50 (уширений d, 2H); 4.60 (s, 2H); 5.0 (уширений s, 1H); 5.55 (уширений s, 1H); 6.15 (уширений s, 1H); 6.65 (d, 1H); 7.10 (d, 1H); 7.357.60 (m, 4H);8.15 (dd, 2H). Приклад 15 (Сполука 130) 2-(метиламіно)-2-оксоетил-2-[1-(5-хлор-2хіноліл)-4-піперидил]етилкарбамат 15.1. 2-[1-(5-хлор-2-хіноліл)-4піперидил]етанол Процес проводять, як описано в Прикладі 4 (стадія 4.1.). Виходячи з 4,78г (24,14ммоль) 2хлор-5-хлорхіноліну [J. Med. Chem., 2002, 45, 31303137], і 3,43г (26,55ммоль) 2-(4-піперидил)етанолу одержують 7г продукту у вигляді масла, яке використовують без подальшого очищення на наступній стадії. 15.2. 2-[1-(5-хлор-2-хіноліл)-4піперидил]етилметансульфонат Процес проводять, як описано в Прикладі 3 (стадія 3.2.). Виходячи з 7г (24,07ммоль) 2-[1-(5хлор-2-хіноліл)-4-піперидил]етанолу, одержаного на стадії 15.1., 3,31г (28,89ммоль) мезилхлориду і 5,10мл (36,11ммоль) триетиламіну одержують 8,70г продукту у вигляді масла, яке використовують без подальшого очищення на наступній стадії. 15.3. 3-{2-[1-(5-хлор-2-хіноліл)-4піперидил]етил}-1,3-оксазолідин-2,4-діон Процес проводять у відповідності зі способом, описаним в Прикладі 3 (стадія 3.3.). Виходячи з 8,7г (23,58ммоль) 2-[1-(5-хлор-2-хіноліл)-4піперидил]етилметансульфонату, одержаного на стадії 15.2., 2,86г (28,30ммоль) 1,3-оксазолідин2,4-діону і 5,43г (47,17ммоль) 1,1,3,3тетраметилгуанідину і після хроматографії на силікагелі з елююванням сумішшю ди хлорметану і метанолу (99,5/0,5) одержують 6,40г продукту у вигляді твердої речовини білого кольору. Т.пл. (°С): 136°С. 15.4. 2-(метиламіно)-2-оксоетил-2-[1-(5-хлор-2хіноліл)-4-піперидил]етилкарбамат Процес проводять відповідно до методики, описаної в Прикладі 1 (стадія 1.5.). Виходячи з 6,40г (17,12ммоль) 3-{2-[1-(5-хлор-2-хіноліл)-4піперидил]етил}-1,3-оксазолідин-2,4-діону, одержаного на стадії 15.3., і 60мл (119,84ммоль) розчину (2М) метиламіну в тетрагідрофурані і після хроматографії на силікагелі з елююванням сумішшю дихлорметану і метанолу у відношенні 98/2 і потім 96/4 з подальшою кристалізацією з 34 діізопропілового ефіру одержують 5,14г продукту у вигляді твердої речовини білого кольору. РХ-МС: М+Н=405. Т.пл. (°С):158-162°С. 1 Н ЯМР (CDCI3) δ (млн -1): 1.10-1.80 (недозволений пік, 5Н); 1.9 (уширений d, 2Н); 2.90 (d, 3Н); 3.0 (m, 2Н); 3.30 (q, 2Н); 4.60 (m, 4Н); 4.85 (уширений s, 1H); 6.10 (уширений s, 1H); 7.05 (d, 1H); 7.25 (d, 1H); 7.40 (dd, 1H); 7.60 (d, 1H); 8.30 (s, 1H). У представленій нижче Таблиці 1 проілюстровані хімічні структури і фізичні властивості ряду сполук згідно з винаходом. У цій таблиці: - в колонці «основа або сіль» «основа» означає сполуку в формі вільної основи, в той час як «НСl» означає сполуку в формі гідрохлориду; - ОМе означає метоксигрупу. 35 81808 36 37 81808 38 39 81808 40 Ферментативну реакцію далі здійснювали в 70мкл буфера, що містить вільний від жирних кислот бичачий сиворотковий альбумін (1мг/мл). До сполук, що тестуються, в різних концентраціях послідовно додавали анандамід [етаноламін 1-3Н] (питома активність 15-20Ки/ммоль), розбавлений до 10мкМ нерадіоактивним анандамідом, і мембранний препарат (400мкг замороженої тканини на тест). Через 15 хвилин при 25°С ферментативну реакцію гасили шляхом додавання 140мкл суміші хлороформ/метанол (2:1). Суміш перемішували протягом 10 хвилин і потім центрифугували протягом 15 хвилин при 3500g. Аліквоту (30мкл) водної фази, що містить етаноламін [1-3Н], підраховували на рідинному сцинтиляційному лічильнику. У цих умовах найбільш активні сполуки за винаходом мають величини ІС50 (концентрація, при якій інгібується 50% контрольної ферментативної активності FAAH) між 0,001 і 1мкМ. У представленій нижче Таблиці 2 показані величини ІС50 для деяких сполук згідно з винаходом. Таблиця 2 Сполука № 47 126 166 * М+Н (РХ-МС) разл.= розкладання продукту Сполуки за винаходом піддавали фармакологічним випробуванням з метою визначення їх інгібуючої дії відносно ферменту FAAH (fatty acid amide hydrolase; гідролаза амідів жирних кислот) Інгібіторна активність була продемонстрована в радіоферментному тесті, заснованому на вимірюванні продукту гідролізу (етаноламін [1-3Н]) анандаміду [етаноламін 1-3Н] за допомогою FAAH [Life Sciences (1995), 56, 1999-2005 і Journal of Pharmacology and Experimented Therapeutics (1997), 283, 729-734]. Так, у мишей витягували головний мозок (мінус мозочок) і зберігали при 80°С. Мембранні гомогенати для негайного використання одержували гомогенізацією тканин з використанням гомогенізатора Polytron в 10мМ трис-НСІ буфері (рН8,0), що містить 150мМ NaCl і 1мМ EDTA (етилендіамінтетраоцтова кислота). ІС50 85мкМ 113мкМ 87мкМ Таким чином показано, що сполуки згідно з винаходом володіють інгібіторною активністю відносно ферменту FAAH. Активність сполук за винаходом in vivo оцінювали в тесті на аналгезию. Так, внутрішньочеревинне (в.б.) введення PBQ (фенілбензохінон, 2мг/кг в 0,9%-ному розчині хлориду натрію, що містить 5% етанолу) самцям OF1 мишей масою 25-30г викликає абдомінальні тракції, в середньому 30 скручувань або скорочень протягом періоду від 5 до 15 хвилин після ін'єкції. Сполуки, що тестуються, вводять перорально або внутрішньочеревинно у вигляді 0,5%-ної суспензії в Твін 80 за 60 хвилин або 120 хвилин перед введенням PBQ. У цих умовах найбільш сильнодіючі сполуки за винаходом дають зниження на 35%-70% числа тракцій, індукованих дією PBQ, в дозовому інтервалі між 1 і 30мг/кг. У представленій нижче Таблиці 3 показані результати тесту на аналгезію для деяких сполук згідно з винаходом. Таблиця 3 Сполука № 47 126 166 Зниження числа тракцій (%) -63% (б) -43% (б) -62% (а) (а) 1мк/кг n.o. за 1 години; (б) 3 мг/кг п.о. за 1 годину. Фермент FAAH (Chemistry and Physics of Lipids, (2000), 108, 107-121) каталізує гідроліз 41 81808 ендогенних амідних і складноефірних похідних різноманітних жирних кислот, таких як Nарахідоноїлетаноламін (анандамід), Nпальмітоїлетаноламін, N-олеоїлетаноламін, олеамід або 2-арахідоноїлгліцерин. Ці похідні виявляють різну фармакологічну активність шляхом взаємодії, inter alia, з канабіноїдними і ванілоїдними рецепторами. Сполуки за винаходом блокують даний шлях деградації і збільшують тканинний вміст цих ендогенних речовин. Вони можуть бути використані в цьому відношенні в попередженні і лікуванні патологій, в які залучені ендогенні канабіноїди і/або будь-які інші субстрати, що метаболізуються під дією ферменту FAAH. Приклади, які можуть бути згадані, включають наступні захворювання і нездужання: біль, особливо, гострий або хронічний біль нейрогенного типу: мігрень, невропатичний біль, в тому числі форми, асоційовані з вірусом герпесу і діабетом, гострий або хронічний біль, асоційований із запальними захворюваннями: артритом, ревматоїдним артритом, остеоартритом, спондилітом, подагрою, васкулітом, хворобою Крона, синдромом роздратованого кишечнику, гострий або хронічний периферичний біль, запаморочення, блювота, нудота, зокрема нудота після хіміотерапії, порушення харчової поведінки, зокрема анорексія і кахексія різної природи, неврологічні і психіатричні патології: тремор, дискінезія, дистонія, мишечна спастичність, компульсивна і обсесивна поведінка, синдром Туретта, всі форми депресії і тривоги будь-якої природи або походження, розлади настрою, психози, гострі і хронічні нейродегенеративні захворювання: хвороба Паркінсона, хвороба Альцгеймера, сенільна деменція, хорея Гантінгтона, ураження, асоційовані з церебральною ішемією і черепною і мозковою травмою, епілепсія, розлади сну, в тому числі апное уві сні, сердечно-судинні захворювання, зокрема гіпертензія, серцева аритмія, артеріосклероз, серцевий приступ, серцева ішемія, ниркова ішемія, рак: доброякісні пухлини шкіри, папіломи, пухлини передміхурової залози, церебральні пухлини (гліобластоми, медулоепітеліоми, медулобластоми, нейробластоми, пухлини ембріонального походження, астроцитоми, астробластоми, эпендимоми, олігодендрогліоми, пухлини сплетення, нейроепітеліоми, пухлини шишкоподібного тіла, епендимобластоми, злоякісні менінгіоми, саркоматоз, злоякісні меланоми, шваноми), розлади імунної системи, особливо аутоімунні захворювання: псоріаз, червоний вовчак, захворювання сполучної тканини, синдром Шегрена, анкілозивний спондилоартрит, недиференційований спондиліт, хвороба Бехчета, гемолітичні аутоімунні анемії, розсіяний склероз, аміотрофічний бічний склероз, амілоз, 42 відторгнення трансплантатів, захворювання, що впливає на лінію плазмоцитів, алергічні захворювання: алергічна реакція негайного або уповільненого типу, алергічний риніт або алергічний кон'юнктивіт, контактний дерматит, паразитарні, вірусні або бактеріальні інфекційні захворювання: СНІД, менінгіт, запальні захворювання, особливо суглобові захворювання: артрит, ревматоїдний артрит, остеоартрит, спондиліт, подагра, васкуліт, хвороба Крона, синдром роздратованого кишечнику, остеопороз, очні хвороби: очна гіпертензія, глаукома, легеневі хвороби: захворювання дихальних шляхів, бронхоспазми, кашель, астма, хронічний бронхіт, хронічна обструкція дихальних шля хів, емфізема, шлунково-кишкові захворювання: синдром роздратованого кишечнику, запальні розлади кишечнику, виразки, діарея, нетримання сечі і запалення сечового міхура. Застосування сполук згідно з винаходом в формі основи або солі приєднання фармацевтично прийнятної кислоти, гідрату або сольвату для виготовлення ліків для лікування згаданих вище патологій є невід'ємною частиною даного винаходу. Об'єктом винаходу також є ліки, що містять сполуку формули (І) або її сіль приєднання кислоти або, альтернативно, фармацевтично прийнятний гідрат або сольват сполуки формули (І). Ці ліки знаходять своє терапевтичне застосування особливо в лікуванні згаданих вище патологій. Відповідно до наступного з аспектів даний винахід відноситься до фармацевтичних композицій, що містять як активне начало щонайменше одну сполуку згідно з винаходом. Ці фармацевтичні композиції містять ефективну дозу сполуки згідно з винаходом або солі приєднання фармацевтично прийнятної кислоти, гідрату або сольвату вказаної сполуки і можливо один або більше ніж один фармацевтично прийнятний ексципієнт. Вказані ексципієнти вибирають відповідно до фармацевтичної форми і бажаного способу введення із загальноприйнятих ексципієнтів, відомих фа хівцям в даній області техніки. У фармацевтичних композиціях за даним винаходом для перорального, сублінгвального, підшкірного, внутрішньом'язового, внутрішньовенного, місцевого, локального, інтратекального, інтраназального, трансдермального, легеневого, очного або ректального введення активне начало формули (І), наведеної вище, або його можлива сіль приєднання кислоти, сольват або гідрат можуть бути введені в одиничних формах введення у вигляді суміші зі стандартними фармацевтичними ексципієнтами людині або тваринам для профілактики або лікування згаданих вище розладів або захворювань. Відповідні одиничні форми введення включають пероральні форми, такі як таблетки, м'які або тверді гелеві капсули, порошки, гранули, жувальні гумки і пероральні розчини або суспензії, 43 81808 сублінгвальні, трансбукальні, інтратрахеальні, внутришньоочні і інтаназальні форми введення, форми для введення за допомогою інгаляції, подшкірно, внутрішньом'язово або форми, що вводяться внутрішньовенно, і форми, що вводяться ректально або вагінально. Для місцевого введення сполуки згідно з винаходом можуть бути використані в кремах, мазях або лосьйонах. Як приклад, одинична форма введення сполуки згідно з винаходом в формі таблетки може містити наступні компоненти: Сполука згідно з винаходом 50,0мг Маніт 223,75мг Кроскармелози натрієва сіль 6,0мг Крохмаль кукурудзяний 15,0мг Гідроксипропілметилцелюлоза 2,25мг Магнію стеарат 3,0мг Зазначені одиничні форми вводять для забезпечення добового введення від 0,01 до 20мг активного начала на кг ваги тіла в залежності від форми представлення. Можуть мати місце конкретні випадки, в яких необхідними виявляються більш високі або більш низькі дози, і такі дози також становлять частину даного винаходу. Згідно із загальноприйнятою практикою доза, відповідна для кожного пацієнта, визначається лікарем у відповідності зі способом введення, масою і реакцією вказаного пацієнта. Відповідно до наступного з аспектів винахід також відноситься до способу лікування згаданих вище патологій, який включає введення ефективної дози сполуки згідно з винаходом, її солі приєднання фармацевтично прийнятної кислоти або сольвату або гідрату вказаної сполуки. 44
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;derivatives of piperidinyl- and piperazinyl-alkyl carbamates, process for preparation and therapeutic uses thereof
Автори англійськоюAbouabdellah Ahmed, Burnier Philippe, Hoornaert Christian, Jeunesse Jean, Puech Frederic
Назва патенту російськоюПроизводные пиперидинил- и пиперазинилалкилкарбаматов, способ их получения (варианты) и их применение в терапие
Автори російськоюАбуабделла Ахмед, Бюрнье Филипп, Хорнарт Кристиан, Женесс Жан, Пюек Фредерик
МПК / Мітки
МПК: C07D 401/14, C07D 211/26, C07D 417/04, A61P 35/00, C07D 491/048, C07D 495/04, C07D 413/04, C07D 471/04, A61P 25/00, A61P 9/00, C07D 295/13, C07D 213/38, A61P 37/00, C07D 491/04, A61P 31/00, C07D 401/04
Мітки: піперидиніл, спосіб, одержання, варіанти, терапії, піперазинілалкілкарбаматів, застосування, похідні
Код посилання
<a href="https://ua.patents.su/22-81808-pokhidni-piperidinil-i-piperazinilalkilkarbamativ-sposib-kh-oderzhannya-varianti-i-kh-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні піперидиніл- і піперазинілалкілкарбаматів, спосіб їх одержання (варіанти) і їх застосування в терапії</a>
Попередній патент: Фармацевтично корисні солі похідних карбонової кислоти
Наступний патент: Пристрій для виконання будівельних робіт
Випадковий патент: Пристрій для сортування виробів












