Спосіб одержання хлорапатитів
Номер патенту: 88806
Опубліковано: 25.11.2009
Автори: Тімухін Єгор Володимирович, Ковалевська Ірина Петрівна, Магунов Ігор Робертович, Тарасенко Світлана Олександрівна
Формула / Реферат
Спосіб одержання хлорапатитів загальної формули М10(PO4)6Сl2, де М=Са, Sr, Ва, Рb, що включає приготування шихти шляхом змішування сполук М, хлоровмісної сполуки і фосфоровмісної сполуки і їх взаємодії при підвищеній температурі та відокремлення цільового продукту, який відрізняється тим, що як сполуки М використовують МО або М(ОН)2, або МСО3, або їх суміш, як фосфоровмісну сполуку використовують NH4H2PO4 або (NH4)2HPO4, або МНPO4, як хлоровмісну сполуку використовують МСl2 або NH4Cl, які беруть в стехіометричних пропорціях, а процес здійснюють в розтопі еквімолярної суміші NaCl-KCl при температурі 680-750 °С і масовому співвідношенні шихти і суміші NaCl-KCl рівному 1:(0,05-1,0) і тривалості прокалювання 1,5-2 год.
Текст
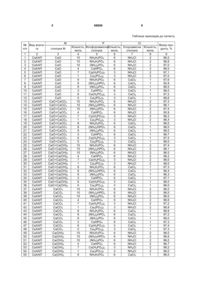
Спосіб одержання хлорапатитів загальної формули М10(PO4)6Сl2, де М=Са, Sr, Ва, Рb, що включає приготування шихти шляхом змішування сполук М, хлоровмісної сполуки і фосфоровмісної сполуки і їх взаємодії при підвищеній температурі та відокремлення цільового продукту, який відрізняється тим, що як сполуки М використовують МО або М(ОН)2, або МСО3, або їх суміш, як фосфоровмісну сполуку використовують NH4H2PO4 або (NH4)2HPO4, або МНPO4, як хлоровмісну сполуку використовують МСl2 або NH4Cl, які беруть в стехіометричних пропорціях, а процес здійснюють в розтопі еквімолярної суміші NaCl-KCl при температурі 680-750 °С і масовому співвідношенні шихти і суміші NaCl-KCl рівному 1:(0,05-1,0) і тривалості прокалювання 1,5-2 год. Винахід відноситься до матеріалознавства, а саме до одержання хлороапатитів загальної формули М10(РО4)6Сl2, де М - Са, Sr, Ва, Рb. Заявленим способом можна отримати хлороапатит кальцію (СаХАП) формули Са10(РO4)6Сl2, або хлороапатит стронцію (SrХАП) формули Sr10(РO4)6Сl2, або хлороапатит барію (ВаХАП) формули Ва10(РO4)6Сl2, або хлороапатит свинцю (РbХАП) формули Рb10(РO4)6Сl2. Відомий спосіб одержання фтороапатита (патент UA 72729), що включає приготування шихти шляхом змішування KРО3, CaO, CaF2 і СаСО3, термообробку шихти в розтопі евтектики NaCl KСI при температурі 680-700°С і масовому співвідношенні шихта:евтектика рівному 1:1 і відокремлення цільового продукту - фтороапатиту кальцію. Найближчим до заявленого способу є спосіб одержання хлороапатиту кальцію, який передбачає спікання при 1100-1300°С двозаміщеного фосфату кальцію, карбонату кальцію і хлориду кальцію (див. Константинова - Шлезингер М.А. Химия ламповых гетеродесмических люминофоров. М., «Наука», - 1970г., с.116). Даний спосіб обрано аналогом. Аналог і заявлений винахід мають такі спільні ознаки: - взаємодія кальцію з фосфорвмісною і хлорвмісною сполуками при підвищеній температурі; - відокремлення цільового продукту. Але, як вказує автор вищенаведеної книги, синтез хлороапатиту кальцію має труднощі, пов'язані з великою кількістю побічних реакцій, які можуть проходити при спіканні, гідролізі хлороапатитів з утворюванням гідроксоапатиту. Окрім того, процес проводять при досить високій температурі. Доречи, вказаним способом можна одержати тільки один представник хлороапатитів - хлороапатит кальцію. В основу винаходу, що заявляється, поставлено задачу розробити спосіб одержання хлороапатитів, в якому за рахунок якісної заміни компонентів шихти й умов проведення синтезу, забезпечити підвищення чистоти цільових продуктів, спрощення процесу та розширення асортименту отримуємих хлороапатитів. Поставлену задачу вирішено в способі одержання хлороапатитів загальної формули М10(РO4)6Сl2, де Μ = Са, Sr. Ba, Pb, що включає (19) UA (11) 88806 (13) C2 (21) a200712527 (22) 12.11.2007 (24) 25.11.2009 (46) 25.11.2009, Бюл.№ 22, 2009 р. (72) МАГУНОВ ІГОР РОБЕРТОВИЧ, ТАРАСЕНКО СВІТЛАНА ОЛЕКСАНДРІВНА, ТІМУХІН ЄГОР ВОЛОДИМИРОВИЧ, КОВАЛЕВСЬКА ІРИНА ПЕТРІВНА (73) ФІЗИКО-ХІМІЧНИЙ ІНСТИТУТ ІМ. О.В. БОГАТСЬКОГО НАЦІОНАЛЬНОЇ АКАДЕМІЇ НАУК УКРАЇНИ (56) UA 68775, A, 15.08.2004 UA 69746, C2, 15.09.2004 UA 72729, A, 15.03.2005 SU 1834836, A3, 15.08.1993 RU 2014846, C1, 30.06.1994 3 взаємодію сполук Μ з фосфорвмісною і хлорвмісною сполуками при підвищеній температурі та відокремлення цільового продукту, який відрізняється тим, до. як сполуки Μ використовують МО або М(ОН)2 або МСО3 або MCl2, як фоcфорвмісну сполуку використовують NH4H2PO4 або Н3РО4 або МНРО4, як хлорвмісну сполуку використовують МСI2 або NH4Cl, які беруть в стехіометричних співвідношеннях, а процес здійснюють в розтопі еквімолярної суміші NaCl-KCl при температурі 680750°С, і масовому співвідношенні шихти та розтопу NaCl-KСI рівному 1:(0,05-1,0). Новим у винаході, що заявляється, є: - інший склад шихти; - умови проведення синтезу, - в еквімолярній суміші NaCl-KCl, при 680-750°С, і співвідношенні суміші фосфоровмісної і хлорвмісної сполук та розтопі NaCl-KCl рівному 1:(0,05-1,0). Причинно-наслідковий зв'язок між сукупністю заявлених ознак та досягнутих результатом можна пояснити наступним. На утворення апатитів (аналог) з двозаміщеного фосфату кальцію, карбонату кальцію і хлориду кальцію необхідна температура спікання 11001300°С, а в заявленому способі використовується більш розширений обсяг реагентів, синтез проходить в розтопі NaCl-KCl, який утворюється при нагріванні суміші, отриманої після змішування шихти із приготовленою раніше еквімолярною сумішшю NaCl-KCl при значно нижчий температурі (680-750°С). При цій температурі утворюється розтоп СаСI2 (або ВаСI2, або SrCl2, або РbСI2) з NaClKCl, що знижує температуру топлення суміші, та має велику дифузійну рухливість і реакційну здатність, що збільшує швидкість реакції утворення відповідного хлороапатиту (Са, Sr, Ba, Pb). Реакція одержання хлороапатиту проходить швидко (1-2год.), через то, що проходить у розтопі солей, який інтенсифікує дифузійні процеси. Крім того, механізм взаємодії розтопу та шихти пов'язаний із застосуванням складу розтопу системи NaCl-KCl. Зміна складу проходить через витяг з розтопу МСI2, необхідного для побудови структури відповідного хлороапатиту. Схема одержання заявлених хлороапатитів може бути представлена наступним чином: 3СаО+6СаНРO4+СаСl2 ¾ t Са10(PO4)6Сl2+3Н2O↑ ¾® 3Са(ОН)2+6СаНPO4+СаСl2 ¾ t Са10(PO4)6Сl2+ ¾® +6H2O↑ 3СаСО3+6СаНPO4+СаСl2 ¾ t Са10(PO4)6Сl2+ ¾® +3H2O↑+3СO2↑ 8СаО+СаСО3+6NH4H2PO4+ +СаСl2 ¾ t Са10(PO4)6Сl2+6NH3↑+9H2O↑+СO2↑ ¾® СаО+2NH4Cl ¾ t СаСl2+2NH3↑+H2O↑ ¾® 9РbО+6NH4H2PO4+РbСl2 ¾ t Рb10(РO4)6Сl2+ ¾® +6NH3↑+9H2O↑ PbO+2NH4Cl ¾ t РbСl2+2NH3↑+H2O↑ ¾® 88806 4 10SrCO3+6NH4H2PO4+2NH4Cl ¾ t Sr10(РO4)6Сl2+8 ¾® NH3↑+10H2O↑+10СO2↑ SrСО3+2NH4Cl ¾ t SrCl2+2NH3↑+H2O↑+СO2↑ ¾® 9ВаСО3+6NH4H2PO4+2NH4Cl+Ва(ОН)2 ¾ t Ва ¾® 10(РO4)6Сl2+8NH3↑+11Н2O↑+9СO2↑ Ва(ОН)2+2NH4Cl ¾ t ВаСl2+2NH3↑+H2O↑ ¾® Тривалість прокалювання 1,5-2год.; температура - 680-750°С, співвідношення шихта:розтоп =1:(0,05-1,0). Масове співвідношення в шихті відповідає необхідності повного проходження реакції й одержання стехіометричного відповідного хлороапатиту. Масове співвідношення шихти й еквімолярної суміші NaCl-KCl підібрано експериментальним шляхом. При кількості суміші NaCl-KCl менш ніж 5мас.% від кількості шихти за даних умов одержуємо не чистий за фазовим складом хлороапатит через те, що не вся шихта змочується розтопом NaCl-KCl. При кількості суміші NaCl-KCl більш ніж 100мас.% від кількості шихти відбувається невиправдана витрата еквімолярної суміші NaCl-KCl та збільшення вартості процесу. Проведення процесу при температурі нижче 680°С, наприклад, 650°С різко сповільнює швидкість одержання хлороапатита через те, що не утворюється розтоп NaCl-KCl й швидкість синтезу лімітується дифузійними процесами в суміші шихти й еквімолярної суміші. Збільшення температури вище 750°С невиправдано через перевитрату енергії проведення процесу й незмінності позитивного ефекту одержання відповідного хлороапатита. Приклад 1. Для одержання 50г хлороапатиту кальцію як вихідні реагенти взяті порошкоподібні СаО (41,07г),NH4H2PO4(8,51г) і NH4Cl (4,34г). Отриману шихту змішували з рівним за вагою (58,2г) кількістю суміші NaCl-KCl (1:1), яка була попередньо прожарена при 750°С, загартована й перетерта в агатовій ступці. Суміш шихти й NaCl-KCl ретельно перетирали в порцеляновій ступці й прожарювали при температурі 700°С протягом 2год. на повітрі. Після охолодження отриманий спік витягали з тиглю, розтирали в ступці й відмивали дистильованою водою до негативної реакції на хлор-іон (перевірка проводилася за допомогою розчину AgNO3). Після відмивання продукт висушували при 100-120°С. РФА підтверджує наявність однофазного продукту - СаХАП. Одержали 48г білого кристалічного порошку. Вихід продукту склав 96%. Приклади 2-82 ілюструють одержання відповідних галогеноапатитів аналогічно прикладу 1. Дані наведені в таблиці. 5 88806 6 Таблиця прикладів до патенту № Вид апатип/п ту 1 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 2 СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП М сполука М 3 СаО СаО СаО СаО СаО СаО СаО СаО СаО СаО СаО СаО СаО+СаСО3 СаО+СаСО3 СаО+СаСО3 СаО+СаСО3 СаО+СаСО3 СаО+СаСО3 СаО+СаСО3 СаО+СаСО3 СаО+СаСО3 СаО+СаСО3 СаО+СаСО3 СаО+СаСО3 СаО+Са(ОН)2 СаО+Са(ОН)2 СаО+Са(ОН)2 СаО+Са(ОН)2 СаО+Са(ОН)2 CaO+Ca(OH)2 CaO+Ca(OH)2 СаО+Са(ОН)2 СаО+Са(ОН)2 СаО+Са(ОН)2 СаО+Са(ОН)2 СаО+Са(ОН)2 СаСО3 СаСО3 СаСО3 СаСО3 СаСО3 СаСО3 СаСО3 СаСО3 СаСО3 СаСО3 СаСО3 СаСО3 Са(ОН)2 Са(ОН)2 Са(ОН)2 Са(ОН)2 Са(ОН)2 Са(ОН)2 Са(ОН)2 Р Сl Вихід проКількість, ФосфоровміснаКількість, Хлоровмісна Кількість, дукту, % моль сполука моль сполука моль 4 5 6 7 8 9 10 NH4H2PO4 6 NH4Cl 2 96,0 10 NH4H2PO4 6 NH4Cl 2 96,6 10 (NH4)3PO4 6 NH4Cl 2 97,0 4 CaHPO4 6 NH4Cl 2 96,0 7 Ca(H2PO4)2 3 NH4Cl 2 97,1 1 Са3(РO4)2 3 NH4Cl 2 97,0 9 NН4Н2РO4 6 CaCl2 1 97,6 9 (NH4)2HPO4 6 CaCl2 1 95,9 9 (NH4)3PO4 6 CaCl2 1 96,0 3 CaHPO4 6 CaCl2 1 96,0 6 Са(Н2РO4)2 3 CaCl2 1 97,2 0 Са3(РO4)2 3 CaCl2 1 96,6 10 NH4H2PO4 6 NH4Cl 2 97,3 10 (NH4)2HPO4 6 NH4Cl 2 98,1 10 (NH4)3PO4 6 NH4Cl 2 97,4 4 СаНPO4 6 NH4Cl 2 95,9 7 Са(Н2PO4)2 3 NH4Cl 2 96,2 1 Са3(PO4)2 3 NH4Cl 2 96,4 9 NH4H2PO4 6 CaCl2 1 96,0 9 (NH4)2HPO4 6 CaCl2 1 96,0 9 (NH4)3PO4 6 CaCl2 1 96,0 3 СаНPO4 6 CaCl2 1 96,7 6 Са(Н2PO4)2 3 CaCl2 1 97,5 0 Са3(PO4)2 3 CaCl2 1 96,0 10 NH4H2PO4 6 NH4Cl 2 97,4 10 (NH4)2HPO4 6 NH4Cl 2 98,1 10 (NН4)3PO4 6 NH4Cl 2 96.0 4 СаНPO4 6 NH4Cl 2 98,2 7 Ca(H2PO4)2 3 NH4Cl 2 96,0 1 Са3(PO4)2 3 NH4Cl 2 96,0 9 NH4H2PO4 6 СаСl2 1 97,3 9 (NH4)2HPO4 6 СаСl2 1 96,4 9 (NH4)3PO4 6 СаСl2 1 96,3 3 CaHPO4 6 СаСl2 1 97,1 6 Са(Н2PO4)2 3 СаСl2 1 96,0 0 Са3(PO4)2 3 СаСl2 1 96,0 10 NH4H2PO4 6 NH4Cl 2 96,0 10 (NH4)2HPO4 6 NH4Cl 2 96,0 10 (NH4)3PO4 6 NH4Cl 2 96,0 4 CaHPO4 6 NH4Cl 2 96,6 7 Са(Н2PO4)2 3 NH4Cl 2 97,2 1 Са3(PO4)2 3 NH4Cl 2 96,8 9 NH4H2PO4 6 СаСl2 1 96,8 9 (NH4)2HPO4 6 СаСl2 1 97,2 9 (NH4)3PO4 6 СаСl2 1 96,0 3 CaHPO4 6 СаСl2 1 97,3 6 Ca(H2PO4)2 3 СаСl2 1 97,4 0 Са3(PO4)2 3 СаСl2 1 97,3 10 NH4H2PO4 6 NH4Cl 2 96,0 10 (NH4)2HPO4 6 NH4Cl 2 96,6 10 (NH4)3PO4 6 NH4Cl 2 96,0 4 CaHPO4 6 NH4Cl 2 96,7 7 Са(Н2PO4)2 3 NH4Cl 2 98,2 1 Са3(PO4)2 3 NH4Cl 2 96,0 9 NH4H2PO4 6 СаСl2 1 96,0 7 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП СаХАП SrХАП SrХАП SrХАП SrХАП ВаХАП ВаХАП ВаХАП ВаХАП РbХАП РbХАП РbХАП РbХАП Са(ОН)2 Са(ОН)2 Са(ОН)2 Са(ОН)2 Са(ОН)2 СаСО3+Са(ОН)2 СаСО3+Са(ОН)2 СаСО3+Са(ОН)2 СаСО3+Са(ОН)2 СаСО3+Са(ОН)2 СаСО3+Са(ОН)2 СаСО3+Са(ОН)2 СаСО3+Са(ОН)2 СаСО3+Са(ОН)2 СаСО3+Са(ОН)2 СаСО3+Са(ОН)2 СаСО3+Са(ОН)2 SrO SrO SrСО3 SrСО3 ВаО ВаО ВаСО3 ВаСО3 РbО РbО РbСО3 РbСО3 Комп’ютерна верстка Т. Чепелева 88806 9 9 3 6 0 10 10 10 4 7 1 9 9 9 3 6 0 10 9 10 9 10 9 10 9 10 9 10 9 (NH4)2HPO4 (NH4)3PO4 CaHPO4 Ca(H2PO4)2 Са3(РO4)2 NH4H2PO4 (NH4)2HPO4 (NH4)3PO4 СаНPO4 Са(Н2PO4)2 Са3(PO4)2 NH4H2PO4 (NH4)2HPO4 (NH4)3PO4 СаНPO4 Са(Н2PO4)2 Са3(PO4)2 NH4H2PO4 NH4H2PO4 NH4H2PO4 NH4H2PO4 NH4H2PO4 NH4H2PO4 NH4H2PO4 NH4H2PO4 NH4H2PO4 NH4H2PO4 NH4H2PO4 NH4H2PO4 8 6 6 6 3 3 6 6 6 6 3 3 6 6 6 6 3 3 6 6 6 6 6 6 6 6 6 6 6 6 Підписне СаСl2 СаСl2 СаСl2 СаСl2 СаСl2 NH4Cl NH4Cl NH4Cl NH4Cl NH4Cl NH4Cl СаСl2 СаСl2 СаСl2 СаСl2 СаСl2 СаСl2 NH4Cl SrCl2 NH4Cl SrCl2 NH4Cl BaCl2 NH4Cl BaCl2 NH4Cl PbCl2 NH4Cl PbCl2 1 1 1 1 1 2 2 2 2 2 2 1 1 1 1 1 1 2 1 2 1 2 1 2 1 2 1 2 1 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 96,3 96,4 96,0 96,0 96,8 97,2 96,0 97,6 96,0 98,1 97,6 96,0 96,2 95,5 97,1 96,0 96,6 97,2 97,4 97,5 96,0 96,0 96,4 96,0 96,8 94,4 95,3 94,6 95,0
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of chlorapatites
Автори англійськоюMahunov Ihor Robertovych, Tarasenko Svitlana Oleksandrivna, Timukhin Yehor Volodymyrovych, Kovalevska Iryna Petrivna
Назва патенту російськоюСпособ получения хлорапатитов
Автори російськоюМагунов Игорь Робертович, Тарасенко Светлана Александровна, Тимухин Егор Владимирович, Ковалевская Ирина Петровна
МПК / Мітки
МПК: C01B 25/00, C04B 35/22, C04B 35/00
Мітки: одержання, спосіб, хлорапатитів
Код посилання
<a href="https://ua.patents.su/4-88806-sposib-oderzhannya-khlorapatitiv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання хлорапатитів</a>
Попередній патент: Безперервний дротовий стан
Наступний патент: Спосіб очищення олії
Випадковий патент: Дифузійний апарат нахиленого типу