Спосіб одержання модифікованого со-вмісного перовськітного каталізатора для процесу селективного перетворення метану в вищі вуглеводні
Номер патенту: 9966
Опубліковано: 17.10.2005
Автори: Дзязько Олександр Григорович, Пятницький Юрій Ігорович, Неділько Сергій Андрійович, Бостан Анатолій Іванович
Формула / Реферат
1. Спосіб одержання модифікованого Со-вмісного перовськітного каталізатора для процесу селективного перетворення метану в вищі вуглеводні, який відрізняється тим, що каталізатор одержують за золь-гельною технологією випарюванням водно-аміачних розчинів нітратів Sr, Co з додаванням цитрату амонію для утворення гелю та Li2СО3 до вихідного водно-аміачного розчину; та/або спільним розкладанням оксидів в інтервалі температур від 943 до 1068К, при цьому каталізатор має селективність у вищі вуглеводні, що дорівнює від 70 до 100 %.
2. Спосіб одержання каталізатора за п. 1, який відрізняється тим, що одержаний каталізатор не є модифікованим, при цьому має максимальну селективність в вуглеводні С2+, що дорівнює 91,7 % при Т = 973К.
3. Спосіб одержання каталізатора за п. 1, який відрізняється тим, що одержаний каталізатор не є модифікованим, при цьому має максимальну селективність в вуглеводні C2+, що дорівнює 84,9 % при Т = 973К.
4. Спосіб одержання каталізатора за п. 1, який відрізняється тим, що літій частково заміщує стронцій.
5. Спосіб одержання каталізатора за п. 4, який відрізняється тим, що одержаний каталізатор має максимальну селективність в вуглеводні С2+, що дорівнює 95,9 % при Т = 973К.
6. Спосіб одержання каталізатора за п. 1, який відрізняється тим, що замість перехідного металу кобальту в одержаному каталізаторі може знаходиться марганець.
7. Спосіб одержання каталізатора за п. 6, який відрізняється тим, що одержаний каталізатор має максимальну селективність в вуглеводні С2+, що дорівнює 76,9 % при Т = 1023К.
8. Спосіб одержання каталізатора за п. 1, який відрізняється тим, що замість перехідного металу кобальту в одержаному каталізаторі знаходиться нікель.
9. Спосіб одержання каталізатора за п. 8, який відрізняється тим, що одержаний каталізатор має максимальну селективність в вуглеводні С2+, що дорівнює 99,7 % при Т = 973К.
10. Спосіб одержання каталізатора за п. 1, який відрізняється тим, що каталізатор одержують спільним розкладанням оксидів після випарювання водних розчинів ацетатів та нітратів металів в газовій атмосфері при 873К для одержання змішаних оксидів перовськітної структури.
11. Спосіб одержання каталізатора за п. 10, який відрізняється тим, що як атмосфера може бути повітря, газоподібний аргон або азот.
Текст
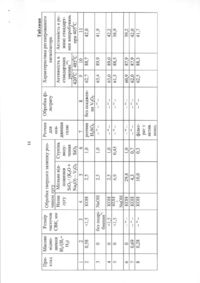
1. Спосіб одержання модифікованого Совмісного перовськітного каталізатора для процесу селективного перетворення метану в вищі вуглеводні, який відрізняється тим, що каталізатор одержують за золь-гельною технологією випарюванням водно-аміачних розчинів нітратів Sr, Co з додаванням цитрату амонію для утворення гелю та U2CO3 до вихідного водно-аміачного розчину; та/або спільним розкладанням оксидів в інтервалі температур від 943 до 1068К, при цьому каталізатор має селективність у вищі вуглеводні, що дорівнює від 70 до 100 %. 2. Спосіб одержання каталізатора за п. 1, який відрізняється тим, що одержаний каталізатор не є модифікованим, при цьому має максимальну селективність в вуглеводні Сг+, що дорівнює 91,7% при Т = 973К. 3. Спосіб одержання каталізатора за п. 1, який відрізняється тим, що одержаний каталізатор не є модифікованим, при цьому має максимальну селективність в вуглеводні Сг+, що дорівнює 84,9 % при Т = 973К. 4. Спосіб одержання каталізатора за п. 1, який відрізняється тим, що літій частково заміщує стронцій. 5. Спосіб одержання каталізатора за п. 4, який відрізняється тим, що одержаний каталізатор має максимальну селективність в вуглеводні Сг+, що дорівнює 95,9 % при Т = 973К. 6. Спосіб одержання каталізатора за п. 1, який відрізняється тим, що замість перехідного металу кобальту в одержаному каталізаторі може знаходиться марганець. 7. Спосіб одержання каталізатора за п. 6, який відрізняється тим, що одержаний каталізатор має максимальну селективність в вуглеводні Сг+, що дорівнює 76,9 % при Т = 1023К. 8. Спосіб одержання каталізатора за п. 1, який відрізняється тим, що замість перехідного металу кобальту в одержаному каталізаторі знаходиться нікель. 9. Спосіб одержання каталізатора за п. 8, який відрізняється тим, що одержаний каталізатор має максимальну селективність в вуглеводні Сг+, що дорівнює 99,7 % при Т = 973К. 10. Спосіб одержання каталізатора за п. 1, який відрізняється тим, що каталізатор одержують спільним розкладанням оксидів після випарювання водних розчинів ацетатів та нітратів металів в газовій атмосфері при 873К для одержання змішаних оксидів перовськітної структури. 11. Спосіб одержання каталізатора за п. 10, який відрізняється тим, що як атмосфера може бути повітря, газоподібний аргон або азот. Корисна модель відноситься до способу одержання каталізаторів перовськітної структури, які можуть бути застосовані у процесі окислювального сполучення метану (ОСМ) у вищі вуглеводні. Одним з найважливіших властивостей каталізаторів є його вибірковість (селективність), використовуване для керування ходом складних реакцій і напрямку їх убік утворення потрібного продукту [1]. Переважна більшість досліджень процесу ОСМ виконані в стаціонарному режимі з застосуванням каталізаторів на основі оксидів металів (простих і складних) як масивних, нанесених на різні носії [2-5], так і модифікованих катіонами лужних і лужноземельних металів [6-9]. Найбільшу селективність по Сг-вуглеводням (93%) при Т=700°С виявив оксид Sm 2 O 3 [3]. Процес ОСМ у нестаціонарних умовах (періодичний режим), при якому реагенти метан і ки CD О) О) о> 9966 сень реагують з оксидним каталізатором поперемінно, вивчений значно менше, хоча він є більш перспективним і ефективним способом перетворення метану в цінні продукти. Перше повідомлення про реакції окислювальної конденсації метану (ОКМ) з'явилося в 1980 році; фірмою «Ексон» був взятий патент на спосіб окислювальної конденсації метану з переважним утворенням етилену. Як каталізатори-реагенти використовували тверді оксиди з нанесеними на них благородними металами [10]. Подальші експерименти по вивченню реакції ОСМ у періодичному режимі також були проведені, головним чином на оксидних каталізаторах [11-15]. Найбільша селективність по вищих вуглеводнях була характерна для каталізаторів: MnOx/SiO2, модифікованого Na (1.7 ваг. %) 88% (Т=800°С) [14] і оксидних марганцевих каталізаторів 90% [15]. Перовськіти загальної формули АВОз, де А іон рідкоземельного або лужноземельного металу, В - іон перехідного металу належать до складних оксидних систем, що мають велику ємність по кисню. Причому вони здатні віддавати відносно великі кількості його без руйнування кристалічної структури, що важливо для каталізаторів, які використовуються в періодичному режимі. В даний час реакція ОСМ на перовськітах у нестаціонарних умовах вивчена дуже незначно. Відомо усього кілька робіт японських авторів [16, 17] в цій області. В той час, як у стаціонарних умовах даний процес досліджений більш докладно [18-28]. В роботах [29-31] проведене систематичне дослідження перовськітів АВОз, де А - Sr, Ba, La; В Co, Mn, Ni, а також вивчені системи з частковим заміщенням А и В на лужні метали в відсутності кисню в газовій фазі. Встановлено, що часткове заміщення стронцію в Со- і Mn-вмісних перовськітах на іони лужних металів призводить до збільшення питомої каталітичної активності і селективності у відношенні утворення вищих вуглеводнів. В таблиці приведені значення селективностей по вищих вуглеводнях, отримані в результаті проведення реакції ОСМ у періодичному режимі (Т=973-1048К). Проведено зіставлення каталізаторів перовськітної структури із Со-вмісним перовськітом, модифікованим літієм (приклад №1). З таблиці видно, що запропонований нами перовськітний каталізатор (приклад №1) має 100% селективність по вищих вуглеводнях в інтервалі температур 973-1048К. Важливо відзначити, що приведені значення селективності по цінних продуктах характерні як для відновлювального, так і для окислювального імпульсів. SrCoo,7sLio,2503-x перовськіт стабільний в роботі протягом 10-12 годин. Практично всі приведені в таблиці перовськіти синтезовані за зольгельної технології розпарюванням водно-аміачних розчинів нітратів відповідних солей з додаванням цитрату амонію для утворення гелю. Контроль фазового складу зразків здійснювали рентгенофазовим аналізом. Таблиця Селективність перовськітів загальної формули АВОз, де А = Sr; В = Mn, Co,Ni (WCH4=WHE=W O 2=20004 Приклади №№ 1 1 2 3 4 5 6 7 , приклади №№1-6) Каталізатор S yfl ., м2/г 2 3 1.48 1.42 1.275 1.76 1.41 SrCOo,75Lio,2503-x ЭгСоо.эСз-х S r C o O 2 5-х Sro 75І-І0,25СоО2 5-х SrMno,75L"lo,2503-x SrNi 0 ,75Lio.250 3 -x БгСоо.вІ-іо.гОз-х Немодифіковані аналоги (приклади №№2, 3) уступають за значеннями селективностей, причому із зростанням температури спостерігається зниження цієї характеристики процесу. Важливо відзначити, що ЭгСоо.эОз-х (приклад №2) з дефіцитом кобальту більш селективний, ніж без нього (приклад №3). Це зв'язано з тим, що в перовськіті SrCo2,5-x (за даними РФА) знаходиться домішкована фаза СозО,*, активна в реакціях повного окислювання. З огляду на той факт, що селективність процесу може бути підвищена такою зміною складу каталізатора, що зменшує кількість центрів каталізатора, відповідальних за горіння метану, нами був синтезований зразок SrCoo,75Lio,2503-x, що і підтвердив наше припущення про підвищення селектив Селективність по Сг+вуглеводням,% /Т, К 4 100/973, 100/1023, 100/1048 91.7/973,76.3/1023 84.9/973,68.9/1023 95.9/973, 90.9/1023, 82.3/1048 76.1/973,76.9/1023, 71.4/1048 99.7/973,98.7/1023 98.2/1023 ності по вищим вуглеводням в ході експерименту. Зразок Sro,75Lio,25Co02,5-x 5-х (приклад №4) близький по стехіометричному складу обраному нами перовськітному каталізаторові (приклад №1). Відмінність полягає в тому, що Sr, який знаходиться в положенні А перовськітної структури АВОз, частково заміщений на літій (приклад №4), тоді як у SrCoo,75Lio,2503-x перехідний метал Co, що знаходиться в положенні В перовськіта АВОз, заміщений цим лужним металом. З таблиці видно, що модифікований перовськітний каталізатор (приклад №4) більш селективний, ніж вихідні зразки (приклади №№2, 3), що і підтверджує висновки, зроблені в роботі [29]. Зростання температури призведе до того, що селективність по вищих вуглеводнях (зразок Sr0,75Li0,25Co2,5-x) 9966 падає з 95.9% при Т=973К до 82.3% (Т=1048К), що уступає обраному нами зразкові (приклад №1). Каталізатор SrNio,75Lio,2s03-x максимально наближається по селективності до зразка SrCo0,75Lio,2503-x (99.7 і 98.7% при Т=973, і 1023К, відповідно). Але слід зазначити, що Ni-вмісні перовськіти, включаючи розглянутий зразок, в ході каталізу поводиться вкрай нестабільно [31]. З ростом температури їхня активність падає, що зв'язано з утворенням фази Ni (дані РФА). Для SrCoo,75Li'o,2503-x спостерігається зворотна картина: підвищення активності з ростом температури при збереженні 100% селективності по вуглеводнях і стабільності роботи протягом 10-12 годин. Для SrCoo,8Lio,203-x -перовськіта [16], що практично ідентичний по стехіометричному складу з обраним нами зразком значення селективності по вищих вуглеводнях при 1023К складають 98.2%, що уступає 100% селективності, характерної для перовськіта SrCoo,75Lio,2503-x при цій же температурі (таблиця). Порівняльна характеристика перовськіта SrCoo,75Lio,2503-x із приведеними в таблиці каталізаторами (аналогами - приклади №№2-4) показала, що жоден з порівнюваних зразків не має 100% селективність по вищих вуглеводнях. Більш того, для приведених каталізаторів характерне падіння селективності по Сг+-вуглеводням із зростанням температури. Таким чином, синтезований нами зразок SrCoo,75Lio,2503-x, в якому перехідний метал, що знаходиться в положенні В перовськітної структури АВОз, частково заміщений літієм виявився високоселективним (Sc2+=100%) каталізатором процесу ОСМ в інтервалі температур 973-1048К і стабільним в роботі протягом 10-12 годин, що робить його досить привабливим для комерційного використання. Корисна модель ілюструється наступними прикладами: Приклад №1 Каталізатор готували за зольгельної технології розпарюванням водно-аміачних розчинів нітратів Sr, Co з додаванням цитрату амонію для утворення гелю. Докладна методика готування каталізатора полягала в наступному. Для синтезу перовськітів на основі SrCoO3 використовували водні розчини Sr(NO)3, Co(NO3)2 6(H2O), NaHCO3 (стандарт-титр), К2С2О4 (стандарт-титр), цитрату амонію, а також розчиненого в оцтовій кислоті І_іг(СОз). Концентрацію літію визначали гравиметрично у виді U2SO4 [32]. Розчини зазначених солей металів змішували в необхідних співвідношеннях, додавали для утворення гелю цитрат амонію (одну масову частину в розрахунку на 2, 3 масові частини одержуваної речовини) і упарювали на пісковій лазні до повного розкладання нітратів. Розпарювання закінчувалося самозайманням шихти. Отриманий матеріал перетирали в агатовій ступці і прожарювали в порцеляновому тиглі при 873К протягом 3 годин для випалювання вуглецю й органічних залишків. Потім шихту знову перетирали і проводили остаточне прокалювання при 1123К протягом 10 годин. Приклад №2 Каталізатор готували за методикою аналогічній прикладові №1, але без додавання в розчин солей І_і2(СОз). Приклад №3 Каталізатор готували за методикою аналогічній прикладові №1, але без додавання в розчин солей ЩСОз). Приклад №4 Каталізатор готували за методикою аналогічній прикладові №1. Відмінності полягали в співвідношенні компонентів розчинів солей для одержання зразка потрібного стехіометричного складу. Приклад №5 Каталізатор готували за методикою аналогічній прикладові №1. Тільки замість водного розчину Co(NO3)2 6(H2O) використовували розчин Mn(NO3)2 6(H2O). Приклад №6 Каталізатор готували за методикою аналогічній прикладові №1. Тільки замість водного розчину Со(ІЧОз)2 6(Н2О) використовували розчин Mn(NO 3 ) 2 6(H 2 O). Приклад №7 Каталізатор був приготовлений спільним розкладанням оксидів. Після випарювання водних розчинів, що включають в себе ацетати і нітрати металів, суміші солей піддалися розкладанню в атмосфері повітря при 873К для одержання змішаних оксидів перовськітної структури. Джерела інформації: 1. Ройтер В.А., Голодец Г И . Введение в теорию кинетики и катализа. - Киев: Наукова думка. 1971.-184 с. 2. Baems М, Hinsen W. // (DE) №3237079. 12.04.84. 3. Otsuka К. et al. //J.Catal. - 1986. - V.100, No.2. - P.353-359. 4. Piao H., Bi Y., Zhen K. //Cuihua xuebao = J.Catal. - 1996. - V.17, No.3. - P.217-221. 5. Xanthopoulou G. //Appl.Catal. A. - 1998. V.185, No. 2.-L. 185-192. 6. Otsuka K. et al. //Chem.Lett. - 1986, No.4. P.467-468. 7. Миначев Х.М. и др. //Изв.АН СССР.Сер.хим. -1987, №9.-С.2124-2126. 8. Deboy J.M., Hickst R.F. //J.Chem.Soc.Chem.Commun. - 1988, No.14. P.982-984. 9. Tiwari K. et al. //J.Chem.Technol. and Biotechnol. - 1995. - V.63, No.2. - P. 190-194. 10. Mitchell H.L, Waghome R.H. // (US). №4205194.-27.05.80. 11. Leonard J.J. et al. // (GB). №2156842. 16.10.84. 12. Johnson M.F. // (US). №4547608. -15.10.85. 13. Sofranko J.A. // (US). №4517398. -14.05.85. 14. Sofranko J.A., Leonard J.J., Jones C.A. //J.Catal. -1987. - V.103, No.2. - P.311-319. 15. Усачев Н.Я. и др. //Нефтехимия. - 1998. Т.38, №6. - с.468-480. 16. Omata К. et al. //J.Chem.Soc.Chem.Commun. - 1994, No.14. P.1647-1648. 17. Tagawa Т., Imai H. //J.Chem.Soc. Faraday Trans. Pt.1 - 1988. - V.84, No.4. - P.923-929. 9966 18. Braxdil J. et al. // (US). №4822944. 18.04.1989. 19. Siriwardane R.V., Shamsi A. //Appl.Catal. A: General. - 1990. - V.60, No.1. - P.119-136. 20. Campbell K.D. // (US). №5026945 - 25.06.91. 21. Barrault J and Grosset С //Appl.Catal. A: General. - 1992. - V.88, No.1. - P.197-211. 22. Dissanayake D. et al. //J.Catal. - 1993. V.139, No.2. - P.652-663. 23. Yamamura M. et al. //Appl.Catal. A: General. - 1994. - V.115, No.1-2. - P.269-283. 24. Elshof J. E. et al. //Appl. Catal. A: General 1995 - V.130, No.2. - P.195-212. 25. Lin Y.S., Zeng Y. //J.Catal. - 1996. - V.164, No.L-P.220-231. 26. Srmivasan С et al. //Indian J.Chem.Sect.A.: Комп'ютерна верстка А. Крулевський 8 Inorg., Bio-inorg., Phys., Theor.Anal.Chem. - 1997. V.36, No.11.-P.926-930. 27. Tsiarakas P. et al. //Appl.Catal. A: General. 1998. - V.169, No.2. - P.249-261. 28. Spinicci R. et al. // Journal of Molecular Catalysis A: Chemical V. 176, No. 1-2, 2001, P. 253265. 29. Ильченко Н.И. и др. //ТЭХ. - 2000, Т.36. №1.-С.47-52. 30. Бостан А.И. и др. // ТЭХ. 2005. Т.41. №1. С.30-34. 31. Пятницкий Ю.И. и др. // ТЭХ. 2005. (в печати). 32. Шарло Г. Методы аналитической химии.. М.: Химия. -1969. -с.1206. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП "Український інститут промислової власності", вул. Глазунова, 1, м. Київ - 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for the preparation of modified со-containing perovskite catalyst for the process of selective transformation of methane in higher hydrocarbons
Автори англійськоюNedilko Serhii Andriiovych
Назва патенту російськоюСпособ получения модифицированного со-содержащего перовскитного катализатора для процесса селективного превращения метана в высшие углеводороды
Автори російськоюНедилько Сергей Андреевич
МПК / Мітки
МПК: B01J 37/03, B01J 37/08
Мітки: вищі, модифікованого, процесу, перетворення, вуглеводні, перовськітного, спосіб, каталізатора, одержання, метану, селективного, со-вмісного
Код посилання
<a href="https://ua.patents.su/4-9966-sposib-oderzhannya-modifikovanogo-so-vmisnogo-perovskitnogo-katalizatora-dlya-procesu-selektivnogo-peretvorennya-metanu-v-vishhi-vuglevodni.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання модифікованого со-вмісного перовськітного каталізатора для процесу селективного перетворення метану в вищі вуглеводні</a>
Попередній патент: Ресивер
Наступний патент: Пристрій для пневмомасажу
Випадковий патент: Закупорювальний пристрій для пляшки