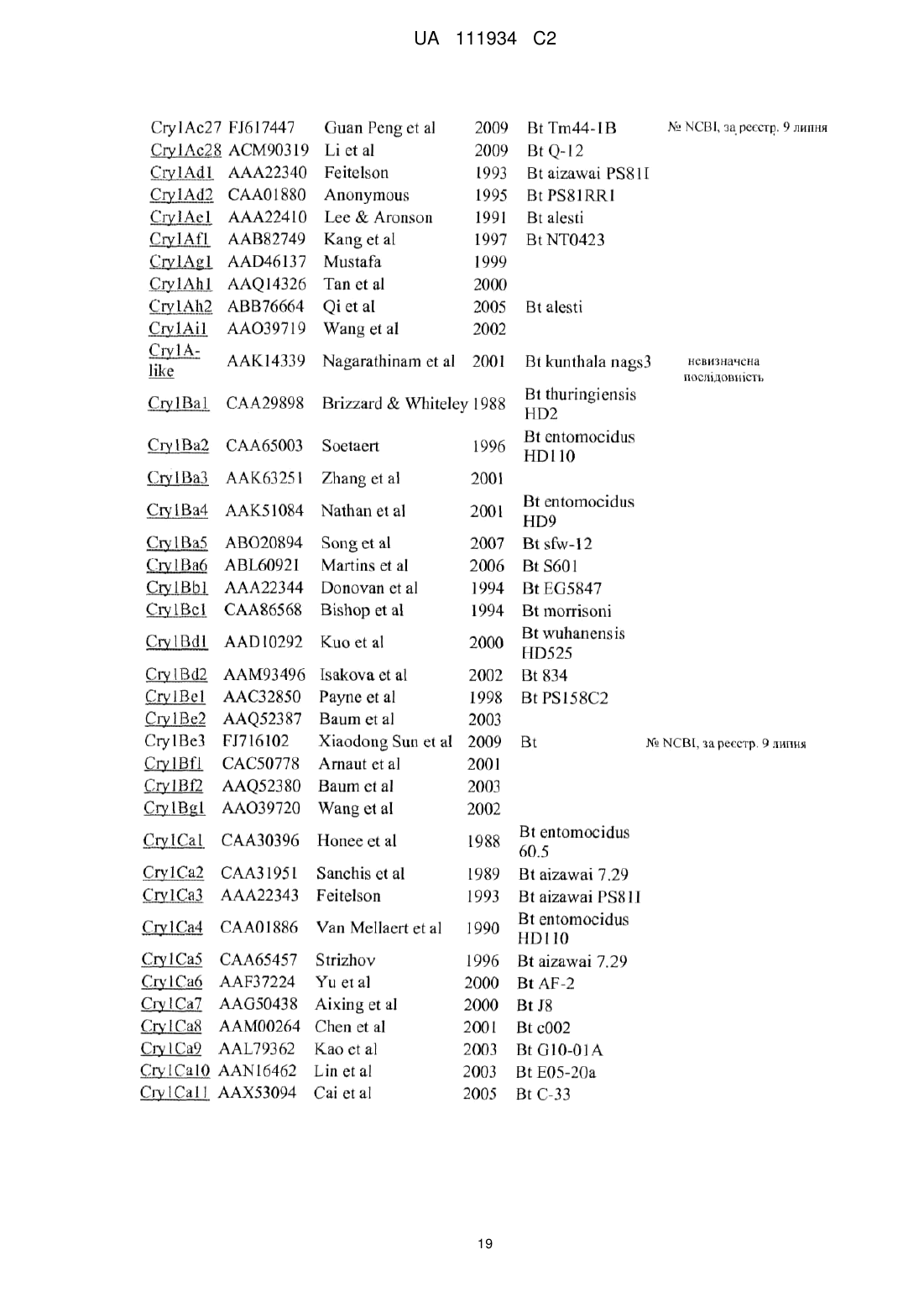
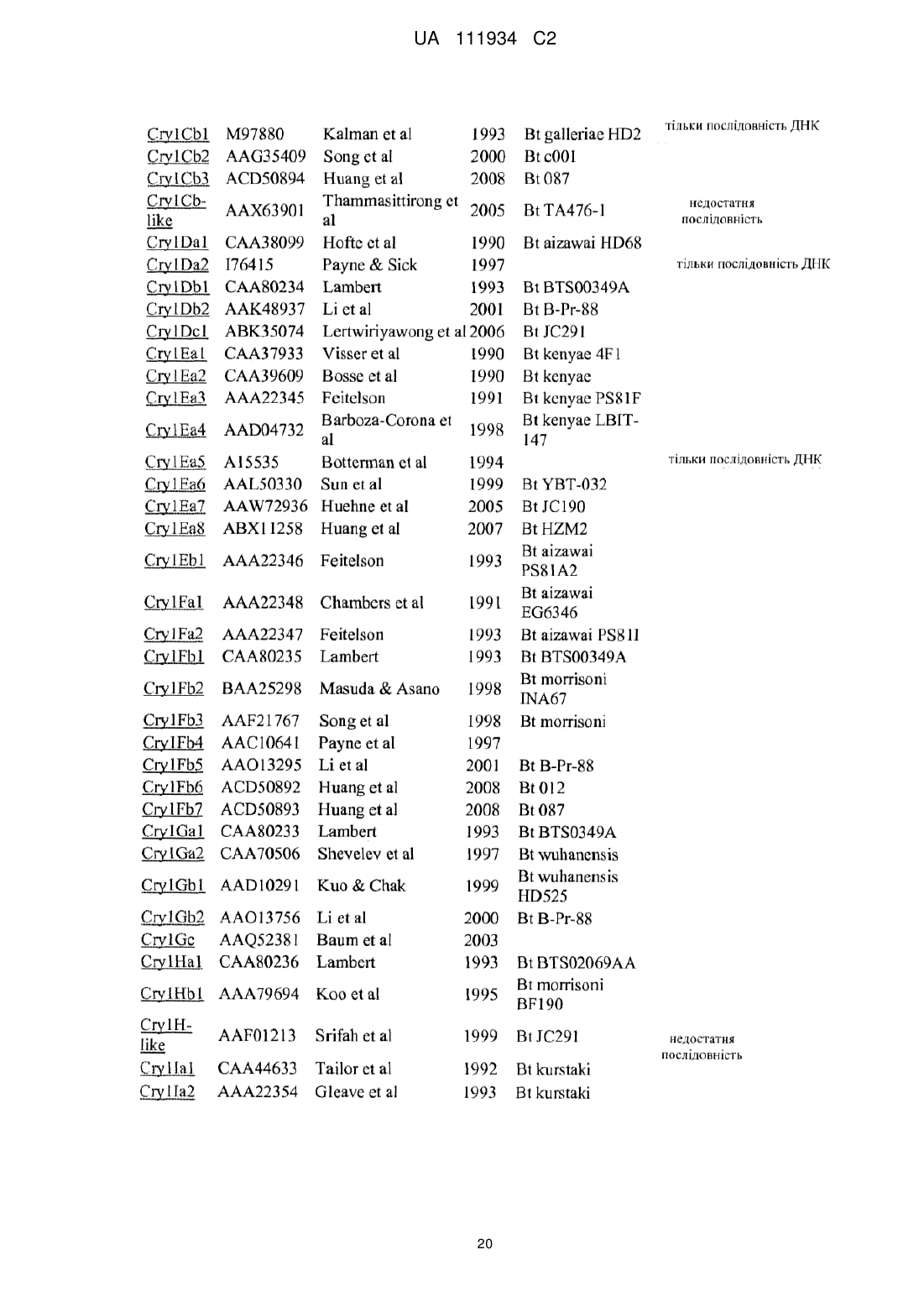
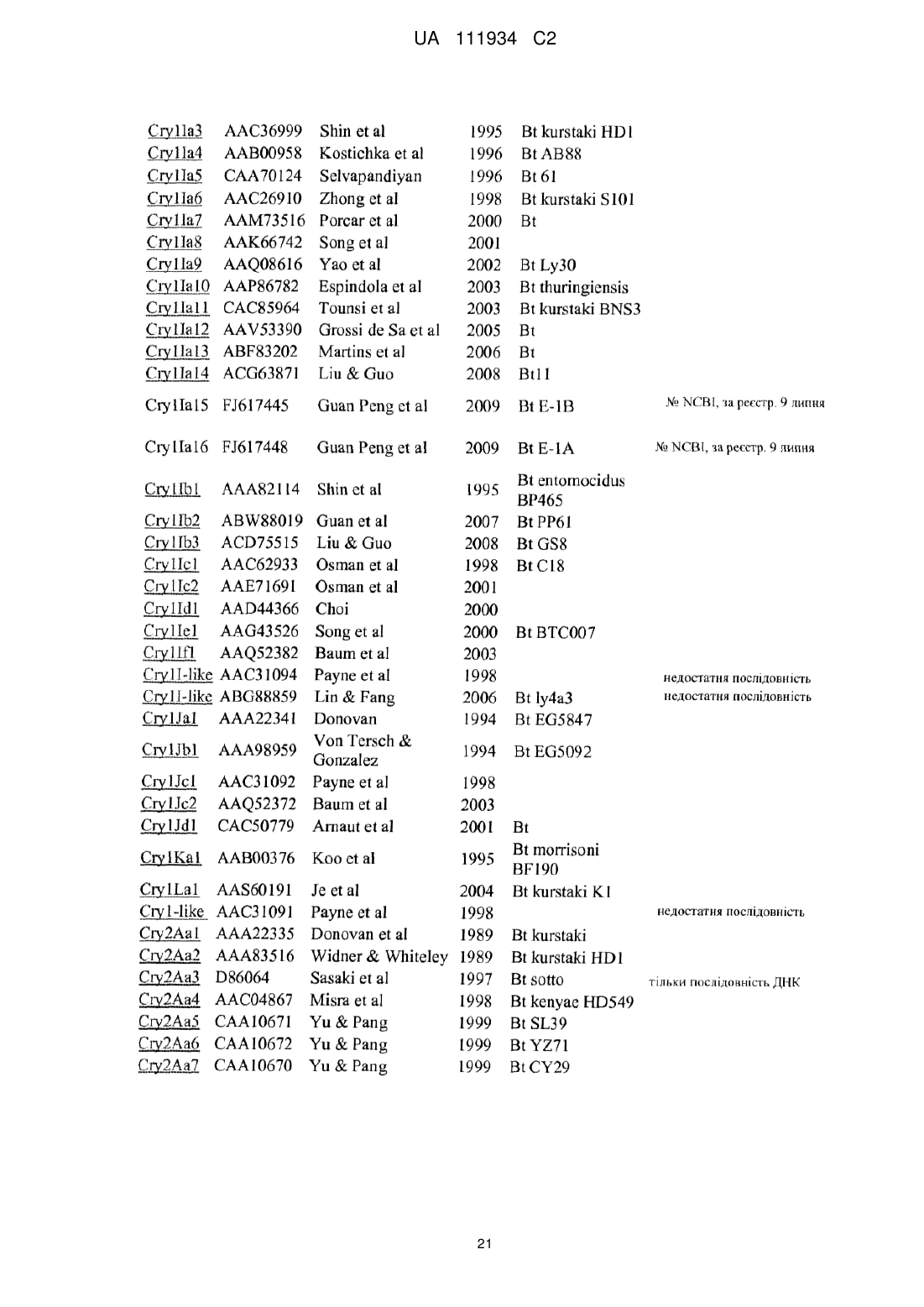
Трансгенна рослина, що містить днк, яка кодує інсектицидний білок vip3ab, і днк, яка кодує інсектицидний білок cry1fa, стійка до лускокрилих шкідників
Номер патенту: 111934
Опубліковано: 11.07.2016
Автори: Бертон Стефані Л., Мід Томас, Шитс Джоел Дж., Вуслі Аарон Т., Нарва Кеннет, Сторер Ніколас П.
Формула / Реферат
1. Трансгенна рослина, що містить ДНК, яка кодує інсектицидний білок Vip3Ab, і ДНК, яка кодує інсектицидний білок Cry1Fa, де вказаний інсектицидний білок Cry1Fa є щонайменше на 95 % ідентичним SEQ ID NO:1, і вказаний інсектицидний білок Vip3Ab є щонайменше на 95 % ідентичним SEQ ID NO:2.
2. Насінина рослини за п. 1, що містить ДНК, яка кодує інсектицидний білок Vip3Ab, і ДНК, яка кодує інсектицидний білок Cry1Fa.
3. Трансгенна рослина за п. 1, де ДНК, яка кодує інсектицидний білок Vip3Ab, і ДНК, яка кодує інсектицидний білок Cry1Fa, введені у вказану рослину шляхом інтрогресії.
4. Насінина рослини за п. 3, що містить ДНК, яка кодує інсектицидний білок Vip3Ab, і ДНК, яка кодує інсектицидний білок Cry1Fa.
5. Сукупність рослин в полі, що містить не-Bt рослини-сховища, і сукупність трансгенних рослин за п. 1, де вказані рослини-сховища складають менше ніж 40 % від всіх сільськогосподарських культур у вказаній сукупності рослин.
6. Сукупність рослин в полі за п. 5, де вказані рослини-сховища складають менше ніж 30 % від всіх сільськогосподарських культур у вказаній сукупності рослин.
7. Сукупність рослин в полі за п. 5, де вказані рослини-сховища складають менше ніж 20 % від всіх сільськогосподарських культур у вказаній сукупності рослин.
8. Сукупність рослин в полі за п. 5, де вказані рослини-сховища складають менше ніж 10 % від всіх сільськогосподарських культур у вказаній сукупності рослин.
9. Сукупність рослин в полі за п. 5, де вказані рослини-сховища складають менше ніж 5 % від всіх сільськогосподарських культур у вказаній сукупності рослин.
10. Сукупність рослин в полі за п. 5, де вказані рослини-сховища знаходяться у вигляді блоків або смуг.
11. Суміш насіння, що містить насіння не-Bt рослин-сховищ і сукупність трансгенного насіння за п. 2, що містить ДНК, яка кодує інсектицидний білок Vip3Ab, і ДНК, яка кодує інсектицидний білок Cry1Fa, де вказане насіння нетрансгенних рослин складає менше ніж 40 % від всього насіння у вказаній суміші.
12. Суміш насіння за п. 11, де вказане насіння рослин-сховищ складає менше ніж 30 % від всього насіння у вказаній суміші.
13. Суміш насіння за п. 11, де вказане насіння рослин-сховищ складає менше ніж 20 % від всього насіння у вказаній суміші.
14. Суміш насіння за п. 11, де вказане насіння рослин-сховищ складає менше ніж 10 % від всього насіння у вказаній суміші.
15. Суміш насіння за п. 11, де вказане насіння рослин-сховищ складає менше ніж 5 % від всього насіння у вказаній суміші.
16. Спосіб запобігання виробленню у комахи совки трав′яної (FAW; Spodoptera frugiperda) резистентності до інсектицидного білка, що походить від Bacillus thuringiensis, де вказаний спосіб включає посів насіння для одержання сукупності рослин за п. 5, що містять ДНК, яка кодує інсектицидний білок Vip3Ab, і ДНК, яка кодує інсектицидний білок Cry1Fa, і контактування вказаної комахи із вказаною сукупністю трансгенних рослин.
17. Трансгенна рослина за п. 1, де вказана рослина також включає ДНК, що кодує третій інсектицидний білок, де вказаний третій білок вибраний із групи, яка складається з Cry1C, Cry1D, Cry1Be і Cry1E.
18. Сукупність рослин в полі, що містить не-Bt рослини-сховища і сукупність трансгенних рослин за п. 17, де вказані рослини-сховища складають менше ніж 20 % від всіх сільськогосподарських культур у вказаній сукупності рослин.
19. Сукупність рослин в полі, яка містить не-Bt рослини-сховища і сукупність рослин за п. 17, де вказані рослини-сховища складають менше ніж 10 % всіх сільськогосподарських культур у вказаній сукупності рослин.
20. Спосіб запобігання виробленню у комахи совки трав′яної резистентності до інсектицидного білка, що походить від Bacillus thuringiensis, де вказаний спосіб включає посів насіння для одержання сукупності рослин за п. 19 і контактування вказаної комахи з вказаною сукупністю трансгенних рослин.
21. Композиція для боротьби з лускокрилими шкідниками, що містить клітини, що експресують інсектицидно активну кількість білка, що містить коровий токсин Cry1Fa, і білка Vip3Ab.
22. Композиція за п. 21, що містить хазяїна, трансформованого так, щоб він експресував білок, який містить коровий токсин Cry1Fa, і білок Vip3Ab, де вказаним хазяїном є мікроорганізм або клітина рослини.
23. Спосіб боротьби з лускокрилими шкідниками, що включає обробку вказаних шкідників або середовища проживання цих шкідників інсектицидно активною кількістю композиції за п. 21.
24. Трансгенна рослина за п. 1, де вказана рослина також включає ДНК, що кодує третій інсектицидний білок, де вказаний третій білок вибраний із групи, яка складається з Cry1C, Cry1D і Cry1E.
25. Трансгенна рослина за п. 24, де вказана рослина продукує четвертий білок і п′ятий білок, вибрані з групи, яка складається з Cry2A, Cry1l, Cry1Ab і DIG-3.
26. Трансгенна рослина за п. 17, де вказана рослина продукує четвертий білок, вибраний із групи, яка складається з Cry2A, Cry1l, Cry1Ab і DIG-3.
27. Спосіб запобігання виробленню у комахи совки трав′яної резистентності до токсину Cry, де вказаний спосіб включає посів насіння для одержання сукупності рослин за п. 26 і контактування вказаної комахи з вказаною сукупністю трансгенних рослин.
28. Сукупність рослин в полі, що містить не-Bt рослини-сховища і сукупність трансгенних рослин за п. 26, де вказані не-Bt рослини-сховища складають менше ніж 10 % у вказаній сукупності рослин.
29. Сукупність рослин за п. 28, де вказана сукупність рослин містить менше ніж приблизно 5 % рослин-сховищ.
30. Спосіб запобігання виробленню у комахи совки трав′яної резистентності до токсину Cry, де вказаний спосіб включає посів насіння для одержання сукупності рослин за п. 28 або 29 і контактування вказаної комахи з вказаною сукупністю трансгенних рослин.
31. Суміш насіння, що містить насіння не-Bt рослин-сховищ і сукупність трансгенного насіння рослин за п. 26, де вказане насіння рослин-сховищ складає менше ніж 10 % від всього насіння у вказаній суміші.
32. Сукупність рослин за будь-яким із пп. 5, 18 і 28, де вказані рослини займають площу, більшу ніж 10 акрів.
33. Рослина за будь-яким із пп. 1, 17, 24 і 26, де вказана рослина вибрана з групи, яка складається з кукурудзи, сої і бавовнику.
34. Рослина за будь-яким із пп. 1, 17, 24 і 26, де вказаною рослиною є рослина кукурудзи.
35. Трансгенна рослина за п. 26, де вказаним третім білком є білок Cry1Be.
36. Спосіб запобігання виробленню у комахи совки трав′яної резистентності до токсину Cry, де вказаний спосіб включає посів насіння для одержання сукупності рослин за п. 35 і контактування вказаної комахи з вказаною сукупністю трансгенних рослин.
37. Сукупність рослин в полі, що містить не-Bt рослини-сховища і множину рослин за п. 35, де вказані рослини-сховища складають менше ніж приблизно 10 % від всіх сільськогосподарських культур у вказаній сукупності рослин.
38. Сукупність рослин за п. 37, де вказана сукупність рослин містить менше ніж приблизно 5 % рослин-сховищ.
39. Спосіб запобігання виробленню у комахи совки трав′яної резистентності до токсину Cry, де вказаний спосіб включає посів насіння для одержання сукупності рослин за п. 37 або 38 і контактування вказаної комахи з вказаною сукупністю трансгенних рослин.
40. Суміш насіння, що містить насіння не-Bt рослин-сховищ і сукупність трансгенного насіння рослин за п. 35, де вказане насіння рослин-сховищ складає менше ніж 10 % від всього насіння у вказаній суміші.
41. Сукупність рослин за будь-яким із пп. 37 і 38, де вказані рослини займають площу, більшу ніж 10 акрів.
42. Рослина за будь-яким із пп. 1, 3, 17, 24, 25, 26 і 33, де вказана рослина вибрана з групи, яка складається з кукурудзи, сої і бавовнику.
43. Рослина за п. 42, де вказаною рослиною є рослина кукурудзи.
44. Клітина рослини за будь-яким із пп. 1, 3, 17, 24, 25, 26, 33 і 34, де вказана клітина рослини містить вказану ДНК, що кодує вказаний інсектицидний білок Cry1Fа, і вказану ДНК, що кодує вказаний інсектицидний білок Vip3Ab, і де вказаний інсектицидний білок Cry1Fа принаймні на 99 % ідентичний послідовності SEQ ID NO:1, а вказаний інсектицидний білок Vip3Ab принаймні на 99 % ідентичний послідовності SEQ ID NO:2.
45. Рослина за будь-яким із пп. 1, 3, 17, 24, 25, 26, 33 і 34, де вказаний інсектицидний білок Cry1Fa містить SEQ ID NO:1, а вказаний інсектицидний білок Vip3Ab містить SEQ ID NO:2.
Текст
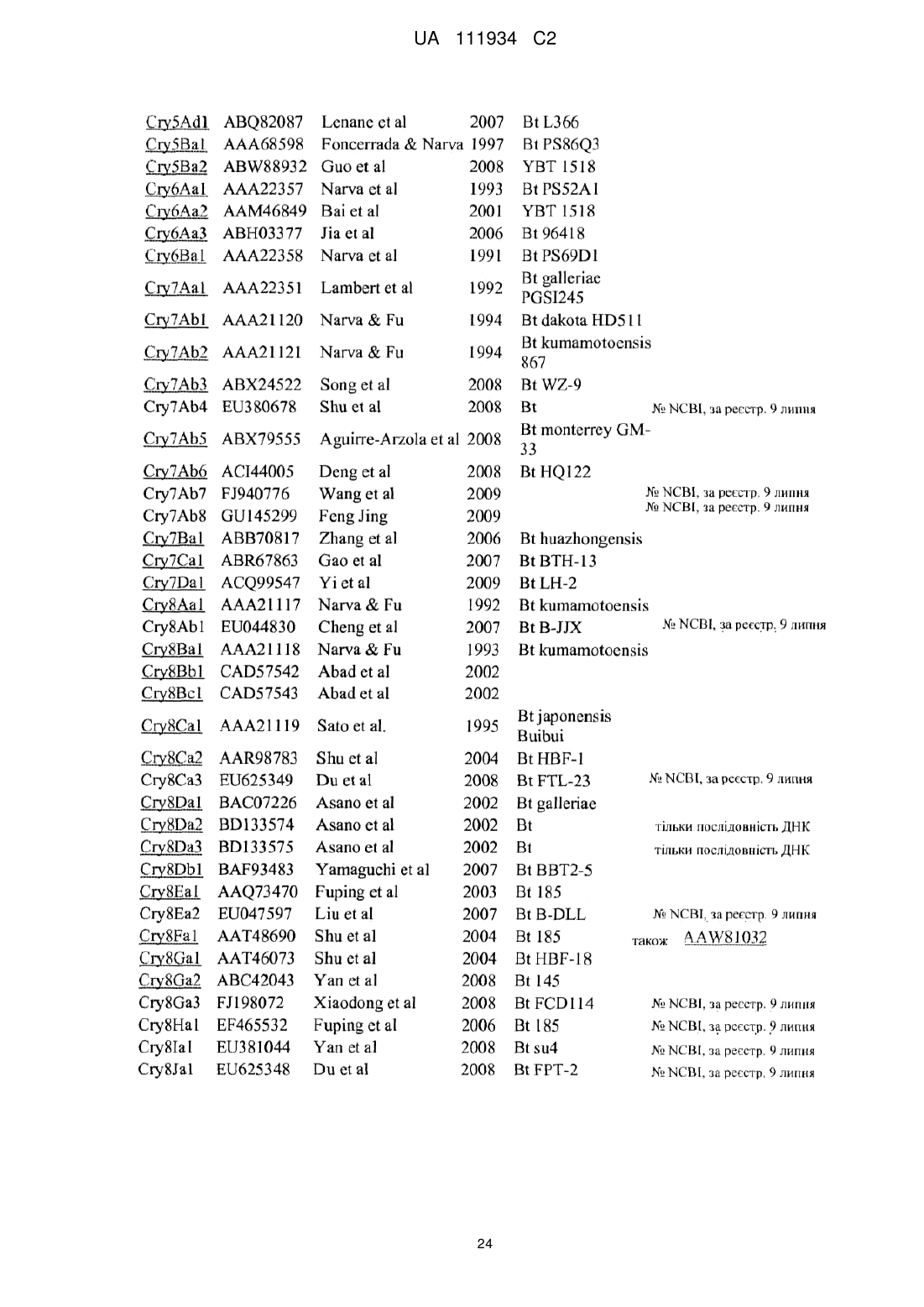
Реферат: Даний винахід включає способи боротьби з лускокрилими шкідниками і рослини, стійкі до цих шкідників, де вказані рослини містять інсектицидний білок Vip3Ab у комбінації з інсектицидним білком Cry1Fa, і де вказані способи дозволяють сповільнювати або попереджати виробляння резистентності у совки трав′яної Spodoptera frugiperda до цих білків. UA 111934 C2 (12) UA 111934 C2 UA 111934 C2 5 10 15 20 25 30 35 40 45 50 55 60 Попередній рівень техніки Людина вирощує кукурудзу для вживання в їжу і для енергетичних цілей. Людина також вирощує безліч інших культур, включаючи сою і бавовну. Комахи поїдають і пошкоджують рослини, і тим самим наносять збиток діяльності людини. Для боротьби з комахами-шкідниками щорічно витрачаються мільярди доларів, і ще мільярди йдуть на відшкодування збитку, що наноситься цими шкідниками. Інсектициди, синтезовані методами органічної хімії, є головним інструментом, що використовується для боротьби з комахами-шкідниками, але в деяких регіонах, у боротьбі з комахами-шкідниками важливу роль відіграють біологічні інсектициди, такі як інсектицидні білки, що походять від Bacillus thuringiensis (Bt). Можливість культивувати резистентні до комах рослини за допомогою трансформації цих рослин генами інсектицидних білків Bt стала революцією в сучасному сільському господарстві і довела важливість і цінність інсектицидних білків та їхніх генів. Деякі білки Bt були використані для створення резистентних до комах трансгенних рослин, які успішно пройшли випробування, і в цей час їх виготовляють у промисловому масштабі. Такими білками є Cry1Ab, Cry1Ac, Cry1F і Cry3Bb, що вводяться в кукурудзу, Cry1Ac і Cry2Ab, що вводяться в бавовну, і Cry3A, що вводиться в картоплю. Комерційно доступні продукти, що експресують ці білки, експресують тільки один із цих білків, за винятком випадків, коли бажано одержати комбінований інсектицидний спектр із 2 білків (наприклад, у кукурудзі, Cry1Ab і Cry3Bb об'єднані для вироблення резистентності до лускокрилих шкідників і кореневих личинок, відповідно), або випадків, коли незалежна дія цих білків робить їх цінним інструментом для сповільнення розвитку резистентності до інсектицидів у сприйнятливих популяцій комах (наприклад, Cry1Ac і Cry2Ab в бавовнику об'єднують з метою вироблення у рослин резистентності до тютюнової листовійки). Див. також патент США 20090313717, який стосується білків Cry2 плюс Vip3Aa, Cry1F або Cry1A, що використовується для боротьби з Helicoverpa zea або armigerain. Заявка WO 2009132850 стосується Cry1F або Cry1A і Vip3Aa, що використовується для боротьби зі Spodoptera frugiperda. Патент США 2008 0311096 стосується частково білка Cry1Ab, що використовується для боротьби з Cry1Fрезистентним ECB. Тобто, деякі сорти резистентних до комах трансгенних рослин, які швидко і повсюдно пристосовуються до цієї технології, також мають той недолік, що популяції шкідників виробляють резистентність до інсектицидних білків, продукованих цими рослинами. Було запропоновано декілька стратегій для збереження цінних ознак резистентності до Bt-комах, де вказані стратегії включають використання високих доз білків в комбінації зі збереженням площ "захистків" нетрансгенних рослин, і чергування або спільного використання різних токсинів (McGaughey et al. (1998), "Bt-Resistance Management" Nature Biotechnol. 16: 144-146). Необхідно, щоб білки, відібрані для використання в IRM-кластерах, мали незалежну інсектицидну дією, при якій резистентність, що виробляється до одного білка, не розповсюджувалася на інший білок (тобто, не спостерігалася перехресна резистентність до білків). Так, наприклад, якщо популяція комах, вибраних на резистентність до "білка А", є сприйнятливою до "білка В", то можна зробити висновок, що в цьому випадку перехресна резистентність відсутня, і комбінація "білок А і білок В" буде ефективною для сповільнення вироблення резистентності до одного білка А. У разі відсутності популяції резистентних комах, оцінка може бути зроблена виходячи з інших характеристик, які, як передбачається, стосуються механізму дії і можливої перехресної резистентності. Було висловлене припущення, що застосування опосередкованого рецептором зв'язування при ідентифікації інсектицидних білків, очевидно, не буде призводити до вироблення перехресної резистентності. (van Mellaert et al. 1999). Ключовим прогностичним чинником відсутності перехресної резистентності, що з'являється при такому підході, є те, що інсектицидні білки не конкурують за зв'язування з рецепторами у сприйнятливих видів комах. У випадку, коли два токсини Bt конкурують за зв'язування з одним і тим же рецептором, і якщо цей рецептор мутує у комахи так, що один із токсинів більше не зв'язується з цим рецептором, а тому не має інсектицидної дії проти комахи, то така комаха може набувати резистентність до другого токсину (який конкурентно зв'язується з тим же рецептором). Тобто, можна сказати, що така комаха буде мати перехресну резистентність до обох токсинів Bt. Однак якщо два токсини зв'язуються з двома різними рецепторами, то це означає, що така комаха не має одночасної резистентності до цих двох токсинів. Cry1Fa може бути використаний для боротьби з лускокрилими шкідниками багатьох видів, включаючи європейського кукурудзяного трача (ECB; Ostrinia nubilalis (Hübner)) і совку трав'яну (FAW; Spodoptera frugiperda), і має активність проти бурякового трача (SCB; Diatraea saccharalis). Білок Cry1Fa, що продукується в рослинах кукурудзи, які містять TC1507, 1 UA 111934 C2 5 10 15 20 25 30 35 40 45 50 55 60 відповідає за вироблення ознаки резистентності до комах, і цей білок застосовується у провідних галузях промисловості для боротьби з совкою трав'яною (FAW). Cry1Fa також використовується в продуктах Herculex®, SmartStax™ і WideStrike™. Можливість провести дослідження на зв'язування з рецептором (конкурентне або гомологічне) із використанням білка Cry1Fa має певні обмеження, оскільки при застосуванні більшості методів мічення білків для детектування в аналізах на зв'язування з рецептором відбувається інактивація інсектицидної активності білка Cry1Fa. Додаткові токсини Cry перераховані на web-сайті офісу Комітету з номенклатури Bt (Crickmore et al; lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/). У цей час відомо приблизно 60 основних груп токсинів "Cry" (Cry1-Cry59), і крім того, існують інші токсини, такі як токсини Cyt і токсини VIP і т.ін. Багато токсинів з кожної пронумерованої групи мають підгрупи, позначені великими буквами, а підгрупи, позначені великими буквами, у свою чергу, поділяються на підгрупи (суб-підгрупи), позначені малими буквами (наприклад, Cry1 має підгрупу A-L, а Cry1A має підгрупу a-i). Стислий опис суті винаходу Даний винахід частково ґрунтується на несподіваному виявленні того факту, що популяція трав'яної совки (Spodoptera frugiperda; FAW), відібрана на резистентність до інсектицидної активності білка Cry1Fa, не є резистентною до інсектицидної активності білка Vip3Ab. Пара токсинів, що розглядається, не має перехресної резистентності щодо FAW. Для фахівця у даній галузі очевидно, що перевага такого відкриття полягає в тому, що рослини, які експресують Vip3Ab і Cry1Fa або їхні інсектицидні частини, можуть бути використані для сповільнення або попередження розвитку резистентності до будь-якого з цих окремо взятих інсектицидних білків. Даний винахід також підтверджується виявленням того факту, що Vip3Ab і Cry1Fa не конкурують один з одним за сайти зв'язування в кишечнику FAW. Таким чином, даний винахід стосується, зокрема, застосування білка Vip3Ab у комбінації з білком Cry1Fa. Рослини (і площі, засіяні такими рослинами), які продукують Vip3Ab плюс Cry1Fa, входять до обсягу даного винаходу. Даний винахід також стосується, зокрема, трикомпонентних кластерів або "пірамід" із трьох (або більше) токсинів, де токсини Vip3Ab і Cry1Fa являють собою базову пару. У деяких переважних варіантах піраміди, вибраний(і) токсин(и) не має(ють) перехресну резистентність стосовно FAW. Деякими переважними білками для цих трикомпонентних комбінацій піраміди є Cry1Fa плюс Vip3Ab плюс Cry1C плюс Cry1D, Cry1Be або Cry1E. Відповідно до даного винаходу, ці конкретні трикомпонентні кластери, як було несподівано виявлено авторами винаходу, переважно, не мають перехресну резистентність стосовно FAW. Це дозволяє знизити або взагалі уникнути потреби в площах-"сховищах" нетрансгенних культур. Що стосується Cry1Fa, який має активність проти FAW і європейського кукурудзяного трача (ECB), то виходячи з представлених тут даних, можна зробити висновок, що може бути також вибрана кластер-тетрада (із чотирьох компонентів) для використання чотирьох білків, де три з цих чотирьох білків не мають перехресну резистентність стосовно ЕСВ, і три з цих чотирьох білків не мають перехресну резистентність стосовно FAW. Це може бути досягнуте з використанням Cry1Ве (що має активністю проти ЕСВ і FAW) разом із розглядуваною парою білків плюс один додатковий білок, що має активність проти ЕСВ. Такими кластерамитетрадами згідно з винаходом є: Cry1F плюс Cry1Be плюс Vip3Ab (активний проти FAW) плюс Cry1Ab, Cry2A, Cry1I або DIG-3 (активний проти ECB). Стислий опис графічного матеріалу Фіг. 1. Гістограма інгібування росту (стовпці) і загибелі комах (♦) залежно від дози повнорозмірного Vip3Ab1, спрямованого проти Spodoptera frugiperda дикого типу (J.E. Smith), (FAW) і Cry1Fa-резистентної Spodoptera frugiperda (J.E. Smith), (rFAW). Відсоток інгібування росту обчислювали шляхом порівняння середньої маси 8 личинок, оброблених тільки буфером, із масою личинок, оброблених токсином протягом 5 днів. 125 Фіг. 2. Флуоресцентна візуалізація I-Cry1Fa, пов'язаного з BBMV від S. frugiperda, із подальшим розділенням за допомогою електрофорезу в ДСН-ПААГ. Зразки брали в дублікаті. 125 125 Концентрація I-Cry1Fa становила 1 нM. Контроль означає рівень зв'язування I-Cry1Fa з BBMV за відсутності будь-якого ліганду, що конкурентно зв'язується. 1000 нM Cry1Fa означає 125 рівень зв'язування I-Cry1Fa з BBMV у присутності 1000 нM Cry1Fa, що не містить радіоактивної мітки, де вказаний рівень зв'язування вказує на повне витіснення радіоактивно 125 міченого ліганду з білка BBMV. 1000 нM Vip3Ab1 означає рівень зв'язування I-Cry1Fa з BBMV в присутності 1000 нM Vip3Ab1, що не містить радіоактивної мітки, де вказаний рівень 125 зв'язування вказує на те, що цей білок не має здатності витісняти I-Cry1Fa з BBMV S. 2 UA 111934 C2 5 10 15 20 25 30 35 40 45 50 55 60 frugiperda навіть при концентрації, що у 1000 разів перевищує концентрацію радіоактивно міченого ліганду. 125 Фіг. 3. Флуоресцентна візуалізація I-Cry1Fa, пов'язаного з BBMV S. frugiperda дикого типу (FAW) або Cry1Fa-резистентною S. frugiperda (rFAW), із подальшим розділенням за допомогою 125 електрофорезу в ПААГ із ДСН. Зразки брали в дублікаті. Концентрація I-Cry1Fa становила 2,5 125 нM. FAW-0 означає рівень зв'язування I-Cry1Fa з BBMV S. frugiperda дикого типу за відсутності якого-небудь ліганду, що конкурентно зв'язується. FAW-1000 нM Cry1Fa означає 125 рівень зв'язування I-Cry1Fa з BBMV S. frugiperda дикого типу в присутності 1000 нM не міченого радіоактивної міткою Cry1Fa, де такий рівень зв'язування вказує на витіснення 125 радіоактивно міченого ліганду з білка BBMV. rFAW-0 означає рівень зв'язування I-Cry1Fa з BBMV Cry1Fa-резистентної S. frugiperda за відсутності будь-якого ліганду, що конкурентно 125 зв'язується. Потрібно звернути увагу на відсутність зв'язування I-Cry1Fa з BBMV, що походять 125 від резистентної FAW. rFAW-1000 нМ Cry1Fa означає рівень зв'язування I-Cry1Fa з BBMV у присутності 1000 нM Vip3Ab1, що не містить радіоактивну мітку, де такий рівень зв'язування 125 також вказує на нездатність I-Cry1Fa зв'язуватися з BBMV від Cry1Fa-резистентної S. frugiperda. Детальний опис винаходу Як повідомляється в даній заявці, токсин Vip3Ab, що продукується в трансгенній кукурудзі та в інших рослинах (наприклад, у бавовнику і сої), виявляє високу ефективність у боротьбі проти совки трав'яної (FAW; Spodoptera frugiperda), в якої виробляється резистентність до активності Cry1Fa. Таким чином, даний винахід частково ґрунтується на несподіваному виявленні того факту, що совка трав'яна, резистентна до дії Cry1Fa, є сприйнятливою (тобто, не має перехресної резистентності) до дії Vip3Ab. Відповідно до іншого варіанту, даний винахід також частково ґрунтується на несподіваному виявленні того факту, що токсин Vip3Ab є ефективним для захисту рослин (таких як рослини кукурудзи) від ураження Cry1Fa-резистентної совки трав'яної. Обговорення цього шкідника наводиться, наприклад, у публікації Tabashnik, PNAS (2008), vol. 105 no. 49, 19029-19030. Даний винахід включає застосування токсину Vip3Ab для захисту кукурудзи та інших економічно цінних видів рослин від ураження шкідниками, і зниження врожайності, що викликається поїданням цих рослин совкою трав'яною або популяціями совки трав'яної, в яких виробляється резистентність до Cry1Fa. Даний винахід також стосується IRM-кластера, що використовується для попередження або сповільнення розвитку резистентності совки трав'яної до Cry1Fa. Даний винахід також стосується композицій, що використовуються для боротьби з лускокрилими шкідниками, у клітинах яких продукується білок, що містить коровий токсин Cry1Fa, і білок, що містить коровий токсин Vip3Ab. Даний винахід також стосується хазяїна, трансформованого так, щоб він продукував білок, що містить коровий токсин Cry1Fa, і білок, що містить коровий токсин Vip3Ab, де вказаним хазяїном є клітина мікроорганізму або рослини. Розглядуваний(і) полінуклеотид(и) переважно присутній(і) у генетичній конструкції під контролем промотору (функціонально приєднаного до промотору або що містять цей промотор), що не є промотором Bacillus thuringiensis. Розглядувані полінуклеотиди можуть містити кодони, що звичайно зустрічаються в цій рослині і сприяють підвищенню рівня експресії в рослині. Даний винахід також стосується способу боротьби з лускокрилими шкідниками, що включає контактування вказаних шкідників або середовища їх проживання з ефективною кількістю композиції, яка містить білок, що включає коровий токсин Cry1Fa, а також білок, що включає коровий токсин Vip3Ab. В одному зі своїх варіантів, даний винахід стосується рослини кукурудзи, що включає експресований у цій рослині ген, який кодує білок, що містить коровий токсин Vip3Ab, і експресований у цій рослині ген, який кодує білок, що містить коровий токсин Cry1Fa, і насіння такої рослини. В іншому своєму варіанті, даний винахід стосується рослини кукурудзи, де експресований у цій рослині ген, який кодує білок, що містить коровий токсин Vip3Ab, і експресований в цій рослині ген, який кодує білок, що містить коровий токсин Cry1Fa, були введені у вказані рослини кукурудзи і в насіння таких рослин шляхом інтрогресії. Як описано в прикладах, дослідження за конкурентним зв'язуванням, що проводяться з використанням радіоактивно міченого білка, який містить коровий токсин Vip3Ab, показали, що білок, що містить коровий токсин Cry1Fa, не конкурує за зв'язування в тканинах комахи FAW, із якими зв'язується Vip3Ab. Одержані результати також показали, що комбінації білків Cry1Fa і Vip3Ab являють собою ефективний засіб для зниження вироблення резистентності популяції 3 UA 111934 C2 5 10 15 20 25 30 35 40 45 50 55 FAW до Cry1Fa (та аналогічним чином, вироблення резистентності до Vip3Ab), і отже, для підвищення рівня резистентності рослин кукурудзи, що експресують обидва білки, до цього шкідника. Таким чином, виходячи частково з описаних даних, можна зробити висновок, що спільне продукування (кластеризація) білків Vip3Ab і Cry1Fa може бути застосована з метою одержання IRM-кластера з високою дозою для боротьби з FAW. Що стосується Cry1Fa, що має активність проти FAW і європейського кукурудзяного трача (ECB), то пара токсинів, що розглядається, має неконкурентну дію проти FAW. Для розширення спектра дії проти комах, до цієї пари можуть бути додані й інші білки. В іншому своєму варіанті, даний винахід стосується застосування білків Cry1Fa і Vip3Ab у комбінації з іншим третім токсином/геном, і застосування такого трикомпонентного кластера для зниження розвитку резистентності у FAW до будь-кого з цих токсинів. Таким чином, в іншому своєму варіанті, даний винахід стосується застосування двох, трьох або більше білків у сільськогосподарських регіонах, в яких можуть розвиватися резистентні популяції FAW. Відповідно до цього, даний винахід також стосується, зокрема, трикомпонентних кластерів або "пірамід" із трьох (або більше) токсинів, де вказані токсини Cry1Fa і Vip3Ab являють собою базову пару. У деяких переважних варіантах піраміди, три вибраних білки не мають перехресну резистентність проти FAW. Деякі переважні комбінації пірамід "потрійної дії" являють собою Cry1Fa плюс Vip3Ab плюс будь-який з Cry1C або Cry1D. Див., заявку США реєстр. № 61/284281 (подану 16 грудня, 2009), в якій показано, що Cry1C є активним проти Cry1F-резистентної FAW, і заявку США реєстр. № 61/284252 (подану 16 грудня, 2009), в якій показано, що Cry1D є активним проти Cry1F-резистентної FAW. У цих двох заявках також показано, що Cry1C не конкурує з Cry1F за зв'язування з мембранними препаратами FAW, і що Cry1D не конкурує з Cry1F за зв'язування з мембранними препаратами FAW. У деяких варіантах винаходу, Cry1Be або Cry1E можуть бути об'єднані з Vip3A і Cry1F як третій білок проти FAW. Опис застосування Cry1Be разом з Cry1F можна знайти в заявці США реєстр. № 61/284290 (поданої 16 грудня, 2009). Опис застосування Cry1E разом з Cry1F можна знайти в заявці США реєстр. № 61/284278 (поданій 16 грудня, 2009). Відповідно до даного винаходу, ці конкретні трикомпонентні кластери білків, як було несподівано виявлено авторами винаходу, переважно не мають перехресну резистентність стосовно FAW. Це дозволяє знизити або взагалі уникнути потреби в площах-"сховищах" нетрансгенних культур. Виходячи з представлених тут даних, можна зробити висновок, що може бути також вибрана кластер-тетрада (із чотирьох компонентів) для використання чотирьох білків, де три з цих чотирьох білків не мають перехресної резистентності стосовно ЕСВ, і три з цих чотирьох білків не мають перехресну резистентність стосовно FAW. Це може бути досягнуте з використанням Cry1Ве (що має активність проти ЕСВ і FAW) і Cry1Fa (що має активність проти ЕСВ і FAW), разом із розглядуваним Vip3Ab (що має активність проти FAW) і з четвертим білком, токсичним стосовно ЕСВ. (Див. заявку США реєстр. № 61/284290, подану 16 грудня, 2009 і що стосується комбінацій Cry1Fa і Cry1Be). Прикладами кластерів-тетрад згідно з винаходом є: Cry1F плюс Cry1Be плюс Vip3Ab (активний проти FAW) плюс Cry1Ab, Cry2A, Cry1I або DIG-3 – всі вони активні проти ECB). DIG-3 описаний у патенті США 2010 00269223. Рослини (і площі, засіяні такими рослинами), які продукують будь-які з комбінацій білків, що розглядаються, входять до обсягу даного винаходу. Можуть бути також додані додаткові токсини/гени, і ці конкретні трикомпонентні кластери, що обговорюються вище, будуть, як було несподівано виявлено, переважно діяти проти FAW і/або ЕСВ за декількома механізмами. Це дозволяє знизитиабо уникнути потреби в площах-"сховищах" нетрансгенних культур. Таким чином, у даному винаході розглядається посівна площа понад 10 акрів. Для одержання послідовностей будь-яких описаних або згаданих тут генів і білків можна також звернутися в GENBANK. Див. нижче Додаток А. У патенті США № 5188960 і в патенті США № 5827514 описані білки, які містять коровий токсин Cry1Fa, і які можуть бути використані для здійснення даного винаходу. У патенті США № 6218188 описані оптимізовані для рослини послідовності ДНК, що кодують білки, які містять коровий токсин Cry1Fa, і які можуть бути використані у даному винаході. Cry1Fa також використовується в продуктах Herculex®, SmartStax™ і WideStrike™. Ген vip3Ab може бути введений, наприклад, у продукт Cry1Fa, такий як Herculex®, SmartStax™ і WideStrike™. Відповідно до цього, застосування Vip3Ab дозволяє значно знизити тиск відбору на ці та інші промислові продукти. Таким чином, Vip3Ab може бути використаний у комбінації з 3 генів для кукурудзи та інших рослин (наприклад, бавовнику і сої). 4 UA 111934 C2 5 10 15 20 25 30 35 40 45 50 55 60 Комбінації білків, описаних у даному винаході, можуть бути використані для боротьби з лускокрилими шкідниками. Дорослі лускокрилі, наприклад, метелики і молі, харчуються, головним чином, нектаром і відіграють значну роль у запиленні. Майже всі личинки лускокрилих, тобто, гусінь, поїдає рослини, і багато з них є небезпечними шкідниками. Гусінь живе на листі або поїдає внутрішню частину листя, або вона ушкоджує коріння або стебла рослини, що призводить до виснаження поживних речовин у рослини, і в більшості випадків, до руйнування основної фізичної структури рослини. Крім того, гусінь ушкоджує плоди, тканини і зерно, що зберігається, і борошно, внаслідок чого продукти або взагалі стають непридатними для продажу, або їх комерційна цінність значно знижується. Використовуваний тут термін "лускокрилі шкідники" також стосується різних стадій життєвого циклу шкідника, включаючи стадії розвитку личинок. Деякі химерні токсини згідно з винаходом містять повнорозмірну частину N-кінцевого корового токсину Bt, і в певному положенні, розташованому за кінцем частини корового токсину, цей білок переходить у гетерологічну послідовність протоксину. N-кінцева, інсектицидно активна частина токсину Bt називається "коровим токсином". Перехід від корового сегмента токсину в гетерологічний сегмент протоксину може відбуватися приблизно в ділянці стику токсин/протоксин, або альтернативно, частина нативного протоксину (що тягнеться за межі корової частини токсину) може зберігатися, причому, перехід у гетерологічну частину протоксину може відбуватися нижче. Прикладом може бути один химерний токсин згідно з винаходом, який являє собою повнорозмірну частину корового токсину Cry1Fa (приблизно перші 600 амінокислот) і гетерологічний протоксин (інший білок до С-кінця). В одному переважному варіанті винаходу, частина химерного токсину, що містить протоксин, походить від токсину білка Cry1Ab. У переважному варіанті винаходу, частина химерного токсину, що містить протоксин, походить від токсину білка Cry1Ab. Для фахівців у даній галузі очевидно, що токсини Bt, навіть токсини, що належать до певного класу, такого як Cry1F, можуть до деякого ступеню варіюватися за своєю довжиною і точною локалізацією переходу від частини корового токсину в частину протоксину. Звичайно, токсин Cry1Fa має довжину приблизно від 1150 до 1200 амінокислот. Перехід від частини корового токсину в частину протоксину звичайно відбувається на ділянці між частинами, що складають приблизно від 50 % і приблизно до 60 % від всієї довжини токсину. Химерний токсин згідно з винаходом включає повнорозмірну область N-кінцевої частини корового токсину. Таким чином, химерний токсин містить принаймні приблизно 50 % повнорозмірного білка Cry1Fa токсину Bt. Цей білок має довжину, що звичайно складає принаймні приблизно 590 амінокислот. Що стосується частини протоксину, то повнорозмірна ділянка частини протоксину Cry1Ab тягнеться від кінця частини корового токсину до С-кінця молекули. Гени і токсини. Гени і токсини, що використовуються у даному винаході, включають не тільки описані тут повнорозмірні послідовності, але також і фрагменти цих послідовностей, варіанти, мутанти і гібридні білки, які зберігають характерну пестицидну активність токсинів, конкретно описаних у даній заявці. Використовувані тут терміни "варіанти" або "модифікації" генів означають нуклеотидні послідовності, які кодують ті ж самі токсини або токсини, еквівалентні токсинам, що мають пестицидну активність. Використовуваний тут термін "еквівалентні токсини" означає токсини, що мають такий же або, по суті, таку ж біологічною активністю проти шкідниківмішеней, як і заявлені токсини. Використовувані тут межі ідентичності становлять приблизно 95 % (Cry1F і Vip3Ab), 78 % (Cry1F і Vip3Ab) і 45 % (Cry1 і Vip3) відповідно до "змін номенклатури для пестицидних кристалічних білків Bacillus thuringiensis" ("Revision of the Nomenclature for the Bacillus thuringiensis Pesticidal Crystal Proteins", N. Crickmore, D.R. Zeigler, J. Feitelson, E. Schnepf, J. Van Rie, D. Lereclus, J. Baum, and D.H. Dean. Microbiology and Molecular Biology Reviews (1998) Vol 62: 807-813). Такі межі можуть бути також застосовані тільки для корових токсинів (наприклад, для Cry1Fа). Для фахівців у даній галузі очевидно, що гени, що кодують активні токсини, можуть бути ідентифіковані та одержані декількома способами. Специфічні гени або частини генів, описані в даній заявці, можуть бути одержані з ізолятів, депонованих у депозитаріях культур. Ці гени або їхні частини або варіанти можуть бути також сконструйовані шляхом синтезу, наприклад, на синтезаторі генів. Варіанти генів можуть бути легко сконструйовані стандартними методами одержання точкових мутацій. Крім того, фрагменти цих генів можуть бути одержані з використанням комерційно доступних екзонуклеаз або ендонуклеаз відповідно до стандартних процедур. Так, наприклад, для систематичного відщепленні нуклеотидів від кінців цих генів можуть бути використані ферменти, такі як Bal31, або може бути застосований сайт 5 UA 111934 C2 5 10 15 20 25 30 35 40 45 спрямований мутагенез. Гени, що кодують активні фрагменти, можуть бути також одержані з використанням різних ферментів, що рестрикціюють. Для безпосереднього одержання активних фрагментів цих білків-токсинів можуть бути використані протеази. Фрагменти та еквіваленти, які зберігають пестицидну активність описаних тут токсинів, входять до обсягу даного винаходу. Крім того, внаслідок надмірності генетичного коду, ряд різних послідовностей ДНК може кодувати описані тут амінокислотні послідовності. Фахівець у даній галузі може легко одержати такі альтернативні послідовності ДНК, що кодують ті ж самі або, по суті, ті ж самі токсини. Такі варіанти послідовностей ДНК входять до обсягу даного винаходу. Використовуваний тут термін послідовності "по суті, ті ж самі" означає послідовності, що мають амінокислотні заміни, делеції, додавання або інсерції, які фактично не надають впливу на пестицидну активність. У це визначення також входять фрагменти генів, що кодують білки, що зберігають пестицидну активність. Іншим методом ідентифікації генів, що кодують токсини і частини генів, що використовуються у даному винаході, є застосування олігонуклеотидних зондів. Такими зондами є детектовані нуклеотидні послідовності. Ці послідовності можуть бути детектовані за допомогою відповідної мітки, або вони можуть бути спочатку зроблені флуоресцентними, як описано в Міжнародній заявці № WO93/16094. Фахівцям добре відомо, що якщо молекула-зонд і зразок нуклеїнової кислоти гібридизуються за допомогою утворення міцного зв'язку між двома молекулами, то розумно передбачити, що такий зонд і зразок будуть мати значну гомологію. Гібридизацію, переважно, проводять у жорстких умовах із застосуванням методів, добре відомих фахівцям, наприклад, описаних Keller, G. Н., M. M. Manak (1987) DNA Probes, Stockton Press, New York, N.Y., pp. 169-170. Нижче наводяться деякі приклади комбінацій концентрацій солі і температур (в порядку зростання жорсткості): 2 SSPE або SSC при кімнатній температурі; 1 SSPE або SSC при 42 °C; 0,1 SSPE або SSC при 42 °C; 0,1 SSPE або SSC при 65 °C. Детектування зонда являє собою відомий метод, що застосовується для того, щоб визначити, відбувається гібридизація чи ні. Такий аналіз з використанням зонда являє собою швидкий метод ідентифікації токсин-кодуючих генів згідно з винаходом. Нуклеотидні сегменти, що використовуються як зонди згідно з винаходом, можуть бути синтезовані на синтезаторі ДНК відповідно до стандартних процедур. Ці нуклеотидні послідовності можуть бути також використані в якості ПЛР-праймерів для ампліфікації генів згідно з винаходом. Варіанти токсинів. Деякі токсини згідно з винаходом конкретно описані в даній заявці. Оскільки ці токсини наводяться тут просто як приклади токсинів згідно з винаходом, то потрібно зазначити, що даний винахід включає варіанти токсинів або еквівалентні токсини (і нуклеотидні послідовності, що кодують еквівалентні токсини), які мають таку ж пестицидну активність, як і представлений тут токсин, або аналогічну активність. Еквівалентні токсини мають амінокислотну послідовність, гомологічну амінокислотній послідовності представленого тут токсину. Така гомологія амінокислотних послідовностей звичайно складає більш ніж 75 %, переважно, більш ніж 90 %, а найпереважніше, більше, ніж 95 %. Гомологія амінокислотних послідовностей є найвищою в критичних ділянках токсину, відповідальних за біологічну активність або що визначають тримірну конфігурацію, яка, зрештою, відповідальна за біологічну активність. Відповідно до цього, деякі амінокислотні заміни є допустимими і можуть бути присутніми в тих ділянках, які не відіграють важливої ролі в надаванні активності, або є консервативними амінокислотними замінами, які не впливають на тримірну конфігурацію молекули. Так, наприклад, амінокислоти можуть бути поділені на наступні класи: неполярні, незаряджені полярні, основні і кислотні. Таким чином, при консервативних замінах, амінокислоту одного класу замінюють іншою амінокислотою того ж типу, і така заміна входить до обсягу даного винаходу, за умови, що вона, фактично, не буде впливати на біологічну активність сполуки. Нижче наданий список прикладів амінокислот, що належать до кожного класу. 50 Таблиця 1 Клас амінокислот Неполярні Незаряджені полярні Кислотні Основні Приклади амінокислот Ala, Val, Leu, Ile, Pro, Met, Phe, Trр Gly, Ser, Thr, Сys, Tyr, Asn, Gln Asр, Glu Lys, Arg, His У деяких випадках можуть бути також зроблені неконсервативні заміни. Важливим чинником є те, що такі заміни не повинні значно знижувати біологічну активність токсину. 6 UA 111934 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рекомбінантні хазяїни. Гени, що кодують токсини згідно з винаходом, можуть бути введені мікробним або рослинним хазяїнам широкого ряду. Експресія гена токсину призводить, прямо або опосередковано, до продукування пестициду всередині клітин і до його збереження в цих клітинах. Для одержання штаму Bt, що експресує обидва токсини згідно з винаходом, може бути застосований кон'югативне і рекомбінантне перенесення. Інші організми-хазяїни можуть бути також трансформовані одним або обома генами токсинів, що використовуються для досягнення синергічного ефекту. Із використанням придатних мікробів-хазяїнів, наприклад, Pseudomonas, ці мікроби можуть бути внесені в місця проживання шкідників, де вони можуть розмножуватися і поїдати ці мікроби. Це буде призводити до знищення шкідників. Альтернативно, мікроб, що містить ген токсину, може бути оброблений в умовах, сприяючих пролонгуванню активності токсину і стабілізації клітини. Оброблена клітина, яка зберігає токсичну активність, може бути потім внесена в середовище проживання шкідників-мішеней. Якщо ген токсину Bt вводять мікробу-хазяїну за допомогою придатного вектора, і якщо вказаний хазяїн вносять у середовище проживання в живому вигляді, то важливо, щоб були використані певні мікроби-хазяїни. При цьому, вибирають такі мікроорганізми-хазяїни, які, як відомо, займають певну "фітосферу" (філоплан, філосферу, ризосферу і/або ризоплан) одного або декількох культур, що становлять інтерес. Ці мікроорганізми вибирають так, щоб вони мали здатність успішно конкурувати в конкретних умовах (у культурі і в іншому середовищі проживання комах) із мікроорганізмами дикого типу, і забезпечували стабільне збереження та експресію генів, що кодують поліпептид-пестицид, а бажано, кращий захист пестициду від руйнування та інактивації в умовах навколишнього середовища. Відомо, що велике число мікроорганізмів мешкає на філоплані (на поверхні листя рослин) і/або на ризосфері (у ґрунті, що оточує коріння рослин) цінних сільськогосподарських культур широкого ряду. Такими мікроорганізмами є бактерії, водорості і гриби. Особливий інтерес представляють такі мікроорганізми, як бактерії, наприклад, бактерії роду Pseudomonas, Erwinia, Serratia, Klebsiella, Xanthomonas, Streptomyces, Rhizobium, Rhodopseudomonas, Methylophilius, Agrobactenum, Acetobacter, Lactobacillus, Arthrobacter, Azotobacter, Leuconostoc і Alcaligenes; гриби, а зокрема, дріжджі, наприклад, дріжджі роду Saccharomyces, Cryptococcus, Kluyveromyces, Sporobolomyces, Rhodotorula і Aureobasidium. Особливий інтерес представляють такі види бактерій фітосфер, як Pseudomonas syringae, Pseudomonas fluorescens, Serratia marcescens, Acetobacter xylinum, Agrobactenium tumefaciens, Rhodopseudomonas spheroides, Xanthomonas campestris, Rhizobium melioti, Alcaligenes entrophus і Azotobacter vinlandii; і дріжджів-фітосфер, таких як Rhodotorula rubra, R. glutinis, R. marina, R. aurantiaca, Cryptococcus albidus, З. diffluens, З. laurentii, Saccharomyces rosei, S. pretoriensis, S. cerevisiae, Sporobolomyces roseus, S. odorus, Kluyveromyces veronae і Aureobasidium pollulans. Особливий інтерес представляють пігментовані мікроорганізми. Для введення гена Bt, що кодує токсин, мікроорганізму-хазяїну в умовах, що забезпечують стабільне збереження гена і стабільну експресію гена, можуть бути застосовані методи широкого ряду. Такі методи добре відомі фахівцям у даній галузі та описані, наприклад, у патентіСША No. 5135867, який вводиться в даний опис за допомогою посилання. Обробка клітин. Bacillus thuringiensis або рекомбінантні клітини, що експресують токсини Bt, можуть бути оброблені з метою пролонгування активності токсину і стабілізації клітин. Пестицидна мікрокапсула, що утворюється, містить токсин або токсини Bt у клітинній структурі, яка стабілізує і захищає токсин у випадку, коли цю мікрокапсулу вносять у середовище проживання шкідника-мішені. Придатними клітинами-хазяїнами можуть бути прокаріоти або еукаріоти, і такими клітинами звичайно є, але не обмежуються ними, клітини, які не продукують речовини, що є токсичними для вищих організмів, таких як ссавці. Однак можуть бути також використані мікроорганізми, які продукують речовини, токсичні для вищих організмів, але, при цьому, ці токсичні речовини є нестабільними, або рівень їх введення є досить низьким, що виключає можливість будь-якого токсичного впливу на ссавця-хазяїна. Як хазяїни, особливий інтерес становлять прокаріоти і нижчі еукаріоти, такі як гриби. Оброблювані клітини звичайно є інтактними і, по суті, знаходяться в проліферативній формі, а не у формі спор, хоча, у деяких випадках можуть використовуватися і спори. Обробка мікробних клітин, наприклад, мікробів, що містять ген або гени токсину Bt, може бути здійснена хімічними і/або фізичними методами, або комбінацією хімічних і фізичних методів, за умови, що такий метод не буде чинити негативний вплив на властивості токсину і не буде призводити до зниження здатності клітин захищати токсин. Прикладами хімічних реагентів є галогенуючі агенти, а зокрема, галогени з атомними номерами 17-80. Конкретніше, може бути використаний йод у м'яких реакційних умовах протягом певного періоду часу, достатнього для досягнення бажаних результатів. Іншими придатними методами є обробка альдегідами, такими 7 UA 111934 C2 5 10 15 20 25 30 35 40 45 50 55 60 як глутаральдегід; протиінфекційними агентами, такими як хлорид зефірану і хлорид цетилпіридинію; спиртами, такими як ізопропіловий спирт і етанол; різними гістологічними фіксаторами, такими як йод Люголя, фіксатор Боуїна; різні кислоти і фіксатор Хеллі (див: Humason, Gretchen L., Animal Tissue Techniques, W. H. Freeman and Company, 1967); або комбінацією фізичного методу (нагрівання) і хімічних агентів, які зберігають і пролонгують активність токсину, продукованого в клітинах, введених у середовище проживання хазяїна. Прикладами фізичних методів є короткохвильове випромінювання, таке як гаммавипромінювання і рентгенівське випромінювання, заморожування, УФ-випромінювання, ліофілізація і т.ін. Методи обробки мікробних клітин описані в патентах США №№ 4695455 і 4695462, які вводяться в даний опис за допомогою посилання. Ці клітини звичайно мають підвищену структурну стабільність, що призводить до збільшення резистентності до умов навколишнього середовища. Якщо пестицид присутній у формі попередника, то спосіб обробки клітин повинен бути вибраний так, щоб він не призводив до інгібування процесингу попередника з утворенням зрілої форми пестициду під дією патогену шкідника-мішені. Так, наприклад, формальдегід буде забезпечувати перехресне зшивання з білками, і тим самим інгібувати процесинг попередника поліпептидного пестициду. Спосіб обробки повинен зберігати принаймні значний ступінь біологічної доступності або біологічної активності токсину. Властивостями, що становлять особливий інтерес для продукування при виборі клітинихазяїна, є простота введення гена або генів Bt хазяїну, доступність експресійних систем, ефективність експресії, стабільність пестициду в хазяїні і наявність додаткових генетичних ознак. Технологічними властивостями, що становлять інтерес пестицидних мікрокапсул є їхня протективна здатність стосовно пестициду, наприклад, товщина клітинних стінок, пігментація і внутрішньоклітинна упаковка або здатність утворювати тільця включення; виживаність у водному середовищі; відсутність токсичності для ссавців; привабливість із точки зору поїдання шкідниками; простота утилізації; фіксація без пошкодження токсину і т.ін. Іншими розглядуваними властивостями є простота приготування препарату і його транспортування, матеріальні витрати, стабільність при збереженні і т.ін. Культивування клітин. Клітини-хазяїни, що містять інсектицидний ген або гени Bt, можуть бути вирощені в будь-якому придатному поживному середовищі, в якому ДНК-конструкція буде забезпечувати селективну перевагу, тобто, забезпечувати селективне середовище, в якому всі або майже всі клітини будуть зберігати ген Bt. Потім ці клітини можуть бути зібрані звичайними способами. Альтернативно, ці клітини можуть бути оброблені до їхнього збору. Клітини Bt, що продукують токсини згідно з винаходом, можуть бути культивовані з використанням стандартних середовищ і методом ферментації. Після завершення циклу ферментації, бактерії можуть бути зібрані спочатку шляхом відділення спор і кристалів Bt від бульйону, що збродив, стандартними методами. Виділені спори і кристали Bt можуть бути приготовані у вигляді змочуваного порошку; рідкого концентрату; гранул або інших препаратів, одержаних шляхом додавання поверхнево-активних речовин, диспергуючих речовин, інертних носіїв та інших компонентів, що полегшує транспортування та обробку ними конкретних шкідників-мішеней. Такі процедури приготування і застосування добре відомі фахівцям. Препарати. Приготовані гранули-приманки, що містять атрактант і спори, кристали і токсини ізолятів Bt, або рекомбінантні мікроби, що містять гени, одержані з описаних тут ізолятів Bt, можуть бути внесені в ґрунт. Приготований продукт може бути застосований у вигляді покриття, що наноситься на насіння, або препарату для обробки коріння або всієї рослини на останніх стадіях циклу вирощування сільськогосподарської культури. Для обробки рослин і ґрунту, клітини Bt можуть бути приготовані у вигляді змочуваних порошків, гранул або дустів, шляхом змішування з різними інертними матеріалами, такими як неорганічні мінеральні речовини (філосилікати, карбонати, сульфати, фосфати і т.ін.) або рослинні матеріали (подрібнені в порошок качани кукурудзи, рисове лушпиння, шкаралупа волоського горіха і т.ін.). Такі препарати можуть включати ад'юванти типу "розпилювачів-зв'язуючих речовини", що стабілізують агенти, інші пестицидні добавки або поверхнево-активні речовини. Рідкі препарати можуть бути водними або безводними, і можуть бути використані у вигляді пін, гелів, суспензій, емульгованих концентратів або т.ін. Інгредієнтами можуть бути реологічні агенти, поверхневоактивні речовини, емульгатори, диспергуючі речовини або полімери. Як відомо фахівцям у даній галузі, концентрація пестициду може значно варіюватися залежно від природи конкретного препарату, а зокрема, залежно від того, чи використовується він у вигляді концентрату або в чистому вигляді. Пестицид складає принаймні 1 % за масою, а може становити 100 % за масою. Сухі препарати можуть становити приблизно 1-95 % за масою пестициду, а рідкі препарати звичайно становлять приблизно 1-60 % за масою твердих речовин 8 UA 111934 C2 5 10 15 20 25 30 35 40 45 50 55 у рідкій фазі. Ці препарати звичайно містять приблизно від 102 до 104 клітин/мг. Ці препарати можуть бути введені в кількості приблизно від 50 мг (у рідкому або в сухому вигляді) до 1 кг або більше на гектар. Препарати можуть бути внесені в середовище проживання лускокрилих шкідників, наприклад, нанесені на листя або ґрунт шляхом розпилення, обпилювання, зрошування або т.ін. Трансформація рослин. Переважними рекомбінантними хазяїнами, які можуть бути використані для продукування інсектицидних білків згідно з винаходом, є трансформовані рослини. Гени, що кодують описані тут білки токсинів Bt, можуть бути введені в рослинні клітини із застосуванням різних методів, добре відомих фахівцям. Так, наприклад, існує велике число клонуючих векторів, що містять систему реплікації в Escherichia coli, і маркер, що дозволяє провести відбір трансформованих клітин, і ці вектори можуть бути використані з метою одержання препарату для інсерції чужорідних генів у вищі рослини. Вектори містять, наприклад, inter alia pBR322, серії pUC, серії M13mp, pACYC184. Відповідно до цього, ДНК-фрагмент, що має послідовність, яка кодує білок токсину Bt, може бути вбудована у вектор у придатний рестрикційний сайт. Отриману плазміду використовують для трансформації Е. coli. Клітини E. coli культивують у придатному поживному середовищі, а потім збирають і піддають лізису. Потім цю плазміду виділяють. Методами аналізу звичайно є аналіз послідовності, рестрикційний аналіз, електрофорез та інші методи, що застосовуються в біохімії і молекулярній біології. Після кожної маніпуляції використовувана послідовність ДНК може бути розщеплена і приєднана до наступної послідовності ДНК. Кожна послідовність плазміди може бути клонована в одній і тій же або в інших плазмідах. Залежно від методу вбудовування потрібних генів у рослину, можуть виявитися необхідними й інші послідовності ДНК. Так, наприклад, якщо плазміду Ti або Ri використовують для трансформації клітин рослини, то принаймні праву межу, а в більшостівипадків, праву і ліву межу Т-ДНК-плазміди Ti або Ri приєднують у ролі фланкуючої ділянки генів, що вбудовуються. Використання Т-ДНК для трансформації клітин рослин було ретельно досліджене і детально описане в EP 120516, Lee and Gelvin (2008), Hoekema (1985), Fraley et al., (1986), і An et al., (1985), і добре відомо фахівцям. Після інтеграції вбудованої ДНК у геном рослини, така ДНК стає відносно стабільною. Трансформуючий вектор звичайно містить селективний маркер, що надає трансформованим клітинам рослини резистентність до біоциду або антибіотика, таких як біалафос, канаміцин, G418, блеоміцин або гігроміцин, inter alia. Із використанням окремо узятого маркера можна, відповідно, здійснювати добір трансформованих клітин, а не клітин, що не містять убудовану ДНК. Існує багато методів, що є придатними для вбудовування ДНК у клітини рослин-хазяїнів. Такими методами є трансформація молекулою T-ДНК із використанням Agrobacterium tumefaciens або Agrobacterium rhizogenes як трансформуючих агентів, зливання, інжекція, біобалістичні методи (бомбардування мікрочастинками) або електропорацію, а також інші можливі методи. Якщо для трансформації використовуються агробактерії, то ДНК, що вбудовується, клонують у конкретні плазміди, а саме, у проміжний вектор або у бінарний вектор. Проміжні вектори можуть бути інтегровані в плазміду Ti або Ri за допомогою гомологічної рекомбінації з використанням послідовностей, гомологічних до послідовностей, що є присутніми у T-ДНК. Плазміда Ti чи Ri також містить ділянку vir, необхідну для переносу T-ДНК. Проміжні вектори не можуть самі реплікуватися в агробактеріях. Проміжний вектор може бути перенесений у Agrobacterium tumefaciens за допомогою хелперної плазміди (кон'югування). Бінарні вектори можуть самі реплікуватися як у E. coli, так і в агробактеріях. Вони містять селективний маркерний ген і лінкер або полілінкер, що замикають праву і ліву межові ділянки TДНК. Вони можуть бути трансформовані безпосередньо в агробактерії (Holsters et al., ділянку vir. Ділянка vir необхідна для переносу T-ДНК у клітину рослини. Може також бути присутньою і додаткова T-ДНК. Трансформовану в такий спосіб бактерію використовують для трансформації клітин рослин. Рослинні експлантати можуть бути переважно культивовані з Agrobacterium tumefaciens або Agrobacterium rhizogenes для переносу ДНК у клітину рослини. Потім цілі рослини можуть бути вирощені з інфікованого рослинного матеріалу (наприклад, зі шматочків листя, сегментів стебел, коренів, а також протопластів або клітин, культивованих суспензійним методом) у придатному середовищі, що може містити антибіотики або біоциди для добору. Потім вирощені в такий спосіб рослини можуть бути протестовані на присутність вбудованої ДНК. У випадку інжекції і електропорації, будь-яких спеціальних вимог до одержання плазмід не пред'являється. При цьому, можуть бути використані стандартні плазміди, такі як, наприклад, похідні pUC. 9 UA 111934 C2 5 10 15 20 25 30 35 40 45 50 55 Трансформовані клітини розвиваються в рослині як звичайно. Вони можуть утворювати зародкові клітини і передавати трансформований(і) ознаку(и) потомству. Такі рослини можуть бути вирощені звичайним способом і схрещені з рослинами, що мають трансформовані наслідувані фактори або інші наслідувані фактори. Одержані гібридні рослини мають придатні фенотипічні властивості. У переважному варіанті винаходу, рослини трансформують генами, у яких зустрічальність кодонів оптимізована для рослин. Див., наприклад, патент США № 5380831, що вводиться в даний опис за допомогою посилання. Хоча в даній заявці описані деякі зрізані токсини, однак, фахівцям із Bt добре відомо, що токсини, що належать до типу токсинів довжиною 130 кДа (повнорозмірні), мають N-кінцеву половину, що являє собою коровий токсин, і С-кінцеву половину, що являє собою протоксиновий "хвіст". Таким чином, відповідні "хвости" можуть бути використані разом з зрізаними/коровими токсинами відповідно до винаходу. Див., наприклад, патент США № 6218188 і патент США № 6673990. Крім того, методи створення синтетичних генів Bt для їхнього використання в рослинах відомі фахівцям (Stewart and Burgin, 2007). Одним з необмежуючих прикладів переважної трансформованої рослини є фертильна рослина кукурудзи, що містить експресований у рослині ген, кодуючий білок Cry1Fa, а також другий експресований у рослині ген, кодуючий білок Vip3Ab. Перенос (або інтрогресія) Cry1Fa- і Vip3Ab-детермінованого(их) ознаки (ознак) в інбредні лінії кукурудзи може бути досягнуто шляхом рекурентного селективного схрещування, наприклад, зворотного схрещування. У цьому випадку, потрібну рекурентну рослину спочатку схрещують з інбредним донором (нерекурентною батьківською рослиною), що несе відповідний(і) ген(и), який надає(ють) Cry1F- і Vip3Ab-детерміновані ознаки. Потім потомство цього кроса піддають зворотному схрещуванню з рекурентною рослиною з наступним відбиранням одержаного потомства на потрібну(і) ознаку(и), перенесену(і) від нерекурентної батьківської рослини. Через три, переважно, чотири, а ще більш переважно, через п'ять або більш поколінь "бекросів" з рекурентною батьківською рослиною з відбиранням на потрібну(і) ознаку(и), потомство буде гетерозиготним за локусами, що контролює перенесену(і) ознаку(и), але вона буде аналогічна до рекурентної батьківської рослини за більшістю або майже за всіма іншими генами (див., наприклад, Poehlman & Sleper (1995) Breeding Field Crops, 4th Ed., 172175; Fehr (1987) Principles of Cultivar Development, Vol. 1: Theory and Technique, 360-376). Стратегії вирощування культур, резистентних до комах (IRM). Наприклад, Roush і співробітниками були описані стратегії з використанням двох токсинів, також називані створенням "пірамід" або "кластерів" для вирощування трансгенних культур, що мають інсектицидні властивості. (The Royal Society. Phil. Trans. R. Soc. Lond. B. (1998) 353, 1777-1786). На web-сайті Агентства США із захисту навколишнього середовища (epa.gov/oppbppdl/biopesticides/pips/bt_corn_refuge_2006.htm) опубліковані наступні вимоги із забезпечення площ-захистків із нетрансгенними культурами (тобто, не-Bt) культурами (земельної ділянки із сільськогосподарськими не-Bt-культурами/кукурудзою) для їхнього використання під трансгенні культури, продукуючі один білок Bt, що має активність проти шкідників-мішеней. "Конкретними структурними вимогами до продуктів з Bt-кукурудзи (Cry1Ab або Cry1F), захищеної від кукурудзяного трача, є: Структурні площі-"сховища": 20 % площі-сховища під Bt-кукурудзу, не захищену від Лускокрилих у Кукурудзяному поясі; 50 % площі-сховища під Bt-бавовник, не захищений від Лускокрилих у Бавовняному поясі; Блоки: Внутрішні (тобто, у полях із Bt) Зовнішні (тобто, окремі поля у межах ½ милі (за можливості ¼ милі) від Bt-поля для максимізації вільного схрещування) Смужки регулярно оброблюваних сільськогосподарських земель: Ці смужки повинні мати ширину принаймні в 4 ряди (переважно, 6 рядів) для зниження числа випадків міграції личинок". Крім того, Національна асоціація виробників кукурудзи, на своєму web-сайті (ncga.com/insect-resistance-management-fact-sheet-bt-corn) також опублікувала аналогічний посібник із вимог для площ-захистків. Так, наприклад: "Вимоги до IRM у випадку кукурудзяного трача: - Засівати принаймні 20 % акрів кукурудзою для збереження нетрансгенних гібридів - У регіонах вирощування бавовнику, повинне залишатися 50 % площі-сховища - Повинно бути засіяне 1/2 милі нетрансгенними гібридами 10 UA 111934 C2 5 10 15 20 25 30 35 40 45 50 55 60 - Площі-захистки можуть бути засіяні смугами на Bt-поля; площі-захистки повинні бути засіяні у вигляді смуг, що повинні мати ширину принаймні в 4 ряди - Площі-захистки можуть бути оброблені стандартними пестицидами тільки, якщо досягаються економічні пороги для комах-мішеней - Розпилювальні інсектициди на основі Bt не можуть бути використані на площах-сховищах під кукурудзу - Відповідний притулок повинен бути засіяний Bt-кукурудзою на кожній фермі". Як зазначали Roush і співробітники (наприклад, на сторінках 1780 і 1784 у правому стовпчику), кластери або піраміди з двох різних білків, кожен з яких є ефективним проти шкідників-мішеней із мінімальною перехресною резистентністю або з відсутністю такої резистентності, можуть бути використані на більш дрібних "сховищах" нетрансгенних рослин. Roush висловив припущення, що для успішного використання кластерів, площа-сховище, розмір якого складає менше ніж 10 %, може бути оброблена культурою з резистентністю, порівнянною з резистентністю культур, оброблюваної приблизно на 50 % площі-сховища для одного (непірамідного) токсину. Що стосується доступних у даний час продуктів з кукурудзи, що містять "пірамідні" Bt, то Агентство США із захисту навколишнього середовища вимагає, щоб значно менша (звичайно 5 %) площа структурного сховища була засіяна не-Bt кукурудзою, а не культурою з одним токсином (звичайно 20 %). Існують різні шляхи забезпечення IRM-ефектів використання площ-захистків, включаючи різні геометричні схеми засівів на полях (як згадувалося вище) і суміші насіння в одному пакеті, що також обговорюється Roush і ін. (див. вище), і в патенті США № 6551962. Вищевказані відсотки або аналогічні співвідношення площ-захистків можуть бути використані для розглянутих двокомпонентних або трикомпонентних кластерів або пірамід. Для трикомпонентних кластерів із трьома механізмами дії проти одного шкідника-мішені, сховищавзагалі бути не повинно (або наприклад, площа-сховище повинна бути меншою 5 %). Це особливо справедливо для площ під комерційні культури, наприклад, понад 10 акрів. Усі патенти, патентні заявки, попередні заявки і публікації або цитовані в них роботи у всій своїй повноті вводяться в даний опис за допомогою посилання в тому ступені, в якому вони відповідають детальному опису даної заявки. Якщо це не вказано або не мається на увазі конкретно, то використовувані тут артиклі "a", "an" і "the" означають "принаймні один". Нижче наводяться приклади, що ілюструють способи практичного здійснення даного винаходу. Ці приклади не повинні розглядатися як обмеження обсягу винаходу. Усі відсотки дані за масою, а всі співвідношення сумішей розчинників дані за об'ємом, якщо це не обговорено особливо. Усі температури дані в градусах Цельсія. ПРИКЛАДИ Приклад 1 - Короткий опис прикладів У наданих нижче прикладах показано, що Vip3Ab1 має активність проти личинок Spodoptera frugiperda (совки трав'яної) дикого типу і проти зібраного на полях штаму Spodoptera frugiperda, що був виявлений у Пуерто-Ріко, і який є резистентним до кристалічного токсину Cry1Fa Bacillus thuringiensis. Ці біологічні дані підтвержують, що Vip3Ab1 може бути використаний для запобігання розвитку резистентності комах до Cry1, оскільки комахи, в яких розвивається резистентність до токсинів Cry1Fa, залишаються чутливими до токсичності Vip3Ab1. 125 Аналогічним чином, у Spodoptera frugiperda, I-мічений Cry1Fa зв'язується з білкамирецепторами, і таке зв'язування може бути витиснуте з використанням нерадіоактивного 125 Cry1Fa. Однак, у цих експериментах було показано, що Vip3Ab1 не може витісняти I-Cry1Fa при зв'язуванні з його рецептором. Ці результати показали, що Vip3Ab1 має унікальний сайт зв'язування в порівнянні з Cry1Fa. Здатність Vip3Ab1 виробляти токсичність проти комах, що є резистентними до Cry1Fa, обумовлена його нездатністю взаємодіяти із сайтом, з яким зв'язуються ці токсини. Є й інші дані, що зазначають на те, що природа резистентності Spodoptera frugiperda до Cry1Fa обумовлена нездатністю Cry1Fa зв'язуватися з BBMV, виділеними з цієї комахи. Біологічна активність Vip3Ab1 проти Cry1Fa-резистентних личинок S. frugiperda, що втрачає свою здатність зв'язуватися з Cry1Fa, також підтверджує відсутність взаємодії Vip3Ab1 із сайтом-мішенню, на відміну від Cry1Fa. Приклад 2 - Очищення і процесинг білків Cry1Fa і Vip3Ab1 трипсином Гени, що кодують протоксини Cry1Fa і Vip3Ab1, були експресовані в експресійних штамах Pseudomonas fluorescens, а повнорозмірні білки були виділені у вигляді нерозчинних тілець включення. Промиті тільця включення солюбілізували шляхом перемішування при 37 °C у буфері, що містить 20 мМ буфера CAPS, p 11+10 мМ DDT+0,1 % 2-меркаптоетанолу, протягом 2 годин. Розчин центрифугували при 27000 g протягом 10 хвилин при 37 °C, і супернатант 11 UA 111934 C2 5 10 15 20 25 30 35 40 45 50 55 60 обробляли 0,5 % (мас/об) TCPK-оброблений трипсин (Sigma). Цей розчин інкубували при змішуванні протягом ще 1 години при кімнатній температурі, фільтрували, а потім завантажували на колонку Pharmacia Mono Q 1010, урівноважену 20 мм CAPS, p 10,5. Після промивання завантаженої колонки 2 колонковими об'ємами буфера, зрізаний токсин елюювали 15 колонковими об'ємами лінійного градієнта 0–0,5 M NaCl у 20 мм CAPS при швидкості потоку 1,0 мл/хв. Очищені трипсином зрізані білки Cry елюювали приблизно при 0,2-0,3 M NaCl. Чистоту білків оцінювали за допомогою електрофорезу в ДСН-ПААГ і візуалізували з використанням кумасі брильянтового блакитного. У деяких випадках, об'єднані фракції очищеного токсину концентрували і завантажували на стовпчик з Superose 6 (діаметром 1,6 см, довжиною 60 см), а потім очищали за допомогою ексклюзивної хроматографії. Фракції, що містять одиночний пік мономера з відповідною молекулярною масою, поєднували і концентрували, у результаті чого одержували більш ніж 95 % гомогенний препарат білка, що має молекулярну масу приблизно 60000 кДа. Процесинг Vip3Ab1 досягався аналогічним чином, де як вихідний білок використовували очищений повнорозмірний білок масою 85 кДа (DIG-307), що постачається Monte Badger. Білок (12 мг) діалізували в 50 мм натрій-фосфатний буфер, pН 8,4, а потім обробляли шляхом додавання 1 мг твердого трипсину та інкубування протягом 1 години при кімнатній температурі. Розчин завантажували на аніонообмінну колонку MonоQ (діаметром 1 см, довжиною 10 см), і елюювали 7 колонковими об'ємами лінійного градієнта NaCl від 0 до 500 мМ у 20 мМ натрійфосфатного буфера, pН 8,4. Моніторинг елюювання білка здійснювали за допомогою електрофорезу в ДСН-ПААГ. Головна смуга процесованого білка мала молекулярну масу 65 кДа, як було визначено за допомогою електрофорезу в ДСН-ПААГ із використанням стандартів молекулярної маси для порівняння. Приклад 3 - Біоаналізи комах Очищені білки тестували на інсектицидну активність у біоаналізах, проведених із використанням личинок Spodoptera frugiperda (J.E. Smith), що тільки що вилупилися, яким давали штучний корм для комах. Cry1F-резистентних FAW збирали на полях кукурудзи Herculex I (Cry1Fa) у Пуерто-Ріко, і поміщали в інсектарій Dow AgroSciences Insectary для безупинного розмноження. Характеризація цього резистентного штаму FAW описана в Міжнародному звіті Шленца та ін. (Schlenz et al., 2008). Біоаналізи комах проводили в 128-ямкових пластикових планшетах для біоаналізів комах (C-D International, Pitman, NJ). Кожна ямка містила 0,5 мл корму для лускокрилих багатьох видів (Southland Products, Lake Village, AR). 40 мкл-аліквоти очищеного білка Cry або Vip3Ab1, розведені до різних концентрацій у 10 мМ CAPS, pН 10,5, або контрольний розчин наносили 2 2 піпеткою на поверхню в 1,5 см кожної ямки з кормом (26,7 мкл/см ). Було протестовано 16 ямок на зразок. Негативний контроль являв собою буферний розчин, що не містить білка. Позитивний контроль включав препарати Cry1F. Оброблені ямки витримували у витяжній шафі доти, поки рідина на поверхні корму не випаровувалася або не абсорбувалася в цьому кормі. Протягом декількох годин розмноження, окремі личинки збирали зволоженою щіткою з верблюжої вовни і поміщали на оброблений корм, одну личинку на ямку. Потім заражені ямки герметично закривали клейкими прозорими пластиковими пластинами, і оснащували отвором для газообміну (C-D International). Планшети для біоаналізу витримували в регульованих умовах навколишнього середовища [28 °C, відносна вологість (ВВ) приблизно 40 %, 16 год.:8 год. (день:ніч)]. Через 5 днів реєстрували загальне число комах, оброблених кожним зразком білка, число загиблих комах і масу комах, що вижили. Приклад 4 - Йодування токсинів Cry1Fa Повідомлялося, що Cry1F впливає на токсичність і зв'язувальну здатність цього білка, як показав тест, проведений із використанням личинок тютюнової листовійки і BBMV, виділених у цих комах (Luo et al., 1999; Sheets and Storer, 2001). Така інактивація, приблизно, обумовлена потребою в присутності не модифікованих тирозинових залишків поруч із сайтом зв'язування білка. При проведенні реакції йодування Cry1F методом із використанням йодовмісних сфер, білок повністю втрачає свою здатність специфічно зв'язуватися з BBMV, одержаними від H. virescens. При застосуванні нерадіоактивного Na для йодування Cry1F, проведеного методом з використанням йодовмісних сфер, було виявлено, що йодований Cry1F також втрачає свою інсектицидну активність проти H. virescens. Більш ранні дослідження, проведені заявниками у своїй лабораторії, показали, що Cry1Fa може бути флуоресцентно позначений кон'югованими з малеїмідом реагентами для мічення, що специфічно алкілують білки в положеннях цистеїнових залишків. Оскільки оброблений трипсином коровий токсин Cry1Fa містить один цистеїновий залишок у положенні 205, те мічення білка таким реагентом приводить до алкілування білка в одному специфічному сайті. 12 UA 111934 C2 5 10 15 20 25 30 35 40 45 50 55 Було визначено, що Cry1Fa може бути флуоресцентно позначений флуоресцеїн-5-мелеімідом, і що мічений білок зберігає свою інсектицидну активність. Виходячи зі збереження біологічної активності Cry1Fa, міченого флуоресцеїном у положенні цистеїну, авторами даного винаходу було встановлено, що може бути також проведене радіоактивне йодування флуоресцентної частини мітки методом, описаним Palmer et al. (Palmer et al., 1997), і приєднання цієї мітки до цистеїну Cry1Fa, де вказаний радіоактивно мічений Cry1Fa зберігає свою біологічну активність. Флуоресцеїн-5-малеімід розчиняли в 10 мМ (4,27 мг/мл) у ДМСО, а потім розводили в 1 мМ -1 -1 у PBS, як було визначено за його коефіцієнтом молярної екстинкції 68000 M см . До 70 мкл 125 розчину PBS, що включає дві йодовмісних сфери, додавали 0,5 мКі Na- I, а потім закривали свинцевим кожухом. Цей розчин перемішували при кімнатній температурі протягом 5 хвилин, а потім додавали 10 мкл 1 мМ флуоресцеїн-5-малеімід. Реагенти залишали на 10 хвилин для проходження реакції, а потім видаляли з йодовмісних сфер. До розчину, що прореагував, додавали 2 мкг зрізаного та у високому ступені очищеного та обробленого трипсином корового токсину Cry1Fa у PBS. Білок інкубували з йодованим розчином флуоресцеїн-5-малеіміду протягом 48 годин при 4 °C. Реакцію завершували додаванням 2-меркаптоетанолу до 14 мМ. Потім, реакційну суміш додавали в центрифужну колонку Zebra, урівноважену в 20 мМ CAPS, 150 мМ KCl, pН 9, і центрифугували при 1500 g протягом 2 хвилин для відділення йодованого 125 барвника, що не прореагував, від білка. I-мічений флуоресцеїн-Cry1Fa підраховували на гамма-лічильнику для визначення питомої активності цієї сполуки, приблизно, у розрахунку на то, що кількість цієї сполуки буде складати 80 % від кількості вихідного токсину. Білок також характеризували за допомогою електрофорезу в ДСН-ПААГ і візуалізували шляхом флуоресцентної візуалізації для того, щоб переконатися, що виміряна радіоактивність ковалентно зв'язана з білком Cry1Fa. Приклад 5 - Одержання і фракціонування солюбілізованих BBMV Стандартні методи кількісної оцінки білка та електрофорезу в поліакриламідному гелі з ДСН здійснювали, наприклад, як описано в керівництві Сембрука та ін. (Sambrook and Russell, 2001) і в більш пізніх виданнях. Личинки S. frugiperda в останній віковій стадії витримували в умовах голодування протягом ночі, а потім, після охолодження на льоді протягом 15 хвилин, розкривали. Тканину середньої частини кишечнику видаляли з порожнини тіла, а задню частину кишечнику залишали приєднаною до покривного шару. Середню частину кишечнику поміщали в 9 об'ємів охолодженого льодом гомогенізуючого буфера (300 мМ маніт, 5 мМ EGTA, 17 мМ основи трис, pН 7,5), в який була додана суміш інгібіторів протеази (Sigma-Aldrich P-2714), розведена відповідно до рекомендації постачальників. Тканину гомогенізували 15 імпульсами, подаваними скляним гомогенізатором тканини. BBMV одержували методом MgCl2-преципітації, описаним Вольферсбергером (Wolfersberger, 1993). Коротко, рівний об'єм 24 мМ розчину MgCl 2 у 300 мМ маніту змішували з гомогенатом, виділеним із середньої частини кишки, перемішували протягом 5 хв і залишали на льоді на 15 хвилин. Розчин центрифугували при 2500 g протягом 15 хвилин при 4 °C. Супернатант зберігали, і осад суспендували у вихідному об'ємі 0,5 розведеного гомогенізуючого буфера, а потім знову центрифугували. Два супернатанти поєднували і центрифугували при 27000 g протягом 30 хвилин при 4 °C з одержанням фракції BBMV. Осад суспендували в буфері для збереження BBMV (10 мм HEPES, 130 мм KCl, 10 % гліцерин, p 7,4) до одержання концентрації білка приблизно 3 мг/мл. Концентрацію білка визначали з використанням BSA як стандарт. Перед заморожуванням зразків визначали L-лейцин-п-нітроанілід-амінопептидазну активність (ферменту-маркера для фракції BBMV). Коротенько, 50 мкл L-лейцин-п-нітроаніліду (1 мг/мл у PBS) додавали в 940 мл 50 мм трис-HCl у стандартну кювету. Цю кювету поміщали в спектрофотометр Cary 50 Bio, установлений на нуль для зчитування оптичної густини на довжині хвилі 405 нм, і реакцію ініціювали додаванням 10 мкл або гомогенату середньої частини кишки комахи, або BBMV-препарату, одержаного від комахи. Потім проводили моніторинг збільшення оптичної густини на 405 нм протягом 5 хвилин при кімнатній температурі. Питому активність гомогенату і BBMV-препаратів визначали за кінетикою зростання оптичної густини протягом періоду часу, за який спостерігалося лінійне зростання оптичної густини, на одиницю загального білка, використовуваного в аналізі, за наступним рівнянням: OD/(хв•мг) = швидкість збільшення кількості амінопептидази (OD/мл•хв/[білок] (мг/мл) Питома активність цього ферменту звичайно в 7 разів вища, ніж активність, що спостерігається в початковій фракції гомогенату середньої кишки. BBMV розділяли на 250 мклаліквоти, швидко заморожували в рідкому N2 і зберігали при -80 °C. Приклад 6 - Електрофорез 13 UA 111934 C2 5 10 15 20 25 30 35 40 Аналіз білків за допомогою електрофорезу в ДСН-ПААГ проводили в відновних умовах (тобто, в 5 % β-меркаптоетанолі, BME) і в денатуруючих умовах (тобто, при нагріванні протягом 5 хвилин, при 90 °C у присутності 4 % ДСН). Білки завантажували на ямку з 4-20 % трисгліциновим поліакриламідним гелем (BioRad; Hercules, CA) і розділяли під напругою 200 вольт протягом 60 хвилин. Смуги білка детектували шляхом забарвлювання кумасі діамантовим блакитним R-250 (BioRad) протягом однієї години, і знебарвлювали розчином 5 % метанолу в 7 % оцтовій кислоті. Гелі візуалізували та аналізували на візуалізаторі BioRad Fluro-S Multi Imager™. Відносні молекулярні маси смуг білка визначала шляхом порівняння з рухливістю білків із відомою молекулярною масою, що спостерігаються в зразку ледера білка BenchMark™ (Invitrogen, Carlsbad, CA), завантаженого на одну ямку гелю. Приклад 7 - Візуалізація Радіоактивну чистоту йодованих білків Cry і радіоактивність Cry1Fa в аналізах на інгібування визначали за допомогою електрофорезу в ДСН-ПААГ і візуалізації флуоресцентним методом. Коротко, ДСН-ПААГ-гелі візуалізували шляхом обгортання гелів у плівку Mylar (товщиною 12 мкм), а потім, після розділення і фіксації білка, гель експонували під флуоресціюючим екраном з накопиченням Molecular Dynamics (35 см 43 см) принаймні протягом ночі і до 4 днів. Планшети виявляли за допомогою флуоресцентного визуалізатора Molecular Dynamics Storm 820, і зображення аналізували за допомогою комп'ютерної програми ImageQuant™. Приклад 8 - Стислий опис результатів Результати із знищення комах, одержані в біоаналізах повнорозмірного білка Vip3Ab1, протестованого в різних дозах на його дію проти личинок S. frugiperda дикого типу і Cry1Faрезистентних личинок S. frugiperda, представлені на фіг. 1. Загибель личинок S. frugiperda 2 дикого типу становила 100 % при самій високій концентрації (9000 нг/см ), що тестується, а при 2 більш низьких дозах, відсоток загибелі був нижчим. LC50 оцінювали приблизно при 2000 нг/см . Vip3Ab1 виявився у високому ступені ефективним відносно інгібування росту личинок S. frugiperda, при цьому більше, ніж 95 % інгібування росту спостерігалося при концентраціях 1000 2 нг/см і вище. Високий рівень інгібування росту, що спостерігається для личинок S. frugiperda обох типів, дозволяє передбачити, що відсоток загибелі цих комах, ймовірно, буде зростати під дією цього білка протягом більш тривалого періоду часу. Був також проведений біоаналіз для порівняння біологічної активності Vip3Ab1 проти S. frugiperda дикого типу і проти Cry1Fa-резистентної S. frugiperda (фіг. 1). Відсоток інгібування росту наданий вертикальними стовпцями, а відсоток загибелі комах наданий ромбами. Загибель комах, що вимірюється протягом 5 днів після впливу токсину, була нижче на 50 % для комах обох типів при всіх концентраціях, що тестуються. При цьому, спостерігалася явна залежність інгібування росту від дози. Vip3Ab1 давав >95 % інгібування росту Cry1Fa-чутливих і 2 Cry1Fa-резистентних личинок S. frugiperda при концентрації вище за 1000 нг/см , і приблизно 2 50 % інгібування росту личинок S. frugiperda дикого типу при концентрації приблизно 40 нг/см . Vip3Ab1 давав більш, ніж 50 % інгібування росту Cry1Fa-резистентних личинок S. frugiperda при 2 всіх концентраціях, що тестуються, де сама нижча концентрація становила 4,1 нг/см . Таким чином, Vip3Ab1 має високу активність проти Cry1Fa-резистентних личинок S. frugiperda. Були проведені повторні біоаналізи для одержання середніх летальних концентрацій (LC 50), і середніх ріст-інгібіруючих концентрацій (GI50). У таблиці 2 вказані GI 50 і 95 % довірчі інтервали, одержані при впливі Vip3Ab1 на Cry1Fa-чутливі і Cry1Fa-резистентні личинки Spodoptera frugiperda в порівнянні з контролем. 45 Таблиця 2 Комаха LC-50 95 % ДІ GI50 95 % ДІ FAW 3966,3 (2150,3-9406,6) 21,9 (18,5-25,6) Cry1Fa (позитивний 57,3 (43,6-77,4)
ДивитисяДодаткова інформація
Назва патенту англійськоюCombined use of vip3ab and cry1fa for management of resistant insects
Автори англійськоюMeade, Thomas, Narva, Kenneth, Storer, Nicholas, P., Sheets, Joel, J., Woosley, Aaron, T., Burton, Stephanie, L.
Автори російськоюМид Томас, Нарва Кеннет, Сторер Николас П., Шитс Джоел Дж., Вусли Аарон Т., Бертон Стэфани Л.
МПК / Мітки
МПК: A01H 5/10, C07K 14/325, C12N 15/82, A01P 7/04, A01H 5/00, A01N 63/02
Мітки: стійка, рослина, днк, трансгенна, інсектицидний, містить, білок, шкідників, vip3ab, кодує, яка, cry1fa, лускокрилих
Код посилання
<a href="https://ua.patents.su/40-111934-transgenna-roslina-shho-mistit-dnk-yaka-kodueh-insekticidnijj-bilok-vip3ab-i-dnk-yaka-kodueh-insekticidnijj-bilok-cry1fa-stijjka-do-luskokrilikh-shkidnikiv.html" target="_blank" rel="follow" title="База патентів України">Трансгенна рослина, що містить днк, яка кодує інсектицидний білок vip3ab, і днк, яка кодує інсектицидний білок cry1fa, стійка до лускокрилих шкідників</a>
Попередній патент: Піролопіридини як інгібітори кінази
Наступний патент: Трансгенна рослина, яка містить днк, що кодує інсектицидний білок cry1ab, і днк, що кодує інсектицидний білок cry1be, для керування резистентністю комах
Випадковий патент: Спосіб герніопластики при післяопераційних грижах живота