Заміщені хінолони iii, спосіб їх одержання (варіанти), лікарський засіб та спосіб боротьби з інфікуванням вірусами (варіанти)
Номер патенту: 94934
Опубліковано: 25.06.2011
Автори: Шое-Лооп Рудольф, Фюрстнер Шанталь, Хеннінгер Керстін, Ланг Дітер, Теде Кай, Брюкнер Давід, Ціммерманн Хольгер
Формула / Реферат
1. Сполука формули
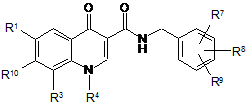 , (І)
, (І)
у якій
R1 означає водень, фтор, хлор або трифторметил,
R3 означає галоген, гідроксигрупу, С1-С4-алкоксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу або етиніл,
R4 означає С1-С6-алкіл або С3-С8-циклоалкіл, де алкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, гідроксикарбоніл, амінокарбоніл, С1-С6-алкоксигрупу, С1-С6-алкіламіногрупу, С1-С6-алкілкарбоніл і С1-С6-алкоксикарбоніл,
та
де циклоалкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, гідроксикарбоніл, амінокарбоніл, С1-С6-алкіл, С1-С6-алкоксигрупу, С1-С6-алкіламіногрупу, С1-С6-алкілкарбоніл і С1-С6-алкоксикарбоніл,
або
R3 і R4 разом з атомами, до яких вони приєднані, утворюють кільце із групою формули
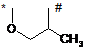 ,
,
у якій
* вказує місце зв'язування з атомом вуглецю,
та
# вказує місце зв'язування з атомом азоту,
R7 і R8 незалежно один від одного означають галоген, гідроксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, С1-С3-алкіл або С1-С3-алкоксигрупу,
та
R9 означає водень, галоген, гідроксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, С1-С3-алкіл або С1-С3-алкоксигрупу,
або
R8 означає трифторметоксигрупу,
та
R7 і R9 означають водень,
R10 означає групу формули
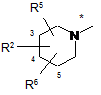 ,
, 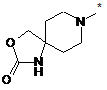 або
або 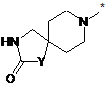 ,
,
у якій
* вказує місце зв'язування з атомом вуглецю,
R2 приєднаний у положенні 3 або 4 і означає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, С1-С4-алкіл, С1-С4-алкоксикарбоніл, С3-С6-циклоалкіламінокарбоніл або необов'язково гідроксизаміщений С1-С6-алкіламінокарбоніл,
де алкіл є заміщеним і замісник вибраний із групи, яка включає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, С1-С4-алкоксикарбоніл і 2-оксопіролідин-1-іл,
R5 і R6 незалежно один від одного приєднані в положеннях 3, 4 або 5 і незалежно один від одного означають водень, гідроксигрупу, метил або етил,
та
Y означає метиленову групу або атом кисню,
або одна(-ин) з її солей, її сольватів або сольватів її солей.
2. Сполука за п. 1, яка характеризується тим, що вона описується формулою
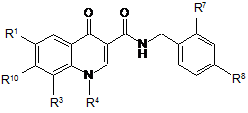 , (Іа)
, (Іа)
у якій
R1 означає водень, фтор, хлор або трифторметил,
R3 означає галоген, гідроксигрупу, С1-С4-алкоксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу або етиніл,
R4 означає С1-С6-алкіл або С3-С8-циклоалкіл,
де алкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, гідроксикарбоніл, амінокарбоніл, С1-С6-алкоксигрупу, С1-С6-алкіламіногрупу, С1-С6-алкілкарбоніл і С1-С6-алкоксикарбоніл,
та
де циклоалкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, гідроксикарбоніл, амінокарбоніл, С1-С6-алкіл, С1-С6-алкоксигрупу, С1-С6-алкіламіногрупу, С1-С6-алкілкарбоніл і С1-С6-алкоксикарбоніл,
або
R3 і R4 разом з атомами, до яких вони приєднані, утворюють кільце із групою формули
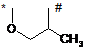 ,
,
у якій
* вказує місце зв'язування з атомом вуглецю, та
# вказує місце зв'язування з атомом азоту,
R7 і R8 незалежно один від одного означають галоген, гідроксигрупу, ціаногрупу. трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, С1-С3-алкіл або С1-С3-алкоксигрупу,
R10 означає групу формули
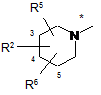 ,
, 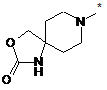 або
або 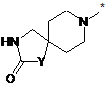 ,
,
у якій
* вказує місце зв'язування з атомом вуглецю,
R2 приєднаний у положенні 3 або 4 і означає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, С1-С4-алкіл або С1-С4-алкоксикарбоніл,
де алкіл є заміщеним і замісник вибраний із групи, яка включає гідроксигрупу, гідроксикарбоніл, амінокарбоніл і С1-С4-алкоксикарбоніл,
R5 і R6 незалежно один від одного приєднані в положеннях 3, 4 або 5 і незалежно один від одного означають водень, гідроксигрупу, метил або етил,
та
Y означає метиленову групу або атом кисню,
або одна(-ин) з її солей, її сольватів або сольватів її солей.
3. Сполука за п. 2, яка характеризується тим, що
R1 означає водень, фтор або хлор,
R3 означає галоген, гідроксигрупу, С1-С3-алкоксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу або трифторметоксигрупу,
R4 означає С1-С6-алкіл або С3-С6-циклоалкіл,
де алкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил і С1-С4-алкоксигрупу,
та
де циклоалкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, С1-С4-алкіл і С1-С4-алкоксигрупу,
або
R3 і R4 разом з атомами, до яких вони приєднані, утворюють кільце із групою формули
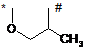 ,
,
у якій
* вказує місце зв'язування з атомом вуглецю, та
# вказує місце зв'язування з атомом азоту,
R7 і R8 незалежно один від одного означають галоген, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, С1-С3-алкіл або С1-С3-алкоксигрупу, R10 означає групу формули
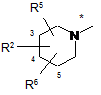 ,
, 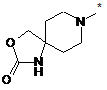 або
або 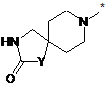 ,
,
у якій
* вказує місце зв'язування з атомом вуглецю,
R2 приєднаний у положенні 3 або 4 і означає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, С1-С4-алкіл або С1-С4-алкоксикарбоніл,
де алкіл є заміщеним і замісник вибраний із групи, яка включає гідроксикарбоніл і С1-С4-алкоксикарбоніл,
R5 і R6 незалежно один від одного приєднані в положеннях 3, 4 або 5 і незалежно один від одного означають водень, гідроксигрупу, метил або етил,
та
Y означає метиленову групу або атом кисню,
або одна(-ин) з її солей, її сольватів або сольватів її солей.
4. Спосіб одержання сполуки формули (І) за п. 1, який характеризується тим, що
сполуку формули
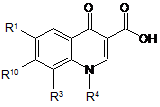 , (ІІ)
, (ІІ)
у якій
R1, R3, R4 і R10 мають значення за п. 1,
вводять у реакцію зі сполукою формули
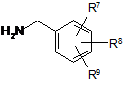 , (ІІІ)
, (ІІІ)
у якій
R7, R8 і R9 мають значення за п. 1,
або
сполуку, яка одержана зазначеним способом та містить складноефірну групу в радикалі R10, гідролізують основою з утворенням відповідної кислоти.
5. Спосіб одержання сполуки формули (І) за п. 1, який характеризується тим, що
сполуку формули
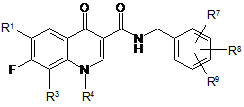 , (IV)
, (IV)
у якій
R1, R3, R4, R7, R8 і R9 мають значення за п. 1,
вводять у реакцію зі сполукою формули
R10-H, (V)
у якій
R10 має значення за п. 1,
або
сполуку, яка одержана зазначеним способом та містить складноефірну групу в радикалі R10, гідролізують основою з утворенням відповідної кислоти.
6. Сполука за будь-яким з пп. 1-3, призначена для лікування і/або профілактики захворювань.
7. Лікарський засіб, який містить сполуку за будь-яким з пп. 1-3 у комбінації з інертним, нетоксичним, фармацевтично прийнятним інертним наповнювачем.
8. Застосування сполуки за будь-яким з пп. 1-3 для приготування лікарського засобу, призначеного для лікування і/або профілактики інфікування вірусами.
9. Застосування за п. 8, яке характеризується тим, що інфікування вірусом являє собою інфікування цитомегаловірусом людини (ЦМВЛ) або іншим представником групи herpes viridae (віруси герпесу).
10. Лікарський засіб за п. 7, призначений для лікування і/або профілактики інфікування вірусами.
11. Спосіб боротьби з інфікуванням вірусами в людей і тварин шляхом введення противірусно ефективної кількості принаймні однієї сполуки за будь-яким з пп. 1-3.
12. Спосіб боротьби з інфікуванням вірусами в людей і тварин шляхом введення противірусно ефективної кількості лікарського засобу за п. 7.
Текст
УКРАЇНА (19) UA (11) 94934 (13) C2 (51) МПК C07D 401/04 (2006.01) C07D 498/04 (2006.01) C07D 471/10 (2006.01) C07D 498/10 (2006.01) C07D 401/14 (2006.01) A61K 31/4709 (2006.01) A61P 31/22 (2006.01) МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ОПИС ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ДО ПАТЕНТУ НА ВИНАХІД (54) ЗАМІЩЕНІ ХІНОЛОНИ III, СПОСІБ ЇХ ОДЕРЖАННЯ (ВАРІАНТИ), ЛІКАРСЬКИЙ ЗАСІБ ТА СПОСІБ БОРОТЬБИ З ІНФІКУВАННЯМ ВІРУСАМИ (ВАРІАНТИ) 1 2 N H N R10 R3 R4 R8 R9 , (І) у якій 1 R означає водень, фтор, хлор або трифторметил, 3 R означає галоген, гідроксигрупу, С1-С4алкоксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу або етиніл, 4 R означає С1-С6-алкіл або С3-С8-циклоалкіл, де алкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, гідроксикарбоніл, амінокарбоніл, С1-С6-алкоксигрупу, С1-С6-алкіламіногрупу, С1-С6-алкілкарбоніл і С1-С6-алкоксикарбоніл, та де циклоалкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, R5 * N 3 R2 R6 N HN O 4 * * N 5 O N H Y O , або у якій * вказує місце зв'язування з атомом вуглецю, , C2 (13) , у якій * вказує місце зв'язування з атомом вуглецю, та # вказує місце зв'язування з атомом азоту, 7 8 R і R незалежно один від одного означають галоген, гідроксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, С1-С3-алкіл або С1-С3алкоксигрупу, та 9 R означає водень, галоген, гідроксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, С1-С3алкіл або С1-С3-алкоксигрупу, або 8 R означає трифторметоксигрупу, та 7 9 R і R означають водень, 10 R означає групу формули 94934 R7 CH3 (11) O O UA O R1 ціаногрупу, трифторметил, гідроксикарбоніл, амінокарбоніл, С1-С6-алкіл, С1-С6-алкоксигрупу, С1-С6алкіламіногрупу, С1-С6-алкілкарбоніл і С1-С6алкоксикарбоніл, або 3 4 R і R разом з атомами, до яких вони приєднані, утворюють кільце із групою формули # * (19) (21) a200810891 (22) 02.02.2007 (24) 25.06.2011 (86) PCT/EP2007/000923, 02.02.2007 (31) 10 2006 005 861.5 (32) 09.02.2006 (33) DE (46) 25.06.2011, Бюл.№ 12, 2011 р. (72) ФЮРСТНЕР ШАНТАЛЬ, CH/DE, ТЕДЕ КАЙ, DE, ЦІММЕРМАНН ХОЛЬГЕР, DE, БРЮКНЕР ДАВІД, DE, ХЕННІНГЕР КЕРСТІН, DE, ЛАНГ ДІТЕР, DE, ШОЕ-ЛООП РУДОЛЬФ, DE (73) АІКУРІС ГМБХ & КО. КГ, DE (56) WO 0040561 A, 13.07.2000 WO 02085886 A, 31.10.2002 (57) 1. Сполука формули 3 94934 4 2 R приєднаний у положенні 3 або 4 і означає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, С1-С4алкіл, С1-С4-алкоксикарбоніл, С3-С6циклоалкіламінокарбоніл або необов'язково гідроксизаміщений С1-С6-алкіламінокарбоніл, де алкіл є заміщеним і замісник вибраний із групи, яка включає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, С1-С4-алкоксикарбоніл і 2оксопіролідин-1-іл, 5 6 R і R незалежно один від одного приєднані в положеннях 3, 4 або 5 і незалежно один від одного означають водень, гідроксигрупу, метил або етил, та Y означає метиленову групу або атом кисню, або одна(-ин) з її солей, її сольватів або сольватів її солей. 2. Сполука за п. 1, яка характеризується тим, що вона описується формулою O R1 R7 O N H N R10 R3 R8 R4 , (Іа) у якій 1 R означає водень, фтор, хлор або трифторметил, 3 R означає галоген, гідроксигрупу, С1-С4алкоксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу або етиніл, 4 R означає С1-С6-алкіл або С3-С8-циклоалкіл, де алкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, гідроксикарбоніл, амінокарбоніл, С1-С6-алкоксигрупу, С1-С6-алкіламіногрупу, С1-С6-алкілкарбоніл і С1-С6-алкоксикарбоніл, та де циклоалкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, гідроксикарбоніл, амінокарбоніл, С1-С6-алкіл, С1-С6-алкоксигрупу, С1-С6алкіламіногрупу, С1-С6-алкілкарбоніл і С1-С6алкоксикарбоніл, або 3 4 R і R разом з атомами, до яких вони приєднані, утворюють кільце із групою формули # * O CH3 , у якій * вказує місце зв'язування з атомом вуглецю, та # вказує місце зв'язування з атомом азоту, 7 8 R і R незалежно один від одного означають галоген, гідроксигрупу, ціаногрупу. трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, С1-С3-алкіл або С1-С3алкоксигрупу, 10 R означає групу формули R5 * * N 3 R2 N O 4 R6 * N 5 , O HN N H Y або O , у якій * вказує місце зв'язування з атомом вуглецю, 2 R приєднаний у положенні 3 або 4 і означає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, С1-С4алкіл або С1-С4-алкоксикарбоніл, де алкіл є заміщеним і замісниквибраний із групи, яка включає гідроксигрупу, гідроксикарбоніл, амінокарбоніл і С1-С4-алкоксикарбоніл, 5 6 R і R незалежно один від одного приєднані в положеннях 3, 4 або 5 і незалежно один від одного означають водень, гідроксигрупу, метил або етил, та Y означає метиленову групу або атом кисню, або одна(-ин) з її солей, її сольватів або сольватів її солей. 3. Сполука за п. 2, яка характеризується тим, що 1 R означає водень, фтор або хлор, 3 R означає галоген, гідроксигрупу, С1-С3алкоксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу або трифторметоксигрупу, 4 R означає С1-С6-алкіл або С3-С6-циклоалкіл, де алкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил і С1-С4-алкоксигрупу, та де циклоалкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, С1-С4-алкіл і С1-С4алкоксигрупу, або 3 4 R і R разом з атомами, до яких вони приєднані, утворюють кільце із групою формули # * O CH3 , у якій * вказує місце зв'язування з атомом вуглецю, та # вказує місце зв'язування з атомом азоту, 7 8 R і R незалежно один від одного означають галоген, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, 10 С1-С3-алкіл або С1-С3-алкоксигрупу, R означає групу формули R5 3 R2 R6 N N HN O 4 * * * N 5 O N H Y O , або , у якій * вказує місце зв'язування з атомом вуглецю, 2 R приєднаний у положенні 3 або 4 і означає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, С1-С4алкіл або С1-С4-алкоксикарбоніл, де алкіл є заміщеним і замісник вибраний із групи, яка включає гідроксикарбоніл і С1-С4алкоксикарбоніл, 5 5 94934 6 R і R незалежно один від одного приєднані в положеннях 3, 4 або 5 і незалежно один від одного означають водень, гідроксигрупу, метил або етил, та Y означає метиленову групу або атом кисню, або одна(-ин) з її солей, її сольватів або сольватів її солей. 4. Спосіб одержання сполуки формули (І) за п. 1, який характеризується тим, що сполуку формули O O R1 OH N R10 R3 R4 , (ІІ) у якій 1 3 4 10 R , R , R і R мають значення за п. 1, вводять у реакцію зі сполукою формули R7 H2 N R8 R9 , (ІІІ) у якій 7 8 9 R , R і R мають значення за п. 1, або сполуку, яка одержана зазначеним способом та 10 містить складноефірну групу в радикалі R , гідролізують основою з утворенням відповідної кислоти. 5. Спосіб одержання сполуки формули (І) за п. 1, який характеризується тим, що сполуку формули O R1 O R7 N H N F R3 R4 6 у якій 1 3 4 7 8 9 R , R , R , R , R і R мають значення за п. 1, вводять у реакцію зі сполукою формули 10 R -H, (V) у якій 10 R має значення за п. 1, або сполуку, яка одержана зазначеним способом та 10 містить складноефірну групу в радикалі R , гідролізують основою з утворенням відповідної кислоти. 6. Сполука за будь-яким з пп. 1-3, призначена для лікування і/або профілактики захворювань. 7. Лікарський засіб, який містить сполуку за будьяким з пп. 1-3 у комбінації з інертним, нетоксичним, фармацевтично прийнятним інертним наповнювачем. 8. Застосування сполуки за будь-яким з пп. 1-3 для приготування лікарського засобу, призначеного для лікування і/або профілактики інфікування вірусами. 9. Застосування за п. 8, яке характеризується тим, що інфікування вірусом являє собою інфікування цитомегаловірусом людини (ЦМВЛ) або іншим представником групи herpes viridae (віруси герпесу). 10. Лікарський засіб за п. 7, призначений для лікування і/або профілактики інфікування вірусами. 11. Спосіб боротьби з інфікуванням вірусами в людей і тварин шляхом введення противірусно ефективної кількості принаймні однієї сполуки за будь-яким з пп. 1-3. 12. Спосіб боротьби з інфікуванням вірусами в людей і тварин шляхом введення противірусно ефективної кількості лікарського засобу за п. 7. R8 R9 , (IV) Даний винахід стосується заміщених хінолонів і способів їх одержання, а також їх застосування для приготування лікарських засобів, призначених для лікування і/або профілактики захворювань, особливо застосування як противірусні засоби, переважно - для боротьби із цитомегаловірусами. В WO 00/040561 і US 4959363 описані хінолони, які мають активність відносно вірусів групи герпесу. В EP-A 612731 описані хінолони як притивірусні засоби, особливо для боротьби з ВІЛ (вірус імунодефіциту людини). В WO 02/009758, WO 02/085886 і WO 03/050107 заявлені хінолони як антибіотики широкого спектра дії. В WO 97/004775 і WO 97/004779 описані хінолони як інгібітори PDE4 і TNFα, зокрема, призначені для лікування запальних захворювань, ВІЛ і ЦМВЛ. В EP-A 276700 описані 8-ціанохінолони як антибіотики. В WO 02/026713 описані хінолони як протипаразитні засоби. У продажу є засоби, які мають різні структури, які характеризуються противірусною активністю, застосування яких сильно обмежено численними побічними ефектами й можливим розвитком резистентності. Тому для кращої й більш ефективної терапії необхідні нові засоби. Тому одним об'єктом даного винаходу є нові сполуки, які мають таку ж або більшу противірусну активність, призначені для лікування вірусних інфекційних захворювань у людей і тварин. Відповідно до винаходу несподівано було встановлено, що заміщені хінолони, описані в даному винаході, мають противірусну активність. Даний винахід стосується сполук формули O R R O R 1 7 N H 10 R N R 3 R 4 R 8 (I) 9 у якій 1 R означає водень, фтор, хлор або трифторметил, 7 3 R означає галоген, гідроксигрупу, C1-C4алкоксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу або етиніл, 4 R означає C1-C6-алкіл або C3-C8-циклоалкіл, де алкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, гідроксикарбоніл, амінокарбоніл, C1-C6-алкоксигрупу, C1-C6-алкіламіногрупу, C1-C6-алкілкарбоніл і C1-C6-алкоксикарбоніл, та де циклоалкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, гідроксикарбоніл, амінокарбоніл, C1-C6-алкіл, C1-C6-алкоксигрупу, C1C6-алкіламіногрупу, C1-C6-алкілкарбоніл і C1-C6алкоксикарбоніл, або 3 4 R і R разом з атомами, до яких вони приєднані, утворюють кільце із групою формули # * O CH3 у якій * вказує місце зв'язування з атомом вуглецю, та # вказує місце зв'язування з атомом азоту, 7 8 R і R незалежно один від одного означають галоген, гідроксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, C1-C3-алкіл або C1-C3алкоксигрупу, та 9 R означає водень, галоген, гідроксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, C1-C3алкіл або C1-C3-алкоксигрупу, або 8 R означає трифторметоксигрупу, та 7 9 R і R означають водень, 10 R означає групу формули у якій * вказує місце зв'язування з атомом вуглецю, 2 R приєднаний у положенні 3 або 4 і означає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, C1C4-алкіл, C1-C4-алкоксикарбоніл, C3-C6циклоалкіламінокарбоніл або необов'язково гідроксизаміщений C1-C6-алкіламінокарбоніл, де алкіл є заміщеним і замісник вибраний із групи, яка включає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, C1-C4-алкоксикарбоніл і 2оксопіролідин-1-іл, 5 6 R і R незалежно один від одного приєднані в положеннях 3, 4 або 5 і незалежно один від одного означають водень, гідроксигрупу, метил або етил, та Y означає метиленову групу або атом кисню, 94934 8 та їх солей, їх сольватів і сольватів їх солей. Сполуки, пропоновані в даному винаході, являють собою сполуки формули (I) і (Ia) та їх солі, сольвати й сольвати солей; а також сполуки, зазначені нижче, як типовий варіант (варіанти) здійснення й описувані формулою (I) і (Ia), і їх солі сольвати й сольвати солей, якщо тільки сполуки, зазначені нижче й описувані формулою (I) і (Ia), вже не є солями, сольватами й сольватами солей. Сполуки, пропоновані в даному винаході, залежно від структури можуть існувати в стереоізомерних формах (енантіомери, діастереоізомери). Відповідно до цього даний винахід стосується енантіомерів або діастереоізомерів і відповідних їх сумішей. З таких сумішей енантіомерів і/або діастереоізомерів за відомими методиками можна виділити стереоізомерно чисті компоненти. Якщо сполуки, пропоновані в даному винаході, можуть існувати в таутомерних формах, то даний винахід включає всі такі таутомерні форми. Солями, кращими для задач даного винаходу, є фізіологічно прийнятні солі сполук, пропонованих у даному винаході. Однак в об'єм даного винаходу включені й солі, які самі й непридатні для застосування у фармацевтиці, але які все-таки можна використовувати, наприклад, для виділення або очищення сполук, пропонованих у даному винаході. Фізіологічно прийнятні солі сполук, пропонованих у даному винаході, включають солі приєднання неорганічних кислот, карбонових кислот і сульфонових кислот, наприклад, солі хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, метансульфонової кислоти, етансульфонової кислоти, толуолсульфонової кислоти, бензолсульфонової кислоти, нафталіндисульфонової кислоти, оцтової кислоти, трифтороцтової кислоти, пропіонової кислоти, молочної кислоти, винної кислоти, яблучної кислоти, лимонної кислоти, фумарової кислоти, малеїнової кислоти та бензойної кислоти. Фізіологічно прийнятні солі сполук, пропонованих у даному винаході, також включають солі звичайних основ, таких як, наприклад і переважно солі лужних металів (наприклад, солі натрію й калію), солі лужноземельних металів (наприклад, солі кальцію й магнію) і солі амонію, одержані з аміаку або органічних амінів, які містять від 1 до 16 атомів вуглецю, таких як, наприклад і переважно етиламін, діетиламін, триетиламін, етилдіізопропіламін, моноетаноламін, діетаноламін, триетаноламін, дихлоргексиламін, диметиламіноетанол, прокаїн, дибензиламін, N-метилморфолін, аргінін, лізин, етилендіамін, N-метилпіперидин і холін. Сольвати, для задач даного винаходу, означають такі форми сполук, пропонованих у даному винаході, які у твердому або рідкому стані утворюють комплекс шляхом координації з молекулами розчинника. Гідрати є особливою формою сольватів, у яких координація відбувається з водою. Крім того, даний винахід також стосується проліків сполук, пропонованих у даному винаході. Термін "проліки" включає сполуки, які самі можуть бути біологічно активними або неактивними, але під час присутності в організмі перетворюються в 9 сполуки, пропоновані в даному винаході (наприклад, внаслідок метаболізму або гідролізу,). Для задач даного винаходу, якщо не зазначено інше, замісники мають наступні значення. Алкіл сам по собі й "алкіл" в алкоксигрупі, алкіламіногрупі, алкілкарбонілі, алкоксикарбонілі й алкіламінокарбонілі означає лінійний або розгалужений алкільний радикал, який звичайно містить від 1 до 6, переважно - від 1 до 4, більш краще від 1 до 3 атомів вуглецю, наприклад і переважно метил, етил, н-пропіл, ізопропіл, н-бутил, третбутил, н-пентил або н-гексил. Алкоксигрупа наприклад і переважно означає метоксигрупу, етоксигрупу, н-пропоксигрупу, ізопропоксигрупу, н-бутоксигрупу, трет-бутоксигрупу, н-пентоксигрупу та н-гексоксигрупу. Алкіламіногрупа означає алкіламіновий радикал, який містить 1 або 2 алкільних замісники (вибраних незалежно один від одного), наприклад і переважно - метиламіногрупу, етиламіногрупу, нпропіламіногрупу, ізопропіламіногрупу, нбутиламіногрупу, трет-бутиламіногрупу, нпентиламіногрупу, н-гексиламіногрупу, N,Nдиметиламіногрупу, N,N-діетиламіногрупу, N-етилN-метиламіногрупу, N-метил-N-нпропіламіногрупу, N-ізопропіл-N-нпропіламіногрупу, N-метил-N-н-бутиламіногрупу, N-трет-бутил-N-метиламіногрупу, N-етил-N-нпентиламіногрупу й N-н-гексил-N-метиламіногрупу. C1-C3-Алкіламіногрупа означає, наприклад, моноалкіламіновий радикал, який містить від 1 до 3 атомів вуглецю, або діалкіламіновий радикал, який містить від 1 до 3 атомів вуглецю в алкільному заміснику. Алкілкарбоніл наприклад і переважно означає ацетил і пропаноїл. Алкоксикарбоніл наприклад і переважно означає метоксикарбоніл, етоксикарбоніл, нпропоксикарбоніл, ізопропоксикарбоніл, нбутоксикарбоніл, трет-бутоксикарбоніл, нпентоксикарбоніл або н-гексоксикарбоніл. Алкіламінокарбоніл означає алкіламінокарбонільний радикал, який містить 1 або 2 алкільних замісники (вибраних незалежно один від одного), наприклад і переважно - метиламінокарбоніл, етиламінокарбоніл, н-пропіламінокарбоніл, ізопропіламінокарбоніл, трет-бутиламінокарбоніл, нпентиламінокарбоніл, н-гексиламінокарбоніл, N,Nдиметиламінокарбоніл, N,N-діетиламінокарбоніл, N-етил-N-метиламінокарбоніл, N-метил-N-нпропіламінокарбоніл, N-ізопропіл-N-нпропіламінокарбоніл, N-метил-N-нбутиламінокарбоніл, N-трет-бутил-Nметиламінокарбоніл, N-етил-N-нпентиламінокарбоніл або N-н-гексил-Nметиламінокарбоніл. C1-C3-Алкіламінокарбоніл означає, наприклад, моноалкіламінокарбонільний радикал, який містить від 1 до 3 атомів вуглецю, або діалкіламінокарбонільний радикал, який містить від 1 до 3 атомів вуглецю в алкільному заміснику. Циклоалкіл означає циклоалкільну групу, яка звичайно містить від 3 до 8, переважно - від 3 до 5 атомів вуглецю. Кращі приклади циклоалкілу включають циклопропіл, циклобутил, циклопентил, 94934 10 циклогексил і циклогептил. Циклоалкіламінокарбоніл означає циклоалкільну групу, яка звичайно містить від 3 до 6 атомів вуглецю, що приєднана через амінокарбонільну групу. Кращі приклади циклоалкіламінокарбонілу включають циклопропіламінокарбоніл, циклобутиламінокарбоніл, циклопентиламінокарбоніл і циклогексиламінокарбоніл. Галоген означає фтор, хлор, бром або йод, переважно - фтор або хлор. 3 4 У формулі, що описує групи R і R , кінцеві точки сусідніх відрізків, поруч із якими знаходяться значки * або #, означають не атом вуглецю й не групу CH2, а ділянки зв'язків з атомами, до яких 3 4 приєднані групи R і R . 10 У формулі, що описує групу R , кінцеві точки відрізків, поруч із якими знаходяться значки *, означають не атом вуглецю й не групу CH2, а ділянки зв'язків з атомами, до яких приєднана група 10 R . Перевагу надають таким сполукам формули (I), які описуються формулою O R R O R 7 1 N H 10 N R 3 R (Ia) R 8 4 у якій 1 R означає водень, фтор, хлор або трифторметил, 3 R означає галоген, гідроксигрупу, C1-C4алкоксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу або етиніл, 4 R означає C1-C6-алкіл або C3-C8-циклоалкіл, де алкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, гідроксикарбоніл, амінокарбоніл, C1-C6-алкоксигрупу, C1-C6-алкіламіногрупу, C1-C6-алкілкарбоніл і C1-C6-алкоксикарбоніл, та де циклоалкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, гідроксикарбоніл, амінокарбоніл, C1-C6-алкіл, C1-C6-алкоксигрупу, C1C6-алкіламіногрупу, C1-C6-алкілкарбоніл і C1-C6алкоксикарбоніл, або 3 4 R і R разом з атомами, до яких вони приєднані, утворюють кільце із групою формули # * O CH3 у якій * вказує місце зв'язування з атомом вуглецю, та # вказує місце зв'язування з атомом азоту, 7 8 R і R незалежно один від одного означають галоген, гідроксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, C1-C3-алкіл або C1-C3 11 алкоксигрупу, 10 R означає групу формули у якій * вказує місце зв'язування з атомом вуглецю, 2 R приєднаний у положенні 3 або 4 і означає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, C1C4-алкіл або C1-C4-алкоксикарбоніл, де алкіл є заміщеним і замісник вибраний із групи, яка включає гідроксигрупу, гідроксикарбоніл, амінокарбоніл і C1-C4-алкоксикарбоніл, 5 6 R і R незалежно один від одного приєднані в положеннях 3, 4 або 5 і незалежно один від одного означають водень, гідроксигрупу, метил або етил, та Y означає метиленову групу або атом кисню, і їх солям, їх сольватам і сольватам їх солей. Перевагу також надають таким сполукам формули (I) і (Ia), у якій 1 R означає водень, фтор або хлор, 3 R означає галоген, гідроксигрупу, C1-C3алкоксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу або трифторметоксигрупу, 4 R означає C1-C6-алкіл або C3-C6-циклоалкіл, де алкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил і C1-C4-алкоксигрупу, та де циклоалкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, гідроксигрупу, аміногрупу, ціаногрупу, трифторметил, C1-C4-алкіл і C1C4-алкоксигрупу, або 3 4 R і R разом з атомами, до яких вони приєднані, утворюють кільце із групою формули 94934 12 групи, яка включає гідроксикарбоніл і C1-C4алкоксикарбоніл, 5 6 R і R незалежно один від одного приєднані в положеннях 3, 4 або 5 і незалежно один від одного означають водень, гідроксигрупу, метил або етил, та Y означає метиленову групу або атом кисню, і їх солям, їх сольватам і сольватам їх солей. Перевагу також надають таким сполукам формули (I) і (Ia), у якій 1 R означає водень або фтор, 3 R означає хлор, гідроксигрупу, метоксигрупу, етоксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу або трифторметоксигрупу, 4 R означає C1-C4-алкіл, циклопропіл, циклобутил або циклопентил, де алкіл може містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, трифторметил і C1-C4алкоксигрупу, та де циклопропіл, циклобутил і циклопентил можуть містити 1-3 замісники й замісники незалежно один від одного вибрані із групи, яка включає галоген, трифторметил, метил, етил, метоксигрупу й етоксигрупу, або 3 4 R і R разом з атомами, до яких вони приєднані, утворюють кільце із групою формули # * O CH3 у якій * вказує місце зв'язування з атомом вуглецю, та # вказує місце зв'язування з атомом азоту, 7 8 R і R незалежно один від одного означають хлор, бром, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, метил або метоксигрупу, 10 R означає групу формули # * O CH3 у якій * вказує місце зв'язування з атомом вуглецю, та # вказує місце зв'язування з атомом азоту, 7 8 R і R незалежно один від одного означають галоген, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу, C1-C3-алкіл або C1-C3-алкоксигрупу, 10 R означає групу формули у якій * вказує місце зв'язування з атомом вуглецю, 2 R приєднаний у положенні 3 або 4 і означає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, C1C4-алкіл або C1-C4-алкоксикарбоніл, де алкіл є заміщеним і замісник вибраний із у якій * вказує місце зв'язування з атомом вуглецю, 2 R приєднаний у положенні 3 або 4 і означає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, метил, етил або C1-C4-алкоксикарбоніл, де метил і етил є заміщеними й замісник вибраний із групи, яка включає гідроксикарбоніл і C1C4-алкоксикарбоніл, 5 R приєднаний у положенні 3 і означає водень, гідроксигрупу або метил, 6 R приєднаний у положенні 5 і означає водень, гідроксигрупу або метил, та Y означає метиленову групу або атом кисню, і їх солям, їх сольватам і сольватам їх солей. Перевагу також надають таким сполукам формули (I) і (Ia), у якій 1 R означає фтор, 13 3 R означає хлор, гідроксигрупу, метоксигрупу або етоксигрупу 4 R означає C1-C3-алкіл, циклопропіл або циклобутил, де алкіл може містити 1-2 замісники й замісники незалежно один від одного вибрані із групи, яка включає фтор і трифторметил, та де циклопропіл і циклобутил можуть бути заміщені 1-3 атомами фтору, 7 8 R і R незалежно один від одного означають хлор, трифторметил, трифторметоксигрупу або метил, 10 R означає групу формули у якій * вказує місце зв'язування з атомом вуглецю, 2 R приєднаний у положенні 3 або 4 і означає гідроксигрупу, гідроксикарбоніл, амінокарбоніл, метил або етил, де метил і етил заміщений гідроксикарбонілом, 5 R приєднаний у положенні 3 і означає водень або метил, 6 R приєднаний у положенні 5 і означає водень або метил, та Y означає метиленову групу, і їх солям, їх сольватам і сольватам їх солей. Перевагу також надають таким сполукам фо1 рмули (I) і (Ia), у якій R означає фтор. Перевагу також надають таким сполукам фо2 рмули (I) і (Ia), у якій R приєднаний у положенні 3 або 4 і означає гідроксигрупу, гідроксикарбоніл, амінокарбоніл або метил, де метил заміщений гідроксикарбонілом. Перевагу також надають таким сполукам фо2 рмули (I) і (Ia), у якій R означає гідроксикарбоніл або гідроксикарбонілметил. Перевагу також надають таким сполукам фо3 рмули (I) і (Ia), у якій R означає галоген, гідроксигрупу, C1-C3-алкоксигрупу, ціаногрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу або етиніл. Перевагу також надають таким сполукам фо3 рмули (I) і (Ia), у якій R означає галоген, ціаногрупу, метоксигрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметоксигрупу або етиніл. Перевагу також надають таким сполукам фо3 рмули (I) і (Ia), у якій R означає галоген, ціаногрупу, метоксигрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу або трифторметоксигрупу. Перевагу також надають таким сполукам фо3 рмули (I) і (Ia), у якій R означає хлор, ціаногрупу, метоксигрупу, трифторметил, монофторметоксигрупу, дифторметоксигрупу або трифторметоксигрупу. Перевагу також надають таким сполукам фо 94934 14 3 рмули (I) і (Ia), у якій R означає хлор, метоксигрупу, трифторметил або дифторметоксигрупу. Перевагу також надають таким сполукам фо3 рмули (I) і (Ia), у якій R означає хлор або метоксигрупу. Перевагу також надають таким сполукам фо3 рмули (I) і (Ia), у якій R означає хлор, гідроксигрупу, метоксигрупу або етоксигрупу. Перевагу також надають таким сполукам фо4 рмули (I) і (Ia), у якій R означає циклопропіл або 2-фторциклопроп-1-іл. Перевагу також надають таким сполукам фо4 рмули (I) і (Ia), у якій R означає 2,2,2трифторетил, 2,2-дифторетил, 2-фторетил, 1фторпроп-2-іл або 1,1,1-трифторпроп-2-іл. Перевагу також надають таким сполукам фо4 рмули (I) і (Ia), у якій R означає 2,2,2трифторетил. Перевагу також надають таким сполукам фо5 6 рмули (I) і (Ia), у якій R і R означають водень або метил. Перевагу також надають таким сполукам фо7 8 рмули (I), у якій R і R незалежно один від одного означають галоген, трифторметил, монофторметоксигрупу, дифторметоксигрупу, трифторметокси9 групу, метил або метоксигрупу, і R означає водень або метил. Перевагу також надають таким сполукам фо7 рмули (I) і (Ia), у якій R означає хлор або метил й 8 R означає хлор, трифторметил або трифторметоксигрупу. Перевагу також надають таким сполукам фо9 рмули (I), у якій R означає водень. Перевагу також надають таким сполукам фо10 рмули (I) і (Ia), у якій R означає групу формули * N HN O у якій * вказує місце зв'язування з атомом вуглецю. Визначення радикалів, зазначені для відповідних комбінацій і кращих комбінацій радикалів, при необхідності замінюються на визначення радикалів іншої комбінації, незалежно конкретної комбінації радикалів, яка зазначена. Особливу перевагу також надають комбінаціям двох або більшої кількості зазначених вище кращих діапазонів. Даний винахід також стосується способу одержання сполук формули (I), у якій [A] сполуки формули O R O 1 OH (lI) R 10 N R 3 R 4 у якій 1 3 4 10 R , R , R і R мають зазначені вище значення, вводять у реакцію зі сполуками формули 15 R 94934 7 H2N R R 8 (llI) 9 у якій 7 8 9 R , R і R мають зазначені вище значення або [B] сполуки формули O R O R 1 7 N H F R N R 3 R 4 R 8 (IV) 9 у якій 1 3 4 7 8 9 R , R , R , R , R і R мають зазначені вище значення, вводять у реакцію зі сполуками формули 10 R H (V) у якій 10 R має зазначене вище значення, або [C] сполуки, які одержані способом [A] або [B] і 10 містять складноефірну групу в радикалі R , гідролізують основою з утворенням відповідної кислоти. (Складноефірна група може, але не повинна від10 повідати визначенню R .) Реакцію в способі [A] звичайно проводять в інертних розчинниках, у присутності дегідратуючого реагенту, якщо це доцільно, то в присутності основи, переважно - у температурному діапазоні від -30 до 50°C при атмосферному тиску. Приклади інертних розчинників включають галогеновані вуглеводні, такі як дихлорметан або трихлорметан, вуглеводні, такі як бензол, нітрометан, діоксан, диметилформамід або ацетонітрил. Також можна використовувати суміші розчинників. Особливо кращими є дихлорметан або диметилформамід. Приклади основ включають карбонати лужних металів, такі як карбонати або гідрокарбонати натрію або калію, і органічні основи, такі як триалкіламіни, наприклад, триетиламін, Nметилморфолін, N-метилпіперидин, 4диметиламінопіридин або діізопропілетиламін. Приклади придатних для даного винаходу дегідратуючих реагентів включають карбодііміди, такі як N,N'-діетил-, N,N,'-дипропіл-, N,N'-діізопропіл-, N,N'-дициклогексилкарбодіімід, N-(3диметиламіноізопропіл)-N'етилкарбодіімідгідрохлорид (ЕДХ), Nциклогексилкарбодіімід-N'пропілоксиметилполістирол (ПС-карбодіімід) або карбонільні сполуки, такі як карбонілдіімідазол, або 1,2-оксазолієві сполуки, такі як 2-етил-5-феніл1,2-оксазолій-3-сульфат або 2-трет-бутил-5-метилізоксазолійперхлорат, або ациламінові сполуки, такі як 2-етокси-1-етоксикарбоніл-1,2дигідрохінолін, або ангідрид пропанфосфінової кислоти, або ізобутилхлорформіат, або біс(2-оксо3-оксазолідиніл)фосфорилхлорид, або O(бензотриазол-1-іл)-N,N,N',N'тетраметилуронійгексафторфосфат (HBTU), 2-(2 16 оксо-1-(2H)-піридил)-1,1,3,3тетраметилуронійтетрафторборат (TPTU) або O(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуронійгексафторфосфат (HATU), або 1-гідроксибензотриазол (HOBt) або бензотриазол1ілокситрис(диметиламіно)фосфонійгексафторфосфат (BOP), або бензотриазол-1ілокситрис(піролідино)фосфонійгексафторфосфат (PyBOP), або N-гідроксисукцинімід, або їх суміші з основами. Конденсацію краще проводити з використанням HATU, бензотриазол-1ілокситрис(піролідино)фосфонійгексафторфосфату (PyBOP) або ЕДХ у присутності HOBt. Альтернативно, реакцію відповідно до способу [A] можна проводити шляхом активації кислоти формули (II) шляхом використання хлорангідриду або змішаного ангідриду кислоти. Реакцію в способі [B] можна проводити за методиками, описаними у публікації A. Da Silva, M. De Almeida, V. De Souza, M. Couri, Current Medicinal Chemistry, 2003, 10, 21-39. Гідроліз у способі [C] звичайно проводять у воді або інертних розчинниках або в сумішах води й інертних розчинників, у присутності основи, переважно - у температурному діапазоні від -30 до 100°C при атмосферному тиску. Прикладами інертних розчинників є галогеновані вуглеводні, такі як дихлорметан або трихлорметан, вуглеводні, такі як бензол, або інші розчинники, такі як нітрометан, діоксан, метанол, тетрагідрофуран, диметилформамід або ацетонітрил. Також можна використовувати суміші розчинників. Особливо кращими є діоксан, метанол, тетрагідрофуран або диметилформамід. Приклади основ включають гідроксиди лужних металів і карбонати лужних металів, такі як гідроксиди натрію, калію або літію, карбонати або гідрокарбонати натрію або калію. Сполуки формули (III) і (V) є відомими або їх можна синтезувати за відомими методиками з відповідних вихідних речовин. Сполуки формули (II) є відомими або їх можна одержати за реакцією сполуки формули O R O 1 OH (VI) F N R 3 R 4 у якій 1 3 4 R , R і R мають зазначені вище значення, з сполуками формули (V) відповідно до способу [B]. У сполуках формули (VI), якщо це доцільно, до реакції зі сполуками формули (V) карбоксигрупу активують шляхом утворення боронового ефіру. Сполуки формули (VI) є відомими або їх можна синтезувати за відомими методиками з відповідних вихідних речовин, як це описано, наприклад, у публікації A. Da Silva, M. De Almeida, V. De Souza, M. Couri, Current Medicinal Chemistry, 2003, 17 94934 18 Одержання сполук, пропонованих у даному винаході, можна проілюструвати за допомогою наведеної нижче схеми синтезу. 10, 21-39. Сполуки формули (IV) є відомими або їх можна одержати за реакцією сполук формули (VI) зі сполуками формули (III) відповідно до способу [A]. Схема синтезу: 2) ß-аміноакрилат 3) R4-NH2 1) SOCl2 O F O OH F 1) SOCl2 2) малоновий ефір O F R O O F O 2) R4-NH2 F F 3 F O 1) ортоформіат R F F R O F R 3 1) основа 2) діетилкарбонат R N H 3 R 4 основа CH 3 F F R 3 O O O 1) розщеплення ефіру F O R OH 2) H 3C O F N O O R 3 R F NH N N R O 4 3 R 4 H 3C 1) розщеплення ефіру O сполучення з амідом 2) сполучення з амідом Cl Cl H 2N H 2N Cl O O F H 3C Cl Cl O N H N N O R 3 R O F Cl Cl N H F N 4 R 3 R Cl 4 O O NH LiOH/діоксан O H 3C O O Cl N H N HO O F F N R 3 R LiOH/діоксан H 3C 4 O Сполуки, пропоновані в даному винаході, характеризуються неочікуваним діапазоном ефектів, які не можна було передбачити. Вони мають противірусну активність відносно представників групи herpes viridae (віруси герпесу), зокрема, відносно цитомегаловірусів (ЦМВ) і особливо відносно цитомегаловірусу людини (ЦМВЛ). Ділянками показань, які можна відзначити як приклад, є: 1) Лікування та профілактика інфікування за допомогою ЦМВЛ у пацієнтів зі СНІД (синдром O Cl N H N Cl O N R 3 R Cl 4 O набутого імундефіциту) (ретиніту, пневмоніту, шлунково-кишкових інфекційних захворювань). 2) Лікування та профілактика інфікування цитомегаловірусом пацієнтів, яким трансплантований кістковий мозок або орган і в яких розвивається часто небезпечний для життя викликаний ЦМВЛ пневмоніт або енцефаліт, або шлунково-кишкові й системні викликані ЦМВЛ інфекційні захворювання. 3) Лікування та профілактика викликаних ЦМВЛ інфекційних захворювань у немовлят і ді 19 тей. 4) Лікування гострого інфікування за допомогою ЦМВЛ у вагітних жінок. 5) Лікування інфікування за допомогою ЦМВЛ пацієнтів з послабленим імунітетом, викликаним раком і протираковою терапією. 6) Лікування інфікованих за допомогою ЦМВЛ пацієнтів, які страждають на рак з метою послаблення опосередковуваного ЦМВЛ прогресування пухлини (див. J. Cinatl, et al., FEMS Microbiology Reviews 2004, 28, 59-77). Даний винахід також стосується застосування сполук, пропонованих у даному винаході, для лікування і/або профілактики захворювань, зокрема інфікування вірусами, переважно - зазначеними вище вірусами, і викликаних ними інфекційних захворювань. Інфікування вірусами нижче в даному винаході означає і інфікування вірусами, і захворювання, викликане інфікуванням вірусом. Даний винахід також стосується застосування сполук, пропонованих у даному винаході, для лікування і/або профілактики захворювань, переважно - зазначених вище захворювань. Даний винахід також стосується застосування сполук, пропонованих у даному винаході, для приготування лікарського засобу, призначеного для лікування і/або профілактики захворювань, переважно - зазначених вище захворювань. Сполуки, пропоновані в даному винаході, переважно використовують для приготування лікарських засобів, які є придатними для профілактики і/або лікування інфікування представниками групи herpes viridae (віруси герпесу), переважно - цитомегаловірусом, переважно - цитомегаловірусом людини. Даний винахід також стосується способу лікування і/або профілактики захворювань, переважно - зазначених вище захворювань, із застосуванням противірусно ефективної кількості сполук, пропонованих у даному винаході. Даний винахід також стосується лікарських засобів, які включають принаймні одну сполуку, пропоновану в даному винаході, і принаймні одну або більшу кількість додаткових активних інгредієнтів, зокрема, призначених для лікування і/або профілактики зазначених вище захворювань. Активними інгредієнтами, які придатні для комбінації, які наприклад і переважно можна відзначити, є: противірусно активні інгредієнти, такі як вальганцикловір, ганцикловір, ацикловір, цидофовір або фоскарнет. Сполуки, пропоновані в даному винаході, можуть впливати системно і/або місцево. Для цього їх можна вводити придатним шляхом, таким як, наприклад, пероральний, парентеральний, пульмональний, назальний, сублінгвальний, лінгвальний, трансбукальний, ректальний, шкірний, черезшкірний, кон’юнктивальний, вушний або місцевий, або у вигляді імплантату або стента. При цих шляхах введення сполуки, пропоновані в даному винаході, можна вводити в придатних препаративних формах. Для перорального введення придатними є препаративні форми, які впливають відповідно до попереднього рівня техніки й виділяють сполуки, пропоновані в даному винаході, швидко і/або мо 94934 20 дифікованим чином і які включають сполуки, пропоновані в даному винаході, у кристалічній і/або аморфізованій і/або розчиненій формі, такі як, наприклад, таблетки (таблетки без покриття або з покриттям, наприклад, які містять покриття, які стійкі до впливу шлункового соку або розчиняються з затримкою або нерозчинні й регулюють вивільнення сполуки, пропонованої в даному винаході), таблетки або плівки/облатки, які швидко розпадаються в порожнині рота, плівки/ліофілізати, капсули (наприклад, капсули з м'якого або твердого желатину), таблетки, покриті цукром, гранули, пелети, порошки, емульсії, суспензії, аерозолі або розчини. Парентеральне введення можна проводити без стадії всмоктування (наприклад, внутрішньовенно, внутрішньоартеріально, внутрішньокардиально, внутрішньоспинально або внутрішньолюмбально) або із включенням стадії всмоктування (наприклад, внутрішньом’язово, підшкірно, внутрішньошкірно, черезшкірно або внутрішньочеревно). Препаративними формами, які придатні для парентерального введення, є, зокрема, препарати для ін'єкції та вливання у вигляді розчинів, суспензій, емульсій, ліофілізатів або стерильних порошків. Прикладами форм, які придатні для інших шляхів введення, є препаративні форми для інгаляції (зокрема, призначені для порошкових інгаляторів і розпилюваних пристроїв), краплі, розчини, спреї для носа; таблетки, плівки/облатки або капсули, які вводять лінгвально, сублінгвально або трансбукально, супозиторії, препарати для очей і вух, вагінальні капсули, водні суспензії (лосьйони, мікстури, які необхідно збовтувати), ліпофільні суспензії, мазі, креми, черезшкірні терапевтичні системи, молочко, пасти, пінки, розпилювані порошки, імплантати або стенти. Сполуки, пропоновані в даному винаході, можна приготувати у вигляді стандартних препаративних форм. Це виконують за відомими технологіями, включаючи змішування з інертними, нетоксичними, фармацевтично прийнятними інертними наповнювачами. Ці інертні наповнювачі, зокрема, включають носії (наприклад, мікрокристалічна целюлоза, лактоза, маніт), розчинники (наприклад, рідкі поліетиленгліколі), емульгатори й диспергуючі агенти або змочувальні агенти (наприклад, додецилсульфат натрію, поліоксисорбітанолеат), сполучні (наприклад, полівінілпіролідон), синтетичні й натуральні полімери (наприклад, альбумін), стабілізатори (наприклад, антиоксиданти, такі як аскорбінова кислота), барвники (наприклад, неорганічні пігменти, такі як оксиди заліза) або агенти, що змінюють смак і/або запах. Даний винахід також стосується лікарських засобів, які включають принаймні одну сполуку, пропоновану в даному винаході, звичайно разом з одним або більшою кількістю інертних, нетоксичних, фармацевтично прийнятних інертних наповнювачів, і їх застосування для зазначених вище цілей. Для забезпечення ефективних результатів при внутрішньовенному введенні звичайно краще вводити кількості, які складають приблизно від 0,001 21 до 10 мг/кг, бажано - приблизно 0,01 до 5 мг/(кг маси тіла), і при пероральному введенні доза становить приблизно від 0,01 до 25 мг/кг, бажано - від 0,1 до 10 мг/(кг маси тіла). Проте у відповідних випадках може виявитися доцільним відхилення від зазначених кількостей, особливо залежно від маси тіла, шляху введення, індивідуальної реакції на активний інгредієнт, типу препарату та часу введення або інтервалів між введеннями. Так, у деяких випадках може виявитися достатнім введення кількості, меншої, ніж зазначена мінімальна, а в інших випадках буде необхідно перевищити зазначену верхню граничну кількість. У випадку введення великих кількостей може виявитися доцільним їх розділення на декілька окремих доз, які вводяться протягом доби. Якщо не зазначено інше, то виражені у відсотках вмісти в описах досліджень і прикладах є масовими; виражені в частинах вмісти також є масовими. Відношення кількостей розчинників, співвідношення при розведенні й значення концентрацій розчинів рідин у рідинах у всіх випадках є об'ємними. Виражені у відсотках значення виходів сполук у прикладах є молярними. A. Приклади Абревіатури: BOC CDCl3 ПХІ ДІЕА ДМСО ДМФ ЕДХ ЕУ ІЕР год. ВЕРХ ВВ РХ-МС ДАЛ хв МС МТБЕ ЯМР Pd-C PyBOP ОФВЕРХ КТ Rt ТФК ТГФ трет-бутоксикарбоніл дейтерохлороформ пряма хімічна іонізація (у МС) N,N-діізопропілетиламін диметилсульфоксид N,N-диметилформамід N-(3-диметиламіноізопропіл)-N'етилкарбодіімідгідрохлорид іонізація електронним ударом (у МС) іонізація електророзпиленням (у МС) години високоефективна рідинна хроматографія високий вакуум об'єднана рідинна хроматографія - масспектроскопія діізопропіламід літію хвилини мас-спектроскопія метил-трет-бутиловий ефір спектроскопія ядерного магнітного резонансу паладій на вугіллі 1-бензотриазолілокситрипіролідинофосфонійгексафторфосфат ВЕРХ з оберненою фазою кімнатна температура час утримання (у ВЕРХ) трифтороцтова кислота тетрагідрофуран Загальні методики РХ-МС і ВЕРХ: Методика 1 (РХ-МС): Прилад: Micromass Quattro LCZ з HPLC Agilent series 1100; колонка: Phenomenex Synergi 2 мкм Hydro-RP Mercury 20 мм4 мм; елюент A: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 94934 22 мл 50% мурашиної кислоти; градієнт: 0,0 хв 90%A 2,5 хв 30%A 3,0 хв 5%A 4,5 хв 5%A; швидкість потоку: 0,0 хв 1 мл/хв, 2,5 хв/3,0 хв/4,5 хв 2 мл/хв; температура печі: 50°C; довжина хвилі УФдетектування: 208-400 нм. Методика 2 (РХ-МС): тип приладу МС: Micromass ZQ; тип приладу HPLC: Waters Alliance 2795; колонка: Phenomenex Synergi 2 мкм HydroОФ Mercury 20 мм4 мм; елюент A: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнт: 0,0 хв 90%A 2,5 хв 30%A 3,0 хв 5%A 4,5 хв 5%A; швидкість потоку: 0,0 хв 1 мл/хв, 2,5 хв/3,0 хв/4,5 хв 2 мл/хв; температура печі: 50°C; довжина хвилі УФ-детектування: 210 нм. Методика 3 (РХ-МС): тип приладу МС: Micromass ZQ; тип приладу HPLC: HP 1100 series; UV DAD; колонка: Phenomenex Synergi 2 мкм Hydro-ОФ Mercury 20 мм4 мм; елюент A: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнт: 0,0 хв 90%A 2,5 хв 30%A 3,0 хв 5%A 4,5 хв 5%A; швидкість потоку: 0,0 хв 1 мл/хв, 2,5 хв/3,0 хв/4,5 хв 2 мл/хв; температура печі: 50°C; довжина хвилі УФ-детектування: 210 нм. Методика 4 (РХ-МС): Прилад: Micromass Platform LCZ з HPLC Agilent series 1100; колонка: Thermo Hypersil GOLD 3 мкм 20 мм4 мм; елюент A: 1 л води + 0,5 мл 50% мурашиної кислоти, елюент B: 1 л ацетонітрилу + 0,5 мл 50% мурашиної кислоти; градієнт: 0,0 хв 100%A 0,2 хв 100%A 2,9 хв 30%A 3,1 хв 10%A 5,5 хв 10%A; температура печі: 50°C; швидкість потоку: 0,8 мл/хв; довжина хвилі УФ-детектування: 210 нм. Методика 5 (препаративна ВЕРХ, мурашина кислота): колонка: Grom-Sil 120 ODS-4HE, 10 мкм, SNr. 3331, 250 мм×30 мм. Елюент A: мурашина кислота 0,1% у воді, елюент B: ацетонітрил; швидкість потоку: 50 мл/хв. програма: 0-3 хв: 10% B; 327 хв: градієнтний режим від 95% B; 27-34 хв: 95% B; 34,01-38 хв: 10% B. Методика 6 (препаративна ВЕРХ, хлористоводнева кислота): колонка: Grom-Sil 120 ODS-4HE, 10 мкм, SNr. 3331, 250 мм×30 мм. Елюент A: хлористоводнева кислота 0,1% у воді, елюент B: ацетонітрил; швидкість потоку: 50 мл/хв. програма: 0-2 хв 10% B, 3-43 хв: градієнтний режим від 100% B, 43,01-45 хв: 100% B. Методика 7 (аналітична ВЕРХ): Прилад: HP 1100 з детектуванням DAD; колонка: Kromasil 100 ОФ-18, 60 мм2,1 мм, 3,5 мкм; елюент A: 5 мл хлорної кислоти (70%)/л води, елюент B: ацетонітрил; градієнт: 0 хв 2%B, 0,5 хв 2%B, 4,5 хв 90%B, 9 хв 90%B, 9,2 хв 2%B, 10 хв 2%B; швидкість потоку: 0,75 мл/хв; температура колонки: 30°C; довжина хвилі УФ-детектування: 210 нм. Методика 8 (аналітична ВЕРХ): Прилад: HP 1100 з детектуванням DAD; колонка: Kromasil 100 ОФ-18, 60 мм2,1 мм, 3,5 мкм; елюент A: 5 мл хлорної кислоти (70%) /л води, елюент B: ацетонітрил; градієнт: 0 хв 2%B, 0,5 хв 2%B, 4,5 хв 90%B, 6,5 хв 90%B, 6,7 хв 2%B, 7,5 хв 2%B; швидкість потоку: 0,75 мл/хв; температура колонки: 30°C; довжина хвилі УФ-детектування: 210 нм. Вихідні речовини 23 94934 Приклад 1A 2-Бром-4-хлорбензонітрил Br 24 7,95 (d, 1H), 8,18 (d, 1H). Приклад 4A 2-Метил-4-(трифторметокси)бензамід O NC CH3 H2N F Cl 588 мг (2,5 ммоль) 2-Бром-4-хлорбензойної кислоти й 300 мг сечовини розчиняють у суміші дихлорметан/метанол і концентрують на 364 мг оксиду алюмінію (нейтрального) у роторному випарнику. Залишок обробляють мікрохвильовим випромінюванням при 150°C протягом усього 60 хв. Після охолодження залишок перемішують із етилацетатом і водою, фільтрують і водну фазу відокремлюють. Органічну фазу промивають розчином гідрокарбонату натрію, сушать над сульфатом натрію, концентрують у роторному випарнику й потім сушать у високому вакуумі. Продукт (383 мг, 80% чистота, 57% від теоретичного виходу) вводять у наступну реакцію без додаткового очищення. 1 H ЯМР (300 МГц, CDCl3): = 7,72 (d, 1H), 7,60 (d, 1H), 7,42 (dd, 1H). Приклад 2A 2-Хлор-4(трифторметокси)фенілтрифторметоксисульфонат F S O F O O F F F O 4,00 г 2-Хлор-4-трифторметоксифенолу поміщають в 50 мл толуолу й 50 мл 30% водного розчину фосфату калію у воді при 0°C, повільно додають 3,82 мл ангідриду трифторметансульфонової кислоти й суміш перемішують при КТ протягом 1,5 год. Водну фазу відокремлюють і органічну фазу промивають водою, сушать над сульфатом натрію та концентрують. Неочищений продукт (6,2 г) вводять у наступну реакцію в прикладі 3A без очищення. Приклад 3A 2-Хлор-4-трифторметоксибензонітрил Cl NC F F O F 3,00 г Сполуки прикладу 2A розчиняють в 12 мл дегазованого ДМФ разом з 2,04 г ціаніду цинку та 1,00 г тетракіс(трифенілфосфін)паладію й розчин нагрівають в атмосфері аргону при 120°C протягом 2 год. Після охолодження реакційну суміш розбавляють етилацетатом і екстрагують шляхом струшування двічі з насиченим розчином гідрокарбонату натрію й потім насиченим розчином хлориду натрію. Органічну фазу сушать над сульфатом натрію та концентрують. Залишок очищають за допомогою хроматографії на силікагелі (циклогексан/етилацетат 10:1). Одержують 880 мг (44% від теоретичного виходу) цільової сполуки. 1 H ЯМР (300 МГц, ДМСО-d6): = 7,62 (dd, 1H), F CH3 H2N Cl F 795 мг (3,61 ммоль) 2-Метил-4(трифторметокси)бензойної кислоти кип'ятять зі зворотним холодильником з 4 мл (54,8 ммоль) тіонілхлориду й однією краплею ДМФ протягом 30 хв. Після охолодження розчин по краплях повільно вводять в охолоджуваний льодом концентрований водний розчин аміаку. Одержаний осад збирають фільтруванням з відсмоктуванням, розбавляють за допомогою 30 мл води й перемішують при 60°C протягом 1 год. Суміші дають охолонути й тверду речовину збирають фільтруванням і сушать у вакуумі. Вихід 562 мг (71% від теоретичного виходу). РХ-МС (методика 2): Rt = 1,61 хв. + МС (ІЕР+): m/z = 220 (M+H) 1 H ЯМР (400 МГц, ДМСО-d6): = 7,79 (bs, 1H), 7,42-7,50 (m, 2H), 7,19-7,28 (m, 2H), 2,39 (s, 3H). Приклад 5A 2-Метил-4-(трифторметокси)бензиламін F O F O F F В атмосфері аргону при охолодженні льодом приготовляють 18,8 мл (18,8 ммоль) комплексу боран-ТГФ (1M). По краплях додають розчин 823 мг (3,76 ммоль) 2-метил-4(трифторметокси)бензаміду (приклад 4A) в 80 мл ТГФ і потім суміш перемішують при кип'ятінні зі зворотним холодильником протягом 8 год. При охолодженні льодом по краплях додають 80 мл 1 н. хлористоводневої кислоти (до припинення виділення газу) і суміш кип'ятять зі зворотним холодильником протягом 1 год. Потім реакційну суміш підлуговують 1 н. розчином гідроксиду натрію й три рази екстрагують дихлорметаном, об'єднані органічні фази сушать над сульфатом натрію та розчинник видаляють у вакуумі. Одержують масло, яке вводять у наступну реакцію без додаткового очищення. Вихід: 732 мг (95% від теоретичного виходу). РХ-МС (методика 3): Rt = 1,41 хв. + МС (ІЕР+): m/z = 206 (M+H) 1 H ЯМР (400 МГц, CDCl3): = 7,32-7,40 (m, 1H), 6,99-7,11 (m, 2H), 3,95-4,01 (m, 2H), 2,40 (s, 3H). Додавання надлишку HCl у діоксані (4 н.) і видалення летких компонентів у роторному випарнику дає відповідний гідрохлорид. Приклад 6A 2-Бром-4-хлорбензиламін Br H2N Cl 25 При охолодженні льодом приготовляють 13,9 мл (13,9 ммоль) комплексу боран-ТГФ (1 M). Повільно додають розчин 604 мг (2,8 ммоль) 2-бром-4хлорбензонітрилу (приклад 1A) в 60 мл ТГФ. Потім реакційну суміш кип'ятять зі зворотним холодильником протягом 1 год, охолоджують і при охолодженні льодом по краплях додають 20 мл 1 н. хлористоводневої кислоти. Для обробки розчин підлуговують 1 н. розчином гідроксиду натрію й екстрагують дихлорметаном. Органічну фазу сушать над сульфатом натрію та концентрують у роторному випарнику. Неочищений продукт (450 мг, чистота приблизно 73%) вводять у наступну реакцію без очищення. 1 H ЯМР (300 МГц, CDCl3): = 3,89 (s, 2H), 7,357,45 (m [ABM], 2H), 7,55 (d, 1H). Приклад 7A 2-Хлор-4трифторметоксибензиламінгідрохлорид Cl x HCl F H2 N O F F Одержують за аналогією із прикладом 6A зі сполуки прикладу 3A з наступною обробкою за допомогою 4 н. хлористоводневої кислоти в діоксані й видаленням летких компонентів у роторному випарнику. 1 H ЯМР (300 МГц, ДМСО-d6): = 4,15 (s, 2H), 7,52 (d, 1H), 7,70 (s, 1H), 7,78 (d, 1H), 8,56 (bs, 3H). Приклад 8A 2,4-Дихлор-6-метилбензиламінгідрохлорид Cl x HCl H2N H3C Cl Одержують за аналогією із прикладом 6A з 2,4-дихлор-6-метилбензонітрилу з наступною обробкою за допомогою 4 н. хлористоводневої кислоти в діоксані й видаленням летких компонентів у роторному випарнику. 1 H ЯМР (300 МГц, ДМСО-d6): = 2,5 (s, 3H), 4,10 (s, 2H), 7,40 (s, 1H), 7,60 (s, 1H), 8,40 (bs, 3H). РХ-МС (методика 4): Rt = 2,44 хв, МС (ІЕР+) = + 190 (M+H) . Приклад 9A 2-Метил-4трифторметилбензиламінгідрохлорид CH3 H2N x HCl CF3 Одержують за аналогією із прикладом 6A з 2метил-4-трифторметилбензонітрилу з наступною обробкою за допомогою 4 н. хлористоводневої кислоти в діоксані й видаленням летких компонентів у роторному випарнику. 1 H ЯМР (300 МГц, ДМСО-d6): = 2,43 (s, 3H), 4,09 (s, 2H), 7,63 (s, 3H), 8,56 (br. s, 3H). Приклад 10A (повністю-цис)-N-Бензил-3,5-диметил-4 94934 26 гідроксипіперидин CH3 N OH CH3 200 мг (0,60 ммоль) Солі N-бензил-3,5диметилпіперидин-4-ону із ТФК (одержання див. в: Journal of Medicinal Chemistry (1964), 7 (6), 726728) поміщають в 2 мл етанолу при КТ, додають 46 мг (1,21 ммоль) борогідриду натрію й суміш перемішують протягом ночі. Додають 2 мл води й суміш екстрагують шляхом струшування з етилацетатом і насиченим розчином хлориду натрію. Водну фазу повторно екстрагують етилацетатом і об'єднані органічні фази сушать над сульфатом натрію. Видалення розчинника в роторному випарнику дає 130 мг (98% від теоретичного виходу) цільової сполуки, яку без обробки вводять у наступну реакцію. Приклад 11A (повністю-цис)-3,5-Диметил-4гідроксипіперидингідрохлорид CH3 H N OH x HCl CH3 130 мг Сполуки прикладу 10A гідрують з використанням 10% Pd на вугіллі як каталізатор в 10 мл метанолу й 0,5 мл4 M розчину хлориду водню в діоксані при атмосферному тиску протягом 24 год. Каталізатор відфільтровують і фільтрат звільняють від розчинників у вакуумі. Залишок сушать у високому вакуумі. Це дає 98 мг (кількісний вихід) цільової сполуки, яку використовують без додаткового очищення. + МС (ПХІ (NH3)): m/ z = 147 (27) [M+NH4] , 130 + (100) [M+H] . Приклад 12A Етил-(4-гідроксипіперидин-4іл)ацетатгідрохлорид H3C O HO NH x HCl O 3,01 мл (6,02 ммоль) 2 M Розчину ДАЛ у ТГФ розбавляють в 7 мл ТГФ і охолоджують до -78°C. Додають 540 мкл (5,52 ммоль) і розчин перемішують при -78°C протягом 30 хв. По краплях додають розчин 1,00 г (5,01 ммоль) N-третбутоксикарбонілпіперидин-4-ону в 10 мл ТГФ. Суміш перемішують при -78°C протягом ще 1 год і потім повільно нагрівають до КТ протягом ночі. Додають насичений розчин хлориду амонію й продукт екстрагують дихлорметаном. Видалення розчинника дає етил-(N-трет-бутоксикарбоніл-4гідроксипіперидин-4-іл)ацетат. Цей неочищений продукт хроматографують за допомогою ВЕРХ (методика 6), і одночасно трет-бутоксикарбонільну 27 захисну групу відщеплюють за допомогою хлористоводневою кислоти, яка міститься в елюенті. Одержують 478 мг (42% від теоретичного виходу) цільової сполуки. 1 H ЯМР (400 МГц, ДМСО-d6): = 1,20 (t, J = 7,1 Гц, 3H), 1,69-1,86 (m, 4H), 2,48 (s, 2H), 2,96-3,18 (m, 4H), 4,07 (q, J = 7,1 Гц, 2H), 5,05 (br. s, 1H). Приклад 13A 3-Оксо-2,8-діазаспіро[4,5]декангідрохлорид HN NH x HCl O Цільову сполуку одержують із кількісним виходом шляхом обробки 310 мг (1,22 ммоль) 8-третбутоксикарбоніл-3-оксо-2,8-діазаспіро[4,5]декану (одержання див. в: Journal of Medicinal Chemistry (1995), 38(19), 3772-3780) за допомогою 8 мл 4 M розчину хлориду водню в діоксані при КТ протягом 2 год із наступним видаленням летких компонентів у роторному випарнику й у високому вакуумі. + МС (ІЕР+): m/z = 155 [M+H] . 1 H ЯМР (400 МГц, ДМСО-d6): = 1,71 (t, J = 7,1 Гц, 3H), 2,13 (s, 2H), 2,95-3,11 (m, 4H), 3,09 (s, 2H), 7,60 (br. s, 1H), 8,78 (br. s, 2H). Приклад 14A 8-Бензил-2-окса-4,8-діазаспіро[4,5]декан-3-он N O NH O 1,04 г (4,72 ммоль) 4-Аміно-1-бензил-4гідроксиметилпіперидину (одержання див. в: Eur. J. Med. Chim. Ther. (1974) 9, 424-433) суспендують в 16 мл дихлорметану й додають 842 мг (5,2 ммоль) карбонілдіімідазолу. У міру протікання реакції утворюється розчин, який після закінчення реакції розбавляють дихлорметаном і промивають спочатку водою, потім 5 % розчином бікарбонату натрію й ще один раз водою. Органічну фазу сушать над сульфатом натрію й звільняють від розчинника в роторному випарнику. Одержують 1,04 г цільової сполуки у вигляді неочищеного продукту, який вводять у наступну реакцію без обробки. РХ-МС (методика 4): Rt = 1,80 хв, МС (ІЕР+): + m/z = 247 (M+H) 1 H ЯМР (400 МГц, CDCl3): = 1,74-1,84 (m, 4H), 2,40 (br.s, 4H), 3,50 (s, 2H), 4,12 (s, 2H), 5,90 (br.s, 1H), 7,22-7,35 (m, 5H). Приклад 15A 2-Окса-4,8-діазаспіро[4,5]декан-3-он O NH O N H 500 мг (1,61 ммоль) Сполуки прикладу 14A гідрують з використанням 10 мг Pd (10% на вугіллі) у метанолі й 100 мкл 4 н. хлориду водню в діоксані при атмосферному тиску при КТ протягом ночі. Каталізатор відфільтровують і фільтрат звільняють від розчинника в роторному випарнику. Вільну основу неможливо очистити шляхом екстракції етилацетатом і розчином бікарбонату натрію. Тому 94934 28 водну фазу концентрують у роторному випарнику й сушать і залишок перемішують із метанолом. Солі в основному видаляють фільтруванням. Видалення розчинника з фільтрату дає 360 мг неочищеного продукту, який використовують без додаткового очищення. + МС (ПХІ (NH3)): m/z = 174 (M+NH4) , 157 + (M+H) . 1 H ЯМР (400 МГц, MeOD): = 1,68-1,80 (m, 4H), 2,73 (m, 2H), 2,90 (m, 2H), 4,19 (s, 2H). Приклад 16A Етил-(S)-(1-трет-бутоксикарбонілпіперидин-3іл)ацетат O H3C H3C O N O CH3 CH3 O 1 г (5,84 ммоль) Рацемічного етилпіперидин-3ілацетату поміщають у дихлорметан і додають 1,4 г (6,42 ммоль) ди-трет-бутилдикарбонату. Розчин перемішують при КТ до припинення виділення газу, і звільняють від розчинника в роторному випарнику. Два енантіомери розділяють за допомогою хіральної ВЕРХ (Daicel Chirapak AD-H, 5 мкм, 250 мм20 мм, елюент ізогексан/2-пропанол 95:5). Продукт, який елююється першим (Rt = 5,10 хв), є (S)-енантіомером (приклад 16A) (311 мг, 20% від теоретичного виходу). Продукт, який елююється пізніше (Rt = 5,34 хв) є (R)-енантіомером (приклад 17A) (290 мг, 18% від теоретичного виходу). Потім абсолютну стереохімічну конфігурацію встановлюють на основі даних рентгеноструктурного аналізу сполуки прикладу 73. Приклад 17A Етил-(R)-(1-трет-бутоксикарбонілпіперидин-3іл)ацетат O H3C H3C O N O CH3 CH3 O Одержання: див. у прикладі 16A. Приклад 18A Етил-(S)-піперидин-3ілацетатгідротрифторацетат 280 мг (1,03 ммоль) Етил-(S)-(1-третбутоксикарбонілпіперидин-3-іл)ацетату (приклад 16A) перемішують із 2 мл дихлорметану й 2 мл трифтороцтової кислоти при КТ протягом 1 год. Леткі компоненти видаляють у роторному випарнику й залишок сушать у високому вакуумі. Одержане масло (290 мг, 99% від теоретичного виходу) вводять у наступну реакцію без обробки. + МС (ІЕР+): m/z = 172 [M+H] . 1 H ЯМР (400 МГц, CDCl3): = 1,28 (t, 3H), 1,30 (m, 1H), 1,80-2,00 (m, 3H), 2,28-2,35 (m, 3H), 2,70 (br.q, 1H), 2,87 (br.q, 1H), 3,42 (d, 1H), 3,51 (d, 1H), 4,13 (q, 2H), 8,50 (br s, 1H), 9,10 (br s, 1H). Приклад 19A Етил-(R)-піперидин-3ілацетатгідротрифторацетат 29 94934 290 мг (1,07 ммоль) Етил-(R)-(1-третбутоксикарбонілпіперидин-3-іл)ацетат (приклад 17A) перемішують із 2 мл дихлорметану й 2 мл трифтороцтової кислоти при КТ протягом 1 год. Леткі компоненти видаляють у роторному випарнику й залишок сушать у високому вакуумі. Одержане масло (301 мг, 99% від теоретичного виходу) вводять у наступну реакцію без обробки. + МС (ІЕР+): m/z = 172 [M+H] . 1 H ЯМР (400 МГц, CDCl3): = 1,28 (t, 3H), 1,30 (m, 1H), 1,80-2,00 (m, 3H), 2,32 (br s, 3H), 2,70 (m, 1H), 2,87 (m, 1H), 3,42 (d, 1H), 3,50 (d, 1H), 4,13 (q, 2H), 8,72 (br s, 1H), 9,30 (br s, 1H). Приклад 20A Етил-3-[(2,2,2-трифторетил)аміно]-2-(2,4,5трифтор-3-метоксибензоїл)акрилат (E + Z) O O F O F F O NH CH3 F F 2,00 CH3 г (5,79 F ммоль) Етил-3-оксо-3-(2,4,5 30 трифтор-3-метоксифеніл)пропаноату (одержання див. в Journal of Medicinal Chemistry (1995), 38 (22), 4478-87) перемішують при кип'ятінні зі зворотним холодильником в 3,8 мл (4,14 г, 40,55 ммоль) оцтового ангідриду й 4,82 мл (4,29 г, 28,96 ммоль) триетилортоформіату протягом 2 год. Потім розчинник повністю видаляють у роторному випарнику й залишок розчиняють в 10 мл етанолу. До охолоджуваного льодом розчину по краплях додають 1,03 г (10,43 ммоль) 2,2,2-трифтор-1-аміноетану. Суміш нагрівають до кімнатної температури й перемішують при цій температурі протягом ночі. Для обробки розчинник видаляють і залишок вводять у наступну реакцію у вигляді неочищеного продукту без проведення стадій очищення (вихід вважають кількісним). РХ-МС (методика 2): Rt = 2,37 хв, МС (ІЕР+) = + 386 (M+H) . Сполуки наведених нижче прикладів 21A - 25A одержані за аналогією із прикладом 20A з відповідних амінів. 31 94934 Приклад 26A Етил-6,7-дифтор-8-метокси-4-оксо-1-(2,2,2трифторетил)-1,4-дигідрохінолін-3-карбоксилат O O F O F H3C CH3 N O F F F В атмосфері аргону й при охолодженні льодом 0,32 г (8,11 ммоль) 60% гідриду натрію поміщають в 5 мл тетрагідрофурану й по краплях повільно додають розчин 2,23 г (5,79 ммоль) сполуки прикладу 20A в 15 мл тетрагідрофурану. Потім суміш нагрівають до кімнатної температури, перемішують при цій температурі протягом 2 год і витримують протягом ночі. Для обробки по краплях додають 2 мл оцтової кислоти, суміш перемішують протягом 5 хв, розбавляють етилацетатом, декілька разів промивають водою й один раз шляхом 32 струшування з насиченим розчином гідрокарбонату натрію, органічну фазу сушать над сульфатом магнію й фільтрують, і розчинник повністю видаляють у роторному випарнику. Неочищений продукт попередньо очищають за допомогою колонкової хроматографії на силікагелі 60 (елюент: дихлорметан/метанол 100/1 100/2). Для ретельного очищення половину неочищеного продукту очищають за допомогою препаративної ВЕРХ (методика 5) (0,83 г чистого продукту). Іншу половину перекристалізовують з ацетонітрилу (1,02 г). Сумарний вихід становить 1,85 г (87% від теоретичного виходу). ВЕРХ (методика 8): Rt = 4,34 хв + МС (ПХІ (NH3)) = 366 (M+H) . 1 H ЯМР (300 МГц, CDCl3): = 1,41 (t, 3H), 4,15 (s, 3H), 4,41 (q, 2H), 5,23 (q, 2H), 8,11 (dd, 1H), 8,33 (s, 1H). Сполуки прикладів 27A - 31A, наведені в представленій нижче таблиці, одержані за аналогією із прикладом 26A. 33 Приклад 32A 6,7-Дифтор-8-метокси-4-оксо-1-(2,2,2трифторетил)-1,4-дигідрохінолін-3-карбонова кислота O O F OH F H3C N O F F F 800 мг (2,19 ммоль) Сполуки прикладу 26A поміщають в 25 мл суміші оцтова кислот-водасірчана кислота складу 12:8:1 і перемішують при кип'ятінні зі зворотним холодильником протягом 94934 34 ночі. Для обробки розчинник в основному видаляють у роторному випарнику, значення pН залишку обережно доводять до 3 насиченим розчином гідрокарбонату натрію при охолодженні льодом, суспензію розбавляють водою й осад збирають фільтруванням з відсмоктуванням. Після сушіння залишку на фільтрі у високому вакуумі одержують 575 мг цільової сполуки. РХ-МС (методика 3): Rt = 2,41 хв, МС (ІЕР+) = + 338 (M+H) . 1 H ЯМР (300 МГц, CDCl3): = 4,21 (s, 3H), 5,37 (q, 2H), 8,11 (dd, 1H), 8,62 (s, 1H), 14,05 (bs, 1H). Сполуки наведених нижче прикладів 33A - 37A одержані за аналогією із прикладом 32A. 35 94934 Приклад 38A [6,7-Дифтор-8-метокси-4-оксо-1-(2,2,2трифторетил)-1,4-дигідрохінолін-3іл]карбонілдифторборат O F H 3C F O O F B F N O F F F 1,45 г (4,30 ммоль) Сполуки прикладу 32A поміщають в 10 мл тетрагідрофурану, потім додають 6,81 мл (7,63 г, 53,75 ммоль) комплексу трифторид бору-діетиловий ефір і суміш перемішують протя 36 гом ночі при 70°C. Для обробки реакційну суміш охолоджують до кімнатної температури й додають 50 мл діетилового ефіру, суміш перемішують протягом 20 хв і одержаний осад збирають фільтруванням з відсмоктуванням. Сушіння твердої речовини у високому вакуумі дає 1150 мг цільової сполуки, яку вводять у наступну реакцію без очищення. ВЕРХ (методика 7): Rt = 4,25 хв, + МС (ПХІ (NH3)) = 402 (M+NH4) . 1 H ЯМР (300 МГц, ДМСО-d6): = 4,21 (s, 3H), 6,12 (q, 2H), 8,38 (dd, 1H), 9,66 (s, 1H). Сполуки наведених нижче прикладів 39A - 43A одержані за аналогією із прикладом 38A. 37 Приклад 44A [6,7-Дифтор-1-{(1R,2S)-2фторциклопропіламіно}-8-метокси-4-оксо-1,4дигідрохінолін-3-іл]карбонілдифторборат O O F H3C 38 7-(4-Етоксикарбонілпіперидин-1-іл)-6-фтор-1(2-фторетил)-8-метокси-4-оксо-1,4-дигідрохінолін3-карбонова кислота B F H3C N N H3C O F O F З 750 мг (2,39 ммоль) 6,7-дифтор-1-{(1R,2S)-2фторциклопропіламіно}-8-метокси-4-оксо-1,4дигідрохінолін-3-карбонової кислоти (одержання див. в WO 96/01262) і 4,08 г (29 ммоль) ефірату BF3 за аналогією із прикладом одержують 38A 582 мг цільової сполуки. РХ-МС (методика 2): Rt = 1,74 хв + МС (ІЕР+): m/z = 362 (M+H) , 1 H ЯМР (400 МГц, CDCl3): = 9,17 (s, 1H), 8,15 (t, J = 8,5 Гц, 1H), 5,01 (dm, J = 63 Гц, 1H), 4,43 (m, 1H), 4,29 (s, 3H), 2,00-1,75 (m, 3H). Приклад 45A 8,9-Дифтор-3-метил-7-оксо-2,3-дигідро-7H[1,4]оксазино[2,3,4-ij]хінолін-6карбонілдифторборат O O F F O B F N O OH N O O F O O F F O F 94934 CH3 З 1,0 г 8,9-дифтор-3-метил-7-оксо-2,3-дигідро7H-[1,4]оксазино[2,3,4-ij]хінолін-6-карбонової кислоти (одержання див. в Journal of Medicinal Chemistry 1992, 35 (4), 611) і 1,51 г (3 екв.) ефірату BF3 за такою ж методикою, як, наприклад, описана в прикладі 38A, виділяють 1,0 г (85% від теоретичного виходу) цільової сполуки. + МС (ІЕР, позитивна) : m/z = 330 (M+H) . 1 H ЯМР (400 МГц, ДМСО-d6): = 9,64 (s, 1H), 8,15 (dd, J = 7,5, 10,0 Гц, 1H), 5,32 (m, 1H), 4,82 (d, J = 11,6 Гц, 1H), 4,57 (dd, J = 11,5 Гц, 1,8 Гц, 1H), 1,56 (d, J = 7,0 Гц, 3H). Приклад 46A 155 мг (0,38 ммоль) 6,7-Дифтор-1-(2фторетил)-8-метокси-4-оксо-1,4-дигідрохінолін-3іл]-карбонілдифторборату (одержання див. в EP0241206) і 120 мг (0,76 ммоль, 2 екв.) етилпіперидин-4-карбоксилату перемішують в 3 мл ацетонітрилу при 50°C протягом 3 год. Розчинник видаляють у роторному випарнику й до залишку додають 0,56 мл етанолу й 0,53 мл триетиламіну. Цей розчин кип'ятять зі зворотним холодильником протягом 2 год. Розчинники видаляють у роторному випарнику й залишок розбавляють невеликою кількістю ДМСО й розділяють за допомогою препаративної ВЕРХ (методика 5). Концентрування відповідних фракцій у роторному випарнику й сушіння у високому вакуумі дає 100 мг (59% від теоретичного виходу) цільової сполуки. РХ-МС (методика 2): Rt = 2,30 хв, МС (ІЕР+) : + m/z = 439 (M+H) . 1 H ЯМР (500 МГц, CDCl3): = 14,67 (s, 1H), 8,59 (s, 1H), 7,98 (d, J = 12,1 Гц, 1H), 4,83 (dt, J = 25,6, 4 Гц, 2H), 4,71 (dt, J = 47 Гц, 4 Гц, 2H), 4,19 (q, J = 7,1 Гц, 2H), 3,83 (s, 3H), 3,51 (br. d, J = 12 Гц, 2H), 3,23 (br. t, J = 12 Гц, 2H), 2,54 (m, 1H), 2,05 (br. d, J = 10 Гц, 2H), 1,90 (m, 2H), 1,28 (t, J = 7,1 Гц, 3H). Приклад 47A 7-(4-Етоксикарбонілпіперидин-1-іл)-6-фтор-8метокси-4-оксо-1-(2,2,2-трифторетил)-1,4дигідрохінолін-3-карбонова кислота O O F H3C OH N O H3C O N O F F F 39 За такою ж методикою, як, наприклад, описана в прикладі 46A, з 800 мг (2,08 ммоль) [6,7-дифтор8-метокси-4-оксо-1-(2,2,2-трифторетил)-1,4дигідрохінолін-3-іл]карбонілдифторборату (приклад 38A) і 653 мг (4,15 ммоль) етилпіперидин-4карбоксилату одержують 625 мг (63% від теоретичного виходу) цільової сполуки. ВЕРХ (методика 8): Rt = 4,97 хв. + МС (ІЕР+): m/z = 475 [M+H] . 1 H ЯМР (400 МГц, CDCl3): = 14,40 (s, 1H), 8,54 (s, 1H), 7,93 (d, J = 12,1 Гц, 1H), 5,31 (q, J = 7,9 Гц, 2H), 4,19 (q, J = 7,1 Гц, 2H), 3,86 (s, 3H), 3,53 (br. d, J = 12,5 Гц, 2H), 3,23 (br. t, J = 12 Гц, 2H), 2,54 (m, 1H), 2,09-2,01 (m, 2H), 1,97-1,85 (m, 2H), 1,29 (t, J = 7,1 Гц, 3H). Альтернативна методика для одержання більш значних кількостей: 15,5 г (40,3 ммоль) Сполуки прикладу 38A і 12,66 г (80,52 ммоль) етилпіперидин-4 94934 40 карбоксилату перемішують в 290 мл ацетонітрилу при 50°C протягом ночі. Розчинник повністю видаляють у роторному випарнику й залишок перемішують при кип'ятінні зі зворотним холодильником із сумішшю 250 мл етанолу й 125 мл триетиламіну протягом 1 год. Розчинник видаляють у роторному випарнику й залишок розчиняють у метанолі. Цей розчин перемішують із 1000 мл 1 н. хлористоводневої кислоти. Продукт, який осів, збирають фільтруванням з відсмоктуванням і сушать у високому вакуумі. Це дає 19,1 г (74% від теоретичного виходу) цільової сполуки. Сполуки наведених нижче прикладів 48A - 54A одержані за аналогією з інструкціями прикладу 46A. Якщо для піперидинівого фрагмента не зазначена вихідна речовина, це означає, що заміщений піперидин, який використовується, є у продажу. 41 94934 Приклад 55A 7-[(3S)-3-(2-Етокси-2-оксоетил)піперидин-1-іл]6-фтор-8-метокси-4-оксо-1-(2,2,2-трифторетил)1,4-дигідрохінолін-3-карбонова кислота O O F H3C O OH N O H3C N F O F F 290 мг (1,05 ммоль) Сполуки прикладу 18A (Sенантіомер) поміщають в 8 мл ацетонітрилу при КТ і додають 177 мкл N,N-діізопропілетиламіну (1,1 екв.) і потім 356 мг (0,92 ммоль) сполуки прикладу 38A. Суміш перемішують при 50°C. Через 1 год додають 80 мкл N,N-діізопропілетиламіну (0,5 екв.) і через 2 год ще 80 мкл N,Nдіізопропілетиламіну (0,5 екв.). Суміш перемішують при 50°C протягом ночі, потім звільняють від летких компонентів у роторному випарнику. Залишок кип'ятять із 1,4 мл етанолу й 1,4 мл триетиламіну протягом 2 год і розчин охолоджують до КТ. Після видалення летких компонентів у роторному випарнику залишок розбавляють за допомогою ДМСО й розділяють за допомогою препаративної ВЕРХ (методика 5). Одержують 243 мг (52% від теоретичного виходу) цільової сполуки. РХ-МС (методика 2): Rt = 2,65 хв + МС (ІЕР+): m/z = 489 (M+H) 1 H ЯМР (400 МГц, CDCl3): = 14,41 (s, 1H), 8,52 (s, 1H), 7,92 (d, J = 12 Гц, 1H), 5,31 (dq, J = 2,5, 7,9 Гц, 2H), 4,14 (q, J = 7,1 Гц, 2H), 3,84 (s, 3H), 3,50 (br. d, J = 12,1 Гц, 2H), 3,23 (br. d, J = 12,7 Гц, 2H), 3,14 (br. t, J = 11 Гц, 1H), 2,90 (br. t, J ~ 11 Гц, 1H), 2,30-2,20 (m, 3H), 1,96 (br. d, J ~ 8 Гц, 1H), 1,85-1,70 (m, 2H), 1,26 (t, J = 7,1 Гц, 3H). Приклад 56A 7-[(3R)-3-(2-Етокси-2-оксоетил)піперидин-1-іл]6-фтор-8-метокси-4-оксо-1-(2,2,2-трифторетил)1,4-дигідрохінолін-3-карбонова кислота O O F H3C O OH N O H3C N F O F F 42 300 мг (1,05 ммоль) Сполуки прикладу 19A (Rенантіомер) поміщають в 8 мл ацетонітрилу при КТ і додають 183 мкл N,N-діізопропілетиламіну (1,1 екв.) і потім 368 мг (0,96 ммоль) сполуки прикладу 38A. Суміш перемішують при 50°C. Через 1 год додають 83 мкл N,N-діізопропілетиламіну (0,5 екв.) і через 2 год ще 83 мкл N,Nдіізопропілетиламіну (0,5 екв.). Суміш перемішують при 50°C протягом ночі, потім звільняють від летких компонентів у роторному випарнику. Залишок кип'ятять із 1,4 мл етанолу й 1,4 мл триетиламіну протягом 2 год і розчин охолоджують до КТ. Після видалення летких компонентів у роторному випарнику залишок розбавляють за допомогою ДМСО й розділяють за допомогою препаративної ВЕРХ (методика 5). Одержують 243 мг (52% від теоретичного виходу) цільової сполуки. РХ-МС (методика 2): Rt = 2,65 хв + МС (ІЕР+): m/z = 489 (M+H) 1 H ЯМР (400 МГц, CDCl3): = 14,44 (s, 1H), 8,53 (s, 1H), 7,92 (d, J = 12 Гц, 1H), 5,31 (dq, J = 2,5, 7,9 Гц, 2H), 4,14 (q, J = 7,1 Гц, 2H), 3,84 (s, 3H), 3,50 (br. d, J = 12,1 Гц, 2H), 3,23 (br. d, J = 12,7 Гц, 2H), 3,14 (br. t, J = 11 Гц, 1H), 2,90 (br. t, J ~ 11 Гц, 1H), 2,30-2,20 (m, 3H), 1,96 (br. d, J ~ 8 Гц, 1H), 1,85-1,70 (m, 2H), 1,26 (t, J = 7,1 Гц, 3H). Приклад 57A 7-[4-(2-Етокси-2-оксоетил)піперидин-1-іл]-6фтор-8-метокси-4-оксо-1-(2,2,2-трифторетил)-1,4дигідрохінолін-3-карбонова кислота O O F O H3C O OH N H3C N F O F F 1100 мг (2,86 ммоль) 6,7-дифтор-8-метокси-1(2,2,2-трифторетил)-4-оксо-1,4-дигідрохінолін-3іл]карбонілдифторборату (приклад 38A) і 979 мг (5,71 ммоль, 2 екв.) етилпіперидин-4-ілацетату перемішують в 20,6 мл ацетонітрилу при 50°C протягом 3 год. Розчинник видаляють у роторному випарнику й до залишку додають 14 мл етанолу й 28 мл триетиламіну. Цей розчин кип'ятять зі зворотним холодильником протягом 1 год. Розчинники видаляють у роторному випарнику й залишок 43 94934 розбавляють сумішшю ДМСО/ацетонітрил і розділяють за допомогою препаративної ВЕРХ (методика 5). Концентрування відповідних фракцій у роторному випарнику й сушіння у високому вакуумі дає 358 мг (26% від теоретичного виходу) цільової сполуки. РХ-МС (методика 2): Rt = 2,64 хв + МС (ІЕР+): m/z = 489 (M+H) 1 H ЯМР (400 МГц, CDCl3): = 14,48 (s, 1H), 8,54 (s, 1H), 7,90 (d, 1H), 5,32 (q, 2H), 4,17 (q, 2H), 3,83 (s, 3H), 3,50 (br. d, 2H), 3,22 (br. d, J = 12,7 Гц, 2H), 2,32 (d, 2H), 2,04 (m, 1H), 1,84 (br. d, 2H), 1,49 (dq, 2H), 1,28 (t, 3H). Приклад 58A 7-(4-Амінокарбонілпіперидин-1-іл)-6-фтор-8метокси-4-оксо-1-(2,2,2-трифторетил)-1,4дигідрохінолін-3-карбонова кислота O O F OH N N H2N O O H3C F F F 800 мг (2,08 ммоль) Сполуки прикладу 38A і 533 мг 4-амінокарбонілпіперидину (4,16 ммоль) перемішують в 15 мл ацетонітрилу при 50°C протягом ночі. Розчинник видаляють у роторному випарнику й залишок кип'ятять із 20 мл етанолу й 10 мл триетиламіну протягом 1 год. Після охолодження леткі компоненти видаляють у роторному випарнику. Залишок перемішують із ацетонітрилом і тверду речовину збирають фільтруванням, промивають ацетонітрилом і сушать у ВВ. Одержують 655 мг цільової сполуки (71% від теоретичного виходу). РХ-МС (методика 1): Rt = 1,90 хв + МС (ІЕР+): m/z = 446 (M+H) 1 H ЯМР (400 МГц, ДМСО-d6): = 9,01 (s, 1H), 7,81 (d, J = 12,2 Гц, 1H), 7,31 (s, 1H), 6,82 (s, 1H), 5,78 (q, J = 8,7 Гц, 2H), 3,81 (s, 3H), 3,45 (br. d, J ~ 12,4 Гц, 2H), 3,16 (br. t, J = 12,2 Гц, 2H), 2,38-2,27 (m, 1H), 1,83-1,67 (m, 4H). 44 Приклад 59A 1-Циклопропіл-7-(4-етоксикарбонілпіперидин1-іл)-6-фтор-8-метокси-4-оксо-1,4-дигідрохінолін-3карбонова кислота O F H3C OH N O H3C O N O O Розчин 275 мг (1,75 ммоль) етилпіперидин-4карбоксилату й 250 мг (0,73 ммоль) (T-4)-(1циклопропіл-6,7-дифтор-1,4-дигідро-8-метокси-4оксо-3-хінолінкарбоксилато-O3,O4)трифториду бору (одержання див. в: Journal of Medicinal Chemistry (1995), 38(22), 4478-87) в 5 мл ацетонітрилу перемішують при 50°C протягом ночі. Розчинник видаляють у роторному випарнику й залишок розбавляють за допомогою 5 мл триетиламіну й 50 мл етанолу й кип'ятять зі зворотним холодильником протягом 4 год. Після охолодження розчин концентрують у роторному випарнику й продукт очищають за допомогою ОФ-ВЕРХ (методика 6). Одержують 214 мг (68% від теоретичного виходу) цільової сполуки. 1 H ЯМР (300 МГц, ДМСО-d6): =1,00-1,06 (m, 2H), 1,09-1,16 (m, 2H), 1,21 (t, J = 7,1 Гц, 3H), 1,681,80 (m, 2H), 1,96 (br d, J = 11 Гц, 2H), 2,59 (m, 1H), 3,22 (br. t, J = 12 Гц, 2H), 3,48 (br. d, J = 12,5 Гц, 2H), 3,75 (s, 3H), 4,10 (q, J = 7,1 Гц, 2H), 4,16 (m, 1H), 7,74 (d, J = 12,0 Гц, 1H), 8,69 (s, 1H), 14,95 (s, 1H). За тією ж методикою, що й наведена в прикладі 59A, з тієї ж вихідної речовини й відповідним чином заміщених піперидинів, одержують сполуки наведених нижче прикладів 60A - 62A. Якщо для піперидинівого фрагмента не зазначений номер прикладу, це означає, що заміщений піперидин, який використовується, є у продажу. 45 94934 Приклад 63A 6-Фтор-7-(4-гідроксипіперидин-1-іл)-8-метокси4-оксо-1-(2,2,2-трифторетил)-1,4-дигідрохінолін-3карбонова кислота O O F OH N N O HO F H3C F F 500 мг (1,30 ммоль) Сполуки прикладу 38A і 394 мг (3,90 ммоль) 4-гідроксипіперидину перемішують в 5 мл ацетонітрилу протягом ночі при 50°C. Розчинник видаляють у роторному випарнику й залишок кип'ятять зі зворотним холодильником в 5 мл етанолу протягом 2 год. Суспензію охо Приклад 65A 7-[3-(2-Етокси-2-оксоетил)-піперидин-1-іл]-6фтор-8-метокси-4-оксо-1-(2,2,2-трифторетил)-1,4дигідрохінолін-3-карбонова кислота (рацемічна) O O H3C O O F OH N H 3C 46 лоджують до 0°C і фільтрують. Тверду речовину промивають сумішшю етанол/вода 10:1 і сушать у високому вакуумі. Одержують 253 мг (47% від теоретичного виходу) цільової сполуки. РХ-МС (методика 3): Rt = 2,21 хв, МС (ІЕР+) = + 419 (M+H) . 1 H ЯМР (400 МГц, ДМСО-d6): = 1,50-1,61 (m, 2H), 1,86-1,93 (m, 2H), 3,16 (br t, J = 11,5 Гц, 2H), 3,44 (br d, J = 12 Гц, 2H), 3,70 (m, 1H), 3,80 (s, 3H), 4,79 (d, J = 4,1 Гц, 1H), 5,78 (q, J = 8,6 Гц, 2H), 7,80 (d, J = 12,2 Гц, 1H), 9,01 (s, 1H), 14,66 (s, 1H). За тією ж методикою, що й наведена в прикладі 63A, з використанням відповідним чином заміщеного піперидину, одержують сполуку наступного прикладу 64A. (s, 1H), 14,6 (br s, 1H). Приклад 66A 6-Фтор-7-[(повністю-цис)-4-гідрокси-3,5диметилпіперидин-1-іл]-8-метокси-4-оксо-1-(2,2,2трифторетил)-1,4-дигідрохінолін-3-карбонова кислота O O F N O F F H3C OH N N F 100 мг (0,26 ммоль) Сполуки прикладу 38A і 80 мг (0,47 ммоль) етилпіперидин-3-ілацетату перемішують в 1,5 мл ацетонітрилу при 50°C протягом ночі. Розчинник видаляють у роторному випарнику й залишок кип'ятять зі зворотним холодильником в 3 мл етанолу протягом 1 год. Етанол видаляють у роторному випарнику. Залишок декілька разів перемішують із етанолом і розчинник видаляють у роторному випарнику. Потім тверду речовину розчиняють в 4 мл суміші етанол/вода 8:2 і основну частину етанолу видаляють відгоном і при цьому осаджується продукт. Суміш охолоджують до 0°C протягом 20 хв і продукт збирають фільтруванням. Тверду речовину сушать у високому вакуумі. Одержують 85 мг (67% від теоретичного виходу) цільової сполуки. РХ-МС (методика 2): Rt = 2,62 хв + МС (ІЕР+): m/z = 489 (M+H) 1 H ЯМР (400 МГц, ДМСО-d6): = 1,18 (t, 3H), 1,22 (m, 1H), 1,59-1,80 (m, 2H), 1,84 (br d, 1H), 2,09 (m, 1H), 2,30 (d, 2H), 3,11 (t, 1H), 3,39 (m, 2H), 3,79 (s, 3H), 4,05 (q, 2H), 5,78 (q, 2H), 7,80 (d, 1H), 9,01 O HO CH3 H3C F F F 201 мг (0,52 ммоль) Сполуки прикладу 38A і 95 мг (0,57 ммоль) (повністю-цис)-3,5-диметил-4гідроксипіперидингідрохлориду (приклад 11A) перемішують із 109 мкл (0,63 ммоль) N,Nдіізопропілетиламіну в 1,5 мл ацетонітрилу при 50°C протягом ночі. Розчинник видаляють у роторному випарнику й залишок розбавляють за допомогою 2 мл триетиламіну й 4 мл етанолу та кип'ятять зі зворотним холодильником протягом 1 год. Після охолодження розчин звільняють від розчинників у роторному випарнику й продукт очищають за допомогою ОФ-ВЕРХ (методика 5). Одержують 36 мг (15% від теоретичного виходу) цільової сполуки. РХ-МС (методика 2): Rt = 2,28 хв, МС (ІЕР+) = + 447 (M+H) . 1 H ЯМР (400 МГц, CDCl3): = 1,01 (d, J = 6,9 Гц, 6H), 1,43 (br.s, 1H), 2,02 (m, 2H), 3,09 (dd, J = 4,2, 12,4 Гц, 2H), 3,22 (br t, J = 11,5 Гц, 2H), 3,76 (br s, 1H), 3,78 (s, 3H), 5,31 (q, J = 7,9 Гц, 2H), 7,91 (d, 47 94934 J = 12,1 Гц, 1H), 8,52 (s, 1H), 14,50 (s, 1H). Приклад 67A 6-Фтор-8-метокси-4-оксо-7-{3-оксо-1-окса-3,8діазаспіро[4,5]дец-8-ил}-1-(2,2,2-трифторетил)-1,4дигідрохінолін-3-карбонова кислота O 48 6-Фтор-8-метокси-4-оксо-7-(3-оксо-2,8діазаспіро[4,5]дец-8-ил)-1-(2,2,2-трифторетил)-1,4дигідрохінолін-3-карбонова кислота O O F OH O F N OH N O N N HN O HN F O F O З 760 мг (4,87 ммоль) 1-окса-3,8діазаспіро[4,5]декан-2-ону (одержання див. в Journal of Medicinal Chemistry (1981), 24, 1320-28) і 937 мг (2,43 ммоль) сполуки прикладу 38A за аналогією з одержанням сполуки прикладу 66A виділяють 160 мг (6% від теоретичного виходу) цільової сполуки. РХ-МС (методика 3): Rt = 2,30 хв, МС (ІЕР+) = + 474 (M+H) . Приклад 68A 1-Циклопропіл-6-фтор-8-метокси-4-оксо-7-{3оксо-2,8-діазаспіро[4,5]декан-8-іл}-1,4дигідрохінолін-3-карбонова кислота O O F N O H3C O З 99 мг (0,52 ммоль) 3-Оксо-2,8діазаспіро[4,5]декангідрохлориду (приклад 13A) вільну основу виділяють шляхом перемішування з 1 г трис(аміноетил)полістиролу в суміші дихлорметан/метанол 10:1 протягом 20 хв і наступного фільтрування й видалення розчинників у роторному випарнику. Залишок розбавляють за допомогою 3 мл ацетонітрилу й перемішують із 89 мг (0,26 ммоль) (T-4)-(1-циклопропіл-6,7-дифтор-1,4дигідро-8-метокси-4-оксо-3-хінолінкарбоксилатоO3,O4)трифториду бору (одержання див. в: Journal of Medicinal Chemistry (1995), 38(22), 44784487) при 50°C протягом ночі. Розчинник видаляють у роторному випарнику й залишок розбавляють за допомогою 3 мл триетиламіну та 30 мл етанолу й кип'ятять зі зворотним холодильником протягом 1,5 год. Після охолодження розчинники видаляють у роторному випарнику й залишок розбавляють невеликою кількістю ДМСО та очищають за допомогою ОФ-ВЕРХ (методика 5). Одержують 56 мг (50% від теоретичного виходу) цільової сполуки. РХ-МС (методика 3): Rt = 1,92 хв, МС (ІЕР+) = + 430 (M+H) . 1 H ЯМР (400 МГц, CDCl3): = 0,97-1,03 (m, 2H), 1,18-1,27 (m, 2H), 1,86 (t, J = 5,3 Гц, 4H), 2,35 (s, 2H), 3,32 (s, 2H), 3,33-3,43 (m, 4H), 3,79 (s, 3H), 4,03 (m, 1H), 5,50 (s, 1H), 7,89 (d, J = 12,2 Гц, 1H), 8,82 (s, 1H), 14,73 (s, 1H). Приклад 69A Cl O N H O OH N HN За аналогією з одержанням сполуки прикладу 68A з 146 мг сполуки прикладу 38A (0,38 ммоль) і 145 мг (0,76 ммоль) 3-оксо-2,8діазаспіро[4,5]декангідрохлориду (приклад 13A) одержують 73 мг (21% від теоретичного виходу) цільової сполуки. РХ-МС (методика 3): Rt = 2,13 хв, МС (ІЕР+) = + 472 (M+H) . Приклад 70A 8-Хлор-1-циклопропіл-N-(2,4-дихлорбензил)6,7-дифтор-4-оксо-1,4-дигідрохінолін-3карбоксамід Cl N F F F F F H3 C O F H3 C Cl 15,0 г 8-Хлор-1-циклопропіл-6,7-дифтор-4оксо-1,4-дигідрохінолін-3-карбонової кислоти (одержання див. в DE 3420743 або публікації Y. Kimura et al. J. Med. Chem. 1994, 37 (20), 3344) розчиняють в 500 мл ДМФ і додають 31,3 г PyBOP і 10,6 г 2,4-дихлорбензиламіну. Через 1 день розчинник видаляють у роторному випарнику й залишок очищають за допомогою колонкової флешхроматографії на силікагелі (толуол/етилацетат 95:5). Одержують 21,2 г (93% від теоретичного виходу) цільової сполуки. РХ-МС (методика 1): Rt = 3,10 хв, МС (ІЕР+) = + 457 (M+H) . 1 H ЯМР (300 МГц, ДМСО-d6): = 1,05-1,16 (m, 2H), 1,18-1,29 (m, 2H), 4,32 (m, 1H), 4,99 (d, J = 6,0 Гц, 1H), 7,35-7,45 (m, 2H), 7,64 (d, J = 2,0 Гц, 1H), 8,22 (dd, J = 8,9, 10,0 Гц, 1H), 8,79 (s, 1H), 10,01 (t, J = 6,0 Гц, 1H). Типові варіанти здійснення Приклад 1 Етил-1-[3-{[(2,4-дихлорбензил)аміно]карбоніл}6-фтор-8-метокси-4-оксо-1-(2,2,2-трифторетил)1,4-дигідрохінолін-7-іл]піперидин-4-карбоксилат O H3 C N H N O H3 C O Cl O F Cl N O F F F 200,0 мг (0,42 ммоль) Сполуки прикладу 47A і 111,3 мг (0,63 ммоль) 2,4-дихлорбензиламіну поміщають в 2,6 мл N,N-диметилформаміду й дода 49 94934 ють 257 мкл (1,48 ммоль) N,N-діізопропілетиламіну й на закінчення 438,8 мг (0,84 ммоль) PyBOP. Реакційну суміш перемішують при кімнатній температурі протягом 3 год. Для обробки суміш розбавляють етилацетатом і двічі промивають водою, об'єднані водні фази один раз екстрагують етилацетатом і об'єднані органічні фази сушать над сульфатом натрію й повністю звільняють від розчинника в роторному випарнику. Ретельне очищення залишку за допомогою препаративної ОФ-ВЕРХ (методика 5) дає 250,0 мг цільової сполуки (94% від теоретичного виходу). 1 H ЯМР (400 МГц, CDCl3): = 1,29 (t, J = 7 Гц, 3H), 1,83-1,96 (m, 2H), 2,03 (dd, J = 3, 13 Гц, 2H), 2,52 (tt, J = 3,8, 11,1 Гц, 1H), 3,21 (br t, J = 12 Гц, 2H), 3,49 (br d, J = 12 Гц, 2H), 3,84 (s, 3H), 4,19 (q, J = 7,1 Гц, 2H), 4,70 (d, J = 6,2 Гц, 2H), 5,24 (q, J = 8,1 Гц, 2H), 7,21 (dd, J = 2,0, 8,3 Гц, 1H), 7,390 (d, J = 8,1 Гц, 1H), 7,392 (d, J = 2 Гц, 1H), 7,91 (d, J = 12,5 Гц, 1H), 8,54 (s, 1H), 10,22 (t, J = 5,9 Гц, 1H). ВЕРХ (методика 7): Rt = 5,65 хв. + МС (ІЕР+): m/z = 632 (M+H) Приклад 2 Етил-1-[6-фтор-8-метокси-3-({[2-метил-4(трифторметокси)бензил]аміно}карбоніл)-4-оксо-1(2,2,2-трифторетил)-1,4-дигідрохінолін-7іл]піперидин-4-карбоксилат O H3 C H3 C O F N H N O CH3 O F O N O F F F F 50 O H3 C H3 C O N O F F F F F O 50,0 мг (0,105 ммоль) Сполуки прикладу 47A і 55,2 мг (0,21 ммоль) 2-хлор-4(трифторметокси)бензиламіну (приклад 7A) поміщають в 1,5 мл N,N-диметилформаміду й додають 101 мкл (0,58 ммоль) N,N-діізопропілетиламіну й на закінчення 137 мг (0,26 ммоль) PyBOP. Через 30 хв всю реакційну суміш розділяють за допомогою препаративної ВЕРХ (методика 5). Одержують 63 мг (87% від теоретичного виходу) цільової сполуки. РХ-МС (методика 3): Rt = 3,43 хв. + МС (ІЕР, позитивна): m/z = 682 (M+H) 1 H ЯМР (400 МГц, CDCl3): = 1,29 (t, J = 7,1 Гц, 3H), 1,83-1,96 (m, 2H), 1,99-2,03 (m, 2H), 2,52 (m, 1H), 3,21 (br. t, J = 12 Гц, 2H), 3,49 (br. d, J = 12 Гц, 2H), 3,84 (s, 3H), 4,19 (q, J = 7,1 Гц, 2H), 4,72 (d, J = 6,0 Гц, 2H), 5,24 (q, J = 8,0 Гц, 2H), 7,10 (d, J = 8,7 Гц, 2H), 7,27 (під сигналом CHCl3, 1H), 7,49 (d, J = 8,7 Гц, 1H), 7,86 (d, J = 12,6 Гц, 1H), 8,55 (s, 1H), 10,77 (t, J = 6,0 Гц, 1H). Приклад 4 Етил-1-[6-фтор-1-(2-фторетил)-8-метокси-3({[2-метил-4(трифторметокси)бензил]аміно}карбоніл)-4-оксо1,4-дигідрохінолін-7-іл]піперидин-4-карбоксилат O F 100,0 мг (0,21 ммоль) Сполуки прикладу 47A і 157,2 мг (0,42 ммоль) 2-метил-4(трифторметокси)бензиламіну (приклад 5A) поміщають в 3 мл N,N-диметилформаміду й додають 202 мкл (1,16 ммоль) N,N-діізопропілетиламіну й на закінчення 274,2 мг (0,84 ммоль) PyBOP. Через 3 год при КТ всю реакційну суміш розділяють за допомогою препаративної ВЕРХ (методика 5). Одержують 96,0 мг (69% від теоретичного виходу) цільової сполуки. 1 H ЯМР (400 МГц, CDCl3): = 1,29 (t, J = 7,1 Гц, 3H), 1,83-1,96 (m, 2H), 2,03 (br dd, J = 3, 13 Гц, 2H), 2,40 (s, 3H), 2,51 (m, 1H), 3,21 (br. t, J = 12 Гц, 2H), 3,49 (br. d, J = 12 Гц, 2H), 3,84 (s, 3H), 4,19 (q, J = 7,1 Гц, 2H), 4,62 (d, J = 5,6 Гц, 2H), 5,24 (q, J = 8,0 Гц, 2H), 6,98-7,03 (m, 2H), 7,36 (d, J = 8,1 Гц, 1H), 7,88 (d, J = 12,5 Гц, 1H), 8,56 (s, 1H), 10,07 (t, J = 5,6 Гц, 1H). ВЕРХ (методика 8): Rt = 5,43 хв. + МС (ІЕР+): m/z = 662 (M+H) Приклад 3 Етил-1-[3-({[2-хлор-4(трифторметокси)бензил]аміно}карбоніл)-6-фтор8-метокси-4-оксо-1-(2,2,2-трифторетил)-1,4дигідрохінолін-7-іл]піперидин-4-карбоксилат F N H N O Cl O F H3 C H3 C O F N H O N N O CH3 O F F F O F 72,0 мг (0,164 ммоль) Сполуки прикладу 46A і 47,6 мг (0,197 ммоль) 2-метил-4(трифторметокси)бензиламінгідрохлориду (приклад 5A) поміщають в 2,15мл N,Nдиметилформаміду й додають 157 мкл (0,90 ммоль) N,N-діізопропілетиламіну й на закінчення 170,9 мг (0,33 ммоль) PyBOP. Після перемішування протягом ночі при КТ всю реакційну суміш розділяють за допомогою препаративної ВЕРХ (методика 5). Одержують 85 мг (83% від теоретичного виходу) цільової сполуки. РХ-МС (методика 3): Rt = 3,22 хв. + МС (ІЕР, позитивна): m/z = 626 (M+H) 1 H ЯМР (400 МГц, CDCl3): = 1,29 (t, J = 7,1 Гц, 3H), 1,83-1,96 (m, 2H), 2,03 (m, 2H), 2,41 (s, 3H), 2,51 (m, 1H), 3,21 (br. t, J = 12 Гц, 2H), 3,47 (br. d, J = 13 Гц, 2H), 3,82 (s, 3H), 4,18 (q, J = 7,1 Гц, 2H), 4,62 (d, J = 5,7 Гц, 2H), 4,69 (dt, J = 46, 4 Гц, 2H), 4,78 (dt, J = 31, 4 Гц, 2H), 7,01 (d, J = 8,0 Гц, 1H), 7,02 (s, 1H), 7,36 (d, J = 8,0 Гц, 1H), 7,93 (d, J = 12,6 Гц, 1H), 8,64 (s, 1H), 10,19 (t, J = 5,7 Гц, 1H). Приклад 5 Етил-[6-фтор-8-метокси-3-({[2-метил-4(трифторметокси)бензил]аміно}карбоніл)-4-оксо-1(2,2,2-трифторетил)-1,4-дигідрохінолін-7 51 94934 52 іл]піперидин-4-ілацетат O O F O H3C O H 3C F N H N H3C CH3 O O N O F F 100,0 мг (0,18 ммоль) Сполуки прикладу 57A і 46,7 мг (0,19 ммоль) 2-метил-4(трифторметокси)бензиламінгідрохлориду (приклад 5A) поміщають в 1 мл N,N-диметилформаміду й додають 177 мкл (1,01 ммоль) N,Nдіізопропілетиламіну й на закінчення 234,7 мг (0,46 ммоль) PyBOP. Через 1,5 год при КТ всю реакційну суміш розділяють за допомогою препаративної ВЕРХ (методика 5). Одержують 82,0 мг (66% від теоретичного виходу) цільової сполуки. РХ-МС (методика 2): Rt = 3,22 хв. + МС (ІЕР, позитивна): m/z = 676 (M+H) 1 H ЯМР (400 МГц, CDCl3): = 1,28 (t, J = 7,1 Гц, 3H), 1,46 (m, 2H), 1,82 (br. d, J = 11 Гц, 2H), 2,20 (m, 1H), 2,32 (d, J = 7,1 Гц, 2H), 2,41 (s, 3H), 3,20 (br. t, J = 12 Гц, 2H), 3,45 (br. d, J = 12 Гц, 2H), 3,81 (s, 3H), 4,16 (q, J = 7,1 Гц, 2H), 4,62 (d, J = 5,6 Гц, 2H), 5,25 (q, J = 8,0 Гц, 2H), 7,00-7,04 (m, 2H), 7,36 (d, J = 8,1 Гц, 1H), 7,87 (d, J = 12,5 Гц, 1H), 8,56 (s, 1H), 10,08 (t, J = 5,6 Гц, 1H). Приклад 6 Етил-[3-{[(2,4-дихлорбензил)аміно]карбоніл}-6фтор-8-метокси-4-оксо-1-(2,2,2-трифторетил)-1,4дигідрохінолін-7-іл]піперидин-3-ілацетат N H N F F F F O O Cl N O H3 C Cl O F F F 78 мг (0,16 ммоль) Сполуки прикладу 65A, 116,3 мг (0,22 ммоль) PyBOP і 9,7 мг ДМАП (4диметиламінопіридин) (0,08 ммоль) поміщають в 2 мл N,N-диметилформаміду й додають 56,2 мг (0,32 ммоль) 2,4-дихлорбензиламіну. Суміш перемішують при КТ протягом ночі й потім розділяють за допомогою препаративної ВЕРХ (методика 5). Одержують 49,0 мг (47% від теоретичного виходу) цільової сполуки. РХ-МС (методика 2): Rt = 3,21 хв. + МС (ІЕР, позитивна): m/z = 646 (M+H) 1 H ЯМР (400 МГц, ДМСО-d6): = 1,16 (t, J = 7,1 Гц, 3H), 1,18-1,28 (m, 1H), 1,60-1,78 (m, 2H), 1,84 (m, 1H), 2,09 (m, 1H), 2,27-2,31 (m, 2H), 2,87 (br. t, J = 10,5 Гц, 1H), 3,08 (br. t, J = 11,5 Гц, 1H), 3,36 (m, частково під сигналом води, 1H ?), 3,78 (s, 3H), 4,04 (q, J = 7,1 Гц, 2H), 4,60 (d, J = 6,0 Гц, 2H), 5,69 (q, J = 8,7 Гц, 2H), 7,38-7,45 (m, 2H), 7,64 (d, J = 1,7 Гц, 1H), 7,77 (d, J = 12,1 Гц, 1H), 8,83 (s, 1H), 10,14 (t, J = 6,0 Гц, 1H). За аналогією із прикладом 1 одержують сполуки наведених нижче прикладів 7 - 19. Якщо для вихідного аміну не зазначений номер прикладу, це означає, що він є у продажу. 53 94934 54 55 94934 Приклад 20 7-[(3S)-3-(2-Етокси-2-оксоетил)піперидин-1-іл]6-фтор-8-метокси-N-[2-метил-4(трифторметокси)бензил]-4-оксо-1-(2,2,2трифторетил)-1,4-дигідрохінолін-3-карбоксамід O H3 C F O H3 C O F F F 100,0 мг (0,21 ммоль) Сполуки прикладу 55A і 59,4 мг (0,25 ммоль) 2-метил-4(трифторметокси)бензиламінгідрохлориду (приклад 5A) поміщають в 2,7 мл N,Nдиметилформаміду й додають 196 мкл (1,13 ммоль) N,N-діізопропілетиламіну й на закінчення 213,1 мг (0,41 ммоль) PyBOP. Реакційну суміш перемішують протягом ночі при КТ і потім розділяють, як ціле, за допомогою препаративної ВЕРХ (методика 5). Одержують 100,0 мг (72% від теоретичного виходу) цільової сполуки. РХ-МС (методика 2): Rt = 3,24 хв + МС (ІЕР+): m/z = 676 (M+H) 1 H ЯМР (400 МГц, CDCl3): = 10,08 (t, J = 5,7 Гц, 1H), 8,55 (s, 1H), 7,87 (d, J = 12,4 Гц, 1H), 7,36 (d, J = 8,3 Гц, 1H), 6,98-7,03 (m, 2H), 5,25 (q, J = 7,9 Гц, 2H), 4,62 (d, J = 5,6 Гц, 2H), 4,14 (q, J = 7,1 Гц, 2H), 3,83 (s, 3H), 3,45 (br. d, J ~ 11 Гц, 1H), 3,38 (br. d, J ~ 12 Гц, 1H), 3,12 (br.t, J ~ 11 Гц, 1H), 2,88 (br.t, J ~ 11 Гц, 1H), 2,41 (s, 3H), 2,30-2,20 (m, 3H), 1,95 (br. d, J ~ 11 Гц, 1H), 1,85-1,70 (m, 2H), 1,25 (t, J = 7,1 Гц, 3H), 1,24 (m, 1H). Приклад 21 7-[(3R)-3-(2-Етокси-2-оксоетил)піперидин-1-іл] F N H N H3 C CH3 O F O F F O H3 C F O N 6-фтор-8-метокси-N-[2-метил-4(трифторметокси)бензил]-4-оксо-1-(2,2,2трифторетил)-1,4-дигідрохінолін-3-карбоксамід O N H N O CH3 O 56 O N O F F F F F 100,0 мг (0,21 ммоль) Сполуки прикладу 56A і 59,4 мг (0,25 ммоль) 2-метил-4(трифторметокси)бензиламінгідрохлориду (приклад 5A) поміщають в 2,7 мл N,Nдиметилформаміду й додають 196 мкл (1,13 ммоль) N,N-діізопропілетиламіну й на закінчення 213,1 мг (0,41 ммоль) PyBOP. Реакційну суміш перемішують протягом ночі при КТ і потім розділяють, як ціле, за допомогою препаративної ВЕРХ (методика 5). Одержують 108 мг (78% від теоретичного виходу) цільової сполуки. РХ-МС (методика 2): Rt = 3,23 хв + МС (ІЕР+): m/z = 676 (M+H) 1 H ЯМР (400 МГц, CDCl3): = 10,08 (t, J = 5,7 Гц, 1H), 8,55 (s, 1H), 7,87 (d, J = 12,4 Гц, 1H), 7,36 (d, J = 8,3 Гц, 1H), 6,98-7,03 (m, 2H), 5,25 (q, J = 7,9 Гц, 2H), 4,62 (d, J = 5,6 Гц, 2H), 4,14 (q, J = 7,1 Гц, 2H), 3,83 (s, 3H), 3,45 (br. d, J ~ 11 Гц, 1H), 3,38 (br. d, J ~ 12 Гц, 1H), 3,12 (br. t, J ~ 11 Гц, 1H), 2,88 (br. t, J ~ 11 Гц, 1H), 2,41 (s, 3H), 2,30-2,20 (m, 3H), 1,95 (br. d, J ~ 11 Гц, 1H), 1,85-1,70 (m, 2H), 1,25 (t, J = 7,1 Гц, 3H), 1,24 (m, 1H). За аналогією із прикладом 1 також одержують сполуки наведених нижче прикладів 22 - 30. 57 94934 Приклад 31 1-[6-Фтор-8-метокси-3-({[2-метил-4(трифторметокси)бензил]аміно}карбоніл)-4-оксо-1(2,2,2-трифторетил)-1,4-дигідрохінолін-7іл]піперидин-4-карбоксамід O O O N O H3 C F N H N H2 N CH3 O F F F 58 J = 5,6 Гц, 2H), 5,26 (q, J = 8,0 Гц, 2H), 5,34 (br.s, 1H), 5,49 (br s, 1H), 6,98-7,04 (m, 2H), 7,34 (d, J = 8,1 Гц, 1H), 7,89 (d, J = 12,5 Гц, 1H), 8,56 (s, 1H), 10,06 (t, J ~ 5Hz, 1H). Приклад 32 6-Фтор-7-[(повністю-цис)-4-гідрокси-3,5диметилпіперидин-1-іл]-8-метокси-N-[2-метил-4(трифторметокси)бензил]-4-оксо-1-(2,2,2трифторетил)-1,4-дигідрохінолін-3-карбоксамід O F O F N H F F 60,0 мг (0,14 ммоль) Сполуки прикладу 58A і 46 мг (0,16 ммоль) 2-метил-4(трифторметокси)бензиламінгідрохлориду (приклад 5A) поміщають в 1,7 мл N,Nдиметилформаміду й додають 129 мкл (0,74 ммоль) N,N-діізопропілетиламіну й на закінчення 140,2 мг (0,27 ммоль) PyBOP. Реакційну суміш перемішують протягом ночі при КТ і потім розділяють, як ціле, за допомогою препаративної ВЕРХ (методика 5). Одержують 57 мг (67% від теоретичного виходу) цільової сполуки. РХ-МС (методика 1): Rt = 2,63 хв + МС (ІЕР+): m/z = 633 (M+H) . 1 H ЯМР (400 МГц, CDCl3): = 1,88-2,03 (m, 4H), 2,40 (m, 1H), 2,41 (s, 3H), 3,23 (br. t, J = 12 Гц, 2H), 3,53 (br. d, J = 12 Гц, 2H), 3,87 (s, 3H), 4,62 (d, H 3C N N O O HO CH 3 CH3 H3C F F CF3 F 36 мг (0,081 ммоль) Сполуки прикладу 66A і 21,4 мг (0,089 ммоль) 2-метил-4(трифторметокси)бензиламінгідрохлориду (приклад 5A) поміщають в 0,7 мл N,Nдиметилформаміду й додають 77 мкл (0,44 ммоль) N,N-діізопропілетиламіну й на закінчення 105 мг (0,20 ммоль) PyBOP. Реакційну суміш перемішують при КТ протягом 1,5 год, додають 1 мл 1 н. хлористоводневої кислоти й потім суміш розділяють, як ціле, за допомогою препаративної ВЕРХ (методика 5). Одержують 36 мг (70% від теоретичного виходу) цільової сполуки. 59 94934 РХ-МС (методика 3): Rt = 3,24 хв + МС (ІЕР+): m/z = 634 (M+H) . 1 H ЯМР (400 МГц, CDCl3): = 1,01 (d, J = 6,9 Гц, 6H), 2,02 (m, 2H), 2,41 (s, 3H), 3,05 (dd, J = 4,1, 12,4 Гц, 2H), 3,20 (t, J = 11,7 Гц, 2H), 3,74 (s, 1H), 3,77 (s, 3H), 4,62 (d, J = 5,6 Гц, 2H), 5,26 (q, J = 8,0 Гц, 2H), 6,99-7,04 (m, 2H), 7,36 (d, J = 8,1 Гц, 1H), 7,87 (d, J = 12,5 Гц, 1H), 8,55 (s, 1H), 10,10 (t, J ~ 5,4 Гц, 1H). Приклад 33 6-Фтор-8-метокси-N-[2-метил-4(трифторметокси)бензил]-4-оксо-7-(3-оксо-2,8діазаспіро[4,5]дец-8-ил)-1-(2,2,2-трифторетил)-1,4дигідрохінолін-3-карбоксамід O O F N O O H3C F F (q, J = 8,0 Гц, 2H), 6,99-7,03 (m, 2H), 7,36 (d, J = 7,7 Гц, 1H), 7,90 (d, J = 12,5 Гц, 1H), 8,57(s, 1H), 10,05 (t, J ~ 5,5 Гц, 1H). Приклад 34 1-Циклопропіл-6-фтор-8-метокси-N-[2-метил-4(трифторметокси)бензил]-4-оксо-7-(3-оксо-2,8діазаспіро[4,5]дец-8-ил)-1,4-дигідрохінолін-3карбоксамід O F CH3 N H N N O HN O O CF3 H3C O N H N HN CH3 60 CF3 F O 36 мг (0,076 ммоль) Сполуки прикладу 69A і 22,1 мг (0,092 ммоль) 2-метил-4(трифторметокси)бензиламінгідрохлориду (приклад 5A) поміщають в 1,0 мл N,Nдиметилформаміду й додають 73 мкл (0,42 ммоль) N,N-діізопропілетиламіну й на закінчення 79,4 мг (0,15 ммоль) PyBOP. Реакційну суміш перемішують протягом ночі при КТ і потім розділяють, як ціле, за допомогою препаративної ВЕРХ (методика 5). Одержують 27 мг (54% від теоретичного виходу) цільової сполуки. РХ-МС (методика 1): Rt = 2,73 хв + МС (ІЕР+): m/z = 659 (M+H) . 1 H ЯМР (400 МГц, CDCl3): = 1,84-1,88 (m, 4H), 2,34 (s, 2H), 2,41 (s, 3H), 3,31 (s, 2H), 3,32 (br.s, 4H), 3,84 (s, 3H), 4,62 (d, J = 5,6 Гц, 2H), 5,24 28 мг (0,065 ммоль) Сполуки прикладу 68A і 18,9 мг (0,078 ммоль) 2-метил-4(трифторметокси)бензиламінгідрохлориду (приклад 5A) поміщають в 0,8 мл N,Nдиметилформаміду й додають 62 мкл (0,36 ммоль) N,N-діізопропілетиламіну й на закінчення 67,9 мг (0,13 ммоль) PyBOP. Реакційну суміш перемішують протягом 30 хв при КТ і потім розділяють, як ціле, за допомогою препаративної ВЕРХ (методика 5) Одержують. 27 мг (54% від теоретичного виходу) цільової сполуки. РХ-МС (методика 2): Rt = 2,45 хв + МС (ІЕР+): m/z = 617 (M+H) . 1 H ЯМР (400 МГц, CDCl3): = 0,97 (m, 2H), 1,17 (m, 2H), 1,85 (m, 4H), 2,34 (s, 2H), 2,41 (s, 3H), 3,31 (s, 2H), 3,30-3,38 (m, 4H), 3,78 (s, 3H), 3,97 (m, 1H), 4,61 (d, J = 5,4 Гц, 2H), 5,58 (s, 1H), 7,005 (d, J ~ 8 Гц, 1H), 7,01 (s, 1H), 7,36 (d, J = 8,0 Гц, 1H), 7,85 (d, J = 12,4 Гц, 1H), 8,86 (s, 1H), 10,21 (br. s, 1H). За аналогією із прикладом 1 також одержують сполуки наведених нижче прикладів 35 - 42.
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted quinolones iii, processes for the preparation thereof, medicament and methods for virus infection control
Автори англійськоюFuerstner Chantal, Thede Kai, Zimmermann Holger, Brueckner David, Henninger Kerstin, Lang Dieter, Schohe-Loop Rudolf
Назва патенту російськоюЗамещенные хинолоны iii, способ их получения (варианты), лекарственное средство и способ борьбы с инфицированием вирусами (варианты)
Автори російськоюФюрстнер Шанталь, Теде Кай, Циммерманн Хольгер, Брюкнер Давид, Хеннингер Керстин, Ланг Дитер, Шоэ-Лооп Рудольф
МПК / Мітки
МПК: C07D 498/10, C07D 471/10, A61P 31/22, C07D 401/04, C07D 498/04, C07D 401/14, A61K 31/4709
Мітки: засіб, боротьби, варіанти, вірусами, одержання, хінолони, заміщені, спосіб, інфікуванням, лікарський
Код посилання
<a href="https://ua.patents.su/40-94934-zamishheni-khinoloni-iii-sposib-kh-oderzhannya-varianti-likarskijj-zasib-ta-sposib-borotbi-z-infikuvannyam-virusami-varianti.html" target="_blank" rel="follow" title="База патентів України">Заміщені хінолони iii, спосіб їх одержання (варіанти), лікарський засіб та спосіб боротьби з інфікуванням вірусами (варіанти)</a>
Попередній патент: Амфолітичні полімери низької молекулярної маси для особистої гігієни
Наступний патент: Система, пристрій і спосіб асиметричного формування діаграми спрямованості для передавання з однаковою потужністю
Випадковий патент: Спосіб реєстрації руху транспорту












