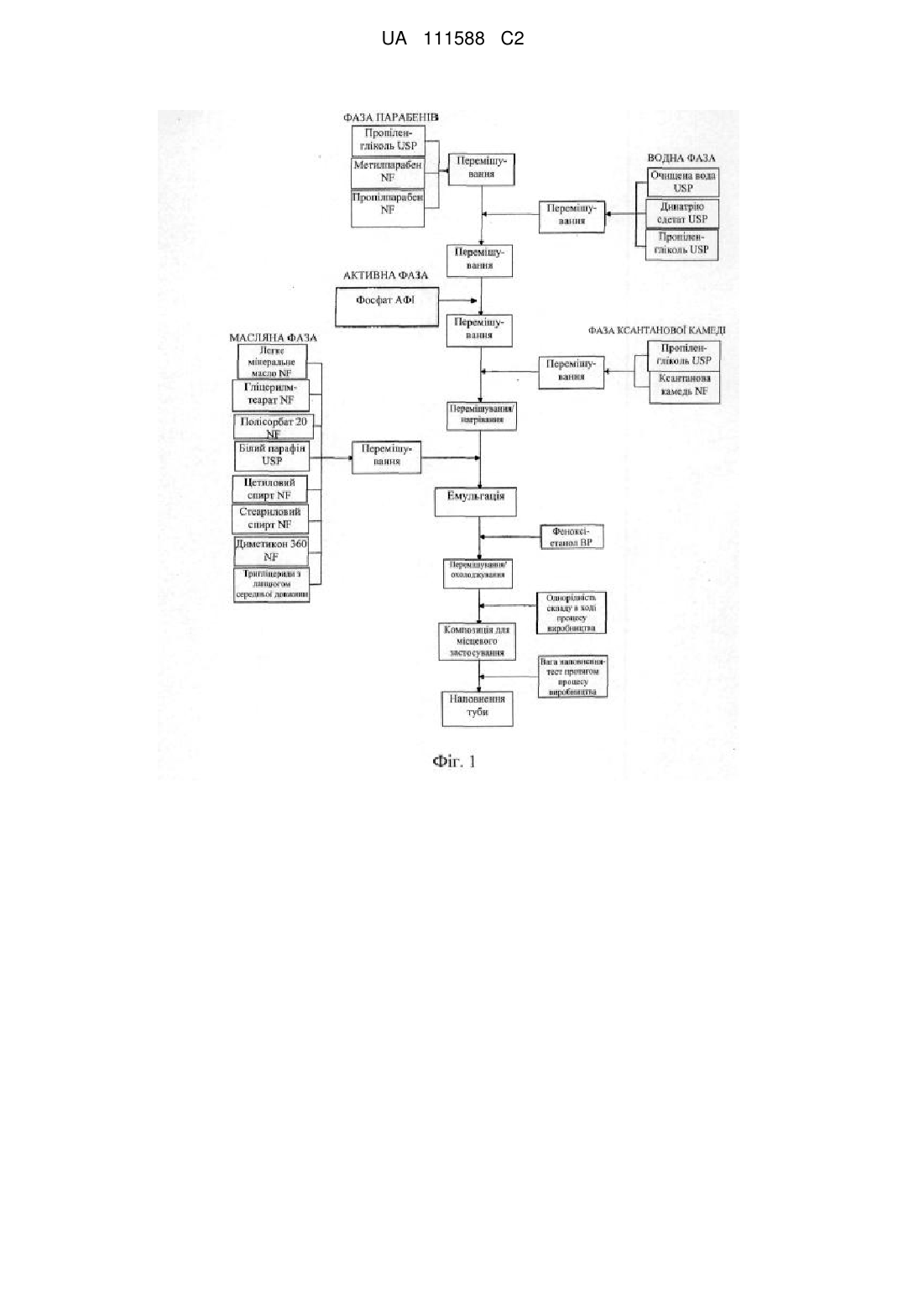
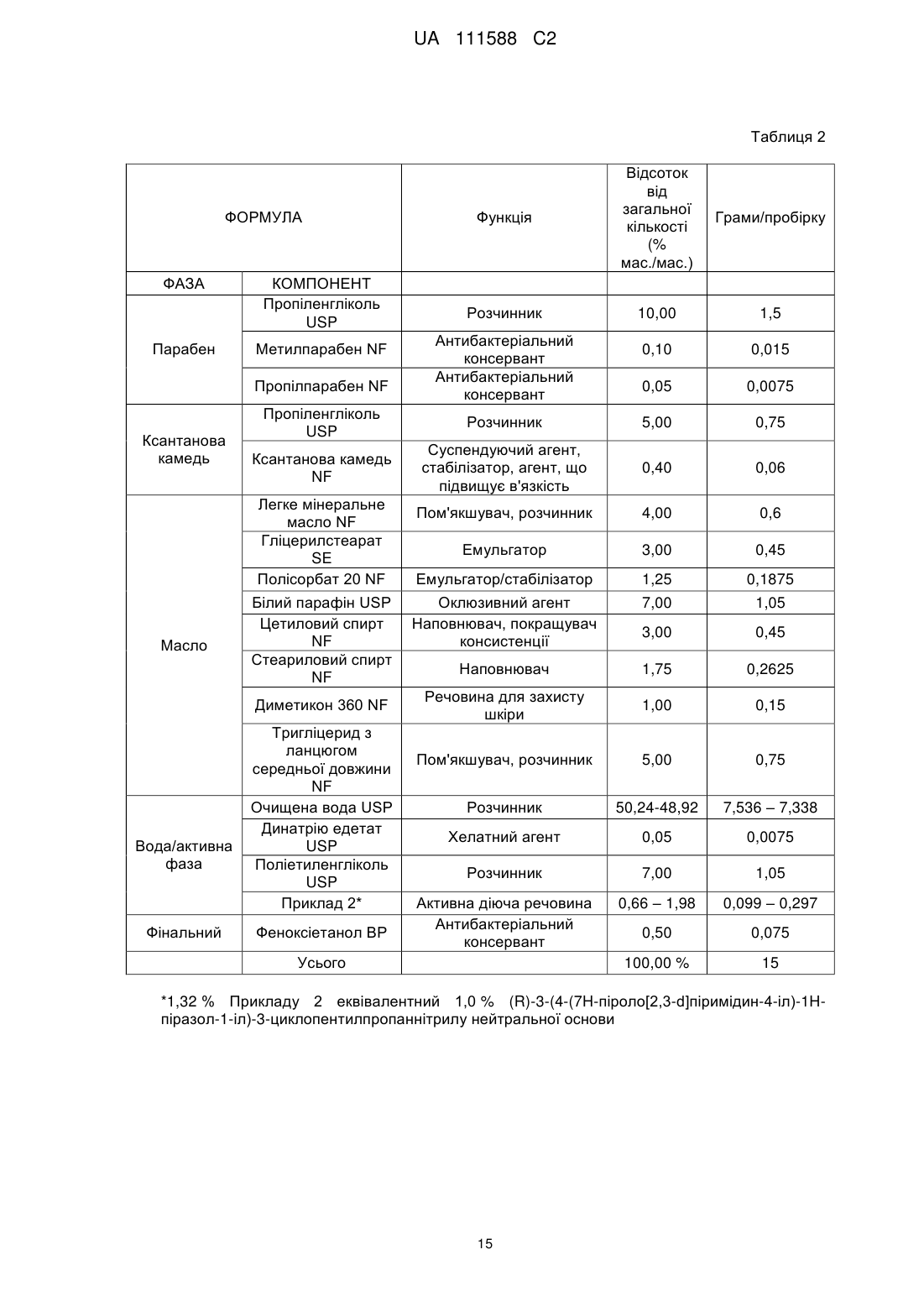
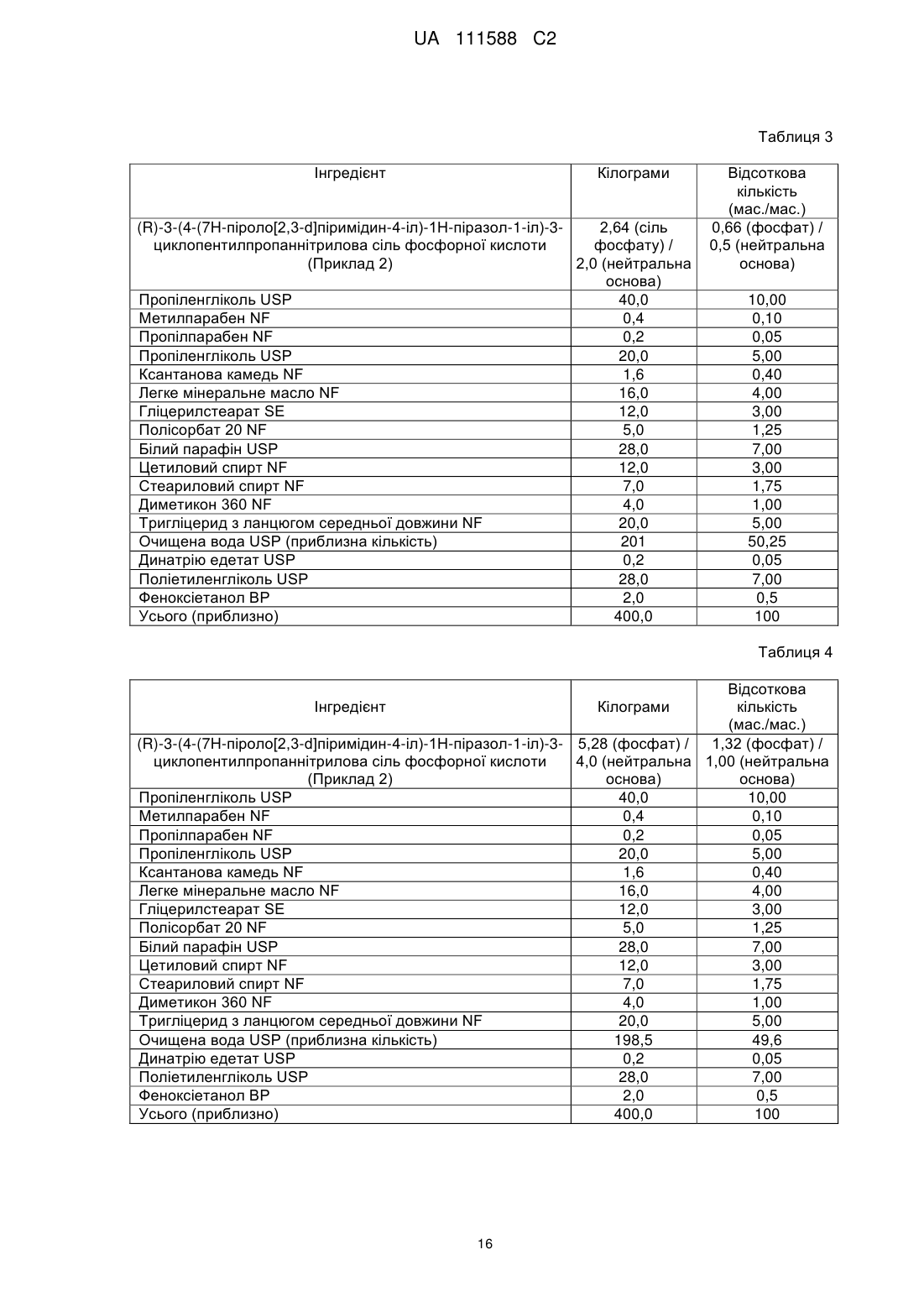
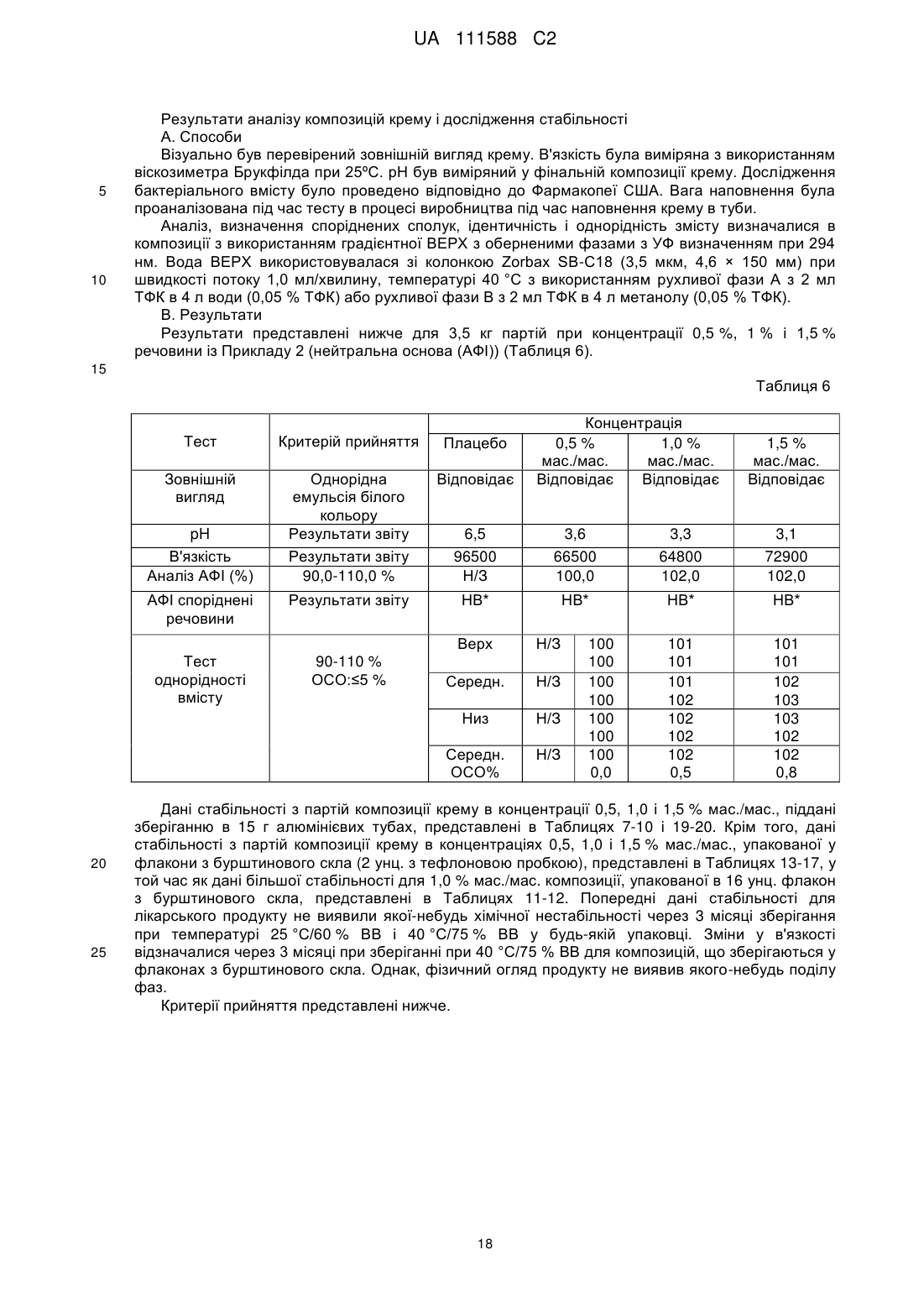
Композиція інгібітора jak для місцевого застосування
Номер патенту: 111588
Опубліковано: 25.05.2016
Автори: Паріх Бхавніш, Елесварам Крішнасвамі, Шах Бхавеш
Формула / Реферат
1. Кремоподібна в вигляді емульсії масло-в-воді фармацевтична композиція для місцевого застосування на шкірі, що включає:
емульсію масло-у-воді; що включає воду, масляний компонент, емульгатор, розчинник і
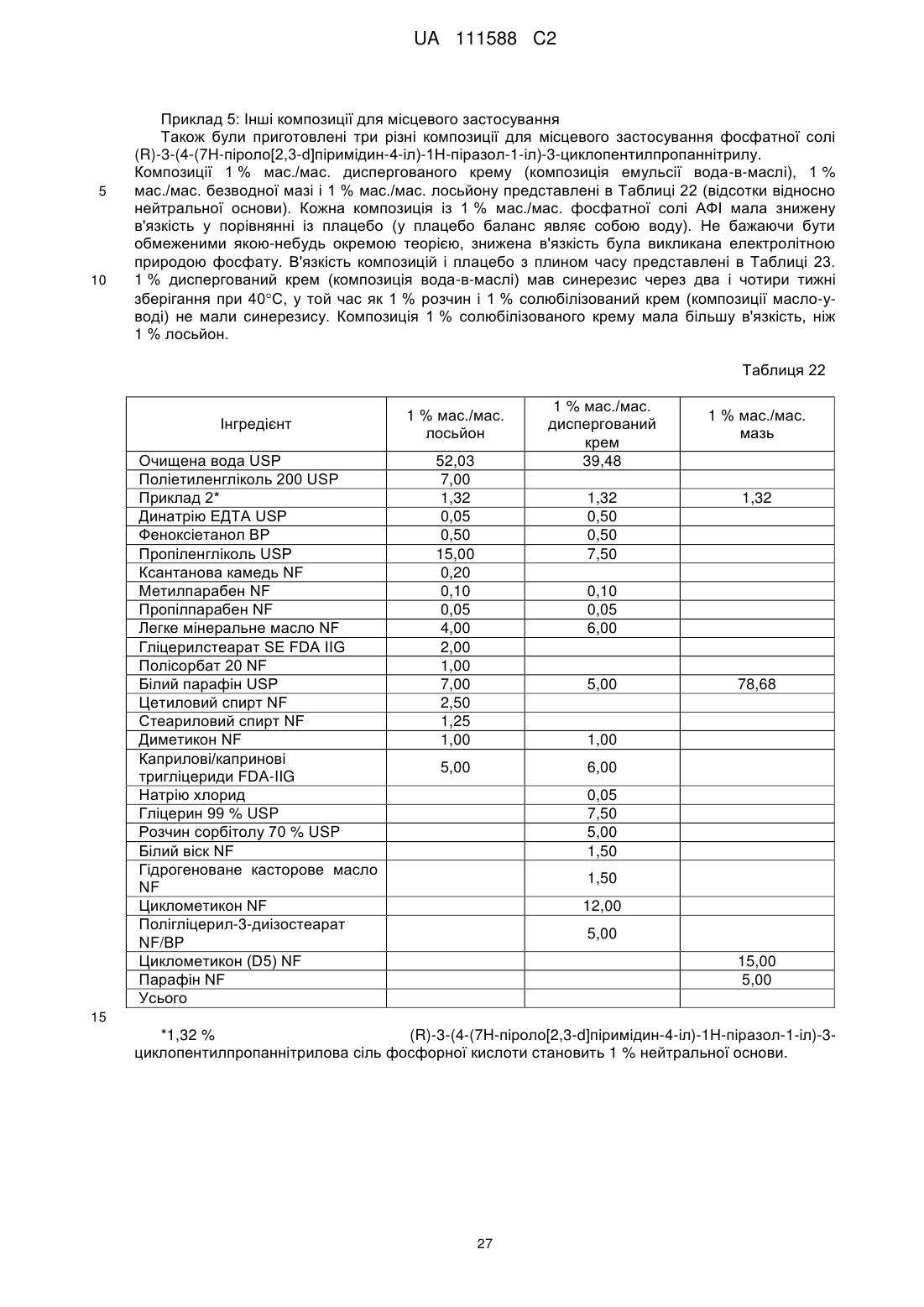
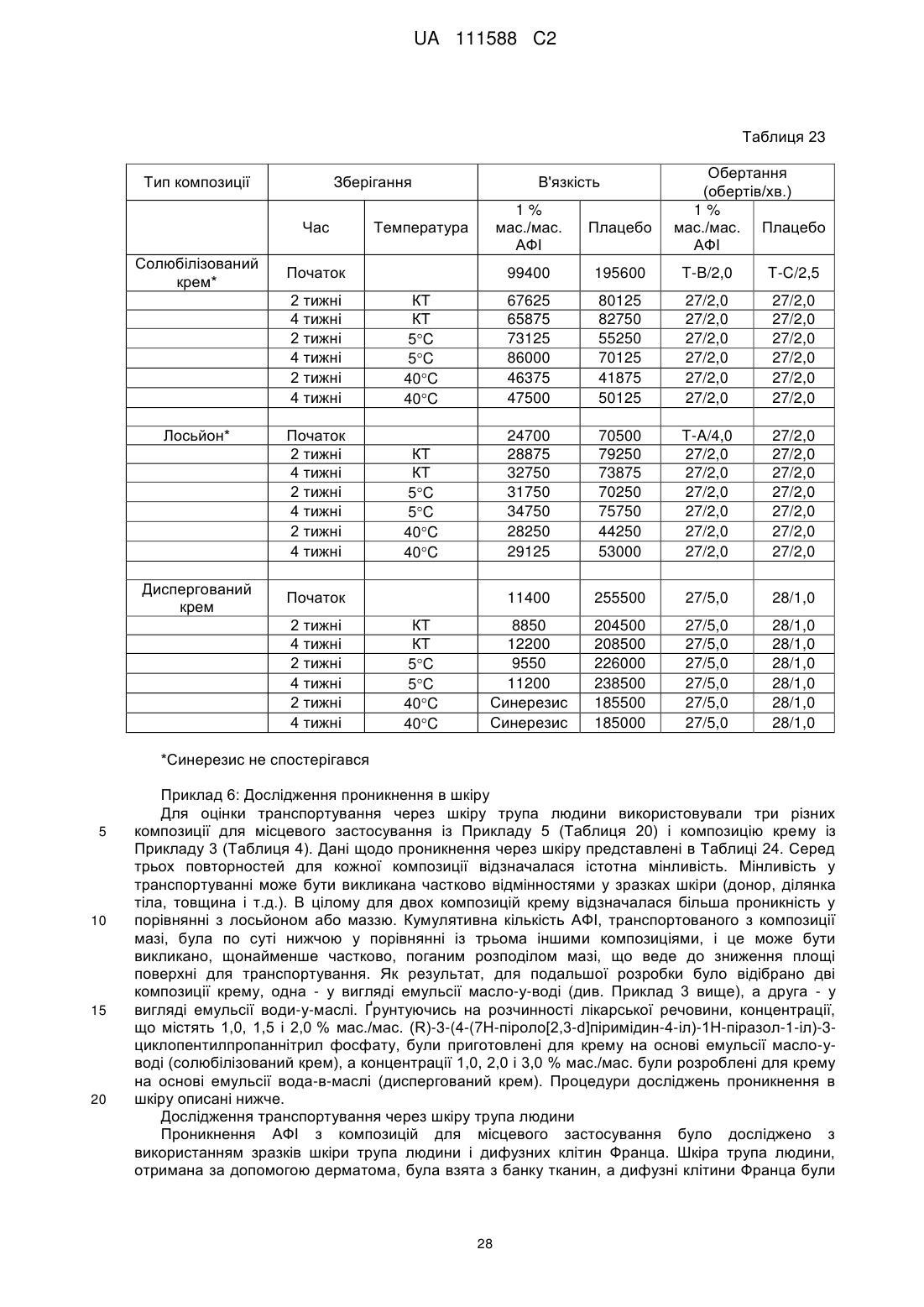
терапевтичний агент, який є сіллю фосфорної кислоти (R)-3-циклопентил-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]пропаннітрилу, де емульсія масло-у-воді утворює крем і де терапевтичний агент присутній в кількості від приблизно 0,5 % до приблизно 1,5 % від ваги композиції в розрахунку на вільну основу.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що масляний компонент присутній у кількості від приблизно 20 % до приблизно 27 % від ваги композиції.
3. Фармацевтична композиція за п. 2, яка відрізняється тим, що масляний компонент включає одну або більше речовин, незалежно вибраних із вазелінів, жирних спиртів, мінеральних масел, тригліцеридів і силіконових масел.
4. Фармацевтична композиція за п. 2, яка відрізняється тим, що масляний компонент включає одну або більше речовин, незалежно вибраних із білого вазеліну, цетилового спирту, стеарилового спирту, легкого мінерального масла, тригліцеридів з середньою довжиною ланцюга і диметикону.
5. Фармацевтична композиція за п. 1, яка відрізняється тим, що масляний компонент включає оклюзійний агент.
6. Фармацевтична композиція за п. 5, яка відрізняється тим, що оклюзійний агент присутній у кількості від приблизно 5 % до приблизно 10 % по масі композиції.
7. Фармацевтична композиція за п. 5, яка відрізняється тим, що оклюзійний агент включає білий вазелін.
8. Фармацевтична композиція за п. 1, яка відрізняється тим, що масляний компонент включає наповнювач, який збільшує жорсткість.
9. Фармацевтична композиція за п. 8, яка відрізняється тим, що наповнювач, який збільшує жорсткість, присутній у кількості від приблизно 4 % до приблизно 7 % від ваги вказаної композиції.
10. Фармацевтична композиція за п. 9, яка відрізняється тим, що наповнювач, який збільшує жорсткість, включає одну або більше речовин, незалежно вибраних із цетилового спирту і стеарилового спирту.
11. Фармацевтична композиція за п. 1, яка відрізняється тим, що масляний компонент включає пом'якшувач.
12. Фармацевтична композиція за п. 11, яка відрізняється тим, що пом'якшувач присутній у кількості від приблизно 7 % до приблизно 13 % від ваги композиції.
13. Фармацевтична композиція за п. 12, яка відрізняється тим, що пом'якшувач включає одну або більше речовин, незалежно вибраних із легкого мінерального масла і тригліцеридів з ланцюгом середньої довжини і диметикону.
14. Фармацевтична композиція за п. 1, яка відрізняється тим, що вода присутня в кількості від приблизно 45 % до приблизно 55 % від ваги композиції.
15. Фармацевтична композиція за п. 1, яка відрізняється тим, що емульгатор присутній у кількості від приблизно 4 % до приблизно 7 % від ваги композиції.
16. Фармацевтична композиція за п. 1, яка відрізняється тим, що включає емульгатор і наповнювач, який збільшує жорсткість, при цьому комбінована кількість емульгатора і наповнювача, який збільшує жорсткість, становить щонайменше приблизно 8 % від ваги композиції.
17. Фармацевтична композиція за п. 16, яка відрізняється тим, що емульгатор включає одну або більше речовин, незалежно вибраних з гліцерилстеарату і полісорбату20.
18. Фармацевтична композиція за п. 1, яка відрізняється тим, що додатково включає стабілізатор.
19. Фармацевтична композиція за п. 18, яка відрізняється тим, що стабілізатор присутній у кількості від приблизно 0,3 % до приблизно 0,5 % від ваги композиції.
20. Фармацевтична композиція за п. 19, яка відрізняється тим, що стабілізатор включає ксантанову камедь.
21. Фармацевтична композиція за п. 1, яка відрізняється тим, що розчинник присутній у кількості від приблизно 20 % до приблизно 25 % від ваги композиції.
22. Фармацевтична композиція за п. 21, яка відрізняється тим, що розчинник включає одну або більше речовин, незалежно вибраних із пропіленгліколю і поліетиленгліколю.
23. Фармацевтична композиція за п. 1, яка відрізняється тим, що терапевтичний агент присутній у кількості приблизно 0,5 % від ваги композиції в розрахунку на вільну основу.
24. Фармацевтична композиція за п. 1, яка відрізняється тим, що вказаний терапевтичний агент присутній у кількості приблизно 1 % від ваги композиції в розрахунку на вільну основу.
25. Фармацевтична композиція за п. 1, яка відрізняється тим, що вказаний терапевтичний агент присутній у кількості приблизно 1,5 % від ваги композиції в розрахунку на вільну основу.
26. Фармацевтична композиція за п. 1, яка відрізняється тим, що включає:
від приблизно 35 % до приблизно 65 % води від ваги композиції;
від приблизно 10 % до приблизно 40 % масляного компонента від ваги композиції;
від приблизно 1 % до приблизно 9 % емульгатора від ваги композиції;
від приблизно 10 % до приблизно 35 % розчинника від ваги композиції;
від приблизно 0,05 % до приблизно 5 % стабілізатора від ваги композиції; і
від приблизно 0,5 % до приблизно 1,5 % солі фосфорної кислоти (R)-3-циклопентил-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]пропаннітрилу від ваги композиції в розрахунку на вільну основу.
27. Фармацевтична композиція за п. 1, яка відрізняється тим, що включає:
від приблизно 40 % до приблизно 60 % води від ваги композиції;
від приблизно 15 % до приблизно 30 % масляного компонента від ваги композиції;
від приблизно 2 % до приблизно 6 % емульгатора від ваги композиції;
від приблизно 15 % до приблизно 30 % розчинника від ваги композиції;
від приблизно 0,1 % до приблизно 2 % стабілізатора від ваги композиції; і
від приблизно 0,5 % до приблизно 1,5 % солі фосфорної кислоти (R)-3-циклопентил-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]пропаннітрилу від ваги композиції в розрахунку на вільну основу.
28. Фармацевтична композиція за п. 1, яка відрізняється тим, що включає:
від приблизно 45 % до приблизно 55 % води від ваги композиції;
від приблизно 17 % до приблизно 27 % масляного компонента від ваги композиції;
від приблизно 3 % до приблизно 5 % емульгатора від ваги композиції;
від приблизно 20 % до приблизно 25 % розчинника від ваги композиції;
від приблизно 0,3 % до приблизно 0,5 % стабілізатора від ваги композиції; і
від приблизно 0,5 % до приблизно 1,5 % солі фосфорної кислоти (R)-3-циклопентил-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]пропаннітрилу від ваги композиції в розрахунку на вільну основу.
29. Фармацевтична композиція за п. 1, яка відрізняється тим, що включає:
від приблизно 45 % до приблизно 55 % води від ваги композиції;
від приблизно 17 % до приблизно 27 % масляного компонента від ваги композиції;
від приблизно 4 % до приблизно 7 % емульгатора від ваги композиції;
від приблизно 20 % до приблизно 25 % розчинника від ваги композиції;
від приблизно 0,3 % до приблизно 0,5 % стабілізатора від ваги композиції; і
від приблизно 0,5 % до приблизно 1,5 % солі фосфорної кислоти (R)-3-циклопентил-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]пропаннітрилу від ваги композиції в розрахунку на вільну основу.
30. Фармацевтична композиція за будь-яким з пп. 26-29, яка відрізняється тим, що:
масляний компонент включає одну або більше речовин, які вибирають незалежним чином із вазелінів, жирних спиртів, мінеральних масел, тригліцеридів і диметиконів;
емульгатор включає одну або більше речовин, незалежно вибраних із жирних ефірів гліцерину і жирних ефірів сорбітану;
розчинник включає одну або більше речовин, незалежно вибраних із алкіленгліколів і поліалкіленгліколів; і
стабілізатор включає одну або більше речовин, незалежно вибраних із полісахаридів.
31. Фармацевтична композиція за будь-яким з пп. 26-29, яка відрізняється тим, що:
масляний компонент включає одну або більше речовин, які незалежно вибирають із білого вазеліну, цетилового спирту, стеарилового спирту, легкого мінерального масла, тригліцеридів із середньою довжиною ланцюга і диметикону;
емульгатор включає одну або більше речовин, незалежно вибраних із гліцерилстеарату і полісорбату 20;
розчинник включає одну або більше речовин, незалежно вибраних із пропіленгліколю і поліетиленгліколю; і
стабілізатор включає ксантанову камедь.
32. Фармацевтична композиція за п. 1, яка відрізняється тим, що включає:
від приблизно 35 % до приблизно 65 % води від ваги композиції;
від приблизно 2 % до приблизно 15 % оклюзійного агента від ваги композиції;
від приблизно 2 % до приблизно 8 % наповнювача, що збільшує жорсткість, від ваги зазначеної композиції;
від приблизно 5 % до приблизно 15 % пом'якшувача від ваги композиції;
від приблизно 1 % до приблизно 9 % емульгатора від ваги композиції;
від приблизно 0,05 % до приблизно 5 % стабілізатора від ваги композиції;
від приблизно 10 % до приблизно 35 % розчинника від ваги композиції; і
від приблизно 0,5 % до приблизно 1,5 % солі фосфорної кислоти (R)-3-циклопентил-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]пропаннітрилу від ваги композиції в розрахунку на вільну основу.
33. Фармацевтична композиція за п. 1, яка відрізняється тим, що включає:
від приблизно 40 % до приблизно 60 % води від ваги композиції;
від приблизно 5 % до приблизно 10 % оклюзійного агента від ваги композиції;
від приблизно 2 % до приблизно 8 % наповнювача, що збільшує жорсткість, від ваги зазначеної композиції;
від приблизно 7 % до приблизно 12 % пом'якшувача від ваги композиції;
від приблизно 2 % до приблизно 6 % емульгатора від ваги композиції;
від приблизно 0,1 % до приблизно 2 % стабілізатора від ваги композиції;
від приблизно 15 % до приблизно 30 % розчинника від ваги композиції; і
від приблизно 0,5 % до приблизно 1,5 % солі фосфорної кислоти (R)-3-циклопентил-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]пропаннітрилу від ваги композиції в розрахунку на вільну основу.
34. Фармацевтична композиція за п. 1, яка відрізняється тим, що включає:
від приблизно 45 % до приблизно 55 % води від ваги композиції;
від приблизно 5 % до приблизно 10 % оклюзійного агента від ваги композиції;
від приблизно 3 % до приблизно 6 % наповнювача, що збільшує жорсткість, від ваги зазначеної композиції;
від приблизно 7 % до приблизно 13 % пом'якшувача від ваги композиції;
від приблизно 3 % до приблизно 5 % емульгатора від ваги композиції;
від приблизно 0,3 % до приблизно 0,5 % стабілізатора від ваги композиції;
від приблизно 20 % до приблизно 25 % розчинника від ваги композиції; і
від приблизно 0,5 % до приблизно 1,5 % солі фосфорної кислоти (R)-3-циклопентил-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]пропаннітрилу від ваги композиції в розрахунку на вільну основу.
35. Фармацевтична композиція за п. 1, яка відрізняється тим, що включає:
від приблизно 45 % до приблизно 55 % води від ваги композиції;
від приблизно 5 % до приблизно 10 % оклюзійного агента від ваги композиції;
від приблизно 4 % до приблизно 7 % наповнювача, що збільшує жорсткість, від ваги зазначеної композиції;
від приблизно 7 % до приблизно 13 % пом'якшувача від ваги композиції;
від приблизно 4 % до приблизно 7 % емульгатора від ваги композиції;
від приблизно 0,3 % до приблизно 0,5 % стабілізатора від ваги композиції;
від приблизно 20 % до приблизно 25 % розчинника від ваги композиції; і
від приблизно 0,5 % до приблизно 1,5 % солі фосфорної кислоти (R)-3-циклопентил-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]пропаннітрилу від ваги композиції в розрахунку на вільну основу.
36. Фармацевтична композиція за п. 1, яка відрізняється тим, що включає:
від приблизно 45 % до приблизно 55 % води від ваги композиції;
приблизно 7 % оклюзійного агента від ваги композиції;
від приблизно 4,5 % до приблизно 5 % наповнювача, що збільшує жорсткість, від ваги зазначеної композиції;
приблизно 10 % пом'якшувача від ваги композиції;
від приблизно 4 % до приблизно 4,5 % емульгатора від ваги композиції;
приблизно 0,4 % стабілізатора від ваги композиції;
приблизно 22 % розчинника від ваги композиції; і
від приблизно 0,5 % до приблизно 1,5 % солі фосфорної кислоти (R)-3-циклопентил-3-[4-(7Н-піроло[2,3-d]піримідин-4-іл)-1H-піразол-1-іл]пропаннітрилу від ваги композиції в розрахунку на вільну основу.
37. Фармацевтична композиція за будь-яким з пп. 32-36, яка відрізняється тим, що комбінована кількість наповнювача, що посилює жорсткість, і емульгатора становить щонайменше 8 % від ваги композиції.
38. Фармацевтична композиція за будь-яким з пп. 32-36, яка відрізняється тим, що:
оклюзійний агент включає вазелін;
наповнювач, який збільшує жорсткість, включає одну або більше речовин, незалежно вибраних із одного або більше жирних спиртів;
пом'якшувач включає одну або більше речовин, незалежно вибраних із мінеральних масел і тригліцеридів;
емульгатор включає одну або більше речовин, незалежно вибраних із жирних ефірів гліцерилу і жирних ефірів сорбітану;
стабілізатор включає одну або більше речовин, незалежно вибраних із полісахаридів; і
розчинник включає одну або більше речовин, незалежно вибраних із алкіленгліколів і поліалкіленгліколів.
39. Фармацевтична композиція за будь-яким з пп. 32-36, яка відрізняється тим, що:
оклюзійний агент включає білий вазелін;
наповнювач, який збільшує жорсткість, включає одну або більше речовин, незалежно вибраних із цетилового спирту і стеарилового спирту;
пом'якшувач включає одну або більше речовин, незалежно вибраних із легкого мінерального масла, тригліцеридів з ланцюгом середньої довжини і диметикону;
емульгатор включає одну або більше речовин, незалежно вибраних із гліцерилстеарату і полісорбату 20;
стабілізатор включає ксантанову камедь; і
розчинник включає одну або більше речовин, незалежно вибраних із пропіленгліколю і поліетиленгліколю.
40. Спосіб лікування порушення шкіри у пацієнта, який цього потребує, що включає застосування фармацевтичної композиції за будь-яким з пп. 1-39 на ділянку шкіри вказаного пацієнта.
41. Спосіб за п. 40, який відрізняється тим, що шкірне порушення являє собою атопічний дерматит або псоріаз.
42. Спосіб за п. 40, який відрізняється тим, що шкірне порушення являє собою псоріаз.
43. Спосіб за п. 40, який відрізняється тим, що шкірне порушення являє собою сенсибілізацію шкіри, подразнення шкіри, шкірний висип, контактний дерматит або алергічну сенсибілізацію шкіри.
44. Спосіб за п. 40, який відрізняється тим, що шкірне порушення являє собою бульозне захворювання шкіри.
45. Спосіб за п. 44, який відрізняється тим, що зазначене бульозне захворювання шкіри являє собою пухирчатку звичайну (PV) або бульозний пемфігоїд (ВР).
Текст
Реферат: Винахід належить до фармацевтичних композицій для місцевого нашкірного застосування, які включають (R)-3-циклопентил-3-[4-(7Н-пірол[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]пропаннітрил або його фармацевтично прийнятну сіль, а також до використання в лікуванні шкірних захворювань. UA 111588 C2 (12) UA 111588 C2 UA 111588 C2 5 10 15 20 25 30 35 40 45 50 55 60 Дана заявка заявляє пріоритет попередньої заявки на патент США № 61/347132, поданої 21 травня 2010 р. і включеної у всій своїй повноті в даний документ за допомогою посилання. ГАЛУЗЬ ТЕХНІКИ Винахід описує фармацевтичні композиції для місцевого нашкірного застосування, що включають (R)-3-циклопентил-3-[4-(7H-пірол[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]пропаннітрил або його фармацевтично прийнятну сіль, а також використання в лікуванні шкірних захворювань. РІВЕНЬ ТЕХНІКИ Протеїнкінази (ПК) регулюють різні біологічні процеси, включаючи, крім усього іншого, ріст клітин, здатність до виживання, диференціювання, утворення органів, морфогенез, неоваскуляризацію, відновлення тканин і регенерацію. Протеїнкінази також відіграють особливі ролі при цілому ряді захворювань людини, включаючи рак. Цитокіни, низькомолекулярні поліпептиди або глікопротеїни регулюють багато шляхів метаболізму, включених у запальну відповідь організму-хазяїна на сепсис. Цитокіни впливають на диференціацію клітин, проліферацію і активацію і можуть модулювати прозапальну і протизапальну відповідь для забезпечення належної реакції хазаїнів на патогени. Передача сигналу цілим рядом цитокінів залучає сімейство Янус-кіназ (JAK) білкових тирозинкіназ і переносники сигналу, і активатори транскрипції (STAT). Відомо чотири JAK ссавці: JAK1 (Янус-кіназа-1), JAK2, JAK3 (також відома як Янус-кіназа, лейкоцитарна; JAKL і L-JAK) і TYK2 (білкова тирозин-кіназа 2). Стимульовані цитокінами імунні і запальні відповіді сприяють патогенезу наступних захворювань: патології, такі як тяжкий комбінований імунодефіцит (ТКІД), що виникає при супресії імунної системи, при цьому гіперактивна або невідповідна імунна/запальна відповідь сприяє розвитку патології аутоімунних захворювань (наприклад, астмі, системному червоному вовчаку, тироїдиту, міокардиту) і таким захворюванням як склеродерма і остеоартрит (Ortmann, R. A., T. Cheng, et al. (2000) Arthritis Res 2(1): 16-32). Дефіцит експресії JAK пов'язаний з багатьма хворобливими станами. Наприклад, миші Jak1/- мають карликовий зріст при народженні, складно вигодовуються і вмирають у перинатальному віці (Rodig, S. J., M. A. Meraz, et al. (1998) Cell 93(3): 373-83). Ембріони мишей Jak2-/- мають ознаки анемії і вмирають приблизно на 12,5 день після парування через відсутність дефінітивного еритропоезу. Вважається, що шлях JAK/STAT і, зокрема, всі чотири JAK відіграють роль у патогенезі астматичної відповіді, хронічної обструктивної хвороби легенів, бронхіту та інших пов'язаних запальних захворювань нижніх дихальних шляхів. Множина цитокінів, що передають свій сигнал за допомогою JAK, були пов'язані із запальними захворюваннями/станами верхніх дихальних шляхів, наприклад, що вражають ніс і синусові пазухи (наприклад, риніт і синусит), незалежно від наявності класичних алергійних реакцій. Також було показано, що шлях JAK/STAT задіяний у запальних захворюваннях/станах ока і хронічних алергійних відповідях. Активація JAK/STAT при раку може виникнути під впливом стимуляції цитокінами (наприклад, ІЛ-6 або ГМ-КСФ) або шляхом зниження ендогенної супресії сигналізації JAK, такої як SOCS (супресори або цитокінові сигнали) або PIAS (білковий інгібітор активованої STAT) (Boudny, V., and Kovarik, J., Neoplasm. 49:349-355, 2002). Активація сигналізації STAT, а також інших шляхів після JAK (наприклад, Akt) мала кореляцію з поганим прогнозом при раку багатьох типів (Bowman, T., et al. Oncogene 19:2474-2488, 2000). Підвищені рівні циркулюючих цитокінів, що передають сигнал за допомогою JAK/STAT, відіграють важливу роль при розвитку кахексії і/або хронічної стомлюваності. Таким чином, інгібування JAK може бути переважним для пацієнтів з раковим захворюванням через підвищення потенційної протипухлинної активності. Також було показано, що інгібування кіназ JAK має терапевтичні переваги у пацієнтів, що страждають шкірними імунними порушеннями, такими як псоріаз і сенсибілізація шкіри. При звичайному псоріазі - формі псоріазу, що найчастіше зустрічається, - було прийнято, що активовані Т-лімфоцити відіграють важливу роль у підтримці стану хвороби і пов'язані з утворенням псоріатичних бляшок (Gottlieb, A.B., et al, Nat Rev Drug Disc., 4:19-34). Псоріатична бляшка містить важливий імунний інфільтрат, включаючи лейкоцити і моноцити, а також декілька епідермальних шарів з підвищеною проліферацією кератиноцитів. У той час як первинна активація імунних клітин при псоріазі виникає шляхом певного механізму захворювання, вважається, що стан хвороби залежить від ряду запальних цитокінів, крім різних хемокінів і факторів росту (JCI, 113:1664-1675). Більша частина з них, включаючи інтерлейкіни 2, -4, -6, -7, -12, -15, -18 і -23, а також ГМ-КСФ та ІНФg сигналізують через Янус-кінази (JAK) (Adv Pharmacol. 2000; 47:113-74). Таким чином, блокування передачі сигналу на рівні JAK-кіназ може призвести до терапевтичних переваг у пацієнтів, що страждають на псоріаз або інші імунні порушення шкіри. 1 UA 111588 C2 5 10 15 20 25 30 35 40 45 50 Беручи до уваги користь інгібіторів JAK у лікуванні шкірних захворювань, існує необхідність у розробці поліпшених композицій інгібіторів JAK для місцевого застосування. Зокрема, існує потреба в наявності стабільних композицій інгібіторів JAK легкого застосування з гарними параметрами проникнення в шкіру. Композиції згідно з винаходом, а також описані тут способи спрямовані на вирішення даного питання та інших цілей. СУТЬ ВИНАХОДУ Сильний інгібітор JAK1/JAK2, (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3циклопентилпропаннітрил і його фармацевтично прийнятні солі були раніше описані в патенті США № 7598257, публікації патенту США № 2009/0181959 і публікації патенту США № 2008/0312259, усі з яких включені сюди у всій своїй повноті за допомогою посилання. Даний винахід описує композицію емульсії масло-у-воді (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Нпіразол-1-іл)-3-циклопентилпропаннітрил, що підходить для місцевого введення і лікування шкірних захворювань. Відповідно до цього даний винахід забезпечує, inter alia, фармацевтичну композицію для місцевого застосування на шкірі, яка включає: емульсію масло-у-воді; і терапевтично ефективну кількість терапевтичного агента, представленого (R)-3циклопентил-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]пропаннітрилом або його фармацевтично прийнятною сіллю. Даний винахід також забезпечує спосіб лікування шкірного порушення, що включає застосування описаної тут фармацевтичної композиції на ділянці шкіри пацієнта. Даний винахід також забезпечує фармацевтичну композицію, описану тут, для використання у лікуванні шкірного захворювання у пацієнта, який має потребу в цьому. Даний винахід також забезпечує використання фармацевтичної композиції, описаної тут, для приготування препарату для лікування шкірного захворювання у пацієнта, який має потребу в цьому. Деталі одного або більше варіантів втілення винаходу представлені в доданих графічних матеріалах і описі нижче. Інші характеристики, об'єкти і переваги винаходу будуть очевидними з опису, фігур і формули винаходу. ОПИС КРЕСЛЕНЬ ФІГ. 1 відображає схему, що описує процес виробництва композиції емульсії масло-у-воді солі фосфорної кислоти (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3циклопентилпропаннітрилу. ФІГ. 2 відображає зміни у показниках ураження у суб'єктів із хронічним бляшковим псоріазом, підданих лікуванню 0,5 %, 1,0 % і 1,5 % мас./мас. композицією емульсії масло-у-воді солі фосфорної кислоти (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3циклопентилпропаннітрилу (на нейтральній основі), у порівнянні з лікуванням плацебо протягом 12 тижнів (пунктирна лінія є базовою). ФІГ. 3 відображає фотографії суб'єктів із хронічним бляшковим псоріазом до (ФІГ. 3(а)) і через 84 дні (ФІГ. 3(b)) лікування 1,0 % мас./мас. композицією емульсії масло-у-воді солі фосфорної кислоти (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3циклопентилпропаннітрилу (на нейтральній основі). ФІГ. 4 відображає фотографії суб'єктів із хронічним бляшковим псоріазом до (ФІГ. 4(а)) і через 84 дні (ФІГ. 4(b)) лікування 1,0 % мас./мас. композицією емульсії масло-у-воді солі фосфорної кислоти (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3циклопентилпропаннітрилу (на нейтральній основі). ФІГ. 5 відображає фотографії суб'єктів із хронічним бляшковим псоріазом до (ФІГ. 5(а)) і через 84 дні (ФІГ. 5(b)) лікування 1,5 % мас./мас. композицією емульсії масло-у-воді солі фосфорної кислоти (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3 2 UA 111588 C2 5 10 15 20 25 30 35 40 45 50 55 60 циклопентилпропаннітрилу (на нейтральній основі). ФІГ. 6 відображає фотографії суб'єктів із хронічним бляшковим псоріазом до (ФІГ. 6(а)) і через 84 дні (ФІГ. 6(b)) лікування 0,5 % мас./мас. композицією емульсії масло-у-воді солі фосфорної кислоти (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3циклопентилпропаннітрилу (на нейтральній основі). ФІГ. 7 відображає фотографії суб'єктів із хронічним бляшковим псоріазом до (ФІГ. 7(а)) і через 84 дні (ФІГ. 7(b)) лікування 1,0 % мас./мас. композицією емульсії масло-у-воді солі фосфорної кислоти (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3циклопентилпропаннітрилу (на нейтральній основі). ДЕТАЛЬНИЙ ОПИС Даний винахід забезпечує, inter alia, фармацевтичну композицію для місцевого нашкірного застосування, що включає терапевтично ефективну кількість (R)-3-циклопентил-3-[4-(7Hпіроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]пропаннітрилу або його фармацевтично прийнятної солі. У деяких варіантах втілення винаходу фармацевтична композиція включає: емульсію масло-у-воді; і терапевтично ефективну кількість терапевтичного агента, представленого (R)-3циклопентил-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]пропаннітрилом або його фармацевтично прийнятною сіллю. У деяких варіантах втілення винаходу емульсія включає воду, масляний компонент і компонент-емульгатор. Як використовується тут, термін "компонент-емульгатор" належить, в одному аспекті, до речовини або сумішей речовин, які підтримують елемент або частку в суспензії в рідкому середовищі. У деяких варіантах втілення винаходу емульгатор забезпечує утворення масляною фазою емульсії при комбінації з водою. У деяких варіантах втілення винаходу емульгатор належить до одного або декількох неіонних сурфактантів. Композиції емульсії масло-у-воді мали кращий зовнішній вигляд, здатність до розподілу і стабільність у порівнянні з іншими композиціями. Композиції мають щільний, кремовидний зовнішній вигляд, що забезпечує гарний розподіл композиції по шкірі. Такий гарний розподіл веде до кращого проникнення в шкіру у порівнянні з безводними композиціями. Наприклад, композиції емульсій масло-у-воді мали підвищені кумулятивні показники в ході досліджень перенесення через шкіру трупа людини протягом 24 годин у порівнянні з безводною маззю. Не бажаючи бути зв'язаними якою-небудь окремою теорією, вважається, що більш високий кумулятивний показник пояснюється кращим розподілом композиції емульсії масло-у-воді у порівнянні з безводною маззю, що приводить до збільшення площі поверхні для транспортування. Підвищена в'язкість для композицій емульсії масло-у-воді, як виявилося, виявилася переважною стосовно проникнення в шкіру, тому що композиції крему з підвищеною в'язкістю мали кращі властивості транспорту через шкіру трупа людини у порівнянні з лосьйонами масло-у-воді зі зниженою в'язкістю. Описані тут композиції масло-у-воді, як виявилося, мали гарну стабільність протягом тримісячного періоду при зберіганні при 25 °C/60 % відносній вологості і 40 °C/75 % відносній вологості в алюмінієвих тубах, і підтримуванні відповідної в'язкості протягом періоду. Для порівняння: композиції емульсій масло-у-воді характеризувалися синерезисом при зберіганні при 40 °C (синерезис позначає відділення рідини від емульсії). Композиція емульсії вода-в-маслі була менш бажаною, ніж композиції згідно з винаходом, оскільки АФІ, розчинений в основі з часом, приводив до надзвичайно варіюючого проникнення у шкіру під час досліджень in vitro, а також до відсутності підвищення проникності при збільшенні концентрації композиції. У дослідженнях транспортування через шкіру з використанням свіжовисіченої шкіри миші композиції емульсії масло-у-воді також характеризувалися загальною тенденцією підвищення проникнення при підвищенні концентрації солюбілізованого крему з 0,5 % мас./мас. до 1,5 % мас./мас., при цьому така тенденція для композицій емульсії вода-в-маслі не відзначалася. Таким чином, виявилося, що емульсії вода-в-маслі не будуть мати якої-небудь переваги щодо забезпечення підвищеного проникнення з підвищенням концентрації. Крім того, описані тут композиції відносно прості у виробництві з відтвореним процесом одержання композиції. Отриманий продукт легко упаковується. Композиції мають гарну стабільність і відносно постійні профілі проникнення. У деяких варіантах втілення винаходу масляний компонент присутній у кількості приблизно від 10 % до приблизно 40 % по масі композиції. У деяких варіантах втілення винаходу масляний компонент присутній у кількості приблизно 3 UA 111588 C2 5 10 15 20 25 30 35 40 45 50 55 60 від 17 % до приблизно 27 % по масі композиції. У деяких варіантах втілення винаходу масляний компонент присутній у кількості приблизно від 20 % до приблизно 27 % по масі композиції. У деяких варіантах втілення винаходу масляний компонент включає одну або більше речовин, які вибирають незалежним чином з рідкого парафіну, насичених спиртів, мінеральних масел, тригліцеридів і силіконових масел. У деяких варіантах втілення винаходу масляний компонент включає одну або більше речовин, які вибирають незалежним чином з білого парафіну, цетилового спирту, стеарилового спирту, легкого мінерального масла, тригліцеридів із середньою довжиною ланцюга й диметикону. У деяких варіантах втілення винаходу масляний компонент включає оклюзивний агент. У деяких варіантах втілення винаходу оклюзивний агент присутній у кількості приблизно від 2 % до приблизно 15 % по масі композиції. У деяких варіантах втілення винаходу оклюзивний агент присутній у кількості приблизно від 5 % до приблизно 10 % по масі композиції. Як використовується тут, термін "оклюзивний агент" належить до гідрофобного агента або суміші гідрофобних агентів, які утворюють оклюзивну плівку на шкірі, що знижує черезепідермальну втрату води (ЧЕВВ) шляхом запобігання випарювання води з рогового шару. У деяких варіантах втілення винаходу оклюзивний агент включає одну або більше речовин, вибраних із жирних кислот (наприклад, ланолінової кислоти), жирних спиртів (наприклад, ланолінового спирту), вуглеводневих масел і восків (наприклад, парафіну), полігідридних спиртів (наприклад, пропіленгліколю), силіконів (наприклад, диметикону), стеролів (наприклад, холестерину), рослинного або тваринного жиру (наприклад, какао-масла), рослинного воску (наприклад, карнаубського воску) і воскових ефірів (наприклад, бджолиного воску). У деяких варіантах втілення винаходу оклюзивний агент включає одну або більше речовин, вибраних з ланолінової кислоти, жирних спиртів, ланолінового спирту, парафіну, пропіленгліколю, диметикону, холестерину, масла какао, карнаубського воску і бджолиного воску. У деяких варіантах втілення винаходу оклюзивний агент включає парафін. У деяких варіантах втілення винаходу оклюзивний агент включає білий парафін. У деяких варіантах втілення винаходу масляний компонент включає наповнювач. У деяких варіантах втілення винаходу наповнювач присутній у кількості приблизно від 2 % до приблизно 8 % по масі композиції. У деяких варіантах втілення винаходу наповнювач присутній у кількості приблизно від 3 % до приблизно 6 % по масі композиції. У деяких варіантах втілення винаходу наповнювач присутній у кількості приблизно від 4 % до приблизно 7 % по масі композиції. Як використовується тут, термін "наповнювач" належить до речовини або суміші речовин, які підвищують в'язкість і/або консистенцію композиції або поліпшують реологічні властивості композиції. У деяких варіантах втілення винаходу наповнювач включає одну або більше речовин, вибраних незалежним чином із жирних спиртів. У деяких варіантах втілення винаходу наповнювач включає одну або більше речовин, вибраних незалежним чином із жирних спиртів C12-20. У деяких варіантах втілення винаходу наповнювач включає одну або більше речовин, вибраних незалежним чином із жирних спиртів C16-18. У деяких варіантах втілення винаходу наповнювач включає одну або більше речовин, вибраних незалежним чином із цетилового спирту й стеарилового спирту. У деяких варіантах втілення винаходу масляний компонент включає пом'якшувач. У деяких варіантах втілення винаходу пом'якшувач присутній у кількості приблизно від 5 % до приблизно 15 % по масі композиції. У деяких варіантах втілення винаходу пом'якшувач присутній у кількості приблизно від 7 % до приблизно 13 % по масі композиції. Як використовується тут, термін "пом'якшувач" належить до агента, що пом'якшує або зволожує шкіру, або зволожує подразнену внутрішню поверхню. У деяких варіантах втілення винаходу пом'якшувач включає одну або більше речовин, вибраних незалежним чином із мінеральних масел і тригліцеридів. У деяких варіантах втілення винаходу пом'якшувач включає одну або більше речовин, вибраних незалежним чином із легкого мінерального масла і тригліцеридів з ланцюгом 4 UA 111588 C2 5 10 15 20 25 30 35 40 45 50 55 60 середньої довжини. У деяких варіантах втілення винаходу пом'якшувач включає одну або більше речовин, вибраних незалежним чином із легкого мінерального масла, тригліцеридів з ланцюгом середньої довжини і диметикону. У деяких варіантах втілення винаходу вода присутня в кількості від приблизно 35 % до приблизно 65 % по масі композиції. У деяких варіантах втілення винаходу вода присутня в кількості від приблизно 40 % до приблизно 60 % по масі композиції. У деяких варіантах втілення винаходу вода присутня в кількості від приблизно 45 % до приблизно 55 % по масі композиції. У деяких варіантах втілення винаходу емульгатор присутній у кількості приблизно від 1 % до приблизно 9 % по масі композиції. У деяких варіантах втілення винаходу емульгатор присутній у кількості приблизно від 2 % до приблизно 6 % по масі композиції. У деяких варіантах втілення винаходу емульгатор присутній у кількості приблизно від 3 % до приблизно 5 % по масі композиції. У деяких варіантах втілення винаходу емульгатор присутній у кількості приблизно від 4 % до приблизно 7 % по масі композиції. У деяких варіантах втілення винаходу фармацевтична композиція включає емульгатор і наповнювач, при цьому комбінована кількість емульгатора і наповнювача становить щонайменше приблизно 8 % по масі композиції. У деяких варіантах втілення винаходу емульгатор включає одну або більше речовин, вибраних незалежним чином із жирних ефірів гліцерину і жирних ефірів сорбітану. У деяких варіантах втілення винаходу емульгатор включає одну або більше речовин, вибраних незалежним чином із гліцерилстеарату й полісорбату 20. У деяких варіантах втілення винаходу фармацевтична композиція додатково включає стабілізатор. У деяких варіантах втілення винаходу стабілізатор присутній у кількості приблизно від 0,05 % до приблизно 5 % по масі композиції. У деяких варіантах втілення винаходу стабілізатор присутній у кількості приблизно від 0,1 % до приблизно 2 % по масі композиції. У деяких варіантах втілення винаходу стабілізатор присутній у кількості приблизно від 0,3 % до приблизно 0,5 % по масі композиції. Як використовується тут, термін "стабілізатор" належить до речовини або суміші речовин, які поліпшують стабільність фармацевтичної композиції і/або сумісність компонентів у композиції. У деяких варіантах втілення винаходу стабілізатор запобігає агломерації емульсії і стабілізує краплі в емульсії масла-у-воді. У деяких варіантах втілення винаходу стабілізатор включає одну або більше речовин, вибраних незалежним чином із полісахаридів. У деяких варіантах втілення винаходу стабілізатор включає ксантанову камедь. У деяких варіантах втілення винаходу фармацевтична композиція додатково включає розчинник. У деяких варіантах втілення винаходу розчинник присутній у кількості приблизно від 10 % до приблизно 35 % по масі композиції. У деяких варіантах втілення винаходу розчинник присутній у кількості приблизно від 15 % до приблизно 30 % по масі композиції. У деяких варіантах втілення винаходу розчинник присутній у кількості приблизно від 20 % до приблизно 25 % по масі композиції. Як використовується тут, термін "розчинник" представлений рідкою речовиною або сумішшю рідких речовин, здатних розчиняти (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3циклопентилпропаннітрил або інші речовини в композиції. У деяких варіантах втілення винаходу розчинник представлений рідкою речовиною або сумішшю рідких речовин, у яких (R)-3-(4-(7Hпіроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3-циклопентилпропаннітрил або його фармацевтично прийнятна сіль має достатню розчинність. Наприклад, у Таблиці 21 представлена розчинність (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3циклопентилпропаннітрилу (нейтральна основа) або його фосфатної солі. У деяких варіантах втілення винаходу розчинник представлений речовиною або його сумішшю, у якій (R)-3-(4-(7Hпіроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3-циклопентилпропаннітрил або його фармацевтично прийнятна сіль (залежно від того, що використовують) мають розчинність, яка становить щонайменше приблизно 10 мг/мл або більше, щонайменше приблизно 15 мг/мл або 5 UA 111588 C2 5 10 15 20 25 30 35 40 45 50 55 60 більше, або щонайменше приблизно 20 мг/мл або більше, при вимірюванні, як це описано у Прикладі 4. У деяких варіантах втілення винаходу розчинник включає одну або більше речовин, вибраних незалежним чином із алкіленгліколів і поліалкіленгліколів. У деяких варіантах втілення винаходу розчинник включає одну або більше речовин, вибраних незалежним чином із пропіленгліколю і поліетиленгліколю. У деяких варіантах втілення винаходу терапевтичний агент присутній у кількості від приблизно 0,5 % до приблизно 1,5 % по масі нейтральної основи. У деяких варіантах втілення винаходу терапевтичний агент присутній у кількості приблизно 0,5 % по масі нейтральної основи. У деяких варіантах втілення винаходу терапевтичний агент присутній у кількості приблизно 1 % по масі нейтральної основи. У деяких варіантах втілення винаходу терапевтичний агент присутній у кількості приблизно 1,5 % по масі нейтральної основи. У деяких варіантах втілення винаходу терапевтичний агент представлений (R)-3циклопентил-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл]пропаннітрил фосфатом. У деяких варіантах втілення винаходу фармацевтична композиція включає: від приблизно 35 % до приблизно 65 % води по масі композиції; від приблизно 10 % до приблизно 40 % масляного компонента по масі композиції; від приблизно 1 % до приблизно 9 % емульгатора по масі композиції; від приблизно 10 % до приблизно 35 % розчинника по масі композиції; від приблизно 0,05 % до приблизно 5 % стабілізатора по масі композиції; і від приблизно 0,5 % до приблизно 1,5 % (R)-3-циклопентил-3-[4-(7H-пірол[2,3-d]піримідин-4іл)-1Н-піразол-1-іл]пропаннітрилу або його фармацевтично прийнятної солі по масі композиції на нейтральній основі. У деяких варіантах втілення винаходу фармацевтична композиція включає: від приблизно 40 % до приблизно 60 % води по масі композиції; від приблизно 15 % до приблизно 30 % масляного компонента по масі композиції; від приблизно 2 % до приблизно 6 % емульгатора по масі композиції; від приблизно 15 % до приблизно 30 % розчинника по масі композиції; від приблизно 0,1 % до приблизно 2 % стабілізатора по масі композиції; і від приблизно 0,5 % до приблизно 1,5 % (R)-3-циклопентил-3-[4-(7H-пірол[2,3-d]піримідин-4іл)-1Н-піразол-1-іл]пропаннітрилу або його фармацевтично прийнятної солі по масі композиції на нейтральній основі. У деяких варіантах втілення винаходу фармацевтична композиція включає: від приблизно 45 % до приблизно 55 % води по масі композиції; від приблизно 17 % до приблизно 27 % масляного компонента по масі композиції; від приблизно 3 % до приблизно 5 % емульгатора по масі композиції; від приблизно 20 % до приблизно 25 % розчинника по масі композиції; від приблизно 0,3 % до приблизно 0,5 % стабілізатора по масі композиції; і від приблизно 0,5 % до приблизно 1,5 % (R)-3-циклопентил-3-[4-(7H-пірол[2,3-d]піримідин-4іл)-1Н-піразол-1-іл]пропаннітрилу або його фармацевтично прийнятної солі по масі композиції на нейтральній основі. У деяких варіантах втілення винаходу фармацевтична композиція включає: від приблизно 45 % до приблизно 55 % води по масі композиції; від приблизно 17 % до приблизно 27 % масляного компонента по масі композиції; від приблизно 4 % до приблизно 7 % емульгатора по масі композиції; від приблизно 20 % до приблизно 25 % розчинника по масі композиції; від приблизно 0,3 % до приблизно 0,5 % стабілізатора по масі композиції; і від приблизно 0,5 % до приблизно 1,5 % (R)-3-циклопентил-3-[4-(7H-пірол[2,3-d]піримідин-4іл)-1Н-піразол-1-іл]пропаннітрилу або його фармацевтично прийнятної солі по масі композиції на нейтральній основі. У деяких варіантах втілення винаходу: масляний компонент включає одну або більше речовин, які вибирають незалежним чином із рідкого парафіну, насичених спиртів, мінеральних масел, тригліцеридів і диметиконів; емульгатор включає одну або більше речовин, вибраних незалежним чином із жирних ефірів гліцерину і жирних ефірів сорбітану; розчинник включає одну або більше речовин, вибраних незалежним чином із алкіленгліколів і поліалкіленгліколів; і стабілізатор включає одну або більше речовин, вибраних незалежним чином із 6 UA 111588 C2 5 10 15 20 25 30 35 40 45 50 55 60 полісахаридів. У деяких варіантах втілення винаходу: масляний компонент включає одну або більше речовин, які вибирають незалежним чином із білого парафіну, цетилового спирту, стеарилового спирту, легкого мінерального масла, тригліцеридів із середньою довжиною ланцюга й диметикону; емульгатор включає одну або більше речовин, вибраних незалежним чином із гліцерилстеарату й полісорбату 20; розчинник включає одну або більше речовин, вибраних незалежним чином із пропіленгліколю і поліетиленгліколю; і стабілізатор включає ксантанову камедь. У деяких варіантах втілення винаходу фармацевтична композиція включає: від приблизно 35 % до приблизно 65 % води по масі композиції; від приблизно 2 % до приблизно 15 % оклюзивного агента по масі композиції; від приблизно 2 % до приблизно 8 % наповнювача по масі композиції; від приблизно 5 % до приблизно 15 % пом'якшувача по масі композиції; від приблизно 1 % до приблизно 9 % емульгатора по масі композиції; від приблизно 0,05 % до приблизно 5 % стабілізатора по масі композиції; від приблизно 10 % до приблизно 35 % розчинника по масі композиції; і від приблизно 0,5 % до приблизно 1,5 % (R)-3-циклопентил-3-[4-(7H-пірол[2,3-d]піримідин-4іл)-1Н-піразол-1-іл]пропаннітрилу або його фармацевтично прийнятної солі по масі композиції на нейтральній основі. У деяких варіантах втілення винаходу фармацевтична композиція включає: від приблизно 40 % до приблизно 60 % води по масі композиції; від приблизно 5 % до приблизно 10 % оклюзивного агента по масі композиції; від приблизно 2 % до приблизно 8 % наповнювача по масі композиції; від приблизно 7 % до приблизно 12 % пом'якшувача по масі композиції; від приблизно 2 % до приблизно 6 % емульгатора по масі композиції; від приблизно 0,1 % до приблизно 2 % стабілізатора по масі композиції; від приблизно 15 % до приблизно 30 % розчинника по масі композиції; і від приблизно 0,5 % до приблизно 1,5 % (R)-3-циклопентил-3-[4-(7H-пірол[2,3-d]піримідин-4іл)-1Н-піразол-1-іл]пропаннітрилу або його фармацевтично прийнятної солі по масі композиції на нейтральній основі. У деяких варіантах втілення винаходу фармацевтична композиція включає: від приблизно 45 % до приблизно 55 % води по масі композиції; від приблизно 5 % до приблизно 10 % оклюзивного агента по масі композиції; від приблизно 3 % до приблизно 6 % наповнювача по масі композиції; від приблизно 7 % до приблизно 13 % пом'якшувача по масі композиції; від приблизно 3 % до приблизно 5 % емульгатора по масі композиції; від приблизно 0,3 % до приблизно 0,5 % стабілізатора по масі композиції; від приблизно 20 % до приблизно 25 % розчинника по масі композиції; і від приблизно 0,5 % до приблизно 1,5 % (R)-3-циклопентил-3-[4-(7H-пірол[2,3-d]піримідин-4іл)-1Н-піразол-1-іл]пропаннітрилу або його фармацевтично прийнятної солі по масі композиції на нейтральній основі. У деяких варіантах втілення винаходу фармацевтична композиція включає: від приблизно 45 % до приблизно 55 % води по масі композиції; від приблизно 5 % до приблизно 10 % оклюзивного агента по масі композиції; від приблизно 4 % до приблизно 7 % наповнювача по масі композиції; від приблизно 7 % до приблизно 13 % пом'якшувача по масі композиції; від приблизно 4 % до приблизно 7 % емульгатора по масі композиції; від приблизно 0,3 % до приблизно 0,5 % стабілізатора по масі композиції; від приблизно 20 % до приблизно 25 % розчинника по масі композиції; і від приблизно 0,5 % до приблизно 1,5 % (R)-3-циклопентил-3-[4-(7H-пірол[2,3-d]піримідин-4іл)-1Н-піразол-1-іл]пропаннітрилу або його фармацевтично прийнятної солі по масі композиції на нейтральній основі. У деяких варіантах втілення винаходу фармацевтична композиція включає: від приблизно 45 % до приблизно 55 % води по масі композиції; приблизно 7 % оклюзивного агента по масі композиції; від приблизно 4,5 % до приблизно 5 % наповнювача по масі композиції; приблизно 10 % пом'якшувача по масі композиції; від приблизно 4 % до приблизно 4,5 % емульгатора по масі композиції; 7 UA 111588 C2 5 10 15 20 25 30 35 40 45 50 55 60 приблизно 0,4 % стабілізатора по масі композиції; приблизно 22 % розчинника по масі композиції; і від приблизно 0,5 % до приблизно 1,5 % (R)-3-циклопентил-3-[4-(7H-пірол[2,3-d]піримідин-4іл)-1Н-піразол-1-іл]пропаннітрилу або його фармацевтично прийнятної солі по масі композиції на нейтральній основі. У деяких варіантах втілення винаходу комбінована кількість наповнювача і емульгатора становить щонайменше приблизно 8 % по масі композиції. У деяких варіантах втілення винаходу: оклюзивний агент включає парафін; наповнювач включає одну або більше речовин, вибраних незалежним чином із одного або декількох жирних спиртів; пом'якшувач включає одну або більше речовин, вибраних незалежним чином із мінеральних масел і тригліцеридів; емульгатор включає одну або більше речовин, вибраних незалежним чином із жирних ефірів гліцерину й жирних ефірів сорбітану; стабілізатор включає одну або більше речовин, вибраних незалежним чином із полісахаридів; і розчинник включає одну або більше речовин, вибраних незалежним чином із алкіленгліколів і поліалкіленгліколів. У деяких варіантах втілення винаходу: оклюзивний агент включає білий парафін; наповнювач включає одну або більше речовин, вибраних незалежним чином із цетилового спирту і стеарилового спирту; пом'якшувач включає одну або більше речовин, вибраних незалежним чином із легкого мінерального масла, тригліцеридів з ланцюгом середньої довжини і диметикону; емульгатор включає одну або більше речовин, вибраних незалежним чином із гліцерилстеарату і полісорбату 20; стабілізатор включає ксантанову камедь; і розчинник включає одну або більше речовин, вибраних незалежним чином із пропіленгліколю й поліетиленгліколю. У деяких варіантах втілення винаходу фармацевтична композиція додатково включає антибактеріальний консервант. У деяких варіантах втілення винаходу антибактеріальний консервант присутній у кількості приблизно від 0,05 % до приблизно 3 % по масі композиції. У деяких варіантах втілення винаходу антибактеріальний консервант присутній у кількості приблизно від 0,1 % до приблизно 1 % по масі композиції. Як використовується тут, фраза "антибактеріальний консервант" позначає речовину або суміші речовин, які інгібують ріст мікроорганізмів у композиції. У деяких варіантах втілення винаходу антибактеріальний консервант включає одну або більше речовин, вибраних незалежним чином із алкілпарабенів і феноксіетанолу. У деяких варіантах втілення винаходу антибактеріальний консервант включає одну або більше речовин, вибраних незалежним чином із метилпарабену, пропілпарабену і феноксіетанолу. У деяких варіантах втілення винаходу фармацевтична композиція додатково включає хелатний агент. Як використовується тут, фраза "хелатний агент" належить до сполуки або сумішей сполук, що володіють сильною здатністю зв'язуватися з іонами металів. У деяких варіантах втілення винаходу хелатний агент включає динатрію едетат. (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3-циклопентилпропаннітрил може бути отриманий, як це описано в патенті США № 7598257 і публікації патенту США № 2009/0181959, кожен з яких включений сюди у всій своїй повноті за допомогою посилання. Фосфатна сіль 1:1 (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3циклопентилпропаннітрилу може бути отримана, як це описано в публікації патенту США № 2008/0312259, що включений сюди у всій своїй повноті за допомогою посилання. Сполуки згідно з даним винаходом також включають фармацевтично прийнятні солі описаних тут сполук. Як використовується тут, термін "фармацевтично прийнятна сіль" належить до солі, утвореної шляхом додавання фармацевтично прийнятної кислоти або основи до описаної тут сполуки. Як використовується тут, фраза "фармацевтично прийнятний" належить до речовини, яка є прийнятною для використання у фармації з погляду токсикології й не взаємодіє негативним чином з активною діючою речовиною. Фармацевтично прийнятні солі, 8 UA 111588 C2 5 10 15 20 25 30 35 40 45 50 55 60 включаючи моно- і бісолі, включають, але не обмежуються цим, солі, отримані з органічних і неорганічних кислот, таких як, не обмежуючись цим, оцтова, молочна, лимонна, корична, тартарова, сукцинілова, фумарова, малеїнова, малонова, мигдальна, яблучна, оксалатна, пропіонова, соляна, бромоводнева, фосфорна, азотна, сірчана, гліколева, піруватна, метансульфонова, етансульфонова, толуолсульфонова, саліцилова, бензойна, а також із подібних відомих прийнятних кислот. Списки прийнятних солей представлені в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., 1985, p. 1418 і Journal of Pharmaceutical Science, 66, 2 (1977), кожен з яких включений сюди у всій своїй повноті за допомогою посилання. Також буде зрозуміло, що описані тут сполуки можуть існувати у розчиненій формі, наприклад, формі гідратів, а також у нерозчиненій формі. Додатково буде зрозуміло, що даний винахід охоплює всі розчинені форми сполук. Як використовується тут, термін «% по масі композиції" позначає концентрацію компонента, виражену у відсотках, у композиції на основі співвідношення мас./мас… Наприклад, 1 % мас./мас. компонента А = [(маса компонента A) / (загальна маса композиції)] x 100. Як використовується тут, термін «% по масі композиції на основі нейтральної основи" (R)-3(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3-циклопентилпропаннітрилу або його фармацевтично прийнятної солі" означає, що % мас./мас. розраховується на основі маси (R)-3(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3-циклопентилпропаннітрилу у загальній композиції. Наприклад, "0,5 % мас./мас. на нейтральній основі" (R)-3-(4-(7H-піроло[2,3d]піримідин-4-іл)-1Н-піразол-1-іл)-3-циклопентилпропаннітрил фосфату означає, що на 100 грам загальної ваги композиції існує 0,66 грам (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1іл)-3-циклопентилпропаннітрилу фосфату в композиції (що дорівнює 0,5 грамам нейтральної основи, (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3-циклопентилпропаннітрилу). У деяких варіантах втілення винаходу компоненти присутні в точно вказаних діапазонах (наприклад, термін "приблизно" відсутній). У деяких варіантах втілення винаходу термін "приблизно" означає плюс або мінус 10 % від значення. Як це буде очевидно, деякі компоненти описаних тут фармацевтичних композицій можуть володіти декількома функціями. Наприклад, дана речовина може діяти як емульгатор і стабілізатор. У деяких таких випадках функція даного компонента може розглядатися як виняткова, навіть якщо її властивості можуть забезпечувати множинну функціональність. У деяких варіантах втілення винаходу кожен компонент у композиції включає різні речовини або суміш речовин. У контексті даного винаходу термін "компонент" може означати одну речовину або суміш речовин. Як використовується тут, термін "жирна кислота" належить до аліфатичної кислоти, насиченої або ненасиченої. У деяких варіантах втілення винаходу жирна кислота знаходиться в суміші різних жирних кислот. У деяких варіантах втілення винаходу жирна кислота має в середньому від приблизно восьми до приблизно тридцяти атомів вуглецю. У деяких варіантах втілення винаходу жирна кислота має в середньому від приблизно 12 до 20, 14-20 або 16-18 атомів вуглецю. Прийнятні жирні кислоти включають, але не обмежуються цим, цетилову кислоту, стеарилову кислоту, лаурилову кислоту, міристинову кислоту, ерукову кислоту, пальмітинову кислоту, пальмітолеїнову кислоту, капринову кислоту, каприлову кислоту, олеїнову кислоту, лінолеву кислоту, ліноленову кислоту, гідроксистеаринову кислоту, 12гідроксистеаринову кислоту, кетостеаринову кислоту, ізостеаринову кислоту, сесквіолеїнову кислоту, сескві-9-октадеканоєву кислоту, сесквіізооктадеканоєву кислоту, бегенову кислоту, ізобегенову кислоту та арахідонову кислоту або їх солі. Як використовується тут, термін "жирний спирт" належить до аліфатичного спирту, насиченого або ненасиченого. У деяких варіантах втілення винаходу жирний спирт знаходиться в суміші різних жирних спиртів. У деяких варіантах втілення винаходу жирний спирт має в середньому від приблизно 12 до приблизно 20, від приблизно 14 до приблизно 20 або від приблизно 16 до приблизно 18 атомів вуглецю. Прийнятні жирні спирти включають, але не обмежуються цим, стеариловий спирт, лауриловий спирт, пальмітиловий спирт, цетиловий спирт, каприловий спирт, каприліловий спирт, олеїловий спирт, ліноленовий спирт, арахідоновий спирт, бегениловий спирт, ізобегеніловий спирт, селахіловий спирт, хіміловий спирт і лінолевий спирт або їх суміші. Як використовується тут, термін "поліалкіленгліколь", використовуваний як один термін або в комбінації з іншими термінами, належить до полімеру, який містить одиниці мономера оксіалкілену, або співполімеру з різних одиниць мономера оксіалкілену, при цьому алкіленова група має від 2 до 6, від 2 до 4 або від 2 до 3 атомів вуглецю. Як використовується тут, термін 9 UA 111588 C2 5 10 15 20 25 30 35 40 45 50 55 60 "оксіалкілен", використовуваний як один термін або в комбінації з іншими термінами, означає групу по формулі -О-алкілен-. У деяких варіантах втілення винаходу поліалкіленгліколь представлений поліетиленгліколем. Як використовується тут, термін "жирний ефір сорбітану" включає продукти, отримані із сорбітану або сорбітолу і жирних кислот, і, необов'язково, одиниць полі(етиленгліколю), включаючи ефіри сорбітану та ефіри поліетоксилованого сорбітану. У деяких варіантах втілення винаходу жирний ефір сорбітану представлений поліетоксилованим ефіром сорбітану. Як використовується тут, термін "ефір сорбітану" належить до сполуки або суміші сполук, отриманих у результаті етерифікації сорбітолу і щонайменше однієї жирної кислоти. Жирні кислоти, що підходять для одержання ефірів сорбітану, включають, але не обмежуються цим, описані тут жирні кислоти. Прийнятні ефіри сорбітану включають, але не обмежуються цим, серію Span™ (доступну від Uniqema), що включає Span 20 (сорбітану монолаурат), 40 (сорбітану монопальмітат), 60 (сорбітану моностеарат), 65 (сорбітану тристеарат), 80 (сорбітану моноолеат) і 85 (сорбітану триолеат). Інші прийнятні ефіри сорбітану включають ефіри, перераховані в R. C. Rowe and P. J. Shesky, Handbook of pharmaceutical excipients, (2006), 5th ed., що включена сюди у всій своїй повноті за допомогою посилання. Як використовується тут, термін "поліетоксилований ефір сорбітану" належить до сполуки або її сумішей, отриманих після етоксилування ефіру сорбітану. Поліоксіетиленовий фрагмент сполуки може перебувати між молекулою жирного ефіру і молекулою сорбітану. Як використовується тут, термін "ефір сорбітану" належить до сполуки або суміші сполук, отриманих у результаті етерифікації сорбітолу і щонайменше однієї жирної кислоти. Жирні кислоти, використовувані для одержання поліетоксилованих ефірів сорбітану, включають, але не обмежуються цим, описані тут жирні кислоти. У деяких варіантах втілення винаходу поліоксіетиленовий фрагмент сполуки або її суміші має від приблизно 2 до приблизно 200 оксіетиленових одиниць. У деяких варіантах втілення винаходу поліоксіетиленовий фрагмент сполуки або її суміші має від приблизно 2 до приблизно 100 оксіетиленових одиниць. У деяких варіантах втілення винаходу поліоксіетиленовий фрагмент сполуки або її суміші має від приблизно 4 до приблизно 80 оксіетиленових одиниць. У деяких варіантах втілення винаходу поліоксіетиленовий фрагмент сполуки або її суміші має від приблизно 4 до приблизно 40 оксіетиленових одиниць. У деяких варіантах втілення винаходу поліоксіетиленовий фрагмент сполуки або її суміші має відприблизно 4 до приблизно 20 оксіетиленових одиниць. Прийнятні поліетоксиловані ефіри сорбітану включають, але не обмежуються цим, серію Tween™ (доступну від Uniqema), що включає Tween 20 (ПОЕ(20) сорбітану монолаурат), 21 (ПОЕ(4) сорбітану монолаурат), 40 (ПОЕ(20) сорбітану монопальмітат), 60 (ПОЕ(20) сорбітану моностеарат), 60K (ПОЕ(20) сорбітану моностеарат), 61 (ПОЕ(4) сорбітану моностеарат), 65 (ПОЕ(20) сорбітану тристеарат), 80 (ПОЕ(20) сорбітану моноолеат), 80K (ПОЕ(20) сорбітану моноолеат), 81 (ПОЕ(5) сорбітану моноолеат) і 85 (ПОЕ(20) сорбітану триолеат). Як використовується тут, абревіатура "ПОЕ" означає поліоксіетилен. Число, вказане поруч із абревіатурою ПОЕ, означає кількість повторюваних одиниць оксіетилену у сполуці. Інші прийнятні поліетоксиловані ефіри сорбітану включають ефіри сорбітану з поліоксіетиленом, перераховані в R. C. Rowe and P. J. Shesky, Handbook of pharmaceutical excipients, (2006), 5th ed., яка включена сюди у всій своїй повноті за допомогою посилання. У деяких варіантах втілення винаходу поліетоксилований ефір сорбітану представлений полісорбатом. У деяких варіантах втілення винаходу поліетоксилований ефір сорбітану представлений полісорбатом 20. Як використовується тут, термін "гліцерилові жирні ефіри" належить до моно-, ди- або тригліцеридів жирних кислот. Гліцерилові жирні ефіри можуть бути, необов'язково, заміщені групами сульфонової кислоти або її фармацевтично прийнятних солей. Прийнятні жирні кислоти, використовувані для одержання тригліцеридів жирних кислот, включають, але не обмежуються цим, описані тут жирні кислоти. У деяких варіантах втілення винаходу гліцериловий жирний ефір представлений моногліцеридом жирної кислоти, що має 12-18 атомів вуглецю. У деяких варіантах втілення винаходу гліцериловий жирний ефір представлений гліцерилстеаратом. Як використовується тут, термін "тригліцериди" означає тригліцерид жирної кислоти. У деяких варіантах втілення винаходу тригліцерид представлений тригліцеридами з ланцюгом середньої довжини. Як використовується тут, термін "алкіленгліколь" позначає групу по формулі -О-алкілен-, при цьому алкіленова група має від 2 до 6, від 2 до 4 або від 2 до 3 атомів вуглецю. У деяких варіантах втілення винаходу алкіленгліколь представлений пропіленгліколем (1, 2пропандіолом). 10 UA 111588 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як використовується тут, термін "поліетиленгліколь" належить до полімеру, що містить одиниці мономера етиленгліколю по формулі -O-CH2-CH2-. Прийнятні поліетиленгліколі можуть містити незв'язану гідроксильну групу на кожному кінці молекули полімеру або можуть містити одну або більше гідроксильних груп, етерифікованих нижчим алкілом, наприклад, метиловою групою. Також прийнятними є похідні поліетиленгліколів, що мають карбоксильні групи, здатні до етерифікації. Поліетиленгліколі, що підходять для використання згідно з даним винаходом, можуть бути представлені полімерами з ланцюгом будь-якої довжини або будь-якою молекулярною вагою і можуть включати розгалуження. У деяких варіантах втілення винаходу середня молекулярна вага поліетиленгліколю становить від приблизно 200 до приблизно 9000. У деяких варіантах втілення винаходу середня молекулярна вага поліетиленгліколю становить від приблизно 200 до приблизно 5000. У деяких варіантах втілення винаходу середня молекулярна вага поліетиленгліколю становить від приблизно 200 до приблизно 900. У деяких варіантах втілення винаходу середня молекулярна вага поліетиленгліколю становить приблизно 400. Прийнятні поліетиленгліколі включають, але не обмежуються цим, поліетиленгліколь-200, поліетиленгліколь-300, поліетиленгліколь-400, поліетиленгліколь-600 і поліетиленгліколь-900. Число після риски в назві означає середню молекулярну вагу полімеру. Крім того, взято до уваги те, що певні ознаки винаходу, які для ясності описані в контексті окремих варіантів втілення винаходу, також можуть бути описані в комбінації в одному варіанті втілення винаходу. У свою чергу, різні ознаки винаходу, які для стислості описані в контексті одного варіанту втілення винаходу, також можуть бути представлені окремо або в будь-якій прийнятній субкомбінації. Способи Фармацевтичні композиції згідно з даним винаходом використовують у лікуванні шкірних порушень. У деяких варіантах втілення винаходу шкірне порушення представлене аутоімунним бульозним шкірним захворюванням, таким як вульгарна пухирчатка (ВП) або бульозний пемфігоїд (БП). У деяких варіантах втілення винаходу шкірне порушення представлене псоріазом (наприклад, звичайним псоріазом), атопічним дерматитом, шкірним висипанням, подразненням шкіри, сенсибілізацією шкіри (наприклад, контактним дерматитом або алергійним контактним дерматитом). Наприклад, певні речовини, що включають деякі фармацевтичні препарати, при місцевому застосуванні можуть викликати сенсибілізацію шкіри. У деяких варіантах втілення винаходу одночасне введення або послідовне введення місцевих препаратів згідно з даним винаходом разом із препаратом, що викликає небажану сенсибілізацію, може виявитися корисним для лікування такої подібної небажаної сенсибілізації або дерматиту. Даний винахід, крім того, забезпечує спосіб лікування дерматологічних побічних ефектів, викликаних іншими препаратами, шляхом введення сполуки згідно з даним винаходом. Наприклад, множинні фармацевтичні препарати приводять до небажаних алергійних реакцій, які можуть проявлятися у вигляді вугрового сипу або відповідного дерматиту. Приклади фармацевтичних препаратів, що мають подібні небажані побічні ефекти, включають протиракові препарати, такі як гефітиніб, цетуксимаб, ерлотиніб і т. п. Композиції згідно з даним винаходом можуть бути введені системно або місцево (наприклад, з локалізацією в безпосередній близькості від дерматиту) у комбінації з (наприклад, одночасно або послідовно) фармацевтичним препаратом, що має небажаний дерматологічний побічний ефект. У деяких варіантах втілення винаходу композиція згідно з даним винаходом може бути введена місцево разом з одним або більше інших препаратів, при цьому інші препарати, при місцевому застосуванні під час відсутності композиції згідно з даним винаходом, можуть викликати контактний дерматит, алергійну контактну сенсибілізацію або подібне шкірне порушення. Відповідно до цього композиція згідно з даним винаходом включає композиції для місцевого застосування, які додатково включають додатковий фармацевтичний агент, що може викликати дерматит, шкірні порушення або пов'язані побічні ефекти. Як використовується тут, термін "індивідуум" або "пацієнт", використовуваний взаємозамінним чином, належить до будь-якої тварини, включаючи ссавців, переважно мишей, щурів, інших гризунів, кроликів, собак, кішок, свиней, рогатий худобу, овець, коней або приматів, і найбільш переважно - людей. Як використовується тут, фраза "терапевтично ефективна кількість" належить до кількості активної діючої речовини або фармацевтичного агента, що викликає біологічну або медичну відповідь, яка може бути виявлена у тканині, системі, тварині, індивідуумі або в людини дослідником, ветеринаром, лікарем або іншим фахівцем. Як використовується тут, термін "лікування" або "лікувати" належить до одного або більше наступних понять: (1) профілактика захворювання; наприклад, профілактика захворювання, стану або порушення у індивідуума, схильного до захворювання, стану або порушення, однак, 11 UA 111588 C2 5 10 15 20 25 30 35 40 45 50 55 60 досвід або патологія, або симптоми захворювання відсутні; (2) інгібування захворювання; наприклад, інгібування захворювання, стану або порушення у індивідуума з наявністю або присутністю патології або симптомів захворювання, стану або порушення (тобто блокування подальшого розвитку патології і/або симптомів); (3) зниження ступеня тяжкості захворювання; наприклад, зниження ступеня тяжкості захворювання, стану або порушення у індивідуума з наявністю або присутністю патології або симптомів захворювання, стану або порушення (тобто зворотний розвиток патології і/або симптомів), наприклад, зниження ступеня тяжкості хвороби. Комбінована терапія У комбінації з композиціями згідно з даним винаходом для лікування JAK-асоційованих захворювань, порушень або станів можуть використовуватися один або більше додаткових фармацевтичних агентів, таких як, наприклад, хіміотерапевтичні препарати, протизапальні агенти, стероїди, імуносупресанти, а також інгібітори Bcr-Abl, Flt-3, RAF і FAK-кінази, такі як, наприклад, описані в WO 2006/056399, та інші агенти. Пацієнту одночасно або послідовно може бути введений один або більше додаткових фармацевтичних агентів. Приклади хіміопрепаратів включають інгібітори протеосоми (наприклад, бортезоміб), талідомід, ревлімід і агенти, що пошкоджують ДНК, такі як мелфалан, доксорубіцин, циклофосфамід, вінкристин, етопозид, кармустин і т. п. Приклади стероїдів включають кортикостероїди, такі як дексаметазон або преднізон. Приклад інгібіторів Bcr-Abl включає сполуки і їх фармацевтично прийнятні солі, сімейства і види яких описані в патенті США № 5521184, WO 04/005281 і патентній заявці США № 60/578491. Приклади прийнятних інгібіторів Flt-3 включаютьсполуки і їх фармацевтично прийнятні солі, як це описано в WO 03/037347, WO 03/099771 і WO 04/046120. Приклади прийнятних інгібіторів RAF включають сполуки і їх фармацевтично прийнятні солі, як це описано в WO 00/09495 і WO 05/028444. Приклади прийнятних інгібіторів FAK включають сполуки і їх фармацевтично прийнятні солі, як це описано в WO 04/080980, WO 04/056786, WO 03/024967, WO 01/064655, WO 00/053595 і WO 01/014402. У деяких варіантах втілення винаходу композиції згідно з даним винаходом можуть використовуватися в комбінації з одним або більше інших інгібіторів кінази, включаючи іматініб, зокрема, для лікування пацієнтів, резистентних до іматінібу або інших інгібіторів кінази. У деяких варіантах втілення винаходу кортикостероїд, такий як дексаметазон, вводять пацієнту в комбінації зі сполукою згідно з даним винаходом, при цьому дексаметазон вводять періодично, а не постійно. Мічені сполуки і способи аналізу Інший аспект даного винаходу належить до композицій, що включають мічену активну сполуку (мічену радіоміткою, флуоресціюючою міткою і т. д.), що може використовуватися не тільки у способах візуалізації, але також в аналізах як in vitro, так і in vivo для локалізації і кількісного аналізу JAK у зразках тканин, включаючи тканини людини, а також для ідентифікації лігандів JAK шляхом інгібування зв'язування міченої сполуки. Відповідно до цього даний винахід описує аналізи JAK, що містять такі мічені сполуки. Даний винахід додатково включає композиції сполуки, міченої ізотопом. Сполука "мічена ізотопом" або "мічена радіологічно" представлена сполукою, у якій один або більше атомів заміщені або замінені атомом з атомною масою або масовим числом, що відрізняється від атомної маси або масового числа, що зустрічаються звичайно в природі (тобто, природно зустрічаються). Прийнятні радіонукліди, які можуть використовуватися у сполуках згідно з даним 2 винаходом, включають, але не обмежуються цим, H (також позначається як D для дейтерію), 3 11 13 14 13 15 15 17 18 18 35 36 82 H (також позначається як T для тритію), C, C, C, N, N, O, O, O, F, S, Cl, Br, 75 76 77 123 124 125 131 Br, Br, Br, I, I, I та I. Радіонуклід, введений у радіомічені сполуки, буде залежати від специфічного застосування такої радіологічно міченої сполуки. Наприклад, для in vitro JAK3 14 82 125 131 35 мічення та аналізів конкурентного зв'язування сполуки, що включають H, C, Br, I, I, S, будуть звичайно більш прийнятними. Для використання в радіологічній візуалізації більш 11 18 125 123 124 131 75 76 77 прийнятним буде використання C, F, I, I, I, I, Br, Br або Br. Зрозуміло, що "радіологічно мічена" або "мічена сполука" представлена сполукою, що включає щонайменше один радіонуклід. У деяких варіантах втілення винаходу радіонуклід 3 14 125 35 82 вибирають із групи, що складається з H, C, I, S і Br. Набори Даний винахід також описує фармацевтичні набори, використовувані, наприклад, у лікуванні або профілактиці JAK-асоційованих захворювань або порушень, таких як рак, які включають один або більше контейнерів, що містять фармацевтичну композицію згідно з даним винаходом. 12 UA 111588 C2 5 10 15 Такі набори можуть додатково включати, при необхідності, один або більше різних стандартних компонентів фармацевтичного набору, таких як, наприклад, контейнери з одним або більше фармацевтично прийнятних носіїв, додаткових контейнерів і т. д., як це стане очевидно для фахівця в даній галузі техніки. У набір також можуть бути включені інструкції, у вигляді вкладишів або етикеток, що вказують кількості компонентів для введення, посібники для введення і/або посібники для змішування компонентів. Винахід буде описаний більш докладно у специфічних прикладах. Представлені нижче приклади приводяться тільки з ілюстративною метою і не повинні ніяким чином обмежувати даний винахід. Фахівець у даній галузі техніки з легкістю розпізнає цілий ряд некритичних параметрів, які можуть бути змінені або модифіковані для одержання по суті подібних результатів. У деяких варіантах втілення даний винахід забезпечує фармацевтичні композиції, що включають компоненти, вказані в композиціях прикладів (наприклад, Приклад 3), при цьому компоненти присутні у приблизних кількостях, вказаних у Таблицях 2-5. ПРИКЛАДИ Приклад 1: (3R)- і (3S)-3-циклопентил-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1іл]пропаннітрил CN CN N N N N and N 20 25 30 35 40 45 50 N N N N N H H Етап 1. (2E)- і (2Z)-3-циклопентилакрилонітрил До розчину 1,0 М калію трет-бутоксиду в ТГФ (235 мл) при 0 °C по краплях був доданий розчин діетилціанометилфосфату (39,9 мл, 0,246 моль) у ТГФ (300 мл). Крижана баня була вилучена, і реакційна суміш була нагріта до кімнатної температури з наступним повторним охолодженням до 0ºC, у ході чого по краплі був доданий розчин циклопентанкарбальдегіду (22,0 г, 0,224 моль) у ТГФ (60 мл). Баня була вилучена, і реакційна суміш була нагріта до кімнатної температури і перемішана протягом 64 годин. Суміш була розділена на діетиловий ефір і воду, і вода була екстрагована з використанням трьох частин ефіру з наступним додаванням двох частин етилацетату. Комбіновані екстракти були промиті соляним розчином, потім висушені з використанням натрію сульфату, профільтровані і сконцентровані in vacuo для забезпечення суміші, що містить 24,4 г ізомерів олефіну, що використовувалася без подальшого очищення (89 %). 1 H ЯМР (400 МГц, CDCl3): δ 6,69 (dd, 1H, транс-олефін), 6,37 (t, 1H, цис-олефін), 5,29 (dd, 1H, транс-олефін), 5,20 (d, 1H, цис-олефін), 3,07-2,95 (m, 1H, цис-продукт), 2,64-2,52 (m, 1H, транспродукт), 1,98-1,26 (m, 16H). Етап 2. (3R)- і (3S)-3-циклопентил-3-[4-(7-[2-(триметилсиліл)етокси]метил-7H-піроло[2,3d]піримідин-4-іл)-1Н-піразол-1-іл]пропаннітрил До розчину 4-(1Н-піразол-4-іл)-7-[2-(триметилсиліл)етокси]метил-7H-піроло[2,3-d]піримідину (15,0 г, 0,0476 моль) в ACN (300 мл) був доданий 3-циклопентилакрилонітрил (15 г, 0,12 моль) (як суміш цис- і транс-ізомерів) з наступним додаванням DBU (15 мл, 0,10 моль). Отримана суміш була піддана перемішуванню при кімнатній температурі протягом ночі. ACN був випарений. Суміш була розведена етилацетатом, і розчин був промитий 1,0 N HCl. Водний шар був знову екстрагований із трьома частинами етилацетату. Комбіновані органічні екстракти були промиті з використанням насиченого сольового розчину, висушені в присутності натрію сульфату, профільтровані і сконцентровані. Неочищений продукт був очищений з використанням хроматографії із силікагелем (градієнт етилацетату/гексанів) для одержання в'язкого прозорого сиропу, що був розчинений в етанолі і очищений кілька разів для видалення етилацетату з одержанням 19,4 г рацемату (93 %). Енантіомери були розділені препаративною ВЕРХ (OD-H, 15 % етанолу/гексанів) і використані окремо в наступному етапі для одержання відповідного фінального продукту. Фінальні продукти (див. Етап 3) очищених один від одного енантіомерів виявилися активними інгібіторами JAK; однак, фінальний продукт, відділений від другого піка, отриманого під час препаративної ВЕРХ, був більш активний, ніж його енантіомер. 1 H ЯМР (300 МГц, CDCl3): δ 8,85 (s, 1H), 8,32 (s, 2H), 7,39 (d, 1H), 6,80 (d, 1H), 5,68 (s, 2H), 4,26 (dt, 1H), 3,54 (t, 2H), 3,14 (dd, 1H), 2,95 (dd, 1H), 2,67-2,50 (m, 1H), 2,03-1,88 (m, 1H), 1,80 13 UA 111588 C2 5 10 15 20 1,15 (m, 7H), 0,92 (t, 2H), -0,06 (s, 9H); MS(ES):437 (M+1). Етап 3. (3R)- і (3S)-3-циклопентил-3-[4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1іл]пропаннітрил До розчину 3-циклопентил-3-[4-(7-[2-(триметилсиліл)етокси]метил-7H-піроло[2,3-d]піримідин4-іл)-1Н-піразол-1-іл]пропаннітрилу (6,5 г, 0,015 моль, R або S енантіомер, отриманий, як це описано вище) в DCM (40 мл) був доданий ТФК (16 мл), і суміш була перемішана протягом 6 годин. Розчинник і ТФК були вилучені в in vacuo. Залишок був розчинений в DCM і сконцентрований з використанням ротаційного випарника додатково два рази для видалення по можливості максимальної кількості ТФК. Після цього залишок був перемішаний з етилендіаміном (4 мл, 0,06 моль) у метанолі (30 мл) протягом ночі. Розчинник був вилучений in vacuo, була додана вода, і продукт був екстрагований у три порції етилацетату. Комбіновані екстракти були промиті сольовим розчином, висушені у присутності натрію сульфату, декантовані і сконцентровані для одержання неочищеного продукту, який був очищений з використанням колонкової хроматографії (елюювання із градієнтом метанолу/DCM). Отримана суміш була додатково очищена з використанням препаративної ВЕРХ-MS (С18 елюювання із градієнтом ACN/H2O, який містить 0,15 % NH4OH) для одержання продукту (2,68 г, 58 %). 1 H ЯМР (400 МГц, D6-DMSO): δ 12,11 (br s, 1H), 8,80 (s, 1H), 8,67 (s, 1H), 8,37 (s, 1H), 7,60 (d, 1H), 6,98 (d, 1H), 4,53 (dt, 1H), 3,27 (dd, 1H), 3,19 (dd, 1H), 2,48-2,36 (m, 1H), 1,86-1,76 (m, 1H), 1,68-1,13 (m, 7H); MS(ES):307(M+1). Приклад 2: (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3циклопентилпропаннітрилова сіль фосфорної кислоти H (R) CN N N H3 PO4 N N H У пробірку, яка піддавалась тестуванню, були додані (R)-3-(4-(7H-піроло[2,3-d]піримідин-4іл)-1Н-піразол-1-іл)-3-циклопентилпропаннітрил (153,5 мг) і фосфорна кислота (56,6 мг) з наступним додаванням ізопропілового спирту (ІПС) (5,75 мл). Отримана суміш була нагріта до прозорого стану, охолоджена до кімнатної температури і потім перемішана протягом додаткових 2 годин. Осад був зібраний шляхом фільтрації і промитий 0,6 мл холодного ІПС. Осад був висушений у вакуумі до постійної ваги для одержання фінального продукту - солі (171,7 мг). 1 Як було виявлено, сіль фосфорної кислоти знаходилася у співвідношенні 1:1 до H ЯМР, і кристалоутворення було підтверджене порошковою рентгенографією (ПРГ). Диференціальна скануюча калориметрія (ДСК) дозволила виявити чіткий пік плавлення при приблизно 198,66 °C. Була виявлена незначна втрата ваги продукту до 200 °C шляхом термогравіметричного аналізу. Приклад 3: Одержання композицій крему масло-у-воді (R)-3-(4-(7H-піроло[2,3-d]піримідин-4іл)-1Н-піразол-1-іл)-3-циклопентилпропаннітрилової солі фосфорної кислоти Композиція крему масло-у-воді була отримана із включенням (R)-3-(4-(7H-піроло[2,3d]піримідин-4-іл)-1Н-піразол-1-іл)-3-циклопентилпропаннітрилової солі фосфорної кислоти (Приклад 2) при 0,5 %, 1,0 % і 1,5 % по масі композиції (еквівалент нейтральної основи). Композиції для 15 г пробірки представлені в Таблиці 2 нижче. Композиції із трьома концентраціями були ідентичні, за винятком корекції кількості очищеної води на основі кількості активної діючої речовини. Всі допоміжні речовини, використовувані в композиції, мали затверджений ступінь чистоти (тобто Фармакопеї США/Національного формуляру або Британської фармакопеї) або затверджені для використання в продуктах для місцевого застосування. Кількісна формула для репрезентативних 400 кг партій композиції крему для Прикладу 2 у концентрації 0,5, 1,0 і 1,5 % також представлена в Таблицях 3, 4 і 5, відповідно. N 25 30 35 40 45 14 UA 111588 C2 Таблиця 2 ФОРМУЛА ФАЗА Парабен КОМПОНЕНТ Пропіленгліколь USP Метилпарабен NF Пропілпарабен NF Ксантанова камедь Фінальний Розчинник 10,00 1,5 0,10 0,015 0,05 0,0075 Антибактеріальний консервант Антибактеріальний консервант Розчинник 5,00 0,75 Ксантанова камедь NF Суспендуючий агент, стабілізатор, агент, що підвищує в'язкість 0,40 0,06 Пом'якшувач, розчинник 4,00 0,6 Емульгатор 3,00 0,45 Емульгатор/стабілізатор 1,25 0,1875 Оклюзивний агент Наповнювач, покращувач консистенції 7,00 1,05 3,00 0,45 Наповнювач 1,75 0,2625 Речовина для захисту шкіри 1,00 0,15 Пом'якшувач, розчинник 5,00 0,75 Розчинник 50,24-48,92 7,536 – 7,338 Хелатний агент 0,05 0,0075 Розчинник 7,00 1,05 Активна діюча речовина Антибактеріальний консервант 0,66 – 1,98 0,099 – 0,297 0,50 0,075 100,00 % 15 Білий парафін USP Цетиловий спирт NF Стеариловий спирт NF Диметикон 360 NF Вода/активна фаза Грами/пробірку Пропіленгліколь USP Легке мінеральне масло NF Гліцерилстеарат SE Полісорбат 20 NF Масло Функція Відсоток від загальної кількості (% мас./мас.) Тригліцерид з ланцюгом середньої довжини NF Очищена вода USP Динатрію едетат USP Поліетиленгліколь USP Приклад 2* Феноксіетанол ВР Усього *1,32 % Прикладу 2 еквівалентний 1,0 % (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Hпіразол-1-іл)-3-циклопентилпропаннітрилу нейтральної основи 15 UA 111588 C2 Таблиця 3 Інгредієнт Кілограми (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-32,64 (сіль циклопентилпропаннітрилова сіль фосфорної кислоти фосфату) / (Приклад 2) 2,0 (нейтральна основа) Пропіленгліколь USP 40,0 Метилпарабен NF 0,4 Пропілпарабен NF 0,2 Пропіленгліколь USP 20,0 Ксантанова камедь NF 1,6 Легке мінеральне масло NF 16,0 Гліцерилстеарат SE 12,0 Полісорбат 20 NF 5,0 Білий парафін USP 28,0 Цетиловий спирт NF 12,0 Стеариловий спирт NF 7,0 Диметикон 360 NF 4,0 Тригліцерид з ланцюгом середньої довжини NF 20,0 Очищена вода USP (приблизна кількість) 201 Динатрію едетат USP 0,2 Поліетиленгліколь USP 28,0 Феноксіетанол ВР 2,0 Усього (приблизно) 400,0 Відсоткова кількість (мас./мас.) 0,66 (фосфат) / 0,5 (нейтральна основа) 10,00 0,10 0,05 5,00 0,40 4,00 3,00 1,25 7,00 3,00 1,75 1,00 5,00 50,25 0,05 7,00 0,5 100 Таблиця 4 Відсоткова кількість (мас./мас.) (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3- 5,28 (фосфат) / 1,32 (фосфат) / циклопентилпропаннітрилова сіль фосфорної кислоти 4,0 (нейтральна 1,00 (нейтральна (Приклад 2) основа) основа) Пропіленгліколь USP 40,0 10,00 Метилпарабен NF 0,4 0,10 Пропілпарабен NF 0,2 0,05 Пропіленгліколь USP 20,0 5,00 Ксантанова камедь NF 1,6 0,40 Легке мінеральне масло NF 16,0 4,00 Гліцерилстеарат SE 12,0 3,00 Полісорбат 20 NF 5,0 1,25 Білий парафін USP 28,0 7,00 Цетиловий спирт NF 12,0 3,00 Стеариловий спирт NF 7,0 1,75 Диметикон 360 NF 4,0 1,00 Тригліцерид з ланцюгом середньої довжини NF 20,0 5,00 Очищена вода USP (приблизна кількість) 198,5 49,6 Динатрію едетат USP 0,2 0,05 Поліетиленгліколь USP 28,0 7,00 Феноксіетанол ВР 2,0 0,5 Усього (приблизно) 400,0 100 Інгредієнт Кілограми 16 UA 111588 C2 Таблиця 5 Інгредієнт Кілограми (R)-3-(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3- 7,92 (фосфат) / циклопентилпропаннітрилова сіль фосфорної кислоти 6,0 (нейтральна (Приклад 2) основа) Пропіленгліколь USP 40,0 Метилпарабен NF 0,4 Пропілпарабен NF 0,2 Пропіленгліколь USP 20,0 Ксантанова камедь NF 1,6 Легке мінеральне масло NF 16,0 Гліцерилстеарат SE 12,0 Полісорбат 20 NF 5,0 Білий парафін USP 28,0 Цетиловий спирт NF 12,0 Стеариловий спирт NF 7,0 Диметикон 360 NF 4,0 Тригліцерид з ланцюгом середньої довжини NF 20,0 Очищена вода USP (приблизна кількість) 195,5 Динатрію едетат USP 0,2 Поліетиленгліколь USP 28,0 Феноксіетанол ВР 2,0 Усього (приблизний) 400,0 5 10 15 20 25 30 Відсоткова кількість (мас./мас.) 1,98 (фосфат) / 1,5 (нейтральна основа) 10,00 0,10 0,05 5,00 0,40 4,00 3,00 1,25 7,00 3,00 1,75 1,00 5,00 48,9 0,05 7,00 0,5 100 Композиції крему масло-у-воді були синтезовані відповідно до нижчеподаної процедури у масштабі 3,5 кг або 400 кг (при партії розміром 3,5 кг кількості з Таблиць 3-5 були відповідним чином помножені). Деякі партії були піддані незначним змінам, пов'язаним зі збільшенням масштабу, наприклад, змінений розмір посудин і міксерів для змішування. Як правило, для процесу підходить заглибний міксер і лопати з низькою швидкістю перемішування. На Фігурі 1 представлена схема процесу одержання композиції емульсії масла-у-воді. У даній схемі (R)-3(4-(7H-піроло[2,3-d]піримідин-4-іл)-1Н-піразол-1-іл)-3-циклопентилпропаннітрил позначається як "АФІ". Процедура 1. Фаза парабену була приготовлена шляхом змішування метилових і пропілових парабенів із частиною пропіленгліколю (див. % у Таблицях 2-5). 2. Потім фаза ксантанової камеді була приготовлена шляхом змішування ксантанової камеді із пропіленгліколем (див. % у Таблицях 2-5). 3. Масляна фаза була приготовлена шляхом змішування легкого мінерального масла, гліцерилстеарату, полісорбату 20, білого парафіну, цетилового спирту, стеарилового спирту, диметикону й тригліцеридів з ланцюгом середньої довжини. Фаза була нагріта до 70-80 °C для розплавлювання й утворення однорідної суміші. 4. Водна фаза була потім отримана шляхом змішування очищеної води, поліетиленгліколю й динатрію ЕДТА. Фаза була нагріта до 70-80 °C. 5. Водна фаза з етапу 4, фаза парабену з етапу 1 і Приклад 2 (фосфорна сіль АФІ) були скомбіновані з утворенням суміші. 6. Фаза ксантанової камеді з етапу 2 була додана до суміші з етапу 5. 7. Масляна фаза з етапу 3 була потім скомбінована при швидкому перемішуванні із сумішшю з етапу 6 для утворення емульсії. 8. Потім до емульсії з етапу 7 був доданий феноксіетанол. Перемішування було продовжено, і потім продукт був охолоджений при повільному перемішуванні. Шляхом додавання речовини із Прикладу 2 покроково до водної фази з наступною комбінацією з іншими фазами можуть бути отримані додаткові партії при більшому масштабі (наприклад, 140 кг). Подібним чином такі партії можуть бути отримані шляхом більш повільного охолодження (наприклад, з використанням води кімнатної температури у зовнішньому кожусі реактора на відміну від використання води зниженої температури). 17 UA 111588 C2 5 10 Результати аналізу композицій крему і дослідження стабільності A. Способи Візуально був перевірений зовнішній вигляд крему. В'язкість була виміряна з використанням віскозиметра Брукфілда при 25ºC. рН був виміряний у фінальній композиції крему. Дослідження бактеріального вмісту було проведено відповідно до Фармакопеї США. Вага наповнення була проаналізована під час тесту в процесі виробництва під час наповнення крему в туби. Аналіз, визначення споріднених сполук, ідентичність і однорідність змісту визначалися в композиції з використанням градієнтної ВЕРХ з оберненими фазами з УФ визначенням при 294 нм. Вода ВЕРХ використовувалася зі колонкою Zorbax SB-C18 (3,5 мкм, 4,6 × 150 мм) при швидкості потоку 1,0 мл/хвилину, температурі 40 °C з використанням рухливої фази A з 2 мл ТФК в 4 л води (0,05 % ТФК) або рухливої фази B з 2 мл ТФК в 4 л метанолу (0,05 % ТФК). B. Результати Результати представлені нижче для 3,5 кг партій при концентрації 0,5 %, 1 % і 1,5 % речовини із Прикладу 2 (нейтральна основа (АФІ)) (Таблиця 6). 15 Таблиця 6 Концентрація 0,5 % 1,0 % мас./мас. мас./мас. Відповідає Відповідає Тест Критерій прийняття Плацебо Зовнішній вигляд Однорідна емульсія білого кольору Результати звіту Результати звіту 90,0-110,0 % Відповідає 6,5 96500 Н/З 3,6 66500 100,0 3,3 64800 102,0 3,1 72900 102,0 АФІ споріднені речовини Результати звіту НВ* НВ* НВ* НВ* Тест однорідності вмісту 90-110 % ОСО:≤5 % 101 101 101 102 102 102 102 0,5 101 101 102 103 103 102 102 0,8 pH В'язкість Аналіз АФІ (%) Верх Н/З Н/З Середн. ОСО% 25 Середн. Низ 20 Н/З Н/З 100 100 100 100 100 100 100 0,0 1,5 % мас./мас. Відповідає Дані стабільності з партій композиції крему в концентрації 0,5, 1,0 і 1,5 % мас./мас., піддані зберіганню в 15 г алюмінієвих тубах, представлені в Таблицях 7-10 і 19-20. Крім того, дані стабільності з партій композиції крему в концентраціях 0,5, 1,0 і 1,5 % мас./мас., упакованої у флакони з бурштинового скла (2 унц. з тефлоновою пробкою), представлені в Таблицях 13-17, у той час як дані більшої стабільності для 1,0 % мас./мас. композиції, упакованої в 16 унц. флакон з бурштинового скла, представлені в Таблицях 11-12. Попередні дані стабільності для лікарського продукту не виявили якої-небудь хімічної нестабільності через 3 місяці зберігання при температурі 25 °C/60 % ВВ і 40 °C/75 % ВВ у будь-якій упаковці. Зміни у в'язкості відзначалися через 3 місяці при зберіганні при 40 °C/75 % ВВ для композицій, що зберігаються у флаконах з бурштинового скла. Однак, фізичний огляд продукту не виявив якого-небудь поділу фаз. Критерії прийняття представлені нижче. 18 UA 111588 C2 Тест Критерій прийняття Зовнішній вигляд Однорідний крем білого кольору pH Втрата ваги В'язкість (сПз) Результати звіту Результати звіту Результати звіту Аналіз АФІ (%) 90,0-110,0 % кількості, заявленої на етикетці Результати звіту АФІ споріднені речовини (ОВУ:площа %) Загальна кількість споріднених (ОВУ:площа %) MLT (неприйнятні мікроорганізми) MLT (P.Aeruginosa) речовин Результати звіту Відсутні/1 г Відсутні/1 г Відсутні/1 г MLT (S.Aureus) MLT (загальна кількість всіх аеробів) NMT 100 КОЕ/г MLT (загальна кількість дріжджів і плісняви) NMT 10 КОЕ/г Таблиця 7: Дані стабільності для 0,5 % мас./мас. крему при 25 °C/60 % ВВ (15 г алюмінієві туби) Тест 0 Відповідає Зовнішній вигляд Час (місяці) 1 3 Відповідає Відповідає 6 Відповідає pH Втрата ваги В'язкість (сПз) 3,6 НЗ 23400 3,6 НЗ 29900 3,6 0,0 25400 3,6 0,0 24900 Аналіз АФІ (%) 103,7 107,2 102,5 105,9 АФІ споріднені речовини (ОВУ:площа %) НВ НВ 1,09:0,15 1,18:0,19 НВ Загальна кількість споріднених речовин (ОВУ:площа %) MLT (неприйнятні мікроорганізми) MLT (P.Aeruginosa) НЗ НЗ 0,34 НЗ Відсутні/1 г Відсутні/1 г Відсутні/1 г
ДивитисяДодаткова інформація
Назва патенту англійськоюTopical formulation for a jak inhibitor
Автори англійськоюParikh, Bhavnish, Shah, Bhavesh, Yeleswaram, Krishnaswamy
Автори російськоюПарих Бхавниш, Шах Бхавеш, Элесварам Кришнасвами
МПК / Мітки
МПК: A61K 9/107, A61K 31/519, A61K 9/00, A61P 17/00, A61K 47/10
Мітки: композиція, інгібітора, місцевого, застосування
Код посилання
<a href="https://ua.patents.su/41-111588-kompoziciya-ingibitora-jak-dlya-miscevogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Композиція інгібітора jak для місцевого застосування</a>
Попередній патент: Сполуки для лікування захворювань, пов’язаних з амілоїдними або амілоїдоподібними білками
Наступний патент: Кристалічна форма похідної тієнопіримідину (варіанти)
Випадковий патент: П'єзорезистивний датчик