Похідні оксііндолу як агоністи 5-нт4 рецептора
Формула / Реферат
1. Сполука формули (І):
 , (I)
, (I)
де:
А являє собою С1-С4алкіленову групу; вказана алкіленова група є незаміщеною або заміщеною 1-4 замісниками, що незалежно вибираються з групи, що складається з С1-С4алкільної групи, гідроксизаміщеної С1-С4алкільною групою і С1-С2алкоксизаміщеної С1-С4алкільною групою, де 2 з вказаних замісників можуть необов'язково утворювати місточковий зв'язок, з отриманням 3-6-членного кільця, що є незаміщеним або заміщеним гідроксигрупою або карбоксигрупою;
R1 являє собою атом водню, атом галогену або С1-С4алкільну групу;
R2 і R3, незалежно, являють собою метильну або етильну групу; або R2 і R3 можуть разом утворювати С2-С4алкіленовий місточковий зв'язок, утворюючи 3-5-членне кільце;
R4 являє собою атом водню, атом галогену або гідроксигрупу; і
R5 являє собою гідроксигрупу, карбоксигрупу, тетразолільну групу, (5-оксо-1,2,4-оксадіазол-3-іл)групу або (5-оксо-1,2,4-тіадіазол-3-іл)групу;
або її фармацевтично прийнятна сіль.
2. Сполука або фармацевтично прийнятна сіль за п. 1, де А являє собою С1-С2алкіленову групу, вказана алкіленова група є незаміщеною або заміщеною 1-4 замісниками, що незалежно вибираються з групи, що складається з С1-С4алкільної групи, гідроксизаміщеної С1-С4алкільною групою і С1-С2алкоксизаміщеної С1-С4алкільною групою, де 2 з вказаних замісників можуть необов'язково утворювати місточковий зв'язок, утворюючи 3-6-членне кільце;
R1 являє собою атом водню, атом галогену або С1-С4алкільну групу;
R2 і R3 являють собою метильну групу, або R2 і R3 можуть разом утворювати тетраметиленовий місточковий зв'язок, з отриманням 5-членного кільця;
R4 являє собою атом водню, атом галогену або гідроксигрупу; і
R5 являє собою гідроксигрупу, карбоксигрупу, тетразолільну групу, (5-оксо-1,2,4-оксадіазол-3-іл)групу або (5-оксо-1,2,4-тіадіазол-3-іл)групу.
3. Сполука або фармацевтично прийнятна сіль за п. 2, де А являє собою С1-С2алкіленову групу, вказана алкіленова група є незаміщеною або заміщеною 1-2 замісниками, що незалежно вибираються з групи, яка складається з С1-С4алкільної групи, гідроксизаміщеної С1-С4алкільної групи і С1-С2алкоксизаміщеної С1-С4алкільної групи, де 2 з вказаних замісників можуть необов'язково утворювати місточковий зв'язок, утворюючи 3-6-членне кільце;
R1 являє собою атом водню або атом галогену;
R2 і R3 являють собою метильну групу, або R2 і R3 можуть разом утворювати тетраметиленовий місточковий зв'язок з отриманням 5-членного кільця;
R4 являє собою атом водню; і
R5 являє собою карбоксигрупу, тетразолільну групу, (5-оксо-1,2,4-оксадіазол-3-іл)групу або (5-оксо-1,2,4-тіадіазол-3-іл)групу.
4. Сполука або фармацевтично прийнятна сіль за п. 3, де А являє собою С1-С2алкіленову групу, вказана алкіленова група є незаміщеною або заміщеною 2 замісниками, що незалежно вибираються з групи, яка складається з С1-С4алкільної групи і гідроксизаміщеної С1-С4алкільної групи, де 2 з вказаних замісників необов'язково можуть утворювати місточковий зв'язок з отриманням 3-6-членного кільця;
R1 являє собою атом водню або атом фтору;
R2 і R3 являють собою метильну групу, або R2 і R3 можуть разом утворювати тетраметиленовий місточковий зв'язок з отриманням 5-членного кільця;
R4 являє собою атом водню; і
R5 являє собою карбоксигрупу або тетразолільну групу.
5. Сполука або фармацевтично прийнятна сіль за п. 4,
де А являє собою:
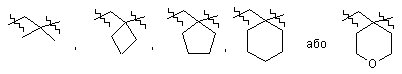 ;
;
R1 являє собою атом водню або атом фтору;
R2 і R3 являють собою метильну групу;
R4 являє собою атом водню; і
R5 являє собою карбоксигрупу або тетразолільну групу.
6. Сполука за п. 1, яку вибирають з:
1-{[4-({[(3,3-диметил-2-оксо-2,3-дигідро-1Н-індол-1-іл)карбоніл]аміно}метил)піперидин-1-іл]метил}циклобутанкарбонової кислоти;
1-{[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигідро-1Н-індол-1-іл)карбоніл]аміно}метил)-піперидин-1-іл]метил}циклобутанкарбонової кислоти;
3-[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигідро-1Н-індол-1-іл)карбоніл]аміно}метил)-піперидин-1-іл]-2,2-диметилпропанової кислоти
і їх фармацевтично прийнятних солей.
7. Фармацевтична композиція, що містить сполуку або фармацевтично прийнятну сіль за будь-яким з пп. 1-6 разом з фармацевтично прийнятним наповнювачем.
8. Сполука або фармацевтично прийнятна сіль за будь-яким з пп. 1-6 для застосування як лікарський засіб.
9. Застосування сполуки або фармацевтично прийнятної солі за будь-яким з пп. 1-6 для отримання лікарського засобу для лікування хвороб, для яких показаний агоніст 5-НТ4.
10. Застосування сполуки або фармацевтично прийнятної солі за будь-яким з пп. 1-6 для отримання лікарського засобу для лікування рефлюксної гастроезофагеальної хвороби, шлунково-кишкового захворювання, розладу рухової функції шлунка, невиразкової диспепсії, функціональної диспепсії, синдрому подразненої товстої кишки (IBS), констипації, диспепсії, езофагіту, гастроезофагеральної хвороби, нудоти, захворювання центральної нервової системи, хвороби Альцгеймера, розладу пізнавальної здатності, блювання, мігрені, неврологічного захворювання, болю, серцево-судинних розладів, серцевої недостатності, серцевої аритмії, цукрового діабету або синдрому ядухи.
11. Спосіб лікування ссавців, включаючи людину, що мають захворювання, для якого показаний агоніст 5-НТ4, що включає лікування вказаних ссавців ефективною кількістю сполуки або фармацевтично прийнятної солі за будь-яким з пп. 1-6.
12. Спосіб лікування ссавців, включаючи людину, що мають рефлексну гастроезофагеальну хворобу, шлунково-кишкове захворювання, розлад рухової функції шлунка, невиразкову диспепсію, функціональну диспепсію, синдром подразненої товстої кишки (IBS), констипацію, диспепсію, езофагіт, гастроезофагеральну хворобу, нудоту, захворювання центральної нервової системи, хворобу Альцгеймера, розлад пізнавальної здатності, блювання, мігрень, неврологічне захворювання, біль, серцево-судинні розлади, серцеву недостатність, серцеву аритмію, цукровий діабет або синдром задухи, що включає лікування вказаних ссавців ефективною кількістю сполуки або фармацевтично прийнятної солі за будь-яким з пп. 1-6.
Текст
1. Сполука формули (І): C2 2 (19) 1 3 86301 4 4. Сполука або фармацевтично прийнятна сіль за 8. Сполука або фармацевтично прийнятна сіль за п. 3, де А являє собою С1-С2алкіленову групу, вкабудь-яким з пп. 1-6 для застосування як лікарський зана алкіленова група є незаміщеною або заміщезасіб. ною 2 замісниками, що незалежно вибираються з 9. Застосування сполуки або фармацевтично пригрупи, яка складається з С1-С4алкільної групи і йнятної солі за будь-яким з пп. 1-6 для отримання гідроксизаміщеної С1-С4алкільної групи, де 2 з вкалікарського засобу для лікування хвороб, для яких заних замісників необов'язково можуть утворювати показаний агоніст 5-НТ4. місточковий зв'язок з отриманням 3-6-членного 10. Застосування сполуки або фармацевтично кільця; прийнятної солі за будь-яким з пп. 1-6 для отриR1 являє собою атом водню або атом фтору; мання лікарського засобу для лікування рефлюксR2 і R3 являють собою метильну групу, або R2 і R3 ної гастроезофагеальної хвороби, шлунковоможуть разом утворювати тетраметиленовий міскишкового захворювання, розладу рухової функції точковий зв'язок з отриманням 5-членного кільця; шлунка, невиразкової диспепсії, функціональної R4 являє собою атом водню; і диспепсії, синдрому подразненої товстої кишки R5 являє собою карбоксигрупу або тетразолільну (IBS), констипації, диспепсії, езофагіту, гастроезогрупу. фагеральної хвороби, нудоти, захворювання 5. Сполука або фармацевтично прийнятна сіль за центральної нервової системи, хвороби Альцгейп. 4, мера, розладу пізнавальної здатності, блювання, де А являє собою: мігрені, неврологічного захворювання, болю, серцево-судинних розладів, серцевої недостатності, серцевої аритмії, цукрового діабету або синдрому , , або , ядухи. O 11. Спосіб лікування ссавців, включаючи людину, ; що мають захворювання, для якого показаний агоR1 являє собою атом водню або атом фтору; ніст 5-НТ4, що включає лікування вказаних ссавців R2 і R3 являють собою метильну групу; ефективною кількістю сполуки або фармацевтично R4 являє собою атом водню; і прийнятної солі за будь-яким з пп. 1-6. R5 являє собою карбоксигрупу або тетразолільну 12. Спосіб лікування ссавців, включаючи людину, групу. що мають рефлексну гастроезофагеальну хворо6. Сполука за п. 1, яку вибирають з: бу, шлунково-кишкове захворювання, розлад ру1-{[4-({[(3,3-диметил-2-оксо-2,3-дигідро-1Н-індол-1хової функції шлунка, невиразкову диспепсію, фуіл)карбоніл]аміно}метил)піперидин-1нкціональну диспепсію, синдром подразненої іл]метил}циклобутанкарбонової кислоти; товстої кишки (IBS), констипацію, диспепсію, езо1-{[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигідро-1Нфагіт, гастроезофагеральну хворобу, нудоту, заіндол-1-іл)карбоніл]аміно}метил)-піперидин-1хворювання центральної нервової системи, хвоіл]метил}циклобутанкарбонової кислоти; робу Альцгеймера, розлад пізнавальної здатності, 3-[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигідро-1Нблювання, мігрень, неврологічне захворювання, індол-1-іл)карбоніл]аміно}метил)-піперидин-1-іл]біль, серцево-судинні розлади, серцеву недостат2,2-диметилпропанової кислоти ність, серцеву аритмію, цукровий діабет або синді їх фармацевтично прийнятних солей. ром задухи, що включає лікування вказаних ссав7. Фармацевтична композиція, що містить сполуку ців ефективною кількістю сполуки або або фармацевтично прийнятну сіль за будь-яким з фармацевтично прийнятної солі за будь-яким з пп. пп. 1-6 разом з фармацевтично прийнятним напо1-6. внювачем. Даний винахід стосується похідних оксііндолу. Дані сполуки мають селективну агоністичну активність по відношенню до 5-НТ4 рецептора. Даний винахід також стосується фармацевтичної композиції, способу лікування і застосування, включаючи вказані вище похідні, для лікування хворобливих станів, опосередкованих активністю 5-НТ4 рецептора; зокрема, агоністичної активності по відношенню до 5-НТ4 рецептора. Взагалі кажучи, виявлено, що агоністи 5-НТ4 рецептора виявляються застосовними для лікування безлічі хвороб, таких як рефлюксна гастроезофагеальна хвороба, шлунково-кишкове захворювання, розлад рухової функції шлунка, невиразкова диспепсія, функціональна диспепсія, синдром подразненої говстої кишки (IBS), констипація, диспепсія, езофагіт, гастроезофагеальна хвороба, нудота, захворювання центральної нервової системи, хвороба Альцгеймера, розлад пізнавальної здатності, блювота, мігрень, неврологічне захворювання, біль, серцево-судинні розлади, серцева недостатність, серцева аритмія, цукровий діабет і синдром задухи [див. TiPs, 1992, 13, 141; Ford A. Ρ D. W. et al., Med. Res. Rev., 1993, 13, 633; Gullikson G. W. et al., Drug Dev. Res., 1992, 26, 405: Richard M. Eglen et al, TiPS, 1995, 16, 391; Bockaert J. Et al., CNS Drugs, 1. 6; Romanelli M. N. et al., Arzheim Forsch./Drug Res., 1993, 43, 913; Kaumann A. et al., Naunyn-Schmiedeberg's. 1991, 344, 150; і Romanelli M. N. et al.. Arzheim Forsch./Drug Res., 1993, 43, 913]. В US 5399562A описують сполуки індолону як агоністи або антагоністи 5-НТ4 і/або антагоністи 5FIT3. Головним чином, сполуки, що представляються нижченаведеною формулою, описані як приклад 5: 5 86301 6 щеної C1-C4 алкільної групи і С1-С2 алкоксизаміщеної С1-С4 алкільної групи, де 2 з вказаних замісників можуть необов'язково утворювати місточковий зв'язок з отриманням 3-6-членного кільця, яке є незаміщеним або заміщеним гідроксигрупою або карбоксигрупою; R1 представляє атом водню, атом галогену або С1-С4 алкільну групу; R2 і R3 незалежно представляють метильну Існує необхідність в отриманні нових агоністів або етильну групу, або R2 і R3 можуть разом утво5-НТ4, які розглядають як передбачувані лікарські рювати С2-С4 алкіленовий місточковий зв'язок з засоби високої якості. Зокрема, переважні сполуки отриманням 3-5-членного кільця, повинні міцно зв'язуватися з 5-НТ4 рецептором, R4 представляє атом водню, атом галогену виявляючи при цьому низький афінітет по відноабо гідроксигрупу; і шенню до інших рецепторів, і виявляти функціонаR5 представляє гідроксигрупу, карбоксигрупу, льну активність як агоністи. Вони повинні добре тетразолільну групу, (5-оксо-1,2,4-оксадіазол-3адсорбуватися з шлунково-кишкового тракту, бути іл)групу або (5-оксо-1,2,4-тіадіазол-3-іл)групу. метаболічно стійкими і мати сприятливі фармакоКрім того, даний винахід пропонує застосуванкінетичні властивості. Коли мішенню є рецептори ня сполуки формули (І) або її фармацевтично прицентральної нервової системи, вони повинні вільйнятної солі, з яких кожна сполука описана в цьоно перетинати гематоенцефалічний бар'єр, а коли му документі, для отримання лікарського засобу мішенню, що селективно вибирається, с рецептодля лікування стану, опосередкованого модулююри периферичної нервової системи, вони не почою активністю 5-НТ4; зокрема, агоністичною активинні перетинати гематоенцефалічний бар'єр. вністю до 5-НТ4. Вони повинні бути нетоксичними і мати мало Переважно, що даний винахід також пропонує побічних ефектів. Більш того, ідеальний застосування сполуки формули (І) або її фармацепередбачуваний лікарський засіб буде втично прийнятної солі, кожна з яких описана в знаходитися в такій фізичній формі, яка є стійкою, цьому документі, для отримання лікарського засонегігроскопічною і легко утворює суміші. бу для лікування хвороб, що вибираються з 5-НТ4 У даному винаході, було виявлено, що заміна хвороб. хінуклідинового циклу піперидиновим циклом знаКрім того, даний винахід пропонує фармацевчно підвищує агоністичну активність по відношентичну композицію, що містить сполуку формули (І) ню до 5-НТ4. або її фармацевтично прийнятну сіль, кожна з яких Тому, як було із здивуванням виявлено, сполуописана в цьому документі, разом з фармацевтички по винаходу, якшо порівнювати з попереднім но прийнятним носієм вказаної сполуки. рівнем техніки, мають більш високу селективну Крім того, даний винахід пропонує фармацевагоністичну активність по відношенню до 5-НТ4. І, тичну композицію, що містить сполуку формули (І) таким чином, вони є застосовними при лікуванні або її фармацевтично прийнятну сіль, кожна з яких хворобливих станів, опосередкованих 5-НТ4 активописана в цьому документі, разом з фармацевтичністю, таких як рефлюксна гастроезофагеальна но прийнятним носієм вказаної сполуки і ще одним хвороба, шлунково-кишкове захворювання, розлад фармакологічно активним агентом. рухової функції шлунка, невиразкова диспепсія, Додатково. даний винахід пропонує спосіб ліфункціональна диспепсія, синдром подразненої кування стану, опосередкованого модулюючою товстої кишки (IBS), констатація, диспепсія, езофаактивністю 5-НТ4, у ссавців, який включає введенгіт, гастроезофагеальна хвороба, нудота, захвоня ссавцеві, що потребує такого лікування, терарювання центральної нервової системи, хвороба певтично ефективної кількості сполуки формули (І) Альцгеймера, розлад пізнавальної здатності, блюабо її фармацевтично прийнятної солі, кожна з вота, мігрень, неврологічне захворювання, біль, яких описана в цьому документі. серцево-судинні розлади, серцева недостатність, Приклади станів, опосередкованих модулююсерцева аритмія, цукровий діабет і синдром задучою активністю 5-НТ4, включають, крім інших, 5хи (надалі ці захворювання позначають як «5-НТ4 НТ4 хвороби. хвороби»). Сполуки за даним винаходом можуть демонДаний винахід пропонує сполуку нижченавеструвати меншу токсичність, хорошу всмоктуваденої формули (І): ність, розподіл в організмі, хорошу розчинність, меншу здатність до зв'язування білка, що відрізняється від кислотного насоса, меншу взаємодію з іншими лікарськими засобами, і задовільну метаболічну стійкість. У сполуках по даному винаходу: де А являє собою С1-С4 алкіленову групу. Дана С1-С4 алкіленова група може бути групою з або її фармацевтично прийнятну сіль, в якій: прямим ланцюгом, що має від одного до чотирьох А представляє С1-С4 алкіленову групу, вказана атомів вуглецю, де приклади включають, крім іналкіленова група є незампценою або заміщеною 1ших, метилен, етилен, триметилен і тетраметилен. 4 замісниками, незалежно вибираними з групи, що Переважними з них є метилен або етилен; етилен складається з С1-С4 алкільної групи, гідроксизаміє більш переважним. 7 86301 8 до якого застосовний цей термін, або одного або Там. де R2 і R3 утворюють С2-С4 алкіленовий декількох симптомів такої о розладу або стану. місточковий зв'язок з отриманням 3-5-членного Переважними сполуками за даним винаходом кільця, це 3-5-членне кільце може являти собою є такі сполуки формули (І) або фармацевтично циклоалкільну групу, що має від трьох до п'яти прийнятної їх солі, кожна з яких описана тут, де: атомів вуглецю, де приклади включають, крім ін(А) А являє собою С1-С2 алкіленову групу. ших, циклопропіл, циклобутил і циклопентил. ПеВказана алкіленова група є незаміщеною або зареважним з них є циклопентил. міщеною 1-4 замісниками, що незалежно вибираТам. де R1 і R4 являють собою атом галогену, ються з групи, що складається з С1-С4 алкільної що є атомом фтору, хлору, брому або йоду. Перегрупи, гідроксизаміщеної С1-С4 алкільної групи і С1важними з них є атом фтору і атом хлору. Більш С2алкоксизаміщеної С1-С4 алкільної групи, де 2 з переважним є атом фтору. вказаних замісників можуть необов'язково утворюТам, де R1 і замісник А являють собою С1-С4 вати місточковий зв'язок з отриманням 3-6алкільну групу, ця С1-С4 алкільна група може бути членного кільця R1 предсгавляс атом водню, атом групою з прямим або розгалуженим ланцюгом, що галогену або С1-С4 алкільну групу; R2 і R3 являють має від одного до чотирьох атомів вуглецю, де собою метильну групу, або R2 і R3 можуть разом приклади включають, крім інших. метил, етил, утворювати тетраметиленовий місточковий зв'язок пропіл, ізопропіл, бутил, ізобутил, втор-бутил і з отриманням 5-членного кільця; R4 представляє трет-бутил Переважними з них є метил або етил; 1 атом водню, атом галогену або гідроксигрупу; a R5 більш переважним для R є метил. Там, де замісник А є гідроксизаміщеною С1-С4 представляє гідроксигрупу. карбоксигрупу, тетраалкільною групою, він являє собою вказану С1-С4 золільну групу, (5-оксо-1,2,4-оксадіазол-3-іл)групу алкільну групу, заміщену гідрокси, де приклади або (5-оксо-1,2,4-тіадіазол-3-іл)групу. включають, крім інших, гідроксиметил. 2(B) А являє собою С1-С2 алкіленову групу. гідроксіетил. 1-гідроксіетил. 3-гідроксипропіл, 2Вказана алкіленова група є незаміщеною або загідроксипропіл, 2-гідрокси-1-метилетил, 4міщеною і або 2 замісниками, що незалежно вибигідроксибутил, 3-гідроксибутил, 2-гідроксибутил, 3раються з групи, що складається з С1-С4 алкільної гідрокси-2-метилпропіл і 3-гідрокси-1-метилпропіл. групи, пдроксизаміщеної С1-С4 алкільної групи і С1Переважними з них с гідроксіалкільні групи, що С2алкоксизаміщеної С1-С4 алкільної групи, де 2 з мають від 1 до 3 атомів вуглецю, більш переважвказаних замісників можуть необов'язково утворюними є гідроксиметил, 2-гідроксіетил, і 2вати місточковий зв'язок з отриманням 3-6гідроксипропіл. членного кільця. R1 являє собою атом водню або Там, де замісник А є С1-С2 алкоксизаміщеною атом галогену; R2 і R3 являють собою метильну С1-С4 алкільною групою, він являє собою вказану групу, або R2 і R3 можуть разом утворювати тетС1-С4 алкільну групу, метокси- або етоксизаміщераметиленовий місточковий зв'язок з отриманням ну, де приклади включають, крім інших, метокси5-членного кільця; R4 є атомом водню: a R5 являє метил, етоксиметил, 2-метоксіетил, 2-етоксіетил, собою карбоксигрупу, тетразолільну групу, (5-оксо1-метоксіетил, 3-метоксипропіл, 3-етоксипропіл, 21,2,4-оксадіазол-3-іл)групу або (5-оксо-1,2,4метоксипропіл, 2-метокси-1-метилетил, 4тіадіазол-3-іл)групу; метоксибутил, 4-етоксибутил, 3-метоксибутил, 2(C) А являє собою С1-С2 алкіленову групу. метоксибутил, 3-метокси-2-метилпропіл і 3Вказана алкіленова група є незаміщеною або заметокси-1-метилпропіл. Переважними з них є, алміщеною 2 замісниками, що незалежно вибиракілоксіалкільні групи, що мають від 2 до 4 атомів ються з групи, що складається з С1-С4 алкільної вуглецю; більш переважними є метоксиметил, 2групи, гідроксизаміщеної C1-C4 алкільної групи і С1метоксіетил і 3-метоксипропіл. С2 алкоксизаміщеної С1-С4 алкільної групи, де 2 з Там, де 2 із замісників А утворюють місточковказаних замісників можуть необов'язково утворювий зв'язок з отриманням 3-6-членного кільця, де вати місточковий зв'язок з отриманням 3-6кільце може являти собою циклоалкільну або гечленного кільця. R1 являє собою атом водню або тероциклільну групу, де приклади включають цикатом φ гору. R2 і R3 являють собою метильну грулопропіл, циклопентил, пиклобутил, циклогексил, пу, або R2 і R3 можуть разом утворювати тетрамеметилциклопропіл, етилциклопропіл, метилциклотиленовий місточковий зв'язок з отриманням 5бутил, метилциклопентил, метилциклогексил, етичленного кільця. R4 є атомом водню; a R5 являє лциклогексил, гідроксициклопропіл, гідроксициксобою карбоксигрупу або гетразолільну групу; лобутил, гідроксициклопентил, (D) А являє собою гідроксициклогексил, метоксициклопропіл, метоксициклобутил, метоксициклопентил, метоксициклогексил, тетрагідрофурил і тетрагідропіраніл, переважно, циклопропіл, циклобутил, циклопентил, циклогексил, метоксициклогексил і тетрагідR1 являє собою атом водню або атом фтору; 2 ропіраніл. і, найбільш переважно, циклобутил, циR і R3 являють собою метильну групу; R4 є атоклопентил, циклогексил і тетрагідропіраніл. мом водню; a R5 являє собою карбоксигрупу. тетТерміни "терапія" і "лікування", що використоразолільну групу. вуються тут, означають цілюще, паліативне і про(E) А являє собою С1-С2 алкіленову групу. філактичне лікування, що включає повернення до Вказана алкіленова група є незаміщеною або запопереднього стану, полегшення, пригнічення проміщеною 2 замісниками, що незалежно вибирагресу розладу або запобігання розладу або стану, ються з групи, що складається з С -С алкільної 1 2 групи і гідроксизаміщеної С1-С2 алкільної групи, де 9 86301 10 2 з вказаних замісників можуть необов'язково раметиленовий міс точковий зв'язок з отриманням утворювати місточковий зв'язок з отриманням 4-65-членного кільця; R4 є атомом водню, атомом членного кільця; R1 являє собою атом водню або фтору або гідроксигрупою, a R5 являють собою атом фтору; R2 і R3 являють собою метильну гругідроксигрупу, карбоксигрупу. тетразолільну групу, пу, або R2 і R3 можуть разом утворювати тетраме(5-оксо-1,2,4-оксадіазол-3-іл)групу або (5-оксотиленовий місточковий зв'язок з отриманням 51,2,4-тіадіазол-3-іл)групу; членного кільця; R4 є атомом водню; a R5 являє (J) А являє собою С1-С2 алкіленову групу. Вкасобою карбоксигрупу або тетразолільну групу; (F)A зана алкіленова група є незаміщеною або заміщеє ною 1 або 2 замісниками, що незалежно вибираються з групи, що складається з С1-С4 алкільної групи, гідроксизаміщеної С1-С4 алкільної групи і С1С2алкоксизаміщеної С1-С4 алкільної групи, де 2 з вказаних замісників можуть необов'язково утворювати місточковий зв'язок з отриманням 3-6членного кільця. R1 являє собою атом водню або атом галогену. R2 і R3 являють собою метильну R1 являє собою атом водню або атом фтору; 2 3 4 групу. R4 є атомом водню, a R5 являють собою R і R являють собою метильну групу; R є атокарбоксигрупу, тетразолільну групу, (5-оксо-1,2,4мом водню; a R5 являє собою карбоксигрупу або оксадіазол-3-іл)групу або (5-оксо-1,2.4-тіадіазол-3тетразолільну групу; іл)групу; (G) А являє собою С1-С4 алкіленову групу. (К) А являє собою С1-С2 алкіленову групу. ВкаВказана алкіленова група є незаміщеною або зазана алкіленова група є незаміщеною або заміщеміщеною 1-4 замісниками, що незалежно вибираною 2 замісниками, що незалежно вибираються з ються з групи, що складається з С1-С4 алкільної групи. що складається з С1-С4 алкільної групи і групи, гідроксизаміщеної С1-С4 алкільної групи і С1гідроксизаміщеної С1-С4 алкільної групи. де 2 з С2алкоксизаміщеної С1-С4 алкільної ірупи, де 2 з вказаних замісників можуть необов'язково утворювказаних замісників можуть необов'язково утворювати місточковий зв'язок з отриманням 3-6вати місточковий зв'язок з отриманням 3-6членного кільця. R1 є атомом водню, або атомом членного кільця, незаміщеного або заміщеного 1 фтору Кожний з R2 і R3 являє собою метильну гругідроксигрупою або карбоксигрупою. R являє сопу R4 є атомом водню, a R5 являють собою карбобою атом водню або атом фтору, або С1-С4 алкіксигрупу. тетразолільну групу. льну групу. R2 і R3 являють собою метильну групу; Переважними класами сполук за даним винаабо R2 і R3 можуть разом утворювати тетраметиходом є такі сполуки формули (І) або їх фармацеленовий місточковий зв'язок з отриманням 5втично прийнятної солі, описані тут. в яких: членного кільця. R4 є атомом водню, атомом гало5 (a) А являє собою С1-С2 алкіленову групу. Вкагену або гідроксигрупою, a R являють собою гідзана алкіленова група є незаміщеною або заміщероксигрупу, карбоксигрупу. тетразолільну група, ною 1-4 замісниками, що незалежно вибираються (5-оксо-1,2,4-оксадіазол-3-іл)групу або (5-оксоз групи, що складається з С1-С4 алкільної групи, 1,2.4-тіадіазол-3-іл)групу; гідроксизаміщеної С1-С4 алкільної групи і С1(Н) А являє собою С1-С2 алкіленову групу. С2алкоксизаміщеної С1-С4 алкільної групи, де 2 з Вказана алкіленова група є незаміщеною або завказаних замісників можуть необов’язково утворюміщеною 1-4 замісниками, що незалежно вибираювати місточковий зв'язок з отриманням 3-6іься з групи, що складається з С1-С4 алкільної гручленного кільця. R1 є атомом водню, атомом галопи, гідроксизаміщеної С1-С4 алкільної групи і С1гену або С1-С4 алкільною групою. С2алкоксизаміщеної С1-С4 алкільної групи, де 2 з (b) А являє собою С1-С2 алкіленову групу. Вкавказаних замісників можуть необов'язково утворюзана алкіленова група є незаміщеною або заміщевати містечковий зв'язок з отриманням 3-6ною 1-2 замісниками, що незалежно вибираються членного кільця. R1 являє собою атом водню або 2 3 з групи, що складається з С1-С4 алкільної групи, атом хлору. R і R являють собою метильну групу, гідроксизаміщеної С1-С4 алкільної групи і С1-С2 або R2 і R3 можуть разом утворювати тетраметиалкоксизаміщеної С1-С4 алкільної групи, де 2 з леновий місточковий зв'язок з отриманням 5вказаних замісників можуть необов'язково утворючленного кільця. R4 є атомом водню, атомом гало5 вати місточковий зв'язок з отриманням 3-6гену або гідроксигрупою, a R являють собою гідчленного кільця. роксигрупу, карбоксигрупу, тетразолільну групу, (5(c) А являє собою С1-С2 алкіленову групу. Вкаоксо-1,2,4-оксадіазол-3-іл)групу або (5-оксо-1,2,4зана алкіленова група є незаміщеною або заміщетіадіазол-3-іл)групу; ною 2 замісниками, що незалежно вибираються з (І) А являє собою С1-С2 алкіленову групу. Вкагрупи, що складається з С1-С4 алкільної групи і зана алкіленова група є незаміщеною або заміщегідроксизаміщеної С1-С4 алкільної групи, де 2 з ною 1-4 замісниками, що незалежно вибираються вказаних замісників можуть необов'язково утворюз групи, що складається з С1-С4 алкільної групи, вати місточковий зв'язок з отриманням 3-6гідроксизаміщеної С1-С4 алкільної групи і С1-С2 членного кільця. алкоксизаміщеної С1-С4 алкільної групи, де 2 з (d) А являє собою С1-С2 алкіленову групу. Вкавказаних замісників можуть необов'язково утворюзана алкіленова група є незаміщеною або заміщевати місточковий зв'язок з отриманням 3-6ною 2 замісниками, що незалежно вибираються з членного кільця. R1 являє собою атом водню або 2 3 групи, що складається з С1-С2 алкільної групи і атом галогену; R і R являють собою метильну гідроксизаміщеної С1-С2 алкільної групи. де 2 з групу, або R2 і R3 можуть разом утворювати тет 11 86301 12 вказаних замісників можуть необов'язково утворючленного кільця. R1 являє собою атом водню або вати місточковий зв'язок з отриманням 4-6атом фтору; (g) R1 являє собою атом водню або атом галогену; (h) R1 являє собою атом водню або атом фтору; (і) R2 і R3 являють собою метильну групу, або 2 R і R3 можуть разом утворювати тетраметиленовий містечковий зв'язок з отриманням 5-членного кільця; (j) R2 і R3 являють собою метильну групу; (k) R4 являє собою атом водню; (1) R5 являє собою карбоксигрупу, тетразолільну групу, (5-оксо-1,2,4-оксадіазол-3-іл)групу або (5-оксо-1,2,4-тіадіазол-3-іл)групу; (m) R5 являє собою карбоксигрупу або тетразолільну групу. З цих класів сполук будь-яка комбінація із сполук від (а) до (m) також є переважною. В одному варіанті здійснення винаходу пропонують сполуку, що вибирається з групи, що складається з: 1-{[4-({[(3,3-диметил-2-оксо-2,3-дигідро-1Hіндол-1-іл)карбоніл]аміно}метил)піперидин-1іл]метил}циклобутанкарбонової кислоти; 1-{[4-({[(6-фтор-3,3-диметил-2-оксо-2,3дигідро-1Н-індол-1іл)карбоніл]аміно}метил)піперидин-1іл]метил}циклобутанкарбонової кислоти; 3-[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-Дигідро1Н-індол-1-іл)карбоніл]аміно}метил)піперидин-1іл]-2,2-диметилпропанової кислоти; і їх фармацевтично прийнятна сіль. Фармацевтично прийнятні солі сполук формули (І) включають кислотно-адитивні солі і основноадитивні солі (включаючи бісолі). Придатні кислотно-адитивні солі утворюють з кислот, які дають нетоксичні солі. Приклади включають нижченаведені солі: ацетат, адипат, аспартат, бензоат, безилат, бікарбонат/карбонат, бісульфат/сульфат, борат, камсилат, цитрат, кольцамат, едисилат, езилат, форміат, фумарат, глюцептат, глюконат, глюкуронат, гексафторфосфат. гібензат, гідрохлорид/хлорид, гідробромід/бромід, гідройодид/йодид, ізетіонат, лактат, малат. малеат, малонат, мезилат, метилсульфат. нафтилат, 2-напсилат, нікотинат, нітрат, оротат, оксалат, пальмітат. памоат. фос фат/гідрофосфат/дигідрофосфат, піроглутамат, сахарат, стеарат, сукцинат, танат, тартрат, тозилат, трифторацетат і ксинофоат. Придатні основні солі утворюють з основ, які дають нетоксичні солі. Приклади включають себе солі алюмінію, аргініну, бензатину, кальцію, холіну, діетиламіну, дюламіну. гліцину, лізину, магнію, меглуміну, оламіну, калію, натрію, грометаміну і цинку. Огляд по придатних солях, можна знайти в "Handbook of Pharmaceutical Salts; Properties, Selection, and Use" Stahl and Wermuth (Wiley-VCH, Weinheim. Germany, 2002). Фармацевтично прийнятна сіль сполуки формули (І) може бути легко отримана змішуванням разом в належній кількості розчинів сполуки формули (І) і бажаної кислоти або основи. Сіль можна осаджувати з розчину і збирати фільтруванням; або можна отримати випарюванням розчинника. Ступінь іонізації солі може мінятися від повністю іонізованої, до неіонізованої. Сполуки по винаходу можуть знаходитися як в несольватованій, так і в сольватованій формах. Термін "сольват" використовують тут для опису молекулярного комплексу, що містить сполуку за винаходом і одну або декілька фармацевтично прийнятних молекул розчинника, наприклад, етанолу. Термін «гідрат» використовують, якщо вказаним розчинником є вода. Фармацевтично прийнятні сольвати, згідно з винаходом, включають гідрати і сольвати, в яких захоплений при кристалізації розчинник, може бути заміщений ізотопом, наприклад, D2O, d6aneTOH, d6-ДМСО. Включеними в об'єм винаходу є і такі комплекси, як клатрати-комплекси включення лікарський засіб-хазяїн, в яких, в протилежність згаданим вище сольватам, лікарський засіб і хазяїн присутні в стехіометричних або нестехюметричних кількостях. Також включеними в об'єм винаходу є комплекси лікарського засобу, що містить два або декілька органічних і/або неорганічних компонентів, які можуть бути в стехіометричних або нестехіометричних кількостях. Отримані комплекси можуть бути іонізованими, частково іонізованими або неіонізованими. Огляд по таких комплексах можна 13 86301 14 знайти в J Pharm Sci, 64 (8), 1269-1288 Haleblian або L-лізин, або рацемічні, наприклад, DL-тартрат (August 1975). або DL-аргінін. Надалі всі посилання на сполуку формули (І) Даний винахід включає всі фармацевтично включають посилання на її солі і комплекси і на прийнятні мічені ізотопами сполуки формули (І), де сольвати і комплекси її солей. один або декілька атомів замінені атомами, що Термін "сполука за винаходом" або "сполуки мають такий же атомний номер, але атомну масу за винаходом" означає, якщо не обумовлено інакабо масове число, яке відрізняється від атомної ше, сполуку формули (І), визначену вище, її полі маси або масового числа, що звичайно зустрічаморфи, пролікарські засоби і ізомери (включаючи ється в природі. оптичні, геометричні і таутомерні ізомери), визнаПриклади ізотопів, придатних для включення в чені далі, і мічені ізотопами сполуки формули (І). сполуки по винаходу включають ізотопи водню, Також в об'єм винаходу входять так звані такі як 2Н і 3Н; вуглецю, такі як 11С. 13С і 14С; хлору, «пролікарські засоби» сполук формули (І). Таким такі як 36Cl; фтору, такі як 18F, йоду, такі як 123І і 125І; чином, деякі похідні сполук формули (І), які самі по азоту, такі як 13N і 15N; кисню, такі як 15О, 17О і 18О; собі можуть мати незначну фармакологічну активфосфору, такі як 32Р, і сірки, такі як 35S. ність або зовсім не мати її, можуть при введенні Деякі мічені ізотопами сполуки формули (І), всередину або нанесенні на тіло самі перетворюнаприклад, сполуки, що включають радіоактивний ватися в сполуки формули (І), що мають необхідну ізотоп, застосовні при дослідженнях по розподілу в активність, наприклад, за допомогою гідролітичнолікарському засобі і/або в тканині субстрату. Раго розщеплення. Такі похідні позначають як "пролідіоактивні ізотопи тритію, тобто, 3Н, і вуглецю-14, карські засоби". Додаткову інформацію по викоритобто, 14С, є особливо використовуваними для цих станню пролікарських засобів можна знайти в цілей, в зв'язку з легкістю їх впровадження і наяв[«Pro-drugs as Novel Delivery Systems», Vol. 14, ністю способів їх виявлення. ACS Symposium Series (T Higuchi and W Stella) і Заміщення більш важкими ізотопами, такими «Bioreversible Carriers in Drug Design», Pergamon як дейтерій, тобто, 2Н, може дати деякі терапевтиPress, 1987 (ed. Ε Β Roche, American чні переваги внаслідок більшої метаболічної стійPharmaceutical Association)]. кості, наприклад, збільшений in vivo період напівПролікарські засоби за винаходом можуть, навиведення або знижені вимоги по дозуванню, і, приклад, бути отримані заміною відповідних притому може виявитися переважним в деяких обстасутніх в сполуках формули (І) функціональних груп винах. на певні частини, відомі фахівцям в даній галузі як Заміщення ізотопами, що випускають позит«прочастини», описані, наприклад, в "Design of рони, такими як 11С, 18F, 15O і 13N, може бути викоProdrugs" H Bundgaard (Elsevier, 1985). Деякі прикристане при аналізах топографії позитронного лади пролікарських засобів по винаходу включавипромінювання (PET) для дослідження залучення ють: рецепторів субстрату. (і) коли сполука формули (І) містить функціоМічені ізотопами сполуки формули (І) звичайнальну групу карбонової кислоти (карбоксильну но можуть бути отримані по загальноприйнятих групу) (-СООН), її складний ефір, наприклад, виметодиках, відомих фахівцям в даній галузі, або ходить при заміні атома водню (С1-С8)алкілом: використовуючи способи, аналогічні способам, (іі) коли сполука формули (І) містить функціоописаним в супровідних прикладах і способах нальну групу спирту (-ОН),. її простий ефір, наприотримання, що використовують відповідні мічені клад, виходить при заміні атома водню (С1-С6) ізотопами реагенти замість реагентів, що не місалканоїлоксиметилом. тять ізотопних міток, які використовувалися раніДодаткові приклади замінюючих груп, відповіше. дно до вищенаведених прикладів і прикладів інших Всі сполуки формули (І) можуть бути отримані типів пролікарських засобів, можуть бути знайдені по методиках, представлених в описі основних у вказаних вище посиланнях. способів, наведеному нижче; або за допомогою В результаті, окремі сполуки формули (І) моконкретних способів, описаних в розділі, що стосужуть самі поводитися як пролікарські засоби для ється прикладів, а також в розділі, що стосується інших сполук формули (І). способів отримання, або шляхом стандартної їх Сполуки формули (І), що містять один або демодифікації. Даний винахід також охоплює будькілька асиметричних атомів вуглецю, можуть знаякий (один або декілька) з цих способів отримання ходитися в формі двох або більше стереоізомерів. сполук формули (І), в доповнення до будь-яких Коли сполука містить, наприклад, кетогрупу або нових інтермедіатів. що там використовуються. оксим або ароматичну частину, то таутомерна Загальний синтез ізомерія ("таутомерія") може мати місце. Звідси Сполуки за даним винаходом можуть бути слідує, що окрема сполука може виявляти більше отримані великою кількістю добре відомих спосоза один вид ізомерії. бів отримання сполук цього типу, наприклад, покаВсі стереоізомери, геометричні ізомери і таузаних в нижченаведених способах від А до І. томерні форми сполуки формули (І), включаючи Нижченаведені способи А і В ілюструють сполуки, що демонструють більше одного виду отримання сполук формули (І). Способи від С до І ізомерії, і суміш одного або декількох ізомерів вхоілюструють отримання різних інтермедіатів. дять в об'єм даного винаходу. Включені також кисДоти, поки не обумовлено інакше. R1, R2, R3, 4 лотно-адитивні або основно-адитивні солі, у яких R , R5 і А в нижченаведених способах є такими, як протиіон є оптично активним, наприклад, D-лактат визначено вище. Термін "захисна група", що використовується далі, означає гідрокси-, карбокси 15 86301 16 або амінозахисну групу, яку звичайно вибирають з 143; Joensson, N et al., Acta Chem. Scand. Ser. У, гідрокси-, карбокси- або амінозахисних груп, опи1974, 28. 225; Robertson, David W et al.. J Med. саних в Protective Groups in Organic Synthesis, Chem., 1986, 29, 1832; Quallich, George J et al.. edited by T. W. Greene et al. (John Wiley & Sons. Synthesis, 1993. 351], опис яких включений в цей 1999). Всі вихідні речовини в нижченаведених осдокумент у вигляді посилання. новних синтезах можуть бути комерційно доступСпосіб А ними або отримані звичайними способами, відоСпосіб ілюструє отримання сполуки формули мими фахівцям в даній галузі, такими як описані в (І). [Howard, Harry R. et al., J. Med. Chem., 1996, 39, Реакційна схема А У реакційній схемі А, замісник R5a являє собою R , визначений вище, або групу формули COOR6, де R6 являє собою карбоксизахисну групу. Термін "карбоксизахисна група", що використовується тут, означає захисну групу, здагну до відщеплення внаслідок хімічного впливу, такого як гідрогеноліз. гідроліз, електроліз або фотоліз; такі карбоксизахисні групи описані в [Protective Groups in Organic Synthesis, edited by T. W. Greene et al. (John Wiley & Sons, 1999)]. Стандартні карбоксизахисні групи включають, крім інших, метил, етил, тбутил, метоксиметил. 2,2,2-трихлоретил, бензил, дифенілметил, триметилсиліл, тбутилдиметилсиліл і аліл. З цих груп, т-бутил, етил або метил є переважними. Стадія А1 На цій стадії необхідну сполуку формули (І) за даним винаходом отримують карбонілуванням сполуки формули (II) сполукою формули (III). Сполука формули (II) є комерційно доступною або може бути отримана способами С і D, запропонованими нижче. Сполука формули (III) може бути отримана способами від Ε до G, запропонованими нижче. Реакцію звичайно і переважно здійснюють в присутності розчинника. Не існує особливих обмежень на природу розчинника, що використовується, при умові, що він не чинить шкідливого впливу на перебіг реакції або на включені реагенти, і він здатний розчиняти реагенти, принаймні, в деякій мірі. Приклади придатних розчинників включають, крім інших, галогеновані вуглеводні, такі як дихлорметан, хлороформ, чотирихлористий вуглець і 1,2-дихлоретан; ароматичні вуглеводні, такі як бензол, толуол і нітробензол; прості ефіри, такі як діетиловий ефір, діізопропіловий ефір, тетрагідрофуран і діоксан; і аміди, такі як Ν,Νдиметилформамід і Ν,Ν-диметилацетамід. З цих розчинників дихлорметан є переважним. Не існує також особливих обмежень на природу карбонілуючих агентів, що використовуються, і тут однаково може бути використаний будь-який карбонілуючий агені, що звичайно застосовується в реакціях такого типу. Приклади таких карбонілуючих агентів включають, крім інших, похідне імідазолу, таке як Ν,Ν'-карбонілдіімідазол (CDI); хлорформіат, такий як трихлорметилхлорформіат і 45 нітрофенілхлорформіат; сечовину і трифосген. З цих агентів 4-нітрофенілхлорформіат є переважним. Реакція може протікати в широкому інтервалі температур, і точна температура реакції не є визначальною для винаходу. Переважна температура реакції буде залежати від таких факторів, як природа розчинника і вихідні речовини. Однак, взагалі кажучи, зручно здійснювати реакцію при температурі від, приблизно, 0°С до, приблизно, 100°С. Час, необхідний для реакції, може також мінятися в широких межах, в залежності від багатьох чинників, особливо температури реакції і природи вихідних речовин і розчинника, що використовується. Однак, при умові, що реакцію здійснюють в переважних умовах, описаних вище, період від, приблизно, 5 хвилин до, приблизно, 24 годин, як правило, буде достатнім. У випадку, коли R5a являє собою групу сполук формули -COOR6, для отримання карбоксигрупи здійснюють реакцію для видалення захисту. Ця реакція детально описана в роботі [Т. W. Greene et al., Protective Groups in Organic Synthesis, 369-453, (1999)]; яка включена тут у вигляді посилання. Нижченаведене ілюструє типову реакцію з участю захисної т-бутильної групи. Реакцію видалення захисту звичайно переважно здійснюють в присутності розчинника. Не існує особливих обмежень на природу розчинника, що використовується, при умові, що він не чинить шкідливого впливу на перебіг реакції або на реагенти, що використовуються, і він здатний розчиняти реагенти, принаймні, до деякої міри. Приклади придатних розчинників включають, крім інших, галогеновані вуглеводні, такі як дихлорметан, хлороформ, чотирихлористий вуглець і 1,2дихлоретан; і ароматичні вуглеводні, такі як бензол, толуол і нітробензол. З цих розчинників галогеновані вуглеводні є переважними. Реакцію видалення захисту здійснюють в присутності кислоти Не існує також особливих обмежень на природу кислот, що використовуються; і будь-яка кислота, що звичайно використовується в реакціях такого типу, однаково може бути тут використана. Приклади таких кислот включають, крім інших, такі кислоти, як хлористоводнева кислота, оцтова кислота п-толуолсульфокислота або три 17 86301 18 фтороцтова кислота. З них, трифтороцтова кислотаких чинників, як природа розчинника і вихідні та є переважною. речовини. Однак, взагалі кажучи, зручно здійснюРеакцію видалення захисту можна здійснювавати реакцію при температурі від, приблизно, 0°С ти в присутності акцептора радикалів. Не існує до, приблизно, 100°С. Час, необхідний для реакції, також особливих обмежень на природу акцептора може також мінятися в широких межах, в залежнорадикалів, що використовується, і будь-який акцесті від багатьох чинників, особливо температури птор радикалів, що звичайно використовується в реакції і природи вихідних речовин і розчинника, реакціях такого типу, однаково може бути тут вищо використовується. Однак, при умові, що реаккористаний. Приклади таких акцепторів радикалів цію здійснюють в переважних умовах, описаних включають, крім інших, НВr, диметилсульфоксид вище, період від, приблизно, 5 хвилин до, приблиабо (СН3СН2)3SіН. З них (CH3CH2)3SiH є переважзно, 24 годин як правило, буде достатнім. ним. Спосіб В Реакція видалення захисту може протікати в Спосіб ілюструє отримання сполук формули широкому інтервалі температур, і точна темпера(І). тура реакції не є визначальною для винаходу. ПеРеакційна схема В реважна температура реакції буде залежати від На реакційній схемі В, замісник R5a визначений вище; R7 є амінозахисною групою, Aa являє собою групу А. визначену вище, або С1-С3 алкіленову групу, вказана алкіленова група є незаміщеною або заміщеною 1-4 замісниками, незалежно вибираними з групи, що складається з атома галогену, С1-С4 алкільної групи, гідроксизаміщеної С1-С4 алкільної групи і С1-С2 алкоксизаміщеної С1-С4 алкільної групи, де 2 з вказаних замісників можуть, необов'язково, разом з атомами вуглецю утворювати 3-6-членне кільце; а X являє собою атом галогену, такий як атом йоду, атом хлору або атом брому. Термін "амінозахисна група", що використовується тут, означає захисну групу, здатну до відщеплення хімічними засобами, такими як гідрогеноліз, гідроліз, електроліз або фотоліз. Такі амінозахисні групи описані в [Protective Groups in Organic Synthesis, edited by T. W. Greene et al. (John Wiley & Sons, 1999)]. Звичайні амінозахисні групи включають, крім інших, бензил, С2Н5О(С=О), СН3(С )-, О = т-бутилдиметилсиліл, тбутилдифенілсиліл, бензилоксикарбоніл і тбутоксикарбоніл. З цих груп т-буюксикарбоніл є переважним. Стадія В1 На цій стадії, сполуку формули (V) отримують за допомогою видалення захисту сполуки формули (IV), яка може бути отримана, наприклад, способом, аналогічним способу, описаному в способі А для отримання сполуки формули (І) із сполуки формули (II). Цей спосіб видалення захисту детально описаний в Т. W. Greene et al. [Protective Groups in Organic Synthesis, 494-653, (1999)]; опис включений в даний документ у вигляді посилання. Нижченаведене ілюструє типовий спосіб з участю т-бутоксикарбонільної захисної групи. Реакцію звичайно і переважно здійснюють в присутності розчинника. Не існує особливих обмежень на природу розчинника, що використовується, при умові, що він не чинить шкідливого впливу на перебіг реакції або на включені реагенти, і здатний розчиняти реагенти, принаймні, до деякої міри. Приклади придатних розчинників включають, крім інших, галогеновані вуглеводні, такі як дихлормеіан, хлороформ, чотирихлористий вуглець і 1,2-дихлоретан; і спирти, такі як метанол, етанол, пропанол, 2-пропанол і бутанол. З цих розчинників спирти є переважними. Реакцію здійснюють в присутності кислоти. Не існує також особливих обмежень на природу кислот, що використовуються; і будь-яка кислота, що звичайно використовується в реакціях такого типу, однаково може бути тут використана. Приклади таких кислот включають, крім інших, такі кислоти, як хлористоводнева або трифтороцтова кислота. З них хлористоводнева кислота с переважною. Реакція може протікати в широкому інтервалі температур, і точна температура реакції не є визначальною для винаходу. Переважна температура реакції буде залежати від таких чинників, як природа розчинника і вихідні речовини. Однак, взагалі кажучи, зручно здійснювати реакцію при температурі від, приблизно. 0°С до. приблизно, 100°С. Час, необхідний для реакції, може також змінюватися в широких межах, в залежності від багатьох чинників, особливо температури реакції і природи вихідних речовин і розчинника, що вико 19 86301 20 ристовується. Однак, при умові, що реакцію здійснюють в описаних вище переважних умовах, перінюють в переважних умовах, описаних вище, період від, приблизно, 5 хвилин до, приблизно, 48 од від, приблизно, 5 хвилин до, приблизно. 24 гогодин, як правило, буде достатнім. дин як правило, буде достатнім. (В2-b) Відновне амінування: Стадія В2 Реакцію звичайно і переважно здійснюють в На цій стадії необхідну сполуку формули (І) присутності розчинника. Не існує особливих обмеотримують (В2-а) поєднанням сполуки формули жень на природу розчинника, що використовуєть(V), що отримується як описано для стадії В1, із ся, при умові, що він не чинить шкідливого впливу сполукою формули (VI) або шляхом відновного на перебіг реакції або на включені реагенти, і здаамінування (В2-b) сполуки формули (V) сполукою тний розчиняти реагенти, принаймні, до деякої формули (VII). міри. Приклади придатних розчинників включають, (В2-а) Поєднання із сполукою формули (VI): крім інших, галогеновані вуглеводні, такі як дихлоРеакцію звичайно і переважно здійснюють в рметан, хлороформ, чотирихлористий вуглець і присутності розчинника. Не існує особливих обме1,2-дихлоретан; прості ефіри, такі як діетиловий жень на природу розчинника, що використовуєтьефір, діізопропіловий ефір, тетрагідрофуран і діокся, при умові, що він не чинить шкідливого впливу сан; спирти, такі як метанол, етанол, пропанол, 2на перебіг реакції або на включені реагенти, і здапропанол і бутанол; оцтову кислоту і воду. З цих тний розчиняти реагенти, принаймні, до деякої розчинників галогеновані вуглеводні є переважниміри. Приклади придатних розчинників включають, ми. крім інших, галогеновані вуглеводні, такі як дихлоРеакцію здійснюють в присутності відновника. рметан, хлороформ, чотирихлористий вуглець і Не існує також особливих обмежень на природу 1,2-дихлоретан; простий ефір, такий як діетиловий відновників, що використовуються, і будь-який ефір, діізопропіловий ефір, тетрагідрофуран і діоквідновник, що звичайно використовується в реаксан; аміни, такі як N-метилморфолін, триетиламін, ціях такого типу, однаково може бути тут використрипропіламін, трибутиламін, діізопропілетиламін, таний. Приклади такого відновника включають, дициклогексиламін, N-метилпіперидин. Nкрім інших, боргідрид натрію, ціаноборпдрид наметилпіролідин, піридин, 4-піролідинопіридин, Ν,Νтрію і триацетоксиборгідрид натрію. З них, триацедиметиланілін і Ν,Ν-діетиланілін; і аміди, такі як токсиборгідрид натрію є переважним. Необхідна Ν,Ν-диметилформамід і Ν,Ν-диметилацетамід. З для реакції кількість відновника також може змінюних, Ν,Ν-диметилформамід або Ν,Νватися в широких межах, в залежності від багатьох метилпіролідин є переважними. чинників, особливо температури реакції і природи Реакцію здійснюють в присутності основи. Не вихідних речовин і розчинника, що використовуіснує також особливих обмежень на природу осється. Однак, при здійсненні реакції в переважних нов, що використовуються; і будь-яка основа, що умовах, співвідношення хімічних еквівалентів відзвичайно використовується в реакціях такого типу, новника і вихідної речовини, що дорівнює 1:3, буоднаково може бути тут використана. Приклади де, як правило, достатнім. таких основ включають, крім інших, аміни, такі як Реакція може протікати в широкому інтервалі N-метилморфолін, триетиламін, трипропіламін, температур, і точна температура реакції не є витрибутиламін, діізопропілетиламін, значальною для винаходу. Переважна температудициклогексиламін, N-метилпіперидин, пірира реакції буде залежати від таких чинників, як дин, 4-піролідинопіридин, піколін, 4-(]^,Кприрода розчинника і вихідні речовини. Однак, диметиламіно)піридин, 2,6-ди(т-бутил)-4взагалі кажучи, зручно здійснювати реакцію при метилпіридин, хінолін. Ν,Ν-диметиланілін і Ν,Νтемпературі від, приблизно, -20°С до, приблизно, діетиланілін, 1,5-діазабіцикло[4.3.0]нон-5-ен (DBN), 60°С. Час, необхідний для реакції, може також 1.4-діазабіцикло[2.2.2]октан(ОАВСО) і 1,8змінюватися в широких межах, в залежності від діазабіцикло[5.4.0]ундек-7-ен (DBU); гідриди лужбагатьох чинників, особливо температури реакції і них металів, такі як гідрид літію, гідрид натрію і природи вихідних речовин і розчинника, що викогідрид калію; і алкоксиди лужних металів, такі як ристовується. Однак при умові, що реакцію здійсметилат натрію, етилат натрію, т-бутилат калію. нюють в описаних вище переважних умовах, періПереважним з них є діізопропілетиламін. од від, приблизно, 5 хвилин до, приблизно, 24 Реакція може протікати в широкому інтервалі годин, як правило, буде достатнім. температур, і точна температура реакції не є виУ випадку, коли R5a являє собою групу сполук, значальною для винаходу. Переважна температущо відповідають формулі -COOR6, отримання карра реакції буде залежати від таких чинників, як боксигрупи буде супроводжуватися реакцією виприрода розчинника і вихідні речовини. Однак, далення захисної групи. Реакція може бути здійсвзагалі кажучи, зручно здійснювати реакцію при нена в умовах, аналогічних умовам, описаним для температурі від, приблизно, 0°С до, приблизно, стадії А1 способу А. 120°С. Час, необхідний для реакції, може також Спосіб С змінюватися в широких межах, в залежності від Нижченаведене ілюструє отримання сполук багатьох чинників, особливо температури реакції і формули (II). природи вихідних речовин і розчинника, що викоРеакційна Схема С ристовується. Однак при умові, що реакцію здійс 21 На реакційній схемі С, R8 являє собою С1-С4 алкільну групу, переважно, метильну або етильну; а замісник X визначений вище. Стадія С1 На цій стадії, сполуку формули (X) отримують (С1-а) поєднанням сполуки формули (VIII) і сполуки формули (IX) з подальшим (С1-b) декарбоксилюванням отриманої сполуки. Сполука формули (VIII) і сполука формули (IX) комерційно доступні. (С1-а) Поєднання із сполукою формули (VIII) Реакцію звичайно і переважно здійснюють в присутності розчинника Не існує особливих обмежень на природу розчинника, що використовується, при умові, що він не чинить шкідливого впливу на перебіг реакції або на включені реагенти, і здатний розчиняти реагенти, принаймні, до деякої міри. Приклади придатних розчинників включають простий ефір, такий як діетиловий ефір, діізопропіловий ефір, тетрагідрофуран і діоксан; аміди, такі як формамід, Ν,Ν-диметилформамід, Ν,Νдиметилацетамід і гексаметилтриамід фосфорної кислоти; і сульфоксиди, такі як диметилсульфоксид і сульфолан. З цих розчинників, Ν,Νдиметилсульфоксид є переважним. Реакцію здійснюють в присутності основи. Також, не існує особливих обмежень на природу основ, що використовуються, і будь-яка основа, що звичайно використовується в реакціях такого типу, однаково може бути тут використана. Приклади таких основ включають гідриди лужних металів, такі як гідрид літію, гідрид натрію і гідрид калію; алкоксиди лужних металів, такі як метилат натрію, етилат натрію, т-бутилат калію, карбонати лужних металів, такі як карбонат літію, карбонат натрію і карбонаї калію; і аміди лужних металів, такі як амід літію, амід натрію, амід калію, діізопропіламід літію, діізопропіламід калію, діізопропіламід натрію, біс(триметилсиліл)амід літію і біс(триметилсиліл)амід калію. З них переважним є гідрид натрію. Реакція може протікати в широкому інтервалі температур, і точна температура реакції не є визначальною для винаходу. Переважна температура реакції буде залежати від таких чинників, як природа розчинника і вихідні речовини. Однак, взагалі кажучи, зручно здійснювати реакцію при температурі від, приблизно, 20°С до, приблизно, 200°С. Час, необхідний для реакції, може також змінюватися в широких межах, в залежності від багатьох чинників, особливо температури реакції і природи вихідних речовин і розчинника, що вико 86301 22 ристовується. Однак, при умові, що реакцію здійснюють в описаних вище переважних умовах, період від, приблизно, 10 хвилин до, приблизно, 24 годин, як правило, буде достатнім. (С1-b) Декарбоксилювання Реакцію звичайно і переважно здійснюють в присутності розчинника. Не існує особливих обмежень на природу розчинника, що використовується, при умові, що він не чинить шкідливого впливу на перебіг реакції або на включені реагенти, і здатний розчиняти реагенти, принаймні, до деякої міри. Приклади придатних розчинників включають простий ефір, такий як діетиловий ефір, діізопропіловий ефір, тетрагідрофуран і діоксан; аміди, такі як формамід, Ν,Ν-диметилформамід. Ν,Νдиметилацетамід і гексаметилтриамід фосфорної кислоти; і сульфоксиди, такі як диметилсульфоксид і сульфолан. З цих розчинників, Ν,Νдиметилсульфоксид є переважним. Реакцію здійснюють в присутності галогеніду металу і води. Не існує особливих обмежень на природу галогеніду металу, що використовується при умові, що він не чинить шкідливого впливу на перебіг реакції, принаймні, до деякої міри. Приклади галогеніду металу включають хлорид літію, хлорид калію, хлорид натрію і йодид натрію. З них переважним є хлорид літію. Реакція може протікати в широкому інтервалі температур, і точна температура реакції не визначальною для винаходу. Переважна температура реакції буде залежати від таких чинників, як природа розчинника і вихідні речовини. Однак, взагалі кажучи, зручно здійснювати реакцію при температурі від, приблизно, 50°С до, приблизно, 200°С. Час, необхідний для реакції, може також змінюватися в широких межах, в залежності від багатьох чинників, особливо температури реакції, і природи вихідних речовин і розчинника, що використовується. Однак, при умові, що реакцію здійснюють в описаних вище переважних умовах, період від, приблизно, 10 хвилин до. приблизно, 24 годин, як правило, буде достатнім. Стадія С2 На цій стадії, сполуку формули (XI) отримують алкілуванням сполуки формули (X) сполуками формул R2-X і R3-X. Реакцію звичайно і переважно здійснюють в присутності розчинника Не існує особливих обмежень на природу розчинника, що використовується, при умові, що він не чинить шкідливого впливу на перебіг реакції або на включені реагенти, і зда 23 86301 24 тний розчиняти реагенти, принаймні, до деякої На цій стадії, сполуку формули (II) отримують міри. Приклади придатних розчинників включають шляхом прокалювання сполуки формули (XI) у простий ефір, такий як діетиловий ефір, діізопровідновних умовах. піловий ефір, тетрагідрофуран і діоксан; аміди, Реакцію звичайно і переважно здійснюють в такі як формамід, Ν,Ν-диметилформамід, Ν,Νприсутності розчинника Не існуг особливих обмедиметилацетамід і гексаметилтриамід фосфорної жень на природу розчинника, що використовуєтькислоти; і сульфоксиди, такі як диметилсульфокся, при умові, що він не чинить шкідливого впливу сид і сульфолан. З цих розчинників, Ν,Νна перебіг реакції або на включені реагенти, і здадиметилформамід є переважним. тний розчиняти реагенти, принаймні, до деякої Реакцію здійснюють в присутності основи. Таміри. Приклади придатних розчинників включають кож, не існує особливих обмежень на природу осспирти, такі як метанол, етанол, пропанол, 2нов, що використовуються; і будь-яка основа, що пропанол і буіанол; і складний ефір, такий як етизвичайно використовується в реакціях такого типу, лацетат і пропілацетат 3 цих розчинників, метанол однаково може бути тут використана. Приклади є переважним. таких основ включають гідриди лужних металів, Реакцію здійснюють в присутності відновника. такі як гідрид літію, гідрид натрію і гідрид калію; Не існує також особливих обмежень на природу алкоксиди лужних металів, такі як метилат натрію, відновників, що використовуються, і будь-який етилат нагрію, т-бутилат калію; карбонати лужних відновник, що звичайно використовується в реакметалів, такі як карбонат літію, карбонат натрію і ціях такого типу, однаково може бути тут викорискарбонат калію; аміди лужних металів, такі як амід таний. Приклади такого відновника включають літію, амід натрію, амід калію, діізопропіламід лікомбінації постачальника водню, такого як газопотію, діізопропіламід калію, діізопропіламід натрію, дібний водень і форміат амонію, і каталізатора, біс(триметилсиліл)амід літію і такого як паладій/вуглець, платина і нікель Ренея; і біс(триметилсиліл)амід калію; і органічні сполуки комбінацію металів, таких як цинк і залізо, і кислої, літію, такі як н-бутиллітій. втор-бутиллітій, ттаких як хлористоводнева кислота, оцтова кислота бутиллітій і феніллітій. З них. переважним є гідрид і комплекс оцтова кислота·хлорид амонію. З них натрію або н-бутиллітій. комбінація заліза і оцтової кислоти є переважною. Реакцію можуть провести в присутності або у Реакція може протікати в широкому інтервалі відсутність добавок, таких як 16-краун-6, N,N,N¢,N¢температур, і точна температура реакції не є витетрамеіилетилендіамін (TMEDA) і гексаметилтризначальною для винаходу. Переважна температуамід фосфорної кислоти (НМРА). З цих добавок, ра реакції буде залежати від таких чинників, як 16-краун-6 або TMEDA є переважним. природа розчинника і вихідні речовини. Однак, Реакція може протікати в широкому інтервалі взагалі кажучи, зручно здійснювати реакцію при температур, і точна температура реакції не є витемпературі від, приблизно, 10°С до, приблизно, значальною для винаходу. Переважна температу50°С, у разі застосування як відновника комбінації ра реакції буде залежати від таких чинників, як постачальника водню і каталізатора; або від. приприрода розчинника і вихідні речовини. Однак, близно, 50°С до, приблизно, 200°С, у разі застосувзагалі кажучи, зручно здійснювати реакцію при вання як відновника комбінації металів і кислот. температурі від, приблизно, 50°С до, приблизно, Час, необхідний для реакції, може також змінюва200°С. Час, необхідний для реакції, може також тися в широких межах, в залежності від багатьох змінюватися в широких межах, в залежності від чинників, особливо температури реакції, і природи багатьох чинників, особливо температури реакції, і вихідних речовин і розчинника, що використовуприроди вихідних речовин і розчинника, що викоється. Однак, при умові, що реакцію здійснюють в ристовується. Однак, при умові, що реакцію здійсописаних вище переважних умовах, період від, нюють в описаних вище переважних умовах, періприблизно, 10 хвилин до. приблизно, 24 годин, як од від, приблизно, 10 хвилин до. приблизно, 24 правило, буде достатнім. годин, як правило, буде достатнім. Спосіб D Стадія С3 Нижченаведене ілюструє отримання сполуки формули (II). Реакційна схема D У реакційній схемі D. кожний з Ra і X визначений вище. Стадія D1 На цій стадії сполуку формули (XII) отримують прокалюванням сполуки формули (X), яка є комерційно доступною, або її отримують, у відповідності зі стадією СІ способу С. Реакцію можуть здійс нювати в умовах, аналогічних умовам, описаним для стадії СЗ способу С. Стадія D2 На цій стадії, сполуку формули (II) отримують алкілуванням сполуки формули (XII) сполуками формули R2-X і R3-X. Реакцію можуть здійснювати в умовах аналогічних умовам, описаним для стадії С2 способу С. 25 86301 Спосіб Ε Нижченаведене ілюструє отримання сполуки формули (III). 26 Реакційна Схема Ε У реакційній схемі Ε кожний з, X, Аа і R3a визначений вище; a R9 являє собою амінозахисну групу Стадія Е1 На цій стадії сполуку формули (XIV) отримують поєднанням сполуки формули (XIII) із сполукою формули (VI) або за допомогою відновного амінування сполуки формули (XIII) сполукою формули (VII). Сполука формули (XIII) або є комерційно доступною, або може бути отримана способами Η і І, що пропонуються нижче. Стадія Е2 На цій стадії, сполуку формули (III) отримують шляхом видалення захисту від сполуки формули (XIV), що отримується як описано для стадії Е1. Реакцію можуть здійснювати в умовах, аналогічних умовам, описаним для стадії В1 способу В. Спосіб F Нижченаведене ілюструє отримання сполуки формули (III), де А являє собою Аb. Реакційна схема F На реакційній схемі F кожний з F, R5a, R6 і R9 визначений вище; R10 являє собою силільну групу, таку як т-бутилдиметилсиліл, тбутилдифенілсиліл, триетилсиліл або триметилсиліл, переважно триметилсиліл; R11 і R12 незалежно являють собою атом галогену, С1-С4 алкільну групу, гідроксизаміщену С1-С4-алкільну групу і С1С2алкоксизаміщену С1-С4 алкільну групу, де R11 і R12. необов'язково, можуть разом з атомом вуглецю, до якого вони приєднані, утворювати 3-6членне кільце; Аb є А, визначеним вище, з тією обмовкою, що метиленова група і заміщена метиленова група виключаються; a Y являє собою алкоксигрупу, що має від 1 до 4 атомів вуглецю, імідазолільну групу або фталімідильну групу. Стадія F1 На цій стадії, сполуку формули (XV) отримують по реакції конденсації сполуки формули (XIII) із сполукою формули Η-Υ, в присутності параформальдегіду. Сполука формули (XIII) може бути отримана способами FI і І або ж є комерційно доступною. У випадку, коли Υ не є алкоксигрупою, реакцію звичайно і переважно здійснюють в присутності розчинника. Не існує особливих обмежень на природу розчинника, що використовується, при умові, що він не чинить шкідливого впливу на перебіг реакції або на включені реагенти, і здатний розчиняти реагенти, принаймні, до деякої міри. Прикла ди придатних розчинників включають, крім інших, галогеновані вуглеводні, такі як дихлорметан, хлороформ, чогирихлористий вуглець і 1,2дихлоретан; і спирти, такі як метанол, етанол, пропанол, 2-пропанол і бутанол. З них дихлорметан або етанол є переважними. Реакція може протікати в широкому інтервалі температур, і точна температура реакції не є визначальною для винаходу. Переважна температура реакції буде залежати від таких чинників, як природа розчинника і вихідні речовини. Однак, взагалі кажучи, зручно здійснювати реакцію при температурі від. приблизно, 0°С до, приблизно, 120°С. Час, необхідний для реакції, може також мінятися в широких межах, в залежності від багатьох чинників, особливо температури реакції, і природи вихідних речовин, і розчинника, що використовується. Однак, при умові, що реакцію здійснюють в описаних вище переважних умовах, період від, приблизно, 5 хвилин до, приблизно, 48 годин, як правило, буде достатнім. Стадія F2 На цій стадії, сполуку формули (ІІІа) отримують по реакції Манніха сполуки формули (XV) із сполукою формули (XVI). Реакцію звичайно і переважно здійснюють в присутності розчинника. Не існує особливих обмежень на природу розчинника, що використовується, при умові, що він не чинить шкідливого впливу 27 86301 28 на перебіг реакції або на включені реагенти, і здаРеакція може протікати в широкому інтервалі тний розчиняти реагенти, принаймні, до деякої температур. і точна температура реакції не є виміри. Приклади придатних розчинників включають, значальною для винаходу. Переважна температукрім інших, галогеновані вуглеводні, такі як дихлора реакції буде залежати від таких чинників, як рметан, хлороформ, чотирихлористий вуглець і природа розчинника і вихідні речовини Однак, вза1,2-дихлоретан; простий ефір, такий як діетиловий галі кажучи, зручно здійснювати реакцію при темефір, діізопропіловий ефір, тетрагідрофуран і діокпературі від, приблизно, 0°С до, приблизно. 100°С. сан: нітрили, такі як ацетонітрил і бензонітрил; і Час, необхідний для реакції, може також мінятися аміди, такі як формамід, Ν,Ν-диметилформамід. в широких межах, в залежності від багатьох чинΝ,Ν-диметилацетамід і гексаметилтриамід фосників, особливо температури реакції, і природи форної кислоти. З цих розчинників дихлормеган є вихідних речовин і розчинника, що використовупереважним. ється. Однак, при умові, що реакцію здійснюють в Реакцію здійснюють в присутності кислоти описаних вище переважних умовах, період від, Льюїса. Також не існує особливих обмежень на приблизно, 5 хвилин до, приблизно, 24 годин, як природу кислот Льюїса, що використовуються; і правило, буде достатнім. будь-яка кислота Льюїса. що звичайно використоСпосіб G вується в реакціях такого типу, може тут однаково Нижченаведене ілюструє отримання сполуки бути використана. Приклади такої кислоти Льюїса формули (III), де R4 являє собою атом водню, і А є включають, крім інших, BF3, AICI3, FeCl3, MgCl2, Аb. AgCl, Fe(NO3)3, CF3SO3Si(CH3)3, Yb(CF3SO3)3 і Реакційна схема G SnCl4. З них Yb(CF3SO3)3, CF3SO3Si(CH3)3 або MgCl2 є переважними. На реакційній схемі G кожний з Аа, Аb і R5a визначений вище; кожний з R і R' являє собою С1-С4 алкільну групу, переважно, метильну групу, або аралкільну групу, таку як бензильна або фенетильна група, переважно бензильну групу. Стадія G1 На цій стадії сполуку формули (XVI) отримують шляхом відновлення щаногрупи сполуки формули (XV), яка є комерційно доступною. Реакцію звичайно і переважно здійснюють в присутності розчинника Не існує особливих обмежень на природу розчинника, що використовується, при умові, що він не чинить шкідливого виливу на перебіг реакції або на включені реагенти, і здатний розчиняти реагенти, принаймні, до деякої міри. Приклади придатних розчинників включають, крім інших, простий ефір, такий як діетиловий ефір, діізопропіловий ефір, гетрагідрофуран і діоксан; ароматичні вуглеводні, такі як бензол, толуол і нітробензол; і спирти, такі як метанол, етанол, пропанол. 2-пропанол і бутанол. З них метанол є переважним. Реакцію здійснюють в присутності відновника. Не існує також особливих обмежень на природу відновників, що використовуються, і будь-який відновник, що звичайно використовується в реакціях такого типу, однаково може бути тут використаний. Приклади таких відновників включають, крім інших, боргідриди металів, таких як боргідрид натрію і ціаноборгідрид натрію в комбінації газопо дібного водню і каталізатора, такого як паладій/вуглець, платина і нікель Ренея; і сполуки гідридів, такі як алюмогідрид літію, діізобутилалюмогідрид. З них Нікель Ренея є переважним. Реакція може протікати в широкому інтервалі температур, і точна температура реакції не є визначальною для винаходу. Переважна температура реакції буде залежати від таких чинників, як природа розчинника і вихідні речовини. Однак, взагалі кажучи, зручно здійснювати реакцію при температурі від, приблизно, 0°С до. приблизно, 100°С. Час, необхідний для реакції, може також мінятися в широких межах, в залежності від багатьох чинників, особливо температури реакції і природи вихідних речовин і розчинника, що використовується. Однак, при умові, що реакцію здійснюють в описаних вище переважних умовах, період від, приблизно, 5 хвилин до, приблизно, 24 годин, як правило, буде достатнім. Стадія G2 На цій стадії сполуку формули (XVIII) отримують взаємодією сполуки формули (XVII). яка є комерційно доступною, із сполукою формули (XVI). Реакцію звичайно і переважно здійснюють в присутності розчинника. Не існує особливих обмежень на природу розчинника, що використовується, при умові, що він не чинить шкідливого впливу на перебіг реакції або на включені реагенти, і здатний розчиняти реагенти, принаймні, до деякої 29 86301 30 міри. Приклади придатних розчинників включають, тний розчиняти реагенти, принаймні, до деякої крім інших, воду і спирти, такі як метанол, етанол, міри. Приклади придатних розчинників включають, пропанол, 2-пропанол і бутанол. З них суміш води крім інших, простий ефір, такий як діетиловий і етанолу є переважною. ефір, діізопропіловий ефір, диметиловий ефір Реакцію здійснюють в присутності основи. Таетиленгліколю, тетрагідрофуран і діоксан; і спирти, кож, не існує особливих обмежень на природу остакі як метанол, етанол, пропанол, 2-пропанол і нови, що використовується, і будь-яка основа, що бутанол. З них суміш диметилового ефіру етилензвичайно використовується в реакціях такого типу, гліколю і етанолу є переважною. може бути тут однаково використана. Приклади Реакцію здійснюють в присутності основи. Татаких основ включають, крім інших, гідроксиди кож, не існує особливих обмежень на природу ослужних металів, такі як гідроксид літію, гідроксид нови, що використовується, і будь-яка основа, що натрію і гідроксид калію; алкоксиди лужних метазвичайно використовується в реакціях цього типу, лів, такі як метилат натрію, етилат натрію, тможе бути тут однаково використана. Приклади бутилат калію; і карбонати лужних металів, такі як таких основ включають, крім інших, алкоксиди лукарбонат літію, карбонат нагрію і карбонат калію 3 жних металів, такі як метилат натрію, етилат наних карбонат калію є переважним. трію і т-бутилат калію. З них переважним є тРеакція може протікати в широкому інтервалі бутилат калію. температур, і точна температура реакції не є виРеакція може протікати в широкому інтервалі значальною для винаходу. Переважна температутемператур, і точна температура реакції не є вира реакції буде залежати від таких чинників, як значальною для винаходу. Переважна температуприрода розчинника і вихідні речовини. Однак, ра реакції буде залежати від таких чинників, як взагалі кажучи, зручно здійснювати реакцію при природа розчинника і вихідні речовини. Однак, температурі від, приблизно, 0°С до, приблизно, взагалі кажучи, зручно здійснювати реакцію при 120°С. Час, необхідний для реакції, може також температурі від, приблизно, 0°С до, приблизно, мінятися в широких межах, в залежності від бага100°С. Час, необхідний для реакції, може також тьох чинників, особливо температури реакції, і мінятися в широких межах, в залежності від багаприроди вихідних речовин і розчинника, що викотьох чинників, особливо температури реакції, і ристовується. Однак, при умові, що реакцію здійсприроди вихідних речовин і розчинника, що виконюють в описаних вище переважних умовах, періристовується. Однак, при умові, що реакцію здійсод від, приблизно, 5 хвилин до, приблизно, 24 нюють в описаних вище переважних умовах, перігодин, як правило, буде достатнім. од від, приблизно, 5 хвилин до, приблизно, 24 Стадія G3 годин, як правило, буде достатнім. На цій стадії, сполуку формули (XIX) отримуСтадія G4 ють за допомогою перетворення оксогрупи сполуНа пій стадії, сполуку формули (lllb) отримують ки формули (XVIII) в присутності пвідновленням ціаногрупи сполуки формули (XIX). толуолсульфонілметилізоціаніду в ціаногрупу. Реакцію можуть здійснювати в умовах, аналогічРеакцію звичайно і переважно здійснюють в них умовам, описаним для стадії G1 способу G. присутності розчинника. Не існує особливих обмеСпосіб Η жень на природу розчинника, що використовуєтьНижченаведене ілюструє отримання сполуки ся, при умові, що він не чинить шкідливого впливу формули (XIII), де R4 являє собою атом галогену. на перебіг реакції або на включені реагенти, і здаРеакційна Схема Η У реакційній схемі Н, R4a являє собою атом галогену; R9 визначений вище; а R13 являє собою амінозахисну групу, переважно, бензоїльну групу. Стадія Н1 На цій стадії, сполуку формули (XXI) отримують, перетворюючи карбонільну групу сполуки формули (XX) в епоксидну групу. Реакцію звичайно і переважно здійснюють в присутності розчинника. Не існує особливих обмежень на природу розчинника, що використовується, при умові, що він не чинить шкідливого впливу на перебіг реакції або на включені реагенти, і зда тний розчиняти реагенти, принаймні, до деякої міри. Приклади придатних розчинників включають, крім інших, аміди, такі як формамід, Ν,Νдиметилформамід, Ν,Ν-диметилацетамід і гексаметилтриамід фосфорної кислоти; і сульфоксиди, такі як диметилсульфоксид або сульфолан. З цих розчинників диметилсульфоксид є переважним. Реакцію здійснюють в присутності основи. Не існує також особливих обмежень на природу основ, що використовуються, і будь-яка основа, що звичайно використовується в реакціях цього типу, може бути тут однаково використана. Приклади 31 86301 32 таких основ включають, крім інших, алкоксиди лурмеган, хлороформ, чотирихлористий вуглець і жних металів, такі як метилат натрію, етилат на1,2-дихлоретан; простий ефір, такий як діетиловий трію, т-бутилат калію; і карбонати лужних металів, ефір, діізопропіловий ефір, тетрагідрофуран і діоктакі як карбонат літію, карбонат натрію і карбонат сан: аміди, такі як формамід, Ν,Νкалію. З них т-бутилат калію є переважним. диметилформамід, Ν,Ν-диметилацетамід і гексаРеакція може протікати в широкому інтервалі метилтриамід фосфорної кислоти; і сульфоксиди, температур, і точна температура реакції не є витакі як диметилсульфоксид або сульфолан. З цих значальною для винаходу. Переважна температурозчинників Ν,Ν-диметилформамід є переважним. ра реакції буде залежати від таких чинників, як Перед додаванням азиду натрію, гідроксигруприрода розчинника і вихідні речовини. Однак, пу додаванням таких реагентів, як трифторметанвзагалі кажучи, зручно здійснювати реакцію при сульфонілхлорид, мезилхлорид і тозилхлорид, температурі від, приблизно, 0°С до, приблизно, перетворюють в групу, що відщеплюється, таку як 100°С. Час, необхідний для реакції, може також метил сульфонільна група, трифторметилсульфомінятися в широких межах, в залежності від баганільна група і 4-метилфенілсульфонільна група. З тьох чинників, особливо температури реакції, і цих реагентів мезилхлорид є переважним. природи вихідних речовин, і розчинника, що викоРеакція може протікати в широкому інтервалі ристовується. Однак, при умові, що реакцію здійстемператур, і точна температура реакції не є винюють в описаних вище переважних умовах, перізначальною для винаходу Переважна температуод від, приблизно, 5 хвилин до, приблизно, 24 ра реакції буде залежати від таких чинників, як годин, як правило, буде достатнім. природа розчинника і вихідні речовини Однак, взаСтадія Н2 галі кажучи, зручно здійснювати реакцію при темНа цій стадії сполуку формули (XXII) отримупературі від, приблизно, 0°С до, приблизно, 120°С. ють взаємодією галогеніду водню із сполукою фоЧас, необхідний для реакції, може також мінятися рмули (XXI). в широких межах, в залежності від багатьох чинРеакцію звичайно і переважно здійснюють в ників, особливо температури реакції і природи присутності розчинника. Не існує особливих обмевихідних речовин і розчинника, що використовужень на природу розчинника, що використовуєтьється. Однак, при умові, що реакцію здійснюють в ся, при умові, що він не чинить шкідливого впливу описаних вище переважних умовах, період від, на перебіг реакції або на включені реагенти, і здаприблизно, 5 хвилин до, приблизно, 24 годин, як тний розчиняти реагенти, принаймні, до деякої правило, буде достатнім. міри. Приклади придатних розчинників включають, (Н3-b) Відновлення: крім інших, простий ефір, такий як діетиловий Реакцію можуть здійснювати в умовах, аналоефір, діізопропіловий ефір, тетрагідрофуран і діокгічних умовам, описаним для стадії G1 способу G сан: аміди, такі як формамід, Ν,ΝСтадія Н4 диметилформамід, Ν,Ν-диметилацетамід і гексаНа цій стадії, сполуку формули (ХІllа) отримуметилтриамід фосфорної кислоти. З цих розчинють шляхом введення амінозахисної групи R9 до ників тетрагідрофуран є переважним. первинної аміногрупи (Н4-а), селективно видаляюРеакція може протікати в широкому інтервалі чи амінозахисну групу R13 вторинної аміногрупи температур, і точна температура реакції не є ви(Н4-b). значальною для винаходу. Переважна температу(Н4-а) Введення амінозахисної групи: ра реакції буде залежати від таких чинників, як Цю реакцію детально описують Т. W Greene et природа розчинника і вихідні речовини. Однак, al. [Protective Groups in Organic Synthesis, 494-653, взагалі кажучи, зручно здійснювати реакцію при (1999)]; опис її включений тут у вигляді посилання. температурі від, приблизно, 0°С до, приблизно, Нижченаведене ілюструє типові реакції, що вклю100°С. Час, необхідний для реакції, може також чають т-бутоксикарбонільну захисну групу. мінятися в широких межах, в залежності від багаРеакцію звичайно і переважно здійснюють в тьох чинників, особливо температури реакції, і присутності розчинника. Не існує особливих обмеприроди вихідних речовин і розчинника, що викожень на природу розчинника, що використовуєтьристовується. Однак, при умові, що реакцію здійсся, при умові, що він не чинить шкідливого впливу нюють в описаних вище переважних умовах, періна перебіг реакції або на включені реагенти, і здаод від, приблизно, 5 хвилин до, приблизно, 24 тний розчиняти реагенти, принаймні, до деякої годин, як правило, буде достатнім. міри. Приклади придатних розчинників включають, Стадія Н3 крім інших, воду, простий ефір, такий як діетилоНа цій стадії, сполуку формули (XXIII) отримувий ефір, діізопропіловий ефір, тетрагідрофуран і ють реакцією сполуки формули (XXII) з азидом діоксан; сульфоксид, такий як диметилсульфоксид натрію (Н3-а) з подальшим відновленням азидної і сульфолан. З цих розчинників тетрагідрофуран є групи (Н3-b). переважним. (Н3-а) реакція з азидом натрію: Реакцію здійснюють в присутності реагенту. Реакцію звичайно і переважно здійснюють в Не існує також особливих обмежень на природу присутності розчинника. Не існує особливих обмереагентів, що використовуються, і будь-який реажень на природу розчинника, що використовуєтьгент, що звичайно використовується в реакціях ся, при умові, що він не чинить шкідливого впливу цього типу, може бути тут однаково використаний. на перебіг реакції або на включені реагенти, і здаПриклади таких реагентів включають, крім інших, тний розчиняти реагенти, принаймні, до деякої ди-т-бутилкарбонат і 1-(тміри. Приклади придатних розчинників включають, бутоксикарбоніл)бензотриазол. З них ди-ткрім інших, галогеновані вуглеводні, такі як дихлобутилкарбонат є переважним. 33 86301 34 Реакція може протікати в широкому інтервалі У реакційній схемі І, кожний з R9 і R13 визначетемператур, і точна температура реакції не є виний вище, значальною для винаходу. Переважна температуСтадія l1 ра реакції буде залежати від таких чинників, як На цій стадії сполуку формули (XXIV) отримуприрода розчинника і вихідні речовини. Однак, ють взаємодією карбонільної групи комерційно взагалі кажучи, зручно здійснювати реакцію при доступної сполуки формули (XX), з триметилсилітемпературі від, приблизно, 0°С до, приблизно, лціанідом. 120°С. Час, необхідний для реакції, може також Реакцію звичайно і переважно здійснюють в мінятися в широких межах, в залежності від багаприсутності розчинника. Не існує особливих обметьох чинників, особливо температури реакції і прижень на природу розчинника, що використовуєтьроди вихідних речовин і розчинника, що викорисся, при умові, що він не чинить шкідливого впливу товується. Однак, при умові, що реакцію на перебіг реакції або на включені реагенти, і здаздійснюють в описаних вище переважних умовах, тний розчиняти реагенти, принаймні, до деякої період від, приблизно, 5 хвилин до, приблизно, 24 міри. Приклади придатних розчинників включають, годин, як правило, буде достатнім. крім інших, ароматичні вуглеводні, такі як бензол, (H4-b) Видалення захисту: толуол і нітробензол; галогеновані вуглеводні, такі Цей спосіб детально описаний в Т. W. Greene як дихлорметан, хлороформ, чотирихлористий et al., Protective Protective Groups in Organic вуглець і 1.2-дихлоретан; прості ефіри, такі як діеSynthesis, 494-653, (1999); цей опис включений тут тиловий ефір, діізопропіловий ефір, диметиловий у вигляді посилання. Нижченаведене ілюструє ефір етиленгліколю, тетрагідрофуран і діоксан; типовий спосіб, що включає участь бензоїльної нітрили, такі як ацетонітрил і бензонітрил; і спирти, захисної групи, в присутності комбінацій газоподітакі як метанол, етанол, пропанол, 2-пропанол і бного водню і каталізатора, такого як палабутанол. З них толуол є переважним. дій/вуглець або платина. Реакцію здійснюють в присутності реагенту. Реакцію звичайно і переважно здійснюють в Не існує також особливих обмежень на природу присутності розчинника. Не існує особливих обмереагентів, що використовуються, і будь-який реажень на природу розчинника, що використовуєтьгент, що звичайно використовується в реакціях ся, при умові, що він не чинить шкідливого впливу цього типу, може бути тут однаково використаний. на перебіг реакції або на включені реагенти, і здаПриклади таких реагентів включають, крім інших, тний розчиняти реагенти, принаймні, до деякої кислоти Льюїса, такі як BF3, АlСl3, FeCl3, AgCl, Znl2, міри. Приклади придатних розчинників включають, Fe(NO3)3, CF3SO3Si(CH3)3, Yb(CF3SO3)3 і SnCl4; крім інших, галогеновані вуглеводні, такі як дихлооснови, такі як СаО; прості ефіри, такі як 18-краунрметан, хлороформ, чотирихлористий вуглець і 6; кислоти, такі як смола Amberlite XAD-4. З них 1,2-дихлоретан; спирти, такі як метанол, етанол, Znl2 є переважним. пропанол, 2-пропанол і бутанол; і простий ефір, Реакція може протікати в широкому інтервалі такий як діетиловий ефір, діізопропіловий ефір, температур, і точна температура реакції не є витетрагідрофуран і діоксан. З цих розчинників мезначальною для винаходу. Переважна температутанол є переважним. ра реакції буде залежати від таких чинників, як Реакція може протікати в широкому інтервалі природа розчинника і вихідні речовини. Однак, температур, і точна температура реакції не є вивзагалі кажучи, зручно здійснювати реакцію при значальною для винаходу. Переважна температутемпературі від, приблизно, 0°С до, приблизно, ра реакції буде залежати від таких чинників, як 100°С. Час, необхідний для реакції, може також природа розчинника і вихідні речовини. Однак, мінятися в широких межах, в залежності від багавзагалі кажучи, зручно здійснювати реакцію при тьох чинників, особливо температури реакції і притемпературі від, приблизно, 0°С до, приблизно, роди вихідних речовин і розчинника, що викорис120°С. Час, необхідний для реакції, може також товується. Однак, при умові, що реакцію мінятися в широких межах, в залежності від багаздійснюють в описаних вище переважних умовах, тьох чинників, особливо температури реакції і приперіод від, приблизно, 5 хвилин до, приблизно, 24 роди вихідних речовин і розчинника, що викорисгодин, як правило, буде достатнім. товується. Однак, при умові, що реакцію Стадія l2 здійснюють в описаних вище переважних умовах, На цій стадії, сполуку формули (XXV) отримуперіод від, приблизно, 5 хвилин до, приблизно, 24 ють шляхом перетворення ціаногрупи сполуки годин, як правило, буде достатнім. формули (XXII) в аміногрупу. Реакцію можна здійСпосіб І снювати в умовах, аналогічних умовам, описаним Нижченаведене ілюструє отримання сполуки для стадії G1 способу G. формули (XIII), де R4 являє собою гідроксигрупу. Стадія І3 Реакційна схема І На цій стадії сполуку формули (Хlllа) отримують, захищаючи аміногрупи сполуки формули (XXV) і видаляючи захист. Реакцію можна здійснювати в умовах, аналогічних умовам, описаним для стадії Н4 способу Н. Сполуки формули (І), і інтермедіати з вищезазначених способів отримання можуть бути виділені і очищені по стандартних методиках, таких як очищення шляхом дистиляції, перекристалізації або хроматографії. 35 86301 36 Сполуки по винаходу, призначені для фарманені рідиною), жуйку, мульти- і наночастинки, гелі, цевтичного застосування, можуть бути введені в тверді розчини, ліпосоми, плівки (включаючи ті, що формі кристалічних або аморфних продуктів. Вони прилипають до слизової оболонки), овулі, аерозолі можуть. наприклад, бути отримані, у вигляді щільі рідкі препарати. ної маси, порошків, або плівок, такими способами, Рідкі препарати включають, наприклад, суяк осадження, кристалізація, ліофільне сушіння, спензії, розчини, сиропи і еліксири. Такі препарати розпилювальне сушіння і сушіння випарюванням. можуть бути використані у вигляді наповнювачів Для цих цілей можуть бути використані індукційне м'яких або твердих капсул і звичайно містять носушіння або радіочастотне сушіння. сій, наприклад, воду, етанол, поліетиленгліколь, Стандартні методики отримання/ізолювання пропіленгліколь, метилцелюлозу або придатне окремих енантіомерів включають хіральний синтез масло і один або декілька емульгуючих агентів з придатного оптично чистого попередника або і/або суспендуючих агентів. Рідкі препарати морозділення на складові рацемічної суміші (або ражуть також бути отримані шляхом відтворення з цемічної суміші солі або похідного), використовуютвердої речовини, наприклад, з саше з сухим лічи, наприклад, хіральну рідинну хроматографію карським засобом. високого тиску (HPLC). Сполуки по винаходу можна також використоАльтернативно, спосіб оптичного розділення вувати в лікарських формах, що швидко розчиняна складові рацемічної суміші (або рацемічного ються, що швидко розщеплюються, таких як лікарпопередника) може бути належним чином вибраські форми, описані в Expert Opinion in Therapeutic ний з стандартних методик, наприклад, селективPatents. 11(6), 981-986 Liang and Chen (2001). ної кристалізації, розділення діастереомерних соУ таблетованих лікарських формах, в залежлей між основною частиною сполуки формули (І) і ності від дози, лікарський засіб може складати від, відповідною оптично активною кислотою, такою як приблизно, 1% мас. до, приблизно, 80% мас. лівинна кислота. карської форми, більш звичайно, від, приблизно, Сполуки по винаходу, призначені для фарма5% мас. до, приблизно, 60% мас. лікарської форцевтичного застосування можуть бути введені у ми. У доповнення до лікарського засобу, таблетки вигляді кристалічних або аморфних продуктів. Возвичайно містять агент, що розщеплює. Приклади ни можуть бути отримані, наприклад, у вигляді агентів. що розщеплюють, включають натрійкрохщільної маси, порошків або плівок такими спосомальгліколат, натрій-карбоксиметилцелюлозу, бами, як осадження, кристалізація, ліофільне сукальцій-карбоксиметил целюлозу, кроскармелозушіння, розпилювальне сушіння або сушіння випанатрій. кросповідон, полівінілпіролідон, метилцерюванням. Для цих цілей може бути використане люлозу, мікрокристалічну целюлозу, заміщену ниіндукційне або радіочастотне сушіння. жчим алкілом гідроксипропілиелюлозу, крохмаль, Вони можуть бути введені самі по собі або в заздалегідь клейстеризований крохмаль і альгінат комбінації з однією або декількома іншими сполунатрію. Звичайно, агент, що розщеплює, буде ками по винаходу, або в комбінації з одним або складати від, приблизно, 1% мас. до, приблизно, декількома іншими лікарськими засобами (або у 25% мас, переважно, від приблизно, 5% мас. до, вигляді будь-якої їх комбінації). Звичайно, їх ввоприблизно, 20% мас. від лікарської форми. дять у вигляді фармацевтичної композиції або Зв'язувальні агенти звичайно використовують складу, разом з одним або декількома фармацевдля надання когезійних властивостей таблетоватично прийнятними носіями або наповнювачами. ному препарату. Придатні зв'язувальні агенти Термін "'носій'" або "'наповнювач" використовують включають мікрокристалічну целюлозу, желатин, тут для позначення будь-якого інгредієнта, який цукор, поліетиленгліколь, натуральні і синтетичні відрізняється від сполуки(к) по винаходу. Вибір смоли, полівінілпіролідон, заздалегідь клейстериносія або наповнювача буде у великій мірі залежазований крохмаль, гідроксипропілцелюлозу і гідроти від таких чинників, як конкретний вид введення, ксипропілметилцелюлозу. Таблетки можуть також вплив наповнювача на розчинність і стійкість, і містити розріджувачі, такі як лактозу (моногідрат природа лікарської форми. лактози, висушений спрей моногідрату лактози, Фармацевтичні композиції, придатні для досбезводну лактозу і тому подібне), маніт, ксиліт, тавки сполук за даним винаходом, і способи їх декстрозу, сахарозу, сорбіт, мікрокристалічну цеотримання будуть очевидні для фахівців в даній люлозу, крохмаль і дигідрат двоосновного фосфагалузі Такі композиції і способи їх отримання моту кальцію. жуть бути знайдеш, наприклад, Remington's Таблетки також можуть необов'язково містити Pharmaceutical Sciences', 19th Edition (Mack поверхнево-активні агенти, такі як лаурилсульфат Publishing Company, 1995) натрію і полісорбат 80, і агенти, що полегшують Оральне введення ковзання, такі як двоокис кремнію і тальк. ПоверхСполуки по винаходу можуть бути введені нево-активні агенти, у разі їх присутності, можуть орально. Оральне введення може включати ковскладати від, приблизно, 0,2% мас. до, приблизно, тання, так що сполука поступає в шлунково5% мас. від складу таблетки; а агенти, що полегкишковий тракт, або можна використовувати букашують ковзання, можуть складати від, приблизно, льне або сублінгвальне введення, внаслідок яких 0,2% мас. до, приблизно, 1% мас. від складу табсполука поступає в кровотік безпосередньо з роголетки. вого отвору. Препарати, придатні для орального Таблетки також звичайно містять мастильні введення, включають тверді препарати, такі як, речовини, такі як стеарат магнію, стеарат кальцію, наприклад, таблетки, капсули, що містять частинстеарат цинку, стеарилфумарат натрію, суміші ки, рідини або порошки, коржик (включаючи заповстеарату магнію з лаурилсульфатом натрію. Мас 37 86301 38 тильні речовини звичайно складають від, приблизгляді стерильних неводних розчинів або в сухій но, 0,25% мас. до, приблизно, 10% мас. переважформі для застосування разом з придатним носіно, від, приблизно, 0,5% мас. до, приблизно, 3% єм, таким як стерильна, апірогенна вода. мас. від складу таблетки. Отримання парентеральних препаратів в стеІнші можливі інгредієнти включають антиоксирильних умовах, наприклад, шляхом ліофілізації, данти, агенти, що забарвлюють, ароматизуючі може бути легко виконане, при використанні станагенти, консерванти і агенти, що маскують смак. дартних фармацевтичних методик, добре відомих Типові таблетки містять, приблизно, до, прибфахівцям в даній галузі. лизно. 80% лікарського засобу; від. приблизно, Розчинність сполук формули (І), що викорис10% мас. до, приблизно, 90% мас. зв'язувального товуються при отриманні парентеральних розчиагента; від приблизно. 0% мас. до. приблизно, 85% нів, може бути збільшена шляхом застосування мас. розріджувача; від приблизно, 2% мас. до, відповідних методик отримання препарату, таких приблизно, 10% мас. агента, що розщеплює; і, від, як включення агентів, що поліпшують розчинність. приблизно. 0,25% мас до, приблизно. 10% мас. Препарати для парентерального введення мастильної речовини. можуть бути сформовані для негайного і/або дозоДля утворення таблеток суміші для таблетуваного вивільнення. Препарати дозованого вивівання можуть бути безпосередньо спресовані або льнення включають препарати з уповільненим, ж спресовані за допомогою вальцювання. Суміші безперервним. імпульсним, контрольованим, надля таблетування або порції сумішей можуть бути правленим на мішень і програмованим вивільненальтернативно піддані гранулюванню за допомоням. Таким чином, сполуки по винаходу можуть гою вологого або сухого гранулювання або шлябути сформовані у вигляді твердих речовин, напівхом гранулювання розплаву; заморожування розтвердих речовин або тиксотропних рідин для ввеплаву, або екструдування перед таблетуванням. дення у вигляді імплантованого депо, що забезпеКінцевий препарат може містити один або декілька чує дозоване вивільнення активної сполуки. шарів і може бути покритий оболонкою або не покПриклади таких препаратів включають в себе покритий оболонкою; він навіть може бути інкапсуриті лікарським засобом стенти і PGLA мікросфельований. ри. Склад таблеток обговорюють в Місцеве введення "Pharmaceutical Dosage Forms: Tablets, Vol. 1." Η. Сполуки по винаходу можуть також бути ввеLieberman and L. Lachman, Marcel Dekker, N.Y., дені місцево на шкіру або слизову оболонку, тобN.Y., 1980 (ISBN 0-8247-6918-Х). то, дермально або трансдермально. Звичайні преТверді препарати для орального введення парати для цієї мети включають гелі, гідрогелі, можуть бути сформовані для негайного і/або дозолосьйони, розчини, креми, мазі, опудрювальні заваного вивільнення. Препарати дозованого вивісоби, пов'язки, піни, плівки, пластири на шкіру, льнення включають препарати з уповільненим, облатки, імплантанти, тампони, волокна, перев'ябезперервним, імпульсним, контрольованим, назочні матеріали і мікроемульсії. Також можуть бути правленим на мішень і програмованим вивільненвикористані ліпосоми. Звичайні носії включають ням. спирт, воду, мінеральне масло, рідкий вазелін, Придатні для цілей винаходу препарати з домедичний вазелін, гліцерин, поліетиленгліколь і зованим вивільненням описують в патенті США пропіленгліколь. Можуть бути включені промотори №6106864. Подробиці інших придатних способів проникнення, див., наприклад, J Pharm Sci. 88 (10), вивільнення, таких як способи, що використовують 955-958 by Finnin and Morgan (October 1999). високоенергетичні дисперсні системи, осмотичні Інші способи місцевого введення включають частинки і частинки, покриті оболонкою, потрібно доставку шляхом електропорації. лікарського елешукати в Verma et al, Pharmaceutical Technology ктрофорезу, фонофорезу, сонофорезу шляхом On-line, 25(2). 1-14 (2001). Застосування жувальної мікроголкових або безголкових (наприклад, гумки для досягнення контрольованого вивільненPowderject™, Bioject™ і так далі) ін'єкцій. ня описують в WO 00/35298. Препарати для місцевого введення можуть буПарентеральне введення ти сформовані для негайного і/або дозованого Сполуки по винаходу також можуть бути ввевивільнення. Препарати дозованого вивільнення дені прямо в кровотік, в м'яз або внутрішній орган. включають уповільнене, безперервне, імпульсне, Придатні способи парентерального введення контрольоване, програмоване вивільнення і вивівключають внутрішньовенне, внутрішньоартеріальнення, направлене на мішень. льне, внутрішньоочеревинне. інтратекальне, інВведення вдиханням/інтраназальне введення травентрикулярне, інтрауретральне, інтрастернаСполуки по винаходу також можуть бути ввельне, інтракарніальне, внутрішньом'язове і дені інтразально або інгаляцією. Звичайно вводять підшкірне введення. Придатні пристрої для парену вигляді сухого порошку (або окремого порошку у терального введення включають голку (включаючи вигляді суміші, наприклад, сухої суміші з лактозою, мікроголку), шприци, безголкові шприци і апаратуабо у вигляді частинок змішаного компонента, нару для інфузії. приклад, змішаного з фосфоліпідами, такими як Парентеральні препарати звичайно являють фосфатидилхолін), що розпилюється з інгалятора собою водні розчини, які можуть містити наповнюдля сухого порошку: або у вигляді аерозольної вачі, такі як солі, карбогідрати і буферні агенти рідини, що розпилюється з герметичного контей(переважно для рН від, приблизно, 3 до, приблизнера, розбризкувача, розпилювача, (переважно, но, 9). Але для деяких застосувань вони можуть розпилювача, для отримання легкого серпанку, що бути сформовані більш прийнятним чином, у вивикористовує електрогідродинамику), або небу 39 86301 40 лайзера, що використовує або не використовує помогою клапана, що дозволяє випускати дозовавідповідний пропелент, такий як 1,1,1,2ну кількість. Пристрої, відповідно до винаходу, тетрафторетан або 1,1,1,2,3,3,3-гептафторпропан. звичайно пристосовані для введення відміряної Порошок для інграназального застосування може дози або "пуфа", що містить від, приблизно, 1 до, містити біоадгезивний агент, наприклад, хітозан приблизно, 100мкг сполуки формули (І). Повна або циклодекстрин. добова доза буде, як правило, знаходитися в діаГерметичний контейнер, розбризкувач, розпипазоні, приблизно, від 50мкг до, приблизно, 20мг; лювач або небулайзер містять розчин або суспенця доза може бути введена в однократній дозі або зію сполуки(к) по винаходу, що містить, наприклад, частіше - в розділених дозах протягом дня. етанол, водний етанол, або придатний альтернаРектальне/інтравагінальне введення тивний агент для диспергування, солюбілізації, Сполуки по винаходу можуть бути введені рекабо пролонгованого вивільнення активного компотально або вагінально, наприклад, у вигляді супонента, пропелент(и) як розчинник і, необов'язково, зиторія, вагінального супозиторія або клізми. Масповерхнево-активну речовину, таку як сорбітантло какао є звичайною основою супозиторіїв, але риолеат, олеїнову кислоту або олігомолочну кисможуть бути використані різні альтернативні варілоту. анти як прийнятні. Перед застосуванням в сухому порошку або в Препарати для ректального/вагінального ввепрепараті у вигляді суспензії, лікарський продукт дення можуть бути сформовані для негайного дуже тонко подрібнюють до розміру, придатного і/або дозованого вивільнення. Препарати дозовадля доставки інгаляцією (звичайно менше за 5 ного вивільнення включають препарати з уповільмікрон). Це може бути досягнуте будь-яким відпоненим, безперервним, імпульсним, контрольовавідним способом подрібнення, таким як подрібним, направленим на мішень і програмованим нення на вихровому млині, подрібнення на струвивільненням. меневому млині з псевдозрідженим шаром, Очне/вушне введення обробкою надкритичним текучим середовищем з Сполуки по винаходу також можуть бути ввеутворенням наночастинок, гомогенізацією високим дені безпосередньо через око або вухо, звичайно тиском або розпилювальним сушінням. у вигляді крапель дуже дрібнодисперсної суспензії Капсули (виконані, наприклад. з желатину або або розчину в ізотонічному, відкоректованому по гідроксипропілметилцелюлози (НРМС)), блістери і рН, стерильному фізіологічному розчині. Інші презнімні блоки для застосування в інгаляторі або парати, придатні для введення через око або вухо, інсуфляторі можуть бути розроблені для утриманвключають мазі, здатні до біорозщеплення (наприня суміші порошків сполуки по винаходу, придатної клад, гелеві губки, що всмоктуються, колаген) і що основи порошку, гакої як лактоза або крохмаль і біологічно не розщеплюються (наприклад, силікон) модифікатора ефективності, такого як L-лейцин, імплантати, облатки, лінзи і системи макрочастиманіт або стеарат магнію. Лактоза може бути безнок або везикулярні системи, такі як ніосоми або водною або у вигляді моногідрату, що є переважліпосоми. Може бути включений такий полімер, як ним. Інші придатні наповнювачі включають декполівініловий спирт, зшита поперечними зв'язками стран, глюкозу, мальтозу, сорбіт, ксиліт, фруктозу, поліакрилова кислота, гіалуронова кислота, полісахарозу і трегалозу. мер целюлози, наприклад, гідроксипропілметилРозчин придатного складу для застосування в целюлоза, гідроксіетилцелюлоза. або метилцелюрозпилювачі, що використовує електрогідродиналоза, або полімер гетерополісахариду, наприклад, мику для отримання легкого серпанку, може містисмола з властивостями гелю, разом з таким конти від, приблизно. 1мкг до, приблизно, 20мг сполусервантом, як бензалконійхлорид. Такі препарати ки по винаходу, що припадає на один запуск; і також можуть бути доставлені за допомогою ліоб'єм одного запуску може мінятися від, приблизкарського електрофорезу. но, 1мкл до, приблизно, 100мкл. Типовий препарат Препарати дозованого вивільнення включають може містити сполуку формули (І), пропіленгліпрепарати з уповільненим, безперервним, імпульколь, стерильну воду, етанол і хлорид натрію. сним, контрольованим, направленим на мішень і Альтернативні розчинники, які можуть бути викопрограмованим вивільненням. ристані замість пропіленгліколю, включають гліцеІнші технології рин і поліетиленгліколь. Щоб поліпшити розчинність, швидкість розчиПридатні ароматизатори, такі як ментол і ленення, поліпшити смак, біодоступність і/або стійвоментол або підсолоджувачі, такі як сахарин або кість при використанні в будь-якому з вказаних натрійсахарин, можуть бути додані до препаратів вище способів введення сполук по винаходу, вони по винаходу, призначених для введення інгаляціможуть бути об'єднані з розчинними макромолекуєю/інтраназального введення. Препарати для ввелярними частинками, такими як циклодекстрин і дення інгаляцією/інтраназального введення мойого придатні похідні або полімери, що містять жуть бути сформовані для негайного і/або поліетиленгліколь. дозованого вивільнення, використовуючи, наприВиявлено, наприклад, що комплекси лікарськлад, полі(DL-молочну-ко-гліколеву) кислоту ких засобів з циклодекстрином звичайно виявля(PGLA). Препарати дозованого вивільнення вклюються застосовними для більшості лікарських чають препарати з уповільненим, безперервним, форм і шляхів введення. Можуть бути використані імпульсним, контрольованим, направленим на як комплекси включення, так і комплекси, що не мішень і вивільненням, що програмується. відносяться до комплексів включення. Як альтерУ разі інгаляторів для сухих порошків і аерозонатива прямому комплексоутворенню з лікарським лів, стандартну лікарську дозу визначають за дозасобом, циклодекстрин може бути використаний 41 86301 42 як додаткова добавка, тобто, як носій, розріджувач (і) Антагоністів гістамінового Н2 рецептора, наабо солюбілізатор. Найчастіше для цих цілей виприклад, ранітидину. лафутидину, нізатидину, сикористовують альфа-, бетаі гаммаметидину, фамотидину і роксатидину; циклодекстрини, приклади яких можна знайти в (іі) Блокаторів протонової помпи, наприклад, WO 91/11172. WO 94/02518 і WO 98/55148. омепразолу, есомепразолу, пантопразолу, рабепНабір компонентів разолу, тенатопразолу, ілапразолу і лансопразолу: У зв'язку з тим, що може виявитися бажаним (ііі) Блокаторів кислотного насоса, наприклад, ввести комбінацію активних сполук, наприклад, з сорапразану, ревапразану (YH-1885), AZD-0865, метою лікування певної хвороби або стану, об'єм CS-526, AU-2064 і YJA-20379-8: даного винаходу включає дві або більше фарма(iv) Оральних сумішей антацидних засобів, нацевтичних композицій, принаймні, одна з яких місприклад, Маалокс®, Алдурокс® і Гавіскох®; тить сполуку по винаходу, які можуть бути зручно (ν) Агентів, що захищають слизову оболонку, об'єднані у вигляді набору, придатного для спільнаприклад, полапрецинку, екабету натрію, ребаміного введення композицій. піду, тепренону, цетараксату, скуралфату, хлопіТаким чином, набір по винаходу включає дві лін-копе і плаунотолу: або більше окремих фармацевтичних композиції, (vi) Агоністів ГАМКв (GABAB), наприклад, бакпринаймні, одна з яких містить сполуку формули лофену і AZD-3355; (І) по винаходу, і засоби для того, щоб зберігати (vii) Агоністів a2, наприклад, клонідину, медевказані композиції нарізно, такі як контейнер, розтомідину, лофексидину, моксонідину, тіазинідину, ділений на частини флакон або розділений на часгуанфасину. гуанабензу, таліпексолу і дексмедетини пакет з фольги. Приклад такого набору добре томідину; відомий, це блістерна упаковка, що використову(viii) Похідних ксантину, наприклад, теофіліну, ється для упаковки таблеток, капсул і тому подібамінофіліну і доксофіліну; ного. (іх) Блокаторів кальцієвих каналів, наприклад, Набір по винаходу, зокрема, застосовний для аранідипіну, ласидипіну. фалодипіну, азелінідипівведення різних лікарських форм, наприклад, орану, клінідипіну, ломеризину, дилтіазему, галопамільних і парентеральних, для введення окремих лу, ефонідипіну, нізолдипіну, амлодипіну, лерканікомпозицій з різними інтервалами дозування, або дипіну, бевантололу, нікардипіну, ізрадипіну, для титрування окремих композицій іншими комбенідипіну, верапамілу, нітрендипіну, бамідипіну, позиціями. На допомогу виконанню, набір звичайпропафенону. манідипіну, бепридилу, ніфедипіну, но містить інструкції для введення і може бути занілвадипіну, німодипіну, і фазудилу; безпечений, так званою, «пам'яткою». (х) Агоністів бензодіазепіну, наприклад, діазеДозування паму, залеплону, золпідему, галоксазоламу, клоВ залежності від способу введення, повна доназепаму, празепаму, квазепаму, флутазоламу, бова доза сполуки по винаходу, призначена для триазоламу, лорметзепаму, мідазоламу, тофізовведення людині, звичайно знаходиться в діапапаму, клобазаму, флунітразепаму і флутопразезоні від, приблизно, 0,05мг до. приблизно, 100мг; паму; переважно в діапазоні від, приблизно, 0,1мг до, (хі) Аналогів простагландину, наприклад, просприблизно, 50мг; і, більш переважно, в діапазоні тагландину, мізопростолу, трепростинілу, езопросвід, приблизно, 0,5мг до, приблизно, 20мг. Напритенолу, латанопросту, ілопросту, берапросту, енпклад, для орального введення може бути потрібна ростилу, ібудиласту і озагрелю; повна добова доза від, приблизно, 1мг до, прибли(хіі) Агоністів гістаміну Нз, наприклад, Rзно, 20мг. тоді як для внутрішньовенної дози може альфа-метилгістаміну і ВР-294; бути потрібним тільки від, приблизно, 0,5мг до, (хііі) Протигастритних агентів, наприклад, анприблизно, 10мг. Повна добова доза може бути тигастритної вакцини, ітриглуміду і Z-360: введена в однократній дозі або розділених дозах. (xiv) Антагоністів 5-НТ3, наприклад, доластеЦе дозування засноване на розрахунках для рону. палоностерону. алостерону, азастерону, середнього хворого, що має масу від, приблизно, рамостерону, мітразипіну, граністерону, тропісте65кг до, приблизно, 70кг. Лікар буде в змозі легко рон)-, Е-3620, онданстерону і індистерону; підібрати дози для суб’єктів, чия маса виходить за (xv) Трициклічних антидепресантів, наприклад, межі діапазону, таких як діти і люди похилого віку. імпіраміну, амітриптиліну, кломіпраміну, амоксапіЯк обговорювали вище, сполука по винаходу ну і лофепраміну; демонструє агоністичну активність по відношенню (xvi) Агоністів ГАМК, наприклад, габапентину, до 5-НТ4. Агоніст 5-НТ4 за даним винаходом можна топірамату, цинолазепаму, клоназепаму, прогабізручно об'єднати, принаймні, ще з одним фармаду, бротизоламу, зопіклону. прегабаліну і есзопіккологічно активним агентом або сполукою, зокрелону; ма, при лікуванні рефлюксної гастроезофагеаль(xvii) Опіоїдних анальгетиків, наприклад, морної хвороби. Наприклад, 5-НТ4 агоніст, зокрема, фіну, героїну, гідроморфону, оксиморфону, левосполука формули (І) або її фармацевтично прийнрфанолу, левалорфану, метадону, меперидину, ятні сіль або сольват, визначені вище, можуть буфентанілу, кокаїну, кодеїну, дигідрокодеїну, оксити введені спільно, послідовно або окремо, при кодону, гідрокодону, пропоксифену, налмефену, введенні в комбінації з одним або декількома фаналорфіну, налоксону, налтрексону, бупренорфірмакологічно активними агентами, що вибираютьну, буторфанолу, налбуфіну, і пентазоцину; ся з: (xviii) Аналогів соматостатину, наприклад, октреотиду, AN-238 і PTR-3173; 43 86301 44 (хіх) Активатора хлорних каналів: наприклад, GR113808 (Amersham. остаточно 0,2нМ) і 150мкл лубіпростону; мембранного гомогенату і розчинів суспензії WGA(хх) Інгібіторів селективного повторного поглиSPA гранул) (Amersham) (10мкг білка і 1мг SPA нання серотоніну, наприклад, сертраліну, есцитагранул/ямку) (WGA-аглютиніни пшеничного зародлопраму, флуоксетину, нефазодону, флавоксаміка; SPA-антигенний комплекс, що захищає строну, циталопраму, мілнашшрану, парооксетину, му). Неспецифічне зв'язування визначали при кінвенлафаксину, трамадолу, сибутораміну. дулоксецевій концентрації з допомогою 1мкМ GR113808 тину, десвенлафаксину і дапоксетину; (Tocris). Інкубування припиняли центрифугуванням (ххі) Антихолінергічних засобів, наприклад, при 1000об./хв. дицикломіну і хіосциміну; Радіоактивність, пов'язану з рецептором, ви(ххіі) Проносних засобів, наприклад, трифіба®, значали кількісно шляхом підрахунку за допомофібогель®, консил®, ізогель®, регулан®, клевак® і гою планшетного лічильника Бета-частинок нормакол®; (Wallac). Всі сполуки прикладів демонстрували (ххііі) Волокнистих продуктів, наприклад, Меафінітет до 5НТ4 рецептора. тамуцил®; Зв'язування(2) людського 5-НТд рецептора (xxiv) Протисудомних засобів, наприклад: меОтримували клітини НЕК293 трансфіковані беверину: людським 5-HT4(d), і вирощували (in-house). Зібрані (xxv) Антагоністів допаміну. наприклад, метокклітини суспендували в 50мМ Трис-буфера (рН 7,4 лопраміду, домперидону і левосульпіриду; при 4°С), збагаченого сумішшю інгібіторів протеаз, (xxvi) Холіноміметиків. наприклад, неостигміну (Boehringer, розбавлення 1:1000), протягом 30сек. (xxvii) Інгібіторів AChE, наприклад, галантамігомогенізували на льоду, використовуючи виведену, мегрифонату, ривазтигміну, ітоприду і донепений на повну потужність ручний комплект для подзилу; рібнення Polytron PT 1200. Гомогенати центрифу(xxviii) антагоністів Тахікініну (NK), зокрема, гували при 40000xg, при 4°С протягом 10хв. Потім антагоністів NK-3. NK-2 і NK-1, наприклад, непадуосади ресуспендували в 50мМ Трис-буфера) (рН танту, саредутанту і таланетанту, 7,4, при 4°С) і центрифугували ще раз аналогічним чином. Кінцеві осади ресуспендували у відповід(aR,9R)-7-[3,5-біс(трифторметил)бензил]ному об'ємі, з 50мМ Трис-буфера (рН 7,4, при 8,9,10,11-тетрагідро-9-метил-5-(4-метилфеніл)-7Н25°С), що містить 10мМ MgCl2, гомогенізували, [1,4]діазоціано[2,1-g][1,7]нафтридин-6-13-діону розливали по аліквотах і зберігали до застосуван(ТАК-637) ня при -80°С. Аліквоту мембранних фракцій вико5-[[(2R,3S)-2-[(1R-1-[3,5ристовували для визначення концентрації білка, біс(трифторметил)феніл]етокси-3-(4-фторфеніл)використовуючи набір (PIERCE) для протеїнової 4-морфолініл]метил]-1,2-дигідро-3Н-1,2,4-триазолВСА проби і ARVOsx планшетний рідер (Wallac). 3-ону (МК-869), ланепітанту, дапітанту і Для експериментів по зв'язуванню, 50мкл спо3-[[2-метокси-5луки, що тестується, протягом 60 хвилин при кім(трифторметокси)феніл]метиламіно]-2натній температурі інкубували з [3Н] 5-НТ фенілпіперидину (2S,3S) (Amersham, остаточно 8,0нМ) і 400мкл мембранноСпосіб визначення біологічної активності: го гомогенату (300мкг білок/пробірка). НеспецифіАфінітет зв'язування сполук по винаходу з 5чне зв'язування визначали при кінцевій концентНТ4 рецептором встановлюють за допомогою нижрації з допомогою 50мкМ GR113808 (Tocris). ченаведених процедур. Інкубацію припиняли швидким фільтруванням у Зв'язування (1) людського 5-НТ4 рецептора вакуумі через просочений 0,2% РЕІ (поліетиленіОтримували клітини НЕК293, трансфіковані мін) фільтрувальний папір з скловолокна, викорислюдським 5-HT4(d), і вирощували (in-house). Зібратовуючи колектор клітин BRANDEL, з подальшим ні клітини суспендували в 50мМ HEPES (N-2триразовим промиванням 50мкМ Трис-буфером гідроксіетилпіперазин-N-2-етансульфонова кисло(рН 7,4, при 25°С). Радіоактивність, пов'язану з та) (рН 7,4, при 4°С), збагаченому сумішшю інгібірецептором, визначали кількісно, підраховуючи торів протеаз (Boehringer, розбавлення 1:1000), і сцинтиляції рідини, за допомогою лічильника протягом 30сек гомогенізували на льоду, викорисPackard LS Всі сполуки прикладів демонстрували товуючи виведений на повну потужність ручний афінітет до 5НТ4 рецептора. комплект для подрібнення Polytron PT 1200. ГомоІндуковане агоністом збільшення цАМФ генати 30хв. центрифугували при 40000xg. при (сАМР) в клітинах НЕК293 трансфікованих людсь4°С. Потім осади ресуспендували в 50мМ HEPES ким 5-НТ4(d) (рН 7,4, при 4°С), і центрифугували ще раз аналоКлітини ІІЕК293, трансфіковані людським 5гічним чином. Кінцеві осади ресуспендували у відHT4(d) отримували (in-house). Клітини вирощували повідному об'ємі, що містить 50мМ HEPES (рН 7,4, в DMEM (модифіковане по Дульбекко середовище при 25°С), гомогенізували, розливали по аліквотах Ігла) при 37°С і 5% вмісті СО2, збагаченому 10% і зберігали до застосування при -80°С. Аліквоту FCS (фетальна теляча сироватка), 20мМ HEPES мембраннних фракцій використовували для ви(рН 7,4), 200мкг/мл гігроміцину В (Gibco), 100 одизначення концентрації білка, використовуючи наниць/мл пеніциліну і 100мкл/мл стрептоміцину. бір (PIERCE) для протеїнової ВСА (бичачий сироКлітини вирощували до 60-80% моношару. У ватковий альбумін) проби і ARVOsx планшетний день, попередній лікуванню сполуками, діалізоварідер (Wallac). ну FCS (Gibco) замінювали на нормальну; і клітини Для експериментів по зв'язуванню, 25мкл споінкубували протягом ночі. Сполуки отримували в луки, що тестується, протягом 60 хвилин при кім96-ямкових планшетах (12,5мкл/ямку). Клітини натній температурі інкубували з 25мкл [HJ 45 86301 46 збирали з допомогою суміші PBS (фосфатнососкорочення. Тканини потім піддавали впливу 1мкМ льовий буферний розчин)/1мМ EDTA (етилендіа5-НТ (це повинно було служити затравкою для мінтетраоцтова кислота), центрифугували і прорелаксації тканин). У відповідь на 5-НТ тканини мивали PBS. На початку досліду, клітинний осад різко релаксували, протягом 1 хвилини. Як тільки повторно ресуспендували в DMEM, збагаченому наступала максимальна релаксація, і вимірювання 20мМ HEPES, 10мкМ паргіліну (Sigma) і 1мМ 3були зняті, тканини промивали з максимальною ізобутил-1-метилксантину (Sigma) при концентрашвидкістю (66мл/хв.), протягом не менш, ніж 1 ції 1,6x105 клітин/мл і залишали на 15 хвилин при хвилина, поки не відновлювався базовий рівень, кімнатній температурі. Реакцію ініціювали додащо передував впливу карбохоліну і 5-НТ (звичайванням клітин в планшети (12,5мкл/ямку). Після но, базовий рівень опускається нижче вихідного інкубації протягом 15 хвилин при кімнатній темперівня, після чого підіймається до рівня первинного ратурі, додавали 1% Triton X-100, для того, щоб урівноваження. Швидкість течії, що задається назупинити реакцію (25мкл/ямку); і планшети залисосом, знижували до 2мл/хв., і тканини залишали шали на 30 хвилин при кімнатній температурі. Дена 60 хвилин. тектування цАМФ на основі однорідної з розрізКомулятивна крива ефекту концентрацій ненням за часом флуоресценції (HTRF) (по (СЕС) 5-НТ була побудована для діапазону від Шерінгу) здійснювали, відповідно до інструкції ви0,1нМ до 1мкМ, з кроком 0,5 log, (5-НТ крива 1 для робника. Для вимірювання HTRF використовували аналізу даних). Час контакту між дозами становив лічильник ARVOsx для мультиміток (Wallac) (збу3 хвилини, або до моменту встановлення плато. дження 320нм, випромінювання 665нм/620нм, час При зростанні концентрації 5-НТ в кюветі реакція запізнення 50мкс. часове вікно 400мкс). Дані анатканин у відповідь прискорювалася. У кінці кривої, лізували на основі співвідношення інтенсивності тканини промивали (при максимальній швидкості) флуоресценції кожної ямки при 620нм і 665нм з з максимально можливою швидкістю, для уникподальшим кількісним визначенням цАМФ, виконення десенсибілізації рецепторів. Швидкість течії, ристовуючи стандартну криву по цАМФ. Збільшенщо задається насосом, знижували до 2мл/хв., і ня продукції нАМФ, що виявляється кожною спозалишали тканини на 60 хвилин. лукою, нормували до кількості цАМФ, що Другу СЕС отримували - або по відношенню продукується 1000 нМ серотоніну (Sigma). Всі сподо 5-НТ (для контролю тканин у часі), по віднолуки прикладів демонструють агоністичну актившенню до ще одного агоніста 5-НТ4 (стандарт) або ність по відношенню до 5НТ4 рецептора. по відношенню до сполуки, що тестується (крива 2 Функціональна проба на ТММ для аналізу даних). Час контакту інших агоністів 5У літературі повідомляли про присутність 5НТ4 і сполуки, що тестується, варіювали і пристоНТ4 рецепторів в стравоході щура і здатність пресовували до індивідуальних реакцій у відповідь парату ТММ виявляти частковий агонізм [див.: тканин на кожного конкретного агента. У тканини, G.S. Baxter et al. Naunyn-Schmiedeberg's Arch що піддаються впливу сполуки, що тестується, Pharmacol (1991) 343: 439-446: M. Yukiko et al. після отримання останньої концентрації сполуки, JPET (1997) 283: 1000-1008; і J.J. Reeves et al. Br. що тестується, додавали в кювету високу концентJ. Pharmacol. (1991) 103: 1067-1072)]. Більш конкрацію (1мкМ) антагоніста 5-НТ4 (SB203186: 2-(1ретно, часткова агоністична активність може бути піперидиніл)етиловий ефір 1Н-індол-3-карбонової виміряна по нижченаведених методиках. кислоти, Tocris). Це було зроблено, щоб зрозуміти, Самців SD (з порушенням розподілу хромочи може бути звернена будь-яка релаксація (якщо сом) щурів (Charles River) з масою 250-350г оглувона мас місце), що індукується агоністом. Звершували і потім вбивали шляхом цервікального нення 5-НТ індукованої релаксації з допомогою SB зміщення. Стравохід вилучали, починаючи від 203186 відновлює первинний ступінь тонусу ткашлунка (включаючи ділянку шлунка, щоб маркуванини, що індукується карбохоліном. ти дистальний кінець стравоходу) до рівня трахеї, і Агоністичну активність сполук, що тестуються, потім вміщували в свіжий розчин Кребса. підтверджували за допомогою попереднього інкуЗовнішній шар скелетних м'язів видаляли за бування тканин з 100нМ стандартного антагоніста один раз шляхом відшарування від шару гладкого 5НТ4. такого як SB 203186. За 5 хвилин до додам'яза, що лежить нижче, використовуючи пінцет (у вання карбохоліну, перед побудовою кривої 2 в напрямі від шлунка до трахеї). Внутрішня трубка, кювету додавали SB 203186. Для аналізу даних що залишалася, утворена гладкою мускулатурою, тканини повинні складати пару; тобто, порівнювавідома як ТММ. її відмірювали до 2см від залишели сполуку, що тестується, при відсутності SB ного «шлункового кінця», і інше видаляли. 203186 в одній тканині, із сполукою, що тестуєтьЗ ТММ був зроблений препарат, у вигляді пося, в присутності SB 203186 в окремій тканині. Не вністю відкритих трубок в поздовжній орієнтації, в було можливості здійснити криву 3, тобто. 5-НТ 5мл органній кюветі, заповненій теплим (32°С) криву 1. з подальшою побудовою кривої 2 для аерованим розчином Кербса. Тканини вміщували в сполуки (-SB 203186), що тестується, з подальшою умови вихідного натягу в 750мг і залишали на 60 побудовою кривої 3 для сполуки (+SB 203186), що хвилин для урівноваження. Під час урівноваження тестується. Всі сполуки прикладів демонструють тканини двічі повторно розтягували з інтервалами агоністичну активність 5НТ4 рецептора. в 15 хвилин. Протягом цього часу швидкість течії, Зв'язування людського дофетиліду що задається насосом, встановлювали на 2мл/хв. Отримували клітини HEK293S, трансфіковані Після встановлення рівноваги насос вимикали. людським HERG, і вирощували (in-house). Зібрані Тканини піддавали впливу 1мкМ карбохоліну і стиклітини суспендували в 50мМ Трис-НСІ (рН 7,4 при скали, і за 15 хвилин досягали плато стабільного 4°С) і гомогенізували на льоду, використовуючи 47 86301 48 ручний комплект для подрібнення Polytron PT середнє для 2 вкладок. Цілісність моношару ви1200, виведений на повну потужність. Гомогенати значали по переносу Люцеферового Жовтого. центрифугували при 48000xg, при 4°С протягом Період напіввиведення в мікросомах людської 20хв. Потім осади ресуспендували, гомогенізували печінки (HLM) і центрифугували ще раз аналогічним чином. КінСполуки, що тестуються (1мкМ), інкубували з цеві осади ресуспендували у відповідному об'ємі 3,3мМ MgCl2 і 0,78мг/мл HLM (НL101) в 100мМ 50мМ Трис-НСІ, 10мМ КСl, 1мМ MgCl2 (рН 7,4, при калійфосфатного буфера (рН 7,4) при 37°С в 964°С), гомогенізували, розливали по аліквотах і ямковому планшеті з глибокими ямками. Реакційну зберігали до застосування при -80°С. Аліквоту суміш розділяли на дві групи, група Р450 і група мембранних фракцій використовували для визна«не Р450». НАДФ (NADP) додавали тільки в реакчення концентрації білка, використовуючи набір ційну суміш групи Р450 група. Аліквоту зразків гру(PIERCE) для протеїнової ВСА проби і ARVOsx пи Р450 збирали на часових точках: 0, 10, 30, і планшетний рідер (Wallac). 60хв., де 0хв. відповідає точці, що вказує час доПроби на зв'язування виконували в загальнодавання НАДФ в реакційну суміш групи Р450. Аліму об'ємі, що становить 200мкл, в 96-ямкових квоту зразків групи «не Р450» збирали на часових планшетах. Двадцять мкл сполук, що тестуються, точках: -10 і 65хв. Зібрані аліквоти екстрагували інкубували з 20 мкл [ΉΙ-дофетиліду (Amersham, розчином ацетонітрилу, що містить внутрішній остаточно, 5нМ) і 160мкл мембранного гомогенату стандарт Осаджений білок центрифугували в (25мкг білка) при кімнатній температурі протягом центрифузі (2000об./хв., 15хв.). Концентрацію спо60 хвилин. Неспецифічне зв'язування визначали луки в надосадовій рідині вимірювали за допомопо 10мкМ дофетиліду в кінцевій концентрації. Інкугою системи РХ/МС/МС. бацію припиняли швидким фільтруванням у вакуВеличину періоду напіввиведення отримували умі над попередньо просоченим 0,5% GF/B фільтшляхом побудови графіка залежності від часу наром Betaplate, використовуючи колектор клітин турального логарифма відношення площі піка Skatron з 50мМ Трис-НСІ. 10мМ КСl, 1мМ MgCl2, сполуки до площі піка внутрішнього стандарту. (рН 7,4, при 4°С). Фільтри сушили, вміщували в Нахил лінії кращого підбору для всіх точок дає пакети для зразків і заповнювали складом швидкість метаболізму (k), яку перетворювали у Betaplate Scint. Радіоактивність, пов'язану з фільтвеличину періоду напіввиведення, використовуючи ром, рахували за допомогою лічильника Wallac нижченаведене рівняння: Betaplate. Період напіввиведення=1n 2/к Проникність Сасо-2 Приклади Проникність Сасо-2 вимірювали способом, Винахід ілюструють нижченаведеними прикописаним в Shiyin Yee, Pharmaceutical Research, ладами, що не обмежують рамки винаходу, в яких 763 (1997). всі операції здійснювали, якщо не обумовлено Сасо-2 клітини вирощували на підкладках фіінакше, при кімнатній температурі або температурі льтра (Falcon HTS система багатоямкових вкланавколишнього середовища, тобто, в діапазоні 18док) протягом 14 днів. Культуральне середовище 25°С; випаровування розчинника здійснювали, видаляли з обох, апікального і базолатерального, використовуючи роторний випарник при зниженовідділень; і протягом 0,5 години моношари преінму тиску з температурою бані, що доходить до кубували при 37°С на вібруючій водяній бані, при 60°С; реакції контролювали з допомогою тонкоша50 циклах/хв. із заздалегідь нагрітими 0,3мл апікарової хроматографії (TLC), і часи реакції наведені льного буфера і 1,0мл базолатерального буфера. тільки для ілюстрації; наведені точки плавлення Апікальний буфер складався із збалансованого (т.пл.) не відкоректовані (поліморфізм може присоляного розчину Hanks, 25мМ моногідрату Dвести до точок плавлення, що відрізняються); глюкози, 20мМ біологічного буфера MES, 1,25мМ структура і чистота всіх виділених сполук гарантоСаСl2 і 0,5мМ MgCl2 (pH 6,5). Базолатеральний вані, принаймні, одним з нижченаведених методів: буфер складався із збалансованого соляного розТШХ (пластинки ТШХ, заздалегідь покриті Merck чину Hanks. 25мМ моногідрату D-глюкози. 20мМ силікагелем 60F254, або пластинки ТШХ. заздалеHEPES біологічного буфера, 1,25мМ СаСl2 і 0,5мМ гідь покриті Merck NH2 гелем (силікагелем з амінMgCl2 (pH 7,4). У кінці преінкубування середовище ним покриттям)Р254s), мас-спектрометрією, спектвидаляли, і в апікальне відділення додавали розрами ядерного магнітного резонансу (ЯМР), чин (10мкМ) сполуки, що тестується, в буфері. інфрачервоними спектрами поглинання (ІЧ) або Вкладки переміщували в ямки, що містять свіжий мікроаналізом. Виходи наведені тільки з ілюстрабазолатеральний буфер, на 1 годину. Концентративними цілями. Обробку за допомогою катіонооцію лікарського засобу в буфері вимірювали за бмінної колонки здійснювали, використовуючи знідопомогою РХ/МС аналізу. мний блок SCX (Varian BondElute), який Швидкість магнітного потоку (F, маса/час) разаздалегідь обробляли метанолом. Колонкову хували по нахилу комулятивної появи субстрату на флеш-хроматографію здійснювали, використовуприймальній стороні; і коефіцієнт істинної проникючи Merck силікагель 60 (63-200мкм), Wako силіканості (Рарр) рахували по нижченаведеному рівнянгель 300HG (40-60 мкм), Fuji Silysia NH гель (силіню. кагель з амінним покриттям) (30-50мкм). Biotage KP-SIL (32-63мкм) або Biotage AMINOSILICA (силіРарр (см/сек.)=(F·VD)/(SA·MD), кагель з амінним покриттям) (40-75мкм). Препараде SA являє собою площу поверхні переносу тивну ТШХ здійснювали, використовуючи ТШХ (0,3см2), VD являє собою поданий об'єм (0,3мл), пластинки, заздалегідь покриті Merck силікагелем MD є повною кількістю лікарського засобу на по60F254 (0,5 або 1,0мм товщини). Дані по масдаючій стороні при t=0. Всі дані являють собою 49 86301 50 спектрах низького розрізнення (ЕІ) отримували на ли у вакуумі для отримання 19,0г (57%) вказаної в мас-спектрометрі безперервної дії (Waters). Дані заголовку сполуки у вигляді білого кристала. 1 по мас-спектрах низького розрізнення (електроноН-ЯМР (CDCІ3) δ: 3,96 (2Н, дт, J=3,9Гц, розпилювальна іонізація) (ESІ) отримували на 12,3Гц), 3,73 (2Н, дт, J=2,6Гц, 12,3Гц), 2,20-1,94 ZMD™ або ZQ™ (Waters) і мас-спектрометрі. Дані (4Н, м). 1,52 (9Н, с). ЯМР отримували в мільйонних частках (м.ч.) при Стадія 2. трет-Бутил-4270МГц (спектрометр JEOL JNM-LA 270), 300МГц (амінометил)тетрагідро-2Н-піран-4-карбоксилат (спектрометр JEOL JNM-LA 300) або 600МГц (спеСуміш трет-бутил-4-ціанотетрагідро-2Н-піранктрометр Bruker A VANCE 600). якщо не обумов4-карбоксилату (18,95г, 0,0897моль, стадії 1 приклено інакше, використовуючи як розчинник дейтеладу 1) і Ni Ренея (1,00г) в метанолі (200мл) гідруровані хлороформ (99,8% D) або вали (3 атм.) при кімнатній температурі протягом диметилсульфоксид (99,9% D) відносно тетраме12 годин. Потім, суміш фільтрували через подушку тилсилану (ТМС) як внутрішнього стандарту; викоцеліту, і фільтрат концентрували у вакуумі для ристовували стандартні скорочення: с = синглет, д отримання 16,01г (83%) вказаної в заголовку спо= дублет, т = триплет, кв = квартет, квінт = квінтет, луки у вигляді жовтого сиропу. 1 H-ЯМР(CDCl3) δ: 3,86 (2Н, дт, J=4,1Гц, 11,4 м = мультиплет, ш. = широкий і так далі. ІЧ спектри Гц), 3,48 (2Н, дт, J=2,5 Гц, 11,5 Гц). 2,75 (2Н, с), отримували на інфрачервоному спектрометрі з 2,03 (2Н, шир. д, J=10,7 Гц), 1,55-1,35 (13Н, м, Фурьє перетворенням (Shimazu FTIR-8300). Повключаючи 9Н, с, 1,49 м.ч.). рошкові рентгенограми (PXRD) отримували, викоСтадія 3. трет-Бутил-4-[(4-оксопіперидин-1ристовуючи рентгенівський порошковий дифракіл)метил]тетрагідро-2Н-піран-4-карбоксилат тометр Rigaku RINT-TTR, забезпечений До киплячої із зворотним холодильником суавтоматичним пристроєм зміни зразка, гоніометміші трет-бутил-4-(амінометил)тетрагідро-2Нром для вимірювання кутів від 2 тета до тета, щіпіран-4-карбоксилату (8,00г, 0,0372моль, стадії 2 линами для пучка, що розходиться, допоміжним прикладу 1) і К2СО3 (0,51г, 0,0372моль) в суміші монохроматором і сцинтиляційним лічильником. етанол/Н2О (2:1, 240мл) по краплях додавали 1 Зразок готували до аналізу, упаковуючи порошок в етил-1-метил-4-оксопіперидиніййодид [12,0г, алюмінієвий тримач зразка. Зразок обертали з 0,0445моль. J. Org. Chem. 1995, 60, 4324] в суміші швидкістю 6000об./хв., і розгортку проводили з етанол/Н2О (2:1, 150мл); і при тій же температурі швидкістю 4°/хв. при кімнатній температурі при отриману суміш перемішували 1 годину. Після випромінюванні Сu-Кa. Хімічні символи мають охолоджування до кімнатної температури, розчинсвоє звичайне значення; т.к. (точка кипіння), т.пл. ник видаляли у вакуумі. Залишок вливали в наси(точка плавлення), л (літр(и)), мл (мілілітр(и)), г чений водний розчин NaHCO3 (200мл), і суміш екс(грам(и)), мг (міліграм(и)), моль (молі), мМоль (мітрагували СН2Сl2 (200млх3). Екстракти сушили лімолі), екв. (еквівалент(и)), кільк., (кількісний винад Na2SO4, фільтрували і концентрували. Осад хід). хроматографували на колонці з силікагелем, елюПриклад 1 юючи сумішшю гексан/етилацетат (від 3:1 до 2:1), 4-{[4-({[2'-оксоспіро[циклопентан-1,3¢-індол]щоб отримати 10,77г (98%) сполуки, вказаної в 1'(2'H)-іл)карбоніл]аміно}метил)піперидин-1заголовку, у вигляді безбарвного сиропу. іл]метил}тетрагідро-2Н-піран-4-карбонова кислота МС (ESI) m/z: 298 (М+Н)+. 1 H ЯМР (CDCl3) δ 3,84 (2Н, шир. д, J=11,4 Гц), 3,50 (2Н, дт, J=2,0 Гц, 11,7 Гц), 2,85 (4Н. т, J=5,9 Гц), 2,61 (2H, с), 2,39 (4Н, т, J=6,1 Гц), 2,05 (2Н, д, J=11,5 Гц), 1,75-1,45 (11Н, м, включаючи 9Н. с, 1,49 м.ч.). Стадія 4. трет-Бутил-4-[(4-ціанопіперидин-1іл)метил|тетрагідро-2Н-піран-4-карбоксилат Стадія 1. трет-Бутил-4-ціанотетрагідро-2НДо перемішаного розчину трет-бутил-4-[(4піран-4-карбоксилат оксопіперидин-1-іл)метил]тетрагідро-2Н-піран-4До перемішаної в Ν,Ν-диметилформаміді карбоксилату (8,77г, 0,0295моль, стадії 3 прикладу (200мл) суспензії NaH (17,7г, 0,443моль) в атмос3) в 1,2-диметоксіетані (250мл) при 0°С додавали фері N2 при 0°С по краплях додавали розчин третп-толуолсульфонілметилізоціанід (11,51г, бутилціаноацетату (25,0г, 0,177моль) в Ν,Ν0,0590моль), етанол (3,96мл, 0,0678моль) і тдиметилформаміді (100мл). Суміш залишали набутилат калію (11,58г, 0,1032моль). Отриману сугріватися до температури навколишнього середоміш перемішували при 50°С протягом 16 годин. вища, і перемішували протягом 1 години. Потім, до Після охолоджування, реакційну суміш виливали в суміші додавали біс(2-брометиловий) простий насичений водний розчин NaHCO3 (200мл); і суміш ефір (49,3г, 0,177моль), і отриману суміш перемітри рази екстрагували СН2СІ2 (200мл). Екстракти шували при 90°С протягом 24 годин. Після охолосушили над Na2SO4, фільтрували і концентрували. джування до 0°С суміш промивали водою (100мл). Осад хроматографували на колонці з силікагелем, Легкі компоненти видаляли випарюванням, і осад елюючи сумішшю гексан/етилацетат (2:1), щоб осаджували сумішшю етилацетат/толуол (1:2, отримати 5,76г (63%) сполуки, вказаної в заголов500мл) і водою (500мл). Органічну фазу промиваку, у вигляді жовтого сиропу. ли три рази водою (500мл), сушили над Na2SO4, МС (LSI) m/z: 309 (М+Н)+. фільтрували і упарювали. Тверду речовину про1 Н-ЯМР (CDCІ3) δ: 3,81 (2Н, дт, J=3,1 Гц, 11,0 мивали гексаном, збирали фільтруванням і сушиГц), 3,48 (2Н, дт, J=2,1 Гц, 11,7 Гц). 2,76-2,64 (2Н, 51 86301 52 фільтрували і концентрували, щоб отримати сим), 2,64-2,52 (1Н, м), 2,50-2,35 (4Н, м, включаючи роп, який хроматографували на колонці з силіка2Н, с, 2,46 м.ч.), 1,98 (2Н, шир. д, J=11,9 Гц). 1,92гелем, елююючи сумішшю СН2Сl2/метанол (15:1), 1,70 (4Н, м), 1,65-1,40 (11Н, м, включаючи 9Н, с, щоб отримати 2,1 г (кільк.) сполуки, вказаної в за1,47 м.ч.). головку, у вигляді білої твердої речовини. ПерекСтадія 5. трет-Бутил-4-{|4ристалізація з суміші етилацетат/н-гептан дала (амінометил)піперидин-1-іл]метил}тетрагідро-2Нбілий порошок. піран-4-карбоксилат MC (ESI) m/z; 470 (M+H)+. Суміш трет-бутил-4-[(4-ціанопіперидин-1т.пл.: 146,3 °С іл)метил]тетрагідро-2Н-піран-4-карбоксилату ІЧ (KBr) v: 2943, 2864, 1733, 1558, 1465, 1352, (5,76г, 0,0187моль, стадії 4 прикладу 1) і Ni Ренея 1151, 1109, 759 см-1 (3,00г) в метанолі (100мл) гідрували (3атм) при 1 Н-ЯМР (CDCl3) δ: 8,85 (1H, шир. с), 8,21 (1H, кімнатній температурі 12 годин. Потім, суміш фільд, J-8,1 Гц), 7,30-7,15 (3Н, м), 3.95-3,72 (4Н, м), трували через подушку целіту, і фільтрат концент3,40-3,25 (2Н. м), 3,20-3,06 (2Н, м), 2,65-2,45 (4Н, рували у вакуумі для отримання 5,72г (98%) спом), 2,25-1,85 (13Н, м), 1,60-1,40 (4Н, м). Сигнал, що луки, вказаної в заголовку, у вигляді жовтого належить до СО2Н, не спостерігали. сиропу. MC (ESI) m/z:313(M+H)+. Для Ο26Η35Ν3Ο5·0,25 Н2О аналітично розрахо1 H-ЯМР(CDCl3) d: 3,80 (2Н, дт, J=3,1 Гц, 11,5 вано: С, 65,87; Η, 7,55; Ν, 8,86. Виявлено: С, 65,58; Η, 7,39; Ν, 8,86. Гц), 3,49 (2Н, дт, J=2,1 Гц, 12,2 Гц). 2,80 (2Н, шир. Приклад 2 д, J= 11,5 Гц), 2,58-2,40 (4Н, м, включаючи 2Н, с, 2,2-диметил-3-[4-({[(2'-оксоспіро[циклопентан2,43 м.ч.). 2,15 (2Н, шир. т. J=7,3 Гц). 1,98 (2Н, 1,3'-індол]-1(2’Н)шир. д, J=13,7 Гц), 1,70-1,40 (16Н, м, включаючи іл)карбоніл]аміно}метил)піперидин-1-іл]пропанова 9Н, с, 1,47 м.ч.), 1,30-1,10 (2Н, м). кислота Стадія 6. трет-Бутил-4-{[4-({[(2'оксоспіро[циклопентан-1,3'-індолі-1'(2'H)іл)карбоніл]аміно}метил)піперидин-1іл]метил}тетрагідро-2Н-піран-4-карбоксилат До перемішаного розчину спіро[циклопентан1,3'-індол]-2'(1'Н)-ону (600мг, 3,2ммоль. Howard, Harry R. et al, J. Med. Chem., 1996, 39, 143) і триетиламіну (972мг, 9,6ммоль) в СН2Сl2 (20мл) при кімнатній температурі додавали 4нітрохлорформіат (677мг, 3,4ммоль) і перемішуваСтадія 1. трет-Бутил-4-({[(2'ли при температурі навколишнього середовища 3 оксоспіро[циклопентан-1,3'-індол-1 '(2'H)години. Потім, при кімнатній температурі додавали іл)карбоніл]аміно}метил)піперидин-1-карбоксилат розчин трет-бутил-4-{[4-(амінометил)піперидин-1Вказану в назві сполуку отримували, відповіділ]метил}тетрагідро-2Н-піран-4-карбоксилату (1,0г, но до методики, описаної на стадії 6 прикладу 1, з 3,2ммоль, стадії 5 прикладу 1) в СН2Сl2 (5мл) і трет-бутил-4-(амінометил)піперидин-1перемішували 18 годин. Потім, додавали насичекарбоксилату. ний водний розчин NaHCO3 (20мл), екстрагували 3 Rf=0,2 (гексан/етилацетат (8/1)) 1 рази СН2Сl2 (30мл). сушили над MgSO4, фільтруH-ЯМР(CDCl3) δ: 8,78 (1H, шир. с), 8,23 (1Н, д, вали і концентрували, отримуючи жовто-коричневе J=9 Гц). 7,31-7,10 (3Н, м), 4,20-4,05 (2Н, м), 3,35масло. Осад хроматографували на колонці з амі3,25 (2Н, м), 2,80-2,60 (2Н, м), 2,25-1,80 (9Н, м), нопропілсилікагелем, елююючи сумішшю гек1,80-1,65 (2Н, м), 1,46 (9Н, с), 1,30-1,10 (2Н, м). сан/етилацетат (11:1), щоб отримати 1,3г (75%) Стадія 2. 2'-Оксо-N-(піперидин-4сполуки, вказаної в заголовку, у вигляді прозорого ілметил)спіро[циклопентан-1,3'-індол]-1'(2'H)жовтого масла. карбоксамід МС (ESI) m/z: 526 (М+H)+. трет-Бутил-4-({[(2'-оксоспіро[циклопентан-1,3'1 Н-ЯМР (CDCl3) δ: 8,70 (1H, шир. с), 8,23 (1Н, індол]-1'(2’H)-іл)карбоніл]аміно}метил)піперидин-1д, J=8,1 Гц), 7,41-7,10 (3Н, м). 3,83-3,75 (2Н, м), карбоксилат (750 мг, 1,8 ммоль, стадії 1 прикладу 3,52-3,47 (2Н, м), 3,29-3,20 (2Н, м), 2,83-2,75 (2Н, 2) розчиняли в 10% НСl в метанолі (20 мл), і суміш м), 2,44 (2Н, с), 2,25-1,20 (28Н, м). 7 годин перемішували при кімнатній температурі. Стадія7. 4-{[4-({[(2'-Оксоспіро[циклопентан-1,3'Концентрування дало безбарвне масло, яке хроіндол]-1'(2’)-іл)карбоніл]аміно}метил)піперидин-1матографували на колонці з силікагелем, елюююіл]метил}тетрагідро-2Н-піран-4-карбонова кислота чи сумішшю СН2Сl2/метанол/NH4OH (12/1/0,1) з До розчину трет-бутил-4-{[4-({[(2'отриманням 570 мг (кільк.) вказаної в заголовку оксоспіро[циклопентан-1,3'-індол]-1’(2'Н)сполуки у вигляді безбарвного масла. іл)карбоніл]аміно}метил)піперидин-1МС (ESI) m/z: 328 (М+Н)+ 1 іл]метил}тетрагідро-2Н-піран-4-карбоксилату (2,3 г, Н-ЯМР (CDCl3) δ: 8,76 (1Н, шир. с), 8,24 (1Н, 4,38 ммоль, стадії 6 прикладу 1) в СН2Сl2 (14 мл) д, J=9,0 Гц), 7,31-7,10 (3Н, м). 3,32-3,25 (2Н, м), при кімнатній температурі додавали трифтороцто3,15-3,09 (2Н, м), 2,67-2,60 (2Н, м), 2,30-1,60 (12Н, ву кислоту (18 мл), і суміш перемішували протягом м), 1,32-1,10 (2Н, м). ночі при кімнатній температурі. Суміш концентруСтадія 3. Метил-2,2-диметил-3-[4-({[(2'вали, щоб отримати жовте масло; додавали оксоспіро[циклопентан-1,3'-індол]-1'(2'Н)СН2Сl2 (200 мл) і промивали насиченим водним іл)карбоніл]аміно}метил)піперидин-1-іл]пропаноат розчином NаНСО3 (80 мл), сушили над MgSO4, 53 86301 54 До перемішаного розчину 2'-оксо-N(піперидин-4-ілметил)спіро[циклопентан-1,3'індол]-1’(2'Н)-карбоксаміду (480 мг, 1,5 ммоль, стадії 2 прикладу 2) і метил 2,2-диметил-3оксопропаноату (248 мг, 1,7 ммоль, Кim, Hwa-Ok et al., Synth.Commun., 1997, 27, 2505) в СН2Сl2 (40 мл) при кімнатній температурі однією порцією додавали триацетоксиборогідрид натрію (623 мг. 2,9 Стадія 1. трет-Бутил-1ммоль). Суміш перемішували 20 годин при темпе(йодометил)циклопропанкарбоксилат ратурі навколишнього середовища. До суміші доДо перемішаного розчину діізопропіламіну (7,7 давали насичений водний розчин NaHCO3 (10 мл), мл, 0,055 моль) в тетрагідрофурані (80 мл) при екстрагували СН2Сl2 (30 млх2), сушили над 70°С повільно додавали н-бутиллітій (1,59 Μ в MgSO4, фільтрували і концентрували, отримуючи циклогексані, 34 мл, 0,055 моль), і суміш 20 хв. жовте масло. Осад хроматографували на колонці перемішували при 0°С. Суміш охолоджували до з амінопропілсилікагелем, елююючи сумішшю гек78°С, і по краплях додавали третсан/етилацетат (9:1) з отриманням 150 мг (23%) бутилциклопропанкарбоксилат (6.5 г, 0.046 моль, сполуки, вказаної в назві, у вигляді прозорого безKohlrausch et al., Z. Elektrochem. Angew. Phys. барвного масла. Chem., 1937, 70, 392) в тетрагідрофурані (10 мл), і + МС (ESI) m/z: 442 (М+Н) . 1 суміш перемішували протягом 3 годин. Потім, по H-ЯМР(CDCl3) δ: 8,72 (1Н, шир. с), 8,24 (1Н, д, краплях додавали дийодометан (4,0 мл, 0,050 J=8,1 Гц), 7,31-7,10 (3Н, м), 3,65 (3Н, с). 3,27-3,20 моль) в тетрагідрофурані (10 мл), і суміш залиша(2Н, м), 2,85-2,75 (2Н, м), 2,46 (2Н, с), 2.23-1,90 ли нагріватися до кімнатної температури протягом (11Н, м), 1,70-1,60 (2Н, м), 1,35-1,28 (2Н, м), 1,15 ночі. До розчину додавали насичений водний роз(6Н, с). чин NH4Cl (80 мл) і екстрагували діетиловим ефіСтадія 4. 2,2-Диметил-3-[4-({[(2'ром (50 мл), промивали соляним розчином (20 оксоспіро[циклопентан-1,3'-індол]-1’(2'H)мл), сушили над MgSO4, фільтрували і концентруіл)карбоніл]аміно}метил)піперидин-1-іл]пропанова вали, щоб отримати коричневе масло. Масло хрокислота матографували на колонці з силікагелем, елюючи До перемішаного розчину метил-2,2-диметилсумішшю гексан/діетиловий ефір (40:1), щоб отри3-[4-({[(2'-оксоспіро[циклопентан-1,3'-індол]-1’(2'Н)мати 1,9 г вказаної в назві сполуки у вигляді неіл)карбоніл]аміно}метил)піперидин-1-іл]пропаноату очищеного продукту. Неочищений продукт викори(170 мг. 0,38 ммоль, стадії 3 прикладу 2) в оцтовій стовували без додаткового очищення. кислоті (2 мл), додавали H2SO4 (113 мг) у воді (2 Rf: 0,3 (суміш гексан/діетиловий ефір (40:1)) мл); і суміш 36 годин кип'ятили із зворотним холоСтадія 2. трет-Бутил-1-[(4-{[(третдильником. Суміш охолоджували до кімнатної тебутоксикарбоніл)аміно]метил}піперидин-1мператури і повільно додавали твердий NаНСО3 іл)метил]циклопропанкарбоксилат (500 мг). Отриману суміш концентрували, щоб Суміш трет-бутил-1отримати білу тверду речовину. До твердої речо(йодометил)циклопропанкарбоксилату (1,9 г 6,7 вини додавали СН2Сl2 (40 мл) і перемішували 10 ммоль, стадії 1 Приклади 3), трет-бутилхв., сушили над MgSO4 Розчин фільтрували і кон(піперидин-4-ілметил)карбамату (3,0 г. 14 ммоль), центрували і, в результаті, отримували жовте масΝ,Ν-діізопропілетиламіну (5,8 мл, 34 ммоль) в Ν,Νло. Масло хроматографували на колонці з силікадиметилформаміді (25 мл) нагрівали при 120°С гелем, елююючи сумішшю СН2Сl2/метанол (14:1), протягом 20 годин. Після охолоджування до кімнащоб отримати 130 мг (80%) вказаної в назві сполутної температури додавали воду (50 мл), 2 рази ки у вигляді білої твердої речовини. Перекристаліекстрагували сумішшю етилацетат/толуол (1:2, 60 зація з суміші етилацетат/діетиловий ефір давала мл), 2 рази промивали водою (50 мл), соляним білий порошок. + розчином (50 мл), сушили над MgSO4, фільтруваМС (ESI) m/z: 427 (М+Н) . ли і концентрували, щоб отримати коричневе маст.пл.: 189,1 °С ло. Масло хроматографували на колонці з силікаІЧ (KBr) v: 2950, 1732, 1600, 1537, 1475, 1348, гелем, елюючи сумішшю СН2Сl2/метанол (10:1). 1321, 1280, 1153, 964, 873, 758 см-1 1 щоб отримати 560 мг (11%) сполуки, вказаної в H-ЯМР(CDCl3) δ: 8,80 (1Η, шир. с), 8,21 (1Н, д, назві, у вигляді прозорого коричневого масла. J=8,1 Гц), 7,35-7,10 (3Н, м), 3,36-3,20 (2Н, м), 3,20МС (ESI) m/z: 369 (М+Н)+ 3,10 (2Н, м), 2,56 (2Н, с), 2,54-2,40 (2Н, м), 2,301 H-ЯМР(CDCl3) δ: 4,60 (1Н. шир.), 3,08-2,82 1,60 (11Н, м), 1,58-1,35 (2Н, м), 1,24 (6Н, с). Сиг(4Н, м), 2,59 (2Н, с). 2,10-1,90 (2Н, м), 1,75-1,55 нал, що належить до СО2Н, не спостерігали. (4Н, м), 1,50-1,05 (23Н, м). Для С24Н33NO4 · 0,3Н2О аналітично розрахоСтадія 3. 1 - {[4-(Амінометил)піперидин-1вано: С, 66,58; Η, 7,82; Ν, 9,71. іл]метил} циклопропанкарбонова кислота Виявлено: С, 66,33; Η, 7,72; Ν, 9,51. трет-Бутил-1-[(4-{[(третПриклад 3 бутоксикарбоніл)аміно]метил}піперидин-11-{[4-({(2'-оксоспіро[циклопентан-1,3'-індол]іл)метил]циклопропанкарбоксилат (211 мг, 0,57 1’(2'Н)-іл)карбоніл]аміно}метил)пііперидин-1моль, стадії 2 прикладу 3) розчиняли в 10% розчиіл]метил}циклопропанкарбонова кислота ні НСl в діоксані (5 мл), і суміш 4 години перемішували при кімнатній температурі. Отриману в результаті коричневу суспензію концентрували з отриманням 150 мг (кільк.) сполуки, вказаної в на 55 86301 56 фтороцтову кислоту (5 мл) перемішували при кімзві, у вигляді блідо-коричневої твердої речовини. її натній температурі протягом 1,5 години. Реакційну використовували без додаткового очищення. суміш потім концентрували, підлужували насичеMC(ESI)m/z:211 (М+Н)+. ним водним розчином NaHCO3 (100 мл) і п'ять раСтадія 4. 1-{[4-({[(2'-Оксоспіро[циклопентанзів екстрагували СНСl3 (100 мл). Об'єднані екстра1,3'-індол]-1'(2'H)кти сушили над MgSO4, фільтрували і іл)карбоніл]аміно}метил)піперидин-1концентрували для отримання 0,831 г (100%) споіл]метил}циклопропанкарбонова кислота луки, вказаної в назві, у вигляді жовтого сиропу. Сполуку, вказану в назві, отримували по метоMC (ESI) m/z: 255 (М+Н)+. диці, описаній для стадії 6 прикладу 1, з 1-{[41 H-ЯМР(CDCl3) δ: 3,66 (3Н, с), 2,78 (2Н, д, (амінометил)піперидин-1J=11,5 Гц), 2,62-2,50 (4Н, м), 2,15-1,98 (4Н, м), іл]метил}циклопропанкарбонової кислоти (стадія 3 1,80-1,40 (9Н, м), 1,30-1,05 (2Н, м). прикладу 3). Очищення здійснювали на колонці з Стадія 4. Метил-1-{[4-({[(2'силікагелем, елюючи сумішшю СН2Сl2/метанол оксоспіро[циклопентан-1,3'-індол]-1’(2'H)(18:1~10:1), щоб отримати 130 мг (53%) сполуки, іл)карбоніл]аміно}метил)піперидин-1вказаної в назві, у вигляді білої твердої речовини. іл]метил}циклопентанкарбоксилат Тверду речовину розтирали в суміші гекСполуку, вказану в назві, отримували по метосан/діетиловий ефір, і збирали фільтруванням з диці, описаній на стадії 6 прикладу 1, з метил-1-{[4отриманням сполуки, вказаної в назві, у вигляді (амінометил)піперидин-1білої твердої речовини. іл]метил}циклопентанкарбоксилату (стадія 3 прикМС (ESI) m/z: 426 (М+Н)+. ладу 4). т.пл.: 186,5°С. MC (ESI) m/z: 468 (М+Н)+. ІЧ (KBr) v: 3300, 2960, 2908, 1743, 1697. 1542. 1 -1 H-ЯМР(CDCl3) δ: 8,71 (1Н, шир. с), 8,23 (1Н, д, 1463, 1348, 1267, 1161, 1143, 1105, 779 см 1 J=8,1 Гц), 7,34-7,10 (3Н, м). 3,66 (3Н, с), 3,28-3,20 H-ЯМР(CDCl3) δ: 8,81 (1Η, шир. с), 8,21 (1Н, д, (2Н, м), 2,82-2,75 (2Н, м), 2,56 (2Н, с), 2,25-1,40 J=8,1 Гц), 7,32-7,14 (3Н, м). 3,43-3,15 (4Н. м), 2,59 (21Н, м), 1,38-1,12 (2Н,м). (2Н, с), 2,30-1,60 (17Н, м), 0,65-0,56 (2Н, м). СигСтадія 5. 1-{[4-({[(2'-оксоспіро[циклопентаннал, що належить до СО2Н, не спостерігали. 1,3'-індол]-1'(2'H)Для C24H31N3O4 аналітично розраховано: С, іл)карбоніл]аміно}метил)піперидин-167,74; Η, 7,34; Ν, 9,88. іл]метил}циклопентанкарбонова кислота Знайдено: С, 67,45; Η, 7,36; Ν, 9,80. Сполуку, вказану в назві, отримували по метоПриклад 4 диці, описаній для стадії 4 прикладу 2, з метил-11-{[4-({[(2'-оксоспіро[цииклопентан-1,3'-індол]{[4-({[(2'-оксоспіро[циклопентан-1,3'-індол]-Γ(2Ή)1'(2’H)-іл)карбоніл]аміно}метил)піперидин-1іл)карбоніл]аміно}метил)піперидин-1іл]метил}циклопентанкарбонова кислота іл]метил}циклопентанкарбоксилату (стадія 4 прикладу 4). MC (ESI) m/z: 454 (М+Н)+. т.пл.. 188,1°С. ІЧ (КВr) ν: 3301, 2935, 2869, 1730, 1602, 1531, 1469, 1278,1147.758 см-1. 1 H-ЯМР(CDCl3) δ: 8,80 (1H, шир. с), 8,21 (1H, д. J=8,1 Гц), 7,32-7,14 (3Н, м), 3,31 (2Н, т, J=5,4 Гц), 3,23-3,12 (2Н, м), 2,67 (2Н, с), 2,50-2,32 (2Н, м), Стадія 1. Метил-1-(йодометил )циклопентан2,31-1,56 (17Н, м), 1,55-1,32 (4Н, м). Сигнал, що карбоксилат належить до СО2Н, не спостерігали. Сполуку, вказану в назві, отримували по метоДля С26Н35N3О4·0,5 Н2О аналітично розраходиці, описаній для стадії 1 прикладу 3, з метилцивано: С, 67,51; Η, 7,84; Ν, 9,08 клопентанкарбоксилату. 1 Знайдено: С, 67,17; Η, 7,83; Ν, 8,85. Н-ЯМР (CDCl3) δ: 3,73 (3Н, с), 3,42 (2Η, с), Приклад 5 2,30-2,15 (2Н, м). 1,80-1,55 (6Н, м). 1-{[4-({[(2'-оксоспіро[циклопентан-1,3'-індол]Стадія 2. Метил-1-[(4-{[(трет1'(2'H)-іл)карбоніл]аміно}метил)піперидин-1бутоксикарбоніл)аміно]метил}піперидиніл]метил}циклобутанкарбонова кислота 1іл)метил]циклопентанкарбоксилат Сполуку, вказану в назві, отримували по методиці, описаній для стадії 2 прикладу 3, з метил-1(йодометил )циклопентанкарбоксилату. MC (ESI) m/z: 355 (M+H)+. 1 H-ЯМР(CDCl3) δ: 4,58 (1H, шир. с), 3,66 (ЗН, с), 2,97 (2Н, т, J=6,3 Гц). 2,77 (2Н, шир. д, J=11,5 Гц), 2,55 (2Н, с), 1,70-1,50 (9Н, м), 1,44 (9Н, с), 1,25-1,08 (2Н, м). Стадія 1. Метил-1-[(4-{[третСтадія 3. Метил-1 - {[4-(амінометил)піперидинбутоксикарбоніл)аміно]метил}піперидин-11 –іл]метил}циклопентанкарбоксилат іл)метил]циклобутанкарбоксилат Розчин метил-1-[(4-{[третДо перемішаної суміші трет-бутил-(піперидинбутоксикарбоніл)аміно]метил}піперидин-14-ілметил)карбамату (12,8 г, 60 ммоль) і метил-1іл)метил]циклопентанкарбоксилату (1,16 г, 3,27 формілциклобутанкарбоксилату (2,13 г, 15 ммоль, ммоль, стадії 2 прикладу 4) в СН2Сl2 (25 мл) і три 57 86301 58 м), 2.45-1,70 (17Н, м), 1,54-1,35 (2Н, м). Сигнал, що Davis, Charles R.; Swenson, Dale С; Burton, Donald належить до СО2Н, не спостерігали. J., J. Org. Chem., 1993, 58, 6843) в тетрагідрофурані (50 мл) при температурі навколишнього сереДля С25Н33N33О4·0,5 Н2О аналітично розраходовища додавали оцтову кислоту (8,6 мл, 150 вано: С, 66,94; Η, 7,64; Ν, 9,37. ммоль). Після 30 хв., до суміші додавали триацеЗнайдено: С, 66,95; Η, 7,75; Ν. 9,32. токсиборогідрид натрію (12,7 г, 60 ммоль). Потім, Приклад 6 протягом 2 годин суміш нагрівали до 60°С. Після 2-етил-2-{[4-({[(2'-оксоспіро[циклопентан-1,3'охолоджування реакційну суміш виливали в насиіндол]-1’(2H)-іл)карбоніл]аміно}метил)піперидин-1чений водний розчин NаНСО3. Водний шар 3 рази іл]метил}бутанова кислота екстрагували СН2Сl2. Об'єднану органічну фазу промивали соляним розчином, сушили над MgSO4, фільтрували і концентрували. Осад хроматографували на колонці з силікагелем, елююючи сумішшю гексан/етилацетат (1:1) для отримання 4,25 г (83%) сполуки, вказаної в назві, у вигляді білої твердої речовини. MC(ESI)m/z:341 (М+Н)+. 1 H-ЯМР(CDCl3) δ: 3,69 (3Н, с), 2,96 (2Н, т, Стадія 1. Метил-2-[(4-{[(трет-бутоксикарбоніл J=6,2 Гц), 2,75 (2Н, д, J=11,4 Гц), 2,67 (2Н, с), 2,37)аміно]метил}піперидин-1-іл)метил]-22,46 (2Н, м). 1,78-2,05 (6Н, м), 1,45-1,65 (2Н, м), етилбутаноат 1,43 (9Н, с), 1,09-1,21 (2Н, м). Сполуку, вказану в назві, отримували спосоСтадія 2. Метил-1-{[4-(амінометил )піперидинбом, аналогічним способу, показаному для стадії 1 1-іл]метил}циклобутанкарбоксилат прикладу 5, за допомогою застосування метил-2Сполуку, вказану в назві, отримували по метоетил-2-формілбутаноату (Okano, К.; Morimoto, Т.; диці, описаній для стадії 3 прикладу 4 з метил-1Sekiya, M. Journal of the Chemical Society, Chemical [(4-{[(трет-бутоксикарбоніл)аміно]метил}піперидинCommunications, 1985, 3, 119). 1-іл)метил]циклобутанкарбоксилату (стадія 1 приMC (ESI) m/z: 357 (M+H)+. кладу 5). 1 H-ЯМР(CDCl3) δ: 4,62-4,48 (1H, шир.), 3,65 MC(ESI)m/z: 241 (M+H)+. (3Н, с), 3,01-2,93 (2Н, м), 2,73-2,65 (2Н, м), 2,46 1 H-ЯМР(CDCl3) δ: 3,67 (3Н, с), 2,72-2,78 (2Н, (2Н, с). 2,13-2,02 (2Н, м), 1,73-1,50 (6Н, м), 1,44 м), 2,66 (2Н, с), 2,54 (2Н, д, J=6,2 Гц), 2,34-2,47 (9Н, с), 1,28-1,10 (3Н, м), 0,76 (6Н, т, J=7,5 Гц). (2Н, м), 1,79-2,04 (8Н, м), 1,54-1,64 (2Н, м), 1,05Стадія 2. Метил-2-{[4-(амінометил)піперидин1,35 (3Н, м). 1-іл]метил}-2-етилбутаноат Стадія 3. Метил-1-{[4-({[(2'Сполуку, вказану в назві, отримували по метооксоспіро[циклопентан-1,3'-індол]-1’(2'Н)диці, описаній для стадії 3 прикладу 4 з метил-2іл)карбоніл]аміно}метил)піперидин-1[(4-{[(трет-бутоксикарбоніл)аміно]метил}піперидиніл]метил}циклобутанкарбоксилат 1-іл)метил]-2-етилбутаноату (стадія 1 прикладу 6). Сполуку, вказану в назві, отримували по метоMC (ESI) m/z: 459 (М+Н)+. диці, описаній для стадії 6 прикладу 1, з метил-11 H-ЯМР(CDCl3) δ: 8,92-8,86 (1H, м), 8,28-8,23 {[4-(амінометил)піперидин-1(1H, м), 7,20-7,12 (3Н, м), 4.77-4,61 (1H, м). 3,65 іл]метил}циклобутанкарбоксилату (стадія 2 прик(3Н, с), 3,27 (2Н, т, J=6,4 Гц), 2,75-2,66 (2Н, м), 2,47 ладу 5). (2Н, с), 2,16-2,05 (2Н, м), 1,72-1,49 (10Н, м), 1,38+ МС (ESI) m/z: 454 (М+Н) . 1,21 (5Н, м), 0,76 (6Н, д, J=7,5 Гц). 1 H-ЯМР(CDCl3) δ: 8,71 (1Н, шир. с), 8,23 (1H, д, Стадія 3. Метил-2-етил-2-{[4-({[(2'J=8,1 Гц), 7,35-7,10 (3Н, м), 3,70 (3Н, с), 3,27-3,21 оксоспіро[циклопентан-1,3'-індол]-1’(2'Н)(2Н, м), 2,88-2,70 (2Н, м), 2,68 (2Н, с), 2,49-2,35 іл)карбоніл]аміно}метил)піперидин-1(2Н, м), 2,28-2,15 (2Н, м), 2,14-1,75 (13Н, м), 1,70іл]метил}бутаноат 1,62 (2Н, м), 1,34-1,15 (2Н, м). Сполуку, вказану в назві, отримували по метоСтадія 4. 1 - {[4-({[(2'-оксоспіро[циклопентандиці, описаній для стадії 6 прикладу 1, з метил-21,3'-індол]-1 '(2'H){[4-(амінометил)піперидин-1-іл]метил}-2іл)карбоніл]аміно}метил)піперидин-1етилбутаноату (стадія 2 прикладу 6). іл]метил}циклобутанкарбонова кислота MC (ESI) m/z: 470 (М+Н)+. Сполуку, вказану в назві, отримували по мето1 Н-ЯМР (CDCl3) δ: 8,72 (1Η, шир. с), 8,23 (1H, диці, описаній для стадії 4 прикладу 2, з метил-1д, J=8.1 Гц), 7,30-7,13 (3Н, м), 3,65 (3Н, с), 3,24 {[4-({[(2'-оксоспіро[циклопентан-1,3’-індол]-1’(2'Н)(2Н, т. J=5,4 Гц), 2,75-2,69 (2Н, м), 2,47 (2Н, м), іл)карбоніл]аміно}метил)піперидин-12,30-1,50 (20Н, м), 1,35-1,20 (2Н, м), 0,76 (3Н, т, іл]метил}циклобутанкарбоксилату (стадія 3 прикJ=6,0 Гц). ладу 5). Стадія 4. 2-Етил-2-{[4-({[(2'+ МС (ESI)m/z: 440 (М+Н) . оксоспіро[циклопентан-1,3'-індол]-1’(2'Н)т.пл.: 171,0°С. іл)карбоніл]аміно}метил)піперидин-1ІЧ (КВr) ν: 3303, 2937, 2868, 1728, 1537, 1461. іл]метил}бутанова кислота + 1280, 1226, 1145, 765, 750 см Сполуку, вказану в назві, отримували по мето1 Н-ЯМР (CDCl3) δ: 8,80 (1Н, шир. с), 8,20 (1Н, диці, описаній для стадії 4 прикладу 2, з метил-2д, J=8,0 Гц), 7,32-7,12 (3Н, м), 3,30 (2Н, т, J=6,1 етил-2-{[4-({[(2'-оксоспіро[циклопентан-1,3'-індол]Гц), 3,14-3,00 (2Н, м), 2,77 (2Н. с), 2,60-2,46 (2Н, 1’(2'Н)-іл)карбоніл]аміно}метил)піперидин-1іл]метил}бутаноату (стадія 3 Прикладу 6). 59 86301 60 толуолсульфокислоти (52,4 г, 276 ммоль) в тетраМС (ESI) m/z: 456 (М+Н)+. гідрофурані (150 мл). Після перемішування при ІЧ (КВr) ν: 3323, 2937, 1732, 1596, 1539, 1463, вказаній температурі протягом 10 хв., отриманий 1348, 1147, 746 см-1 1 розчин гріли в умовах утворення флегми протягом H-ЯМР(CDCl3) δ: 8,80 (1H, шир. с), 8,22 (1H, д, 3 годин. Після охолоджування до кімнатної темпеJ=8,1 Гц), 7,35-7,15 (3Н, м), 3,31 (2Н, т, J=6,0 Гц), ратури дуже повільно протягом 1 години додавали 3,18-3,05 (2Н, м), 2,61 (2Н, с), 2,57-2,40 (2Н, м), триетиламін (28,1 мл, 202 ммоль) з внесенням 2,30-1,25 (17Н, м), 0,88 (6Н, т, J=9,0 Гц). Сигнал, затравки. Під час додавання триетиламіну випащо відноситься до СО2Н, не спостерігали. дав білий осад. Отриману білу суспензію переміДля C26H37N3O4·0,4 Н2О аналітично розрахошували при кімнатній температурі 6 годин і фільтвано: С, 67,48; Н, 8,23; N, 9,08. рували, отримуючи тверду речовину, яку 2 рази Знайдено: С, 67,87; Н, 8,13; N, 8,95. промивали тетрагідрофураном (по 100 мл), сушиПриклад 7 ли 5 годин при 50°С, щоб отримати 35 г (96%) вка1-{[4-({[(6'-фтор-2'-оксоспіро[циклопентан-1,3'заної в назві сполуки у вигляді білого порошку. індол]-1'(2'H)-іл)карбоніл]аміно}метил)піперидин-1т.пл.:210°С іл]метил}циклобутанкарбонова кислота 1 H-ЯМР(D2O) δ: 7,40 (2Н, д, J=7,2 Гц), 7,07 (2Н, д, J=7,2 Гц), 3,28-3,00 (4Н, м). 2,80-2,57 (4Н, м), 2,09 (3Н, с), 2,18-1,97 (2Н, м), 1,85-1,58 (8Н, м), 1,36-1,12 (2Н, м). Стадія 4. 1-{[4-({[(6'-фтор-2'оксоспіро[циклопентан-1,3'-індол]-1’(2'Н)іл)карбоніл]аміно}метил)піперидин-1іл]метил)циклобутанкарбонова кислота Стадія 1. Етил-1 –[(4-{[(третСполуку, вказану в назві, отримували по метобутоксикарбоніл)аміно]метил}піперидин-1диці, описаній для стадії 6 прикладу 1, з 6'іл)метил]циклобутанкарбоксилат фторспіро[циклопентан-1,3'-індол]-2'(1’Н)-ону Сполуку, вказану в назві, отримували по мето(Joensson, N et al., Acta Chem, Scand. Ser. У, 1974, диці, описаній для стадії 3 прикладу 8, з [циклобу28, 225) і 4-метилбензолсульфонату 1-{[4тиліден(етокси)метокси](триметил)силану (Kuo. Y.(амінометил)піперидин-1N, et al., J, Chem. Soc. D., 1971, 136). іл]метил}циклобутанкарбонової кислоти (стадія 3 МС (ESI) m/z: 355 (M+H)+. прикладу 7). 1 Н-ЯМР (CDCl3) δ: 4,55 (1Η, шир.), 4,17 (2Н, q, МС (ESI)m/z: 458 (М+Н)+. J=7,1 Гц), 2,96 (2Н, т, J=6,3 Гц), 2,76 (2Н, д, J=11,4 т.пл.: 150,3°С Гц), 2,48-2,33 (2Н, м), 2,05-1,80 (6Н, м), 1,43 (9Н, ІЧ (KBr) v: 3305, 2935, 1735, 1602, 1492, 1440, с), 1,25 (3Н, q, J=7,1 Гц), 1,40-1,05 (7Н, м). 1357, 1296,1228, 1157, 1095, 869 см-1. Стадія 2. 1-[(4-([(трет1 H-ЯМР(CDCl3) δ: 8,73 (1H, шир. с), 8,01 (1Н, бутоксикарбоніл)аміно]метил} піперидин-1дд, J=5,4, 8,1 Гц), 6,92-6,83 (1H, м), 3.30 (2H, т, іл)метил]циклобутанкарбонова кислота J=5,4 Гц), 3,15-3,03 (2H, м), 2,78 (3Н, с), 2,64-2,50 Суміш етил-1 [(4{[(трет(2Н, м), 2,45-1,70 (16Н, м), 1,55-1,36 (2Н, м). Сигбутоксикарбоніл)аміно]метил} піперидин-1нал, що належить до СО2Н, не спостерігали. іл)метил]циклобутанкарбоксилату (4,2 г, 11,9 Для C25H32N3О4· 0,4 Н2О аналітично розрахоммоль, стадії 1 прикладу 7), 2н, NaOH (18 мл) і вано: С, 64,61; Η, 7,11; Ν, 9,01. етанолу (12 мл) прогрівали при 50°С протягом 4 Знайдено: С, 64,31; Η, 7,11; Ν, 9,05. годин. Отриманий розчин охолоджували на крижаПриклад 8 ній бані і додавали 2н. НСl (приблизно, 19 мл), 4-{[4-({[(6'-фтор-2'-оксоспіро[циклопентан-1,3'поки рН суміші не дорівнювала, приблизно, 5-6. індол]-1'(2’H)-іл)карбоніл]аміно}метил)піперидин-1Все екстрагували 3 рази сумішшю іл]метил}тетрагідро-2Н-піран-4-карбонова кислота СН Сl /ізопропанол (3:1, 30 мл). Об'єднані органіч2 2 ні шари сушили (Na2SO4) і фільтрували. Фільтрат концентрували з отриманням 3,8 г (98%) сполуки, вказаної в назві, у вигляді жовтої твердої речовини. 1 H ЯМР (CDCl3) δ: 4,08 (1H, м), 3,20-3,10 (2Н, м), 3,08-2,99 (2Н, м), 2,91(2Н, с), 2,60-2,38 (4Н, м), 2,35-2,16 (2Н, м), 2,05-1,76 (6Н, м), 1,65 (1Н, м), 1,44 (9Н, с). Стадія 3. 4-Метилбензолсульфонат-1 - {[4(амінометил)піперидин-1-іл]метил} циклобутанкарбонової кислоти Суміш 1-[(4-{[(третбутоксикарбоніл)аміно]метил}піперидин-1іл)метил]циклобутанкарбонової кислоти (30 г, 92 ммоль, стадії 2 прикладу 7) в тетрагідрофурані (150 мл) 10 хв. перемішували при кімнатній температурі в 500 мл, 3-горлій круглодонній колбі в атмосфері N2. До цієї суспензії при кімнатній температурі додавали, розчин моногідрату п Стадія 1. трет-Бутил-{[1(етоксиметил)піперидин-4-іл]метил}карбамат До перемішаного розчину трет-бутил(піперидин-4-ілметил)карбамату (7,0 г, 33 ммоль) в етанолі (19 мл) при температурі навколишнього середовища додавали параформальдегід (1,2 г. 39 ммоль) і К2СО3 (5,4 г, 39 ммоль). Суміш 4 години перемішували при температурі навколишнього середовища. Суміш фільтрували, і фільтрувальний осад промивали етанолом (50 мл). Леткі компоненти видаляли випаровуванням, щоб отримати
ДивитисяДодаткова інформація
Назва патенту англійськоюOxyindole derivatives as 5ht4 receptor agonists
Автори англійськоюKawamura Kiyoshi, Sone Hiroki, Uchida Chikara
Назва патенту російськоюПроизводные оксииндола как агонисты 5-нт4 рецептора
Автори російськоюКавамура Кийоси, Сонэ Хироки, Утида Тикара
МПК / Мітки
МПК: C07D 401/14, C07D 401/12, A61P 1/04, A61K 31/454, C07D 405/14
Мітки: 5-нт4, оксііндолу, рецептора, похідні, агоністи
Код посилання
<a href="https://ua.patents.su/41-86301-pokhidni-oksiindolu-yak-agonisti-5-nt4-receptora.html" target="_blank" rel="follow" title="База патентів України">Похідні оксііндолу як агоністи 5-нт4 рецептора</a>
Попередній патент: Абразивний виріб, способи виготовлення абразивного виробу та зв’язуюча композиція
Наступний патент: Спосіб транспортування і очистки коренебульбоплодів та пристрій для його здійснення
Випадковий патент: Машина для виготування розеток













































