Заміщені похідні фенілпропіонової кислоти як агоністи активованого пероксизомним проліфератором рецептора альфа (аппр) людини, спосіб їх одержання, фармацевтична композиція на їх основі, проміжна сполука (варіанти)
Номер патенту: 77987
Опубліковано: 15.02.2007
Автори: Ольссон Анна Крістіна, Лі Ланна, Альстермарк Ліндстедт Ева-Лотте
Формула / Реферат
1. S-енантіомер сполуки формули І
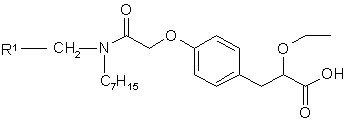 , I
, I
де R1 представляє 2,4-дифлуорфеніл або циклогексил, та його фармацевтично прийнятні солі, сольвати, кристалічні форми та проліки.
2. Сполука вибрана з групи:
(2S)-3-(4-{2-[(циклогексилметил)(гептил)аміно]-2-оксоетокси}феніл)-2-етоксипропанова кислота та
(2S)-3-(4-{2-[(2,4-дифлуорбензил)(гептил)аміно]-2-оксоетокси}феніл)-2-етоксипропанова кислота
та їх фармацевтично прийнятні солі, сольвати, кристалічні форми та проліки.
3. (2S)-3-(4-{2-[(циклогексилметил)(гептил)аміно]-2-оксоетокси}феніл)-2-етоксипропанова кислота та її фармацевтично прийнятні солі, сольвати, кристалічні форми та проліки.
4. (2S)-3-(4-{2-[(2,4-дифлуорбензил)(гептил)аміно]-2-оксоетокси}феніл)-2-етоксипропанова кислота та її фармацевтично прийнятні солі, сольвати, кристалічні форми та проліки.
5. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-4 у суміші з фармацевтично прийнятними розріджувачами, ад'ювантами або носіями.
6. Спосіб лікування або попередження ліпідних розладів (дисліпідемії), асоційованих або не асоційованих з резистентністю до інсуліну, що полягає у введенні ссавцю, що потребує цього, сполуки за будь-яким з пп. 1-4 .
7. Застосування сполуки за будь-яким з пп. 1-4 у виробництві медикаменту для лікування ліпідних розладів (дисліпідемії), асоційованих або не асоційованих з резистентністю до інсуліну.
8. Спосіб лікування або попередження діабету типу 2, що полягає у введенні ссавцю, що потребує цього, ефективної кількості сполуки формули І за будь-яким з пп. 1-4 .
9. Спосіб отримання сполуки формули І, в якому проводять взаємодію сполуки формули II
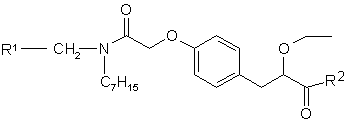 , II
, II
в якій R1 означає 2,4-дифлуорфеніл або циклогексил, R2 представляє захисну групу для гідроксилу карбоксильної групи,
з агентом, що забезпечує зняття захисту.
10. Сполука формули II
 , II
, II
в якій R1 означає 2,4-дифлуорфеніл або циклогексил, R2 представляє захисну групу для гідроксилу карбоксильної групи.
11. Сполука формули III
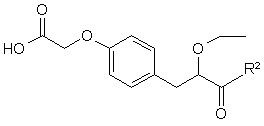 , III
, III
в якій R2 представляє захисну групу для гідроксилу карбоксильної групи.
12. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-4 у комбінації з іншим терапевтичним засобом, що є корисним при лікуванні розладів, асоційованих з розвитком та прогресом атеросклерозу, як-то гіпертензія, гіперліпідемія, дисліпідемія, діабет та ожиріння.
13. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-4 у комбінації з іншим засобом модуляції АППР.
14. Фармацевтична композиція, що містить сполуку за будь-яким одним з пп. 1-4 у комбінації із засобом, що знижує рівень холестерину.
15. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-4 у комбінації з інгібітором HMG-CoA редуктази.
16. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-4 у комбінації з аторвастатином або його фармацевтично прийнятною сіллю, сольватом, кристалічною формою або проліками.
17. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-4 у комбінації з розувастатином або його фармацевтично прийнятною сіллю.
18. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-4 у комбінації з інгібітором ТЖККК.
19. Фармацевтична композиція за п. 18, в якій інгібітор ТЖККК вибирають з групи:
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)-1'-феніл-1'-[N'-(карбоксиметил)-карбамоїл]метил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N'-(карбоксиметил)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(карбоксиметил)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)-1'-феніл-1'-[N'-(2-сульфоетил)-карбамоїл]метил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(N-{(R)-1'-феніл-1'-[N'-(2-сульфоетил)-карбамоїл]метил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N'-(2-сульфоетил)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(2-сульфоетил)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N'-(2-сульфоетил)-карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(2-сульфоетил)-карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N'-(2-карбоксіетил)-карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(2-карбоксіетил)-карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-(R)- ![]() -[N'-(2-карбоксіетил)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(2-карбоксіетил)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N'-(5-карбоксипентил)-карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(5-карбоксипентил)-карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N'-(2-карбоксіетил)карбамоїл] бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(2-карбоксіетил)карбамоїл] бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3>3-дибутил-5-феніл-7-метилтіо-8-(N-{ ![]() -[N'-(2-сульфоетил)карбамоїл]-2-флуорбензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(2-сульфоетил)карбамоїл]-2-флуорбензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N'-(R)-(2-гідрокси-1-карбоксіетил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(R)-(2-гідрокси-1-карбоксіетил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-дioкco-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N'-(R)-(2-гідрокси-1-карбоксіетил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(R)-(2-гідрокси-1-карбоксіетил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3,3-дибутил-5-фeніл-7-метилтіо-8-(N-[(R)- ![]() -(N'-{(R)-1-[N"-(R)-(2-гідрокси-1 карбоксіетил)карбамоїл]-2-гідроксіетил}карбамоїл)бензил]карбамоїлметокси}-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-(N'-{(R)-1-[N"-(R)-(2-гідрокси-1 карбоксіетил)карбамоїл]-2-гідроксіетил}карбамоїл)бензил]карбамоїлметокси}-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(N-{ ![]() -[N'-(карбоксиметил)карбамоїл]-бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(карбоксиметил)карбамоїл]-бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(N-{ ![]() -[N'-((етокси)(метил)фосфорил-метил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-((етокси)(метил)фосфорил-метил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(N-[(R)- ![]() -(N'-{2-[(гідрокси)(метил)-фосфорил]етил}карбамоїл)бензил]карбамоїлметокси}-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-(N'-{2-[(гідрокси)(метил)-фосфорил]етил}карбамоїл)бензил]карбамоїлметокси}-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N'-(2-метилтіо-1-карбоксіетил)-карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(2-метилтіо-1-карбоксіетил)-карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-{N-[(R)- ![]() -(N'-{2-[(метил)(етил)-фосфорил]етил}карбамоїл)-4-гідроксибензил]карбамоїлметокси}-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-(N'-{2-[(метил)(етил)-фосфорил]етил}карбамоїл)-4-гідроксибензил]карбамоїлметокси}-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-{N-[(R)- ![]() -(N-{2-[(метил)(гідрокси)-фосфорил]етил}карбамоїл)-4-гідроксибензил]карбамоїлметокси}-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-(N-{2-[(метил)(гідрокси)-фосфорил]етил}карбамоїл)-4-гідроксибензил]карбамоїлметокси}-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[(R)-N'-(2-метилсульфініл-1-карбоксіетил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[(R)-N'-(2-метилсульфініл-1-карбоксіетил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метокси-8-[N-{(R)- ![]() -[N'-(2-сульфоетил)карбамоїл]-4-гідроксибензил}карбамоїлметокси]-2,3,4,5-тетрагідро-1,5-бензотіазепін;
-[N'-(2-сульфоетил)карбамоїл]-4-гідроксибензил}карбамоїлметокси]-2,3,4,5-тетрагідро-1,5-бензотіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-((R)-1-карбокси-2-метилтіо-етил)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-((R)-1-карбокси-2-метилтіо-етил)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-((S)-1-карбокси-2-(R)-гідроксипропіл)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-((S)-1-карбокси-2-(R)-гідроксипропіл)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-((S)-1-карбокси-2-метилпропіл)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-((S)-1-карбокси-2-метилпропіл)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-((S)-1-карбоксибутил)-карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-((S)-1-карбоксибутил)-карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-((S)-1-карбоксипропіл)-карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-((S)-1-карбоксипропіл)-карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-((S)-1-карбоксіетил)-карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-((S)-1-карбоксіетил)-карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-((S)-1-карбокси-2-(R)-гідроксипропіл)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-((S)-1-карбокси-2-(R)-гідроксипропіл)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діoкco-3,3-дибyтил-5-фeнiл-7-мeтилтіo-8-(N-{(R)- ![]() -[N-(2-cyльфoeтил)кapбaмoїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-(2-cyльфoeтил)кapбaмoїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-((S)-1-карбоксіетил)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-((S)-1-карбоксіетил)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-((R)-1-карбокси-2-метилтіоетил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-((R)-1-карбокси-2-метилтіоетил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-{(S)-1-[N-((S)-2-гідрокси-1-карбоксіетил)карбамоїл]пропіл}карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-{(S)-1-[N-((S)-2-гідрокси-1-карбоксіетил)карбамоїл]пропіл}карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-((S)-1-карбокси-2-метилпропіл)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-((S)-1-карбокси-2-метилпропіл)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-((S)-1-карбоксипропіл)-карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-((S)-1-карбоксипропіл)-карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-[N-((R/S)- ![]() -{N-[1-(R)-2-(S)-1-гідрокси-1-(3,4-дигідроксифеніл)проп-2-іл]карбамоїл}-4-гідроксибензил)карбамоїлметокси]-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-{N-[1-(R)-2-(S)-1-гідрокси-1-(3,4-дигідроксифеніл)проп-2-іл]карбамоїл}-4-гідроксибензил)карбамоїлметокси]-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-(2-(S)-3-(R)-4-(R)-5-(R)-2,3,4,5,6-пентагідроксигексил)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін та
-[N-(2-(S)-3-(R)-4-(R)-5-(R)-2,3,4,5,6-пентагідроксигексил)карбамоїл]-4-гідроксибензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін та
1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N-{(R)- ![]() -[N-(2-(S)-3-(R)-4-(R)-5-(R)-2,3,4,5,6-пентагідроксигексил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
-[N-(2-(S)-3-(R)-4-(R)-5-(R)-2,3,4,5,6-пентагідроксигексил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін;
або її фармацевтично прийнятна сіль, сольват, сольват такої солі або проліки.
Текст
1. S-енантіомер сполуки формули І O R1 CH2 N O O OH C7 H15 O I де R1 представляє 2,4-дифлуорфеніл або циклогексил, та його фармацевтично прийнятні солі, сольвати, кристалічні форми та проліки. 2. Сполука вибрана з групи: (2S)-3-(4-{2-[(циклогексилметил)(гептил)аміно]-2оксоетокси}феніл)-2-етоксипропанова кислота та (2S)-3-(4-{2-[(2,4-дифлуорбензил)(гептил)аміно]-2оксоетокси}феніл)-2-етоксипропанова кислота та їх фармацевтично прийнятні солі, сольвати, кристалічні форми та проліки. 3. (2S)-3-(4-{2-[(циклогексилметил)(гептил)аміно]2-оксоетокси}феніл)-2-етоксипропанова кислота та її фармацевтично прийнятні солі, сольвати, кристалічні форми та проліки. 4. (2S)-3-(4-{2-[(2,4-дифлуорбензил)(гептил)аміно]2-оксоетокси}феніл)-2-етоксипропанова кислота та її фармацевтично прийнятні солі, сольвати, кристалічні форми та проліки. 5. Фармацевтична композиція, що містить сполуку за будь-яким з пп.1-4 у суміші з фармацевтично прийнятними розріджувачами, ад'ювантами або носіями. (13) 77987 2 (11) 1 UA (54) ЗАМІЩЕНІ ПОХІДНІ ФЕНІЛПРОПІОНОВОЇ КИСЛОТИ ЯК АГОНІСТИ АКТИВОВАНОГО ПЕРОКСИЗОМНИМ ПРОЛІФЕРАТОРОМ РЕЦ ЕПТОРА АЛЬФА (АППР) ЛЮДИНИ, СПОСІБ ЇХ ОД ЕРЖАННЯ, ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ НА ЇХ ОСНОВІ, ПРОМІЖНА СПОЛУКА (ВАРІАНТИ) C2 ДО ПАТЕНТУ НА ВИНАХІД (19) ДЕРЖАВНИЙ Д ЕПАРТАМЕНТ ІНТЕЛ ЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 77987 4 6. Спосіб лікування або попередження ліпідних 19. Фармацевтична композиція за п.18, в якій інгірозладів (дисліпідемії), асоційованих або не асоцібітор ТЖККК вибирають з групи: йованих з резистентністю до інсуліну, що полягає 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nу введенні ссавцю, що потребує цього, сполуки за {(R)-1'-феніл-1'-[N'-(карбоксиметил)будь-яким з пп.1-4 . карбамоїл]метил}карбамоїлметокси)-2,3,4,57. Застосування сполуки за будь-яким з пп.1-4 у тетрагідро-1,5-бензотіазепін; виробництві медикаменту для лікування ліпідних 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nрозладів (дисліпідемії), асоційованих або не асоці{(R)a -[N'-(карбоксиметил)карбамоїл]-4йованих з резистентністю до інсуліну. гідроксибензил}карбамоїлметокси)-2,3,4,58. Спосіб лікування або попередження діабету тетрагідро-1,5-бензотіазепін; типу 2, що полягає у введенні ссавцю, що потре1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nбує цього, ефективної кількості сполуки формули І {(R)-1'-феніл-1'-[N'-(2-сульфоетил)за будь-яким з пп.1-4 . карбамоїл]метил}карбамоїлметокси)-2,3,4,59. Спосіб отримання сполуки формули І, в якому тетрагідро-1,5-бензотіазепін; проводять взаємодію сполуки формули II 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(NO {(R)-1'-феніл-1'-[N'-(2-сульфоетил)O CH N R O карбамоїл]метил}карбамоїлметокси)-2,3,4,5II CH R2 тетрагідро-1,5-бензотіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(NO в якій R1 означає 2,4-дифлуорфеніл або циклогек{(R)a -[N'-(2-сульфоетил)карбамоїл]-4сил, R2 представляє захисну гр упу для гідроксилу гідроксибензил}карбамоїлметокси)-2,3,4,5карбоксильної групи, тетрагідро-1,5-бензотіазепін; з агентом, що забезпечує зняття захисту. 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(N10. Сполука формули II {(R)a -[N'-(2-сульфоетил)-карбамоїл]-4O гідроксибензил}карбамоїлметокси)-2,3,4,5O R CH N O тетрагідро-1,5-бензотіазепін; II C H R2 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(NO {(R)a -[N'-(2-карбоксіетил)в якій R1 означає 2,4-дифлуорфеніл або циклогеккарбамоїл]бензил}карбамоїлметокси)-2,3,4,5сил, R2 представляє захисну гр упу для гідроксилу тетрагідро-1,5-бензотіазепін; карбоксильної групи. 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N11. Сполука формули III (R)a -[N'-(2-карбоксіетил)карбамоїл]-4O гідроксибензил}карбамоїлметокси)-2,3,4,5O HO O тетрагідро-1,5-бензотіазепін; III R2 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(N{(R)a -[N'-(5-карбоксипентил)O карбамоїл]бензил}карбамоїлметокси)-2,3,4,5в якій R2 представляє захисну груп у для гідроксилу тетрагідро-1,5-бензотіазепін; карбоксильної групи. 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N12. Фармацевтична композиція, що містить сполуку за будь-яким з пп.1-4 у комбінації з іншим тера{(R)a -[N'-(2-карбоксіетил)карбамоїл] бенпевтичним засобом, що є корисним при лікуванні зил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5розладів, асоційованих з розвитком та прогресом бензотіазепін; атеросклерозу, як-то гіпертензія, гіперліпідемія, 1,1-діоксо-3>3-дибутил-5-феніл-7-метилтіо-8-(N-{ дисліпідемія, діабет та ожиріння. a -[N'-(2-сульфоетил)карбамоїл]-213. Фармацевтична композиція, що містить сполуфлуорбензил}карбамоїлметокси)-2,3,4,5ку за будь-яким з пп.1-4 у комбінації з іншим засотетрагідро-1,5-бензотіазепін; бом модуляції АППР. 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(N14. Фармацевтична композиція, що містить сполу{(R)a -[N'-(R)-(2-гідрокси-1ку за будь-яким одним з пп.1-4 у комбінації із засокарбоксіебом, що знижує рівень холестерину. тил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,515. Фармацевтична композиція, що містить сполутетрагідро-1,5-бензотіазепін; ку за будь-яким з пп.1-4 у комбінації з інгібітором 1,1-дioкco-3,3-дибутил-5-феніл-7-метилтіо-8-(NHMG-CoA редуктази. {(R)a -[N'-(R)-(2-гідрокси-116. Фармацевтична композиція, що містить сполукарбоксіеку за будь-яким з пп.1-4 у комбінації з аторвастатил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5тином або його фармацевтично прийнятною сілтетрагідро-1,5-бензотіазепін; лю, сольватом, кристалічною формою або 1,1-діоксо-3,3-дибутил-5-фeніл-7-метилтіо-8-(Nпроліками. [(R)- a -(N'-{(R)-1-[N"-(R)-(2-гідрокси-1 карбоксіе17. Фармацевтична композиція, що містить сполутил)карбамоїл]-2ку за будь-яким з пп.1-4 у комбінації з розувастагідроксіетил}карбамоїл)бензил]карбамоїлметокси}тином або його фармацевтично прийнятною сіл2,3,4,5-тетрагідро-1,5-бензотіазепін; лю. 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(N18. Фармацевтична композиція, що містить сполу{ a -[N'-(карбоксиметил)карбамоїл]ку за будь-яким з пп.1-4 у комбінації з інгібітором бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,5ТЖККК. бензотіазепін; 1 2 7 15 1 2 7 15 5 77987 6 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(Nкарбамоїл]бензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; { a -[N'-((етокси)(метил)фосфорил1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nметил)карбамоїл]бензил}карбамоїлметокси){(R)a -[N-((S)-1-карбокси-2-(R)2,3,4,5-тетрагідро-1,5-бензотіазепін; 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо-8-(Nгідроксипропіл)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5[(R)a -(N'-{2-[(гідрокси)(метил)тетрагідро-1,2,5-бензотіадіазепін; фосфо1,1-діoкco-3,3-дибyтил-5-фeнiл-7-мeтилтіo-8-(Nрил]етил}карбамоїл)бензил]карбамоїлметокси}2,3,4,5-тетрагідро-1,5-бензотіазепін; {(R)a -[N-(2-cyльфoeтил)кapбaмoїл]-41,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nгідроксибензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; {(R)a -[N'-(2-метилтіо-1-карбоксіетил)1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nкарбамоїл]бензил}карбамоїлметокси)-2,3,4,5{(R)a -[N-((S)-1-карбоксіетил)карбамоїл]-4тетрагідро-1,5-бензотіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-{Nгідроксибензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; [(R)a -(N'-{2-[(метил)(етил)1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nфосфорил]етил}карбамоїл)-4{(R)a -[N-((R)-1-карбокси-2гідроксибензил]карбамоїлметокси}-2,3,4,5тетрагідро-1,5-бензотіазепін; метилтіое1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-{Nтил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; [(R)a -(N-{2-[(метил)(гідрокси)1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nфосфорил]етил}карбамоїл)-4гідроксибензил]карбамоїлметокси}-2,3,4,5{(R)a -[N-{(S)-1-[N-((S)-2-гідрокси-1тетрагідро-1,5-бензотіазепін; карбоксіе1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nтил)карбамоїл]пропіл}карбамоїл]бензил}карбамоїл метокси)-2,3,4,5-тетрагідро-1,2,5-бензотіадіазепін; {(R)a -[(R)-N'-(2-метилсульфініл-11,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nкарбоксіе{(R)a -[N-((S)-1-карбокси-2тил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,5-бензотіазепін; метилпро1,1-діоксо-3,3-дибутил-5-феніл-7-метокси-8-[Nпіл)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; {(R)a -[N'-(2-сульфоетил)карбамоїл]-41,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nгідроксибензил}карбамоїлметокси]-2,3,4,5тетрагідро-1,5-бензотіазепін; {(R)- a -[N-((S)-1-карбоксипропіл)-карбамоїл]-41,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nгідроксибензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; {(R)a -[N-((R)-1-карбокси-2-метилтіо1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-[Nетил)карбамоїл]-4((R/S)a -{N-[1-(R)-2-(S)-1-гідрокси-1-(3,4гідроксибензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; дигідроксифеніл)проп-2-іл]карбамоїл}-41,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nгідроксибензил)карбамоїлметокси]-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; {(R)a -[N-((S)-1-карбокси-2-(R)1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nгідроксипропіл)карбамоїл]-4гідроксибензил}карбамоїлметокси)-2,3,4,5{(R)a -[N-(2-(S)-3-(R)-4-(R)-5-(R)-2,3,4,5,6тетрагідро-1,2,5-бензотіадіазепін; пентагідроксигексил)карбамоїл]-41,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nгідроксибензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін та {(R)a -[N-((S)-1-карбокси-21,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nметилпропіл)карбамоїл]-4{(R)a -[N-(2-(S)-3-(R)-4-(R)-5-(R)-2,3,4,5,6гідроксибензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; пентагідроксигек1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(Nсил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; {(R)- a -[N-((S)-1-карбоксибутил)-карбамоїл]-4або її фармацевтично прийнятна сіль, сольват, гідроксибензил}карбамоїлметокси)-2,3,4,5сольват такої солі або проліки. тетрагідро-1,2,5-бензотіадіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N{(R)a -[N-((S)-1-карбоксипропіл)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8-(N{(R)a -[N-((S)-1-карбоксіетил) вих Представлений винахід стосується деяких нопохідних (2S)-3-(4-{2-[аміно]-2 оксоетокси}феніл)-2-етоксипропанової пропіонової кислоти, способів отримання таких сполук, їх кори 7 77987 8 сності при лікуванні клінічних станів, включаючи що не звертаючись до теорії, можна вважати, що ліпідні розлади (дисліпідемії) або неасоційовані з більша частина активності, асоційованої з пролірезистентністю до інсуліну та інші прояви метабоками, є результатом активності сполуки формули І, лічного синдрому, способів їх терапевтичного зав яку проліки перетворюються. Проліки можна стосування та фармацевтичних композицій, що їх отримувати звичайними способами, добре відомістять. мими фахівцям. Різні проліки на основі карбоксигМетаболічним синдром, включаючи цукровий рупи відомі у рівні техніки. Приклади таких похіддіабет типу 2, стосується комплексу проявів, що них проліків дивись: включають резистентність до інсуліну із супровоa) [Bundgaard Η. Design of Prodrugs. - Elsevier, дженням гіперінсулінемією, можливо цукровим 1985; Widder К. et al, Methods in Enzymology. – діабетом типу 2, артеріальною гіпертензією, 1985. – 42. - P.309-396]; центральним (вісцеральним) ожирінням, дисліпіb) [Krogsgaard-Larsen, Bundgaard Н. A Textдемією, що спостерігають як порушені рівні ліпопbook of Drug Design and Development. Chapter 5 ротеїнів, звичайно характеризується підвищеними "Design та Application of Prodrugs". – 1991. – P.13ЛДНГ (ліпопротеїни дуже низької густини), части191]; нок низької густини ЛНГ та зменшеними концентc) [Bundgaard Н. // Advanced Drug Delivery Reраціями ЛВГ (ліпопротеїн високої густини) і зменviews. – 1992. – 8. – P.1-38]; шеним фібринолізом. d) [Bundgaard H. et al. // Journal of PharmaceutiНещодавні епідеміологічні дослідження покаcal Sciences. – 1988. – 77. – P.285]; зали, що особи з резистентністю до інсуліну мають e) [Kakeya N. et al. // Chem. Pharm. Bull. – 1984. дуже збільшений ризик серцево-судинної захво– 32. – P.692]. рюваності і смертності, особливо потерпаючи від Вищезазначені документи уведені тут як посиінфаркту міокарду та інсульту. При цукровому діалання. беті типу 2 пов'язані з атеросклерозом стани виРозщеплювані in vivo естери є одним типом кликають до 80% усіх смертей. проліків вихідної молекули. Здатний до гідролізу in У клінічній медицині існує усвідомлення у неvi vo (або розщеплюваний) естер сполуки формули обхідності збільшеної чутливості до інсуліну у па(І), що містить карбоксигрупу, є, наприклад, фарцієнтів з метаболічним синдромом, а відтак корекмацевтично прийнятним естером, який гідролізуції дисліпідемії, яка, як вважають, викликає ється у тілі людини або тварини з утворенням виприскорений прогрес атеросклерозу. Однак, зараз хідної кислоти. Належні фармацевтично прийнятні це не є універсально загальноприйнятим діагноестери для карбоксигрупи включають C1зом з добре визначеними фармакотерапевтични6алкоксиметилові естери, наприклад, метоксимеми показаннями. тиловий; C1-6алканоїлокси метилові естери, наприS-енантіомер сполуки формули С нижче: клад, півалоїлоксиметиловий; фталідилові естери; C3-8циклоалкоксикарбонілокси-C1-6алкілові естери, наприклад, 1-циклогексилкарбонілоксіетиловий; С 1,3-діоксолен-2-онілметилові естери, наприклад, 5-метил-1,3-діоксолен-2-онілметиловий; та C16алкоксикарбонілоксіетилові естери, наприклад, 12-етокси-3-[4-(2-{4метоксикарбонілоксіетиловий; та можуть бути метансульфонілоксифеутвореними при будь-якій карбоксигрупі у сполуках ніл}етокси)феніл]пропанова кислота є розкритим у цього винаходу. публікації РСТ [WO, 99/62872]. Ця сполука показаСполуки формули І мають активність, як медина, як модулятор активованих пероксизомним каменти. Зокрема, сполуки формули І є високо проліфератором рецепторів (АППР, для огляду потужними агоністами ΑΠΠΡa. На додаток, сполуАППР дивись [Willson Т.M. et al, J. Med. Chem. ки формули І є також агоністами АППРg. Термін 2000, - Vol. 43. – P.527] та має комбіновану агонісагоністи, який застосовано тут, включає часткові тичну активність ΑΠΠΡa/ΑΠΠΡg [Cronet P. et al, агоністи. Structure. – 2001. – Vol. 9. –P. 699]. Ця сполука є Конкретними сполуками винаходу є: ефективною при лікуванні станів, асоційованих з (2S)-3-(4-{2резистентністю до інсуліну. [(Циклогексилметил)(гептил)аміно]-2Зараз несподівано виявлено ряд сполук, які є оксоетокси}феніл)-2-етоксипропанова кислота; та високо потужними модуляторами ΑΠΠΡa. (2S)-3-(4-{2-[(2,4Згідно з представленим винаходом запропоДифлуорбензил)(гептил)аміно]-2новано S-енантіомер сполуки формули І: оксоетокси}феніл)-2-етоксипропанова кислота; та їх фармацевтично прийнятні солі, сольвати I та кристалічні форми. У представленому описі вираз "фармацевтично прийнятні солі" означає, але без обмеження 1 де: R представляє 2,4-дифлуорфеніл або цисолі основ, як-то солі лужних металів, солі лужноклогексил, а також їх фармацевтично прийнятні земельних металів, солі амонію, солі з основними солі, сольвати, кристалічні форми та проліки. амінокислотами, та солі з органічними амінами. Термін "проліки ", який використано у цьому Слід також розуміти, що деякі сполуки предописі, включає похідні карбонових кислот, як переставленого винаходу можуть існувати у сольватотворюються у ссавці, зокрема людині, у карбонові ваних, наприклад, гідратованих, а також несольвакислоти або солі або їх кон'югати. Слід розуміти, тованих формах. Зрозуміло, що представлений 9 77987 10 винахід охоплює усі такі сольватовані форми. Депадках більш зручним способом, згадані перед тим які сполуки представленого винаходу можуть існуокремі етапи процесу, можна проводити у відмінвати, як таутомери. Зрозуміло, що представлений ному порядку, та/або окремі реакції можна прововинахід охоплює усі такі таутомери. дити на відмінному етапі загального шляху (тобто Сполуки винаходу можна отримувати, як опихімічні перетворення можна проводити з інтермесано нижче. Однак, винахід не обмежено цими діатами, відмінними від асоційованих перед тим з способами, сполуки можна також отримувати, як конкретною реакцією). описано для структурно споріднених сполук у поВираз "інертний розчинник" стосується розпередньому рівні техніки. Реакції можна проводити чиннику, який не реагує з вихідними матеріалами, стандартними способами або як описано в експереагентами, інтермедіатами або продуктами так, риментальному розділі. щоб погано впливати на вихід потрібного продукту. Сполуки формули І можна отримувати реакціСполуки винаходу звичайно застосовуватиєю S-енантіомеру сполуки формули II: муть перорально, парентерально, внутрішньовенно, внутрішньом'язово, підшкірно або іншими ін'єкціями, букально, ректально, вагінально, II трансдермально та/або назально та/або інгаляціями, у формі фармацевтичних препаратів, що містять активний інгредієнт як вільну кислоту або фа1 2 в якій: R визначено раніше, a R представляє рмацевтично прийнятну органічну або неорганічну захисну гр упу для гідроксилу карбоксильної групи, основно-адитивну сіль у фармацевтично прийнятяку описано у [Greene, Wuts. Protective Groups in ній дозованій формі. Залежно від розладу та паціth Organic Synthesis. 2 Ed. – 1991] із засобом позбаєнта, якого лікують, та шля ху застосування комповлення захисту. Захисна гр упа може також бути зиції можна застосовувати у змінних дозах. смолою, як-то смола Wang або 2Належні добові дози сполук винаходу при техлортритилхлоридна смола. Захисні групи можна рапевтичному лікуванні людей складають прибливидалити способами, добре відомими фахівцям. зно 0,0001-100мг/кг маси тіла, переважно 0,001Одною такою захисною групою є та, де R2 пред10мг/кг маси тіла. ставляє C1-6алкоксигрупу або арилалкоксигрупу, Пероральні композиції рецептур є особливо наприклад, бензил, так що COR2 представляє еспереважно таблетками або капсулами, які можна тер. Такі естери можуть реагувати з реагентом для формувати способами, відомими фахівцям для позбавлення від захисту, наприклад, засобом гідзабезпечення доз активної сполуки у межах 0,5ролізу, наприклад, літій гідроксидом у суміші ТГФ 500мг, наприклад, 1мг, 3мг, 5мг, 10мг, 25мг, 50мг, та води, при температурі у межах 0-100°С з утво100мг та 250мг. ренням сполуки формули І. Отже, згідно з представленим винаходом заСполуки формули II можна отримувати реакціпропоновано фармацевтичну композицію рецепєю S-енантіомеру сполуки формули III: тури, що включає будь-яку сполуку винаходу, або її фармацевтично прийнятні похідні з фармацевтично прийнятними ад'ювантами, розріджувачами III та/або носіями. Представлені сполуки формули (І) є кориснив якій R2 визначено раніше, зі сполукою форми для профілактики та/або лікування клінічних мули IV: станів, асоційованих з властивою або індукованою зменшеною чутливістю до інсуліну (резистентність IV до інсуліну) та асоційованих метаболічних розладів (також відомих, як метаболічний синдром). Ці клінічні стани включають, але без обмеження, зав якій R1 визначено раніше, в інертному розгальне ожиріння, абдомінальне ожиріння, артеріачиннику, наприклад, дихлорметані, у присутності льну гіпертензію, гіперінсулінемію, гіперглікемію, засобу сполучення, наприклад, карбодііміду, надіабет типу 2 та дисліпідемію характеристично приклад, 1-(З-диметиламіно-пропіл)-3виявлюваною з резистентністю до інсуліну. Ця етилкарбодііміду, та, як варіант, у присутності кадисліпідемія, також відома як атерогенічний ліпопталізатору, наприклад, основного каталізатору, ротеїновий профіль, характеризується помірно наприклад, 4-диметиламінопіридину, при темперапідвищеними неестерифікованими жирними кистурі у межах від -25°С до 150°С. лотами, підвищеним ліпопротеїном дуже низької Сполуки формули III та IV можна отримувати густини (ЛДНГ) збагаченими тригліцеридами часспособами, описаними у прикладах, або аналогічтинками, високими рівнями Аро В, рівнями ліпопними способами, відомими фахівцям. ротеїну недостатньо високої густини (ЛВГ) асоціСполуки формул II та III є корисними інтермейованими з рівнями частинок з низьким ароАІ та діатами при отриманні сполук формули І та є, мовисокими рівнями Аро В у присутності невеликих жна вважати, новими. Сполуки формул II та III тут компактних частинок ліпопротеїнів низької густини заявлені як наступний аспект представленого ви(ЛНГ), фенотипу В. находу. S-енантіомери сполук формул II та III є Сполуки представленого винаходу, можна чепереважними. кати, є корисними при лікуванні пацієнтів з комбіСполуки винаходу можна відокремити від їх нованими або змішаними гіперліпідеміями або реакційних сумішей звичайними способами. різними ступенями гіпертригліцеридемії та післяФахівцям буде зрозуміло, що для отримання обідньою дисліпідемією з іншими проявами метасполуки винаходу альтернативним, а у деяких ви 11 77987 12 болічного синдрому або без них. синдрому або діабету типу 2 та асоційованих з Лікування представленими сполуками, можна ними ускладнень, це включає бігуанідні ліки, начекати, знижує серцево-судинну захворюваність і приклад, метформін, фенформін та буформін, смертність, асоційовані з атеросклерозом внасліінсулін (аналоги синтетичного інсуліну, амілин) та док їх антидисліпідемічних, а також антизапальних пероральні антигіперглікеміки (поділені на обідні властивостей. Стани серцево-судинних захворюрегулятори глюкози та інгібітори альфавань включають макро-ангіопатії різних вн утрішніх глюкозидази). Прикладом інгібітору альфаорганів, що викликають інфаркт міокарду, застійні глюкозидази є акарбоза або воглібоза або міглісерцеві нестачі, цереброваскулярні захворювання тол. Прикладом обіднього регулятору глюкози є та периферійну артеріальну нестачу нижчих кінцірепаглінід або натеглінід. вок. Внаслідок їх впливу на чутливість до інсуліну Згідно з подальшим аспектом винаходу сполусполуки формули І, можна також чекати, попереку формули І, або її фармацевтично прийнятну джають або затримують розвиток діабету тип у 2 сіль, сольват, сольват такої солі або проліки, можвід метаболічного синдрому та діабету вагі тності. на застосовувати разом з іншим засобом модуляТому розвиток довготривалих ускладнень, асоціції АППР. Засоби модуляції АППР включають але йованих з хронічною гіперглікемією при цукровому без обмеження, АППР альфа та/або гама-агоніст, діабеті, як-то мікро-ангіопатії, що викликають заабо їх фармацевтично прийнятні солі, сольвати, хворювання нирок, пошкодження сітчатки та засольвати таких солей або проліки. Належні АППР хворювання периферійних судин нижчих кінцівок, альфа та/або гама-агоністи, їх фармацевтично можна чекати, буде затриманим. Крім того, сполуприйнятні солі, сольвати, сольвати таких солей ки можуть бути корисними при лікуванні різних або проліки є добре відомими у рівні техніки. Вони станів поза серцево-судинною системою або невключають сполуки, описані у [WO, 01/12187; WO, асоційованих з резистентністю до інсуліну, типу 01/12612; WO, 99/62870; WO, 99/62872; WO, синдрому полікістозу яєчнику, ожиріння, раку та 99/62871; WO, 98/57941; WO, 01/40170; J. Med. станів запальних захворювань включаючи нейроChem. – 1996. – 39. – P.665; Expert Opinion on дегенеративні розлади, як-то помірні порушення Therapeutic Patents. - 10(5). – P.623-634; J. Med. пізнавальної здатності, хвороба Альцгеймера, хвоChem. – 2000. – 43. – P.527], які усі уведені тут як роба Паркінсона та розсіяний склероз. посилання. Особливо альфа та/або гама-агоніст Сполуки представленого винаходу, можна чеАППР стосується NN622/paгаглітазаpy (Ragaglitaкати, є корисними при контролі рівнів глюкози у zar), BMS 298585, WY-14643, клофібрат, фенофібпацієнтів, потерпаючих від діабету типу 2. рат, безафібрат, гемфіброзил та ципрофібрат; GW Згідно з представленим винаходом запропо9578, циглітазон, троглітазон, піоглітазон, розигліновано спосіб лікування або попередження дислітазон, еглітазон, проглітазон, BRL-49634, KRP-297, підемії, синдрому резистентності до інсуліну JTT-501, SB 213068, GW 1929, GW 7845, GW 0207, та/або метаболічних розладів (які визначені вище), L-796449, L-165041 та GW 2433. Особливо АППР що полягає у застосуванні сполуки формули І ссаальфа та/або гама-агоніст стосується (S)-2-етоксивцем (зокрема людиною), що потребує цього. 3-[4-(2-{4-метансульфонілоксифеніл}етокси)Згідно з представленим винаходом запропофеніл]пропанової кислоти та фармацевтично приновано спосіб лікування або попередження діабейнятних її солей. ту типу 2, що полягає у застосуванні ефективної На додаток, комбінацію винаходу можна закількості сполуки формули І ссавцем (зокрема люстосовувати разом з сульфонілсечовиною, як-то диною), що потребує цього. глімепірид, глібенкламід (глібурид), гліклазид, гліЗгідно з подальшим аспектом представленого пізид, гліквідон, хлорпропамід, толбутамід, ацетовинаходу запропоновано застосування сполуки гексамід, глікопірамід, карбутамід, глібонурид, гліформули І, як медикаменту. зоксепід, глібутіазол, глібузол, глігексамід, Згідно з подальшим аспектом представленого глімідин, гліпінамід, фенбутамід, толциламід та винаходу запропоновано застосування сполуки толазамід. Переважно сульфонілсечовиною є гліформули І у виробництві медикаменту для лікумепірид або глібенкламід (глібурид). Більш перевання резистентності до інсуліну та/або метаболіважно сульфонілсечовиною є глімепірид. Тому чних розладів. представлений винахід включає застосування Сполуки винаходу можна комбінувати з іншисполуки представленого винаходу разом з одним, ми терапевтичними засобами, що є корисними при двома або більше існуючими видами терапії, опилікуванні розладів, асоційованих з розвитком та саними у цьому розділі. Дози інших існуючих видів прогресом атеросклерозу, як-то гіпертензії, гіпертерапії для лікування діабету типу 2 та асоційоваліпідемії, дисліпідемії, діабету та ожиріння. Сполуних з ним ускладнень, добре відомі у рівні техніки ки винаходу можна комбінувати з подальшим тета випробувані для застосування регуляторними рапевтичним засобом, що зменшує тілами, наприклад, FDT і можуть бути виявленими співвідношення ЛНПЛВГ або засобом, що виклив Orange Book, опублікованій FDA (Управління по кає зменшення циркуляційних рівнів ЛНГконтролю за продуктами та ліками США). Альтерхолестерину. У пацієнтів з цукровим діабетом спонативно можна застосовувати менші дози, як релуки винаходу можна також комбінувати з терапезультат похідної від комбінації корисності. втичними засобами, використовуваних для лікуПредставлений винахід також включає сполування ускладнень, споріднених з мікроку представленого винаходу у комбінації із засоангіопатією. бом пониження холестерину. Засоби пониження Сполуки винаходу можна застосовувати при холестерину, що стосуються представленої заявінших видах терапії для лікування метаболічного ки, включають, але без обмеження, інгібітори 13 77987 14 HMG-CoA редуктази (3-гідрокси-3-метилглутарил2,3,4,5-тетрагідро-1,4-бензотіазепін-8-іл b-DкоферментА редуктази). Належно інгібітором глюкопіранозидуронова кислота [ЕР, 864582]. HMG-CoA редуктази є статин, вибраний з групи, Інші придатні інгібітори ТЖККК включають що складається з аторвастатину, бервастатину, один з групи: церівастатину, далвастатину, флювастатину, іта1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8вастатину, ловастатину, мевастатину, нікостатину, (N-{(R)-1'-феніл-1'-[(N'-(карбоксиметил)нівастатину, правастатину та симвастатину, або їх карбамоїл]метил}карбамоїлметокси)-2,3,4,5фармацевтично прийнятної солі, особливо натрію тетрагідро-1,5-бензотіазепін; або кальцію, або сольвату, або сольвату такої со1,1-дioкco-3,3-дибyтил-5-фeнiл-7-мeтилтio-8лі. Конкретним статином є аторвастатин, або його (N-{(R)-a-[N'-(кapбoкcимeтил)кapбaмoїл]-4фармацевтично прийнятна сіль, сольват, сольват гідроксибензил}карбамоїлметокси)-2,3,4,5такої солі або проліки. Більш конкретним статином тетрагідро-1,5-бензотіазепін; є кальцієва сіль аторвастатину. Особливо перева1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8жним статином є, однак, сполука з хімічною на(N-{(R)-1'-феніл-1'-[N’-(2-сульфоетил)звою (Е)-7-[4-(4-флуорфеніл)-6-ізопропіл-2карбамоїл]метил}карбамоїлметокси)-2,3,4,5[метил(метилсульфоніл)-аміно]-пірімідин-5тетрагідро-1,5-бензотіазепін; іл](ЗR,5S)-3,5-дигідроксигепт-6-енова кислота, [та1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіокож відома як (Е)-7-[4-(4-флуорфеніл)-6-ізопропіл8-(N-{(R)-1'-феніл-1'-[N’-(2-сульфоетил)2-[N-метил-N-(метилсульфоніл)-аміно]пірімідин-5карбамоїл]метил}карбамоїлметокси)-2,3,4,5іл](ЗR,5S)-3,5-дигідроксигепт-6-енова кислота] або тетрагідро-1,5-бензотіазепін; її фармацевтично прийнятна сіль, сольват, або 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8сольват такої солі. Сполука (Е)-7-[4-(4(N-{(R)-a-[N'-(2-сульфоетил)карбамоїл]-4флуорфеніл)-6-ізопропіл-2-[метилгідроксибензил}карбамоїлметокси)-2,3,4,5(метилсульфоніл)-аміно]-пірімідин-5-іл](ЗR,5S)-3,5тетрагідро-1,5-бензотіазепін; дигідроксигепт-6-енова кислота та її солі натрію 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіоабо кальцію розкрито у Європейській патентній 8-(N-{(R)-a-[N'-(2-сульфоетил)-карбамоїл]-4заявці [ЕР, 0521471, A; Bioorganic and Medicinal гідроксибензил}карбамоїлметокси)-2,3,4,5Chemistry. – 1997. - 5(2). – P. 437-444]. Цей остантетрагідро-1,5-бензотіазепін; ній статин є зараз відомий під загальною назвою 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіорозувастатин. 8-(N-{(R)-a-[N'-(2-карбоксіетил)У представленій заявці термін "засіб пониженкарбамоїл]бензил}карбамоїлметокси)-2,3,4,5ня холестерину" також включає хімічні модифікації тетрагідро-1,5-бензотіазепін; інгібіторів HMG-CoA редуктази, як-то естери, про1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8ліки та метаболіти, активні або неактивні. (N-{(R)-a-[N'-(2-карбоксіетил)карбамоїл]-4Представлений винахід також включає сполугідроксибензил}карбамоїлметокси)-2,3,4)5ку представленого винаходу у комбінації з інгібітотетрагідро-1,5-бензотіазепін; ром транспортної системи жовчної кислоти клубо1,1-діоксо-З-бутил-З-етил-5-феніл-7-метилтіової кишки (інгібітор ТЖККК). 8-(N-{(R)-a-[N’-(2-карбоксипентил)Придатні сполуки, що виявляють інгібіторну карбамоїл]бензил}карбамоїлметокси)-2,3,4,5активність стосовно ТЖККК, описані, дивись, натетрагідро-1,5-бензотіазепін; приклад, сполуки, описані у [WO, 93/16055; WO, 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-894/18183; WO, 94/18184; WO, 96/05188; WO, (N-{(R)-а-[N'-(2-карбоксіетил)карбамоїл]96/08484; WO, 96/16051; WO, 97/33882; WO, бензил}карбамоїлметокси)-2,3,4,5-тетрагідро-1,598/07449; WO, 98/03818; WO, 98/38182; WO, бензотіазепін; 99/32478; WO, 99/35135; WO, 98/40375; WO, 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-899/35153; WO, 99/64409; WO, 99/64410; WO, (N-{a-[N'-(2-сульфоетил)карбамоїл]-200/01687; WO, 00/47568; WO, 00/61568; WO, флуорбензил}карбамоїлметокси)-2,3,4,500/62810; WO, 01/68906; DE, 19825804; WO, тетрагідро-1,5-бензотіазепін; 00/38725; WO, 00/38726; WO, 00/38727; WO, 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо00/38728; WO, 00/38729; WO, 01/68906; WO, 8-(N-{(R)-a-[N’-(R)-(2-гідрокси-101/66533; WO, 02/32428; WO, 02/50051; ЕР, карбоксіе864582; ЕР, 489423; ЕР, 549967; ЕР, 573848; ЕР, тил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5624593; ЕР, 624594; ЕР, 624595; ЕР, 624596], вміст тетрагідро-1,5-бензотіазепін; цих патентних заявок надано тут як посилання. 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8Конкретними класами інгібіторів ТЖККК, при(N-{(R)-a-[(N'-(R)-(2-гідрокси-1датні для застосування у представленому винахокарбоксіеді є бензотієпіни та сполуки, описані у формулі тил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5винаходу, особливо [WO, 00/01687; WO, 96/08484; тетрагідро-1,5-бензотіазепін; WO, 97/33882], що надано тут як посилання. Інши1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8ми придатними класами інгібіторів ТЖККК є 1,2{N-[(R)-a-(N'-{(R)-1-[N"-(R)-(2-гідрокси-1-бензотіазепіни, 1,4-бензотіазепіни та 1,5карбоксіетил)карбамоїл]-2бензотіазепіни. Наступним придатним класом інгігідроксіетил}карбамоїл)бензил]карбамоїлметокси}біторів ТЖККК є 1,2,5-бензотіадіазепіни. 2)3,4,5-тетрагідро-1,5-бензотіазепін; Одною конкретною придатною сполукою, що 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіовиявляє інгібіторну активність стосовно ТЖККК є 8-(N-{a-[N'(3R,5R)-3-бутил-3-етил-1,1-діоксидо-5-феніл 15 77987 16 (карбоксимегідроксипротил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5піл)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,5-бензотіазепін; тетрагідро-1,2,5-бензотіадіазепін; 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-88-(N-{a-[N'-((етокси)(метил)фосфорил(N-{(R)-a-[N-(2-сульфоетил)карбамоїл]-4метил)карбамоїл]бензил}-карбамоїлметокси)гідроксибензил}карбамоїлметокси)-2,3,4,52,3,4,5-тетрагідро-1,5-бензотіазепін; тетрагідро-1,2,5-бензотіадіазепін; 1,1-діоксо-3-бутил-3-етил-5-феніл-7-метилтіо1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-88-{N-[(R)-a-(N'-{2-[(гідрокси)(метил)(N-{(R)-a-[N-((S)-1-карбоксіетил)-карбамоїл]-4фосфогідроксибензил}карбамоїлметокси)-2,3,4,5рил]етил}карбамоїл)бензил]карбамоїлметокси}тетрагідро-1,2,5-бензотіадіазепін; 2,3,4,5-тетрагідро-1,5-бензотіазепін, 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-81,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8(N-{(R)-a-[N-((R)-1-карбокси-2(N-{(R)-a-[N'-(2-метилтіо-1метилтіоекарбоксіетил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5тил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; тетрагідро-1,5-бензотіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-81,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8(N-{(R)-a-[N-{(S)-1-[N-((S)-2-гідрокси-1{N-[(R)-a-(N'-{2-[(метил)(етил)карбоксіефосфорил]етил}карбамоїл)-4тил)карбамоїл]пропіл}карбамоїл]бензил}карбаі\лої гідроксибензил]карбамоїлметокси}-2,3,4,5лметокси)-2,3,4,5-тетрагідро-1,2,5тетрагідро-1,5-бензотіазепін; бензотіадіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-81,1-дioкco-3,3-дибyтил-5-фeнiл-7-мeтилтio-8{N-[(R)-a-(N'-{2-[(метил)(гідрокси)(N-{(R)-a-[N-((S)-1-кapбoкcи-2фосфорил]етил}карбамоїл)-4метилпрогідроксибензил]карбамоїлметокси}-2,3,4,5піл)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,5-бензотіазепін; тетрагідро-1,2,5-бензотіадіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-81,1-дioкco-3,3-дибyтил-5-фeнiл-7-мeтилтio-8(N-{(R)-a-[(R)-N'-(2-метилсульфініл-1(N-{(R)-a-[N-((S)-1-кapбoкcипpoпiл)-карбамоїл]-4карбоксіегідроксибензил}карбамоїлметокси)-2,3,4,5тил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; тетрагідро-1,5-бензотіазепін; 1,1-дioкco-3,3-дибyтил-5-фeнiл-7-мeтилтio-81,1-діоксо-3,3-дибутил-5-феніл-7-метокси-8-[N[N-((R/S)-a-{N-[1-(R)-2-(S)-1-гідрокси-1-(3,4{(R)-a-[N'-(2-сульфоетил)карбамоїл]-4дигідроксифеніл)проп-2-іл]карбамоїл}-4гідроксибензил}карбамоїлметокси]-2,3,4,5гідроксибензил)карбамоїлметокси]-2,3,4,5тетрагідро-1,5-бензотіазепін; тетрагідро-1,2,5-бензотіадіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-81,1-дioкco-3,3-дибyтил-5-фeнiл-7-мeтилтio-8(N-{(R)-a-[N-((R)-1-карбокси-2-метилтіо(N-{(R)-a-[N-(2-(S)-3-(R)-4-(R)-5-(R)-2,3,4,5,6етил)карбамоїл]-4пентапдроксигексил)карбамот]-4гідроксибензил}карбамоїлметокси)-2,3,4,5пдроксибензил}карбамотметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; тетрапдро-1,2,5-бензотіадіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-81,1-дioкco-3,3-дибyтил-5-фeнiл-7-мeтилтio-8(N-{(R)-a-[N-((S)-1-карбокси-2-(R)(N-{(R)-a-[N-(2-(S)-3-(R)-4-(R)-5-(R)-2,3,4,5,6гідроксипропіл)карбамоїл]-4пентагідроксигекгідроксибензил}карбамоїлметокси)-2,3,4,5сил)карбамоїл]бензил}карбамоїлметокси)-2,3,4,5тетрагідро-1,2,5-бензотіадіазепін; тетрагідро-1,2,5-бензотіадіазепін; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8або їх фармацевтично прийнятні сіль, сольват, сольват такої солі або проліки. (N-{(R)-a-[N-((S)-1-карбокси-2Згідно з додатковим аспектом представленого метилпропіл)карбамоїл]-4винаходу запропоновано комбіноване лікування, гідроксибензил}карбамоїлметокси)-2,3,4,5що полягає у застосуванні ефективної кількості тетрагідро-1,2,5-бензотіадіазепін; сполуки формули І, або її фармацевтично прийня1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8тної солі, сольвату, сольвату такої солі або пролі(N-{(R)-a-[N-((S)-1-карбоксибутил)-карбамоїл]-4ків, як варіант, разом з фармацевтично прийнятгідроксибензил}карбамоїлі\летокси)-2,3,4,5ним розріджувачем або носієм, з одночасним, тетрагідро-1,2,5-бензотіадіазепін; послідовним або роздільним застосуванням одно1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8го або більше з таких засобів, вибраних з групи: (N-{(R)-a-[N-((S)-1-карбоксипропіл)Інгібітор БПХЕ (білок переносу холестериновокарбамоїл]бензил}карбамоїлметокси)-2,3,4,5го естеру), наприклад, представлений та описаний тетрагідро-1,2,5-бензотіадіазепін; у [WO, 00/38725], що надано тут як посилання; 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8антагоніст абсорбції холестерину, наприклад, (N-{(R)-a-[N-((S)-1-карбоксіетил)азетидинони, як-то SCH 58235 та описані у US 5 карбамоїл]бензил}карбамоїлметокси)-2,3,4,5767 115, що надано тут як посилання; тетрагідро)-1,2,5-бензотіадіазепін; інгібітор БМП (білок мікросомного переносу), 1,1-діоксо-3,3-дибутил-5-феніл-7-метилтіо-8наприклад, описаний у [Science. – 1998. – 282. – (N-{(R)-a-[N-((S)-1-кapбокси-2-(R) 17 77987 18 P.751-754}, що надано тут як посилання; обмеження, сполуки: кандесартан, кандесартан похідне нікотинової кислоти, включаючи комцилексетил, лосартан, валсартан, ірбесартан, табінаційні продукти та продукти з уповільненим визосартан, телмісартан та епросартан. Особливо вільненням, наприклад, нікотинова кислота (ніапереважними антагоністами ангіотензину II або їх цин), аципімокс та ніцеритрол; фармацевтично прийнятними похідними для зафітостерольна сполука, наприклад, етаноли; стосування у представленому винаході є кандесапробукол; ртан та кандесартан цилексетил. сполука проти ожиріння, наприклад, орлістат Відтак, як додаткову особливість винаходу за[ЕР, 129748] та сибутрамін [GB, 2184122; US, пропоновано спосіб лікування діабету типу 2 та 4929629]; асоційованих з ним ускладнень у теплокровної антигіпертензивна сполука, наприклад, інгібітварини, як-то людини, що потребує такого лікутор ферменту перетворення ангіотензину (ФПА), вання, який полягає у застосуванні вказаною тваантагоніст рецептору ангіотензину II, адренергічриною ефективної кількості сполуки формули І, ний блокатор, альфа адренергічний блокатор, беабо її фармацевтично прийнятної солі, сольвату, та адренергічний блокатор, змішаний альфа/бета сольвату такої солі або проліків з одночасним, адренергічний блокатор, адренергічний стимуляпослідовним або роздільним застосуванням з тор, блокатор кальцій-каналу, блокатор АТ-1, саефективною кількістю одної іншої сполуки, описалуретик, діуретик або судинорозширювач; ної у цьому комбінаційному розділі, або її фармаантагоніст або зворотний агоніст СВ1, наприцевтично прийнятної солі, сольвату, сольвату таклад, який описано у [WO, 01/70700; ЕР, 65635]; кої солі або проліків. антагоніст гормону концентрування меланіну Відтак як додаткову особливість винаходу за(ГКМ); пропоновано спосіб лікування гіперліпідемічних інгібітор PDK; або станів у теплокровної тварини, як-то людини, що модулятори ядерних рецепторів, наприклад, потребує такого лікування, який полягає у застосуLXR, FXR, RXR та RORальфа; або ванні вказаною твариною ефективної кількості її фармацевтично прийнятна сіль, сольват, сосполуки формули І, або її фармацевтично прийняльват такої солі або проліки, як варіант, разом з тної солі, сольвату, сольвату такої солі або проліфармацевтично прийнятним розріджувачем або ків з одночасним, послідовним або роздільним носієм, теплокровною твариною, як-то людиною, застосуванням з ефективною кількістю одної іншої що потребує такого терапевтичного лікування. сполуки, описаної у цьому комбінаційному розділі Конкретні інгібітори ФПА або їх фармацевтичабо її фармацевтично прийнятної солі, сольвату, но прийнятні солі, сольвати, сольвати таких солей сольвату такої солі або проліків. або проліки, включаючи активні метаболіти, які Згідно з іншим аспектом винаходу запропономожна застосовувати у комбінації зі сполукою фовано фармацевтичну композицію, яка містить спормули І, включають але без обмеження, такі сполуку формули І, або її фармацевтично прийнятну луки: алацеприл, алатриоприл, алтіоприл-кальцій, сіль, сольват, сольват такої солі або проліки, та анковенін, беназеприл, беназеприл-гідрохлорид, одну з інших сполук, описаних у цьому комбінаційбеназеприлат, бензоїлкаптоприл, каптоприл, капному розділі, або її фармацевтично прийнятної топрил-цистеїн, каптоприл-глутатіон, церанаприл, солі, сольвату, сольвату такої солі або проліків, цераноприл, церонаприл, цілазаприл, цілазаприразом з фармацевтично прийнятним розріджувалат, делаприл, делаприл-дикислота, еналаприл, чем або носієм. еналаприлат, енаприл, епікаптоприл, фороксиміЗгідно з наступним аспектом представленого тин, фосфеноприл, фосеноприл, фосеноприл навинаходу запропоновано комплект, що містить трій, фоциноприл, фоциноприл-натрій, фоцинопсполуку формули І, або її фармацевтично прийнярилат, фоциноприлова кислота, глікоприл, тну сіль, сольват, сольват такої солі або проліки, геморфін-4, ідраприл, імідаприл, індолаприл, індота одну з інших сполук, описаних у цьому комбіналаприлат, лібензаприл, лізиноприл, ліціюмін А, ційному розділі, або її фармацевтично прийнятну ліціюмін В, міксанприл, моексиприл, моексиприсіль, сольват, сольват такої солі або проліки. лат, мовелтиприл, мурацеїн А, мурацеїн В, мураЗгідно з наступним аспектом представленого цеїн С, пентоприл, периндоприл, периндоприлат, винаходу запропоновано комплект, що містить: півалоприл, півоприл, хінаприл, хінаприлa) сполуку формули І, або її фармацевтично гідрохлорид, хінаприлат, раміприл, раміприлат, прийнятну сіль, сольват, сольват такої солі або спіраприл, спіраприл-гідрохлорид, спіраприлат, проліки, у першій одиничній дозованій формі; спіроприл, спіроприл-гідрохлорид, темокаприл, b) одну з інших сполук, описаних у цьому комтемокаприл-гідрохлорид, тепротид, трандолаприл, бінаційному розділі, або її фармацевтично прийнятрандолаприлат, утибаприл, забіциприл, забіциптну сіль, сольват, сольват такої солі або проліки; у рилат, зофеноприл та зофеноприлат. Переважно другій одиничній дозованій формі; та інгібіторами ФПА для застосування у представлеc) контейнер, що містить вказані першу та друному винаході є раміприл, раміприлат, лізиноприл, гу дозовані форми. еналаприл та еналаприлат. Більш переважно інгіЗгідно з наступним аспектом представленого біторами ФПА для застосування у представленому винаходу запропоновано комплект, що містить: винаході є раміприл та раміприлат. a) сполуку формули І, або її фармацевтично Переважно антагоністи ангіотензину II, їх фаприйнятну сіль, сольват, сольват такої солі або рмацевтично прийнятні солі, сольвати, сольвати проліки, разом з фармацевтично прийнятним розтаких солей або проліки для застосування у комбіріджувачем або носієм, у першій одиничній дозонації зі сполукою формули І включають, але без ваній формі; 19 77987 20 b) одну з інших сполук, описаних у цьому ком(і) Етил (2S)-3(4-[2-(бензилокси)-2бінаційному розділі, або її фармацевтично прийняоксоетокси]феніл)-2-етоксипропаноат тну сіль, сольват, сольват такої солі або проліки, у У розчин етил (2s)-2-етокси-3-(4другій одиничній дозованій формі; та гідроксифеніл)пропаноату (23,8г, 100ммоль, отриc) контейнер, що містить вказані першу та друманого,як описано у [WO, 99/62872] в ацетонітрилі гу дозовані форми. (200мл) додавали безводний калій карбонат Згідно з іншою особливість винаходу запропо(31,9г, 231ммоль), а потім бензилбромацетат новано застосування сполуки формули І, або її (17,4мл, 110ммоль) та реакційну суміш гріли при фармацевтично прийнятної солі, сольвату, сольтемпературі кипіння під зворотним холодильником вату такої солі або проліків, та одної з інших спопротягом ночі. Реакційну суміш охолоджували до лук, описаних у цьому комбінаційному розділі, або кімнатної температури, нерозчинні солі відфільтїї фармацевтично прийнятної солі, сольвату, сольровували та розчин концентрували у вакуумі. Завату такої солі або проліків, у виробництві медилишок переносили у етилацетат (300мл), та оргакаменту для застосування при лікуванні метаболінічну фазу промивали водним натрій чного синдрому або діабету типу 2 та гідрокарбонатом (3x100 мл) та розсолом (100мл), асоційованих з ним ускладнень у теплокровної сушили безводним сульфатом магнію, та конценттварини, як-то людини. рували у вакуумі. Очистка на силікагелі з метиленЗгідно з іншою особливість винаходу запропохлоридом, як елюентом та збирання чистих фракновано застосування сполуки формули І, або її цій дали 22,4г (58%) жовтого масла. 1 фармацевтично прийнятної солі, сольвату, сольH-ЯМР (400МГц, CDCI3): d 1,16 (t, 3Н), 1,22 (t, вату такої солі або проліків, та одної з інших спо3Н), 2,93-2,97 (m, 2H), 3,35 (m, 1H), 3,60 (m, 1H), лук, описаних у цьому комбінаційному розділі, або 3,97 (m, 1H), 4,16 (q, 2H), 4,64 (s, 2H), 5,23 (s, 2H), її фармацевтично прийнятної солі, сольвату, соль6,82 (d, 2H), 7,15 (d, 2H), 7,32-7,39 (m, 5H). 13 вату такої солі або проліків, у виробництві медиC-ЯМР (100МГц, CDCI3): d 14,3, 15,2, 38,6, каменту для застосування при лікуванні гіперліпі60,9, 65,6, 66,3, 67,0, 80,4, 114,6, 128,5, 128,6, демічних станів у теплокровної тварини, як-то 128,7, 130,6, 135,3, 156,7, 169,0, 172,6. людини. (іі) {4-[(2S)-2,3-Діетокси-3Згідно з наступним аспектом представленого оксопропіл]Фенікси}оцтова кислота винаходу запропоновано комбінаційне лікування, У розчин етил (2S)-3-{4-[2-(бензилокси)-2що полягає у застосуванні ефективної кількості оксоетокси]феніл}-2-етоксипропаноат (22,33г, сполуки формули І, або її фармацевтично прийня57,8ммоль) у свіже-дистильованому ТГФ (290мл) тної солі, сольвату, сольвату такої солі або пролідодавали Pd/C (10%, 3,1г) та реакційну суміш гідків, як варіант, разом з фармацевтично прийнятрували під атмосферним тиском при кімнатній теним розріджувачем або носієм, з одночасним, мпературі протягом ночі. Суміш фільтрували через послідовним або роздільним застосуванням ефекшар броунмілериту та фільтрат концентрували у тивної кількості одної з інших сполук, описаних у вакуумі з утворенням 16,6г (97%) світло-жовтого цьому комбінаційному розділі, або її фармацевтимасла. 1 чно прийнятної солі, сольвату, сольвату такої солі H-ЯМР (400МГц, CDCI3): d 1,15 (t, 3Н), 1,21 (t, або проліків, як варіант, разом з фармацевтично ЗН), 2,93-2,98 (m, 2H), 3,35 (m, 1H), 3,60 (m, 1H), прийнятним розріджувачем або носієм теплокров3,97 (m, 1H), 4,16 (q, 2H), 4,65 (s, 2H), 6,84 (d, 2H), ною твариною, як-то людиною, що потребує такого 7,17 (d, 2H), 8,48 (bs, 1H). 13 терапевтичного лікування. C-ЯМР (100МГц, CDCI3): d 14,3,15,1, 38,5, Приклади 61,0, 65,1, 66,4, 80,3, 114,6, 130,7, 130,9, 156,4, 1 13 Виміри Н-ЯМР та С-Я МР проводили на спе172,7, 173,7. ктрометрах Varian Mercury 300 або Varian UNITY (ііі) N-Цикпогексилметилгептанамід plus 400, 500 або 600, при частотах 1Н 300, 400, У розчин амінометилциклогексану (0,34г, 13 500 та 600МГц, відповідно, та при частотах С 75, 3,0ммоль) у метиленхлориді (30мл) додавали геп100, 125 та 150МГц, відповідно. Виміри робили на танову кислоту (0,39г, 3ммоль) та ДМАП (0,37г, дельта-шкалі (8). 3,0ммоль), а потім 1-етил-3-(3Якщо не встановлено інше, хімічні зсуви преддиметиламінопропіл)карбодііміду гідрохлорид -1 ставлено у млн з розчинником, як внутрішнім (0,57г, 3,0ммоль) та реакційну суміш перемішувастандартом. ли при кімнатній температурі протягом ночі. Суміш Скорочення розбавляли метиленхлоридом (100мл), та органічДМСО диметилсульфоксид; ну фазу промивали 5% НСІ (3x75мл), водним наТГФ тетрагідрофуран; трій гідрокарбонатом (75мл) та розсолом (75мл), ДМАП диметиламінопіридин; та сушили сульфатом натрію. Концентрація у ваt куумі дала 0,62г (92%) масла, яке далі кристалізутриплет; валося. 1 s синглет; H-ЯМР (400МГц, CDCI3): d 0,84-0,98 (m, 5H), d дублет; 1,08-1,36 (m, 8H), 1,44 (m, 1H), 1,56-1,78 (m, 8H), q квартет; 2,16 (t, 2H), 3,09 (t, 2H), 5,45 (bs, 1H). 13 m мультиплет; C-ЯМР (100МГц, CDCI3): d 14,1, 22,7, 26,0, bs широкий синглет. 26,6, 29,1, 31,0, 31,7, 37,1, 38,1, 45,8, 173,2. Приклад 1 (iv) N-(Циклогексилметил)-N(23)-3-(4-{2-[(Циклогексилметил)(гептил)аміно]гептиламінгідрохлорид 2-оксоетокси}феніл)-2-етоксипропанова кислота N-(Циклогексилметил)гептанамід (0,58г, 21 77987 22 2,6ммоль) сушили одноразово азеотропним диссуміш перемішували при кімнатній температурі тилюванням з толуолом, переносили у свіжепротягом ночі Суміш підкислювали 2М НСІ та ексдистильованомий ТГФ (23мл) та охолоджували на трагували етилацетатом (4x25мл). Комбіновану льодяній бані під атмосферною аргону. Боран, органічну фазу промивали розсолом (25мл), су(3,2мл 2М розчин метил-сульфідного комплексу у шили сульфатом натрію, та концентрували у вакудіетилетері) додавали та льодяну баню видаляли умі з утворенням 0,027г (93%) безбарвного масла. 1 через 15хв. Реакційну суміш гріли при температурі H-ЯМР (400МГц, CDCI3): d 0,82-0,99 (m, 5H), кипіння під зворотним холодильником протягом 1,10-1,35 (m, 14Н), 1,46-1,82 (m, 8H), 2,94 (m, 1H), 4год. та далі о холоджували до кімнатної темпера3,05 (m, 1H), 3,15 та 3,21 (2d, 2Н, ротамери), 3,25тури. 1,2мл 10% НСІ обережно додавали та суміш 3,46 (m, 3Н), 3,61 (m, 1H), 4,02 (m, 1Н), 4,66 та 4,68 перемішували протягом ночі. Концентрація у ваку(2s, 2H, ротамери), 6,85 (d, 2H), 7,16 (d, 2H), 7,77 умі, а потім додавання охолодженого льодом ТГФ (bs, 1H). 13 (приблизно 15мл) дала білий осад. Воду (приблизC-ЯМР (100МГц, CDCI3): d 14,2, 15,1, 22,7, но 3мл) додавали, а потім толуол (приблизно 26,0, 26,0, 26,4, 26,5, 27,0, 27,0, 27,2, 28,9, 29,1, 10мл) і суміш концентрували у вакуумі. Охолодже31,0, 31,2, 31,9, 36,1, 37,2, 38,0, 46,6, 48,0, 51,8, ний льодом ТГФ (приблизно 15мл) додавали до 53,4, 66,8, 67,3, 67,5, 79,9, 114,7, 114.8, 129,9, залишку та утворений осад відфільтровували та 130,6, 157,1, 157,2, 168,2, 168,3, 175,2. (Число піків сушили у вакуумі, що дало 2,96г сирого продукту, є більшим числа атомів карбону внаслідок ротаяк білу сіль. Цей матеріал використовували у намерів). ступному реакційному етапі без будь-якої очистки. Приклад 2 1 H-ЯМР (400МГц, CD3OD): d 0,87-0,98 (m, 3Н), (2S)-3-(4-(2-[(2,40,97-1,11 (m, 2H), 1,15-1,45 (m, 11Н), 1,65-1,86 (m, Дифлуорбензил)(гептил)аміно]-28H), 2,84 (d, 2H), 2,93-3,01 (m, 2H). оксоетокси)феніл)-2-етоксипропанова кислота 13 C-ЯМР (100МГц, CD3OD): d 14,3, 23,6, 26,6, (і) N-(2.4-Дифлуорбензил)гептанамід 27,0, 27,1, 27,6, 29,9, 31,5, 32,7, 36,4, 55,0. У розчин 2,4-дифлуорбензиламіну (0,43г, (v) Етил(2S)-3-(4-{23,0ммоль) у метиленхлориді (30мл) додавали геп[(циклогексилметил)(гептил)аміно]-2-оксоетокси}танову кислоту (0,39г, 3,0ммоль) та ДМАП (0,37г, феніл)-2-етоксипропаноат 3,0ммоль), а потім 1-етил-3-(3У розчин {4-[(2S)-2,3-діетокси-3диметиламінопропіл)карбодііміду гідрохлорид оксопропіл]фенокси}оцтової кислоти (0,108г, (0,58г, 3,0ммоль) та реакційну суміш перемішува0,36ммоль) у метиленхлориді (3,6 мл) додавали Nли при кімнатній температурі протягом ночі. Суміш (цикпогексилметил)-N-гептиламіну гідро хлорид розбавляли метиленхлоридом (100мл), та органіч(0,090г, 0,36ммоль) та ДМАП (0,098г, 0,80ммоль), ну фазу промивали 5% НСІ (3x75 мл), водним наа потім 1-етил-3-(3трій гідрокарбонатом (75мл) та розсолом (75мл), диметиламінопропіл)карбодііміду гідрохлорид сушили сульфатом натрію. Концентрація у вакуумі (0,070г, 0,36ммоль) та реакційну суміш перемішудала 0,63г (82%) жовтого масла. 1 вали при кімнатній температурі протягом ночі. СуH-ЯМР (400МГц, CDCI3): d 0,83-0,91 (m, 3Н), міш розбавляли метиленхлоридом (25мл) та орга1,22-1,35 (m, 6H), 1,56-1,68 (m, 2H), 2,19 (t, 2H), нічну фазу промивали 5% НСІ (3x25мл), водним 4,43 (d, 2H), 5,80 (bs, 1H), 6,75-6,88 (m, 2H), 7,33 натрій гідрокарбонатом (25мл) та розсолом (25мл), (m, 1H). 13 сушили сульфа том натрію, та концентрували у C-ЯМР (100МГц, CDCI3): d 14,1, 22,6, 25,7, вакуумі. Очистка на попередньо заповненій колон29,0, 31,6, 36,8, 37,1, 104,0 (t), 111,5 (dd), 131,5 ці з силікагелем (Колонка Izolute® SPE, 5г Si/25мл) (dd), 173,2. (Непротоновані атоми карбону не з метанолом (градієнт 0-1%) у метиленхлориді, як представлено). елюенті дала 0,103г (58%) безбарвного масла. (іі) N-(2,4-Дифлуорбензил)-N1 H-ЯМР (400МГц, CDCI3): d 0,83-0,97 (m, 5H), гептиламінгідрохлорид 1,11-1,33 (m, 17Н), 1,45-1,80 (m, 8H), 2,88-3,00 (m, N-(2,4-Дифлуорбензил)гептанамід (0,55г, 2H), 3,14 та 3,19 (2d, 2Н, ротамери), 3,24-3,39 (m, 2,2ммоль) сушили одноразово азеотропним дис3Н), 3,58 (m, 1H), 3,95 (m, 1H), 4,15 (q, 2Н), 4,64 та тилюванням з толуолом, переносили у свіжедис4,66 (2s, 2H, ротамери), 6,84 та 6,84 (2d, 2H, ротатильований ТГФ (19мл) та охолоджували на льомери), 7,14 (d, 2H). дяній бані під атмосферною аргону. Боран, (2,7мл 13 C-ЯМР (100МГц, CDCI3): d 14,2, 14,3, 15,2, 2М розчин диметилсу-льфідного комплексу у діе22,7, 26,0, 26,0, 26,5, 26,5, 27,0, 27,0, 27,2, 28,9, тилетері) додавали та льодяну баню видаляли 29,1, 31,0, 31,2, 31,9, 36,1, 37,3, 38,6, 46,4, 48,0, через 15хв. Реакційну суміш гріли при температурі 51,7, 53,3, 60,9, 66,3, 67,5, 67,7, 80,4, 114,6, 114.7, кипіння під зворотним холодильником протягом 130,2, 130,5, 157,1, 157,1, 167,8, 167,9, 172,6. (Чи4год. та далі о холоджували до кімнатної темперасло піків є більшим числа атомів карбону внаслітури. 1,0мл 10% НСІ обережно додавали та суміш док ротамерів). перемішували протягом ночі. Концентрація у ваку(vі) (2S)-3-(4-(2умі, а потім додавання охолодженого льодом ТГФ [(циклогексилметил)(гептил)аміно1-2(приблизно 15мл) дали осад, який відфільтровуоксоетокси)феніл)-2-етокси-пропанова кислота вали та сушили у вакуумі з утворенням 0,81г сироУ розчин етил (2S)-3-(4-{2го продукту, як білуватої солі. Цей матеріал вико[(циклогексилметил)(гептил)аміно]-2ристовували у наступному реакційному етапі без оксоетокси}феніл)-2-етокси-пропаноату (0,031г, будь-якої очистки. 1 0,057ммоль) у ТГФ (2,0мл) додавали воду (2,0мл) H-ЯМР (400МГц, CD3OD): d 0,88-0,95 (m, 3Н), та літій гідроксид (0,006г, 0,26ммоль), і реакційну 1,27-1,45 (m, 8H), 1,66-1,79 (m, 2H), 3,03-3,10 (m, 23 77987 24 2H), 4,27 (s, 2H), 7,06-7,17 (m, 2H), 7,62 (m, 1H). атомів карбону внаслідок ротамерів. Флуоровані 13 атоми карбону не представлено). C-ЯМР (100МГц, CD3OD): d 14,3, 23,6, 27,1, 27,5, 29,8, 32,7, 45,0 (d), 48,9,105,4 (t), 113,3 (dd), Біологічна активність композицій рецептур Сполуки розчиняли у ДМСО для отримання 134,8 (dd). (Непротоновані атоми карбону не пред16мМ вихідних розчинів. Перед дослідженням виставлено). хідні розчини далі розбавляли ДМСО та культива(ііі) Етил (2S)-3-(4-(2-[(2,4ційними середовищами. дифлуорбензил)(гептил)аміно]-2-оксоетокси)феніл)-2-етоксипропаноат Загальні хімікати та реагінти Реагент для люциферазного дослідження У розчин {4-[(2S)-2,3-діетокси-3одержували від Packard, USA. Рестрикційні фероксопропіл]фенокси}оцтової кислоти (0,104г, менти одержували від Boehringer, a Vent поліме0,35ммоль) у метиленхлориді (3,5мл) додавали Nразу від New England Biolabs. (2,4-дифлуорбензил)-N-гептиламіну гідрохлорид (0,098г, 0,35ммоль) та ДМАП (0,094г, 0,77ммоль), Лінії клітин та умови культивації клітин U2-OS, (Остеогенічна саркома людини) одера потім 1-етил-3-(3жували з АТСС, USA. Клітини розмножували та диметиламінопропіл)карбодііміду гідрохлорид знов заморожували партіями з шести прогонів. (0,067г, 0,35ммоль) та реакційну суміш перемішуКлітини культивували у модифікованому Дульбеквали при кімнатній температурі протягом ночі. Суміш розбавляли метиленхлоридом (50мл), та орко середовищі Ігла (МДСІ) з 25мМ глюкози, 2мМ глутаміну або 4мМ L-апаніл-1-глутаміну,10% сироганічну фаз у промивали 5% НСІ (3x25мл), водним ватки зародка теляти, при 5% СО2. Буферований натрій гідрокарбонатом (25мл) та розсолом (25мл), фосфа том фізіологічний розчин (БФФР) без додасушили сульфа том натрію, та концентрували у вання кальцію або магнію використовували. Усі вакуумі. Очистка на попередньо заповненій колонці з силікагелем (Колонка Izolute® SPE, 5г Si/25мл) реагенти культивації клітин були від Gibco (USA), а 96-коміркові планшети культивації клітин одержуз метанолом (градієнт 0-1%) у метиленхлориді, як вали від Wallach. елюенті дала 0,066г (36%) безбарвного масла. 1 Плазмідні констракти для гетерологічної ексH-ЯМР (400МГц, CDCI3): d 0,81-0,90 (m, 3Н), пресії 1,15 (t, 3Н), 1,17-1,31 (m, 11Н), 1,43-1,65 (m, 2H), Стандартну техніку рекомбінантної ДНК про2,89-3,00 (m, 2H), 3,24-3,39 (m, 3Н), 3,59 (m, 1H), водили, як описано Ausubel (7). Репортерний век3,96 (m, 1H), 4,15 (q, 2H), 4,60 (s, 2H), 4,69 та 4,70 тор люциферази, pGLSUAS (клон складається з 5 (2s, 2Н, ротамери), 6,73-6,88 (m, 4Н), 7,08-7,22 та копій зв'язуючої ДНК посилальної послідовності 7,22-7,31 (2m, 3Н, ротамери). 13 GAL4, C-ЯМР (100МГц, CDCI3): d 14,1, 14,3, 15,1, 5'-COACGGAGTACTGTCCTCCGAGCT-3', 22,6, 26,9, 27,1, 28,7, 29,0, 31,8, 38,5, 41,5, 44,3, клонованої у сайти Sacl/Xhol промотеру pGL3 46,1, 47,2, 60,9, 66,3, 67,5, 68,1, 80,3, 103,6 (t), (Promega). Фрагмент Sacl/Xhol, що несе сайти 104,2 (t), 111,6 (dd), 114,4, 114,6, 119,8 (dd), 120,3 UAS, створювали, використовуючи гібридизовані (dd), 129,6 (dd), 130,4, 130,6, 131,7 (dd), 156,7, частково перекриті олігонуклеотиди. 156,9, 168,2, 168,3, 172,5. (Число піків є більшим Вектори експресії, що використані, базуються числа атомів карбону внаслідок ротамерів. Флуона pSG5 (Stratagene). Усі вектори містять фрагровані атоми карбону не представлено). мент EcoRI/Nhel, що кодує ДНК-звязуючий домен (iv) (2S)-3-(4-(2-[(2,4GAL4 (що кодує позиції амінокислот 1-145 з поДифлуорбензил)(гептил)аміно]-2повнення бази даних номер Р04386), а потім фраоксоетокси)феніл)-2-етоксипропанова кислота гмент сполучення у рамці, що кодує ядерну локаУ розчин етил (2S)-3-(4-{2-[(2,4лізацію посилальної послідовності Т-антигену дифлуорбензил)(гептил)аміно]-2вірусу поліоми. оксоетокси}феніл)-2-етоксипропаноату (0,047г, Локалізовану в ядрі посилальну послідовність 0,090ммоль) у ТГФ (2,0мл) додавали воду (2,0мл) створювали, використовуючи гібридизовані частта літій гідроксид (0,010мг, 0,42ммоль) і реакційну ково перекриті олігонуклеотиди, створюючи липучі суміш перемішували при кімнатній температурі кінці Nhel/Kpnl протягом ночі. Реакційну суміш концентрували у (5'вакуумі, підкислювали 2М НСІ, та екстрагували CTAGCGCTCCTAGAAGAAACGCAAGGTTGGTACетилацетатом (4x25 мл). Комбіновану органічну 3'). фазу промивали розсолом (25мл), сушили сульЗвязуючі ліганд домени від АППРa людини та фатом натрію, та концентрували у вакуумі з утвомиші та ΑΠΠΡg людини та миші ПЛРренням 0,044г (89%) безбарвного масла. 1 ампліфікували, як фрагменти Kpnl/BamHI та клоH-ЯМР (400МГц, CDCI3): d 0,83-0,93 (m, 3Н), нований у ДНК-звязуючий домен рамки GAL4 та 1,17 (t, 3Н), 1,20-1,35 (m, 8H), 1,45-1,67 (m, 2H), ядерну локалізацію посилальної послідовності. 2,90-3,14 (m, 2H), 3,26-3,35 (m, 2H), 3,42 (m, 1H), Посилальну послідовність усіх використаних пла3,63 (m, 1H), 4,04 (m, 1H), 4,63 (s, 2H), 4,74 (s, 2H), змідних констрактів підтверджували секвенсуван6,75-6,90 (m, 4H), 7,11-7,22 та 7,25-7,35 (2m, 3Н, ням. Такі вектори експресії використовували для ротамери), 9,13 (bs, 1Н). 13 перехідних трансфекцій: C-ЯМР (100МГц, CDCI3): d 14,1, 15,1, 22,6, 26,9, 27,1, 28,6, 29,0, 31,8, 38,0, 41,6, 44,3, 46,2, 47,3, 66,8, 67,3, 68,0, 79,8, 103,7 (t), 104,3 (t), 104,3, 111,7 (dd), 114,6, 114,7, 119,7 (dd), 120,1 (dd), 129,7 (m), 130,1, 130,7, 131,8 (dd), 156,8, 157,0, 168,6, 168,7, 175,6. (Число піків є більшим числа 25 Вектор pSGGALhPPa pSGGALmPPa pSGGALhPPg pSGGALmPPg 77987 26 Посилальна послідовність 1) S74349,nt 625-1530 X57638,nt 668-1573 U63415,nt 613-1518 U09138,nt 652-1577 Кодований підтип АППР людини АППРa миші АППРa людини ΑΠΠΡg миші ΑΠΠΡg Примітка: 1) - Стосується позицій нуклеотидів входу в базу даних, використаного для експресування звязуючого ліганд домену. Заморожені вихідні партії клітин з прогону шість розморожували та розмножували для прогону номер вісім перед трансфекціями. Конфлюєнтні клітини трипсинізували, промивали та гранулювали центрифугуванням при 270хg протягом 2хв. Гранулу клітин знов суспендували у холодному БФФР до концентрації клітин приблизно 18´106 клітини/мл. Після додавання ДНК суспензію клітин інкубували на льоді протягом приблизно 5хв. перед електропорацією при 230В, 960мкФ у Biorad's Gene Pulser™ партіями по 0,5мл. Загалом 50мкг ДНК додавали до кожної партії по 0,5мл клітин, включаючи 2,5мкг вектору експресії, 25мкг репортерного вектору та 22,5мкг неспецифічної ДНК (pBluescript, Stratagene). Після електропорації клітини розбавляли до концентрації 320000 клітини/мл у МДСІ без фенолчервоного, та приблизно 25000 клітин/комірку засівали у 96-коміркових планшетах. Для повернення клітин засіяні планшети інкубували при 37°С протягом 3-4год. Перед додавання тест-сполук. У дослідженнях АППРa, клітинне середовище доповнювали десорбованою зі смоли-вугілля сироваткою зародка теляти (СЗТ) для запобігання зворотній активації жирно-кислотними компонентами СЗТ. Десорбовану зі смоли-вугілля СЗТ продукували так: до 500мл інактивованої теплом СЗТ додавали 10г вугілля та 25г аналітичної аніонообмінної смоли Bio-Rad 200-400 меш, та розчин перемішували магнітною мішалкою при кімнатній температурі протягом ночі. У наступну добу СЗТ центрифугували та перемішування продовжували протягом 4-6год. Після другої обробки СЗТ центрифугували та фільтр стерилізували для видалення залишків вугілля та смоли. Вихідні розчини сполук у ДМСО розбавляли у прийнятних концентраційних межах у основних планшетах. З основних планшетів сполуки розбавляли у к ультиваційних середовищах для отримання розчинів тест-сполук для кінцевих доз. Після доведення кількості клітинного середовища до 75мкл у кожній комірці, додавали 50мкл розчину тест-сполуки. Перехідно трансфектовані Комп’ютерна в ерстка В.Сердюк клітини піддавали дії сполук протягом приблизно 24год. перед проведенням дослідження визначення люциферази. Для досліджень люциферази, 100мкл реагенту для дослідження додавали вручну у кожну комірку та планшети залишали приблизно на 20хв. для лізису клітин. Після лізису активність люциферази вимірювали у лічильнику 1420 Multiwell, Victor, від Wallach. Піоглітазон TZD використовували, як посилальну речовин для активації ΑΠΠΡg людини та миші. 5,8,11,14-Ейкозатетраіонову кислоту (ΕΤΥΑ) використовували, як посилальну речовину для АППРa людини. Для розрахунку величин ЕК50 отримували криву концентрація-ефект. Використані величини були похідними від середнього з двох чи трьох незалежних вимірів (після вирахування середньої величини фону) та виражали як процент максимальної активації, отриманої з посилальною сполукою. Величини відкладали проти логарифму концентрації тест-сполуки. Величини ЕК50 вираховували лінійною інтерполяцією даних та розрахунком концентрації, потрібної для 50% від максимальної активації, отриманої з посилальною сполукою. Сполуки формули І мають ЕК50 менше 0,5мкмоль/л для АППРa, а переважні сполуки мають ЕК50 менше 0,05мкмоль/л для АППРa. Сполуки формули І є вибраною групою сполук за тим, що вони є більш потужними стосовно АППРa, ніж стосовно ΑΠΠΡg. Можна вважати, що це співвідношення є важливим з огляду на фармакологічну активність сполук та їх терапевтичний профіль. На додаток, сполуки представленого винаходу виявляють поліпшені властивості DMPK (метаболізм ліків та фармакокінетика), наприклад, вони виявляють поліпшену метаболічну стабільність in vitro, а також виявляють сприятливі криві дозареакція in vivo. Сполуки також мають перспективний токсикологічний профіль. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSubstituted derivatives of phenylpropionic acid as agonists of peroxisome proliferators activated alpha receptor, method for synthesis, pharmaceutical composition, intermediate (variants)
Автори англійськоюAlstermark Lindstedt Eva-Lotte, Olsson Anna Christina, Li Lanna
Назва патенту російськоюЗамещенные производные фенилпропионовой кислоты как агонисти активированного пероксисомным пролифератором рецептора альфа (аппр) человека, способ их получения, фармацевтическая композиция на их основе, промежуточное соединение (варианты)
Автори російськоюАльстермарк Линдстедт Эва-Лотте, Ольссон Анна Кристина, Ли Ланна
МПК / Мітки
МПК: A61K 31/192, A61K 31/195, A61P 3/10, A61P 43/00, C07C 69/734, A61P 9/12, C07C 69/736, A61P 9/10, A61K 31/16, C07C 235/20, A61K 45/06, A61P 3/06, A61P 3/00, A61K 31/40, C07C 231/00, A61K 45/00, A61K 31/554, A61K 31/505, A61P 3/04
Мітки: фармацевтична, аппр, пероксизомним, сполука, агоністи, варіанти, основі, альфа, активованого, проліфератором, спосіб, проміжна, фенілпропіонової, композиція, одержання, рецептора, похідні, людини, заміщені, кислоти
Код посилання
<a href="https://ua.patents.su/13-77987-zamishheni-pokhidni-fenilpropionovo-kisloti-yak-agonisti-aktivovanogo-peroksizomnim-proliferatorom-receptora-alfa-appr-lyudini-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-na-k.html" target="_blank" rel="follow" title="База патентів України">Заміщені похідні фенілпропіонової кислоти як агоністи активованого пероксизомним проліфератором рецептора альфа (аппр) людини, спосіб їх одержання, фармацевтична композиція на їх основі, проміжна сполука (варіанти)</a>
Попередній патент: Спосіб одержання солей біциклічних дикетонів
Наступний патент: Мишощуроловка коротюка – доробала
Випадковий патент: Газорозрядна електронна пушка












