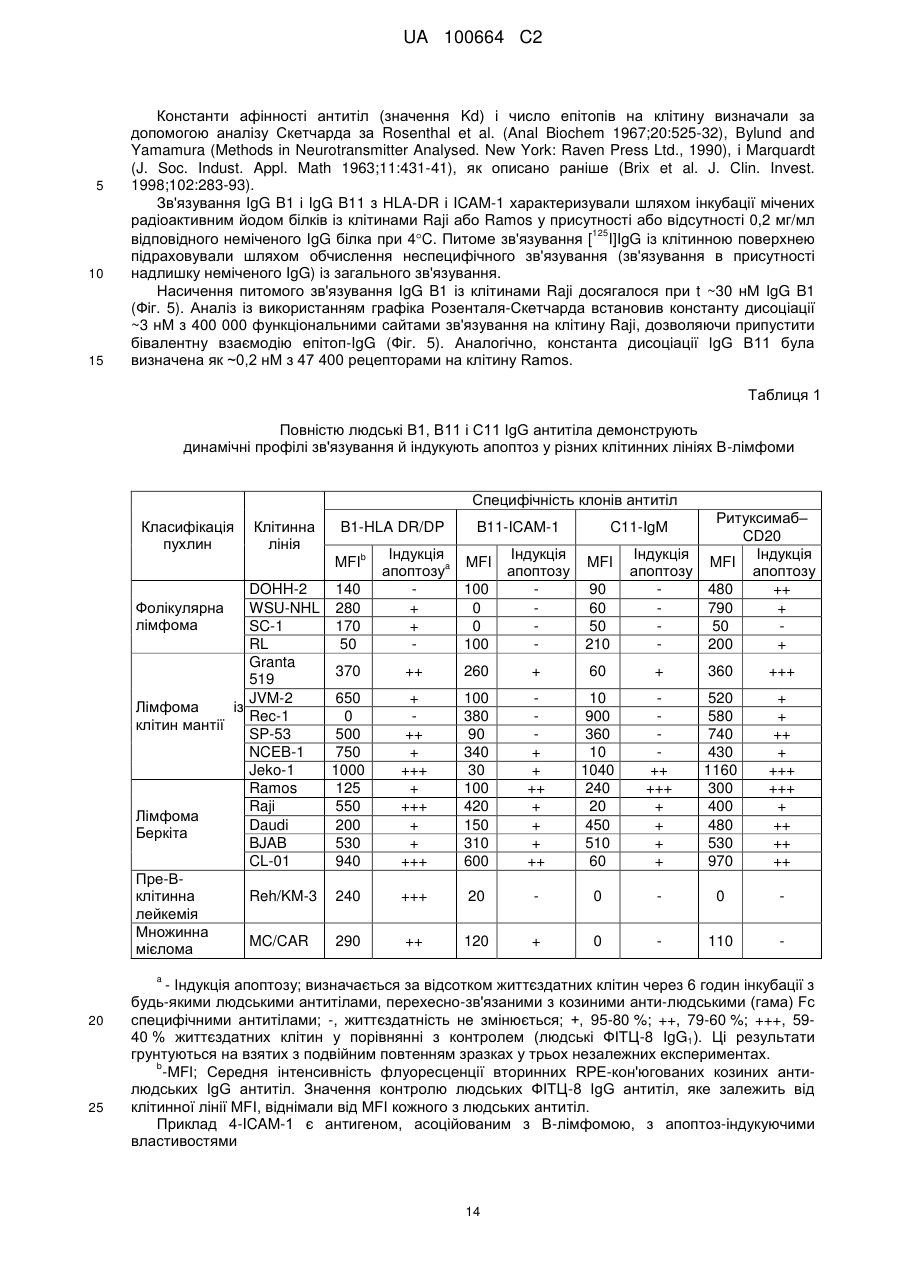
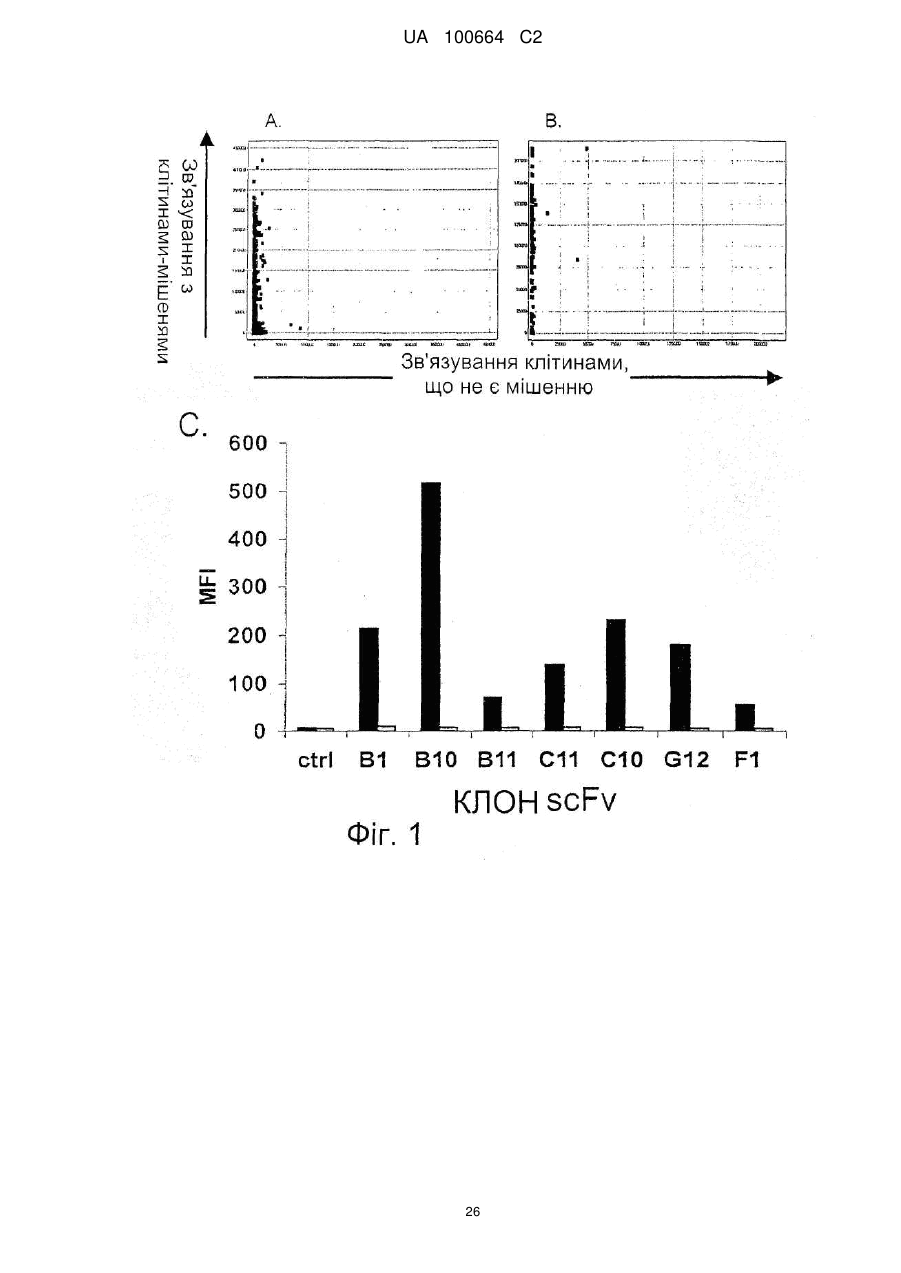
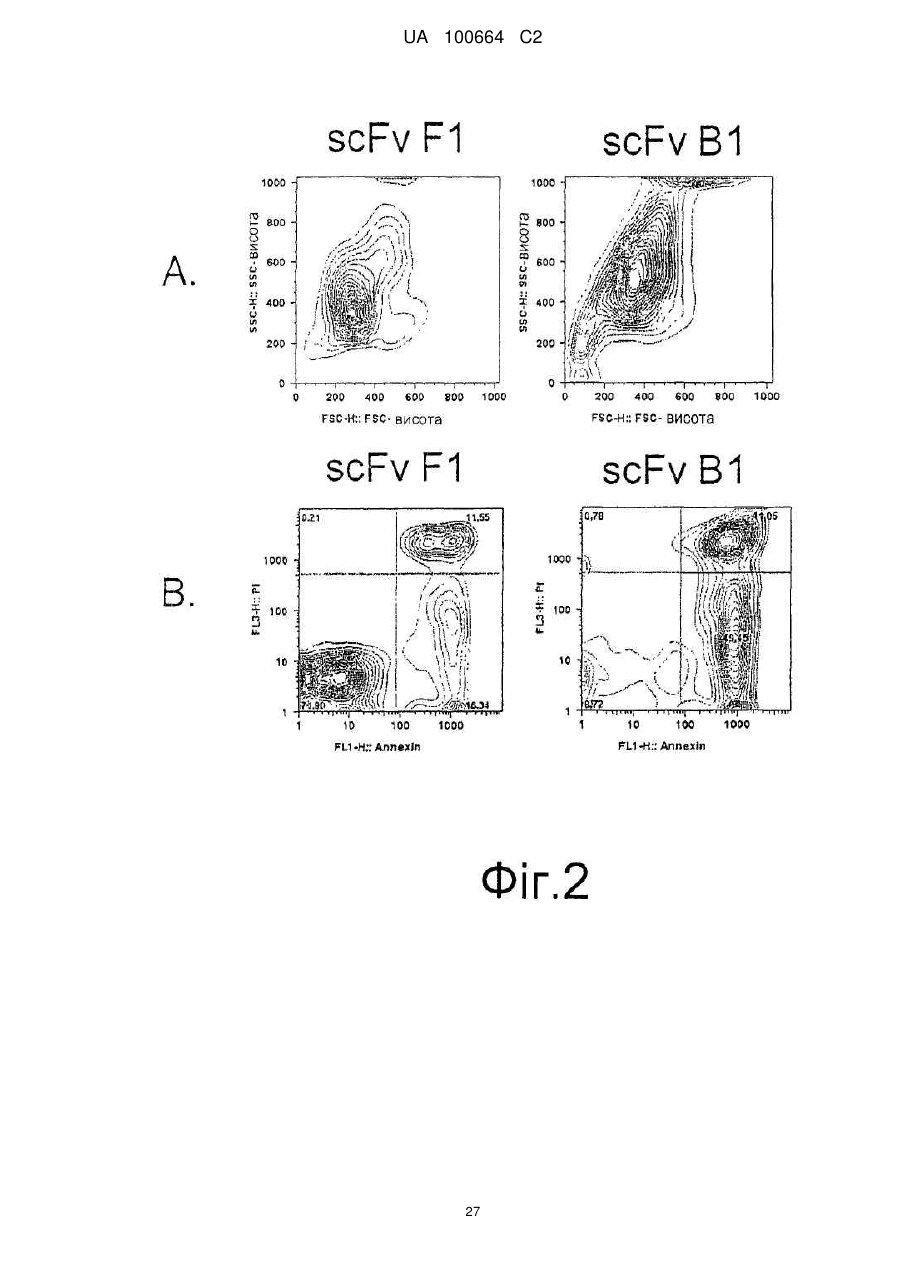
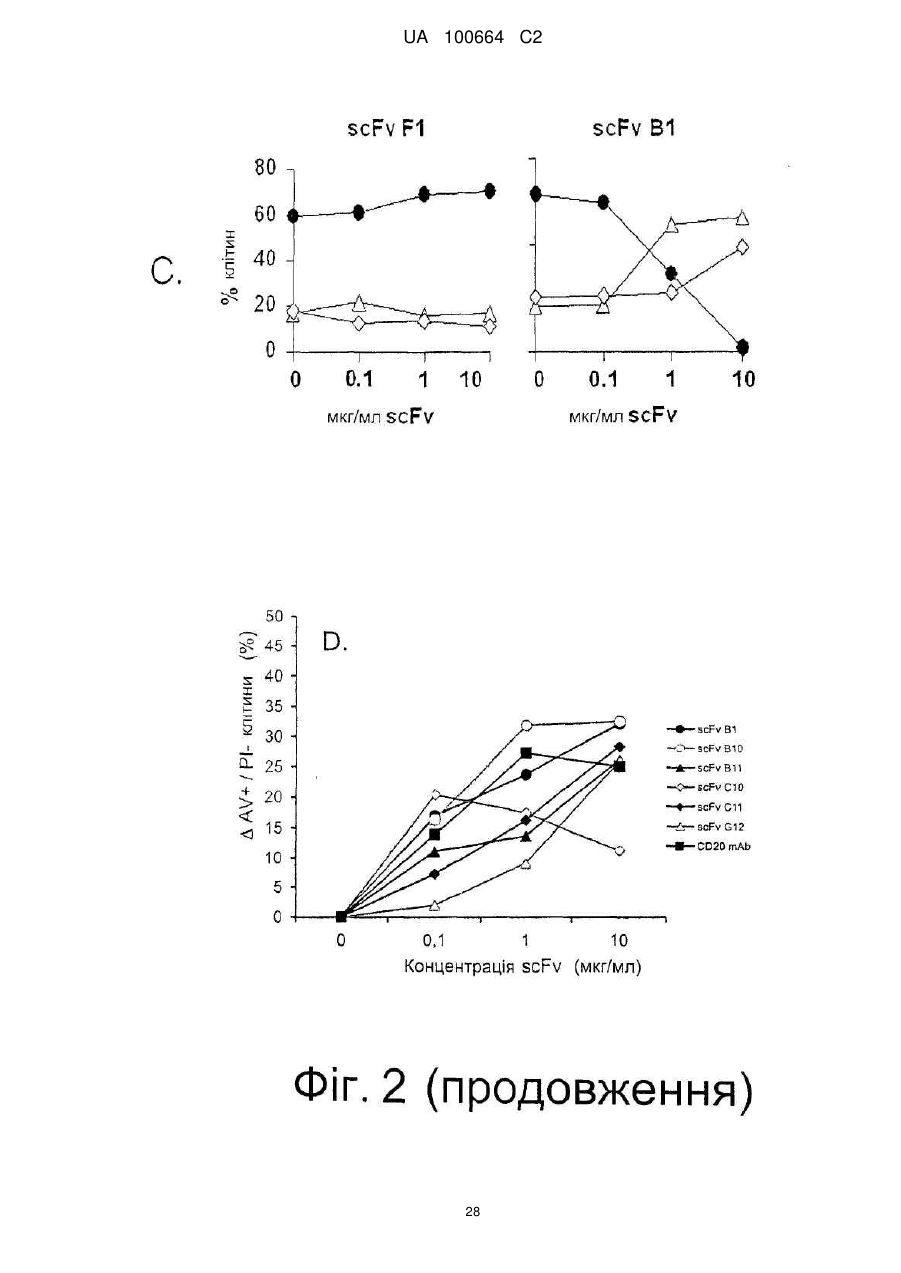
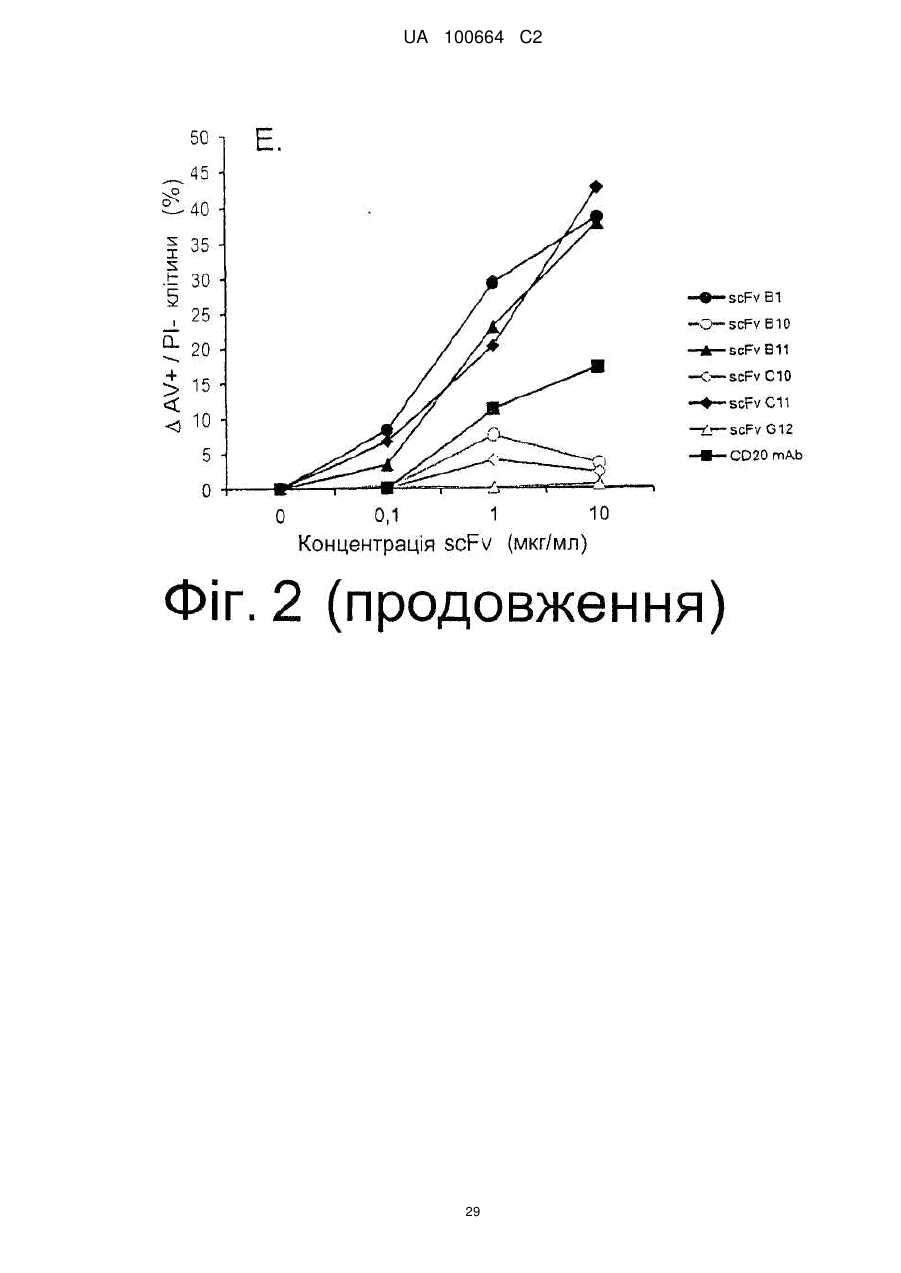
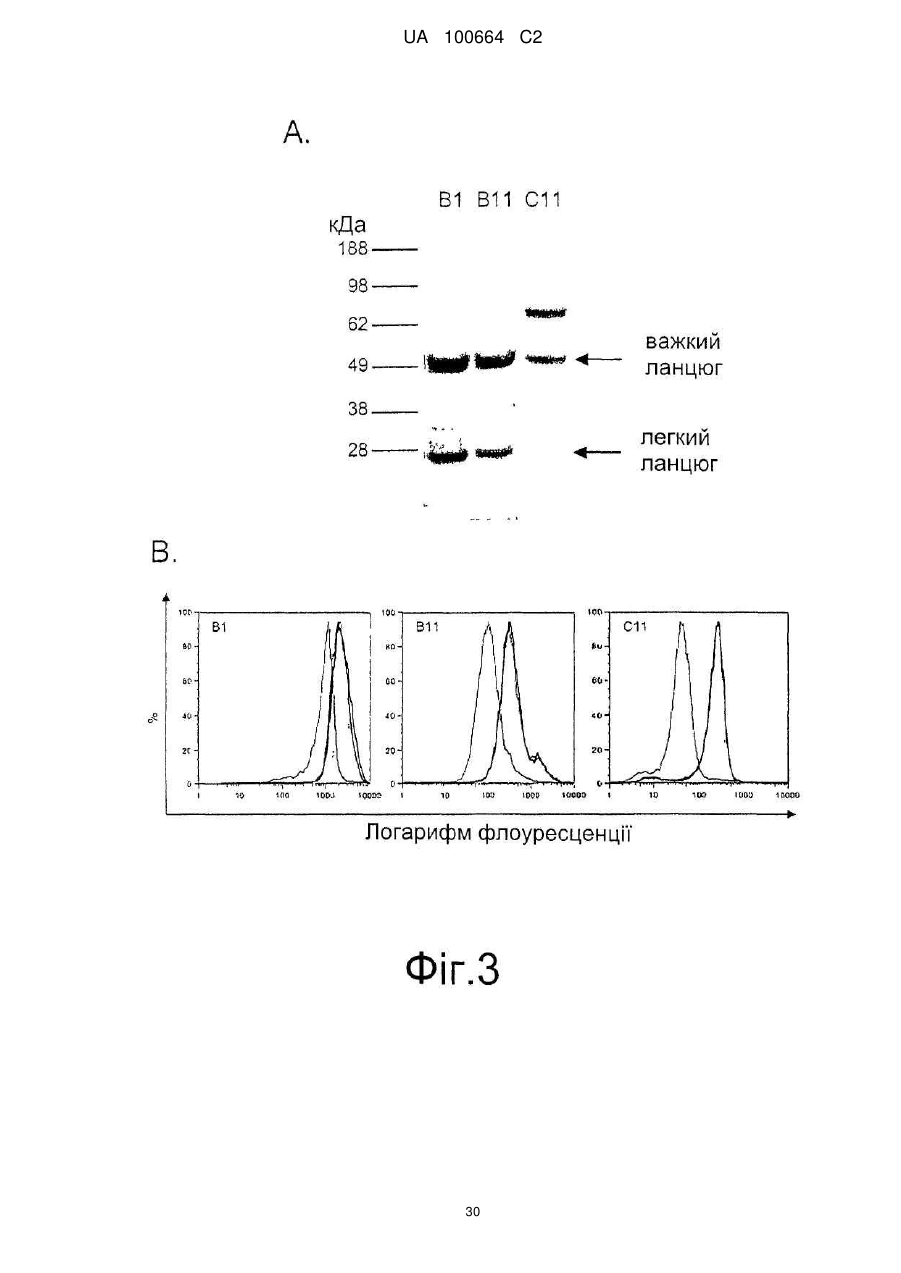
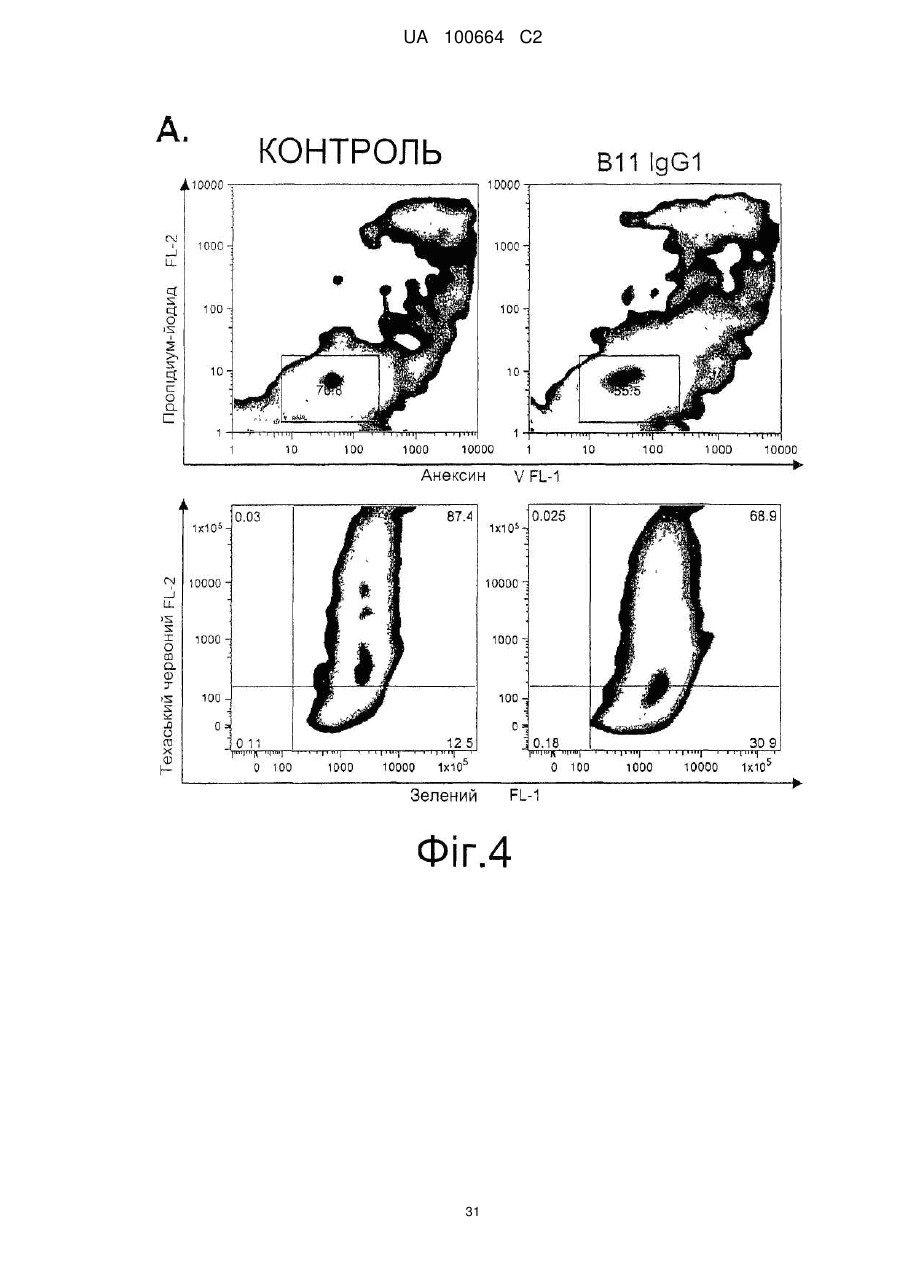
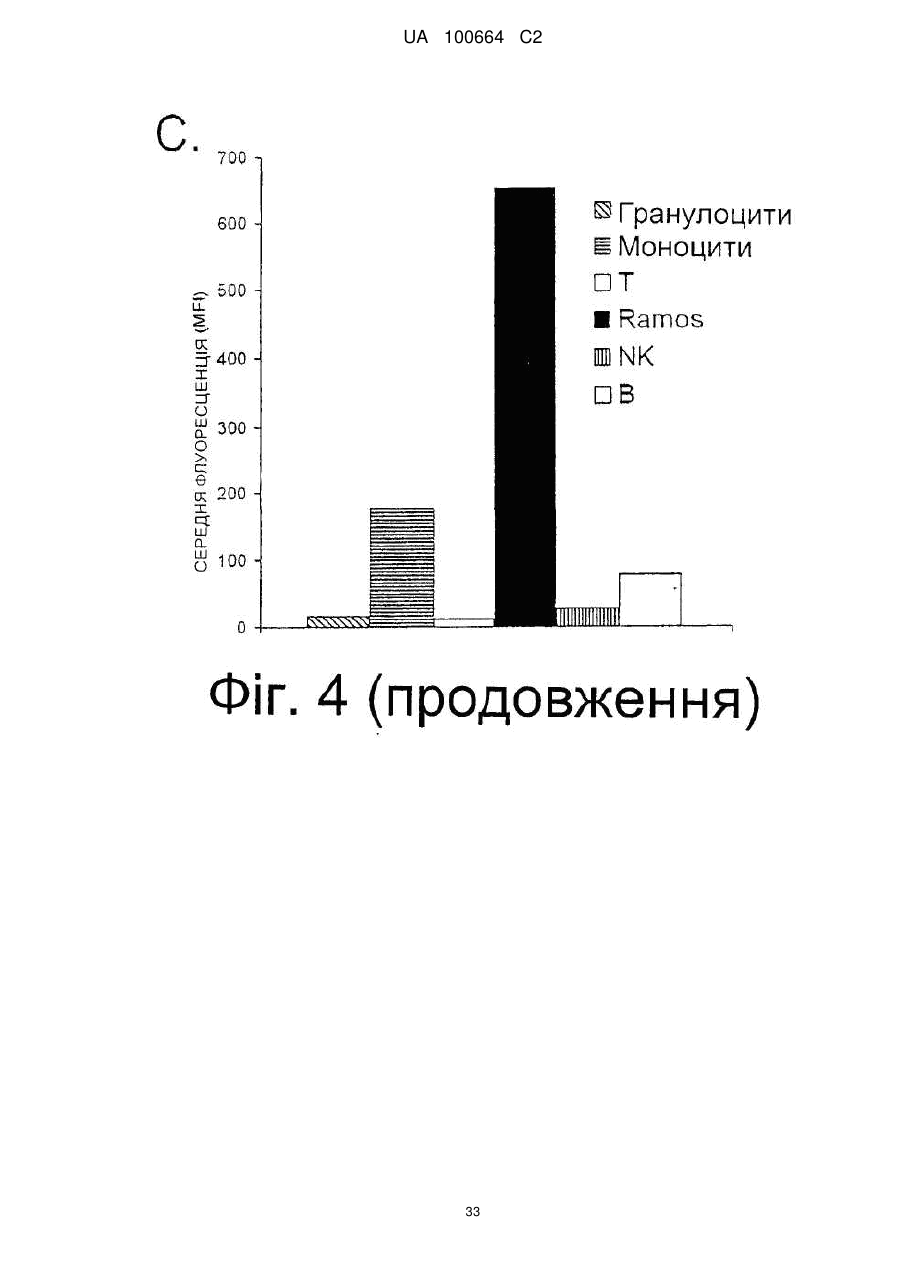
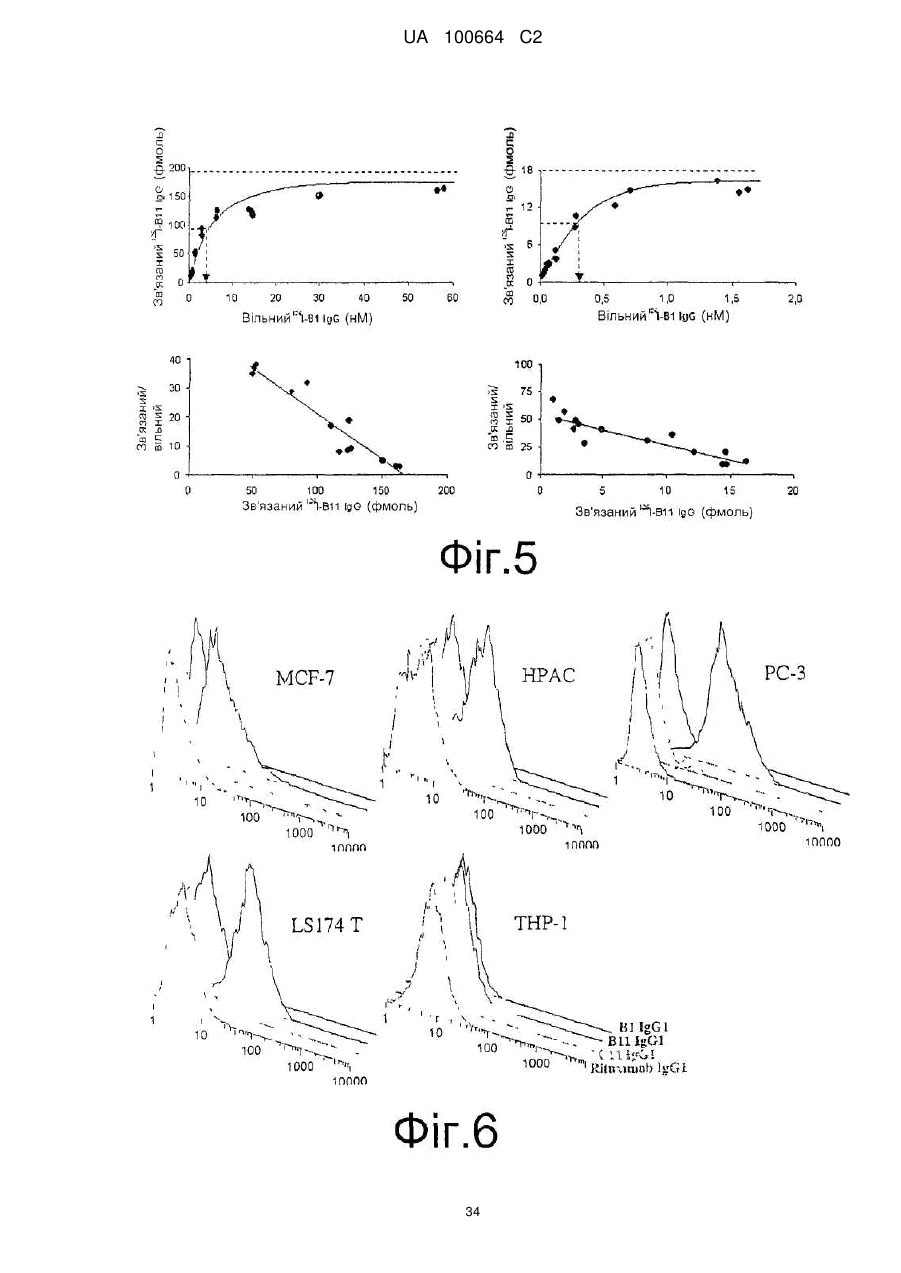
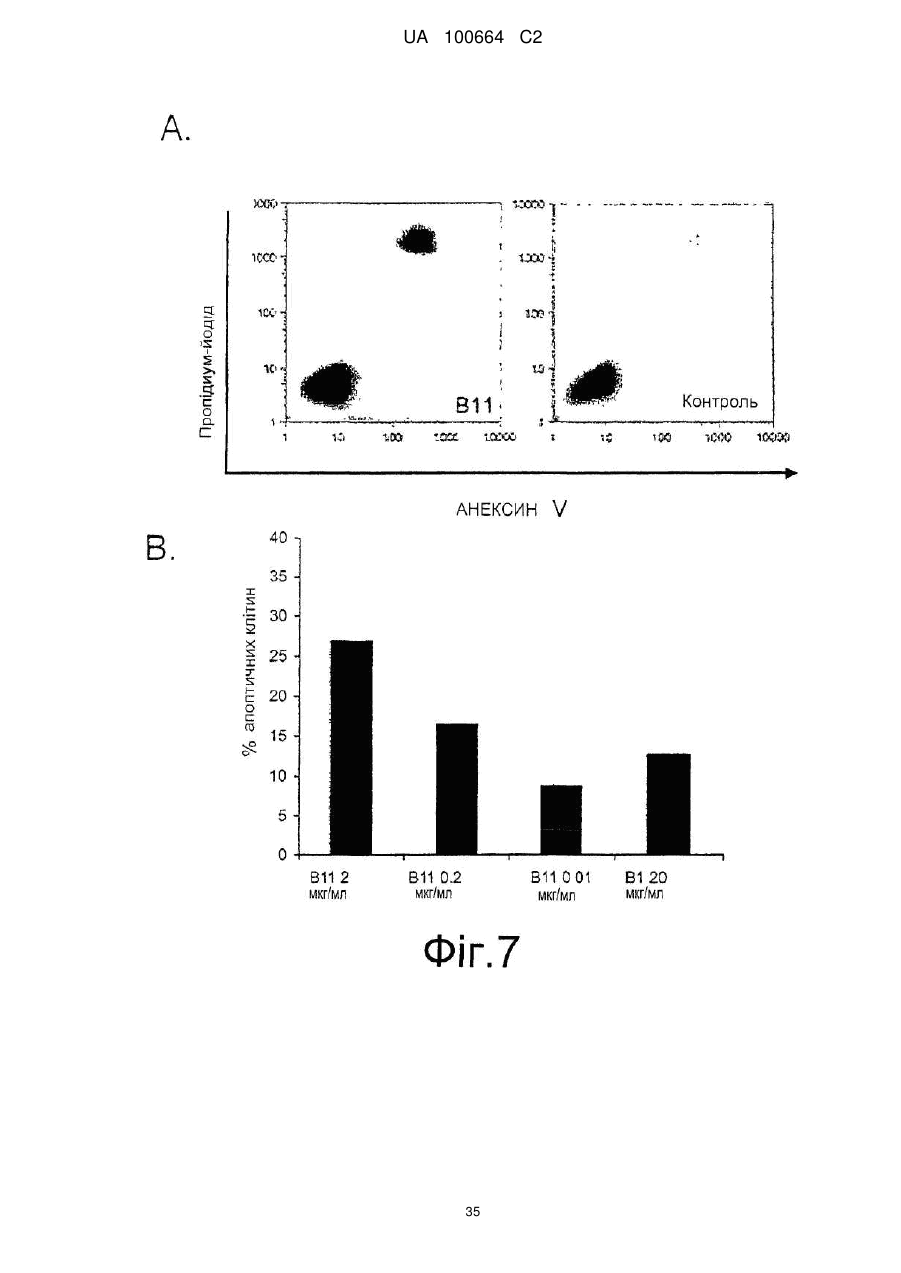
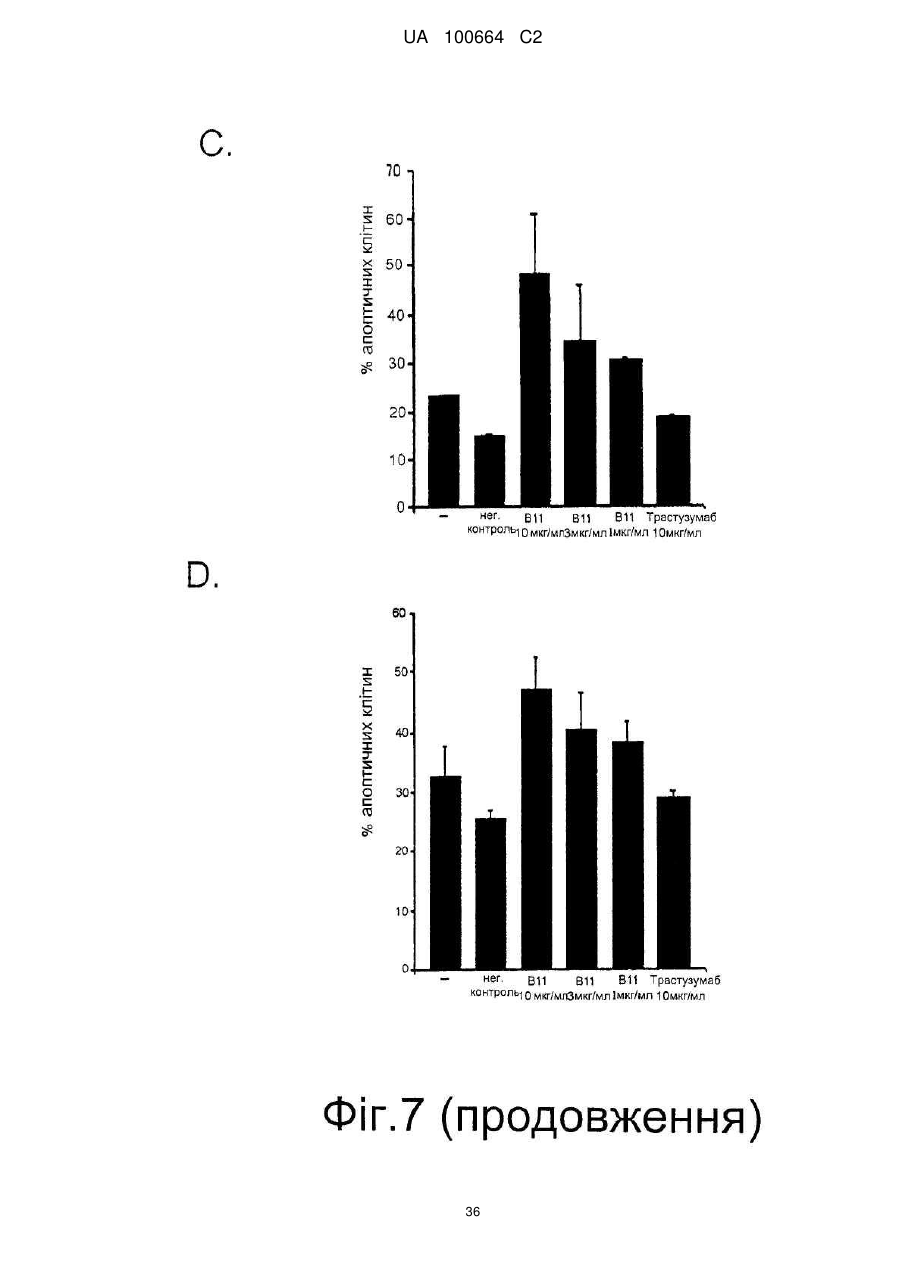
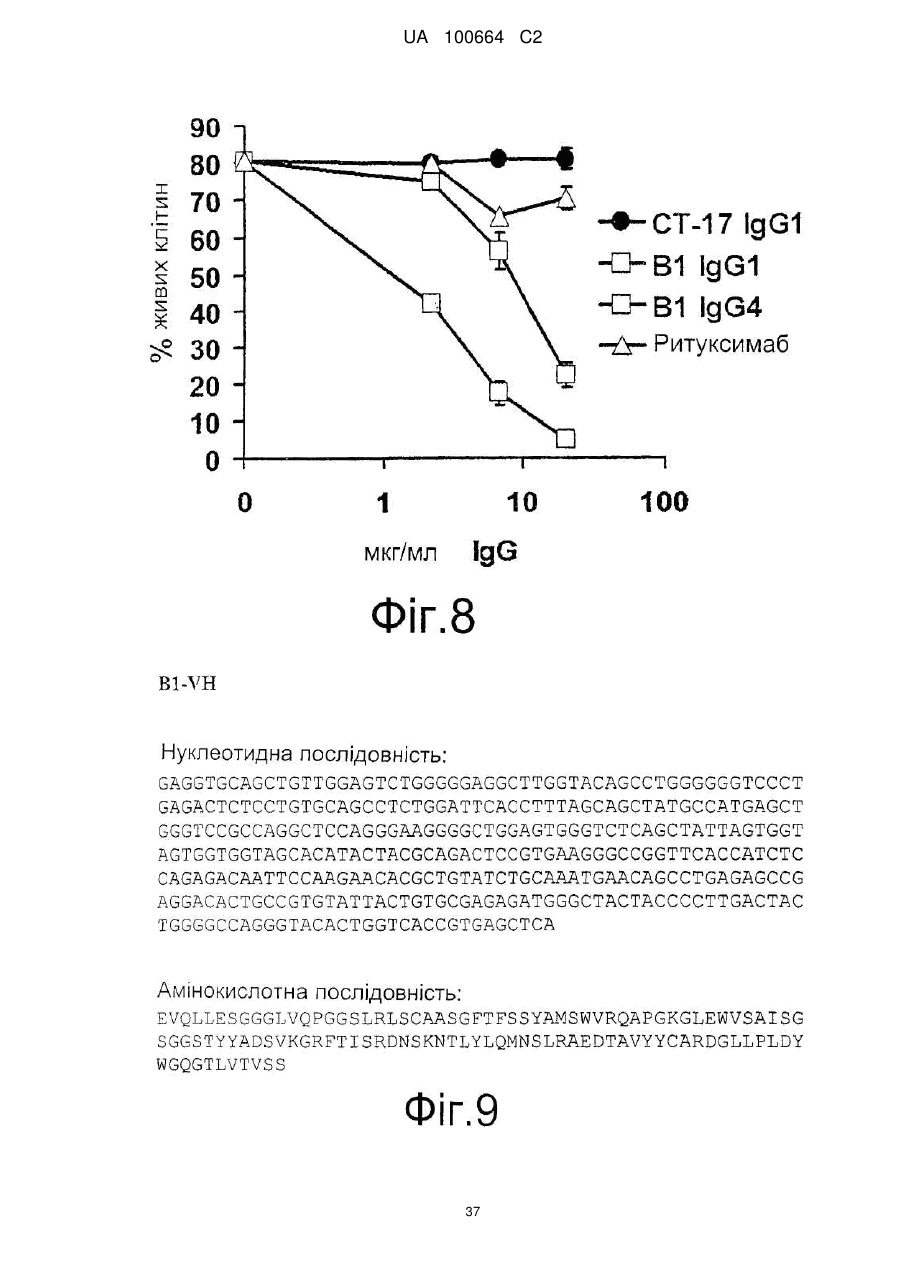
Спосіб індукції апоптозу в клітині-мішені
Формула / Реферат
1. Спосіб індукції апоптозу в клітині-мішені, що включає стадії:
a) забезпечення однієї або більше клітин-мішеней, які несуть поверхневий клітинний антиген, ICAM-1;
b) забезпечення однієї або більше зв'язуючих молекул, які вибірково зв'язуються із клітинним поверхневим ICAM-1 і, при зв'язуванні з ICAM-1, індукують апоптоз у клітині-мішені;
с) обробки клітин-мішеней відповідно до пункту (а) зв'язуючими молекулами відповідно до пункту (b), для індукції апоптозу в клітинах-мішенях, де зв'язуюча молекула є антитілом, послідовності якого представлені у SEQ ID NO: 6 та SEQ ID NO: 8 або похідною даного антитіла.
2. Зв'язуюча молекула, яка вибірково зв'язується із клітинним поверхневим ICAM-1 і, при зв'язуванні з ICAM-1, індукує апоптоз у клітині-мішені, де зв'язуюча молекула є антитілом, послідовності якого представлені у SEQ ID NO: 6 та SEQ ID NO: 8 або похідною даного антитіла.
3. Зв'язуюча молекула за п. 2, яка призначена для застосування в способі за п. 1.
4. Зв'язуюча молекула за п. 2, де клітинним поверхневим антигеном є ICAM-1.
5. Зв'язуюча молекула або молекула антитіла за будь-яким з пп. 2-4, яка відрізняється тим, що клітиною-мішенню є імунна клітина або епітеліальна клітина.
6. Зв'язуюча молекула або молекула антитіла за п. 5, яка відрізняється тим, що імунна клітина є В-лімфоцитом.
7. Зв'язуюча молекула або молекула антитіла за будь-яким з пп. 2-6, яка відрізняється тим, що клітина-мішень асоційована із захворюванням.
8. Зв'язуюча молекула або молекула антитіла за п. 7, яка відрізняється тим, що захворювання вибране із групи, яка складається з: онкологічних захворювань; аутоімунних захворювань, включаючи, але не обмежуючись, ревматоїдний артрит і системний червоний вовчак (СЧВ); гострих і хронічних запальних захворювань, сепсису та інфекційних захворювань, включаючи, але не обмежуючись, СНІД.
9. Зв'язуюча молекула або молекула антитіла за п. 8, яка відрізняється тим, що захворювання є онкологічним захворюванням, вибраним з-поміж лімфоми (лейкемії, мієломи), раку шлунка, раку молочної залози, раку печінки, раку легенів, меланоми, раку сечового міхура, хоріокарциноми, раку підшлункової залози, раку товстої кишки та раку простати.
10. Зв'язуюча молекула або молекула антитіла за будь-яким з пп. 2-9, яка відрізняється тим, що молекулою антитіла є IgG.
11. Зв'язуюча молекула або молекула антитіла за п. 10, яка відрізняється тим, що одноланцюгове антитіло вибране із групи IgG1, IgG2, IgG3 або IgG4.
12. Зв'язуюча молекула або молекула антитіла за будь-яким з пп. 2-11, яка відрізняється тим, що молекула антитіла є людською або гуманізованою.
13. Нуклеїнова кислота, яка має нуклеотидну послідовність, яка кодує молекулу антитіла за будь-яким з пп. 2-12.
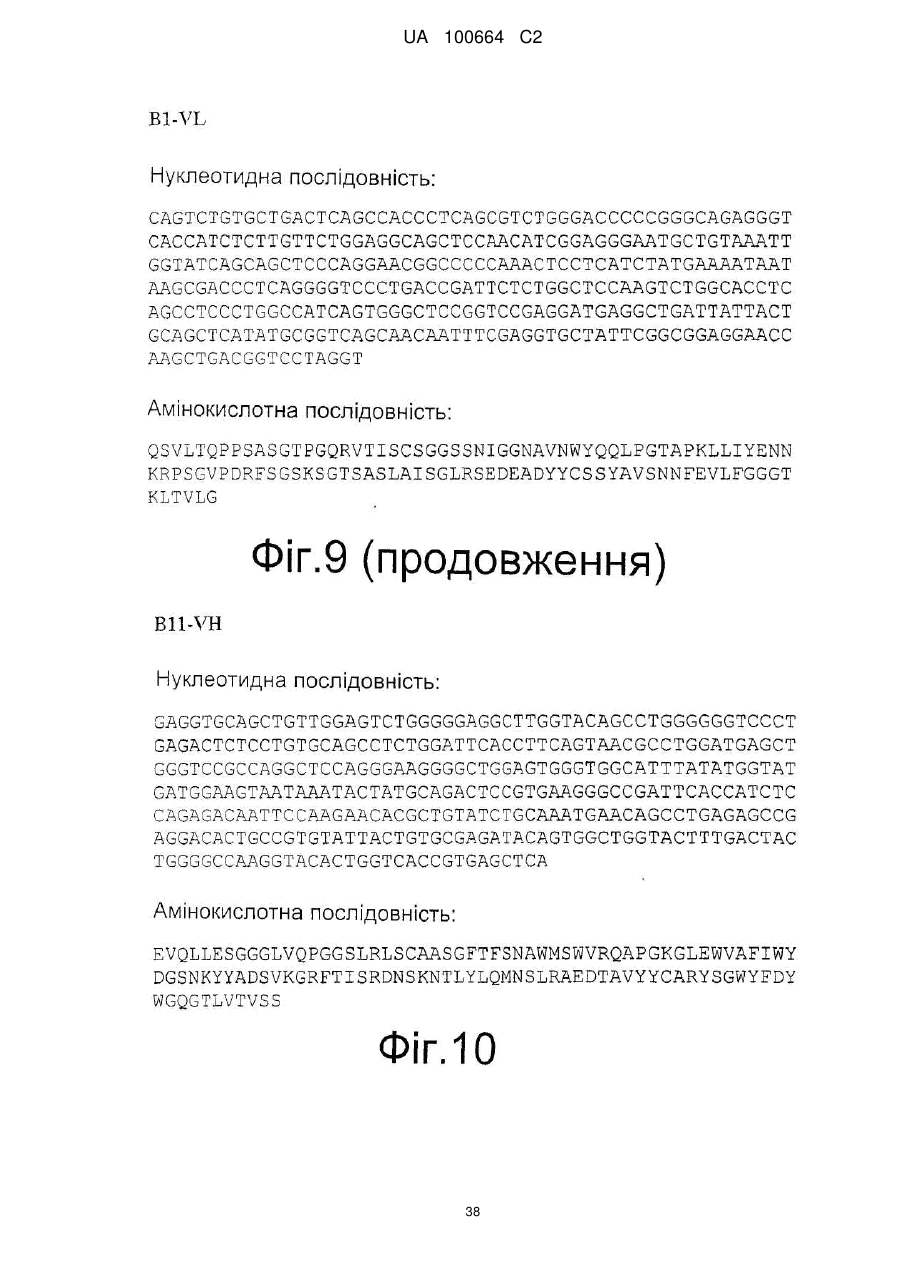
14. Нуклеїнова кислота за п. 12, яка відрізняється тим, що має нуклеотидну послідовність, представлену у SEQ ID NO: 5 і SEQ ID NO: 7.
15. Застосування зв'язуючої молекули або молекули антитіла за будь-яким з пп. 2-12 у діагностиці, де діагностика вимагає руйнування клітини-мішені.
16. Застосування зв'язуючої молекули або молекули антитіла за будь-яким з пп. 2-12 у лікуванні та/або профілактиці захворювання, де лікування та/або профілактика вимагають руйнування клітини-мішені.
17. Застосування зв'язуючої молекули або молекули антитіла за будь-яким з пп. 2-12 у виробництві медикаменту для діагностики захворювання, яке відрізняється тим, що діагностика вимагає руйнування клітини-мішені.
18. Застосування зв'язуючої молекули або молекули антитіла за будь-яким з пп. 2-12 у виробництві медикаменту для лікування та/або профілактики захворювання, яке відрізняється тим, що лікування та/або профілактика вимагають руйнування клітини-мішені.
19. Застосування за будь-яким з пп. 15-18, яке відрізняється тим, що захворювання, яке підлягає лікуванню, вибрано із групи, яка складається з: онкологічних захворювань; аутоімунних захворювань, включаючи, але не обмежуючись, ревматоїдний артрит і СЧВ; гострих і хронічних запальних захворювань, сепсису та інфекційних захворювань, включаючи, але не обмежуючись, СНІД.
20. Застосування за п. 19, яке відрізняється тим, що захворювання, яке підлягає лікуванню, є онкологічним захворюванням, вибраним з поміж лімфоми (лейкемії, мієломи), раку шлунка, раку молочної залози, раку печінки, раку легенів, меланоми, раку сечового міхура, хоріокарциноми, раку підшлункової залози, раку товстої кишки та раку простати.
21. Застосування за будь-яким з пп. 15-20, яке відрізняється тим, що зв'язуюча молекула або молекула антитіла є такою, як визначено в будь-якому з пп. 2-4, а захворювання, яке підлягає лікуванню, є лімфомою, як визначено в п. 20.
22. Фармацевтична композиція, яка включає зв'язуючу молекулу або молекулу антитіла за будь-яким з пп. 2-12, та фармацевтично прийнятний носій, наповнювач або розріджувач.
Текст
Реферат: Винахід належить до способу індукції апоптозу в клітині-мішені, що включає забезпечення однієї або більше зв'язуючих молекул, які вибірково зв'язуються із клітинним поверхневим ICAM-1, зв'язуючої ICAM-1 молекули, нуклеїнової кислоти, що її кодує, фармацевтичної композиції, що її містить, та застосування зв'язуючої молекули у виробництві медикаменту для лікування або профілактики захворювання, яке вимагає руйнування клітини-мішені. UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої відноситься винахід Винахід відноситься до молекул, залучених до процесу індукції апоптозу, способів та фармацевтичних композицій для індукції апоптозу та їхнього застосування. Рівень техніки Антитіла нещодавно стали білками терапевтичного вибору, націленими не тільки на рак, але також і на лікування за іншими діагнозами (Brekke et al. Nat Rev Drug Discov 2003;2:52-62). Поява інженерії антитіл забезпечила необхідні інструменти для створення людських антитіл із бібліотек синтетичних фагів, які проявляють знижену імуногеність та підвищену специфічність і афінність завдяки своїй людській природі й більшій різноманітності (Weiner et al. Nat Biotechnol 2005;23:556-7). Вихідні бібліотеки особливо привабливі, оскільки вони можуть застосовуватися для виділення антитіл за їхньою специфічністю, включаючи само-антигени (Griffiths et al. Embo J 1993;12:725-34), незалежно від імунізації й реконструкції нових бібліотек. Клітинні поверхневі рецептори становлять значно більш успішну групу антигенів, на які націлені сучасні лікувальні засоби, включаючи низькомолекулярні інгібітори й антитіла. Особливий інтерес представляють клітинні поверхневі рецептори, які є унікально експресованими або проявляють підвищений рівень експресії в клітинах-мішенях, та додатково здатні передавати сигнали загибелі або виживання для клітин. Такі диференціально експресовані рецептори із властивими сигнальними властивостями дозволяють здійснювати заснований на антитілах тарґетинг інфікованих мікробами, трансформованих або інших клітин з порушенням функції. Для лікування пухлин антитіла, які мають здатність до індукції апоптозу в пухлинній клітинімішені, не впливаючи на нормальну тканину, становлять особливий інтерес. Деякі такі антитіла вже застосовуються, вони зареєстровані в Управлінні з контролю продуктів та медикаментів США (FDA), і є альтернативою стандартному лікуванню онкологічних захворювань, наприклад, лімфоми (ритуксимаб, націлений на СD20) або раку молочної залози (трастузумаб або цетуксимаб, націлені, відповідно, на Her-2 та EGFR). На теперішній час у клінічній розробці є також інші антитіла з апоптоз-індукуючими ефектами. Однак, навіть якщо ці антитіла демонструють потрібні ефекти у пацієнтів або при аналізах у тварин, усе ще залишається незадоволена клінічна потреба в них. Анти-ідіотипічний імуноглобуліновий тарґетинг В-клітинних пухлин був першою терапією із застосуванням моноклональних антитіл, проведеною на людині (Miller et al. N Engl J Med 1982;306:517-22.).Руйнування пухлинних клітин за допомогою такого пасивного застосування антитіл (Riechmann et al. Nature 1988;332:323-7), або активної вакцинації власним білком імуноглобуліну проти пухлини пацієнта (Kwak et al. N Engl J Med 1992;327:1209-15.), як це було продемонстровано, викликає регресію пухлини або загальмовує її розвиток у пацієнтів з різними видами В-клітинних новоутворень. Більш недавній звіт описує вироблення повних людських анти-ідіотипічних антитіл із застосуванням трансгенних мишей, дефіцитних за продукцією мишачих антитіл, які експресують обрані локуси ланцюга антитіла людини (Suarez et al. Mol Immunol 2004;41:519-26.). У даному винаході використаний спосіб конкурентного біопенінгу, де антиген клітини-мішені у формі цілих клітин, і надлишок віднятого клітинного антигену у формі мембранних везикул одночасно піддаються взаємодії з фаговою бібліотекою наївних антитіл n-CoDeR (WO 2004/023140; Soderlind et al. Nat Biotechnol 2000;18:852-6.), для вилучення та послідовного тестування фрагментів антитіл з відмінною вибірковістю відносно клітин-мішеней В-лімфоми. Далі, функціональність обраних зв'язуючих молекул була продемонстрована за здатністю тестованих антитіл до індукції апоптозу в клітинах-мішенях, але не в інших клітинах. Ідентифіковані специфічності антитіл включають HLA-DR/DP (B1 антитіло винаходу) і поверхневий IgM (C11 антитіло винаходу), а також ICAM-1 (В11 антитіло винаходу), молекулу адгезії, не асоційовану раніше з індукцією апоптозу. Виділені антитіла проявляють афінність в суб-наномолярному та наномолярному діапазоні, безпосередньо забезпечуючи можливий вибір для цільової терапії антитілами. Розкриття винаходу У першому аспекті винахід забезпечує спосіб індукції апоптозу в клітині-мішені, який передбачає етапи: a. забезпечення однієї або більше клітин-мішеней, які несуть поверхневий клітинний антиген, ICAM-1; b. забезпечення однієї або більше зв'язуючих молекул, які вибірково зв'язуються з ICAM-1 клітинною поверхнею й, при зв'язуванні з ICAM-1, індукують апоптоз клітини-мішені; c. обробки клітин-мішеней згідно (a) зв'язуючими молекулами згідно (b) для індукції апоптозу клітин-мішеней. Бажано з'єднуючі молекули є молекулами антитіл. 1 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 У другому аспекті винахід забезпечує спосіб індукції апоптозу в клітині-мішені, який передбачає етапи: a. забезпечення однієї або більше клітин-мішеней, які несуть поверхневий клітинний антиген, HLA-DR/DP і/або поверхневий IgM; b. забезпечення однієї або більше молекул антитіл, які вибірково зв'язуються з HLA-DR/DP клітинної поверхні й/або поверхневим IgM і які, при зв'язуванні з HLA-DR/DP і/або поверхневим IgM, індукують апоптоз клітини-мішені; c. обробки клітин-мішеней згідно з (a) молекулами антитіл відповідно (b) для індукції апоптозу клітин-мішеней. У третьому аспекті винаходу забезпечується зв'язуюча молекула, яка вибірково зв'язується з ICAM-1 клітинної поверхні, і, при зв'язуванні з ICAM-1, індукує апоптоз клітини-мішені. Альтернативно зв'язуюча молекула є молекулою антитіла, яка вибірково зв'язується з HLADR/DP клітинної поверхні й/або поверхневим IgM. ICAM-I також позначається як CD54, але для цілей даного застосування буде використовуватися позначення ICAM-1. Джерелом походження зв'язуючих молекул можуть бути антитіла і ґрунтуються вони на молекулярному каркасі антитіл [Clackson T et al., Nature. 1991 Aug 15;352(6336):624-8, Marks JD et al., J Mol Biol. 1991 Dec 5;222(3):581-97], який широко використовується в багатьох бібліотеках, але з'єднуючі молекули також можуть бути отримані з інших молекулярних каркасів, таких як каркас фібронектину [Weng S et al., Proteomics. 2002 Jan;2(1):48-57] і каркас протеїну А [Nord K, et al., Nat Biotechnol 1997 Aug;15(8):772-7, Hogbom M et al., Proc Natl Acad Sci USA. 2003 Mar 18;100(6):3191-6]. Кожний із цих каркасів може мати перевагу залежно від застосування, і каркас антитіл, як один із прикладів, може вигідно застосовуватися для створення варіабельності, яка не відрізняється від природної варіабельності. Базова структура антитіл, каркас, який застосовується найбільш часто, є дуже добре вивченим. У принципі, каркасна структура, яка включає бета-ланцюги, упорядковані у вигляді двох шарів, представляє набір варіабельних петель, так званих гіперваріабельних ділянок (CDRs), які мають здатність зв'язувати молекули антигенів. Хоча антитіла можуть варіювати в структурі каркаса, найбільш велика варіабельність спостерігається в CDRs. Значна варіабельність між антитілами є основою для їхньої здатності взаємодіяти специфічним чином з, у принципі, всіма типами молекулярних структур. Завдяки цій здатності антитіла широко застосовуються для створення специфічних зв'язуючих агентів, із застосуванням їх для досліджень, діагностики/прогнозу захворювання і як лікувальних агентів, специфічних до певних структур-мішеней [Borrebaeck CA and Carlsson R, Curr Opin Pharmacol. 2001 Aug; 1(4):404-8]. Іншими зв'язуючими молекулами, які не відносяться до антитіл, що застосовуються в даному винаході, є ті, які мають структуру каркаса з високим ступенем стабільності, але яка допускає варіабельність при введенні в певні позиції. Прикладом іншої зв'язуючої молекули є домен фібронектину та великий домен протеїну А з 58 амінокислот, який є толерантним щодо варіабельності. Існують також інші молекулярні складки, які допускають певний ступінь варіації. Такі приклади включають молекули I та II класів головного комплексу гістосумісності (МНС) і нещодавно відкритий новий клас молекул, так званих дефензинів, які були ідентифіковані як подібні за базовою структурою при збереженні значної варіабельності послідовності між членами сімейства генів, що свідчило про їхню придатність як каркасу для збереження молекулярного різноманіття. До того ж, природний ліганд(и), наприклад, LFA-1 у випадку ICAM-1 як цільова молекула, або його рекомбінантні варіанти, можуть бути специфічними зв'язуючими молекулами, здатними індукувати апоптоз у клітинах-мішенях. Далі, зв'язуюча молекула може бути будь-якою молекулою, яка вибірково зв'язує ICAM-1 клітинної поверхні клітини-мішені та яка при зв'язуванні індукує апоптоз клітини-мішені. Зв'язуюча молекула переважно є молекулою антитіла. В одному втіленні антигеном клітинної поверхні є ICAM-1. Представлений скринінг виявив антитіло (В11), специфічне щодо ICAM-1 - рецептора, який не пов'язували раніше з апоптозом і, як уважають, який не проявляє істотних властивостей передачі негативних сигналів клітинам. Ідентифікація ICAM-1 як молекули, яка індукує апоптоз, була прямим результатом скринінгу, розробленого для виділення специфічностей у відношенні всіх поверхневих рецепторів, які дифференціально експресуються клітинами-мішенями, і клітинами, які не є мішенями, незалежно від і без попередніх знань про їхню відповідну ідентичність. Було підтверджено, що ICAM-1-індукована загибель клітин була активним апоптотичним процесом, який залучає деполяризацію мембрани мітохондрій. Деполяризація мітохондріальної мембрани була раніше описана як при каспазо-залежному, так і каспазо-незалежному апоптозі (Nagy et al. J Mol Med 2 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 2003;81:757-65.). Представлені знахідки далі показали, що епітоп, який зв'язується В11 антитілом, експресується тканиною В-лімфоми різного походження, і позитивно регулюється в певних клітинах В-лімфоми в порівнянні зі спочиваючими лейкоцитами периферійної крові. Важливо, що на додачу до клітин В-лімфоми клітини карциноми, які експресують ICAM-1, також піддаються апоптозу при обробці ICAM-1-специфічними В 11-антитілами in vitro (див. Приклад 6). Попередні дослідження продемонстрували обмежену експресію ICAM-1 нормальними тканинами людини (Smith et al. J Clin Pathol 1990;43:893-900.). ICAM-1 залучається до адгезії клітини з клітиною й відіграє важливу роль в імунній відповіді та запаленні шляхом зв'язування з їхнім рецептором LFA-1. Антитіла, спрямовані на ICAM-1, використовуються для перешкоджання патологічній імунній відповіді та запаленню. Застосування in vivo мишачих анти-ICAM-1 моноклональних антитіл (mAb) у яванских макак (Cosimi et al. J Immunol 1990;144:4604-12.), або застосування при клінічних випробуваннях у людей, хворих ревматоїдним артритом, або пацієнтів із трансплантатом нирки, також не виявило явної токсичності (Kavanaugh et al. Arthritis Rheum 1994;37:992-9; Haug et al. Transplantation 1993;55:766-72.). Нове відкриття того, що ICAM-1-тарґетинг може призвести до апоптозу, демонструє можливість застосування ICAM-1-специфічних зв'язуючих молекул, таких як антитіла, для лікування онкологічних захворювань різного походження, за умови, що вони експресують цей антиген. Ґрунтуючись на їхній експресії ICAM-1, перелік типів онкологічних захворювань, які можуть лікуватися за допомогою індукуючого апоптоз анти- ICAM-1 антитіла, такого як В11, включає: Влімфому, мієлому (Huang et al. (1993) Hybridoma 12 p661-75; Huang et al., (1995) Cancer Res 55 p610-6; Smallshaw et al., (2004) J Immunother 27 p419-24), рак шлунку (Maruo et al., (2002) Int J Cancer 100 p486-90), рак молочної залози (Rosette et al., (2005) Carcinogenesis 26 p943-50), рак печінки (Sun et al., (1999) J Cancer Res Clin Oncol 125 p28-34), рак легень (Grothey et al., (1998) Br J Cancer 77 p801-7), меланому (Wang et al., (2005) Int J Cancer 27 p419-24), рак сечового міхура (Roche et al., (2003) Thromb Haemost 89 1089-97) та рак простати (Aalinkeel et al., (2004) Cancer Res 64 p5311-21). Експресія ICAM-1 також була виявлена на метастазах опухолей, як показано (Maruo et al., 2002), (Rosette et al., 2005), (Sun et al., 1999), (Grothey et al., 1998), (Aalinkeel et al., 2004), що вказує на можливість втручання в процеси метастазування з застосуванням ICAM-1 специфічних антитіл. В іншому втіленні поверхневим клітинним антигеном є HLA-DR/DP. HLA-DR/DP у нормі є присутнім на, наприклад, В-клітинах і може виявлятися як позитивно регульований на клітинах В-лімфоми. На сьогоднішній день три різних види HLA-DR специфічних моноклональних антитіл проходять клінічні випробування. Самим недавнім доповненням до них є людський IgG 4 1D09C3, який був виділений з подібної за розміром наївної фагової бібліотеки, у порівнянні з nCoDeR, але із застосуванням твердофазного пенінгу очищеного антигену (Nagy et al. Nat Med 2002;8:801-7). У даному винаході ідентифіковане нове антитіло людини (в1), спрямоване проти HLADR/DP, яке швидко та з високою ефективністю індукує апоптоз безлічі клітинних ліній Влімфоми, у такий спосіб демонструючи, що HLA-DR/DP пов'язаний з індукцією апоптозу клітинимішені. В 1-антитіло зв'язується з великою кількістю клітинних ліній В-лімфоми різного походження (див. Приклад 1 та Таблицю 1) і як було показано, індукує апоптоз у клітинах, які експресують HLA-DR/DP антиген. Далі, В 1-антитіло показало більш високу потужність, ніж Ритуксимаб при аналізі на Raji клітинній лінії В-лімфоми. Це є особливо явним, коли застосовується IgG 4 формат B1 антитіл (Фіг.8). Виходячи із отриманих даних, це антитіло має придатні характеристики для обробки HLADR/ DP-експресуючих клітин В-лімфоми. До того ж, подібно до тарґетинга ревматоїдного артриту та системного червоного вовчаку (ВКВ) Ритуксимабом, В1 антитіло може виявитися ефективним в елімінації активованих В-клітин при захворюваннях, де експресуючі HLA-DR/DP В-клітини є шкідливими. У ще одному втіленні поверхневим клітинним антигеном є поверхневий IgM. IgM у його вільній формі існує у вигляді великої пентамірної структури, чия велика молекулярна маса сприяє її утриманню в межах кровоносних судин. Мономерний IgM може бути знайдений на клітинній стінці В-лімфоцитів і функціонує як рецептор антитіла для розпізнавання антигену. 3 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 С11 антитіло винаходу при зв'язуванні з поверхневим IgM, експресованим на клітинах Влімфоми, індукує апоптоз у швидкій і ефективній манері (див. Приклад 1 та Таблицю 1). На противагу ідіотип-специфічним анти-IgM антитілам, які раніше використовувались у клініці для лікування В-лімфоми, С11 антитіло зв'язується з не-поліморфним епітопом, який експресується на В-клітинах від різних донорів, і таким чином, є придатним для лікування пацієнтів, які страждають на В-лімфому, незалежно від ідіотипу В-лімфоми. Зокрема, ефекторна молекула, наприклад, анти- IgM антитіло, може також бути будь-яким типом специфічно зв'язуючої молекули, яка викликає апоптоз в Ig-експресуючих клітинах різних ідіотипів. Кінетика В1-, В11- та С11-індукованого апоптозу була швидкою, з максимальною ефективністю, яка спостерігалася вже через 3 години на деяких клітинних лініях. Швидка ефекторна функція важлива для ефективності лікування, оскільки це знижує ризик ухилення пухлини в результаті наприклад, відсутності експресії пухлинного антигену (Uyttenhove et al. J. Exp. Med. 1983;157:1040-52; Kennedy et al. Br J Haematol 2002;119:412-6) або мутації епітопу (Weiner et al. J Immunol 1989;142:343-51; Bai et al. J. Clin. Invest. 2003;111:1487-96), і здатне обмежити тривалість лікування та побічні ефекти (Robert et al. Lancet Oncol 2005;6:491-500.). Бажано, щоб клітиною-мішенню була імунна клітина або епітеліальна клітина і особливо бажано, щоб імунна клітина була В-лімфоцитом. Зручно, щоб клітина-мішень була пов'язана із захворюванням. Переважно, захворювання обирають із групи, яка складається з: онкологічного захворювання, аутоімунного захворювання, включаючи, але не обмежуючись названими, ревматоїдний артрит та СЧВ, гострі й хронічні запальні захворювання, сепсис та інфекційні захворювання, включаючи, але не обмежуючись названим, СНІД. Переважно, захворювання є онкологічним, обраним з поміж лімфоми (лейкемії, мієломи), раку шлунка, раку молочної залози, раку печінки, раку легенів, меланоми, раку сечового міхура, хоріокарциноми, раку підшлункової залози, раку товстої кишки та раку простати. Як визначено в розділі визначень даної заявки, фраза "молекула антитіла" застосовується для зручності та охоплення, серед іншого, антитіл, фрагментів антитіл та похідних антитіл. Переважно, молекулою антитіла є IgG. IgG, який може бути представлений IgG1, IgG2, IgG3 або IgG4, але більш бажано, щоб це був IgG1 та IgG4. Молекула антитіла бажано є гуманізованою або людською. Бажано, зв'язуюча молекула або молекула антитіла винаходу має послідовність будь-якої з послідовностей варіабельного регіону з Фігури 9-11 або її функціонально еквівалентних гомологів. В одному втіленні винаходу зв'язуюча молекула або молекула антитіла має послідовності варіабельних регіонів з Фігури 9 або їх функціонально еквівалентних гомологів. В іншому втіленні винаходу, зв'язуюча молекула або молекула антитіла має послідовності варіабельних регіонів з Фігури 10 або їх функціонально еквівалентних гомологів. У ще одному втіленні винаходу, зв'язуюча молекула або молекула винаходу має послідовність варіабельних регіонів з Фігури 11 або їх функціонально еквівалентних гомологів. У четвертому аспекті винаходу забезпечується нуклеїнова кислота, яка має нуклеотидну послідовність, яка кодує зв'язуючу молекулу або молекулу антитіла, як зазначено в кожному з попередніх пунктів. Переважно нуклеїнова кислота має нуклеотидну послідовність із кожної з фігур 9-11. У п'ятому аспекті винаходу забезпечується застосування зв'язуючої молекули або молекули антитіла, як визначено в першому або другому аспекті винаходу, для діагностики та/або лікування, і/або профілактики захворювання, яке вимагає руйнування клітини-мішені. Також передбачається застосування зв'язуючої молекули або молекули антитіла, як визначено в першому або другому аспекті винаходу, при виробництві медикаменту для лікування та/або профілактики захворювання, яке вимагає руйнування клітини-мішені. У кращому втіленні зв'язуюча молекула є молекулою антитіла. Переважно, захворювання, при яких застосовується лікування, обирають із групи, яка складається з: онкологічних захворювань; аутоімунних захворювань, включаючи, але не обмежуючись названими, ревматоїдний артрит і СЧВ, гострі та хронічні запальні захворювання, сепсис і інфекційні захворювання, включаючи, але не обмежуючись названим, СНІД. Найкраще застосовується лікування при захворюванні яке є онкологічним захворюванням, обраним з поміж лімфоми (лейкемії, мієломи), раку шлунка, раку молочної залози, раку печінки, раку легенів, меланоми, раку сечового міхура, хоріокарциноми, раку підшлункової залози, раку товстої кишки та раку простати. В одному втіленні винаходу зв'язуюча молекула або молекула антитіла зв'язується 4 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 специфічно з ICAM-1 і/або має послідовність із фігури 10, і застосовується проти захворювань, перерахованих вище. В іншому втіленні винаходу молекула антитіла зв'язується специфічно з HLA-DR/DP і/або має послідовність із фігури 9, і застосовується проти захворювань: лімфоми (лейкемії, мієломи), раку шлунка, раку молочної залози, раку печінки, раку легенів, меланоми, раку сечового міхура, хоріокарциноми, раку підшлункової залози, раку товстої кишки та раку простати. У ще одному втіленні винаходу молекула антитіла зв'язується специфічно з поверхневим IgM і/або має послідовність із малюнка 11 і застосовується проти захворювань: лімфоми (лейкемії, мієломи), раку шлунка, раку молочної залози, раку печінки, раку легенів, меланоми, раку сечового міхура, хоріокарциноми, раку підшлункової залози, раку товстої кишки та раку простати. У шостому аспекті винаходу забезпечується фармацевтична композиція, яка містить зв'язуючу молекулу або молекулу антитіла винаходу та фармацевтично придатний носій, наповнювач або розріджувач. У кращому втіленні зв'язуюча молекула є молекулою антитіла. У сьомому аспекті винаходу забезпечується in vitro спосіб індукції апоптозу в клітині-мішені, який передбачає етапи: (i) забезпечення однієї або більше клітин-мішеней; (ii) забезпечення однієї або більше зв'язуючих молекул, як визначено в першому втіленні винаходу; (iii) обробки клітин-мішеней відповідно до пункту (i) зв'язуючими молекулами або молекулами антитіл відповідно до пункту (ii), з індукцією в такий спосіб апоптозу в клітинахмішенях. У кращому втіленні зв'язуюча молекула є молекулою антитіла. Бажано, клітини-мішені, отримані на етапі (i), є імунними клітинами або епітеліальними клітинами. Бажано, імунні клітини є В-лімфоцитами. Переважно клітини-мішені пов'язані із захворюванням, де перелік яких утворює групу, яка складається з: онкологічних захворювань; аутоімунних захворювань, включаючи, але не обмежуючись названими, ревматоїдний артрит і СЧВ, гострі та хронічні запальні захворювання, сепсис і інфекційні захворювання, включаючи, але не обмежуючись названим, СНІД. Переважно, захворювання є онкологічним захворюванням, обраним з поміж лімфоми (лейкемії, мієломи), раку шлунка, раку молочної залози, раку печінки, раку легенів, меланоми, раку сечового міхура, хоріокарциноми, раку підшлункової залози, раку товстого кишечника та раку простати. Значення застосованих термінів Передбачається, що термін "молекула антитіла" відноситься до будь-якого із фрагментів антитіла, або похідного антитіла. Він покликаний охоплювати природні антитіла, синтетичні антитіла, рекомбінантні антитіла або гібриди антитіл, таких як, без обмежень, одноланцюгові модифіковані молекули антитіл, які виробляються фагом, який відображає варіабельні та/або константні ділянки легкого та/або важкого ланцюга імуноглобуліну, або інші імунореактивні молекули, здатні зв'язуватися з антигеном у форматі імуноаналізу, відомому фахівцям у даній галузі техніки. Термін "фрагмент антитіла" застосовується відносно будь-якого антитіла, фрагмента антитіла, або похідного антитіла. Він покликаний охоплювати природні антитіла (тобто молекули, які включають чотири поліпептидних ланцюги), синтетичні антитіла, рекомбінантні антитіла або гібриди антитіл, таких як, без обмежень, одноланцюгові модифіковані молекули антитіл, які виробляються фагом, який відображає варіабельні та/або константні ділянки легкого та/або важкого ланцюга імуноглобуліну, або інші імунореактивні молекули, здатні зв'язуватися з антигеном у форматі імуноаналізу, відомому фахівцям у даній галузі техніки. Термін "похідне антитіла" відноситься до модифікованої молекули антитіла, яка здатна зв'язуватися з антигеном у форматі імуноаналізу, відомому фахівцям у даній галузі техніки, такий як фрагмент антитіла (наприклад, Fab або Fv фрагмент), або модифікована молекула антитіла, яка модифікована додаванням однієї або більше амінокислот або інших молекул для полегшення зв'язування антитіл з іншим пептидом або поліпептидом, з більшим білком-носієм або із твердою основою (наприклад, з амінокислотами тирозином, лізином, глутаміновою кислотою, аспарагіновою кислотою, цистеіном та їхніми похідними, NH 2-ацетильними групами або COOH-кінцевими амідо-групами, крім іншого). Термін "ScFv молекула" відноситься до будь-якої молекули, де VH та VL домени-партнери з'єднані за допомогою гнучкого олігопептида. Терміни "нуклеотидна послідовність" або "нуклеїнова кислота" або "полінуклеотид" є 5 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 взаємно замінними й стосовно гетерополімера нуклеотидів або послідовності цих нуклеотидів. Ці фрази також відносяться до ДНК або РНК геномного або синтетичного походження, які можуть бути одноланцюговими або дво-ланцюговими й можуть представляти значеннєвий та анти-значеннєвий ланцюг, до пептидної нуклеїнової кислоти (ПНК) або до будь-якого ДНКподібного або РНК-подібного матеріалу. У цих послідовностях А є аденіном, Ц є цитозином, Т є тиміном, Г є гуаніном, а N є А, Ц, Г або Т(У). Зрозуміло, що коли полінуклеотид є РНК, Т (тимін) у представленій послідовності заміняється на У (урацил). У цілому, сегменти нуклеїнових кислот, представлені цим винаходом, можуть бути зібрані із фрагментів генома й коротких олігонуклеотидних лінкерів, або із серій олігонуклеотидів, або з індивідуальних нуклеотидів, для забезпечення синтетичної нуклеїнової кислоти, яка здатна експресуватися в рекомбінантну транскрипційну одиницю, яка включає регуляторні елементи, отримані з мікробного або вірусного оперона, або еукаріотичного гена. Термін "поліпептид", або "пептид", або "амінокислотна послідовність" відноситься до олігопептидної, пептидної, поліпептидної або білкової послідовності або її фрагмента та до молекул природного походження або синтетичних. Поліпептидний "фрагмент", "порція" або "сегмент" є послідовністю з амінокислотних залишків із принаймні 5 амінокислот, бажано принаймні 7 амінокислот, щем краще із принаймні 17 або більше амінокислот. Щоб бути активними, будь-які поліпептиди повинні мати достатню довжину для проявлення біологічної та/або імунологічної активності. Терміни "очищений" або "істотно очищений" як вони застосовуються тут, означають, що зазначені нуклеїнова кислота або поліпептид є в основному вільними від інших біологічних макромолекул, наприклад, полінуклеотидів, білків, і тому подібного. В одному втіленні, полінуклеотид або поліпептид очищують так, що він складається принаймні на 95 % за вагою, ще краще, принаймні на 99 % за вагою, із зазначених представлених біологічних макромолекул (але можуть бути присутніми вода, буфери, або інші малі молекули, особливо молекули з молекулярною масою меншою від 1000 дальтон). Термін "виділений" як він застосовується тут, відноситься до нуклеїнової кислоти або поліпептида, відділеного від принаймні одного іншого компонента (наприклад, нуклеїнової кислоти або поліпептида), присутнього з нуклеїновою кислотою або поліпептидом у його природному джерелі. В одному втіленні, нуклеїнова кислота або поліпептид перебувають у присутності (якщо він є) тільки розчинника, буфера, іона або іншого компонента, звичайно присутнього в його розчині. Терміни "виділений" та "очищений" не охоплюють нуклеїнові кислоти або поліпептиди, які є присутніми у їхньому природному джерелі. Термін "рекомбінантний", як він застосовується тут стосовно поліпептиду або білка, означає, що поліпептид або білок отримані з рекомбінантних (наприклад, мікробних, комах або ссавців) систем експресії. "Мікробний" відноситься до рекомбінантних поліпептидів або білків, отриманих з бактеріальних або грибкових (наприклад, дріжджових) систем експресії. Як продукт "рекомбінантний мікробний" позначає поліпептид або білок, власне кажучи вільний від нативних ендогенних субстанцій, і який не супроводжується зв'язаним нативним глікозилюванням. Поліпептиди або білки, експресовані в більшості бактеріальних культур, наприклад, Escherichia coli, вільні від модифікацій глікозилювання; поліпептиди або білки, які експресуються в грибах, мають форму глікозилювання, яка у цілому відрізняється від тієї, що експресується в клітинах ссавців. Термін "вибіркове зв'язування" і "вибірковість зв'язування" указує, що варіабельні ділянки антитіл винаходу розпізнають і зв'язують винятково поліпептиди винаходу (тобто, здатні відрізняти поліпептид винаходу від інших подібних поліпептидів незважаючи на ідентичність, гомологію, або подібність послідовності, знайдену в родині поліпептидів), але можуть також взаємодіяти з іншими білками (наприклад, білком А Staphylococcus aureus або іншими антитілами в методиці ІФА) за допомогою взаємодій з послідовностями поза варіабельною ділянкою антитіл, і зокрема, у константній ділянці молекули. Скринінгові аналізи для визначення вибірковості зв'язування антитіл винаходу добре відомі й рутинно практикуються в даній галузі техніки. Вичерпне обговорення таких аналізів можна знайти в Harlow et al. (Eds), Antibodies A Laboratory Manual; Cold Spring Harbor Laboratory; Cold Spring Harbor, N.Y. (1988), Chapter 6. Антитіла, які розпізнають і зв'язують фрагменти поліпептидів винаходу, також враховані, забезпечуючи той факт, що антитіла в першу чергу й найбільше є обиральними для, як визначено вище, поліпептидів повної довжини за винаходом. Як з антитілами, які є обиральними щодо поліпептидів повної довжини, антитіла винаходу, які розпізнають фрагменти, є такими, які можуть розрізняти поліпептиди з тієї самої родини поліпептидів незважаючи на властиву ідентичність, гомологію, або подібність, знайдені в родині білків. Термін "афінність зв'язування" включає позначення сили зв'язування між молекулою 6 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 антитіла й антигеном. Під терміном "імунна клітина" ми маємо на увазі будь-які клітини, які залучаються в імунітет хазяїна або запальну відповідь, включаючи, але не обмежуючись названими, В-клітини та Тклітини. Під терміном "епітеліальна клітина" ми маємо на увазі клітинний епітелій. Епітелій є тканиною, яка складається із шару клітин. Епітелій може вистилати внутрішню (наприклад, ендотелій, який вистилає внутрішню сторону кровоносних судин) або зовнішню (наприклад, шкіра) вільну поверхню тіла. Самий крайній шар нашої шкіри побудований з лускатих епітеліальних клітин, як і слизові мембрани, які вистилають внутрішню поверхню рота й порожнин тіла. Зовнішні епітеліальні клітини вистилають внутрішню частину легенів, шлунково-кишкового тракту, репродуктивного й сечового трактів, і утворюють екзокринні й ендокринні залози. Функції епітеліальних клітин включають секрецію, абсорбцію й захист. Епітеліальні клітини знаходяться на базальній мембрані. Короткий перелік фігур Приклади, які втілюють конкретні кращі аспекти винаходу, описані з посиланням на наступні фігури, на яких: Фігура 1 – scFv, виділений диференціальним біопенінгом цілих клітин/ клітинних мембранних везикул, показує високу специфічність щодо клітин-мішеней Клони scFv, виділені диференціальним біопенінгом, експресували в E. coli TOP10 клітинах, і інкубували із клітинами Ramos або Jurkat і (A) scFv клонами, експресованими для первинного скринінгу, або (B) сімдесятьма двома довільно обраними й повторно експресованими scFv клонами. Зв'язування scFv виявляли з анти-гіс-MAb, і Cy анти-мишачими поліклональними антитілами. Клітинне зв'язування виявляли на макроконфокальному пристрої для скринінгу з високою продуктивністю FMAT. Клітинне зв'язування відображали у вигляді середньої інтенсивності флуоресценції з Ramos клітинами-мішенями (Y-вісь) і клітинами не-мішенями Jurkat (Х-вісь). (С) Зв'язування семи унікальних scFv клонів із клітинами Ramos (зафарбовані прямокутники) і клітинами Jurkat (незафарбовані прямокутники). Контрольний scFv (ctrl) не зв'язується з якими-небудь клітинами. Фігура 2. Індукція апоптозу анти-Ramos scFv Клітини В-лімфоми Ramos послідовно інкубували з анти-Ramos scFv, анти-гіс- mAb, і антимишачими поліклональними Ab на кризі (з періодичним відмиванням для видалення надлишку незв'язаного антитіла), та інкубували у зволоженій атмосфері при 5 % CO2 і 37 °C протягом 24 годин. Клітини збирали й піддавали комбінованому фарбуванню анексином V-AF488 (AV) і пропідіум-йодидом (PI). Клітини були оцінені як життєздатні (AV-PI-, зафарбовані кола Фіг. 2C), ранні апоптотичні (AV+PI-, незафарбовані трикутники Фіг. 2C), або пізні апоптотичні/некротичні (AV+PI+, незафарбовані ромби Фіг. 2C), на підставі диференціальної позитивності за AV і PI фарбуванням (визначеному в квадратних координатах на Фіг.2B). Результати представлені побудовою (A) розсіювання в передньому напрямку (FSC-висота) розсіювання в бічному напрямку й (B) AV (FL-1) проти PI (FL-3). Титрований ефект scFv B1 і F1 також представлений (C). Сім унікальних клонів scFv інкубували із клітинами В-лімфоми (D) Ramos або (E) Raji при 37 °C протягом 24 годин за різної концентрації, і вивчали вплив на індукцію апоптозу. Три scFv; B1, B11, і C11, показали титровану активність стосовно обох клітинних ліній, у той час як апоптоз-індукуюча здатність scFv B10, C10, і G12 обмежувалася клітинами В-лімфоми Ramos. Фігура 3. Специфічності виділених антитіл, включаючи HLA-DR/DP, IgM, і ICAM-1 6 A) 50-600 × 10 клітин В-лімфоми Raji лізували з неіонним детергентом тритоном X-100 при 0,5 % об./об. і осаджували імунопреципітацією з 100 мкг повного людського IgG1 формату B1 (смуга 1) і B11 (смуга 2) антитіла, з наступною перехресною зшивкою із протеїн-А-сефарозою. 6 Лізати клітин В-лімфоми Ramos з 50 × 10 клітин використовували для осадження 20 мкг C11 (смуга 3). Антитіло-специфічні смуги вирізали й піддавали розщепленню трипсином, і аналізували за допомогою MALDI-TOF. B) Зв'язування B1 IgG, B11 IgG, і C11 IgG із клітинами В-лімфоми специфічно блокувалося пре-інкубуванням з анти-HLA-DR/DP, анти-ICAM-1 або анти-IgM антитілами, відповідно. Щоб підтвердити ідентичність знайдених за допомогою MALDI-TOF антигенів клонів антитіл B1, B11, і C11, були проведені дослідження із блокування з комерційно доступними антитілами, з аналізом проточною цитометрією. Клітини були попередньо блоковані з 10-разовим молярним надлишком (у порівнянні з людськими антитілами) видоспецифічних блокуючих антитіл, протягом 1 години, з наступним додаванням якого-небудь із виділених клонів людських антитіл. Через 30 хвилин, клітини відмивали й виявляли зв'язування людського антитіла із клітинами за допомогою Пе-кон'югованого козячого анти-людського IgG (Caltag Laboratories, Берлингейм, 7 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 Каліфорнія, США). Блокуючими антитілами, які використовувались в дослідженні, були: для B1 мишачі моноклональні анти-HLA DR (Sigma, клон HK14) або анти-CD40 антитіла (Beckton Dickinson, клон 5C3); для B11 - кролячі поліклональні анти-ICAM-1 (Abcam, ab7815-250) або анти-CD22 антитіла (Abcam, ab25135-100); для C11 - козині поліклональні анти-IgM (Zymed, Південний Сан-Франциско, Каліфорнія, США, 62-7500) або анти-IgG антитіла (Zymed, 62-8400). Фігура 4. ICAM-1 рецептором поверхні клітини, асоційованим з В-лімфомою, здатним опосередковувати запрограмовану клітинну загибель 5 A. 2 мкг/мл B11 або анти-фитц-8 (контроль) IgG1 додавали до 4 × 10 клітин В-лімфоми CL01, інкубували протягом 2 годин на кризі, з наступним додаванням 10 мкг/мл перехрестнозв'язаних вторинних Fab’2 козячих анти-людських Fc антитіл. Клітини інкубували при 37 °C протягом 6 годин, і визначали ефект інкубації з антитілами за допомогою двох незалежних аналізів апоптозу. Клітини фарбували або AV/PI (верхня панель), подібно до того, як описано це вище, або інкубацією з 5 мкг/мл реагентом JC-1, деполяризуючим мембрану мітохондрій, протягом 30 хв за кімнатної температури (нижня панель). Індукцію апоптозу виявляли за зниженням відношення інтенсивності червоної (Y-вісь)/ зеленої (X-вісь) флуоресценції. (B) Гістологічна секція показує зразкове зв'язування В11 антитіл із тканиною В-лімфоми. Кріоконсервовану тканину, узяту у пацієнта з анапластичною крупноклітинною В-лімфомою, фарбували з В11 або ФІТЦ-8 (контроль) scFv антитілом. Зв'язування антитіл виявляли з DAB (коричневе фарбування). Вкладена картинка показує фарбування з контролем scFv. (C) CD45PerCp-Cy5.5 mAb попередньо мічені Ramos клітини змішували з отриманими від донора мононуклеарними клітинами периферійної крові (PBMCs), і фарбували різні популяції клітин флуорохром-кон'югованими CD-специфічними антитілами й Alexa Fluor 647 Zenon попередньо міченим B11 IgG1 або контрольним ФIТЦ-8 IgG1. IgG B11 зв'язування з різними клітинними популяціями реєстрували на FL4 каналі. Фігура 5. Афіність IgG B1 і IgG B11 щодо клітин В-лімфоми Клітини Raji (ліві панелі, IgG B1) або клітини Ramos (праві панелі, IgG B11) інкубували із зростаючими кількостями радіойодованого IgG B1 або радіойодованого IgG B11 у присутності або відсутності 0,2 мг/мл відповідного неміченого IgG білка. Специфічне зв'язування визначали шляхом вирахування зв'язування в присутності неміченого білка із загального зв'язування. Кількість зв'язаного IgG B1 або IgG B11 білка зростала з підвищенням кількості вільного IgG білка з досягненням насичення зв'язування при ~30 н IgG B1 і ~1 н IgG B11, відповідно (верхні панелі). Аналіз із використанням графіка Розенталя-Скетчарда (нижні панелі) продемонстрував константу дисоціації ~3 н з 400,000 функціональних сайтів зв'язування на клітину Raji для IgG B1, і константу дисоціації ~0,3 н з 47,400 функціональних сайтів зв'язування для IgG B11 (клітини Raji). Фігура 6 - Зв'язування B1, B11, C11 IgG1 із клітинами пухлинних ліній різного походження Антигенний розподіл антигенів, які є мішенями для B1, B11, і C11 антитіл на різних клітинних лініях карциноми досліджували за допомогою проточної цитометрії. Гістограми показали зв'язування анти-CD20 Mab Ритуксимаба (передні основні піки першого ряду), B1 IgG 1 (піки другого ряду), B11 IgG1 (піки третього ряду), або C11 IgG1 (основні задні піки четвертого ряду) з карциномою молочної залози MCF-7, карциномою підшлункової залози HPAC, карциномою простати PC-3, карциномою прямої кишки LS174 T, і клітинами моноцитарной лейкемії THP-1, як зазначено. Фігура 7 – B11 IgG1 індукція апоптозу в клітинах карциноми Клітинну лінію карциноми простати PC-3 вирощували в повному виростному середовищі (RPMI 1640, з додаванням 10 % ЕТС, 10 м HEPES, і 2 м L-глутаміна) до 80 % конфлюентності в 6-комірковому планшеті. Клітинну лінію карциноми простати DU145 вирощували на середовищі MEM із солями Ерла, з додаванням 10 % ембріональної телячої сироватки (ЕТС), 1 мм пірувата натрію, і 1 мм замінних амінокислот, а клітинну лінію меланоми MDA MB 435 вирощували на середовищі DMEM з додаванням 10 % ЕТС. Для аналізів апоптозу клітини відмивали фосфатно-сольовим буферним розчином (ФБР) і додавали серійні розведення B11 IgG1 (або B1 IgG1, трастузумаба або негативного контролю антитіл для контролів) в окремі комірки з наступною 1-2 годинною інкубацією при 4C. Клітини відмивали й додавали повне виростне середовище, яке містить перехресно-зшиваєюче антитіло, Fab’2 кози анти людського Fab’2, при 10 мкг/мл. Клітини інкубували у зволоженій атмосфері, з 5 % CO2 при 37C, протягом 16-24 годин. Клітини збирали трипсинізацією і фарблували з Alexa Fluor 488-анексином V (AF488-AV) і пропідіум-йодидом (PI), відповідно до інструкцій виробника. Відсоток апоптотичних клітин визначали за формулою: % апоптотичних клітин = 100 - % AF488-AV/PI -/-. A) Контурні графіки показують відносний розподіл клітин PC-3 як функцію позитивності за 8 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 Аннексином V і пропідіум-йодидом після інкубації, як зазначено вище, з 2 мкг/мл IgG B11 або IgG B1. B) Графіки у вигляді стовпчиків показують середній відсоток апоптотичних клітин PC-3 після інкубації із серійними розведеннями B11 IgG1 або 20 мкг/мл B1 IgG1. C) Графіки у вигляді стовпчиків показують середній відсоток апоптотичних клітин MDA MB 435 після інкубації з контролем, який не містить антитіл, 10 мкг/мл негативного контролю антитіл, серійними розведеннями B11 IgG1, або 10 мкг/мл трастузумаба IgG1. D) Графіки у вигляді стовпчиків показують середній відсоток апоптотичних DU145 клітин після інкубації з контролем, який не містить антитіл, 10 мкг/мл негативного контролю антитіл, серійними розведеннями B11 IgG1, або 10 мкг/мл Трастузумаба IgG1. Фігура 8. B1 IgG1 і B1 IgG4 індукують пряму клітинну цитотоксичність на клітинах Raji Влімфоми за відсутності перекрестно-зв'язаних реагентів Клітини Raji інкубували з B1 IgG1, B1 IgG4, Ритуксимабом IgG1, або контрольним CT-17 IgG1 при 20, 6,7 або 2,2 мкг/мл протягом 24 годин. Клітини збирали й визначали життєздатність як відсоток Аннексин V- і пропідіум-йодид- подвійних негативних клітин. Фігура 9-VH і VL послідовності (нуклеотидна й амінокислотна) для В1 антитіла Фігура 10-VH і VL послідовності (нуклеотидна й амінокислотна) для В11 антитіла Фігура 11-VH і VL послідовності (нуклеотидна й амінокислотна) для С11 антитіла Здійснення винаходу Приклад 1 - Вибір і скринінг (біопенінг) апоптоз-індукуючих антитіл зі специфічністю відносно рецепторів клітинної поверхні, асоційованих з В-лімфомою. Культура клітин Клітинну лінію, яка застосовувалась в даному дослідженні, одержували з ATCC (Манассас, Вірджинія, США) або Deutsche Sammlung von Mikroorganismen und Zellkulturen (DSMZ) GmbH (Брауншвейг, Німеччина) і культивували в середовищі RPMI 1640 з додаванням 10 % ЕТС, 2 м L-глутаміну, 10 м HEPES і 1 м Na пірувату (усе від Invitrogen, Карлсбад, Каліфорнія, США), якщо не зазначено інакше. Клітинна лінія Т-лейкемії Jurkat (клон E6-1, TIB-152, ATCC), клітинні лінії Влімфоми DOHH-2 (ACC47, DSMZ), SC-1 (ACC558, DSMZ), WSU-NHL (ACC58, DSMZ), JVM-2 (ACC12, DSMZ), Jeko-1 (ACC553, DSMZ вирощена в 20 % ЕТС), Rec-1 (ACC 584, DSMZ), SP-53 (Daibata et al. Cancer 1989;64:1248-53), RL (CRL-2261, ATCC), Granta 519 (DSMZ), NCEB-1 (Saltman et al. Blood 1988;72:2026-30), BJAB (Menezes et al. Biomedicine 1975;22:276-84), Ramos (CRL-1596, ATCC), Raji (CCL-86, ATCC), Daudi (CCL-213, ATCC), CL-01 (Cerutti et al. J Immunol 1998;160:2145-57), пре-В-клітинну лімфому KM-3/Reh (CRL-8286, ATCC) і множинна мієлома MC/CAR (CRL-8083, ATCC, вирощена в IMDM (Invitrogen) з доповненням 20 % ЕТС) всі були вільні від мікоплазми й культивовані у зволоженій атмосфері при 37 C, із застосуванням 5 % 56 CO2 атмосфери. Клітини підтримували при 2 10 1 10 клітин/мл. Приготування мембранних везикул клітин Jurkat Клітини Jurkat збирали центрифугуваням при 300 g протягом 15 хвилин в 500 мл склянках (Corning Inc. Life Sciences, Нью-Йорк, США), відмивали у ФБР Dulbecco (Invitrogen), і ресуспендували в буфері A (1 м NaHCO3, 1.5 м MgAc, pH 7,4). Концентрація клітин склала 7 9 приблизно 5 10 клітин Jurkat /мл (5 10 клітин в 100 мл буфера А). Руйнування клітин домагалися гіпоосмотичним шоком (Буфер А) на кризі протягом 10-30 хвилин і наступною кавітацією азотом в азотнії кавітаційній бомбі (Parr Instrument Company, Молін, Іллінойс, США). Клітини витримували при постійному тиску 40 бар (4 000 кПа) протягом о 15 хвилин при 0 C . Зруйновані клітини збирали в 250 мл пробірку Sarstedt (Sarstedt AG & Co, Нумбрехт, Німеччина), яка містить 500 мкл 0,5 М ЕДТА до одержання кінцевої концентрації ЕДТА 2,5 мм. Додавання ЕДТА запобігає агрегації мембранних везикул. Гомогенат (100 мл) розділяли в 4 (25 мл Бекмановскі товстостінні центрифужні пробірки (Beckman Coulter, Inc., Фуллертон, Каліфорнія, США), які центрифугували протягом 10 хвилин при 1900 (g (4 000 об./хв. на роторі Sorvall SS34) при 4(C для видалення незруйнованих клітин, ядер і важких мітохондрій. Збирали надосадову рідину, і ресуспендували обложений матеріал в 25 мл 1 мМ NaHCO 3 буфера, який містить 1 мМ ЕДТА й центрифугували повторно (додатковий вихід обложених неочищених мембран Jurkat). Мембрани Jurkat об'єднували з мембранами від першого центрифугування. Надосадові рідини, які містять неочищені мембранні везикули Jurkat, піддавали ультрацентрифугуванню із застосуванням ротора Beckman Типу 45Ti при 40 000 об./хв. (приблизно 200 000 g) протягом 2,5 годин при 4C. Надосадові рідини відкидали, і буфер, який залишається, видаляли, перевертаючи пробірку й поміщаючи її краї на тканину (наприклад, KleenexTM). Осад неочищених мембран переносили в гомогенізатор Даунса за допомогою металевого 9 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 шпателя й ресуспендували в 2,5 мл HES буфера (10 м Hepes, 1 м ЕДТА, 0,25 M сахарози, pH 7,4) декількома обережними перемішуваннями в гомогенізаторі. У такий спосіб досягалася 9 концентрація мембранної суспензії, еквівалентна 2 10 клітин/мл, яка містить 80-100 мг білка. Селекція фагових антитіл за допомогою конкурентного біопенінга із застосуванням цілих клітин/клітинних мембранних везикул 13 Приблизно 2 10 фагових часток попередньо нагрівали при 37 C протягом 15 при періодичному перемішуванні, центрифугували протягом 15 хв. при 14 000 g для видалення осаду, і надосадову рідину переносили в нову пробірку Епендорф. Додавали знежирене сухе молоко до кінцевої концентрації 2 % (мас./об.). Препарати мембранних везикул Jurkat, отримані 9 8 з 2 10 клітин (етап 1 добору; 2 10 клітин етапів 2 і 3 добору) відтавали на кризі, і змішували із блокуючими фаговими частками. Суміш інкубували протягом 15 хвилин на кризі. 7 6 25 10 (5 10 й і 3-й етапи) клітин Ramos збирали центрифугуванням при 1 200 об./хв. протягом 6 хвилин при 4 °C. Надосадову рідину відкидали, і клітини Ramos ресуспендували в суміші молока, фагів і мембранних везикул Jurkat. Суспензію інкубували при 10 °C при повільному обертанні від дна до верху протягом 4 годин. Суміш клітин/клітинних мембранних везикул/фагів переносили в 15 мл пробірку Falcon (BD Biosciences, Бедфорд, Массачусетс, США), що містить 0,5 мл 100 % (фарбування трипановим синім) Ficoll-Paque PLUS (Amersham Biosciences, Уппсала, Швеція) на дні, і нашаровані зверху 9,5 мл 40 % (об./об.) Фікола в 2 % (мас./об.) БСА/ФБР (подушка Фікола). Пробірку центрифугували при 1 500 об./хв. протягом 10 хв при 4 °C. Пробірку виймали із центрифуги, закривали пробкою й герметично заклеювали. Нижній кінець пробірки Falcon, яка містить 100 % Фікол, зрізали за допомогою ножиць для обрізання сигар. Таким чином, матеріал дуже високої щільності, який включає шари мембранних везикул і клітинних ядер, видаляли із пробірки. Пробку пробірки обережно відкривали, порушуючи вакуум усередині пробірки, і дозволяючи рідині витікати краплинами крізь отвір (відріз) на дні пробірки. Суспензію зібраних клітин відмивали ФБР один раз для видалення надлишку Фікола. Осад ресуспендували в 1 мл ФБР (не проводячи наступного кінцевого відмивання), суспензію повторно наносили на верх свіжої подушки Фікола, і повторювали процедуру відмивання (двічі на етапах 2 і 3). Фаги елюювали із клітин додаванням 150 мкл 76 мм лимонної кислоти (рН 2,5) у ФБР із наступною інкубацією за кімнатної температури протягом 5 хвилин. Суміш нейтралізували додаванням 200 мкл 1 М Трис-HCl, pH 7,4. Надосадову рідину, яка містить елюйований фаг, зберігали з наступним осадженням клітин при 300 × g протягом 5 хв. Подальшу елюцію фага проводили ресуспендуванням та інкубацією осаду клітин в 1 мл трипсину за кімнатної температури протягом 10 хвилин. Після інактивації з 40 мкм апротиніну 1 мг/мл клітини центрифугували й зберігали надосадову рідину, яка містить елюйований фаг. Елюйований фаг застосовували для зараження Escherichia coli HB101F, і поміщали бактерії на середовище ТВ, яке містить придатні антибіотики й глюкозу. Підраховували бактеріальні колонії, зібрані із планшетів, і застосовували його як інокуляти для наступного етапу біопенінга. Конверсія у формат scFv, експресія scFv, очищення, і аналіз зв'язування із клітинами Фагмідний пул, отриманий після трьох етапів селекції, обробляли EagI для видалення гена III. Отриманий вектор зв'язували повторно. Вектори, які містять повторно зв'язані фрагменти не розрізаного гена III, лінеаризували обробкою ферментом EcoRI. Пул вектора scFv, створений таким чином, застосовували для трансформації клітин E. coli TOP10 в основному так, як це описано раніше (Soderlindet al. Nat Biotechnol 2000;18:852-6.). 2 Бактерії поміщали на більші 500 см агарові пластини й відбирали індивідуальні клони, переносили в 96-коміркові планшети, і експресували в TB середовищі при культивуванні протягом ночі при 37C, 220 об./хв. із застосуванням автоматизованої системи (Hallborn Biotechniques 2002;Suppl:30-7.). Фрагменти рекомбінантного scFv продукувались у середовищі ТВ, яке містить придатні антибіотики. Для первинного скринінгу scFv клону, який зв'язується із клітинами-мішенями Ramos і клітинами, які не є мішенню, Jurkat, 5,000 клітин Ramos або Jurkat інкубували з яким-небудь із 960 scFv клонів, отриманих на 3-му етапі селекції, і продукували, як це описано вище. Клітини інкубували з 0,5 мкг/мл анти-6xГіс моноклональних антитіл (R&D Systems, Мінеаполіс, Мінесота, США) і 0,7 мкг/мл Cy 5-кон'югованого козиного анти-мишачого реагенту (Amersham Biosciences). Зв'язування із клітинами аналізували за допомогою пристрою 8200 Cellular Detection System Fluorescence Macroconfocal High Throughput Screening (FMAT) instrument (Applied Biosystems, Фостер Сіті, Каліфорнія, США). 10 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 Після первинного скринінгу довільно відбирали сімдесят два бактеріальних клони (тобто незалежно від клітинної реактивності клітин-мішеней і клітин, які не є мішенню, у первинному скринінгу) для ДНК-секвенування, як це було описано раніше (Soderlind et al. Nat Biotechnol 2000;18:852-6.) (Soderlind et al., 2000). Для оцінки зв'язування із клітинною поверхнею за 5 допомогою проточної цитометрії, клітини Ramos і Jurkat (ті й інші при додаванні 2 10 клітин на аналіз) інкубували з індивідуальними клонами scFv при концентрації 2-10 мкг/мл у ФБР (Invitrogen), що містить 0,5 % мас./об. БСА (DPBS-B) протягом 1 години. Клітини відмивали центрифугуванням при 300 × g протягом 6 хвилин. Потім клітини інкубували з ФІТЦ-кон'югованими CD19 моноклональними антитілами й ПЕ-кон'югованими CD3 моноклональними антитілами (BD), забезпечуючи наступну ідентифікацію клітин-мішеней і клітин, які не є мішенню, відповідно. Виявлення зв'язування scFv досягали інкубацією з RPE-Cy 5-стрептавідином (Dako Cytomation, Глоструп, Данія) з наступною інкубацією з біотинільованими анти-6xГіс моноклональними антитілами. Клітини інкубували із вторинним і третинним реагентами протягом 40 хвилин, і 15 хвилин, відповідно. Всі інкубації проводили на кризі із застосуванням охолоджених на кризі розчинів. Диференціальний пенінг цілих клітин/ клітинних мембранних везикул У даному дослідженні застосовували новий протокол пенінга для виділення антитіл, спрямованих на диференціально експресовані антигени в їхній вихідній конфігурації для клітинної поверхні. Після трьох етапів конкурентного біопенінга із застосуванням цілих клітин Влімфоми Ramos і мембранних везикул, отриманих із клітин Т-лейкемії Jurkat, виділяли рекомбінантні фаги scFv. Їх конвертували в розчинні scFv і експресували в клітинах E. coli TOP10. Рекомбінантний scFv інкубували із цілими клітинами-мішенями (Ramos) або клітинами, які не є мішенню (Jurkat), і оцінювали зв'язування із клітинами. Специфічність клонів антитіл щодо антигенів клітин-мішеней була разючою, оскільки було показано, що експресувані 482 scFv клони вибірково зв'язувалися із клітинами-мішенями Ramos з інтенсивностю від слабкої до дуже сильної (Фіг. 1А). Були ідентифіковані тільки два клони, які слабко фарбують клітини Jurkat, які не є мішенню, (Фіг. 1A). Далі ми визначили різноманіття генотипів ізольованого ScFv, представленого на поверхні фагів. Сімдесят два scFv клони були довільно відібрані (тобто незалежно від тропізму зв'язування, визначеного при первинному скринінгу) для ДНК-секвенування. Клони одночасно повторно експресували й повторно оцінювали на специфічність відносно клітин-мішеней (Ramos і Jurkat) за допомогою FMAT технології, як це описано (Фіг. 1B). Ідентифікували сім різних генотипів антитіл, як було визначено за їх різним CDRH3 і CDRL3 послідовностями (дані не показані). Висока специфічність анти-Ramos scFv була підтверджена триколірною проточною цитометрією, з наступною інкубацією з рівним числом клітин Ramos і Jurkat та детекцією scFv зв'язування за допомогою анти-tag антитіла (Фіг. 1C). Клітини-мішені й клітини, які не є мішенню, визначали за CD19 і CD3 експресією, відповідно, із застосуванням кон'югованих із флуорохромом CD-специфічних моноклональних антитіл. Сім генотипово унікальних scFv клонів показали високу й варіабельну інтенсивність зв'язування із клітинами-мішенями Ramos, але не показали зв'язування із клітинами Jurkat, які не є мішенню, у порівнянні з негативним контролем scFv. Аналіз апоптозу Рівні ліпополісахариду в рекомбінанто зроблених фрагментах scFv знижували із застосуванням колонок Detoxigel відповідно до інструкцій виробника (Pierce Biotechnology, Рокфорд, Ілінойс, США). Рівень решти ендотоксину визначали за допомогою тесту з використанням лізата амебоцитів LAL (Cambrex Bioscience, Уолкерсвіль, Меріленд, США). Було встановлено, що всі зразки scFv містять менше 0,1 МЕ/мл ліпополісахариду. Хімерне анти-CD20 антитіло Мабтера (Ритуксимаб) одержували з Університетського госпіталю Лунда 5 (Лунд, Швеція 2 × 10 клітин В-лімфоми (Raji або Ramos) або Т-клітин Jurkat інкубували із серійно розведеними й детоксицированими scFv в культуральному середовищі протягом 1 години на кризі. Клітини послідовно інкубували із вторинними анти-6xГіс моноклональними антитілами (5 мкг/мл), і третинними козиними Fab’2 анти-мишачими Fab’2 антитілами (Jackson ImmunoResearch Laboratories, Inc., Вест Гроув, Пенсільванія, США). Періодичне відмивання забезпечувало видалення надлишку незв'язаного реагенту антитіл. Клітини інкубували при 37 C у зволоженій атмосфері з 5 % CO2 протягом 24 годин. Коли цільний IgG застосовували для індукції апоптозу, перехесно-зв'язаний реагент заміняли на козині Fab'2 анти-людські Fc (антитіла (Jackson ImmunoResearch) з мінімальною 11 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 перехресною реактивністю з відмінними від IgG ізотипами антитіл (для запобігання неспецифічного перехресного зв'язування з ендогенними імуноглобулінами, асоційованими з поверхнею В-лімфоми), та інкубували, як це описано вище, протягом 6 годин. Апоптотичні клітини виявляли, якщо не було встановлено інакше, комбінованим фарбуванням з Annexin V Alexa Fluor 488 (AV) і пропідіум-йодидом (PI) (обидва від Molecular Probes, Invitrogen) і наступним аналізом проточною цитометрією. Клітини були оцінені як життєздатні (AV-/PI-), ранні апоптотичні (AV+/ PI-) або пізні апоптотичні/некротичні (AV+/PI+). AV і PI сигнали реєстрували на FL1 і FL2 або FL3 каналах (як зазначено в тексті), відповідно, за допомогою приладу FACSCalibur (BD Biosciences). Для того щоб досліджувати функціональність виділеного scFv, ми встановили високопродуктивний скринінговий аналіз апоптозу, заснований на послідовній інкубації й відмиванні від клітин з scFv і перехесно-зв'язаним реагентом. Залежність від scFv клону й концентрації в аналізі апоптозу продемонстрована на Фіг.2 A-C, де апоптотичний ефект обраного scFv клону B1 дорівнює ефекту scFv клону F1, який не проявляє індукції апоптозу. Клітини Jurkat, у яких відсутня експресія цільового антигену, не гинуть у результаті апоптозу після обробки з яким-небудь оцінюваним scFv, демонструючи, що індукція апоптозу залежить від зв'язування із цільовим антигеном (дані не показані). Застосовуючи встановлений аналіз scFv-апоптозу, ми відібрали клони для апоптозу на клітинах В-лімфоми Ramos і Raji, scFv-індуковані апоптотичні ефекти порівнювали з тими, які були індуковані Ритуксимабом і анти-CD20 моноклональними антитілами (Фіг. 2D). Три scFv клони - B1, B11 і C11 - були ідентифіковані як такі, що індукують значний апоптоз як у клітинах Ramos, так і в Raji (Фіг. 2 D і E). Індукція апоптозу scFv на клітинах Raji корелювала зі зв'язуванням із цими клітинами (Фіг. 2D), оскільки scFv клони, нездатні зв'язуватися із клітинами Raji, не індукували апоптоз. B1, B11 і C11 клони переводили в повністю людські антитіла IgG1. Їхня специфічність і функціональність залишалися інтактними після реформатування, як це продемонстровано їхнім сильним зв'язуванням й потужною цитотоксичністю стосовно широкої панелі клітинних ліній Влімфоми (Таблиця 1). Важливо, що індукція апоптозу була швидкою з максимальним відсотком анексин-V позитивних клітин, який досягається вже через три-шість годин на деяких клітинних лініях (Таблиця 1 і не показані дані). Аналізи продукції IgG і скринінг ендотоксина Фрагменти антитіл scFv були конвертовані у формат повнорозмірних людських IgG1 за допомогою клонування в модифікований вектор pCDNA3 (Norderhaug et al. J Immunol Methods 1997;204:77-87.), і транзиторно трансфектували в клітини HEK293 із застосуванням реагенту Ліпофектамін 2000 відповідно до інструкцій виробника (Invitrogen). Людський IgG очищали з відпрацьованого культиваційного середовища на колонці MabSelect із протеїном А (Amersham Biosciences). Чистота препаратів склала The >98 % за результатами електрофоретического аналізу в поліакриламідному гелі в присутності додецилсульфату натрію (ДСН-ПААГ). Препарати антитіл були проаналізовані й, як було встановлено, містили < 0,1 МЕ/мл ендотоксина при концентраціях, які застосовуються у даному дослідженні, як було визначено за допомогою тесту з лізатом амебоцитів LAL (Cambrex Bioscience). Приклад 2 - Аналіз специфічності антитіл Ідентифікація антигену Справжність антигенів-мішеней визначали імунопреципітацією з лізатами клітин В-лімфоми. 6 Клітини (50-600 10 на мл лізуючого буфера, залежно від антитіла й клітинної лінії) збирали центрифугуванням, двічі відмивали у ФБР й інкубували протягом 15 хвилин у лізуючому буфері (25 мМ Трис-HCl, pH 7,5, 150 мМ NaCl, 5 мМ ЕДТА, і повний коктейль інгібіторів протеаз без ЕДТА (Roche Diagnostics GmbH, Маннхейм, Німеччина)), який містить детергент Тритон X-100 (Sigma-Aldrich, Сент-Луїс, Міссурі, США) при 0,5 % об./об. Клітинний дебрис осаджували при 16 000 × g протягом 15 хвилин у стандартній настільній центрифузі, і попередньо очищали на протеїн А-сефарозі 4 Fast Flow (Amersham Biosciences) (1/10 об'єму реакційної суміші) протягом 1 години при перемішуванні. Для кожного зразка 1 мл попередньо очищеного клітинного лізата осаджували імунопреципітацією протягом 2 годин 20100 мкг будь-яких людських антитіл. Протеїн А-сефарозу 4 Fast Flow додавали знову й інкубували протягом 30 хвилин, а після інтенсивного промивання імунних комплексів у лізуючому буфері, кип'ятили протягом 5 хвилин, і остаточно ресуспендували в буфері для зразків (1X NuPAGE LDS буфер для зразків, 1X NuPAGE відновлюючий агент для зразків) і розділяли в NuPAGE Novex 4-12 % Біс-Трис Гелі (усе від Invitrogen). Після фарбування (Simply Blue Safestain, Invitrogen), білкові ланцюги, які власне і цікавили 12 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 вирізали із ДСН-ПААГ і піддавали розщепленню трипсином, як це описано (Edvardsson et al. Electrophoresis 1999;20:935-42.). Коротко кажучи, блоки гелю відмивали від фарби й урівноважували трикратним відмиванням з 200 мкл 50 % ацетонітрилу (ACN) при перемішуванні. Після висушування в концентраторі SpeedVac (Savant, Farmingdale, Нью-Йорк, США) протягом 15 хвилин, зразки відновлювали додаванням 25 мкл 10 мМ ДТТ / 100 mM NH 4HCO3 та інкубували при 56 °C протягом 1 години, і алкілювали додаванням 25 мкл 55 мМ йодоацетаміду/100 мМ NH 4HCO3 з наступною інкубацією протягом 45 хвилин за кімнатної температури. Після двох додаткових 10 хвилинних етапів відмивання в 100 мМ NH 4HCO3 з наступним відмиванням в 50 % об./об. ACN, шматочки гелю висушували в концентраторі SpeedVac і повторно намочували й переварювали в 15 мкл 15 нг/мкл трипсину. (Promega Corporation, Медисон, Висконсин, США) в 25 мМ NH4HCO3 при 37 °C протягом ночі. Пептиди екстрагували додаванням 50 % об./об. ACN /1 % об./об. ТФУ й 10 хв інкубацією за кімнатної температури. 1 мкл екстракту наносили на пластини для зразків MALDI і залишали до висихання. 1 мкл розчину матриці (5 мг/мл альфа-ціано-4-гідрокси коричної кислоти (CHCA) в 75 % об./об. ACN /1 % об./об. ТФУ) наносили поверх пептидів Маси пептидів визначали із застосуванням 4700 Maldi Workstation фірми Applied Biosystems. Протеїни ідентифікували на базі даних пептидних мас із використанням пошукових інструментів Mascot (Matrixscience, Великобританія). Антигенну специфічність клонів B10, C10, і G12 ідентифікували із застосуванням подібної методології, за винятком покритих scFv- і анти-гіс магнітних мікронамистин (Miltenyi Biotec GmbH, Bergisch Gladbach, Німеччина), використаних для імунопреципітації. Після конверсії до формату повних антитіл B1, B11 і C11 IgG використовували для преципітації антигенів із клітин В-лімфоми Raji і Ramos. IgG B1 преципітував дві смуги приблизно 28 і 34 кДа, відповідно (Фіг. 3A, смуга 1). Шматки гелю, які містять ці смуги, вирізали, обробляли трипсином і аналізували мас-спектрометрією, ідентифікуючи HLADR/DP як цільовий антиген. Специфічність IgG B1 у відношенні HLA-DR/DP була підтверджена вестерн-блотингом і детекцією HLA-DR/DP білка, із застосуванням комерційно доступних моноклональних антитіл, і блокуванням B1 IgG зв'язування після попередньої інкубації клітин з комерційно доступними HLA-DR специфічними моноклональними антитілами (Фіг. 3B). Ідентичність IgG B11 і C11 визначених антигенів була встановлена із застосуванням подібної методології. Було встановлено, що IgG C11 преципітує 68 кДа смугу білка, ідентифікованого як мембранно-зв'язана форма µ-ланцюга В-клітинного рецептора (Фіг. 3A, смуга 3). IgG B11 преципітував 90 кДа смугу білка, ідентифікованого як молекула клітинної адгезії -1 (ICAM-1) (Фіг. 3A, смуга 2). Специфічність IgG B11 для ICAM-1, і C11 IgG для IgM була підтверджена тандемною мас-спектрометрією, дослідженнями блокування антитіл (Фіг. 3B), і вестерн-блотингом (дані не показані) із застосуванням комерційно доступних антитіл. Специфічність клонів B10, C10, і G12 визначали із застосуванням scFv і анти-His покритих магнітних мікронамистин для імунопреципітації. Три scFv клони преципітували смугу білка 68 кДа, і МС-аналіз шматочків гелю, які містять ці смуги, після обробки трипсином виявив їхню специфічність у відношенні поверхневого IgM. Можливо, ці антитіла розпізнають Ramos IgM ідіотип, оскільки жодне з них не дає перехресної реакції з В-лімфоцитами периферійної крові або іншими Ig-позитивними В-клітинними лініями. Приклад 3 - Аналіз афінності антитіл Йодування in vitro B1 і B11 імуноглобулінів 125 Йодування 1 мг/мл IgG1 B1 або IgG1 B11 білків з [ I]NaI проводили у ФБР протягом 10 125 хвилин із застосуванням покритих Йодогеном пробірок для йодування (Pierce). Вільний [ I] NaI видаляли знесоленням на колонках PD-10 (Amersham Biosciences), одержуючи питому 125 125 радіоактивність у діапазоні 1000-1600 імп./хв. на нг білка. [ I] IgG1 B1 і [ I] IgG1 B11 застосовували для визначення афінності антитіл. Визначення констант афінності IgG B1 і IgG B11 Мічені радіоактивним йодом IgG B1 або IgG B11 інкубували із клітинами В-лімфоми в DPBSB-hIgG (DPBS-B, який містить 0,2 мг/мл людського IgG) протягом двох годин на кризі з періодичним перемішуванням. Неспецифічне зв'язування визначали в присутності 0,2 мг/мл неміченого IgG B1 або IgG B11 білка, відповідно. Аналізи проводили в трьох повторностях. Клітини наносили поверх подушки 40 % об./об. Ficoll/DPBS-B в окремі пробірки й центрифугували при 400 g протягом 6 хвилин при 4 C. Зразки заморожували при -80 C. 125 Клітинні осади й надосадову рідину виділяли й аналізували окремо щодо вмісту I-IgG білка в гамма-лічильнику, після розрізання пробірок навпіл. 13 UA 100664 C2 5 10 15 Константи афінності антитіл (значення Kd) і число епітопів на клітину визначали за допомогою аналізу Скетчарда за Rosenthal et al. (Anal Biochem 1967;20:525-32), Bylund and Yamamura (Methods in Neurotransmitter Analysed. New York: Raven Press Ltd., 1990), і Marquardt (J. Soc. Indust. Appl. Math 1963;11:431-41), як описано раніше (Brix et al. J. Clin. Invest. 1998;102:283-93). Зв'язування IgG B1 і IgG B11 з HLA-DR і ICAM-1 характеризували шляхом інкубації мічених радіоактивним йодом білків із клітинами Raji або Ramos у присутності або відсутності 0,2 мг/мл 125 відповідного неміченого IgG білка при 4C. Питоме зв'язування [ I]IgG із клітинною поверхнею підраховували шляхом обчислення неспецифічного зв'язування (зв'язування в присутності надлишку неміченого IgG) із загального зв'язування. Насичення питомого зв'язування IgG B1 із клітинами Raji досягалося при t ~30 нМ IgG B1 (Фіг. 5). Аналіз із використанням графіка Розенталя-Скетчарда встановив константу дисоціації ~3 нМ з 400 000 функціональними сайтами зв'язування на клітину Raji, дозволяючи припустити бівалентну взаємодію епітоп-IgG (Фіг. 5). Аналогічно, константа дисоціації IgG B11 була визначена як ~0,2 нМ з 47 400 рецепторами на клітину Ramos. Таблиця 1 Повністю людські B1, B11 і C11 IgG антитіла демонструють динамічні профілі зв'язування й індукують апоптоз у різних клітинних лініях В-лімфоми Специфічність клонів антитіл Класифікація пухлин Клітинна лінія B1-HLA DR/DP MFI b DOHH-2 140 WSU-NHL 280 SC-1 170 RL 50 Granta 370 519 JVM-2 650 Лімфома із Rec-1 0 клітин мантії SP-53 500 NCEB-1 750 Jeko-1 1000 Ramos 125 Raji 550 Лімфома Daudi 200 Беркіта BJAB 530 CL-01 940 Пре-Вклітинна Reh/KM-3 240 лейкемія Множинна MC/CAR 290 мієлома Фолікулярна лімфома B11-ICAM-1 Індукція MFI a апоптозу 100 + 0 + 0 100 25 Індукція апоптозу 90 60 50 210 Індукція апоптозу MFI Ритуксимаб– CD20 Індукція MFI апоптозу 480 ++ 790 + 50 200 + ++ 260 + 60 + 360 +++ + ++ + +++ + +++ + + +++ 100 380 90 340 30 100 420 150 310 600 + + ++ + + + ++ 10 900 360 10 1040 240 20 450 510 60 ++ +++ + + + + 520 580 740 430 1160 300 400 480 530 970 + + ++ + +++ +++ + ++ ++ ++ +++ 20 0 0 ++ 120 + 0 110 a 20 C11-IgM - Індукція апоптозу; визначається за відсотком життєздатних клітин через 6 годин інкубації з будь-якими людськими антитілами, перехесно-зв'язаними з козиними анти-людськими (гама) Fc специфічними антитілами; -, життєздатність не змінюється; +, 95-80 %; ++, 79-60 %; +++, 5940 % життєздатних клітин у порівнянні з контролем (людські ФІТЦ-8 IgG1). Ці результати грунтуються на взятих з подвійним повтенням зразках у трьох незалежних експериментах. b -MFI; Середня інтенсивність флуоресценції вторинних RPE-кон'югованих козиних антилюдських IgG антитіл. Значення контролю людських ФІТЦ-8 IgG антитіл, яке залежить від клітинної лінії MFI, віднімали від MFI кожного з людських антитіл. Приклад 4-ICAM-1 є антигеном, асоційованим з В-лімфомою, з апоптоз-індукуючими властивостями 14 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 Аналіз зв'язування IgG із клітинами Ramos за допомогою проточної цитометрії 6 Клітини Ramos (13 × 10 ) фарбували моноклональними антитілами CD45-PerCp-Cy5.5 шляхом інкубації на кризі протягом 45 хвилин, відмивали DPBS-B, і зберігали на кризі до змішування з неміченими очищеними лейкоцитами периферійної крові. Лейкоцити від двох здорових добровольців були отримані з Університетського госпіталю Лунда. Лейкоцити розбавляли 1:2 ФБР і відмивали центрифугуванням при 500 × g (1500 об./хв. на центрифузі Beckman Spinchron) протягом 10 хвилин, з повним видаленням надосадової рідини й ресуспендуванні в DPBS, який містить 1 % інактивованої нагріванням ЕТС (DPBS-HI). Відмивання повторювали двічі. Червоні кров'яні клітини руйнували інкубацією з розчином, лізуючим еритроцити (BD Biosciences) протягом 15 хвилин за кімнатної температури. Клітини відмивали центрифугуванням при 60 × g (667 об./хв. на центрифузі Beckman Spinchron) протягом 10 хвилин, і ретельно видаляли надосадову рідину аспірацією. Клітини підраховували в камері Бюркера з наступним фарбуванням трипановим синім (Invitrogen) і виключенням мертвих клітин, відмивали в DPBS-HI, осаджували, і ресуспендували в DPBS-B, який містить 200 мкг/мл очищеного людського IgG (блокування Fc рецепторів). 6 5 Для кожного донора й умов аналізу, приблизно 2,5 10 лейкоцитів змішували з 1,6 10 PerCpCy5.5 попередньо мічених клітин Ramos. Додавали мишачі моноклональні CD3- ФІТЦ, CD56-PE, і CD19-PerCpCy5.5 антитіла (BD Biosciences) і інкубували суміші на кризі до додавання міченого людського IgG. Мічення на людських IgG антитіл n-CoDeR і позитивного контролю - анти-CD20 мишачих-людських хімерних антитіл Ритуксимаба за допомогою AF647 Fab фрагментів (Molecular Probes, Invitrogen) проводили відповідно до інструкцій виробника. Кажучи коротко, 4 мкг кожного з антитіл IgG B1, B11, C11, і Ритуксимаба інкубували з 20 мкл реагенту, який мітить, AF647-Fab протягом 5 хвилин за кімнатної температури. Після додавання 20 мкл людського IgG блокуючого реагенту і наступної інкубації протягом 5 хвилин, готовили триразові серійні розведення AF 647-міченого IgG в DBPS-B, і розведені IgG білки додавали до змішаних розчинів клітин Ramos/лейкоцитів периферійної крові. Зразки інкубували протягом 1 години, відмивали, ресуспендували в DPBS-B, і аналізували на зв'язування з різними субпопуляціями клітин проточною цитометрією, з наступним належним калібруванням і компенсацією приладу для чотирьохколірного аналізу. Клітини Ramos високий низький ідентифікували як популяцію PerCpCy5.5 , на відміну від популяції PerCpCy5.5 Влімфоцитів. Імуногістохімія Кріозберігання біоптати лімфовузлів пацієнтів з анапластичною крупноклітинною лімфомою (один пацієнт), центробластною/центроцитарною В-не-Ходжкінскою лімфомою (три пацієнти), і В-клітинною хронічною лімфоцитарною лейкемією (один пацієнт) були отримані у відділенні патології Університету Лунда (Лунд, Швеція). Зрізи товщиною вісім мікрометрів кріозбереженої тканини фіксували в ацетоні протягом 10 хвилин при 4 °C. Ендогенну біотин-зв'язуючу активність блокували послідовною обробкою Авідином і Біотином (Набір для блокування Авідину/Біотину, Invitrogen) по 20 хвилин для кожного. Тканини інкубували з 5 мкг/мл контролю scFv або B11 scFv протягом 1 години. Після відмивання, секції інкубували з біотин-кон'югованими мишачими анти-гіс моноклональними антитілами (R&D Systems) протягом 30 хвилин. scFv зв'язування виявляли після обробки ABC комплекс/ ПХ (пероксидаза хріну) реагентом (Dako Cytomation) протягом 30 хвилин, і наступною інкубацією з диамінобензидином (ДАБ) протягом 5 хвилин. Секції фотографували із застосуванням цифрової камери Leica DC 300F, установленої на світловому/флуоресцентному мікроскопі Leica DMR. Обробку людських тканин проводили відповідно до рекомендації місцевого Комітету з етики Університетського госпіталю Лунда. Аналіз деполяризації мітохондріальної мембрани Деполяризацію мітохондріальної мембрани аналізували, як це попередньо описано (Kim et al. Mol Biol Cell 2004;15:420-34). Кажучи коротко, оброблені антитілами клітини змішували з реагентом JC-1 (Molecular Probes) при 5 мкг/мл і інкубували протягом 30 хвилин за кімнатної температури. Клітини відмивали двічі в охолодженому льодом ФБР, і ресуспендували в 300 мкл ФБР і аналізували на FACS Aria (BD Biosciences). Зелену й червону флуоресценцію аналізували з використанням проникних фільтрів 494/518 нм (FL-1) і 595/615 нм (FL-2) відповідно. ICAM-1 є глікопротеїном надродини імуноглобулінів (Marlin et al. Cell 1987;51:813-9), здатним індукувати двонаправлений сигналінг (Rothlein et al. J Immunol 1994;152:2488-95; Vyth-Dreese et al. Blood 1995;85:2802-12). Раніше не було показано, що ICAM-1 є задіяним в запрограмовану загибель клітин В-лімфоми. Таким чином, ми хотіли підтвердити, що індукована IgG B11 клітинна загибель була 15 UA 100664 C2 5 10 15 20 25 30 активним процесом, за допомогою інакших процесів, крім транслокації фосфатидил-серину крізь клітинну мембрану. Деполяризація мітохондріальної мембрани була обрана для підтвердження апоптозу, оскільки вона є спільною рисою каспазо-залежного й каспазо-незалежного апоптозу, який можна реєструвати шляхом фарбування клітин з 5,5',6,6'-тетрахлоро-1,1',3,3'тетраетилбензимідазоліл-карбоцианін йодидом (реагентом JC-1). Відповідно до нашого анексин V/ пропідіум-йодидного аналізу (Фіг. 4A, верхня панель), IgG B11 індукував деполяризацію мітохондріальної мембрани в клітинах CL-01 B-лімфоми, як було визначено аналізом проточною цитометрією після фарбування JC-1 реагентом (Фіг. 4A, нижня панель). Для того, щоб виключити можливість того, що експресія ICAM-1 була in vitro артефактом, який виник у результаті загальної позитивної регуляції при культивуванні клітин, ми оцінювали зв'язування IgG B11 із тканинами, отриманими від п'яти різних пацієнтів з різними видами Влімфоми. При імуногістохімії IgG B11 показав сильне зв'язування з п'ятьма тканинами лімфоми (Фіг. 4B), з інтенсивністю, порівнюваною або дещо більш низкою, ніж анти-HLA-DR/DP антитіло IgG B1 (Таблиця 2). Далі ми оцінювали зв'язування IgG B11 з В-лімфомою у порівнянні зі спочиваючими лейкоцитами периферійної крові. Ramos були обрані як представники клітинної лінії В-лімфоми виходячи з іх низькорівневої експресії епітопа при значній інтенсивності B11-індукованого апоптозу. Аналіз методом проточної цитометрії після змішаної інкубації попередньо мічених клітин Ramos з лейкоцитами цільної периферійної крові IgG B1, B11 або C11 антитіл виявив, що IgG B11 показує сильне зв'язування із клітинами Ramos. Навіть ще більш важливим є те, що В11 демонстрував найбільше диференційне зв'язування (найбільш сильна позитивна регуляція антигену) із трьох антитіл до клітин B-лімфоми Ramos у порівнянні з нормальними лейкоцитами периферійної крові (Фіг. 4C і не наведені дані). IgG B11 зв'язування досягало піка вже при 0,1 мкг/мл і було 3,7-разово позитивно-регульованим на клітинах Ramos у порівнянні з моноцитами (MFI 654 проти 176), 8, 3-разово позитивнорегульованим на клітинах Ramos у порівнянні з В-лімфоцитами периферійної крові (MFI 654 проти 78), і 23- разово позитивно регульованим у порівнянні з NK-клітинами. Зв'язування з іншими досліджуваними субпопуляціями лейкоцитів периферійної крові було негативним. Таблиця 2 ICAM-1 сильно експресується в тканинах В-лімфоми різного походження ПаціКласифікація пухлини єнт c A B-CLL (низькомалігнантна не-Ходжкінска лімфома) B Анапластична крупноклітинна В-клітинна лімфома Центробластна/центроцитарна не-Ходжкінска C лімфома d D B-CLL / B-PLL E Центробластна не-Ходжкінска В-лімфома Центробластна/центроцитарна не-Ходжкінска F лімфома c 35 40 45 Клоноспецифічність антитіл B11– ICAM-1 B1– HLA-DR/DP + ++ ++ +++ В++/+++ ++ ++/+++ ++ +++ +++ ++ +++ В d B-CLL = Хронічна В-лімфоцитарна лейкемія, B-PLL = Про-В-лімфоцитарна лейкемія. Підвищення числа + указує на більш сильне фарбування. Приклад 5 – Розподіл антигенів B1, B11, C11 IgG1 у пухлинних клітинних лініях різного походження за даними проточної цитометрії Досліджували розподіл антигенів – мішеней людських антитіл, головним чином для B11, на різних клітинних лініях карциноми. Клітини (MCF-7 і MDA MB 435S карцинома молочної залози, JAR і JEG-3 хоріокарцинома, A549 карцинома легенів, TCC-SUP карцинома сечового міхура, MDA MB 435 меланома, HPAC, PANC-1 і BxPC-3 карцинома підшлункової залози, PC-3 і DU145 карцинома простати, LS174 T, CaCo2, та Lovo карцинома прямої кишки, і THP-1 клітини 6 моноцитарної лейкемії), відмивали у ФБР та ресуспендували до 4 × 10 клітин/мл у повному середовищі (200 000 клітин/50 мкл зразка). Готовили 10-разові серійні розведення B1 IgG1, B11 16 UA 100664 C2 5 10 15 IgG1, C11 IgG1, негативного контролю ФІТЦ-8 IgG1, та Ритуксимабу анти-CD20 моноклональних антитіл (10-0,1 пкг/мл) у Повному середовищі (50 мкл на зразок). Клітини інкубували з якиминебудь антитілами протягом 1 години на кризі, відмивали ресуспендуванням у ФБР/БСА 0,5 %, центрифугували при 1200 об./хв. протягом 15 хвилин, і проводили повну аспірацію надосадової рідини. Клітини інкубували з ПЕ-кон'югованими козиними F(ab')2 анти-людськими IgG (Caltag Laboratories, Кат. № H10104), розведеними 1/50 у ФБР/БСА 0,5 %, протягом 30 хвилин на кризі. Після ресуспендування в 300 мкл ФБР/БСА 0,5 %, клітини аналізували на зв'язування IgG за допомогою приладу FACScan. PC-3 клітини карциноми передміхурової залози показали найсильнішу експресію ICAM-1, як було продемонстровано найбільш сильним зв'язуванням B11 IgG із цими клітинами (Фіг. 6). Клітини карциноми молочної залози MCF-7, карциноми підшлункової залози HPAC, та карциноми прямої кишки LS174 T також експресували ICAM-1, хоча й з більш низькою інтенсивністю, у порівнянні із клітинами раку простати. Напроти, клітини моноцитарної лейкемії THP-1 не експресували ICAM-1. Всі початково проаналізовані клітинні лінії карциноми були негативними за експресією CD20, HLA-DR/DP, та IgM, як свідчила відсутність зв'язування Ритуксимабу IgG, B1 IgG, та C11 IgG, відповідно. Подальші дослідження на додаткових клітинних лініях карциноми показали, що всі проаналізовані клітини карциноми були позитивними за експресією ICAM-1 (Таблиця 3). Таблиця 3 ICAM-1 сильно експресрується в клітинних лініях карциноми різного походження Тип пухлинних клітин Хоріокарцинома Карцинома простати Карцинома підшлункової залози Карцинома товстої кишки Карцинома легенів Карцинома сечового міхура Меланома Карцинома молочної залози Клітинна лінія JAR JEG-3 DU145 PC-3 BxPC-3 PANC-1 CaCo2 Lovo A549 TCC-SUP MDA MB 435 MDA MB 435S MFI 2000 1600 2200 1500 2000 3800 800 1600 800 3200 4000 800 20 25 30 35 40 Приклад 6 - Індукція апоптозу B11 IgG1 у клітинах карциноми У прикладі 5 було показано, що B11 IgG1 сильно зв'язується із клітинами карциноми. У даному прикладі оцінюються апоптоз-індукуючі властивості даних антитіл відносно клітин карциноми. Клітини витримували в 6-коміркових планшетах з повним виросним середовищем протягом трьох днів перед початком експерименту. Клітини були на 50-75 % конфлюентними на час експерименту. Клітини відмивали охолодженим кригою ФБР та інкубували із серійними розведеннями (20-0,02 мкг/мл, як зазначено на фігурах, в 1 мл повного виросного середовища) B11 IgG1, 20 мкг/мл контролю B1 IgG1, 10 мкг/мл негативного контролю IgG1 або 10 мкг/мл Трастузумабу IgG1, як зазначено, при 4C протягом 1-2 годин. Клітини відмивали охолодженим на кризі ФБР і додавали вторинні F(ab’2) козинні анти-людські F(ab’2) антитіла (розведені в повному виросному середовищі до 10 мкг/мл). Клітини інкубували при 37C, у зволоженій атмосфері з 5 % CO2 протягом 16-24 годин. Всі клітини збирали першим виділенням надосадової рідини, з наступним відмиванням ФБР і трипсинізацією прилиплих клітин, які залишилися. Ферментативну реакцію зупиняли ресуспендуванням у ФБР, який містить 10 % інактивованої нагріванням ембріональної телячої сироватки. Клітини відмивали в охолодженому на кризі ФБР, піддавали фарбуванню анексином V/ пропідіум-йодидом, та аналізували на життєздатність/апоптоз, як це описано у прикладі 5 вище. Було показано, що B11 IgG1 індукує апоптоз клітинних ліній карциноми специфічним чином, який піддається титруванню (Фігура 7). Контроль IgG B1, який не зв'язувався із клітинами PC-3 (дивися приклад 5), також не індукував апоптоз у клітинах PC-3. Негативний контроль IgG1 або трастузумаб IgG1 не були здатні індукувати апоптоз у клітинах DU145 або MDA MB435. 17 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 7 - Фармацевтичні композиції та введення Подальший аспект винаходу забезпечує фармацевтичну композицію, яка включає сполуку відповідно до першого аспекту винаходу в суміші з фармацевтично або ветеринарно прийнятною допоміжною речовиною, розріджувачем або носієм. Бажано, композиція є стандартною дозувальною формою, яка включає добову дозу або стандартну, добову суб-дозу або її придатну частку активного інгредієнта. Сполуки запропоновані винаходом можуть звичайно застосовуватися пероральним або будь-яким парентеральним способом, у формі фармацевтичної композиції, яка включає активний інгредієнт, за необхідності у формі нетоксичної органічної або неорганічної кислотноабо основно-адуктивної солі, у фармацевтично прийнятній лікарській формі. Залежно від захворювання та пацієнта, якому призначене лікування, а також способу введення, композиції можуть застосовуватися в різних дозах. При лікуванні людини, сполуки запропоновані винаходом можуть застосовуватися окремо, але в загальному можуть застосовуватися в суміші з придатним фармацевтичним наповнювачем, розріджувачем або носієм, обраним відповідно до призначеного способу введення та стандартної фармацевтичної практики. Наприклад, сполуки запропоновані винаходом можуть бути застосовані перорально, буккально або сублінгвально у формі таблеток, капсул, овул, еліксирів, розчинів або суспензій, які можуть включати ароматизуючі або забарвлюючі агенти, для застосування зі швидким, уповільненим або контрольованим вивільненням. Сполуки запропоновані винаходом можуть також уводитися за допомогою інтракавернозної ін'єкції. Такі таблетки можуть включати допоміжні речовини, такі як мікрокристалічна целюлоза, лактоза, натрію цитрат, кальцію карбонат, двозаміщений кальцію фосфат та гліцин, дезінтегранти, такі як крохмаль (бажано кукурудзяний, картопляний, або крохмаль тапіоки), натрію крохмаль гліколят, кроскармелоза натрію і деякі комплекси силікатів, а також зв'язуючі агенти для гранулювання, такі як полівінілпіролідон, гідроксипропілметилцелюлоза (ГПМЦ), гідроксипропілцелюлоза (ГПЦ), сахароза, желатин та гуміарабік. Додатково, можуть бути включені любриканти, такі як магнію стеарат, стеаринова кислота, гліцерил-бегенат і тальк. Тверді композиції подібного типу також можуть застосовуватися як наповнювачі в желатинових капсулах. Кращі щодо цього допоміжні речовини включають лактозу, крохмаль, целюлозу, молочний цукор або поліетиленгліколі з високою молекулярною масою. Для водних суспензій або еліксирів сполуки винаходу можуть бути об'єднані з різними підсолоджувачами або ароматизуючими агентами, забарвлюючими агентами або барвниками, з емульгуючими та/або суспендуючими агентами й розріджувачами, такими як вода, етанол, пропіленгліколь та гліцерин, та їхніми комбінаціями. Сполуки запропоновані винаходом також можуть застосовуватися парентерально, наприклад, внутрішньовенно, інтра-артеріально, інтраперитонеально, інтратекально, інтравентрикулярно, інтрастернально, інтракраніально, внутрішньом'язово або підшкірно, або можуть застосовуватися інфузійним способом. Найкращим способом вони застосовуються у формі стерильного водного розчину, який може включати інші речовини, наприклад, достатню кількість солей або глюкози для забезпечення ізотонії розчину із кров'ю. Водні розчини повинні бути забуференими придатним способом (бажано до рН від 3 до 9), якщо це необхідно. Приготування придатних парентеральних композицій у стерильних умовах легко досягається стандартними фармацевтичними методиками, добре відомими фахівцям у даній галузі техніки. Композиції, придатні для парентерального застосування, включають водні та не-водні стерильні розчини для ін'єкцій, які можуть включати антиоксиданти, буфери, бактеріостатики та розчинені речовини, які забезпечують ізотонію композиції із кров'ю реципієнта; і водні та неводні стерильні суспензії, які можуть включати суспендуючі агенти та загущувачі. Композиції можуть бути представлені в ємностях для стандартної дози або більшої кількості доз, наприклад, у запаяних ампулах і флаконах, і можуть зберігатися в ліофілізованому стані, який вимагає тільки додавання стерильного рідкого носія, наприклад, води для ін'єкцій, безпосередньо перед застосуванням. Розчини та суспензії для введення, які готуються безпосередньо перед застосуванням, можуть бути приготовлені зі стерильних порошків, гранул і таблеток раніше описаного типу. Для перорального та парентерального застосування для пацієнтів-людей, рівень добового дозування сполук запропонованих винаходом буде звичайно становити від 1 мг/кг до 30 мг/кг. Так, наприклад, таблетки або капсули із сполуки винаходу можуть включати дозу активної сполуки для прийому окремо або в подвійному й більшому об'ємі за один раз, так, як це необхідно. Лікар у кожному випадку визначає необхідну дозу, найбільш придатну для будь-якого окремого пацієнта, і вона може змінюватися залежно від віку, ваги та реакції конкретного 18 UA 100664 C2 5 10 15 20 25 30 35 40 45 50 пацієнта. Вищевказані дозування наведені для прикладу та ілюструють типовий випадок. Можуть, звичайно, бути окремі випадки, коли будуть потрібні більш високі або низькі діапазони дозування, і такі випадки відносяться до обсягу даного винаходу. Сполуки запропоновані винаходом можуть також застосовуватися інтраназально або за допомогою інгаляції, і зручно випускатися у формі інгалятора із сухим порошком або аерозольного спрея, виготовленого у вигляді ємності під тиском, насоса, спрея або розпилювача із застосуванням придатного пропелента, наприклад, дихлордифторметану, трихлорфторметану, дихлортетрафторетану, гідрофторалкану, такого як 1,1,1,2-тетрафторетан (HFA 134A3 або 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA3), діоксиду вуглецю або іншого придатного газу. У випадку аерозолю під тиском, одиничне дозування може визначатися шляхом забезпечення клапана для доставки певної відміряної кількості. Контейнер під тиском, насос, спрей або розпилювач можуть включати розчин або суспензію активної сполуки, наприклад, із застосуванням суміші етанолу та пропелента як розчинника, яка додатково включає любрикант, наприклад, сорбітан триолеат. Капсули та картриджі (виготовлені, наприклад, з желатину) для застосування в інгаляторі або інсуфляторі можуть бути сформовані таким чином, щоб включати порошкові суміші сполуки винаходу й придатної порошкової основи, такої як лактоза або крохмаль. Композиції у вигляді аерозолю або сухого порошку бажано складаються так, щоб кожна відміряна доза або "сприскування" доставляли належну дозу сполуки винаходу пацієнтові. Важливо розуміти, що в цілому загальна добова доза аерозолю може варіювати від пацієнта до пацієнта, і може застосовуватися у вигляді одиничної дози або, більш звичайно, у вигляді розділених доз протягом дня. Альтернативно, сполуки винаходу можуть застосовуватися у формі суппозиторія або песарія, або можуть застосовуватися місцево у формі лосьону, розчину, крему, мазі або порошку-присипки. сполуки запропоновані винаходом можуть також застосовуватися трансдермально, наприклад, із застосуванням трансдермального пластиру. Вони можуть також застосовуватися окулярно, зокрема для лікування захворювань ока. Для офтальмологічного застосування, сполуки винаходу можуть бути скомпоновані у вигляді мікронізованих суспензій в ізотонічному, з відрегульованим рН, стерильному сольовому розчині, або, бажано, у вигляді розчинів в ізотонічному, з відрегульованим рН, стерильному сольовому розчині, на вибір у комбінації з консервантом, таким як хлорид бензалконію. Альтернативно, вони можуть бути скомпоновані у вигляді мазі, такої як петролатум. Для місцевого шкірного нанесення сполуки винаходу можуть бути скомпоновані у вигляді придатної мазі, яка включає активну сполуку, суспендовану або розчинену, наприклад, у суміші з однією або більше з наступних речовин: мінеральної олії, рідкого петролатума, білого петролатума, пропіленгліколю, поліоксиетилен-поліоксипропіленової сполуки, емульгуючого воску та води. Альтернативно, вони можуть бути скомпоновані у вигляді придатного лосьону або крему, суспендованого або розчиненого, наприклад, у суміші з однією або більше з наступних речовин: мінеральної олії, сорбітан-моностеарату, поліетиленгліколю, рідкого парафіну, полісорбату 60, воску цетилового ефіру, цетеарилового спирту, 2-октилдодеканолу, бензилового спирту та води. Перелік композицій, які є придатними для місцевого застосування в порожнині рота, включає таблетки для розсмоктування, які містять активний інгредієнт на ароматизованій основі, звичайно сахарозу та гуміарабік або трагакант; пастилки, які включають активний інгредієнт на інертній основі, такій як желатин та гліцерин, або сахароза та гуміарабік; і ополіскування для рота, яке містить активний інгредієнт у придатному рідкому носії. У цілому, для людини пероральне або місцеве застосування сполук винаходу є кращим способом, будучи найбільш зручним. За обставин, коли реципієнт страждає розладами ковтання або порушенням абсорбції ліків після перорального застосування, ліки можуть застосовуватися парентерально, наприклад, сублінгвально або букально. Для ветеринарного застосування сполука винаходу застосовується у вигляді придатної композиції відповідно до нормальної ветеринарної практики, і ветеринарний лікар визначає режим дозування та спосіб введення, найбільш придатний для конкретної тварини. 19 UA 100664 C2 20 UA 100664 C2 21 UA 100664 C2 22 UA 100664 C2 23 UA 100664 C2 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 1. Спосіб індукції апоптозу в клітині-мішені, що включає стадії: a) забезпечення однієї або більше клітин-мішеней, які несуть поверхневий клітинний антиген, ICAM-1; b) забезпечення однієї або більше зв'язуючих молекул, які вибірково зв'язуються із клітинним поверхневим ICAM-1 і, при зв'язуванні з ICAM-1, індукують апоптоз у клітині-мішені; с) обробки клітин-мішеней відповідно до пункту (а) зв'язуючими молекулами відповідно до пункту (b), для індукції апоптозу в клітинах-мішенях, де зв'язуюча молекула є антитілом, послідовності якого представлені у SEQ ID NO: 6 та SEQ ID NO: 8 або похідною даного антитіла. 2. Зв'язуюча молекула, яка вибірково зв'язується із клітинним поверхневим ICAM-1 і, при зв'язуванні з ICAM-1, індукує апоптоз у клітині-мішені, де зв'язуюча молекула є антитілом, послідовності якого представлені у SEQ ID NO: 6 та SEQ ID NO: 8 або похідною даного антитіла. 3. Зв'язуюча молекула за п. 2, яка призначена для застосування в способі за п. 1. 4. Зв'язуюча молекула за п. 2, де клітинним поверхневим антигеном є ICAM-1. 5. Зв'язуюча молекула або молекула антитіла за будь-яким з пп. 2-4, яка відрізняється тим, що клітиною-мішенню є імунна клітина або епітеліальна клітина. 6. Зв'язуюча молекула або молекула антитіла за п. 5, яка відрізняється тим, що імунна клітина є В-лімфоцитом. 7. Зв'язуюча молекула або молекула антитіла за будь-яким з пп. 2-6, яка відрізняється тим, що клітина-мішень асоційована із захворюванням. 8. Зв'язуюча молекула або молекула антитіла за п. 7, яка відрізняється тим, що захворювання вибране із групи, яка складається з: онкологічних захворювань; аутоімунних захворювань, включаючи, але не обмежуючись, ревматоїдний артрит і системний червоний вовчак (СЧВ); гострих і хронічних запальних захворювань, сепсису та інфекційних захворювань, включаючи, але не обмежуючись, СНІД. 9. Зв'язуюча молекула або молекула антитіла за п. 8, яка відрізняється тим, що захворювання є онкологічним захворюванням, вибраним з-поміж лімфоми (лейкемії, мієломи), раку шлунка, раку молочної залози, раку печінки, раку легенів, меланоми, раку сечового міхура, хоріокарциноми, раку підшлункової залози, раку товстої кишки та раку простати. 10. Зв'язуюча молекула або молекула антитіла за будь-яким з пп. 2-9, яка відрізняється тим, що молекулою антитіла є IgG. 11. Зв'язуюча молекула або молекула антитіла за п. 10, яка відрізняється тим, що одноланцюгове антитіло вибране із групи IgG1, IgG2, IgG3 або IgG4. 24 UA 100664 C2 5 10 15 20 25 30 12. Зв'язуюча молекула або молекула антитіла за будь-яким з пп. 2-11, яка відрізняється тим, що молекула антитіла є людською або гуманізованою. 13. Нуклеїнова кислота, яка має нуклеотидну послідовність, яка кодує молекулу антитіла за будьяким з пп. 2-12. 14. Нуклеїнова кислота за п. 12, яка відрізняється тим, що має нуклеотидну послідовність, представлену у SEQ ID NO: 5 і SEQ ID NO: 7. 15. Застосування зв'язуючої молекули або молекули антитіла за будь-яким з пп. 2-12 у діагностиці, де діагностика вимагає руйнування клітини-мішені. 16. Застосування зв'язуючої молекули або молекули антитіла за будь-яким з пп. 2-12 у лікуванні та/або профілактиці захворювання, де лікування та/або профілактика вимагають руйнування клітини-мішені. 17. Застосування зв'язуючої молекули або молекули антитіла за будь-яким з пп. 2-12 у виробництві медикаменту для діагностики захворювання, яке відрізняється тим, що діагностика вимагає руйнування клітини-мішені. 18. Застосування зв'язуючої молекули або молекули антитіла за будь-яким з пп. 2-12 у виробництві медикаменту для лікування та/або профілактики захворювання, яке відрізняється тим, що лікування та/або профілактика вимагають руйнування клітини-мішені. 19. Застосування за будь-яким з пп. 15-18, яке відрізняється тим, що захворювання, яке підлягає лікуванню, вибрано із групи, яка складається з: онкологічних захворювань; аутоімунних захворювань, включаючи, але не обмежуючись, ревматоїдний артрит і СЧВ; гострих і хронічних запальних захворювань, сепсису та інфекційних захворювань, включаючи, але не обмежуючись, СНІД. 20. Застосування за п. 19, яке відрізняється тим, що захворювання, яке підлягає лікуванню, є онкологічним захворюванням, вибраним з-поміж лімфоми (лейкемії, мієломи), раку шлунка, раку молочної залози, раку печінки, раку легенів, меланоми, раку сечового міхура, хоріокарциноми, раку підшлункової залози, раку товстої кишки та раку простати. 21. Застосування за будь-яким з пп. 15-20, яке відрізняється тим, що зв'язуюча молекула або молекула антитіла є такою, як визначено в будь-якому з пп. 2-4, а захворювання, яке підлягає лікуванню, є лімфомою, як визначено в п. 20. 22. Фармацевтична композиція, яка включає зв'язуючу молекулу або молекулу антитіла за будьяким з пп. 2-12, та фармацевтично прийнятний носій, наповнювач або розріджувач. 25 UA 100664 C2 26 UA 100664 C2 27 UA 100664 C2 28
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for inducing apoptosis in a target cell
Автори англійськоюFrendeus Bjoern, Carlsson Roland
Назва патенту російськоюСпособ индукции апоптоза в клетке-мишени
Автори російськоюФрендеус Бйорн, Карлсон Роланд
МПК / Мітки
МПК: A61P 35/00, C12N 15/13, A61K 39/395, A61P 37/00, C07K 16/28
Мітки: індукції, спосіб, апоптозу, клітині-мішені
Код посилання
<a href="https://ua.patents.su/42-100664-sposib-indukci-apoptozu-v-klitini-misheni.html" target="_blank" rel="follow" title="База патентів України">Спосіб індукції апоптозу в клітині-мішені</a>
Попередній патент: Пальник газовий інжекційний
Наступний патент: Сенсорний інтерфейс
Випадковий патент: Спосіб профілактики і лікування карієсу твердих тканин зубів у дітей з дитячим церебральним паралічем у санаторно-курортних умовах