Похідні тіазолу та їх застосування
Номер патенту: 92489
Опубліковано: 10.11.2010
Автори: Ковіні Дейвід, Рюкле Томас, Добре Жером, Куаттропані Анна, Помель Венсан
Формула / Реферат
1. Похідне тіазолу формули (І)
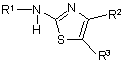 , (І)
, (І)
де:
R1 вибраний з групи, яку складають Н або ацил, факультативно заміщений ацил;
R2 - С1-С6-алкіл, факультативно заміщений С1-С6-алкіл;
R3 вибраний з групи, яку складають тієнільні групи, визначені як Т1 та Т2:
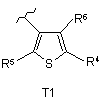 або
або 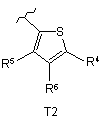 ,
,
де:
R4 вибраний з групи, яку складають
сульфонільна група SO2-R, де R вибраний з групи, яку складають арил, гетероарил, С1-С6-алкіл, С1-С6-алкіл, заміщений галогенами, С2-С6-алкеніл, С2-С6-алкініл, С3-С8-циклоалкіл, гетероциклоалкіл, гетероалкіл; факультативно заміщений арил, гетероарил, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, С3-C8-циклоалкіл, гетероциклоалкіл, гетероалкіл;
аміносульфонільна група SО2-NRR', де кожен з R, R' незалежно від іншого вибраний з групи, яку складають водень, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, С3-С8-циклоалкіл, гетероциклоалкіл, арил, гетероарил, гетероалкіл; факультативно заміщений С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, С3-C8-циклоалкіл, гетероциклоалкіл, арил, гетероарил, гетероалкіл, та де R та R', спільно з атомом азоту, до якого вони приєднані, факультативно утворюють 3-8-членний гетероциклоалкіл;
кожен із R5 та R6 незалежно від іншого вибраний з групи, яку складають Н, С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл; факультативно заміщений С1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл та галоген; та геометричні ізомери, оптично активні форми, наприклад, енантіомери, діастереомери та рацемічні форми, а також фармацевтично прийнятні солі цих сполук.
2. Похідне тіазолу за п. 1, де R1 - ацетил.
3. Похідне тіазолу за пп. 1 або 2, де R2 - метил.
4. Похідне тіазолу за будь-яким із пп. 1-3, де R3 - тієнільна група Т1.
5. Похідне тіазолу за будь-яким із пп. 1-3, де R3 - тієнільна група Т2.
6. Похідне тіазолу за будь-яким із попередніх пунктів, де R4 - сульфонільна група SO2-R.
7. Похідне тіазолу за будь-яким із пп. 1-5, де R4 - аміносульфонільна група SO2-NRR'.
8. Похідне тіазолу за будь-яким із попередніх пунктів, де R5 та R6 - Н.
9. Похідне тіазолу за будь-яким із попередніх пунктів, вибране з групи, яку складають такі сполуки:
N-(4-метил-5-{5-[(проп-2-ін-1-іламіно)сульфоніл]-2-тієніл}-1,3-тіазол-2-іл)ацетамід;
N-(5-{5-[(4-ацетилпіперазин-1-іл)сульфоніл]-2-тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід;
N-{5-[5-({[2-(диметиламіно)етил]аміно}сульфоніл)-2-тієніл]-4-метил-1,3-тіазол-2-іл}ацетамід;
N-[4-метил-5-(5-{[(1-метилпіперидин-4-іл)аміно]сульфоніл}-2-тієніл)-1,3-тіазол-2-іл]ацетамід;
N-[5-(5-{[[2-(диметиламіно)етил](метил)аміно]сульфоніл}-2-тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід;
5-(2-аміно-4-метил-1,3-тіазол-5-іл)-N-(2-морфолін-4-ілетил)тіофен-2-сульфонамід;
метил-5-{[4-метил-5-(5-{[(2-морфолін-4-ілетил)аміно]сульфоніл}-2-тієніл)-1,3-тіазол-2-іл]аміно}-5-оксопентаноат;
N-(4-метил-5-{5-[(4-метилпіперазин-1-іл)сульфоніл]-2-тієніл}-1,3-тіазол-2-іл)ацетамід;
N-[4-метил-5-(5-{[(2-морфолін-4-ілетил)аміно]сульфоніл}-2-тієніл)-1,3-тіазол-2-іл]ацетамід;
N-{5-[5-({[3-(диметиламіно)пропіл]аміно}сульфоніл)-2-тієніл]-4-метил-1,3-тіазол-2-іл}ацетамід;
N-{4-метил-5-[5-(піперазин-1-ілсульфоніл)-2-тієніл]-1,3-тіазол-2-іл}ацетамід;
N2-({5-[2-(aцeтилaмiнo)-4-мeтил-l,3-тiaзoл-5-iл]-2-тiєнiл}cyльфoнiл)-Nl-метилгліцинамід;
N-{5-[5-({[2-(ацетиламіно)етил]аміно}сульфоніл)-2-тієніл]-4-метил-1,3-тіазол-2-іл}ацетамід;
N-{5-[5-({[(2,2-диметил-1,3-діоксолан-4-іл)метил]аміно}сульфоніл)-2-тієніл]-4-метил-1,3-тіазол-2-іл}ацетамід;
метил-N-({5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5-іл]-2тієніл}сульфоніл)серинат;
N-({5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5-іл]-2-тієніл}сульфоніл)серин;
N-[5-(5-{[(2,3-дигідроксипропіл)аміно]сульфоніл}-2-тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід;
N-(5-{5-[(диметиламіно)сульфоніл]-2-тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід;
N-{4-метил-5-[5-({метил[2-(метиламіно)етил]аміно}сульфоніл)-2-тієніл]-1,3-тіазол-2-іл}ацетамід;
N-[5-(5-{[[2-(діетиламіно)етил](метил)аміно]сульфоніл}-2-тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід;
N-[5-(5-{[(2-метоксіетил)(метил)аміно]сульфоніл}-2-тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід;
N-[5-(5-{[[2-(диметиламіно)етил](етил)аміно]сульфоніл}-2-тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід;
N-{5-[5-({[2-(диметиламіно)етил]аміно}сульфоніл)-3-тієніл]-4-метил-1,3-тіазол-2-іл}ацетамід;
N-[4-метил-5-(5-{[(2-морфолін-4-ілетил)аміно]сульфоніл}-3-тієніл)-1,3-тіазол-2-іл]ацетамід;
N-[4-метил-5-(5-{[(2-піперидин-1-ілетил)аміно]сульфоніл}-3-тієніл)-1,3-тіазол-2-іл]ацетамід;
N-{4-метил-5-[5-(піперазин-1-ілсульфоніл)-3-тієніл]-1,3-тіазол-2-іл}ацетамід;
N-{5-[5-({[3-(диметиламіно)пропіл]аміно}сульфоніл)-3-тієніл]-4-метил-1,3-тіазол-2-іл}ацетамід;
N-[4-метил-5-(5-{[(1-метилпіперидин-4-іл)аміно]сульфоніл}-3-тієніл)-1,3-тіазол-2-іл]ацетамід;
N-(4-метил-5-{5-[(4-метилпіперазин-1-іл)сульфоніл]-3-тієніл}-1,3-тіазол-2-іл)ацетамід;
трет-бутил-[1-({4-[2-(ацетиламіно)-4-метил-1,3-тіазол-5-іл]-2-тієніл}сульфоніл)піперидин-4-іл]метилкарбамат;
N-(5-{5-[(3-гідроксипіролідин-1-іл)сульфоніл]-3-тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід;
N-[5-(5-{[(3-гідроксипропіл)аміно]сульфоніл}-3-тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід;
N-[5-(5-{[(цис-4-гідроксициклогексил)аміно]сульфоніл}-3-тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід;
N-(5-{5-[(4-метоксипіперидин-1-іл)сульфоніл]-3-тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід;
N-[4-метил-5-(5-{[4-(метиламіно)піперидин-1-іл]сульфоніл}-3-тієніл)-1,3-тіазол-2-іл]ацетамід;
N-[5-(5-{[[2-(диметиламіно)етил](метил)аміно]сульфоніл}-3-тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід;
N-[5-(5-{[(1S,5S,7S)-7-(гідроксиметил)-6,8-діокса-3-азабіцикло[3.2.1]окт-3-ил]сульфоніл}-3-тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід;
N-[5-(5-{[(2-гідроксіетил)aміно]сульфоніл}-3-тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід;
N-(5-{5-[(4-гідроксипіперидин-1-іл)сульфоніл]-3-тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід;
N-[5-(5-{[(2,3-дигідроксипропіл)аміно]сульфоніл}-3-тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід;
N-(4-метил-5-{5-[(1Н-тетразол-5-іламіно)сульфоніл]-3-тієніл}-1,3-тіазол-2-іл)ацетамід;
N-{4-метил-5-[5-(піролідин-1-ілсульфоніл)-3-тієніл]-1,3-тіазол-2-іл}ацетамід;
4-метил-5-{5-[(4-метилпіперазин-1-іл)сульфоніл]-3-тієніл}-1,3-тіазол-2-амін;
метил-5-[(4-метил-5-{5-[(4-метилпіперазин-1-іл)сульфоніл]-3-тієніл}-1,3-тіазол-2-іл)аміно]-5-оксопентаноат;
1-{[4-(2-аміно-4-метил-1,3-тіазол-5-іл)-2-тієніл]сульфоніл}піперидин-4-ол;
N-{4-метил-5-[5-(морфолін-4-ілсульфоніл)-3-тієніл]-1,3-тіазол-2-іл}ацетамід;
N-(5-{2-хлор-5-[(4-метилпіперазин-1-іл)сульфоніл]-3-тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід;
N-(5-{5-[(3-гідроксипіперидин-1-іл)сульфоніл]-3-тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід;
N-(5-{5-[(аліламіно)сульфоніл]-3-тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід.
10. Похідне тіазолу за будь-яким із пп. 1-9 для застосування як лікарський засіб.
11. Застосування похідного тіазолу за будь-яким із пп. 1-9, а також його ізомерів та сумішей цих сполук для виготовлення лікарського засобу для профілактики та/або лікування аутоімунних захворювань та/або запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, бактеріальних або вірусних інфекцій, алергії, астми, панкреатиту, одночасної недостатності кількох органів, ниркових захворювань, агрегації тромбоцитів, раку, трансплантації, порушення рухливості сперматозоїдів, дефіциту еритроцитів, відторгнення трансплантата або ушкоджень легенів.
12. Застосування за п. 11, причому згадані захворювання вибрані з групи, яку складають розсіяний склероз, псоріаз, ревматоїдний артрит, системний червоний вовчак, запальне захворювання кишечнику, запалення легенів, тромбоз або інфекції/запалення мозку, наприклад, менінгіт або енцефаліт.
13. Застосування за п. 11, причому згадані захворювання вибрані з групи, яку складають захворювання Альцгеймера, захворювання Гантінгтона, травма ЦНС, інсульт або ішемічні стани.
14. Застосування за п. 11, причому згадані захворювання вибрані з групи, яку складають атеросклероз, гіпертрофія серця, дисфункція серцевих міоцитів, підвищений кров'яний тиск та звуження кровоносних судин.
15. Застосування за п. 11, причому згадані захворювання вибрані з групи, яку складають хронічне обструктивне легеневе захворювання, спричинений анафілактичним шоком фіброз, псоріаз, алергічні захворювання, астма, інсульт або ішемічні стани, ішемія-реперфузія, агрегація/активація тромбоцитів, атрофія/гіпертрофія скелетних м'язів, рекрутмент лейкоцитів у ракову тканину, ангіогенез, інвазійні метастази, меланома, саркома Капоші, гострі та хронічні бактеріальні та вірусні інфекції, сепсис, відторгнення трансплантата, гломерулосклероз, гломерулонефрит, прогресуючий нирковий фіброз, ендотеліальні та епітеліальні ураження при запаленнях легенів або загальних дихальних шляхів легенів.
16. Застосування за будь-яким із пп. 11-15, причому лікування полягає у модулюванні, зокрема інгібуванні, активності кінази РІЗ.
17. Застосування за п. 16, причому згадана кіназа РІЗ є кіназою РІЗγ.
18. Фармацевтична композиція, що містить щонайменше одне похідне тіазолу за будь-яким із пп. 1-9 та фармацевтично прийнятний носій, розріджувач або наповнювач.
Текст
1. Похідне тіазолу формули (І) N N R1 R2 H (І) S 3 R , де: R1 вибраний з групи, яку складають Н або ацил, факультативно заміщений ацил; R2 - С1-С6-алкіл, факультативно заміщений С1-С6алкіл; R3 вибраний з групи, яку складають тієнільні групи, визначені як Т1 та Т2: C2 2 (19) 1 3 92489 4 N-{5-[5-({[2-(диметиламіно)етил]аміно}сульфоніл)N-(4-метил-5-{5-[(4-метилпіперазин-12-тієніл]-4-метил-1,3-тіазол-2-іл}ацетамід; іл)сульфоніл]-3-тієніл}-1,3-тіазол-2-іл)ацетамід; N-[4-метил-5-(5-{[(1-метилпіперидин-4трет-бутил-[1-({4-[2-(ацетиламіно)-4-метил-1,3іл)аміно]сульфоніл}-2-тієніл)-1,3-тіазол-2тіазол-5-іл]-2-тієніл}сульфоніл)піперидин-4іл]ацетамід; іл]метилкарбамат; N-[5-(5-{[[2N-(5-{5-[(3-гідроксипіролідин-1-іл)сульфоніл]-3(диметиламіно)етил](метил)аміно]сульфоніл}-2тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід; тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід; N-[5-(5-{[(3-гідроксипропіл)аміно]сульфоніл}-35-(2-аміно-4-метил-1,3-тіазол-5-іл)-N-(2-морфолінтієніл)-4-метил-1,3-тіазол-2-іл]ацетамід; 4-ілетил)тіофен-2-сульфонамід; N-[5-(5-{[(цис-4метил-5-{[4-метил-5-(5-{[(2-морфолін-4гідроксициклогексил)аміно]сульфоніл}-3-тієніл)-4ілетил)аміно]сульфоніл}-2-тієніл)-1,3-тіазол-2метил-1,3-тіазол-2-іл]ацетамід; іл]аміно}-5-оксопентаноат; N-(5-{5-[(4-метоксипіперидин-1-іл)сульфоніл]-3N-(4-метил-5-{5-[(4-метилпіперазин-1тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід; іл)сульфоніл]-2-тієніл}-1,3-тіазол-2-іл)ацетамід; N-[4-метил-5-(5-{[4-(метиламіно)піперидин-1N-[4-метил-5-(5-{[(2-морфолін-4іл]сульфоніл}-3-тієніл)-1,3-тіазол-2-іл]ацетамід; ілетил)аміно]сульфоніл}-2-тієніл)-1,3-тіазол-2N-[5-(5-{[[2іл]ацетамід; (диметиламіно)етил](метил)аміно]сульфоніл}-3N-{5-[5-({[3тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід; (диметиламіно)пропіл]аміно}сульфоніл)-2-тієніл]-4N-[5-(5-{[(1S,5S,7S)-7-(гідроксиметил)-6,8-діокса-3метил-1,3-тіазол-2-іл}ацетамід; азабіцикло[3.2.1]окт-3-ил]сульфоніл}-3-тієніл)-4N-{4-метил-5-[5-(піперазин-1-ілсульфоніл)-2метил-1,3-тіазол-2-іл]ацетамід; тієніл]-1,3-тіазол-2-іл}ацетамід; N-[5-(5-{[(2-гідроксіетил)aміно]сульфоніл}-3-тієніл)N2-({5-[2-(aцeтилaмiнo)-4-мeтил-l,3-тiaзoл-5-iл]-24-метил-1,3-тіазол-2-іл]ацетамід; тiєнiл}cyльфoнiл)-Nl-метилгліцинамід; N-(5-{5-[(4-гідроксипіперидин-1-іл)сульфоніл]-3N-{5-[5-({[2-(ацетиламіно)етил]аміно}сульфоніл)-2тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід; тієніл]-4-метил-1,3-тіазол-2-іл}ацетамід; N-[5-(5-{[(2,3-дигідроксипропіл)аміно]сульфоніл}-3N-{5-[5-({[(2,2-диметил-1,3-діоксолан-4тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід; іл)метил]аміно}сульфоніл)-2-тієніл]-4-метил-1,3N-(4-метил-5-{5-[(1Н-тетразол-5тіазол-2-іл}ацетамід; іламіно)сульфоніл]-3-тієніл}-1,3-тіазол-2метил-N-({5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл)ацетамід; іл]-2тієніл}сульфоніл)серинат; N-{4-метил-5-[5-(піролідин-1-ілсульфоніл)-3-тієніл]N-({5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5-іл]-21,3-тіазол-2-іл}ацетамід; тієніл}сульфоніл)серин; 4-метил-5-{5-[(4-метилпіперазин-1-іл)сульфоніл]-3N-[5-(5-{[(2,3-дигідроксипропіл)аміно]сульфоніл}-2тієніл}-1,3-тіазол-2-амін; тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід; метил-5-[(4-метил-5-{5-[(4-метилпіперазин-1N-(5-{5-[(диметиламіно)сульфоніл]-2-тієніл}-4іл)сульфоніл]-3-тієніл}-1,3-тіазол-2-іл)аміно]-5метил-1,3-тіазол-2-іл)ацетамід; оксопентаноат; N-{4-метил-5-[5-({метил[21-{[4-(2-аміно-4-метил-1,3-тіазол-5-іл)-2(метиламіно)етил]аміно}сульфоніл)-2-тієніл]-1,3тієніл]сульфоніл}піперидин-4-ол; тіазол-2-іл}ацетамід; N-{4-метил-5-[5-(морфолін-4-ілсульфоніл)-3N-[5-(5-{[[2тієніл]-1,3-тіазол-2-іл}ацетамід; (діетиламіно)етил](метил)аміно]сульфоніл}-2N-(5-{2-хлор-5-[(4-метилпіперазин-1-іл)сульфоніл]тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід; 3-тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід; N-[5-(5-{[(2-метоксіетил)(метил)аміно]сульфоніл}N-(5-{5-[(3-гідроксипіперидин-1-іл)сульфоніл]-32-тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід; тієніл}-4-метил-1,3-тіазол-2-іл)ацетамід; N-[5-(5-{[[2N-(5-{5-[(аліламіно)сульфоніл]-3-тієніл}-4-метил(диметиламіно)етил](етил)аміно]сульфоніл}-21,3-тіазол-2-іл)ацетамід. тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід; 10. Похідне тіазолу за будь-яким із пп. 1-9 для заN-{5-[5-({[2-(диметиламіно)етил]аміно}сульфоніл)стосування як лікарський засіб. 3-тієніл]-4-метил-1,3-тіазол-2-іл}ацетамід; 11. Застосування похідного тіазолу за будь-яким із N-[4-метил-5-(5-{[(2-морфолін-4пп. 1-9, а також його ізомерів та сумішей цих споілетил)аміно]сульфоніл}-3-тієніл)-1,3-тіазол-2лук для виготовлення лікарського засобу для проіл]ацетамід; філактики та/або лікування аутоімунних захворюN-[4-метил-5-(5-{[(2-піперидин-1вань та/або запальних захворювань, серцевоілетил)аміно]сульфоніл}-3-тієніл)-1,3-тіазол-2судинних захворювань, нейродегенеративних заіл]ацетамід; хворювань, бактеріальних або вірусних інфекцій, N-{4-метил-5-[5-(піперазин-1-ілсульфоніл)-3алергії, астми, панкреатиту, одночасної недостаттієніл]-1,3-тіазол-2-іл}ацетамід; ності кількох органів, ниркових захворювань, агреN-{5-[5-({[3гації тромбоцитів, раку, трансплантації, порушення (диметиламіно)пропіл]аміно}сульфоніл)-3-тієніл]-4рухливості сперматозоїдів, дефіциту еритроцитів, метил-1,3-тіазол-2-іл}ацетамід; відторгнення трансплантата або ушкоджень легеN-[4-метил-5-(5-{[(1-метилпіперидин-4нів. іл)аміно]сульфоніл}-3-тієніл)-1,3-тіазол-212. Застосування за п. 11, причому згадані захвоіл]ацетамід; рювання вибрані з групи, яку складають розсіяний склероз, псоріаз, ревматоїдний артрит, системний 5 92489 6 червоний вовчак, запальне захворювання кишечтромбоцитів, атрофія/гіпертрофія скелетних м'язів, нику, запалення легенів, тромбоз або інфекрекрутмент лейкоцитів у ракову тканину, ангіогеції/запалення мозку, наприклад, менінгіт або еннез, інвазійні метастази, меланома, саркома Кацефаліт. поші, гострі та хронічні бактеріальні та вірусні ін13. Застосування за п. 11, причому згадані захвофекції, сепсис, відторгнення трансплантата, рювання вибрані з групи, яку складають захворюгломерулосклероз, гломерулонефрит, прогресуювання Альцгеймера, захворювання Гантінгтона, чий нирковий фіброз, ендотеліальні та епітеліальні травма ЦНС, інсульт або ішемічні стани. ураження при запаленнях легенів або загальних 14. Застосування за п. 11, причому згадані захводихальних шляхів легенів. рювання вибрані з групи, яку складають атеро16. Застосування за будь-яким із пп. 11-15, причосклероз, гіпертрофія серця, дисфункція серцевих му лікування полягає у модулюванні, зокрема інгіміоцитів, підвищений кров'яний тиск та звуження буванні, активності кінази РІЗ. кровоносних судин. 17. Застосування за п. 16, причому згадана кіназа 15. Застосування за п. 11, причому згадані захвоРІЗ є кіназою РІЗγ. рювання вибрані з групи, яку складають хронічне 18. Фармацевтична композиція, що містить щообструктивне легеневе захворювання, спричиненайменше одне похідне тіазолу за будь-яким із пп. ний анафілактичним шоком фіброз, псоріаз, алер1-9 та фармацевтично прийнятний носій, розрігічні захворювання, астма, інсульт або ішемічні джувач або наповнювач. стани, ішемія-реперфузія, агрегація/активація Галузь застосування винаходу Цей винахід стосується застосування похідних тіазолу Формули (І) для лікування та/або профілактики аутоімунних захворювань та/або запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, бактеріальних або вірусних інфекцій, алергії, астми, панкреатиту, одночасної недостатності кількох органів, ниркових захворювань, агрегації тромбоцитів, раку, трансплантації, порушення рухливості сперматозоїдів, дефіциту еритроцитів, порушень рухливості сперматозоїдів, відторгнення трансплантата або ушкоджень легенів. Зокрема, цей винахід стосується застосування похідних тіазолу для модулювання, особливо інгібування, активності або функції фосфоінозитид-3-кіназ (PI3K). Передумови створення винаходу Фосфоінозитид-3-кінази (PI3K) відіграють вирішальну сигнальну роль у проліферації клітин, тривалості життя клітин, васкуляризації, транспорті через мембрани, переносі глюкози, розростанні нейритів, забезпеченні гофрування мембран, продукуванні пероксидів, реорганізації актину та хемотаксисі (Кентлі - Cantley, 2000, Science, 296, 1655-1657; Ванхазебрук та ін. - Vanhaesebroeck et al., 2001, Annu. Rev. Biochem., 70, 535-602). Терміном PI3K позначається група ліпідкіназ, яка у ссавців складається з восьми ідентифікованих PI3K, яка поділяється на три підгрупи відповідно до їх будови та специфічності до субстратів. Терміном PI3K позначається група ліпідкіназ, яка у ссавців складається з восьми ідентифікованих PI3K, яка поділяється на три підгрупи відповідно до їх будови та специфічності до субстратів. Клас PI3K групи І складається з двох підгруп класу ІА та класу IB. Клас ІА включає регуляторну одиницю з молекулярною масою 85 кДа (яка відповідає за взаємодію протеїнів із протеїнами шляхом взаємодії домена Src-гомології 2 (SH2) із фосфотирозиновими залишками інших протеїнів) та каталітичну субодиницю з молекулярною масою 110 кДа. У цьому класі існують три каталітичні форми (р100 , p110 та p110 ) та п'ять регуляторних ізоформ (p85 , p85 , p55 , р55 та р50 ). PI3K класу IB стимулюються -субодиницями протеїну G гетеродимерних G-протеїнів. Єдиним ідентифікованим членом класу IB є РІЗK (каталітична субодиниця p110 у комплексі з регуляторним протеїном молекулярної маси 101 кДа, р101). PI3K класу II включають ізоформи , та , які мають молекулярну масу приблизно 170 кДа та характеризуються присутністю С-кінцевого домена С2. Клас III PI3K включає фосфатидинінозитспецифічні 3-кінази. Еволюційно збережені ізоформи р110 та експресуються у різноманітних тканинах, тоді як ізоформи та експресуються більш специфічно у гемопоетичній системі клітин, у клітинах гладких м'язів, міоцитах та клітинах ендотелію (Ванхазебрук та ін. - Vanhaesebroeck et al., 1997, Trends Biochem Sci., 22(7), 267-272). Їхню експресію можна також регулювати шляхом індукції залежно від типу клітин, тканин та подразників, а також від загальної картини захворювання. PI3K є ензимами, які беруть участь у фосфоліпідній сигнальній системі та активуються під впливом різноманітних позаклітинних сигналів, наприклад, факторів росту, мітогенів, інтегринів (міжклітинної взаємодії) гормонів, цитокінів, вірусів та нейротрансмітерів, а також шляхом внутрішньоклітинної перехресної регуляції під впливом інших сигнальних молекул (перехресний обмін сигналами, при якому первинний сигнал може активувати деякі паралельні сигнальні шляхи, які на другій стадії передають сигнали до PI3K за рахунок внутрішньоклітинних сигнальних подій), наприклад, низькомолекулярних гуанозинтрифосфатаз, кіназ або фосфатаз. Фосфатидилінозит (Ptdlns) є основним структурним блоком для міжклітинних інозитліпідів у еукаріотичних клітинах; його молекула складається з D-міо-інозит-1-фосфату (Ins1P), приєднаного через свою фосфатну групу до діацилгліцерину. 7 92489 8 Головна інозитова група Ptdlns містить п'ять вільIn vitro PI3K фосфорилують 3-гідроксил інозиних гідроксилів; виявлено, що у клітинах три з них тового циклу у трьох різних субстратах: фосфатифосфориловані у різних комбінаціях. Ptdlns та його дилінозиті (Ptdlns), фосфатидилінозит-4-фосфаті фосфориловані похідні сполуки мають загальну (РІ(4)Р) та фосфатидилшозит-4,5-дифосфаті назву інозитфосфоліпідів або фосфоінозитидів (РІ(4,5)Р2), утворюючи відповідно три ліпідні про(Pls). У еукаріотичних клітинах виявлено вісім сподукти, а саме фосфатидилінозит-3-монофосфат лук типу PI (Vanhaesebroeck et al., 2001, див. ви(РІ(3)Р), фосфатидилінозит-3,4-дифосфат ще). Усі РІ знаходяться у мембранах і є субстра(РІ(3,4)Р2) та фосфатидилінозит-3,4,5-трифосфат тами для кіназ, фосфатаз та ліпаз. (РІ(3,4,5)Р3 (дивись схему А нижче). Субстратом, якому віддається перевага, для класу І PI3K є РІ(4,5)Р2. PIK класу II віддають сильну перевагу Ptdlns як субстрату перед РІ(4)Р та РІ(4,5)Р2. PI3K класу III можуть використовувати як субстрат in vivo тільки Ptdlns і, ймовірно, відповідають за утворення більшої частини РІ(3)Р у клітинах (Vanhaesebroeck et al., 2001, див. вище). Внутрішньоклітинний фосфоінозитидний шлях передавання сигналу починається зі зв'язування сигнальної молекули (позаклітинного ліганду, подразника, димеризації рецепторів, трансактивації під впливом гетерологічного рецептора (наприклад, рецептора тирозинкінази)) зі з'єднаним з Gпротеїном трансмембранним рецептором, вбудованим у плазмову мембрану, що призводить до активації PI3K. Активовані PI3K перетворюють мембранний фосфоліпід РІ(4,5)Р2 у РІ(3,4,5)Р3, який, у свою чергу, може бути перетворений в іншу 3'фосфориловану форму фосфоінозитидів під впливом 5'-специфічних фосфоінозитидфосфатаз; отже, ензиматична активність PI3K прямим або непрямим шляхом спричиняє утворення двох підтипів 3'-фосфоінозитидів, які діють як вторинні месенджери при внутрішньоклітинному передаванні сигналу (Токер та ін. - Toker et al., 2002, Cell Mol. Life Sci. 59(5) 761-779). У ролі вторинних месенджерів продукти фосфорилування Ptdlns беруть участь у різноманітних шляхах передавання сигналів, в тому числі у таких, що мають істотне значення для проліферації клітин, диференціації клітин, росту клітин, розміру клітин, тривалості життя клітин, апоптозу, адгезії, рухливості клітин, міграції клітин, хемотаксисі, інвазії, цитоскелетного переупорядкування, змін форм клітин, транспорту везикул та метаболізму (Штейн - Stein, 2000, Mol. Med. Today 6(9) 347357). Хемотаксис, тобто спрямований рух клітин у напрямі градієнта концентрації хімічних атрактантів, що звуться також хімокінами, є істотним чинником при багатьох значних захворюваннях, наприклад, при запаленнях та аутоімунних захворюваннях, нейродегенерації, ангіогенезі, інвазії та утворенні метастазів та при загоєнні ран (Уайман та ін. - Wyman et al., 2000, Immunol. Today 21(6) 260-264; Гірш та ін. - Hirsch et al., 2000, Science 287(5455) 1049-1053; Гірш та ін., 2001, 9 92489 10 FASEB J. 15(11) 2019-2021; Жерар та ін. - Gerard et al., 2001, Nat. Immunol. 2(2) 108-115). Таким чином, активація РІ3-кіназ вважається складовим елементом різноманітних клітинних реакцій, в тому числі росту, диференціації та апоптозу клітин (Паркер та ін. - Parker et al., 1995, Current Biology, 5, 577-599; Yao et al., 1995, Science, 267, 2003-05). Недавно при біохімічних дослідженнях було виявлено, що PI3K класу І (наприклад, ізоформа ΡΒΚ класу IB) є кіназами подвійної специфічності, Значення ІС50 для вортманіну стосовно кожної тобто вони виявляють активність як ліпідкінази з РІ3-кіназ класу І лежать у межах від 1 нМ до 10 (фосфорилування фосфоінозитидів), а також як нМ, а значення ІС50 для LY294002 стосовно кожної протеїнкінази, оскільки вони здатні індукувати фоіз цих РІ3-кіназ становлять приблизно 15-20 мкМ сфорилування інших протеїнів як субстратів, в (Фрумен та ін. - Fruman et al., 1998, Ann. Rev. тому числі автофосфорилування як внутрішньоBiochem., 67, 481-507), тоді як щодо СK2-протеїнмолекулярний регуляторний механізм. кінази відповідний показник становить 5-10 мМ; ця Виявлено, що PI3K відіграють певну роль у сполука виявляє також деяку інгібувальну активчисленних аспектах активації лейкоцитів. Показаність щодо фосфоліпаз. но, що активність РІ3-кіназ, пов'язана з р85, фізичВортманін є продуктом метаболізму грибів, но зв'язана з цитоплазмовим доменом CD28, який який незворотно інгібує активність PI3K внаслідок є важливою коактивувальною молекулою для акковалентного зв'язування з каталітичним доменом тивації Т-клітин як реакції на антиген. Ці ефекти цього ензиму. Інгібування активності PI3K вортмапов'язані з підвищенням транскрипції численних ніном виключає подальшу клітинну реакцію на генів, в тому числі інтерлейкіну-2 (IL2), який є важпозаклітинний фактор (Телен та ін. - Thelen et al., ливим фактором росту Т-клітин (Фрейзер та ін. 1994, Proc. Natl. Acad. Sci. USA, 91, 4960-4964). Fraser et al., 1991, Science, 251, 313-316). Мутація Експерименти із застосуванням вортманіну покаCD28, внаслідок якої він може довше взаємодіяти зують, що активність PI3K у клітинах гемопоетичз РІ3-кіназою, призводить до втрати здатності ініної групи, зокрема, у нейтрофілах, моноцитах та ціювати продукування IL2, що вказує на вирішальінших типах лейкоцитів, є елементом багатьох ну роль РІ3-кінази в активації Т-клітин. позбавлених ефекту пам'яті імунних реакцій, поДо клітинних процесів, у яких PI3K відіграють в'язаних із гострим та хронічним запаленням. істотну роль, належать пригнічення апоптозу, реоНа основі досліджень із застосуванням вортрганізація скелета актину, ріст серцевих міоцитів, маніну доведено, що функція РІ3-кіназ потрібна стимуляція глікогенсинтази під впливом інсуліну, також для деяких аспектів лейкоцитної сигнальної опосередкований TNF праймінг нейтрофілів та системи через посередництво рецепторів, сполупродукування пероксидів, а також міграція лейкочених із G-протеїном (Thelen et al., 1994). Крім тоцитів та їх адгезія до клітин ендотелію. го, показано, що вортманін та LY294002 блокують PI3K ідентифіковано як медіатор регуляції акміграцію нейтрофілів та вивільнення пероксидів. тивності JNK, залежної від бета-гамма-G, де бетаОднак, оскільки ці сполуки не розрізняють різні гамма-G є субодиниці гетеротримерних Gізоформи PI3K, залишається неясним, яка саме протеїнів. конкретна ізоформа (або ізоформи) PI3K бере Нещодавно повідомлялося, PI3K передає за(беруть) участь у цих явищах. пальні сигнали через різноманітні рецептори, споДеякі результати вказують, що інгібітори PI3K, лучені з G(i) (Лафарг та ін. - Laffargue et al., 2002, наприклад, LY294002, здатні підвищувати протиImmunity 16(3) 441-451), і його імунологічна функпухлинну активність деяких цитотоксичних агентів ція, основна щодо тканинних базофільних грану(наприклад, паклітакселю) in vivo (Грант - Grant, лоцитів та подразників у контексті лейкоцитів, охо2003, Current Drugs, 6(10), 946-948). плює, наприклад, цитокіни, хімоміни, аденозини, Нещодавно було розроблено похідні тіазолу, антитіла, штегрини, фактори агрегації, фактори придатні як інгібітори PI3K (WO 2005/021519; WO росту, віруси або гормони (Лоулор та ін. - Lawlor et 04/078754 та WO 04096797). al., 2001, J. Cell Sci., 114 (Pt 16) 2903-1). WO 2005/021519 розкриває похідні тіазолу таСпецифічні інгібітори окремих ензимів або груп кої структури: ензимів є цінними засобами для розшифрування функцій кожного ензиму. Як інгібітори РІ3-кіназ широко застосовуються дві сполуки - LY294002 та вортманін (дивись нижче). Ці сполуки є неспецифічними інгібіторами PI3K, оскільки вони не розрізняють чотири члени класу І РІ3-кіназ. WO 04/078754 розкриває похідні тіазолу такої структури: 11 92489 12 статність кількох органів, ниркові захворювання, агрегація тромбоцитів, рак, трансплантація, порушення рухливості сперматозоїдів, дефіцит еритроцитів, відторгнення трансплантата, ураження легенів, респіраторні захворювання та ішемічні стани. За іншим варіантом здійснення винаходу запропоновано спосіб лікування та/або профілактики WO 04096797 розкриває похідні тіазолу такої захворювань, вибраних із групи, яку складають структури: аутоімунні, запальні захворювання, серцевосудинні захворювання, нейродегенеративні захворювання, бактеріальні або вірусні інфекції, алергія, астма, панкреатит, одночасна недостатність кількох органів, ниркові захворювання, агрегація тромбоцитів, рак, трансплантація, порушення рухливості сперматозоїдів, дефіцит еритроцитів, відторгнення трансплантата, ураження легенів, респіраторні захворювання та ішемічні стани. За одним із варіантів здійснення, цей винахід Високий ступінь участі шляху PI3K у деяких пропонує похідні тіазолу Формули (І): поширених захворюваннях підкреслює необхідність розроблення інгібіторів PIK, в тому числі селективних інгібіторів PIK. Суть винаходу За одним із варіантів здійснення винаходу запропоновано речовини, корисні для лікування та/або профілактики розладів, пов'язаних із фосфоінозитид-3-кіназами, PI3K. За іншим варіантом здійснення винаходу запропоновано речовини, корисні для лікування де R1, R2 та R3 відповідають визначенням, ната/або профілактики аутоімунних та/або запальних веденим у описі. захворювань. За іншим варіантом здійснення, цей винахід За іншим варіантом здійснення винаходу засполуку, що відповідає Формулі (І), для застосупропоновано речовини, корисні для лікування вання як лікарський засіб. та/або профілактики серцево-судинних захворюЗа іншим варіантом здійснення, цей винахід вань. пропонує застосування сполуки, що відповідає За іншим варіантом здійснення винаходу заФормулі (І), для виготовлення фармацевтичної пропоновано речовини, корисні для лікування композиції для лікування захворювання, вибраного та/або профілактики нейродегенеративних захвоіз групи, яку складають аутоімунні, запальні захворювань. рювання, серцево-судинні захворювання, нейроЗа іншим варіантом здійснення винаходу задегенеративні захворювання, бактеріальні або пропоновано речовини, корисні для лікування вірусні інфекції, алергія, астма, панкреатит, однота/або профілактики захворювань, вибраних із часна недостатність кількох органів, ниркові загрупи, яку складають бактеріальні або вірусні інхворювання, агрегація тромбоцитів, рак, транспфекції, алергія, астма, панкреатит, одночасна нелантація, порушення рухливості сперматозоїдів, достатність кількох органів, ниркові захворювання, дефіцит еритроцитів, відторгнення трансплантата, агрегація тромбоцитів, рак, трансплантація, поруураження легенів, респіраторні захворювання та шення рухливості сперматозоїдів, дефіцит еритішемічні стани та інші захворювання та розлади, роцитів, відторгнення трансплантата, ураження пов'язані із фосфоінозитид-3-кіназою, PI3K, в тому легенів, респіраторні захворювання та ішемічні числі PI3K та . стани. За іншим варіантом здійснення, цей винахід За іншим варіантом здійснення винаходу, запропонує фармацевтичну композицію, що містить пропоновано хімічні сполуки, здатні модулювати, щонайменше одну сполуку, що відповідає Формулі зокрема, інгібувати активність або функції фосфоі(І), та фармацевтично прийнятний носій розріджунозитид-3-кіназ, PI3K при хворобливих станах у вач або наповнювач. ссавців, особливо у людей. За варіантом здійсЗа іншим варіантом здійснення, цей винахід нення, якому віддається перевага, фермент PI3K є пропонує спосіб лікування пацієнта, що страждає РІ3-кіназою . на захворювання, вибране з групи, яку складають За іншим варіантом здійснення винаходу зааутоімунні, запальні захворювання, серцевопропоновано нові види фармацевтичних композисудинні захворювання, нейродегенеративні захвоцій для лікування та/або профілактики захворюрювання, бактеріальні або вірусні інфекції, алергія, вань, опосередкованих PI3K, вибраних із групи, астма, панкреатит, одночасна недостатність кільяку складають аутоімунні, запальні захворювання, кох органів, ниркові захворювання, агрегація тросерцево-судинні захворювання, нейродегенератимбоцитів, рак, трансплантація, порушення рухливні захворювання, бактеріальні або вірусні інфеквості сперматозоїдів, дефіцит еритроцитів, ції, алергія, астма, панкреатит, одночасна недовідторгнення трансплантата, ураження легенів, 13 92489 14 респіраторні захворювання та ішемічні стани та етеніл (-СН=СН2), н-2-пропеніл (аліл, -СН2СН=СН2) інші захворювання та розлади, пов'язані із фосфотощо. інозитид-3-кіназами, PI3K. Цей спосіб включає Термін "С2-С6-алкініл" означає алкінільні групи, введення сполуки, що відповідає Формулі (І). які відповідно до варіанта, якому віддається переЗа іншим варіантом здійснення, цей винахід вага, містять від 2 вуглецевих атомів до 6 вуглепропонує спосіб синтезу сполуки, що відповідає цевих атомів та мають щонайменше 1-2 алкінільні Формулі (І). ненасичені зв'язки; до алкінільних груп, яким відКороткий опис рисунків дається перевага, належать етиніл (-С СН), проФіг. 1: Κ/ΒΧΝ модель артриту, індукованого паргіл (-СН2С СН) тощо. перенесенням сироватки, після лікування сполуТермін "С3-С8-циклоалкіл" означає насичену кою 39. карбоциклічну групу з 3-8 вуглецевих атомів, що Фіг. 2: Колаген-індукований артрит (миша) пісмістить один цикл (наприклад, циклогексил) або ля лікування сполукою 39. Показано варіацію клікілька конденсованих циклів (наприклад, норборнічних оцінок. ніл). Термін "С3-С8-циклоалкіл" охоплює циклопенДетальний опис винаходу тил, циклогексил, норборніл тощо. У нижченаведених абзацах подано визначенТермін "гетероциклоалкіл" означає С3-С8ня різноманітних хімічних груп, що утворюють споциклоалкільну групу відповідно до наведеного вилуки за цим винаходом, призначені для вживання ще означення, в якій до 3 вуглецевих атомів заміу всьому тексті опису та формулі винаходу, якщо нені гетероатомами, вибраними з групи, яку склаінше подане в явній формі визначення не є більш дають О, S, N, NR, де R визначено як водень або широким. метил. Термін "гетероциклоалкіл" охоплює піроліТермін "C1-С6-алкіл" означає одновалентні алдин, піперидин, піперазин, морфолін, тетрагідрокільні групи, що містять від 1 атому до 6 атомів фуран, 6,8-діокса-3-азабіцикло[3.2.1]октан тощо. вуглецю. Цей термін охоплює такі групи, як метил, Термін "ацил" означає групу -C(O)R, де R охоетил, н-пропіл, ізопропіл, н-бутил, ізобутил, третплює Н, "C1-С6-алкіл", за варіантом, якому віддабутил, н-гексил тощо. За аналогією, термін "С1-С12ється перевага, "C1-С6-алкіл", "С2-С6-алкеніл", "С2алкіл" означає одновалентні алкільні групи, що С6-алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл". містять від 1 атому до 12 атомів вуглецю, в тому Термін "алкокси(група)" означає групу -O-R, де числі групи "C1-С6-алкіл" та гептил, октил, ноніл, R означає "C1-С6-алкіл" або "арил" або "гетероадеканоїл, ундеканоїл та додеканоїл. рил". До алкоксигруп, яким віддається перевага, Термін "гетероалкіл" означає С1-С12-алкіл, за належать, наприклад, метокси-, етокси-, феноксиваріантом, якому віддається перевага, C1-С6-алкіл, група тощо. де щонайменше один вуглецевий атом замінений Термін "алкоксикарбоніл" означає групу гетероатомом, вибраним з-посеред О, N або S, в C(O)OR, де R означає Н, "C1-С6-алкіл", або "арил", тому числі 2-метоксіетил. або "гетероарил", або "гетероалкіл". Термін "арил" означає ненасичену ароматичну Термін "амінокарбоніл" означає групу карбоциклічну групу з 6-14 вуглецевих атомів, що C(O)NRR', де кожен із R, R' означає незалежно від містить один цикл (наприклад, феніл) або декілька іншого водень, або C1-С6-алкіл або арил або гетеконденсованих циклів (наприклад, нафтил). Термін роарил. арил охоплює феніл, нафтил, фенантреніл тощо. Термін "карбамат" означає групу -NRC(O)OR', Термін "гетероарил" означає моноциклічну геде кожен із R, R' незалежно від іншого є водень, тероароматичну або біциклічну чи трициклічну "C1-С6-алкіл", "С2-С6-алкеніл", "С2-С6-алкініл", "С3конденсовану гетероароматичну групу. До конкреС8-циклоалкіл", "гетероциклоалкіл", "арил", "гететних прикладів гетероароматичних груп належать роарил". факультативно заміщені піридил, піроліл, піриміТермін "аміно(група)" означає групу -NRR', де диніл, фурил, тієніл, імідазоліл, охазоліл, ізохазокожен із R,R' незалежно від іншого є водень, або ліл, тіазоліл, ізотіазоліл, піразоліл, 1,2,3-триазоліл, "C1-С6-алкіл", або "арил", або "гетероарил", або 1,2,4-триазоліл, 1,2,3-оксадіазоліл, 1,2,4"циклоалкіл", або "гетероциклоалкіл", та де R та R', оксадіазоліл, 1,2,5-оксадіазоліл, 1,3,4спільно з атомом азоту, до якого вони приєднані, оксадіазоліл, 1,3,4-триазиніл, 1,2,3-триазиніл, бенможуть факультативно утворювати 3-8-членну зофурил, [2,3-дигідро]бензофурил, ізобензофурил, гетероциклоалкільну групу. бензотієніл, бензотриазоліл, ізобензотієніл, індоТермін "амоній" означає позитивно заряджену ліл, ізоіндоліл, 3H-індоліл, бензимідазоліл, імідагрупу -N+RR'R", де. кожен із R, R', R" незалежно від зо[1,2-а]піридил, бензотіазоліл, бензоксазоліл, інших є "C1-С6-алкіл" або "циклоалкіл", або "гетехінолізиніл, хіназолініл, фталазиніл, хіноксалініл, роциклоалкіл", та де R та R', спільно з атомом азоцинолініл, нафтиридиніл, піридо[3,4-b]піридил, ту, до якого вони приєднані, можуть факультативпіридо[3,2-b]піридил, піридо[4,3-b]піридил, хіноліл, но утворювати 3-8-членну гетероциклоалкільну ізохіноліл, тетразоліл, 5,6,7,8-тетрагідрохіноліл, групу. 5,6,7,8-тетрагідроізохіноліл, пуриніл, птеридиніл, "Галоген" означає атоми фтору, хлору, брому карбазоліл, ксантеніл або бензохіноліл. та йоду. Термін "С2-С6-алкеніл" означає алкенільні груТермін "сульфоніл" означає групу "-SO2-R", де пи, які відповідно до варіанта, якому віддається R вибраний з групи, яку складають "арил", "гетеперевага, містять від 2 вуглецевих атомів до 6 роарил", "C1-С6-алкіл", "C1-С6-алкіл", заміщений вуглецевих атомів та включають щонайменше 1 галогенами, наприклад, група -SO2-CF3, "С2-С6або 2 алкенільні ненасичені зв'язки. До алкенільалкеніл", "С2-С6-алкініл", "С3-С8-циклоалкіл", "гетених груп, яким віддається перевага, належать . роциклоалкіл", "гетероалкіл". 15 92489 16 Термін "сульфініл" означає групу "-S(O)-R", де лат, фумарат, цитрат, тартрат, аскорбат, цинамоR вибраний з групи, яку складають Н, "C1-С6ат, манделоат та дифенілацетат). алкіл", "C1-С6-алкіл", заміщений галогенами, наВислів "фармацевтично активне похідне" приклад, група -SO-CF3, "С2-С6-алкеніл", "С2-С6означає будь-яку сполуку, яка при введенні в оралкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", ганізм реципієнта здатна прямо або непрямо ви"арил", "гетероарил". являти активність, розкриту у цьому описі. Термін Термін "сульфаніл" означає групи -S-R, де R "непрямо" також охоплює проліки, які можуть пеозначає Н, "C1-С6-алкіл", "C1-С6-алкіл", заміщений ретворюватися в активну форму лікарського засогалогенами, наприклад, група -SO-CF3, "С2-С6бу під впливом ендогенних ферментів або метаалкеніл", "С2-С6-алкініл", "С3-С8-циклоалкіл", "гетеболізму. роциклоалкіл", "арил", "гетероарил". До сульфаніНа цей час виявлено, що сполуки відповідно льних груп, яким віддається перевага, належать до даного винаходу є модуляторами фосфоінозиметилсульфаніл, етилсульфаніл тощо. тид-3-кіназ (PI3K), в тому числі PI3K та . Коли Термін "сульфоніламіно(група)" означає групу фермент фосфоінозитид-3-кіназа (PI3K) інгібова-NRSO2-R', де кожен із R, R' означає незалежно від ний сполукою за цим винаходом, PI3K нездатна іншого водень, "C1-С6-алкіл", "С2-С6-алкеніл", "С2виявляти свої ферментні, біологічні та/або фармаС6-алкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", кологічні ефекти. "арил", "гетероарил". Сполуки Формули (І) за цим винаходом, таким Термін "аміносульфоніл" означає групу -SO2чином, є корисними при лікуванні та профілактиці NRR', де кожен із R, R' означає незалежно від інаутоімунних захворювань та/або запальних захвошого водень, "C1-С6-алкіл", "С2-С6-алкеніл", "С2-С6рювань, серцево-судинних захворювань, нейродеалкініл", "С3-С8-циклоалкіл", "гетероциклоалкіл", генеративних захворювань, бактеріальних або "арил", "гетероарил", "гетероалкіл" та де R та R', вірусних інфекцій, алергії, астми, панкреатиту, спільно з атомом азоту, до якого вони приєднані, одночасної недостатності кількох органів, ниркоможуть факультативно утворювати 3-8-членну вих захворювань, агрегації тромбоцитів, раку, трагетероциклоалкільну групу. нсплантації, порушення рухливості сперматозоїдів, Термін "заміщені" означає групи, заміщені 1-5 дефіциту еритроцитів, відторгнення трансплантата замісниками, вибраними з групи, яку складають або ушкоджень легенів. "C1-С6-алкіл", "С2-С6-алкеніл", "С2-С6-алкініл", "С3С8-циклоалкіл", "гетероциклоалкіл", "арил", "гетеФормула (І) відповідно до даного винаходу тароарил", "галоген", "аміногрупа", "аміносульфоніл", кож охоплює відповідні таутомери, геометричні "амоній", "амінокарбоніл", "сульфініл", "сульфаніл", ізомери, оптично активні форми, наприклад, енан"сульфоніл", гідрокси-, "алкоксигрупа", "алкоксикатіомери, діастереомери та рацемічні форми, а тарбоніл", "карбамат", тригалогенметил, ціано-, меркож фармацевтично прийнятні солі відповідних капто-, нітрогрупа тощо. сполук. До фармацевтично прийнятних солей ФоВислів "фармацевтично прийнятні солі або рмули (І), яким віддається перевага, належать солі комплекси" означає солі або комплекси нижчезакислот, утворені з фармацевтично прийнятними значених сполук Формули (І), які зберігають бажакислотами, наприклад, гідрохлориди, гідроброміну біологічну активність. До необмежувальних ди, сульфати або бісульфати, фосфати або гідроприкладів таких солей належать солі кислот, утвофосфати, ацетати, бензоати, сукцинати, фумарарені з неорганічними кислотами (наприклад, хлоти, малеати, лактати, цитрати, тартрати, ристоводневою кислотою, бромистоводневою кисглюконати, метансульфонати, бензолсульфонати лотою, сірчаною кислотою, фосфорною кислотою, та пара-толуолсульфонати. азотною кислотою тощо), та солі, утворені з оргаСполуки, що відповідають Формулі (І), є кориснічними кислотами, наприклад, оцтовою кислотою, ними для модулювання, особливо інгібування, щавлевою кислотою, винною кислотою, бурштиактивності фосфоінозитид-3-кіназ (PI3K). Сполуки новою кислотою, яблучною кислотою, фумаровою за цим винаходом за Формулою (І) також особливо кислотою, малеїновою кислотою, аскорбіновою корисні для лікування та/або попередження захвокислотою, бензойною кислотою, дубильною кислорювань, опосередкованих PI3K, особливо PI3K тою, памоєвою кислотою, альгіновою кислотою, та/або PI3K . Згадане лікування включаємодулюполіглутаміновою кислотою, нафталінсульфоновання - особливо інгібування або регулювання за вою кислотою, нафталін-дисульфоновою кислотипом зворотного негативного зв'язку - фосфатоітою та полігалактуроновою кислотою. Згадані спонозитид-3-кіназ. луки можуть також бути застосовані у формі Сполуки, що відповідають Формулі (І), придатфармацевтично прийнятних четвертинних солей, ні для застосування як лікарські засоби. відомих фахівцям у цій галузі, до яких конкретно За одним із варіантів здійснення, цей винахід належать четвертинні солі амонію формули пропонує похідні тіазолу Формули (І): NR,R',R"+ Ζ", де R, R', R" незалежно один від одного є водень, алкіл, або бензил, C1-С6-алкіл, С2-С6алкеніл, С2-С6-алкініл, C1-С6-алкіларил, C1-С6алкілгетероарил, циклоалкіл, гетероциклоалкіл, a Z - протиіон, в тому числі хлорид, бромід, йодид, О-алкіл, толуолсульфонат, метилсульфонат, сульфонат, фосфат або карбоксилат (наприклад, бензоат, сукцинат, ацетат, гліколят, малеат, ма 17 92489 18 де R1 вибраний з групи, яку складають Η або (диметиламіноетил)етиламіносульфоніл, 2ацил; факультативно заміщений ацил; (діетиламіноетил)метиламіносульфоніл, 2R2 - C1-С6-алкіл; факультативно заміщений C1(метоксіетил)метиламіносульфоніл, 3С6-алкіл; (диметиламіно)пропіламіносульфоніл, 2,3R3 вибраний з групи, яку складають тієнільні дигідроксипропіламіносульфоніл, 3групи, визначені як Т1 та Т2: гідроксипропіламіносульфоніл), С2-С6-алкеніл, С2С6-алкініл, С3-С8-циклоалкіл, гетероциклоалкіл (наприклад, 2-морфолін-4-іл-етиламіно-сульфоніл, 2-піперидин-1-іл-етиламіносульфоніл, 1метилпіперидин-4-іл-аміносульфоніл, 4гідроксициклогексиламіносульфоніл), арил, гетероарил (наприклад, 1Н-тетразол-5іламіносульфоніл), гетероалкіл, та де R та R', спільно з атомом азоту, до якого вони приєднані, факультативно утворюють 3-8-членний гетероциклоалкіл; кожен із R5 та R6 незалежно від іншого вибраний з групи, яку складають Н, C1-С6-алкіл, С2-С6де: алкеніл, С2-С6-алкініл; факультативно заміщений R4 вибраний з групи, яку складають C1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл та галосульфонільна група SO2-R, де R вибраний з ген; групи, яку складають арил, гетероарил, C1-С6а також геометричні ізомери, оптично активні алкіл (наприклад, метилсульфоніл), C1-С6-алкіл, форми, наприклад, енантіомери, діастереомери та заміщений галогенами, С2-С6-алкеніл, С2-С6рацемічні форми, а також фармацевтично прийняалкініл, С3-С8-циклоалкіл, гетероциклоалкіл, гететні солі відповідних сполук. роалкіл; факультативно заміщений арил, гетероаЗа конкретним варіантом здійснення, цей вирил, C1-С6-алкіл, С2-С6-алкеніл, С2-С6-алкініл, С3нахід пропонує похідні тіазолу Формули (І), де R1 С8-циклоалкіл, гетероциклоалкіл, наприклад, піпеацетил. ридин (наприклад, 3-гідроксипіперидин-1За іншим конкретним варіантом здійснення, ілсульфоніл, 4-гідроксипіперидин-1-ілсульфоніл, 4цей винахід пропонує похідні тіазолу Формули (І), метоксипіперидин-1-іл сульфоніл, 4де R2 - метил. метиламінопіперидин-1-ілсульфоніл, піперидин-4За іншим конкретним варіантом здійснення, (трет-бутилметилкарбамат)-ілсульфоніл), морфоцей винахід пропонує похідні тіазолу Формули (І), лін (наприклад, морфолін-4-ілсульфоніл), піпераде R3 - тієніл ТІ. зин (наприклад, піперазин-1-ілсульфоніл, 4За іншим конкретним варіантом здійснення, ацетилпіперазин-1 -ілсульфоніл, 4цей винахід пропонує похідні тіазолу Формули (І), метилпіперазин-1-ілсульфоніл), піролідин (наприде R3 - тієніл Т2. клад, 3-піролідин-1-ілсульфоніл, 3За іншим конкретним варіантом здійснення, гідроксипіролідин-1-ілсульфоніл), 6,8-діокса-3цей винахід пропонує похідні тіазолу Формули (І), азабідикло[3.2.1]окт-3-іл (наприклад, 7де R4 - сульфонільна група SO2-R. (гідроксиметил)-6,8-діокса-3-азабіцикло[3.2.1]октЗа іншим конкретним варіантом здійснення, 3-іл ) та 8-(1,4-діокса-8-азаспіро[4.5]декан), гетецей винахід пропонує похідні тіазолу Формули (І), роалкіл; де R4 - аміносульфонільна група SO2-NRR'. аміносульфонільна група SO2-NRR', де кожен За іншим конкретним варіантом здійснення, з R, R' незалежно від іншого вибраний з групи, яку цей винахід пропонує похідні тіазолу Формули (І), складають водень, C1-С6-алкіл, С2-С6-алкеніл (наде R5 та R6 - Н. приклад, аліламіносульфоніл), С2-С6-алкініл (наЗа іншим варіантом здійснення, якому віддаприклад, проп-2-ін-1-іламіносульфоніл), С3-С8ється перевага, сполуки, що відповідають Формулі циклоалкіл, гетероциклоалкіл, арил, гетероарил, (І) за даним винаходом, мають ІС50, визначений гетероалкіл; факультативно заміщений C1-С6-алкіл шляхом випробування ліпідкінази PI3K, що дорів(наприклад, диметиламіносульфоніл, (2нює або нижче ніж 0,5 мкМ, за варіантом, якому гідроксіетил)аміносульфоніл, 2-(метиламіно)віддається перевага, 0,05 мкМ. етиламіносульфоніл, 2До сполук Формули (І) за даним винаходом (диметиламіно)етиламіносульфоніл, 2належить, зокрема, будь-яка зі сполук, наведених гідроксіетил-аміносульфоніл, 2у Таблиці І: (ацетиламіно)етиламіносульфоніл, 2(диметиламіноетил)-метиламіносульфоніл, 2 19 92489 20 21 92489 22 23 Сполуки, що відповідають Формулі (І), та будь-яка зі сполук 1-49 Таблиці І за цим винаходом корисні як лікарські засоби. Вони можуть бути застосовані для виготовлення лікарського за 92489 24 собу для профілактики та/або лікування аутоімунних захворювань та/або запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, бактеріальних або 25 92489 26 вірусних інфекцій, ниркових захворювань, агрегацитів, наприклад, анемії, в тому числі гемолітичції тромбоцитів, раку, трансплантації, дефіциту ної анемії, апластичної анемії та справжньої ериеритроцитів, відторгнення трансплантата або троцитарної анемії. ушкоджень легенів. Відповідно до ще одного варіанта здійснення, Відповідно до одного з варіантів здійснення, сполуки Формули (І) корисні для лікування та/або сполуки Формули (І) корисні для лікування та/або профілактики хронічного обструктивного легенепрофілактики аутоімунних захворювань або завого захворювання, спричиненого анафілактичпальних захворювань, наприклад, розсіяного ним шоком фіброзу, псоріазу, алергічних захвосклерозу, псоріазу, ревматоїдного артриту, сисрювань, астми, інсульту або ішемічних станів, темного червоного вовчака, запального захворюішемїї-реперфузії, агрегації/активації тромбоцивання кишечнику, запалення легенів, тромбозу тів, атрофії/гіпертрофії скелетних м'язів, відновабо інфекції/запалення мозку, наприклад, менінгілення лейкоцитів у раковій тканині, ангіогенезу, ту або енцефаліту. інвазійних метастазів, зокрема, меланоми, сарВідповідно до іншого варіанта здійснення, коми Калоші, гострих та хронічних бактеріальних сполуки Формули (І) корисні для лікування та/або та вірусних інфекцій, сепсису, трансплантації, профілактики нейродегенеративних захворювідторгнення трансплантата, гломерулосклерозу, вань, в тому числі захворювання Альцгеймера, гломерулонефриту, прогресуючого ниркового захворювання Гантінгтона, травми ЦНС, інсульту фіброзу, ендотеліальних та епітеліальних ураабо ішемічних станів. жень при запаленнях легенів або загальних диВідповідно до ще одного додаткового варіанхальних шляхів легенів. та здійснення, сполуки Формули (І) корисні для Відповідно до іншого варіанта здійснення вилікування та/або профілактики серцево-судинних находу запропоновано спосіб виготовлення похізахворювань, наприклад, атеросклерозу, гіпертдних тіазолу за Формулою (І), який включає старофії серця, дисфункції серцевих міоцитів, піддію проведення реакції сполуки Формули (Р1) з вищеного кров'яного тиску або звуження кровопохідним Формули (Р2) у присутності комплексів носних судин. паладію, наприклад, Рd(РРh3)4, (хлориду [1,1'Відповідно до ще одного додаткового варіанбіс(дифенілфосфіно)ферроцен]паладію(ІІ)) та здійснення, сполуки Формули (І) корисні для (Pd(dppf) CI2), РdСl2(РРh3)2, Pd(OAc)2 та основи: лікування та/або профілактики дефіциту еритро де X може бути Br або І, R7 може бути Н, для похідних борної кислоти, або будь-якою C1-С6алкільною або заміщеною C1-С6-алкільною групами для похідних складного ефіру борної кислоти, та де група -B(OR7)2 може факультативно утворювати гетероцикл, наприклад, пінаконовий складний ефір борної кислоти. Відповідно до іншого варіанта здійснення винаходу запропоновано спосіб виготовлення похідних тіазолу за Формулою (І), який включає стадію проведення реакції сполуки Формули (Р1) з похідним олова Формули (Р3) у присутності комплексів паладію, наприклад, Рd(РРh3)4, (хлориду [1,1'-біс(дифенілфосфіно)ферроцен]паладію(ІІ)) (Pd(dppf)Cl2), PdCl2(PPh3)2, Pd(OAc)2: де X може бути Br або І та R8 - метил або нбутил. Похідні тіазолу за Формулою (І), приклади яких наведено у цьому винаході, можуть бути одержані з легкодоступних вихідних матеріалів із застосуванням описаних нижче загальних способів та методик. Мається на увазі, що у випадках, коли вказано типові експериментальні умови або умови, яким віддається перевага (тобто температура проведення реакції, її тривалість, молярні кількості реагентів, розчинники тощо), можна застосовувати також інші експериментальні умови, якщо не вказано інакше. Оптимальні умови проведення реакцій можуть варіювати залежно від застосовуваних конкретних реагентів або розчинників, але такі умови фахівець у галузі може визначити шляхом проведення звичайних процедур оптимізації. У разі застосування як фармацевтичні препарати, сполуки, що відповідають Формулі (І), як правило, використовують у формі фармацевтичних композицій. Отже, фармацевтичні композиції, що містять сполуку Формули (І) та фармацевтично прийнятні носій, розчинник або наповнювач, 27 92489 28 також охоплюються цим винаходом. Фахівцю у Рідкі форми, придатні для перорального ввегалузі відома безліч таких носіїв, розріджувачів та дення, можуть містити придатні водні або неводні наповнювачів, придатних для виготовлення фарнаповнювачі з буферами, суспензаторами та димацевтичної композиції. спергаторами, барвниками, ароматизаторами Сполукам за Формулою (І), спільно з прийнятощо. Тверді форми можуть містити, наприклад, тними допоміжними речовинами, носіями, розрібудь-який з перелічених нижче інгредієнтів або джувачами або наповнювачами може бути надасполук подібної природи: в'яжучі, наприклад, мікна форма фармацевтичних композицій та рокристалічну целюлозу, трагакантову камедь дозованих лікарських форм, які можуть бути як у або желатин; наповнювач, наприклад, крохмаль твердій формі, наприклад, таблетки або заповнеабо лактозу, розпушувальну речовину, наприні капсули, так і у рідкій формі, наприклад, розчиклад, альгінову кислоту, примогель або кукуруни, суспензії, емульсії, еліксири, або капсули, дзяний крохмаль; змащувальну речовину, стеазаповнені такими рідинами, усі для перорального рат магнію; ковзну речовину, наприклад, застосування, або у формі стерильного розчину колоїдний діоксид кремнію; підсолоджувач, надля ін'єкцій для парентерального (в тому числі приклад, сахарозу або сахарин; або ароматизапідшкірного застосування). Такі фармацевтичні тор, наприклад, перцеву м'яту, метилсаліцилат, композиції та одиничні дозовані лікарські форми або апельсиновий ароматизатор. можуть містити інгредієнти у звичайних пропорціПридатні для ін'єкцій композиції, як правило, ях, з додатковими активними сполуками або діюмають за основу придатний для ін'єкцій стерильчими речовинами чи без них, та такі одиничні ний сольовий розчин або сольовий розчин із фодозовані лікарські форми можуть містити будьсфатним буфером, або інші придатні для ін'єкцій яку придатну ефективну кількість активного інгносії, відомі в галузі. Як зазначалось вище, похідредієнта, що відповідає діапазону призначених ні тіазолу Формули (І) у таких композиціях як прадобових доз. вило, є неосновним компонентом, вміст якого Фармацевтичні композиції, що містять похідні часто лежить в діапазоні від 0,05% до 10% за тіазолу Формули (І), можуть бути одержані спомасою, а решту становить придатний для ін'єкцій собом, добре відомим у фармацевтичній галузі, носій тощо. та містять щонайменше одну активну сполуку. Як Описані вище компоненти для перорального правило, сполуки за цим винаходом застосовувведення або придатні для ін'єкцій композиції є ють у фармацевтично ефективній кількості. Факпросто ілюстративними. Додаткові матеріали, а тична застосовувана кількість сполуки в типових також методики виготовлення тощо наведені в випадках визначається лікарем-куратором із враЧастині 5 довідника Remington's Pharmaceutical th хуванням релевантних обставин, в тому числі Sciences, 20 Edition, 2000, Marck Publishing стану, що підлягає лікуванню, вибраного шляху Company, Easton, Pennsylvania, який включено до введення, конкретної використовуваної сполуки, цього опису шляхом посилання. віку, маси, індивідуальної чутливості пацієнта та Сполуки, що відповідають Формулі (І) за цим тяжкості симптомів у пацієнта тощо. винаходом можуть також бути введені у формах Фармацевтичні композиції за цим винаходом пролонгованого вивільнення або за допомогою можуть бути введені різноманітними шляхами, в систем доставки лікарського засобу пролонговатому числі пероральним, ректальним, черезшкірного вивільнення. Опис типових речовин пролонним, підшкірним, внутрішньовенним, внутрішньогованого вивільнення можна знайти у матеріалах, м'язовим та інтраназальним. Композиції для певключених у довідник Remington's Pharmaceutical рорального введення можуть бути виготовлені у Sciences. формі недозованих рідких розчинів або суспензій Синтез сполук Формули (І): або недозованих порошків. Частіше, однак, комНові похідні тіазолу, які відповідають Формулі позиції застосовують у одиничних дозованих фо(І), можна одержати з легкодоступних вихідних рмах для полегшення точності дозування. Термін матеріалів, використовуючи кілька принципів син"одиничні дозовані форми" означає фізично дистезу, із застосуванням методик синтезу як в розкретні одиниці, придатні як одиничні дози для чинах, так і в твердій фазі (Brummond et al., 1999, людей та інших ссавців, причому кожна одиниця J.O.C., 64, 1723-1726). Нижче описано приклади містить заздалегідь визначену кількість активної схем синтезу згаданих сполук. речовини, розраховану на спричинення бажаного У поданому нижче описі застосовано абревітерапевтичного ефекту, у поєднанні з прийнятатури, що мають такі значення: ним фармацевтичним наповнювачем. До типових Å (Ангстрем), см (сантиметр), екв. (еквіваодиничних дозованих форм належать заповнені лент), год (година), г (грам), Μ (молярний), МГц виміряною кількістю рідких композицій ампули (мегагерц), мл (мікролітр), хв (хвилина), мг (мілігабо шприци або гранули, таблетки, капсули тощо рам), мл (мілілітр), мм (міліметр), ммоль (міліу разі твердих композицій. У таких композиціях, моль), мМ (мілімолярний), нм (нанометр), к.т. похідна тіазолу, як правило, є неосновним компо(кімнатна температура), BSA (бичачий сироватнентом (від приблизно 0,1% до приблизно 50% за ковий альбумін), CDI (Ν,Ν'-карбонілдіімідазол), масою або за варіантом, якому віддається переCMC (карбоксиметилцелюлоза), DCC (дицикловага, від приблизно 1% до приблизно 40% за магексилкарбодіімід), ДХМ (дихлорметан), DIEA сою), решту становлять різноманітні наповнювачі (діізопропілетиламін), DMF (диметилформамід), або носій та технологічні допоміжні речовини, DMSO (диметил сульфоксид), EDC (1-(3корисні для утворення бажаної дозованої форми. диметиламінопропіл)-3-етилкарбодіімід, гідрохлорид), HOBt (1-гідроксибензотриазол), РХВЕ 29 92489 30 (рідинна хроматографія високої ефективності), тковому розчиннику. До типових основ належать ІНС (імуногістохімія), Ins1P (D-міоінозит-1гідроксид натрію, метилат натрію, етилат натрію, фосфат), РХ (рідинна хроматографія), МС (масгідрид натрію, гідроксид калію, метилат калію, спектрометрія), NBS (N-бромсукцинімід), NIS (Nгідроксид магнію, гідроксид кальцію, бензатин, йодсукцинімід), ЯМР (ядерно-магнітний резохолін, діетаноламін, етилендіамін, меглумін, бенанс), PBS (сольовий розчин з фосфатним буфенетамін, діетиламін, піперазин та трометамін. ром), Pd(dppf)Cl2 (хлорид [1,1'Сіль виділяють концентруванням досуха або біс(дифенілфосфіно)-ферроцен]паладію(ІІ)), PIs шляхом додання осаджувача. У деяких випадках, (фосфоінозитиди), PI3K (фосфоінозитид-3солі можуть бути одержані шляхом змішування кінази), РІ(3)Р (фосфатидилінозит-4-фосфат), розчину кислоти з розчином катіону (етилгексаРІ(3,4)Р2 (фосфатидилінозит-3,4-дифосфат), ноат натрію, олеат магнію), застосування розчинРІ(3,4,5)Р3 (фосфатидилінозит-3,4,5-трифосфат), ника, в якому бажана катіонна сіль осаджується, РІ(4)Р (фосфатидилінозит-4-фосфат), РІ(4,5)Р2) або напроти, можуть бути виділені шляхом кон(фосфатидилінозит-4,5-дифосфат), Ptdlns (фосцентрування та додавання осаджувача. фатидилінозит), РуВОР (гексафторфосфат бенСпособи одержання проміжних продуктів зотриазол-1-ілокси)трипіролідинофосфонію), SPA сполуки Формули (І) (випробування спорідненості зі сцинтиляційним Залежно від природи X, R1, R2, R3, R4, R5 та детектуванням), TEA (триетиламін), TFA (триR6 для синтезу сполук Формули (І) можуть бути фтороцтову кислоту), THF (тетрагідрофуран), вибрані різні методики синтезу. ХТШ (хроматографія в тонкому шарі), УФ (ультСполуки Формули (І) можуть бути одержані рафіолетовий). шляхом каталізованої металом реакції перехресПохідні тіазолу 1-49 (дивись Таблицю І), приного сполучення. Наприклад, вони можуть бути клади яких наведено у цьому винаході, можуть одержані шляхом проведення реакції сполучення бути одержані з легкодоступних вихідних матеріСузукі (Suzuki) між арилгалогеном (Р1), де X моалів із застосуванням описаних нижче загальних же бути Br або І, та борною кислотою або складспособів та методик. Мається на увазі, що у виним ефіром (Р2), де R7 може бути Н, для похідних падках, коли вказано типові експериментальні борної кислоти, або будь-яким алкілом або заміумови або умови, яким віддається перевага (тобщеним алкілом для похідних складних ефірів бото температура проведення реакції, її тривалість, рної кислоти, в тому числі факультативно молярні кількості реагентів, розчинники тощо), B(OR7)2 може утворювати цикл, наприклад, пінаінші умови експериментів також можуть бути законовий ефір борної кислоти (Схема 1 нижче) стосовані, якщо не зазначено інше. Оптимальні (Bellina et al., 2004, Synthesis, 2419). умови проведення реакцій можуть варіювати заМожуть бути використані різні комплекси палежно від застосовуваних конкретних реагентів ладію, наприклад, Pd(PPh3)4, (хлорид [1,1'або розчинників, але такі умови фахівець у галузі біс(дифенілфосфіно)ферроцен]паладію(ІІ)) може визначити шляхом проведення звичайних (Pd(dppf)Cl2), РdСl2(РРh3)2, Pd(OAc)2, з можливим процедур оптимізації. доданням лігандів фосфіну наприклад, PPh3. У способі, ілюстрованому нижченаведеними Можуть бути використані різні органічні або неорсхемами, R1, R2, R3, R4, R5 та R6 відповідають ганічні основи, наприклад, TEA, DIEA, алкоголят наведеним вище визначенням. натрію, наприклад, NaOMe або NaOEt, KF, або Як правило, похідні тіазолу, які відповідають будь-які карбонати, наприклад, K2СО3, Na2CO3, Формулі (І), можна одержати, використовуючи Cs2CO3. Розчинник або суміш розчинників може кілька принципів синтезу, із застосуванням метобути вибраний з групи, яка включає THF, толуол, дик синтезу як в розчинах, так і в твердій фазі діоксан, МеОН, MeCN, DMF, воду тощо. Вибір (Kodomari et al., 2002, Tetrahedron Lett., 43, 1717розчинника або суміші розчинників може залежа1720) як звичайними способами, так і із застосути від природи основи, (Р1) та (Р2). Одержана ванням мікрохвильової обробки. реакційна суміш може бути піддана нагріванню, у Фармацевтично прийнятні солі сполук за цим інертній атмосфері, при різних температурах, із винаходом легко одержати шляхом проведення можливим застосуванням мікрохвильової обробреакції кислотних форм із прийнятною основою, ки. Можуть бути застосовані всі різноманітні комяк правило, у кількості 1 екв., розчиненою у додабінації, описані вище. Для одержання сполуки Формули (І) може бути застостоване сполучення Стілле (Stille), включаючи реакцію між арилгалогеном (Р1), де X може бути Br або І, та похідним олова (Р3), де R8 метил або н-бутил (наведена нижче Схема 2). Ця реакція може бути каталізована різними комплексами паладію, наприклад, Pd(PPh3)4, (хлоридом [1,1'-біс(дифенілфосфіно)ферроцен]паладію(II)) 31 92489 32 (Pd(dppf)Cl2), PdCl2(PPh3)2, Pd(OAc)2, з можливим солей хлору, наприклад, LiCl або ZnCl2. доданням лігандів фосфіну, наприклад, РРh3, та Якщо вказані вище умови каталізованої металом реакції перехресного сполучення неприйнятні для одержання сполук, що відповідають Формулі (І), то слід застосовувати придатні способи підготовчих синтезів, відомі фахівцям у галузі. Сполуки Формули (І) можна перетворювати у альтернативні сполуки Формули (І), застосовуючи придатні способи взаємного перетворення, добре відомі фахівцям у галузі. Якщо R4 - Н, сполуки Формули (Іа), де R3 може бути Т1 або Т2, можуть бути додатково функціоналізовані електрофільними замісниками (дивись наведену нижче Схему 3). Наприклад, шляхом хлорсульфонування хлорсульфоновою кислотою, з подальшим проведенням реакції з РСІ5/РОСІ3 можна одержати відповідний сульфонілхлорид (Р4). Проміжний продукт (Р4) можна додатково вводити в реакцію з аміном, HNR9R10, де R9 та R10 вибрані з групи, яку складають Н, факульта тивно заміщений C1-С6-алкіл (наприклад аліл, 2гідроксіетил), факультативно -NR9R10 може утворювати цикл, та може бути вибраний з групи, яку складають заміщений гетероциклоалкіл, наприклад, факультативно заміщений піперидин (наприклад, 3-гідроксипіперидин-1-іл, 4гідроксипіперидин-1-іл), факультативно заміщений морфолін (наприклад, морфолін-4-іл) та факультативно заміщений 8-(1,4-діокса-8азаспіро[4.5]декан), у присутності основи, наприклад TEA, DIEA, піридину тощо, одержуючи сполуки Формули (Іb) (Сполуки Формули (І), де R4=SO2NR9R10), аміносульфоніл, який відповідає наведеному вище визначенню, та де R3 може бути Т1 або Т2. Сполука Формули (Іа) може піддана іншим електрофільним заміщенням, наприклад, бромуванню, нітруванню, формілуванню, ацилуванню тощо, із застосуванням умов, відомих фахівцю в галузі (дивись, наприклад, Beaton et al., 1976, J. Chem. Soc, Perkin I, 2355-2363). Сполуки Формули (Іа) можна одержати безпосередньо шляхом проведення каталізованої металом реакції перехресного сполучення, виконуючи цю реакцію між (Р1) та придатним заміщеним тіофеном (Р2) або (Р3). Борна кислота або складний ефір (Р2) можуть надходити у продаж із різних джерел або їх можна синтезувати, як це буде докладно описано нижче у Прикладах, застосовуючи умови, відомі фахівцю в галузі. Борна кислота (Р2а) може бути перетворена у відповідний складний ефір борної кислоти (Р2b), шляхом нагрівання (Р2а) у присутності спирту або діолу (наведена нижче Схема 4). Складний ефір борної кислоти (Р2b) можна перетворити у альтернативний складний ефір борної кислоти, застосовуючи умови, відомі фахівцю в галузі. 33 92489 34 Пінаконовий складний ефір борної кислоти (Р2с) може бути виготовлений шляхом проведення каталізованої металом реакції сполучення між відповідним галогентіофеном, (Р4), де Х=Br, І тощо, та біс(пінаконато)дибором (Р5) або пінаконбораном (Р6) (наведена нижче Схема 5). Ця реакція може бути каталізована шляхом застосування різних комплексів паладію, наприклад, Pd(PPh3)4, (хлориду [1,1'біс(дифенілфосфшо)ферроцен]паладію(II)) (Pd(dppf)Cl2), PdCl2(PPh3)2, Pd(OAc)2, з можливим доданням лігандів фосфіну, наприклад, РРh3. Можуть бути використані різні органічні або неорганічні. основи, наприклад, TEA, DIEA, KF, KОН, або будь-які карбонати, наприклад, K2СО3, Na2CO3, Cs2CO3. Розчинник або суміш розчинників може бути вибраний з групи, яка включає THF, толуол, діоксан, МеОН, MeCN, DMF, воду тощо. Одержана реакційна суміш може бути піддана нагріванню, у інертній атмосфері, при різних температурах, із можливим застосуванням мікрохвильової обробки. Можуть бути застосовані всі різноманітні комбінації, описані вище. Галогентіофен (Р4) може бути спочатку перетворений у відповідний тіофеновий реагент Гріньяра (Grignard) (P7), який може реагувати з триалкілборатом, наприклад, В(ОМе)3, після чого або шляхом підкислення одержують відповідну борну кислоту (Р2а), або шляхом обробки відпо7 відним спиртом або діолом R OH одержують відповідний складний ефір борної кислоти (Р2b). Пряме 2-борилування може бути виконане шляхом каталізованої іридієм реакції з 2незаміщених похідних тіофену (Р8) (дивись наведену нижче Схему 6). Комплекс іридію(І) утворюють з 1/2[Ir(OMe)(COD)]2 та 4,4'-ди-трет-бутил2,2'-біпіридином, каталізують пряме борилування похідних тіофенів у стехіометричній кількості відносно біс(пінаконато)дибору, одержуючи складний ефір тіофен-2-борної кислоти (Р2с'). 35 92489 36 Якщо вказані вище умови сполучення неприйнятні для одержання борної кислоти або складного ефіру борної кислоти (Р2), можуть бути використані придатні методики одержання, відомі фахівцю в цій галузі. Оловоорганічні реагенти (Р3) можуть надходити у продаж із різних джерел або їх можна синтезувати, застосовуючи умови, відомі фахівцю в галузі. Сполуки Формули (Р1), де Х=Br або І можуть бути виготовлені шляхом галогенування відповідного тіазолу (Р9) реагентами наприклад, Br2, І2 або NBS, NIS (дивись наведену нижче Схему 7). Залежно від природи R1, перед галогенуванням може бути потрібний захист вторинного аміну, наприклад, групою РG=ацетил або будь-якої іншої групи, яка може бути легко видалена. Тіазол (Р9) може надходити у продаж із різних джерел або його можна синтезувати, застосовуючи умови, відомі фахівцю в галузі, із застосуванням методик синтезу як в розчинах, так і в твердій фазі {Kodomari et al., 2002, згаданий вище). Наприклад, його можна одержати у дві стадії (дивись наведену нижче Схему 8), починаючи з -галогенування кетону (Р10), використовуючи, наприклад, Br2 для бромування або тіонілхлорид для хлорування, одержуючи проміжний продукт (Р11). "Hal" у проміжному продукті (Р11) може бути також тозилоксигрупою, яку можна ввести із застосуванням придатних реагентів, наприклад, гідрокси(тозилокси)йодбензолу. Потім проміжний продукт (Р11) можна додати до розчину заміщеної тіосечовини R1NHC(S)NH2 (P12) у придатному розчиннику, за варіантом, якому віддається перевага, у полярному розчиннику, наприклад, EtOH, одержуючи проміжний продукт (Р9). Одержаний проміжний продукт (Р11) можна вводити в реакцію з тіосечовиною, одержуючи тіазол (Р13), який може бути додатково заміщений групою R1, яка відповідає наведеному вище визначенню, застосовуючи умови, відомі фахівцю в галузі. 37 Тіосечовини (Р12), використовувані у синтезах наведеної вище Схеми 8, можуть надходити у продаж із різних джерел або можуть бути синтезовані в умовах відомих фахівцю у галузі. Наприклад, тіосечовини (Р12) можуть бути одержані сполученням солі аміну R1NH2, за варі 92489 38 антом, якому віддається перевага, гідрохлориду, з тіоціанатом калію, застосованим у еквімолярній кількості, у THF при нагріванні зі зворотним холодильником як показано на наведеній нижче Схемі 9, Шлях А. 39 Амін R1NH2 можна спочатку активувати етоксикарбонілізотіоціанатом, одержуючи проміжну етоксикарбонілтіосечовину, як показано на Схемі 9, Шлях В. Після видалення групи захисту у кислотних умовах, наприклад, концентрованою HCl, одержують бажану тіосечовину (Р12). Амін R1NH2 також можна активувати бензоїлізотіоціанатом, який одержують шляхом додання бензоїлхлориду до тіоціанату амонію, одержуючи проміжну бензоїлтіосечовину, як показано нижче на Схемі 9, Шлях С Після відщеплення групи захисту у основних умовах, наприклад, NaOH, одержують бажану тіосечовину (Р12). За альтернативним варіантом, амін R1NH2 можна вводити в реакцію з тіофосгеном, із подальшим доданням амонію, як показано на Схемі 9, Шлях D. Якщо визначені вище методи синтезу непридатні для одержання N-заміщеної тіосечовини (Р12), то слід застосовувати придатні способи підготовчих синтезів, відомі фахівцям у галузі. Способи одержання проміжних продуктів сполуки Формули (І) За ше одним загальним способом, сполуки Формули (І) можна перетворювати в альтернативні сполуки Формули (І), застосовуючи придатні способи взаємного перетворення, добре відомі фахівцям у галузі. Якщо вищезазначена сукупність загальних способів синтезу є непридатною для одержання сполук Формули (І) та/або необхідних проміжних продуктів для синтезу сполук Формули (І), то слід застосовувати придатні способи підготовчих синтезів, відомі фахівцям у галузі. Як правило, способи синтезу будь-якої індивідуальної сполуки Формули (І) залежать від конкретних замісників у кожній молекулі та від доступності необхідних проміжних продуктів; такі фактори, знов-таки, можуть враховуватися пересічним фахівцем у галузі. Усі способи введення та відщеплення груп захисту описані у монографіях Косеньського "Групи захисту" (Philip J. Kocienski, in "Protecting Groups'", Georg Thieme Verlag Stuttgart, New York, 1994) та Гріні та Бутса "Групи захисту в органічному синтезі" (Theodora W. Greene and Peter G.M. Wuts in "Protective Groups in Organic Synthesis", Wiley Interscience, 3rd Edition 1999). Сполуки за цим винаходом можна виділяти в поєднанні з молекулами розчинника шляхом кристалізації після випарювання відповідного розчинника. Фармацевтично прийнятні солі сполук 92489 40 Формули (І), які містять основні центри, з кислотами можна одержати звичайним способом. Наприклад, розчин вільної основи можна обробити придатною кислотою, розчиненою або нерозведеною, і відділити утворену сіль або фільтруванням, або випарюванням у вакуумі розчинника, в якому проводили реакцію. Фармацевтично прийнятні солі з основами можна одержати аналогічним способом, шляхом оброблення розчину сполуки Формули (І) придатною основою. Обидва типи солей можна одержувати або перетворювати один в одного, застосовуючи іонообмінні смоли. Нижче цей винахід ілюстровано деякими прикладами, які не слід розглядати як такі, що обмежують обсяг винаходу. Приклади Використовують такі наявні на ринку вихідні сполуки: РуВОР (Novabiochem), 2(трибутилстаніл)тіофен (Aldrich), 5(дигідроксиборил)-2-тіофенкарбонова кислота (Acros), 3-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)тіофен (Boron-Mol), 5-форміл2-тіофенборна кислота (Aldrich), 2-ацетамідо-4метилтіазол (Aldrich), пінакон (Aldrich), 2-н. розчин (триметилсиліл)діазометану (Aldrich), Pd(dppf)Cl2 (Avocado), карбонат цезію (Fluka), фторид калію (Fluka), ацетат міді (Fluka), аліламін (Fluka), морфолін (Fluka), етаноламін (Fluka), 4гідроксипіперидин (Aldrich), 3-гідроксипіперидин (Aldrich), 2-н. розчин аміаку у МеОН (Aldrich), 1,4діокса-8-азаспіро[4.5]декан (Aldrich), хлорсульфонова кислота (Fluka), пентахлорид фосфору (Aldrich), оксихлорид фосфору (Aldrich), гідрохлорид гідроксиламіну (Fluka). Дані про РХВЕ, ЯМР та МС, подані у прикладах, описаних нижче, одержано при таких умовах: РХВЕ: колонка Waters Symmetry C8 50 4,6 мм, умови: MeCN/H2O, 5-100% (8 хв), максимальна висота піків на довжинах хвиль 230-400 нм; мас-спектри: прилад PE-SCIEX АРІ 150 ЕХ (позитивна хімічна іонізація - АРСІ та іонізація електронним ударом - ESI), мас-спектри після рідинної хроматографії (РХ/МС); 1H-ЯМР: прилад Bruker DPX-300MHz. Очищення методом препаративної РХВЕ виконується на системі РХВЕ Waters Prep LC 4000, обладнаній колонками Prep Nova-Pak HR, C18, розмір зерен сорбенту 6 мкм, діаметр пор 60Å, 41 92489 42 розміри колонки 40 30 мм (кількість речовини до Стадія І: N-[4-метил-5-(2-тієніл)-1,3-тіазол-2100 мг) або XTerra Prep MS C8, 10 мкм, 50 300 іл]ацетамід мм (до 1 г). Усі операції очищення виконуються N-(5-йод-4-метил-1,3-тіазол-2-іл)ацетамід, при елююванні градієнтом MeCN/H2O з домішкою Проміжний продукт 1 (2 г; 7,09 ммоль; 1 екв.), та 0,09% TFA. Напівпрепаративне очищення РХВЕ з Pd(dppf)Cl2 (0,52 г; 0,71 ммоль; 0,10 екв.) розчиоберненою фазою виконуються із застосуванням няють у DMF (35 мл). Додають 2системи Biotage Parallex Flex, обладнаної колон(трибутилстаніл)тіофен (2,68 мл; 8,44 ммоль; 1,19 ками Supelcosil ABZ+Plus (25 см 21,2 мм, 12 екв.). Одержану реакційну суміш продувають армм); УФ детектування на довжинах хвиль 254 нм гоном та нагрівають при 100°С протягом 1,5 год. та 220 нм; об'ємна швидкість потоку 20 мл/хв (до Розчинники випарюють, та неочищену суміш роз50 мг). Аналіз методом ТШХ виконується на плачиняють у EtOAc (100 мл), промивають водою стинах Merck Precoated 60 F254. Очищення (3 100 мл). Водні фази об'єднують та екстрагуфлеш-хроматографією виконується на носії SiO2 ють EtOAc (2 50 мл). Об'єднані органічні фази із застосуванням для елюювання сумішей циклопромивають розсолом та сушать над MgSO4. Пігексан/EtOAc або ДХМ/МеОН. сля випарювання розчинників неочищений проРеакції при мікрохвильовому опроміненні дукт очищають препаративною РХВЕ, одержуючи проводять в однорежимному мікрохвильовому N-[4-метил-5-(2-тієніл)-1,3-тіазол-2-іл]ацетамід у реакторі Emrys Optimiser фірми Personal вигляді злегка забарвленого порошку (1,24 г; Chemistry. 73,5%).Проміжний продукт 1: Одержання N-(5-йод-41 H ЯМР (DMSO-d6) 2,16 (s, 3H), 2,42 (s, 3H), метил-1,3-тіазол-2-іл)ацетаміду (Проміжний про7,15 (dd, J=3,8 Гц, 5,3 Гц, 1Н), 7,20 (dd, J=1,1 Гц, дукт (Р1), де R1 - С(О)СН3, R2 - СН3 та X - І) 3,8 Гц, 1Н), 7,60 (dd, J=1,1 Гц, 5,3 Гц, 1Н), 12,19 (s, 1Н). M (ESI): 237,01; M+(ESI): 239,01. РХВЕ, Rt: 3,01 хв (чистота: 98,7%). Стадія II: 5-[2-(ацетиламіно)-4-метил-1,3тіазол-5-іл]тіофен-2-сульфонілхлорид N-[4-метил-5-(2-тієніл)-1,3-тіазол-2іл]ацетамід, одержаний на Стадії І (500 мг; 2,10 ммоль; 1 екв.), розчиняють у ДХМ (30 мл). ОдерДо розчину 2-ацетамідо-4-метилтіазолу (5 г; жану реакційну суміш охолоджують до 0°С, та 32,01 ммоль; 1 екв.) у MeCN (100 мл) додають Nдодають краплями хлорсульфонову кислоту (0,70 йодсукцинімід (8,642 г; 38,41 ммоль; 1,2 екв.). мл; 10,49 ммоль; 5 екв.), розчинену у ДХМ (30 мл) Одержаний гомогенний розчин перемішують при протягом 15 хв. Одержаний розчин стає рожевим. кімнатній температурі. Через 5 хв утворюється Його перемішують 15 хв при 0°С. Послідовно осад. Його відфільтровують та промивають хододають пентахлорид фосфору (873,7 мг; 4,20 лодним MeCN. Першу порцію Проміжного продуммоль; 2 екв.) та оксихлорид фосфору (0,78 мл; кту 1 виділяють у вигляді злегка забарвленої тве8,39 ммоль; 4 екв.). Одержану реакційну суміш рдої речовини (5,072 г; 57%). Маточні розчини перемішують протягом додаткових 2 год при кімвипарюють та розчиняють у EtOAc. Їх промиванатній температурі. Її виливають на лід, та бажають двома порціями 1-н. розчину Na2S2O3 та суний продукт екстрагують 2 порціями EtOAc, сушать над MgSO4. Після фільтрування та випарюшать над MgSO4 та випарюють, одержуючи 5-[2вання розчинників, одержану тверду речовину (ацетиламіно)-4-метил-1,3-тіазол-5-іл]тіофен-2суспендують у MeCN, фільтрують та сушать у сульфонілхлорид у вигляді жовтої твердої речовакуумі, одержуючи другу порцію Проміжного вини (650 мг; 92%). M (ESI): 335,08; M+(ESI): продукту 1 у вигляді злегка забарвленої твердої 337,08. речовини (1,813 г; 20%). Загальний вихід за цією Стадія III: N-(4-метил-5-{5-[(проп-2-ін-11 реакцією становить 77%. H ЯМР (DMSO-d6, 300 іламіно)сульфоніл]-2-тієніл}-1,3-тіазол-2МГц) 1,88 (s, 3H), 2,02 (s, 3H), 12,02 (s, 1Н). M іл)ацетамід (1) (ESI): 281,02; M+(ESI): 283,09. PXBE, Rt: 2,55 хв 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5(чистота: 100%). іл]тіофен-2-сульфонілхлорид, одержаний на СтаПриклад 1: N-(4-метил-5-{5-[(проп-2-ін-1дії II (200 мг; 0,59 ммоль; 1 екв.), розчиняють у іламіно)сульфонілї-2-тієніл}-1,3-тіазол-2безводному ДХМ (10 мл). Реакційну суміш умііл)ацетамід (1) щують в атмосферу азоту. Послідовно додають проп-2-ініламін (0,08 мл; 1,19 ммоль; 2 екв.) та діізопропілетиламін (0,61 мл; 3,56 ммоль; 6 екв.), і одержану реакційну суміш перемішують протягом 3 год при кімнатній температурі. Розчинники випарюють, а одержаний неочищений продукт очищають препаративною РХВЕ. Сполуку (1) виділяють у вигляді бежевого порошку (25 мг; 12%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,15 (s, 3H), 2,43 (s, 3H), 3,13 (t, J=3 Гц, 1Н), 3,77 (q, J=6 Гц, 2Н), 7,20 (d, J=3 Гц, 1Н), 7,58 (d, J=6 Гц, 1Н), 8,4 (t, J=6 Гц, 1H), 12,31 (s, 1H). M (ESI): 354,2; 43 92489 44 M+(ESI): 356,1. РХВЕ (методика А), Rt: 2,88 XB ним розчином NH4CI (двічі) та розсолом. Органіч(чистота: 100%). ний шар сушать над MgSO4, а розчинники випаПриклад 2: N-(5-{5-[(4-ацетилпіперазин-1рюють. Одержаний неочищений продукт розчиіл)сульфоніл]-2-тієніл}-4-метил-1,3-тіазол-2няють у ДХМ та екстрагують 1-н. розчином HCl. іл)ацетамід (2) Водну фазу промивають ДХМ (тричі) та підлуговують, додаючи 5-н. розчин NaOH до досягнення рН 10. Бажаний продукт екстрагують EtOAc (тричі). Об'єднані органічні фази сушать над MgSO4, фільтрують та випарюють, одержуючи Сполуку (3) у вигляді бежевої твердої речовини (480 мг; 40%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,08 (s, 6H), 2,14 (s, 3H), 2,25 (t, J=6 Гц, 2H), 2,43 (s, 3H), 2,94 (t, J=9 Гц, 2H), 7,20 (d, J=3 Гц, 1Н), 7,55 (d, J=6 Гц, 1Н), 7,81 (s, 1H), 12,30 (s, 1H). M (ESI): 387,2; M+(ESI): 389,2. PXBE (методика A), Rt: 1,96 XB (чистота: 98,0%). Приклад 4: N-[4-мeтил-5-(5-{[(15-[2-(ацетиламіно)-4-метил-1,3-тіазол-5мeтилпіпepидин-4-iл)aмiнo]cyльфoнiл}-2-тієніл)іл]тіофен-2-сульфонілхлорид, одержаний за ме1,3-тіазол-2-іл]ацетамід (4) тодикою Стадії II Прикладу 1 (100 мг; 0,3 ммоль; 1 екв.), розчиняють у безводному ДХМ (5 мл). Реакційну суміш уміщують в атмосферу азоту. Послідовно додають 1-піперазин-1-іл-етанон (76,1 мг; 0,59 ммоль; 2 екв.) та діізопропілетиламін (0,3 мл; 1,78 ммоль; 6 екв.), і одержану реакційну суміш перемішують протягом 3 год при кімнатній температурі. Розчинники випарюють, а неочищений продукт очищають препаративною РХВЕ. Сполуку (2) виділяють у вигляді блідожовтого порошку (35 мг; 27%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,80 (s, 3H), 2 (s, 3H), 2,30 (s, 3H), 2,82 (m, J=21 Гц, 4H), 3,38 (d, 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5J=3 Гц, 4H), 7,15 (d, J=6 Гц, 1Н), 7,45 (d, J=3 Гц, іл]тіофен-2-сульфонілхлорид, одержаний, як опи1Н), 12,18 (s, 1Н). M (ESI): 427,1; M+(ESI): 429,0. сано для Стадії 1 Прикладу 9 (110 мг; 0,33 PXBE (методика A), Rt: 2,86 хв (чистота: 99,8%). ммоль; 1 екв.), розчиняють у суміші ДХМ/DMF Приклад 3: N-{5-[5-({[2(1/1, 10 мл). Додають 4-аміно-1-метилпіперидин (диметиламіно)етил]аміно}сульфоніл)-2-тієніл]-4(188 мг; 1,65 ммоль; 5 екв.) та DIEA (0,17 мл; 0,98 метил-1,3-тіазол-2-іл}ацетамід (3) ммоль; 3 екв.). Через 3 год розчинники випарюють. Неочищений продукт розчиняють у ДХМ та промивають насиченим розчином NH4CI та водою та сушать над MgSO4. Після випарювання розчинників неочищений матеріал розчиняють у ДХМ (3 мл), і вказану в заголовку сполуку осаджують Et2O, одержуючи після фільтрування сполуку (4) у вигляді білого порошку (120 мг; 90%). 1 H ЯМР (DMSO-d6) 1,25 (m, 2Н), 1,55 (m, 2Н), 1,80 (m, 2Н), 2,05 (m, 2Н), 2,25 (s, 6Н), 2,40 (s, 3H), 3,05 (m, 1Н), 6,95 (d, J=3 Гц, 1Н), 7,52 (d, J=3 Гц, 1H), 12,23 (m, 1H). M (ESI): 413,30; M+(ESI): 415,30. PXBE, Rt: 2,08 хв (чистота: 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-599,33%). іл]тіофен-2-сульфонілхлорид, одержаний за меПриклад 5: N-(5-{5-[(2тодикою Стадії II Прикладу 1, (1000 мг; 2,97 диметиламіноетил)метилсульфамоїл)тіофен-2ммоль; 1 екв.) розчиняють у безводному ДХМ іл}-4-метилтіазол-2-іл)-ацетамід (5) (100 мл). Реакційну суміш уміщують в атмосферу азоту. Послідовно додають 2диметиламіноетиламін (0,97 мл; 8,91 ммоль; 3 екв.) та триетиламін (1,66 мл; 11,9 ммоль; 4 екв.), і одержану реакційну суміш перемішують протягом ночі при кімнатній температурі. Через 15 год додають триетиламін (4 екв.) та 2диметиламіноетиламін (3 екв.) для завершення реакції. Через 1 год реакція завершується. Потім одержану реакційну суміш промивають насиче 45 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії II Прикладу 1 (500 мг; 1,48 ммоль; 1 екв.), розчиняють у безводному ДХМ (50 мл). Реакційну суміш уміщують у атмосферу азоту. Послідовно додають N,N,N'-триметил-етан-1,2діамін (0,58 мл; 5,94 ммоль; 3 екв.) та триетиламін (0,83 мл; 5,94 ммоль; 4 екв.), і одержану реакційну суміш перемішують протягом ночі при кімнатній температурі. Реакційну суміш промивають насиченим розчином NH4CI (двічі), водою (тричі), розсолом, та сушать над MgSO4. Після випарювання розчинників, неочищений продукт суспендують у ACN, фільтрують та сушать у вакуумі, одержуючи Сполуку (5) у вигляді бежевої твердої речовини (309 мг; 41%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,14 (s, 6H), 2,15 (s, 3H), 2,40 (t, J=6 Гц, 2H), 2,44 (s, 3H), 2,77 (s, 3H), 3,10 (t, J=6 Гц, 2H), 7,28 (s, 1H), 7,63 (s, 1H), 12,33 (s, 1H). M (ESI): 401,2; M+(ESI): 403,3. PXBE (методика A), Rt: 2,10 хв (чистота: 94,4%). Приклад 6: 5-(2-аміно-4-метил-1,3-тіазол-5іл)-N-(2-морфолін-4-ілетил)-тіофен-2сульфонамід (6) До N-[4-метил-5-(5-{[(2-морфолін-4ілетил)аміно]сульфоніл}-2-тієніл)-1,3-тіазол-2іл]ацетаміду (9) (240 мг; 0,56 ммоль; 1 екв.) додають 1,25 Μ розчин хлороводню в EtOH (8,9 мл; 1,25 Μ; 11,2 ммоль; 20 екв.). Одержану суміш перемішують протягом ночі при 90°С. Реакційну суміш охолоджують до кімнатної температури. Утворений осад відфільтровують та промивають холодним EtOH, одержуючи Сполуку (6) у вигляді жовтуватої твердої речовини (241,5 мг; 94%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,33 (s, 3H), 3,11 (m, 2H), 3,22 (m, 2H), 3,29 (m, 2H), 3,41 (m, 2H), 3,76 (m, 2H), 3,93 (m, 2H), 7,17 (d, J=4 Гц, 1Н), 7,63 (d, J=4 Гц, 1H), 8,40 (t, J=6 Гц, 1H), 8,72 (br s, 2H), 11,06 (br s, 1H). PXBE (методика A), Rt: 1,02 хв (чистота: 99,8%). M (ESI): 387,20; M+(ESI): 389,20. Приклад 7: Метил-5-{[4-метил-5-(5-{[(2морфолін-4-ілетил)аміно]сульфоніл}-2-тієніл)-1,3тіазол-2-іл]аміно}-5-оксопентаноат (7) 92489 46 До знегаженого розчину 5-(2-аміно-4-метил1,3-тіазол-5-іл)-N-(2-морфолін-4-ілетил)тіофен-2сульфонаміду (6) (100 мг; 0,22 ммоль; 1 екв.) у безводному THF (10 мл) послідовно додають тетрафторборат N-[(1Н-1,2,3-бензотриазол-1ілокси)(диметиламіно)метилен]-Nметилметанамінію (104,4 мг; 0,33 ммоль; 1,50 екв.), монометилглутарат (68 мкл; 0,54 ммоль; 2,50 екв.) та Ν,Ν-діізопропілетиламін (148 мкл; 0,87 ммоль; 4 екв.). Одержану реакційну суміш перемішують при кімнатній температурі протягом трьох діб. Розчинники випарюють у вакуумі. Одержаний неочищений продукт розчиняють у EtOAc та промивають насиченим розчином NH4CI, водою, розсолом та сушать над MgSO4. Після випарювання розчинників, неочищений продукт очищають флеш-хроматографією (градієнт СН3СІ/МеОН від 1/0 до 1/1 протягом 40 хв), одержуючи Сполуку (7) у вигляді жовтої твердої речовини (68,5 мг; 61,18%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,05 (квінтет, J=6 Гц, 2Н), 2,34 (m, 4H), 2,46 (m, 9Н), 3,13 (m, 2Н), 3,63 (m, 4Н), 3,68 (s, 3H), 5,38 (br s, 1Н), 7,01 (d, J=4 Гц, 1Н), 7,53 (d, J=4 Гц, 1Н), 9,17 (br s, 1Н). РХВЕ (методика A), Rt: 2,28 хв (чистота: 95,7%). M (ESI): 515,21; M+(ESI): 517,40. Приклад 8: N-(4-метил-5-{5-[(4метилпіперазин-1-іл)сульфоніл]-2-тієніл}-1,3тіазол-2-іл)ацетамід (8) 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії II Прикладу 1 (280 мг; 0,84 ммоль; 1 екв.), розчиняють у ДХМ (10 мл). Додають Nметилпіперазин (8,4 мл; 8,4 ммоль; 10 екв.) та DIEA (0,17 мл; 0,98 ммоль; 3 екв.). Через 4 год додають воду (1 мл), і розчинники випарюють досуха. Неочищений продукт вдруге розчиняють у ДХМ та промивають насиченим розчином NH4CI, водою та сушать над MgSO4. Після випарювання розчинників неочищений матеріал осаджують у суміші ДХМ та діетилового ефіру, одержуючи після фільтрування Сполуку (8) у вигляді білої твердої речовини (173 мг; 51%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,95 (s, 3H), 2,05 (s, 3H), 2,28 (m, 7H), 2,80 (m, 4H), 7,10 (d, J=6 Гц, 1Н), 7,40 (d, J=6 Гц, 1H), 12,14 (m, 1H). M (ESI): 399,3; M+(ESI): 401,3. РХВЕ (методика A), Rt: 2,13 хв (чистота: 100%). 47 92489 48 1 Приклад 9: N-(4-метил-5-{5-[(2-морфолін-4H ЯМР (DMSO-d6, 300 МГц) 1,80 (m, 2H), ілетиламіно)сульфоніл]-2-тієніл}-1,3-тіазол-22,16 (s, 3H), 2,45 (s, 3H), 2,71 (s, 6H), 2,94 (q, J=6 іл)ацетамід (9) Гц, 2H), 3,05 (m, 2H), 7,23 (d, J=6 Гц, 1Н), 7,59 (d, J=6 Гц, 1Н), 8,08 (m, 1Н), 10,22 (m, 1H). M (ESI): 401,4; M+(ESI): 403,4. PXBE (методика A), Rt: 2,07 хв (чистота: 99,7%). Приклад 11: N-(4-мeтил-5-{5-[(пiпepaзин-1iл)cyльфoнiл]-2-тiєнiл}-1,3-тіазол-2-іл)ацетамід (11) 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії І Прикладу 9 (4000 мг; 11,9ммоль; 1 екв.), розчиняють у безводному ДХМ (400 мл). Реакційну суміш уміщують у атмосферу азоту. Послідовно додають 2-морфолін-4-іл-етиламін (4638 мг; 35,6 ммоль; 3 екв.) та триетиламін (6,6 мл; 47,5 ммоль; 4 екв.), і одержану реакційну суміш перемішують протягом ночі при кімнатній температурі. До одержаної реакційної суміші додають 1-н. розчин HCl. Водну фазу промивають ДХМ (тричі) та підлуговують, додаючи 5-н. розчин NaOH до досягнення рН 10. Бажаний продукт екстрагують EtOAc (тричі), одержуючи Сполуку (9) у вигляді білої твердої речовини (3134 мг; 60%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,14 (s, 3H), 2,30 (m, 4H), 2,34 (t, J=6 Гц, 2H), 2,43 (s, 3H), 2,98 (t, J=9 Гц, 2H), 3,50 (t, J=6 Гц, 4H), 7,20 (s, 1Н), 7,56 (s, 1H), 7,83 (s, 1H), 12,31 (s, 1H) M (ESI): 429,3; M+(ESI): 431,3. PXBE (методика A), Rt: 1,95 хв (чистота: 99,3%). Приклад 10: N-{5-[5-({[3(димeтилaмiнo)пpoпiл]aмiнo}cyльфoнiл)-2-тiєнiл]4-метил-1,3-тіазол-2-іл}ацетамід (10) 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії II Прикладу 1 (280 мг; 0,84 ммоль; 1 екв.), розчиняють у ДХМ (10 мл). Додають N,Nдиметилпропан-1,3-діамін (0,89 мл; 8,4 ммоль; 10 екв.) та DIEA (0,17 мл; 0,98 ммоль; 3 екв.). Через 12 год до реакційної сусіші додають воду (1 мл), і розчинники випарюють досуха. Неочищений продукт вдруге розчиняють у ДХМ та промивають насиченим розчином NH4CI, водою та сушать над MgSO4. Після випарювання розчинників, неочищений матеріал осаджують у суміші ДХМ та діетилового ефіру, одержуючи після фільтрування Сполуку (10) у вигляді білої твердої речовини (105 мг; 28%). 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії II Прикладу 1 (280 мг; 0,84 ммоль; 1 екв.), розчиняють у ДХМ (10 мл). Додають Nметилпіперазин (1,4 г; 16,8 ммоль; 20 екв.) та DIEA (0,17 мл; 0,98 ммоль; 3 екв.). Через 12 год до реакційної суміші додають воду (1 мл), та розчинники випарюють досуха. Неочищений продукт вдруге розчиняють у ДХМ та промивають насиченим розчином NH4CI, водою та сушать над MgSO4. Після випарювання розчинників неочищений матеріал осаджують у суміші ДХМ та діетилового ефіру, одержуючи після фільтрування Сполуку (11) у вигляді білої твердої речовини (125 мг; 40%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,17 (s, 3H), 2,47 (s, 3H), 3,24 (s, 8H), 7,38 (d, J=6 Гц, 1Н), 7,70 (d, J=6 Гц, 1H), 9,12 (m, 1H), 12,39 (m, 1H). M (ESI): 385,3; M+(ESI): 387,3. PXBE (методика A), Rt: 2,09 хв (чистота: 100%). Приклад 12: N-2-({5-[2-(ацетиламіно)-4метил-1,3-тіазол-5-іл]-2-тієніл}сульфоніл)-Nметилгліцинамід (12) 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний на Стадії II Прикладу 1 (110 мг; 0,33 ммоль; 1 екв.), розчиняють у суміші ДХМ/DMF (1/1, 10 мл). Додають у атмосфері азоту 2-аміно-N-метилацетамід (145 мг; 1,65 ммоль; 5 екв.) та DIEA (0,17 мл; 0,98 ммоль; 3 екв.). Через 3 год розчинники випарюють. Неочищений продукт розчиняють у ДХМ та промивають насиченим розчином NH4CI, водою та сушать над MgSO4. Після випарювання розчинників неочищений матеріал очищають препаративною РХВЕ, одержуючи Сполуку (12) у вигляді масла (4 мг; 3%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,99 (s, 3H), 2,30 (s, 3H), 2,55 (d, J=3 Гц, 3H), 3,50 (d, J=6 Гц, 49 92489 50 1 2H), 7,21 (d, J=3 Гц, 1Н), 7,55 (d, J=3 Гц, 1Н), 7,85 H ЯМР (DMSO-d6, 300 МГц) 1,30 (s, 3H), (d, J=3 Гц, 1Н), 8,24 (t, J=6 Гц, 1Н), 12,32 (m, 1H). 1,35 (s, 3H), 2,30 (s, 3H), 2,50 (s, 3H), 3,10 (m, J=6 M (ESI): 387,10; M+(ESI): 389,10. РХВЕ (методика Гц, 1Н), 3,30 (m, J=6 Гц, 1Н), 3,70 (m, J=6 Гц, 1Н), A), Rt: 2,37 хв (чистота: 100%). 4,05 (m, J=6 Гц, 1Н), 4,25 (m, J=6 Гц, 1H), 4,93 (t, Приклад 13: N-(5-{5-[(2J=6 Гц, 1H), 7,05 (d, J=3 Гц, 1Н), 7,55 (d, J=3 Гц, + (aцeтилaмiнo)eтил)аміно]cyльфoнiл-2-тiєнiл}-41H). M (ESI): 430,2; M (ESI): 432,3. PXBE (метометил-1,3-тіазол-2-іл)ацетамід (13) дика A), Rt: 3,06 хв (чистота: 95,44%). Приклад 15: Метил-N-({5-[2-(ацетиламіно)-4метил-1,3-тіазол-5-іл]-2-тієніл}сульфоніл)серинат (15) 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії II Прикладу 1 (110 мг; 0,33 ммоль; 1 екв.), розчиняють у суміші ДХМ/DMF (1/1, 10 мл). Додають N-ацетилетилендіамін (168 мг; 1,65 ммоль; 5 екв.) та DIEA (0,17 мл; 0,98 ммоль; 3 екв.). Через 3 год розчинники випарюють. Неочищений продукт розчиняють у ДХМ та промивають насиченим розчином NH4CI, водою та сушать над MgSO4. Після випарювання розчинників неочищений матеріал розчиняють у ДХМ (3 мл), та вказану у заголовку сполуку осаджують діетиловим ефіром, одержуючи після фільтрування Сполуку (13) у вигляді жовтого порошку (14 мг; 11%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,75 (s, 3H), 2,15 (s, 3H), 2,35 (s, 3H), 2,90 (q, J=6 Гц, 2Н), 3,10 (q, J=6 Гц, 2Н), 7,21 (d, J=3 Гц, 1Н), 7,53 (d, J=3 Гц, 1Н), 7,90 (m, 2H), 12,31 (m, 1H). M (ESI): 401,20; M+(ESI): 403,20. РХВЕ (методика A), Rt: 2,41 хв (чистота: 92,1%). Приклад 14: N-[5-(5-{[(2,2-димeтил-1,3дioкcoлaн-4-іл)метил]аміносульфоніл}-2-тієнїл)-4метил-1,3-тіазол-2-іл]ацетамід (14) 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії II Прикладу 1 (110 мг; 0,33 ммоль; 1 екв.), розчиняють у суміші ДХМ/DMF (1/1, 10 мл). Додають метиловий складний ефір 2-аміно3-гідроксипропіонової кислоти (0,2 мл; 1,65 ммоль; 5 екв.) та DIEA (0,17 мл; 0,98 ммоль; 3 екв.). Через 1 год розчинники випарюють досуха. Неочищений продукт вдруге розчиняють у ДХМ та промивають насиченим розчином NH4CI, водою та сушать над MgSO4. Після випарювання розчинників, неочищений матеріал осаджують у ACN, одержуючи після фільтрування Сполуку (15) у вигляді білого порошку (54 мг; 39%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,26 (s, 3H), 2,59 (s, 3H), 3,72 (s, 3H), 4 (m, 2H), 4,15 (m, 1Н), 5,75 (d, J=3 Гц, 1Н), 7,14 (d, J=3 Гц, 1Н), 7,61 (d, J=3 Гц, 1Н), 12,35 (m, 1H). M (ESI): 418,2; M+(ESI): 420,2. PXBE (методика A), Rt: .2,50 хв (чистота: 99,41%). Приклад 16: N-({5-[2-(aцeтилaмiнo)-4-мeтил1,3-тiaзoл-5-iл]-2-тiєнiл}-сульфоніл)серин (16) 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії II Прикладу 1 (110 мг; 0,33 ммоль; 1 екв.), розчиняють у ДХМ (10 мл). Додають 2,2диметил-1,3-діоксолан-4-метанамін (216 мг; 1,65 ммоль; 5 екв.) та DIEA (0,17 мл; 0,98 ммоль; 3 екв.). Через 1 год розчинники випарюють. Неочищений продукт розчиняють у ДХМ та промивають насиченим розчином NH4CI, водою та сушать над MgSO4. Після випарювання розчинників, неочищений матеріал розчиняють у ДХМ (3 мл). Вказану у заголовку сполуку осаджують шляхом додання діетилового ефіру, одержуючи після фільтрування Сполуку (14) у вигляді білого порошку (65 мг; 46%). Метил-N-({5-[2-(ацетиламіно)-4-метил-1,3тіазол-5-іл]-2-тієніл}-сульфоніл)серинат (15) (48 мг; 0,11 ммоль; 1 екв.) розчиняють у THF (2 мл). Одержаний розчин охолоджують до 0°С, та повільно додають гідроксид натрію (5М) (0,3 мл; 14 ммоль; 12,5 екв.). Одержану реакційну суміш перемішують при кімнатній температурі протягом 30 хв, після чого нейтралізують, додаючи HCl (1М). Розчинники випарюють досуха, очікувану сполуку екстрагують EtOAc (тричі) та сушать над MgSO4. Після випарювання розчинників неочищений матеріал осаджують у ACN, одержуючи після фільтрування Сполуку (16) у вигляді білої твердої речовини (5 мг; 10%). 51 92489 H ЯМР (DMSO-d6, 300 МГц) 1,75 (m, 2H), 2,16 (s, 3H), 2,43 (s, 3H), 3,83 (m, 1Н), 7,17 (d, J=3 Гц, 1Н), 7,53 (d, J=3 Гц, 1Н), 8,39 (d, J=9 Гц, 1Н), 12,37 (m, 1H). M (ESI): 404,2; M+(ESI): 406,2. PXBE (методика A), Rt: 2,23 хв (чистота: 93,44%). Приклад 17: N-(5-{5-[(2.3дигідроксипропіламіно)сульфоніл]-2-тієніл}-4метил-1,3-тіазол-2-іл)ацетамід (17) 52 1 N-[5-(5-{[(2,2-диметил-1,3-діоксолан-4іл)метил]аміносульфоніл}-2-тієніл)-4-метил-1,3тіазол-2-іл]ацетамід (14) (48 мг; 0,11 ммоль; 1 екв.), розчиняють у ДХМ (5 мл). Додають трифтороцтову кислоту (0,2 мл), та реакційну суміш перемішують при кімнатній температурі протягом 30 хв. Розчинники випарюють, а неочищений продукт одразу ж очищають препаративною РХВЕ, одержуючи Сполуку (17) у вигляді злегка забарвленої твердої речовини (7 мг; 16%). M (ESI): 390,2; M+(ESI): 392,2. РХВЕ (методика A), Rt: 2,13 хв (чистота: 83,5%). Приклад 18: N-(5-{5[(диметиламіно)сульфоніл]-2-тієніл}-4-метил-1,3тіазол-2-іл)ацетамід (18) 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії II Прикладу 1 (110 мг; 0,33 ммоль; 1 екв.), розчиняють у DMF (10 мл). Додають диметиламін (0,1 мл; 1,65 ммоль; 5 екв.) та DIEA (0,17 мл; 0,98 ммоль; 3 екв.). Через 1 год розчинники випарюють досуха. Неочищений продукт вдруге розчиняють у ДХМ та промивають насиченим розчином NH4CI, водою та сушать над MgSO4. Після випарювання розчинників неочищений матеріал осаджують у суміші ДХМ та діетилового ефіру, одержуючи після фільтрування Сполуку (18) у вигляді жовтого порошку (52 мг; 46%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,30 (s, 3H), 2,50 (s, 3H), 2,70 (s, 6H), 7,11 (d, J=3 Гц, 1Н), 7,48 (d, J=3 Гц, 1H). M (ESI): 344,1; M+(ESI): 346,1. PXBE (методика A), Rt: 3,26 хв (чистота: 99,4%). Приклад 19: N-{4-мeтил-5-[5-({мeтил[2(метиламіно)етил]аміно}сульфоніл)-2-тієніл]-1,3тіазол-2-іл}ацетамід (19) 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії II Прикладу 1 (500 мг; 1,48 ммоль; 1,00 екв.), розчиняють у ДХМ (30 мл). Одержаний розчин знегажують N2 та охолоджують до 0°С. Додають триетиламін (1 мл; 7,42 ммоль; 5,00 екв.), а потім Ν,Ν'-диметилетилендіамін (0,79 мл; 7,42 ммоль; 5,00 екв.). Через 30 хв при 0°С реакція завершується. Одержану реакційну суміш промивають насиченим розчином NаНСО3 (двічі) та водою (двічі). Органічну фазу сушать над MgSO4, фільтрують та концентрують у вакуумі, одержуючи Сполуку (19) у вигляді бежевої твердої речовини (457 мг; 79%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,20 (s, 3H), 2,31 (s, 3H), 2,49 (s, 3H), 2,68 (t, 2Н), 2,81 (s, 3H), 3,08 (t, 2Н), 7,33 (d, 1Н), 7,67 (d, 1H). M (ESI): 387,2; M+(ESI): 389,3. PXBE (методика A), Rt: 2,06 хв (чистота: 99,2%). Приклад 20: N-[5-(5-{[[2(дieтиламіно)eтил](мeтил)aмiнo]cyльфoнiл}-2тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід (20) 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії II Прикладу 1 (500 мг; 1,48 ммоль; 1,00 екв.) розчиняють у ДХМ (30 мл). Одержаний розчин знегажують N2 та охолоджують до 0°С. Додають триетиламін (1,0 мл; 7,42 ммоль; 5,00 екв.), а потім Ν,Ν-діетил-N'-метилетилендіамін (1,2 мл; 7,42 ммоль; 5,00 екв.). Через 1 год при 0°С реакція завершується. Одержану реакційну суміш промивають насиченим розчином NaHCO3 (двічі) та водою (двічі). Органічну фазу сушать над MgSO4, фільтрують та концентрують у вакуумі, одержуючи Сполуку (20) у вигляді бежевої твердої речовини (570 мг; 89%). 1 Н ЯМР (DMSO-d6, 300 МГц) 0,97 (t, 6H), 2,19 (s, 3H), 2,49 (m, 7H), 2,59 (t, 2H), 2,84 (s, 3H), 3,11 (t, 2H), 7,33 (d, 1H), 7,66 (d, 1H), 12,36 (s, 1H). M (ESI): 429,2; M+(ESI): 431,3. PXBE (методика A), Rt: 2,35 хв (чистота: 98,9%). Приклад 21: N-[5-(5-{[(2мeтoкcieтил)(мeтил)aмiнo]cyльфoнiл}-2-тієніл)-4метил-1,3-тіазол-2-іл]ацетамід (21) 53 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії II Прикладу 1 (500 мг; 1,48 ммоль; 1,00 екв.) розчиняють у ДХМ (30 мл). Одержаний розчин знегажують N2 та охолоджують до 0°С. Додають триетиламін (1,0 мл; 7,42 ммоль; 5,00 екв.), а потім N-(2-метоксіетил)метиламін (0,80 мл; 7,42 ммоль; 5,00 екв.). Через 45 хв при 0°С реакція завершується. Одержану реакційну суміш промивають насиченим розчином NaHCO3 (двічі) та водою (двічі). Органічну фазу сушать над MgSO4, фільтрують та концентрують у вакуумі, одержуючи Сполуку (21) у вигляді бежевої твердої речовини (478 мг; 83%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,19 (s, 3H), 2,49 (s, 3H), 2,83 (s, 3H), 3,23 (t, 2H), 3,28 (s, 3H), 3,53 (t, 2H), 7,33 (d, 1H), 7,66 (d, 1H), 12,38 (s, 1H). M (ESI): 388,2; M+(ESI): 390,2. PXBE (методика A), Rt: 3,27 хв (чистота: 99,9%). Приклад 22: N-[5-(5-{[[2(диметиламіно)етил](етил)аміно]сульфоніл}-2тієніл)-4-метил-1,3-тіазол-2-іл]ацетамід (22) 5-[2-(ацетиламіно)-4-метил-1,3-тіазол-5іл]тіофен-2-сульфонілхлорид, одержаний за методикою Стадії II Прикладу 1 (500 мг; 1,48 ммоль; 1,00 екв.) розчиняють у ДХМ (30 мл). Одержаний розчин знегажують N2 та охолоджують до 0°С. Додають триетиламін (1,0 мл; 7,42 ммоль; 5,00 екв.), а потім N,N-диметил-N'-етилетилендіамін (1,2 мл; 7,42 ммоль; 5,00 екв.). Через 30 хв при 0°С реакція завершується. Одержану реакційну суміш промивають насиченим розчином NаНСО3 (двічі) та водою (двічі). Органічну фазу сушать над MgSO4, фільтрують та концентрують у вакуумі, одержуючи Сполуку (22) у вигляді бежевої твердої речовини (544 мг; 88%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,14 (t, 3H), 2,19 (m, 9H), 2,45 (t, 2H), 2,49 (s, 3H), 3,25 (m, 4H), 7,29 (d, 1Н), 7,67 (d, 1H), 12,37 (s, 1H). M (ESI): 415,2; M+(ESI): 417,3. PXBE (методика A), Rt: 2,35 хв (чистота: 98,6%). Приклад 23: трифторацетат N-{5-[5-({[2(диметиламіно)етил]аміно}-сульфоніл)-3-тієніл]-4метил-1,3-тіазол-2-іл}ацетаміду (23) 92489 54 Стадія І: N-[4-метил-5-(3-тієніл)-1,3-тіазол-2іл]ацетамід У флаконі для мікрохвильової обробки N-(5йод-4-метил-1,3-тіазол-2-іл)ацетамід, Проміжний продукт 1 (564,2 мг; 2 ммоль; 1 екв.), та Pd(dppf)Cl2 (73,2 мг; 0,10 ммоль; 0,05 екв.) суспендують у толуолі (7 мл). Додають розчин фториду калію (464,8 мг; 8 ммоль; 4 екв.) у МеОН (7 мл). Потім додають 3-(4,4,5,5-тетраметил-1,3,2діоксаборолан-2-іл)тіофен (630,3 мг; 3 ммоль; 1,50 екв.) у вигляді твердої речовини. Одержаний розчин продувають аргоном, флакон герметично закривають та нагрівають мікрохвильовим опроміненням при 120°С протягом 15 хв. Реакційну суміш фільтрують через целіт, та розчинники випарюють. Одержаний неочищений продукт розчиняють у EtOAc, промивають водою та розсолом та сушать над MgSO4. Потім його очищають препаративною РХВЕ, одержуючи вказану в заголовку сполуку у вигляді злегка забарвленої твердої речовини (316,7 мг; вихід 66%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,12 (s, 3H), 2,35 (s, 3H), 7,28 (dd, J=1,5 Гц, 4,9 Гц, 1Н), 7,58 (dd, J=1,5 Гц, 3,0 Гц, 1Н), 7,67 (dd, J=3,0 Гц, 4,9 Гц, 1H), 12,09 (s, 1H). M (ESI): 237,03; M+(ESI): 239,03. РХВЕ (методика A), Rt: 2,92 хв (чистота: 99,6%). Стадія II: N-[5-(2-бромтіофен-3-іл)-4метилтіазол-2-іл]-ацетамід N-[4-метил-5-(3-тієніл)-1,3-тіазол-2іл]ацетамід, одержаний на Стадії І, як описано вище (3880 мг; 16,3 ммоль; 1 екв.), розчиняють у ACN (375 мл). Додають N-бромсукцинімід (2898 мг; 16,3 ммоль; 1 екв.), та одержаний розчин перемішують при кімнатній температурі протягом 30 хв. Розчинники випарюють. Додають воду, та бажаний продукт екстрагують EtOAc (тричі). Органічні фази промивають водою (тричі) та сушать над MgSO4, одержуючи вказану в заголовку сполуку (5000 мг; 97%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,06 (s, 3H), 2,13 (s, 3H), 7,11 (s, 1Н), 7,70 (s, 1H), 12,13 (s, 1H). M (ESI): 317,2; M+(ESI): 319,1. РХВЕ (методика A), Rt: 1,27 хв (чистота: 80,7%). Стадія III: 4-[2-(ацетиламіно)-4-метип-1,3тіазол-5-іп]-5-бромтіофен-2-сульфонілхпорид Суміш N-[5-(2-бром-тіофен-3-іл)-4метилтіазол-2-іл]-ацетаміду, одержаного на Стадії II, як описано вище (1100 мг; 3,47 ммоль; 1 екв.), у ДХМ (60 мл) охолоджують до 0°С на льодяній бані. Реакційну суміш знегажують азотом, та додають краплями хлорсульфонову кислоту (1,16 мл; 17,3 ммоль; 5 екв.), розчинену у ДХМ 55 92489 56 (30 мл). Одержану реакційну суміш перемішують при 0°С протягом 15 хв. Додають пентахлорид фосфору (1444 мг; 6,94 ммоль; 2 екв.), та одразу ж оксихлорид фосфору (1,3 мл; 13,9 ммоль; 4 екв.). Реакційну суміш перемішують протягом додаткових 2 год при кімнатній температурі. Після чого одержану реакційну суміш виливають у склянку з подрібненим льодом та негайно переносять у ділильну лійку. Суміш екстрагують двічі EtOAc. Органічний шар сушать над MgSO4, одержуючи вказану в заголовку сполуку (1440 мг; кількісний вихід). Стадія І: N-{5-[2-бром-5-(2-морфолін-4-ілM (ESI): 415,1; M+(ESI): 417,1. РХВЕ (методиетилсульфамоїл)-тіофен-3-іл]-4-метилтіазол-2ка A), Rt: 3,94 хв (чистота: 95,5%). іл}-ацетамід Стадія IV: N-{5-[2-бром-5-(24-[2-(ацетиламіно)-4-метил-1,3-тіазол-5-іл]-5диметиламіноетилсульфамоїл)-тіофен-3-іл]-4бромтіофен-2-сульфонілхлорид, одержаний за метилтіазол-2-іл}-ацетамід методикою Стадії III Прикладу 23 (586 мг; 1,41 4-[2-(ацетиламіно)-4-метил-1,3-тіазол-5-іл]-5ммоль; 1 екв.) розчиняють у безводному ДХМ (15 бромтіофен-2-сульфонілхлорид, одержаний на мл). Реакційну суміш уміщують у атмосферу азоСтадії III, як описано вище (586 мг; 1,41 ммоль; 1 ту. Після чого додають послідовно триетиламін екв.), розчиняють у безводному ДХМ (15 мл). (1,96 мл; 14,1 ммоль; 10 екв.) та 2-морфолін-4-ілРеакційну суміш уміщують у атмосферу азоту. етиламін (367 мг; 2,82 ммоль; 2 екв.), а одержану Послідовно додають триетиламін (1,9 мл; 14,1 реакційну суміш перемішують при кімнатній темммоль; 10 екв.) та N,N-диметил-етан-1,2-діамін пературі протягом 30 хв. Розчинники випарюють, (0,17 мл; 2,82 ммоль; 2 екв.), та одержану реакта неочищений продукт очищають препаративційну суміш перемішують при кімнатній темпераною РХВЕ, одержуючи вказану в заголовку спотурі протягом 30 хв. Розчинники випарюють, а луку (100 мг; 14%). неочищену суміш очищають препаративною M (ESI): 509,4; M+(ESI): 511,3. РХВЕ (методиРХВЕ, одержуючи вказану в заголовку сполуку ка A), Rt: 2,25 хв (чистота: 99,3%). (68 мг; 10%). Стадія II: N-[4-метил-5-(5-{[(2-морфолін-41 H ЯМР (DMSO-d6, 300 МГц) 1,80 (s, 3H), 2 ілетил)аміно]сульфоніл}-3-тієніл)-1,3-тіазол-2(s, 3H), 2,30 (s, 3H), 2,82 (m, J=21 Гц, 4Н), 3,38 (d, іл]ацетамід, трифторацетат (24) J=3 Гц, 4Н), 7,15 (d, J=6 Гц, 1Н), 7,45 (d, J=3 Гц, N-{5-[2-бром-5-(2-морфолін-4-іл+ 1Н), 12,18 (s, 1H) M (ESI): 467,2; M (ESI): 469,2. етилсульфамоїл)-тіофен-3-іл]-4-метилтіазол-2РХВЕ (методика A), Rt: 2,22 хв (чистота: 100%). іл}ацетамід, одержаний на Стадії І, як описано Стадія V: N-{5-[5-({[2вище (100 мг; 0,2 ммоль; 1 екв.), розчиняють у (диметиламіно)етил]аміно}сульфоніл)-3-тієніл]-4безводному THF (12 мл). Одержану реакційну метил-1,3-тіазол-2-іл}ацетамід, трифторацетат суміш охолоджують до -70°С та уміщують у атмо(23) сферу азоту. Додають краплями н-бугиллітій N-{5-[2-бром-5-(2(0,98 мл; 1,6 М; 1,57 ммоль; 8 екв.). Через 15 хв диметиламіноетилсульфамоїл)-тіофен-3-іл]-4реакція завершується, і реакційну суміш гасять метилтіазол-2-іл}-ацетамід (68 мг; 0,15 ммоль; 1 водою. Розчинники випарюють, а неочищений екв.) розчиняють у безводному THF (10 мл). Одепродукт очищають препаративною РХВЕ, одерржану реакційну суміш охолоджують до -70°С та жуючи сіль Сполуки (24) із трифтороцтовою кисуміщують у атмосферу азоту. Додають краплями лотою у вигляді злегка забарвленої твердої рен-бутиллітій (0,73 мл; 1,6 М; 1,16 ммоль; 8 екв.). човини (44 мг; 40%). 1 Через 15 хв при -78°С реакція завершується. Її H ЯМР (DMSO-d6, 300 МГц) 2,14 (s, 1H), гасять водою. Розчинники випарюють, а неочи2,37 (s, 3H), 3,94-3,12 (m, 12H), 7,74 (s, 1H), 7,99 щений продукт очищають препаративною РХВЕ, (s, 1H), 8,26 (s, 1H), 9,72 (s, 1H), 12,17 (s, 1H) M одержуючи сіль Сполуки (23) із трифтороцтовою (ESI): 429,3; M+(ESI): 431,3. РХВЕ (методика A), кислотою у вигляді злегка забарвленого порошку Rt: 1,86 хв (чистота: 98,47%). (34 мг; 46%). Приклад 25: трифторацетат N-[4-метил-5-(51 H ЯМР (DMSO-d6, 300 МГц) 2,14 (s, 3H), {[(2-піперидин-1-ілетил)аміно]сульфоніл}-32,37 (s, 3H), 2,79 (s, 6H), 3,20 (s, 4H), 7,74 (s, 1Н), тієніл)-1,3-тіазол-2-іл]ацетаміду (25) 7,99 (s, 1H), 8,24 (s, 1H), 9,42 (s, 1H), 12,17 (s, + 1H). M (ESI): 387,3; M (ESI): 389,3. РХВЕ (методика A), Rt: 1,80 хв (чистота: 100%). Приклад 24: трифторацетат N-[4-метил-5-(5([(2-морфолін-4-ілетил)аміно]сульфоніл}-3-тієніл)1,3-тіазол-2-іл]ацетаміду (24) 57 Стадія І: N-{5-[2-бром-5-(2-піперидин-1-ілетилсульфамоїл)-тіофен-3-іл]-4-метилтіазол-2іл}ацетамід 4-[2-(ацетиламіно)-4-метил-1,3-тіазол-5-іл]-5бромтіофен-2-сульфонілхлорид, одержаний за методикою Стадії III Прикладу 23 (200 мг; 0,48 ммоль; 1 екв.), розчиняють у безводному ДХМ (10 мл). Одержану реакційну суміш охолоджують до 0°С та уміщують у атмосферу азоту. Додають послідовно триетиламін (0,4 мл; 2,88 ммоль; 6 екв.) та 2-піперидин-1-іл-етиламін (0,16 мл; 1,16 ммоль; 2,4 екв.), та одержану реакційну суміш перемішують при 0°С протягом 2 год. Цю суміш промивають водою, NaHCO3, та сушать над MgSO4, одержуючи вказану в заголовку сполуку (170 мг; 68%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,80 (s, 3H), 2 (s, 3H), 2,30 (s, 3H), 2,82 (m, J=21 Гц, 4Н), 3,38 (d, J=3 Гц, 4Н), 7,15 (d, J=6 Гц, 1Н), 7,45 (d, J=3 Гц, 1Н), 12,18 (s, 1H) M (ESI): 401,2; M+(ESI): 403,3. PXBE (методика A), Rt: 2,10 хв (чистота: 94,4%). Стадія II: N-[4-метил-5-(5-{[(2-піперидин-1ілетил)аміно]сульфоніл}-3-тієніл)-1,3-тіазол-2іл]ацетамід, трифторацетат (25) N-{5-[2-бром-5-(2-піперидин-1-ілетилсульфамоїл)-тіофен-3-іл]-4-метилтіазол-2іл}-ацетамід, одержаний на Стадії І, як описано вище (170 мг; 0,33 ммоль; 1 екв.), розчиняють у безводному THF (50 мл). Одержану реакційну суміш охолоджують до -70°С та уміщують у атмосферу азоту. Додають краплями н-бутиллітій (1,67 мл; 1,6 М; 2,68 ммоль; 8 екв.). Через 30 хв реакція завершується, і реакційну суміш гасять водою. Розчинники випарюють, та неочищену суміш очищають препаративною РХВЕ, одержуючи сіль Сполуки (25) із трифтороцтовою кислотою у вигляді злегка забарвленої твердої речовини (10 мг; 5%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,64-1,77 (m, 6Η), 2,14 (s, 3H), 2,38 (s, 3H), 2,88-2,92 (q, 2Н), 3,17-3,25 (m, 4H), 3,42-3,46 (d, J=6 Гц, 2Н), 7,73 (s, 1H), 7,99 (s, 1H), 8,24 (s, 1Н), 9,08 (s, 1H), 12,17 (s, 1H) M (ESI): 427,4; M+(ESI): 429,5. PXBE (методика A), Rt: 2,11 хв (чистота: 93,5%). Приклад 26: трифторацетат N-{4-метил-5-[5(піперазин-1-ілсульфоніл)-3-тієніл]-1,3-тіазол-2іл}ацетаміду (26) 92489 58 Стадія І: трет-бутиловий складний ефір 4-[4(2-ацетиламіно-4-метилтіазол-5-іл)-5-бромтіофен-2-сульфоніл]-піперазин-1-карбонової кислоти 4-[2-(ацетиламіно)-4-метил-1,3-тіазол-5-іл]-5бромтіофен-2-сульфонілхлорид, одержаний за методикою Стадії III Прикладу 23 (400 мг; 0,96 ммоль; 1 екв.), розчиняють у безводному ДХМ (20 мл). Одержаний розчин охолоджують до 0°С та уміщують у атмосферу азоту. Послідовно додають триетиламін (0,54 мл; 1,92 ммоль; 4 екв.) та 1-Вос-піперазин (358,4 мг; 1,92 ммоль; 2 екв.), та одержану реакційну суміш перемішують при 0°С протягом 1 год. Реакційну суміш промивають водою, NaHCO3 та сушать над MgSO4, одержуючи вказану в заголовку сполуку (440 мг; 76%). M (ESI): 565,3; M+(ESI): 567,2. PXBE (методика A), Rt: 4,16 хв (чистота: 93,91%). Стадія II: N-{4-метил-5-[5-(піперазин-1ілсульфоніл)-3-тієніл]-1,3-тіазол-2-іл}ацетамід, трифторацетат (26) Трет-бутиловий складний ефір 4-[4-(2ацетиламіно-4-метилтіазол-5-іл)-5-бром-тіофен2-сульфоніл]піперазин-1-карбонової кислоти, одержаний на Стадії І, як описано вище (440 мг; 0,78 ммоль; 1 екв.), розчиняють у безводному THF (50 мл). Одержану реакційну суміш охолоджують до -70°С та уміщують у атмосферу азоту. Додають краплями н-бутиллітій (3,9 мл; 1,6 М; 6,22 ммоль; 8 екв.). Через 1 год реакція завершується, і реакційну суміш гасять водою. Розчинники випарюють, а неочищений продукт очищають препаративною РХВЕ. При випарюванні фракцій у присутності TFA відбувається відщеплення групи захисту Вос. Виділений продукт суспендують у діетиловому ефірі, одержуючи сіль Сполуки (26) із трифтороцтовою кислотою у вигляді злегка забарвленої твердої речовини (25 мг; 6%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,15 (s, 3H), 2,40 (s, 3H), 3,11 (s, 8H), 7,85 (s, 1Н), 8,15 (s, 1H), 8,61 (s, 1H), 12,20 (s, 1H). M (ESI): 385,3; M+(ESI): 387,3. PXBE (методика A), Rt: 1,98 хв (чистота: 100%). Приклад 27: N-{5-[5-({[3(димeтилaмiнo)пpoпіл]aмiнo}cyльфoнiл)-3-тiєнiл]4-метил-1,3-тіазол-2-іл}ацетамід (27) 59 Стадія І: N-{5-[2-бром-5-(3диметиламінопропілсульфамоїл)тіофен-3-іл]-4метилтіазол-2-іл}-ацетамід 4-[2-(ацетиламіно)-4-метил-1,3-тіазол-5-іл]-5бромтіофен-2-сульфонілхлорид, одержаний за методикою Стадії III Прикладу 23 (200 мг; 0,48 ммоль; 1 екв.), розчиняють у безводному ДХМ (10 мл). Одержану реакційну суміш охолоджують до 0°С та уміщують у атмосферу азоту. Послідовно додають триетиламін (0,33 мл; 2,41 ммоль; 5 екв.) та N,N-диметил-1,3-пропандіамін (0,3 мл; 2,41 ммоль; 5 екв.), та одержану реакційну суміш перемішують при 0°С протягом 1 год. Потім її промивають водою, NaHCO3, та сушать над MgSO4, одержуючи вказану в заголовку сполуку (200 мг; 86%). M (ESI): 481,3; M+(ESI): 483,3. PXBE (методика A), Rt: 2,30 хв (чистота: 100%). Стадія II: N-{5-[5-({[3(диметиламіно)пропіл]аміно}сульфоніл)-3-тієніл]4-метил-1,3-тіазол-2-іл}ацетамід (27) N-{5-[2-бром-5-(3-диметиламінопропілсульфамоїл)-тіофен-3-іл]-4-метилтіазол-2іл}-ацетамід, одержаний на Стадії І, як описано вище (200 мг; 0,42 ммоль; 1 екв.), розчиняють у безводному THF (50 мл). Одержану реакційну суміш охолоджують до -70°С та уміщують у атмосферу азоту. Додають краплями н-бутиллітій (2,1 мл; 1,6 М; 3,32 ммоль; 8 екв.). Через 2,5 год реакція завершується, і реакційну суміш гасять водою. Розчинники випарюють, а одержану суміш очищають препаративною РХВЕ, одержуючи Сполуку (27) у вигляді коричневого масла (120 мг; 68%). 1 H ЯМР (DMSO-d6, 300 МГц) 2,13 (s, 3H), 2,37 (s, 3H), 2,72 (d, J=3 Гц, 6H), 3,46-3,58 (m, 6H), 7,68 (s, 1Н), 7,95 (s, 1H), 8,05-8,09 (t, J=6 Гц, 1Н), 9,90 (s, 1H), 12,16 (s, 1H) M (ESI): 401,3; M+(ESI): 403,3. РХВЕ (методика A), Rt: 1,88 хв (чистота: 94,3%). Приклад 28: гідрохлорид N-[4-метил-5-(5-{[(1метилпіперидин-4-іл)-аміно]сульфоніл}-3-тієніл)1,3-тіазол-2-іл]ацетаміду (28) 92489 60 Стадія І: N-{5-[2-бром-5-(1-метил-піперидин4-ілсульфамоїл)-тіофен-3-іл]-4-метилтіазол-2іл}ацетамід 4-[2-(ацетиламіно)-4-метил-1,3-тіазол-5-іл]-5бромтіофен-2-сульфонілхлорид, одержаний за методикою Стадії III Прикладу 23 (200 мг; 0,48 ммоль; 1 екв.), розчиняють у безводному ДХМ (10 мл). Одержану реакційну суміш охолоджують до 0°С та уміщують у атмосферу азоту. Послідовно додають триетиламін (0,27 мл; 1,92 ммоль; 4 екв.) та 1-метил-піперидин-4-іламін (0,11 мл; 0,96 ммоль; 2 екв.), і одержану реакційну суміш перемішують при 0°С протягом 40 хв. Потім її промивають водою, NaHCO3 та сушать над MgSO4, одержуючи вказану в заголовку сполуку (185 мг; 74%). M (ESI): 493,2; M+(ESI): 495,3. РХВЕ (методика A), Rt: 2,32 хв (чистота: 95,5%). Стадія II: N-[4-метил-5-(5-{[(1метилпіперидин-4-іл)аміно]сульфоніл}-3-тієніл)1,3-тіазол-2-іл]ацетамід, гідрохлорид (28) N-{5-[2-бром-5-(1-метил-піперидин-4ілсульфамоїл)тіофен-3-іл]-4-метилтіазол-2іл}ацетамід, одержаний на Стадії І, як описано вище (185 мг; 0,37 ммоль; 1 екв.), розчиняють у безводному THF (50 мл). Одержану реакційну суміш охолоджують до -70°С та уміщують у атмосферу азоту. Додають краплями н-бутиллітій (1,87 мл; 1,6 М; 3 ммоль; 8 екв.). Через 2,5 год реакція завершується, і реакційну суміш гасять водою. Розчинники випарюють, а одержаний неочищений продукт очищають препаративною РХВЕ. Фракції, що містять чистий бажаний продукт концентрують, нейтралізують NaHCO3 та екстрагують EtOAc. Органічну фазу сушать над MgSO4 та випарюють. Одержаний продукт (59,7 мг) розчиняють у МеОН та додають 1,25М розчин HCl у МеОН (115 мл). Після випарювання розчинників виділяють гідрохлорид Сполуки (28) у вигляді бежевої твердої речовини (65 мг; 37%). 1 H ЯМР (DMSO-d6, 300 МГц) 1,75-1,80 (m, 5H), 2,15 (s, 3H), 2,38 (s, 3H), 2,61 (d, 3H), 2,903,40 (m, 4H), 7,70 (s, 1Н), 7,95 (s, 1H), 8,35 (d, 1H), 12,25 (s, 1H). M (ESI): 413,3; M+(ESI): 415,4. PXBE (методика A), Rt: 1,89 хв (чистота: 95,5%). Приклад 29: N-(4-метил-5-{5-[(4метилпіперазин-1-іл)сульфоніл]-3-тієніл}-1,3тіазол-2-іл)ацетамід (29)
ДивитисяДодаткова інформація
Назва патенту англійськоюThiazole derivatives and use thereof
Автори англійськоюCovini David, Quattropani Anna, Pomel Vincent, Dorbais Jerome, Rueckle Thomas
Назва патенту російськоюПроизводные тиазола и их применение
Автори російськоюКовини Дейвид, Куаттропани Анна, Помель Венсан, Добре Жером, Рюкле Томас
МПК / Мітки
МПК: A61K 31/427, A61P 37/00, A61P 25/00, C07D 417/04, A61P 31/00
Мітки: застосування, похідні, тіазолу
Код посилання
<a href="https://ua.patents.su/42-92489-pokhidni-tiazolu-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні тіазолу та їх застосування</a>
Попередній патент: Заміщені індоли, що мають активність інгібування nos
Наступний патент: Імідазохіноліни як інгібітори ліпідкінази
Випадковий патент: Розсадосадильна машина












