Похідне акрилонітрилу та його застосування як інгібітору bcrp/abcg2
Номер патенту: 105162
Опубліковано: 25.04.2014
Автори: Нісіяма Йукіко, Сугімото Йосіказу, Фурута Томіо, Хасімото Сусуке, Йосіда Ох, Хатано Хіросі, Аійама Ріцуо, Нагаока Масато, Мацузакі Такесі, Ямазакі Ріута
Формула / Реферат
1. Застосування похідного акрилонітрилу, представленого формулою (1):
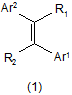 (Е або Z),
(Е або Z),
де один з R1 і R2 означає ціаногрупу, і інший означає атом водню;
Ar1 означає групу, вибрану з груп, представлених формулами (2)-(4):
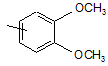 ,
,
 ,
,
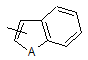 ,
,
(2)
(3)
(4)
де R7 і R8, які можуть бути однаковими або різними, кожний, означають атом водню, атом галогену або С1-6алкоксигрупу;
А означає атом кисню, атом сірки або NR9; і
R9 означає атом водню або С1-6алкільну групу;
Ar2 означає групу, вибрану з груп, представлених формулами (5)-(15):
![]() ,
,
![]() ,
,
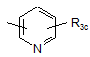 ,
,
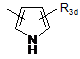 ,
,
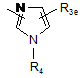 ,
,
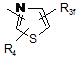 ,
,
(5)
(6)
(7)
(8)
(9)
(10)
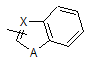 ,
,
 ,
,
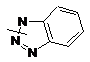 ,
,
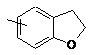 ,
,
![]() ,
,
(11)
(12)
(13)
(14)
(15)
де R3 означає атом водню, атом кисню (у вигляді N-оксиду), С1-6алкільну групу, С1-6алкоксигрупу, атом галогену, нітрогрупу, метилсульфанільну групу, С1-6гідроксіалкільну групу, фенільну групу, яка може містити нітро- або аміногрупу як замісник, або NR5(R6);
R5 і R6, які можуть бути однаковими або різними, кожний, означають атом водню, С1-6алкільну групу, яка може містити С1-6алкіламіногрупу або ді(С1-6алкіл)аміногрупу як замісник, С1-6гідроксіалкільну групу або фенільну групу, яка може містити нітро- або аміногрупу як замісник, або гетероциклічну групу, де гетероциклічна група являє собою піперазинільну групу, піперидиногрупу, морфоліногрупу, імідазольну групу або піролідинільну групу; R5 і R6 можуть утворювати разом з сусіднім атомом азоту гетероциклічне кільце, яке може містити гідроксильну групу, С1-6алкільну групу або С1-6гідроксіалкільну групу як замісник, де гетероциклічне кільце являє собою піридин, піперазин, піперидин, піримідин, морфолін, індол, бензімідазол, бензпіразол, хінолін, імідазол або піролідин; і гідроксильна група С1-6гідроксіалкільної групи або гетероциклічне кільце, яке може бути заміщене гідроксильною групою або С1-6гідроксіалкільною групою, можуть утворювати складноефірний зв’язок з групою фосфорної кислоти або її сіллю, або з С1-8алканоїльною групою, яка може містити як замісник ді(С1-6алкіл)аміногрупу, фенілкарбамоїльну групу, яка може містити як замісник С1-6алкіламіногрупу або ді(С1-6алкіл)аміногрупу, N-(С1-6алкіл)карбамоїльну групу, N,N-ді(С1-6алкіл)карбамоїльну групу, N-піперидинкарбамоїльну групу, яка може містити піролідин, піперидин або піперазин як замісник, або 4-піперидинопіперидин-1-ільну групу;
R4 означає атом водню, С1-6алкільну групу, фенільну групу, яка може містити галоген або С1-6алкоксигрупу як замісник, або бензильну групу;
Х означає атом вуглецю, CH або атом азоту, за умови, що, коли А означає атом кисню, Х не може бути атомом азоту; і
A, R7, R8 і R9 мають значення, визначені вище; або його солі як інгібітору BCRP.
2. Застосування похідного акрилонітрилу формули (1) або його солі, описаних в п. 1, як агента для усунення резистентності до протиракового агента, опосередкованої BCRP, або агента для потенціювання протиракового ефекту агента при раку, який характеризується наявністю набутої лікарської резистентності, опосередкованої BCRP.
3. Застосування похідного акрилонітрилу або його солі, описаних в п. 1, для одержання інгібітору BCRP як агента для усунення резистентності до протиракового агента, опосередкованої BCRP, або агента для потенціювання протиракового ефекту агента, де рак характеризується наявністю набутої лікарської резистентності, опосередкованої участю BCRP.
4. Застосування похідного акрилонітрилу або його солі, представлених формулою (1а):
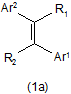 (Е або Z),
(Е або Z),
де один з R1 і R2 означає ціаногрупу і інший означає атом водню;
Ar1 означає групу, вибрану з груп, представлених формулами (2)-(4):
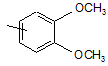 ,
,
 ,
,
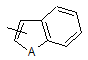 ,
,
(2)
(3)
(4)
де R7 і R8, які можуть бути однаковими або різними, кожний, означають атом водню, атом галогену або С1-6алкоксигрупу;
А означає атом кисню, атом сірки або NR9; і
R9 означає атом водню або С1-6алкільну групу;
Ar2 означає групу, вибрану з груп, представлених формулами (5)-(15):
![]() ,
,
![]() ,
,
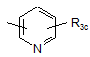 ,
,
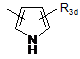 ,
,
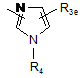 ,
,
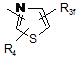 ,
,
(5)
(6)
(7)
(8)
(9)
(10)
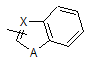 ,
,
 ,
,
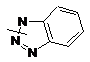 ,
,
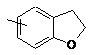 ,
,
![]() ,
,
(11)
(12)
(13)
(14)
(15)
де R3а означає атом водню (Ar1 означає групу, представлену формулою (3) або (4)), С1-6алкільну групу, С1-6алкоксигрупу, атом галогену, нітрогрупу, метилсульфанільну групу, С1-6гідроксіалкільну групу або фенільну групу, яка може бути заміщена нітрогрупою або аміногрупою, або NR5(R6);
R3b означає атом водню, С1-6алкільну групу, С1-6алкоксигрупу, атом галогену, нітрогрупу, метилсульфанільну групу, С1-6гідроксіалкільну групу, фенільну групу, яка може бути заміщена аміногрупою, або NR5(R6);
R3с означає атом водню (Ar1 означає групу, представлену формулою (3) або (4)), атом кисню (у вигляді N-оксиду), С1-6алкільну групу, С1-6алкоксигрупу, атом галогену, нітрогрупу, метилсульфанільну групу, С1-6гідроксіалкільну групу, фенільну групу, яка може бути заміщена нітрогрупою або аміногрупою, або NR5(R6);
кожний з R3d, R3e і R3f означає атом водню, атом кисню (у вигляді N-оксиду), С1-6алкільну групу, С1-6алкоксигрупу, атом галогену, нітрогрупу, метилсульфанільну групу, С1-6гідроксіалкільну групу, фенільну групу, яка може бути заміщена аміногрупою, або NR5(R6);
R5 і R6, які можуть бути однаковими або різними, кожний, означають атом водню, С1-6алкільну групу, яка може містити С1-6алкіламіногрупу або ді(С1-6алкіл)аміногрупу як замісник, С1-6гідроксіалкільну групу або фенільну групу, яка може містити нітро- або аміногрупу як замісник, або гетероциклічну групу, де гетероциклічна група являє собою піперазинільну групу, піперидиногрупу, морфоліногрупу, імідазольну групу або піролідинільну групу; R5 і R6 можуть утворювати разом з сусіднім атомом азоту гетероциклічне кільце, яке може містити гідроксильну групу, С1-6алкільну групу або С1-6гідроксіалкільну групу як замісник, де гетероциклічне кільце являє собою піридин, піперазин, піперидин, піримідин, морфолін, індол, бензімідазол, бензпіразол, хінолін, імідазол або піролідин; і гідроксильна група С1-6гідроксіалкільної групи або гетероциклічне кільце, яке може бути заміщене гідроксильною групою або С1-6гідроксіалкільною групою, можуть утворювати складноефірний зв’язок з групою фосфорної кислоти або її сіллю, або з С1-8алканоїльною групою, яка може містити як замісник ді(С1-6алкіл)аміногрупу, фенілкарбамоїльну групу, яка може містити С1-6алкіламіно групу або ді(С1-6алкіл)аміногрупу як замісник, N-(С1-6алкіл)карбамоїльну групу, N,N-ді(С1-6алкіл)карбамоїльну групу, N-піперидинкарбамоїльну групу, яка може містити піролідин, піперидин або піперазин як замісник, або 4-піперидинопіперидин-1-ільну групу;
R4 означає атом водню, С1-6алкільну групу, фенільну групу, яка може містити галоген або С1-6алкоксигрупу як замісник, або бензильну групу;
Х означає атом вуглецю, CH або атом азоту, за умови, що, коли А означає атом кисню, Х не може бути атомом азоту; і
A, R7, R8 і R9 мають значення, визначені вище, як інгібітору BCRP.
5. Застосування похідного акрилонітрилу формули (1) або його солі, вибраного з:
(Z)-2-(3,4-диметоксифеніл)-3-піридин-4-ілакрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-піридин-3-ілакрилонітрилу,
(Z)-3-(3,4-диметоксифеніл)-2-піридин-3-ілакрилонітрилу,
(Z)-3-(3,4-диметоксифеніл)-2-піридин-2-ілакрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-піридин-2-ілакрилонітрилу,
(Е)-3-(3,4-диметоксифеніл)-2-тіофен-2-ілакрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-хінолін-4-ілакрилонітрилу,
(Е)-2-бензотриазол-1-іл-3-(3,4-диметоксифеніл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-хінолін-2-ілакрилонітрилу,
(Z)-2-піридин-3-іл-3-хінолін-4-ілакрилонітрилу,
(Е)-3-бензо[b]тіофен-3-іл-2-тіофен-2-ілакрилонітрилу,
(Z)-3-бензофуран-2-іл-2-(3,4-диметоксифеніл)акрилонітрилу,
як інгібітору BCRP.
6. Застосування похідного акрилонітрилу або його солі, описаних в п. 4 або 5, як агента для усунення резистентності до протиракового агента, опосередкованої BCRP, або агента для потенціювання протиракового ефекту при раку, що характеризується наявністю набутої лікарської резистентності, опосередкованої BCRP.
7. Застосування похідного акрилонітрилу або його солі, описаних в п. 4 або 5, для одержання інгібітору BCRP як агента для усунення резистентності до протиракового агента, опосередкованої BCRP, або агента для потенціювання протиракового ефекту агента відносно раку, що має набуту лікарську резистентність, опосередковану BCRP.
8. Похідне акрилонітрилу або його сіль, вибрані з:
(Z)-2-(3,4-диметоксифеніл)-3-(5-нітротіофен-2-іл)акрилонітрилу,
(Z)-3-(5-бромтіофен-2-іл)-2-(3,4-диметоксифеніл)акрилонітрилу,
(Z)-3-(5-амінотіофен-2-іл)-2-(3,4-диметоксифеніл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-(5-піперидин-1-ілтіофен-2-іл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-(5-морфолін-4-ілтіофен-2-іл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-[5-(4-гідроксипіперидин-1-іл)-тіофен-2-іл]акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-{5-[(2-гідроксіетил)метиламіно]тіофен-2-іл}акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-[5-(4-метилпіперазин-1-іл)тіофен-2-іл]акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-{5-[4-(2-гідроксіетил)піперазин-1-іл]тіофен-2-іл}акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-{5-[(2-диметиламіноетил)метиламіно]тіофен-2-іл}акрилонітрилу,
моно(1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл}піперидин-4-іл)фосфату,
моно(1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл}піперидин-4-іл)сукцинату,
(Z)-2-(3,4-диметоксифеніл)-3-(5-нітрофуран-2-іл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-(5-гідроксиметилфуран-2-іл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-[5-(3-нітрофеніл)фуран-2-іл]акрилонітрилу,
(Z)-3-[5-(3-амінофеніл)фуран-2-іл]-2-(3,4-диметоксифеніл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-(5-піперидин-1-ілфуран-2-іл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-(5-морфолін-4-ілфуран-2-іл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-[5-(4-гідроксипіперидин-1-іл)фуран-2-іл]акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-[5-(4-метилпіперазин-1-іл)фуран-2-іл]акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-{5-[4-(2-гідроксіетил)піперазин-1-іл]фуран-2-іл}акрилонітрилу,
N-оксиду (Z)-2-(3,4-диметоксифеніл)-3-піридин-4-ілакрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-(6-метоксипіридин-3-іл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-(1Н-пірол-2-іл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-(3Н-імідазол-4-іл)акрилонітрилу,
(Z)-3-(3-бензил-2-метилсульфаніл-3Н-імідазол-4-іл)-2-(3,4-диметоксифеніл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-(4-метил-2-фенілтіазол-5-іл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-{5-[(2-диметиламіноетил)метиламіно]фуран-2-іл}акрилонітрилу,
моно(1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]фуран-2-іл}піперидин-4-іл)сукцинату,
моно(1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]фуран-2-іл}піперидин-4-іл)фосфату,
(Z)-3-(5-бромфуран-2-іл)-2-(3,4-диметоксифеніл)акрилонітрилу,
(Z)-3-(3,4-диметоксифеніл)-2-тіофен-3-ілакрилонітрилу,
1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4-іл-N-(2-діетиламіноетил)сукцинамату,
1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4-іл-N-(3-діетиламінопропіл)сукцинамату,
1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4-ілдиметиламіноацетату,
1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4-іл-[1,4']біпіперидиніл-1'-карбоксилату,
1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4-іл-4-[1,4']біпіперидиніл-1'-іл-4-оксобутилату,
(Z)-3-бензо[b]тіофен-3-іл-2-(3,4-диметоксифеніл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-(1-метил-1Н-бензімідазол-2-іл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-(1-метил-1Н-індол-3-іл)акрилонітрилу,
(Z)-3-(2-хлорхінолін-3-іл)-2-(3,4-диметоксифеніл)акрилонітрилу,
(Z)-2-бензофуран-3-іл-3-(3,4-диметоксифеніл)акрилонітрилу,
(Z)-3-(2-хлор-6-метоксихінолін-3-іл)-2-(3,4-диметоксифеніл)акрилонітрилу,
(Е)-2-бензотіазол-2-іл-3-(3,4-диметоксифеніл)акрилонітрилу,
(Z)-3-(2,3-дигідробензофуран-5-іл)-2-(3,4-диметоксифеніл)акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-[5-(4-фторфеніл)ізоксазол-3-іл]акрилонітрилу,
(Z)-2-(3,4-диметоксифеніл)-3-[5-(4-метоксифеніл)ізоксазол-3-іл]акрилонітрилу,
(Z)-3-(2-хлор-6-метоксихінолін-3-іл)-2-піридин-2-ілакрилонітрилу,
(Z)-3-(2-хлор-6-метоксихінолін-3-іл)-2-піридин-3-ілакрилонітрилу,
(Е)-3-(2-хлор-6-метоксихінолін-3-іл)-2-тіофен-2-ілакрилонітрилу,
(Z)-3-(2-хлор-6-метоксихінолін-3-іл)-2-тіофен-3-ілакрилонітрилу,
(Е)-2-бензотриазол-1-іл-3-(2-хлор-6-метоксихінолін-3-іл)акрилонітрилу,
(Е)-2-бензотіазол-2-іл-3-(2-хлор-6-метоксихінолін-3-іл)акрилонітрилу,
(Z)-2-піридин-2-іл-3-хінолін-4-ілакрилонітрилу,
(Е)-3-хінолін-4-іл-2-тіофен-2-ілакрилонітрилу,
(Z)-3-хінолін-4-іл-2-тіофен-3-ілакрилонітрилу,
(Е)-3-бензо[b]тіофен-3-іл-2-бензотіазол-2-ілакрилонітрилу,
(Z)-3-бензофуран-2-іл-2-бензофуран-3-ілакрилонітрилу,
(Е)-2-бензотіазол-2-іл-3-(1-метил-1Н-індол-3-іл)акрилонітрилу,
1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4-ілдіетиламіноацетату,
1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4-ілдіетилкарбамату,
1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4-іл-N-(2-діетиламіноетил)-N-метилсукцинамату і
1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4-іл-N-(4-діетиламінофеніл)сукцинамату.
9. Лікарський засіб, який містить як активний інгредієнт сполуку або її сіль за п. 8.
10. Фармацевтична композиція, яка містить сполуку або її сіль за п. 8 і фармацевтично прийнятний носій.
11. Застосування сполуки або її солі за п. 8 для одержання лікарського засобу.
Текст
Реферат: Описаний інгібітор білка, що визначає резистентність при раку молочної залози (BCRP/ABCG2). Інгібітор BCRP включає як активний інгредієнт похідне акрилонітрилу, представлене загальною формулою (1), або його сіль: (1) (Е або Z), де один з R1 і R2 означає ціаногрупу, та інший 1 означає атом водню; Аr означає групу, вибрану з груп, представлених формулами (2)-(4), 2 наведеними нижче; і Аr означає ароматичну вуглеводневу групу, яка містить конденсоване кільце, необов'язково заміщене атомом галогену або групою, вибраною з груп, представлених формулами (5)-(15), наведеними нижче. Ar2 R1 R2 Ar1 (1) (Е або Z), OCH3 OCH3 R7 N R8 , (2) A , (3) S O , (5) (6) N , (7) A , R8 N (12) , (8) R4 N (13) R4 S , , (9) (10) N O R4 N , R3f N N N H , R3e N R3d R3c R7 X (11) (4) R3b R3a , N O , (14) . , (15) UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується інгібітору білка, що визначає резистентність при раку молочної залози (BCRP/ABCG2). Серйозні проблеми, асоційовані з протираковою хіміотерапією, включають властиву їй резистентність до протиракового агента, яка в значній мірі знижує ефект протиракового агента з моменту початку протиракової терапії і приводить до розвитку набутої резистентності до протиракового агента (тобто до зниження ефекту лікарського препарату, яке викликається його тривалим безперервним введенням). В ході вивчення досліджувались можливості подолання такої резистентності до протиракових агентів, з метою підвищення ефекту протиракової хіміотерапії, що проводиться, і були зроблені спроби зрозуміти різні механізми резистентності. Зокрема, експресія транспортера лікарського препарату, який активно переносить протираковий агент за межі ракових клітин, знижуючи, таким чином, рівень внутрішньоклітинної акумуляції лікарського препарату, грає, як вважається, важливу роль в розвитку такого роду механізму резистентності. Зокрема, П-глікопротеїн, який являє собою транспортер лікарського засобу, відкритий в 1970-х роках, і який кодується геном MDR1, розглядається як потужна молекула-мішень для агента, на основі якого можна подолати резистентність до множинних лікарських препаратів, оскільки даний білок викликає перехресну резистентність до множини протиракових агентів, що мають різні хімічні структури і механізми дії. Однак поступово з'ясувалось, що механізм резистентності до протиракового агента не може бути пояснений на основі аналізу одного тільки П-глікопротеїну, таким чином, виникла потреба в розробці агента, здатного подолати резистентність, мішенню якого буде інший транспортер лікарського засобу. При такій постановці питання, в 1998 році був відкритий білок, що визначає резистентність при раку молочної залози (BCRP, також названий ABCG2, MXR або ABCP), який являє собою транспортер лікарського засобу, що належить до групи, названої "суперсімейство транспортера касети зв'язування з АТФ (ABC)", до якої також належить П-глікопротеїн (див. не патентний документ 1). BCRP має структуру, що включає всього одну касету зв'язування з АФТ, що відрізняє її від структури у випадку П-глікопротеїну або іншого ABC транспортера, що містить дві касети зв'язування з АТФ. BCRP залучається до механізму резистентності до інгібітору топоізомерази I (наприклад, до гідрохлориду іринотекану (CPT-11) або топотекану), до інгібітору топоізомерази II (наприклад, до мітоксантрону) або до терапевтичного засобу, діючого на певну молекулу (наприклад, до гефітинібу та іматинібу). У той же час, було показано, що BCRP демонструє субстратну специфічність, яка відрізняється від субстратної специфічності Пглікопротеїну, оскільки BCRP не діє, наприклад, на паклітаксел або вінкристин, які екскретуються П-глікопротеїном, і BCRP залучається до екскреції похідного камптотецину (наприклад, СРТ-11 або 7-етил-10-гідроксикамптотецин (SN-38: активний метаболіт CPT-11), який рідко екскретується у внутрішньоклітинний простір П-глікопротеїном (див. не патентний документ 2). Крім того, було зроблене припущення, що BCRP залучається до процесу обмеження біодоступності протиракового агента, що вводиться перорально (див. не патентний документ 3). У зв'язку з вищесказаним, виникла потреба в розробці інгібітору BCRP, здатного демонструвати ефект в напрямі подолання резистентності до протиракового агента, яку не вдається подолати традиційними агентами, направленими на усунення резистентності, і для підвищення біодоступності протиракового агента. У зв'язку з цим, в даній роботі, з метою подолання резистентності до протиракових агентів, була розроблена множина інгібіторів П-глікопротеїну. Тоді як, навпаки, є тільки декілька звітів за результатами дослідження інгібіторів BCRP, і виявлена інгібуюча дія не була задовільною. У зв'язку з цим, робились безперервні спроби розробити більш ефективні інгібітори BCRP. Приклади відомих за літературним повідомленнями сполук, що демонструють інгібуючу дію у відношенні BCRP, включають: похідне FTC (фумітреморгін С) (див. не патентний документ 4), естроген і антиестроген (див. не патентний документ 5) і новобіоцин (див. не патентний документ 6). Автори даного винаходу також виявили, що флавоноїд (див. патентний документ 1) і похідне дифенілакрилонітрилу (див. патентний документ 2) володіють потужною активністю з інгібування BCRP. При цьому що стосується похідних акрилонітрилів, які містять гетероциклічне кільце, є повідомлення про протираковий агент, що активується CYP1B1 (див. патентний документ 3) та інгібітором 12-ліпоксигенази (патентний документ 4). Однак не знайдено повідомлень про похідне акрилонітрилу, що містить гетероциклічне кільце, яке може служити інгібітором BCRP, виконуючи функцію агента для подолання резистентності до протиракового агента, і агента для потенціювання ефекту протиракового агента. Патентний документ 1: WO 2004/069233 Патентний документ 2: WO 2004/069243 1 UA 105162 C2 5 10 15 Патентний документ 3: WO 99/40056 Патентний документ 4: JP-A-7-48336 Не патентний документ 1: Proc. Natl. Acad. Sci. USA, 1998, 95: 15665-15670 Не патентний документ 2: Cancer Res., 1999, 59: 5938-5946 Не патентний документ 3: J. Clin. Oncol., 2002, 20: 2943-2950 Не патентний документ 4: Mol. Cancer Ther., 2002, 1: 417-425 Не патентний документ 5: Mol. Cancer Ther., 2003, 2: 105-112 Не патентний документ 6: Int. J. Cancer, 2004, 108: 146-151 Задачею даного винаходу є розробка лікарського засобу для інгібування білка, який визначає резистентність при раку молочної залози (BCRP). У спробі вирішити вказані вище проблеми, автори даного винаходу провели скринінг сполук з використанням ракових клітин, які володіють набутою резистентністю, опосередкованою експресією BCRP, і виявили, що похідні акрилонітрилу, представлені наведеною нижче формулою (1), демонструють потужну BCRP-інгібуючу дію. Також було виявлено, що вказані похідні акрилонітрилу, що демонструють BCRP-інгібуючу дію, включають нові сполуки. Даний винахід оснований на вказаних відкриттях. Відповідно, даний винахід стосується інгібітору BCRP, що включає як активний інгредієнт похідне акрилонітрилу, представлене формулою (1): 20 [де один з R1 і R2 означає ціаногрупу, та інший означає атом водню; 1 Ar означає групу, вибрану з груп, представлених формулами (2)-(4): 25 30 (де R7 і R8, які можуть бути однаковими або різними, кожний, означає атом водню, атом галогену або нижчу алкоксигрупу; А означає атом кисню, атом сірки або NR 9; і R9 означає атом водню або нижчу алкільну групу; 2 Ar означає ароматичну вуглеводневу групу, що містить конденсоване кільце, яке може бути заміщене атомом галогену, або групу, вибрану з груп, представлених формулами (5)-(15): 35 (де R3 означає атом водню, атом кисню (у вигляді N-оксиду), нижчу алкільну групу, нижчу алкоксигрупу, атом галогену, нітрогрупу, метилсульфанільну групу, нижчу гідроксіалкільну групу, ароматичну вуглеводневу групу, яка може мати замісник, або NR 5(R6); 2 UA 105162 C2 5 10 15 20 25 R5 і R6, які можуть бути однаковими або різними, кожний, означає атом водню, нижчу алкільну групу, яка може містити замісник, нижчу гідроксіалкільну групу або ароматичну вуглеводневу групу, яка може мати замісник, або гетероциклічну групу; R 5 і R6 можуть утворювати, разом з сусіднім атомом азоту, гетероциклічне кільце, яке може містити замісник; і де гідроксильна група в нижчій гідроксіалкільній групі або гетероциклічне кільце, заміщене гідроксильною групою або нижчою гідроксіалкільною групою, можуть утворювати складноефірний зв'язок з групою фосфорної кислоти або її сіллю, або з ацильною групою, яка може містити замісник; R4 означає атом водню, нижчу алкільну групу, фенільну групу, яка може містити замісник, або бензильну групу; Х означає атом вуглецю, CH або атом азоту, за умови, що коли А означає атом кисню, то X не може бути атомом азоту); і А, R7, R8 і R9 мають значення, визначені вище)] або його сіль. Даний винахід також стосується агента для подолання резистентності до протиракового агента (названого далі "агент для подолання резистентності до протиракового агента"), або агента для потенціювання ефекту протиракового агента (далі названий "агент для потенціювання ефекту протиракового агента"), де вказаний агент включає як активний інгредієнт вказане вище похідне акрилонітрилу або його сіль. Даний винахід також стосується композиції протиракового агента, яка містить вказане вище похідне акрилонітрилу або його сіль і протираковий агент, який служить як субстрат BCRP. Даний винахід також стосується застосування вказаного вище похідного акрилонітрилу або його солі для одержання інгібітору CRP як агента для подолання резистентності до протиракового агента або агента для потенціювання ефекту протиракового агента. Даний винахід також стосується способу лікування рака, який характеризується наявністю набутої резистентності до лікарського засобу по механізму, опосередкованому BCRP, що включає введення вказаного вище похідного акрилонітрилу або його солі. Серед сполук, представлених формулою (1), сполуки, представлені наведеною нижче формулою (1а), є новими сполуками. Таким чином, даний винахід стосується похідних акрилонітрилу, представлених формулою (1а): 30 [де один з R1 і R2 означає ціаногрупу, та інший означає атом водню; 1 Ar означає групу, вибрану з груп, представлених формулами (2)-(4): 35 40 (де R7 і R8, які можуть бути однаковими або різними, кожний, означає атом водню, атом галогену або нижчу алкоксигрупу; А означає атом кисню, атом сірки або NR9; і R9 означає атом водню або нижчу алкільну групу); 2 Ar означає ароматичну вуглеводневу групу, що містить конденсоване кільце, яке може бути заміщене атомом галогену, або групу, вибрану з груп, представлених формулами (5)-(15): 3 UA 105162 C2 1 5 10 15 20 25 30 35 40 45 (де R3а означає атом водню (Ar означає групу, представлену формулою (3) або (4)), нижчу алкільну групу, нижчу алкоксигрупу, атом галогену, нітрогрупу, метилсульфанільну групу, нижчу гідроксіалкільну групу або ароматичну вуглеводневу групу, яка може бути заміщена нітрогрупою або аміногрупою, або NR5(R6); R3b означає атом водню, нижчу алкільну групу, нижчу алкоксигрупу, атом галогену, нітрогрупу, метилсульфанільну групу, нижчу гідроксіалкільну групу, ароматичну вуглеводневу групу, яка може бути заміщена аміногрупою, або NR5(R6); 1 R3с означає атом водню (Ar означає групу, представлену формулою (3) або (4)), атом кисню (у вигляді N-оксиду), нижчу алкільну групу, нижчу алкоксигрупу, атом галогену, нітрогрупу, метилсульфанільну групу, нижчу гідроксіалкільну групу, ароматичну вуглеводневу групу, яка може бути заміщена нітрогрупою, або NR5(R6); кожний з R3d, R3e і R3f означає атом водню, атом кисню (у вигляді N-оксиду), нижчу алкільну групу, нижчу алкоксигрупу, атом галогену, нітрогрупу, метилсульфанільну групу, нижчу гідроксіалкільну групу, ароматичну вуглеводневу групу, яка може бути заміщена аміногрупою, або NR5(R6); R5 і R6, які можуть бути однаковими або різними, кожний, означає атом водню, нижчу алкільну групу, яка може містити замісник, нижчу гідроксіалкільну групу або ароматичну вуглеводневу групу, яка може містити замісник, або гетероциклічну групу; R 5 і R6 можуть утворювати, разом з сусіднім атомом азоту, гетероциклічне кільце, яке може містити замісник; і гідроксильна група нижчої гідроксіалкільної групи або гетероциклічне кільце, заміщене гідроксильною групою або нижчою гідроксіалкільною групою, можуть утворювати складноефірний зв'язок з групою фосфорної кислоти або її сіллю, або з ацильною групою, яка може містити замісник; R4 означає атом водню, нижчу алкільну групу, фенільну групу, яка може містити замісник, або бензильну групу; Х означає атом вуглецю, CH або атом азоту, за умови, що коли А означає атом кисню, то X не може бути атомом азоту); і А, R7, R8 і R9 мають значення, визначені вище)] або їх солі. Даний винахід також стосується лікарського засобу, який містить як активний інгредієнт, сполуку, представлену формулою (1а), або її сіль. Даний винахід також стосується фармацевтичної композиції, яка містить сполуку, представлену формулою (1а), або її сіль і фармацевтично прийнятний носій. Даний винахід також стосується застосування сполуки, представленої формулою (1а), або її солі для одержання лікарського препарату. Згідно з даним винаходом, BCRP-інгібуючий ефект похідного акрилонітрилу або його солі може усунути BCRP-асоційовану резистентність до протиракового агента. В доповнення, може бути потенційований ефект протиракового агента відносно ракових клітин, в яких експресується BCRP. Крім того, відповідно до даного винаходу, підвищується біодоступність протиракового агента, який розглядається, що веде до підвищення якості протиракової хіміотерапії. [Фіг.1] На графіку показаний вплив деяких сполук даного винаходу на резистентність клітин P388/BCRP до SN-38. [Фіг.2] На графіку показана дія деяких сполук даного винаходу щодо посилення акумуляції SN-38 в клітинах K562/BCRP. Приклади ароматичної вуглеводневої групи, що містить конденсоване кільце, яке може бути 2 заміщене атомом галогену, представленої Ar в формулі (1), включає С10-С14 арильні групи. Конкретні приклади включають нафтил, антраценіл і фенантрил. Приклади атома галогену, 4 UA 105162 C2 2 5 10 15 20 25 30 35 40 45 50 55 яким ароматична вуглеводнева група Ar може бути заміщена, включають атом фтору, атом хлору і атом йоду. Приклади нижчих алкільних груп, представлених R 3, R3a-R3f, R4 або R9 в формулі (1), включають лінійні або розгалужені C 1-C6 алкільні групи. Конкретні приклади включають метил, етил, н-пропіл, ізопропіл і н-бутил. З вказаних груп особливо переважним є метил. Приклади нижчих алкоксигруп, представлених R3, R3a-R3f, R7 або R8, включають лінійні або розгалужені C1-C6 алкоксигрупи і С3-С6 циклоалкоксигрупи. Конкретні приклади включають метокси, етокси, н-пропокси, ізопропокси і н-бутокси. З вказаних груп особливо переважним є метокси. Приклади атомів галогену включають атом фтору, атом хлору, атом брому і атом йоду. Приклади нижчих гідроксіалкільних груп, представлених R 3 або R3a-R3f, включають лінійні або розгалужені C1-C6 гідроксіалкільні групи. Конкретні приклади включають гідроксиметил, гідроксіетил і 1-гідроксипропіл. З вказаних груп особливо переважною є гідроксиметильна група. Приклади ароматичних вуглеводневих груп, представлених R 3 або R3a-R3f, включають лінійні або розгалужені C6-C14 арильні групи. Конкретні приклади включають феніл і нафтил. Приклади групи, якою ароматична вуглеводнева група R3 може бути заміщена, включають аміногрупу і нітрогрупу. Конкретні приклади включають нітрофенільну групу і амінофенільну групу. Приклади групи, якою фенільна група R4 може бути заміщена, включають атоми галогену і нижчу алкоксигрупи. Атом галогену і нижча алкоксигрупа мають значення, визначені вище застосовно до R3. Приклади нижчих алкільних груп, які можуть містити замісники і які представлені R 5 і R6, включають лінійні або розгалужені С1-С6 алкільні групи. Приклади групи, якою нижча алкільна група може бути заміщена, включають С1-С6 алкіламіногрупи і ді(С1-С6 алкіл)аміногрупи. Конкретні приклади включають метиламіно, етиламіно, н-пропіламіно, ізопропіламіно, циклопропіламіно, диметиламіно і діетиламіно. Нижча гідроксіалкільна група, представлена R5 або R6, і ароматична вуглеводнева група, яка може містити замісник, має значення, визначені застосовно до R3. Приклади гетероциклічної групи, представленої R5 або R6, включають аліциклічні або ароматичні гетероциклічні сполуки, кожна з яких містить щонайменше один гетероатом в кільці. Конкретні приклади включають піперазиніл, піперидино, морфоліно, імідазол і піролідиніл. Приклади гетероциклічного кільця, яке може містити замісник і яке може бути утворене з R 5 або R6, разом з сусіднім атомом азоту, включають піролідин, імідазол, піридин, піперидин, піримідин, піперазин, морфолін, індол, бензімідазол, бензопіразол і хінолін. Приклади групи, якою вказані гетероциклічні кільця можуть бути заміщені, включають гідроксильну групу, нижчі алкільні групи і нижчі гідроксіалкільні групи. Вказані групи мають значення, визначені вище. Приклади замісника NR5(R6) включають аміногрупу, диметиламіногрупу, Nметилетаноламіногрупу (-N(CH3)CH2CH2OH), складний фосфатний ефір Nметилетаноламіногрупи (-N(CH3)CH2CH2OH) і їх сіль, моносукцинат N-метилетаноламіногрупи (N(CH3)CH2CH2OH), піролідиногрупу, піперидиногрупу, морфоліногрупу, 4гідроксипіперидиногрупу, складний фосфатний ефір 4-гідроксипіперидиногрупи і його сіль, моносукцинат 4-гідроксипіперидиногрупи, 4-метилпіперазиногрупу, 4-етанолпіперазиногрупу, складний фосфатний ефір 4-етанолпіперазиногрупи і його сіль, моносукцинат 4етанолпіперазиногрупи і N, N,N'-триметилетилендіаміногрупу (-N(CH3)CH2CH2N(CH3)2). Гідроксигрупа в нижчій гідроксіалкільній групі, представлена R 5 або R6, і гідроксигрупа в гідроксильній групі або нижчій гідроксіалкільній групі, якою гетероциклічна група може бути заміщена, гетероциклічна група, що утворюється R 5 або R6, разом з сусіднім атомом азоту, можуть утворювати складноефірний зв'язок з фосфатною групою або її сіллю, або з ацильною групою, яка може містити замісник. Приклади ацильної групи включають С1-С8 нижчі алканоїльні групи. Конкретні приклади включають форміл, ацетил, пропіоніл, малоніл і сукциніл. Приклади групи, якою може бути заміщена ацильна група, включають нижчі діалкіламіногрупи; фенілкарбамоїльні групи, які можуть містити замісник, N-нижчі алкілкарбамоїльні групи, які можуть містити замісник, N-N-динижчі алкілкарбамоїльні групи і N-гетероциклічні карбамоїльні групи, які можуть бути заміщені аліфатичним гетероциклічним кільцем. Нижча алкільна група має значення, визначені вище. Приклади групи, якою фенілкарбамоїльна група, N-нижча алкілкарбамоїльна група або N, Nди-нижча алкілкарбомоїльна група можуть бути заміщені, включають нижчі алкіламіногрупи, такі як метиламіногрупа і етиламіногрупа; і нижчі діалкіламіногрупи, такі як діетиламіногрупа і дипропіламіногрупа. 5 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади N-гетероциклічної карбамоїльної групи, яка може бути заміщена аліфатичним гетероциклічним кільцем, включають N-піперидинокарбонільні групи, кожна з яких заміщена піролідином, піперидином, піперазином або аналогічним гетероциклічним кільцем. Приклади ацильної групи, яка може містити замісник, включають диметиламіноацетильну групу, діетиламіноетиламінокарбонілпропіонільну групу, діетиламінопропіламінокарбонілпропіонільну групу, діетиламінофеніламінокарбонілпропіонільну групу, 4-піперидинопіперидин-1-ілкарбонільну групу і 4-піперидинопіперидин-1ілкарбонілпропіонільну групу. Похідні акрилонітрилу даного винаходу можуть утворювати фармацевтично прийнятні солі вказаних похідних і такі солі включені в об'єм даного винаходу. Приклади солей включають неорганічні солі, такі як гідрохлориди, сульфати, нітрат і фосфати; солі лужного металу, такі як солі натрію і солі калію; солі лужноземельного металу, такі як солі кальцію і солі магнію; солі органічних кислот, такі як п-толуолсульфонати, метансульфонати, фумарати, сукцинати і лактати. Сполуки за даним винаходом можуть бути представлені у формі сольватів (гідратів). Гідрати також включені в об'єм даного винаходу. Похідні акрилонітрилу даного винаходу можуть включати їх ізомери і кожний з таких ізомерів і суміші таких ізомерів також включені в об'єм даного винаходу. З вказаних сполук найбільш переважними є наступні сполуки і солі: (Z)-2-(3,4-диметоксифеніл)-3-(5-нітротіофен-2-іл)акрилонітрил (сполука 1), (Z)-3-(5-бромтіофен-2-іл)-2-(3,4-диметоксифеніл)акрилонітрил (сполука 2), (Z)-3-(5-амінотіофен-2-іл)-2-(3,4-диметоксифеніл)акрилонітрил (сполука 3), (Z)-2-(3,4-диметоксифеніл)-3-(5-піперидин-1-ілтіофен-2-іл)акрилонітрил (сполука 4) або його сіль хлористоводневої кислоти (сполука 11), (Z)-2-(3,4-диметоксифеніл)-3-(5-морфолін-4-ілтіофен-2-іл)акрилонітрил (сполука 5), (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-гідроксипіперидин-1-іл)тіофен-2-іл]акрилонітрил (сполука 6) або його сіль хлористоводневої кислоти (сполука 12), (Z)-2-(3,4-диметоксифеніл)-3-{5-[(2-гідроксіетил)метиламіно]тіофен-2-іл}акрилонітрил (сполука 7), (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-метилпіперазин-1-іл)тіофен-2-іл]акрилонітрил (сполука 8) або його сіль хлористоводневої кислоти (сполука 13), (Z)-2-(3,4-диметоксифеніл)-3-{5-[4-(2-гідроксіетил)піперазин-1-іл]тіофен-2-іл}акрилонітрил (сполука 9) або його сіль хлористоводневої кислоти (сполука 14), його сіль метансульфонової кислоти (сполука 59), його кисла сіль сірчаної кислоти (сполука 100), його сіль сірчаної кислоти (сполука 101) або його сіль азотної кислоти (сполука 102), (Z)-2-(3,4-диметоксифеніл)-3-{5-[(2-диметиламіноетил)метиламіно]-тіофен-2-іл}акрилонітрил (сполука 10) або його сіль хлористоводневої кислоти (сполука 15), моно(1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл}піперидин-4-іл)фосфат (сполука 16) або його натрієва сіль (сполука 17), моно(1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл}піперидин-4-іл)сукцинат (сполука 18) або його натрієва сіль (сполука 57), (Z)-2-(3,4-диметоксифеніл)-3-(5-нітрофуран-2-іл)акрилонітрил (сполука 19), (Z)-2-(3,4-диметоксифеніл)-3-(5-гідроксиметилфуран-2-іл)акрилонітрил (сполука 20), (Z)-2-(3,4-диметоксифеніл)-3-[5-(3-нітрофеніл)фуран-2-іл]акрилонітрил (сполука 21), (Z)-3-[5-(3-амінофеніл)фуран-2-іл]-2-(3,4-диметоксифеніл)акрилонітрил (сполука 22) або його сіль хлористоводневої кислоти (сполука 23), (Z)-2-(3,4-диметоксифеніл)-3-(5-піперидиніл-2-ілфуран-2-іл)акрилонітрил (сполука 24), (Z)-2-(3,4-диметоксифеніл)-3-(5-морфолін-4-ілфуран-2-іл)акрилонітрил (сполука 25), (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-гідроксипіперидин-1-іл)фуран-2-іл]акрилонітрил (сполука 26), (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-метилпіперазин-1-іл)фуран-2-іл]акрилонітрил (сполука 27) або його сіль хлористоводневої кислоти (сполука 29), (Z)-2-(3,4-диметоксифеніл)-3-{5-[4-(2-гідроксіетил)піперазин-1-іл]фуран-2-іл}акрилонітрил (сполука 28) або його сіль хлористоводневої кислоти (сполука 50), (Z)-2-(3,4-диметоксифеніл)-3-піридин-4-ілакрилонітрил (сполука 30), його сіль хлористоводневої кислоти (сполука 31) або його сіль метансульфонової кислоти (сполука 32), N-оксид (Z)-2-(3,4-диметоксифеніл)-3-піридин-4-ілакрилонітрилу (сполука 33), (Z)-2-(3,4-диметоксифеніл)-3-піридин-3-ілакрилонітрил (сполука 34) або його сіль хлористоводневої кислоти (сполука 36), (Z)-2-(3,4-диметоксифеніл)-3-(6-метоксипіридин-3-іл)акрилонітрил (сполука 35) або його сіль хлористоводневої кислоти (сполука 37), 6 UA 105162 C25 10 15 20 25 30 35 40 45 50 55 60 (Z)-2-(3,4-диметоксифеніл)-3-піридин-2-ілакрилонітрил (сполука 38), (Z)-2-(3,4-диметоксифеніл)-3-(1Н-пірол-2-іл)акрилонітрил (сполука 39) або його сіль хлористоводневої кислоти (сполука 40), (Z)-2-(3,4-диметоксифеніл)-3-(3Н-імідазол-4-іл)акрилонітрил (сполука 41), (Z)-3-(3-бензил-2-метилсульфаніл-3Н-імідазол-4-іл)-2-(3,4-диметоксифеніл) акрилонітрил (сполука 42), (Z)-2-(3,4-диметоксифеніл)-3-(4-метил-2-фенілтіазол-5-іл)акрилонітрил (сполука 43), (Z)-3-(3,4-диметоксифеніл)-2-піридин-3-ілакрилонітрил (сполука 44) або його сіль хлористоводневої кислоти (сполука 46), (Z)-3-(3,4-диметоксифеніл)-2-піридин-2-ілакрилонітрил (сполука 45) або його сіль хлористоводневої кислоти (сполука 47), (Z)-2-(3,4-диметоксифеніл)-3-{5-[(2-диметиламіноетил)метиламіно]фуран-2-іл}акрилонітрил (сполука 48) або його сіль хлористоводневої кислоти (сполука 49), моно(1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]фуран-2-іл}піперидин-4-іл)сукцинат (сполука 51) або його натрієва сіль (сполука 58), моно(1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]фуран-2-іл}піперидин-4-іл) фосфат (сполука 52) або його натрієва сіль (сполука 53), (Z)-3-(5-бромфуран-2-іл)-2-(3,4-диметоксифеніл)акрилонітрил (сполука 54), (Е)-3-(3,4-диметоксифеніл)-2-тіофен-2-ілакрилонітрил (сполука 55), (Z)-3-(3,4-диметоксифеніл)-2-тіофен-3-ілакрилонітрил (сполука 56), сіль хлористоводневої кислоти 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)-вініл]тіофен-2іл]піперидин-4-іл-N-(2-діетиламіноетил)сукцинамату (сполука 60), сіль хлористоводневої кислоти 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)-вініл]тіофен-2іл]піперидин-4-іл-N-(3-діетиламінопропіл)сукцинамату (сполука 61), сіль п-толуолсульфонової кислоти 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2іл]піперидин-4-ілдиметиламіноацетату (сполука 62) або його сіль хлористоводневої кислоти (сполука 104), сіль хлористоводневої кислоти 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)-вініл]тіофен-2іл]піперидин-4-іл-[1,4']біпіперидиніл-1'-карбоксилату (сполука 63), сіль хлористоводневої кислоти 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)-вініл]тіофен-2іл]піперидин-4-іл-4-[1,4']біпіперидиніл-1'-іл-4-оксобутилату (сполука 64), (Z)-2-(3,4-диметоксифеніл)-3-хінолін-4-ілакрилонітрил (сполука 65), (Z)-3-бензо[b]тіофен-3-іл-2-(3,4-диметоксифеніл)акрилонітрил (сполука 66), (Z)-2-(3,4-диметоксифеніл)-3-(1-метил-1Н-бензімідазол-2-іл)акрилонітрил (сполука 67), (Z)-2-(3,4-диметоксифеніл)-3-(1-метил-1Н-індол-3-іл)акрилонітрил (сполука 68), (Z)-3-бензофуран-2-іл-2-(3,4-диметоксифеніл)акрилонітрил (сполука 69), (Z)-3-(2-хлорхінолін-3-іл)-2-(3,4-диметоксифеніл)акрилонітрил (сполука 70), (Е)-2-бензотриазол-1-іл-3-(3,4-диметоксифеніл)акрилонітрил (сполука 71), (Z)-2-бензофуран-3-іл-3-(3,4-диметоксифеніл)акрилонітрил (сполука 72), (Z)-3-(2-хлор-6-метоксихінолін-3-іл)-2-(3,4-диметоксифеніл)акрилонітрил (сполука 73), (Е)-2-бензотіазол-2-іл-3-(3,4-диметоксифеніл)акрилонітрил (сполука 74), (Z)-3-(2,3-дигідробензофуран-5-іл)-2-(3,4-диметоксифеніл)акрилонітрил (сполука 75), (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-фторфеніл)ізоксазол-3-іл]акрилонітрил (сполука 76), (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-метоксифеніл)ізоксазол-3-іл]акрилонітрил (сполука 77), (Z)-2-(3,4-диметоксифеніл)-3-хінолініл-2-ілакрилонітрил (сполука 78), (Z)-3-(2-хлор-6-метоксихінолін-3-іл)-2-піридин-2-ілакрилонітрил (сполука 79), (Z)-3-(2-хлор-6-метоксихінолін-3-іл)-2-піридин-2-ілакрилонітрил (сполука 80), (Е)-3-(2-хлор-6-метоксихінолін-3-іл)-2-тіофен-2-ілакрилонітрил (сполука 81), (Z)-3-(2-хлор-6-метоксихінолін-3-іл)-2-піридин-2-ілакрилонітрил (сполука 82), (Е)-2-бензотриазол-1-іл-3-(2-хлор-6-метоксихінолін-3-іл)акрилонітрил (сполука 83), (Е)-2-бензотіазол-2-іл-3-(2-хлор-6-метоксихінолін-3-іл)акрилонітрил (сполука 84), (Z)-2-піридин-2-іл-3-хінолін-4-ілакрилонітрил (сполука 85), (Z)-2-піридин-3-іл-3-хінолін-4-ілакрилонітрил (сполука 86), (Е)-3-хінолін-4-іл-2-тіофен-2-ілакрилонітрил (сполука 87), (Z)-3-хінолін-4-іл-2-тіофен-3-ілакрилонітрил (сполука 88), (E)-3-бензо[b]тіофен-3-іл-2-тіофен-2-ілакрилонітрил (сполука 89), (E)-3-бензо[b]тіофен-3-іл-2-бензотіазол-2-ілакрилонітрил (сполука 90), (Z)-3-бензофуран-2-іл-2-бензофуран-3-ілакрилонітрил (сполука 91), (Е)-2-бензотіазол-2-іл-3-(1-метил-1Н-індол-3-іл)акрилонітрил (сполука 92), (Z)-3-(10-хлорантрацен-9-іл)-2-(3,4-диметоксифеніл)акрилонітрил (сполука 93), 7 UA 105162 C2 5 10 (Z)-3-(3,4-диметоксифеніл)-3-нафталін-2-ілакрилонітрил (сполука 94), (Z)-3-(3,4-диметоксифеніл)-3-фенантрен-9-ілакрилонітрил (сполука 95), 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4-ілдіетиламіноацетат (сполука 103), його сіль п-толуолсульфонової кислоти (сполука 96) або його сіль хлористоводневої кислоти (сполука 105), 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4-ілдіетилкарбамат (сполука 97), сіль хлористоводневої кислоти 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)-вініл]тіофен-2іл]піперидин-4-іл-N-(2-діетиламіноетил)-N-метилсукцинамату (сполука 98) і 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4-іл-N-(4діетиламінофеніл)сукцинамату (сполука 99). Похідні акрилонітрилу даного винаходу і їх солі можуть бути одержані з використанням, наприклад, наведених нижче реакційних схем (А) або (В): Схема (А) 15 Схема (В) 20 1 25 30 35 40 45 50 2 (де Ar і Ar мають значення, визначені вище). Зокрема, в ході реакції конденсації між ароматичним альдегідом (16) або (19) і ароматичним ацетонітрилом (17) або (18) може бути одержане похідне акрилонітрилу (1-1) або (1-2). Більш конкретно, реакція конденсації між ароматичним альдегідом (16) і 3,4-диметоксибензилціанідом (17) приводить до утворення похідного акрилонітрилу (1-1), і реакція конденсації між ароматичним ацетонітрилом (18) і 3,4-диметоксибензальдегідом (19) приводить до утворення похідного акрилонітрилу (1-2). Альтернативно, в ході реакції конденсації між поліциклічним ароматичним альдегідом (16) і 3,4-диметоксибензилціанідом (17) може бути одержане похідне акрилонітрилу (1-1). В ході реакції конденсації між гетероциклічним ацетонітрилом (18) і хінолінкарбоксальдегідом (19) може бути одержане похідне акрилонітрилу (1-2). А також, в ході реакції конденсації між бензотіофенкарбоксальдегідом, бензофуранкарбоксальдегідом або індолкарбоксальдегідом (19) і гетероциклічним ацетонітрилом (18) може бути одержане похідне акрилонітрилу (1-2). Реакцію конденсації переважно проводять у присутності основи, такої як алкоксид натрію, гідроксид натрію або гідроксид калію. В тому випадку, коли використовують алкоксид натрію, реакцію конденсації проводять в спиртовому розчиннику, такому як метанол або етанол, при температурі, відповідній приблизно температурі охолоджування льодом і температурі кипіння зі зворотним холодильником, тоді як у разі використання гідроксиду натрію реакцію конденсації проводять в суміші розчинників, що включає воду та інертний розчинник, такий як метиленхлорид або хлороформ, у присутності солі четвертинного амонію або аналогічної сполуки, що додається в суміш. Кожне з похідних акрилонітрилу, що містить гетероциклічне кільце даного винаходу, або їх солі можуть бути введені як такі. Альтернативно, вказані похідні або їх солі можуть бути змішані з фармацевтично прийнятним носієм, таким як диспергуюча допоміжна речовина або ексципієнт, і можуть бути використані у формі препаратів для ін'єкцій або препаратів для перорального введення, такого як порошок, розчин, капсула, суспензія, емульсія, сироп, еліксир, гранули, пілюлі, таблетки, льодяники або лимонад. Вказані продукти можуть бути одержані за допомогою загальноприйнятого способу. Приклади такого носія включають водорозчинні моносахариди, олігосахариди і полісахариди, такі як маніт, лактоза і декстран; гелеутворювальні або водорозчинні целюлози, такі як гідроксипропілцелюлоза, гідроксипропілметилцелюлоза і метилцелюлоза; 8 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 60 водопоглинаючі і погано розчинні у воді целюлози, такі як кристалічна целюлоза, такі як αцелюлоза, зшита натрій-карбоксиметилцелюлоза і її похідні; водопоглинаючі і погано розчинні у воді полісахариди, такі як гідроксипропілкрохмаль, карбоксиметилкрохмаль, зшитий крохмаль, амілоза, амілопектин, пектин і їх похідні; водопоглинаючі і погано розчинні у воді камеді, такі як аравійська камедь, трагакант, глюкоманан і їх похідні; зшиті вінільні полімери, такі як полівінілпіролідон, зшита поліакрилова кислота і її солі, зшитий полівініловий спирт, полігідроксіетилметакрилат і його похідні; і ліпіди, які утворюють молекулярні агрегати (наприклад, ліпосоми), такі як фосфоліпід і холестерин. У тому випадку, коли сполука даного винаходу має низьку розчинність, вказана сполука може бути солюбілізована. Приклади методу солюбілізації включають такі, які в основному застосовні до лікарських препаратів, таких як метод, в якому до даної сполуки додають поверхнево-активну речовину (наприклад, ефір поліоксіетиленового спирту, складний ефір поліоксіетиленацилу, складний ефір сорбітанацилу або складний ефір поліоксіетиленсорбітанацилу), і метод, що використовує водорозчинний полімер (наприклад, поліетиленгліколь). За бажання, може використовуватись, наприклад, метод одержання розчинної солі сполуки або метод, що використовує одержання клатратної сполуки на основі циклодекстрину або аналогічного матеріалу. Відповідний метод солюбілізації може бути вибраний, відповідно до природи потрібного похідного акрилонітрилу або його солі. За рахунок потужного BCRP-інгібуючого ефекту, сполука даного винаходу може застосовуватись як агент для подолання резистентності до протиракового агента, і як агент для потенціювання ефекту протиракового агента. Інгібітор BCRP може використовуватись як агент для подолання резистентності до протиракового агента, у випадку раку, при якому має місце набута BCRP-опосередкована резистентність до протиракового препарату, що вводиться. При цьому, інгібітор BCRP може використовуватись як агент для потенціювання ефекту протиракового агента, у випадку раку, при якому експресується BCRP і відмічається низька чутливість до протиракового препарату. Немає ніяких обмежень відносно протиракового засобу, який є мішенню для дії агента для подолання резистентності до протиракового агента або агента для потенціювання ефекту протиракового агента, що містить як активний інгредієнт інгібітор BCRP даного винаходу, головне, щоб протираковий препарат міг служити як субстрат для BCRP або його аналога. Приклади такого протиракового засобу включають інгібітори топоізомерази I, такі як гідрохлорид іринотекану/CPT-11 (активний метаболіт: SN-38) і топотекан; інгібітори топоізомерази II, такі як мітоксантрон, доксорубіцин, даунорубіцин, бісантрен і етопозид; антифоляти, такі як метотрексат; і терапевтичні препарати, діючі на цільові молекули, такі як гефітиніб та іматиніб. Потрібно зазначити, що немає яких-небудь конкретних обмежень відносно аналога BCRP, головне, щоб він характеризувався такою ж резистентністю до протиракового препарату, що і BCRP. Доза інгібітору BCRP даного винаходу може бути відповідним чином визначена з урахуванням, наприклад, способу введення або симптому, що є у пацієнта. Денна доза для дорослої людини складає переважно від 1 мг до 10 г, більш переважно, від 100 мг до 10 г, і найбільш переважно, від 500 мг до 10 г. Немає яких-небудь конкретних обмежень відносно співвідношення між протираковим препаратом та інгібітором BCRP, і переважний коефіцієнт їх співвідношення може варіювати, в залежності, наприклад, від типу протиракового препарату або інгібітору, що використовується. У тому випадку, коли використовують, наприклад, гідрохлорид іринотекану як протираковий препарат, масове співвідношення протиракового препарату до інгібітору BCRP складає переважно, 1:1 1:500, особливо переважно, 1:1 1:100 і більш переважно, від 1:1 до 1:10. Приклад Далі даний винахід буде описаний більш детально за допомогою прикладів, які жодним чином не треба розглядати як такі, що обмежують даний винахід. Приклад 1: Одержання похідного акрилонітрилу, що містить гетероциклічне кільце (Стадія одержання 1). Введення аміну в галогенвмісний гетероциклічний альдегід В реактор, в якому знаходиться галогенвмісний гетероциклічний альдегід, додають воду і амін (3 екв.). При кип'ятінні зі зворотним холодильником суміш перемішують протягом часу від десяти хвилин до одного дня. Після охолоджування суміш екстрагують хлороформом. Органічний шар промивають насиченим розчином солі і сушать над безводним сульфатом натрію. Розчинник випаровують досуха. Залишок, що утворився, очищують хроматографією на колонці з силікагелем, одержуючи сполуку, яка представляє інтерес. (Стадія одержання 2: Спосіб А). Стадія реакції конденсації між ароматичним або поліциклічним ароматичним альдегідом і 3,4-диметоксибензилціанідом 9 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 60 Рівні кількості (в еквівалентах) похідного ароматичного або поліциклічного ароматичного альдегіду і 3,4-диметоксибензилціаніду вводять в реактор і додають етанол. Далі, до реактора приєднують трубку з хлоридом кальцію і суміш в реакторі перемішують до розчинення. Окремо зважують 1-2 еквіваленти етоксиду натрію і розчиняють в етанолі, потім розчин додають краплями до вказаного вище розчину. Суміш перемішують при температурі приблизно від температури охолоджування льодом до приблизно температури кипіння зі зворотним холодильником. Після завершення реакції до реакційної суміші додають воду і випаровують досуха етанол. Суміш екстрагують хлороформом і органічний шар промивають насиченим розчином солі, потім сушать над безводним сульфатом натрію. Розчинник випаровують досуха. Залишок очищують хроматографією на колонці з силікагелем і перекристалізовують з етанолу, одержуючи сполуку, яка представляє інтерес. (Стадія одержання 2: спосіб В). Стадія реакції конденсації між ароматичним ацетонітрилом і 3,4-диметоксибензальдегідом Рівні кількості (в еквівалентах) похідного ароматичного ацетонітрилу і 3,4диметоксибензальдегіду вводять в реактор і додають етанол. Далі, до реактора приєднують трубку з хлоридом кальцію і суміш в реакторі перемішують до розчинення. Окремо зважують 1-2 еквіваленти етоксиду натрію і розчиняють в етанолі, потім розчин додають краплями до одержаного вище розчину. Суміш перемішують при кімнатній температурі. Після завершення реакції до реакційної суміші додають воду і випаровують досуха етанол. Суміш екстрагують хлороформом і органічний шар промивають насиченим розчином солі, потім сушать над безводним сульфатом натрію. Розчинник випаровують досуха. Залишок очищують хроматографією на колонці з силікагелем і перекристалізовують з етанолу, одержуючи сполуку, яка представляє інтерес. (Стадія одержання 3: Спосіб В). Стадія реакції конденсації між гетероциклічним ацетонітрилом і хінолінкарбоксальдегідом, бензотіофенкарбоксальдегідом, бензофуранкарбоксальдегідом або індолкарбоксальдегідом Еквімолярні кількості похідного гетероциклічного ацетонітрилу і похідного альдегіду вносять в реактор. З використанням методики, описаної в розділі "Стадія одержання 2: Спосіб В", одержують сполуку, яка представляє інтерес. Нижче описані конкретні варіанти способів одержання вказаних похідних і результати їх аналізу. Одержання (Z)-2-(3,4-диметоксифеніл)-3-(5-нітротіофен-2-іл)акрилонітрилу (сполука 1) 5-нітротіофен-2-карбоксальдегід (3,14 г) піддають реакції конденсації з 3,4диметоксибензилціанідом (3,54 г) відповідно до способу А (стадія одержання 2), одержуючи цільовий продукт (вихід: 540 мг, 8,5 %). Оранжеві кристали. МС (APCI, m/z): 316 (M) . 1 H-ЯМР (CDCl3) δ: 7,93 (1H, д, J=4,4), 7,56 (1H, д, J=4,4), 7,43 (1H, с), 7,30 (1H, дд, J=2,0, 8,3), 7,12 (1H, д, J=2,0), 6,94 (1H, д, J=8,3), 3,97 (3H, с), 3,95 (3H, с). Одержання (Z)-3-(5-бромтіофен-2-іл)-2-(3,4-диметоксифеніл)акрилонітрилу (сполука 2) 5-Бромтіофен-2-карбоксальдегід (381 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (355 мг) відповідно до способу А (стадія одержання 2), одержуючи цільовий продукт (вихід: 359 мг, 51 %). Світло-жовті кристали. + МС (APCI, m/z): 349 (M) . 1 H-ЯМР (CDCl3) δ: 7,41 (1H, с), 7,31 (1H, д, J=4,2), 7,21 (1H, дд, J=2,2, 8,5), 7,10 (1H, д, J=4,2), 7,08 (1H, д, J=2,2), 6,90 (1H, д, J=8,5), 3,96 (3H, с), 3,93 (3H, с). Одержання (Z)-3-(5-амінотіофен-2-іл)-2-(3,4-диметоксифеніл)акрилонітрилу (сполука 3) Сполуку 1 (316 мг) розчиняють в етанолі (25 мл) і до розчину додають дигідрат хлориду кальцію (132 мг) і порошок цинку (2,55 г) з подальшим перемішуванням протягом 2-х годин при кип'ятінні зі зворотним холодильником. Реакційну суміш фільтрують, використовуючи рихлий шар целіту, що приводить до видалення цинкового порошку, і розчинник випаровують досуха. Залишок очищують хроматографією на колонці з силікагелем (гексан-етилацетат), одержуючи цільовий продукт (вихід: 35 мг, 12 %). Жовтувато-коричневі кристали. + МС (ESI, m/z): 287 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,37 (1H, с), 7,14 (1H, д, J=3,9), 7,13 (1H, дд, J=2,4, 8,3), 7,04 (1H, д, J=2,4), 6,88 (1H, д, J=8,3), 6,13 (1H, д, J=3,9), 4,34 (2H, уш.с), 3,94 (3H, с), 3,91 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-(5-піперидин-1-ілтіофен-2-іл)акрилонітрилу (сполука 4) 10 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з піперидину (1,02 г), вводять в 5-бромтіофен-2-карбоксальдегід (764 мг) з одержанням 5-піперидин-1-ілтіофен-2-карбальдегіду (вихід: 500 мг, 64 %). Одержаний 5піперидин-1-ілтіофен-2-карбальдегід (293 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (266 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 279 мг, 53 %). Жовті кристали. + МС (ESI, m/z): 355 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,36 (1H, с), 7,22 (1H, д, J=4,2), 7,12 (1H, дд, J=2,2, 8,5), 7,04 (1H, д, J=2,2), 6,87 (1H, д, J=8,5), 6,06 (1H, д, J=4,2), 3,94 (3H, с), 3,90 (3H, с), 3,29-3,43 (4H, м), 1,60-1,76 (6H, м). Одержання (Z)-2-(3,4-диметоксифеніл)-3-(5-морфолін-4-ілтіофен-2-іл)акрилонітрилу (сполука 5) Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з морфоліну (523 мг), вводять в 5-бромтіофен-2-карбоксальдегід (382 мг) з одержанням 5-морфолін-4-ілтіофен-2-карбальдегіду (вихід: 176 мг, 45 %). Одержаний 5морфолін-4-ілтіофен-2-карбальдегід (172 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (154 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 46 мг, 15 %). Жовті кристали. + МС (ESI, m/z): 357 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,38 (1H, с), 7,24 (1H, д, J=4,4), 7,14 (1H, дд, J=2,2, 8,3), 7,05 (1H, д, J=2,2), 6,88 (1H, д, J=8,3), 6,08 (1H, д, J=4,4), 3,95 (3H, с), 3,91 (3H, с), 3,83-3,88 (4H, м), 3,28-3,33 (4H, м). Одержання (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-гідроксипіперидин-1-іл)тіофен-2іл]акрилонітрилу (сполука 6) Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з 4-гідроксипіперидину (3,03 г), вводять в 5-бромтіофен-2-карбоксальдегід (1,91 г) з одержанням 5-(4-гідроксипіперидин-1-іл)тіофен-2-карбальдегіду (вихід: 1,36 г, 64 %). Одержаний 5-(4-гідроксипіперидин-1-іл)тіофен-2-карбальдегід (1,27 г) піддають реакції конденсації з 3,4-диметоксибензилціанідом (1,06 г) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 1,09 г, 50 %). Жовті кристали. + МС (ESI, m/z): 371 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,36 (1H, с), 7,22 (1H, д, J=4,4), 7,13 (1H, дд, J=2,2, 8,3), 7,04 (1H, д, J=2,2), 6,87 (1H, д, J=8,3), 6,04 (1H, д, J=4,4), 3,88-3,98 (1H, м), 3,94 (3H, с), 3,90 (3H, с), 3,60-3,67 (2H, м), 3,14-3,22 (2H, м), 1,98-2,06 (2H, м), 1,68-1,78 (2H, м). Одержання (Z)-2-(3,4-диметоксифеніл)-3-{5-[(2-гідроксіетил)метиламіно]тіофен-2іл}акрилонітрилу (сполука 7) Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з N-метилетаноламіну (2,25 г), вводять в 5-бромтіофен-2-карбоксальдегід (1,91 г) з одержанням 5-[(2-гідроксіетил)метиламіно]тіофен-2-карбальдегіду (вихід: 991 мг, 53 %). Одержаний 5-[(2-гідроксіетил)-метиламіно]тіофен-2-карбальдегід (682 мг) піддають реакції конденсації з 3,4-диметоксибензилціанідом (654 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 300 мг, 24 %). Оранжеві кристали. + МС (ESI, m/z): 345 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,35 (1H, с), 7,21 (1H, д, J=4,2), 7,12 (1H, дд, J=2,2, 8,3), 7,03 (1H, д, J=2,2), 6,87 (1H, д, J=8,3), 5,91 (1H, д, J=4,2), 3,94 (3H, с), 3,92 (2H, кв, J=5,6), 3,90 (3H, с), 3,56 (2H, т, J=5,6), 3,15 (3H, с), 1,63 (1H, т, J=5,6). Одержання (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-метилпіперазин-1-іл)тіофен-2іл]акрилонітрилу (сполука 8) Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з 1-метилпіперазину (6,01 г), вводять в 5-бромтіофен-2-карбоксальдегід (3,82 г) з одержанням 5-(4-метилпіперазин-1-іл)тіофен-2-карбальдегіду (вихід: 3,71 г, 88 %). Одержаний 5-(4-метилпіперазин-1-іл)тіофен-2-карбальдегід (2,10 г) піддають реакції конденсації з 3,4диметоксибензилціанідом (1,77 г) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 2,47 г, 67 %). Жовтувато-оранжеві кристали. + МС (ESI, m/z): 370 (M+Н) . 11 UA 105162 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H-ЯМР (CDCl3) δ: 7,37 (1H, с), 7,22 (1H, д, J=4,4), 7,13 (1H, дд, J=2,2, 8,5), 7,04 (1H, д, J=2,2), 6,87 (1H, д, J=8,5), 6,04 (1H, д, J=4,4), 3,94 (3H, с), 3,90 (3H, с), 3,33-3,37 (4H, м), 2,53-2,58 (4H, м), 2,36 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-{5-[4-(2-гідроксіетил)піперазин-1-іл]тіофен-2іл}акрилонітрилу (сполука 9) Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з 1-піперазинетанолу (7,81 г), вводять в 5-бромтіофен-2-карбоксальдегід (3,82 г) з одержанням 5-[4-(2-гідроксіетил)піперазин-1-іл]тіофен-2-карбальдегіду (вихід: 3,22 г, 67 %). Одержаний 5-[4-(2-гідроксіетил)піперазин-1-іл]тіофен-2-карбальдегід (1,85 г) піддають реакції конденсації з 3,4-диметоксибензилціанідом (1,37 г) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 1,51 г, 49 %). Жовтувато-оранжеві кристали. + МС (ESI, m/z): 400 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,37 (1H, с), 7,23 (1H, д, J=4,4), 7,13 (1H, дд, J=2,2, 8,3), 7,05 (1H, д, J=2,2), 6,88 (1H, д, J=8,3), 6,05 (1H, д, J=4,4), 3,95 (3H, с), 3,91 (3H, с), 3,67 (2H, м), 3,33-3,38 (4H, м), 2,65-2,70 (4H, м), 2,60-2,65 (2H, м), 2,57 (1H, м). Одержання (Z)-2-(3,4-диметоксифеніл)-3-{5-[(2-диметиламіно-етил)метиламіно]тіофен-2іл}акрилонітрилу (сполука 10) Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з N, N,N'-триметилетилендіаміну (6,13 г), вводять в 5-бромтіофен-2-карбоксальдегід (3,82 г) з одержанням 5-[(2-диметиламіноетил)метиламіно]тіофен-2-карбальдегіду (вихід: 3,26 г, 77 %). Одержаний 5-[(2-диметиламіноетил)метиламіно]тіофен-2-карбальдегід (2,12 г) піддають реакції конденсації з 3,4-диметоксибензилціанідом (1,77 г) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 1,20 г, 32 %). Жовтувато-коричнева олія. + МС (ESI, m/z): 372 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,34 (1H, с), 7,22 (1H, д, J=4,2), 7,11 (1H, дд, J=2,2, 8,3), 7,03 (1H, д, J=2,2), 6,87 (1H, д, J=8,3), 5,86 (1H, д, J=4,2), 3,94 (3H, с), 3,90 (3H, с), 3,48 (2H, т, J=7,1), 3,10 (3H, с), 2,56 (2H, т, J=7,1), 2,30 (6H, с). Одержання гідрохлориду (Z)-2-(3,4-диметоксифеніл)-3-(5-піперидин-1-ілтіофен-2іл)акрилонітрилу (сполука 11) 0,1н. хлористоводневу кислоту (7,0 мл) додають до сполуки 4 (226 мг) і до одержаної суміші додають очищену воду (30 мл), ацетонітрил (30 мл) і хлороформ (3 мл) для розчинення суміші. Розчин перемішують при кімнатній температурі протягом 1 години і розчинник випаровують досуха. Залишок суспендують в суміші гексан-етилацетат і розчинник випаровують досуха з подальшим ретельним сушінням, одержуючи цільовий продукт (вихід: 235 мг, 94 %). Жовті кристали. + МС (ESI, m/z): 355 (M-HCl+Н) . 1 H-ЯМР (CDCl3) δ: 7,37 (1H, с), 7,23 (1H, уш.с), 7,13 (1H, дд, J=2,0, 8,5), 7,04 (1H, д, J=2,0), 6,87 (1H, д, J=8,5), 6,15 (1H, уш.с), 3,94 (3H, с), 3,90 (3H, с), 3,30-3,37 (4H, м), 1,72-1,80 (4H, м), 1,60-1,68 (2H, м). Одержання гідрохлориду (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-гідроксипіперидин-1-іл)тіофен-2іл]акрилонітрилу (сполука 12) 0,1н. хлористоводневу кислоту (3,0 мл) додають до сполуки 6 (100 мг) і до одержаної суміші додають очищену воду (5 мл), ацетонітрил (30 мл) і хлороформ (5 мл) для розчинення суміші. Розчин перемішують при кімнатній температурі протягом 1 години і розчинник випаровують досуха, з подальшим ретельним сушінням, одержуючи цільовий продукт (вихід: 95 мг, 87 %). Жовтувато-оранжевий порошок. + МС (ESI, m/z): 371 (M-HCl+Н) . 1 H-ЯМР (ДМСО-d6) δ: 8,32 (1H, с), 7,89 (1H, с), 7,40 (1H, д, J=4,4), 7,16 (1H, д, J=2,0), 7,08 (1H, дд, J=2,0, 8,5), 7,00 (1H, д, J=8,5), 6,25 (1H, д, J=4,4), 4,82 (1H, д, J=3,9), 3,83 (3H, с), 3,77 (3H, с), 3,68-3,78 (1H, м), 3,50-3,60 (2H, м), 3,08-3,18 (2H, м), 1,80-1,90 (2H, м), 1,45-1,57 (2H, м). Одержання гідрохлориду (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-метилпіперазин-1-іл)тіофен-2іл]акрилонітрилу (сполука 13) 0,1н. хлористоводневу кислоту (14,9 мл) додають до сполуки 8 (500 мг) для розчинення і до одержаного розчину додають очищену воду (10 мл), з подальшим перемішуванням при кімнатній температурі протягом 1 години. Реакційну суміш ліофілізують з одержанням цільового продукту (вихід: 546 мг, 99 %). Жовтувато-оранжевий порошок. + МС (ESI, m/z): 370 (M-HCl+Н) . 12 UA 105162 C2 1 5 10 15 20 25 30 35 40 45 50 55 H-ЯМР (CDCl3) δ: 7,38 (1H, с), 7,21 (1H, д, J=4,1), 7,16 (1H, дд, J=2,2, 8,3), 7,05 (1H, д, J=2,2), 6,89 (1H, д, J=8,3), 6,16 (1H, д, J=4,1), 3,95 (3H, с), 3,92 (3H, с), 3,86-4,00 (2H, м), 3,65-3,78 (2H, м), 3,48-3,60 (2H, м), 2,98-3,11 (2H, м), 2,86 (3H, с). Одержання гідрохлориду (Z)-2-(3,4-диметоксифеніл)-3-{5-[4-(2-гідроксіетил)піперазин-1іл)тіофен-2-іл}акрилонітрилу (сполука 14) 0,1н. хлористоводневу кислоту (13,8 мл) додають до сполуки 9 (500 мг) для розчинення і до одержаного розчину додають очищену воду (10 мл), з подальшим перемішуванням при кімнатній температурі протягом 1 години. Реакційну суміш ліофілізують з одержанням цільового продукту (вихід: 540 мг, 99 %). Жовтувато-оранжевий порошок. + МС (ESI, m/z): 400 (M-HCl+Н) . 1 H-ЯМР (CDCl3) δ: 7,39 (1H, с), 7,22 (1H, д, J=4,1), 7,16 (1H, дд, J=2,2, 8,3), 7,05 (1H, д, J=2,2), 6,89 (1H, д, J=8,3), 6,16 (1H, д, J=4,2), 4,05-4,15 (2H, м), 3,95 (3H, с), 3,92 (3H, с), 3,90-4,05 (2H, м), 3,65-3,83 (4H, м), 3,05-3,25 (4H, м). Одержання гідрохлориду (Z)-2-(3,4-диметоксифеніл)-3-{5-[(2диметиламіноетил)метиламіно]тіофен-2-іл}акрилонітрилу (сполука 15) 0,1н. хлористоводневу кислоту (3,8 мл) додають до сполуки 10 (100 мг) і до даної суміші додають очищену воду (5 мл) і ацетонітрил (5 мл) для розчинення суміші. Вказаний розчин перемішують при кімнатній температурі протягом 1 години і розчинник випаровують досуха, з подальшим ретельним сушінням, одержуючи цільовий продукт (вихід: 100 мг, 91 %). Оранжевий порошок. + МС (ESI, m/z): 372 (M-HCl+Н) . 1 H-ЯМР (CDCl3) δ: 7,38 (1H, с), 7,21 (1H, д, J=4,1), 7,13 (1H, дд, J=2,2, 8,3), 7,03 (1H, д, J=2,2), 6,88 (1H, д, J=8,3), 6,09 (1H, д, J=4,1), 4,00-4,06 (2H, м), 3,95 (3H, с), 3,91 (3H, с), 3,24-3,30 (2H, м), 3,18 (3H, с), 2,90 (3H, с), 2,88 (3H, с). Одержання моно(1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл}піперидин-4іл)фосфату (сполука 16) Сполуку 6 (400 мг) і біс(2,2,2-трихлоретил)фосфорохлоридат (1,64 г) розчиняють в піридині (4 мл) і одержаний розчин перемішують при кімнатній температурі протягом 2 годин. Після завершення реакції до реакційної суміші додають метанол, з подальшим перемішуванням протягом 30 хвилин. Розчинник випаровують досуха і залишок очищують хроматографією на колонці з силікагелем (етилацетат:гексан=7:13) з одержанням 1-{5-[(Z)-2-ціано-2-(3,4диметоксифеніл)вініл]тіофен-2-іл}піперидин-4-іл-біс-(2,2,2-трихлоретил)-фосфату (вихід: 694 мг, 90 %). Одержаний 1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл}піперидин-4-іл-біс(2,2,2-трихлоретил)фосфат (385 мг) розчиняють в суміші розчинників (5 мл), що містить піридин і оцтову кислоту (4:1). До розчину додають порошок цинку (353 мг) і потім перемішують при кімнатній температурі протягом 4 годин. Нерозчинний порошок цинку видаляють фільтруванням + і до фільтрату додають смолу IRC748 (NH4 ) (11 г), з подальшим перемішуванням при кімнатній температурі протягом 30 хвилин. Смолоподібну речовину видаляють фільтруванням і розчинник випаровують досуха. Залишок промивають етанолом з одержанням цільового продукту (вихід: 195 мг, 80 %). Жовтувато-коричневий порошок. МС (ESI, m/z): 449 (M-H) . 1 H-ЯМР (ДМСО) δ: 1,71-1,77 (2H, м), 1,96-1,99 (2H, м), 3,23-3,28 (2H, м), 3,50-3,56 (2H, м), 3,77 (3H, с), 3,83 (3H, с), 4,27-4,30 (1H, м), 6,28 (1H, д, J=3,9), 7,01 (1H, д, J=8,8), 7,08 (1H, дд, J=2,0, 8,3), 7,16 (1H, д, J=2,0), 7,91 (1H, с), 8,58 (1H, д, J=3,9). Одержання натрієвої солі моно(1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2іл}піперидин-4-іл)фосфату (сполука 17) До сполуки 16 (100 мг) додають очищену воду (10 мл) з утворенням суспензії. До суспензії додають смолу IRC748 (Na) (2 г), з подальшим перемішуванням при кімнатній температурі. Після розчинення вихідних речовин смолоподібну речовину видаляють фільтруванням і розчинник випаровують при зниженому тиску з одержанням цільового продукту (вихід: 104 мг, 95 %). Жовтувато-коричневий порошок. + МС (ESI, m/z): 449 (M-2Na+Н) . 1 H-ЯМР (D2O) δ: 7,13 (1H, с), 6,90 (1H, д, J=2,2), 6,60-6,75 (3H, м), 5,96 (1H, д, J=4,1), 4,054,08 (1H, м), 3,64 (3H, с), 3,63 (3H, с), 3,42-3,45 (2H, м), 2,69-3,01 (2H, м), 1,91-1,92 (2H, м), 1,571,59 (2H, м). 13 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 Одержання моно(1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл}піперидин-4іл)сукцинату (сполука 18) Сполуку 6 (200 мг) розчиняють в піридині (2 мл) і до розчину додають янтарний ангідрид (270 мг), з подальшим перемішуванням при кип'ятінні зі зворотним холодильником протягом 2-х годин. Після завершення реакції до реакційної суміші додають метанол з подальшим перемішуванням протягом 30 хвилин. Розчинник випаровують досуха і залишок екстрагують хлороформом і очищеною водою. Органічний шар сушать над безводним сульфатом натрію і розчинник випаровують досуха. Залишок промивають гексаном з одержанням цільового продукту (вихід: 212 мг, 95 %). Жовтий порошок. МС (ESI, m/z): 469 (M-H) . 1 H-ЯМР (CDCl3) δ: 7,36 (1H, с), 7,22 (1H, д, J=4,1), 7,13 (1H, дд, J=2,2, 8,5), 7,04 (1H, д, J=2,2), 6,87 (1H, д, J=8,5), 6,05 (1H, д, J=4,1), 5,02-5,04 (1H, м), 3,94 (3H, с), 3,90 (3H, с), 3,50-3,55 (2H, м), 3,25-3,32 (2H, м), 2,69-2,72 (2H, м), 2,64-2,67 (2H, м), 2,00-2,05 (2H, м), 1,83-1,89 (2H, м). Одержання (Z)-2-(3,4-диметоксифеніл)-3-(5-нітрофуран-2-іл)акрилонітрилу (сполука 19) 5-нітро-2-фуральдегід (1,41 г) піддають реакції конденсації з 3,4-диметоксибензилціанідом (1,77 г) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 88 мг, 2,9 %). Оранжеві кристали. МС (APCI, m/z): 300 (M) . 1 H-ЯМР (CDCl3) δ: 7,53 (1H, д, J=3,9), 7,46 (1H, д, J=3,9), 7,36 (1H, с), 7,32 (1H, дд, J=2,4, 8,3), 7,13 (1H, д, J=2,4), 6,95 (1H, д, J=8,3), 3,97 (3H, с), 3,95 (3H, с), Одержання (Z)-2-(3,4-диметоксифеніл)-3-(5-гідроксиметилфуран-2-іл)акрилонітрилу (сполука 20) 5-ацетоксиметил-2-фуральдегід (505 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (532 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 726 мг, 85 %). Оранжеві кристали. МС (ESI, m/z): 284 (M-Н) . 1 H-ЯМР (CDCl3) δ: 7,26 (1H, с), 7,22 (1H, дд, J=2,4, 8,5), 7,12 (1H, д, J=3,7), 7,09 (1H, д, J=2,4), 6,91 (1H, д, J=8,5), 6,48 (1H, д, J=3,7), 4,49 (2H, д, J=6,3), 3,85 (3H, с), 3,80 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-[5-(3-нітрофеніл)фуран-2-іл]акрилонітрилу (сполука 21) 5-(3-нітрофеніл)фурфурал (1,09 г) піддають реакції конденсації з 3,4диметоксибензилціанідом (889 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 1,85 г, 98 %). Жовтувато-оранжеві кристали. МС (APCI, m/z): 376 (M) . 1 H-ЯМР (CDCl3) δ: 8,61 (1H, т, J=2,0), 8,17 (1H, дд, J=2,0, 8,1), 8,16 (1H, дд, J=2,0, 8,1), 7,64 (1H, т, J=8,1), 7,31 (1H, с), 7,30 (1H, дд, J=2,2, 8,5), 7,16 (1H, д, J=3,7), 7,15 (1H, д, J=2,2), 7,00 (1H, д, J=3,7), 6,94 (1H, д, J=8,5), 3,99 (3H, с), 3,94 (3H, с). Одержання (Z)-3-[5-(3-амінофеніл)фуран-2-іл]-2-(3,4-диметоксифеніл)-акрилонітрилу (сполука 22) До сполуки 21 (1,00 г) додають оцтову кислоту (300 мл) з утворенням суспензії. До суспензії додають порошок цинку (3,47 г), з подальшим перемішуванням при кімнатній температурі протягом 4-х годин. Реакційну суміш фільтрують через рихлий шар целіту і рихлий шар целіту промивають хлороформом. Фільтрат (розчин оцтова кислота-хлороформ) випаровують досуха. Залишок очищують хроматографією на колонці з силікагелем (хлороформ-метанол) з одержанням цільового продукту (вихід: 184 мг, 24 %). Жовті кристали. + МС (ESI, m/z): 347 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,24-7,28 (2H, м), 7,18-7,23 (3H, м), 7,14 (1H, д, J=2,4), 7,08 (1H, д, J=3,9), 6,92 (1H, д, J=8,8), 6,79 (1H, д, J=3,9), 6,65-6,68 (1H, м), 3,97 (3H, с), 3,93 (3H, с). Одержання гідрохлориду (Z)-3-[5-(3-амінофеніл)фуран-2-іл]-2-(3,4диметоксифеніл)акрилонітрилу (сполука 23) 0,1н. хлористоводневу кислоту (3,7 мл) додають до сполуки 22 (117 мг) і до одержаної суміші додають очищену воду (30 мл), ацетонітрил (30 мл) і хлороформ (5 мл) для розчинення суміші. Одержаний розчин перемішують при кімнатній температурі протягом 1 години і розчинник випаровують досуха. Залишок суспендують в суміші гексан-етилацетат і розчинник 14 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 випаровують досуха, з подальшим ретельним сушінням, одержуючи цільовий продукт (вихід: 124 мг, 96 %). Жовтувато-коричневий порошок. + МС (ESI, m/z): 347 (M-HCl+Н) . 1 H-ЯМР (ДМСО-d6) δ: 7,88 (1H, с), 7,75 (1H, уш.д, J=7,9), 7,63 (1H, уш.с), 7,53 (1H, т, J=7,9), 7,35 (1H, д, J=2,2), 7,22-7,28 (3H, м), 7,17 (1H, д, J=3,7), 7,09 (1H, д, J=8,8), 3,87 (3H, с), 3,82 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-(5-піперидин-1-ілфуран-2-іл)акрилонітрилу (сполука 24) Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з піперидину (1,28 г), вводять в 5-бром-2-фуральдегід (875 мг) з одержанням 5піперидин-1-ілфуран-2-карбальдегіду (вихід: 650 мг, 73 %). Одержаний 5-піперидин-1-ілфуран2-карбальдегід (179 мг) піддають реакції конденсації з 3,4-диметоксибензилціанідом (177 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 100 мг, 30 %). Оранжеві кристали. + МС (ESI, m/z): 339 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,13 (1H, дд, J=2,2, 8,5), 7,05 (1H, д, J=2,2), 6,94 (1H, с), 6,87 (1H, д, J=8,5), 6,84 (1H, д, J=3,4), 5,24 (1H, д, J=3,4), 3,94 (3H, с), 3,90 (3H, с), 3,37-3,42 (4H, м), 1,61-1,72 (6H, м). Одержання (Z)-2-(3,4-диметоксифеніл)-3-(5-морфолін-4-ілфуран-2-іл)акрилонітрилу (сполука 25) Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з морфоліну (523 мг), вводять в 5-бром-2-фуральдегід (350 мг) з одержанням 5морфолін-4-ілфуран-2-карбальдегіду (вихід: 138 мг, 38 %). Одержаний 5-морфолін-4-ілфуран-2карбальдегід (137 мг) піддають реакції конденсації з 3,4-диметоксибензилціанідом (135 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 102 мг, 40 %). Жовті кристали. + МС (ESI, m/z): 341 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,14 (1H, дд, J=2,2, 8,5), 7,05 (1H, д, J=2,2), 6,96 (1H, с), 6,88 (1H, д, J=8,5), 6,82 (1H, д, J=3,7), 5,29 (1H, д, J=3,7), 3,94 (3H, с), 3,91 (3H, с), 3,82-3,86 (4H, м), 3,37-3,42 (4H, м). Одержання (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-гідроксипіперидин-1-іл)фуран-2іл)акрилонітрилу (сполука 26) Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з 4-гідроксипіперидину (1,52 г), вводять в 5-бром-2-фуральдегід (875 мг) з одержанням 5-(4-гідроксипіперидин-1-іл)фуран-2-карбальдегіду (вихід: 660 мг, 68 %). Одержаний 5-(4-гідроксипіперидин-1-іл)фуран-2-карбальдегід (390 мг) піддають реакції конденсації з 3,4-диметоксибензилціанідом (354 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 458 мг, 65 %). Оранжеві кристали. + МС (ESI, m/z): 355 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,13 (1H, дд, J=2,2, 8,3), 7,05 (1H, д, J=2,2), 6,94 (1H, с), 6,87 (1H, д, J=8,3), 6,83 (1H, д, J=3,7), 5,28 (1H, д, J=3,7), 3,88-3,96 (1H, м), 3,93 (3H, с), 3,90 (3H, с), 3,77-3,82 (2H, м), 3,15-3,23 (2H, м), 1,97-2,05 (2H, м), 1,63-1,73 (2H, м). Одержання (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-метилпиперизин-1-іл)фуран-2іл)акрилонітрилу (сполука 27) Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з 1-метилпіперазину (1,03 г), вводять в 5-бром-2-фуральдегід (602 мг) з одержанням 5-(4-метилпіперазин-1-іл)фуран-2-карбальдегіду (вихід: 447 мг, 67 %). Одержаний 5-(4метилпіперазин-1-іл)фуран-2-карбальдегід (388 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (355 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 215 мг, 30 %). Жовті кристали. + МС (ESI, m/z): 354 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,14 (1H, дд, J=2,2, 8,5), 7,05 (1H, д, J=2,2), 6,95 (1H, с), 6,87 (1H, д, J=8,5), 6,83 (1H, д, J=3,7), 5,28 (1H, д, J=3,7), 3,94 (3H, с), 3,90 (3H, с), 3,41-3,48 (4H, м), 2,50-2,56 (4H, м), 2,35 (3H, с). 15 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержання (Z)-2-(3,4-диметоксифеніл)-3-{5-[4-(2-гідроксіетил)піперазин-1-іл]фуран-2іл}акрилонітрилу (сполука 28) Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з 1-піперазинетанолу (3,91 г), вводять в 5-бром-2-фуральдегід (1,75 г) з одержанням 5-[(4-(2-гідроксіетил)піперазин-1-іл)фуран-2-карбальдегіду (вихід: 1,37, 61 %). Одержаний 5-[(4(2-гідроксіетил)піперазин-1-іл)фуран-2-карбальдегід (1,12 г) піддають реакції конденсації з 3,4диметоксибензилціанідом (888 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 1,32 г, 69 %). Жовтувато-коричнева олія. + МС (ESI, m/z): 384 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,14 (1H, дд, J=2,2, 8,5), 7,05 (1H, д, J=2,2), 6,96 (1H, с), 6,87 (1H, д, J=8,5), 6,82 (1H, д, J=3,7), 5,28 (1H, д, J=3,7), 3,94 (3H, с), 3,90 (3H, с), 3,63-3,69 (2H, м), 3,42-3,48 (4H, м), 2,58-2,68 (6H, м). Одержання гідрохлориду (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-метилпіперазин-1-іл)фуран-2-іл] акрилонітрилу (сполука 29) 0,1н. хлористоводневу кислоту (3,1 мл) додають до сполуки 27 (100 мг) для розчинення і до одержаного розчину додають очищену воду (5 мл), з подальшим перемішуванням при кімнатній температурі протягом 30 хвилин. Реакційну суміш ліофілізують з одержанням цільового продукту (вихід: 109 мг, 99 %). Жовтувато-коричневий порошок. + МС (ESI, m/z): 354 (M-HCl+Н) . 1 H-ЯМР (CDCl3) δ: 7,16 (1H, дд, J=2,2, 8,5), 7,05 (1H, д, J=2,2), 6,98 (1H, с), 6,89 (1H, д, J=8,5), 6,77 (1H, д, J=3,7), 5,41 (1H, д, J=3,7), 3,94 (3H, с), 3,91 (3H, с), 3,85-3,95 (4H, м), 3,50-3,58 (2H, м), 2,97-3,08 (2H, м), 2,86 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-піридил-4-ілакрилонітрилу (сполука 30) 4-піридинкарбоксальдегід (2,14 г) піддають реакції конденсації з 3,4диметоксибензилціанідом (3,54 г) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 3,36 г, 63 %). Світло-жовті кристали. + МС (ESI, m/z): 267 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,73 (2H, д, J=6,3), 7,69 (2H, д, J=6,3), 7,36 (1H, с), 7,31 (1H, дд, J=2,4, 8,8), 7,17 (1H, д, J=2,4), 6,95 (1H, д, J=8,8), 3,97 (3H, с), 3,95 (3H, с). Одержання гідрохлориду (Z)-2-(3,4-диметоксифеніл)-3-піридин-4-ілакрилонітрилу (сполука 31) 0,1н. хлористоводневу кислоту (12,4 мл) додають до сполуки 30 (300 мг) і до одержаної суміші додають очищену воду (25 мл) і ацетонітрил (20 мл) для розчинення суміші. Одержаний розчин перемішують в темряві при кімнатній температурі протягом 4 годин і розчинник випаровують досуха. Залишок суспендують в суміші гексан-етилацетат і розчинник випаровують досуха, з подальшим ретельним сушінням, одержуючи цільовий продукт (вихід: 333 мг, 98 %). Жовтувато-оранжевий порошок. + МС (ESI, m/z): 267 (M-HCl+Н) . 1 H-ЯМР (ДМСО-d6) δ: 8,94 (2H, д, J=5,4), 8,20 (3H, уш.с), 7,46 (1H, д, J=2,2), 7,39 (1H, дд, J=2,2, 8,5), 7,15 (1H, д, J=8,5), 3,88 (3H, с), 3,85 (3H, с). Одержання метансульфонату (Z)-2-(3,4-диметоксифеніл)-3-піридин-4-ілакрилонітрилу (сполука 32) Водний розчин метансульфонової кислоти, 0,1 моль/л (10,0 мл), додають до сполуки 30 (266 мг) і до одержаного розчину додають очищену воду (10 мл) і ацетонітрил (5 мл) для розчинення суміші. Одержаний розчин перемішують в темряві при кімнатній температурі протягом 3 годин і розчинник випаровують досуха. Залишок суспендують в метанолі і розчинник випаровують досуха, з подальшим ретельним сушінням, одержуючи цільовий продукт (вихід: 350 мг, 97 %). Жовтувато-оранжеві кристали. + МС (ESI, m/z): 267 (M-CH3SO3H+Н) . 1 H-ЯМР (ДМСО-d6) δ: 9,01 (2H, д, J=6,8), 8,35 (2H, д, J=6,8), 8,22 (1H, с), 7,45 (1H, д, J=2,0), 7,39 (1H, дд, J=2,0, 8,3), 7,14 (1H, д, J=8,3), 3,87 (3H, с), 3,83 (3H, с), 2,40 (3H, с). Одержання N-оксиду (Z)-2-(3,4-диметоксифеніл)-3-піридин-4-ілакрилонітрилу (сполука 33) Сполуку 30 (266 мг) розчиняють в безводному дихлорметані (50 мл). До одержаного розчину додають краплями м-хлорпероксибензойну кислоту (266 мг) при перемішуванні на крижаній бані. Суміш перемішують протягом 15 хвилин в атмосфері аргону, який вводять з балону, заповненого аргоном. Далі суміш знов доводять до кімнатної температури і потім перемішують протягом приблизно 3 годин. Реакційну суміш екстрагують очищеною водою і хлороформом. 16 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 60 Органічний шар промивають насиченим розчином солі і промитий органічний шар сушать над безводним сульфатом натрію. Розчинник випаровують досуха. Залишок очищують хроматографією на колонці з силікагелем (хлороформ-метанол) з одержанням цільового продукту (вихід: 265 мг, 94 %). Жовті кристали. + МС (ESI, m/z): 283 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,23 (2H, д, J=7,3), 7,79 (2H, д, J=7,3), 7,29 (1H, дд, J=2,4, 8,3), 7,26 (1H, с), 7,13 (1H, д, J=2,4), 6,94 (1H, д, J=8,3), 3,97 (3H, с), 3,95 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-піридин-3-ілакрилонітрилу (сполука 34) 3-піридинкарбоксальдегід (2,14 г) піддають реакції конденсації з 3,4диметоксибензилціанідом (3,54 г) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 4,79 г, 90 %). Світло-жовті кристали. + МС (ESI, m/z): 267 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,83 (1H, д, J=2,4), 8,64 (1H, дд, J=1,5, 4,9), 8,44-8,48 (1H, м), 7,40-7,45 (2H, м), 7,30 (1H, дд, J=2,0, 8,3), 7,16 (1H, д, J=2,0), 6,94 (1H, д, J=8,3), 3,98 (3H, с), 3,95 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-(6-метоксипіридин-3-іл)акрилонітрилу (сполука 35) 6-метокси-3-піридинкарбоксальдегід (411 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (532 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 850 мг, 96 %). Світло-жовті кристали. + МС (ESI, m/z): 267 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,40-8,45 (1H, м), 8,42 (1H, с), 7,34 (1H, с), 7,25 (1H, дд, J=2,2, 8,5), 7,13 (1H, д, J=2,2), 6,92 (1H, д, J=8,5), 6,85 (1H, м), 4,00 (3H, с), 3,97 (3H, с), 3,93 (3H, с). Одержання гідрохлориду (Z)-2-(3,4-диметоксифеніл)-3-піридин-3-ілакрилонітрилу (сполука 36) 0,1н. хлористоводневу кислоту (21,0 мл) додають до сполуки 34 (500 мг) і до суміші додають очищену воду (40 мл), ацетонітрил (50 мл) і хлороформ (1 мл) для розчинення суміші. Одержаний розчин перемішують в темряві при кімнатній температурі протягом 3 годин і розчинник випаровують досуха. Осаджені кристали ретельно сушать з одержанням цільового продукту (вихід: 550 мг, 97 %). Жовті кристали. + МС (ESI, m/z): 267 (M-HCl+Н) . 1 H-ЯМР (ДМСО-d6) δ: 9,12 (1H, уш.с), 8,80 (1H, уш.д, J=4,8), 8,65 (1H, уш.д, J=8,3), 8,14 (1H, с), 7,88 (1H, м), 7,40 (1H, д, J=2,4), 7,32 (1H, дд, J=2,4, 8,5), 7,13 (1H, д, J=8,8), 3,88 (3H, с), 3,83 (3H, с). Одержання гідрохлориду (Z)-2-(3,4-диметоксифеніл)-3-(6-метокси-піридин-3іл)акрилонітрилу (сполука 37) 0,1н. хлористоводневу кислоту (2,0 мл) додають до сполуки 35 (50 мг) і до одержаної суміші додають очищену воду (8 мл) і ацетонітрил (8 мл) для розчинення суміші. Одержаний розчин перемішують в темряві при кімнатній температурі протягом 4 годин і розчинник випаровують досуха. Осаджені кристали ретельно сушать з одержанням цільового продукту (вихід: 55 мг, 98 %). Жовті кристали. + МС (ESI, m/z): 297 (M-HCl+Н) . 1 H-ЯМР (ДМСО-d6) δ: 8,63 (1H, д, J=2,4), 8,35 (1H, дд, J=2,4, 8,8), 7,33 (1H, д, J=2,2), 7,25 (1H, дд, J=2,2, 8,5), 7,08 (1H, д, J=8,5), 7,02 (1H, д, J=8,8), 3,93 (3H, с), 3,86 (3H, с), 3,81 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-піридин-2-ілакрилонітрилу (сполука 38) 2-піридинкарбоксальдегід (2,14 г) піддають реакції конденсації з 3,4диметоксибензилціанідом (3,54 г) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 3,77 г, 71 %). Світло-жовті кристали. + МС (ESI, m/z): 267 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,73-8,77 (1H, м), 8,01 (1H, д, J=8,3), 7,81 (1H, м), 7,57 (1H, с), 7,36 (1H, дд, J=2,2, 8,5), 7,31 (1H, дд, J=4,9, 7,8), 7,23 (1H, д, J=2,4), 6,94 (1H, д, J=8,3), 3,96 (3H, с), 3,94 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-(1Н-пірол-2-іл)акрилонітрилу (сполука 39) Пірол-2-карбоксальдегід (951 мг) розчиняють в дихлорметані (50 мл) і до розчину додають ди-трет-бутилдикарбонат (2,40 г), 4-диметоксіамінопіридин (61 мг) і триетиламін (1,01 г), потім одержану суміш перемішують при кімнатній температурі протягом 30 хвилин. Розчинник 17 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 60 випаровують досуха і залишок очищують хроматографією на колонці з силікагелем (хлороформ) з одержанням трет-бутил-2-формілпірол-1-карбоксилату (вихід: 1,95 г, приблизно 100 %). Одержаний трет-бутил-2-формілпірол-1-карбоксилат (976 мг) піддають реакції конденсації з 3,4-диметоксибензилціанідом (886 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 300 мг, 24 %). Жовтий порошок. МС (ESI, m/z): 253 (M-H) . 1 H-ЯМР (CDCl3) δ: 9,74 (1H, уш.с), 7,28 (1H, с), 7,15 (1H, дд, J=2,2, 8,3), 7,05 (2H, м), 6,90 (1H, д, J=8,3), 6,63-6,68 (1H, м), 6,32-6,36 (1H, м), 3,95 (3H, с), 3,92 (3H, с). Одержання гідрохлориду (Z)-2-(3,4-диметоксифеніл)-3-(1Н-пірол-2-іл)акрилонітрилу (сполука 40) 0,1н. хлористоводневу кислоту (4,3 мл) додають до сполуки 39 (100 мг) і до суміші додають ацетонітрил (20 мл) для розчинення суміші. Одержаний розчин перемішують в темряві при кімнатній температурі протягом 2,5 години і розчинник випаровують досуха. Осаджені кристали ретельно сушать з одержанням цільового продукту (вихід: 100 мг, 88 %). Жовтий порошок. + МС (ESI, m/z): 253 (M-HCl+Н) . 1 H-ЯМР (ДМСО-d6) δ: 11,38 (1H, уш.с), 7,63 (1H, с), 7,02-7,17 (5H, м), 6,28-6,32 (1H, м), 3,83 (3H, с), 3,79 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-(3Н-імідазол-4-іл)акрилонітрилу (сполука 41) 4(5)-імідазолкарбоксальдегід (285 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (532 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 75 г, 10 %). Світло-жовтий порошок. + МС (ESI, m/z): 256 (M+Н) . 1 H-ЯМР (ДМСО-d6) δ: 12,5 (1H, уш.с), 7,86 (1H, с), 7,75 (1H, д, J=3,9), 7,25 (1H, д, J=2,2), 7,18 (1H, дд, J=2,2, 8,5), 7,04 (1H, д, J=8,5), 3,84 (3H, с), 3,79 (3H, с). Одержання (Z)-3-(3-бензил-2-метилсульфаніл-3Н-імідазол-4-іл)-2-(3,4диметоксифеніл)акрилонітрилу (сполука 42) 1-бензил-2-(метилсульфаніл)-1Н-імідазол-5-карбальдегід (465 мг) піддають реакції конденсації з 3,4-диметоксибензилціанідом (354 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 723 мг, 92 %). Жовтий порошок. + МС (ESI, m/z): 392 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,24 (1H, с), 7,40-7,30 (3H, м), 7,14-7,10 (2H, м), 6,99 (1H, дд, J=2,2, 8,5), 6,94 (1H, д, J=1,0), 6,83 (1H, д, J=8,5), 6,78 (1H, д, J=2,2), 5,23 (2H, с), 3,89 (3H, с), 3,84 (3H, с), 2,72 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-(4-метил-2-фенілтіазол-5-іл)акрилонітрилу (сполука 43) 4-метил-2-феніл-1,3-тіазол-5-карбальдегід (407 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (354 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 667 мг, 92 %). Жовтий порошок. + МС (ESI, m/z): 363 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,06-8,00 (2H, м), 7,56 (1H, с), 7,49-7,44 (3H, м), 7,25 (1H, дд, J=2,2, 8,5), 7,13 (1H, д, J=2,2), 6,93 (1H, д, J=8,5), 3,97 (3H, с), 3,94 (3H, с), 2,65 (3H, с). Одержання (Z)-3-(3,4-диметоксифеніл)-2-піридин-3-ілакрилонітрилу (сполука 44) 3-піридинацетонітрил (1,18 г) піддають реакції конденсації з 3,4-диметоксибензальдегідом (1,66 г) відповідно до способу В (стадія одержання 2) з одержанням цільового продукту (вихід: 1,96 г, 74 %). Світло-жовті кристали. + МС (ESI, m/z): 267 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,91 (1H, д, J=2,7), 8,61 (1H, дд, J=1,5, 4,9), 7,92-7,97 (1H, м), 7,74 (1H, д, J=2,2), 7,49 (1H, с), 7,36-7,41 (2H, м), 6,95 (1H, д, J=8,5), 3,98 (3H, с), 3,96 (3H, с). Одержання (Z)-3-(3,4-диметоксифеніл)-2-піридин-2-ілакрилонітрилу (сполука 45) 2-піридинацетонітрил (1,18 г) піддають реакції конденсації з 3,4-диметоксибензальдегідом (1,66 г) відповідно до способу В (стадія одержання 2) з одержанням цільового продукту (вихід: 2,06 мг, 77 %). Світло-жовті кристали. + МС (ESI, m/z): 267 (M+Н) . 18 UA 105162 C2 1 5 10 15 20 25 30 35 40 45 50 55 H-ЯМР (CDCl3) δ: 8,61-8,65 (1H, м), 8,41 (1H, с), 7,73-7,81 (3H, м), 7,52 (1H, дд, J=2,1, 8,3), 7,28 (1H, м), 6,96 (1H, д, J=8,3), 3,98 (3H, с), 3,96 (3H, с). Одержання гідрохлориду (Z)-3-(3,4-диметоксифеніл)-2-піридин-3-ілакрилонітрилу (сполука 46) 0,1н. хлористоводневу кислоту (8,3 мл) додають до сполуки 44 (200 мг) для розчинення і до суміші додають очищену воду (5 мл), з подальшим перемішуванням при кімнатній температурі протягом 20 хвилин. Реакційну суміш ліофілізують з одержанням цільового продукту (вихід: 224 мг, 99 %). Жовтий порошок. + МС (ESI, m/z): 267 (M-HCl+Н) . 1 H-ЯМР (ДМСО-d6) δ: 9,04 (1H, д, J=1,7), 8,71 (1H, дд, J=1,5, 5,1), 8,33-8,38 (1H, м), 8,16 (1H, с), 7,76 (1H, дд, J=5,1, 8,1), 7,70 (1H, д, J=2,2), 7,60 (1H, дд, J=2,2, 8,5), 7,17 (1H, д, J=8,5), 3,85 (3H, с), 3,82 (3H, с). Одержання гідрохлориду (Z)-3-(3,4-диметоксифеніл)-2-піридин-2-ілакрилонітрилу (сполука 47) 0,1н. хлористоводневу кислоту (4,1 мл) додають до сполуки 45 (100 мг) і до суміші додають ацетонітрил (20 мл) для розчинення суміші. Розчин перемішують в темряві при кімнатній температурі протягом 1 години і розчинник випаровують досуха. Осаджені кристали ретельно сушать, одержуючи цільовий продукт (вихід: 112 мг, 99 %). Жовті кристали. + МС (ESI, m/z): 267 (M-HCl+Н) . 1 H-ЯМР (ДМСО-d6) δ: 8,63-8,67 (1H, м), 8,41 (1H, с), 7,92-7,98 (1H, м), 7,82 (1H, д, J=8,3), 7,76 (1H, д, J=2,0), 7,66 (1H, дд, J=2,0, 8,3), 7,43 (1H, дд, J=4,8, 7,4), 7,16 (1H, д, J=8,3), 3,86 (3H, с), 3,83 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-{5-[(2-диметиламіно-етил)метиламіно]фуран-2іл}акрилонітрилу (сполука 48) Відповідно до методики, що використовується на стадії одержання 1, амінопохідне, одержане з N, N,N'-триметилетилендіаміну (3,06 г), вводять в 5-бром-2-фуральдегід (1,75 г) з одержанням 5-(4-метилпіперазин-1-іл)фуран-2-карбальдегіду (вихід: 1,18 г, 60 %). Одержаний 5(4-метилпіперазин-1-іл)фуран-2-карбальдегід (1,18 г) піддають реакції конденсації з 3,4диметоксибензилціанідом (1,06 г) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 2,06 г, 96 %). Жовтувато-коричнева олія. + МС (ESI, m/z): 356 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,12 (1H, дд, J=2,2, 8,5), 7,05 (1H, д, J=2,2), 6,92 (1H, с), 6,86 (1H, д, J=8,5), 6,83 (1H, д, J=3,7), 5,16 (1H, д, J=3,7), 3,94 (3H, с), 3,90 (3H, с), 3,53 (2H, т, J=7,0), 3,07 (3H, с), 2,56 (2H, т, J=3,7), 2,31 (6H, с). Одержання гідрохлориду (Z)-2-(3,4-диметоксифеніл)-3-{5-[(2диметиламіноетил)метиламіно]фуран-2-іл}акрилонітрилу (сполука 49) 0,1н. хлористоводневу кислоту (12,5 мл) додають до сполуки 48 (404 мг) для розчинення і до одержаного розчину додають очищену воду (20 мл), з подальшим перемішуванням при кімнатній температурі протягом 20 хвилин. Реакційну суміш ліофілізують з одержанням цільового продукту (вихід: 400 мг, 90 %). Жовто-коричневий порошок. + МС (ESI, m/z): 356 (M-HCl+Н) . 1 H-ЯМР (CDCl3) δ: 7,11 (1H, дд, J=2,2, 8,5), 7,02 (1H, д, J=2,2), 6,91 (1H, с), 6,88 (1H, д, J=8,5), 6,70 (1H, д, J=3,7), 5,24 (1H, д, J=3,7), 4,03 (2H, т, J=7,3), 3,94 (3H, с), 3,91 (3H, с), 3,44 (2H, т, J=7,3), 3,11 (3H, с), 2,89 (6H, с). Одержання гідрохлориду (Z)-2-(3,4-диметоксифеніл)-3-{5-[4-(2-гідроксіетил)піперазин-1іл]фуран-2-іл}акрилонітрилу (сполука 50) 0,1н. хлористоводневу кислоту (11,8 мл) додають до сполуки 28 (410 мг) для розчинення і до розчину додають очищену воду (20 мл), з подальшим перемішуванням при кімнатній температурі протягом 20 хвилин. Реакційну суміш ліофілізують з одержанням цільового продукту (вихід: 404 мг, 90 %). Жовтувато-коричневий порошок. + МС (ESI, m/z): 384 (M-HCl+Н) . 1 H-ЯМР (CDCl3) δ: 7,16 (1H, дд, J=2,2, 8,5), 7,05 (1H, д, J=2,2), 6,98 (1H, с), 6,89 (1H, д, J=8,5), 6,77 (1H, д, J=3,7), 5,41 (1H, д, J=3,7), 4,05-4,12 (2H, м), 3,94 (3H, с), 3,91 (3H, с), 3,90-3,94 (6H, м), 3,49 (2H, с), 3,18-3,22 (2H, м). 19 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержання моно(1-{5-[(Z)-2-ціано-2(3,4-диметоксифеніл)вініл]фуран-2-іл}піперидин-4іл)сукцинату (сполука 51) Сполуку 26 (800 мг) розчиняють в піридині (4 мл) і до розчину додають янтарний ангідрид (1,13 г), з подальшим перемішуванням при кип'ятінні зі зворотним холодильником протягом 2 годин. Після завершення реакції до реакційної суміші додають метанол, з подальшим перемішуванням протягом 30 хвилин. Розчинник випаровують досуха і залишок екстрагують хлороформом і очищеною водою. Органічний шар сушать над безводним сульфатом натрію і розчинник випаровують досуха. Залишок промивають гексаном з одержанням цільового продукту (вихід: 954 мг, 93 %) Жовтий порошок. МС (ESI, m/z): 453 (M-H) . 1 H-ЯМР (ДМСО) δ: 1,64-1,66 (2H, м), 1,87-1,89 (2H, м), 2,08-2,13 (2H, м), 2,34-2,39 (2H, м), 3,21-3,28 (2H, м), 3,59-3,62 (2H, м), 3,77 (3H, с), 3,82 (3H, с), 4,86-4,88 (1H, м), 5,60 (1H, д, J=3,7), 6,96 (1H, д, J=3,4), 7,00 (1H, д, J=8,5), 7,09 (1H, дд, J=2,0, 8,5), 7,16 (1H, д, J=2,0), 7,46 (1H, с). Одержання моно(1-{5-[(Z)-2-ціано-2(3,4-диметоксифеніл)вініл]фуран-2-іл}піперидин-4іл)фосфату (сполука 52) Сполуку 26 (383 мг) і біс(2,2,2-трихлоретил)фосфорохлоридат (1,64 г) розчиняють в піридині (4 мл) і одержаний розчин перемішують при кімнатній температурі протягом 2 годин. Після завершення реакції до реакційної суміші додають метанол, з подальшим перемішуванням протягом 30 хвилин. Розчинник випаровують досуха і залишок очищують хроматографією на колонці з силікагелем (етилацетат:гексан=7:13) з одержанням 1-{5-[(Z)-2-ціано-2-(3,4диметоксифеніл)вініл]фуран-2-іл}піперидин-4-іл-біс(2,2,2-трихлоретил)фосфату (вихід: 663 мг, 88 %). Одержаний 1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]фуран-2-іл}піперидин-4-іл-біс(2,2,2трихлоретил)фосфат (376 мг) розчиняють в суміші розчинників (5 мл), що містить піридин і оцтову кислоту (4:1). До розчину додають порошок цинку (353 мг) і все перемішують при кімнатній температурі протягом 4 годин. Нерозчинний порошок цинку видаляють фільтруванням + і до фільтрату додають смолу IRC748 (NH4 ) (11 г), з подальшим перемішуванням при кімнатній температурі протягом 30 хвилин. Смолоподібну речовину видаляють фільтруванням і розчинник випаровують досуха. Залишок промивають етанолом з одержанням цільового продукту (вихід: 192 мг, 82 %). Жовтувато-коричневий порошок. МС (ESI, m/z): 433 (M-H) . 1 H-ЯМР (ДМСО) δ: 1,68-1,72 (2H, м), 1,93-1,99 (2H, м), 3,24-3,30 (2H, м), 3,60-3,63 (2H, м), 3,77 (3H, с), 3,82 (3H, с), 4,27-4,30 (1H, м), 5,58 (1H, д, J=3,7), 6,96 (1H, д, J=3,4), 6,99 (1H, д, J=8,5), 7,08 (1H, дд, J=2,0, 8,5), 7,15 (1H, д, J=2,0), 7,44 (1H, с). Одержання натрієвої солі моно(1-{5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]фуран-2іл}піперидин-4-іл)фосфату (сполука 53) До сполуки 52 (96 мг) додають очищену воду (10 мл) з утворенням суспензії. До одержаної суспензії додають смолу IRC748 (Na) (2 г), з подальшими перемішуванням при кімнатній температурі. Після розчинення вихідних речовин смолоподібну речовину видаляють фільтруванням і розчинник випаровують досуха, одержуючи цільовий продукт (вихід: 93 мг, 96 %). Жовтувато-коричневий порошок. + МС (ESI, m/z): 433 (M-2Na+Н) . 1 H-ЯМР (D2O) δ: 1,50-1,53 (2H, м), 1,87-1,91 (2H, м), 2,96-2,99 (2H, м), 3,53-3,66 (2H, м), 3,64 (3H, с), 3,66 (3H, с), 4,04-4,06 (1H, м), 5,31 (1H, д, J=3,7), 6,64 (1H, д, J=3,9), 6,69-6,72 (2H, м), 6,78-6,81 (1H, м), 6,84 (1H, с). Одержання (Z)-3-(5-бромфуран-2-іл)-2-(3,4-диметоксифеніл)акрилонітрилу (сполука 54) 5-бром-2-фуральдегід (350 мг) піддають реакції конденсації з 3,4-диметоксибензилціанідом (354 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 558 мг, 84 %). Світло-жовті кристали. + МС (APCI, m/z): 334 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,23 (1H, с), 7,22 (1H, д, J=3,7), 7,22 (1H, дд, J=2,2, 8,5), 7,08 (1H, д, J=2,2), 6,91 (1H, д, J=8,5), 6,51 (1H, д, J=3,7), 3,95 (3H, с), 3,93 (3H,с). Одержання (Е)-3-(3,4-диметоксифеніл)-2-тіофен-2-ілакрилонітрилу (сполука 55) 2-тіофенацетонітрил (246 мг) піддають реакції конденсації з 3,4-диметоксибензальдегідом (332 мг) відповідно до способу В (стадія одержання 2) з одержанням цільового продукту (вихід: 262 мг, 48 %). 20 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 60 Жовті кристали. + МС (APCI, m/z): 272 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,64 (1H, д, J=2,0), 7,31-7,36 (2H, м), 7,31 (1H, с), 7,28 (1H, дд, J=1,2, 5,1), 7,07 (1H, дд, J=3,7, 5,1), 6,92 (1H, д, J=8,5), 3,97 (3H, с), 3,95 (3H, с). Одержання (Z)-3-(3,4-диметоксифеніл)-2-тіофен-3-ілакрилонітрилу (сполука 56) 3-тіофенацетонітрил (246 мг) піддають реакції конденсації з 3,4-диметоксибензальдегідом (332 мг) відповідно до способу В (стадія одержання 2) з одержанням цільового продукту (вихід: 354 мг, 65 %). Світло-жовті кристали. + МС (APCI, m/z): 272 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,66 (1H, д, J=2,0), 7,55 (1H, дд, J=1,4, 2,9), 7,40 (1H, дд, J=2,9, 5,1), 7,38 (1H, с), 7,35 (1H, дд, J=1,4, 5,1), 7,33 (1H, дд, J=2,0, 8,0), 6,92 (1H, д, J=8,0), 3,97 (3H, с), 3,95 (3H, с). Одержання натрієвої солі моно(1-{5-[(Z)-2-ціано-2(3,4-диметоксифеніл)вініл]тіофен-2іл}піперидин-4-іл)сукцинату (сполука 57) До сполуки 18 (104 мг) додають очищену воду (10 мл) з утворенням суспензії. До суспензії додають смолу IRC748 (Nа) (2 г), з подальшим перемішуванням при кімнатній температурі. Після розчинення вихідних речовин смолоподібну речовину видаляють фільтруванням і розчинник випаровують досуха з одержанням цільового продукту (вихід: 102 мг, 94 %). Жовтий порошок. МС (ESI, m/z): 469 (M-Na) . 1 H-ЯМР (D2O) δ: 1,42-1,48 (2H, м), 1,64-1,70 (2H, м), 2,28-2,32 (2H, м), 2,39-2,43 (2H, м), 2,722,78 (2H, м), 3,05-3,10 (2H, м), 3,52 (3H, с), 3,62 (3H, с), 4,65-4,73 (1H, м), 5,67 (1H, д, J=3,4), 6,45 (1H, д, J=8,1), 6,59-6,61 (2H, м), 6,83 (1H, д, J=3,9), 7,03 (1H, с). Одержання натрієвої солі моно(1-{5-[(Z)-2-ціано-2(3,4-диметоксифеніл)вініл]фуран-2іл}піперидин-4-іл)сукцинату (сполука 58) До сполуки 51 (101 мг) додають очищену воду (10 мл) з утворенням суспензії. До суспензії додають смолу IRC748 (Nа) (2 г), з подальшим перемішуванням при кімнатній температурі. Після розчинення вихідних речовин смолоподібну речовину видаляють фільтруванням і розчинник випаровують досуха з одержанням цільового продукту (вихід: 96 мг, 91 %). Жовтий порошок. МС (ESI, m/z): 453 (M-Na) . 1 H-ЯМР (D2O) δ: 1,44-1,52 (2H, м), 1,68-1,72 (2H, м), 2,31-2,34 (2H, м), 2,40-2,45 (2H, м), 2,912,98 (2H, м), 3,25-3,33 (2H, м), 3,56 (3H, с), 3,59 (3H, с), 4,68-4,76 (1H, м), 5,10-5,12 (1H, м), 6,446,49 (2H, м), 6,56-6,57 (3H, м). Одержання метансульфонату (Z)-2-(3,4-диметоксифеніл)-{5-[4-(2-гідроксіетил)піперазин-1іл]тіофен-2-іл}акрилонітрилу (сполука 59) До сполуки 9 (500 мг) додають метансульфонову кислоту (81,6 мкл) і етанол (10 мл) і суміш нагрівають для розчинення (зовнішня температура 70 °C). Розчин знов доводять до кімнатної температури, з подальшим перемішуванням протягом ночі. Осаджені кристали відновлюють фільтруванням і відновлені кристали промивають послідовно невеликою кількістю етанолу і гексану. Кристали ретельно сушать, одержуючи цільовий продукт (вихід: 530 мг, 85 %). Жовті кристали. + МС (ESI, m/z): 400 (M-CH3SO3H+Н) . 1 H-ЯМР (ДМСО-d6) δ: 7,98 (1H, с), 7,45 (1H, д, J=4,4), 7,19 (1H, д, J=2,2), 7,11 (1H, дд, J=2,2, 8,5), 7,02 (1H, д, J=8,5), 6,42 (1H, д, J=4,4), 3,83 (3H, с), 3,78 (3H, с), 3,75-3,83 (4H, м), 3,57-3,64 (2H, м), 3,25-3,40 (6H, м), 2,30 (3H, с). Одержання гідрохлориду 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин4-іл-N-(2-діетиламіноетил)сукцинамату (сполука 60) Сполуку 18 (235 мг) розчиняють в метиленхлориді (10 мл) і до розчину додають 2-хлор-4,6диметокси-1,3,5-триазин (105 мг) і N-метилморфолін (66 мкл), з подальшим перемішуванням протягом 30 хвилин при охолоджуванні льодом. Потім до суміші додають N, Nдіетилетилендіамін (85 мкл) і N-метилморфолін (110 мкл), з подальшим перемішуванням при кімнатній температурі протягом 17 годин. Розчинник випаровують досуха і осад очищують хроматографією на колонці з силікагелем (CHCl 3-MeOH) з одержанням цільового продукту (вихід: 287 мг, 95 %). Жовтий порошок. + МС (ESI, m/z): 569 (M-HCl+Н) . 1 H-ЯМР (CDCl3) δ: 7,60 (1H, м), 7,37 (1H, с), 7,22 (1H, д, J=4,1), 7,13 (1H, дд, J=2,2, 8,3), 7,04 (1H, д, J=2,2), 6,87 (1H, д, J=4,1), 6,05 (1H, д, J=8,5Гц), 4,96-5,00 (1H, м), 3,94 (3H, с), 3,90 (3H, с), 21 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 3,50-3,56 (2H, м), 3,39-3,43 (2H, м), 3,25-3,31 (2H, м), 3,05-3,17 (6H, м), 2,65-2,69 (2H, м), 2,562,59 (2H, м), 2,02-2,12 (2H, м), 1,97-2,01 (2H, м), 1,83-1,90 (2H, м), 1,39 (6H, т, J=7,3). Одержання гідрохлориду 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин4-іл-N-(3-діетиламінопропіл)сукцинамату (сполука 61) Сполуку 18 (235 мг) розчиняють в метиленхлориді (10 мл) і до розчину додають 2-хлор-4,6диметокси-1,3,5-триазин (105 мг) і N-метилморфолін (66 мкл), з подальшим перемішуванням протягом 30 хвилин при охолоджуванні льодом. Потім до суміші додають N, N-діетил-1,3діамінопропан (94 мкл) і N-метилморфолін (110 мкл), з подальшим перемішуванням при кімнатній температурі протягом 17 годин. Розчинник випаровують досуха і осад очищують хроматографією на колонці з силікагелем (CHCl3-MeOH) з одержанням цільового продукту (вихід: 279 мг, 90 %). Жовтий порошок. + МС (ESI, m/z): 583 (M-HCl+Н) . 1 H-ЯМР (CDCl3) δ: 7,60 (1H, м), 7,37 (1H, с), 7,22 (1H, д, J=4,1), 7,13 (1H, дд, J=2,2, 8,3),7,04 (1H, д, J=2,2), 6,87 (1H, д, J=4,1), 6,05 (1H, д, J=8,5), 4,96-5,00 (1H, м), 3,94 (3H, с), 3,90 (3H, с), 3,50-3,56 (2H, м), 3,39-3,43 (2H, м), 3,25-3,31 (2H, м), 3,05-3,17 (6H, м), 2,65-2,69 (2H, м), 2,562,59 (2H, м), 2,02-2,12 (2H, м), 1,97-2,01 (2H, м), 1,83-1,90 (2H, м), 1,39 (6H, т, J=7,3). (1) Одержання 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4ілдиметиламіноацетату Сполуку 6 (3,70 г) розчиняють в піридині (100 мл) і до розчину додають N, N-диметилгліцин (5,15 г), з подальшим перемішуванням при кімнатній температурі протягом 1 години. Далі до суміші додають п-толуолсульфонілхлорид (9,43 г), з подальшим перемішуванням при кип'ятінні зі зворотним холодильником протягом 12 годин. Після завершення реакції розчинник випаровують досуха. До залишку додають хлороформ (800 мл) і суміш промивають три рази водою. pH водного шару перевіряють по лакмусовому папірцю і доводять до 4-5 з використанням 1н. водної хлористоводневої кислоти. Органічний шар сушать над безводним сульфатом натрію і розчинник випаровують досуха. Залишок очищують хроматографією на колонці з силікагелем (СHCl3-гексан) з одержанням цільового продукту (вихід: 3,48 г, 76 %). Жовтий порошок. + МС (ESI, m/z): 456 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,36 (1H, с), 7,22 (1H, д, J=4,1), 7,13 (1H, дд, J=2,2, 8,3), 7,04 (1H, д, J=2,2), 6,87 (1H, д, J=8,5), 6,05 (1H, д, J=4,1), 5,03-5,09 (1H, м), 3,94 (3H, с), 3,90 (3H, с), 3,54-3,60 (2H, м), 3,24-3,30 (2H, м), 3,19 (2H, с), 2,37 (6H, с), 2,02-2,07 (2H, м), 1,83-1,91 (2H, м). (2) Одержання п-толуолсульфонату 1-[5-[(Z)-2-ціано-2-(3,4-диметокси-феніл)вініл]тіофен-2іл]піперидин-4-ілдиметиламіноацетату (сполука 62) Сполуку 6 (370 мг) розчиняють в толуолі (80 мл) і до розчину додають гідрохлорид N, Nдиметилгліцину (140 мг) і моногідрат толуолсульфонової кислоти (380 мг), з подальшим перемішуванням при кип'ятінні зі зворотним холодильником протягом 5 годин. Розчинник випаровують досуха і залишок очищують хроматографією на колонці з силікагелем (СHCl 3MeOH) з одержанням цільового продукту (вихід: 38 мг, 7,7 %). Жовтий порошок. + МС (ESI, m/z): 456 (M+Н) . 1 H-ЯМР (ДМСО) δ: 7,94 (1H, с), 7,49 (4H, д, J=7,8), 7,43 (1H, д, J=4,1), 7,17 (1H, д, J=2,2), 7,12 (4H, д, J=7,8), 7,09 (1H, дд, J=2,2, 8,5), 7,00 (1H, д, J=8,5), 6,32 (1H, д, J=4,1), 5,09-5,12 (1H, м), 4,26 (2H, с), 3,83 (3H, с), 3,78 (3H, с), 3,51-3,55 (2H, м), 3,31-3,37 (2H, м), 2,89 (6H, с), 2,29 (6H, с), 2,02-2,06 (2H, м), 1,78-1,82 (2H, м). Одержання гідрохлориду 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин4-іл-[1,4']біпіперидиніл-1'-карбоксилату (сполука 63) Сполуку 6 (2,00 г) розчиняють в піридині (50 мл) і до розчину додають 1-хлоркарбоніл-4піперидинопіперидин (2,50 г), з подальшим перемішуванням при кип'ятінні зі зворотним холодильником протягом 2 годин. Після завершення реакції до реакційної суміші додають метанол, з подальшим перемішуванням протягом 30 хвилин. Розчинник випаровують при зниженому тиску і залишок екстрагують хлороформом і очищеною водою. Органічний шар сушать над безводним сульфатом натрію і розчинник випаровують досуха. Залишок перекристалізовують з етилацетату з одержанням цільового продукту (вихід: 974 мг, 30 %) Жовтий порошок. + МС (ESI, m/z): 565 (M-HCl+Н) . 1 H-ЯМР (CDCl3) δ: 7,37 (1H, с), 7,22 (1H, д, J=4,4), 7,13 (1H, дд, J=2,0, 8,3), 7,04 (1H, д, J=2,0), 6,87 (1H, д, J=8,3), 6,05 (1H, д, J=4,4), 4,90-4,94 (1H, м), 3,94 (3H, с), 3,90 (3H, с), 3,48-3,54 (2H, 22 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 м), 3,25-3,34 (2H, м), 2,74 (2H, м), 2,42-2,53 (7H, м), 2,01-2,06 (2H, м), 1,83-1,85 (4H, м), 1,60-1,61 (4H, м), 1,45 (4H, м). Одержання гідрохлориду 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин4-іл-4-[1,4']біпіперидиніл-1'-іл-4-оксобутилату (сполука 64) Сполуку 18 (1,00 г) розчиняють в метиленхлориді (20 мл) і до розчину додають 2-хлор-4,6диметокси-1,3,5-триазин (448 мг) і N-метилморфолін (258 мкл), з подальшим перемішуванням протягом 30 хвилин при охолоджуванні льодом. Потім до суміші додають 4піперидинопіперидин (429 мг) і N-метилморфолін (430 мкл), з подальшим перемішуванням при кімнатній температурі протягом 17 годин. Розчинник випаровують досуха і осад перекристалізовують з етилацетату з одержанням цільового продукту (вихід: 1,37 г, 98 %). Жовтий порошок. + МС (ESI, m/z): 621 (M-HCl+Н) . 1 H-ЯМР (CDCl3) δ: 7,38 (1H, с), 7,22 (1H, д, J=4,4), 7,13 (1H, дд, J=2,4, 8,3), 7,04 (1H, д, J=2,4), 6,87 (1H, д, J=8,3), 6,05 (1H, д, J=4,4), 5,00-5,04 (1H, м), 3,94 (3H, с), 3,90 (3H, с), 3,50-3,56 (2H, м), 3,26-3,32 (2H, м), 3,00-3,06 (2H, м), 2,50-2,72 (11H, м), 1,95-2,04 (2H, м), 1,87-1,90 (4H, м), 1,65-1,70 (4H, м), 1,42-1,55 (4H, м). Одержання (Z)-2-(3,4-диметоксифеніл)-3-хінолін-4-ілакрилонітрилу (сполука 65) 4-хінолінкарбоксальдегід (500 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (564 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 522 мг, 52 %). Світло-жовті кристали. + МС (ESI, m/z): 317 (M+Н) . 1 H-ЯМР (CDCl3) δ: 9,04 (1H, д, J=4,5), 8,20 (1H, д, J=8,5), 8,07 (1H, с), 7,99 (1H, д, J=8,5), 7,87 (1H, д, J=4,5), 7,77-7,81 (1H, м), 7,61-7,65 (1H, м), 7,39 (1H, дд, J=8,5, 2,3), 7,25 (1H, д, J=2,3), 6,98 (1H, д, J=8,5), 4,00 (3H, с), 3,97 (3H, с). Одержання (Z)-3-бензо[b]тіофен-3-іл-2-(3,4-диметоксифеніл)акрилонітрилу (сполука 66) Бензо[b]тіофен-3-карблоксальдегід (200 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (218 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 365 мг, 92 %). Світло-жовті кристали. + МС (APCI, m/z): 322 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,56 (1H, с), 7,93 (1H, д, J=7,3), 7,89 (1H, д, J=7,3), 7,72 (1H, с), 7,43-7,51 (2H, м), 7,32 (1H, дд, J=2,3, 8,5), 7,20 (1H, д, J=2,3), 6,96 (1H, д, J=8,5), 3,99 (3H, с), 3,95 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-(1-метил-1Н-бензімідазол-2-іл)акрилонітрилу (сполука 67) 1-метил-2-формілбензімідазол (200 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (221 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 369 мг, 93 %). Світло-жовті кристали. + МС (ESI, m/z): 320 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,88-7,92 (1H, м), 7,37 (1H, с), 7,32-7,39 (4H, м), 7,24 (1H, д, J=2,3), 6,94 (1H, д, J=8,5), 3,98 (3H, с), 3,95 (3H, с), 3,89 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-(1-метил-1Н-індол-3-іл)акрилонітрилу (сполука 68) 1-метиліндол-3-карбоксальдегід (200 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (223 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 292 мг, 73 %). Світло-жовті кристали. + МС (ESI, m/z): 319 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,29 (1H, с), 7,78 (1H, д, J=8,0), 7,74 (1H, с), 7,31-7,36 (1H, м), 7,37-7,42 (1H, м), 7,22-7,28 (3H, м), 7,16 (1H, д, J=2,3), 6,93 (1H, д, J=8,5), 3,98 (3H, с), 3,93 (3H, с), 3,91 (3H, с). Одержання (Z)-3-бензофуран-2-іл-2-(3,4-диметоксифеніл)акрилонітрилу (сполука 69) 2-бензофуранкарбоксальдегід (166 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (201 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 265 мг, 77 %). Жовті кристали. + МС (APCI, m/z): 306 (M+Н) . 23 UA 105162 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H-ЯМР (CDCl3) δ: 7,65 (1H, уш.д, J=7,8), 7,55 (1H, уш.д, J=8,3), 7,48 (1H, уш.с), 7,36-7,42 (2H, м), 7,31 (1H, дд, J=2,4, 8,5), 7,29 (1H, уш.д, J=7,8), 7,17 (1H, д, J=2,4), 6,94 (1H, д, J=8,5), 3,98 (3H, с), 3,94 (3H, с). Одержання (Z)-2-(2-хлорхінолін-3-іл)-2-(3,4-диметоксифеніл)-3-хінолін-4-ілакрилонітрилу (сполука 70) 2-хлор-3-хінолінкарбоксальдегід (200 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (185) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 311 мг, 85 %). Світло-жовті кристали. + МС (ESI, m/z): 351 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,87 (1H, с), 8,05 (1H, уш.д, J=8,0), 7,96 (1H, уш.д, J=8,0), 7,83 (1H, с), 7,847,89 (1H, м), 7,61-7,66 (1H, м), 7,37 (1H, д, J=2,2, 8,5), 7,22 (1H, д, J=2,2), 6,98 (1H, д, J=8,5), 3,99 (3H, с), 3,96 (3H, с). Одержання (Е)-2-бензотриазол-1-іл-3-(3,4-диметоксифеніл)акрилонітрилу (сполука 71) 3,4-диметоксибензальдегід (210 мг) піддають реакції конденсації з 1Н-бензотриазол-1ацетонітрилом (200 мг) відповідно до способу В (стадія одержання 2) з одержанням цільового продукту (вихід: 133 мг, 34 %). Білі кристали (безбарвні). + МС (ESI, m/z): 307 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,15 (1H, уш.д, J=8,5), 7,90 (1H, уш.д, J=8,5), 7,83 (1H, с), 7,69 (1H, д, J=2,2), 7,62-7,66 (1H, м), 7,47-7,51 (1H, м), 7,44 (1H, дд, J=2,2, 8,5), 6,99 (1H, д, J=8,5), 4,00 (3H, с), 3,99 (3H, с). Одержання (Z)-2-бензофуран-3-іл-3-(3,4-диметоксифеніл)акрилонітрилу (сполука 72) 3,4-диметоксибензальдегід (106 мг) піддають реакції конденсації з бензотриазол-3ацетонітрилом (100 мг) відповідно до способу В (стадія одержання 2) з одержанням цільового продукту (вихід: 110 мг, 57 %). Білі голчаті кристали (безбарвні). + МС (APCI, m/z): 306 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,97 (1H, с), 7,90-7,94 (1H, м), 7,69 (1H, д, J=2,0), 7,57 (1H, с), 7,56-7,58 (1H, м), 7,35-7,43 (3H, м), 6,95 (1H, д, J=8,5), 3,99 (3H, с), 3,96 (3H, с). Одержання (Z)-3-(2-хлор-6-метоксихінолін-3-іл)-2-(3,4-диметоксифеніл)акрилонітрилу (сполука 73) 2-хлор-6-метокси-3-хінолінкарбоксальдегід (500 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (400 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 784 мг, 91 %). Світло-жовті кристали. + МС (ESI, m/z): 381 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,78 (1H, с), 7,93 (1H, д, J=9,3), 7,82 (1H, с), 7,44 (1H, дд, J=2,9, 9,3), 7,36 (1H, дд, J=2,2, 8,5), 7,22 (1H, д, J=2,2), 7,19 (1H, д, J=2,9), 6,97 (1H, д, J=8,5), 4,00 (3H, с), 3,97 (3H, с), 3,96 (3H, с). Одержання (Е)-2-бензотіазол-2-іл-3-(3,4-диметоксифеніл)акрилонітрилу (сполука 74) 3,4-диметоксибензальдегід (191 мг) піддають реакції конденсації з 2бензотіазолацетонітрилом (200 мг) відповідно до способу В (стадія одержання 2) з одержанням цільового продукту (вихід: 330 мг, 89 %). Жовтий порошок. + МС (ESI, m/z): 323 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,18 (1H, с), 8,05-8,08 (1H, м), 7,89-7,92 (1H, м), 7,83 (1H, д, J=2,2), 7,507,55 (2H, м), 7,40-7,44 (1H, м), 6,97 (1H, д, J=8,5), 3,99 (3H, с), 3,98 (3H, с). Одержання (Z)-3-(2,3-дигідробензофуран-5-іл)-2-(3,4-диметоксифеніл)-акрилонітрилу (сполука 75) 2,3-дигідробензофуран-5-карбоксальдегід (150 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (180 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 154 мг, 50 %). Жовтий порошок. + МС (APSI, m/z): 308 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,93 (1H, уш.с), 7,55 (1H, д, J=1,6, 8,4), 7,34 (1H, с), 7,22 (1H, дд, J=2,2, 8,4), 7,12 (1H, д, J=2,2), 6,91 (1H, д, J=8,5), 6,85 (1H, д, J=8,5), 4,66 (2H, т, J=8,7), 3,96 (3H, с), 3,92 (3H, с), 3,29 (2H, т, J=8,7). 24 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержання (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-фторфеніл)ізоксазол-3-іл]акрилонітрилу (сполука 76) 5-(4-фторфеніл)ізоксазол-3-карбоксальдегід (200 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (185 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 150 мг, 41 %). Жовтий порошок. + МС (ESI, m/z): 351 (M+Н) . 1 H-ЯМР (CDCl3) δ: 3,95 (3H, с), 3,98 (3H, с), 6,95 (1H, д, J=8,5), 7,18-7,24 (3H, м), 7,35 (1H, дд, J=2,3, 8,5), 7,44 (1H, с), 7,59 (1H, с), 7,87 (2H, дд, J=2,5, 9,5). Одержання (Z)-2-(3,4-диметоксифеніл)-3-[5-(4-метоксифеніл)ізоксазол-3-іл]акрилонітрилу (сполука 77) 5-(4-метоксифеніл)ізоксазол-3-карбоксальдегід (200 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (174 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 127 мг, 36 %). Жовтий порошок. + МС (ESI, m/z): 363 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,81 (1H, д, J=9,4), 7,59 (1H, с), 7,37 (1H, с), 7,35 (1H, дд, J=2,2, 8,5), 7,19 (1H, д, J=2,2), 7,01 (2H, д, J=9,4), 6,95 (1H, д, J=8,5), 3,97 (3H, с), 3,95 (3H, с), 3,89 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-хінолін-2-ілакрилонітрилу (сполука 78) 2-хінолінкарбоксальдегід (200 мг) піддають реакції конденсації з 3,4диметоксибензилціанідом (225 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 252 мг, 63 %). Жовтий порошок. + МС (ESI, m/z): 316 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,27 (1H, д, J=8,5), 8,18 (1H, д, J=8,5), 8,15 (1H, д, J=8,5), 7,86 (1H, уш.д, J=8,5), 7,76 (1H, с), 7,74-7,80 (1H, м), 7,58-7,62 (1H, м), 7,43 (1H, дд, J=2,2, 8,3), 7,29 (1H, д, J=2,2), 6,96 (1H, д, J=8,3), 3,99 (3H, с), 3,96 (3H, с). Одержання (Z)-2-(2-хлор-6-метоксихінолін-3-іл)-2-піридин-2-ілакрилонітрилу (сполука 79) 2-хлор-6-метоксихінолінкарбоксальдегід (222 мг) піддають реакції конденсації з 2піридинацетонітрилом (118 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 311 мг, 97 %). Світло-жовті кристали. + МС (ESI, m/z): 322 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,883 (1H, с), 8,875 (1H, с), 8,71-8,74 (1H, м), 7,94 (1H, д, J=9,1), 7,83-7,87 (2H, м), 7,46 (1H, д, J=2,8, 9,1), 7,35-7,39 (1H, м), 7,21 (1H, д, J=2,8), 3,97 (3H, с). Одержання (Z)-3-(2-хлор-6-метоксихінолін-3-іл)-2-піридин-3-ілакрилонітрилу (сполука 80) 2-хлор-6-метоксихінолінкарбоксальдегід (222 мг) піддають реакції конденсації з 3піридинацетонітрилом (118 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 251 мг, 78 %). Білі кристали. + МС (ESI, m/z): 322 (M+Н) . 1 H-ЯМР (CDCl3) δ: 9,03 (1H, д, J=2,4), 8,84 (1H, с), 8,72 (1H, дд, J=1,5, 4,9), 8,03-8,07 (1H, м), 8,02 (1H, с), 7,95 (1H, д, J=9,0), 7,44-7,50 (2H, м), 7,21 (1H, д, J=2,7), 3,97 (3H, с). Одержання (Е)-3-(2-хлор-6-метоксихінолін-3-іл)-2-тіофен-2-ілакрилонітрилу (сполука 81) 2-хлор-6-метоксихінолінкарбоксальдегід (222 мг) піддають реакції конденсації з 2тіофенацетонітрилом (123 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 301 мг, 92 %). Світло-жовті кристали. + МС (ESI, m/z): 327 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,77 (1H, с), 7,92 (1H, д, J=9,3), 7,79 (1H, с), 7,50 (1H, дд, J=1,2, 3,7), 7,44 (1H, дд, J=2,7, 9,3), 7,42 (1H, дд, J=1,5, 6,6), 7,18 (1H, д, J=2,7), 7,14 (1H, дд, J=3,7, 5,1), 3,96 (3H, с). Одержання (Z)-2-(2-хлор-6-метоксихінолін-3-іл)-2-тіофен-3-ілакрилонітрилу (сполука 82) 2-хлор-6-метоксихінолінкарбоксальдегід (222 мг) піддають реакції конденсації з 3тіофенацетонітрилом (123 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 273 мг, 83 %). Світло-жовті кристали. + МС (ESI, m/z): 327 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,78 (1H, с), 7,92 (1H, д, J=9,1), 7,85 (1H, с), 7,72-7,75 (1H, м), 7,46-7,48 (2H, м), 7,44 (1H, дд, J=2,8, 9,1), 7,18 (1H, д, J=2,8), 3,96 (3H, с). 25 UA 105162 C2 Одержання (Е)-2-бензотриазол-1-іл-3-(2-хлор-6-метоксихінолін-3-іл)акрилонітрилу (сполука 83) 5 10 15 20 25 30 35 40 45 50 55 60 2-хлор-6-метоксихінолінкарбоксальдегід (111 мг) піддають реакції конденсації з 1Нбензотриазол-1-ацетонітрилом (79 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 129 мг, 71 %). Білий порошок. + МС (ESI, m/z): 362 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,85 (1H, с), 8,21 (1H, д, J=8,3), 8,36 (1H, с), 8,00 (1H, т, J=9,3), 7,98 (1H, т, J=9,3), 7,69-7,73 (1H, м), 7,53-7,57 (1H, м), 7,51 (1H, дд, J=2,8, 9,3), 7,24 (1H, д, J=2,8), 3,99 (3H, с). Одержання (Е)-2-бензотриазол-2-іл-3-(2-хлор-6-метоксихінолін-3-іл)акрилонітрилу (сполука 84) 2-хлор-6-метокси-3-хінолінкарбоксальдегід (111 мг) піддають реакції конденсації з 2бензотіазолацетонітрилом (87 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 148 мг, 78 %). Жовті кристали. + МС (ESI, m/z): 378 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,99 (1H, с), 8,65 (1H, с), 8,17 (1H, д, J=8,1), 7,90-7,95 (2H, м), 7,55-7,61 (1H, м), 7,46-7,52 (2H, м), 7,22 (1H, д, J=2,7), 3,98 (3H, с). Одержання (Z)-2-піридин-2-іл-3-хінолін-4-ілакрилонітрилу (сполука 85) 4-хінолінкарбоксальдегід (157 мг) піддають реакції конденсації з 2-піридинацетонітрилом (118 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 138 мг, 54 %). Світло-рожеві кристали. + МС (ESI, m/z): 258 (M+Н) . 1 H-ЯМР (CDCl3) δ: 9,22 (1H, с), 9,06 (1H, д, J=4,4), 8,72-8,74 (1H, м), 8,21 (1H, д, J=8,3), 8,10 (1H, д, J=8,3), 7,96 (1H, д, J=4,4), 7,80-7,83 (2H, м), 7,75-7,82 (1H, м), 7,62-7,67 (1H, м), 7,38-7,41 (1H, м). Одержання (Z)-2-піридин-3-іл-3-хінолін-4-ілакрилонітрилу (сполука 86) 4-хінолінкарбоксальдегід (157 мг) піддають реакції конденсації з 3-піридинацетонітрилом (118 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 76 мг, 29 %). Білий порошок. + МС (ESI, m/z): 258 (M+Н) . 1 H-ЯМР (CDCl3) δ: 9,08 (1H, д, J=4,6), 9,07 (1H, д, J=2,4), 8,74 (1H, д, J=1,6, 4,8), 8,27 (1H, с), 8,23 (1H, д, J=7,8), 8,09 (1H, ддд, J=1,7, 2,4, 8,1), 7,98 (1H, д, J=8,5), 7,91 (1H, д, J=4,8), 7,80-7,84 (1H, м), 7,64-7,68 (1H, м), 7,49 (1H, дд, J=4,8, 8,1). Одержання (Е)-3-хінолін-4-іл-2-тіофен-2-ілакрилонітрилу (сполука 87) 4-хінолінкарбоксальдегід (157 мг) піддають реакції конденсації з 2-тіофенацетонітрилом (123 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 175 мг, 67 %). Світло-жовті кристали. + МС (ESI, m/z): 263 (M+Н) . 1 H-ЯМР (CDCl3) δ: 9,03 (1H, д, J=4,4), 8,20 (1H, д, J=8,5), 8,03 (1H, с), 7,99 (1H, д, J=8,5), 7,89 (1H, дд, J=0,9, 4,4), 7,78-7,82 (1H, м), 7,63-7,67 (1H, м), 7,53 (1H, дд, J=1,2, 3,7), 7,45 (1H, дд, J=1,2, 5,1), 7,16 (1H, дд, J=3,7, 5,1). Одержання (Z)-3-хінолін-4-іл-2-тіофен-3-ілакрилонітрилу (сполука 88) 4-хінолінкарбоксальдегід (157 мг) піддають реакції конденсації з 3-тіофенацетонітрилом (123 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 81 мг, 31 %). Жовтий порошок. + МС (ESI, m/z): 263 (M+Н) . 1 H-ЯМР (CDCl3) δ: 9,03 (1H, д, J=4,4), 8,20 (1H, д, J=8,4), 8,09 (1H, с), 7,98 (1H, д, J=8,4), 7,87 (1H, д, J=4,4), 7,76-7,82 (2H, м), 7,61-7,65 (1H, м), 7,50 (1H, с), 7,49 (1H, с). Одержання (Е)-3-бензо[b]тіофен-3-іл-2-тіофен-2-ілакрилонітрилу (сполука 89) Бензо[b]тіофен-3-карбоксальдегід (81 мг) піддають реакції конденсації з 2тіофенацетонітрилом (62 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 40 мг, 30 %). Жовтий порошок. + МС (ESI, m/z): 268 (M+Н) . 26 UA 105162 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H-ЯМР (CDCl3) δ: 8,55 (1H, с), 7,91-7,93 (1H, м), 7,89 (1H, дд, J=1,2, 7,3), 7,67 (1H, с), 7,49 (1H, дд, J=1,2, 7,9), 7,46 (1H, дд, J=1,2, 7,9), 7,42 (1H, дд, J=1,2, 3,7), 7,34 (1H, дд, J=1,2, 5,1), 7,11 (1H, дд, J=3,7, 5,1). Одержання (Е)-3-бензо[b]тіофен-3-іл-2-бензотіазол-2-ілакрилонітрилу (сполука 90) Бензо[b]тіофен-3-карбоксальдегід (81 мг) піддають реакції конденсації з 2бензотіазолацетонітрилом (87 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 111 мг, 69 %). Жовтий порошок. + МС (ESI, m/z): 319 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,89 (1H, с), 8,60 (1H, с), 8,11 (1H, уш.д, J=8,2), 8,06 (1H, уш.д, J=7,8), 7,917,96 (2H, м), 7,53-7,58 (2H, м), 7,43-7,52 (2H, м). Одержання (Z)-3-бензофуран-2-іл-1-бензофуран-3-ілакрилонітрилу (сполука 91) 2-бензофуранкарбоксальдегід (73 мг) піддають реакції конденсації з бензофуран-3ацетонітрилом (79 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 110 мг, 77 %). Жовтий порошок. + МС (ESI, m/z): 319 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,06 (1H, с), 7,92-7,96 (1H, м), 7,66 (1H, уш.д, J=7,8), 7,58 (1H, с), 7,56-7,60 (2H, м), 7,47 (1H, с), 7,38-7,45 (3H, м), 7,28-7,32 (1H, м). Одержання (Е)-2-бензотіазол-2-іл-3-(1-метил-1Н-індол-3-іл)акрилонітрилу (сполука 92) 1-метиліндол-3-карбоксальдегід (79 мг) піддають реакції конденсації з 2бензотіазолацетонітрилом (87 мг) відповідно до способу В (стадія одержання 3) з одержанням цільового продукту (вихід: 157 мг, 99 %). Жовтий порошок. + МС (ESI, m/z): 316 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,56 (1H, с), 8,50 (1H, с), 8,03-8,07 (1H, м), 7,90-7,94 (1H, м), 7,86-7,90 (1H, м), 7,48-7,53 (1H, м), 7,33-7,45 (4H, м), 3,95 (3H, с). Одержання (Z)-3-(10-хлорантрацен-9-іл)-2-(3,4-диметоксифеніл)акрилонітрилу (сполука 93) 10-хлор-9-антральдегід (500 мг) піддають реакції конденсації з 3,4-диметоксибензилціанідом (368 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 466 мг, 56 %). Жовтий порошок. + МС (APSI, m/z): 400 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,61 (2H, д, J=8,5), 8,27 (1H, с), 8,09 (2H, д, J=8,5), 7,62-7,68 (2H, м), 7,557,61 (2H, м), 7,48 (1H, дд, J=2,2, 8,5), 7,35 (1H, д, J=2,2), 7,02 (1H, д, J=8,5), 4,01 (3H, с), 3,99 (3H, с). Одержання (Z)-2-(3,4-диметоксифеніл)-3-нафталін-2-ілакрилонітрилу (сполука 94) 2-нафтальдегід (500 мг) піддають реакції конденсації з 3,4-диметоксибензилціанідом (567 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 872 мг, 86 %). Жовтий порошок. + МС (APSI, m/z): 316 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,27 (1H, с), 8,07 (1H, дд, J=1,7, 8,8), 7,84-7,93 (3H, м), 7,59 (1H, с), 7,517,58 (2H, м), 7,32 (1H, дд, J=2,2, 8,5), 7,20 (1H, д, J=2,2), 6,94 (1H, д, J=8,5), 3,99 (3H, с), 3,94 (3H, с). Одержання (Z)-3-(3,4-диметоксифеніл)-3-фенантрен-9-ілакрилонітрилу (сполука 95) Фенантрен-9-альдегід (250 мг) піддають реакції конденсації з 3,4-диметоксибензилціанідом (214 мг) відповідно до способу А (стадія одержання 2) з одержанням цільового продукту (вихід: 278 мг, 63 %). Жовтий порошок. + МС (APSI, m/z): 366 (M+Н) . 1 H-ЯМР (CDCl3) δ: 8,77 (1H, д, J=7,8), 8,70 (1H, д, J=7,8), 8,26 (1H, с), 8,15 (1H, д, J=1,2), 7,998,02 (2H, м), 7,70-7,76 (2H, м), 7,63-7,68 (2H, м), 7,40 (1H, дд, J=2,4, 8,3), 7,28 (1H, д, J=2,4), 6,99 (1H, д, J=8,3), 4,00 (3H, с), 3,97 (3H, с). Одержання п-толуолсульфонату 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2іл]піперидин-4-ілдіетиламіноацетату (сполука 96) Сполуку 6 (480 мг) розчиняють в толуолі (100 мл) і до розчину додають натрієву сіль N, N'діетилгліцину (296 мг) і моногідрат п-толуолсульфонової кислоти (490 мг), з подальшим 27 UA 105162 C2 5 10 15 20 25 30 35 40 45 50 55 60 перемішуванням при кип'ятінні зі зворотним холодильником протягом 5 годин. Розчинник випаровують досуха і залишок очищують хроматографією на колонці з силікагелем (CHCl3MeOH) з одержанням цільового продукту (вихід: 237 мг, 37,7 %). Жовтий порошок. + МС (ESI, m/z): 484 (M+Н) . 1 H-ЯМР (ДМСО) δ: 7,94 (1H, с), 7,49 (4H, д, J=7,8), 7,43 (1H, д, J=4,1), 7,17 (1H, д, J=2,2), 7,12 (4H, д, J=7,8), 7,09 (1H, дд, J=2,2, 8,5), 7,00 (1H, д, J=8,5), 6,32 (1H, д, J=4,1), 5,09-5,12 (1H, м), 4,26 (2H, с),3,83 (3H, с), 3,78 (3H, с), 3,51-3,55 (2H, м), 3,31-3,37 (2H, м), 3,22 (4H, кв, J=7,1), 2,29 (6H, с), 2,02-2,06 (2H, м), 1,78-1,82 (2H, м), 1,21 (6H, т, J=7,1). Одержання 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин-4ілдіетилкарбамату (сполука 97) Сполуку 6 (150 мг) розчиняють в піридині (1 мл) і до розчину додають діетилкарбамоїлхлорид (55 мг), з подальшим перемішуванням при кип'ятінні зі зворотним холодильником протягом 2 годин. Після завершення реакції до реакційної суміші додають метанол і потім перемішують ще протягом 30 хвилин. Розчинник випаровують досуха і залишок екстрагують хлороформом і очищеною водою. Органічний шар сушать над безводним сульфатом натрію і розчинник випаровують досуха. Залишок перекристалізовують з етилацетату з одержанням цільового продукту (вихід: 40,6 мг, 21,3 %). Жовтий порошок. + МС (ESI, m/z): 470 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,37 (1H, с), 7,23 (1H, д, J=4,4), 7,13 (1H, дд, J=2,2, 8,5), 7,04 (1H, д, J=2,2), 6,87 (1H, д, J=8,5), 6,05 (1H, д, J=4,4), 4,93-4,97 (1H, м), 3,74 (3H, с), 3,90 (3H, с), 3,48-3,54 (2H, м), 3,30-3,36 (6H, м), 2,01-2,08 (2H, м), 1,83-1,91 (2H, м), 1,14 (6H, т, J=7,1). Одержання гідрохлориду 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин4-іл-N-(2-діетиламіноетил)-N-метилсукцинамату (сполука 98) Сполуку 18 (500 мг) розчиняють в метиленхлориді (10 мл) і до розчину додають 2-хлор-4,6диметокси-1,3,5-триазин (224 мг) і N-метилморфолін (129 мкл), з подальшим перемішуванням при охолоджуванні льодом протягом 30 хвилин. Потім до суміші додають N, N-діетил-N'метилетилендіамін (166 мкл) і N-метилморфолін (215 мкл), з подальшим перемішуванням при кімнатній температурі протягом 17 годин. Розчинник випаровують досуха і залишок очищують хроматографією на колонці з силікагелем (CHCl 3-MeOH) з одержанням цільового продукту (вихід: 503 мг, 76 %). Жовтий порошок. + МС (ESI, m/z): 583 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,60 (1H, м), 7,37 (1H, с), 7,22 (1H, д, J=4,1), 7,13 (1H, дд, J=2,2, 8,3), 7,04 (1H, д, J=2,2), 6,87 (1H, д, J=4,1), 6,05 (1H, д, J=8,5 Гц), 4,96-5,00 (1H, м), 3,94 (3H, с), 3,90 (3H, с), 3,50-3,56 (2H, м), 3,39-3,43 (2H, м), 3,25-3,31 (2H, м), 3,05-3,17 (6H, м), 3,13 (3H, с), 2,65-2,69 (2H, м), 2,56-2,59 (2H, м), 2,02-2,12 (2H, м), 1,97-2,01 (2H, м), 1,83-1,90 (2H, м), 1,39 (6H, т, J=7,3). Одержання гідрохлориду 1-[5-[(Z)-2-ціано-2-(3,4-диметоксифеніл)вініл]тіофен-2-іл]піперидин4-іл-N-(4-діетиламінофеніл)сукцинамату (сполука 99) Сполуку 18 (500 мг) розчиняють в метиленхлориді (10 мл) і до розчину додають 2-хлор-4,6диметокси-1,3,5-триазин (224 мг) і N-метилморфолін (129 мкл), з подальшим перемішуванням при охолоджуванні льодом протягом 30 хвилин. Потім до суміші додають N, N-діетил-1,4фенілендіамін (209 мкл) і N-метилморфолін (215 мкл), з подальшим перемішуванням при кімнатній температурі протягом 17 годин. Розчинник випаровують досуха і залишок очищують хроматографією на колонці з силікагелем (CHCl 3-MeOH) з одержанням цільового продукту (вихід: 322 мг, 40 %). Жовтий порошок. + МС (ESI, m/z): 617 (M+Н) . 1 H-ЯМР (CDCl3) δ: 7,91 (1H, с), 7,40 (1H, д, J=4,4), 7,30 (2H, д, J=8,5), 7,17 (1H, д, J=2,2), 7,09 (1H, дд, J=2,2, 8,3), 7,00 (1H, д, J=8,8), 6,57 (2H, д, J=8,8), 6,27 (1H, д, J=4,1), 4,91-4,95 (1H, м), 3,83 (3H, с), 3,78 (3H, с), 3,44-3,49 (2H, м), 3,25-3,30 (6H, м), 2,57-2,60 (4H, м), 1,91-1,97 (2H, м), 1,71-1,74 (2H, м), 1,03 (6H, т, J=6,8). Одержання кислого сульфату (Z)-2-(3,4-диметоксифеніл)-3-{5-[4-(2-гідроксіетил)піперазин-1іл]тіофен-2-іл}акрилонітрилу (сполука 100) 0,1-моль/л сірчаної кислоти (6,36 мл) і очищену воду (18,65 мл) додають до сполуки 9 (500 мг) і суміш нагрівають для розчинення (зовнішня температура: 90 °C). Розчин знов доводять до кімнатної температури і залишають вистоюватись протягом ночі. Осаджені кристали збирають фільтруванням і відновлені кристали промивають послідовно невеликою кількістю очищеної 28
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/4184, A61K 31/44, A61K 31/381, A61K 31/4535, A61K 31/40, A61K 31/341, A61K 31/404, A61K 31/4409, A61K 31/47, A61P 35/00, A61K 31/661, A61K 31/4164, A61K 31/345, A61K 31/4525, A61K 31/428, A61K 31/277, A61K 31/5377, A61K 31/426, C07D 207/337, A61K 31/42
Мітки: акрилонітрилу, похідне, інгібітору, застосування
Код посилання
<a href="https://ua.patents.su/43-105162-pokhidne-akrilonitrilu-ta-jjogo-zastosuvannya-yak-ingibitoru-bcrp-abcg2.html" target="_blank" rel="follow" title="База патентів України">Похідне акрилонітрилу та його застосування як інгібітору bcrp/abcg2</a>
Попередній патент: Спосіб визначення динаміки загоєння шкірних виразок
Наступний патент: Комбінована композиція, яка містить пестицидний агент для боротьби зі шкідниками, та способи її використання
Випадковий патент: Станція для обробки стічних вод












