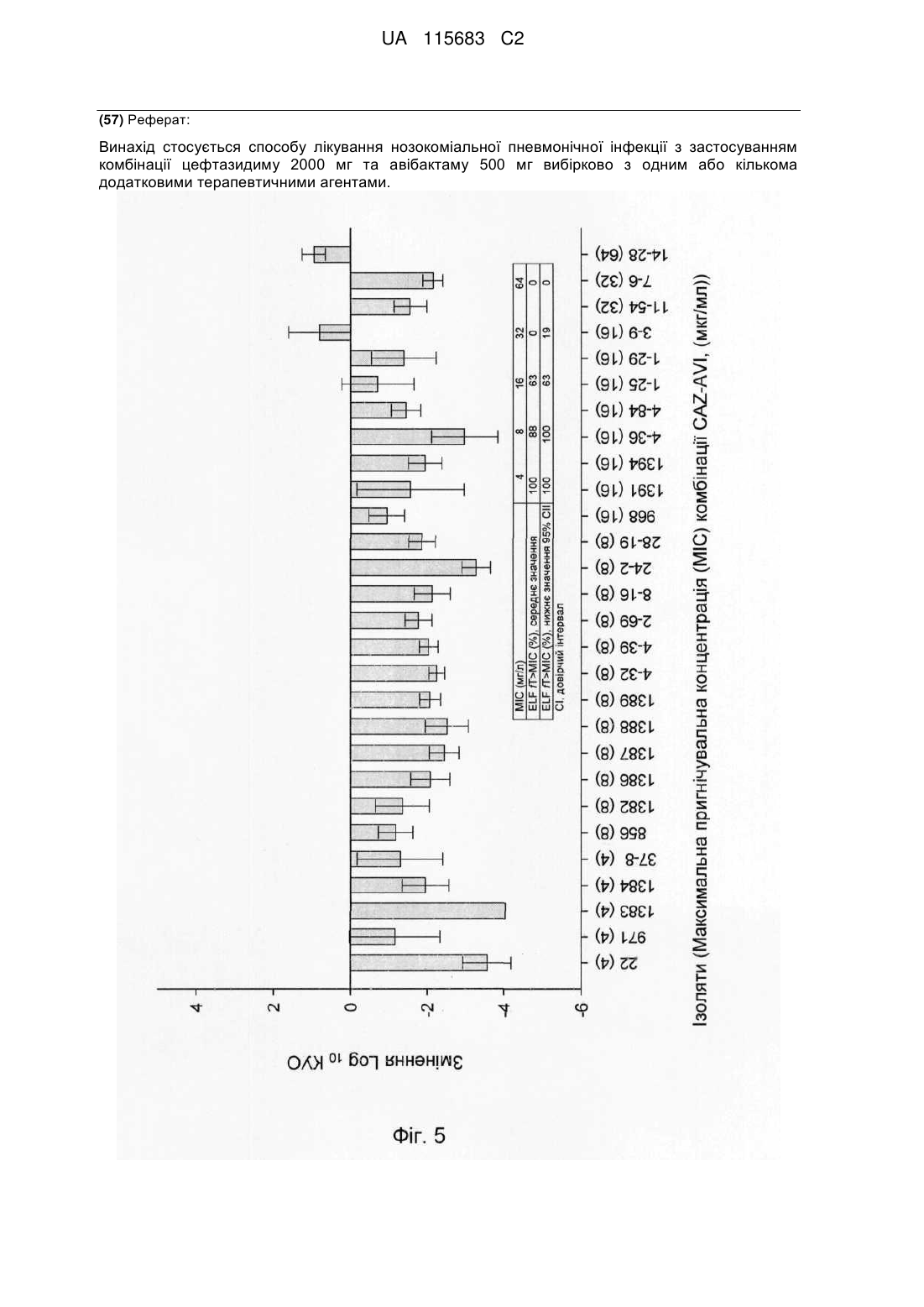
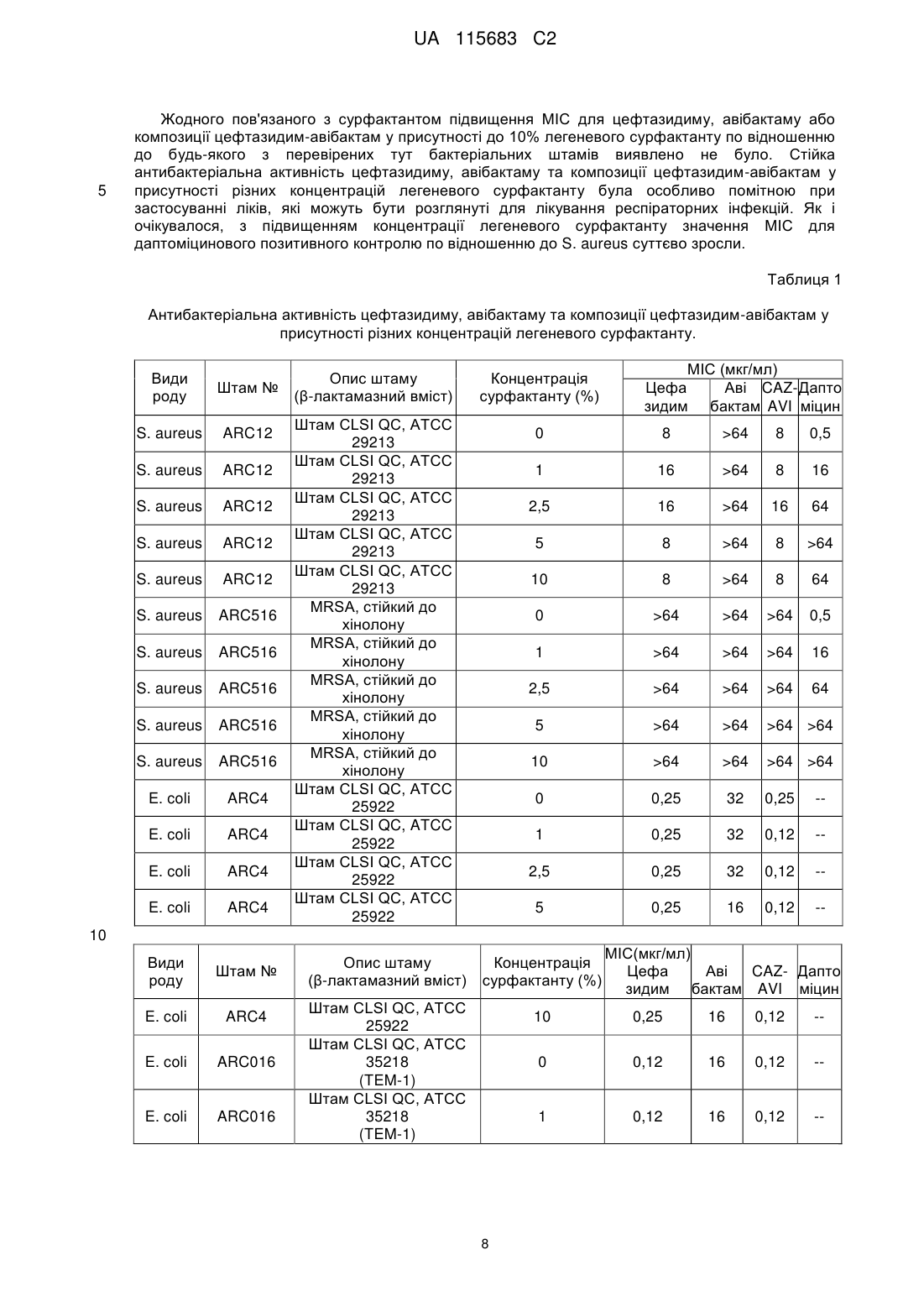
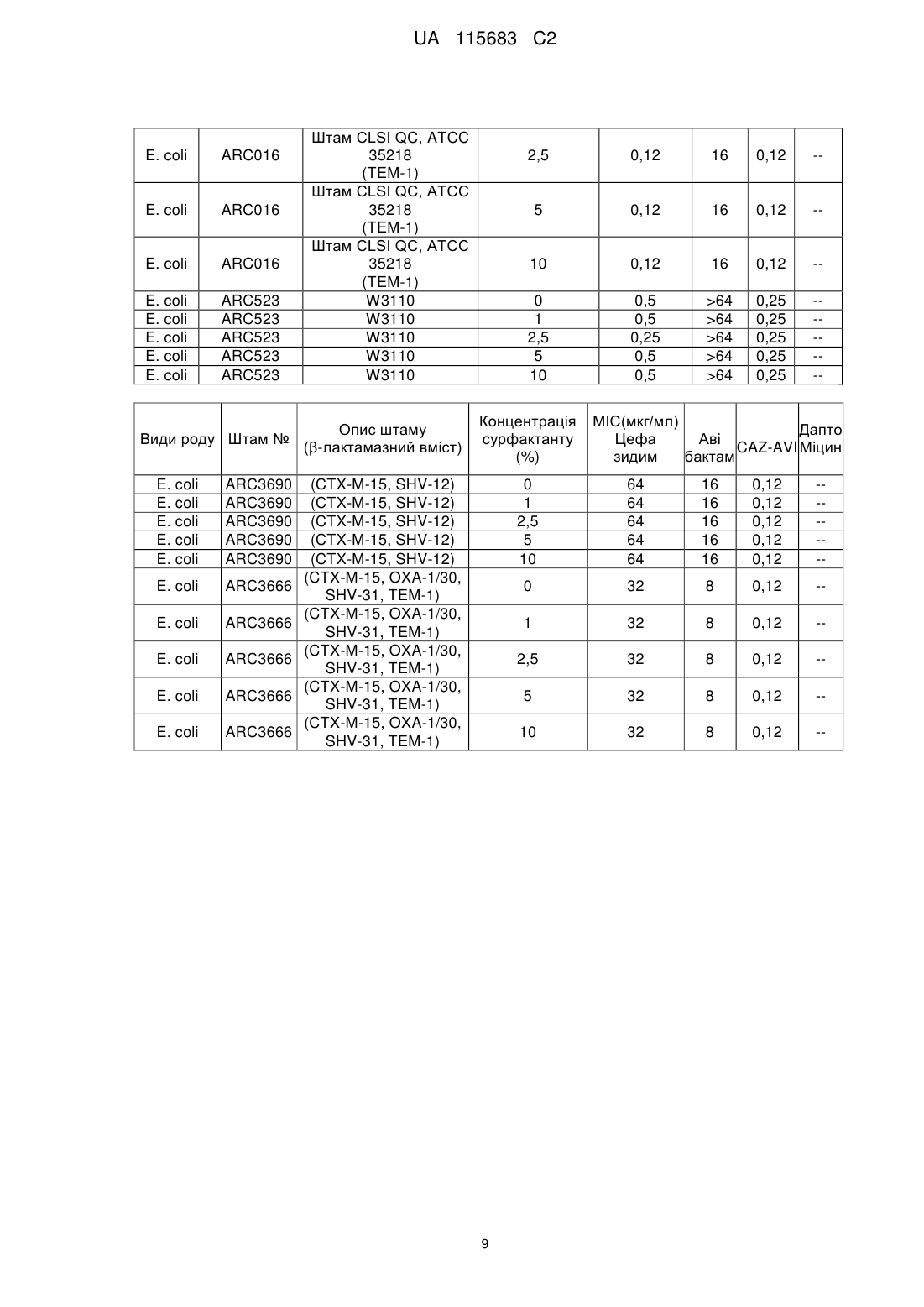
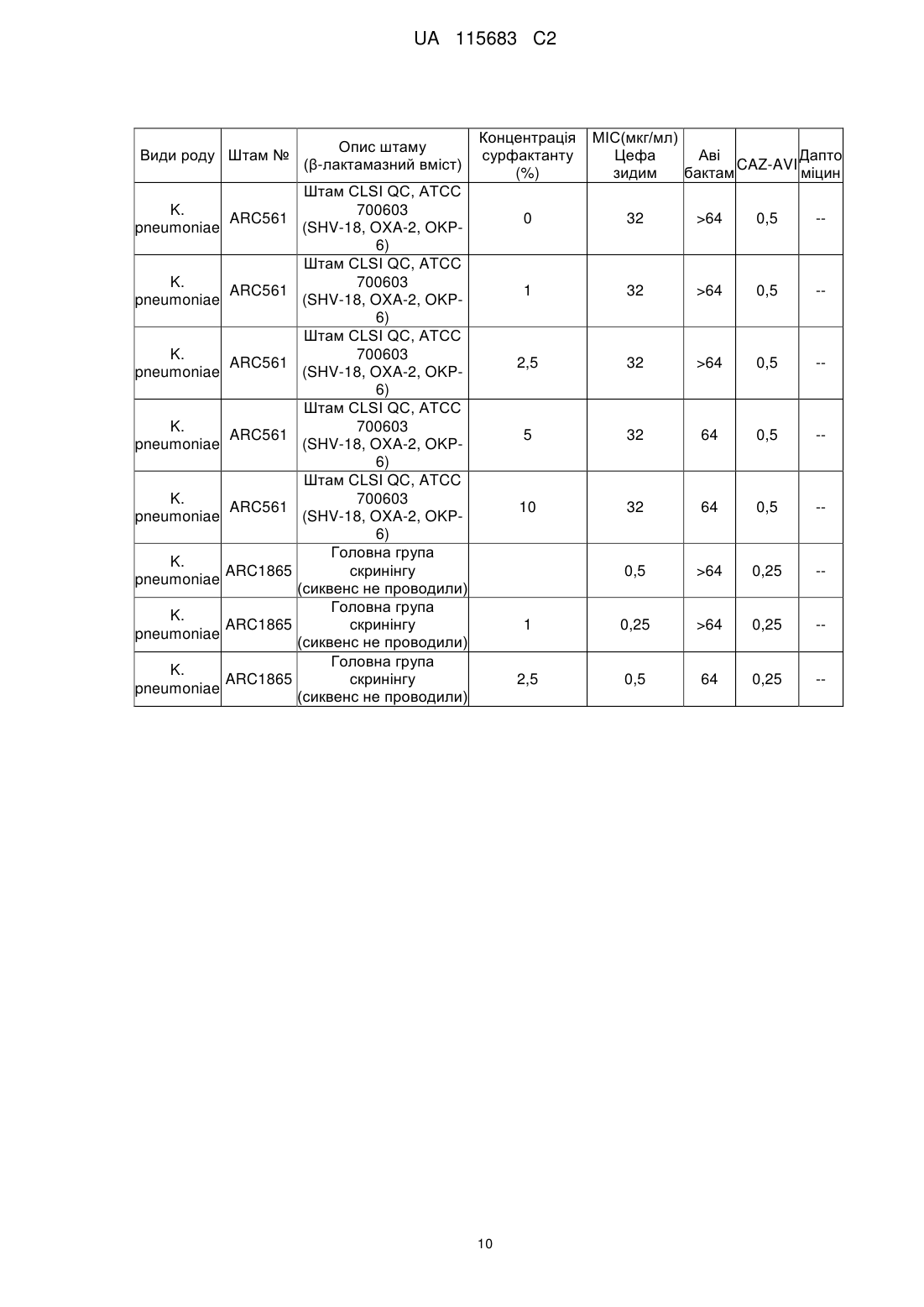
Комбінована терапія для лікування госпітальної пневмонії
Номер патенту: 115683
Опубліковано: 11.12.2017
Автори: Моутон Йохан Віллем, Ніколс Райт, Лі Цзяньґо, Дас Шампа
Формула / Реферат
1. Спосіб лікування нозокоміальної пневмонійної інфекції у пацієнта за необхідності, що складається з призначення пацієнту ефективної кількості комбінації цефтазидиму або його фармацевтично прийнятної солі та авібактаму або його фармацевтично прийнятної солі;
де ефективна кількість цефтазидиму є приблизно 2000 мг та ефективна кількість авібактаму є приблизно 500 мг на дозу;
де ефективну кількість комбінації призначають приблизно кожні вісім годин;
де комбінацію цефтазидиму та авібактаму вводять одночасно;
та де ефективну кількість комбінації призначають внутрішньовенно.
2. Спосіб за п. 1, де нозокоміальна пневмонійна інфекція є набутою в лікарні пневмонією.
3. Спосіб за п. 1, де нозокоміальна пневмонійна інфекція є набутою вентиляторною пневмонією.
4. Спосіб за будь-яким з пп. 1-3, що додатково включає введення одного або більше додаткових терапевтичних агентів.
5. Спосіб за п. 4, в якому один або кілька додаткових терапевтичних агентів є антибактеріальними агентами, вибраними з групи, що складається з тобраміцину, левофлоксацину, ванкоміцину, лінезоліду, тигецикліну та колістину.
6. Спосіб за будь-яким з пп. 1-5, в якому комбінацію вводять внутрішньовенно протягом приблизно 2 годин.
Текст
Реферат: Винахід стосується способу лікування нозокоміальної пневмонічної інфекції з застосуванням комбінації цефтазидиму 2000 мг та авібактаму 500 мг вибірково з одним або кількома додатковими терапевтичними агентами. UA 115683 C2 5 10 15 20 25 30 35 40 45 50 55 60 Винахід стосується способу лікування госпітальної пневмонії із застосуванням комбінації цефтазидиму (цефалоспорину третього покоління) та авібактаму (нового пригнічувача βлактамази) вибірково з одним або кількома додатковими терапевтичними агентами. Міжнародна наукова спільнота, яка досліджує мікробні та інфекційні захворювання, висловлює серйозну стурбованість щодо тривалого розвитку стійкості до антибактеріальних засобів, яка зрештою може призвести до появи бактеріальних штамів, проти яких наявні на даний час антибактеріальні агенти будуть неефективними. Наслідком такої появи може бути значний ріст захворюваності та смертності. У боротьбі з бактеріальною інфекцією необхідною умовою є застосування бета-лактамних антибіотиків. Бета-лактами охоплюють великий клас ліків, всі з яких містять бета-лактам у складі основної молекулярної структури та звичайно є ефективними проти широкого спектру грам-позитивних та грам-негативних бактерій, пригнічуючи синтез стінок бактеріальних клітин. Через те, що мета таких лікарських засобів не має еукаріотичного аналога, їх токсичність є низькою та вони звичайно мають добру толерантність. Бета-лактамні антибіотики охоплюють похідні пеніциліну (пенами), цефалоспорини, монобактами та карбапенеми. Вони залишаються одними з найбільш широко запропонованих, безпечних та ефективних лікарських засобів, які можуть боротися з бактеріальною інфекцією, однак їх ефективність є обмеженою через появу дуже стійких інфекційних штамів, як-то стійкий до метициліну Staphylococcus aureus (MRSA) та мультирезистентні (MDR) штами Pseudomonas aeruginosa, Acinetobacter baumannii, Escherichia coli, Klebsiella pneumonia, та інші види Enterobacteriaceae. Ці стійкі бактерії є головною причиною захворюваності та смертності пацієнтів (див. Helfand, β-lactams Against Emerging ‘Superbugs’: Progress and Pitfalls, («Бета-лактамні антибіотики проти нових «супербактерій»: прогрес та труднощі»), Expert Rev. Clin. Pharmacol. 1(4):559-571 (2008). Щоб підвищити ефективність бета-лактамних антибіотиків, були розроблені певні пригнічувачі бета-лактамази, однак наявних на цей час пригнічувачів бета-лактамази у багатьох випадках є недостатньо для протидії постійно зростаючій різноманітності β-лактамаз. Три найбільш поширених серинових бета-лактамазних агенти, які застосовують на даний час, як-то клавуланова кислота, тазобактам та сульбактам мають активність тільки проти ферментів класу А, що серйозно обмежує їх корисність. Новітні пригнічувачі бета-лактамаз, які зараз проходять клінічні випробування, як-то авібактам, неспроможні працювати з ферментами класів A та C та мають певну обмежену ефективність у протидії бета-лактамазам класу D. Див. Bebrone, et al., Current Challenges in Антиmicrobial Chemotherapy: Focus on β-Лактамase Inhibition («Сучасні проблеми у антимікробній хіміотерапії: зосередження на бета-лактамазному пригніченні»), Drugs, 70(6):651679 (2010). Бета-лактамні антибіотики, окремо та у поєднанні з пригнічувачами бета-лактамази залишаються суттєвою неодмінною частиною антибактеріальних агентів, яких застосовують для подолання хвороби. β-лактамна стійкість до грам-негативних інфекцій виникає головним чином за рахунок β-лактамазної активності, та суттєва залежність від β-лактамних антибіотиків має привести до диверсифікації та зростання розповсюдженості β-лактамаз. Ці β-лактамази стають причиною виникнення стійкості до навіть новітніх β-лактамних антибіотиків (Див. Llarrull, et al., The Future of Beta-Lactams («Майбутнє бета-лактамів»), Current Opinion in Microbiology, 13:551557 (2010). Бактерії Enterobacteriaceae, які виробляють β-лактамазу розширеного спектра (ESBL)-, AmpC-, KPC-, NDM- та OXA-48, а також бактерії Acinetobacter baumannii та Pseudomonas aeruginosa є одними з найбільш важливих часто отриманих внутрішньолікарняних патогенів, які часто є стійкими до багатьох класів антибіотиків (Див. D.M. Livermore, et al. Activities of NXL104 Combinations with Ceftazidime and Aztreonam Against CarbapenemaseProducing Enterobacteriaceae, («Активні властивості комбінацій NXL104 з цефлазидимом та азтреонамом, спрямована проти бактерій Enterobacteriaceae, які виробляють карбапенемазу»), Antimicrobial Agents Chemotherapy 55 (2011), pp. 390–394; S. Mushtaq, et al., In Vitro Activity of Ceftazidime + NXL104 Against Pseudomonas aeruginosa and other Non-Fermenter («Активність цефлазидиму+ NXL104 in vitro проти Pseudomonas aeruginosa та інших бактерій, які не є збудниками бродіння»); J. Antimicrobial Chemotherapy, 65(2010) 2376-381; A. Endimiani, et al., In Vitro Activity of NXL104 in Combination with β-Lactams Against Klebsiella pneumonia Isolates Producing KPC Carbapenemases; («Активність NXL104 in vitro у поєднанні з бета-лактамами, спрямована проти ізолятів Klebsiella pneumonia, які виробляють карбапенемази КРС»); Antimicrobial Agents Chemotherapy, 53 (2009) 3599-3601.) Госпітальна пневмонія має відношення до будь-якої пневмонії, що уражає пацієнта у лікарні через принаймні 48-72 год. після потрапляння та охоплює внутрішньолікарняну пневмонію (HAP) та пневмонію, пов'язану зі штучною вентиляцією легенів (VAP). Частка пацієнтів, хворих на HAP, складає біля 70% від загальної кількості інфекцій на госпітальну пневмонію, та 1 UA 115683 C2 5 10 15 20 25 30 35 40 45 50 55 60 позосталі приблизно 30% припадають на VAP. Рівень лікарняної смертності пацієнтів, хворих на HAP, складає 12-35% (Freire et al 2010; Chung et al 2011), але фактичні показники є часто пов’язаними з загальним попереднім станом пацієнтів. Пацієнтів, хворих на VAP, розглядають, як популяцію з більш тяжким рівнем захворювання, обумовленим рівнем смертності, який складає 33-50% (Am J Respir Crit Care Med, 2005, 171, pp388). Існує суттєва потреба у засобах першої лінії лікування (емпіричних) госпітальної пневмонії, які є більш ефективними у лікуванні патогенів, які найбільш часто знаходять при дослідженні цієї хвороби. Підтвердження патогенів займає до 48 год., та у деяких клінічних умовах, як-то у разі HAP, рівень виявлення є досить низьким (приблизно 60%), через що курс лікування вибирають за підозрою існування патогену та/або можливості його стійкості. Існує суттєва потреба у засобах емпіричної терапії, що будуть більш ефективними у лікуванні найбільш часто виявлених у госпітальній пневмонії патогенів, оскільки існуючі засоби лікування грам-негативних патогенів мають рівні сприйнятливості до ключових стійких патогенів, які не перевищують 80%. Існує кілька ефективних емпіричних агентів для лікування тяжких грам-негативних інфекцій (Pseudomonas aeruginosa та стійкі патогени, які виробляють β-лактамази розширеного спектра (ESBL) або карбапенемази Klebsiella pneumoniae (KPC). Зменшення ефективності існуючих емпіричних терапевтичних засобів (наприклад, карбапенемів, цефалопоринів) створює суттєву потребу у отриманні агентів, подібних до комбінації цефтазидим-авібактам (CAZ-AVI), яка у порівнянні з визнаними засобами лікування є активною проти широкого спектру стійких та важких до лікування патогенів. Новітні лікувальні засоби, як-то CAZ-AVI є необхідними для емпіричного застосування для підвищення успіху лікування у пацієнтів з підвищеним ризиком ускладнень та смертності при неадекватному рівні емпіричної терапії. Було несподівано та непередбачено знайдено, що комбінація CAZ-AVI надає чудову можливість лікування госпітальної пневмонії у пацієнтів. У той час, як набір цієї комбінації in vitro було визнано перспективним засобом для лікування основних бактеріальних штамів, які викликають госпітальну пневмонію, результати, отримані винахідниками показують, що ця комбінація може проникати у цільові тканини в кількості, достатній для ефективного лікування інфекції. Винахід спрямовано на застосування комбінації цефтазидиму та авібактаму у лікуванні госпітальної пневмонії, включаючи HAP та VAP, вибірково у поєднанні з одним або кількома додатковими терапевтичними агентами. Винахід також спрямовано на надання, у разі такої потреби, способу лікування пацієнта, зараженого госпітальною пневмонією, який полягає у введенні такому пацієнту ефективної кількості комбінації цефтазидиму або його фармацевтично прийнятної солі та авібактаму або його фармацевтично прийнятної солі. В одному втіленні застосування цієї комбінації також полягає у її введенні з одним або кількома додатковими терапевтичними агентами. Фіг. 1 - Змодельований для людини профіль концентрація сироватки - час для композиції цефтазидим-авібактам (2000-500 мг), яку застосовували кожні 8 год.як двогодинне введення (інфузію) людині у порівнянні з впливом сироватки, який спостерігали у інфікованих та неінфікованих мишей ICR жіночої статі. Чорною лінією позначено дію цефтазидиму на людину, чорними колами позначено сироваткові концентрації цефтазидиму (інфіковані миші), чорними квадратами позначено сироваткові концентрації цефтазидиму (неінфіковані миші), пунктирною лінією позначено дію авібактаму на людину, білими колами позначено сироваткові концентрації авібактаму (інфіковані миші), та білими квадратами позначено сироваткові концентрації авібактаму (неінфіковані миші). Фіг. 2 - Профіль концентрації періциліарної рідини (ELF) та часу після застосування змодельованих для людини сироваткових доз композиції цефтазидим-авібактам (2000-500 мг), яку застосовували кожні 8 год. як двогодинне введення (інфузію) людині, спостережений у інфікованих та неінфікованих мишей A) чорними колами позначено концентрації цефтазидиму у ELF (інфіковані миші ICR жіночої статі); чорними квадратами позначено концентрації цефтазидиму у ELF (неінфіковані миші); у B), чорними трикутниками позначено концентрації авібактаму у ELF (інфіковані миші) та чорними ромбами позначено концентрації авібактаму у ELF (неінфіковані миші). Фіг. 3 - Профіль сироваткової концентрації та часу після застосування змодельованих для людини сироваткових доз композиції цефтазидим-авібактам (2000-500 мг), яку застосовували кожні 8 год. як двогодинне введення (інфузію) людині, у порівнянні з результатами, отриманими при застосуванні інфікованих мишей ICR жіночої статі. Чорною лінією позначено дію цефтазидиму у людині, чорними колами позначено сироваткові концентрації цефтазидиму у мишей, пунктирною лінією позначено дію авібактаму у людині та білими трикутниками позначено сироваткові концентрації авібактаму у мишей. 2 UA 115683 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіг. 4 - Профіль концентрації періциліарної рідини (ELF) та часу після застосування змодельованих для людини сироваткових доз композиції цефтазидим-авібактам (2000-500 мг), яку застосовували кожні 8 год. як двогодинне введення (інфузію) людині , спостережений при застосуванні інфікованих мишей ICR жіночої статі. Чорними колами позначено концентрації цефтазидиму у мишачій ELF та чорними квадратами позначено концентрації авібактаму у мишачій ELF. Фіг. 5 - Ефективність застосування змодельованих для людини сироваткових доз композиції цефтазидим-авібактам (2000-500 мг), яку застосовували кожні 8 год. як двогодинне введення (інфузію), та пов'язаної з цим ELF ƒT>MIC проти бактерій P. aeruginosa у моделі нейтропенічної легеневої інфекції. Значення MIC (найменших пригнічувальних концентрацій) CAZ-AVI наведено у дужках після кожної назви штаму. Заштрихованими стовпчиками позначено середні значення ± SD (стандартне відхилення). Фіг. 6 - Профіль сироваткової концентрації та часу після застосування змодельованих для людини сироваткових доз цефтазидиму (2000 мг), який застосовували кожні 8 год. як двогодинне введення (інфузію) людині, спостережений у мишей ICR жіночої статі. Чорними колами позначено сироваткові концентрації цефтазидиму у мишей, чорними квадратами позначено концентрації цефтазидиму у мишачій ELF. Фіг. 7 - Ефективність застосування змодельованих для людини сироваткових доз цефтазидиму (2000 мг), які застосовували кожні 8 год. як двогодинне введення (інфузію) проти бактерій P. aeruginosa у моделі нейтропенічної легеневої інфекції. Значення MIC (найменших пригнічувальних концентрацій) CAZ наведено у дужках після кожної назви штаму. Заштрихованими стовпчиками позначено середні значення ± SD (стандартне відхилення). Фіг. 8 - Профіль сироваткової концентрації та часу після застосування схеми вживання цефтазидиму для отримання цільового показника ELF ƒT>MIC, спостереженого у інфікованих мишей ICR жіночої статі. Чорними колами позначено сироваткові концентрації цефтазидиму у мишей, чорними квадратами позначено концентрації цефтазидиму у мишачій ELF. Фіг. 9 - Ефективність застосування змодельованих для людини сироваткових доз цефтазидиму відносно показника ELF ƒT>MIC та пов'язаного з ним значення ELF ƒT>MIC проти бактерій P. aeruginosa у моделі нейтропенічної легеневої інфекції. Значення MIC (найменших пригнічувальних концентрацій) цефтазидиму (CAZ) наведено у дужках після кожної назви штаму. Заштрихованими стовпчиками позначено середні значення ± SD (стандартне відхилення). Фіг. 10 - Відповідь на дію авібактаму у мишей, інфікованих у стегно, які отримали лікування цефтазидимом, що полягало у введенні лікарського препарату кожні дві години (q2h): фракціонування дози. Фіг. 11 - Відповідь на дію авібактаму у мишей, інфікованих у стегно, які отримали лікування цефтазидимом, яке полягало у введенні лікарського препарату кожні дві години (q2h) для шести штамів P. aeruginosa. Фіг. 12 - Лікування мишей, інфікованих у легені з застосуванням цефтазидиму (кожні 2 год.) та авібактаму (кожні 2 або 8 год). Фіг. 13 - Відповідь на дію авібактаму у мишей, інфікованих у легені, які отримали лікування цефтазидимом (q2h): фракціонування дози. Фіг. 14 - Відповідь на дію авібактаму у мишей, інфікованих у легені, які отримали лікування цефтазидимом (q2h) для чотирьох штамів P. Aeruginosa. Комбінація CAZ-AVI демонструє наявність значної активності проти клінічно важливих грамнегативних патогенів (наприклад, P. aeruginosa та Enterobacteriaceae, включаючи K. pneumoniae та види Enterobacter), включаючи ті з них, які є стійкими до цефалоспоринів розширеного спектру, піперациліну/тазобактаму та карбапенемів завдяки виробленню ESBL, KPC, AmpC або OXA-48 β-лактамази. Комбінація CAZ-AVI також демонструє більш високі, ніж стандартні лікувальні антибіотики, рівні чутливості до ключових місцевих грам-негативних патогенів (як-то P. aeruginosa та Enterobacteriaceae, включаючи K. pneumoniae), в тому числі до штамів, які є стійкими до звичайно застосованих антибіотиків, включаючи мультирезистентні штами. Цей потужний набір може забезпечити ефективне охоплення переважної більшості пацієнтів, уражених госпітальною пневмонією лише в тому випадку, якщо ліки дійсно зможуть проникати до місця інфекції у клінічно ефективних кількостях. Численні агенти з потенційно відповідною ефективністю до патогенів є неспроможними до ефективного лікування інфекцій госпітальної пневмонії через їх нездатність проникати до місця інфекції (проходити крізь періциліарну рідину (ELF)) у ефективних кількостях. Часто навантаження лікарським препаратом повинно бути значно збільшено для забезпечення доставляння ефективної кількості препарату у місце інфекції, що також збільшує потенційні побічні ефекти, від яких 3 UA 115683 C2 5 10 15 20 25 30 35 40 страждає пацієнт та в свою чергу може призвести до недотримання схеми введення лікарського засобу або до припинення лікування. Для ефективного лікування госпітальної пневмонії необхідно не тільки ефективне проходження крізь ELF, крім того ефективний агент також повинен зберегти свою антибактеріальну активність у присутності легеневого сурфактанта та не зазнавати жодних шкідливих міжлікових взаємодій з додатковими терапевтичними агентами, які разом з ним можуть бути введені пацієнтові в загальній схемі лікування. Будь-яка з цих значних перешкод може зробити потенційно привабливий антибактеріальний агент неприйнятним для лікування госпітальних пневмонійних інфекцій, як-то HAP та VAP. Винахідники несподівано та непередбачено знайшли, що комбінація CAZ-AVI має профіль, необхідний для успішного лікування внутрішньолікарняних інфекцій, що обумовлено не тільки тим, що вона має привабливий профіль для застосування проти основних патогенів, які викликають госпітальні пневмонійні інфекції, але й вона здатна ефективно проходити крізь ELF для доступу до сайту інфекції, не втрачає ефективності у присутності легеневих сурфактантів та може бути успішно введеною з багатьма загальноприйнятними агентами в ході загального плану лікування цієї популяції дуже хворих пацієнтів. Рівень проникнення авібактаму крізь людську ELF, який дорівнює приблизно 30% та той факт, що легеневий сурфактант не впливає на ефективність авібактаму, спрямовану до відновлення дії цефтазидиму у місці розташування госпітальних пневмонійних інфекцій навіть з тими ж дозами, які застосовують для лікування інфекції в інших місцях організму викликає подив та являє собою величезний крок вперед у можливих варіантах лікування для пацієнтів з госпітальною пневмонією. Одним з аспектів винаходу є спосіб лікування госпітальної пневмонії у пацієнта у разі потреби, який полягає у введенні пацієнту ефективної кількості цефтазидиму або його фармацевтично прийнятної солі та авібактаму або його фармацевтично прийнятної солі . Цефтазидим є пентангідратом (6R,7R)-7-[[(2Z)-2-(2-аміно-1,3-тіазол-4-іл)-2-(1-гідрокси-2метил-1-оксопропан-2-іл)оксиіміноацетил]аміно]-8-оксо-3-(піридин-1-іум-1-ілметил)-5-тіа-1азабіцикло[4,2,0]окт-2-ен-2-карбоксилату. Хімічна структура цефтазидиму зображена нижче: Авібактам є гідросульфатом [(2S,5R)-2-карбамоїл-7-оксо-1,6-діазабіцикло[3,2,1] октан-6-ілу]. Хімічна структура авібактаму зображена нижче: Відповідно до деяких втілень, винахід надає спосіб лікування інфекцій госпітальної пневмонії у пацієнтів, які того вимагають шляхом отримання лікарської форми, яка містить приблизно 2000 мг цефтазидиму та приблизно 500 мг авібактаму. У цьому втіленні введення лікарської форми є введенням дози цієї комбінації. В одному аспекті цього втілення пацієнт отримує дозу комбінації кожні 8 годин. В одному аспекті цього втілення пацієнт отримує кожну дозу комбінації шляхом внутрішньовенної інфузії. В одному аспекті цього втілення пацієнт отримує кожну дозу комбінації шляхом внутрішньовенної інфузії, яка триває протягом приблизно двох годин. В одному аспекті цього втілення пацієнт отримує кожну дозу комбінації шляхом внутрішньовенної інфузії, яка триває протягом приблизно однієї години. В одному аспекті цього втілення пацієнт отримує комбінацію шляхом одиничної інфузії. В одному аспекті цього втілення пацієнт отримує комбінацію шляхом серії інфузій. 4 UA 115683 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких втіленнях винаходу передбачено композиції, які по суті складаються з комбінації цефтазидиму та авібактаму або фармацевтично прийнятної солі одного або обох цих компонентів. У таких композиціях, єдиними активними інгредієнтами є цефтазидим та авібактам. Активним інгредієнтом, як тут визначено, є такий інгредієнт, який є ефективним у лікуванні інфекцій госпітальної пневмонії. Такі композиції можуть мати інші інгредієнти, які не є активними та/або антибактеріальними, антимікробними агентами. Приклади таких інгредієнтів охоплюють, але без обмеження, один або кілька фармацевтично прийнятних носіїв, наповнювачів, домішок або інших агентів, корисних для отримання композицій. Одним втіленням винаходу є комбінація цефтазидиму або його фармацевтично прийнятної солі та авібактаму або його фармацевтично прийнятної солі для застосування як лікарського засобу. Одним втіленням винаходу є комбінація цефтазидиму або його фармацевтично прийнятної солі та авібактаму або його фармацевтично прийнятної солі для застосування у лікуванні інфекції госпітальної пневмонії. В одному аспекті цього втілення ця комбінація призначена для застосування у лікуванні інфекції госпітальної пневмонії, яку викликають один або декілька патогенів, здатних до експресії однієї або кількох бета-лактамаз. В одному аспекті цього втілення цю комбінацію застосовують у лікуванні інфекції госпітальної пневмонії, яка не піддається монотерапії з цефтазидимом. В одному аспекті цього винаходу цю комбінацію застосовують у лікуванні інфекції госпітальної пневмонії, яка є внутрішньолікарняною пневмонією (HAP). В одному аспекті цього винаходу цю комбінацію застосовують у лікуванні інфекції госпітальної пневмонії, яка є пневмонією, пов'язаною зі штучною вентиляцією легенів (VAP). В одному втіленні винаходу комбінація цефтазидиму або його фармацевтично прийнятної солі та авібактаму або його фармацевтично прийнятної солі також містить один або більше додаткових терапевтичних агентів. В одному аспекті цього втілення ця комбінація також містить додатковий терапевтичний агент, вибраний з групи, що складається з антибактеріальних агентів, пригнічувачів бета-лактамази та протигрибкових агентів. В одному аспекті цього втілення ця комбінація також містить антибактеріальний агент, вибраний з групи, що складається з тобрамицину, левофлоксацину, ванкоміцину, лінезоліду, тигецикліну та колістину. В одному втіленні винаходу комбінацію цефтазидиму або його фармацевтично прийнятної солі та авібактаму або його фармацевтично прийнятної солі вводять одночасно. В іншому втіленні винаходу комбінацію цефтазидиму або його фармацевтично прийнятної солі та авібактаму або його фармацевтично прийнятної солі отримують незалежним чином та вводять разом. В іншому втіленні винаходу комбінацію цефтазидиму або його фармацевтично прийнятної солі та авібактаму або його фармацевтично прийнятної солі отримують незалежним чином та вводять послідовно. У будь-якому з вищезазначених втілень винаходу ця комбінація містить приблизно 2000 мг цефтазидиму або його фармацевтично прийнятної солі та приблизно 500 мг авібактаму або його фармацевтично прийнятної солі на дозу. В одному аспекті цих втілень цю комбінацію вводять приблизно кожні 8 год. В одному аспекті будь-якого з цих втілень цю комбінацію вводять приблизно кожні 20 год. В одному втіленні винаходу комбінацію цефтазидиму або його фармацевтично прийнятної солі та авібактаму або його фармацевтично прийнятної солі вводять внутрішньовенно. В одному аспекті цього втілення цю комбінацію вводять внутрішньовенно протягом приблизно 1-2 год. В одному аспекті цього втілення цю комбінацію вводять внутрішньовенно протягом приблизно 1 год. У іншому аспекті цього втілення цю комбінацію вводять внутрішньовенно протягом приблизно 2 год. Будь-яке з наведених вище втілень та аспектів може бути поєднано з будь-яким іншим для утворення додаткових призначених втілень винаходу. Існує багато стандартних посилань, в яких описані процедури отримання різних композицій, прийнятних для застосування сполук за винаходом. Приклади потенційних композицій та процедур знаходяться, наприклад, у книгах Handbook of Pharmaceutical Excipients, American Pharmaceutical Association (current edition); Pharmaceutical Dosage Forms: Tablets (Lieberman, Lachman and Schwartz, editors) current edition, published by Marcel Dekker, Inc., а також у Remington's Pharmaceutical Sciences (Arthur Osol, editor), 1553-1593 (current edition). Ці композиції можуть існувати у рідкій та твердій формі та бути присутніми у фармацевтично прийнятних формах, як-то, наприклад, у вигляді звичайних або покритих цукром таблеток, желатинових капсул, гранул, супозиторіїв, препаратів для ін'єкцій, мазей, кремів, гелів, які отримують з допомогою загальноприйнятних способів. Активний інгредієнт або інгредієнти можуть бути включені зі звичайно застосованими у цих фармацевтичних композиціях наповнювачами, як-то тальк, гуміарабік, лактоза, крохмаль, стеарат магнію, масло какао, водні 5 UA 115683 C2 5 10 15 20 25 30 35 40 45 50 55 60 або неводні носії, жири тваринного або рослинного походження, парафинові похідні, гліколі, різні змочувальні агенти, диспергуючі або емульгуючі агенти та консерванти. В одному варіанті втілення винаходу дозу комбінації цефтазидиму та авібактаму вводять внутрішньовенно. Ці композиції можуть знаходитися у вигляді ліофілізату, призначеного для розчинення у відповідному носії, як-то у апірогенній стерильній воді, безпосередньо перед застосуванням. Наприклад, цю композицію можна отримати у вигляді твердої лікарської форми, як-то у вигляді сухого порошка, до якого перед застосуванням додають розчинник. У зразкових втіленнях ця композиція може бути отримана у вигляді сухого порошку, який містить комбінацію цефтазидиму та авібактам. До цього сухого порошку перед застосуванням може бути додано стерильний розчинник, як-то воду, з отриманням відновленого розчину, pH якого може бути приблизно 4 - 10, У інших втілення pH відновленого розчину може бути приблизно 5,6 - 7. Цей відновлений розчин також може бути розведеним перед введенням з застосуванням відповідного розчину, як-то розчину для інфузії. Прикладами таких розчинів для інфузії є 0,9% хлорид натрію (ізотонічний розчин хлориду натрію), 5% декстроза, 2,5% декстроза та 0,45% хлорид натрію та лактований розчин Рингера. Ці композиції можуть бути отримані у вигляді різних рідких лікарських форм для перорального застосування, включаючи водні та неводні розчини, емульсії, суспензії, сиропи та еліксири. Такі лікарські форми також можуть містити відомі у цій галузі прийнятні інертні розчинники, як-то воду та відомі у цій галузі прийнятні наповнювачі, як-то консерванти, змочувальні агенти, підсолоджувачі, ароматизатори, а також агенти, призначені для емульгування та/або суспендування сполуки винаходу. Композиції даного винаходу можуть бути введені, наприклад, внутрішньовенно у вигляді ізотонічного стерильного розчину. Також можливо застосування інших шляхів отримання цих композицій. В деяких варіантах втілення способи можуть полягати у введенні комбінації цефтазидиму та авібактаму кожні 4 год., 6 год., 8 год., 12 год., 18 год. або кожні 24 год. Наприклад, цю комбінацію цефтазидиму та авібактаму можна вводити кожні 8 год. внутрішньовенно шляхом інфузії протягом приблизно 1 год. Наприклад, цю комбінацію цефтазидиму та авібактаму можна вводити кожні 8 год. внутрішньовенно шляхом інфузії протягом приблизно 2 год. В інших втіленнях ці способи можуть полягати у введенні комбінації цефтазидиму та авібактаму шляхом безперервної або тривалої інфузіі. Наприклад, цю комбінацію цефтазидиму та авібактам можна вводити шляхом інфузії протягом 3 год., 4 год., 5 год., 6 год., 7 год., 8 год., 9 год., 10 год., 11 год. або 12 год. У інших втіленнях тривалість інфузіі може бути більшою, ніж 12 год., наприклад вона може тривати 13 год., 14 год., 15 год., 16 год., 17 год., 18 год., 19 год., 20 год., 21 год., 22 год., 23 год. або 24 год. Ця тривалість лікування може залежати від тяжкості інфекції та від клінічного та бактеріологічного прогресу пацієнта, а також від будь-яких притаманних цьому пацієнту супутніх захворювань. У деяких втіленнях курс лікування може тривати приблизно 5 14 днів. У інших втіленнях курс лікування може тривати приблизно 5-7 днів. Наприклад, комбінацію, яка містить приблизно 2000 мг цефтазидиму та приблизно 500 мг авібактаму можна вводити кожні 8 год. впродовж приблизно 5 14 днів. У додаткових втіленнях комбінацію, яка містить приблизно 2000 мг цефтазидиму та приблизно 500 мг авібактаму можна вводити кожні 8 год. протягом приблизно 5-10 днів. У інших втіленнях комбінацію, яка містить приблизно 2000 мг цефтазидиму та приблизно 500 мг авібактаму можна вводити кожні 8 год. протягом приблизно 5-7 днів. Термін “приблизно” або “майже” означає межі прийнятного діапазону похибок для певного значення, як це визначено фахівцем зі звичайною кваліфікацією в даній галузі, які будуть частково залежати від вимірювання або визначення цього значення, тобто від обмежень системи вимірювання. Наприклад, на практиці у цій галузі, термін " приблизно " може означати стандартне відхилення в межах 1 або більш ніж 1. Крім того, термін "приблизно" по відношенню до композиції може означати позитивне чи негативне коливання в межах до 20%, переважно до 10%, ще переважніше до 5%. Альтернативним чином, зокрема відносно біологічних систем або процесів цей термін може означати порядок величини, переважно у 5-разових межах та більш переважно у 2-разових межах значення. Якщо певні значення є описаними у цій заявці та у Формулі Винаходу, то термін "приблизно" означає знаходження в межах прийнятного діапазону помилок для певного значення, якщо не тільки не вказано іншого. Наприклад, при зверненні до періоду часу, наприклад, годин, більш застосовними є поточні значення (± 20%). Таким чином, зазначені 6 годин можуть мати відношення не тільки до звичайних 6 год., але й також до, наприклад, 4,8 год., 5,5 год., 6,5 год. чи 7,2 год. Терміни “лікувати”, “лікування” та “лікувальний” мають відношення до одного або до кількох пунктів наступного переліку: полегшення або ослаблення принаймні одного симптому 6 UA 115683 C2 5 10 15 20 25 30 35 40 45 50 55 60 бактеріальної інфекції у суб'єкта; зменшення або пом'якшення інтенсивності та/або тривалості проявів бактеріальної інфекції у суб'єкта; припинення, затримку початкового періоду (тобто періоду, який триває до клінічного прояву інфекції) та/або зниження ризику розвитку або погіршення бактеріальної інфекції. Термін "терапевтично ефективний" стосується дози або кількості, яка має відношення до такої кількості сполуки або фармацевтичної композиції, яка є достатньою для отримання бажаної активності при введенні її ссавцю, який того потребує. Термін "ефективна кількість" означає кількість сполуки за винаходом, якої при введенні пацієнту для лікування інфекції або захворювання буде достатньо для здійснення такого лікування. "Ефективна кількість" буде змінюватися в залежності від активного інгредієнту, стану інфекції, захворювання або стану, що підлягає лікуванню та його тяжкості, а також від віку, ваги, фізичного стану та сприйнятливості ссавця, який підлягає лікуванню. Приклади. Приклад 1 - Ефективність комбінації CAZ-AVI іn vitro у легеневому сурфактанті. Бактеріальні штами. У цих дослідженнях були застосовані бактеріальні штами, які складали частину мікробіологічної культуральної колекції, розташованої у компанії AstraZeneca R&D Boston (AstraZeneca Research Collection, позначена, як ARC). Застосований для цієї перевірки набір бактеріальних ізолятів охоплював 5 еталонних штамів CLSI QC (штами від Інституту клінічних та лабораторних стандартів, призначені для контролю якості) та позосталі або здатні до експресії β-лактамаз клінічні ізоляти або ізоляти з головних бактеріальних скринінгових наборів. План досліджень. Значення мінімальної пригнічувальної концентрації (MIC) визначали з застосуванням способу мікророзведення середовища CLSI з незначним зміненням. Було отримано основні «материнські» планшети з базовою сполукою та їх застосували для мічення «дочірніх» 96луночних планшетів 2 мкл аліквотами серійно розведених лікарських засобів (колонки 1-11) з ™ допомогою багатопозиційного диспенсера Perkin-Elmer MiniTrak . Колонка 12 не містила лікарських засобів та була застосована як контроль росту. Потім з допомогою багатоканального ® дозатора Finnpipette у кожну лунку 96-луночного планшета додали інокулят об'ємом 100 мкл (5 5 x 10E КУО/мл) у середовищі CAMHB, яке містило 0; 1; 2,5; 5 або 10% легеневого сурфактанту. Авібактам перевіряли з незмінною концентрацією 4 мкг/мл під час його дослідження у комбінації з цефтазидимом. Експериментальні процедури. Значення MIC для кожної комбінації організму/ліків визначали з застосуванням способу мікророзведень у бульйоні у відповідності з директивами CLSI. До складу кожної досліджуваної групи були включені рекомендовані еталонні бактеріальні штами та до кожного тесту були включені відповідні зразкові сполуки. Для грам-негативних бактерій такими еталонними бактеріальними штамами були штами Escherichia coli ATCC 25922, E. coli ATCC 35218, Klebsiella pneumoniae ATCC 700603 та Pseudomonas aeruginosa ATCC 27853. Еталонним штамом для грам-позитивних бактерій був штам Staphylococcus aureus ATCC 29213. Аналіз даних. Значення MIC для окремих ізолятів визначали шляхом візуального спостереження. Значення MIC для кожної сполуки або комбінації у легеневому сурфактанті порівнювали зі значеннями, отриманими для сполук або комбінацій при їх перевірці у середовищі CAMHB без інших домішок. Результати. Результати щодо антибактеріальної активності цефтазидиму, авібактаму, композиції цефтазидим-авібактам та даптоміцину, перевіреної з різними концентраціями середовища CAMHB перелічені у Таблиці 1. Окрім випадкового тимчасового (+/-) дворазового змінення MIC,жодного підвищення цього показника для цефтазидиму, авібактаму або композиції цефтазидимавібактам відносно будь-якого перевіреного у легеневому сурфактанті (з концентрацією до 10%) грам-позитивного або грам-негативного бактеріального штаму спостережено не було. На відміну від цього було виявлено суттєве зростання MIC для даптоміцину (від 32-разового до >128-разового зростання) відносно досліджених штамів S. aureus. 32-разове зростання значень MIC (штам S. aureus даптоміцину) призвело до появи лише 1% легеневого сурфактанту. Показники MIC для цефтазидиму, цефтазидим-авібактаму та даптоміцину порівняно з CLSI QC штамом бактерій зазначено в Таблиці 1. Значення MIC для цефтазидиму, композиції цефтазидим-авібактам та даптоміцину знаходилися у межах, прийнятних для кожного штаму відповідно до директив CLSI QC. Висновки. 7 UA 115683 C2 5 Жодного пов'язаного з сурфактантом підвищення MIC для цефтазидиму, авібактаму або композиції цефтазидим-авібактам у присутності до 10% легеневого сурфактанту по відношенню до будь-якого з перевірених тут бактеріальних штамів виявлено не було. Стійка антибактеріальна активність цефтазидиму, авібактаму та композиції цефтазидим-авібактам у присутності різних концентрацій легеневого сурфактанту була особливо помітною при застосуванні ліків, які можуть бути розглянуті для лікування респіраторних інфекцій. Як і очікувалося, з підвищенням концентрації легеневого сурфактанту значення MIC для даптоміцинового позитивного контролю по відношенню до S. aureus суттєво зросли. Таблиця 1 Антибактеріальна активність цефтазидиму, авібактаму та композиції цефтазидим-авібактам у присутності різних концентрацій легеневого сурфактанту. Види роду Штам № S. aureus ARC12 S. aureus ARC12 S. aureus ARC12 S. aureus ARC12 S. aureus ARC12 S. aureus ARC516 S. aureus ARC516 S. aureus ARC516 S. aureus ARC516 S. aureus ARC516 E. coli ARC4 E. coli ARC4 E. coli ARC4 E. coli ARC4 Види роду Штам № E. coli ARC4 E. coli ARC016 E. coli ARC016 Опис штаму (β-лактамазний вміст) Концентрація сурфактанту (%) Штам CLSI QC, ATCC 29213 Штам CLSI QC, ATCC 29213 Штам CLSI QC, ATCC 29213 Штам CLSI QC, ATCC 29213 Штам CLSI QC, ATCC 29213 MRSA, стійкий до хінолону MRSA, стійкий до хінолону MRSA, стійкий до хінолону MRSA, стійкий до хінолону MRSA, стійкий до хінолону Штам CLSI QC, ATCC 25922 Штам CLSI QC, ATCC 25922 Штам CLSI QC, ATCC 25922 Штам CLSI QC, ATCC 25922 МІС (мкг/мл) Цефа Аві CAZ- Дапто зидим бактам AVI міцин 0 8 >64 8 0,5 1 16 >64 8 16 2,5 16 >64 16 64 5 8 >64 8 >64 10 8 >64 8 64 0 >64 >64 >64 0,5 1 >64 >64 >64 16 2,5 >64 >64 >64 64 5 >64 >64 >64 >64 10 >64 >64 >64 >64 0 0,25 32 0,25 - 1 0,25 32 0,12 - 2,5 0,25 32 0,12 - 5 0,25 16 0,12 - 10 Опис штаму (β-лактамазний вміст) Концентрація сурфактанту (%) Штам CLSI QC, ATCC 25922 Штам CLSI QC, ATCC 35218 (TEM-1) Штам CLSI QC, ATCC 35218 (TEM-1) МІС(мкг/мл) Цефа Аві CAZ- Дапто зидим бактам AVI міцин 10 16 0,12 - 0 0,12 16 0,12 - 1 8 0,25 0,12 16 0,12 - UA 115683 C2 E. coli ARC016 E. coli ARC016 E. coli ARC016 E. coli E. coli E. coli E. coli E. coli ARC523 ARC523 ARC523 ARC523 ARC523 Види роду Штам № E. coli E. coli E. coli E. coli E. coli ARC3690 ARC3690 ARC3690 ARC3690 ARC3690 E. coli ARC3666 E. coli ARC3666 E. coli ARC3666 E. coli ARC3666 E. coli ARC3666 Штам CLSI QC, ATCC 35218 (TEM-1) Штам CLSI QC, ATCC 35218 (TEM-1) Штам CLSI QC, ATCC 35218 (TEM-1) W3110 W3110 W3110 W3110 W3110 Опис штаму (β-лактамазний вміст) 2,5 0,12 16 0,12 - 5 0,12 16 0,12 - 10 0,12 16 0,12 - 0 1 2,5 5 10 0,5 0,5 0,25 0,5 0,5 >64 >64 >64 >64 >64 0,25 0,25 0,25 0,25 0,25 ----- Концентрація сурфактанту (%) (CTX-M-15, SHV-12) (CTX-M-15, SHV-12) (CTX-M-15, SHV-12) (CTX-M-15, SHV-12) (CTX-M-15, SHV-12) (CTX-M-15, OXA-1/30, SHV-31, TEM-1) (CTX-M-15, OXA-1/30, SHV-31, TEM-1) (CTX-M-15, OXA-1/30, SHV-31, TEM-1) (CTX-M-15, OXA-1/30, SHV-31, TEM-1) (CTX-M-15, OXA-1/30, SHV-31, TEM-1) МІС(мкг/мл) Дапто Цефа Аві CAZ-AVI Міцин зидим бактам 0 1 2,5 5 10 16 16 16 16 16 0,12 0,12 0,12 0,12 0,12 ----- 0 32 8 0,12 - 1 32 8 0,12 - 2,5 32 8 0,12 - 5 32 8 0,12 - 10 9 64 64 64 64 64 32 8 0,12 - UA 115683 C2 Види роду Штам № Опис штаму (β-лактамазний вміст) Концентрація сурфактанту (%) Штам CLSI QC, ATCC K. 700603 ARC561 pneumoniae (SHV-18, OXA-2, OKP6) Штам CLSI QC, ATCC K. 700603 ARC561 pneumoniae (SHV-18, OXA-2, OKP6) Штам CLSI QC, ATCC K. 700603 ARC561 pneumoniae (SHV-18, OXA-2, OKP6) Штам CLSI QC, ATCC K. 700603 ARC561 pneumoniae (SHV-18, OXA-2, OKP6) Штам CLSI QC, ATCC K. 700603 ARC561 pneumoniae (SHV-18, OXA-2, OKP6) Головна група K. ARC1865 скринінгу pneumoniae (сиквенс не проводили) Головна група K. ARC1865 скринінгу pneumoniae (сиквенс не проводили) Головна група K. ARC1865 скринінгу pneumoniae (сиквенс не проводили) МІС(мкг/мл) Цефа Аві Дапто CAZ-AVI зидим бактам міцин 0 >64 0,5 - 1 32 >64 0,5 - 2,5 32 >64 0,5 - 5 32 64 0,5 - 10 32 64 0,5 - 0,5 >64 0,25 - 1 0,25 >64 0,25 - 2,5 10 32 0,5 64 0,25 - UA 115683 C2 Види роду Штам № K. ARC1865 pneumoniae K. ARC1865 pneumoniae K. ARC2528 pneumoniae K. ARC2528 pneumoniae K. ARC2528 pneumoniae K. ARC2528 pneumoniae K. ARC2528 pneumoniae K. ARC2929 pneumoniae K. ARC2929 pneumoniae Види роду Штам № K. ARC2929 pneumoniae K. ARC2929 pneumoniae K. ARC2929 pneumoniae Опис штаму (β-лактамазний вміст) Головна група скринінгу (сиквенс не проводили) Головна група скринінгу (сиквенс не проводили) Клінічний ізолят (сиквенс не проводили) Клінічний ізолят (сиквенс не проводили) Клінічний ізолят (сиквенс не проводили) Клінічний ізолят (сиквенс не проводили) Клінічний ізолят (сиквенс не проводили) Концентрація МІС(мкг/мл) сурфактанту Цефа Аві (%) зидим бактам CAZ-AVI Дапто міцин 5 0,5 >64 0,25 - 10 0,5 >64 0,25 - 0 1 64 1 - 1 2 64 1 - 2,5 1 64 1 - 5 1 64 1 - 10 1 32 1 - (KPC-3) 0 >64 8 0,5 - (KPC-3) 1 >64 8 0,5 - МІС(мкг/мл) Цефа зидим Аві бактам CAZ-AVI Дапто Міцин Опис штаму Концентрація (β-лактамазний вміст) сурфактанту (%) (KPC-3) 2,5 >64 8 0,5 - (KPC-3) 5 >64 8 0,5 - (KPC-3) 10 >64 8 0,5 - K. ARC2945 pneumoniae 0 64 8 0,12 - K. pneumoniae 1 64 8 0,12 - 2,5 64 8 0,12 - 5 64 8 0,12 - 10 64 8 0,12 - 0 >64 16 0,25 - K. pneumoniae K. pneumoniae K. pneumoniae K. pneumoniae (KPC-2, SHV-11, TEM1, OXA-9) (KPC-2, SHV-11, TEMARC2945 1, OXA-9) (KPC-2, SHV-11, TEMARC2945 1, OXA-9) (KPC-2, SHV-11, TEMARC2945 1, OXA-9) (KPC-2, SHV-11, TEMARC2945 1, OXA-9) (CTX-M-15, OXA-1/30, ARC3713 SHV-5, TEM-1) 11 UA 115683 C2 Опис штаму Концентрація Штам № (β-лактамазний сурфактанту вміст) (%) (CTX-M-15, OXAK. pneumoniae ARC3713 1/30, 1 SHV-5, TEM-1) (CTX-M-15, OXAK. pneumoniae ARC3713 1/30, 2,5 SHV-5, TEM-1) (CTX-M-15, OXAK. pneumoniae ARC3713 1/30, 5 SHV-5, TEM-1) (CTX-M-15, OXAK. pneumoniae ARC3713 1/30, 10 SHV-5, TEM-1) Штам CLSI QC, P. aeruginosa ARC3 0 ATCC 27853 Штам CLSI QC, P. aeruginosa ARC3 1 ATCC 27853 Штам CLSI QC, P. aeruginosa ARC3 2,5 ATCC 27853 Штам CLSI QC, P. aeruginosa ARC3 5 ATCC 27853 Штам CLSI QC, P. aeruginosa ARC3 10 ATCC 27853 P. aeruginosa ARC545 PAO1 0 P. aeruginosa ARC545 PAO1 1 P. aeruginosa ARC545 PAO1 2,5 Види роду Види роду Штам № P. aeruginosa P. aeruginosa P. aeruginosa P. aeruginosa P. aeruginosa P. aeruginosa P. aeruginosa P. aeruginosa P. aeruginosa P. aeruginosa P. aeruginosa P. aeruginosa ARC545 ARC545 ARC2761 ARC2761 ARC2761 ARC2761 ARC2761 ARC2532 ARC2532 ARC2532 ARC2532 ARC2532 P. aeruginosa ARC3508 P. aeruginosa ARC3508 P. aeruginosa ARC3508 Опис штаму Концентрація (β-лактамазний сурфактанту вміст) (%) PAO1 5 PAO1 10 Клінічний ізолят 0 Клінічний ізолят 1 Клінічний ізолят 2,5 Клінічний ізолят 5 Клінічний ізолят 10 Клінічний ізолят 0 Клінічний ізолят 1 Клінічний ізолят 2,5 Клінічний ізолят 5 Клінічний ізолят 10 Повторно активована 0 експресія AmpC Повторно активована 1 експресія AmpC Повторно активована 2,5 експресія AmpC 12 МІС(мкг/мл) Цефа зидим Аві Дапто CAZ-AVI бактам міцин >64 16 0,25 - >64 16 0,25 - >64 16 0,25 - >64 16 0,25 - 1 >64 1 - 1 >64 1 - 2 >64 1 - 1 >64 1 - 2 >64 1 - 1 1 1 >64 >64 >64 1 1 1 --- МІС(мкг/мл) Цефа зидим 1 1 2 2 1 2 2 2 2 2 2 2 Аві Дапто CAZ-AVI бактам міцин >64 1 ->64 1 ->64 1 ->64 1 ->64 1 ->64 1 ->64 1 ->64 2 ->64 1 ->64 1 ->64 1 ->64 1 - 32 >64 2 - 32 >64 2 - 32 >64 2 - UA 115683 C2 Опис штаму Концентрація (β-лактамазний сурфактанту вміст) (%) Повторно P. aeruginosa ARC3508 активована 5 експресія AmpC Повторно P. aeruginosa ARC3508 активована 10 експресія AmpC Види роду Штам № МІС(мкг/мл) Цефа зидим Аві Дапто CAZ-AVI бактам міцин 32 >64 2 - 32 >64 2 - CAZ-AVI- композиція цефтазидим-авібактам 5 10 15 20 25 Приклад 2 - Дослідження можливої взаємодії ліків з іншими агентами, звичайно призначеними для спільного введення. Для визначення взаємодії (у разі її наявності) між цефтазидимом або композицією цефтазидим-авібактам та шістьма відомими антибактеріальними агентами, як-то тобрамицин, левофлоксацин, ванкоміцин, лінезолід, тигециклін та колістин було застосовано аналіз з допомогою способу «шахової дошки». Значення MIC цефтазидиму та композиції цефтазидимавібактам у присутності різних концентрацій цих антибактеріальних агентів та у відсутність них порівняли для отримання серій значень індексу фракційної пригнічувальної концентрації (FICI). З кожної комбінації «шахової дошки» було отримано середнє значення FICI, яке отримало інтерпретацію згідно за прийнятним критерієм. У разі, якщо антибактеріальні агенти не спричинювали жодного ефекту (як-то дія ванкоміцину та лінезоліду проти грам-негативних ізолятів; дія колістину проти грам-позитивних ізолятів) було здійснено порівняння MIC цефтазидиму та композиції цефтазидим-авібактам з показниками MIC у поєднанні з Cmax та 0,5 x Cmax цих антибактеріальних агентів. Також були досліджені чотири штами з високим рівнем експресії AmpC, вісім штамів Enterobacteriaceae та P. aeruginosa, здатних до експресії беталактамази розширеного спектру (ESBL), включаючи два штами, які виробляють бета-лактамазу CTX-M-15 та п'ять штамів, які виробляють бета-лактамазу KPC, а також представники кожного виду бактерій з базовими рівнями MIC. Також були досліджені три види S. aureus та три види E. faecalis. Жодної синергетичної або антагоністичної взаємодії між цефтазидимом або композицією цефтазидим-авібактам та будь-яким іншим антибактеріальним агентом спостережено не було. У цих дослідженнях було зроблено висновок, що цефтазидим та цефтазидим-авібактам не мають жодної шкідливої мікробіологічної взаємодії з будь-яким з перевірених тут лікарських засобів при спільному застосуванні. Перевірені штами перелічені нижче у Таблиці 2. 13 UA 115683 C2 Таблиця 2 № ізоляту E. cloacae CAZ-AVI-02-075 - 04 CAZ-AVI-02-075 - 05 CAZ-AVI-02-075 - 06 CAZ-AVI-02-075 - 07 CAZ-AVI-02-075 - 08 CAZ-AVI-02-075 - 09 CAZ-AVI-02-075 - 10 CAZ-AVI-02-075 - 11 CAZ-AVI-02-075 - 12 CAZ-AVI-02-075 - 13 CAZ-AVI-02-075 - 14 CAZ-AVI-02-075 - 15 CAZ-AVI-02-075 - 16 E. coli E. coli E. coli E. coli E. coli K. neumoniae K. neumoniae K. neumoniae K. neumoniae K. neumoniae K. neumoniae K. neumoniae P. aeruginosa CAZ-AVI-02-075 - 17 P. aeruginosa CAZ-AVI-02-075 - 18 P. aeruginosa CAZ-AVI-02-075 - 19 CAZ-AVI-02-075 - 20 CAZ-AVI-02-075 - 21 CAZ-AVI-02-075 - 22 P. aeruginosa P. aeruginosa P. aeruginosa S. aureus CAZ-AVI-02-075 - 23 S. aureus CAZ-AVI-02-075 - 24 S. aureus CAZ-AVI-02-075 - 25 CAZ-AVI-02-075 - 26 CAZ-AVI-02-075 - 27 20 E. cloacae CAZ-AVI-02-075 -03 15 E. cloacae CAZ-AVI-02-075 - 02 10 Фенотип CAZ-AVI-02-075 - 01 5 Організм E. faecalis E. faecalis E. faecalis Базові рівні MIC Повторно активована експресія AmpC Повторно активована експресія AmpC Базові рівні MIC CTX-M-15 TEM-4 SHV-12 SHV-2 Базові рівні MIC TEM-4 CTX-M-15 SHV-12 KPC-3 KPC-3 KPC-2 Базові рівні MIC Повторно активована експресія AmpC Повторно активована експресія AmpC PER KPC-2 KPC-2 Базові рівні MIC Позитивний до пеніцилінази Позитивний до пеніцилінази Базові рівні MIC Базові рівні MIC Базові рівні MIC Реєстраційний номер (якщо є) ATCC 25922 ATCC 27853 ATCC 29213 Постачання лікарських продуктів: Тобраміцин, левофлоксацин, банкоміцин та колістин були отримані від компанії SigmaAldrich (Dorset, UK). Лінезолід та тигециклін були отримані від компанії Molekula (Dorset, UK). Способи перевірки сприйнятливості іn vitro: Всі визначення MIC, включаючи визначення, отримані шляхом способу «шахової дошки» було здійснено з застосуванням бульйону Мюлера-Хінтона зі стандартизованим вмістом катіонів (отримано від Becton Dickinson, Oxford UK). Початкові дані MIC визначали з допомогою способів мікророзведень у бульйоні, як було рекомендовано CLSI (2012b). Спосіб «шахової дошки» здійснювали відповідно до способу, наданого у роботі Pillai et.al., Antimicrobial Combinations («Антимікробні комбінації») у книзі th Antibiotics in Laboratory Medicine («Антибіотики у лабораторній медицині») (Lorian Ed., 5 Ed. (2005)) p. 365-440, як і для стандартних тестів з допомогою мікророзведень у бульйоні, але у комбінації з агентами. Для обчислення отриманих антибактеріальних розведень були отримані базові розчини, які потім серійно розвели до потрібних концентрацій у чотири рази у бульйоні Мюлера-Хінтона зі стандартизованим вмістом катіонів, виключаючи композицію цефтазидим-авібактам, при застосуванні якої було застосовано розведення обох агентів до потрібної концентрації у вісім разів. Кінцева концентрація авібактаму, яку застосовували протягом досліджень дорівнювала 4 мг/л. Антибактеріальні засоби були об'єднані у планшетах для мікротитрування з застосуванням системи дозування рідини Evolution III. 14 UA 115683 C2 5 10 15 20 25 30 35 40 45 50 55 60 У випадку грам-негативних ізолятів проти ванкоміцину та лінезоліду значення MIC, отримані для цефтазидиму та композиції цефтазидим-авібактам порівнювали зі значеннями MIC, отриманими у присутності Cmax та 0,5 x Cmax ванкоміцину (Baxter Healthcare Corp., 2008) та лінезоліду (MacGowan, Pharmacokinetics and Pharmacodynamic Profile of Linezolid in Healthy Volunteers and Patients with Gram-Positive Infections(«Фармакокінетичні характеристики та фармакодинамічний профіль лінезоліду у пацієнтів з інфекціями, спричиненими грампозитивними бактеріями та у здорових добровольців»), JAC, 51 (Sup S2):ii17-1125 (2003)). У випадку грам-позитивних ізолятів проти колітину значення MIC, отримані для цефтазидиму та композиції цефтазидим-авібактам порівнювали зі значеннями MIC, отриманими у присутності Cmax та 0,5 x Cmax колістину, як вказано у Couet et.al, Clinical Microbiology and Infection, Colistin Pharmacokinetics: the Fog is Lifting («Клінічна мікробіологія та інфекції, фармакокінетичні характеристики колістину: туман розвіюється»), CMI 18:30-39 (2011). Планшети для аналізу шляхом способу «шахової дошки» інокулювали та інкубували у відповідності з директивами CLSI (2012b) протягом 16-20 год. у атмосфері навколишнього повітря при 35±2 °C. Значення MIC записували наступного дня у вигляді найнижчої концентрації або комбінації концентрацій, необхідних для пригнічення всього видимого росту. З допомогою одержаних значень MIC відповідно за способом, наведеним у роботі Meletiadis et.al., Defining Fractional Inhibitory Concentration Index Cutoffs for Additive Interactions Based on Self-Drug Additive Combinations, Monte Carlo Simulation Analysis and in vitro-in vivo Correlation Data for Antifungal Drug Combinations Against Aspergillus fumigatus («Визначення граничних значень індексу фракціонної пригнічуючої концентрації для адитивних взаємодій на основі адитивних комбінацій, які мають лікувальну здатність, аналізу імітаційного моделювання з допомогою способу Монте-Карло та результатів кореляції in vitro-in vivo для протигрибкових лікарських комбінацій проти грибків Aspergillus fumigatus») AAC 54:602-09 (2010) були обчислені значення FICI для кожної «шахової дошки». Матеріал кожної лунки планшету, відповідний певному значенню MIC мав значення FICI, яке обчислювали за наступною формулою: FICI = FICA + FICB = (CA/MICA) + (CB/MICB) в якій MICA є MIC комбінації окремо застосованого протимікробного агента та MICB є MIC окремо застосованого цефтазидиму або композиції цефтазидим-авібактам, CA є концентрацією комбінованого препарату у комбінації та C B є концентрацією цефтазидиму або цефтазидимавібактаму у комбінації. З кожної «шахової дошки» було отримано певну кількість значень FICI та було обчислено їх арифметичне середнє значення з отриманням середнього значення FICI для двох агентів, об'єднаних проти одного ізоляту. Інтерпретацію середніх значень FICI здійснювали за наступним критерієм, наданих Одсом (Odds (2003)), який зараз є прийнятним критерієм у більшості наукових журналів: ≤ 0,5 Взаємодія 0,51 - 4 Нейтральність > 4 Антагонізм Широкий діапазон значень FICI для інтерпретації нейтральних взаємодій обумовлений притаманній MIC мінливістю, що призводить до появи схем подвійного розведення (Pillai et al. 2005). Meletiadis et al. (2010) припустили, що значення FICI, які перевищують 2 повинні вважатися антагоністичними, але через цю мінливість до таких інтерпретацій слід ставитися з обережністю. Результати. Підсумкові дані MIC наведено в Таблиці 3. Підсумкові дані FICI наведено в Таблиці 4. Співвідношення MIC цефтазидиму/композиції цефтазидим-авібактам (окремо та у комбінації, в якій обчислення FICI є неможливими) наведено в Таблиці 5. Цефтазидим. Середній діапазон значень FICI для цефтазидиму, поєднаного з іншим агентом для всіх антибактеріальних агентів, з якими його обчислювали дорівнював 0,64-1,99. Середнє значення FICI у всіх комбінаціях з цефтазидимом не перевищувало 2. У разі, коли Cmax та 0,5 x Cmax ванкоміцину та лінезоліду поєднували з цефтазидимом проти грам-негативних ізолятів, значення MIC цефтазидиму (окремо застосованого та у комбінації) у всіх випадках залишалися у межах одного подвоєного розведення. Так само, коли Cmax та 0,5 x Cmax колістину об'єднували з цефтазидимом проти грам-позитивних ізолятів, значення MIC цефтазидиму (окремо застосованого та у комбінації) у всіх випадках також залишалися у межах одного подвоєного розведення. Цефтазидим-авібактам. Середній діапазон значень FICI для композиції цефтазидим-авібактам, об’єднаної зі всіма 15 UA 115683 C2 5 10 антибактеріальними агентами дорівнював 0,72 - 2,13. Об’єднання композиції цефтазидим-авібактам з колістином проти K. pneumoniae 012 призвело до появи середнього значення FICI у 2,13, що було єдиним прикладом середнього значення FICI для всіх комбінацій з цефтазидимом-авібактамом, яке перевищувало 2. Коли значення Cmax та 0,5 x Cmax ванкоміцину та лінезоліду об’єднали з композицією цефтазидим-авібактам проти грам-негативних ізолятів, то значення MIC окремо застосованої композиції цефтазидиму-авібактаму та цієї композиції у комбінації залишалися у межах одного подвоєного розведення у всіх випадках за виключенням єдиного. У цьому разі (E. coli 08) MIC композиції цефтазидим-авібактам зменшилася з 0,12 мг/л до 0,03 мг/л у поєднанні з C max ванкоміцину. При об’єднанні Cmax та 0,5 x Cmax колістину з композицією цефтазидим-авібактам проти грам-позитивних ізолятів значення MIC окремо застосованої композиції цефтазидимавібактам та цієї композиції у комбінації залишалися у всіх випадках у межах одного подвоєного розведення. Таблиця 3: Підсумкові дані MIC для всіх антибактеріальних агентів проти всіх ізолятів. Неактивні комбінації антибактеріальних сполук та ізолятів до таблиці не включено. № ізо Вид ляту 1 E. cloacae 2 E. cloacae 3 E. cloacae 4 5 6 7 8 9 10 11 12 13 14 15 16 E. coli E. coli E. coli E. coli E. coli K.рneumoniae K.рneumoniae K.рneumoniae K.рneumoniae K.рneumoniae K.рneumoniae K.рneumoniae P. aeruginosa 17 P. aeruginosa 18 P. aeruginosa 19 20 21 22 P. aeruginosa P. aeruginosa P. aeruginosa S.aureus 23 S. aureus 24 S. aureus 25 E. faecalis 26 E. faecalis 27 E. faecalis Фенотип МІС (мг/л) CAZ CAZ Tob Lev Van Lzd Tig Col -AVI 0,12 0,06 0,25 0,03 0,5 0,25 Базові рівні MIC Повторно активована 256 експресія AmpC Повторно активована 128 експресія AmpC Базові рівні MIC 0,25 CTX-M-15 64 TEM-4 8 SHV-12 16 SHV-2 1 Базові рівні MIC 0,12 TEM-4 32 CTX-M-15 32 SHV-12 64 KPC-3 128 KPC-3 16 KPC-2 64 Базові рівні MIC 1 Повторно активована 8 експресія AmpC Повторно активована 64 експресія AmpC PER 128 KPC-2 128 KPC-2 64 Базові рівні MIC 8 Базові рівні MIC, 16 Пеніциліназа + Базові рівні MIC, 8 Пеніциліназа + Базові рівні MIC >512 Базові рівні MIC 256 Базові рівні MIC 256 2 0,25 1 1 0,25 0,25 0,06 0,5 0,25 0,12 0,12 0,06 0,06 0,06 0,12 0,25 0,25 0,12 1 0,25 2 1 0,5 64 1 1 64 0,25 4 0,25 0,25 0,25 8 0,12 0,25 0,015 16 0,015 0,015 16 0,03 0,03 16 0,03 0,06 16 0,06 1 0,12 0,25 0,5 0,5 0,25 0,25 0,25 1 0,5 1 0,25 0,5 16 0,25 0,5 0,25 0,5 0,25 0,25 0,5 0,25 0,25 0,25 0,25 0,25 1 8 0,5 8 32 0,5 4 0,5 0,12 32 1 16 8 2 8 1 16 256 16 8 32 0,25 0,25 1 1 2 1 2 32 16 2 0,12 16 0,5 0,12 1 2 0,12 8 0,25 0,12 1 2 0,12 1 2 2 1 2 2 0,06 0,06 0,06 >512 256 256 16 16 8 0,5 0,5 1 1 CAZ - цефтазидим, CAZ-AVI - цефтазидим-авібактам, Tob-тобраміцин, Lev-левофлоксацин, Van - ванкоміцин, Lzd - лінезолід, Tig - тигециклін, Col - колістин. 15 16 UA 115683 C2 Таблиця 4: Середні підсумкові значення FICI для всіх комбінацій (у разі необхідності). Для неактивних комбінацій антибактеріальних сполук та ізолятів значення FICI не обчислювали. № Вид ізоляту 1 E. cloacae 2 E. cloacae 3 4 5 6 7 8 9 10 11 12 13 14 15 16 E. cloacae E. coli E. coli E. coli E. coli E. coli K. pneumoniae K. pneumoniae K. pneumoniae K. pneumoniae K. pneumoniae K. pneumoniae K. pneumoniae P. aeruginosa 17 P. aeruginosa 18 19 20 21 22 23 24 25 26 27 P. aeruginosa P. aeruginosa P. aeruginosa P. aeruginosa S. aureus S. aureus S. aureus E. faecalis E. faecalis E. faecalis Фенотип Цефтазидим Цефтазидим-авібактам Tob Lev Van Lzd Tig Col Tob Lev Van Lzd Tig Col 1,28 1,33 1,24 1,25 1,03 1,17 1,24 1,48 Базові рівні MIC Повторно активована експресія AmpC 1,17 0,99 0,93 1,54 1,28 1,24 1,67 1,17 Повторно активована експресія AmpC 0,73 0,81 1,05 1,12 0,98 1,23 0,99 1,21 Базові рівні MIC 1,17 1,17 1,41 1,35 1,14 1,39 1,25 1,25 CTX-M-15 1,05 1,05 1,12 1,23 1,14 1,12 1,77 1,58 TEM-4 0,99 1,05 1,27 1,26 1,34 1,06 1,82 1,45 SHV-12 1,19 1,18 0,95 1,66 1,74 1,16 1,96 1,24 SHV-2 0,91 1,11 1,10 1,54 0,76 1,72 1,89 1,78 Базові рівні MIC 1,55 0,96 1,16 1,25 1,13 1,65 1,12 1,17 TEM-4 0,64 1,13 1,32 0,85 1,35 1,26 1,60 1,60 CTX-M-15 1,05 1,21 0,94 1,54 1,04 1,21 1,60 1,48 SHV-12 1,04 1,16 0,97 1,40 1,31 1,66 1,14 2,13 KPC-3 1,12 1,24 1,99 1,26 1,05 1,21 1,79 1,23 KPC-3 0,91 1,26 0,74 1,05 1,23 1,23 1,87 1,42 KPC-2 1,05 1,26 1,23 1,25 1,18 1,14 1,24 1,24 Базові рівні MIC 1,11 1,19 1,05 1,24 1,23 1,19 1,24 1,24 Повторно активована експресія AmpC 1,05 1,10 1,23 1,21 0,98 1,12 1,23 1,05 Повторно активована експресія AmpC 0,89 1,21 1,15 1,23 0,81 1,41 0,96 1,21 PER 0,70 0,99 1,13 1,43 0,73 0,94 1,10 1,09 KPC-2 0,97 1,13 1,40 1,21 0,91 1,13 1,26 1,21 KPC-2 0,97 1,12 1,23 1,34 0,72 1,60 1,57 1,82 Базові рівні MIC 1,60 0,98 1,23 1,43 1,13 1,23 1,21 0,85 1,21 1,12 Базові рівні MIC, Пеніциліназа + 0,86 1,46 0,99 1,10 1,27 0,99 1,32 0,99 1,10 1,48 Базові рівні MIC, Пеніциліназа + 0,84 1,21 1,24 1,32 1,11 1,12 1,21 0,78 1,21 1,35 Базові рівні MIC 0,84 1,15 1,63 1,72 1,19 0,84 0,99 1,52 1,81 1,14 Базові рівні MIC 0,74 1,20 1,18 0,99 0,73 0,80 1,19 0,89 1,24 1,05 Базові рівні MIC 0,99 0,78 1,38 1,64 1,16 0,99 1,11 0,94 0,87 1,08 Нижня межа коливань середнього значення FICI: 0,64 0,78 0,99 0,99 0,73 0,85 0,72 0,94 0,78 0,87 0,96 1,05 Верхня межа коливань середнього значення FICI: 1,60 1,33 1,63 1,64 1,99 1,66 1,74 1,72 1,52 1,81 1,96 2,13 17 UA 115683 C2 Таблиця 5: Співвідношення MIC цефтазидиму/ композиції цефтазидим-авібактам при наявності 0,5 x Cmax та Cmax ванкоміцину та лінезоліду проти грам-негативних ізолятів та колістину проти грампозитивних ізолятів та без присутності цих сполук. № ізоляту 1 Вид E. cloacae 2 E. cloacae 3 4 5 6 7 8 9 10 11 12 13 14 15 16 E. cloacae E. coli E. coli E. coli E. coli E. coli K. pneumoniae K. pneumoniae K. pneumoniae K. pneumoniae K. pneumoniae K. pneumoniae K. pneumoniae P. aeruginosa 17 P. aeruginosa 18 19 20 21 22 23 24 25 26 27 5 10 P. aeruginosa P. aeruginosa P. aeruginosa P. aeruginosa S. aureus S. aureus S. aureus E. faecalis E. faecalis E. faecalis Фенотип Цефтазидим Цефтазидим-авібактам Van Lzd Col Van Lzd Col 0,5 0,5 0,5 0,5 0,5 x x x x x 0,5 x Cmax Cmax Cmax Cmax Cmax Cmax Cmax Cmax Cmax Cmax Cmax Cmax Базові рівні MIC 1 1 2 1 1 0,5 1 1 Повторно активована 2 2 1 1 1 1 1 1 експресія AmpC Повторно активована 1 2 1 1 0,5 0,5 1 1 експресія AmpC Базові рівні MIC 1 1 1 1 1 0,5 1 0,5 CTX-M-15 1 1 1 1 1 1 1 1 TEM-4 1 1 1 1 1 0,5 2 2 SHV-12 1 1 1 0,5 2 1 2 2 SHV-2 1 2 1 1 0,5 0,25 2 1 Базові рівні MIC 2 1 1 1 1 0,5 1 1 TEM-4 1 2 1 1 1 1 1 1 CTX-M-15 2 2 1 0,5 1 1 1 1 SHV-12 1 1 1 1 1 1 1 1 KPC-3 2 1 2 1 1 1 1 1 KPC-3 2 1 1 1 2 2 1 2 KPC-2 2 2 1 1 1 1 1 1 Базові рівні MIC 1 0,5 1 1 1 1 1 1 Повторно активована 1 1 1 1 1 1 1 1 експресія AmpC Повторно активована 1 1 1 1 1 1 1 1 експресія AmpC PER 1 1 1 1 2 1 2 1 KPC-2 1 1 1 1 0,5 1 1 1 KPC-2 2 2 2 2 1 1 1 1 Базові рівні MIC 1 1 1 1 Базові рівні MIC, 2 2 1 1 Пеніциліназа + Базові рівні MIC, 1 1 1 1 Пеніциліназа + Базові рівні MIC 1 1 1 1 Базові рівні MIC 2 2 2 2 Базові рівні MIC 2 1 2 1 Співвідношення обчислені шляхом поділу MIC caz/caz-avi у комбінації на MIC окремого caz/caz-avi. Приклад 3. Проникнення CAZ-AVI у періциліарну рідину (ELF). Наступні фармакокінетичні дослідження проводили для отримання опису розподілення композиції цефтазидиму та авібактаму у легенях інфікованих та неінфікованих мишей. Потім були проведені дослідження ефективності цефтазидиму та композиції цефтазидиму та авібактаму проти ізолятів Pseudomonas aeruginosa з застосуванням моделі нейтропенічної легеневої інфекції. Жодних фармакокінетичних відмінностей у сироватці або ELF між 18 UA 115683 C2 5 10 15 20 25 30 35 40 45 50 55 60 інфікованими та неінфікованими мишами спостережено не було. При застосуванні модельованих для людини сироваткових доз цефтазидиму (2000 мг) та авібактаму (500 мг) у вигляді двохгодинної інфузії, було спостережено максимальну активність проти цих ізолятів з показниками MIC, які дорівнювали 32 мкг/мл, в яких ELF fT>MIC ≥ 19 % для верхнього 95 % довірчого інтервалу. При застосуванні показника MIC90 для композиції цефтазидим-авібактам, який дорівнював 8 мкг/мл було відмічено кілька ізолятів з більш високими та навіть меншими значеннями MIC, які були здатні зростати у мишачій моделі нейтропенічної легеневої інфекції. Отже в результаті цільових досліджень ELF fT>MIC з застосуванням цефтазидиму було виявлено активність проти показників MIC у 32 мкг/мл, в якій ELF fT>MIC=12 %. Модель нейтропенічної легеневої інфекції. У цих дослідженнях застосували вільних від патогенів мишей ICR жіночої статі вагою приблизно 25 г, придбаних у компанії Harlan Sprague Dawley, Inc. (Indianapolis, IN). Доглядання та застосування тварин здійснювали у відповідності з рекомендаціями Національної дослідницької ради, та вони були забезпечені необмеженим доступом до їжі та води. Нейтропенічний стан у мишей викликали шляхом внутрішньочеревинних ін'єкцій (100 та 250 мг/кг) циклофосфаміду (Cytoxan®; Bristol-Myers Squibb, Princeton, NJ) відповідно у перший та четвертий день перед щепленням. За три дні перед щепленням мишам також зробили одиничну внутрішньочеревинну ін'єкцію 5 мг/кг нітрату уранілу. Ці дії призводять до появи передбачуваного рівня ниркової недостатності, потрібної для уповільнення виведення лікарського засобу. За дві години перед початком протимікробного лікування тварини були піддані легкій анестезії з застосуванням ізофлурана (2,5 % у об'ємному співвідношенні у 100 % кисневому носії), доки їх частота дихання візуально не зменшилася. Пневмонію викликали 7 шляхом крапельного вливання (введення по краплям) 0,05 мл інокулята, який містив 10 КУО досліджуваного ізолята, суспендованого у 3 % муцині у фізіологічному розчині. Доки тривала анестезія, інокулят постачали у пероральну порожнину мишей, блокуючи їх ніздрі та утримуючи тварин у вертикальному положенні. Проникнення бактерій у легені відбулося, коли тварини почали спонтанно дихати. Після повного одужання тварин від анестезії, у збагаченій киснем камері щеплених мишей випадковим чином розподілили на контрольні групи (0 год. та 24 год.) та групи, які отримали лікування (CAZ та CAZ-AVI). Характеристичний аналіз концентрацій періциліарної рідини (ELF) для композиції цефтазидим-авібактам. У цих дослідженнях було застосовано попередньо визначену описану вище схему застосування лікарського засобу та окрім того були проведені підтведжувальні сироваткові фармакокінетичні дослідження інфікованих мишей. У цих дослідженнях інфікованим нейтропенічним мишам ввели дозовану кількість препарату відповідно за обчисленою вище схемою та групи по шість тварин піддали евтаназії у різні моменти часу протягом 24-годинного періоду для підтвердження його впливу. Зразки крові збирали шляхом пункції серця та зразки сироватки до початку аналізу зберігали при -80 °C. Метою фармакокінетичних досліджень було отримання опису концентрацій періциліарної рідини у інфікованих мишей. У цих дослідженнях інфікованим нейтропенічним мишам ввели дозовану кількість препарату відповідно за обчисленою вище схемою та групи по шість тварин піддали евтаназії у різні моменти часу протягом третього періоду введення препарату (тобто протягом 16-24 год.). Зразки сироватки та бронхоальвеолярної лаважної рідини (BAL) зібрали, як описано вище, одразу після евтаназії та зберігали до початку аналізу при -80 °C. Значення ELF fT>MIC обчислювали з застосуванням профілю концентрації BAL та часу, включаючи верхній 95 % довірчий інтервал. Характеристичний аналіз концентрацій періциліарної рідини (ELF) для цефтазидиму. У цих дослідженнях було застосовано попередньо визначену описану вище схему застосування лікарського засобу у мишей з моделюванням спостереження у людини, яка кожні 8 год. шляхом двохгодинної інфузії отримувала 2000 мг цефтазидиму сироваткового показника fT>MIC (8). Окрім того були проведені підтверджувальні сироваткові фармакокінетичні дослідження інфікованих мишей з фармакодинамічним аналізом та оцінкою ELF fT>MIC з отриманням профілю концентрації-часу. У цих дослідженнях, для підтвердження дії досліджуваного засобу інфікованим нейтропенічним мишам ввели дозовану кількість препарату відповідно за обчисленою вище схемою та групи по шість тварин піддали евтаназії у різні моменти часу протягом третього періоду введення препарату (тобто протягом 16-24 год.). Метою фармакокінетичних досліджень було отримання опису концентрацій періциліарної рідини у інфікованих мишей. У цих дослідженнях інфікованим нейтропенічним мишам ввели дозовану кількість препарату відповідно за обчисленою вище схемою та групи по шість тварин піддали евтаназії у різні моменти часу протягом третього періоду введення препарату (тобто 19 UA 115683 C2 5 10 15 20 25 30 35 40 45 50 55 60 протягом 16-24 год.). Зразки сироватки та бронхоальвеолярної лаважної рідини (BAL) зібрали, як описано вище, одразу після евтаназії та зберігали до початку аналізу при -80 °C. Значення ELF fT>MIC обчислювали з застосуванням профілю концентрації BAL та часу, включаючи верхній 95 % довірчий інтервал. Визначення схем застосування цефтазидиму для цільових досліджень ELF fT>MIC. У наглядових дослідженнях було спостережено, що величина MIC 90 для композиції цефтазидим-авібактам проти P. aeruginosa дорівнювала 8 мкг/мл (10-12). З огляду на це слід зазначити, що існують ізоляти з більш високими показниками MIC та що спроможна до росту кількість у межах моделі мишачої легеневої інфекції є навіть меншою. У науковій літературі також було виявлено мішені ефективності fT>MIC у крові, отримані для застосування композиції цефтазидим-авібактам проти P. Aeruginosa, які добре корелювали з подібними показниками, отриманими для монотерапії з застосуванням цефтазидиму, а також інших цефалоспоринів. Враховуючі те, що відносні показники MIC для цефтазидиму імовірно дорівнювали ≥32 мкг/мл, для отримання додаткового уявлення про фармакодинамічний розрив між ефективністю та ростом бактерій винахідники планували впровадити описану вище"гуманізовану" схему застосування цефтазидиму. Протягом експериментів було спостережено, що значення ELF fT>MIC було суттєво більшим, ніж очікуваний та отриманий показник ELF fT>MIC, що не дозволило розрізнити потрібні значення fT>MIC по їх ефективності. Таким чином, ці дослідження було здійснено для розробки схеми лікування мишей, яка б призвела до появи суттєво зниженого показника ELF fT>MIC, який може надати змогу дослідникам виявити втрату ефективності у моделі легеневої інфекції. Дози за попередньо описаною вище "гуманізованою" схемою протягом періоду застосування лікарського засобу були зменшені. Додатково дослідники здійснили фармакокінетичні дослідження, в яких протягом 24-годинного періоду мишам ввели дозовану кількість цефтазидиму за схемою та протягом останніх трьох інтервалів (тобто впродовж 16-24 год.) зібрали зразки. Евтаназію мишей та відбір зразків сироватки та BAL збирали у попередньо визначені моменти часу, як визначено вище. Дослідження ефективності іn vivо: схема з застосуванням композиції цефтазидим-авібактам. У групах піддослідних тварин для кожного з 28 ізолятів P. Aeruginosa були застосовані схеми лікування композицією цефтазидим-авібактам, яке починали через дві години після інфікування. Всі дози вводили шляхом 0,2 мл підшкірної ін'єкції з трьома 8-годинними інтервалами між введеннями (тобто протягом 24 год.). Контроль забезпечували додатковою групою мишей, яким було введено такий самий об'єм фізіологічного розчину тим самим шляхом та частотою введення. Збір легенів піддослідних тварин здійснили через 24 год. після початку лікування; легені мишей, які не вижили протягом цих 24 годин, зібрали після їх загибелі. Процедуру такого збору для всіх піддослідних тварин здійснювали після їх евтаназії шляхом дії CO 2 з наступним зсувом шийних хребців, після чого легені тварин вилучали та по окремості гомогенізували у фізіологічному розчині. Для визначення КУО серійно розведений легеневий гомогенат нанесли на чашки з триптиказо-соєвим агаром з 5 % овечою кров'ю. Окрім зазначених вище лікувальних та контрольних груп на початку застосування препарату також було отримано матеріал з іншої групи з 6 інфікованих тварин, які не отримали лікування та були застосовані як нульовий контроль. Ефективність, визначену, як змінення щільності бактерій обчислювали у вигляді змінення log10 КУО бактерій у групах мишей, які отримали лікування та яке спостерігали через 24 год. після спостереження початкових щільностей у групі нульового контролю. Розвиток стійкості також перевіряли шляхом прямого нанесення гомогенату на чашки, які містили 32-4 мкг/мл композиції цефтазидим-авібактам. Дослідження ефективності іn vivо: схема з застосуванням цефтазидиму. У цих дослідженнях попередньо описану схему з застосуванням цефтазидиму (8) перевірили з 9 ізолятами P. Aeruginosa. Цю схему застосовували до груп піддослідних мишей одразу через дві години після початку їх інфікування. Всі дози вводили шляхом 0,2 мл підшкірної ін'єкції з трьома 8-годинними інтервалами між введеннями (тобто протягом 24 год.). У якості контролю була застосована додаткова група мишей, яким було введено такий саме об'єм фізіологічного розчину з таким саме шляхом та частотою введення. Збір та обробку легенів з кожної тварини було здійснено як попередньо описано та ефективність, визначену як змінення щільності бактерій, обчислювали у вигляді змінення log10 КУО бактерій у групах мишей, які отримали лікування та яке спостерігали через 24 год. після спостереження початкових щільностей у групі нульового контролю. Дослідження ефективності іn vivо: цільові дослідження ELF fT>MIC з застосуванням цефтазидиму. У цих дослідженнях було здійснено оцінку 9 ізолятів P. aeruginosa по відношенню до схеми з 20 UA 115683 C2 5 10 15 20 25 застосуванням цефтазидиму у мишей, які мали специфічні показники ELF fT>MIC. Застосування доз лікарського засобу починали через 2 год. після щеплення досліджуваних організмів та всі дози вводили шляхом 0,2 мл підшкірної ін'єкції з трьома 8-годинними інтервалами між введеннями (тобто протягом 24 год.). У якості контролю була застосована додаткова група мишей, яким було введено такий саме об'єм фізіологічного розчину з таким саме шляхом та частотою введення. Збір легенів всіх піддослідних тварин здійснювали після їх евтаназії шляхом дії CO2 з наступним зсувом шийних хребців, після чого легені тварин вилучали та по окремості гомогенізували у фізіологічному розчині. Для визначення КУО серійно розведений легеневий гомогенат нанесли на чашки з триптиказо-соєвим агаром з 5 % овечою кров'ю. Окрім зазначених вище лікувальних та контрольних груп на початку застосування препарату було отримано матеріал з іншої групи з 6 інфікованих тварин, які не отримували лікування та були застосовані як нульовий контроль. Ефективність, визначену як змінення щільності бактерій, обчислювали у вигляді змінення log10 КУО бактерій у групах мишей, які отримали лікування та яке спостерігали через 24 год. після спостереження початкових щільностей у групі нульового контролю. Антибактеріальні засоби: У всіх дослідженнях in vivo було застосовано наявний у продажу цефтазидим (Fortaz®, Lot: L716, GlaxoSmithKline Research Triangle Park, NC, USA), отриманий від аптечного відділення лікарні Хартфорду (Hartford Hospital Pharmacy Department). Препарат авібактам аналітичної чистоти було створено у компанії AstraZeneca Pharmaceuticals (Waltham, MA, USA). Цефтазидим у флаконах для клінічного застосування було відновлено як описано у призначеній інформації та відповідним чином розведено для досягнення бажаних концентрацій; авібактам аналітичної чистоти у порошковому стані зважували у прийнятній для досягнення бажаних концентрацій кількості та відновлювали безпосередньо перед застосуванням. Результати. Бактеріальні ізоляти. Отримані у дослідженнях ефективності показники MIC цефтазидиму та композиції цефтазидим-авібактам для 28 ізолятів наведені у Таблиці 6. Таблиця 6 Фенотипічні дані 29 застосованих у дослідженнях ефективності in vivo грам-негативних ізолятів. P.aeruginosa CAIRD # PSA 22 PSA 971 PSA 1383 PSA 1384 PSA 37-8 PSA 856 PSA 1382 PSA 1386 PSA 1387 PSA 1388 PSA 1389 PSA 4-32 PSA 4-39 PSA 2-69 PSA 8-16 PSA 24-2 PSA 28-19 PSA 968 PSA 1391 PSA 1394 PSA 4-36 PSA 4-84 PSA 1-25 PSA 1-29 PSA 3-9 PSA 11-54 PSA 7-6 PSA 14-28 MIC (мкг/мл) CAZ-AVI CAZ 4 64 4 16 4 64 4 64 4 64 8 8 8 128 8 128 8 32 8 128 8 64 8 32 8 32 8 64 8 64 8 32 8 128 16 32 16 128 16 64 16 64 16 64 16 128 16 32 16 >128 32 32 32 128 64 128 CAZ x Дослідження CAZ fT>MIC x x x x x x x x x x x x x x x x x CAZ-AVI x x x x x x x x x x x x x x X X X X X X x x x x x x x x CAIRD # - № у базі даних Центру антибактеріальних досліджень та розвитку; CAZ - цефтазидим; CAZ-AVI – цефтазидим-авібактам; fT>MIC - цільові дослідження fT>MIC з застосуванням ELF. 21 UA 115683 C2 5 Визначення стану зараження хазяїна згідно з фармакокінетичними профілями. На Фіг.1 та Фіг. 2 наведені профілі концентрації-часу вільної сироватки та ELF, визначені in vivo для композиції цефтазидим-авібактам у інфікованих та неінфікованих мишей. Співвідношення проникнення для інфікованих та неінфікованих мишей були схожі між собою, як описано у Таблиці 7. Крім того, обчислений фармакодинамічний принцип fT>MIC також був прийнятним для порівняння між інфікованими та неінфікованими мишами (Таблиця 8). № ізоляту PSA 22 PSA 971 PSA 1383 PSA 1384 PSA 37-8 PSA 856 PSA 1382 PSA 1386 PSA 1387 PSA 1388 PSA 1389 PSA 4-32 PSA 4-39 PSA 2-69 PSA 8-16 PSA 24-2 Група Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Точка часу (год.) 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 Середнє 5,99* 9,15 2,42 6,27* 9,13 5,12 6,04* 8,13 2 5,9* 8,15 3,95 6,02* 8,26 4,38 6,11* 9,9 4,93 6,06* 9,42 4,7 5,91* 9,93 3,82 6,34* 9,84 3,89 6,13* 9,3 3,61 5,82* 10,09 3,75 5,56* 9,34 3,31 5,82* 7,96 3,78 5,38* 8,31 3,61 5,93* 9,94 3,8 6,13* 8,34 2,84 22 Змінення log КУО* Стандартне відхилення 0,11 0,02 0,63 0,09 0,31 1,18 0,1 0,08 0 0,11 0,04 0,61 0,28 0,15 0,68 0,44 0,17 0,45 0,22 0,08 0,71 0,18 0,11 0,51 0,32 0,15 0,39 0,14 0,25 0,56 0,2 0,13 0,27 0,16 0,14 0,2 0,12 0,24 0,24 0,23 0,05 0,35 0,15 0,18 0,47 0,03 1,07 0,37 Кількість легенів 4 4 5 4 5 4 4 4 5 4 4 5 10 9 9 5 5 4 5 5 4 3 5 4 5 4 4 4 5 5 5 5 3 4 4 5 5 4 4 4 5 4 4 5 3 4 5 5 UA 115683 C2 Продовження Таблиці PSA 28-19 PSA 968 PSA 1391 PSA 1394 PSA 4-36 PSA 4-84 PSA 1-25 PSA 1-29 PSA 3-9 PSA 11-54 PSA 7-6 PSA 14-28 5 10 Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI Контроль Контроль CAZ-AVI 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 6,46* 9,8 4,6 5,73* 9,79 4,79 5,86* 9,28 4,3 5,49* 8,57 3,55 6,53* 9,72 3,56 6,16* 9,66 4,72 6,21* 10,01 5,51 6,28* 9,4 4,89 6,45* 7,77 7,26 6,02* 9,88 4,46 5,34* 8,78 3,19 5,55* 7,9 6,52 0,2 0,16 0,35 1,19 0,05 0,47 0,09 0,06 1,4 0,41 0,19 0,44 0,2 0,08 0,86 0,21 0,14 0,38 0,42 0,13 0,94 0,52 0,09 0,85 0,09 0,93 0,91 0,1 0,08 0,43 0,65 0,41 0,26 0,31 0,01 0,31 4 5 4 5 3 4 5 3 4 5 3 4 4 4 5 4 5 5 4 5 5 5 4 4 4 4 4 4 5 3 4 5 4 5 4 5 Ефективність іn vivо: цільові дослідження ELF fT>MIC з застосуванням цефтазидиму. Результати цільових досліджень ефективності ELF fT>MIC наведені у Таблиці 11 та На Фіг.9. Ці дослідження здійснювали з застосуванням нейтропенічних мишей. Відповідні показники показники бактеріальної щільності у контрольних тваринах на початку застосування лікарського засобу дорівнювали 5,98±0,30 log10КУО зі зростанням до 8,75±0,93 log10КУО через 24 год. Бактеріальні ізоляти обирали на основі MIC цефтазидиму у межах32-128 мкг/мл. При застосуванні схеми монотерапії з цефтазидимом по відношенню до ізолятів з МІС у 32 мкг/мл була спостережена певна активність, рівень ефективності по відношенню до ізолятів з МІС у 64 мкг/мл був змінним та ізоляти з показниками МІС у 128 мкг/мл демонстрували незначну активність або відсутність такої активності. 23 UA 115683 C2 Таблиця 11 Результати досліджень ефективності in vivo з застосуванням схеми цільових досліджень ELF fT>MIC з цефтазидимом у моделі нейтропенічної легеневої інфекції. Контрольні дані у *0 год. є показником щільності бактерій на початку застосування лікарського засобу. № ізоляту PSA 1384 PSA 1383 PSA 1386 PSA 1388 PSA 968 PSA 1387 PSA 1389 PSA 1382 PSA 1394 5 10 15 20 Група Контроль Контроль CAZ Контроль Контроль CAZ Контроль Контроль CAZ Контроль Контроль CAZ Контроль Контроль CAZ Контроль Контроль CAZ Контроль Контроль CAZ Контроль Контроль CAZ Контроль Контроль CAZ Точка часу (год.) 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 0 24 24 Змінення log КУО* Кількість легенів Середнє Стандартне відхилення 5,86* 0,14 5 7,61 0,16 4 4,4 0,48 4 5,77* 0,09 4 7,29 0,48 4 3,73 0,42 5 5,79* 0,4 5 9,67 0,12 5 5,98 0,44 6 5,86* 0,05 4 8,39 0,17 5 5,54 0,8 3 5,98* 0,29 5 9,76 0,07 5 4,45 0,22 5 6,39* 0,19 5 9,45 0,3 5 4,23 0,17 3 5,68* 0,21 4 9,67 0,06 5 6,3 0,34 4 5,91* 0,23 4 8,64 0,31 5 6,42 1,37 5 5,58* 0,09 3 7,73 0,28 5 5,96 1,4 5 Висновки: Застосування комбінації цефтазидиму та авібактаму у моделі мишачої легеневої інфекції веде до отримання значних концентрацій цих сполук у легенях незалежно від імунного статусу хазяїна. Застосовуючи попередньо визначену схему вживання комбінації цефтазидим-авібактам була виявлена її ефективність проти бактеріальних ізолятів з MIC ≤ 32 мкг/мл, при якої ELF fT>MIC ≥ 19 %. Враховуючи ці спостереження слід зазначити, що бажаний рівень fT>MIC у легенях може бути меншим приблизно на 60 %, ніж попередньо очікувалося для цефалоспоринів. Звичайно, якщо при значеннях MIC у 64 мкг/мл не спостерігали появу помітних рівнів ELF fT>MIC, то застосування комбінації цефтазидим-авібактам було неефективним. Результати цільових досліджень ELF fT>MIC з застосуванням цефтазидиму також виявляють можливість позитивного результату з активністю, спостереженою при показниках MIC, які дорівнювали 32 мкг/мл (у цьому разі співвідношення ELF fT>MIC дорівнювало 12 %) та мінливість або відсутність активності при показниках MIC, які дорівнювали 64 та 128 мкг/мл. Приклад 4: Модель нейтропенічного стегна. Нейтропенічних мишей CD-1 інфікували у стегно вибраними штамами P. Aeruginosa, які 6 виробляють β-лактамазу (приблизно 10 КУО). 24- годинне лікування з застосуванням окремо застосованого цефтазидиму почали через 2 год. (q2h з різними дозами) з визначенням КУО у стегні для встановлення наслідків цього лікування. У повнодозових дослідженнях фракціонування авібактаму було застосовано два штами (з MIC цефазидиму у 32 та 64 мг/л). Відповідь на дію авібактаму (q2h) було визначено для інших 6 штамів P. aeruginosa (з MIC цефтазидиму у 64-128 мг/л). Модель Emax було налаштовано до дози та індекс відповідей PK/PD 24 UA 115683 C2 5 10 15 20 25 30 35 40 45 50 55 60 (PDI) був чутливим для визначення значення PDI окремо застосованого цефтазидиму та цефтазидиму у комбінації з авібактамом призвело до появи статичного ефекту, як-то до 1- та 2log10 загиблих бактерій. Також для авібактаму було обчислено відсоток часу наведеного вище інтервалу дозування з фактичними концентраціями MIC in vivo (порогові концентрації, CT) %fT>CT (1 та 4 мг/л при CT 0,25). Статичний показник %fT>MIC цефтазидиму при монотерапії дорівнював 0-38 % та деякі штами вимагали застосування більш низьких значень %fT>MIC. Застосування авібактаму призвело до зменшення статичного показника %fT>MIC цефтазидиму для всіх штамів. У дослідженнях з фракціонуванням дози найкращу кореляцію PDI для авібактаму спостерігали для %fT> CT 1мг/л. Порогова концентрація CT у 1 мг/л вимагала %fT>CT у 30,2-74,1. Для інших 6 штамів середнє значення %fT> CT 1 мг/л дорівнювало 36,3 % (14,1-62,5). Оціночні показники, потрібні для появи статичного ефекту були частково залежними від дози цефтазидиму (підвищення дози цефтазидиму вимагало більш низького значення). Дія авібактаму головним чином залежала від часу збереження концентрації препарату вище порогового значення %fT>CT 1 мг/л з середнім показником у 36,3 % при його одночасному додаванні з цефтазидимом. Застосування більш низьких доз цефтазидиму вимагало відносно збільшеного впливу. Mатеріали та способи. Антибактеріальні засоби: Цефтазидим (CAZ): Отримано від AstraZeneca (ex GSK) № у каталозі: G263770, Термін дії: 05 грудня 2012 Дата виробництва: 06 грудня 2010 Реєстраційний номер CAS: 78439-06-2 Ефективність: 77,2 % Авібактам Отримано від AstraZeneca (ex Dr Reddy) № у каталозі: AFCH005151 (07113P028), Аналітичний номер: A1002CQ055 Термін дії: березень 2013 Ефективність: 91,7 % Бактеріальні штами та перевірка сприйнятливості: Як наведено у Таблиці 1, у цих експериментах було застосовано сім добре описаних стійких до цефтазидиму штамів Pseudomonas aeruginosa, отриманих з різних клінічно значущих джерел. Показники MIC, отримані в результаті попередніх досліджень in vitro з застосуванням способу "шахової дошки" (Berkhout & Mouton 2013 CAZ-AVI-M1-061) були визначені з допомогою мікророзведення у відповідності з керівними принципами ISO (ISO 2006). Цей спосіб є CLSIсумісним. Тварини: У цих експериментах були застосовані нелінійні миші CD-1 жіночої статі (Charles River, Netherlands) у віці 4-5 тижнів та вагою 20-25 г. Гранулоцитопенію у тварин викликали шляхом підшкірного введення двох доз циклофосфаміду, одну з яких вводили за чотири дні (150 мг/кг) та другу за день (100 мг/кг) перед інфікуванням. Tварин утримували у стандартних умовах з необмеженим постачанням їжі та води та раз на день обстежували до імуносупресії та 2-3 рази на день після неї. Дослідження на тваринах здійснювали у відповідності з рекомендаціями ЄС (Директива 86/609/EEC від 24 листопада 1986) та всі процедури с тваринами були затверджені Комітетом захисту тварин Наймігенського університету (RU-DEC 2012-003). Інфікування: Нейтропенічних мишей інфікували двома штамами P. Aeruginosa / тварину з введенням одного штаму у ліве, а другого - у праве стегно. Введення здійснювали шляхом 5 6 внутрішньом'язового щеплення 0,05 мл бактеріальної суспензії, яка містила приблизно 10 –10 бактерій. Лікування здійснювали зі зростаючими дозами цефтазидиму або фізіологічного розчину (контроль) та кожну дозу (0,1 мл) вводили підшкірно, починаючи з нульової точки часу t=0 год. та потім через 2 год. після початку інфікування з застосуванням схеми q2h (введення кожні дві години), яка тривала протягом 24 год. Всі схеми введення препарату застосовували з групами, які складалися принаймні з двох тварин. У нульову точку досліджень двох мишей піддали евтаназії для визначення початкового інокуляту безпосередньо перед лікуванням. Всіх інших тварин піддали евтаназії через 24 год., незважаючи на необхідність того, що з точки зору захисту тварин (за наступними правилами захисту тварин) існувала вимога більш раннього 25 UA 115683 C2 5 10 15 20 25 30 35 40 45 припинення їх участі у дослідженнях. Стегна вилучили та перенесли у попередньо охолоджену 10 мл пластикову пробірку (Transport Tube, Omnilabo, NL), яка містила 2 мл фосфатносольового буферу (PBS; NaCl 8,00 г/л, Na2HPO4 * 2 H2O 1,44 г/л, KH2PO4 0,26 г/л, pH 7,2 - 7,4). Потім стегна піддали гомогенізуванню з застосуванням диспергатора Ultra-Turrax (IKA Labortechnik, Germany), після чого гомогенати були піддані серіям десятиразових розведень та нанесені на чашки (Chromagar, Biomerieux, NL) у кількості 3 × 10 мкл на розведення. Наступного дня було здійснено підрахунок колоній та обчислена кількість КУО / стегно. Лікувальну дію ("dКУО") потім визначали у вигляді різниці між значеннями log 10[КУО/стегно] у моменти часу досліджень t=24 год. та t=0 год. (середнє значення від двох мишей). Вимірювання концентрації антибіотика. Кров відокремили від плазми з застосуванням охолодженої центрифуги. Зразки розділили та зберігали при -80C. Концентрації цефтазидиму та авібактаму визначали з допомогою групи досліджень метаболізму лікарських препаратів та фармакокінетики у компанії AstraZeneca (Waltham, MA) з нижньою межею кількісного аналізу у 1,5 нг/мл для цефтазидиму та 1,8 нг/мл для авібактаму. З’язування білка дорівнювало 10 % для цефтазидиму та 8 % для авібактаму, як було визначено у камері для рівноважного діалізу та досліджено шляхом рідинної хроматографії з тандемною мас-спектрометрією. Оцінка та перевірка комбінованих схем дозованого введення препарату. Причинно-наслідковий зв'язок застосування авібактаму у нейтропенічних мишей з експериментальною інфекцією стегна було визначено під час лікування з фіксованою схемою застосування цефтазидиму, яке призвело до підвищення 1-2 log10 КУО порівняно з показниками початкового інокуляту певного штаму після 24 - годинного лікування цефтазидимом. Цю схему було вибрано через чутливість до змінень у дії авібактаму. Застосований авібактам вводили з різною частотою та дозою. Вплив цефтазидиму та авібактаму визначали з застосуванням програмного забезпечення MicLab 2,36 (Medimatics, Maastricht, The Netherlands) з застосуванням оціночних даних фармакокінетичних параметрів, отриманих в результаті фармакокінетичних досліджень. Зв'язування білка у моделюваннях було застосовано у 10 % випадків для цефтазидиму та у 8 % для авібактаму. Дію лікарського препарату визначали у вигляді різниці між значеннями log10 [КУО/стегно], отриманими на початку (t=0 h) та через 24 години (t=24 h) досліджень та вона являла собою середнє значення результатів досліджень двох тварин (dКУО). У всіх обчисленнях дослідниками були застосовані концентрації лікарських сполук, не зв'язаних з білками плазми крові. Модель Emax (або лінійну регресію) було пристосовано до дози та індекс відповідей PK/PD (PDI) був чутливим для визначення значень PDI окремо застосованого цефтазидиму та цефтазидиму у комбінації з авібактамом, що призвело до появи статичного або особливо визначеного "log-kill" ефекту. Відсоток часу та інтервал дозованого введення препарату вище порогової концентрації C T для показника %fT>CT авібактаму обчислювали для концентрацій CT у 0,25; 1 та 4 мг/л. Вибір значень CT здійснили на основі результатів активності авібактаму in vitro. У перевірці сприйнятливості було застосовано концентрацію, яка дорівнювала 4 мг/л, але менші концентрації також були активними, як було визначено у дослідженнях in vitro з застосуванням способу "шахової дошки" та у моделі розповсюдження інфекції Enterobacteriaceae у реакторі з порожнистими волокнами (Nichols W, Levasseur P, Li J, Das S. 2012. "A threshold concentration of avibactam (AVI) during the pharmacokinetic decline phase, below which β-lactamase inhibition in Enterobacteriaceae becomes ineffectivе.» ("Порогова концентрація авібактаму (AVI) протягом фази фармакокінетичного зменшення, нижче якої пригнічення β-лактамази у Enterobacteriaceae стає неефективним.») (усна доповідь на 52-й Міждисциплинарній конференції, присвяченій протимікробним агентам та nd хіміотерапії (52 Interscience Conference on Antimicrobial Agents and Chemotherapy, San Francisco, CA. Abstract #A 1760)). 26 UA 115683 C2 Таблиця 12 Штами P. Aeruginosa, яких застосували у фармакодинамічних дослідженнях цефтазидиму та авібактаму. № ізоляту 1 3 5 7 11 18 19 5 10 Огляд стійкості (при наявності) MIC MICCAZCAZ AVI Статичний %fT>MIC (мг/л) (мг/л) Нітроцефіназна активність '++'; Надлишкова експресія транскрипту AmpC; 128 β-лактамазний генотип: blaAmpC, blaPoxB; клас A-, клас BМінімальний рівень нітроцефіназної активності та експресії транскрипту AmpC; β-лактамазний 64 генотип: blaAmpC, blaPoxB, blaTEM-24 (CAZ-6), клас BНітроцефіназна активність '++++'; Надлишкова експресія транскрипту AmpC; 128 β-лактамазний генотип: blaampC, blapoxB; клас A-, клас BНітроцефіназна активність '+++'; Надлишкова експресія транскрипту AmpC; 64 β-лактамазний генотип: blaampC, blapoxB; клас A-, клас BOprD-, AmpCcon, клас A-, клас B128 OprD-, AmpCind?, клас A-, клас B32 OprD-, AmpCcon, клас A-, клас B64 8 Немає ефекту 2 0 8 3 4 7,2 16 2 4 Немає ефекту 9 38 Застосовані у цих експериментах штами Pseudomonas aeruginosa були вибрані на основі показників MIC in vitro та результатів досліджень in vitro з застосуванням способу "шахової дошки". CAZ - цефтазидим, CAZ-AVI - комбінація цефтазидиму та авібактаму, *MIC CAZ-AVI визначали з застосуванням 4 мг/л авібактаму. Таблиця 13: Схема експериментів з фракціонуванням дози. Нижче наведено приклад схеми застосування фракціонувань дози для лікування нейтропенічних мишей CD-1 жіночої статі з об'єднаними схемами застосування цефтазидиму та авібактаму. Кожна група складалася з двох тварин, які кожні дві години отримували фіксовану дозу цефтазидиму на основі 2 log10 підвищення у порівнянні з початковим інокулятом та авібактамом, як показано у схемі. 27 UA 115683 C2 Таблиця 14: Вплив авібактаму, пов'язаний з 24-годинною відповіддю стазису для 6 штамів P. aeruginosa у лікуванні мишей, інфікованих у стегна у поєднанні з попередньо визначеним постійним застосуванням дозованої кількості цефтазидиму. Штам 7 18 5 11 1 19 MIC (мг/л) 64 32 128 128 128 64 Доза CAZ (мг/кг) 64 64 64 64 32 32 Середнє значення Стандартна похибка TDD AVI (мг/кг) 267,47 58,91 33,59 77, 88 123,70 541,34 log TDD AVI %fT>CT1 2,43 1,77 1,53 1,89 2,09 2,73 50,4 24,2 14,1 29,1 37,2 62,5 36,3 17,8 CT1 - порогова концентрація у 1 мг/л; TDD - загальна щоденна доза, CAZ - цефтазидим, AVI - авібактам. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCombination therapy for the treatment of nosocomial pneumonia
Автори англійськоюDas, Shampa, Li, Jianguo, Mouton, Johan, Willem, Nichols, Wright
Автори російськоюДас Шампа, Ли Цзяньго, Моутон Йохан Виллем, Николс Райт
МПК / Мітки
МПК: A61K 31/4184, A61K 31/546
Мітки: лікування, терапія, госпітальної, комбінована, пневмонії
Код посилання
<a href="https://ua.patents.su/43-115683-kombinovana-terapiya-dlya-likuvannya-gospitalno-pnevmoni.html" target="_blank" rel="follow" title="База патентів України">Комбінована терапія для лікування госпітальної пневмонії</a>
Попередній патент: Біологічно активний шоколад
Наступний патент: Фармацевтична композиція для перорального застосування, що містить декскетопрофен та трамадол
Випадковий патент: Hіж бурякорізальhий