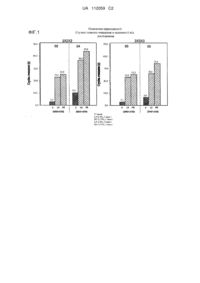
Комбінована терапія із кріохірургією і іміквімодом для лікування актинічного кератозу (варіанти)
Номер патенту: 112059
Опубліковано: 25.07.2016
Автори: Ву Джейсон Дж., Бам Валін С., Лі Джеймс Хурн-дзонг, Баладжі Кодумуді С., Мин Тзе-чіан, Калп Джеймс Х., Нордзік Майкл Т., Леві Шарон Ф., Бебілон Роберт
Формула / Реферат
1. Комбінований спосіб лікування пацієнта з діагнозом актинічний кератоз, при цьому комбінований спосіб включає:
(a) нанесення спрямованої на ділянку імунотерапії, що включає нанесення фармацевтичного складу, що містить 1-ізобутил-1Н-імідазо[4,5-с]-хінолін-4-амін або 1-(2-метилпропіл)-1Н-імідазо[4,5-с]хінолін-4-амін (іміквімод), на оброблювану ділянку пацієнта з діагнозом актинічний кератоз один раз на день відповідно до схеми лікування 2х2х2, де фармацевтичний склад містить іміквімод в кількості 2,5 % або 3,75 % за масою; і
(b) застосування спрямованої на вогнище кріохірургії до вогнища актинічного кератозу в оброблюваній ділянці для видалення вогнища актинічного кератозу.
2. Комбінований спосіб за п. 1, де оброблювана ділянка складає не більше 250 см2.
3. Комбінований спосіб за п. 1, де фармацевтичний склад містить 3,75 % за масою іміквімоду.
4. Комбінований спосіб за п. 1, де фармацевтичний склад містить іміквімод до 2,5 % за масою.
5. Комбінований спосіб за п. 1, де етап нанесення включає:
(a) нанесення фармацевтичного складу щодня протягом першого двотижневого циклу;
(b) перерву протягом двох тижнів; і
(c) нанесення фармацевтичного складу щодня протягом другого двотижневого циклу.
6. Комбінований спосіб за п. 1, де етап нанесення включає:
(a) нанесення фармацевтичного складу на оброблювану ділянку щонайменше один раз на день протягом до двох тижнів, щоб завершити перший цикл;
(b) перерву протягом до двох тижнів, де пацієнту не наносять фармацевтичний склад; і
(c) нанесення фармацевтичного складу на оброблювану ділянку щонайменше один раз на день протягом до двох тижнів, щоб завершити другий цикл.
7. Комбінований спосіб за п. 1, де етап нанесення включає:
(a) нанесення фармацевтичного складу на оброблювану ділянку один раз на день протягом двох тижнів, щоб завершити перший цикл;
(b) перерву протягом до двох тижнів, де пацієнту не наносять фармацевтичний склад; і
(c) нанесення фармацевтичного складу на оброблювану ділянку один раз на день протягом двох тижнів, щоб завершити другий цикл.
8. Комбінований спосіб за п. 1, де етап нанесення включає:
нанесення фармацевтичного складу на оброблювану ділянку щонайменше один раз на день протягом до двох тижнів.
9. Комбінований спосіб за п. 1, де фармацевтичний склад додатково включає фармацевтично прийнятний носій.
10. Комбінований спосіб за п. 9, де фармацевтичний склад являє собою крем.
11. Комбінований спосіб за п. 9, де фармацевтичний склад включає іміквімод, і фармацевтично прийнятний носій включає жирну кислоту.
12. Комбінований спосіб за п. 11, де жирну кислоту вибирають із групи, що складається зі стеаринової кислоти, пальмітинової кислоти, неочищеної олеїнової кислоти, лінолевої кислоти, ізостеаринової кислоти, очищеної олеїнової кислоти і особливо очищеної олеїнової кислоти.
13. Комбінований спосіб за п. 9, де фармацевтичний склад містить іміквімод у кількості за масою 2,5 % іміквімоду.
14. Комбінований спосіб за п. 9, де фармацевтичний склад містить іміквімод у кількості за масою 3,75 % іміквімоду.
15. Комбінований спосіб за п. 11, де жирна кислота є неочищеною олеїновою кислотою.
16. Комбінований спосіб за п. 11, де жирна кислота є очищеною олеїновою кислотою.
17. Комбінований спосіб за п. 11, де жирна кислота є олеїновою кислотою NF SUPER REFINED®.
18. Комбінований спосіб за п. 11, де жирна кислота є ізостеариновою кислотою.
19. Комбінований спосіб за п. 11, де жирна кислота присутня в кількості від 5 % до 30 % за масою.
20. Комбінований спосіб за п. 11, де фармацевтичний склад вибирають із групи складів, перелічених у таблиці 9.
21. Комбінований спосіб за п. 9, де фармацевтичний склад вибирають із групи, що складається зі складів іміквімоду, викладених у прикладі 23.
22. Комбінований спосіб за п. 13, де 2,5 % фармацевтичний склад вибирають із групи, що складається зі складів з 2,5 % іміквімоду, викладених у прикладі 23.
23. Комбінований спосіб за п. 14, де 3,75 % фармацевтичний склад вибирають із групи, що складається зі складів з 3,75 % іміквімоду, викладених у прикладі 23.
24. Комбінований спосіб за п. 9, де фармацевтичний склад досягає стаціонарного стану до тижня 2, наприклад від 8 дня до 14 дня, при нанесенні 500 мг або менше складу щодня протягом 21 дня на оброблювану ділянку 200 см2 на обличчі або лисіючій шкірі голови суб'єкта.
25. Комбінований спосіб за п. 1, де в пацієнта спостерігається двовершинний патерн сумарного показника локальної шкірної реакції, де двовершинний патерн одержують у результаті лікування актинічного кератозу більш низьким дозуванням іміквімоду, що доставляється з фармацевтичного складу, при нанесенні один раз на день відповідно до схеми лікування 2x2x2.
26. Комбінований спосіб за п. 25, де фармацевтичний склад містить іміквімод у кількості за масою 2,5 %.
27. Комбінований спосіб за п. 25, де фармацевтичний склад містить іміквімод у кількості за масою 3,75 % іміквімоду.
28. Комбінований спосіб за п. 1, де спрямовану на вогнище крюхірургію застосовують до початку нанесення спрямованої на ділянку імунотерапії.
29. Комбінований спосіб за п. 28, де спрямовану на вогнище кріохірургію застосовують не більше ніж за 28 днів до початку нанесення спрямованої на ділянку імунотерапії.
30. Комбінований спосіб за п. 28, де спрямовану на вогнище кріохірургію застосовуюють не більше ніж за 14 днів до початку нанесення спрямованої на ділянку імунотерапії.
31. Комбінований спосіб за п. 28, де спрямовану на вогнище кріохірургію застосовують за від 7 днів до 14 днів до початку нанесення спрямованої на ділянку імунотерапії.
32. Комбінований спосіб за п. 1, де спрямовану на ділянку імунотерапію наносять до спрямованої на вогнище кріохірургії.
33. Комбінований спосіб за п. 32, де нанесення спрямованої на ділянку імунотерапії завершують не більше ніж за 28 днів до застосування спрямованої на вогнище кріохірургії.
34. Комбінований спосіб за п. 32, де нанесення спрямованої на ділянку імунотерапії завершують не більше ніж за 14 днів до застосування спрямованої на вогнище кріохірургії.
35. Комбінований спосіб за п. 32, де нанесення спрямованої на ділянку імунотерапії завершують за від 7 днів до 14 днів до застосування спрямованої на вогнище кріохірургії.
36. Комбінований спосіб за п. 1, де спрямовану на вогнище кріохірургію застосовують у будь-який момент часу одночасно з нанесенням спрямованої на ділянку імунотерапії.
37. Комбінований спосіб за п. 6, де спрямовану на вогнище кріохірургію застосовують одночасно з будь-яким з етапів (а)-(с).
38. Комбінований спосіб за п. 7, де спрямовану на вогнище кріохірургію застосовують одночасно з будь-яким з етапів (а)-(с).
39. Комбінований спосіб лікування пацієнта з діагнозом актинічний кератоз, при цьому комбінований спосіб включає:
(a) застосування спрямованої на вогнище кріохірургії до вогнища актинічного кератозу в оброблюваній ділянці пацієнта з діагнозом актинічний кератоз; і
(b) нанесення спрямованої на ділянку імунотерапії на оброблювану ділянку, де етап нанесення включає нанесення фармацевтичного складу, що містить 1-ізобутил-1Н-імідазо[4,5-с]-хінолін-4-амін або 1-(2-метилпропіл)-1Н-імідазо[4,5-с]хінолін-4-амін (іміквімод), на певну ділянку пацієнту з діагнозом актинічний кератоз один раз на день відповідно до схеми лікування 2х2х2, де фармацевтичний склад містить іміквімод в кількості 2,5 % або 3,75 % за масою;
де оброблювана ділянка складає не більше 250 см2;
де нанесення спрямованої на ділянку імунотерапії починається не більше ніж через 28 днів після того, як оброблювана ділянка пацієнта була попередньо оброблена спрямованою на вогнище кріохірургією, застосовуваною до вогнища актинічного кератозу в оброблюваній ділянці відносно актинічного кератозу; або
де нанесення спрямованої на ділянку терапії закінчується не більше ніж за 28 днів перед тим, як оброблювану ділянку пацієнта згодом піддадуть обробці спрямованою на вогнище кріохірургією, застосовуваною до вогнища актинічного кератозу в оброблюваній ділянці відносно актинічного кератозу.
40. Послідовний комбінований спосіб лікування пацієнта з діагнозом актинічний кератоз, при цьому послідовний комбінований спосіб включає:
(а) лікування вибраної кількості вогнищ актинічного кератозу, діагностованих в оброблюваній ділянці шкіри пацієнта, за допомогою кріохірургії для видалення щонайменше декількох вогнищ актинічного кератозу в оброблюваній ділянці шкіри; і
(b) нанесення фармацевтичного крему, що містить 1-ізобутил-1Н-імідазо[4,5-с]-хінолін-4-амін або 1-(2-метилпропіл)-1Н-імідазо[4,5-с]хінолін-4-амін (іміквімод), щонайменше один раз на день відповідно до схеми лікування 2х2х2 на оброблювану ділянку шкіри протягом до 42 днів у межах не більше ніж 28 днів до або після того, як пацієнта лікували кріохірургією згідно з зазначеним етапом лікування, де фармацевтичний склад містить іміквімод в кількості 2,5 % або 3,75 % за масою, і де оброблювана ділянка шкіри складає не більше 250 см2.
41. Місцевий спосіб лікування пацієнта з діагнозом актинічний кератоз, при цьому комбінований спосіб включає:
(а) застосування спрямованої на вогнище кріохірургії до вогнища актинічного кератозу в оброблюваній ділянці пацієнта з діагнозом актинічний кератоз; і
(b) нанесення спрямованої на ділянку імунотерапії на оброблювану ділянку один раз на день відповідно до схеми лікування 2х2х2, де етап нанесення включає нанесення місцевого фармацевтичного складу, що містить 1-ізобутил-1Н-імідазо[4,5-с]-хінолін-4-амін або 1-(2-метилпропіл)-1Н-імідазо[4,5-с]хінолін-4-амін (іміквімод), на оброблювану ділянку пацієнта з
діагнозом актинічний кератоз, де фармацевтичний склад містить іміквімод в кількості 2,5 % або 3,75 % за масою; і
де оброблювана ділянка складає не більше 250 см2.
42. Комбінований спосіб лікування пацієнта з діагнозом актинічний кератоз, при цьому комбінований спосіб включає:
(a) застосування спрямованої на вогнище кріохірургії до вогнища актинічного кератозу для видалення вогнища актинічного кератозу, де вогнище актинічного кератозу знаходиться в оброблюваній ділянці пацієнта з діагнозом актинічний кератоз; і
(b) нанесення спрямованої на ділянку імунотерапії, що включає нанесення фармацевтичного складу, що містить 1-ізобутил-1Н-імідазо[4,5-с]-хінолін-4-амін або 1-(2-метилпропіл)-1Н-імідазо[4,5-с]хінолін-4-амін (іміквімод), на оброблювану ділянку один раз на день, де фармацевтичний склад містить іміквімод в кількості 2,5 % або 3,75 % за масою, і де етап нанесення включає:
(і) нанесення фармацевтичного складу на оброблювану ділянку щонайменше один раз на день протягом до двох тижнів, щоб завершити перший цикл;
(іі) перерву протягом до двох тижнів, де пацієнту не наносять фармацевтичний склад; і
(ііі) нанесення фармацевтичного складу на оброблювану ділянку щонайменше один раз на день протягом до двох тижнів, щоб завершити другий цикл,
де фармацевтичний склад містить іміквімод у кількості за масою 2,5 % від загальної ваги фармацевтичного складу, і
де нанесення спрямованої на ділянку імунотерапії починається не більше ніж через 28 днів від застосування спрямованої на вогнище кріохірургії.
43. Комбінований спосіб лікування пацієнта з діагнозом актинічний кератоз, при цьому комбінований спосіб включає:
(a) застосування спрямованої на вогнище кріохірургії до вогнища
актинічного кератозу для видалення вогнища актинічного кератозу, де вогнище актинічного кератозу знаходиться в оброблюваній ділянці пацієнта з діагнозом актинічний кератоз; і
(b) нанесення спрямованої на ділянку імунотерапії, що включає нанесення фармацевтичного складу, що містить 1-ізобутил-1Н-імідазо[4,5-с]-хінолін-4-амін або 1-(2-метилпропіл)-1Н-імідазо[4,5-с]хінолін-4-амін (іміквімод), на оброблювану ділянку один раз на день, де етап нанесення включає:
(і) нанесення фармацевтичного складу на оброблювану ділянку щонайменше один раз на день протягом до двох тижнів, щоб завершити перший цикл;
(іі) перерву протягом до двох тижнів, де пацієнту не наносять фармацевтичний склад; і
(ііі) нанесення фармацевтичного складу на оброблювану ділянку щонайменше один раз на день протягом до двох тижнів, щоб завершити другий цикл,
де фармацевтичний склад містить іміквімод у кількості за масою 3,75 % від загальної ваги фармацевтичного складу, і
де нанесення спрямованої на ділянку імунотерапії починається не більше ніж через 28 днів від застосування спрямованої на вогнище кріохірургії.
Текст
Реферат: Винахід стосується комбінованої спрямованої на вогнище терапії, такої як кріохірургія, і спрямованої на область терапії, такої як місцева терапія з низьким дозуванням іміквімоду, у комбінації для лікування актинічного кератозу. UA 112059 C2 (12) UA 112059 C2 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 Перехресні посилання на споріднені заявки Дана заявка заявляє перевагу пріоритету попередньої заявки США 61/398494, поданої 25 червня 2010 року, й попередньої заявки США 61/358845, поданої 25 червня 2010 року, розкриття всіх з них включені в даний документ посиланням у повному обсязі, як якби були викладені докладно в даному документі. Галузь винаходу Даний винахід спрямований на застосування сполученої або комбінованої спрямованої на вогнище терапії, такої як кріохірургія, й спрямованої на область місцевої або трансдермальної терапії, такої як 1-ізобутил-1Н-імідазо[4,5-c]- хінолін-4-амін, також відомий як 1-(2-метилпропіл)1Н-імідазо[4,5-c]-хінолін-4-амін або іміквімод. Більш конкретно, терапія області даного винаходу спрямована на місцеву терапію з низьким дозуванням іміквімоду з короткими тривалостями в комбінації зі спрямованою на вогнище кріохірургією для лікування актинічного кератозу ("AK"). При здійсненні даного винаходу спрямована на вогнище й спрямована на область терапії звичайно застосовують послідовно, але можна також застосовувати одночасно. У той час як спрямовану на вогнище терапію, наприклад кріохірургію, звичайно застосовують першою, за якою іде терапія, спрямована на область, наприклад терапія іміквімодом з низькою дозою, переважно з перервою між ними, сполучену, комбіновану або наступну терапії згідно з даним винаходом можна на практиці здійснювати в будь-якому послідовному порядку з перервою між ними або без неї або навіть одночасно. Передумови Актинічний кератоз (AK) являє собою передракову (що передує злоякісній пухлині) хворобу шкіри, викликану або асоційовану із хронічним впливом променистої енергії, такої як сонячне світло. Вогнища актинічного кератозу являють собою дрібні, червоні, шорсткуваті плями або вогнища, що зустрічаються на областях шкіри, що зазнають інсоляції. Вогнища актинічного кератозу мають багато з тих клітинних змін, які спостерігаються при раку шкіри, що називається плоскоклітинний рак (SCC). Наукове дослідження демонструє, що в ушкоджених сонцем клітинах у тілі виявляється мутантна версія гена p53, й вона присутня у більш ніж близько 90% людей з AK і плоскоклітинними раковими пухлинами. Хоча більшість вогнищ актинічного кератозу в дійсності не стають раковими, деякі вогнища можуть стати злоякісними. Вважається що, актинічний кератоз розвивається в клітинах шкіри, що мають назву "кератиноцити", які є клітинами, що становлять близько 90% епідермісу, найбільш зовнішнього шару шкіри. Хронічний сонячний вплив із часом викликає мутації в цих клітинах і змушує клітини змінюватися у розмірі, формі, способі, яким вони організовані, й способі їхньої поведінки. Крім того, клітинне ушкодження може навіть поширюватися на дерму, шар шкіри під епідермісом. Актинічні кератози (AK) є звичайними шкірними ушкодженнями, асоційованими із хронічним 1 впливом сонячного ультрафіолетового випромінювання (UVR). AK і плоскоклітинні ракові пухлини (SCC) мають загальні гістологічні й молекулярні ознаки; тому AK, як вважають деякі експерти, є ранніми SCC. Хоча деякі AK спонтанно регресують, й ризик прогресії індивідуального AK до інвазивного SCC є низьким, AK звичайно бувають з багатьма вогнищами й рецидивуючими. Оскільки пацієнти з наявністю множинних AK можуть піддаватися більш 3,4,5 високому ризику розвитку SCC, лікування AK рекомендується . Вогнища актинічного кератозу звичайно мають розмір від близько 2 до близько 6 міліметрів у діаметрі, вогнища AK можуть варіювати за кольором від тілесного до червонуватого й часто мають білу лусочку на верхівці. Іноді вогнища AK будуть утворюватися у формі рогів тварин. Коли це відбувається, AK відомі як "шкірні роги". Люди, які піддаються більш високому ризику розвитку актинічного кератозу, як правило, є світлошкірими й проводять істотний час поза приміщеннями, наприклад, за роботою або грою, протягом багатьох років. Вогнища AK звичайно виникають на тих областях тіла, які постійно протягом багатьох років зазнавали впливу сонця. Крім того, через хронічний сонячний вплив шкіра часто стає зморшкуватою, плямистою й зі зміненим кольором. Звичайні місця розташування для актинічного кератозу включають обличчя, вуха, губи, лисіючу шкіру голови, задню частину шиї, верхню частину грудей, тильні сторони долоней і передпліч. Коли вогнища AK розвиваються на губах, цей стан відомий як актинічний хейліт. Актинічний хейліт може характеризуватися дифузійним відшаровуванням на нижній губі, яка тріскається й пересихає. У деяких випадках, губи будуть мати білувату зміна кольору на стовщеній губі. Актинічний кератоз звичайно більш поширений після 40 років, оскільки розвиток актинічного кератозу забирає роки. Однак навіть у більш молодих дорослих може розвиватися актинічний кератоз при проживанні в географічних місцях, які цілий рік зазнають впливу високоінтенсійного сонячного світла, таких як Флорида й Південна Каліфорнія. Актинічний кератоз став істотною проблемою охорони здоров'я в Сполучених Штатах 1 UA 112059 C2 5 10 15 20 25 30 35 40 45 Америки. За оцінками, більш 20 мільйонів американців потерпають від актинічного кератозу, і ця кількість продовжує зростати. Фактично, актинічний кератоз у наш час настільки розповсюджений, що лікування актинічного кератозу вважається одною з найбільш частих причин для людей проконсультуватися з дерматологом. Лікування AK можна розділити на спрямоване на вогнище на противагу спрямованому на область, а також лікування, які застосовує виконавець й застосовує пацієнт. У Сполучених Штатах кріохірургія є найпоширенішою застосовуваною виконавцем і спрямованою на вогнище 6 терапією . Кріохірургія використовує екстремальний холод для руйнування тканини, у тому числі патологічної або ураженої тканини, такої як доброякісна або злоякісна хвороба шкіри (наприклад, кератози, бородавки, родимки, м'які бородавки, невроми й дрібні шкірні ракові пухлини). Незважаючи на те, що кріохірургія підходить для локалізованих станів, є ймовірність ушкодження здорових тканин, у тому числі нервових тканин і кровоносних судин, які підтримують здорові тканини. Побічні ефекти кріохірургії включають локалізований біль, почервоніння або іншу зміну кольору, пухирі, утворення кірки й/або лущення. Однією перевагою кріохірургії є можливість спеціально пристосувати лікування на підставі характерних рис індивідуальних вогнищ, таких як рівень гіпертрофії або гіперкератоз. Ефективність, однак, може змінюватися залежно від тривалості заморожування; в одному дослідженні ступені очищення індивідуального вогнища змінювалися від 39% із часом 7 заморожування менших за 5 секунд до 83% із часом заморожування понад 20 секунд . Негативною стороною тривалого часу заморожування, проте, є підвищений ризик гіпопігментації й більш великий дискомфорт у ході процедури, особливо, коли за одну процедуру обробляють багато вогнищ. Будучи спрямованою на вогнище терапією, кріохірургія не в змозі розв'язати 8 проблему "поля канцеризації", що супроводжує UVR-ушкодження . Шкіра навколо клінічно виражених AK піддається такому ж UVR-індукованому ушкодженню, що виявляється в AK, що приводить до дисплатичних вогнищ, які клінічно не виражені, але які були виявлені за 9,10 допомогою біопсії або спеціалізованої візуалізації . Із часом ці "субклінічні" вогнища можуть прогресувати до клінічно виражених "нових" AK, що потребують додаткового лікування або навіть розвиваються у de novo інвазивні SCC. Krawtchenko et al. повідомляють про початковий ступінь повного очищення близько 68% при кріохірургії, але через 1 рік при наступному спостереженні, тільки у 4% пацієнтів, що були піддані лікуванню, було стійке очищення області 11 лікування. Кріохірургія має додатковий недолік. Крім того, що вона неефективна проти субклінічних вогнищ AK, вона є болючою процедурою, яка звичайно занадто болюча або коштовна для обробки всіх клінічних або видимих вогнищ AK при разовій процедурі. Таким чином, фахівецьпрактик у момент лікування звичайно повинен вибирати, які вогнища AK будуть кріохірургічно видалятися. Отже, часто буває так, що деяка кількість клінічних вогнищ AK залишаються без лікування, і вони потребують додаткових кріохірігічних процедур у якийсь період у майбутньому, залежно від обмежень виконавця й переносимості пацієнтом. Також нерідкий є випадок, що внаслідок того, що кріохірургія може бути дуже болючою процедурою, багато пацієнтів не в змозі продовжити лікування клінічних і субклінічних вогнищ AK, що залишилися. Спрямовані на область способи лікування, такі як іміквімод, диклофенак і 5-фторурацил, лікують як індивідуальні AK, так і поле канцеризації. Іміквімод є агонистом Toll-подібного 12,13,14,15 рецептора 7, який, як було показано, є безпечним і ефективним для лікування AK . Крім того, лікування іміквімодом, ймовірно, лікує субклінічні вогнища, сприяючи високому ступеню 11 стійкого повного очищення поля лікування . Іміквімод має молекулярну формулу C14H16N4 і молекулярну вагу 240,3. Хімічна структурна формула іміквімоду наступна: 2 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 Іміквімод, також відомий як 1-ізобутил-1Н-імідазо[4,5-c]-хінолін-4-амін і також відомий як (інакше називаний) 1-(2-метилпропіл)-1Н-імідазо[4,5-c]-хінолін-4-амін, комерційно доступний, наприклад, як 5% крем іміквімоду ALDARA®, який у цей час схвалений Управлінням по контролю над якістю харчових продуктів, медикаментів і косметичних засобів ("FDA"). Крім того, ZYCLARA® є кремом з більш низьким 3,75% дозуванням іміквімоду. ZYCLARA® можна застосовувати для лікування актинічного кератозу з більш короткими тривалостями терапії, ніж призначувані в даний час для комерційно доступного 5% крему іміквімоду ALDARA®. Більш конкретно, даний винахід спрямований на склади з більш низьким дозуванням іміквімоду для доставки ефективної дози для лікування актинічного кератозу із прийнятним профілем безпеки. Іміквімод розкривається , серед іншого, в патенті США № 4689338 і описується там як противірусний засіб і як індуктор інтерферону, що включений в даний документ за допомогою посилання в його повному обсязі. Також там описується ряд складів для місцевого застосування іміквімоду. Цей патент США № 4689338 включений у даний документ за допомогою посилання в його повному обсязі. У патенті США № 4751087 розкривається, серед іншого, застосування комбінації етилолеату й гліцерилмонолаурату як підсилювача проникнення через шкіру для нітрогліцерину, при цьому всі три компоненти міститься в клеючому шарі трансдермального пластиру, де цей патент США включений у даний документ посиланням у його повному обсязі. У патенті США № 4411893 розкривається, серед іншого, застосування N,Nдиметилдодециламін-N-оксиду як підсилювача проникнення через шкіру у водних системах, причому цей патент США включений у даний документ за допомогою посилання в його повному обсязі. У патенті США № 4722941 розкриваються, серед іншого, легко усмоктувані фармацевтичні композиції, які включають розподілений в носії фармакологічно активний засіб, що включає посилюючу усмоктування кількість щонайменше однієї жирної кислоти, що містить 6-12 атомів вуглецю, й, необов'язково, моногліцерид жирної кислоти. Такі композиції , як кажуть, є особливо придатними для підвищення усмоктування фармакологічно активних основ, де цей патент США включений у даний документ за допомогою посилання в його повному обсязі. У патенті США № 4746515, серед іншого, розкривається спосіб застосування гліцерилмонолаурату для посилення трансдермального потоку лікарського засобу, що доставляється трансдермально, через неушкоджену шкіру, де цей патент США включений у даний документ за допомогою посилання в його повному обсязі. У патенті США № 5238944, патенті США № 7038051, патенті США № 6693113, патенті США № 6894060, патентній публікації США № 2011/0021555 (U.S.S.N. 12/636613), патентній публікації США № 2007/0123558, патентній публікації США № 2004/087614, патентній публікації США № 2002/147210 і WO2008US53522 розкриваються, серед іншого, місцеві склади й/або місцеві й трансдермальні системи доставки, що містять 1-ізобутил-1Н-імідазо[4,5-c]-хінолін-4амін або 1-(2-метилпропіл)-1Н-імідазо[4,5-c]хінолін-4-амін, де кожний включений у даний документ за допомогою посилання в повному їхньому обсязі. У цей час, FDA схвалило 5% крем іміквімоду, комерційно доступний під торговельною назвою ALDARA®, для лікування певних станів, асоційованих зі шкірою й слизовими оболонками, такого як, наприклад, (1) місцеве лікування клінічно типового, негіперкератозного актинічного кератозу (AK) на обличчі або шкірі волосистої частини голови у імунокомпетентних дорослих, (2) місцеве лікування підтвердженого біопсією первинного поверхневого базальноклітинного раку (sbcc) у імунокомпетентних дорослих й (3) місцеве лікування зовнішніх генітальних або навколоанальних бородавок/гострих кондилом у пацієнтів 12 років або старших. ALDARA® є торговельною назвою для схваленого FDA 5% крему іміквімоду, який є імуномодулятором. Кожний грам 5% крему іміквімоду ALDARA® містить 50 мг іміквімоду у брудно-білій «олія-в-воді» кремовій основі, що швидко всмоктується, яка складається з ізостеаринової кислоти, цетилового спирту, стеарилового спирту, медичного вазеліну, полісорбату 60, сорбітанмоностеарату, гліцерину, ксантанової камеді, очищеної води, бензилового спирту, метилпарабену й пропілпарабену. 5% крем іміквімоду ALDARA® упаковується у пакети або саше для одноразового застосування, кожний з яких містить 250 мг крему, що еквівалентний 12,5 мг іміквімоду. Оптимізований склад 3,75% крему іміквімоду (ZYCLARA®, Graceway Phermaceuticals, LLC, Бристоль, Теннесі) продемонстрував ефективність і переносимість при лікуванні більш великих областей залученої в AK шкіри (повністю обличчя або лисіюча шкіра голови), у короткій схемі із 14 двох циклів по 2-тижні щоденних нанесень . Незважаючи на схвалення FDA, лікування 5% кремом іміквімоду ALDARA® має обмеження, 3 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 що включають неспрощений і занадто тривалий режим дозування. У загальному випадку, схема лікування актинічного кератозу, із застосуванням схваленого FDA 5% крему іміквімоду ALDARA®, складається з нанесення 5% крему іміквімоду ALDARA® два рази на тиждень протягом повних 16 тижнів на певну/обмежену оброблювану область на обличчі або шкірі волосистої частини голови (але не на обидві одночасно). Поверхня оброблюваної області для 2 5% крему іміквімоду ALDARA® обмежується приблизно 25 см (наприклад, область 5 см x 5 см, яка може бути будь-якої форми; оброблювана область не обов'язково повинна бути квадратною) і визначається як одна безперервна область. Кількість вогнищ AK, що оброблюються 5% кремом іміквімоду ALDARA®, на оброблюваній області, як правило, складає від близько 4 до близько 8. Оскільки оброблювана область є досить невеликою, за одне нанесення, як правило, використовують менше за один пакет або саше для одноразового застосування ALDARA® (усього 250 мг крему, з якого іміквімод складає 12,5 мг). Непослідовності, як у дотриманні режиму, так і в терапевтичних результатах часто мають місце при лікуванні актинічного кератозу схваленим FDA 5% кремом іміквімоду ALDARA® через занадто тривалий період лікування, тобто 16 тижнів, ускладнений режим дозування, тобто двічі на тиждень, й високу частоту виникнення реакцій у ділянці нанесення. Після схвалення FDA 5% крему іміквімоду ALDARA® для лікування актинічного кератозу було проведено пілотне дослідження, яке представляло собою відкрите випробування, що включало 25 пацієнтів, які мали від 5 до 20 дискретних AK у межах косметичної одиниці чола, шкіри волосистої частини голови або щоки. У ході цього пілотного дослідження лікування складалося з нанесення один раз на день 5% крему іміквімоду три рази на тиждень протягом чотирьох тижнів на цілу косметичну одиницю, з наступною перервою чотири тижні. Якщо після завершення восьмитижневого циклу зберігався який-небудь AK, цикл повторювали. Допускали максимум три цикли (24 тижня). Оцінювали тридцять три місця ( тобто, косметичні одиниці) у 25 суб'єктів. За твердженням авторів, дотримання режиму терапії було відмінним з досить прийнятним профілем безпеки. Повне очищення всіх AK було відзначено у 82% (27/33) анатомічних місць у 25 досліджуваних суб'єктів. Майже половина місць (15/33) були чистими наприкінці першого циклу. "Терапевтичний інтервал" відзначався під час перерви, при цьому клінічне запалення вщухало, але AK продовжували очищуватися. Додатковим ефектом, за твердженням авторів, було виявлення й клінічне проявлення, та наступна ліквідація ранніх (субклінічних) AK на оброблюваній області. Як результат, автори зробили висновок, що мало місце відмінна згода із циклічною схемою терапії, що використовувалася в даному дослідженні, і що визначення терапевтичного інтервалу може виявитися корисним при складанні індивідуальних режимів дозування. Автори попереджали, однак, що отримані результати дослідження потрібно оцінювати з обережністю. Автори також попереджали, що, оскільки дане дослідження було відкритим випробуванням на малій кількості суб'єктів дослідження, безпека, ефективність і тривалість ефективності потребує підтвердження за допомогою контрольованих, рандомізованих випробувань із більш великими популяціями дослідження. Див. Salasche S.J., Levine N., Morrison L.: Cycle therapy of actinic keratoses of the face and scalp with 5% topical imiquimod cream: An open-label trial. J Am Acad Dermatol. 47(4):571-7 (Oct. 2002). Також після схвалення FDA 5% крему іміквімоду ALDARA® для лікування актинічного кератозу здійснили двохцентрове, раздомізоване, подвійне сліпе, носій-контрольоване дослідження для оцінки безпеки й ефективності коротких курсів терапії 5% кремом іміквімоду ALDARA® з очищенням >75% сонячних кератозів ("SK") від вихідного рівня в межах області лікування. Суб'єкти з вихідним рівнем 5-15 SK у межах однієї оброблюваної області (шкіра волосистої частини голови, чоло й скроні або обидві щоки) були рандомізовані для нанесення крему з іміквімодом або носієм на всю оброблювану область три рази на тиждень протягом 3 тижнів. Суб'єктів оцінювали через 4 тижні після завершення першого курсу для очищення вогнищ. Суб'єктів з 75% очищення сонячних кератозів вихідного рівня). За твердженням авторів, у двадцяти одного з 29 (72%) суб'єктів, що були піддані лікуванню імімквімодом, очистилося >75% вогнищ вихідного рівня в порівнянні з 3/10 (30%) суб'єктів, що застосовували крем з носієм (точний критерій Фішера, P = 0,027), і іміквімод добре переносився. Також за твердженням авторів, результати даного дослідження свідчать, що 5% іміквімод, що застосовується три рази на тиждень, можна запропонувати в якості терапевтичної альтернативи пацієнтам з SK на обличчі й шкірі волосистої частини голови й, що один або два короткі курси можуть бути альтернативою безперервній більш тривалій терапії 5% кремом іміквімоду ALDARA®, схваленим FDA. Однак автори зробили застереження, що 4 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 внаслідок того, що дослідження мало відносно коротке наступне спостереження після кінцевої точки, можуть знадобитися додаткові дослідження для оцінки чи може терапевтичний результат підтримуватися. Див. Chen K. et al..: Links Short-course therapy with imiquimod 5% cream for solar keratoses: a randomized controlled trial. Australasian J Dermatol. 30 44(4):250-5 (Nov 2005). Крім того, в 2007 році провели й опублікували багатоцентрове, подвійне сліпе, носійконтрольоване дослідження для оцінки безпеки й ефективності 5% крему іміквімоду, який наносять один раз на день 3 дні на тиждень в одному або двох курсах лікування актинічних кератозів на голові. За твердженням авторів, у двадцятьох дослідних центрах у Європі зареєстрували в сумі 259 пацієнтів з діагнозом AK, і їм протягом 4 тижнів наносили іміквімод, надавали 4-тижневу перерву й, якщо в них не було повного очищення, пацієнтам потім 2 надавали другий курс лікування. Область обробки обмежували до близько 25 см . Як повідомляли автори, пацієнти в групі з іміквімодом мали загальний ступінь повного очищення 55,0% (71/129) у порівнянні зі ступенем 2,3% (3/130) для групи з носієм, й існував високий ступінь узгодженості між клінічною оцінкою й отриманими гістологічними даними відносно очищення вогнищ AK. Автори додатково повідомляли, що при обох 8-тижневих оглядах після лікування негативна прогностична цінність оцінки дослідника становила 92,2% для клінічних оцінок у порівнянні з гістологічними результатами. Автори зробили висновок, що 4-тижневий курс лікування дозуванням три рази на тиждень 5% крему іміквімоду з повторним курсом лікування для тих пацієнтів, які не змогли досягнути очищення після першого курсу лікування, є безпечним і ефективним лікуванням AK, й загальний ступінь повного очищення (повне очищення після або курсу 1, або курсу 2) є порівняним з 16-тижневою схемою лікування 5% кремом іміквімоду ALDARA®, незважаючи на зменшення впливу на пацієнта лікарського засобу й зменшення загального часу лікування. Див. Alomar, A., J. Bichel et al..: Vehicle-controlled, randomized, double-blind study to assess safety and 25 efficacy of imiquimod 5% cream applied once daily 3 days per week in one or two courses of treatment of actinic keratoses on the head. British Journal of Dermatology. 157(1): 133-41 (2007). В 2007 році провели й також опублікували інше подвійне сліпе, носій-контрольоване, раздомізоване дослідження 5% крему іміквімоду, який наносили 3 дні на тиждень в одному або двох курсах лікування актинічного кератозу на голові. За твердженням авторів, пацієнти з вогнищами актинічного кератозу на голові наносили крем з іміквімодом або носієм 3х/тиж. протягом 4 тижнів (курс 1), пацієнти з залишаючимися вогнищами, одержували інший курс лікування, і ступені повного й часткового очищення оцінювали після курсу 1, після курсу 2 (загальний) і 1 рік потому. Автори зробили висновок, що іміквімод 3х/тиж. в одному або двох курсах лікування, імовірно, є ефективним для лікування актинічного кератозу на голові, забезпечуючи довгострокові клінічні переваги, й що дійсно трапляються деякі рецидиви, тому рекомендується довгострокове наступне спостереження. Див. Jorizzo, J., S. Dinehart et al.. Vehicle-controlled, double-blind, randomized study of imiquimod 5% cream applied 3 days per week in one or two courses of treatment for actinic keratoses on the head. Journal of the American Academy of Dermatology. 57(2): 265-8 (2007). В 2007 році провели й також опублікували інше багатоцентрове відкрите дослідження із застосуванням 5% крему іміквімоду в одному або двох 4-тижневих курсах лікування множинних актинічних кератозів на голові. За твердженням авторів, це було відкрите дослідження IIIb фази, у яке залучалися 180 дерматологічних клінік і практик у Німеччині, і пацієнти були придатними, якщо вони мали клінічно типові, видимі вогнища AK, локалізовані в будь-якому місці на голові, крім верхніх і нижніх вік, ніздрів, рожевої поверхні губи й внутрішніх частин вуха. Автори опублікували, що пацієнти наносили досліджуваний крем з іміквімодом на оброблювану область один раз на день 3х/тиждень протягом 4 тижнів (курс 1) з наступним4-тижневим періодом після лікування, й що пацієнти з залишаючимися на оброблюваній області вогнищами AK зазнавали другого 4-тижневого курса лікування. Очевидно, оброблювана область не обмежувалася, й пацієнтам дозволялося застосовувати одне або два саше за нанесення. Розмір оброблюваних областей і кількість саше, що наносилися, не повідомлялися. Медіанна кількість вогнищ AK на вихідному рівні становила 7. Автори додатково повідомляли, що в дослідження увійшли 829 пацієнтів, і що загальний ступінь повного очищення склав 68,9% (571/829), ступінь часткового очищення (відсоток пацієнтів з >75% скороченням кількості вогнищ AK від вихідного рівня) склала 80,2%. Автори підтвердили, що локальні шкірні реакції (LSR) і реакції в місці нанесення (ASR) були найбільш часто повідомлюваними побічними явищами, і що чотирьох пацієнтів виключили з дослідження через LSR або ASR. Автори роблять висновок, що більш коротка схема лікування 5% кремом іміквімоду, тобто один раз на день 3х/тиждень протягом 4 тижнів протягом 1 або двох курсів, може давати ступені повного очищення подібні до таких, які спостерігалися при 16-тижневому лікуванні 5% кремом іміквімоду ALDARA®, і вона має 5 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 перевагу через більш низький вплив лікарського засобу, що приводить до кращого профілю вигода-ризик для пацієнта. Див. Stockfleth, E., W. Sterry et al..: Multicentre, open-label study using imiquimod 5% cream in one or two 4-week courses of treatment for multiple actinic keratoses on the head. British Journal of Dermatology. 157 Suppl 2: 41-6 (2007). Проводили інше раздомізоване дослідження місцевого 5% іміквімоду в порівнянні з місцевим 5-фторурацилом у порівнянні з кріохірургією в імунокомпетентних пацієнтів з актинічними кератозами, у тому числі порівняння клінічних і гістологічних результатів, що включають подальше спостереження протягом 1-року. За твердженням авторів, у даному дослідженні порівнювали початкове й клінічне очищення через 12-місяців, гістологічне очищення й косметичні результати 5% крему іміквімоду (IMIQ), 5% мазі 5-фторурацилу (5-FU), які наносилися місцево, й кріохірургії для лікування AK у пацієнтів, які були рандомізовані в одну з наступних трьох груп лікування: один або два курси кріохірургії (20-40 секунд на вогнище), місцевий 5-FU (двічі на день протягом 4 тижнів) або один або два курси місцевого іміквімоду (три рази на тиждень протягом 4 тижнів кожний). У цьому дослідженні оброблювану область 2 обмежували до однієї анатомічної області 50 см або менше. Автори повідомили, що: (1) шістдесят вісім % (17/25) пацієнтів, що було піддано лікуванню кріохірургією, 96% (23/24) пацієнтів, що було піддано лікуванню 5-FU, і 85% (22/26) пацієнтів, що було піддано лікуванню IMIQ, досягли початкового клінічного очищення, P = 0,03; (2) ступінь гістологічного очищення для кріохірургії склав 32% (8/25), 67% (16/24) для 5-FU і 73% (19/26) у групі з іміквімодом, P = 0,03; (3) 12-місячне поадльше спостереження показало високий ступінь рецидиву й нові вогнища в гілках 5-FU і кріохірургії; (4) стійкий ступінь очищення первісно очищених індивідуальних вогнищ склав 28% (7/25) для кріохірургії, 54% (13/24) для 5-FU і 73% (19/26) для іміквімоду (p25 см у 6 UA 112059 C2 2 5 10 15 20 25 30 35 40 45 50 55 60 порівнянні з до 25 см для 5% крему іміквімоду ALDARA®), (2) більш короткого періоду лікування, наприклад, два цикли лікування по 2-тижні або три цикли лікування по 3-тижні із проміжним періодом без лікування 2-тижня або 3-тижня, вставленим між ними, відповідно, у порівнянні з повною схемою лікування 16-тижнів для 5% крему іміквімоду ALDARA®, (3) більш інтуїтивний режим дозування (щоденне дозування в порівнянні з дозуванням двічі на тиждень для 5% крему іміквімоду ALDARA®) і (4) меншої або більш низької частоти виникнення реакцій у місці нанесення. Розкриття патентноої публікації США № 2011/0021555 (U.S.S.N. 12/636613) включається за допомогою посилання в даному документі в її повному обсязі, як якби вона була викладена докладно в даному документі. Незважаючи на досягнення в лікуванні AK, усе ще залишається потреба в поліпшених способах лікування для лікування як клінічних, так і субклінічних вогнищ AK. Короткий опис винаходу Даний винахід долає вищезгадані обмеження, асоційовані з лікуванням актинічного кератозу ("AK") за допомогою схваленої FDA кріохірургії, завдяки відкриттю нових і поліпшених схем лікування AK, що включають спрямовану на вогнище терапію, таку як кріохірургія, і спрямовану на область терапію, таку як місцева терапія іміквімодом, застосовувані в комбінації для сполучення один з одним для лікування актинічного кератозу. Взагалі, даний винахід забезпечує нові й поліпшені способи лікування AK, які більш ефективні в лікуванні клінічних і субклінічних вогнищ AK у порівнянні із кріохірургією, якщо кріохірургію застосовують окремо або в якості монотерапії. При здійсненні даного винаходу спрямовану на вогнище й спрямовану на область терапії звичайно застосовують послідовно. Незважаючи на те, що кращим є застосування спрямованої на вогнище терапії першою, а потім терапії, спрямованої на область, з короткою перервою між ними, наприклад, перервою до близько 28 днів і переважно до близько 14 днів і навіть більш переважно від близько 7 до 14 днів, згідно з даним винаходом сполучені терапії можна здійснювати на практиці в будь-якому послідовному порядку, з або без перерви між ними, або навіть одночасно. Нові сполучені або комбіновані терапії AK, розглянуті даним винаходом: (1) значно поліпшують очищення AK, що піддані лікуванню кріохірургією; (2) лікують як клінічні, так і субклінічні вогнища AK; (3) лікують ті видимі вогнища AK понад такі, які фактично можна лікувати кріохірургією за одиночну обробку через, наприклад, переносимість пацієнтом, обмеження лікування виконавцем і/або вартість кріохірургії для пацієнта; і (4) збільшують загальне стійке очищення в порівнянні зі спрямованою на вогнище монотерапією AK, тобто кріохірургією окремо. Нові й унікальні комбіновані терапії даного винаходу переважно включають лікування певних вогнищ AK за допомогою спрямованої на вогнище терапії, наприклад, кріохірургії, з наступною спрямованою на область терапією, після короткої перерви від близько 7 до 14 днів. Якщо вибирають місцеву терапію іміквімодом, кращим є використання терапії іміквімодом з короткою тривалістю, більш низьким дозуванням і спрощеними режимами дозування так, щоб 2 лікування могла зазнати максимальна область, тобто оброблювана область до близько 250 см або більше, для лікування як клінічних, так і субклінічних вогнищ AK після спрямованої на вогнище терапії. Згідно з даним винаходом, оброблювані області включають обличчя, шкіру волосистої частини голови, шию, торс, груди, спину, живіт, руки, кисті, ноги й ступні. Приклади складів з більш низьким дозуванням іміквімоду, наприклад, від близько 1% до близько 4,25% іміквімоду й більш переважно від близько 2,5% до близько 3,75%, й короткі й спрощені режими дозування іміквімоду, наприклад, до близько 3 тижнів прийому, до близько 3 тижнів паузи й до близько 3 тижнів прийому, включають склади, що обговорюються й описуються в патентній заявці США № 12/636613, яка включена в даний документ за допомогою посилання в повному її обсязі. Інакше кажучи, даний винахід забезпечує нові й поліпшені способи лікування актинічного кератозу, які комбінують терапію, спрямовану на вогнище, з терапією іміквімодом з низькою дозою й короткою тривалістю, спрямованою на область, для більш ефективного лікування як клінічних, так і субклінічних вогнищ. Даний винахід, таким чином, забезпечує численні несподівані переваги в порівнянні з існуючою на даний момент кріохірургією для лікування актинічного кератозу у випадку окремого застосування. Даний винахід також долає вищезгадані обмеження, асоційовані з лікуванням актинічного кератозу за допомогою схваленого FDA 5% крему іміквімоду ALDARA®, за допомогою нового сполученого/комбінованого/ подальшого застосування, разом із кріохірургією, поліпшених схем лікування іміквімодом з короткою тривалістю, фармацевтичних складів з більш низьким дозуванням іміквімоду, а також спрощених режимів дозування для лікування актинічного кератозу. 7 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 У якості стратегії для спрямованої на область терапії, яку застосовують разом зі спрямованою на вогнище терапією (наприклад, кріотерапією), даний винахід забезпечує нові й поліпшені сполучені способи лікування актинічного кератозу з низькими дозами, де: (1) періоди лікування даного винаходу є суттєво коротшими за тривалістю, тобто до шести тижнів і переважно до чотирьох тижнів, ніж існуюча на цей час, схвалена FDA 16-тижнева схема лікування для лікування актинічного кератозу; (2) режими дозування даного винаходу є суттєво простішими, тобто одне нанесення на день щодня протягом до шести тижнів і переважно до чотирьох тижнів, ніж існуючий на цей час режим дозування, тобто один раз на день, але тільки двічі на тиждень протягом 16 тижнів, для на цей час схваленого FDA 5% крему іміквімоду ALDARA® для лікування актинічного кератозу; (3) оброблювані області даного винаходу є 2 суттєво більш великими, тобто до близько 250 см , ніж на цей час схвалена FDA оброблювана 2 область, тобто до близько 25 см , для 5% крему іміквімоду ALDARA® для лікування актинічного кератозу; (4) кількість вогнищ AK, що зазнають лікування згідно з даним винаходом, є суттєво більшою за кількістю, тобто від близько 5 до близько 20 або більше вогнищ AK на оброблювану область, ніж кількість вогнищ AK, тобто від близько 4 до близько 8 вогнищ AK на оброблювану область, які звичайно піддають лікуванню на цей час схваленим FDA 5% кремом іміквімоду ALDARA® для лікування актинічного кератозу; (5) менш подразнюючі фармацевтичні клади з іміквімодом даного винаходу складаються з більш низьким дозуванням, тобто від близько 1% до близько 4,25% іміквімоду (переважно від близько 2,5% до близько 3,75% іміквімоду, і більш переважно близько 2,5% або близько 3,75% іміквімоду), ніж на цей час схвалений FDA 5% крем іміквімоду ALDARA® для лікування актинічного кератозу; і (6) згідно з даним винаходом проявляється більш низька частота виникнення в суб'єкта реакцій у місці нанесення в порівнянні з більш високою частотою виникнення у суб'єктів реакцій у місці нанесення, які проявляються з на цей час схваленим FDA 5% кремом іміквімоду ALDARA® і схемою лікування для лікування актинічного кератозу. Інакше кажучи, даний винахід забезпечує нові й поліпшені сполучені, комбіновані або подальші схеми лікування AK, спрямовані на застосування сполученої, комбінованої або подальшої спрямованої на вогнище терапії, такої як кріохірургія, і спрямованої на область місцевої або трансдермальної терапії, такої як спрямовані на область способи лікування іміквімодом, які охоплюють більш великі оброблювані області, мають короткі тривалості терапій, застосовують більш низькі дозування іміквімоду, мають спрощені щоденні режими дозування й мають більш низьку частоту виникнення реакцій у місці нанесення в порівнянні з лікуванням актинічного кератозу 5% кремом іміквімоду ALDARA®, яке на цей час схвалене FDA. Даний винахід, таким чином, надає численні несподівані переваги в порівнянні з (a) кріохірургією окремо, (b) у порівнянні з на цей час схваленою FDA терапією 5% кремом іміквімоду ALDARA® для лікування актинічного кератозу, і (c) у порівнянні з окремим застосуванням способів лікування з більш низькими дозуваннями іміквімоду. Наприклад, щодо (b) даний винахід забезпечує (1) розширену оброблювану іміквімодом область, що за оцінкою 2 складає близько 200-250 см , наприклад, повністю обличчя або вся лисіюча шкіра голови, (2) укорочену схему лікування, тобто до близько 6 тижнів і переважно до близько 4 тижнів, (3) спрощений режим дозування, тобто один раз на день на кожний день періоду лікування, (4) низькі системні рівні іміквімоду в крові, навіть незважаючи на те, що оброблювана область є значно розширеною й частота дозування підвищена, (5) лікування збільшеної кількості клінічних вогнищ за період лікування, наприклад, від близько 5 до близько 20 вогнищ AK або більше, і (6) більш низька частота виникнення в суб'єктів реакцій у місці нанесення, навіть незважаючи на збільшення площі поверхні проникнення іміквімоду через розширену оброблювану область і підвищені кількості, що наносяться, згідно з даним винаходом під час схеми місцевого лікування актинічного кератозу, ніж на цей час асоційовані зі схваленою FDA терапією 5% кремом іміквімоду ALDARA®. Таким чином, даний винахід долає деякі з обмежень, що асоційовані з лікуванням актинічного кератозу за допомогою або кріохірургії, або схваленого FDA 5% крему іміквімоду ALDARA®, і вирішує поточні медичні потреби в сполучених, або комбінованих, або подальших терапіях, що мають як спрямований на вогнище аспект, так і спрямований на область аспект, з 2 (1) більшою оброблюваною областю (повністю обличчя або лисіюча шкіра голови: >25 см у 2 порівнянні з до 25 см для 5% крему іміквімоду ALDARA®), (2) більш коротким періодом лікування, наприклад, два цикли лікування по 2-тижні або два цикли лікування по 3-тижні із проміжним періодом без лікування 2-тижня або 3-тижня, вставленим між ними, відповідно, у порівнянні з повною схемою лікування 16-тижнів для 5% крему іміквімоду ALDARA®), (3) більш інтуїтивним режимом дозування (щоденне дозування в порівнянні з дозуванням двічі на тиждень для 5% крему іміквімоду ALDARA®) і (4) менша або більш низька частота виникнення 8 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 реакцій у місці нанесення. Спрямована на вогнище терапія даного винаходу може включати кріохірургію. Кріохірургія використовує екстремальний холод для руйнування тканини, у тому числі патологічної або ураженої тканини, такої як доброякісні або злоякісні хвороби шкіри (наприклад, кератози, бородавки, родимки, м'які бородавки, невроми й дрібні шкірні ракові пухлини). Кріохірургічні способи включають, але без обмежень, нанесення на уражену область рідкого азоту, діоксиду вуглецю (або окремо, або з ацетоном), кисню, закису азоту під тиском й/або аргону. Під час терапевтичної спрямованої на область частини лікування менш подразнюючі фармацевтичні склади з більш низьким дозуванням іміквімоду даного винаходу можуть включати: більш низьке дозування 1-ізобутил-1H-імідазо[4,5-c]-хінолін-4-аміну або 1-(2-метилпропіл)1H-імідазо[4,5-c]-хінолін-4-аміну (іміквімоду) для доставки ефективної кількості іміквімоду; і фармацевтично прийнятний носій для іміквімоду, при цьому носій включає жирну кислоту, таку як ізостеаринова кислота, пальмітинова кислота, стеаринова кислота, лінолева кислота, неочищена олеїнова кислота, очищена олеїнова кислота, така як олеїнова кислота NF SUPER REFINED ® (наприклад, високоочищена олеїнова кислота, тобто олеїнова кислота, яка має низьку кількість полярних домішок, таких як перекис водню, низьке пероксидне число й продається компанією CRODA; див. наприклад, www.crodausa.com) і їхня комбінація, у загальній кількості від близько 3% до близько 45% за вагою від загальної ваги складу. Склади з більш низьким дозуванням іміквімоду даного винаходу, особливо ті, де носій у якості жирної кислоти включає ізостеаринову кислоту, унікально розроблені, щоб мати фізичну й хімічну стабільність, розчинність, пом’якшуючі властивості й дозопропорційну доставку, подібну або кращу, ніж у 5% крему іміквімоду ALDARA®. Більш конкретно, вважається, що склади з більш низьким дозуванням іміквімоду даного винаходу, особливо ті, де носій у якості жирної кислоти включає ізостеаринову кислоту, у цілому мають подібне або поліпшене зм'якшення шкіри в місці нанесення, а також дозопропорційні швидкості вивільнення як щодо швидкостей вивільнення іміквімоду, так і щодо загальної кількості вивільненого іміквімоду відносно 5% крему іміквімоду ALDARA®. Інакше кажучи, на склади з більш низьким дозуванням іміквімоду даного винаходу впливає концентрація, і вони мають схожі швидкості вивільнення з 5% кремом іміквімоду ALDARA®. Крім того, чим більшлю є кількість іміквімоду в складі, тем швидше й більше вивільняється загальна кількість іміквімоду, що підтверджує те, що кількість у й швидкість вивільнення зі складів залежать від концентрації іміквімоду. Таким чином, незважаючи на те, що склади з більш низьким дозуванням іміквімоду даного винаходу доставляють різні кумулятивні кількості в роговий шар і епідерміс, тобто локальна доставка в шкіру, від 5% крему іміквімоду ALDARA®, вважається, що такі склади з більш низьким дозуванням іміквімоду мають пропорційну й лінійну залежність, що є подібним до 5% крему іміквімоду ALDARA® як щодо швидкості вивільнення іміквімоду, так і щодо загальної кількості іміквімоду, що вивільняється й доставляється локально в шкіру із часом, так що концентрації іміквімоду в складах даного винаходу, швидкості вивільнення іміквімоду й кількість іміквімоду, непоглиненого й доставленого в роговий шар і епідерміс, яка була вивільнена зі складів, головним чином, пропорційні й лінійні з 5% кремом іміквімоду ALDARA®. При цьому, склади з більш низьким дозуванням іміквімоду даного винаходу, особливо склади, де носій у якості жирної кислоти включає ізостеаринову кислоту, унікально розроблені, щоб бути стабільними й потрапляти в діапазон технічних умов для комерційно доступного 5% крему іміквімоду ALDARA®, як наприклад, відносно в'язкості, pH і стабільності, у тому числі мікроскопічної й макроскопічної стабільності. Більш конкретно, іміквімод, присутній у складах з більш низьким дозуванням іміквімоду даного винаходу, особливо тих, де носій у якості жирної кислоти включає ізостеаринову кислоту (діапазон за фармакопейною статтєю: 90-110%) і бензиловий спирт (діапазон за фармакопейною статтєю: 50-105%), залишається в певних рамках як при близько 25 °C, так і при близько 40 °C понад близько одномісячного періоду й у певних рамках як при близько 25 °C, так і при близько 40 °C понад близько шестимісячного періоду. Більше того, склади з більш низьким дозуванням іміквімоду даного винаходу, особливо ті, де носій у якості жирної кислоти включає ізостеаринову кислоту, залишаються стабільними протягом близько шести місяців при близько 25 °C і близько 40 °C, а також залишаються стабільними щодоі макроскопічного й мікроскопічного зовнішнього вигляду, в'язкості (діапазон за фармакопейною статтєю: 2000-35000 сП) і pH (діапазон за фармакопейною статтєю 4,0-5,5). На додаток, склади з більш низьким дозуванням іміквімоду даного винаходу унікально розроблені, щоб відповідати вимогам, зазначеним як у Фармакопеї США ("USP"), так і в Європейській фармакопеї ("EP"), щодо ефективності консерванту й того, щоб залишатися без продуктів розпаду при зберіганні при близько 25 °C/60%RH, близько 30 °C/65%RH і близько 9 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 40 °C/75%RH понад близько одного, близько двох, близько трьох і близько шести місяців і при аналізі при довжині хвилі близько 318 нм. Даний винахід також розглядає склади з більш низьким дозуванням іміквімоду, які мають унікальні фармакокінетичні профілі при застосуванні, наприклад, у комбінації з короткими тривалостями терапії для лікування актинічного кератозу згідно з даним винаходом. Як приклад, склад з більш низьким 3,75% дозуванням іміквімоду даного винаходу при нанесенні близько 500 мг такого складу (близько 18,75 мг іміквімоду) або менше щодня протягом 21 дня на 2 оброблювану область близько 200 см на обличчі або лисіючій шкірі голови, досягає стаціонарного стану до близько тижня 2, наприклад, від близько дня 8 до дня 14, і забезпечує in-vivo профіль у сироватці, вибраний з наступного (див. ФІГ. 54): (a) Tmax у день 21 від близько 4 годин до близько 16 годин і переважно середнє T max близько 7,4 години зі стандартним відхиленням ("SD") близько 3,5, медіанне T max близько 9 годин, а середнє геометричне Тmax близько 6,6 годин і коефіцієнт варіації ("CV") близько 48%; (b) Cmax у день 21 від близько 0,07 до близько 0,6 нг/мл і переважно середнє C max близько 0,3 нг/мл зі стандартним відхиленням близько 0,16, медіанне Cmax близько 0,35, а середнє геометричне Cmax близько 0,27 нг/мл і коефіцієнт варіації близько 49%; (c) T1/2 У день 21 від близько 9,7 до близько 84 годин і переважно середнє T1/2 близько 29,3 години зі стандартним відхиленням близько 17, медіанне T1/2 близько 25,6 години, а середнє геометричне T1/2 близько 26 годин і коефіцієнт варіації близько 58%; (d) AUC0-24 у день 21 від близько 1,1 до близько 12 нг·год./мл і переважно середнє AUC0-24 близько 6 нг·год./мл зі стандартним відхиленням близько 3, медіанне AUC0-24 близько 7 нг·год./мл, а середнє геометричне AUC0-24 близько 5 нг·год./мл і коефіцієнт варіації близько 52%; -1 -1 (e) λz у день 21 від близько 0,008 год до близько 0,07 год і переважно середнє λz близько -1 -1 0,03 год зі стандартним відхиленням близько 0,01, медіанне λz близько 25,6 год , а середнє -1 геометричне λz близько 0,03 год і коефіцієнт варіації близько 49%; (f) Cmin у день 21 від близько 0,06 до близько 0,4 і переважно середнє C min близько 0,20 з SD близько 0,11, медіанне Cmin близько 0,19, а середнє геометричне Cmin близько 0,17 і коефіцієнт варіації близько 55%; (g) у день 14/7 (співвідношення залишкової концентрації в день 14 до залишкової концентрації в день 7), співвідношення середнього геометричного залишкової концентрації близько 1,09 з 90% довірчим інтервалом ("CI") у діапазоні від близько 0,8 до близько 1,5; (h) у день 21/14 (співвідношення залишкової концентрації в день 21 до залишкової концентрації в день 14), співвідношення середнього геометричного залишкової концентрації близько 1,33 з 90% довірчим інтервалом ("CI") у діапазоні від близько 0,9 до близько 1,9; (i) у день 22/21 (співвідношення залишкової концентрації в день 22 до залишкової концентрації в день 21), співвідношення середнього геометричного залишкової концентрації близько 0,93 з 90% довірчим інтервалом ("CI") у діапазоні від близько 0,6 до близько 1,3; (j) середня пікова концентрація іміквімоду в сироватці близько 0,323 нг/мл у день 21; (k) RAUC у день 21 від близько 1 до близько 7 і переважно середнє RAUC близько 4 зі стандартним відхиленням близько 2, медіанне RAUC близько 3,5, а середнє геометричне RAUC близько 3,3 і коефіцієнт варіації приблизно 56%; (1) RCmax у день 21 від близько 0,5 до близько 5 і переважно середнє RC max близько 3 зі стандартним відхиленням близько 1,5, медіанне RCmax близько 2,7, а середнє геометричне RCmax близько 2,4 і коефіцієнт варіації близько 54%; -1 -1 (m) Lλzeff у день 21 від близько 0,006 год до близько 0,08 год і переважно середнє Lλzeff -1 близько 0,02 год зі стандартним відхиленням близько 0,02, медіанне Lλzeff переважно 0,01 год 1 -1 , а середнє геометричне Lλzeff близько 0,16 год і коефіцієнт варіації близько 97%; і 1/2 1/2 (n) T eff у день 21 від близько 8 год до близько 110 год і переважно середнє T eff близько 1/2 55 год зі стандартним відхиленням близько 36, медіанне T eff близько 50 год, а середнє 1/2 -1 геометричне T eff близько 42 год і коефіцієнт варіації близько 66%. Згідно з даним винаходом середня пікова концентрація в сироватці досягається зі складом з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28. Більш конкретно, середня пікова концентрація в сироватці близько 0,323 нг/мл досягається зі складом з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 після нанесення близько 18,75 мг іміквімоду на 2 оброблювану область близько 200 см на обличчі або лисіючій шкірі голови щодня протягом 21 дня. Фахівцям у даній області повинно бути зрозуміло, що фармакокінетичні параметри й будьякі інші робочі характеристики, що повідомлені вище й у даному документі, у тому числі, наприклад, середня пікова концентрація в сироватці, представлені під час відсутності 10 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 кріохірургії й можуть відтворюватися або можуть мінятися для варіантів здійснення даного винаходу, у яких кріохірургію застосовують згідно з даним винаходом, і що такі характеристики передбачаються даним винаходом. Крім того, даний винахід припускає склади з більш низьким дозуванням, які є фармацевтично еквівалентними, терапевтично еквівалентними, біоеквівалентними й/або взаємозамінними, незалежно від способу, вибраного для демонстрації еквівалентів або біоеквівалентності, такого як дерматофармакокінетичні й фармакокінетичні методології, мікродіаліз, in vitro і in vivo способи й/або клінічні очікувані результати. Таким чином, даний винахід припускає склади з більш низьким дозуванням іміквімоду, які є біоеквівалентними, фармацевтично еквівалентними й/або терапевтично еквівалентними, особливо, склади з більш низьким 2,5% і 3,75% дозуванням іміквімоду, які є біоеквівалентними, фармацевтично еквівалентними й/або терапевтично еквівалентними при застосуванні щодня відповідно до коротких тривалостей терапії даного винаходу для лікування актинічного кератозу, наприклад, при застосуванні на оброблюваних областях, а саме, повністю обличчі або лисіючій шкірі 2 2 голови, які становлять від більше близько 25 см до близько 250 см , на щоденній основі протягом до близько шести тижнів, включаючи схему лікування з 2 циклами 3x3x3тижні, і переважно до близько 4 тижнів, включаючи схему лікування з 2 циклами 2x2x2 тижні. Таким чином, спрямоване на область лікування даного винаходу припускає: (a) фармацевтично еквівалентні склади з більш низьким дозуванням іміквімоду, які містять однакову кількість іміквімоду в однаковій лікарській формі; (b) біоеквівалентні склади з більш низьким дозуванням іміквімоду, які є хімічно еквівалентними, і які при застосуванні у тих же індивідуумів при однакових режимах дозування дають у результаті порівнянні біодоступності; (c) терапевтично еквівалентні склади з більш низьким дозуванням іміквімоду, які при застосуванні у тих же індивідуумів при однакових режимах дозування забезпечують, по суті, однакову ефективність й/або токсичність; і (d) взаємозамінні склади з більш низьким дозуванням іміквімоду даного винаходу, які є фармацевтично еквівалентними, біоеквівалентними й терапевтично еквівалентними. Під терміном "з більш низьким дозуванням(и)", застосовуваним у даному документі, мається на увазі фармацевтичний склад, що містить іміквімод у кількості від близько 1,0% до близько 4,25% за вагою від загальної ваги складу, переважно від близько 2,5% до близько 3,75% за вагою від загальної ваги складу, й більш переважно фармацевтичний склад, що містить іміквімод у кількості близько 2,5% або близько 3,75% за вагою від загальної ваги складу. Одним прикладом придатного складу з більш низьким дозуванням іміквімоду є ZYCLARA® з 3,75% іміквімоду; при цьому слід розуміти, що даний винахід не обмежується цим прикладом. Під терміном "коротка(і) тривалість(і)", застосовуваним у даному документі, мається на увазі щоденне місцеве нанесення ефективної кількості іміквімоду на певну оброблювану область із діагностованими вогнищами AK протягом загального періоду лікування до близько 6 тижнів, залежно від того, який склад з більш низьким дозуванням іміквімоду даного винаходу вибирають для щоденного нанесення, і більш переважно загального періоду лікування до близько 4 тижнів, де необов'язковує певну проміжну перерву (без лікування) до близько 3 тижнів і більш переважно перерву (без лікування) до близько 2 тижнів можна здійснювати в деякий момент під час періоду лікування для лікування актинічного кератозу. Таким чином, "короткі тривалості терапії" можуть включати, як приклад, загальну тривалість 9 тижнів (3 тижні прийому, 3 тижні паузи, 3 тижні прийому) і більш переважно 6 тижнів (2 тижні прийому, 2 тижні паузи, 2 тижні прийому) від початку дозування до кінця дозування з урахуванням перерви. Незважаючи на це, фахівцям у даній області слід розуміти, що схеми лікування з 2-циклами з перервою між ними є кращими. При цьому, "короткі тривалості" терапії можуть також включати період обстеження 8 тижнів (без додаткового лікування) після періоду лікування. Термін "коротка(і) тривалість(і)" спрямованої на область терапії даного винаходу також належить до схеми лікування із двома циклами, яка включає схему лікування 4-тижні або 6тижнів, де кожний цикл лікування складається із двох або трьох тижнів нанесень один раз на день ефективної кількості іміквімоду в щоденному циклі, розділених періодом без лікування 2тижня або 3-тижня, відповідно, таким чином як зазначено нижче: (a) нанесення ефективної кількості іміквімоду на оброблювану область, уражену актинічним кератозом, один раз на день протягом чотирнадцяти (14) наступних один за одним днів або 2 тижнів (цикл 1 – лікування йде), з наступною відсутністю нанесення протягом чотирнадцяти (14) днів або 2 тижнів (лікування не йде), за яким знову слідує нанесення ефективної кількості іміквімоду на уражену область один раз на день протягом чотирнадцяти (14) днів або 2 тижнів (цикл 2 – лікування йде) для усього двадцяти восьми (28) доз або 4 тижнів терапії нанесенням для ефективного лікування актинічного кератозу; або 11 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 (b) нанесення ефективної кількості іміквімоду на оброблювану область, уражену актинічним кератозом, один раз на день протягом двадцяти одного (21) наступних один за одним днів або 3 тижнів (цикл 1 – лікування йде), з наступною відсутністю нанесення протягом двадцяти одного (21) дня або 3 тижнів (лікування не йде), за яким знову слідує нанесення ефективної кількості іміквімоду один раз на день на уражену область протягом двадцяти одного (21) дня або 3 тижнів (цикл 2 – лікування йде) для усього сорока двох (42) доз або 6 тижнів терапії нанесенням для ефективного лікування актинічного кератозу. Як відзначається вище, якщо короткі тривалості терапії застосовуються в комбінації зі складами з більш низьким дозуванням іміквімоду даного винаходу, виявляється, що (1) можна застосовувати спрощені щоденні режими дозування, (2) оброблювана область може бути 2 розширена, наприклад, для лікування більше, ніж близько 25 см , наприклад, тепер можна 2 2 лікувати області розміром близько 200 см - 250 см або більше (наприклад, повністю обличчя або лисіючу шкіру голови) і (3) кількість вогнищ AK, що підлягають лікуванню, є вищою, наприклад, до від близько 5 до близько 20 вогнищ AK або більше на оброблювану область. Також, розширену оброблювану область і збільшену кількість вогнищ AK можна ефективно лікувати за допомогою складів з більш низьким дозуванням іміквімоду без викликання значних локальних шкірних реакцій або подразнення в оброблюваній області або обмежуючих лікування побічних явищ, які можуть привести до передчасного припинення терапії або значних довільних перерв у кілька днів, які звичайно асоційовані з більш високими концентраціями терапії іміквімодом. Також виявляється, що можна застосовувати не менше від близько 250 мг до 500 мг або більше складу з низьким дозуванням іміквімоду на нанесення згідно з даним винаходом, особливо при застосуванні коротких тривалостей терапії в комбінації зі складами з низьким дозуванням іміквімоду даного винаходу. Для порівняння, для 5% крему іміквімоду ALDARA®, схваленого FDA для актинічного 2 кератозу, описується оброблювана область, певна як одна безперервна область близько 25 см на обличчі (наприклад, чоло або одна щока) або шкірі волосистої частини голови, лікування не більш ніж від близько 4 до близько 8 вогнищ AK на оброблювану область і схема дозування тільки два рази в тиждень протягом повних 16 тижнів на певній оброблюваній області на обличчі або шкірі волосистої частини голови (але не обох одночасно) і нанесення не більш 250 мг складу 5% крему іміквімоду ALDARA® на оброблювану область за нанесення. Також, сумарні показники локальної шкірної реакції й середні показники еритеми при локальній шкірній реакції, які одержують під час коротких тривалостей терапії зі складами з більш низьким дозуванням іміквімоду згідно з даним винаходом, створюють унікальні бімодальні або двохвершинні патерни, які відповідають 2-циклам лікування іміквімодом даного винаходу, де (1) найвищий сумарний показник локальної шкірної реакції й середній показник еритеми при локальній шкірній реакції звичайно й характерним образом проявляються або досягають піка під час або наприкінці першого циклу лікування, (2) сумарний показник локальної шкірної реакції й середній показник еритеми при локальній шкірній реакції повертаються до нормального стану або вихідного рівня або приблизно нормального стану або вихідного рівня наприкінці періоду без лікування між циклами, (3) сумарний показник локальної шкірної реакції й середній показник еритеми при локальній шкірній реакції знову переживаються суб'єктом під часабо наприкінці другого циклу лікування, звичайно, але необов'язково, зі зменшеним показником у порівнянні із сумарним показником локальної шкірної реакції й середнім показником еритеми при локальній шкірній реакції під час першого циклу лікування, і (4) сумарний показник локальної шкірної реакції й середній показник еритеми при локальній шкірній реакції звичайно незабаром повертаються до нормального стану або вихідного рівня після другого циклу лікування. Див., наприклад, ФІГ. 18, 18A-B, 20, 20A-B і 43-50 і приклад 28. Коли бімодальний або двохвершинний патерн сумарного показника локальної шкірної реакції й середнього показника еритеми при локальній шкірній реакції зображують у вигляді 2- мірних графіків, де сумарний показник локальної шкірної реакції й середній показник еритеми при локальній шкірній реакції відраховують на вертикальній осі, а огляди суб'єкта під час терапії іміквімодом з 2-циклами відраховують на горизонтальній осі, спостерігаються унікальні бімодальні або двохвершинні патерни. Див., наприклад, ФІГ. 18, 18A-B, 20 і 20A-B. Беручи до уваги даний несподіваний результат, що сумарний показник локальної шкірної реакції й середній показник еритеми при локальній шкірній реакції звичайно в цілому знижуються під час курсу терапії й повертаються до приблизно нормального стану або вихідного рівня наприкінці двотижневого періоду без лікування між двома циклами лікування, і знову повертаються до нормального стану або вихідного рівня приблизно наприкінці другого циклу лікування, дотримання терапії іміквімодом повинне суттєво покращитися, й повинні стабільно досягатися терапевтичні результати, наприклад, повне очищення або часткове очищення або зменьшення вогнищ AK. Ці результати, 12 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 як повідомляється в прикладах, були виявлені, де терапії області з більш низьким дозуванням іміквімоду застосовували у відсутності кріотерапії під час періоду лікування, як описано в даному документі. Бімодальні або двохвершинні патерни можна також спостерігати при сполученій або комбінованій терапії (наприклад, терапія області з більш низьким дозуванням іміквімоду й спрямована на вогнище кріотерапія) згідно з даним винаходом (див., наприклад, ФІГ. 72A-B і 73 і приклад 29), але фахівцям у даній області слід розуміти, що локальні шкірні реакції й будь-які інші побічні явища, повідомлювані вище й у даному документі, можуть відтворюватися або можуть мінятися для варіантів здійснення даного винаходу, у яких згідно з даним винаходом застосовується кріохірургія, і що такі реакції, бімодальні патерни явищ передбачаються даним винаходом. Також статистично значущою в порівнянні із плацебо є ефективність щодо загального очищення, часткового очищення й зменьшення кількості вогнищ AK, що досягається за допомогою складів з більш низьким дозуванням іміквімоду, коли їх застосовують в одній з двох коротких тривалостей терапії, наприклад, схемі лікування даного винаходу з 2-циклами по два тижні або три тижні для лікування актинічного кератозу. Див., наприклад, ФІГ. 51. Також несподіваним є те, що ефективність, що досягається в лікуванні актинічного кератозу, щодо повного очищення або часткового очищення вогнищ AK, переважно є статистично еквівалентною між схемами лікування з 2-циклами по два тижні або три тижні складами з більш низьким дозуванням іміквімоду даного винаходу, коли однакові склади з більш низьким дозуванням іміквімоду застосовують відповідно до кожної зі схем лікування з 2-циклами й проводять порівняння один з одним між двома схемами лікування з 2 циклами. Див., наприклад, ФІГ. 51. Однак, навіть більш дивним є, що ефективність щодо часткового очищення вогнищ AK, що досягається за допомогою складу з більш низьким 3,75% дозуванням іміквімоду, коли його застосовують в одній з двох схем лікування даного винаходу з 2-циклами по два тижні або три тижні для лікування актинічного кератозу, статистично значуще вище, ніж складу з більш низьким 2,5% дозуванням іміквімоду, коли його застосовують в одній з двох схем лікування з 2циклами по два тижні або три тижні. Див., наприклад, ФІГ. 51. Проте, слід зазначити, що ефективності, які досягаються щодо повного очищення або часткового очищення для кожного з складів з більш низьким дозуванням іміквімоду, тобто 2,5% або 3,75%, коли їх застосовують в одній з двох схем лікування з 2-циклами по два тижні або три тижні згідно з даним винаходом, мають близько 95% рівень значущості й P- значення менше близько,001 порівняно з плацебо. Див. ФІГ. 51. Слід також зазначити, що P-значення ефективності, яка досягається щодо часткового очищення для складу з більш низьким 3,75% дозуванням іміквімоду в зіставленні зі складом з більш низьким 2,5% дозуванням іміквімоду, що використовуються у відповідності зі схемою лікування даного винаходу з 2-циклами по два тижні або три тижні, становить близько 0,047 або близько 0,034, відповідно. Див., наприклад, ФІГ. 51. Також досить несподіваним є, що ефективність щодо зменьшення кількості вогнищ AK, що досягається за допомогою складу з більш низьким 3,75% дозуванням іміквімоду, коли його застосовують у схемі лікування даного винаходу з 2-циклами по два тижні для лікування актинічного кератозу, статистично значуще вище складу з більш низьким 2,5% дозуванням іміквімоду, коли його застосовують у схемі лікування з 2-циклами по два тижні, але відмінностей немає, або вони в істотному ступені еквівалентні, коли обидва склади з більш низьким дозуванням іміквімоду застосовують у схемі лікування згідно з даним винаходом з 2-циклами по три тижні. Див., наприклад, ФІГ. 51. Слід зазначити, що P-значення ефективності щодо процентного зменшення кількості вогнищ AK, яке досягається для складу з більш низьким 3,75% дозуванням іміквімоду при зіставленні зі складом з більш низьким 2,5% дозуванням іміквімоду, які використовуються у відповідності зі схемою лікування даного винаходу з 2-циклами по два тижні або три тижні, становить близько 0,048 або близько 0,133, відповідно. Однак P-значення 0,133 не є статистично значущим. Див., наприклад, ФІГ. 51. Ці результати, як повідомляється в прикладах, виявлялися там, де застосовувалася терапія області з більш низьким дозуванням іміквімоду при відсутності кріотерапії під час періоду лікування, як описано в даному документі. Також виявляється, що вважається, що статистично значущість в ефективності не досягається між схемою лікування з 2-циклами по три тижні в зіставленні зі схемою лікування з 2-циклами по два тижні незалежно від складу з більш низьким дозуванням іміквімоду, які застосовуються для лікування актинічного кератозу. Див., наприклад, ФІГ. 52. Інакше кажучи, вважається, що немає додаткової переваги в ефективності при більш довгій схемі лікування з 2циклами по 3-тижні, ніж схема лікування даного винаходу з 2-циклами по два тижні для лікування актинічного кератозу, незалежно від того, який склад з більш низьким дозуванням іміквімоду застосовують в одній з двох схем лікування з 2-циклами згідно з даним винаходом. 13 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 Див., наприклад, ФІГ. 52, 1-13G, 25-27, 36-38A і 42. Слід зазначити, що P-значення, які досягаються щодо (a) повного очищення, (b) часткового очищення й (c) зменшення кількості вогнищ для схеми лікування даного винаходу з 2-циклами по дав тижні й схеми лікування даного винаходу з 2-циклами по три тижні, становлять (a) близько 0,462, загальна лінійна модель ("GLM"), й близько 0,499 (LA), (b) близько 0,233 (GLM) і близько 0,164 (LA), й (c) близько 0,635 (GLM), відповідно. Див., наприклад, ФІГ. 52. Ці результати, як повідомляється в прикладах, виявлялися там, де застосовувалася терапія області з більш низьким дозуванням іміквімоду при відсутності кріотерапії під час періоду лікування, як описано в даному документі. Також, ефективність щодо загального очищення, часткового очищення й зменьшення кількості вогнищ AK, що досягається за допомогою сполученої або комбінованої терапії даного винаходу (наприклад, спрямована на вогнище кріохірургія в комбінації зі складами для терапії області з більш низьким дозуванням іміквімоду), коли застосовується в одній з двох коротких тривалостях терапії, наприклад, схеми лікування даного винаходу з 2-циклами по два тижні або три тижні для лікування актинічного кератозу, є статистично значущою й несподіваною при порівнянні із плацебо, або коли застосовується окремо кріохірургія. Див., наприклад, ФІГ. 72A-B, 73 і 88-90. Фахівцям у даній області повинно бути зрозуміло, що ефективність і будь-які інші робочі характеристики, про які повідомляється вище й у даному документі, за винятком явно зазначених випадків, приводяться під час відсутності кріохірургії й можуть відтворюватися або можуть мінятися для варіантів здійснення даного винаходу, коли кріохірургія застосовується згідно з даним винаходом, і що така ефективність і характеристики передбачаються даним винаходом. Незважаючи на те, що вважається, що немає більшої ефективності, яка досягається між двома схемами лікування даного винаходу з 2-циклами, виявляється в цілому більша частота виникнення побічних явищ, наприклад, локальні шкірні реакції, і перерв, асоційованих з періодом лікування з 2-циклами по три тижні в порівнянні з періодом лікування з 2-циклами по два тижні, коли застосовують однаковий склад з більш низьким дозуванням іміквімоду в кожній зі схем лікування з 2-циклами згідно з даним винаходом. Навіть хоча існує підвищення частоти виникнення побічних ефектів і перерв, асоційованих зі схемою лікування з 2-циклами по три тижні, вважається, що прийнятний профіль безпеки як і раніше зберігається при застосуванні кожної зі схем лікування згідно з даним винаходом з 2-циклами по два тижні або три тижні. Див., наприклад, ФІГ. 14A-23, 28, 28A-B і 39-42. Проте, було виявлено, що існує більш низька частота виникнення в суб'єктів реакцій у місці нанесення, асоційована з кожним з періодів лікування даного винаходу з 2-циклами, ніж асоційована із застосуванням 5% крему іміквімоду ALDARA® для лікування актинічного кератозу відповідно до схваленої FDA схеми лікування, навіть незважаючи на те, що 5% крем іміквімоду ALDARA® наносять тільки два рази на тиждень на 2 оброблювану область близько 25 см протягом 16 тижнів. Див., наприклад, ФІГ. 28, 28A-B, 41 і 41A. Таким чином, фахівцям у даній області слід розуміти, що незважаючи на те, що обидві схеми лікування даного винаходу з 2-циклами забезпечують ефективні режими дозування із прийнятними профілями безпеки, які є короткими й більш придатними для застосування пацієнтом, ніж схвалений на цей час FDA режим дозування для 5% крему іміквімоду ALDARA® для лікування актинічного кератозу, кращою є схема лікування даного винаходу з 2-циклами по 2-тижні. Також буде зрозуміло, що короткі тривалості терапії й склади з більш низьким дозуванням іміквімоду даного винаходу вважаються оптимізованими для лікування актинічного кератозу. Під "оптимізований" у даному документі мається на увазі, що короткі тривалості терапії й склади з більш низьким дозуванням іміквімоду даного винаходу розробляють для досягнення профілів ефективності, стабільності й швидкості вивільнення, які щонайменше в істотному ступені еквівалентні й лінійні з 5% кремом іміквімоду ALDARA®, відповідно, але з поліпшеним прийнятним профілем безпеки. Ці результати, як повідомляється в прикладах, виявлялися там, де застосовувалася терапія області з більш низьким дозуванням іміквімоду під час відсутності кріотерапії під час періоду лікування, як описано в даному документі. Під терміном "прийнятний профіль безпеки" у даному документі мається на увазі, що лікування актинічного кератозу за допомогою короткої тривалості терапії й складу з більш низьким дозуванням іміквімоду згідно з даним винаходом, що включає схеми лікування з 2циклами, не викликає обмежуючі лікування побічні ефекти або перерви в помітного числа суб'єктів, що проходять терапію актинічного кератозу, до того рівня, який є причиною дострокового припинення лікування. Термін "прийнятний профіль безпеки" також належить до лікування актинічного кератозу за допомогою короткої тривалості терапії й складу з більш низьким дозуванням іміквімоду даного винаходу з більш низькою частотою виникнення в суб'єктів реакцій у місці нанесення в порівнянні з лікуванням актинічного кератозу 5% кремом 14 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 іміквімоду ALDARA®. Також, виявляється, що при застосуванні складу з більш низьким дозуванням іміквімоду, тобто близько 2,5%, у схемі лікування з 2-циклами, 2 x 2 x 2 тижні, згідно з даним винаходом для лікування актинічного кератозу, діагностованого у жінок, досягається близько 60% ступінь очищення, що включає повне очищення й часткове очищення. Див. ФІГ. 31. У той же час, виявляється, що при застосуванні складу з низьким дозуванням іміквімоду, тобто близько 3,75%, у схемі лікування з 2-циклами, 2 x 2 x 2 тижні, або в схемі лікування з 2-циклами, 3 x 3 x 3 тижні згідно з даним винаходом для лікування актинічного кератозу, діагностованого у суб'єктів чоловіків або жінок або у суб'єктів зі шкірою I, II або III типу, з близько 10 вогнищами або менше на вихідному рівні, або з вогнищами на обличчі або шкірі волосистої частини голови, досягаються еквівалентні або порівняні ступені очищення, що включають повне очищення й часткове очищення. Див., наприклад, ФІГ. 31, 33, 33A, 34, 34A, 35 і 35A-B. Також виявляється, що при застосуванні складу з низьким дозуванням іміквімоду, тобто близько 3,75%, у схемі лікування з 2-циклами, 2 x 2 x 2 тижні, або в схемі лікування з 2-циклами, 3 x 3 x 3 тижні, згідно з даним винаходом для лікування актинічного кератозу, діагностованого у суб'єктів віком 65 років або старше, або у суб'єктів, що мають більше 10 вогнищ на вихідному рівні, більш ефективною є схема лікування з 2-циклами, 2x2x2 тижні. Див., наприклад, ФІГ. 32,32A, 34 і 34A. Ці результати, як повідомляється в прикладах, виявлялися, де застосовувалася терапія області з більш низьким дозуванням іміквімоду під час відсутності кріотерапії під час періоду лікування, як описано в даному документі. Також виявляється що, при застосуванні складу з більш низьким дозуванням іміквімоду в комбінації з короткою тривалістю терапії, наприклад будь-яка схема лікування даного винаходу з 2-циклами по дві-тижні або три-тижні для лікування актинічного кератозу, дослідницький загальний комплексний показник фотоушкодження ("IGIP") є значно або набагато поліпшеним у порівнянні з вихідним рівнем. Див., наприклад, ФІГ. 24 і 53. Наприклад, і як показано на ФІГ. 53, при об'єднанні досліджень з 3,75% іміквімодом приблизно 44% (132 з 299) суб'єктів, що проходять лікування, демонструють значне поліпшення, й близько 25% (76 з 299) суб'єктів, що проходять лікування, показують істотне поліпшення й близько 17% (51 з 299) суб'єктів, що проходять лікування, показують слабке поліпшення в показнику IGIP від вихідного рівня, тоді як при об'єднанні досліджень з 2,5% іміквімодом близько 32% (97 з 304) суб'єктів, що проходять лікування, показують значне поліпшення, близько 26% (78 з 304) суб'єктів, що проходять лікування, показують істотне поліпшення й близько 23% (69 з 304) суб'єктів, що проходять лікування, показують слабке поліпшення в показнику IGIP від вихідного рівня. Ці результати, як повідомляється в прикладах, виявлялися, де застосовувалася терапія області з більш низьким дозуванням іміквімоду під час відсутності кріотерапії під час періоду лікування, як описано в даному документі. Фахівцям у даній області буде зрозуміло, що ефективність або будь-які інші результати, повідомлювані вище, такі як показник IGIP, і в даному документі можуть відтворюватися або можуть мінятися для варіантів здійснення даного винаходу, де згідно з даним винаходом застосовується кріохірургія, і що така ефективність і результати передбачаються даним винаходом. Наприклад, несподівано виявили, що група суб'єктів, яких лікували кріохірургією з наступним лікуванням області за допомогою плацебо (група Cryo/плацебо), мала медіанні зниження AK 80% і ступені повного очищення ~30%, що узгоджується з попередніми повідомленнями про ефективність щодо кріохірургії, однак, що тандемна група суб'єктів, яких лікували кріохірургією з наступним лікуванням області 3,75% кремом іміквімоду (ZYCLARA®) (група Cryo/ZYCLARA®), може показувати значні додаткові переваги практично без підвищеного ризику. Суб'єкти, яких лікували один раз на день 3,75% кремом іміквімоду протягом двох 2-тижневих циклів, поліпшили медіанні зниження AK до 100% для AK, що піддавали лікуванню кріохірургією, і подвоїли повне очищення для цих AK до ~60%. Див., наприклад, ФІГ. 88-90 і 94-100 і приклад 29. Отже, поєднання двох терапій з дискретними режимами дії, спрямованої на вогнище цитодеструкції й спрямованої на область імунотерапії, може вносити вклад у спостережувані поліпшені ефекти. Крім того, к тижню 26 (кінець дослідження) загальний показник фотостаріння щодо поліпшеного зовнішнього вигляду з урахуванням оцінки фотоушкодження в групі Cryo/ZYCLARA® (51,6%) більш ніж у два рази (2,7x) перевищував такий для групи Cryo/плацебо (19,3%), у той час як кількість випадків, що демонструють відсутність змін у групі Cryo/плацебо (77,3%), більш ніж в 1,5 рази (1,7х) перевищувала таку групи Cryo/ZYCLARA® (44,5%). Подібним чином, к тижню 26 (кінець дослідження) оцінка фотоушкоджень, як показник поліпшеного зовнішнього вигляду дрібних зморщечок у групі Cryo /ZYCLARA® (32,8%) більш ніж у два рази 15 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 (2,2x) перевищувала таку групи Cryo/плацебо (15,1%), у той час як кількість випадків, що демонструють відсутність змін у групі Cryo/плацебо (75,6%), було більше (1,2x) такої групи Cryo/ZYCLARA® (64,8%). Крім того, к тижню 26 (кінець дослідження) оцінка фотоушкоджень щодо поліпшеного зовнішнього вигляду плямистої пігментації в групі Cryo/ZYCLARA® (46,7%) більш ніж у два рази (-2,5x) перевищувала таку групи Cryo/плацебо (18,5%), у той час як кількість випадків, що демонструють відсутність змін у групі Cryo/плацебо (77,3%), більше ніж в 1,5 рази (1,6x) перевищувала таку групи Cryo/ZYCLARA® (49,2%). Також, к тижню 26 (кінець дослідження) оцінка фотоушкоджень щодо поліпшення тактильної шорсткості в групі Cryo/ZYCLARA® (61,5%) більш ніж у два рази (2,7x) перевищувала таку групи Cryo/плацебо (22,7%), у той час як кількість випадків, що демонструють відсутність змін у групі Cryo/плацебо (65,5%), більш ніж у 1,5 рази (1,9x) перевищувала таку групи Cryo/ZYCLARA® (35,2%). Нарешті, к тижню 26 (кінець дослідження), оцінка фотоушкоджень щодо поліпшеного зовнішнього вигляду жовтизни шкіри в групі Cryo/ZYCLARA® (25,4%) приблизно у два рази (2,0x) перевищувала таку групи Cryo/плацебо (12,6%), у той час як кількість випадків, що демонструють відсутність змін у групі Cryo/плацебо (83,2%), була більша (1,2x) такої групи Cryo/ZYCLARA® (68,0%). Див. ФІГ. 85 і приклад 29 (особливо таблицю 95). Характерними елементами фармацевтичного складу за даним винаходом є (a) іміквімод і (b) жирна кислота, наприклад, ізостеаринова, пальмітинова, стеаринова, лінолева, неочищена олеїнова кислота або очищена олеїнова кислота, така як олеїнова кислота NF SUPER REFINED® (наприклад, високоочищена олеїнова кислота, тобто олеїнова кислота, яка має низьку кількість полярних домішок, таких як пероксиди, низьке пероксидне число, і її продає компанія CRODA; див. наприклад, www.crodausa.com) і їх суміші. Фармацевтичний склад даного винаходу може бути в будь-якій формі, відомій в даній області, такій як крем, мазь, піна, гель, лосьйон або чутлива до тиску адгезивна композиція, при цьому кожна форма містить необхідні елементи в конкретних кількостях і додатково містить різні додаткові елементи. Крем даного винаходу містить ефективну кількість іміквімоду, таку як від близько більш ніж 1% до близько 4,25% за вагою іміквімоду від загальної ваги крему, і переважно від близько 2,5% до близько 3,75% іміквімоду від загальної ваги крему, і більш переважно близько 2,5% і близько 3,75% іміквімоду від загальної ваги крему; від близько 5% до близько 30% жирної кислоти за вагою від загальної ваги крему; і необов'язкові інгредієнти, такі як пом’якшувачі, емульгатори, загущувачі й/або консерванти. Мазь даного винаходу містить мазеву основу на додаток до іміквімоду й жирної кислоти. Мазь даного винаходу містить ефективну кількість іміквімоду, таку як від близько більш ніж 1% до близько 4,25% за вагою іміквімоду від загальної ваги мазі, й переважно від близько 2,5% до близько 3,75% іміквімоду від загальної ваги мазі, й переважно близько 2,5% і близько 3,75% іміквімоду від загальної ваги мазі; від близько 3% до близько 45%, більш переважно від близько 3% до близько 30% за вагою жирної кислоти; і від близько 40% до близько 95% за вагою мазевої основи, при цьому всі вагові значення зазначені щодо загальної ваги мазі. Необов'язково, мазь даного винаходу може також містити емульгатори, пом’якшувачі й загущувачі. Склад з більш низьким дозуванням даного винаходу можна застосовувати для місцевого й/або трансдермального застосування ефективної кількості іміквімоду для ефективного лікування актинічного кератозу за допомогою коротких тривалостей терапії й з прийнятним профілем безпеки. Таким чином, склади з більш низьким дозуванням за даним винаходом можна наносити на будь-яке придатне місце розташування, наприклад, місцево на поверхню шкіри, губ і/або слизових. У випадку нанесення на шкіру, наприклад, залежно від концентрації, композиції складу й поверхні шкіри, терапевтичний ефект іміквімоду може поширюватися тільки на зовнішні шари поверхні шкіри або на тканини нижчі за поверхню шкіри. Слід розуміти, що хоча передбачаються склади з більш низьким дозуванням даного винаходу, що містять, за вагою від загальної ваги складу, від близько 1% до близько 4,25%, переважно передбачаються від близько 1,5%, 1,75%, 2,0%, 2,25%, 2,5%, 2,75%, 3,0%, 3,25%, 3,5%, 3,75%, 4,0% до 4,25%, і навіть більш переважно від близько 2,0%, 2,25%, 2,5%, 2,75%, 3,0%, 3,25%, 3,5%, 3,75% до 4,0%, усе ще більш переважно від близько 2,5%, 2,75%, 3,0%, 3,25%, 3,5% до 3,75%, а ще навіть більш переважно від близько 2,5% до близько 3,75% за вагою від загальної ваги складу. Склади з більш низьким дозуванням даного винаходу, які містять близько 2,5% іміквімоду або близько 3,75% іміквімоду за вагою від загальної ваги складу є найбільш переважними. Слід також розуміти, що склади з більш низьким дозуванням іміквімоду даного винаходу, які мають дозопропорційні швидкості вивільнення як щодо швидкостей вивільнення іміквімоду, так й щодо загальної кількості вивільненого іміквімоду відносно 5% крему іміквімоду ALDARA®, також є переважними. 16 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 Таким чином, фахівцям у даній області слід розуміти, що кількість іміквімоду, присутнього в складі даного винаходу, буде ефективною кількістю, якщо склад даного винаходу наноситься щодня відповідно до короткої тривалості терапії, що описується в даному документі, на цільову область з діагностованим актинічним кератозом, і йому дають можливість після кожного індивідуального нанесення залишатися в контакті з цільовою областю протягом достатнього часу для того, щоб дозволити ефективній кількості іміквімоду очистити таке захворювання або вогнища захворювання, частково очистити ряд вогнищ такого захворювання, скоротити кількість вогнищ, запобігти рецидиву такого захворювання без викликання обмежуючих лікування локальних шкірних реакцій або побічних явищ, що включають незаплановані перерви, викликані такими обмежуючими лікування локальними шкірними реакціями або побічними явищами в істотного числа людей, що проходять лікування. Наприклад, при лікуванні актинічного кератозу згідно з даним винаходом ефективна кількість буде досягати часткове очищення у вогнищах AK у якості цільового очікуваного результату, наприклад, щонайменше близько 40% й переважно щонайменше близько 50%, й більш переважно щонайменше близько 60%, й ще більш переважно щонайменше близько 70%, й найбільш переважно щонайменше близько 75% зменьшення кількості вогнищ AK на оброблюваній області порівняно з вихідним рівнем, або щонайменше близько 60%, й переважно щонайменше близько 70%, й навіть більш переважно щонайменше близько 80%, й найбільш переважно щонайменше близько 90% медіанне зменшення кількості вогнищ AK на оброблюваній області порівняно з вихідним рівнем у якості вторинного очікуваного результату, або щонайменше близько 25% повного очищення, й переважно щонайменше близько 30% повного очищення, й навіть більш переважно щонайменше близько 35% повного очищення, й найбільш переважно щонайменше близько 45% повного очищення вогнищ AK у якості первинного очікуваного результату. Див., наприклад, ФІГ. 36, 36A, 37, 37A, 38, 38A, 51 і 52. Застосовуваний у даному документі термін "повне очищення" означає відсутність клінічно видимих або вогнищ AK, що прощупуються на оброблюваній області. Ці результати, які зазначені в прикладах, виявлялися, при застосуванні терапії області з більш низьким дозуванням іміквімоду під час відсутності кріотерапії під час періоду лікування, як описано в даному документі. Фахівцям у даній області слід розуміти, що ефективність і інші явища, описані вище й у даному документі, такі як очищення, можуть відтворюватися або можуть змінюватися для варіантів здійснення даного винаходу, де згідно з даним винаходом застосовується кріохірургія, і що така ефективність і явища передбачаються даним винаходом. Наприклад, несподівано виявили, що група суб'єктів, яких піддавали лікуванню кріохірургією з наступним лікуванням області за допомогою плацебо (група Cryo/плацебо), мала медіанні зниження AK 80% і ступені повного очищення ~30%, що узгоджується з попереднім повідомленням про ефективність для кріохірургії, але що тандемна група суб'єктів, яких піддавали лікуванню кріохірургією з наступним лікуванням області 3,75% кремом іміквімоду (ZYCLARA®) (група Cryo/ZYCLARA®) могла демонструвати значні додаткові переваги без істотного підвищеного ризику. Суб'єкти, яких піддавали лікуванню один раз на день 3,75% кремом іміквімоду протягом двох 2-тижневих циклів, збільшували медіанні зниження AK до 100% для AK, підданих лікуванню кріохірургією, і подвоювали повне очищення для таких AK до ~60%. Див., наприклад, ФІГ. 88-90 і 94-100 і приклад 29. Результати від застосування складів з більш низьким дозуванням іміквімоду відповідно до коротких тривалостей терапії даного винаходу демонструють, що склади з більш низьким дозуванням іміквімоду, які дозували один раз на день протягом періодів лікування з 2 циклами по два тижні або три тижні, є ефективними й добре переносимими способами лікування актинічного кератозу на обличчі або лисіючій шкірі голови. Ущільнені режими дозування даного винаходу роблять можливими короткі періоди лікування, мінімізуючи вплив іміквімоду і додатково сприяючи поліпшеному профілю перевага-ризик, у порівнянні з терапією схваленим FDA 5% кремом іміквімоду ALDARA® протягом 16 тижнів, два рази на тиждень. Переваги лікування складами з більш низьким дозуванням іміквімоду згідно з короткими тривалостями терапії даного винаходу включають повне очищення або часткове очищення (> 66%, переважно > 75%, навіть більш переважно >88% й ще більш переважно >95%) вогнищ AK для більшості суб'єктів, які зазнають лікування. Див. приклад 24 і ФІГ. 51 і 52. Більш конкретно, повне або часткове очищення вогнищ AK досягаються в такий спосіб: (1) >35% (57 з 160 суб'єктів) повного очищення досягається протягом лікування з 2 циклами по 2-тижні із застосуванням складу з більш низьким 3,75% дозуванням іміквімоду даного винаходу; (2) >30% (49 з 160 суб'єктів) повного очищення досягається протягом лікування з 2 циклами по 2-тижні із застосуванням складу з більш низким 2,5% дозуванням іміквімоду даного винаходу; (3) >34% (55 з 162 суб'єктів) повного очищення досягається протягом лікування з 2 циклами по 3-тижні із 17 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосуванням складу з більш низьким 3,75% дозуванням іміквімоду даного винаходу; і (4) >25% (41 з 164 суб'єктів) повного очищення досягається протягом лікування з 2 циклами по 2-тижні із застосуванням складу з більш низьким 2,5% дозуванням іміквімоду даного винаходу; у той час, як (5) >59% (95 з 160 суб'єктів) часткового очищення досягається протягом лікування з 2 циклами по 2-тижні із застосуванням складу з більш низьким 3,75% дозуванням іміквімоду даного винаходу; (6) >48% (77 з 160 суб'єктів) часткового очищення досягається протягом лікування з 2 циклами по 2-тижні із застосуванням складу з більш низьким 2,5% дозуванням іміквімоду даного винаходу; (7) >53% (87 з 162 суб'єктів) часткового очищення досягається протягом лікування з 2 циклами по 3-тижні із застосуванням складу з більш низьким 3,75% дозуванням іміквімоду даного винаходу; й (8) >42% (70 з 164 суб'єктів) часткового очищення досягається протягом лікування з 2 циклами по 2-тижні із застосуванням складу з більш низьким 2,5% дозуванням іміквімоду даного винаходу. Хоча суб'єкти, яких лікують складами з більш низьким дозуванням іміквімоду згідно з короткими тривалостями терапії даного винаходу, можуть відчувати локальні шкірні реакції (LSR), див., наприклад, ФІГ. 16A-20, 20A-B і 29 і 40, лікування є добре переносимим, і протягом терапії AK існує помітно більш низька частота виникнення в суб'єктів реакцій у місці нанесення, наприклад, див. ФІГ. 14A-E, 28, 28A-B, 41 і 41A, у порівнянні з більш тривалою схемою лікування схваленим FDA 5% кремом іміквімоду ALDARA®, тобто 16 тижнів, два рази на тиждень. Ці результати, як повідомляється в прикладах, виявлялися, де застосовувалася терапія області з більш низьким дозуванням іміквімоду під час відсутності кріотерапії під час періоду лікування, як описано в даному документі. Фахівцям у даній області слід розуміти, що локальні шкірні реакції й будь-які інші побічні явища, повідомлювані вище й у даному документі, можуть відтворюватися або можуть мінятися для варіантів здійснення даного винаходу, де згідно з даним винаходом застосовується кріохірургія, і що такі реакції і явища передбачаються даним винаходом. Наприклад, суб'єкти, яких піддавали лікуванню кріохірургією з наступним лікуванням області 3,75% кремом іміквімоду (ZYCLARA®) (група Cryo/ZYCLARA®), можуть демонструвати значні додаткові переваги в порівнянні із застосуванням кріохірургії окремо практично без підвищеного ризику. Суб'єкти, яких піддавали лікуванню один раз на день 3,75% кремом іміквімоду протягом двох 2-тижневих циклів, збільшували медіанні зниження AK до 100% для АК, підданих лікуванню кріохірургією, і подвоювали повне очищення для таких AK до ~60%. Див., наприклад, ФІГ. 88-90 і 94-100 і приклад 29. Цю однакову єдину більш велику "оброблювану область" даного винаходу можна визначати 2 як область більше ніж 25 см (наприклад, оброблювана область більша за область 5 см x 5 см 2 2 будь-якої форми) і до від близько 200 см до 250 см або більше на обличчі (наприклад, чоло або одна щока) або на лисіючій шкірі голови, у тому числі повністю обличчя або уся лисіюча шкіра голови. Кількість вогнищ AK, що підлягають лікуванню, на оброблюваній області може варіювати в діапазоні від близько 5 до близько 20 або більше. Фахівці в даній області повинні також оцінити, що даний винахід також забезпечує додаткову перевагу виявлення й клінічного прояву й наступної повної або часткової ліквідації ранніх (субклінічних) вогнищ AK на оброблюваній області. У цей час вважається, що оскільки оброблювана область перевищує 25 2 см , склади з більш низьким дозуванням іміквімоду й короткі тривалості терапії при практичному здійсненні за даним винаходом будуть підвищувати переносимість і дотримання режиму суб'єктом, поліпшувати терапевтичні результати, наприклад, повне очищення або часткове очищення або зменшення вогнищ AK, знижувати частоту виникнення в суб'єктів реакцій у місці нанесення (див., наприклад, ФІГ. 28, 28A-B, 41 і 41A) й зменшувати незаплановані перерви (див., наприклад, ФІГ. 39 і 39A) під час терапії в порівнянні з 5% кремом іміквімоду ALDARA®, якщо їх наносити на однакову більш велику оброблювану область згідно з даним винаходом. Крім того, вважається, що у зв'язку з тим, що розширена оброблювана область настільки більш велика, ніж більш маленька оброблювана область, тобто менша або що дорівнює приблизно 25 2 см , яку на цей час лікують 5% кремом іміквімоду ALDARA®, розширена оброблювана область даного винаходу буде набагато сильніше навантажена шкірою без вогнищ/ нормальною шкірою, ніж раніше мало місце з меншою оброблюваною ділянкою, що лікували 5% кремом іміквімоду ALDARA®. Переважно, концентрація іміквімоду, що наноситься, складає від близько 1% до близько 4,25% за вагою від загальної ваги складу даного винаходу. Більш переважно, концентрація іміквімоду, що наноситься, складає від близько 2,5% до близько 3,75% іміквімоду за вагою від загальної ваги складу даного винаходу. Ще більш переважно, концентрація іміквімоду, що наноситься, складає близько 2,5% або близько 3,75% іміквімоду за вагою від загальної ваги складу даного винаходу. Також, для лікування актинічного кератозу згідно з даним винаходом ефективну кількість іміквімоду необхідно наносити один раз на день протягом щонайменше до близько 6 тижнів, наприклад, один раз на день протягом повних 2 або 3 тижнів 18 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 (14 або 21 дня) на діагностовану або певну оброблювану область, наприклад, на обличчі або лисіючій шкірі голови (цикл 1), потім зупинити або припинити на 2 або 3 тижні (14 або 21 день), передбачена перерва, за якою йде повторне нанесення один раз на день протягом повних 2 або 3 тижнів (14 або 21 дня) на певну оброблювану область (цикл 2) для досягнення вторинного й більш переважно первинного очікуваного результату, наприклад, для досягнення щонайменше близько 75% зниження вогнищ AK у якості цільового вторинного очікуваного результату й більш переважно повного очищення вогнищ AK у якості первинного очікуваного результату. Також при лікуванні актинічного кератозу згідно з періодами лікування даного винаходу з 2-циклами по два тижні або три тижні ефективна кількість іміквімоду, що наноситься на оброблювану область, буде не лише досягати вторинний або первинний очікуваний результат, але також буде викликати більш низьку частоту виникнення в суб'єктів шкірних реакцій у місці нанесення й менше число незапланованих перерв, які беруться суб'єктами, що проходять лікування, наприклад, не більш ніж близько 11%, більш переважно не більше ніж близько 7% суб'єктів будуть брати одну або кілька перерв під час короткого періоду лікування з 2-циклами по два тижні, або не більш ніж близько 17% і більш переважно не більш ніж близько 27% суб'єктів будуть брати одну або кілька перерв під час короткого періоду лікування з 2циклами по три тижні. Див., наприклад, ФІГ. 21, 39 і 39A. Ці результати, як повідомляється в прикладах, виявлялися, де застосовувалася терапія області з більш низьким дозуванням іміквімоду під час відсутності кріотерапії під час періоду лікування, як описано в даному документі. Фахівцям у даній області слід розуміти, що локальні шкірні реакції й будь-які інші побічні явища, повідомлювані вище й в даному документі можуть відтворюватися або можуть змінюватися для варіантів здійснення даного винаходу, де згідно з даним винаходом застосовується кріохірургія, і що такі реакції і явища передбачаються даним винаходом. Що стосується пацієнтів, які одержали кріохірургію з наступним лікуванням 3,75% кремом іміквімоду (група Cryo/ZYCLARA®), то 112/126 (89%) завершили дослідження порівняно з пацієнтами, які одержували кріохірургію з наступним лікуванням за допомогою плацебо (група Cryo/плацебо) (111/121; 92%). По суті, 14 пацієнтів (11%) із групи Cryo/ZYCLARA® виключили з дослідження, у той же час 10 пацієнтів (8%) із групи Cryo/плацебо виключили з дослідження. Серед пацієнтів у групі Cryo/ZYCLARA®, які перервали лікування, побічні явища зарахували у 4 пацієнтів (3%) порівняно з 5 пацієнтами (4%) у групі Cryo/плацебо; побажання суб'єктів зарахували для 4 пацієнтів (3%) в обох групах; для кожній з незгоди з умовами, неявки для наступного спостереження й "інших" причин зарахували по 2 пацієнти (2%) у групі Cryo/ZYCLARA® порівняно з 0 пацієнтів (0%) у цих категоріях у групі Cryo/плацебо. Див. ФІГ. 87 і 98-100 і приклад 29. Перерви були більш звичайні в групі Cryo/ZYCLARA®, ніж в групі Cryo/плацебо. Див. ФІГ. 98 і приклад 29. Щодо загальної задоволеності пацієнта, більш ніж дві третини (85/121; 70,2%) спостережуваних пацієнтів у групі Cryo/ZYCLARA® оцінювали їхню задоволеність лікуванням як "відмінно" (тобто, дуже задоволені) у порівнянні з менш однією третиною (37/119; 31,1%) спостережуваних пацієнтів у групі Cryo/плацебо. Для порівняння, 22/121 (18,2%) спостережуваних пацієнтів у групі Cryo/ZYCLARA® і 23/119 (19,3%) спостережуваних пацієнтів у групі Cryo/плацебо оцінювали їхню задоволеність лікуванням як "добре" (тобто, помірковано задоволені). Більш ніж у два рази більший (2,6x) відсоток спостережуваних пацієнтів у групі Cryo/плацебо (18/119; 15,1%) оцінювали своє лікування як лише "посередньо" (тобто, слабко задоволені) у порівнянні з відсотком спостережуваних пацієнтів у групі Cryo/ZYCLARA® (7/121; 5,8%), у той час, як більш ніж у п'ять раз більший (5,9x) відсоток спостережуваних пацієнтів у групі Cryo/плацебо (41/119;34,5%) оцінювали своє лікування як "неефективно" (тобто, взагалі незадоволені) у порівнянні з відсотком спостережуваних пацієнтів у групі Cryo/ZYCLARA® (7/121; 5,8%). Див. ФІГ. 96 і приклад 29 (особливо таблиця 96). Щодо загальної задоволеності дослідника, більш ніж дві третини (88/121; 72,1%) дослідників спостережуваних пацієнтів у групі Cryo/ZYCLARA® оцінювали задоволеність їх лікуванням як "відмінно" (тобто, дуже задоволені) у порівнянні з менш ніж однією п'ятою (20/119; 16,8%) дослідників спостережуваних пацієнтів у групі Cryo/плацебо. Для порівняння, 20/121 (16,4%) дослідників спостережуваних пацієнтів у групі Cryo/ZYCLARA® і 20/119 (16,8%) дослідників спостережуваних пацієнтів у групі Cryo/плацебо оцінювали задоволеність їх лікуванням як "добре" (тобто, помірковано задоволені). Більш ніж у чотири рази більший (4,4x) відсоток дослідників спостережуваних пацієнтів у групі Cryo/плацебо (30/119; 25,2%) оцінювали їх лікування тільки як "посереднє" (тобто, слабко задоволені) у порівнянні з відсотком дослідників спостережуваних пацієнтів у групі Cryo/ZYCLARA® (7/121; 5,7%), у той час, як більш ніж сім раз більший (7,2x) відсоток дослідників спостережуваних пацієнтів у групі Cryo/плацебо (49/119; 19 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 41,2%) оцінювали їх лікування як "неефективно" (тобто, взагалі незадоволені) у порівнянні з відсотком дослідників спостережуваних пацієнтів у групі Cryo/ZYCLARA® (7/121; 5,7%). Див. ФІГ. 97 і приклад 29 (особливо таблиця 96). Незважаючи на те, що даний винахід визначив, які концентрації складів іміквімоду, число нанесень на тиждень і тривалості терапії вважаються кращими, фахівцям у даній області слід розуміти, що даним винаходом передбачається будь-яка ефективна концентрація іміквімоду в складі, який доставляє ефективну кількість іміквімоду, а також будь-яка кількість нанесень на тиждень у ході короткої тривалості терапії, описаної в даному документі, яка може ефективно лікувати актинічний кератоз, не викликаючи обмежуючі лікування локальні шкірні реакції або супутні побічні явища, що включають дуже велику кількість перерв. Аналогічно, даний винахід також охоплює спрямовану на область місцеву або трансдермальну терапію із застосуванням періодів лікування з 2 циклами по два тижні або три тижні (із проміжною перервою два тижні або три тижні, відповідно) складами з більш низьким дозуванням іміквімоду (наприклад, від близько 2,5% до близько 3,75%), з наступною спрямованою на вогнище кріохірургією. Якщо спрямована на вогнище терапія (кріохірургія) супроводжується спрямованою на область місцевою або трансдермальною терапією (склади з більш низьким дозуванням іміквімоду), то спрямована на область терапія переважно починається в межах 28 днів, і більш переважно в межах 14 днів, і найбільш переважно в межах від близько 7 днів до близько 14 днів після кріохірургії. Якщо спрямована на область терапія (склади з більш низьким дозуванням іміквімоду) супроводжуються спрямованою на вогнище терапією (кріохірургія), то спрямована на вогнище терапія переважно починається в межах 28 днів, і більш переважно в межах 14 днів, і найбільш переважно в межах від близько 7 днів до близько 14 днів після закінчення спрямованої на область терапії. Альтернативно, даний винахід також охоплює спрямовану на область терапію із застосуванням періодів лікування з 2 циклами по два тижні або три тижні (із проміжною перервою два тижні або три тижні, відповідно) складами з більш низьким дозуванням іміквімоду (наприклад, від близько 2,5% до близько 3,75%) із супутньою кріохірургією (тобто, у будь-який час під час циклів лікування 2 x 2 x 2 (2-2-2) або 3 x 3 x 3 (3-3-3), як наприклад, або під час одного з 2 двотижневих або тритижневих спрямованих на область періодів лікування, відповідно, або під час проміжного двотижневої або тритижневої перерви, відповідно. Вищевказаний короткий опис даного винаходу не передбачено для опису кожного розкритого варіанта здійснення або кожної реалізації даного винаходу. У наступному описі більш детально наведені в якості прикладів ілюстративні варіанти здійснення. У декількох місцях протягом заявки забезпечується керування за допомогою переліку прикладів, при цьому приклади можуть застосовуватися в різних комбінаціях. У кожному випадку, згаданий перелік слугує лише в якості типової групи й не повинен інтерпретуватися як вичерпний перелік. КОРОТКИЙ ОПИС ГРАФІЧНИХ МАТЕРІАЛІВ Вищезгадані й інші об'єкти, переваги й ознаки даного винаходу й спосіб, у який такі виконуютьс, стануть більш очевидними при розгляді наступного докладного опису даного винаходу, узятого в комбінації із супровідною фігурою й прикладами,які ілюструють варіант здійснення, де: На ФІГ. 1 показано показники ефективності: ступені повного очищення залежно від дослідження для досліджень GW01-0702, GW01-0703, GW01-0704 і GW01-0705 для схеми лікування з 2-циклами, 2 x 2 x 2 (2 тижні) і для схеми лікування з 2-циклами, 3 x 3 x 3 (3 тижні); ФІГ. 1A є резюме первинних і вторинних очікуваних результатів ефективності в ході схеми з двотижневими циклами лікування, що стосується ITT- популяції, для досліджень GW01-0702 і GW01-0704. Повне очищення визначають як відсутність клінічно видимих або вогнищ AK, що прощупуються, в оброблюваній області. Часткове очищення визначають як щонайменше 75% зменьшення кількості вогнищ AK в оброблюваній області в порівнянні з вихідним рівнем.Pзначення наведені з тесту Кохрана-Мантеля-Гензеля, стратифікованого за місцем аналізу, враховуючи 2 групи лікування одночасно. P-значення, відзначені**, є статистично значущими із застосуванням модифікованої Хочбергом процедури Бонферроні. LOCF= перенесення даних з останнього спостереження вперед. Довірчі інтервали розраховують за допомогою точної біноміальної статистики. Застосовувані на даній ФІГ. 1A "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, а "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28; На ФІГ. 2 показані показники ефективності: повне очищення залежно від моменту часу, для досліджень GW01-0702 і GW01-0704 для схеми лікування з 2-циклами, 2 x 2 x 2 (2 тижні). 20 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 Застосовувані на даній ФІГ. 2 "повне очищення" відноситься до ступеня повного очищення вогнищ AK, "початок циклу 2" відноситься до початку другого циклу, "після 4 тижнів" відноситься до 4 тижнів після лікування й "EOS" відноситься до кінця дослідження; На ФІГ. 2A показаний ступінь повного очищення залежно від тижня дослідження ITTпопуляції для дослідження GW01-0702. Точки, які відзначені **, показують статистичну відмінність від плацебо. Застосовувані на даній ФІГ. 2A, "ступінь повного очищення" відноситься до ступеня повного очищення вогнищ AK, "A" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "B" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й "C" відноситься до плацебо; На ФІГ. 2B показаний ступінь повного очищення залежно від тижня дослідження ITTпопуляції для дослідження GW01-0704. Точки, які відзначені **, показують статистичну відмінність від плацебо. Точки, які відзначені ##, показують статистично значущу відмінність між активними лікуваннями. Застосовувані на даній ФІГ. 2B "ступінь повного очищення" відноситься до ступеня повного очищення вогнищ AK, "A" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "B" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й "C" відноситься до плацебо; На ФІГ. 3 показані показники ефективності: повне очищення залежно від моменту часу, для досліджень GW01-0703 і GW01-0705 для схеми лікування з 2-циклами, 3 x 3 x 3 (3 тижні). Застосовувані на даній ФІГ. 3 "повне очищення" відноситься до повного очищення вогнищ AK, "початок циклу 2" відноситься до початку другого циклу, "після 4 тижнів" відноситься до 4 тижнів після лікування й "EOS" відноситься до кінця дослідження. Див. також ФІГ. 2A і 2B; На ФІГ. 3A показаний ступінь повного очищення залежно від тижня дослідження ITTпопуляції для дослідження GW01-0703. Точки, які відзначені **, показують статистичну відмінність від плацебо. Точки, які відзначені ##, показують статистично значущу відмінність між активними лікуваннями. Застосовувані на даній ФІГ. 3A "ступінь повного очищення" відноситься до ступеня повного очищення вогнищ AK, "A" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "B" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й «C» відноситься до плацебо; На ФІГ. 3B показаний ступінь повного очищення залежно від тижня дослідження ITTпопуляції для дослідження GW01-0705. Точки, які відзначені **, показують статистичну відмінність від плацебо. Точки, які відзначені ##, показують статистично значущу відмінність між активними лікуваннями. Застосовувані на даній ФІГ. 3B "ступінь повного очищення" відноситься до ступеня повного очищення вогнищ AK, "A" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "B" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й «C» відноситься до плацебо; На ФІГ. 4A показані ступені часткового очищення наприкінці дослідження схеми з двотижневими циклами лікування ITT-популяції для досліджень GW01-0702 і GW01-0704. На даній ФІГ. 4A "ступінь часткового очищення" відноситься до ступеня часткового очищення вогнищ AK (визначається як щонайменше близько 75% зниження кількості AK на оброблюваній області в порівнянні з вихідний рівнем), "L" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "H" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28, P=плацебо, й що стовпчики, що відзначені **, показують статистично значущу відмінність від плацебо, тоді як стовпчики, що відзначені ##, показують статистично значущу відмінність від 2,5%. Вертикальні сині лінії вказують межі 95% довірчого інтервалу; На ФІГ. 4B показаний ступінь часткового очищення на тижні 14 для ITT-популяції для дослідження GW01-0702. Часткове очищення визначають як щонайменше 75% зниження кількості AK на оброблюваній області в порівнянні з вихідним рівнем. Стовпчики, що відзначені **, показують статистично значущу відмінність від плацебо. Темні чорні вертикальні лінії представляють 95% довірчі інтервали для ступенів. На даній ФІГ. 4B, "ступінь часткового очищення" відноситься до ступеня часткового очищення вогнищ AK (визначається як щонайменше близько 75% зменшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем), "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28 і "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28; На ФІГ. 4C показаний ступінь часткового очищення на тижні 14 для ITT-популяції для дослідження GW01-0704. Часткове очищення визначається як щонайменше 75% зменшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем. Стовпчики, що відзначені **, показують статистично значущу відмінність від плацебо. Стовпчики, що відзначені ##, показують статистичну відмінність між активними лікуваннями. Темні чорні вертикальні лінії 21 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 представляють 95% довірчі інтервали для ступенів. На даній ФІГ. 4C "ступінь часткового очищення" відноситься до ступеня часткового очищення вогнищ АК (визначається як щонайменше близько 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем), "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28 і "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28; На ФІГ. 4D показаний ступінь часткового очищення на тижні 17 для ITT-популяції для дослідження GW01-0703. Часткове очищення визначається як щонайменше 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем. Стовпчики, що відзначені **, показують статистично значущу відмінність від плацебо. Темні чорні вертикальні лінії представляють 95% довірчі інтервали для ступенів. На даній ФІГ. 4D "ступінь часткового очищення" відноситься до ступеня часткового очищення вогнищ АК (визначається як щонайменше близько 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем), "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28 і "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28; На ФІГ. 4E показаний ступінь часткового очищення на тижні 17 для ITT-популяції для дослідження GW01-0705. Часткове очищення визначають як щонайменше 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем. Стовпчики, що відзначені **, показують статистично значущу відмінність від плацебо. Темні чорні вертикальні лінії представляють 95% довірчі інтервали для ступенів. На даній ФІГ. 4E "ступінь часткового очищення" відноситься до ступеня часткового очищення вогнищ АК (визначається як щонайменше близько 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем), "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28 і "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28; На ФІГ. 4F показаний ступінь часткового очищення залежно від моменту часу дослідження для комбінованих досліджень для ITT-популяції, що відносяться до застосування складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28. Зверніть увагу на наступне: L2=схема із 2,5%, двотижневими циклами лікування L3=схема із 2,5%, тритижневими циклами лікування H2=схема із 3,75%двотижневими циклами лікування, H3=схема із 3,75% тритижневими циклами лікування, P2=схема із двотижневими циклами лікування плацебо й P3=схема із тритижневими циклами лікування плацебо. На даній ФІГ. 4F "ступінь часткового очищення" відноситься до ступеня часткового очищення вогнищ АК (визначається як щонайменше близько 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем), "початок циклу 2" відноситься до початку другого циклу, "після 4 тижнів" відноситься до 4 тижнів після лікування й "після 8 тижнів" відноситься до 8 тижнів після лікування; На ФІГ. 5 показані показники ефективності часткового очищення залежно від моменту часу для досліджень GW01-0702 і GW01-0704. Див. також ФІГ. 37A. Застосовувані на даній ФІГ. 5 "часткове очищення" відноситься до часткового очищення вогнищ АК (визначається як щонайменше близько 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем), "початок циклу 2" відноситься до початку другого циклу, "після 4 тижнів" відноситься до 4 тижнів після лікування, "EOS" відноситься до кінця дослідження й "2 x 2 x 2" відноситься до лікування з 2-циклами по два тижні, як протягом ФІГ. і опису даного винаходу; На ФІГ. 5A показаний ступінь часткового очищення залежно від тижня дослідження для ITTпопуляції для дослідження GW01-0702. Точки, які відзначені**, показують статистичну відмінність від плацебо. Точки, які відзначені ##, показують статистичну відмінність між активними лікуваннями. Застосовувані на даній ФІГ. 5A "ступінь часткового очищення" відноситься до ступеня часткового очищення вогнищ АК (визначається як щонайменше близько 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем), "A" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "B" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й «C» відноситься до плацебо; На ФІГ. 5B показаний ступінь часткового очищення залежно від тижня дослідження для ITTпопуляції для дослідження GW01-0704. Точки, які відзначені **, показують статистичну відмінність від плацебо. Точки, які відзначені ##, показують статистичну відмінність між активними лікуваннями. Застосовувані на даній ФІГ. 5B "ступінь часткового очищення" відноситься до ступеня часткового очищення вогнищ АК (визначається як щонайменше близько 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем), 22 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 "A" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "B" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й «C» відноситься до плацебо; На ФІГ. 6 показані показники ефективності: часткове очищення залежно від моменту часу, для досліджень GW01-0703 і GW01-0705. Застосовувані на даній ФІГ. 6 "часткове очищення" відноситься до відсотка ступеня часткового очищення вогнищ АК (визначається як щонайменше близько 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем), "початок циклу 2" відноситься до початку другого циклу, "після 4 тижнів" відноситься до 4 тижнів після лікування й "EOS" відноситься до кінця дослідження. Див. також ФІГ. 37A; На ФІГ. 6A показаний ступінь часткового очищення залежно від тижня дослідження для ITTпопуляції для дослідження GW01-0703. Точки, які відзначені **, показують статистично значущу відмінність від плацебо. Точки, які відзначені ##, показують статистично значущу відмінність між активними лікуваннями. Застосовувані на даній ФІГ. 6A "ступінь часткового очищення" відноситься до ступеня часткового очищення вогнищ АК (визначається як щонайменше близько 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем), "A" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "B%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й «C» відноситься до плацебо; На ФІГ. 6B показаний ступінь часткового очищення залежно від тижня дослідження для ITTпопуляції для дослідження GW01-0705. Точки, які відзначені **, показують статистично значущу відмінність від плацебо. Точки, які відзначені ##, показують статистично значущу відмінність між активними лікуваннями. Застосовувані на даній ФІГ. 6B "ступінь часткового очищення" відноситься до ступеня часткового очищення вогнищ АК (визначається як щонайменше близько 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем), "A" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "B" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й «C» відноситься до плацебо; На ФІГ. 7 показані показники ефективності: середня % зміна від підрахунку вихідного рівня залежно від дослідження, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також ФІГ. 9A; На ФІГ. 8 показані показники ефективності: середня % зміна від підрахунку вихідного рівня залежно від моменту часу, для досліджень GW01-0702 і GW01-0704. Застосовувані на даній ФІГ. 8 "% зменшення підрахунку" відноситься до % зменшення у підрахунку АК від вихідного рівня, "початок циклу 2" відноситься до початку другого циклу, "після 4 тижнів" відноситься до 4 тижнів після лікування й "EOS" відноситься до кінця дослідження. Див. також ФІГ. 9A; На ФІГ. 8A показана медіанна відсоткова зміна від підрахунку вогнищ АК вихідного рівня залежно від тижня дослідження для ITT-популяції для дослідження GW01-0702. Точки, які відзначені **, показують статистично значущу відмінність від плацебо. Точки, які відзначені ##, показують статистично значущу відмінність між активними лікуваннями. Застосовувані на даній ФІГ. 8A "медіанна відсоткова зміна" відноситься до медіанної відсоткової зміни підрахунку вогнищ АК від вихідного рівня, "A" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "B" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й «C» відноситься до плацебо; На ФІГ. 8B показана медіанна відсоткова зміна від підрахунку вогнищ АК вихідного рівня залежно від тижня дослідження для ITT-популяції для дослідження GW01-0704. Точки, які відзначені**, показують статистично значущу відмінність від плацебо. Точки, які відзначені ##, показують статистично значущу відмінність між активними лікуваннями. Застосовувані на даній ФІГ. 8B "медіанна відсоткова зміна" відноситься до медіанної відсоткової зміни підрахунку вогнищ АК від вихідного рівня, "A" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "B%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й «C» відноситься до плацебо; На ФІГ. 9 показані показники ефективності: середня % зміна від пірахунку вихідного рівня залежно від моменту часу для досліджень GW01-0703 і GW01-0705. Застосовувані на даній ФІГ. 9 "середня % зміна від підрахунку вихідного рівня" відноситься до середнього процентного зниження числа AK, "початок циклу 2" відноситься до початку другого циклу, "після 4 тижнів" відноситься до 4 тижнів після лікування й "EOS" відноситься до кінця дослідження. Див. також ФІГ. 8A і 8B; На ФІГ. 9A показане резюме підрахунку вогнищ АК для ITT-популяції, що відноситься до GW01-0703. Застосовувані на даній ФІГ. 9A "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "3,75%" відноситься до складу з більш низьким 3,75% 23 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 дозуванням іміквімоду з прикладів 23-28. P-значення наведені з тесту Кохрана-МантеляГензеля, який стратифікований за місцем аналізу, враховуючи 2 групи лікування одночасно. Pзначення, відзначені **, є статистично значущими із застосуванням модифікованої Хочбергом процедури Бонферроні. Кількості вогнищ, які записані як 'невизначені', виключаються з аналізу; На ФІГ. 9B показане резюме підрахунку вогнищ АК для ITT-популяції, що відноситься до GW01-0705. Застосовувані на даній ФІГ. 9A "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28. P-значення наведені з тесту Кохрана-МантеляГензеля, який стратифікований за місцем аналізу, враховуючи 2 групи лікування одночасно. Pзначення, відзначені**, є статистично значущими із застосуванням модифікованої Хочбергом процедури Бонферроні. Кількості вогнищ, які записані як 'невизначені', виключаються із аналізу; На ФІГ. 10 показані показники ефективності: ступені очищення залежно від статі для дослідження GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Застосовувана на даній ФІГ. 10 "ступінь очищення" відноситься до ступеня повного очищення вогнищ AK; На ФІГ. 10A показане резюме первинних і вторинних очікуваних результатах ефективності для субпопуляцій чоловіків і жінок для комбінованих досліджень двотижневих циклів лікування GW01-0702 і GW01-0704 для ITT-популяції із застосуванням одного зі складів з більш низьким 2,5% або 3,75% дозуванням іміквімоду з прикладів 23-28. P-значення для ступенів очищення наведені з узагальненого лінійного модуля (GENMOD), при припущенні про мультіномінальний розподіл (DIST=MULT) і кумулятивну логіт-функцію зв'язку (LINK=CLOGIT), що включає ефекти дози, субпопуляцію й взаємодію. P-значення для відсоткової зміни підрахунку вогнищ АК знаходять з дисперсійного аналізу (GLM), що включає ефекти дози, субпопуляцію й взаємодію; На ФІГ. 10B показане резюме перемінної первинної ефективності, ступені повного очищення на тижні 17 (кінець дослідження), підгруповий аналіз n/N (%) для дослідження GW01-0703 з застосуванням одного зі складів з більш низьким 2,5%, або 3,75% дозуванням іміквімоду з прикладів 23-28; На ФІГ. 10С показане резюме перемінної первинної ефективності, ступені повного очищення на тижні 17 (кінець дослідження), підгруповий аналіз n/N (%) для дослідження GW01-0705 з застосуванням одного зі складів з більш низьким 2,5%, або 3,75% дозуванням іміквімоду з прикладів 23-28; На ФІГ. 11 показані показники ефективності: ступені очищення залежно від оброблюваної області суб'єкта, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Застосовувана на даній ФІГ. 11 "ступінь очищення" відноситься до ступеня повного очищення вогнищ AK; На ФІГ. 12 показані показники ефективності: медіанна відсоткова зміна від вихідного рівня від 0 до -100, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Застосовувана на даній ФІГ. 11 "відсоткова зміна" відноситься до медіанного відсотка, на який є зміна підрахунку вогнищ АК із застосуванням одного зі складів з більш низьким 2,5% або 3,75% дозуванням іміквімоду з прикладів 23-28 в одному з лікувань із 2-циклами по два тижні або три тижні; На ФІГ. 12A показана медіанна відсоткова зміна від вихідного рівня у підрахунку вогнищ АК залежно від моменту часу дослідження для комбінованих досліджень для ITT-популяції із застосуванням одного з двох складів з більш низьким 2,5% або 3,75% дозуванням іміквімоду з прикладів 23-28. Зверніть увагу на наступне: L2=схема із 2,5% двотижневими циклами лікування, L3=схема з 2,5% тритижневими циклами лікування, H2=схема з 3,75% двотижневими циклами лікування, H3=схема з 3,75% тритижневими циклами лікування, P2=схема з двотижневими циклами лікування плацебо й P3=схема з тритижневими циклами лікування плацебо. Застосовувані на даній ФІГ. 12A "медіанна відсоткова зміна" відноситься до медіанної відсоткової зміни у підрахунку вогнищ АК від вихідного рівня, "початок циклу 2" відноситься до початку другого циклу, "після 4 тижнів" відноситься до 4 тижнів після лікування, "після 8 тижнів" відноситься до 8 тижнів після лікування й "P" відноситься до плацебо; На ФІГ. 13 показані показники ефективності: середня відсоткова зміна від вихідного рівня від 0 до -80, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705 із застосуванням одного з двох складів з більш низьким 2,5% або 3,75% дозуванням іміквімоду з прикладів 23-28. Застосовувані на даній ФІГ. 13 "відсоткова зміна" відноситься до середньої відсоткової зміни у підрахунку вогнищ АК від вихідного рівня, "початок циклу 2" відноситься до початку другого циклу, "після 4 тижнів" відноситься до 4 тижнів після лікування й "EOS" відноситься до кінця дослідження (8 тижнів після лікування); На ФІГ. 13A-G показане резюме відсоткової зміни від вихідного рівня підрахунку вогнищ АК залежно від огляду для комбінованих досліджень для ITT-популяції із застосуванням одного з 24 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 двох складів з більш низьким 2,5% або 3,75% дозуванням іміквімоду з прикладів 23-28. Pзначення наведені з тесту Кохрана-Мантеля-Гензеля, який стратифікований за місцем аналізу, враховуючи 2 групи лікування одночасно. P-значення, відзначені **, є статистично значущими із застосуванням модифікованої Хочбергом процедури Бонферроні; На ФІГ. 14A-E показане резюме виникаючих при лікуванні побічних явищ n (%) суб'єктів у порядку зниження частоти виникнення в групі з 3,75% або 2,5% двотижневим або тритижневим циклом лікування, де дослідник розглядає побічні явища як пов'язані з лікуванням, для комбінованих досліджень для ITT-популяції із застосуванням одного з двох складів з більш низьким 2,5% або 3,75% дозуванням іміквімоду з прикладів 23-28. Підрахунки відбивають кількість суб'єктів у кожній групі лікування, що повідомляють про одне або декількох побічних явищ, які позначаються відповідно до класу системи органів MedDRA. Суб’єкт може бути врахований лише один раз у кожному рядку таблиці. Пов'язаний з лікуванням включає ймовірно пов'язаний і пов'язаний. Виникаючим при лікуванні AE є AE з датою появи в день 1 або після дня 1 лікування; На ФІГ. 15 показані показники безпеки: випадки побічних явищ, пов'язаних з лікуванням, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Застосовувані на даній ФІГ. 15 "H" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28, а "L" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28 й "V" відноситься до носія. Див. також ФІГ. 14A-14E; На ФІГ. 16A-C показане резюме локальних шкірних реакцій (LSR) щодо ступеню найбільш тяжких реакцій під час дослідження, для комбінованих досліджень для ITT-популяції із застосуванням складу з більш низьким 2,5% або 3,75% дозуванням іміквімоду в терапіях із двома циклами по 2-тижні або 3-тижні згідно з даним винаходом. Оскільки суб'єкт у групі 3,75% двотижневого лікування, суб'єкт у групі 2,5% тритижневого лікування, суб'єкт у групі 3,75% лікування й два суб'єкти в групі тритижневого плацебо не оглядалися після дослідження вихідного рівня, вони виключаються з аналізу; На ФІГ. 17 показані показники безпеки: сумарний показник LSR AUC для досліджень GW010703, GW01-0702, GW01-0704 і GW01-0705. Застосовувані на даній ФІГ. 17 "H" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 і "L" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28.; На ФІГ. 17A показане резюме локальних шкірних реакцій (LSR): площа під кривої суми LSR показників (дні) для комбінованих досліджень для ITT-популяції із застосуванням одного із двох складів з більш низьким 2,5% або 3,75% дозуванням іміквімоду з прикладів 23-28. P-значення наводяться на підставі дисперсійного аналізу (GLM), що включає ефекти дози, схему й центр аналізу в схемі. Часовий період для AUC триває до восьми тижнів після кінця лікування як для схеми із двотижневими циклами лікування (тиждень 14), так і для схеми із тритижневими циклами лікування (тиждень 17). Лише суб'єкти, що одержують лікування в обох циклах лікування, включаються у даний аналіз; На ФІГ. 18 показані показники безпеки: сумарний показник LSR залежно від моменту часу для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705; На ФІГ. 18A показаний середній сумарний показник LSR залежно від моменту часу дослідження для схем із двотижневими циклами лікування для ITT-популяції із застосуванням складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28. Зверніть увагу на наступне: Bsl=вихідний рівень, Eoc1=кінець циклу 1, Soc2=початок циклу 2, Eoc2=кінець циклу 2, 4WP= 4 тижня після лікування, 8WP=8 тижнів після лікування, L2=схема з 2,5% двотижневими циклами, H2= схема з 3,75% двотижневими циклами лікування, P2=схема з двотижневими циклами лікування плацебо; На ФІГ. 18B показаний середній сумарний показник LSR залежно від моменту часу дослідження для схем з тритижневими циклами лікування для ITT-популяції із застосуванням складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28. Зверніть увагу на наступне: Bsl=вихідний рівень, Eoc1=кінець циклу 1, Soc2=початок циклу 2, Eoc2=кінець циклу 2, 4WP= 4 тижня після лікування, 8WP=8 тижнів після лікування, L3=схема з 2,5% тритижневими циклами, H3=схема з 3,75% тритижневими циклами лікування, P32=схема лікування з тритижневими циклами плацебо; На ФІГ. 19 показані показники безпеки: зустрічальність тяжкої LSR еритеми для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Застосовувані на даній ФІГ. 19 "H" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду, а "L" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28 і "V" відноситься до носія. Див. також ФІГ. 16A-C; На ФІГ. 20 показаний середній показник LSR еритеми залежно від моменту часу, для 25 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705; На ФІГ. 20A показаний середній показник LSR залежно від тижня дослідження для еритеми для ITT-популяції для дослідження GW01-0702. Застосовувані на даній ФІГ. 20A "A" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду, "B" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й C відноситься до плацебо; На ФІГ. 20B показаний середній показник LSR залежно від тижня дослідження для еритеми, для ITT-популяції для дослідження GW01-0704. Застосовувані на даній ФІГ. 20B "A" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду, "B" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й C відноситься до плацебо; На ФІГ. 21 показані показники безпеки: частота перерв для досліджень GW01-0703, GW010702, GW01-0704 і GW01-0705. Див. також ФІГ. 30; На ФІГ. 22 показані показники безпеки: ступінь виключення з дослідження з міркувань безпеки для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Застосовувані на даній ФІГ. 22 "H" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28, "L" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28 й "V" відноситься до носія; На ФІГ. 23 показане резюме вибраних параметрів безпеки, асоційованих з нанесеннями складів крему з 2,5% і 3,75% іміквімоду з прикладу 23, які застосовують у схемах з 2-циклами, 2 x 2 x 2 тижні й застосовують у схемах з 2-циклами, 3 x 3x 3 тижні. Результати показують загальний прийнятний профіль безпеки складів як з 2,5%, так і з 3,75% іміквімоду з прикладу 23 згідно з будь-якими схемами з 2-х або 3-х тижневими циклами. Слід зазначити, що результати безпеки свідчать про кращий профіль безпеки при застосуванні складу або з 2,5%, або з 3,75% іміквімоду в схемі з 2-циклами, 2 x 2 x 2 тижні порівняно зі схемою з 2-циклами, 3 x 3 x 3 тижні. На ФІГ. 24 показане поліпшення в дослідницькому загальному комплексному показнику фотоушкодження від вихідного рівня протягом періоду лікування з 2-циклами по два тижні (2 x 2 x 2 тижні). На даній ФІГ. 24, дослідження 1 відноситься до дослідження GW01-0702, а дослідження 2 відноситься до дослідження GW01-0704, як по всьому даному документу. Застосовуване на даній ФІГ. 24, "Пбо" відноситься до плацебо, а "Imiq" відноситься до іміквімоду; На ФІГ. 25 показаний мета-аналіз ефективності об'єднаних ступенів очищення для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705; На ФІГ. 25A показане резюме первинних і вторинних очікуваних результатів ефективності для комбінованих досліджень, аналіз у межах схеми для ITT- популяції із застосуванням складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28. Повне очищення визначають як відсутність клінічно видимих або вогнищ AK, що прощупуються на оброблюваній області. Часткове очищення визначають як щонайменше 75% зменьшення кількості вогнищ АК на оброблюваній області в порівнянні з вихідним рівнем. P-значення наведені з Кохрана-МантеляГензеля, який стратифікований за місцем аналізу, враховуючи 2 групи лікування одночасно. P-значення, відзначені **, є статистично значущими із застосуванням модифікованої Хочбергом процедури Бонферроні. LOCF= перенесення даних з останнього спостереження вперед. Довірчі інтервали розраховують за допомогою точної біноміальної статистики; На ФІГ. 26 показане порівняння ефективності: ступені повного очищення залежно від дослідження, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Застосовувані на даній ФІГ. 26 "2 x 2 x 2" відноситься до терапії з 2-циклами по два тижні, а "3 x 3 x 3" відноситься до терапії з 2-циклами по три тижні. Див. також ФІГ. 25A; На ФІГ. 27 показане порівняння ефективності: ступені часткового очищення залежно від дослідження, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Застосовувані на даній ФІГ. 27 "2 x 2 x 2" відноситься до терапії з 2-циклами по два тижні, а "3 x 3 x 3" відноситься до терапії з 2-циклами по три тижні. Див. також ФІГ. 25A; На ФІГ. 28 показане порівняння безпеки: частота виникнення побічних явищ для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705 у порівнянні з 5% кремом іміквімоду ALDARA®. Застосовувані на даній ФІГ. 28 "2 тижні" відноситься до терапії з 2-циклами по два тижні, "3 тижні" відноситься до терапії з 2-циклами по три тижні, "Пбо" відноситься до плацебо, "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28 і "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28; На ФІГ. 28A-B показана кількість (%) суб'єктів у дослідженнях фази 3 з виникаючими при лікуванні побічними явищами із частотою більше 1% у групі із двотижневим циклом лікування 3,75% іміквімоду для ITT-популяції. Підрахунки відбивають кількість суб'єктів у кожній групі лікування, що повідомляють про одне або декілька побічних явищ, які позначаються відповідно до класу системи органів MedDRA. Суб’єкт може бути врахований лише один раз у кожному 26 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 рядку таблиці. Виникаючим при лікуванні AE є AE з датою появи на день 1 або після дня 1 лікування. Застосовувані на даних ФІГ. 28A-B "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28 і "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28; На ФІГ. 29 показане порівняння частоти виникнення тяжкої еритеми [(локальна шкірна реакція (LSR)] для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705 у порівнянні з 5% кремом іміквімоду ALDARA®. Застосовувані на даній ФІГ. 29 "H" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28, "L" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28,"V" відноситься до носія й "2 x 2 x 2" відноситься до схеми лікування з 2-циклами по два тижні й "3 x 3 x 3" відноситься до схеми лікування з 2-циклами по три тижні. Див. також ФІГ. 16A; На ФІГ. 30 показані показники безпеки: частота зустрічальності перерв, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705 у порівнянні з 5% кремом іміквімоду ALDARA®. Застосовувані на даній ФІГ. 30 "H" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28, "L" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28 і "V" відноситься до носія, а "2 x 2 x 2" відноситься до схеми лікування з 2-циклами по два тижні й "3 x 3 x 3" відноситься до схеми лікування з 2циклами по три тижні. Див. також ФІГ. 21; На ФІГ. 31 показані показники ефективності: ступені очищення залежно від статі суб'єкта, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також ФІГ. 10A-10C; На ФІГ. 32 показані показники ефективності: ступені очищення залежно від віку суб'єкта, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також ФІГ. 10B-10C; На ФІГ. 32A показане резюме первинних і вторинних очікуваних результатів ефективності для субпопуляцій за віком після й до 65, для комбінованих досліджень двотижневих циклів лікування (GW01-0702 і GW01-0704) для ITT-популяції для активного лікування із застосуванням тільки складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28. P-значення для ступенів очищення наведені з узагальненого лінійного модуля (GENMOD) при припущенні про мультіномінальний розподіл (DIST=MULT) і накопичувальній логіт-функції зв'язку (LINK=CLOGIT), що включає ефекти дози, субпопуляцію й взаємодію. P-значення для відсоткової зміни у підрахунку вогнищ АК знаходять з дисперсійного аналізу (GLM), що включає ефекти дози, субпопуляцію й взаємодію. Застосовувані на даній ФІГ. 32A "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28, "=65" відноситься до вікової популяції, вік якої становить 65 років і більше; На ФІГ. 33 показані показники ефективності: ступені очищення залежно від типу шкіри суб'єкта, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також ФІГ. 10B-10C; На ФІГ. 33A показане резюме первинних і вторинних очікуваних результатів ефективності для субпопуляцій по типу шкіри за Фітцпатріком, для комбінованих досліджень двотижневих циклів лікування (GW01-0702 і GW01-0704) для ITT-популяції для активного лікування із застосуванням тільки складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28. Pзначення для ступенів очищення наведені з узагальненого лінійного модуля (GENMOD) при припущенні про мультіномінальний розподіл (DIST=MULT) і накопичувальну логіт-функцію зв'язку (LINK=CLOGIT), що включає ефекти дози, субпопуляцію й взаємодію. P-значення для відсоткової зміни у підрахунку вогнищ АК знаходять з дисперсійного аналізу (GLM), що включає ефекти дози, субпопуляцію й взаємодію. Застосовувані на даній ФІГ. 33A "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28, і "I", "II", "III", "IV", "V" або "VI" відноситься до типу шкіри за Фітцпатріком; На ФІГ. 34 показані показники ефективності: ступені очищення залежно від підрахунку вихідного рівня в суб'єкта для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також ФІГ. 10B-10C; На ФІГ. 34A показане резюме первинних і вторинних очікуваних результатів ефективності для субпопуляцій за підрахунком вогнищ вихідного рівня, для комбінованих досліджень двотижневих циклів лікування (GW01-0702 і GW01-0704) для ITT-популяції для активного лікування із застосуванням тільки складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28. P-значення для ступенів очищення наведені з узагальненого лінійного модуля (GENMOD) при припущенні про мультіномінальний розподіл (DIST=MULT) і накопичувальну логіт-функцію зв'язку (LINK=CLOGIT), що включає ефекти дози, субпопуляцію й взаємодію. P 27 UA 112059 C2 5 10 15 20 25 30 35 40 45 50 55 60 значення для відсоткової зміни у підрахунку вогнищ АК знаходять з дисперсійного аналізу (GLM), що включає ефекти дози, субпопуляцію й взаємодію. Застосовувані на даній ФІГ. 34A "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, і "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28; На ФІГ. 35 показані показники ефективності: ступені очищення залежно від оброблюваної області в суб'єкта, для досліджень GW01-0703, GW01-0702, GW01-0704 і GW01-0705. Див. також ФІГ. 10B-10C; На ФІГ. 35A показане резюме первинних і вторинних очікуваних результатів ефективності для субпопуляцій за місцем розташування оброблюваних областей (обличчя або лисіюча шкіра голови), для комбінованих досліджень двотижневих циклів лікування (GW01-0702 і GW01-0704) для ITT-популяції для активного лікування із застосуванням тільки складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28. P-значення для ступенів очищення наведені з узагальненого лінійного модуля (GENMOD) при припущенні про мультіномінальний розподіл (DIST=MULT) і накопичувальну логіт-функцію зв'язку (LINK=CLOGIT), що включає ефекти дози, субпопуляцію й взаємодію. P-значення для відсоткової зміни у підрахунку вогнищ АК знаходять з дисперсійного аналізу (GLM), що включає ефекти дози, субпопуляцію й взаємодію. Застосовувані на даній ФІГ. 35A "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 і "обличчя" і "лисіюча шкіра голови" відноситься до оброблюваної області; На ФІГ. 35B показане резюме первинних і вторинних очікуваних результатів ефективності для субпопуляцій за місцем розташування оброблюваної області (обличчя або лисіюча шкіра голови), для комбінованих досліджень двотижневих циклів лікування (GW01-0702 і GW01-0704) для ITT-популяції із застосуванням складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28. P-значення для ступенів очищення наведені з узагальненого лінійного модуля (GENMOD) при припущенні про мультіномінальний розподіл (DIST=MULT) і накопичувальну логіт-функцію зв'язку (LINK=CLOGIT), що включає ефекти дози, субпопуляцію й взаємодію. Pзначення для відсоткової зміни у підрахунку вогнищ АК знаходять з дисперсійного аналізу (GLM), що включає ефекти дози, субпопуляцію й взаємодію. Застосовувані на даній ФІГ. 35B "2,5%" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "3,75%" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28, й "обличчя" і "лисіюча шкіра голови" відноситься до оброблюваної області; На ФІГ. 36 показаний відсоткове повне очищення в порівнянні з 5% кремом іміквімоду ALDARA®. На даній ФІГ. 36 й по всьому опису винаходу дослідження 1 відноситься до дослідження GW01-0702, а дослідження 2 відноситься до дослідження GW01-0704. Застосовувані на даній ФІГ. 36 "Пбо" відноситься до плацебо, "Imiq" відноситься до іміквімоду й "ALDARA" відноситься до 5% крему іміквімоду ALDARA®. Див. також ФІГ. 1; На ФІГ. 36A показаний відсоткове повне очищення в порівнянні із плацебо. На даній Фіг. 36 й по всьому опису винаходу дослідження 1 відноситься до дослідження GW01-0702, дослідження 2 відноситься до дослідження GW01-0704, дослідження 3 відноситься до дослідження GW010703 й дослідження 4 відноситься до дослідження GW01-0705. Застосовувані на даній ФІГ. 36A "Пбо" відноситься до плацебо й "Imiq" відноситься до іміквімоду; На ФІГ. 37 показаний відсоткове часткове очищення в порівнянні з 5% кремом іміквімоду ALDARA®. На даній Фіг. 37 й по всьому опису винаходу дослідження 1 відноситься до дослідження GW01-0702, а дослідження 2 відноситься до дослідження GW01-0704. Застосовувані на даній ФІГ. 37 "Пбо" відноситься до плацебо, "2,5% Imiq" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28, "3,75% Imiq" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28 й "ALDARA" відноситься до 5% крему іміквімоду ALDARA®. Див. також ФІГ. 4A; На ФІГ. 37A показане часткове очищення в порівнянні із плацебо. На даній ФІГ. 37A й по всьому опису винаходу дослідження 1 відноситься до дослідження GW01-0702, дослідження 2 відноситься до дослідження GW01-0704, дослідження 3 відноситься до дослідження GW01-0703 й дослідження 4 відноситься до дослідження GW01-0705. Застосовувані на даній ФІГ. 37A "Пбо" відноситься до плацебо, "2,5% Imiq" відноситься до складу з більш низьким 2,5% дозуванням іміквімоду з прикладів 23-28 і "3,75% Imiq" відноситься до складу з більш низьким 3,75% дозуванням іміквімоду з прикладів 23-28; На ФІГ. 38 показаний медіанний % зменшення АК у порівнянні з 5% кремом іміквімоду ALDARA®. На даній Фіг. 38 й по всьому опису винаходу дослідження 1 відноситься до дослідження GW01-0702 йі дослідження 2 відноситься до дослідження GW01-0704. Застосовувані на даній ФІГ. 38 "Пбо" відноситься до плацебо, "2,5% Imiq" відноситься до складу 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCombination therapy with cryosurgery and low dosage strength imiquimod to treat actinic keratosis
Автори англійськоюNordsiek, Michael, T., Levy, Sharon, F., Lee, James, Hurn-joung, Kulp, James, H., Meng, Tze-chiang, Wu, Jason, J., Babilon, Robert, Balaji, Kodumudi, S., Bahm, Valyn, S.
Автори російськоюНордзик Майкл Т., Леви Шарон Ф., Ли Джэймс Хурн-дзонг, Калп Джэймс Х., Мин Тзе-чиан, Ву Джэйсон Дж., Бэбилон Роберт, Баладжи Кодумуди С., Бам Валин С.
МПК / Мітки
МПК: A61K 31/4745, A01N 43/42, A61P 17/00, A61B 18/02
Мітки: лікування, терапія, актинічного, комбінована, кріохірургією, іміквімодом, кератозу, варіанти
Код посилання
<a href="https://ua.patents.su/314-112059-kombinovana-terapiya-iz-kriokhirurgiehyu-i-imikvimodom-dlya-likuvannya-aktinichnogo-keratozu-varianti.html" target="_blank" rel="follow" title="База патентів України">Комбінована терапія із кріохірургією і іміквімодом для лікування актинічного кератозу (варіанти)</a>
Попередній патент: Спосіб виробництва металевої чашки з листового металу і прес для його здійснення
Наступний патент: Паливні суміші нітрату амонію
Випадковий патент: Спосіб отримання захисно-декоративних покриттів на міді