Аналог апротиніну, структура днк, що його кодує, рекомбінантний експресуючий вектор, культура клітин sacharomyces serevisiae, спосіб одержання аналога апротиніну, фармацевтична композиція
Номер патенту: 34422
Опубліковано: 15.03.2001
Автори: Норріс Кєлд, Брегенгаард Клаус, Дінес Вігго, Крістенсен Ніелс Дір, Бьорн Сорен Ерік, Норсков-Лаурттцен Лейф
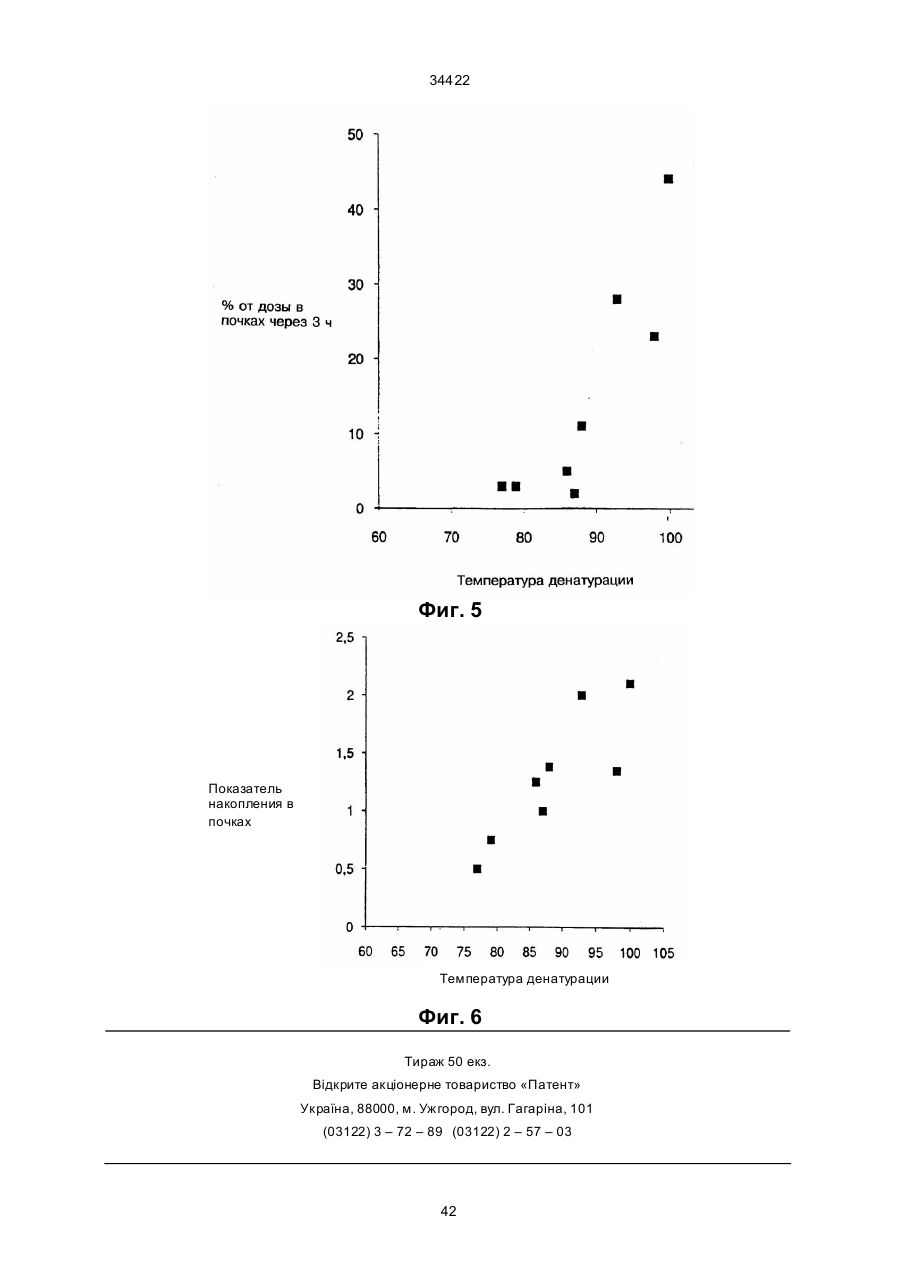
Текст
Ala(58), согласно изобретению, по меньшей мере один положительно заряженный аминокислотный остаток, расположенный за пределами участка связывания протеазы, определенного как положение 12-18 и 3439, удален или замещен нейтральным или отрицательно заряженным аминокислотным остатком, и/или в котором по меньшей мере один отрицательно заряженный аминокислотный остаток введен или добавлен за пределами участка связывания протеазы, и/или в котором по меньшей мере один нейтральный аминокислотный остаток за пределами участка связывания протеазы замещен отрицательно заряженным аминокислотным остатком, и/или один или более аминокислотные остатки, расположенные за пределами участка связывания протеазы, которые участвуют в стабилизации аналога, удале ны или замещены одним или более аминокислотными остатками, и/или один или более аминокислотные остатки, которые дестабилизируют аналог, добавлены за пределами участка связывания протеазы, исключая такие аналоги апротинина, в которых аминокислота в положении 1 или аминокислоты в положениях 1 и 2 удалены, lle в положении 19 замещена другим природным аминокислотным остатком, Lys в положении 41 замещена другим природным аминокислотным остатком, или Arg в положении 42 замещена Lys или Ser. Кроме того, аналог апротинина имеет общую формулу I: R1 Asp Phe Cys Leu Glu Pro R 2 Thr Gly Pro Lys Ala Arg lle lle R 3 Tyr Phe Tyr R4 Ala R5 Ala Gly Leu Cys R6 Thr Phe Val Tyr Gl y Gly C ys Arg R 7 R8 R9 Asn R10 Phe R11 Ser Ala Glu Asp Cys Met R12 Thr Cys Gly Gly Ala (I) в которой R1 представляет собой дипептид, выбранный из группы, состоящей из Arg-Pro, Glu-Pro, Asp-Pro, Ala-Pro, lle-Pro, Thr-Pro, His-Pro, Leu-Pro, Gly-Pro и Ser-Pro, Pro, или R1 представляет собой водород. R2 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Туг, Glu, Asp, Ser, Thr, Ala и Val. R3 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Arg, Glu, Asp, Leu, Ser, Ala, Gln и Thr. R4 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Asn, Glu и Asp. R5 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Lys, Glu, Asp, Thr, Val, Ala, Ser, Phe, Gln и Gl y. R6 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Gln, Glu, Asp, Val и Ala. R7 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Ala, Asp, Glu и Gly. R8 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Lys, Glu, Asp, Asn, Ser, Thr и Ala. R9 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Arg, Glu, Asp, Ser, Asn, Leu, Gly, Gln, Met и Thr. R10 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Asn Glu и Asp. 4 34422 R11 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Lys, Glu, Asp, Leu, Tyr, Ala, Val, Thr, Ser, Pro, His и Ilе, и R12 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Arg, Glu, Asp, Gln, Ala, Asn, His, Gly, Ser и Thr, при условии, что по меньшей мере один из аминокислотных остатков R1-R12 является отличным от соответствующего аминокислотного остатка нативного апротинина, и, когда R1 является водородом, по меньшей мере один из аминокислотных остатков R1- R12 является отличным от соответствующего аминокислотного остатка нативного апротинина, за исключением того, когда R1 является водородом, R9 не является Ser. Кроме того, пептид, состоящий в основном из одного или более отрицательно заряженных или нейтральных аминокислотных остатков, добавлен к N-концу молекулы апротинина. Кроме того, пептид, состоящий в основном из одного или более отрицательно заряженных или нейтральных аминокислотных остатков добавлен к С-концу молекулы апротинина. Кроме того, в до полнение к модифицированию за пределами участка связывания протеазы, он модифицирован путем замещения одного или более аминокислотных остатков на участке связывания протеазы на один или более других аминокислотных остатков, соответственно, за исключением таких аналогов апротинина, в которых аминокислота в положении 1 или аминокислоты в положении 1 и 2 были удале ны, lle в положении 19 замещена другим природным аминокислотным остатком, Lys в положении 41 замещена другим природным аминокислотным остатком, или Arg в положении 42 замещена Lys или Ser, и в которых Gly в положении 12 замещена другим природным аминокислотным остатком, Pro в положении 13 замещена другим природным аминокислотным остатком, Cys в положении 14 замещена другим природным аминокислотным остатком, Lys в положении 15 замещена Arg, Val, Thr, lle, Leu, Phe, Gly, Ser, Met, Trp, Туг или Ala, Ala в положении 16 замещена Gly, Arg в положении 17 замещена другим природным аминокислотным остатком, lle в положении 18 замещена Leu, Met, Val или Phe, или Cys в положении 38 замещена другим природным аминокислотным остатком. Кроме того, аналог апротинина имеет общую формулу II R1 Asp Phe Cys Leu Glu Pro Pro R 2 Thr Gly Pro Cys R 13 R14 R15 R16 R17 R3 Tyr Phe Tyr R4 Ala R5 Ala Gl y Leu Cys R6 Thr Phe R18 Tyr R19 Gl y C ys R 20 R7 R8 R9 Asn R10 Phe R11 Ser Ala Glu Asp Cys Met R12 Thr C ys Gly Gl y Ala (II) в которой R1- R12 определены выше, R13 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Lys, Arg, Glu, Leu, Met, Tyr и Phe, R14 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Ala и Gly, R15 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Arg, Ala, Gl y, Lys, Leu, Met, Phe, Tyr, Ile и Asn, R16 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Ilе, Met, Leu, Phe, Thr и Glu, R17 представляет собой аминокислотный остаток, выбранный из группы, состоящей из lle , Leu, Lys, Gln, Glu, Ser, Arg, Thr и Asn, R18 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Val, Thr, Leu, Ser, Tyr, Gln, His, Pro, Phe, Asn, lle и Lys, R19 представляет собой аминокислотный оста ток, выбранный из группы, состоящей из Gly, Thr и Ser, и R20 представляет собой аминокислотный остаток, выбранный из группы, состоящей из Gln, Lys, Met, Asn, Leu, Gly и Glu, при условии, что по меньшей мере один из аминокислотных остатков R1-R12 и по меньшей мере один из аминокислотных остатков R13- R20 являются отличными от соответствующего аминокислотного остатка нативного апротинина, и, когда R 1 является водородом, R15 не является Ala, R17 не является Glu, и R9 не является Ser, а, когда R15 является Ala, R 9 не является Ser. Кроме того, R1 представляет собой Glu-Pro, R 5 представляет собой Glu, R8 представляет собой Glu, R11 представляет собой Glu, a R2, R3, R4, R6, R7, R9, R10 и R12 являются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R1 представляет собой Glu-Pro, R9 представляет собой Glu, R11 представляет собой Glu, a R2, R3, R4, R6, R7, R8, R10 и R12 являются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R9 представляет собой Glu, R11 представляет собой Glu, a R1, R2, R3, R4, R5 , R6 , R7, R8, R10 и R12 являются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R2 представляет собой Ser, R4 представляет собой Asp, R5 представляет собой Thr, R6 представляет собой Glu, R8 представляет собой Asn, R12 представляет собой Glu, а R1, R3, R7, R9, R10 и R11 являются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R2 представляет собой Ser, R3 представляет собой Leu, R7 представляет собой Gly, R8 представляет собой Asn, R3 представляет собой Gly, R11 представляет собой Туг, a R1, R4, R5, R6 и R12 являются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R1 представляет собой водород, 9 R представляет собой Ser, R11 представляет собой Glu, a R2, R3, R4, R5, R6 , R7, R8 , R10 и R12 являются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R1 представляет собой водород, 9 R представляет собой Ser, R11 представляет собой Ala, a R2, R3, R4 , R5, R6, R7 , R8, R10 и R12 являются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R1 представляет собой водород, 2 R представляет собой Ser, R4 представляет собой Asp, R5 представляет собой Thr, R6 представляет собой Glu, R8 представляет собой Asn, R12 представляет собой Glu, a R3, R7, R9, R10 и R11 являются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R1 представляет собой водород, 4 R представляет собой Asp, R5 представляет собой Thr, R6 представляет собой Glu, R12 представляет собой Glu, a R2, R3, R7, R8, R9, R10 и R11 яв 5 34422 ляются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R1 представляет собой водород, 2 R представляет собой Ser, R7 представляет собой Gly, R8 представляет собой Asn, R9 представляет собой Gly, R12 представляет собой Glu, a R3, R4, R5, R6, R10 и R11 являются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R1 представляет собой водород, 9 R представляет собой Ser, R12 представляет собой Glu, a R2, R3, R4, R5, R6 , R7, R8 , R10 и R11 являются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R1 представляет собой водород, 9 R представляет собой Glu, R12 представляет собой Glu, a R2, R3, R4, R5, R6 , R7, R8 , R10 и R11 являются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R1 представляет собой водород, 5 R представляет собой Glu, R9 представляет собой Ser, R12 представляет собой Glu, a R2, R3 , R4, R6, R7, R8, R10 и R11 являются такими же самыми, как и в последовательности нативного апротинина. Кроме того, R1 представляет собой водород, R5 представляет собой Glu, R9 представляет собой Glu, R12 представляет собой Glu, a R2, R3 , R4, R6, R7, R8, R10 и R11 являются такими же самыми, как и в последовательности нативного апротинина. В основу изобретения также поставлена задача создания структуры ДНК, которую можно было бы использовать в настоящем изобретении. Поставленная задача достигается тем, что в структуре ДНК, содержащей последовательность ДНК, согласно изобретению, указанная последовательность обладает способностью кодировать аналог апротинина, указанный выше. В основу изобретения также поставлена задача создания рекомбинантного экспрессирующего вектора, который можно было бы использовать в настоящем изобретении. Поставленная задача достигается тем, что в рекомбинантном экспрессирующем векторе, содержащем структуру ДНК, согласно изобретению, указанная структура содержит последовательность ДНК, которая обладает способностью кодировать аналог апротинина, указанный выше. В основу изобретения поставлена также задача создания культуры клеток Sacharomyces cerevisiae, которую можно было бы использовать в настоящем изобретении для экспрессии аналога апротинина. Поставленная задача достигается тем, что культура клеток Sacharomyces cerevisiae, согласно изобретению, содержит экспрессирующий вектор, указанный выше. В основу настоящего изобретения также поставлена задача разработки способа получе ния аналога апротинина. Поставленная задача достигается тем, что в способе получения аналога апротинина, согласно изобретению,культи вируют культуру клеток Sacharomyces cerevisiae в условиях, позволяющих экспрессию аналога апротинина, а получае мый при этом аналог извлекают из культуры. В основу настоящего изобретения также поставлена задача разработки фармацевтической композиции, содержащей аналог апротинина. Поставленная задача достигается тем, что фармацевтическая композиция, содержащая биологически активное вещество вместе с фар мацевтически приемлемым носителем или разбавителем, согласно изобретению, в качестве биологически активного вещества содержит аналог апротинина, указанный выше, в фар мацевти чески эффективном количестве. В настоящем описании термин "уменьшенный положительный суммарный заряд" используется при рассмотрении аналогов с положительным суммарным зарядом меньшим, чем у нативного апротинина (который имеет положительный сум марный заряд, равный +6), а также не имеющи х сум марного заряда или имеющи х о трицательный суммарный заряд. Следуе т отмети ть, что сум марный заряд апротинина может изменяться с изменением рН, а также то, что тер мины "положительный суммарный заряд", "отрицательный суммарный заряд", "по ложительно заряженный" или "отрицательно заряженный" используются по отношению к заряду молекулы при нейтральном рН. Термин "участок для связывания протеазы" введен для указания аминокислотных остатков, имеющих важное значение для подавления протеазы, т. е. аминокислотных остатков, находящихся в тесном контакте с протеазой за счет сцепления с аминокислотными остатками, находя щимися на активном участке фермента или вблизи него. В настоящее время под ними подразумеваются (и как они определяются в данном описании) аминокислотные остатки в положениях 12-18 и 34-39. Представляется предпочти тельным удалить, ввести или заменить аминокислотные остатки, расположенные вне участка для связывания протеазы только для того, чтобы избежать существенного изменения характера подавления протеазы аналога, являющего ся предметом изобретения, по сравнению с контуром подавления протеазы нативного апротинина. Неожиданно было обнаружено, что аналоги апротинина с уменьшенным положительным суммарным зарядом имеют значительно меньшую нефротоксичностъ, чем нативный апротинин. Одной из причин меньшей нефротоксичности может быть то, что аналоги апротинина с меньшим положительным суммарным зарядом обладают уменьшенным сродством по связыванию на поверхности проксимальных трубочек (щеточная граничная мембрана), так что они в значительной степени выделяются в мочу. Это объяснение совпадает с открытиями, сделанными Г. Фритцем и др., которые утверждают, что хи мически модифицированные производные апротинина (тетрамалеоиловые и пентамалеоиловые производные), которые являются менее основными, чем нативный апротинин, не связываются со щеточной граничной фракцией, а в большом количестве выделяются в мочу. С другой стороны, химически модифицированный апротинин резко отличается от апротинина и других нативных белков тем, что он содержит производные аминокислот, которые не обнаружи 6 34422 ваются в каких-либо естественно существующих макромолекулах. Таким образом, не следует принимать в расчет возможность того, что отсутствие накопления в почках хи мически модифи цированных производных может быть приписано измененным свойствам модифи цированных производных, отличным от уменьшенного положительного суммарного заряда. Было обнаружено, что другие пепти ды связываются со щеточной границей с меньшим сродством и способностью, чем апротинин, несмотря на содержание положительно заряженных аминокислот и/или на наличие положительного суммарного заряда. Это указывает на то, что по ложительный суммарный заряд апротинина является не единственным объяснением связывания и накопления апротинина в проксимальных трубчатых клетках (М. Just et al., Ist. Symp. Physiol., Prop. Pharmacol. Ration.: Kininogenases, Schattauer, Stuttgart 1973, pp. 1163-1167). Кроме того, неожиданно было обнаружено, что аналоги апротинина с уменьшенной термостойкостью не накапливаются в ткани почек в той же мере, что и нативный апротинин. Как было показано выше, тре хмерная структура апротинина является очень компактной, что позволяет предположить высокую устойчивость ингибитора к денатурации и протеолитическому расщеплению. Таким образом, накопление апротинина в почках может быть также результатом экстраординарной устойчивости апротинина. Отсюда следует возможность того, что замещение одного или более остатков аминокислот в молекуле апротинина может привести к образованию аналогов апротинина с уменьшенной по сравнению с природной молекулой стабильностью. В контексте настоящего описания "уменьшенная стабильность" может, для определенных целей, выражаться как уменьшенная термоустойчивость аналога в водных растворах при рН, равном приблизительно 4-10. В организме влияние такой уменьшенной стабильности может выражаться в том, что аналог будет более податлив к расщеплению, т.е. к протеолитическому расщеплению, приводящему к более быстрому удалению аналога из проксимальных трубочек. В настоящее вре мя считают, что уменьшенная нефротоксичность аналогов, со гласно изобретению, может быть обусловлена комбинацией уменьшен ного положительного суммарного заряда и уменьшенной устой чивости молекулы. Причиной, способствующей нанесению вреда почкам, вытекающей из применения нативного апротинина, может являться то, что апротинин накапливается на клубочковых мембранах из-за сродства отрицательно заряженных структур, расположенных на поверхности мембраны. Это может привести к увеличению размера пор клубочка и, следовательно, к увеличению проницаемости для молекул большего размера, например альбумина, что, в свою очередь, может привести к белковой перегрузке почек. Вероятно, аналог апротинина, согласно изобретению, может оказывать менее вредное влияние на размеры пор клубочковой мембраны, чем нативный апротинин благодаря меньшему сродству отрицательно заряженных структур на этой мембране. Кроме того, в не которых случаях наблюдалось, что применение апротинина приводит к анафилактоидной реакции. Была выдви нута гипотеза, что указанная анафилактоидная реакция связана с выделением гиста мина, что может быть спровоцировано положительным суммарным зарядом апротинина. Поэтому, предполагают, что указанная анафилактоидная реакция, вероятно, связана с применением нативного апротинина и может быть уменьшена или даже исключена за счет применения аналогов апротинина согласно изобретению. Согласно изобретению, любые положительно заряженные аминокислотные остатки, расположенные за пределами участка для связывания протеазы, могут быть замещены либо отрицательно заряженными аминокислотными остатками Glu или Asp, либо каким-либо одним из остатков нативных аминокислот Ala, Cys, Phe, Gly, His, Ile, Leu, Met, Asn, Pro, Glu, Ser, Thr, Val, Thr или Туг. Однако во избежание получе ния инертных аналогов или аналогов с неподходящей трехмерной структурой, возникающих из-за нежелательной укладки молекулы, предпочти тельным является выбор замещений, являющи хся идентичными аминокислотным остаткам в соответствующи х положениях др угих инги биторов протеазы или в областях бо лее крупных струк тур , обладающи х высокой степенью гомологии по отношению к нативному апротинину. Др угими словами, выбор замещающи х аминокислотных остатков преимущественно основан на анализе молекул, гомологенных апротини ну. Следуе т отметить, что совместно с заменой(ами) аминокислоты, которая непосредственно приводит к уменьше нию положительного сум марного заряда, может быть проведе на одна или более замен других аминокислот, что са мо по себе не приводит в ре зультате к уменьшению положительного суммарного заряда, но может тре боваться для получения активного аналога с соответствующей тре хмерной структурой. Таким образом, в более конкретном случае настоящее изобретение относится к аналогу апротинина, который имеет общую формулу 1: R1 Asp Phe Cys Leu Glu Pro Pro R 2 Thr Gly Pro Cys Lys Ala Arg lle lle R 3 Tyr Phe Tyr R4 Ala R5 Ala Gly Leu Cys R6 Thr Phe Val Tyr Gl y Gl y C ys Arg R7 R8 R9 Asn R 10 Phe R11 Ser Ala Glu Asp Cys Met R12 Thr C ys Gly Gl y Ala (I) где R1 - дипептид, выбранный из группы, содержащей Arg-Pro, Glu-Pro, Asp-Pro, Ala-Pro, lle-Pro, ThrPro, His-Pro, Leu-Pro, Gly-Pro, Ser-Pro, Pro или пептидная связь, R2 - аминокислотный остаток, выбранный из груп пы, содержащей Туг, Glu, Asp, Ser, Thr, Ala, Val, R3 - аминокислотный остаток, выбранный из груп пы, содержащей Arg, Glu, Asp, Leu, Ser, Ala, Gln, Thr, R4 - аминокислотный остаток, выбранный из груп пы, содержащей Asn, Glu и Asp, R5 - аминокислотный остаток, выбранный из груп пы, содержащей Lys, Glu, Asp, Thr, Val, Ala, Ser, Phe, Gln и Gly, R6 - аминокислотный остаток, выбранный из груп пы, содержащей Gln, Glu, Аsр, Val, Ala, 7 34422 R7 - аминокислотный остаток, выбранный из груп пы, содержащей Ala, Аsр, Glu и Gly, R8 - аминокислотный остаток, выбранный из груп пы, содержащей L ys, Glu, Asp, Asn, Ser, Thr и Ala, R9 - аминокислотный остаток, выбранный из груп пы, содержащей Arg, Glu, Asp, Ser, Asn, Leu, Gly, Gln; Met и Thr, R10 - аминокислотный остаток, выбранный из группы, содержащей Asn, Glu и Asp, R11 - аминокислотный остаток, выбранный из группы, содержащей Lys, Glu, Asp, Leu, Туг, Ala, Val, Thr, Ser, Pro, His и lle, и R12- аминокислотный оста ток, выбранный из груп пы, содержащей Arg, Glu, Asp, Gln, Аla, Asn, His, Gly, Ser и Thr, при условии, что по меньшей мере один из аминокислотных остатов R1-R12 отличается от соответствующего аминокислотного остатка aпpoтининa. Помимо этих вн утренних замен в молекуле апротинина возможно добавление пептида, содержащего ОДИН или более отрицательно заряженных аминокислотных остатков (т.е. Glu или Asp) на Nили С-терминальном конце молекулы апротинина для обеспечения требуемого уменьшения положительного суммарного заряда. Кроме того, для уменьшения стабильности молекулы возможно добавление к N- или С-терминальному концу молекулы одного или более нейтральных аминокислотных остатков. Такие добавки могут осуществляться либо к молекуле нативного апротинина, либо дополнительно к другим модификациям, как это указано выше. R14 - аминокислотный остаток, выбранный из группы, содержащей Ala и Gl y, R15 - аминокислотный остаток, выбранный из группы, содержащей Arg, Ala, Gly, Lys, Leu, Met, Phe, Tyr, Ile и Asn, R16 - аминокислотный остаток, выбранный из группы, содержащей Ilе, Met, Leu, Phe, Thr и Glu, R17- аминокислотный оста ток, выбранный из груп пы, содержащей lle, Leu, Lys, Gln, Glu, Ser, Arg, Thr и Asn, R18 - аминокислотный остаток, выбранный из группы, содержащей Val, Thr, Leu, Ser, Туг, Gln, His, Pro, Phe, Asn, Ile и Lys, R19 - аминокислотный остаток, выбранный из груп пы, содержащей Gly, Thr, и Ser, и R20 - аминокислотный остаток, выбранный из группы, содержащей Gln, Lys, Met, Asn; Leu, Gly и Glu, при условии, что по меньшей мере один из аминокислотных остатков R1 - R12 и по меньшей мере один из аминокислотных остатков R13 - R20 отличаются от соответствующего аминокислотного остатка нативного aпротининa. Примеры наиболее предпочти тельных аналогов апротинина, известных в настоящее время, с общей формулой (І): аналог, в котором R1 является Glu-Pro, R 5 - Glu, R8 - Glu, R11 - Glu, a R2, R3, R4, R6 , R7, R9 , R10 и R12 - та кие же, как и в последовательности нативного апротинина; или аналог, в котором R1 является Glu-Rro, R5- Glu, R 8Glu, R 11 - Glu, a R2, R3 R4, R6, R7, R9, R10 и R12 - такие, же как и в последовательности нативного апротинина; или в котором R9 является Glu, R11 Glu, a R1, R2, R3 , R4, R5 , R6, R7, R8 , R10 , R12 - та кие же как, и в последовательности нативного апротинина; или в котором R2 является Ser, R4 - Asp, R5 - Thr, R6 - Glu, R 8 - Asn, R12- Glu, a R1, R3, R7, R9, R10 и R11 - такие же, как и в последовательности нативного апротинина; или в котором R2 является Ser, R3 - Leu, R7 - Gly, R8 - Asn, R9 - Gly, R10-GIn, R11- Tyr, a R1, R4, R5 , R6 и R12 - та кие же, как и в последовательности нативного апротинина; или в котором R1 является пептидной связью, R9 - Ser, R11 - Glu, a R2, R3, R4 , R5, R6 , R7, R8, R 10 и R12 - такие же, как и в последовательности нативного апротинина; или в котором R1 является пептидной связью, R9 -Ser, R 11- Ala, и R2, R3, R 4, R5 , R6 , R7 , R8, R10 и R12 такие же, как и в последовательности нативного апротинина; или в котором R1 является пептидной связью, R2 - Ser, R4 - Asp, R5 - Thr, R6 Glu, R 8 - Asn, R12- Glu и R7 , R9, R10 и R11 - такие же, как и в последовательности нативного апротинина; или в котором R1 является пептидной связью, R4 -Asp, R5 - Thr, R6 - Glu, R12 -Glu, и R2, R3, R7, R8, R9, R10 и R11- такие же, как и в последовательности нативного апротинина; или в котором R1 является пептидной связью, R2 - Ser, R7 - Gly, R8 -Asn, R 9 - Gly, R 12- Glu и R3, R4, R 5, R 6 R10 и R11 такие же, как и в последовательности нативного апротинина; или в котором R1 - является пептидной связью, R 9 - Ser, R 12- Glu, и R2, R3, R4, R5, R 6, R 7, R8, R10 и R11- такие же, как и в последовательности нативного апротинина; или в котором R1 является пептидной связью, R9 - Glu, R12- Glu, и R2, R3, R4, R5, R6, R7, R8, R10 и R11 - такие же, как и в последовательности нативного апротинина; или в Если необхо димо изменить свойства аналога апротинина, касающиеся подавления протеазы, помимо уменьше ния его нефротоксичности, возможна дополнительная модифи кация аналога на участке для связывания протеазы. Например, ранее было показано (см. H.R. Wenzel and H. Tschesche, Angew. Chem. Internat. Ed.20, 1981, p.295), что апротинин (1-58, Val15) обнаруживает относительно высокую избирательность для гранулоцитной эласта зы и ингибирующее действие на коллагеназу, апротинин (1-58, Аlа15) оказывает слабое действие на эластазу, а апротинин (1-58, Glu15) показывает очень высокую антитрипсиновую активность, а также неожиданно ингибирует калликреин. Более того, имеется возможность изменить ингибирующее действие апротинина одновременно с уменьше нием положительного суммарного заряда путем замещения одной или более положительно заряженной аминокислоты на участке связывания протеазы нейтральной или отрицательно заряженной аминокислотой(ами). Таким образом, настоящее изобретение кроме того относится к аналогу апротинина, который имеет общую формулу II R1 Asp Phe Cys Leu Glu Pro Pro R 2 Thr Gly Pro Cys R 13 R14 R15 R16 R17 R3 Tyr Phe Tyr R4 Ala R5 Ala Gl y Leu Cys R6 Thr Phe R18 Tyr R19 Gl y C ys R 20 R7 R8 R9 Asn R10 Phe R11 Ser Ala Glu Asp Cys Met R12 Thr C ys Gly Gl y Ala (II) где R1 - R12 соответствуют определенным ранее, R13 - аминокислотный остаток, выбранный из группы, содержащей Lys, Arg, Glu, Leu, Met, Туr и Phe, 8 34422 котором R1 является пептидной связью, R5 - Glu, R9 - Ser, R 12 - Glu и R2, R3, R4, R6, R7, R8, R10 и R11 такие же, как и в последовательности нативного апротинина; или в котором R1 является пептидной связью, R5 - Glu, R9 - Glu, R12- Glu, a R2, R3, R4, R6, R7, R8, R10 и R11 - та кие же, как и в последовательности нативного апротинина. В другом аспекте изобретение относится к созданию ДНК, кодирующей аналог апротинина согласно изобретению. Создание ДНК согласно изобретению может быть осуществлено с помощью стандартных способов, например, способом фосфоамидирования, описанным в S.L. Beaucage and М. Н. Caruthers, Tetrahedron Letters 22, pp. 1859-1869, или способом, описанным: Matthes et al; EMBO Journal 3,1984. p.801. В соответствии со способом фосфоамидирования олигонуклеотиды синте зируются, например, в автоматическом синтезаторе ДНК, очищаются, ренатурируются, лигируются и клонируются в соответствующих векторах. В ином случае возможно использование ге номного кодирования или кодирования кДНК для нативного апротини на (например, полученного скринингом ге номной библиотеки или библиотеки фрагменто в кДНК, используя синтетические олиго нук леотидные пробы) и мо дифицированного на одном или более участках, соответствующи х участку(ам), на ко торы х желате льно провести за мены аминокислот, например, путем направленного мута ге неза, используя синте тические олиго нуклео тиды, ко дирующие желатель ную после дователь ность аминокислот для го мологенной рекомбинации в соотве тствии с из вестными процедурами. Еще в одном аспекте изобретение относится к рекомби нантному эксп рессирующему векто ру, который содержит струк туру ДНК, создавае мую со гласно изобретению. Ре комбинантный экспрессирующий вектор может представлять собой любой вектор , который удобно использова ть для процедур ре комбинации ДНК, при этом вы бор век тора часто за висит от клетки-хо зяина, в ко тор ую он должен быть вве ден. Та ким образом, вектор может представлять собой автономно воспроизводящий ся вектор , т.е. вектор, существующий как вне хромосомный орга низм, воспроизведение которого не зависи т от хро мосомного восп роизве дения, например, плазмида. В др угом случае, век тор может быть та ким, что при вве дении в кле тку-хо зяин он объединяется с ге номом клетки-хо зяина и воспроизводится вместе с хро мосомой(ами), с которы ми он объединился. В векторе последовательность оснований в ДНК, кодирующая аналог апротинина согласно изобретению, должна быть операбельно соединена с соответствующей последовательностью промотора. Промотор может представлять собой любую последовательность оснований в ДНК, которая обнаруживает транскрипционную активность в клетке-хозяине выбора и может быть извлечена из генов, кодирующи х белки либо гомологенных, либо гетерологенных клетке-хозяину. Примерами подхо дящих промоторов для направления транскрипции ДНК, кодирующей аналог апротинина согласно изобретению в клетках млекопитаю щи х, могут служить промотор SV 40 (Subramani et al., Mol . Cell Biol, 1, 1981, pp. 854-064), промотор MT-I (металлотио новые ге ны) (Palmiter et al. , Science 222, 1983 , pp. 809-814) или промотор для позднего белка аденовируса 2-го типа. Подхо дящими промоторами для использования в дрожжевых клетках хозяина являются промоторы из дрожжевых гли колитических ге нов (Hitzeman et al., J. Biol. Chem. 255, 1980, pp. 1207312080; Alber and Kawasaki, J. Mol. Appl. Gen. 1, 1982, pp. 419-434) или спиртовых де гидрогеназных генов (Young et al., Genetic Engineering of Microorganisms for Chemicals (Hollaender et al, eds.) Plenum Press, 1982) или промоторы ТРII /us 4, 599, 311/ или ADH2-4c (Russell et al., Nature 304,1983, pp. 652 - 654). Подходящими промоторами для использования в клетках-хозяевах во локнистых грибков являются, например, промотор ADH3 (McKnight et al., The EMBO J. 4,1985, pp. 20932099) или промотор tpiA. Последовательность оснований в ДНК, кодирующая аналог апротинина, согласно изобретению, может быть также операбельно соединена с подхо дящим терминатором, таким как терминатор гормона роста человека (Palmiter et al., op. cit) или (для грибковых хозяев) промотором TPI 1 (Alber, Kawasaki, op. cit.) или промоторами ADH3 (McKnight et al., op. cit.). Вектор, кроме того, может содержать такие элементы как сигналы полиаденилирования (например, из промотора SV 40 или из области аденовируса 5 E1b), транскрипционные последовательности ге нов-усилителей (например, ген-усилитель SV 40) и трансляционные последовательности ге нов-усилителей (например, последовательности, кодирующие аденовирус VA RN As). Рекомбинантный экспрессирующий вектор, согласно изобретению, может, кроме того, содержать последовательность оснований в ДНК, позволяющую вектору воспроизводиться в клетке-хозяине, которая исследуется. Примерами такой последовательности (когда клетка-хозяин является клеткой млекопитающего) являются область начала репликации SV 40, или (когда клетка-хозяин является дрожжевой клеткой) гены репликации REP 1-3 дрожжевой плазмиды 2 и область начала репликации. Вектор может содержать также отобранный маркер, например, ген, продукт которого дополняет дефект клетки-хозяина, такой как ген, кодирующий дигидрофолатредук тазу (DHFR) или ген, который обеспечивает стойкость к лекарству, например, к неомицину, гигромицину или метотрексату, или ген TPI Schizosaccharomyces pombe (описанный P.R. Russell, Gene 40, 1985, pp. 125-130. Ме тоды, используемые для лигирования последовательностей оснований в ДНК, кодирующих аналог апротинина, согласно изобретению, промотор и терминатор, соответственно, и для введения их в подходящие векторы, содержащие информацию, необхо димую для воспроизве дения, хо рошо известны специалистам в этой области (см., например, Sambrook et aI., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, New York, 1989). 9 34422 Клеткой-хозяином, в которую вво дится экспрессирующий вектор, согласно изобретению, может быть любая клетка, которая способна вырабатывать аналог апротинина, согласно изобретению и преимущественно является эукариотической клеткой, например, клеткой млекопитающи х, дрожжевой или грибковой клеткой. Дрожжевым организмом, используемым в качестве клетки-хозяина, согласно изобретению, может быть любой дрожжевой организм, который в хо де культи вации вырабатывает большое количество аналога апротинина, согласно изобретению. Примерами подходящих дрожжевых организмов являются штаммы дрожжевых ви дов Saccharomyces cerevisiae, Saccharomyces kluyveri, Schizosaccharomyces pombe, Saccharomyces uvarum. Трансфор мация дрожжевых клеток может осуществляться за счет протопласто вой формации, за которой следуе т трансформация как таковая. Примерами подхо дящих линий клеток млекопитающи х являются COS (АТСС CRL 1650), ВНК (АТСС CCL 1632, АТСС CCL 10) или СНО (АТСС CCL 61). Способы трансфекции клеток млекопитающи х и экспрессии последовательностей оснований в ДНК, введенных в клетки, описаны, например, в Kaufman and Sharp, J. Mol. Bid. 159, 1982, pp. 601-621; Southem and Berg, J. Mol. Appl. Genet. 1, 1982, pp. 327-341; Loyter et al., Proc. Natl. Acad. Sci. USA 79, 1982, pp. 422-426; Wigler et al., Cell 14, 1978, p. 725; Corsaro and Pearson, Somatic cell Genetics 7, 1981, p. 603, Graham and van der Eb, Virology 52, 1973, p. 456; Neumann et aI., Embo J. 1, 1982, pp. 841-845. С другой стороны, грибковые клетки могут быть использованы в качестве клеток-хо зяев, согласно изобретению. Примерами подхо дящих грибковых клеток являются клетки гифомицет, например, Aspergillus spp. или Neurospora spp., в частности, штаммы Aspergillus oryzae или Aspergillus niger. Использование Aspergillus spp. для экспрессии белков описано, например, в патенте ЕР 272 277. Настоящее изобретение кроме того относится к способу получения аналога апротинина, являющегося предметом изобретения, при этом способ включает выращивание клетки, как описано выше, в условиях, бла гоприятных для экспрессии аналога апротинина, и восстановление аналога, получен ного из культуры. Средой, используемой для выращивания клеток, может являться любая обычная среда, подхо дящая для культи вирования клеток млекопитающи х или дрожжевых организмов в зависимости от выбора клетки-хозяина. Аналог апротинина выделяется клетками-хозяевами в питательную среду и может восстанавливаться из нее с помощью обычных процедур, включая сепарацию клеток из среды путем центрифуги рования или фильтрации, осаждение белковых компонентов надосадочной жидкости или фильтрата посредством соли, например, сульфата аммония, очищение при помощи различных хро матографических методов, например, ионообменной хроматографией или аффинной хроматографией или методов аналогичных им. Настоящее изобретение также относится к фармацевтической композиции, содержащей аналог апротинина, созданый согласно изобретению, совместно с фармацевтически приемлемым носителем или наполнителем. В композицию, создаваемую согласно изобретению, аналог апротинина может вводиться любыми установленными способами приготовления фармацевтических композиций, например, как это описано в Remington's Pharmaceutical Sciences, 1985. Обычно композиция может изготавливаться в ви де, пригодном для общей инъекции или вливания, и может, как таковая, быть приготовлена со стерильной водой или изотоническим раствором или с раствором глюкозы. Кро ме того , настоя щее изо бретение о тносится к использовани ю анало га ап ротин и на, получен ного согласно изоб ретению, для изгото вления ле карства с умень шен ной по сравнению с на тивным апротини ном нефроток сичностью и /и ли ле карства , ко торое при прие ме обуславли вае т умень шен ное чи сло ана фи лактоидны х реак ций по сравнению с числом та ких реакций при использовании на ти вного ап ротини на. Как указывалось вы ше , было обнар ужено, что на тивный апротинин, принимаемый в дозах, приближающи хся к клиническим, оказывает вредное влияние на почки. Это т эффек т может быть обусловлен чрезвы чайно вы сокой устой чивостью и относите льно высоким положительным суммарным зарядом молекулы апротини на. Таким образом, можно счи тать, что аналог апротини на, созданный согласно изобретению, является благоприятным для использования в терапевти ческих целях, где предполагается использование на тивного ап ротинина, в частности, там , где тре буются его боль шие до зы. Терапевти ческие назначения, для которы х аналог апротинина, создан ный согласно изобретению, используется бла года ря своему свойству подавлять протеазы серина челове ка, например, трипсин, плаз мин, калликреин, эласта зу и катепсин G, включают (но не ограничиваются этим) острые панкреати ты, воспаления, тромбоцитопению, со хранение функ ции тромбоцито в, защи ту ор га нов, ле чение ран, шок (вк лючая поражение легких) и условия, при ко торы х возникает ги пер-фибринолитическое крово те чение. Большая до за апротини на назначается при или после операций с искусственным кровообращением; та ким образом, меньшая нефротоксичность рассматривае мого аналога ап ротини на предста вляет особый инте рес для указанного назначения и воз можна для др уги х хи рур гических операций, связанных (в основном) с потерей крови , поскольку это уменьшае т ве роятность вызва ть ана фи лактоидную реакцию, что обусловлено меньшим по ложитель ным сум марным зарядом аналога. Настоящее изобретение дополнительно поясняется следующими примерами со ссылкой на прилагаемые графические материалы, где: Фиг.1 - структура гена синтетического апротинина из олигонуклеотидных последовательностей; Фиг. 2 - конструкция плазмиды pKFN-1503; 10 34422 Фиг. 3 - диаграмма, показывающая ингибирующую активность в моче и почках после применения аналогов апротинина с различными суммарными зарядами и термоустойчивостью; Фиг. 4 - ингибирующая активность в моче спустя 3 часа после приема аналогов апротинина с различными суммарными зарядами; Фиг. 5 - ингибирующая активность в почках спустя 3 часа после приема аналога апротинина с различной термоустойчивостью; и Фиг. 6 - на копление ингибирующей активности в почках после приема аналогов апротинина с различной термоустойчивостью. Показатель накопления рассчитывается путем деления ингибирующей активности спустя 3 часа после приема на ингибирующую активность спустя 1 час после приема. Настоящее изобретение дополнительно иллюстрируется следующими примерами, которые не ограничивают объем заявляемого изобретения. Пример 1. Получение [Glu1, Glu26, Glu41. Glu46]-апротинина из дрожжевого штамма KFM –1512. Синтетический ген, кодирующий [Glu1, Glu26, Glu41, Glu46]-апротинин, был создан из 10 олигонуклеотидов с помощью лигирования. Олигонуклеотиды были синтезированы на автоматическом синтезаторе ДНК, используя фосфо рамидитную хи мию на пористой стеклянной подложке (Beaucage, S.L, Caruthers, M.H., Tetrahedron Letters 22, (1981) 1859-1869). Были синтезированы следующие 10 олигонуклеотидов: NOR-1948: CATGGCTGAGAGATTGGAGAAGAGAGAGCCTGATTTCTGTTTGGAACCT CCATACACTGGTCC NOR -1947: TTACATGGACC AGTGTATGGAGGTTCC AAACAGAAATC AGGCTCTCTCT TCTCCAATCTCTC AGC NOR-354 : ATGTAAAGCTAGAATCATCAGATACTTCTACAACG NOR-1939:TTCGGCGTTGTAGAAGTATCTGATGATTCTAGCT NOR-1938:CCGAAGCTGGTTTGTGTCAAACTTTCGTTTACGGTGGCT NOR- 357: CTCTGCAGCCACCGTAAACGAAAGTTTGAC AC AAACCAGC NOR-1940: GCAGAGCTGAAAGAAAC AACTTCGAAT NOR-1949: AGC AGATTCGAAGTTGTTTCTTTC AG NOR- 360: CTGCTGAAGACTGC ATGAGAACTTGTGGTGGTGCCTAAT NOR- 361: CTAGATTAGGC ACCACC ACAAGTTCTC ATGC AGTCTTC Как показано на фиг. 1, из вышеуказанных 10 олигонуклеотидов были образованы 5 дуплексов А - Е. 20 пмолей каждого из дуплексов А-Е были образованы из соответствующи х пар 5'-фосфорилированных олигонуклеотидов путем нагрева в течение 5 минут при температуре 90оС с последующим охлаждением до комнатной температуры в течение 75 минут. Пять дуплексов были смешаны и обработаны ДНК-лигазой фага Т4. После электрофореза лигирующей смеси на 2% геле агарозы синтетический ген был изолирован в виде полосы, соответствующей размеру 203 bp*. Получен ный синтетический ген показан на фиг.1. Синтетический ген был лигирован с фрагментом EcoRI-Ncol с размером 209 bp из pLaC212spx3 и с фрагментом EcoRI-Xbal с размером 2,8 Kb плазмиды pTZI9R (Mead.D.A., Szczesna-Skorupa, Е. and Kemper, В., Prot. Engin. 1 (1986.) 67-74). Плазмида pLaC212spx3 описана в примере 3 международной заявки № РСТ/DKK88/00147. Фрагмент EcoRI - Ncol с размером 209 bp из плазмиды pLaC212spx3 кодирует синте тический дрожжевой лидерный пептид. Лигирующая смесь использовалась для трансфор мации компетентного штамма E.coli (г-, m +), отобранного по его устойчивости к ампицилину. Расшифровка последовательности ДНК (Sanger, F., Micklen, S., and Coulson, A.R., Proc. Natl. Acad. Sci. USA 74(1977) 5463-5467) показала, что плазмиды из полученных колоний содержали правильную последовательность оснований в ДНК для /Glu1, Glu26, Glu41, Glu46/- апротинина. Для дальнейшего использования была выбрана плазмида pKFN-1503. Конструкция указанной плазмиды показана на фиг. 2. pKFN-1503 была разрезана EcoRI и Xbal и фрагмент с размером 412 bp был лигирован с фрагментом Ncol-Xbal с размером 9,5 kb из плазмиды рМТ636 и фрагментом Ncol-EcoRI с размером 1,4 kb из плазмиды рМТ636, что привело к получе нию плазмиды pKFN-1508 (см. фиг. 3). Плазмида рМТ636 описана в международной заявке PCT/DK88/00138. Плазмида рМТ6З6 является вектором-челноком относительно Е. coli - cerevisiae, содержащим ген Schizosaccharomyces pombe TPI /POT/ (Russel, P.P., Gene 40 (1985) 125-130), промотор и терминатор изомеразы триозефосфата S. cerevisiae, TPIP TPlT (Alber, Т., Kawasaki, G.J. Mol. Appl. Gen. 1 (1982), 419-434). Плазмида pKFN-1508 содержит следующую последовательность: TPIp - сигнал-лидер LaC212 spx3 (1-47) - Glu Arg Leu Glu Lys Arg [Glu1, Glu26, Glu41, Glu46] апротинин - TPlT, где сигнал-лидер LaC212spx3 является синте тическим дрожжевым лидером, описанным в международной заявке PCT/DK88/00147. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 412 bp из плазмиды pKFN1503 и плазмиды pKFN -1508 показаны в списке последовальностей ID № 1. Штамм S.cerevisiae МТ663 (Е2-7В XEII -36 а/a, tpi / tpi, pep 4-3/pep 4-3) был выращен на YPGaL /1 % дрожжевой бакто экстракт, 2% бакто пептон; 2% галактоза, 1% лактат/ до уровня оптической плотности равной 0,6 при 600 нм. 11 34422 100 мл культуры были собраны путем центрифугирования, промывки водой (10 мл), повторным центрифуги рованием и ресуспендированием в 10 мл раствора, содержащего 1,2 М сор бита, 25 мМ Na2EDTA, pH = 8,0 и 6,7 мг/мл дитиотрейтола. Суспензия была инкубирована в течение 15 минут при температуре 30°С, центрифуги рована, а клетки ресуспендированы в 10 мл раствора, содержащего 1,2 М сорбита, 10 мМ Na2ЕDТА, 0,1 М цитрата натрия, pH = 5,8, и 2 мг Новозима® 234. Суспензия была инкубирована в течение 30 минут при температуре 30oС, клетки отбирались путем центрифугирования, промывались в 10 мл сорбита 1,2 М и 10 мл C AS (1,2 М сор бита, 10 мМ CaCl 2, 10 мМ Tris HCL (Tris = Tris (гидроксиметил)аминометан), рН= 7,5) и ресуспендированы в 2 мл CAS. Для трансфор мации 0,1 мл CAS-ресуспендированных клеток был смешан с приблизительно 1 мкг плазмиды pKFN-1508 и смесь выдерживалась при комнатной температуре в течение 15 минут. Был добавлен 1 мл раствора (20% полиэтиленовый гликоль 4000, 20 мМ CaCI2, 10 мМ СаСl2, 10 мМ Tris HCL, pH = 7,5), после чего смесь выдерживали при комнатной температуре еще 30 минут. Смесь была центрифугирована и гранула ресуспендирована в 0,1 мл SOS (1,2 М сор бита, 33% в объемном отношении Y PD , 6,7 мМ CaCl2, 14 мкг/мл лейцина) и инкубирована в течение 2 часов при температуре 30оС. Затем суспензия была центрифуги рована, а гранула ресуспендирована в 0,5 мл сорбита (1,2 М). Далее 6 мл агара для верхнего слоя (нормальная среда по Шерману и др., (Methods in Yeast Genetics, Cold Spring Harbor Laboratory (1982)), содержащего 1,2 М сорбита и 2,5% агара, были добавлены к суспензии при 52°С и суспензия была налита на верхнюю часть пластин, содержащи х агаризованную твер дую питательную среду, содержащую сорбит. Methods Enzymol. 19 (1970), 844-852 ) и кроме того, интеграцией абсорбции при 280 нм из Е1% 280 (апротинин) = 8,3 С целью получения материала для токсикологических исследований дрожжевой штамм KFN-I5I2 был выращен в большем количестве. Аналог апротинина был очищен с помощью комбинации методов ионообменной хроматографии и жидкостной хроматографии высокого давления (ЖХВД) с обращенной фазой. Пример 2. Получение [Glu1, Glu42, Glu46]апротинина из дрожжевого штамма KFN-1514. Синтетический ген, кодирующий (Glu1, Glu42, Glu46)-апротинин, был сконструирован из 10 олигонуклеотидов путем лигирования, как это описано в примере 1. Производная от pTZ19R плазмида pKFN1505, содержащая синте тический ген, слившийся в рамке считыва ния с синтетическим дрожжевым лидерным пептидом, была сконструирована так, как это описано в примере 1. С помощью процедуры, описанной в примере 1, была получе на дрожжевая экспрессирующая плазмида pKFH-1510, содержащая следующую конструкцию: TPIp-LaC212spx3 сигнал-лидер (1-47)-Glu Arg Leu Glu Lys Arg [Glu1, Glu42, Glu46] апротинин - TPIT. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 412 bp из плазмид pKFN-1505 и pKFN-1510 приводится в списке последовательностей I D № 3. Плазмида pKFN-1510 была трансформирована в дрожжевом штамме МТ663, как это было описано выше, что привело к получению дрожжевого штамма KFN-1514. Культивирование трансформированного штамма KFN-1514 в YPD-среде, анализ [Glu1, Glu42, Glu46]-апротинина в надосадочной жидкости и получе ние материала для токсикологических исследований проводилось, как описано выше. Пример 3. Получение [Glu42, Glu46]-апротинина из дрожжевого штамма KFN-1544. Фрагмент Avall-Xbal с размером 144 bp, кодирующий [Glu42, Glu46]-апротинин (12-58) из плазмиды pKFN-1505, был использован для замещения соответствующего фрагмента ДНК, кодирующего апротинин (12-58) из плазмиды pKFK-1000, что привело к получению плазмиды pKFN-1528. Плазмида pKFN-1000 описана в примера 4 международной заявки с номерoм публикации WO 90/10075. Используя процедуру, описанную в примере 1, была получе на дрожжевая экспрессирующая плазмида pKFN-1541, содержащая сле дующую конструкцию: TPIp-LaC212spx3 сигнал-лидер (1-47) - Glu Arg Leu Glu Lys Arg -[Glu42, Glu46] - апротинин - TPIT. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 412 bp из плазмид pKFK-1528 и pKFN-1541 приводится в списке последовательностей I D № 5. После трех дней выдерживания при температуре 30°С были отобраны колонии трансформированных клеток, повторно выделены и использованы для выращивания жидких культур. Для дальнейшего исследования была выбрана одна такая трансфор мированная клетка. Дрожжевой штамм KFN-1512 был выращен на среде YPD (1% дрожжевой экстракт, 2% пептона (из лаборатории Дифко) и 6% глюкозы). В течение 3 дней 200 мл культуры штамма подвергали встряхива нию при частоте оборотов вибратора 250 об/мин при температуре 30°С до получе ния оптической плотности приблизительно равной 20 при 600 нм. После центрифуги рования надосадочная жидкость была подвергнута анализу с помощью ионообменной хроматографии FPLC (быстрая хроматография белков высокого разрешения). Дрожжевая надосадочная жидкость была отфильтрована через фильтровальное устройство Millex GV с размером пор 0,22 мкм и 1 мл был нанесен на катионоoбменную колонку Monos (0,5 х 0,5 см), уравновешенную 20 мМ муравьиной кислоты, рН 3,7. После промывки равновесным буфером колонка была элюирована линейным градиентом NaCI (0,1 М) в равновесном буфере. Активность ингибитора трипсина определяли в элюированных фракциях путем спектрофото метрического количественного анализа (Kassel, В. , Плазмида pKFN-1541 была трансформирована в дрожжевом штамме МТ663, как это было описано выше, с получением дрожжевого штамма KFN-1544. 12 34422 Культивирoвание трансформированного штамма KFN-1544 в Y PD -среде, анализ [Glu42, Glu46] - апротинина в надосадочной жидкости и получе ние материала для токсикологических исследований осуществлялось так же, как это было описано выше. Пример 4. Получение [Ser10, Asp24, Thr26, Glu31, Asn41, Glu53] - апротинина из дрожжевого штамма KFN-1545. Синтетический ген, кодирующий [Ser10, Asp24, Thr26, Glu31, Asn41, Glu53] - апротинин был сконструирован из 10 олигонуклеотидов путем лигирования, как это описано в примере 1. Производная от pTZI9R ппазмида pKFN1530, содержащая синте тический ген, слившийся в рамке считывания с последовательностью синтетического дрожжевого лидерного пептида, была сконструирована, как это описано в примере 1. Используя процедуру, описанную в примере 1, была получе на дрожжевая экспрессирующая плазмида pKFN-1532, содержащая сле дующую конструкцию: TPIp-LaC212spx3 cигнал - лидер (147) - Glu Arg Leu Glu Lys Arg -[Ser10, Asp24, Thr26, Glu31, Asn41, Glu52]- апротинин -TPIТ. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 412 b из плазмид pKFN-1530 и pKFN-1532 приводится в списке последовательностей ID № 7. Плазмида pKFN-1532 была трансформирована в дрожжевом штамме МТ663, как это было описано выше, с получением дрожжевого штамма KFN-1545. для токсикологических исследований осуществлялось так же, как это было описано выше. Пример 5. Получение [Ser10, Leu20, Gly40, Asn41, Gln44, Туг46]-апротинина из дрожжевого штамма KFN-1547. Синтетический ген, кодирующий [Ser10, Leu20, Gly40, Asn41, Gly42, Gln44, Tyr46]-апротинин, был сконструирован из 10 олигонуклеотидов путем лигирования, как это описано в примере 1. Используя процедуру, описанную в примере 1, была получе на дрожжевая экспрессирующая плазмида, содержащая следующую конструкцию: TPIp-LaC212spx3 сигнал - лидер (1-47) - Glu Arg Leu Glu Lys Arg - [Ser10, Leu20, Gly40, Asn41, Gly42, Gln44, Tyr46]-апротинин - ТРIт. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 412 bp из плазмид pKFN-1534 и pKFN-1537 приводится в списке последовательностей ID № 9. Плазмида pKFN-1537 была трансформирована в дрожжевом штамме, как описано выше, с получе нием дрожжевого штамма KFN-1547. Культивирование трансформированного штамма KFN-1547 в YPD-среде, анализ [Ser10, Leu20, Gly40, Asn41, Gly42, Gln44, Tyr46]-апротинина в надосадочной жидкости и получе ние материала для токсикологических исследований осуществлялось так, как это было описано выше. Пример 6. Получение des-Arg1, des-Pro2 - [Ser42, Glu4] - апротинина из дрожжевого штамма KFN-1660. Фрагмент Ahall-Styl с размером 1,4 kb и фрагмент Ahall-Sall с размером 1,8 kb из плазмиды pKFN-306 были лигированы в дуплекс, содержащий следующие два синтетических олигонуклеотида: Культивирование трансформированного штамма KFN-1545 в YPD-среде, анализ [Ser10, Asp24, Thr26, Glu31, Asn4T, Сlu53]-апротинина в надосадочной жидкости и получение материала NOR-2188: 5' CAAGGCTGGTTTGTGTC AAACTTTCGTTTACGGTGGCTGC AGAGCTAATCCAAC AACTTCGAATCTGCTGAAGACTGCATGAGAACTTGTGGT GGTGCCTAATCTAGAG 3' NOR-2189: 5' TCGACTCTAGATTAGGC ACCACCAC AAGTTCTC ATGC AGTCTTC AGC AGATTCGAAGTTGTTGGACTTAGCTCTGC AGCC ACCGTAAACGAAAGTTTGAC ACAAACC AGC 3" Плазмида pKFN-306 является плазмидой производной от pTZI9R со вставкой EcoRI-Xbal с размером 502 bp, содержащей сигнал-лидерный (1-85) ген скрещивающего фактора альфа 1 Saccharomyces cerevisiae, слитый в рамке считыва ния с синте тическим геном для des-Arg1, dеs-Рго2/Sег42/-апротинина. Используя процедуру, описанную в примере 1, была получе на дрожжевая экспрессирующая плазмида pKFN-1656, содержащая сле дующую конструкцию: TPIp-MF сигнал-лидер (1-85)-desArg1, des-Pro2 - [Ser42 ,Glu46] - апротинин -ТРIТ. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 502 bp из плазмид pKFN-1629 и pKFN-1656 приводится в списке последовательностей ID №11. Плазмида pKFN-1656 была трансформирована в дрожжевом штамме МТ663, как это описано выше, с по лучением дрожжевого штамма KFN-1660. Культивирование трансформированного штамма KFN-1660 в YPD-среде, анализ des-Arg1, des-Pro2 - [Ser42, Glu46] - апротинина в надосадочной жидкости и получе ние материала для токсикологических исследований проводились так, как это описано выше. Пример 7. Конструкция плазмиды pKFN-306 описана в международной заявке WO 89/01968. Для трансформации компетентного штамма E.coli (r-, m +), отобранного по его устойчивости к ампицилину, использовалась лигирующая смесь. Расшифровка последовательности ДНК (Sanger, F., Micklen, S., Coulsen, A.R., Proc. Natl. Acad. Sci. USA 74(1977) 5463-5467) показала, что плазмиды из полученных колоний содержали правильную последовательность для des-Arg1, des-Pro2 [Ser42, Glu46]-апротинина. Для дальнейшегo использования была выбрана плазмида pKFN-1629. 13 34422 Получение des-Arg1, des-Pro2 - [Ser42, Ala46]-апротинина из дрожжевого штамма KFN1661. Фрагмент Ahall-Styl с размером 1,4 kb и фрагмент Ahall-Sall с размером 1,8 kb из плазми ды pKFN-306 были лигированы в дуплекс, состоящий из следующих двух синтетических олигонуклеотидов: NOR-2196: 5' CAAGGCTGGTTTGTGTC AAACTTTCGTTTACGGTGGCTGC AGAGCT AAGTCCAAC AACTTCGCTTCTGCTGAAGACTGCATGAGAAC TTGTG GTGGTGCCTAATCTAGAG 3' NOR-2197:5' TCGACTCTAGATTAGGC ACCACCACC AGTTCTCATGC AGTC TTC AGC ACAGAAGCGAAGTTGTTGGACTTAGCTCTGC AGCC ACCGTAAACGAAAGT TTGAC ACAAACC AGC 3' Плазмида pKFN-306 является производной от pTZI9R плазмиды со вставкой EcoRI-Xbal с размером 502 bp, содержащей сигнал-лидерный /185/ген скрещивающего фактора альфа 1 Saccharomyces cerevisiae, слитый в рамке считыва ния с синте тическим геном для des-Arg1, des-Pro2[Ser42]-апротинина. Конструкция плазмиды pKFN-306 описана в международной заявке WO 89/01968. Для трансформации компетентного штамма Е. coli (r-, m +), отобранного за устойчивость к ампицилину, использовалась лигирующая смесь. Расшифровка последовательности ДНК (Sanger, F., Micklen, S., Coulsen, A.R., Proc. Natl. Acad. Sci. USA 74 (1977) 5463-5467) показала, что плазмиды из полученных колоний содержали правильную последовательность для des-Arg1, des-Pro2[Ser42, Glu46]-апротинина. Для дальнейшего использования была выбрана плазмида pKFN-11631. Используя процедуру примера 1 была получе на дрожжевая экспрессирующая плазмида pKFN-1657, содержащая следующую конструкцию: TPIp-MF 1-сигнал-лидер (1-85)-des-Arg1, des-Pro2 [Ser 42, Ala46 - апрoтинин - ТPIт. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 502 bp из плазмид pKFN-1631 и pKFN-1657 приводится в списке последовательностей I D №13. Плазмида pKFN-1657 была трансформирована в дрожжевом штамме МТ663, как это описано выше, с по лучением дрожжевого штамма KFN-1661. Культивирование трансформированного штамма KFN-1661 в YPD-среде, анализ des-Arg1, des-Pro2 - [Ser42, Ala46] - апротинина в надосадочной жидкости и получе ние материалов для токсикологических исследований проводилось так же, как это описано выше. Пример 8. Получение des-Arg1, des-Pro2 - [Ser10, Asp24, Thr26, Glu31, Asn41, Glu53]-апротинина из дрожжевого штамма KFN-1735. Синтетический ген, кодирующий des-Arg1, des-Pro2 - [Ser10, Asp24, Thr26, Glu31, Asn41, Glu53] - апротинин, был сконструи рован из 10 олигонуклеотидов п утем лигирования, как это описано в примере 1. Производная от плазмиды pTZ19R плазмида pKFN-1707, содержащая синте тический ген, слившийся в рамке считывания с синтетическим дрожжевым лидерным пепти дом, была сконструирована так, как это описано в примере 1. С помощью процедуры, описанной в примере 1, была получе на дрожжевая экспрессирующая плазмида pKFN-1709, содержащая следующую конструкцию: TPIp-LaC212spx3 сигнал - лидер (1-47) - Glu Arg Leu Glu Lys Arg -des-Arg1, des-Pro2 - [Ser10, Asp24, Thr26, Glu31, Asn41, Glu53]-апротинин-TPIT. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 406 bp из плазмид pKFN-1707 и pKFN-1709 приводится в списке последовательностей ID №15. Плазмида pKFN-1709 была трансформирована в дрожжевом штамме МТ663, как это было описано выше, что привело к получению дрожжевого штамма KFN-1735. Культивирование трансформированного штамма KFN-1735 в YPD-среде, анализ des-Arg1, des-Pro2 - [Ser10, Asp24, Thr26, Glu31, Asn41, Glu53]-апротинина в надосадочной жидкости и получе ние материала для токсикологических исследований проводилось, как описано выше. Пример 9. Получение dеs-Arg1, des-Pro2- [Asp24, Thr26, Glu31, Glu53] - апротинина из дрожжевого штамма KFN-1737. Фрагмент Ahall-Xbal с размером 1,8kb и фрагмент Ahall-Avall размером 1,4 kb, полученные из плазмиды pKFN-306 (см. пример 5) были лигированы с синтетическим фрагментом Avall-Xbal с размером 141 bp, кодирующим [Asp24, Thr26, Glu31, Glu53] - апротинин. Производная от pTZ19R плазмида являлась плазмидой pKFN-1711. Применяя процедуру, описанную в примере 1, была получе на дрожжевая экспрессирующая плазмида pKFN-1713, содержащая следующую конструкцию: TPIp-MF 1 сигнал-лидер (1-85)-desArg1, des-Pro2 - [Асn24, Thr26, Glu31, Glu53] - апротинин -ТР1T. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 502 bp из плазмид pKFN-1711 и pKFN-1713 приводится в списке последовательностей ID №17. Плазмида pKFN-1713 была трансформирована в дрожжевом штамме МТ663, как это описано выше, с по лучением дрожжевого штамма KFN-1737. Культивирование трансформированного штамма KFN-1737 в YPD - среде, анализ des-Arg1, des-Pro2 - [Asp24, Thr26, Glu31, Glu53] -апротинина в надосадочной жидкости и получе ние материала для токсикологических исследований осуществлялось так, как описано выше. 14 34422 Пример 10. Получение des-Arg1, des-Pro2 - [Ser10, Gly40, Asn41, Gly42, Glu53]-апротинина из дрожжевого штамма KFN-1739. Синтетический ген, кодирующий des-Arg1, des-Pro2-[Ser10, Gly40, Asn41, Gly42, Glu53]-апротинин был сконструи рован из 10 олигонуклеотидов путем лигирования, как это описано в примере 1. Производная от pTZ19R плазмида pKFN1715, содержащая синте тический ген, слившийся в рамке считыва ния с синтетическим дрожжевым лидерным пептидом, была сконструирована так, как это описано в примере 1. Используя процедуру, описанную в примере 1, была получе на дрожжевая экспрессирующая плазмида pKFN-1718, содержащая сле дующую конструкцию: TPIp-LaC212spx3 сигнал - лидер (147) - Glu Arg Leu Glu Lys Arg- des-Arg-1, des-Pro2 [Ser10, Gly40, Asn41, Gly42, Glu53]-апротинин ТРIт. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 406 bp из плазмид pKFN-1718 и pKFN-1715 приводится в списке последовательностей I D №19. Плазмида pKFN-1718 была трансформирована в дрожжевом штамме как это описано выше, с получением дрожжевого штамма KFN-1739. Культивирование трансформированного штамма KFN-1739 в YPD-среде, анализ des-Arg1, Pro2 - [Sеr10, Gly40, Asn41, Gly42, Glu53]-апротинина в надосадочной жидкости и получе ние материала для токсикологических исследований осуществлялось так, как было описано выше. Пример 11. Получение des-Arg1, des-Pro2 - [Ser42, Glu53] - апротинина из дрожжевого штамма KFN1742. Фрагмент Ahall-Xbal с размером 1,8 кb и фрагмент Ahall-Xbal с размером 1,4 kb из плазмиды pKFN-306 (см. пример 5) были лигированы с синте тическим фрагментом Avall-Xbal размером 141 bp, кодирующий [Ser42, Glu53]-апротинин. Производная от pTZ19R плазмида представляла собой плазмиду pKFN-1721. Используя процедуру, описанную в примере 1, была получе на дрожжевая экспрессирующая плазмида pKFN-1724, содержащая сле дующую конструкцию: TPIp-MF 1-сигнал-лидер (1-85)-desArg1, des-Pro2- [Ser42,Glu53] - апротинин-ТРIT. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 502 bp из плазмид KFN-1721 и pKFN-1724 приводится в списке последовательностей I D №21. Плазмида pKFN-1724 была трансформирована в дрожжевом штамме МТ663, как это описано выше, с по лучением дрожжевого штамма KFN-1742. Культивирование трансформированного штамма KFN-1742 в YPD-среде, анализ des-Arg1, des-Pro2 - [Ser42, Glu53] - апротинина в надосадочной жидкости и получе ние материала для токсикологических исследований осуществлялось, как описано выше. Пример 12. Получение des-Arg1, des-Pro2 - [Glu42, Glu53]-апротинина из дрожжевого штамма KFN1752.Фрагмент Ahall-Xbal с размером 1,8 kb и фрагмент Ahall-Avall с размером 1,4 kb из плазмиды pKFN-306 (см. пример 5) были лигированы с синте тическим фрагментoм Avall-Xbal с размером 141 bp, кодирующим [Glu42, Glu53] - апротинин. Производная от pTZ19R плазмида являлась плазмидой pKFN-1762. Используя процедуру, описанную в примере 1, была получе на дрожжевая экспрессирующая плазмида pKFN-1765, содержащая сле дующую конструкцию: TPIp-MF 1 сигнал - лидер (1-85) - desArg1, des-Pro2 - [Glu42, Glu53] - апротинин-TPIT. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 502 bp из плазмид pKFN-1762 и pKFN-1765 приведена в списке последовательностей I D №23. Плазмида pKFN-1765 была трансформирована в дрожжевом штамме МТ663, как это было описано выше, с получением дрожжевого штамма KFN-1752. Культивирование трансформированного штамма KFN-1752 в YPD-среде, анализ des-Arg1, des-Pro2 - [Glu42, Glu53]-апротинина в надосадочной жидкости и получе ние материала для токсикологических исследований осуществлялось так же, как это описано выше. Пример 13. Получение des-Arg1, des-Pro2 - [Glu26, Ser42, Glu53]-апротинина из дрожжевого штамма KFN-1755. Фрагмент AhaII-Xbal с размером 1,8 kb и фрагмент Ahall-Avall с размером 1,4 kb из плазмиды pKFN-306 (см. пример 5) были лигированы с синте тическим фрагментом Avall-Xbal, размером 141 bp, кодирующим [Glu26, Ser42, Glu53] - апротинин. Производная от pTZ19R плазмида представляла собой плазмиду pKFN-1768. Используя процедуру, описанную в примере 1, была получе на дрожжевая экспрессирующая плазмида pKFN-1770, содержащая сле дующую конструкцию: TPIp-MF 1 сигнал-лидер (1-85) -desArg1, des-Pro2 - [Glu26, Ser42, Glu53] - апротининTPIT. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 502 bp из плазмид pKFN-1768 и pKFN-1770 приведена в списке последовательностей I D №25. Плазмида pKFN-1770 была трансформирована в дрожжевом штамме МТ663, как это было описано выше, с получением дрожжевого штамма KFN-1755. Культивирование трансформированного штамма KFN-1755 в YPD-среде, анализ des-Arg1, des-Pro2 - [Glu26, Ser42, Glu53] - апротинина в надосадочной жидкости и получение материала для токсикологических исследований осуществлялось так, как это описано выше. Пример 14. Получение des-Arg1, des-Pro2 - [Glu26, Glu42, Glu53]-апротинина из дрожжевого штамма KFN-1756. Фрагмент Ahall-Xbal с размером 1,8 kb и фрагмент Ahall-Avall с размером 1,4 kb из плазмиды pKFN-306 (см. пример 5) были лигированы с синте тическим фрагментом Avall-Xbal размером 15 34422 141 bp, кодирующим [Glu26, Glu42, Glu53] - апротинин. Производная от pTZ19R плазмида являлась плазмидой pKFN-1771. Используя процедуру, описанную в примере 1, была получе на дрожжевая экспрессирующая плазмида pKFN-1773, содержащая сле дующую конструкцию: TPIp-MF 1 сигнал-лидер (1-85) - desArg1, des-Pro2 - [Glu26, Glu42, Glu53]-апротининТРIт. Последовательность оснований в ДНК фрагмента EcoRI-Xbal с размером 502 bp из плазмид pKFN-1771 и pKFN-1773 приведена в списке последовательностей I D №27. Плазмида pKFN-1773 была трансформирована в дрожжевом штамме МТ663, как это было описано выше, с получением дрожжевого штамма KFN-1756. Культивирование трансформированного штамма KFN-1756 в YPD - среде, анализ des-Arg1, des-Pro2 - [Ser2, Glu42, Glu53] - апротинина в надосадочной жидкости и получение материала для токсикологических исследований осуществлялось так, как это описано выше. Пример 15. Токсикологический скрининг аналогов апротинина путем внутривенного вве дения единичной дозы крысам. Для токсикологического скрининга были выбраны следующие аналоги апротинина с уменьшенным положительным суммарным зарядом и термоустойчивостью по сравнению с рекомбинантным апротинином (1-58): KFN-1512, KFN-1514, KFN-1544, KFN-1545, KFN -1547, KFN-1660 и KFN1661. В таблице 1 представлены их основные с токсикологической точки зрения характе ристики. Для сравнения приведены данные, характе ризующие рекомбинантный апротинин. В качестве показателя биологической стабильности приводится температура денатурации. Схема опыта. В первый день проведения скрининга каждого аналога груп пе крыс, состоящей из двух самцов и 2 самок вводили 33, 100, 300 или 900 мг аналога на килограмм веса тела. Две аналогичные по строению контрольные группы получали фи зиологический раствор или физиологический раствор, подкисленный соляной кислотой при рН приблизительно равном 4,5. Последний раствор служил в качестве носителя. Во всех случаях объем дозы составлял 10 мл на килограмм веса тела. Обследование крыс проводилось в течение 7 дней, на 8ой день они были умерщвлены. При аутопсии почки были взвешены и подготовлены для проведения гистопатологического анализа. Характерные параметры приведены в верхней части таблицы 2. Результа ты. Результа ты индивидуальных скринингов обобще ны в таблице 2. Для сравнения приведены данные для рекомбинантного апротинина (доза: 11-300 мг/кг). KFN-1512 не смогли растворить, как это необхо димо для введения наибольшей дозы (900 мг/кг). Одно животное погибло при введении дозы, равной 900 мг KFN-1545 на килограмм. Кроме этого другиx смертельных случаев не зафиксировано. После вве дения KFN-1512, KFN-1544, KFN1545 и KFN-1660 (300 мг на килограмм веса тела) гистопатологических изменений в почках не наблюдалось. Более того, гистопатологические изменения в почках не наблюдались и после введения KFN-1514, KFN-1547 и KFN -1661 при дозе 900 мг на килограмм веса те ла. Таким образом, все аналоги имели недействующие уровни токсичности в отношении гистопатологических изменений в почках, равные 300 мг/кг или более по сравнению с 11 мг/кг для апротинина. По отношению к другим характерным параметрам аналоги эквивалентны или превосходят апротинин. Выводы. Показатель токсичности аналогов апротинина, определяемый путем скрининга крыс, которым внутривенно вводили одну до зу препарата, улучшался в различной степени по сравнению с показателем токсичности апротинина. Все аналоги апротинина имели недействующие уровни нефротоксичности, равные 300 мг/кг или более. KFN1514 имел предельный недействующий, уровень токсичности, равный 900 мг/кг, экви валентный наибольшей дозе. Пример 16. Элиминирование и распределение рекомбинантного апротинина и аналогов апротинина. Для получе ния объемной дозы, равной 1 мкг/г веса крысы, рекомбинантный подлинный апротинин и аналоги апротинина, полученные в соответствие с процедурами, описанными в примерах 1-7, были растворены в 0,9% NaCl. Концентрации инъекционных растворов определяли методами, указанными в разделе "Ме тоды". Ме тоды. Использовали крыс-самок весом 200-230 г. Ап ротинин и аналоги испытывали на двух различных моделях: 1) анестeзированные и 2) неанестезированные крысы. Анестезированные крысы. Анестезирование крыс проводили путем внутрибрюшинной инъекции пентобарбитального натрия. С помощью полиэтиленовых катетеров (РЕ-50, Intramedic) были обнажены и канюлированы сонная артерия и яремная вена. Каротидный катетер подсоединяли к перфузору (B.Braun) для вливания 3,8 мл 0,9% NaCI /ч и к датчику кровяного давления. Изменения давления крови записывали с помощью ленточного самописца (Kipp & Zonen, BD 9). Аналоги вводили ударными дозами в течение 15 секунд через яремный катетер. Образцы крови получали с помощью каротидного катетера через 3, 10, 20, 40 и 60 минут после введения препарата. Образцы (0,45 мл) собирали в 3 мл пробирки, содержащие 50 мкл 0,13 М цитрата натрия, и центрифуги ровали. В процессе анализа температуру плазмы поддерживали на уровне -20oС. Через 60 минут после введения препарата крыс умерщвляли с помощью большой дозы пентобарбитального натрия, при этом почки и печень удаляли, взвешивали и хранили при температуре -80oС. Неанесте зированные крысы. Перед введением аналогов крысам перорально вводили дозу дистиллированной воды в объеме, равном 2 мл. Аналоги вво дили внутривен 16 34422 но ударной дозой в пастональную ве ну с помощью внутривенного катетера /Venflon 22 G, ViggoSpectramed, Helsingborg, Sweden). После введения катетер промывали 0,5 мл 0,9% NaCI и удаляли. Для предотвращения кровотечения из хвоста на места инъекции накладывали пластырь. Затем крысу по мещали в камеру для исследования метаболизма с целью сбора выделенной мочи. Через 3 часа крысу умерщвляли путем введения в камеру СО2/О 2 (9/1), почки и печень удаляли и хранили при температуре -80°С до окончания анализа. Во время введения CO2 крыса опорожняла мочевой пузырь и после того, как крысу удаляли из камеры, камеру промывали 0,9% раствором NaCI для того, что бы получить полный объем мочи-NaCI, равный 25 мл. Приготовление гомогенатов. Одну почку (приблиз. 1 г) и приблизительно 2 г ткани печени помещали в о тдельные пластмассовые пробирки объемом 10 мл каждая и добавляли 2 мл 0,9% раствора NaCI. Ткани подвергали гомогенизации в течение 5 мин, используя высокоинтенсивный ультразвуковой процессор (модель VC50, Solics & Materials, Inc. Danbury, USA). Затем гомогенаты почки и печени разбавляли физиологическим раствором для получе ния полного объема 10-25 и 4 мл соответственно. Ме тоды анализа. Уровни апротинина и аналогов в плазме, гомогенатах печени и инъекционных растворах измеряли фотометрическим методом с помощью прибора Cobas Fara II (Roche). Короче говоря, плазму, гомогенаты или инъекционные растворы осаждали кислотой для удаления други х калликреиновых ингибиторов, отличных от апротинина. Ингибиторную активность калликреина в образце измеряли, используя калликреин из поджелудочной железы свиней (Sigma К 3627) и хромогенный субстрат S2266 (Kabi). Уровни гомогенатов почки и мочи измеряли тем же методом, за исключением стадии осаждения, которой пренебрегли, поскольку присущая калликреину ингибиторная активность была незначительна. В каждой среде для каждого аналога были использованы отдельные стандартные кривые. Схема исследования. Были исследованы 14 групп анестезированных и 14 групп неанестезированных крыс. Каждой крысе вводили дозу апротинина или аналога апротинина, равную 1,56 мкмолъ (приблиз. 10 мг на кг веса тела). Обобщенные данные по 28 группам приведены в таблице 3. Статистическая оценка. Для статистической оценки был использован ранговый корреляционный анализ Спирмана. Результа ты. Содержание аналогов в почках и моче. Общее содержание аналогов в почках (в процентном отношении от дозы) спустя 1 и 3 часа, а в моче - спустя 3 ч показано на фиг. 3 и в таблице 4. Как видно, между аналогами были обнаружены большие различия. Что касается апротинина, то его содержание в почках через 1 ч после вве дения составляло приблизительно 20% от принятой дозы, тогда как через 3 ч после введения его содержание увеличилось до более чем 40%. Выделение апротинина в моче было незначительным. Для того, что бы оценить, связано ли выделение в мочу спустя 3 ч после введения с суммарным зарядом аналогов, бы ла рассчитана степень корреляции между этими числами. Было обнаружено, что содержание в моче полностью коррелировалось с суммарными зарядами аналогов (см. фиг. 4). Стабильность аналогов. Для исследования стабильности аналогов в ткани почек одну почку, взятую из груп пы 14 анестезированных крыс (по одной из каждой группы) разделили на два кусочка одинакового веса. Один кусочек хранили при температуре 37°С, а другой при температуре 4°С. После 4 часов хранения ткани были гомогенизированы и было проведено измерение содержания аналогов. Показатель стабильности определяли путем деления содержания аналогов в кусочке, хранившемся при температуре 37°С, на содержание аналогов в кусочке, который хранили при температуре 4°С. Показатели стабильности приведены в таблице 5, из которой видно, что рекомбинантный апротинин, KFN-1514, KFN-1544, по-видимому, являются наиболее стабильными соединениями по сравнению, например, с KFN-1660, который, по-видимому, является наименее стабильным. Стабильность аналогов исследовали также путем определения их температуры денатурации. Было обнаружено, что температура денатурации обладает высокой корреляцией с содержанием аналогов в ткани почек через 3 часа после их введения (фиг. 5) и с показателями накопления (фиг. 6), но не с выделением мочи. Эти данные позволяют предположить, что суммарный заряд может иметь большее, значение для выделения аналогов в мочу, но меньшее значение для концентрации и накопления в почках. С другой стороны, накопление в почках, по-видимому, связано с температурой денатурации и со стабильностью аналогов в тканях почек. Однако, вероятно, что концентрации в ткани почек при измерении, проведенном через 1 час после вве дения препарата, изменялись из-за разрушения или перераспределения. Таким образом, возможно, что концентрации, измеренные, например, через 10 мин после приема препарата, коррелируются с суммарным зарядом. Выводы. Были сделаны следующие вы воды: 1) Все исследованные аналоги усваивались почками, но в разной степени. Накопление их в почках, ве роятно, связано с термоустойчивостью, и стабильностью в ткани почек, но не с суммарным зарядом молекул. 2) Выделение в мочу, вероятно, связано с суммарным зарядом аналогов, но не со стабильностью. Список последовательностей. 1. Основная информация: Заявитель: Bjoern, Soeren Erik; Norris, Kjeld; Diness, Viggo; Noerskov-Lauritsen, Leif; Christensen, Niels Dyhr; Bregengaard, Claus. Название изобретения: Аналоги апротинина Число последовательностей: 36 Почтовый адрес: 17 34422 /А/ Адресат: No vo Nordisk A/S /В/ Улица: Novo Alle /С/ Город: Bagsvaerd /Е/ Страна: Denmark /F/ ZIP: 2880 Компьютерное считывающее устройство: /А/ Тип носителя информации: гибкий диск /В/ Компьютер: совместимая IBM PC /С/ Операционная система: PC-DOS/MS /С/ Ссылочный номер/Номер дела: 3465.204-WO (ix) Данные о средствах электросвязи: /А/Те лефон: /212/ 867 - 0123 /В/ Те лефакс: /212/ 867 -0298 /С/ Те лекс: 2. Данные о последовательности I D №1 (i) Ха рактеристики последовательности: /А/ Длина: 418 комплементарных пар оснований DOS /В/ Тип: н уклеиновая кислота /С/ Цепочечностъ: одноцепочечная /D/ То пология: линейная (ii) Тип молекулы: кДНК (iii) (vi) Исходный материал: /А/ Ор ганизм: синтетический (ix) Признак: /А/ Название/Ключ: CDS /В/ Ло кализация: 77..409 (ix) Признак: /А/ Название/Ключ: сигнальный пептид /В/ Ло кализация: 77.. 235 (ix) Признак: /А/ Название/Ключ: скрещивающий пептид /В/ Ло кализация: 236..409 (xi) Описание последовательности: I D №1: /D/ Программное обеспечение: Patentin Версия №1,0 Версия №1,25 Текущие данные по заявке: /А/ Номер заявки: /В/ Да та подачи: /С/ Классификация: Приоритетные данные по заявке: /А/ Номер заявки: DK 2361/90 /В/ Да та подачи: 1 октября 1990 Приоритетные данные по заявке: /А/ Номер заявки: DK 1118/91 /В/ Да та подачи: 12 июня 1991 Данные о поверенном/агенте /А/ Имя: Thalsoe-Madsen, Birgit 18 34422 /2/ Данные о последовательности I D №2: (i) Ха рактеристики последовательности: /А/ Дли на: 111 аминокислот /В/ Тип: аминокислота /D/ То пология: линейная (ii) Тип молекулы: белок (хi ) Оп исан ие по следо вате льно сти I D №2: /2/ Данные о последовательности I D №3: (i) Ха рактеристики последовательности: /А/ Длина: 418 комплементарных пар осно (ix) Признак: /А/ Название/Ключ: CDS /В/ Ло кализация: 77..409 (ix) Признак: /А/ Название/Ключ: сигнальный пептид /В/ Ло кализация: 77.. 235 (ix) Признак: /А/ Название/Ключ: скрещивающий пептид /В/ Ло кализация: 236.. 409 (xi) Описание последовательности I D №3: ваний /В/ Тип: н уклеиновая кислота /С/ Цепочечность: одноцепочечная /D/ То пология: линейная (ii) Тип молекулы: кДНК (vi.) Исходный материал: /А/ Ор ганизм: синтетический 19 34422 /2/ Данные о последовательности I D №4: (i) Ха рактеристики последовательности: /А/ Дли на: 111 аминокислот /В/ Тип: аминокислота /D/ То пология: линейная (ii)Тип молекулы: белок (xi) Описа ние после дова тель ности I D №4: /2/ Данные о последовательности I D №5: (i) Ха рактеристики последовательности: /А/ Дли на: 418 пар оснований /В/ Тип: н уклеиновая кислота /С/ Цепочечность: одноцепочечная /D/ То пология: линейная (ii) Тип молекулы: кДНК (iii) Исходный материал: /А/ Ор ганизм: синтетический (ix) Признак: /А/ Название/Ключ: CSD /В/ Ло кализация: 77..409 (ix) Признак: /А/ Название/Ключ: сигнальный пептид /В/ Ло кализация: 77... 235 (ix) Признак: /А/ Название/Ключ: скрещивающий пептид /В/ Ло кализация: 236..409 (xi) Описа ние после дова тель ности I D №5: 20 34422 /2/ Данные о последовательности I D № 6: (i) Ха рактеристики последовательности: /А/ Дли на: 111 аминокислот /В/ Тип: аминокислота /D/ То пология: линейная (ii) Тип молекулы: белок; (xi ) Оп исани е по следо вате льн о сти I D № 6 21 34422 /2/ Данные о последовательности I D №7: (i) Ха рактеристики последовательности: /А/ Дли на: 418 пар оснований /В/ Тип: н уклеиновая кислота /С/ Цепочечность: одноцепочечная /D/ То пология: линейная (ii) Тип молекулы: кДНК (vi) Исходный материал: /А/ Ор ганизм: синтетический (ix) Признак: /А/ Название /Ключ: CDS /В/ Ло кализация: 77..409 (ix) Признак: /А/ Название/Ключ: сигнальный пептид /В/ Ло кализация: 77.. 235 (ix) Признак: /А/ Название/Ключ: скрещивающий пептид /В/ Ло кализация: 236..409 (xi) Описание последовательности I D №7: /2/ Данные о последовательности I D №8: (i) Ха рактеристики последовательности: /А/ Дли на: 111 аминокислот /В/ Тип: аминокислота /D/ То пология: линейная (ii) Тип молекулы: белок (xi ) Описание по следовательн ости I D №8: 22 34422 /2 / Данны е о по следо вате льно сти I D №9: (ix) Признак: /А/ Название/Ключ CDS /В/ Ло кализация: 77.. 409 (ix) Признак: /А/ Название/Ключ: сигнальный пептид /В/ Ло кализация: 77... 235 (ix) Признак: /А/ Название/Ключ: скрещивающий пептид /В/ Ло кализация: 236 .. 409 (xi) Описание последовательности I D №9: (i) Ха рактеристики последовательности: /А/ Дли на: 418 пар оснований /В/ Тип: н уклеиновая кислота /С/ Цепочечность: одноцепочечная /D/ То пология: линейная (ii) Тип молекулы: кДНК (vi) Исходный материал: /А/ Ор ганизм: синтетический 157 23 34422 /2/ Данные о последовательности I D №10: (i) Ха рактеристики последовательности: /А/ Дли на: 111 аминокислот /В/ Тип: аминокислота /2 / Данн ые о по следо вате льно сти /D/ То пология: линейная (ii) Тип молекулы: белок (iii ) Описание по следо вательн ости I D №10 : ID (ix) Признак: /А/ Название/Ключ: CDS /В/ Ло кализация: 77..499 (ix) Признак: /А/ Название/Ключ: сигнальный пептид /В/ Ло кализация: 77..331 (ix) Признак: /А/ Название /Ключ: скрещивающий пептид /В/ Ло кализация: 332.. 499 (xi) Описание последовательности ID №11 №11 : (i) Ха рактеристики последовательности: /А/ Дли на: 508 пар оснований /В/ Тип: н уклеиновая кислота /С/ Цепочечность: одноцепочечная /D/ То пология: линейная (ii) Тип молекулы: кДНК (vi) Исходный материал: /А/ Ор ганизм: синтетический 24 34422 /2/ Данные о последовательности I D №12: (i) Ха рактеристики последовательности: /А/ Длина: 141 аминокислота /В/ Тип: аминокислота /D/ То пология: линейная (іі) Тип молекулы: белок (xi ) Описание по следовательн ости I D №12 : 25 34422 /2 / Данны е о по следо вате льно сти I D №13 : (ix) Признак: /А/ Название/Ключ: CDS /В/ Ло кализация: 77. .499 (ix) Признак: /А/ Название/Ключ: сигнальный пептид /В/ Ло кализация: 77 .. 331 (ix) Признак: /А/ Название/Ключ: скрещивающий пептид /В/ Ло кализация: 332 .. 499 (xi) Описание последовательности I D №13: (i) Ха рактеристики последовательности: /А/ Дли на: 508 пар оснований /В/ Тип: н уклеиновая кислота /С/ Цепочечность: одноцепочечная /D/ То пология: линейная (ii) Тип молекулы: кДНК (vl) Исходный материал: /А/ Ор ганизм: синтетический 26 34422 №14 : /2 / Данны е о по следо вате льно сти I D /В/ Тип: аминокислота /D/ То пология: линейная (ii) Тип молекулы: белок (xi) Описание последовательности I D №14: (i) Ха рактеристики последовательности: /А/ Дли на: 141 аминокислота /2/ Данные о последовательности I D №15: (i) Ха рактеристики последовательности: /А/ Дли на: 412 пар оснований: /В/ Тип: н уклеиновая кислота /С/ Цепочечность: одноцепочечная /D/ То пология: линейная (ii) Тип молекулы: кДНК (vi) Исходный материал: /А/ Ор ганизм синтетический (ix) Признак: /А/ Название/Ключ: CDS /В/ Ло кализация: 77 .. 403 (ix) Признак: /А/ Название/Ключ: сигнальный пептид /В/ Ло кализация: 77.. 235 (ix) Признак: /А/ Название/Ключ: скрещивающий пептид /В/ Ло кализация: 236.. 403 (xi) Описание последовательности: I D №15: 27 34422 /2/ Данные о последовательности I D №16: (i) Ха рактеристики последовательности: /А/ Дли на: 109 аминокислот /В/ Тип: аминокислота /D/ То пология: линейная: (ii) Тип молекулы: белок (iii ) Описание по следо вательн ости I D №16 : /2/ Данные о последовательности I D №17: (i) Ха рактеристики последовательности: /А/ Дли на: 508 пар оснований /В/ Тип: н уклеиновая кислота /С/ Цепочечность: одноцепочечная /D/ То пология: линейная (ii) Тип молекулы: кДНК (vi) Исходный материал: /А/ Ор ганизм синтетический (ix) Признак: №17 28 /А/ Название/Ключ: CDS /В/ Ло кализация: 77...499 (ix) Признак: /А/ Название/Ключ: сигнальный пептид /В/ Ло кализация: 77.. 331 (ix) Признак: /А/ Название/Ключ: скрещивающий пептид /В/ Ло кализация: 332..499 (xi ) Описание по следовательн ости I D 34422 /2/ Данные о последовательности I D №18: (i) Ха рактеристики последовательности: /А/ Дли на: 141 аминокислота /В/ Тип: аминокислота /D/ То пология: линейная (ii) Тип молекулы: белок (iii ) Описание по следо вательн ости I D №18 29 34422 /2/ Данные о последовательности I D №19: (i) Ха рактеристики последовательности: /А/ Дли на: 412 пар оснований /В/ Тип: н уклеиновая кислота /С/ Цепочечность: одноцепочечная /D/ То пология: линейная (ii) Тип молекулы: кДНК (vi) Исходный материал: /А/ Ор ганизм синтетический (ix) Признак: /А/ Название/Ключ: CDS /В/ Ло кализация: 77.. 403 (ix) Признак: /А/ Название/Ключ: сигнальный пептид /В/ Ло кализация: 77.. 235 (ix) Признак: /А/ Название/Ключ: скрещивающий пептид /В/ Ло кализация: 236 .. 403 (i x) Описание по следова тельн ости I D №19 : 30
ДивитисяДодаткова інформація
Назва патенту англійськоюAprotinin analogue, aprotinin encoding dna, cell culture of the sacharomyces serevisiae, recombinant expression vector, method for preparing of aprotinin analogue and pharmaceutical composition
Автори англійськоюBJOERN SOEREN ERIK, NORRIS KJELD, DINESS VIGGO, NOERSKOV-LAURITSEN LEIF, CHRISTENSEN NIELS DYHR, BREGENGAARD CLAUS
Назва патенту російськоюАналог апротинина, структурf днк, которая его кодирует, культур клеток sacharomyces serevisiae, рекомбинантный экспрессирующий вектор, способ получения аналога апротинина и фармацевтическая композиция
Автори російськоюБьорн Сорен Эрик, Норрис Келд, Динес Вигго, Норсков-Лауртцен Лейф, Кристенсен Ниелс Дир, Брэгэнгаард Клаус
МПК / Мітки
МПК: C12P 21/02, A61K 38/55, C07K 14/81, C12N 1/19, C12N 15/15, C12N 15/09
Мітки: аналога, кодує, фармацевтична, апротиніну, днк, клітин, експресуючий, рекомбінантний, спосіб, культура, вектор, структура, serevisiae, композиція, аналог, sacharomyces, одержання
Код посилання
<a href="https://ua.patents.su/43-34422-analog-aprotininu-struktura-dnk-shho-jjogo-kodueh-rekombinantnijj-ekspresuyuchijj-vektor-kultura-klitin-sacharomyces-serevisiae-sposib-oderzhannya-analoga-aprotininu-farmacevtichna.html" target="_blank" rel="follow" title="База патентів України">Аналог апротиніну, структура днк, що його кодує, рекомбінантний експресуючий вектор, культура клітин sacharomyces serevisiae, спосіб одержання аналога апротиніну, фармацевтична композиція</a>
Попередній патент: Радіотелефон та генератор для формування сигналу із заданою частотою (варіанти)
Наступний патент: Циклопептиди як інгібітори адгезії та спосіб їх одержання
Випадковий патент: Спосіб виявлення втрат газу в газопроводі