Білок, який зв’язує рецептор nogo
Номер патенту: 87106
Опубліковано: 25.06.2009
Автори: Пепінскі Р. Блейк, Май Ша, Маккой Джон, Лі Деніел Х.С.
Формула / Реферат
1. Виділена нуклеїнова кислота, яка містить нуклеотидну послідовність, що кодує розчинний поліпептид Sp35, вибраний з групи, яка складається з
(a) поліпептиду, який включає в себе амінокислоти 34-532 послідовності SEQ ID NO: 2;
(b) поліпептиду, який включає в себе амінокислоти 34-417 послідовності SEQ ID NO: 2;
(c) поліпептиду, який включає в себе амінокислоти 34-432 послідовності SEQ ID NO: 2;
(d) поліпептиду, який включає в себе амінокислоти 417-531 послідовності SEQ ID NO: 2;
(e) поліпептиду, який включає в себе амінокислоти 425-531 послідовності SEQ ID NO: 2;
(f) поліпептиду, який включає в себе амінокислоти 1-531 послідовності SEQ ID NO: 2;
(g) поліпептиду, який включає в себе амінокислоти 433-493 послідовності SEQ ID NO: 2;
(h) поліпептиду, який включає в себе LRR-домен Sp35, основну ділянку Sp35, розташовану з С-кінця відносно LRR-домену, й імуноглобуліновий (Ig) домен Sp35, розташований з С-кінця відносно основної ділянки, але позбавленого трансмембранного домену;
(i) поліпептиду, який включає в себе Ig-домен Sp35, але позбавленого LRR-домену Sp35, основної ділянки Sp35, трансмембранного домену і цитоплазматичного домену;
(j) поліпептиду, який включає в себе LRR-домен Sp35, але позбавленого Ig-домену Sp35, основної ділянки Sp35, трансмембранного домену і цитоплазматичного домену;
(k) поліпептиду, такого, як вказано в (h), додатково позбавленого цитоплазматичного домену;
(l) поліпептиду, який включає в себе амінокислоти 417-424 послідовності SEQ ID NO: 2;
(m) поліпептиду, який включає в себе амінокислоти 494-551 послідовності SEQ ID NO: 2; і
(n) поліпептиду, який включає в себе амінокислоти 454-458 послідовності SEQ ID NO: 2,
причому поліпептид, який кодований вказаною нуклеїновою кислотою, здатний знижувати інгібування аксонального росту нейрону центральної нервової системи.
2. Виділена нуклеїнова кислота, що кодує поліпептид Sp35, де поліпептид Sp35 складається з амінокислотного мотиву, вибраного з групи, яка складається з:
(i) SPRKH (SEQ ID NO: 34);
(ii) LSPRKH (SEQ ID NO: 10);
(iii) ITPKRR (SEQ ID NO: 11);
(iv) ACPHHK (SEQ ID NO: 12); і
(v) VSPRKH (SEQ ID NO: 13),
причому поліпептид Sp35 необов'язково злитий з гетерологічним поліпептидом.
3. Нуклеїнова кислота за п. 2, де зазначений поліпептид циклізований.
4. Нуклеїнова кислота за п. 1 або п. 2, що додатково містить полінуклеотид, який кодує гетерологічний поліпептид, злитий з вказаним поліпептидом Sp35.
5. Нуклеїнова кислота за будь-яким з пп. 2-4, у якій зазначений гетерологічний поліпептид вибраний з групи, яка складається з поліпептиду Ig, поліпептиду сироваткового альбуміну, поліпептиду спрямованої дії, поліпептиду-репортора, поліпептиду, що зв'язує NgR1 людини, одного або більшої кількості цистеїнових залишків і поліпептиду, що полегшує очищення.
6. Нуклеїнова кислота за п. 5, у якій зазначений гетерологічний поліпептид вибраний з групи, яка складається з імуноглобуліну Fc, сироваткового альбуміну людини або його фрагмента, гістидину tag, олігодендроцит-мієлінового глікопротеїну або його фрагмента, мієлін-асоційованого глікопротеїну або його фрагмента, та глікопротеїну Nogo66 або його фрагмента.
7. Вектор, що містить нуклеїнову кислоту за будь-яким з пп. 1-6.
8. Вектор за п. 7, у якому вказана нуклеїнова кислота оперативно зв'язана з послідовністю, яка контролює експресію.
9. Клітина-хазяїна, що містить вектор за п. 7 або п. 8.
10. Клітина-хазяїна за п. 9, яка експресує поліпептид Sp35.
11. Виділений полілептид Sp35, що кодується нуклеїновою кислотою за будь-яким з пп. 1-6.
12. Поліпептид за п. 11, де зазначений поліпептид здатний знижувати інгібування аксонального росту нейрону центральної нервової системи.
13. Поліпептид за п. 11 або 12, де зазначений поліпептид одержаний синтетичним шляхом.
14. Поліпептид за п. 11 або 12, де зазначений поліпептид циклізований.
15. Поліпептид за будь-яким з пп. 11-14, де зазначений поліпептид кон'югований з полімером.
16. Поліпептид за п. 15, де полімер вибраний з групи, яка складається з поліалкіленгліколю, сахаридного полімеру і поліпептиду.
17. Поліпептид за п. 16, де поліалкіленгліколь являє собою поліетиленгліколь (ПЕГ).
18. Поліпептид за п. 17, де поліпептид кон'югований з 1, 2, 3 або 4 полімерами.
19. Поліпептид за п. 18, де загальна молекулярна маса полімерів становить від 20 000 Да до 40 000 Да.
20. Антитіло, яке специфічно зв'язується з поліпептидом за будь-яким з пунктів 11-19, або антиген-зв'язуючий фрагмент зазначеного антитіла, де вказані антитіло або антиген-зв'язуючий фрагмент знижують інгібування аксонального росту нейрону центральної нервової системи (ЦНС).
21. Спосіб in vitro інгібування трансдукції сигналу за рахунок NgR1, що включає в себе приведення NgR1-експресуючої клітини в контакт з ефективною кількістю поліпептиду Sp35 за будь-яким з пунктів 11-19 або антитіла або його фрагмента за п. 20.
22. Спосіб in vitro зниження інгібування росту аксонів нейрону центральної нервової системи (ЦНС), що включає в себе приведення зазначеного нейрону в контакт з ефективною кількістю поліпептиду Sp35 за будь-яким з пунктів 11-19 або антитіла або його фрагмента за п. 20.
23. Спосіб in vitro інгібування колапсу конусу росту нейрону ЦНС, що включає в себе приведення зазначеного нейрону в контакт з ефективною кількістю поліпептиду Sp35 за будь-яким з пунктів 11-19 або антитіла або його фрагмента за п. 20.
24. Спосіб in vitro стимуляції виживання нейрону при ризику його загибелі, що включає в себе приведення зазначеного нейрону в контакт з ефективною кількістю поліпептиду Sp35 за будь-яким з пунктів 11-19 або антитіла або його фрагмента за п. 20.
25. Застосування поліпептиду Sp35 за будь-яким з пунктів 11-19 або антитіла або його фрагмента за п. 20 для одержання лікарського засобу для лікування захворювання, порушення або пошкодження ЦНС у ссавця.
26. Застосування клітини-хазяїна за п. 10 для одержання лікарського засобу для лікування захворювання, порушення або пошкодження ЦНС у ссавця.
27. Застосування за п. 26, де клітина-хазяїна, що культивується, походить від ссавця, який підлягає лікуванню.
28. Застосування вірусного вектора, що містить нуклеотидну послідовність, яка кодує поліпептид Sp35 за будь-яким з пунктів 11-19, або антитіла або його фрагмента за п. 20 для одержання лікарського засобу для лікування захворювання, порушення або пошкодження ЦНС у ссавця, де зазначений поліпептид Sp35 експресується в організмі ссавця з нуклеотидної послідовності в кількості, достатній для зниження інгібування аксонального витягування нейронів в ділянці пошкодження або поблизу неї.
29. Застосування за п. 28, де вірусний вектор вибраний з групи, яка складається з аденовірусного вектора, лентивірусного вектора, бакуловірусного вектора, вектора на основі вірусу Епштейна-Барра, паповавірусного вектора, вектора на основі вірусу коров'ячої віспи і вектора на основі вірусу простого герпесу.
30. Застосування за п. 28, де вірусний вектор вводять шляхом, вибраним з групи, яка складається з місцевого введення, внутрішньоочного введення, парентерального введення, інтратекального введення, субдурального введення і підшкірного введення.
31. Застосування за п. 28, де захворювання, порушення або пошкодження ЦНС являє собою пошкодження спинного мозку або пошкодження зорового нерва.
32. Застосування за будь-яким з пп. 28-31, де зазначений поліпептид Sp35 стимулює мієлінізацію.
33. Застосування за будь-яким з пп. 28-32, де зазначений лікарський засіб є прийнятним для стимуляції виживання нейрону, при ризику його загибелі, у ссавця з нейродегенеративним захворюванням, порушенням або пошкодженням.
34. Застосування за будь-яким з пп. 28-33, де зазначений лікарський засіб вводять в ділянку захворювання, порушення або пошкодження ЦНС або поблизу неї.
35. Застосування за будь-яким з пп. 28-34, де захворювання, порушення або пошкодження ЦНС вибране з групи, яка складається з розсіяного склерозу, ALS, хвороби Гентінгтона, хвороби Альцгеймера, хвороби Паркінсона, діабетичної невропатії, інсульту, травматичного пошкодження головного мозку і пошкодження спинного мозку.
36. Молекула інтерферуючої РНК, яка специфічно зв'язується з полінуклеотидом за п. 1 або 2, де вказана молекула інтерферуючої РНК знижує інгібування аксонального росту нейрону центральної нервової системи.
37. Молекула інтерферуючої РНК за п. 36, де вказана молекула інтерферуючої РНК являє собою малу шпилькову РНК (shPHK), і де вказана shPHK кодується молекулою ДНК, що включає в себе послідовність SEQ ID NO: 41 або SEQ ID NO: 42.
38. Застосування молекули інтерферуючої РНК за п. 36 або 37 для одержання лікарського засобу для лікування захворювання, порушення або пошкодження ЦНС, де вказана молекула інтерферуючої РНК знижує інгібування аксонального росту нейрону центральної нервової системи (ЦНС).
39. Композиція, що містить виділений поліпептид Sp35 за будь-яким з пп. 11-19 і фармацевтично прийнятний носій.
40. Композиція, що містить антитіло або його антиген-зв'язуючий фрагмент за п. 20 і фармацевтично прийнятний носій.
41. Композиція, що містить виділену нуклеїнову кислоту за будь-яким з пп. 1-8 або молекулу інтерферуючої РНК за п. 36 або 37 і фармацевтично прийнятний носій.
42. Спосіб продукування поліпептиду Sp35, що включає культивування клітини-хазяїна за п. 10 і виділення зазначеного поліпептиду Sp35 з культурального середовища.
43. Спосіб одержання антитіла за п. 20, що включає інсертування полінуклеотидів, що кодують часткові або повнорозмірні легкі та важкі ланцюги, в ті ж самі або окремі вектори експресії, трансформування прийнятної клітини-хазяїна зазначеним вектором або векторами, культивування зазначеної клітини-хазяїна за умов, у яких експресується зазначене антитіло і виділення зазначеного антитіла з культурального середовища.
44. Застосування за будь-яким з пп. 25-35, у якому зазначений лікарський засіб додатково включає допоміжну активну сполуку, вибрану з групи, що включає поліпептид Sp35, антитіло Sp35 або його фрагмент, розчинний поліпептид NgR1 та NgR1 білок злиття.
Текст
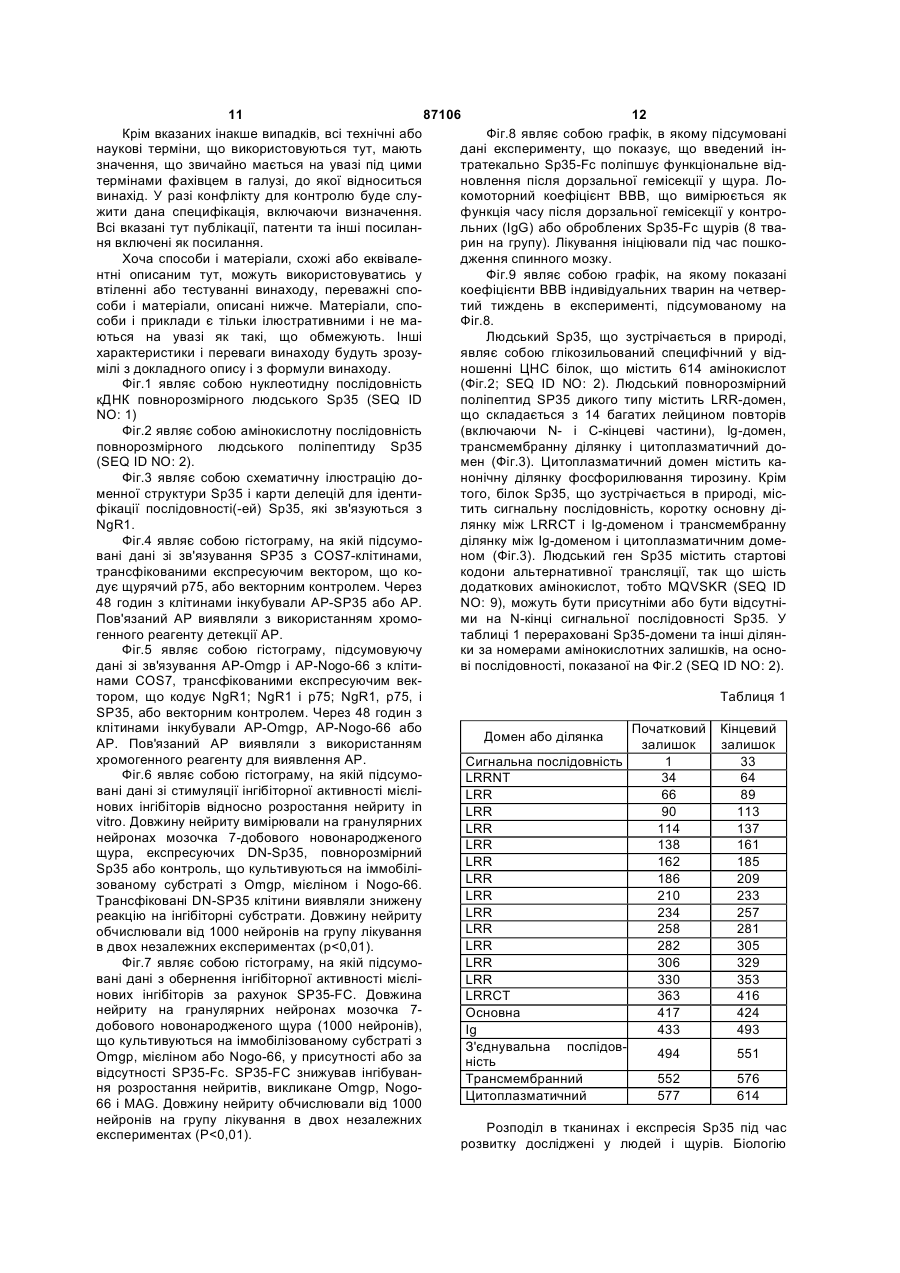
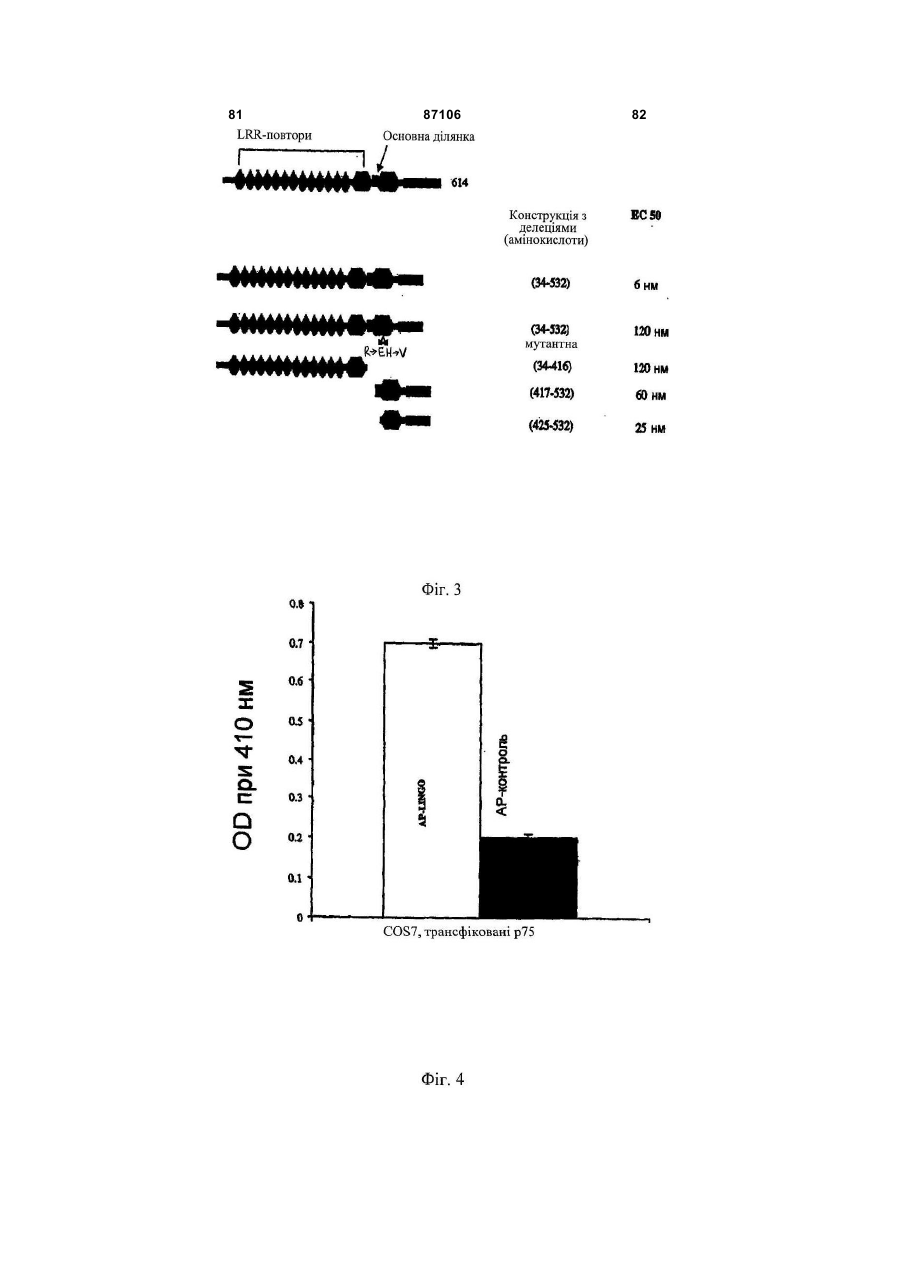
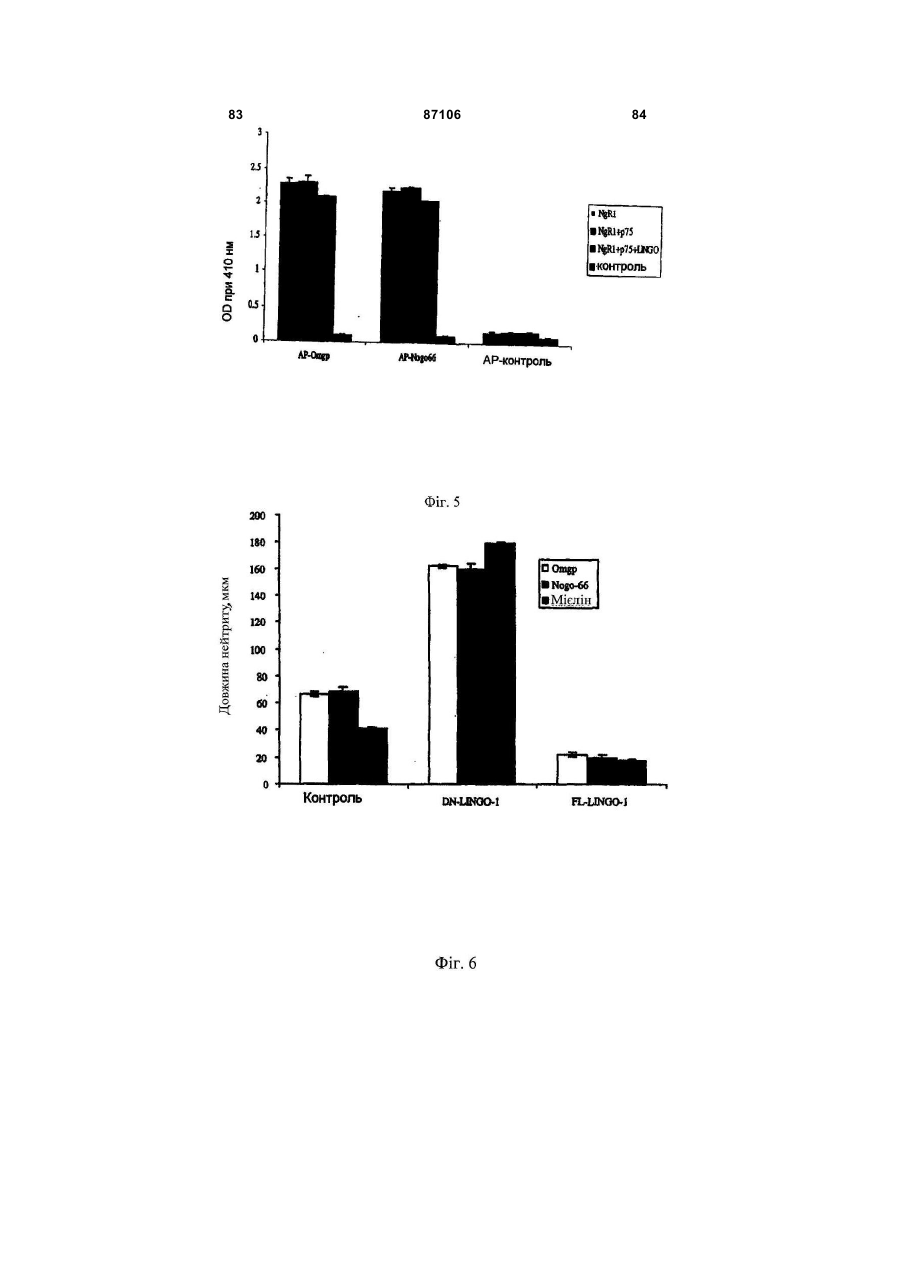
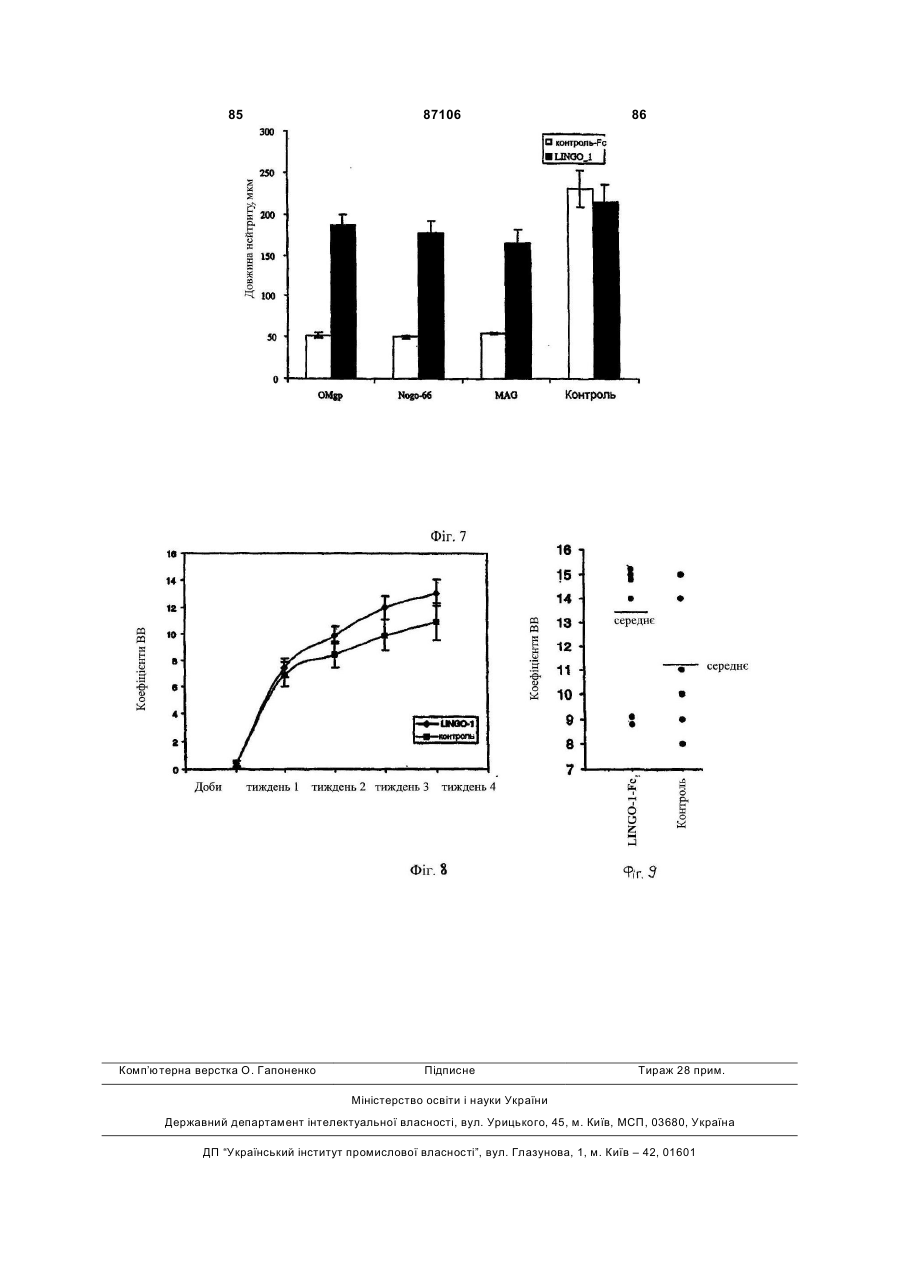
1. Виділена нуклеїнова кислота, яка містить нуклеотидну послідовність, що кодує розчинний поліпептид Sp35, вибраний з групи, яка складається з (a) поліпептиду, який включає в себе амінокислоти 34-532 послідовності SEQ ID NO: 2; (b) поліпептиду, який включає в себе амінокислоти 34-417 послідовності SEQ ID NO: 2; (c) поліпептиду, який включає в себе амінокислоти 34-432 послідовності SEQ ID NO: 2; (d) поліпептиду, який включає в себе амінокислоти 417-531 послідовності SEQ ID NO: 2; (e) поліпептиду, який включає в себе амінокислоти 425-531 послідовності SEQ ID NO: 2; 2 (19) 1 3 87106 4 4. Нуклеїнова кислота за п. 1 або п. 2, що додаткоSp35 за будь-яким з пунктів 11-19 або антитіла або во містить полінуклеотид, який кодує гетерологічйого фрагмента за п. 20. ний поліпептид, злитий з вказаним поліпептидом 23. Спосіб in vitro інгібування колапсу конусу росту Sp35. нейрону ЦНС, що включає в себе приведення за5. Нуклеїнова кислота за будь-яким з пп. 2-4, у якій значеного нейрону в контакт з ефективною кількісзазначений гетерологічний поліпептид вибраний з тю поліпептиду Sp35 за будь-яким з пунктів 11-19 групи, яка складається з поліпептиду Ig, поліпепабо антитіла або його фрагмента за п. 20. тиду сироваткового альбуміну, поліпептиду спря24. Спосіб in vitro стимуляції виживання нейрону мованої дії, поліпептиду-репортора, поліпептиду, при ризику його загибелі, що включає в себе прищо зв'язує NgR1 людини, одного або більшої кільведення зазначеного нейрону в контакт з ефектикості цистеїнових залишків і поліпептиду, що полевною кількістю поліпептиду Sp35 за будь-яким з гшує очищення. пунктів 11-19 або антитіла або його фрагмента за 6. Нуклеїнова кислота за п. 5, у якій зазначений п. 20. гетерологічний поліпептид вибраний з групи, яка 25. Застосування поліпептиду Sp35 за будь-яким з складається з імуноглобуліну Fc, сироваткового пунктів 11-19 або антитіла або його фрагмента за альбуміну людини або його фрагмента, гістидину п.20 для одержання лікарського засобу для лікуtag, олігодендроцит-мієлінового глікопротеїну або вання захворювання, порушення або пошкодженйого фрагмента, мієлін-асоційованого глікопротеїня ЦНС у ссавця. ну або його фрагмента, та глікопротеїну Nogo66 26. Застосування клітини-хазяїна за п. 10 для одеабо його фрагмента. ржання лікарського засобу для лікування захворю7. Вектор, що містить нуклеїнову кислоту за будьвання, порушення або пошкодження ЦНС у ссавяким з пп. 1-6. ця. 8. Вектор за п. 7, у якому вказана нуклеїнова кис27. Застосування за п. 26, де клітина-хазяїна, що лота оперативно зв'язана з послідовністю, яка конкультивується, походить від ссавця, який підлягає тролює експресію. лікуванню. 9. Клітина-хазяїн, що містить вектор за п. 7 або п. 28. Застосування вірусного вектора, що містить 8. нуклеотидну послідовність, яка кодує поліпептид 10. Клітина-хазяїн за п. 9, яка експресує поліпепSp35 за будь-яким з пунктів 11-19, або антитіла тид Sp35. або його фрагмента за п. 20 для одержання лікар11. Виділений полілептид Sp35, що кодується нукського засобу для лікування захворювання, порулеїновою кислотою за будь-яким з пп. 1-6. шення або пошкодження ЦНС у ссавця, де зазна12. Поліпептид за п. 11, де зазначений поліпептид чений поліпептид Sp35 експресується в організмі здатний знижувати інгібування аксонального росту ссавця з нуклеотидної послідовності в кількості, нейрону центральної нервової системи. достатній для зниження інгібування аксонального 13. Поліпептид за п. 11 або 12, де зазначений повитягування нейронів в ділянці пошкодження або ліпептид одержаний синтетичним шляхом. поблизу неї. 14. Поліпептид за п. 11 або 12, де зазначений по29. Застосування за п. 28, де вірусний вектор вибліпептид циклізований. раний з групи, яка складається з аденовірусного 15. Поліпептид за будь-яким з пп. 11-14, де зазнавектора, лентивірусного вектора, бакуловірусного чений поліпептид кон'югований з полімером. вектора, вектора на основі вірусу Епштейна16. Поліпептид за п. 15, де полімер вибраний з Барра, паповавірусного вектора, вектора на основі групи, яка складається з поліалкіленгліколю, сахавірусу коров'ячої віспи і вектора на основі вірусу ридного полімеру і поліпептиду. простого герпесу. 17. Поліпептид за п. 16, де поліалкіленгліколь яв30. Застосування за п. 28, де вірусний вектор вволяє собою поліетиленгліколь (ПЕГ). дять шляхом, вибраним з групи, яка складається з 18. Поліпептид за п. 17, де поліпептид кон'юговамісцевого введення, внутрішньоочного введення, ний з 1, 2, 3 або 4 полімерами. парентерального введення, інтратекального вве19. Поліпептид за п. 18, де загальна молекулярна дення, субдурального введення і підшкірного ввемаса полімерів становить від 20 000 Да до 40 000 дення. Да. 31. Застосування за п. 28, де захворювання, по20. Антитіло, яке специфічно зв'язується з поліперушення або пошкодження ЦНС являє собою поптидом за будь-яким з пунктів 11-19, або антигеншкодження спинного мозку або пошкодження зозв'язуючий фрагмент зазначеного антитіла, де рового нерва. вказані антитіло або антиген-зв'язуючий фрагмент 32. Застосування за будь-яким з пп. 28-31, де зазнижують інгібування аксонального росту нейрону значений поліпептид Sp35 стимулює мієлінізацію. центральної нервової системи (ЦНС). 33. Застосування за будь-яким з пп. 28-32, де за21. Спосіб in vitro інгібування трансдукції сигналу значений лікарський засіб є прийнятним для стиза рахунок NgR1, що включає в себе приведення муляції виживання нейрону, при ризику його загиNgR1-експресуючої клітини в контакт з ефективбелі, у ссавця з нейродегенеративним ною кількістю поліпептиду Sp35 за будь-яким з захворюванням, порушенням або пошкодженням. пунктів 11-19 або антитіла або його фрагмента за 34. Застосування за будь-яким з пп. 28-33, де зап. 20. значений лікарський засіб вводять в ділянку за22. Спосіб in vitro зниження інгібування росту аксохворювання, порушення або пошкодження ЦНС нів нейрону центральної нервової системи (ЦНС), або поблизу неї. що включає в себе приведення зазначеного ней35. Застосування за будь-яким з пп. 28-34, де зарону в контакт з ефективною кількістю поліпептиду хворювання, порушення або пошкодження ЦНС 5 87106 6 вибране з групи, яка складається з розсіяного 40. Композиція, що містить антитіло або його антисклерозу, ALS, хвороби Гентінгтона, хвороби Альген-зв'язуючий фрагмент за п. 20 і фармацевтично цгеймера, хвороби Паркінсона, діабетичної невроприйнятний носій. патії, інсульту, травматичного пошкодження голо41. Композиція, що містить виділену нуклеїнову вного мозку і пошкодження спинного мозку. кислоту за будь-яким з пп. 1-8 або молекулу ін36. Молекула інтерферуючої РНК, яка специфічно терферуючої РНК за п. 36 або 37 і фармацевтично зв'язується з полінуклеотидом за п. 1 або 2, де прийнятний носій. вказана молекула інтерферуючої РНК знижує інгі42. Спосіб продукування поліпептиду Sp35, що бування аксонального росту нейрону центральної включає культивування клітини-хазяїна за п. 10 і нервової системи. виділення зазначеного поліпептиду Sp35 з культу37. Молекула інтерферуючої РНК за п. 36, де вкарального середовища. зана молекула інтерферуючої РНК являє собою 43. Спосіб одержання антитіла за п. 20, що вклюмалу шпилькову РНК (shPHK), і де вказана shPHK чає інсертування полінуклеотидів, що кодують кодується молекулою ДНК, що включає в себе часткові або повнорозмірні легкі та важкі ланцюги, послідовність SEQ ID NO: 41 або SEQ ID NO: 42. в ті ж самі або окремі вектори експресії, трансфо38. Застосування молекули інтерферуючої РНК за рмування прийнятної клітини-хазяїна зазначеним п. 36 або 37 для одержання лікарського засобу для вектором або векторами, культивування зазначелікування захворювання, порушення або пошконої клітини-хазяїна за умов, у яких експресується дження ЦНС, де вказана молекула інтерферуючої зазначене антитіло і виділення зазначеного антиРНК знижує інгібування аксонального росту нейтіла з культурального середовища. рону центральної нервової системи (ЦНС). 44. Застосування за будь-яким з пп. 25-35, у якому 39. Композиція, що містить виділений поліпептид зазначений лікарський засіб додатково включає Sp35 за будь-яким з пп. 11-19 і фармацевтично допоміжну активну сполуку, вибрану з групи, що прийнятний носій. включає поліпептид Sp35, антитіло Sp35 або його фрагмент, розчинний поліпептид NgR1 та NgR1 білок злиття. Винахід відноситься до неврології, нейробіології і молекулярної біології. Більш конкретно, винахід відноситься до молекул і способів для лікування неврологічних захворювань, порушень і пошкоджень, таких як пошкодження спинного мозку. Аксони і дендрити тягнуться від нейронів. Дистальний кінець довгастого аксону або нейтриту включає в себе спеціалізовану ділянку, відому як конус зростання. Конуси зростання чутливі до локальних умов середовища і направляють зростання аксонів у бік клітини-мішені нейрону. Конуси зростання відповідають на навколишні сигнали, наприклад, на адгезію поверхні, фактори зростання, нейротрансміттери і електричні поля. Конуси зростання в основному просуваються з швидкістю від одного до двох міліметрів на добу. Конус зростання досліджує ділянку попереду себе і по обидві сторони за допомогою витягнень, що класифікуються як ламелоподії і філоподії. Коли витягнення контактує з несприятливою поверхнею, воно відстороняється. Коли витягнення контактує зі сприятливою поверхнею зростання, воно продовжує довшати і направляє конус зростання в даному напрямі. Коли конус зростання досягає відповідної клітини-мішені, створюється синаптичне з'єднання. Функція нервової клітини підлягає впливу контакту між нейронами та іншими клітинами в їх безпосередньому оточенні [Rutishauser, et al., 1988, Physiol. Rev. 68:819]. Дані клітини включають в себе спеціалізовані гліальні клітини, олігодендроцити в центральній нервовій системі (ЦНС), і шваннівські клітини в периферичній нервовій сис темі (ПНС), які укладають нейрональний аксон в мієлінову оболонку [Lemke, 1992, in An Introduction to Molecular Neurobiology, Z. Hall, Ed., p. 281, Sinauer]. Нейронам ЦНС властива здатність регенерувати після пошкодження, але вона придушується інгібіторними білками, присутніми в мієліні [Brittis et al., 2001, Neuron 30:11-14; Jones et al, 2002, J. Neurosci. 22:2792-2803; Grimpe et al, 2002, J. Neurosci.:22:3144-3160]. Охарактеризовані деякі інгібіторні білки мієліну, що знаходяться в олігодендрогліоцитах. Відомі приклади інгібіторних білків мієліну включають в себе NogoA [Chen et al., Nature, 2000, 403, 434439; Grandpre et al., Nature 2000, 403, 439-444], асоційований з мієліном глікопротеїн (MAG) [McKerracher et al., 1994, Neuron 13:805-811; Mukhopadhyay et al., 1994, Neuron 13:757-767] і олігодендрогліоцитарний глікопротеїн (OM-gp), [Mikol et al., 1988, J. Cell. Biol. 106:1273-1279]. Як було показано окремо, кожний з цих білків є лігандом нейронального NgR1 [Wang et al., Nature 2002, 417, 941-944; Grandpre et al., Nature 2000, 403, 439-444; Chen et al., Nature, 2000, 403, 434-439; Domeniconi et al., Neuron 2002, опубліковане онлайн 28 червня 2002p.]. Рецептор Nogo I (NgR1) являє собою GPIзаякорений мембранний білок, який містить 8 багатих лейцином повторів [Fournier et al., 2001, Nature 409:341-346]. Після взаємодії з інгібіторними білками (наприклад, NogoA, MAG і OM-gp), комплекс NgR1 передає сигнали, які приводять до 7 87106 8 колапсу конусу зростання та інгібування розросщо не відноситься до Sp35, являє собою фрагмент тання нейриту. Ig, наприклад, фрагмент Fc. Є незадоволена потреба в молекулах і спосоНуклеотидна послідовність може бути функцібах· для інгібування опосередкованого NgR1 колаонально пов'язана з послідовністю контролю експсу конусу зростання і одержаного в результаті пресії, наприклад, з експресуючим вектором. Виінгібування розростання нейриту. нахід також відноситься до клітини хазяїна, Авторами винаходу зроблені різні відкриття, трансформованої вектором, який експресує поліщо стосуються поліпептиду, позначеного «Sp35» пептид Sp35 за винаходом. (позначення авторів винаходу). Альтернативні Винахід також відноситься до поліпептиду позначення Sp35 включають в себе «LINGO» і Sp35, що кодується будь-якою з описаних вище «LINGO-1». Відкриття авторів винаходу включають нуклеїнових кислот. в себе наступне. Sp35 зв'язується з NgR1. Sp35 Винахід також відноситься до поліпептиду зв'язується сам з собою в гомотипічній взаємодії. Sp35, кон'югованого з полімером, наприклад, з Білок злиття Sp35-Fc індукує або сприяє розросполіалкіленгліколем, з цукровим полімером, і з танню паростків гранулярних нейронів. Білок злитполіпептидом. Переважним полімером є поліалкітя Sp35-Fc сприяє виживанню нейронів в моделі ленгліколь, наприклад, поліетиленгліколь (ПЕГ). пошкодження шляхом гемісекції руброспінального Поліпептид може кон'югуватись з 1, 2, 3 або 4 потракту і в моделі розтину очного нерва. Інфіковані лімерами. Переважно, загальна молекулярна маса Sp35-ретровірусом первинні клітини кори при докон'югованих полімерів складає від 20000Да до ставці їх щурам з пошкодженням спинного мозку 40000Да на поліпептид Sp35. забезпечують підвищене виживання нейронів, поВинахід також включає в себе спосіб інгібування трансдукції сигналу, здійснюваної за допосилення забарвлення тубуліну bIII аксонів і підвимогою NgR1. Спосіб охоплює контакт NgR1 з ефещений вміст мієліну. ктивною кількістю поліпептиду Sp35. Переважні Винахід, частково оснований на даних відкритполіпептиди для застосування за даним способом тях, відноситься до виділеної нуклеїнової кислоти, включають в себе наступне: що містить нуклеотидну послідовність, що кодує (a) поліпептид Sp35, де (а) поліпептид включає поліпептид, в якому (а) поліпептид включає в себе в себе (і) LRR-домен Sp35, (ii) основну ділянку (і) LRR-домен Sp35, (ii) основну ділянку Sp35, розSp35, розташовану з С-кінця відносно LRRташовану з С-кінця відносно LRR-домену, і (ііі) домену, і (ііі) імуноглобуліновий (Ig) домен Sp35, імуноглобуліновий (Ig) домен Sp35, розташований розташований з С-кінця відносно основної ділянки; з С-кінця відносно основної ділянки; і (b) поліпепі (b) поліпептид не має трансмембранного домену; тид не має трансмембранного домену. LRR-Домен і Sp35 може містити С-кінцевий LRR (LRRCT), N(b) поліпептид Sp35, який включає в себе Igкінцевий LRR (LRRNT) або обидва варіанти. У дедомен Sp35 і не містить LRR-домену Sp35, основяких варіантах здійснення винаходу поліпептид ної ділянки Sp35, трансмембранного домену і циSp35, що кодується, не має цитоплазматичного топлазматичного домену. домену. У деяких варіантах здійснення поліпептид Винахід також відноситься до способу зниженSp35, що кодується, включає в себе амінокислотні ня інгібування аксонального зростання нейрону залишки 34-532 SEQ ID NO: 2 і не має амінокислоцентральної нервової системи (ЦНС). Спосіб охотних залишків 533-614. плює контакт даного нейрону з ефективною кількіВинахід також відноситься до нуклеїнової кисстю поліпептиду, такого як поліпептид Sp35, антилоти, що кодує поліпептид, де поліпептид включає тіло проти Sp35 або антигензв'язу вальний в себе Ig-домен Sp35 і не має LRR-домену Sp35, фрагмент антитіла проти Sp35. основної ділянки Sp35, трансмембранного домену Винахід також включає в себе спосіб інгібуі цитоплазматичного домену. вання колапсу конусу зростання нейрону ЦНС. Винахід також відноситься до нуклеїнової кисСпосіб охоплює контакт даного нейрону з ефектилоти, що кодує поліпептид, де поліпептид включає вною кількістю поліпептиду, такого як поліпептид в себе LRR-домен Sp35 і не має Ig-домену Sp35, Sp35, антитіло проти Sp35 або антигензв'язувальосновної ділянки Sp35, трансмембранного домену ний фрагмент антитіла проти Sp35. і цитоплазматичного домену. Винахід також відноситься до способу лікуванВинахід також відноситься до нуклеїнової кисня захворювання, порушення або пошкодження лоти, що кодує поліпептид, який не має функціоЦНС у ссавця. Спосіб охоплює введення ссавцеві нального цитоплазматичного домену, але що терапевтично ефективної кількості поліпептиду, включає в себе всі інші домени Sp35. Наприклад, такого як поліпептид Sp35, антитіло проти Sp35 поліпептид, що кодується, може включати в себе або антигензв'язувальний фрагмент антитіла проамінокислоти 1-576 SEQ ID NO: 2 (перед процесити Sp35. У деяких варіантах здійснення винаходу нгом сигнальної послідовності). захворювання, порушення або пошкодження ЦНС У деяких варіантах здійснення винаходу поліявляє собою пошкодження спинного мозку. Поліпептид, що кодується, являє собою поліпептид пептид Sp35 може вводитись місцево. У деяких злиття, який містить фрагмент, що не відноситься здійсненнях способу поліпептид Sp35 вперше вводо Sp35. Фрагмент, що не відноситься до Sp35, диться протягом 48 годин з моменту пошкодження може являти собою, наприклад, фрагмент Ig, фраспинного мозку. Для місцевого введення терапевгмент сироваткового альбуміну, фрагмент спрямотично ефективна кількість поліпептиду переважно ваної дії, репортерний фрагмент, або фрагмент, складає від 10мкг/кг до 10мг/кг. Для системного що полегшує очищення. Переважний фрагмент, 9 87106 10 введення терапевтично ефективна кількість поліклітини хазяїна ссавцеві в ділянці нейронів. У депептиду переважно складає від 1мг/кг до 20мг/кг. яких варіантах здійснення винаходу поліпептид Винахід також відноситься до способу генної вводять посереднім чином за допомогою генної терапії ex vivo для лікування захворювання, порутерапії in vivo. У такому варіанті здійснення спосіб шення або пошкодження ЦНС у ссавця. Спосіб включає в себе введення в ділянку нейрону або охоплює (а) надання культивованої клітини хазяїпоблизу нього вірусного вектора, що включає в на, яка експресує рекомбінантний поліпептид себе нуклеотидну послідовність, яка кодує поліпеSp35; і (b) введення вказаної клітини хазяїна ссавптид Sp35, так що поліпептид Sp35 експресується цеві в ділянку захворювання, порушення або поз нуклеотидної послідовності в організмі ссавця в шкодження ЦНС, наприклад, пошкодження спинкількості, достатній для стимуляції виживання ного мозку. Культивована клітина хазяїна може нейрону. походити з підлягаючого лікуванню ссавця. У даТермін «повнорозмірний людський поліпептид ному способі генної терапії ex vivo рекомбінантний Sp35», що використовується тут, означає поліпепполіпептид Sp35 може являти собою повнорозміртид, амінокислотна послідовність якого являє соний поліпептид Sp35. бою амінокислоти 34-614 SEQ ID NO: 2. Винахід також відноситься до способу стимуТермін «гетерологічна група», що використоляції мієлінізації в ділянці захворювання, порувується тут, означає амінокислотну послідовність, шення або пошкодження ЦНС. Спосіб охоплює не присутню в повнорозмірному поліпептиді Sp35. контакт ділянки захворювання, порушення або Термін «рецептор nogo 1», що використовупошкодження ЦНС з ефективною кількістю поліпеється тут, означає поліпептид, послідовність якого птиду Sp35, наприклад, поліпептиду, що містить доступна під інвентарним номером Genbank LRR-домен Sp35 і не має Ig-домену Sp35, основної AAG53612. ділянки Sp35, трансмембранного домену і цитоТермін «поліпептидний антагоніст Sp35», що плазматичного домену. використовується тут, означає поліпептид Sp35, Винахід також відноситься до способу генної який блокує, інгібує або перешкоджає біологічній терапії in vivo для лікування захворювання, поруактивності Sp35, що зустрічається в природі. шення або пошкодження ЦНС за допомогою генної Термін «основна ділянка Sp35», що використерапії in vivo. Спосіб включає в себе стадії вветовується тут, означає наступний амінокислотний дення ссавцеві в ділянку захворювання, порушенмотив: ня або пошкодження, або поблизу нього вірусного R R A R I R D R K (SEQ ID NO: 4) вектора, що містить нуклеотидну послідовність, K K V K V K E K R (SEQ ID NO: 5) яка кодує поліпептид Sp35, так що поліпептид R R L R L R D R K (SEQ ID NO: 6) Sp35 експресується з нуклеотидної послідовності R R G R G R D R K (SEQ ID NO: 7) ссавця в кількості, достатній для зниження інгібуR R I R A R D R K (SEQ ID NO: 8) вання аксонального витягнення нейронів, в ділянці Верхній рядок амінокислот (жирним шрифтом; пошкодження або поблизу неї. Вірусний вектор, SEQ ID NO: 4) є переважною послідовністю основнаприклад, може являти собою аденовірусний ної ділянки Sp35, з наведеними нижче варіантами, вектор, лентивірусний вектор, вектор на основі в яких показані необов'язкові заміни (SEQ ID NO: вірусу Епштейна-Барр, паповавірусний вектор, 5, 6, 7 і 8). вектор на основі вірусу коров'ячої віспи і вектор на Термін «білок злиття Sp35», що використовуоснові вірусу простого герпесу. Захворювання, ється тут, означає білок злиття, який включає в порушення або пошкодження, наприклад, може себе фрагмент Sp35, злитий з гетерологічним являти собою пошкодження спинного мозку або фрагментом. пошкодження очного нерва. Вірусний вектор може Термін «Ig-домен Sp35», що використовується вводитись, наприклад, шляхом місцевого введентут, означає амінокислоти 433-493 SEQ ID NO: 2, ня, внутрішньоочного введення, парентерального при забезпеченні того, що дана послідовність мовведення, інтратекального введення, субдуральже містити до п'яти індивідуальних амінокислотних ного введення і підшкірного введення. вставок, делецій або консервативних амінокислотВинахід також відноситься до способу стимуних замін. Наступні заміни (нумерація по SEQ ID ляції виживання нейрону при І ризику його загибеNO: 2) введені спеціально: V на Μ в положенні 6; S лі. Спосіб включає в себе контакт нейрону з ефекна G в положенні 294; V на А в положенні 348; і R тивною кількістю поліпептиду Sp35. Поліпептид на Η в положенні 419. Sp35 може являти собою розчинну форму Sp35, Термін «LRR-домен Sp35», що використовунаприклад, білок злиття Sp35-Fc. Нейрон також ється тут, означає домен, який містить від 10 до 14 може знаходитись in vitro або in vivo, наприклад, в послідовностей - багатих лейцином повторів, організмі ссавця з нейродегенеративним захворювключаючи LRRNT і LRRCT, перераховані в табванням, порушенням або пошкодженням, наприлиці 1, при забезпеченні того, що до п'яти амінокиклад, з розсіяним склерозом, ALS, хворобою Генслотних вставок, делецій або консервативних амітінгтона, хворобою Альцгеймера, хворобою нокислотних замін можуть відбуватись в сумарних Паркінсона, діабетичною невропатією, інсультом, 10-14 багатих лейцином повторах. травматичними пошкодженнями головного мозку і Термін «фрагмент Sp35», що використовуєтьпошкодженням спинного мозку. У деяких варіантах ся тут, означає біологічно активний фрагмент повздійснення винаходу поліпептид Sp35 вводять норозмірного поліпептиду Sp35. посереднім чином: шляхом (а) надання культивоТермін «поліпептид Sp35», що використовуваної клітини хазяїна, яка експресує рекомбінантється тут, означає фрагмент Sp35 або білок злитний поліпептид Sp35; і шляхом (b) введення даної тя, який містить фрагмент Sp35. 11 87106 12 Крім вказаних інакше випадків, всі технічні або Фіг.8 являє собою графік, в якому підсумовані наукові терміни, що використовуються тут, мають дані експерименту, що показує, що введений інзначення, що звичайно мається на увазі під цими тратекально Sp35-Fc поліпшує функціональне відтермінами фахівцем в галузі, до якої відноситься новлення після дорзальної гемісекції у щура. Ловинахід. У разі конфлікту для контролю буде слукомоторний коефіцієнт ВВВ, що вимірюється як жити дана специфікація, включаючи визначення. функція часу після дорзальної гемісекції у контроВсі вказані тут публікації, патенти та інші посиланльних (IgG) або оброблених Sp35-Fc щурів (8 тваня включені як посилання. рин на групу). Лікування ініціювали під час пошкоХоча способи і матеріали, схожі або еквіваледження спинного мозку. нтні описаним тут, можуть використовуватись у Фіг.9 являє собою графік, на якому показані втіленні або тестуванні винаходу, переважні спокоефіцієнти ВВВ індивідуальних тварин на четверсоби і матеріали, описані нижче. Матеріали, спотий тиждень в експерименті, підсумованому на соби і приклади є тільки ілюстративними і не маФіг.8. ються на увазі як такі, що обмежують. Інші Людський Sp35, що зустрічається в природі, характеристики і переваги винаходу будуть зрозуявляє собою глікозильований специфічний у відмілі з докладного опису і з формули винаходу. ношенні ЦНС білок, що містить 614 амінокислот Фіг.1 являє собою нуклеотидну послідовність (Фіг.2; SEQ ID NO: 2). Людський повнорозмірний кДНК повнорозмірного людського Sp35 (SEQ ID поліпептид SP35 дикого типу містить LRR-домен, NO: 1) що складається з 14 багатих лейцином повторів Фіг.2 являє собою амінокислотну послідовність (включаючи N- і С-кінцеві частини), Ig-домен, повнорозмірного людського поліпептиду Sp35 трансмембранну ділянку і цитоплазматичний до(SEQ ID NO: 2). мен (Фіг.3). Цитоплазматичний домен містить каФіг.3 являє собою схематичну ілюстрацію дононічну ділянку фосфорилювання тирозину. Крім менної структури Sp35 і карти делецій для ідентитого, білок Sp35, що зустрічається в природі, місфікації послідовності(-ей) Sp35, які зв'язуються з тить сигнальну послідовність, коротку основну діNgR1. лянку між LRRCT і Ig-доменом і трансмембранну Фіг.4 являє собою гістограму, на якій підсумоділянку між Ig-доменом і цитоплазматичним домевані дані зі зв'язування SP35 з COS7-клітинами, ном (Фіг.3). Людський ген Sp35 містить стартові трансфікованими експресуючим вектором, що кокодони альтернативної трансляції, так що шість дує щурячий р75, або векторним контролем. Через додаткових амінокислот, тобто MQVSKR (SEQ ID 48 годин з клітинами інкубували AP-SP35 або АР. NO: 9), можуть бути присутніми або бути відсутніПов'язаний АР виявляли з використанням хромоми на N-кінці сигнальної послідовності Sp35. У генного реагенту детекції АР. таблиці 1 перераховані Sp35-домени та інші ділянФіг.5 являє собою гістограму, підсумовуючу ки за номерами амінокислотних залишків, на оснодані зі зв'язування AP-Omgp і AP-Nogo-66 з клітиві послідовності, показаної на Фіг.2 (SEQ ID NO: 2). нами COS7, трансфікованими експресуючим векТаблиця 1 тором, що кодує NgR1; NgR1 і р75; NgR1, p75, і SP35, або векторним контролем. Через 48 годин з клітинами інкубували AP-Omgp, AP-Nogo-66 або Початковий Кінцевий Домен або ділянка АР. Пов'язаний АР виявляли з використанням залишок залишок хромогенного реагенту для виявлення АР. Сигнальна послідовність 1 33 Фіг.6 являє собою гістограму, на якій підсумоLRRNT 34 64 вані дані зі стимуляції інгібіторної активності мієліLRR 66 89 нових інгібіторів відносно розростання нейриту in LRR 90 113 vitro. Довжину нейриту вимірювали на гранулярних LRR 114 137 нейронах мозочка 7-добового новонародженого LRR 138 161 щура, експресуючих DN-Sp35, повнорозмірний LRR 162 185 Sp35 або контроль, що культивуються на іммобіліLRR 186 209 зованому субстраті з Omgp, мієліном і Nogo-66. LRR 210 233 Трансфіковані DN-SP35 клітини виявляли знижену LRR 234 257 реакцію на інгібіторні субстрати. Довжину нейриту LRR 258 281 обчислювали від 1000 нейронів на групу лікування LRR 282 305 в двох незалежних експериментах (р10ням кількості RhoA-GTP, виявленої на блоті після кратне підвищення сигналу. Як альтернативний трансфекції геном Sp35. Подальше збільшення підхід для тестування внеску даної петельної ділярівня RhoA-GTP спостерігали після обробки Sp35нки в зв'язування, автори винаходу синтезували Fc. На відміну від збільшення рівня RhoA-GTP піспептид, відповідний послідовності LSPRKH (SEQ ля трансфекції одним Sp35, при трансфекції клітин ID NO: 10), який автори циклізували шляхом додаSp35 і NgR1, RhoA частково інактивувався. Обробвання цистеїнів з N- i С-кінців пептиду. Після зв'яка даних клітин Sp35-Fc приводила до подальшої зування з NgR1 даний пептид блокується, інгібує інактивації RhoA. або перешкоджає функції NgR1. Автори винаходу підтверджували сигнальну Приклад 7. Sp35 індукує розростання пароствідповідь на Sp35 з використанням аналізу FLIPR ків CGN р8 (Molecular Devices) для визначення впливу обробДля визначення біологічної функції Sp35 в ки Sp35 на струм Са++. Автори спостерігали значнейронах автори винаходу інкубували Sp35-Fc з ний струм Са++ в клітинах, які експресують Sp35, гранулярними нейронами, виділеними через 8 діб при обробці Sp35-Fc, але не в контрольних клітипісля народження, для виявлення того, чи може нах, оброблених Sp35-Fc. Струм Са++ знижувався, Sp35 регулювати розростання нейриту. Культураколи клітини, які спільно трансфікували NgR1 і льні слайди Labtek (8 ямок) покривали полі-DSp35, обробляли білком злиття Sp35-Fc. лізином (Sigma) в концентрації 0,1мг/мл до розкоПриклад 9. Взаємодія білка Sp35 з самим сопування білка Sp35-Fc (16мкг/ямку білка). Слайди бою сушили протягом ночі, потім ополіскували і покриОскільки домени LRR часто беруть участь в вали ламініном (Gibco) в концентрації 10мкг/мл. гомотипічних взаємодіях, і автори винаходу споМозочкові гранулярні нейрони, виділені через 8 діб стерігали, що додавання розчинного Sp35 до після народження, дисоціювали і висівали на затрансфікованих Sp35 клітин спричиняє підвищення здалегідь покриті слайди. Культури на слайдах RhoA-GTP у порівнянні з тим, що спостерігається інкубували при 37°С в 5% СО2 протягом 24 годин. при трансфекції одним Sp35, автори тестували Потім слайди фіксували в 4% параформальдегіді, зв'язування Sp35 з самим собою. Для проведення що містить 20% сахарозу, і забарвлювали антитіданого тесту автори винаходу використали спільну лом проти тубуліну bIII (Covance TUJ1). Через 24 імунопреципітацію. Клітини COS7, зімкнені на 80%, години CGN характеризувались виразною пучковирощені на чашках для культури тканини діаметподібною морфологією, що підтверджувалось гілром 100мм, трансфікували плазмідами Sp35 НА куванням паростків нейронів. Розростання паростабо Sp35-FLAG, або обома, з використанням реаків не спостерігалось в необроблених клітинах або гентів Fugene 6 (Roche). Через сорок вісім годин контрольних зразках, покритих білком Fc. після трансфекції клітини збирали і лізували в 1мл Приклад 8. Дія Sp35 на активацію/інактивацію лізуючого буфера (50мМ HEPES, рН 7,5, 150мМ RhoA NaCl, 1,5мМ MgCl2, 1мМ EGTA, 1% Triton X-100 і Sp35-Fc індукував розростання паростків в по10% гліцерин) при 4°С протягом 30хв. Лізат стнатальних гранулярних нейронах мозочка. Оскіцентрифугували при 14000хg протягом 15хв., і льки, як відомо, сигнальна молекула RhoA залуче 37 87106 38 зразки надосадової рідини збирали та інкубували, як описано. Клітини 293G пересівали за добу до при 4°С протягом ночі при перемішуванні, з афінтрансфекції. 8мкг Sp35-ретровірусної ДНК викориним матриксом проти НА (Roche). Потім зразки стали для трансфекції 5x106 клітин із застосуванпромивали 3 рази 1мл лізуючого буфера, проминям ліпофектаміну (Invitrogen). Підготовлене серевали в буфері Леммлі для зразка, піддавали 4довище збирали через 92 години після 15% SDS-PAGE, і аналізували шляхом імуноблоту трансфекції. Підготовлене середовище центрифуз антитілами проти FLAG. Смола з антитілами гували при 5000xg протягом 10 хвилин, і надосапроти НА захоплювала комплекс, який містив дову рідину використали як маточний розчин ретSp35-FLAG, що визначено шляхом вестерн-блоту. ровірусу Sp35. Даний маточний розчин зберігали Це вказувало на пряму взаємодію Sp35 з самим при 4°С протягом 1 тижня або при -80°С протягом собою. Автори винаходу також обробляли клітини, 6 місяців. трансфіковані HA-Sp35, Sp35-Fc, і використали Приклад 11. Модель пошкодження спинного схожий підхід імунопреципітації для того, щоб помозку на тваринах казати, що HA-Sp35 зв'язується з Sp35-Fc. Всі хірургічні процедури проводять з викорисSp35-FLAG одержували таким чином. Позаклітанням асептичного способу. Протягом 1 тижня до тинний домен гена Sp35 (а.к. 1-531) ампліфікували будь-якої хірургічної маніпуляції тварин привчають шляхом ПЛР з використанням праймерів до рук. Перед і після операції для профілактики 5'AATTAAGCGGCCGCAT6CTGGCGGGGGGCGT3' вводять ампіцилін 100мг/кг п./ш. для зниження ризику інфекційного пошкодження сечового міху(SEQ ID NO: 35) і ра. 5'AATTAAGCGGCCGCTTTGTCATGT3' (SEQ ID Тварин піддають анестезії з використанням NO: 36), що містять ділянки NotI (підкреслено). мідазоламу в дозі 2,5мг/кг в./чер. в поєднанні з 2Продукт ПЛР розщеплювали NotI і вбудовували в 3% ізофлураном в О2 для глибокого наркозу, який ділянку NotI вектора pV90. Послідовність ДНК оцінюють пощипуванням пальця. Протягом операвставки підтверджували шляхом секвенування ції і відновлення від неї тварин тримають на подуДНК. шці, що нагрівається, з циркулюючою водою. Очну Приклад 10. Трансплантація трансформовазмазку використовують для запобігання висиханню них Sp35 клітин in vivo ока, і атропін в дозі 0,05мг/кг п./ш. вводять для Для визначення біологічної функції Sp35 у щузниження надмірного слиновиділення. На шкірі рів з пошкодженням спинного мозку автори винароблять маленький розріз, і відводять м'яз, щоб ходу інфікували коркові клітини в первинній кульвідкрити хребці. Проводять дорзальну ламінектотурі (змішані культури) ретровірусом, мію на рівні хребця L6 (і L7, якщо необхідне приекспресуючим повнорозмірний Sp35 або ретровіміщення ітратекального катетера, див. нижче), русним контролем, для доставки в епіцентр поL6/L7, і прилеглі остисті паростки міцно фіксують в шкодження спинного мозку щура. Вводили 2x106 спінальній рамці (David Kopf Instruments). Провоклітин, і щурів фіксували на 10 добу. Зразки спиндять дорзальну гемісекцію на рівні L6 тонкими ноного мозку фіксували протягом ночі в 4% парафожицями для іридектомії, повністю перериваючи рмальдегіді, потім дегідрували в 70% EtOH, і потім головний дорзомедіальний і малий дорзолатерав 95% ЕТОН. Зразки тканини просочували парафільний компоненти кортикоспінального тракту ном. Зрізи (товщиною 10 мікрон) використали для (CST). Після операції ділянку ламінектомії покриімуногістохімічного забарвлення. Щури, які одервають захисним матеріалом, таким як Durafilm, і жували клітини, які експресують Sp35, у порівнянні зшивають належні м'язи хромовою ниткою 4,0 для з контролем характеризувались меншим скорозахисту відкритого хребта. Шкіру зшивають і проченням аксонів і великим забарвленням тубуліну тирають розчином бетадину. bIII поблизу епіцентру. У щурів з пошкодженням, Функціональне відновлення тварин оцінюють з Sp35, що одержували, спостерігали підвищене використанням способу коефіцієнта Basso Seattle виживання нейронів. and Bresnehan (BBB), який звичайно застосовуєтьРетровірусну конструкцію Sp35 одержували ся для оцінки щурів після пошкодження спинного таким чином: ген Sp35 ампліфікували шляхом ПЛР мозку. У даному способі проводиться кількісний з використанням праймерів 5'аналіз функції задніх кінцівок щурів шляхом доGATTACTCGAGATGCTGGCGGGGGGCGTGAGGкладного аналізу рухливості в суглобах і здатності 3' (SEQ ID NO: 37), що містить ділянку Xhol (підперенести вагу. Щурів оцінюють через добу після креслено), і пошкодження спинного мозку, після цього - щоти5'CGCGGGAATTCTCATATCATCTTCATGTTGAACT жня. TG-3' (SEQ ID NO: 38), що містить ділянку EcoRI Безпосередньо після пересічення CST в ділян(підкреслено). Продукт ПЛР розщеплювали Xhol і ку пересічення і безпосередньо в каудальному і EcoRI, потім лігували в ретровірусний вектор pMIG ростральному напрямі від ділянки пошкодження (який містить IRES-GFP), який раніше розщеплювводять ін'єкцією аденовірус, експресуючий Sp-35 вали Xhol і EcoRI. Новий вектор називали або GFP, або контрольний вірус (1010 частинок). рММС078. Всі ізоляти рММС078 містили незаплаВсього 10мкл аденовірусу вводять в 5 різних діляновані точкові мутації, так що два ізоляти нок (4мкл/ділянку). Для інтратекального введення рММС078 лігували разом. рММС078.6 розщеплюбілка Sp35 в твердій оболонці спинного мозку робвали Xhol і АссІ, і рММС078.7 розщеплювали Xhol і лять маленький отвір в 2мм каудально від пошкоАссІ. Ці два фрагменти лігували разом з одержандження L7, і вбудовують інтратекальний катетер в ням кінцевої правильної плазміди рММС089. Посубарахноїдальний простір в ділянки L7. Катетер слідовність ДНК вставки підтверджували шляхом повільно і акуратно ведуть вздовж спинного мозку секвенування ДНК. Ретровірус Sp35 одержували, 39 87106 40 приблизно на 1мм каудальніше пошкодження. Ча3' (SEQ ID NO: 37), що містить ділянку Xhol, і стину катетера, яка лежить поза інтратекальним праймера простором, щільно пришивають до навколишньої 5'CGCGGGAATTCTCATATCATCTTCATGTTGAACT тканини. Підготовлений мініосмотичний насос TG-3' (SEQ ID NO: 38), що містить ділянку EcoRI. (Alza Corp.), який містить матеріал (білок Sp35 або Продукт ПЛР розщеплювали Xhol і EcoRI, потім контрольний білок), що тестується, приєднують до лігу вали в ретровірусний вектор pMIG [Cheng et експонованого кінця направляючої канюлі і вміщуal, 1996, Nat. Biotechnol. 145:576], який розщеплюють в підшкірний простір. Після хірургічного втрували Xhol і EcoRI. Даний вектор позначали чання ділянки ламінектомії покривають протективрММС078. Всі ізоляти рММС078 містили точкові ним матеріалом, таким як Durafilm, і зшивають мутації, так що два ізоляти рММС078 лігували раналежні м'язи хромовою ниткою 4,0 для захисту зом. Вектор рММС078.6 розщеплювали Xhol і АссІ, відкритого хребта. Шкіру зшивають і протирають і рММС078.7 розщеплювали Xhol і АссІ. Ці два розчином бетадину. фрагменти лігували з одержанням плазміди Гістологічний аналіз. Операцію з мічення тракрММС089. тів проводять під час операції з індукції пошкоВиникаючий від pMIG вірусний вектор Sp35-HA дження спинного мозку. Шкіру голови голять і проодержували таким чином. Фрагмент, що кодує амітирають бетадином і 70%-ним спиртом. Тварину нокислоти Sp35 326-614, в рамці зчитування з повміщують в рамку стереотаксису. Скальп розтинаслідовністю НА, одержували з використанням ПЛР ють подовжньо, і зіскоблюють періост зі зведення з праймером 5'черепа. У черепі просвердлюють отвір приблизно GCCTTCCGCGGCCTCAACTACCTGCGCGTGCTC1-2мм в діаметрі, і вставляють скляну мікролітрову 3' (SEQ ID NO: 39), що містить ділянку SacII, і 5'голку вертикально в 8 місць моторної кори (коорCCGGAATTCTCAAGCGTAATCAGGAACGTCGTAA динати визначають за атласом мозку щура GGGTATATCATCTTCATGTTGAACTTGCGGGGCG Paxinos and Waston, 1997). Приблизно 5мкл матеCGTCGGC-3' (SEQ ID NO: 40), де рММС089 слуріалу для мічення трактів (наприклад, біотинжила матрицею. Більш довгий праймер включає в декстран-амін, мол. маса 10000) вводять шляхом себе кодуючу НА послідовність (курсив) після коін'єкції, і голку залишають на місці ще на п'ять хвидону 614 Sp35 і перед ділянкою EcoR І. Потім пролин для забезпечення дифузії розчину. Після видукт ПЛР розщеплювали Sac II і EcoR І, і викорисдалення голки отвір в черепі заклеюють гелевою тали для заміни фрагменту Sac II-EcoR I, що піною, і скальп скріпляли, закриваючи ділянку помістить кодони 326-614 Sp35 дикого типу, у винишкодження. Тваринам дозволяють відновитись і каючому від pMIG ретровірусному векторі. одержати післяопераційний догляд (описаний виБакуловірусний вектор Sp35 НА одержували ще). Через чотири-десять тижнів тварин піддають таким чином. Кодуючу Sp35-HA послідовність з глибокому наркозу (інактин 100-110мг/кг в.чер.) і ретровірусного вектора Sp35-HA розщеплювали перфузують для вивчення гістології, як описано Xho І і EcoR I, затупляли кінці і клонували за доповище. Матеріал для мічення тракту переноситься могою Bg12-fill-in в ділянку бакуловірусного човнимеханізмами антеградного транспорту вниз по кового вектора pBV-CZPG [патенти США № кортикоспінальному тракту в напрямі каудального 6190887; і 6338953], заміняючи ген LacZ під прокінця спинного мозку і надає спосіб кількісного мотором CMV. аналізу анатомічної цілісності в межах кортикоспіАденовірусний вектор Sp35 одержували таким нального тракту. Для експериментів з імуногістохічином. Послідовність Sp35-IRES-GFP з ретровірумії тварин піддають глибокому наркозу інактином су Sp35 розщеплювали Xho I-fill-in і Nhe І, потім (100-110мг/кг в.чер.) через 2-8 тижні після операції клонували в ділянки EcoRI-flll-in/Nhe І аденовірусз індукції пошкодження. Грудну порожнину відкриного човникового вектора pDC315, під мінімальний вають і виймають серце для забезпечення перфупромотор CMV. зії. У лівий шлуночок вставляють канюлю, через Приклад 13. Модель ремієлінізації на тваринах яку повільно нагнітають 100сс крижаної PBS (в У всіх дослідженнях використали щурівправому шлуночку прорізають отвір для забезпесамиць Long Evans. Щурів піддавали наркозу з чення виходу рідини). За цим слідує повільне, але використанням ізофлурану, і витягували Т3/4 і рівномірне проколювання 4% параформальдегіду проводили дорзальну геміламінектомію. Потім (50-100мл) до явної фіксації очей/вух/пальців. Вивводили шляхом ін'єкції хімічний демієлінізуючий даляють спинний мозок, піклуючись про мінімальзасіб, лізолецитин (3мкл 1% лізолецитину в 0,9% ну зміну ділянки пошкодження, заморожують в сольовому розчині) у правий бік дорзальних стовОСТ, роблять зрізи і готують їх для імуногістохімії. пів спинного мозку в 0,5-1мм нижче поверхні мозТакож необов'язково збирають інші тканини для ку). До і після операції проводили відповідну знеподальшого аналізу. Тварини, що одержували болюючу обробку. аденовірус з Sp35, характеризувались підвищеним Через три доби ділянку ін'єкції повторно витягілкуванням аксонів, що визначено забарвленням гують (під ізофлурановим наркозом з відповідною знеболюючою обробкою), і вводять шляхом ін'єкції тубуліну bIII в аксонах нейронів. в пошкоджений спинний мозок наступні засоби: в Приклад 12. Конструкції вірусного вектора 5рділянку пошкодження вводять аденовірусний век35 тор, що кодує білок Sp35/контрольний білок. 1010 Виникаючий з pMIG вірусний вектор Sp-35 частинок аденовіруса, що кодує Sp35 або контодержували таким чином. Повнорозмірну кодуючу роль GFP в об'ємі 10мкл, вводять шляхом ін'єкції в Sp35 послідовність ампліфікували шляхом ПЛР з пошкоджений спинний мозок щура в різні ділянки, використанням праймера 5'числом до 5, в ділянку індукованої лізолецитином GATTACTCGAGATGCTGGCGGGGGGCGTGAGG 41 87106 42 демієлінізації і навколо неї. У кожну з 5 ділянок чими р75 клітинами. АР-Р75 зв'язувався з експреін'єкції вводять об'єм, що не перевищує 2мкл. Для суючими NgR1 клітинами. Зв'язування AP-SP35 з гістологічного аналізу демієлінізації/ремієлінізації NgR1 і р75 вимірювали за допомогою ELISA спинного мозку через 2, 3, 4 або 6 тижнів після (Фіг.4). По-друге, зв'язування SP35 з NgR1 і р75 операції, тварин піддають глибокому наркозу за оцінювали за допомогою спільної імунопреципітадопомогою інактину (100-110мг/кг в.чер.) і провоції з клітин COS7, які одночасно експресують дять перфузію фіксуючого розчину через серце. SP35, NgR1 і р75. Антитіло проти NgR1 імунопреПотім виймають спинний мозок і готують до аналіципітувало комплекс, що містить SP35 і р75. Антизу. Тварини, що одержували лікування Sp35, харатіло проти SP35 також імунопреципітує комплекс, ктеризувались підвищеною мієлінізацією аксону, що містить р75. Дані із взаємодії і спільної імунощо визначене ІНС з використанням антитіла проти преципітації надавали докази прямої взаємодії між МВР або швидким луксолом блакитним. SP35, NgR1 і р75. Автори винаходу застосовували Приклад 14. РНКі Sp35 конфокальну мікроскопію і антитіла проти SP35, Для визначення ролі Sp35 у функції мозку авр75 і NgR1 для того, щоб показати, що SP35, NgR1 тори винаходу вводили лентивірусну РНКі Sp35 в і р75 спільно локалізуються в тілах клітин і аксонах клітини CGN, виділені на 8 добу після народження. нейронів р7 CG з щурів. Інфіковані РНКі Sp35 клітини мали більш короткі Далі авторами винаходу показано, що поєднейрити і більш високу швидкість проліферації, ніж нання SP35, NgR1 і р75 достатнє для активності контрольні клітини. Дані результати вказують на мієлінового інгібітору. Не нейронні клітини COS7 роль Sp35 в регуляції активації RhoA. конструювали так, щоб вони експресували всі три Послідовності ДНК Sp35 миші і щура порівнюкомпоненти. З використанням даних клітин автори вали на предмет пошуку ділянок гомології для завинаходу показали, що рівень RhoA/GTP позитивстосування кандидатних PHKsh. CH324 конструюно регулюється OMgp. Обробка OMgp-Fc підвищували шляхом відпалу олігонуклеотидів LV1-035 і вала рівень RhoA/GTP в клітинах, які одночасно LV1-036 і лігування з pLL3.7, розщепленої НраІ і експресують SP35/p75/NgR1, у порівнянні з іншиXhol. Олігонуклеотиди одержували від MWG. Поми комбінаціями трьох цих компонентів. Автори слідовності являють собою: винаходу підтверджували експресію білків за доLV1-035 (смисловий олігонуклеотид) помогою вестерн-блоту лізатів клітин COS7. Спо5'TGATCGTCATCCTGCTAGACTTCAAGAGAGTCT рідненість мієлінових інгібіторів, що зв'язуються з AGCAGGATGACGATCTTTTTТС (SEQ ID NO: 41) NgR1, не підпадала під вплив присутності р75 або LV1-036 (антисмисловий олігонуклеотид) р75 і SP35. Об'єднання результатів підтримує мо5'TCGAGAAAAAAGATCGTCATCCTGCTAGACTCT дель, згідно з якою потрійний комплекс NgR1, CTTGAAGTCTAGCAGGATG ACGATCA (SEQ ID SP35 і р75 потрібний для регуляції RhoA у присутNO: 42). ності лігандів NgR1 (Фіг.5). Перед продукцією вірусу ДНК з pLL3.7 або каSP35 містить цитоплазматичний домен, який ндидатної shPHK в pLL3.7 одночасно трансфікупотенційно прямо або непрямо залучений до певали з мишачою плазмідою, міченою SP35-HA, у редачі сигналу. Для визначення ролі цитоплазмавідношенні 5 до 1, в клітини СНО в 6-ямковому тичного домену автори винаходу продукували форматі. Нокдаун аналізували детекцією шляхом SP35, укорочений по цитоплазматичному домену вестерн-блоту мітки SP35-HA з трансфікованих (амінокислоти від 34 до 576 SEQ ID NO: 2), для лізатів клітин СНО, і шляхом нозерн-блоту загальфункціонування домінантно-негативним чином за ної ДНК, одержаної з паралельних ямок. Блот зондопомогою утворення непродуктивного потрійного дували фрагментом mSP35 розміром 0,7тис.н.п. комплексу, не здібного до передачі. Автори визнаАналізи проводили через 48 годин після трансфечили дану молекулу з укороченням по цитоплазкції (дані не показані). Віруси продукували з краматичному домену «DN-SP35» (по dominant щого кандидата на застосування в культурах нейnegative SP35). Автори винаходу трансфікували ронів щура. Вектор, додаткова методологія і повнорозмірним SP35 або DN-SP35 нейрони CG, продукція вірусу відповідали описаним в [Rubinson виділені на 7 добу після народження (р7), і потім et al. "A lentivirus-based system to functionally аналізували їх відповідь на інгібіторні компоненти silence genes in primary mammalian cells, stem cells мієліну (Omgp, мієлін і Nogo66). Як показано на and transgenic mice by RNA interference". Nat. Фіг.6, трансфіковані DN-SP35 клітини не відповіGenet. 33, 401-6 (2003)]. дали на інгібіторні компоненти мієліну і характериПриклад 15. Активація RhoA зувались більш довгими нейритами у порівнянні з Клітини COS7, які одночасно експресують контролем. Клітини, трансфіковані повнорозмірNgR1 і SP35, не характеризувались змінами рівня ною конструкцією SP35, навпаки, характеризуваRhoA/GTP у відповідь на OMgp. Це вказує на те, лись підвищеною відповіддю на інгібіторні субщо утворення комплексу SP35/NgR1 не достатнє страти, і характеризувались більш короткими для забезпечення трансдукції сигналу за допомонейритами у порівнянні з контролем. Це демонгою мієлінового інгібітору. струє, що DN-SP35 діє як конкурентний інгібітор Автори винаходу досліджували можливість топридушення розростання нейритів, викликаних го, що передачу сигналу опосередковує потрійний компонентами мієліну. Автори винаходу чекали, комплекс SP35/NgR1/p75. Для оцінки взаємодії між що екзогенний, розчинний SP35-FC також зв'язує SP35, NgR1 і р75 використали два підходи. ПоNgR1 і блокує дію інгібітор них речовин. Як покаперше, зв'язування оцінювали прямим аналізом зано на Фіг.7, SP35-FC знижує інгібування розросзв'язування з використанням кон'югату AP-SP35. тання нейритів за рахунок Omgp, Nogo66 і MAG. Кон'югат АР-SP35 слабо зв'язувався з експресуюПриклад 16. Нейропротекторна активність 43 87106 44 Рівні кількості щурячих гранулярних нейронів ках, покритих мієліном, Nogo66, MAG і OMgp. Було мозочка р6 вміщували в кожну ямку 12-ямкового мінімальне розростання нейритів [коротких і випланшета для культури клітин у присутності або за кривлених], і нейрони виявлялись нездоровими, з відсутності 50нМ білка sp35-Fc. Дані полі-Dокруглим тілом клітини і конденсованою ядерною лізинові планшети заздалегідь покривали [дозворечовиною. Забарвлення DAPI продемонструвало, ляли висохти в них] 10мкг мієліну ЦНС, або 200нг що число нейронів, які виявляються в даних ямNogo66, MAG і OMgp або контролем-Fc. Культури ках, було меншим, ніж в контрольних ямках з PBS, нейронів підтримували протягом 1-7 діб при 37°С і що вказувало на втрату нейронів. У присутності 5% СО2. Нейрони були здоровими і добре росли в sp35-Fc були присутніми довгі нейрити, і нейрони контрольних ямках з PBS, з повним витягненням виявлялись здоровими. Забарвлення DAPI демоннейритів незалежно від обробки sp35-Fc [визначеструвало більше число нейронів в даних ямках у но за допомогою специфічного нейронального порівнянні з тими, куди не вводили sp35-Fc. Дані підсумовані нижче в таблиці 2. маркера, тубуліну bIII], за оцінкою після 3 діб. За відсутності sp35-Fc нейрони не росли добре в ямТаблиця 2 висушений субстрат: витягнення нейритів морфологія тіла клітини ядерна речовина число нейронів в кінці експерименту висушений субстрат: витягнення нейритів морфологія тіла клітини ядерна речовина число нейронів в кінці експерименту За відсутності sp35-Fc OMgp/Nogo/MAG/мієлін короткі викривлені округла конденсована знижене У присутності sp35-Fc OMgp/Nogo/MAG/мієлін довгі довгасті розпростерта прозора знижене менше, ніж в контролі FC Ці дані вказують на те, що розчинна форма Sp35, наприклад, Sp35-Fc, володіє нейропротекторною активністю. У спинному мозку щурів з гемітрансекцією (Т9, SCT) забарвлення тубуліну b-IIΙ зрізів спинного мозку виявляло істотну втрату нейронів в ділянці пошкодження. Рекомбінантний вірус, експресуючий sp35, використали для інфікування тваринних SCT в ділянці пошкодження. Гістологічне забарвлення даних зразків спинного мозку виявляло підвищене число нейронів навколо ділянки пошкодження у порівнянні з контрольною групою, яку інфікували векторним вірусом. Це співвідноситься з експериментальними знахідками in vitro, описаними вище, і вказує на подальші нейропротективні властивості, асоційовані з Sp35. Приклад 17. Sp35 в моделі пошкодження спинного мозку на тваринах Оскільки Sp35-Fc знижував розростання нейритів, викликане OMgp, Nogo-66 і MAG in vitro, автори винаходу чекали, що дана молекула сприяє функціональному відновленню пошкоджень ЦНС in vivo. Для підтвердження цього автори вводили Sp35-Fc в спинний мозок підданих гемісекції щурів, тобто, моделі гострої травми ЦНС на тваринах. Як показано на Фіг.8 і Фіг.9, оброблені Sp35-Fc щури демонстрували значно поліпшене функціональне відновлення у порівнянні з контрольними щурами, обробленими IgG. Пошкодження спинного мозку і аналіз поведінки проводили таким чином. Всі хірургічні процедури проводили згідно з керівництвом Biogen Institutional Animal Use and Care Committee. Щурівсамиць Long Evans (190-210г, Charles River, Wilmington, Массачусетс) піддавали наркозу з ви контроль Fc довгі довгасті розпростерта прозора те ж, що в контролі Fc контроль Fc довгі довгасті розпростерта прозора те ж, що в контролі Fc користанням 2,5мг/кг мідазоламу в.чер. і 2-3% флуотану в 02. Дорзальну ламінектомію проводили на рівні хребців Т6 і Т7. Здійснювали дорзальну гемісекцію, повністю перериваючи головний дорзомедіальний і малий дорзолатеральний компоненти кортикоспінального тракту (CST). Негайно після трансекції CST в субарахноїдальний простір вбудовують інтратекальний катетер на рівні Т7 і з'єднують його з підготовленим мініосмотичним насосом (Alzet, модель 2004), вбудованим в підшкірний простір. Мініосмотичні насоси доставляли контрольний людський білок ізотипу Hu IgG (5мг/мл, n=5, Pharmingen), PBS (n=3), розчинний білок злиття Ні Sp35-Ig (4,3мг/мл, n=8) з швидкістю 0,25мкл/ч. Після операції ділянку ламінектомії зшивали і скріпляли рану в шкірі. Післяопераційний догляд включав в себе анальгезію (бупренорфін, 0,05мг/кг п.ш.) протягом 3 діб і обробку антибіотиком (ампіцилін 100мг/кг п.ш. два рази на добу) протягом 7 діб після операції. Сечовий міхур спустошували вручну два рази на добу протягом дослідження (28 діб) або до повернення функції (цей момент відмічали). Всі тварини наосліп оцінювали за допомогою системи тестів «відкритого поля» ВВВ [Basso et al., 1995, J. Neurotrauma 12:121; Ono et al., 2003, J. Neurosci. 23:5887-5896]. Щурів оцінювали на добу після трансекції CST (доба 2) і після цього щотижня протягом 4 тижнів з використанням рейтингової шкали локомоції BassoBeattie-Bresnahan (ВВВ). Дослідники працювали з різними групами обробки наосліп протягом дослідження. Приклад 18. Виживаність нейронів і регенерація аксонів в моделі гемісекції руброспінального тракту (RST) 45 87106 46 Автори винаходу також досліджували дію обДля аналізу поведінки оцінювали застосування робки Sp35 на регенерацію нейронів в руброспінапередніх кінцівок під час спонтанного дослідження льному тракті, який безпосередньо бере участь в у вертикальному напрямі через місяць після різних локомоції. способів обробки, як описано [Liu et al., 1999] з Дорослих щурів Sprague-Dawley у віці 9 тижнів невеликими модифікаціями. Щурів вміщували в (200-250г) піддавали анестезії шляхом внутрішчистий плексигласовий циліндр (15см в діаметрі і ньочеревинної ін'єкції кетаміну (80мг/кг) і ксилази30см у висоту), де допускали застосування передну (8мг/кг). З використанням операційного мікроніх кінцівок для дослідження у вертикальному наскопа проводили ламінектомію і виявляли сьомий прямі протягом 5хв. Проводили підрахунок наступгрудний хребець (С7). Після відкриття твердої них типів поведінки: (1) незалежне використання оболонки проводили правосторонню гемісекцію на лівих (непошкоджених) або правих (непошкоджерівні спинного мозку С7 з використанням пари них) передніх кінцівок для контакту зі стінкою циліпружинних ножиць. Після гемісекції спинного мозку ндра; і (2) одночасне використання обох передніх тварини одержували шматок гелевої піни, змішакінцівок для контакту зі стінкою циліндра. Поведінної з 10мкл 2мкг/мл розчину Sp35-Fc, або з 10мкл ку по дослідженню у вертикальному напрямі вира2мкг/мл розчину людського Ig, або з 10мкл PBS, жали в плані (1) процентної частки використання який вміщували зверху ділянки пошкодження. Післівої (непошкодженої) передньої кінцівки по відля операцій тварин в кожній групі поділяли для ношенню до загального числа застосування повідстеження шляху аксонів і аналізу поведінки. шкодженої, непошкодженої і обох кінцівок; (2) проТваринам, призначеним для відстеження шляху центної частки використання правої (пошкодженої) аксонів (n=5 в кожній групі) і аналізу поведінки (n=7 передньої кінцівки по відношенню до загального в кожній групі), забезпечували виживання протячисла застосування пошкодженої, непошкодженої і гом 1 місяця. обох кінцівок; і (3) процентної частки використання Fluoro-Gold (FG, 6% мас/об., Fluorochrome) виобох кінцівок по відношенню до загального числа користали для мічення нейронів RST, аксони яких застосування пошкодженої, непошкодженої і обох регенерували, пересікаючи рубець пошкодження, і кінцівок. Відмінності між групами тестували за доповторно увійшли в каудальний спинний мозок. За помогою одностороннього дисперсійного аналізу з двоє діб до закінчення періоду виживання після подальшим «post hос»-аналізом Бонферроні. Обпошкодження (1 місяць), тварин піддавали наркозу роблені Sp35-Fc тварини характеризувались значвнутрішньочеревинною ін'єкцією кетаміну (80мг/кг) но поліпшеною рухливістю передніх кінцівок: 30% і ксилазину (8мг/кг). Проводили дорзальну ламіневикористання обох передніх кінцівок у оброблених ктомію, та ідентифікували сегмент хребта Т2. FG в Sp35-1-Fc тварин у порівнянні з 10% використання об'ємі 0,5мл вводили вручну в праву частину обох передніх кінцівок у оброблених контролем-Fc спинного мозку Т2 з використанням шприца Гаміабо PBS тварин; 55% використання лівої (непольтона. Через двоє діб тварин піддавали анестезії шкодженої) кінцівки у порівнянні з 80% викорисі фіксували летальною дозою кетаміну (150мг/кг) і тання у оброблених контролем-Fc або PBS тваксилазину (8мг/кг), і їх перфузували внутрішньосерин; і 29% використання правої (пошкодженої) рцево фіз.розчином і далі 400мл фіксуючого розкінцівки у порівнянні приблизно з 15% у оброблечину, що містить 4% параформальдегіду в них контролем-Fc або PBS тварин. 0,1xPBS. Видаляли головний і спинний мозок, фікПриклад 19. Sp35-Fc сприяє виживанню клітин сували їх після вилучення протягом ночі і потім ганглію сітківки (RGC) в моделі перетину зорового вмішували в 30% розчин сахарози в фосфатному нерва буфері. З тканин головного і спинного мозку одерАвтори винаходу далі підтверджували активжували зрізи товщиною 30мм на криостаті і монтуність Sp35 з використанням моделі перетину зоровали їх в покриті желатином слайди. Число мічевого нерва, в якій досліджуються фактори, що них FG нейронів RST на слайді, що відноситься до впливають на функцію нейронів. У даному досліосередку пошкодження, виражали у вигляді продженні використовувались молоді статевозрілі центної частки від загального числа мічених FG самиці щурів Sprague Dawley (SD). Правий зоронейронів на контралатеральній інтактній стороні. вий нерв кожної тварини пересікали інтраорбітаДану процентну частку в групах порівнювали стально в 1,5мм від оптичного диска. Шматочок гелетистично з використанням одностороннього дисвої губки, просоченої 6% Fluoro-Gold (FG), персійного аналізу з подальшим розрахунком теснаносили на щойно пересічену ділянку праворуч ту множинних порівнянь Tukey-Kramer. Як позаду від оптичного диска для мічення виживаюпоказано в таблиці 3, Sp35-Fc в концентрації чих клітин ганглію сітківки (RGC). Тварини, поділе2мкг/мл сприяв виживанню нейронів руброспінані на 6 груп (n=6 в кожній групі), одержували Sp35льного тракту (RST). Fc, людський lgG1, або просто PBS, шляхом ін'єкції в жовту пляму. Об'єм кожної ін'єкції в жовту Таблиця 3 пляму становив 4мл, причому дозування кожної ін'єкції дорівнювало 2мг. Ін'єкції в жовту пляму проводили безпосередньо після пересічення зороПроцент виживання нейронів RST Обробка вого нерва. (±ст.пом.сер.) Всім тваринам забезпечували виживання проPBS 17,1±2 тягом 1 тижня. За два дні до фіксації тварин переSp35-Fc 31,9±1,5 сікали лівий зоровий нерв кожної тварини, і застоКонтроль-Fc 14,5±2,1 совували 6% FG для мічення RGC, що вижили, які служать внутрішнім контролем. Тварин фіксували 47 87106 48 передозуванням нембуталу, і препарували сітківку жали шляхом порівняння числа RGC, що вижили, в 4% параформальдегіді. Для розділення сітківки в пошкодженому оку з таким в протилежному оку. на чотири квадранти (верхній, нижній, носовий і Всі дані виражали у вигляді середнього значенвисковий) робили чотири радіальних розрізи. Поня±стандартна помилка середнього. Статистичну тім сітківку фіксували після препарування в тому ж значущість оцінювали за допомогою односторонфіксуючому розчині протягом 1 години, після чого нього дисперсійного аналізу з подальшим «post її препарати монтували в слайди з використанням hос»-тестом Tukey-Kramer. Відмінності вважали спеціального середовища (Dako). Слайди оцінюзначущими для р
ДивитисяДодаткова інформація
Назва патенту англійськоюNogo receptor binding protein
Автори англійськоюMi Sha, Mccoy John, Pepinsky R. Blake, Lee Daniel H. S.
Назва патенту російськоюБелок, который связывает рецептор nogo
Автори російськоюМай Ша, Маккой Джон, Пепински Р. Блейк, Ли Дениэл Х.С.
МПК / Мітки
МПК: C12N 15/12, C07K 16/18, C07K 14/47, A61K 38/00
Мітки: зв'язує, білок, рецептор
Код посилання
<a href="https://ua.patents.su/43-87106-bilok-yakijj-zvyazueh-receptor-nogo.html" target="_blank" rel="follow" title="База патентів України">Білок, який зв’язує рецептор nogo</a>
Попередній патент: Композиція вихідної сировини для плавильної печі, з якої вилучають цінні метали, та спосіб вилучення цінних металів з неї
Наступний патент: Спосіб терморозвідки шельфових зон морів та океанів
Випадковий патент: Спосіб прогнозування зрощення перелому