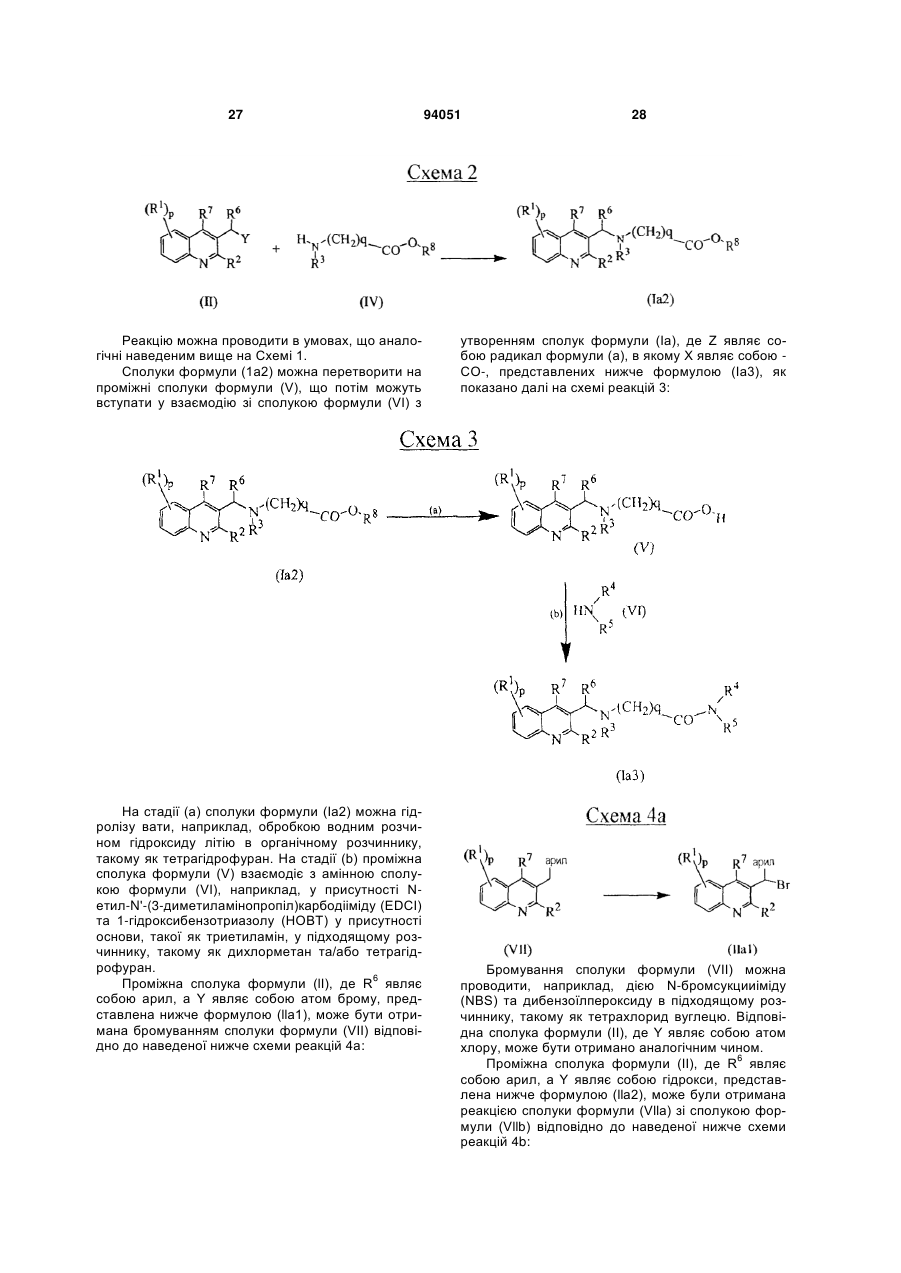
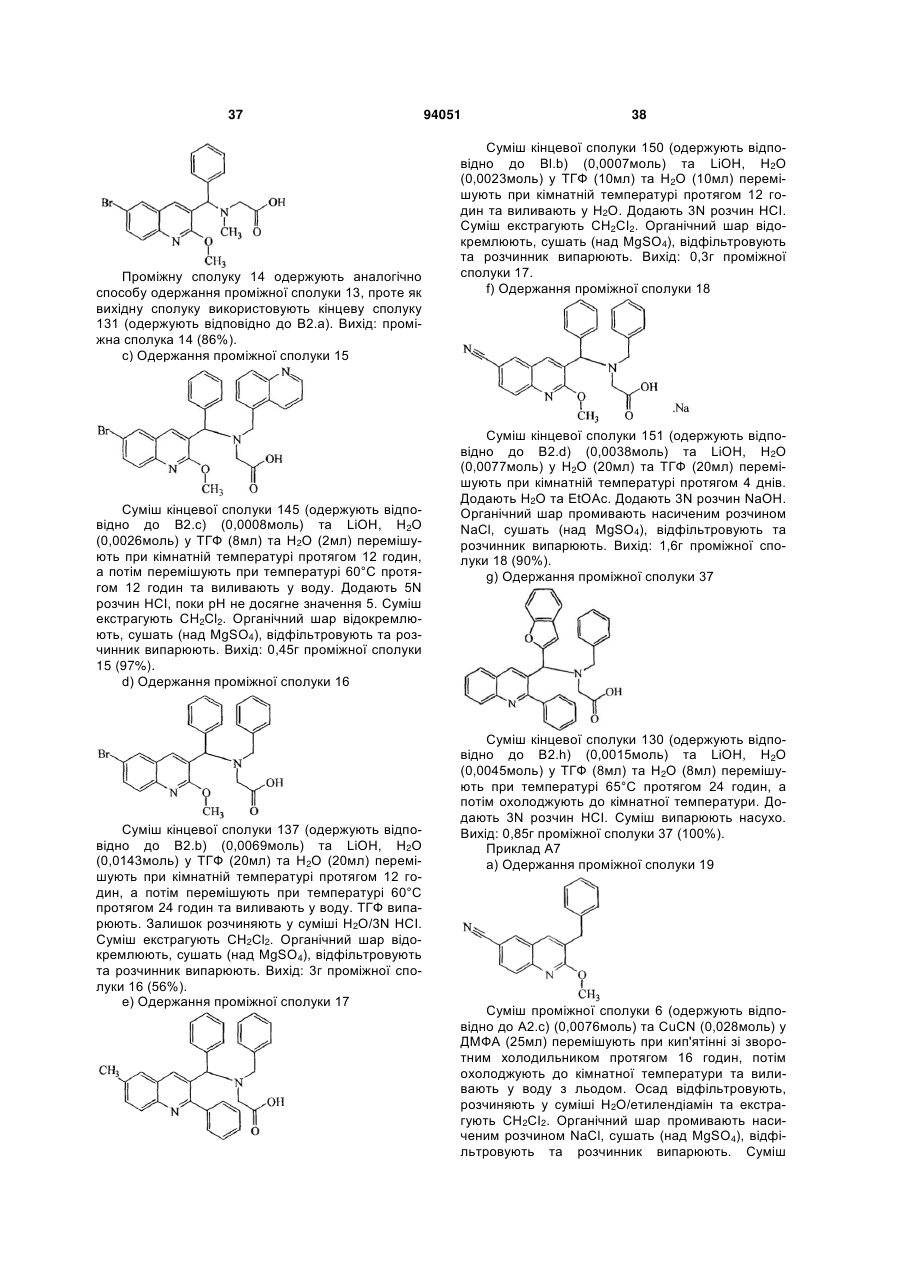
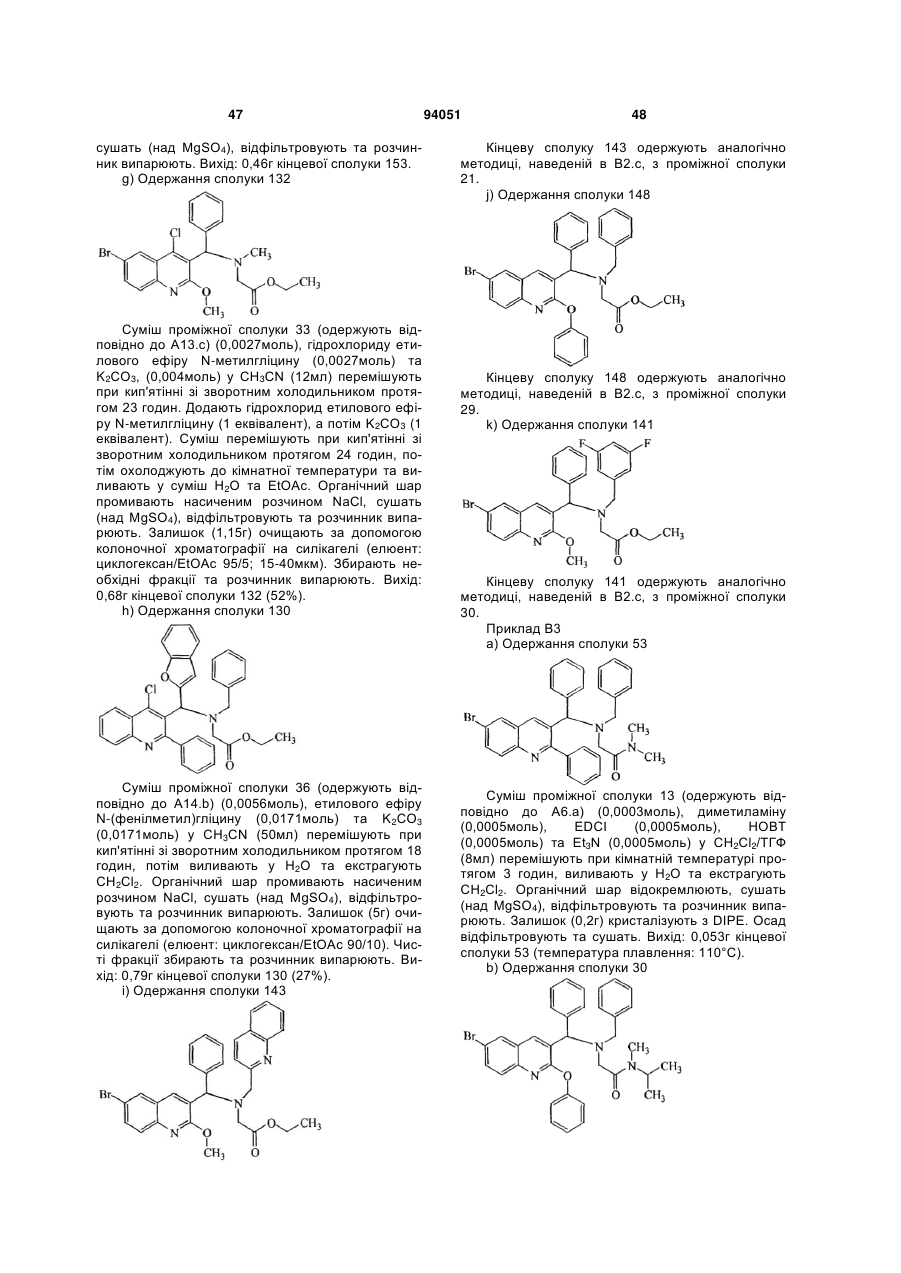
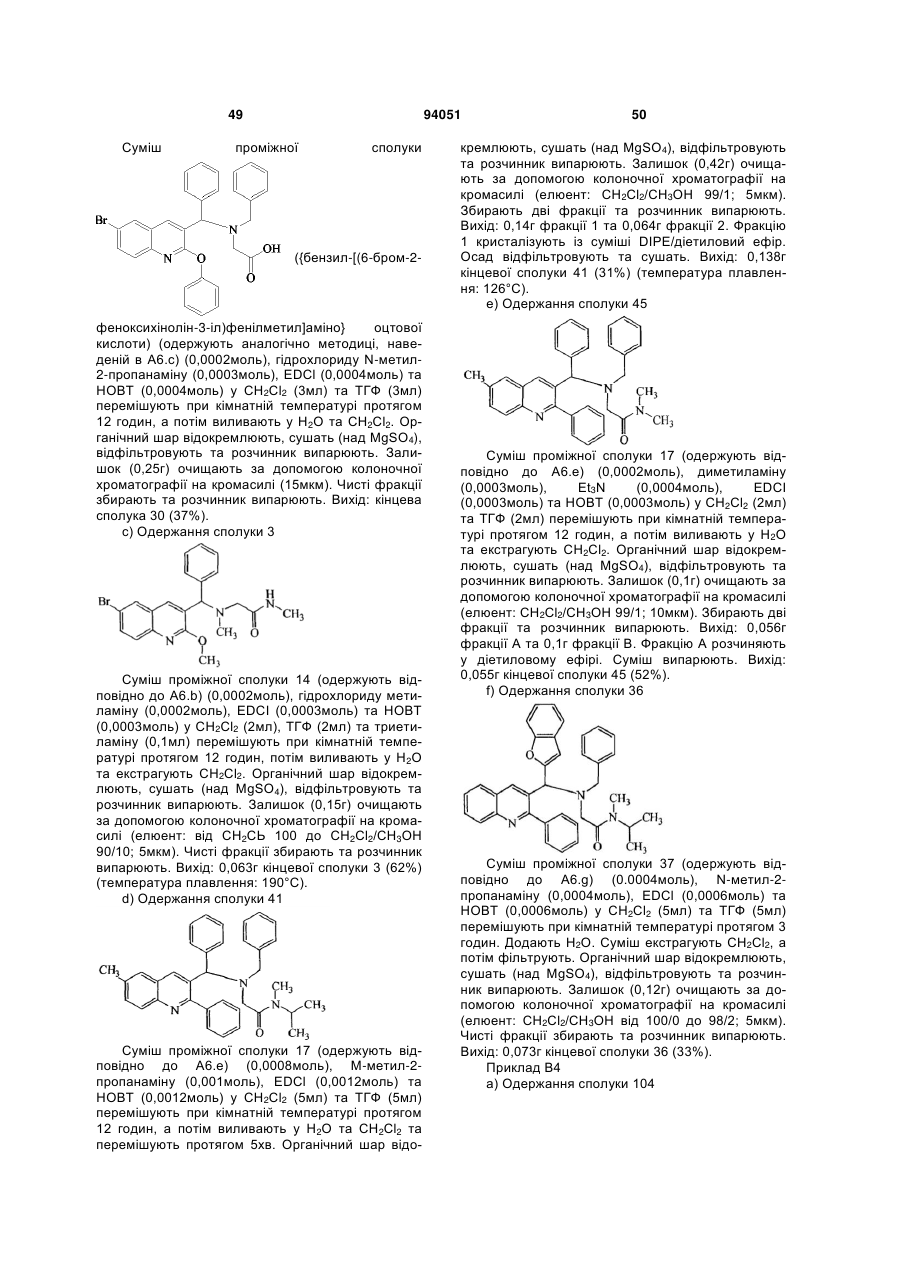
Антибактеріальні похідні хіноліну
Номер патенту: 94051
Опубліковано: 11.04.2011
Автори: Паск'є Елізабет Тереза Жанна, Жільмон Жером Еміль Жорж, Ланкуа Давід Френсіс Ален, Андрієс, Конраад Йозеф Лодевійк Марсель, Кул Аніл
Формула / Реферат
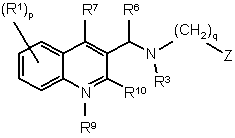
1. Сполука загальної формули (Іа) або формули (Іb):
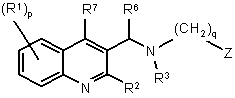 , (Ia)
, (Ia)
 , (Ib)
, (Ib)
її фармацевтично прийнятна кислотно-адитивна або основно-адитивна сіль, її четвертинний амін, її стереохімічна ізомерна форма, її таутомерна форма, її N-оксидна форма або її проліки, де:
р означає ціле число, рівне нулю, 1, 2, 3 або 4;
q означає ціле число, рівне 1, 2 або 3;
Z являє собою радикал, вибраний з формул:
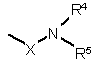 (а) або
(а) або ![]() (b);
(b);
R1 являє собою ціано, атом галогену, алкіл, галогеналкіл, гідрокси, алкілокси, алкілтіо, алкілоксіалкіл, алкілтіоалкіл, арилалкіл, ді(арил)алкіл, арил або Net;
R2 являє собою атом водню, алкілокси, арил, арилокси, гідрокси, меркапто, алкілоксіалкілокси, алкілтіо, моно- або ді(алкіл)аміно, піролідино або радикал формули:
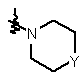 ,
,
де
Y являє собою СН2, О, S, NH або N-алкіл;
R3 являє собою алкіл, арилалкіл, арил, моно- або діалкіламіноалкіл, Het або Het-алкіл;
R4 та R5 кожен незалежно являє собою атом водню; алкіл; алкілоксіалкіл; арилалкіл; Het-алкіл; моно- або діалкіламіноалкіл; Het або арил; або
R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють, радикал, вибраний з групи, що включає піролідино, піперидино, піперазино, морфоліно, 4-тіоморфоліно, 2,3-дигідроізоіндол-1-іл, тіазолідин-3-іл, 1,2,3,6-теграгідропіридил, 1,4-діазациклогептил, 1-аза-4-оксациклогептил, 1,2,3,4-тетрагідроізохінолін-2-іл, 2Н-піроліл, піролініл, піроліл, імідазолідиніл, піразолідиніл, 2-імідазолініл, 2-піразолініл, імідазоліл, піразоліл, триазоліл, піридиніл, піридазиніл, піримідиніл, піразиніл та триазиніл, необов'язково заміщений одним або декількома замісниками, при цьому кожен замісник незалежно вибраний з алкілу, галоген алкілу, атома галогену, арилалкілу, гідрокси, алкілокси, аміно, моно- або діалкіламіну, алкілтіо, алкілоксіалкілу, алкілтіоалкілу, арилу, піридилу або піримідинілу;
R6 являє собою арил або Het;
R7 являє собою атом водню, атом галогену, алкіл, арил або Нet;
R8 являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю;
R9 являє собою атом водню або алкіл;
R10являє собою оксо; та
X являє собою -СН2- або -СО-;
алкіл являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю; або являє собою циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю; або являє собою циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, що приєднаний до насиченого вуглеводневого радикала з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю; де кожен атом вуглецю необов'язково може бути заміщений ціано, гідрокси, алкілокси або оксо;
арил являє собою гомоцикл, вибраний з фенілу, нафтилу, аценафтилу або тетрагідронафтилу, кожний з яких необов'язково заміщений 1, 2 або 3 замісниками, при цьому кожен замісник незалежно вибраний з гідрокси, атома галогену, ціано, нітро, аміно, моно- або діалкіламіно, алкілу, галогеналкілу, алкілокси, карбоксилу, алкілоксикарбонілу, амінокарбонілу, морфолінілу або моно- або діалкіламінокарбонілу;
Het являє собою моноциклічний гетероцикл, вибраний з N-феноксипіперидинілу, піперидинілу, піролілу, піразолілу, імідазолілу, фуранілу, тієнілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, піридинілу, піримідинілу, піразинілу або піридазинілу; або біциклічний гетероцикл, вибраний з хінолінілу, хіноксалінілу, індолілу, бензімідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, бензофуранілу, бензотієнілу, 2,3-дигідробензо[1,4]діоксинілу або бензо[1,3]діоксолілу; при цьому кожен моноциклічний та біциклічний гетероцикл необов'язково заміщений 1, 2 або 3 замісниками, кожний з яких незалежно вибраний з атома галогену, гідрокси, алкілу або алкілокси;
галоген вибраний з атома фтору, хлору, брому або йоду; та галогеналкіл являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю, або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, що приєднаний до насиченого вуглеводневого радикала з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю; де один або декілька атомів вуглецю заміщені одним або декількома атомами галогену.
2. Сполука за п. 1, яка відрізняється тим, що р дорівнює 0 або 1; R1 являє собою атом галогену або алкіл; R2 являє собою алкілокси або арил; R3 являє собою арил, арилалкіл або Het-алкіл; q дорівнює 1; R4 та R5 кожен незалежно являє собою алкіл, або ж R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють радикал 4-тіоморфоліно, піперидино або піперазино, заміщений алкілом або арилалкілом;
R6 являє собою арил, необов'язково заміщений атомом галогену,
або ж R6 являє собою бензофураніл; R7 являє собою атом водню; a R8 являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 4 атомів вуглецю.
3. Сполука за будь-яким з пп. 1 та 2, яка відрізняється тим, що р дорівнює 1; Z являє собою радикал формули (a); R1 являє собою атом брому або метил; R2 являє собою метилокси або феніл; R3 являє собою феніл, необов'язково заміщений метилоксигрупою, або бензил; q дорівнює 1; R4 та R5 кожний являє собою метил, етил або ізопропіл, або ж R1 та R3 разом з атомом азоту, до якого вони приєднані, утворюють радикал 4-тіоморфоліно, радикал піперидино, заміщений метилом у положенні 4, або радикал піперазино, заміщений бензилом у положенні 4; R6 являє собою феніл або бензофураніл; тa R7являє собою атом водню.
4. Сполука за п. 2, яка відрізняється тим, що р дорівнює 0 або 1; R1 являє собою атом брому або метил; R2 являє собою метилокси або феніл; R3 являє собою феніл, бензил або хінолін-5-ілметил; q дорівнює 1; R1 та R5 кожний являє собою метил, або ж R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють радикал піперазини, заміщений метилом у положенні 4; R6 являє собою феніл, необов'язково заміщений атомом фтору в положенні 2; R7 являє собою атом водню; a R8 являє собою етил.
5. Сполука за п. 1, яка відрізняється тим, що сполука вибрана з:
2-{бензил-[(6-метил-2-фенілхінолін-3-іл)фенілметил]аміно}-N-(4-метилпіперазин-1-іл)ацетаміду;
N-[(6-бром-2-метоксихінолін-3-іл)фенілметил]-N',N'-диметил-N-фенілетан-1,2-діаміну;
N-бензил-N-[(6-бром-2-фенілхінолін-3-іл)фенілметил]-N'-N'-диметилетан-1,2-діаміну;
2-{бензил-[(6-метил-2-фенілхінолін-3-іл)фенілметил]аміно}-1-(4-метилпіперазин-1-іл)етанону;
2-{[(6-бром-2-метоксихінолін-3-іл)фенілметил]хінолін-5-ілметиламіно}-1-(4-метилпіперазин-1-іл)етанону;
2-{бензил-[(6-бром-2-метоксихінолін-3-іл)фенілметил]аміно}-1-(4-метилпіперазин-1-іл)етанону;
N-бензил-N-[(6-бром-2-метоксихінолін-3-іл)-(2-фторфеніл)метил]-N',N'-диметилетан-1,2-діаміну;
етилового ефіру {бензил-[(6-бром-2-метоксихінолін-3-іл)фенілметил]аміно}оцтової кислоти та
2-{бензил-[(6-метил-2-фенілхінолін-3-іл)фенілметил]аміно}-1-піпердин-1-ілетанону;
їх фармацевтично прийнятної кислотно-адитивної або основно-адитивної солі, їх четвертинного аміну, їх стереохімічно ізомерної форми, їх таутомерної форми, їх N-оксидної форми або їх проліків.
6. Сполука за п. 1, яка відрізняється тим, що сполука вибрана з:
2-{бензил-[(6-метил-2-фенілхінолін-3-іл)фенілметил]аміно}-1-(4-бензилпіперазин-1-іл)етанону;
N-[(6-бром-2-метоксихінолін-3-іл)фенілметил]-N-(2-метоксифеніл)-N',N'-диметилетан-1,2-діаміну;
2-{бензил-[(6-метил-2-фенілхінолін-3-іл)фенілметил]аміно}-N,N-диметилацетаміду;
N-бензил-N-[(6-бром-2-фенілхінолін-3-іл)фенілметил]N',N'-диметиделан-1,2-діаміну;
2-{бензил-[(6-метил-2-фенілхінолін-3-іл)фенілметил]аміно}-1-(4-метилпіперидин-1-іл)етанону;
2-(бензил-[(6-метил-2-фенілхінолін-3-іл)фенілметил]аміно}-N,N-діетилацетаміду;
2-{бензил-[(6-бром-2-фенілхінолін-3-іл)фенілметил]аміно}-N,N-диметилацетаміду;
2-{[бензофуран-2-іл-(2-фенілхінолін-3-іл)метил]бензиламіно}-N-ізопропіл-N-метилацетаміду;
2-{бензил-[(6-метил-2-фенілхінолін-3-іл)фенілметил]аміно}-1-тіоморфолін-4-ілетанону та
2-{бензил-[(6-метил-2-фенілхінолін-3-іл)фенілметил]аміно}-N-iзопропіл-N-метилацетаміду;
їх фармацевтично прийнятної кислотно-адитивної або основно-адитивної солі, їх четвертинного аміну, їх стереохімічно ізомерної форми, їх таутомерної форми, їх N-оксидної форми або їх проліків.
7. Сполука за будь-яким з пп. 1-6 для використання як лікарського засобу.
8. Композиція, що містить фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-6.
9. Застосування сполуки за будь-яким з пп. 1-6 або композиції за п. 8 для одержання лікарського засобу, призначеного для лікування бактеріальної інфекції.
10. Застосування за п. 9, яке відрізняється тим, що бактеріальна інфекція є інфекцією зі стафілококами, ентерококами або стрептококами.
11. Застосування за п. 9, яке відрізняється тим, що бактеріальна інфекція є інфекцією з метицилінрезистентним Slaphylococcus aureus (MRSA), метицилінрезистентними коагулазанегативними стафілококами (MRCNS), пеніцилінрезистентним Streptococcus рneumoniae або мультирезистентним Enterococcus faecium.
12. Застосування за п. 9, яке відрізняється тим, що бактеріальна інфекція є інфекцією з Staphylococcus aureus або Streptococcus рneumoniae.
13. Застосування за п. 12, яке відрізняється тим, що бактеріальна інфекція є інфекцією з метицилінрезистентним Staphylococcus aureus (MRSA).
14. Застосування сполуки за будь-яким з пп. 1-6 або композиції за п. 8 для одержання лікарського засобу, призначеного для лікування бактеріального захворювання, що викликане Mycobacterium tuberculosis.
Текст
1. Сполука загальної формули (Іа) або формули (Іb): 2 3 імідазолініл, 2-піразолініл, імідазоліл, піразоліл, триазоліл, піридиніл, піридазиніл, піримідиніл, піразиніл та триазиніл, необов'язково заміщений одним або декількома замісниками, при цьому кожен замісник незалежно вибраний з алкілу, галоген алкілу, атома галогену, арилалкілу, гідрокси, алкілокси, аміно, моно- або діалкіламіну, алкілтіо, алкілоксіалкілу, алкілтіоалкілу, арилу, піридилу або піримідинілу; R6 являє собою арил або Het; R7 являє собою атом водню, атом галогену, алкіл, арил або Нet; R8 являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю; R9 являє собою атом водню або алкіл; R10являє собою оксо; та X являє собою -СН2- або -СО-; алкіл являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю; або являє собою циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю; або являє собою циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, що приєднаний до насиченого вуглеводневого радикала з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю; де кожен атом вуглецю необов'язково може бути заміщений ціано, гідрокси, алкілокси або оксо; арил являє собою гомоцикл, вибраний з фенілу, нафтилу, аценафтилу або тетрагідронафтилу, кожний з яких необов'язково заміщений 1, 2 або 3 замісниками, при цьому кожен замісник незалежно вибраний з гідрокси, атома галогену, ціано, нітро, аміно, моно- або діалкіламіно, алкілу, галогеналкілу, алкілокси, карбоксилу, алкілоксикарбонілу, амінокарбонілу, морфолінілу або моно- або діалкіламінокарбонілу; Het являє собою моноциклічний гетероцикл, вибраний з N-феноксипіперидинілу, піперидинілу, піролілу, піразолілу, імідазолілу, фуранілу, тієнілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, піридинілу, піримідинілу, піразинілу або піридазинілу; або біциклічний гетероцикл, вибраний з хінолінілу, хіноксалінілу, індолілу, бензімідазолілу, бензоксазолілу, бензізоксазолілу, бензотіазолілу, бензізотіазолілу, бензофуранілу, бензотієнілу, 2,3дигідробензо[1,4]діоксинілу або бензо[1,3]діоксолілу; при цьому кожен моноциклічний та біциклічний гетероцикл необов'язково заміщений 1, 2 або 3 замісниками, кожний з яких незалежно вибраний з атома галогену, гідрокси, алкілу або алкілокси; галоген вибраний з атома фтору, хлору, брому або йоду; та галогеналкіл являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю, або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, що приєднаний до насиченого вуглеводневого радикала з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю; де один або декілька атомів вуг 94051 4 лецю заміщені одним або декількома атомами галогену. 2. Сполука за п.1, яка відрізняється тим, що р дорівнює 0 або 1; R1 являє собою атом галогену 2 3 або алкіл; R являє собою алкілокси або арил; R являє собою арил, арилалкіл або Het-алкіл; q дорівнює 1; R4 та R5 кожен незалежно являє собою алкіл, або ж R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють радикал 4тіоморфоліно, піперидино або піперазино, заміщений алкілом або арилалкілом; R6 являє собою арил, необов'язково заміщений атомом галогену, або ж R6 являє собою бензофураніл; R7 являє собою атом водню; a R8 являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 4 атомів вуглецю. 3. Сполука за будь-яким з пп.1 та 2, яка відрізняється тим, що р дорівнює 1; Z являє собою радикал формули (a); R1 являє собою атом брому або метил; R2 являє собою метилокси або феніл; R3 являє собою феніл, необов'язково заміщений метилоксигрупою, або бензил; q дорівнює 1; R4 та R5 кожний являє собою метил, етил або ізопропіл, або ж R1 та R3 разом з атомом азоту, до якого вони приєднані, утворюють радикал 4-тіоморфоліно, радикал піперидино, заміщений метилом у положенні 4, або радикал піперазино, заміщений бензилом у положенні 4; R6 являє собою феніл або бензофураніл; тa R7являє собою атом водню. 4. Сполука за п.2, яка відрізняється тим, що р 1 дорівнює 0 або 1; R являє собою атом брому або метил; R2 являє собою метилокси або феніл; R3 являє собою феніл, бензил або хінолін-5-ілметил; q дорівнює 1; R1 та R5 кожний являє собою метил, або ж R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють радикал піперазини, заміщений метилом у положенні 4; R6 являє собою феніл, необов'язково заміщений атомом фтору в положенні 2; R7 являє собою атом водню; a R8 являє собою етил. 5. Сполука за п.1, яка відрізняється тим, що сполука вибрана з: 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-N-(4-метилпіперазин-1іл)ацетаміду; N-[(6-бром-2-метоксихінолін-3-іл)фенілметил]N',N'-диметил-N-фенілетан-1,2-діаміну; N-бензил-N-[(6-бром-2-фенілхінолін-3іл)фенілметил]-N'-N'-диметилетан-1,2-діаміну; 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-1-(4-метилпіперазин-1іл)етанону; 2-{[(6-бром-2-метоксихінолін-3іл)фенілметил]хінолін-5-ілметиламіно}-1-(4метилпіперазин-1-іл)етанону; 2-{бензил-[(6-бром-2-метоксихінолін-3іл)фенілметил]аміно}-1-(4-метилпіперазин-1іл)етанону; N-бензил-N-[(6-бром-2-метоксихінолін-3-іл)-(2фторфеніл)метил]-N',N'-диметилетан-1,2-діаміну; етилового ефіру {бензил-[(6-бром-2метоксихінолін-3-іл)фенілметил]аміно}оцтової кислоти та 5 94051 6 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-1-піпердин-1-ілетанону; їх фармацевтично прийнятної кислотно-адитивної або основно-адитивної солі, їх четвертинного аміну, їх стереохімічно ізомерної форми, їх таутомерної форми, їх N-оксидної форми або їх проліків. 6. Сполука за п.1, яка відрізняється тим, що сполука вибрана з: 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-1-(4-бензилпіперазин-1іл)етанону; N-[(6-бром-2-метоксихінолін-3-іл)фенілметил]-N-(2метоксифеніл)-N',N'-диметилетан-1,2-діаміну; 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-N,N-диметилацетаміду; N-бензил-N-[(6-бром-2-фенілхінолін-3іл)фенілметил]N',N'-диметиделан-1,2-діаміну; 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-1-(4-метилпіперидин-1іл)етанону; 2-(бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-N,N-діетилацетаміду; 2-{бензил-[(6-бром-2-фенілхінолін-3іл)фенілметил]аміно}-N,N-диметилацетаміду; 2-{[бензофуран-2-іл-(2-фенілхінолін-3іл)метил]бензиламіно}-N-ізопропіл-Nметилацетаміду; 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-1-тіоморфолін-4-ілетанону та 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-N-iзопропіл-Nметилацетаміду; їх фармацевтично прийнятної кислотно-адитивної або основно-адитивної солі, їх четвертинного амі ну, їх стереохімічно ізомерної форми, їх таутомерної форми, їх N-оксидної форми або їх проліків. 7. Сполука за будь-яким з пп.1-6 для використання як лікарського засобу. 8. Композиція, що містить фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість сполуки за будь-яким з пп.1-6. 9. Застосування сполуки за будь-яким з пп.1-6 або композиції за п.8 для одержання лікарського засобу, призначеного для лікування бактеріальної інфекції. 10. Застосування за п.9, яке відрізняється тим, що бактеріальна інфекція є інфекцією зі стафілококами, ентерококами або стрептококами. 11. Застосування за п.9, яке відрізняється тим, що бактеріальна інфекція є інфекцією з метицилінрезистентним Slaphylococcus aureus (MRSA), метицилінрезистентними коагулазанегативними стафілококами (MRCNS), пеніцилінрезистентним Streptococcus рneumoniae або мультирезистентним Enterococcus faecium. 12. Застосування за п.9, яке відрізняється тим, що бактеріальна інфекція є інфекцією з Staphylococcus aureus або Streptococcus рneumoniae. 13. Застосування за п.12, яке відрізняється тим, що бактеріальна інфекція є інфекцією з метицилінрезистентним Staphylococcus aureus (MRSA). 14. Застосування сполуки за будь-яким з пп.1-6 або композиції за п.8 для одержання лікарського засобу, призначеного для лікування бактеріального захворювання, що викликане Mycobacterium tuberculosis. Даний Корисна модель відноситься до нових заміщених похідних хіноліну, що придатні для використання при лікуванні бактеріальних захворювань, у тому числі, проте не обмежуючись, захворювань, що викликані пагогенними мікобактеріями, такими як Mycobactersum tuberculosis, M. bovis, Μ aνium та М. marinum. Mycobacterium tuberculosis є збудником туберкульозу (ТБ), небезпечної ι а потенційно смертельної інфекції, що поширена в усьому світі. За оцінкою Всесвітньої організації охорони здоров'я, більше, ніж 8 мільйонів людей заражаються ТБ щорічно, а 2 мільйони людей щорічно вмирають від туберкульозу. Протягом останнього десятиліття випадки ТБ в усьому світі зросли на 20%, при цьому найбільша схильність спостерігається в країнах з найбільш низьким рівнем життя. Якщо зазначена тенденція збережеться, то частота виникнення захворювання протягом наступних двадцяти років збільшиться на 41%. Через п'ятдесятьох років після розробки ефективної хіміотерапії ТБ залишається основною інфекцією після СНІДу, що приводить до смертності дорослого населення в усьому світі. Епідемічна обстановка ТБ ускладнюється збільшенням кількості штамів, що мають множинну лікарську стійкість, та смертоносний симбіоз із ВІЛ. Імовірність розвитку активної форми ТБ у людей, що є ВІЛ-позитивними та інфіковані ТБ, у 30 разів вище, ніж у людей, що є ВІЛнегативними, ТБ відповідальний також за смерть кожного з трьох людей із ВІЛ/СНІД в усьому світі. Всі існуючі підходи до лікування туберкульозу включають комбінацію безлічі засобів. Наприклад, схема лікування, рекомендована службою суспільної охорони здоров'я США, являє собою комбінацію ізоніазиду, рифампіцину та піразинаміду протягом двох місяців, а потім тільки ізоніазиду та рифампіцину ще протягом чотирьох місяців. ВІЛінфікованим пацієнтам зазначені ліки продовжують призначати ще протягом семи місяців. Пацієнтам, інфікованим штамами М. tuberculosis, що мають множинну лікарську стійкість, у комбінаційну терапію включають такі засоби, як етамбутол, стрептоміцин, канаміцин, амікацин, капреоміцин, етіонамід, циклосерин, ципрофоксацин та офлоксацин. Не існує єдиного засобу, який був б ефективним при лікуванні симптомів туберкульозу, а також не існує комбінації засобів, що дозволяє провести лікування за період, менше шести місяців. 7 Продовжує існувати висока потреба в нових ліках, що поліпшують існуюче лікування за рахунок застосування таких схем прийняття ліків, що сприяли б дотриманню режимів як пацієнтами, так і постачальниками. Переважним засобом для досягнення цієї мети є більш короткі схеми прийняття ліків, а також такі схеми прийняття ліків, що вимагають меншого спостереження. Найбільша користь від лікування досягається протягом перших двох місяців під час інтенсивної або бактерицидної фази, коли чотири лікарські засоби призначають одночасно; бактеріальне навантаження значно знижується, та пацієнти перестають бути заразними. Продовження лікування протягом від 4 до 6 місяців, або стадія стерилізації, потрібна для видалення стійких бацил та мінімізації ризику рецидиву. Особливо корисним був б діючий засіб, що стерилізує, який скорочує лікування до 2 місяців або менше. Потрібні також ліки, що сприяють дотриманню режимів та схем лікування, оскільки вимагають менш інтенсивного спостереження. Очевидно, найбільшу користь принесла б сполука, що зменшує як загальну тривалість лікування, так і частоту введення ліків. Епідемічну обстановку ТБ ускладнює зростаюча частота виникнення штамів, що мають множинну лікарську стійкість, або MDR-TB. До чотирьох відсотків усіх випадків зв'язують з MDR-TB, що резистентні до найбільш ефективних ліків із зазначених вище стандартних чотирьох засобів, ізоніазиду та рифампіну. За відсутності лікування MDRTB є смертельними, і а їх неможливо адекватно лікувати за допомогою стандартної терапії, так що лікування вимагає застосування протягом аж до двох років ліків "другого покоління". Зазначені ліки часто є токсичними, дорогими та викликають мінімальний ефект. За відсутності ефективної терапії пацієнти, інфіковані MDR-TB, продовжують поширювати хворобу та продукувати нові інфекції зі штамами MDR-TB. У медицині зберігається значна потреба в нових ліках, що мають новий механізм дії, що мали б активність проти штамів, стійких до дії ліків, зокрема, штамів MDR. Термін "стійкий до дії ліків", що використовують вище та далі в даному описі, є терміном, добре відомим фахівцям в галузі мікробіології. Стійка до дії ліків мікобактерія є мікобактерію, що більше не чутлива до дії, щонайменше, одних раніше ефективних ліків; мікобактерію, у якої розвилася здатність витримувати антибіотичну атаку, щонайменше, одних раніше ефективних ліків. Штам, резистентний до дії ліків, може передавати здатність витримувати дію ліків своєму потомству. Зазначена резистентність може бути наслідком випадкових генетичних мутацій у клітині бактерії, що змінює її чутливість до дії одних ліків або різних ліків. MDR tuberculosis є специфічною формою резистентного до дії ліків туберкульозу завдяки бактерії, що, принаймні, резистентна до ізоніазиду та рифампіцину (та має або не має стійкості до дії інших ліків), що є в даний час двома найбільш ефективними ліками проти туберкульозу. Таким чином, при використанні вище та далі в контексті 94051 8 даного опису, термін ''стійкий до дії ліків" включає множинну лікарську стійкість. Іншим фактором боротьби з епідемією ТБ є проблема латентного ТБ. Незважаючи на застосування протягом десятиліть програм боротьби з туберкульозом (ТБ), М. tuberculosis інфіковано, хоча і безсистемно, близько 2 мільярдів людей. Близько 10% цих індивідів протягом усього житія піддані ризику розвитку активної форми ТБ. Глобальна епідемія ТБ підживлюється інфекцією ВІЛпацієнтів та ростом штамів, що мають множинну лікарську стійкість, ТБ (MDR-TB). Реактивація латентного ТБ є чинником високого ризику розвитку хвороби та відповідальна за 32% смертей у ВІЛінфікованих людей. Для боротьби з епідемією ТБ необхідно розробити нові ліки, що здатні убивати дрімаючі або латентні бактерії. Прихований ТБ може бути реактивований та може викликати захворювання під впливом ряду факторів, таких як придушення імунітету організму-хазяїна під дією імуносупресивних засобів, таких як антитіла проти фактора некрозу пухлин α або інтерферону-. У випадку ВІЛ-позитивних пацієнтів єдиним доступним профілактичним лікуванням латентного ТБ є схема прийняття рифампіцину, піразинаміду протягом двох-трьох місяців. Ефективність зазначеної схеми лікування дотепер неясна, більш того, тривалість лікування є важливим обмеженням в умовах зі стиснутими ресурсами. Таким чином, зберігається крайня потреба в розробці нових ліків, що можуть бути хіміопрофілактичними засобами для індивідів, що є носіями латентних бацил ТБ. Бацили з туберкульозних горбків потрапляють в організм здорових індивідів шляхом інгаляції; вони знищуються за рахунок фагоцитозу альвеолярними макрофагами в легенях. Це приводить до виникнення діючої імунної відповіді та утворення гранулем, що складаються з макрофагів, інфікованих М. tuberculosis, що оточені Т-клітинами. Через 6-8 тижнів імунна відповідь організму-хазяїна викликає смерть інфікованих клітин шляхом некрозу та нагромадження казеозної речовини, що містить деяку кількість позаклітинних бацил, оточених макрофагами, епітелоїдними клітинами та шарами лімфоїдної тканини на периферії. У випадку здорових індивідів велика частина мікобактерій знищується в зазначеному оточенні, однак невелика частина бацил усе-таки виживає та, як вважають, існує в нереплікуючому, гіпометаболічному стані та толерантна до знищення під дією ліків проти туберкульозу, таких як ізоніазид. Зазначені бацили можуть зберігатися у фізіологічному оточенні, що змінилося, навіть протягом всього життя індивіда, не виявляючи будь-яких клінічних симптомів захворювання. Проте, у 10% випадків зазначені латентні бацили можуть знову активувалися та викликати захворювання. Однієї з гіпотез розвитку зазначених стійких бактерій с наявність патофізіологічного оточення, викликаного патологічною зміною у людини, а саме, зниженим кисневим потенціалом, обмеженням у надходженні живильних засобів та кислим значенням рН. Вважають, що дані фактори роблять зазначені бактерії фенотипово толерантними до дії більшості антимікобактеріальних ліків. 9 Крім усунення епідемії ТБ виникає проблема стійкості стосовно антибіотичних засобів першого покоління. Деякі важливі приклади включають резистентні до пеніциліну Streptococcus рnеumоnіае, резистентні до ванкоміцину ентерококі, резистентні до метициліну Staphylococcus aureus, резистентні до багатьох лікарських засобів сальмонели. Наслідки стійкості до антибіотиків є важкими. Інфекції, викликані резистентними мікробами, не піддаються лікуванню, що приводить до більш тривалого періоду захворювання та збільшує ризик смерті. Невдалі результати лікування також приводять до більш тривалих інфекційних періодів, що підвищує кількість інфікованих людей, що бувають у громадських місцях та, таким чином, піддає все населення ризику зараження стійкими штамами інфекції. Лікарні є критичною ланкою проблеми стійкості до антимікробних засобів в усьому світі. Сполучення сприйнятливих пацієнтів, інтенсивного та пролонгованого застосування антимікробних засобів та перехресна інфекція приводять до інфекції з високостійкими бактеріальними патогенами. Самолікування антимікробними засобами є ще одним важливим фактором, що приводить до стійкості. Антимікробні засоби, що приймаються при самолікуванні, можуть бути непотрібними, часто приймаються в неправильній дозі або можуть не містити адекватні кількості активної речовини. Дотримання пацієнтом рекомендованого лікування також є великою проблемою. Пацієнти забувають приймати лікарські засоби, переривають лікування, коли починають почувати себе краще, або не можуть прийняти повний курс, тим самим створюючи ідеальне середовище для адаптації мікробів, а не для їх загибелі. Через виникаючу стійкість до множинних антибіотиків лікарі змушені мати справу з інфекціями, для лікування яких ефективної терапії не існує. Захворюваність, смертність та фінансові витрати на такі інфекції є причиною зростаючих навантажень на системи охорони здоров'я в усьому світі. Таким чином, існує крайня потреба в нових сполуках для лікування бактеріальних інфекцій, особливо мікобактеріальних інфекцій, включаючи резистентні до багатьох лікарських препаратів та латентні мікобактеріальні інфекції, а також інших бактеріальних інфекцій, особливо таких, які викликаються стійкими штамами бактерій. У WO 2004/011436, WO 2005/070924, WO 2005/070430 та WO 2005/075428 описані деякі заміщені похідні хіноліну, що мають активність проти мікобактерій, зокрема, проти Mycobacterium tuberculosis. Конкретна сполука із зазначених заміщених похідних хіноліну описана в Science (2005), 307,223-227. Інші заміщені хіноліни розкриті в патенті США 5965572 для лікування інфекцій, стійких до дії антибіотиків, а в WO 00/34265 - для інгібування росту бактеріальних мікроорганізмів. Задача, на рішення якої спрямований даний Корисна модель, полягає в забезпеченні нових сполук, зокрема, заміщених похідних хіноліну, що мають здатність інгібувати ріст бактерій, зокрема, мікобактерій, а тому придатних для лікування мі 94051 10 кобактеріальних захворювань, зокрема, захворювань, що викликані патогенними мікобактеріями, такими як Mycobacterium tuberculosis (включаючи латентне захворювання та включаючи стійкі до дії ліків штами М. tuberculosis), Μ. bovis, M. avium та Μ marinum. Сполуки придатні також при лікуванні інших бактеріальних інфекцій, як зазначено нижче. Сполуки за даним винаходом характеризуються наявністю третинного атома азоту в альфаположенні в бічному ланцюзі, приєднаному в положенні 3 хінолінового ядра та, таким чином, їх основна структура відрізняється від структури похідних хіноліну, описаних у вищевказаній заявці WO 2004/011436, що містять у зазначеному положенні асиметричний атом вуглецю. Таким чином, сполуки за даним винаходом мають перевагу в тому, що вони здатні утворювати меншу кількість енантіомерів, ніж сполуки, описані в WO 2004/011436. Даний Корисна модель відноситься до нових заміщених похідних хіноліну відповідно до формули (Іа) або формули (Іb): (Ia) (Ib) їх фармацевтично прийнятних кислотноадитивних або основно-адитивних солей, їх четвертинних амінів, їх стереохімічно ізомерних форм, їх таутомерних форм, їх N-оксидних форм або їх проліків, де: р означає ціле число, рівне нулю, 1, 2, 3 або 4; q означає ціле число, рівне 1, 2 або 3; Ζ являє собою радикал, вибраний з формул: (a) або (b) 1 R являє собою ціано, атом галогену, алкіл, галогеналкіл, гідрокси, алкілокси, алкілтіо, алкілоксіалкіл, алкілтіоалкіл, арилалкіл, ді(арил)алкіл, арил або Het; R2 являє собою атом водню, алкілокси, арил, арилокси, гідрокси, меркапто, алкілоксіалкілокси, алкілтіо, моно- або ді(алкіл)аміно, піролідино або радикал формули де Υ являє собою СН2, О, S, NH або N-алкіл; R3 являє собою алкіл, арилалкіл, арил, моноабо діалкіламіноалкіл, Het або Het-алкіл; R4 та R5 кожен незалежно являє собою атом водню; алкіл; алкілоксіалкіл; арилалкіл; Het-алкіл; моно- або діалкіламіноалкіл; Het; або арил; або 11 R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють радикал, вибраний з групи, що включає піролідино, піперидино, піперазино, морфоліно, 4-тіоморфоліно, 2,3-дигідроізоіндол-1іл, тіазолідин-3-іл, 1,2,3,6-тетрагідропіридил, 1,4діазациклогептил, 1-аза-4-оксациклогептил, 1,2,3,4-тетрагідроізохінолін-2-іл, 2Н-піроліл, піролініл, піроліл, імідазолідиніл, піразолідиніл, 2імідазолініл, 2-піразолініл, імідазоліл, піразоліл, триазоліл, піридиніл, піридазиніл, піримідиніл, піразиніл та триазиніл, необов'язково заміщений одним або декількома замісниками, при цьому кожен замісник незалежно вибраний з алкілу, галогеналкілу, атома галогену, арилалкілу, гідрокси, алкілокси, аміно, моно- або діалкіламіно, алкілтіо, алкілоксіалкілу, алкілтіоалкілу, арилу, піридилу або піримідинілу; R6 являє собою арил або Het; R7 являє собою атом водню, атом галогену, алкіл, арил або Het; R8 являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю; R9 являє собою атом водню або алкіл; R10 являє собою оксо; та X являє собою -СН2- або -СО-; алкіл являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю; або являє собою циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю; або являє собою циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, що приєднаний до насиченого вуглеводневого радикалу з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю; де кожен атом вуглецю необов'язково може бути заміщений ціано, гідрокси, алкілокси або оксо; арил являє собою гомоцикл, вибраний з фенілу, нафтилу, аценафтилу або тетрагідронафтилу, кожний з яких необов'язково заміщений 1, 2 або 3 замісниками, при цьому кожен замісник незалежно вибраний з гідрокси, атома галогену, ціано, нітро, аміно, моно- або діалкіламіно, алкілу, галогеналкілу, алкілокси, карбоксилу, алкілокси карбонілу, амінокарбонілу, морфолінілу або моно- або діалкіламінокарбонілу; Het являє собою моноциклічний гетероцикл, вибраний з N-феноксипіперидинілу, піперидинілу, піролілу, піразолілу, імідазолілу, фуранілу, тієнілу, оксазолілу, ізоксазолілу, тіазолілу, ізотіазолілу, піридинілу, піримідинілу, піразинілу або піридазинілу; або біциклічний гетероцикл, вибраний і хінолінілу, хіноксалінілу, індолілу, бензимідазолілу, бензоксазолілу, бензизоксазолілу, бензотіазолілу, бензизотіазолілу, бензофуранілу, бензотієнілу, 2,3-дигідробензо[1,4]діоксинілу або бензо[1,3]діоксолілу; при цьому кожен моноциклічний або біциклічний гетероцикл необов'язково заміщений 1, 2 або 3 замісниками, кожний з яких незалежно вибраний з атома галогену, гідрокси, алкілу або алкілокси; галоген вибраний з атома фтору, хлору, брому або йоду; та 94051 12 галогеналкіл являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю, або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, що приєднаний до насиченого вуглеводневого радикалу з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю; де один або декілька атомів вуглецю заміщені одним або декількома атомами галогену. Якщо не зазначено інше, вищенаведені сполуки формули (Іа) або формули (lb), їх фармацевтично прийнятні кислотно-адитивні або основноадитивні солі, їх четвертинні аміни, їх стереохімічно ізомерні форми, їх таутомерні форми, їх Nоксидні форми або їх проліки далі в контексті даного опису називають сполуками за даним винаходом. Сполуки формули (lа) або формули (lb) є взаємозалежними в тому, що зокрема, сполука формули (lb), де R10 являє собою оксо, є таутомерним еквівалентом сполуки формули (Іа), де R2 являє собою гідрокси (кето-єнольна таутомерія). Мається на увазі, що визначення для Het включає усі можливі ізомерні форми гетероциклів, наприклад, піроліл включає І1Н-піроліл та 2Нпіроліл. Арил або Het, перераховані у визначеннях замісників для сполук формули (Іа) або (lb) (див., наприклад, R3), що зазначені вище або надалі, можуть бути приєднані, якщо не зазначене інше, до залишку молекули формули (Іа) або (lb) через будь-який підходящий кільцевий атом вуглецю або гетероатом. Так, наприклад, у тому випадку, коли Het являє собою імідазоліл, то він може являти собою 1-імідазоліл, 2-імідазоліл, 4-імідазоліл та т.п. Лінії, що проведеш від замісників у напрямку до кільцевої системи, вказують, що зв'язок може бути приєднаний до будь-якого підходящого атома в кільці. Фармацевтично прийнятні кислотно-адитивні солі являють собою солі, що включають терапевтично активні, нетоксичні кислотно-адитивні сольові форми, які здатні утворювати сполуки формули (Іа) або формули (lb). Такі кислотно-адитивні солі можуть бути отримані обробкою основної форми сполук формул (Іа) або формули (lb) відповідними кислотами, наприклад, неорганічними кислотами, такими як галогенводнева кислота, зокрема, хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, азотна кислота та фосфорна кислота; органічними кислотами, наприклад, оцтова кислота, гідроксі оцтова кислота, пропанова кислота, молочна кислота, піровиноградна кислота, щавлева кислота, малонова кислота, бурштинова кислота, малеїнова кислота, фумарова кислота, яблучна кислота, винна кислота, лимонна кислота, метансульфонова кислота, етансульфонова кислота, бснзолсульфонова кислота, птолуолсульфонова кислота, цикламова кислота, саліцилова кислота, п-аміносаліцилова кислота та памова кислота. 13 Сполуки формули (Іа) або формули (lb), які містять кислотні протони, також можуть бути перетворені на їх терапевтично активні, нетоксичні основно-адитивні сольові форми обробкою відповідними органічними та неорганічними основами. Відповідні основні сольові форми включають, наприклад, солі амонію, солі лужних та лужноземельних металів, зокрема, літію, натрію, калію, магнію та кальцію, солі з органічними основами, наприклад, солі бензатину, N-метил-Dглюкаміну, гібраміну, а також солі з амінокислотами, наприклад, аргініном та лізином. І навпаки, зазначені кислотно-адитивні або основно-адитивні сольові форми можуть бути перетворені на вільні форми обробкою відповідною основою або кислотою. Термін "адитивна сіль" у рамках даного опису також включає сольвати, які здатні утворювати сполуки формули (Іа) або формули (lb), а також їх солі. Такі сольвати являють собою, наприклад, гідрати та алкоголяти. Як використовується вище, термін "четвертинний амін" означає четвертинні солі амонію, які здатні утворювати сполуки формули (Іа) або формули (lb), взаємодією між основним азотом сполуки формули (Іа) або формули (lb) з відповідним кватернізуючим агентом, таким як, наприклад, необов'язково заміщений алкілгалогенід, арилалкілгалогенід, алкілкарбонілгалогенід, Аrкарбонілгалогенід, Het-алкілгалогенід або Hetкарбонілгалогенід, наприклад, метилйодид або бензилйодид. Het переважно являє собою моноциклічний гетероцикл, вибраний з фуранілу або тієнілу; або біциклічний гетероцикл, вибраний з бензофуранілу або бензотієнілу; кожен моноциклічний та біциклічний гетероцикл може бути необов'язково заміщений 1, 2 або 3 замісниками, при цьому кожен замісник незалежно вибраний з групи, що включає атом галогену, алкіл та Аr. Кватернізуючий агент переважно являє собою алкілгалогенід. Можуть бути також використані інші реагенти з групами, що легко відходять, такі як алкілфторметансульфонати, алкілметансульфонати та алкіл-п-толуолсульфонати. Четвертинний амін включає позитивно заряджений азот. Фармацевтично прийнятні протиіони включають хлор, бром, йод, трифторацетат, ацетат, трифлат, сульфат, сульфонат. Протиіоном переважно є йод. Вибраний протиіон може бути введений з використанням іонообмінних смол. Як використовується у даному описі, термін "стереохімічно ізомерні форми" означає всі можливі ізомерні форми, які можуть мати сполуки формули (Іа) або (lb), їх N-оксиди, адитивні солі або фізіологічно функціональні похідні. Якщо не приведено або не зазначено інше, хімічне позначення сполук означає суміш усіх можливих стереохімічно ізомерних форм, при цьому зазначені суміші включають всі діастереомери та енантіомери основної молекулярної структури. Більш конкретно, стереогенні центри можуть мати R- або S-конфігурацію; замісники на двовалентних циклічних, (частково) насичених радикалах можуть мати цис- або трансконфігурацію. Сполуки, що містять подвійні зв'язки, можуть мати або Е- (entgegen, напроти), або Z 94051 14 (zusammen, разом) стереохімічну конфігурацію відносно зазначеного подвійного зв'язку. Терміни цис, транс, R, S, Ε та Ζ добре відомі фахівцю в даній галузі техніки. Стереохімічно ізомерні форми сполук формули (Іа) або (lb) очевидно включені в обсяг даного корисної моделі. Відповідно до правил номенклатури CAS, коли два стереогенні центри відомої абсолютної конфігурації присутні в молекулі, дескриптором R або S (на основі правила послідовності Кана-ІнгольдаПрелога) позначають хіральний центр, що має найменший номер, центр відліку. Конфігурацію другого стереогенного центра позначають, використовуючи відносні дескриптори [R*,R*] або [R*,S*], де R* завжди визначають як центр відліку, та [R*,R*] вказує центри з тією ж самою хіральністю, а [R*,S*] вказує центри з різною хіральністю. Наприклад, якщо хіральний центр у молекулі, що має найменший номер, має конфігурацію S, а другий центр - конфігурацію R, стереодескриптор буде визначений як S-[R*,S*]. Якщо використовуються "α" та "β", положення замісника з найвищим пріоритетом на асиметричному атомі вуглецю в кільцевій системі, що має найнижчий кільцевий номер, завжди є положенням "α" стосовно середньої площини, що визначається кільцевою системою. Положення замісника з найвищим пріоритетом на іншому асиметричному атомі вуглецю в кільцевій системі щодо положення замісника з найвищим пріоритетом на атомі, від якого ведуть відлік, називається «α», якщо воно знаходиться з тієї ж самої сторони середньої площини, що визначається кільцевою системою, або "β", якщо воно знаходиться з іншої сторони середньої площини, що визначається кільцевою системою. Позначення конкретної стереоізомерної форми означає, що зазначена форма є по суті вільною, тобто зв'язана з менше ніж 50%, переважно менше ніж 20%, більш переважно менше ніж 10%, ще більш переважно менше ніж 5%, далі переважно менше ніж 2%, та найбільш переважно менше ніж 1% іншого ізомеру (ізомерів). Таким чином, якщо сполука формули (І), наприклад, позначена як (αS, βR), це означає, що сполука є по суті вільною від (αR, βS) ізомеру. Сполуки формули (Іа) та формули (lb) можуть бути синтезовані у вигляді рацемічних сумішей енантіомерів, що можуть бути відділені один від одного з використанням відомих у даній галузі техніки способів розділення. Рацемічні сполуки формули (Іа) та формули (lb) можуть бути перетворені на відповідні діастереомерні сольові форми взаємодією з підходящою хіральною кислотою. Зазначені діастереомерні сольові форми потім розділяють, наприклад, за допомогою селективної або фракційної кристалізації, та енантіомери виділяють з них лугом. Альтернативний спосіб розділення енантіомерних форм сполук формули (Іа) або формули (lb) включає рідинну хроматографію з використанням хіральної нерухомої фази. Зазначені чисті стереохімічно ізомерні форми можуть бути також отримані з відповідних чистих стереохімічно ізомерних форм підходящих вихідних речовин, за умови, що реакція протікає стереоспе 15 цифічно. Переважно, якщо бажаним є конкретний стереоізомер, зазначену сполуку синтезують стереоспецифічними способами одержання. У цих способах переважно будуть використовувати енантіомерно чисті вихідні речовини. Мається на увазі, що таутомерні форми сполук формули (Іа) або формули (lb) включають такі сполуки формули (Іа) або формули (lb), де, наприклад, єнольна група перетворена на кетогрупу (кето-єнольна таутомерія). Мається на увазі, що N-оксидні форми сполук за даним винаходом включають такі сполуки формули (Iа) або формули (lb), в яких один або декілька атомів азоту окиснені до так називаного Nоксиду. Сполуки формули (Іа) або формули (lb) можуть бути перетворені на відповідні N-оксидні форми за допомогою відомих методів перетворення тривалентного азоту на його N-оксидну форму. Така реакція N-окиснення звичайно може бути здійснена шляхом взаємодії вихідної речовини формули (І) з відповідним органічним або неорганічним нероксидом. Відповідні неорганічні пероксиди включають, наприклад, пероксид водню, пероксиди лужних металів або лужноземельних металів, наприклад, пероксид натрію, пероксид калію; відповідні органічні пероксиди можуть включати перкислоти, такі як, наприклад, бензолкарбопероксокислота або галогензаміщена бензолкарбопероксокислота, тобто 3хлорбензолкарбопероксокислота, надалканові кислоти, наприклад, надоцтова кислота, алкілпдропероксиди, наприклад, трет-бутилгідропероксид. Підходящими розчинниками є, наприклад, вода, нижчі спирти, наприклад, етанол та т.п., вуглеводні, наприклад, толуол, кетони, наприклад, 2бутанон, галогеновані вуглеводні, наприклад, дихлорметан, а також суміші таких розчинників. Даний Корисна модель також включає похідні (звичайно називані "проліками") фармакологічно активних сполук відповідно до даного корисної моделі, що розкладаються in vivo з утворенням сполук відповідно до даного корисної моделі. Проліки звичайно (але не завжди) мають більш низький потенціал у відношенні рецептора-мішені, ніж сполуки, до яких вони розкладаються. Проліки особливо корисні в тих випадках, коли бажана сполука має хімічні або фізичні властивості, що утруднюють або роблять неефективним її введення. Наприклад, бажана сполука може бути малорозчинною, вона може погано переноситися через епітелій слизуватої оболонки або може мати небажано короткий період напіввиведення з плазми. Більш повне обговорення проліків можна знайти в Stells, V.J., el al., "Prodmgs", Drug Delivery Systems, 1985, pp.112-176, та Drugs, 1985, 29, pp.455-473. Пролікарські форми фармакологічно активних сполук відповідно до даного корисної моделі звичайно являють собою сполуки формули (Іа) або формули (lb), їх фармацевтично прийнятні кислотно-адитивні або основно-адитивні солі, їх стереохімічно ізомерні форми, їх таутомерні форми та їх N-оксидні форми, що містять естерифіковану або амідовану кислотну групу. У такі естерифіковані кислотні групи включені групи формули -COOR4, 94051 16 де R4 являє собою С1-6алкіл, феніл, бензил або одну з наступних груп: Амідовані групи включають групи формули CONRyRz, де Ry являє собою Η, С1-6алкіл, феніл або бензил, та R'4 являє собою -ОН, Н, С1-6алкіл, феніл або бензил. Сполуки відповідно до корисної моделі, що мають аміногрупу, можуть бути дериватизовані кетоном або альдегідом, таким як формальдегід, з утворенням основи Маніха. Ця основа гідролізує з кінетикою першого порядку у водному розчині. Алкіл, переважно, являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю, вибраний з метилу, етилу, пропілу або бутилу; або циклічний насичений вуглеводневий радикал, що містить від 3 до 6 атомів вуглецю, вибраний з циклопропілу або циклогексилу, необов'язково заміщеного ціано. Або алкіл являє собою С1-6алкіл. С16алкіл являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 6 атомів вуглецю, такий як, наприклад, метил, етил, пропіл, 2-метилетил, пентил, гексил та т.п.Переважною підгрупою С1-6алкілу є С1-4алкіл, що являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 4 атомів вуглецю, такий як, наприклад, метил, етил, пропіл, 2-метилетил та т.п. Арил, переважно, являє собою нафтил або феніл, більш переважно, феніл, кожний з яких необов'язково заміщений одним або двома замісниками, вибраними з атома галогену, наприклад, атома хлору; алкілу, наприклад, метилу; або алкілокси, наприклад, метилокси. Неt, переважно, являє собою фураніл, піридил, піридиніл, хінолініл або бензофураніл. Атом галогену, переважно, являє собою атом брому, фтору або хлору. Галогеналкіл, переважно, являє собою трифторметил. У загальному випадку переважними є сполуки формули (Іа). Даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (lb) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де R1 являє собою атом галогену, арил, алкіл або алкокси; або де R1 являє собою атом галогену, ціано, алкіл або Het Більш переважно, R1 являє собою атом галогену. Найбільш переважно, R1 являє собою бром. Даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (lb) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де p дорівнює нулю або 1. Для сполук формули (Іа), даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної 17 моделі, де R2 являє собою алкілокси, арил, арилокси або Het, зокрема, алкілокси, арил, арилокси або піролідино. Більш переважно, R2 являє собою алкілокси або арил. Найбільш переважно, R2 являє собою метилокси або феніл. Для сполук формули (lb), даний Корисна модель, переважно, відноситься до сполуки формули (lb) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де R9 являє собою алкіл, а R10 являє собою оксо. Даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (lb) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де R3 являє собою алкіл, арилалкіл, арил, моноабо діалкіламіноалкіл або Het-алкіл, наприклад, фураніл-, піридил- або хінолінілалкіл, більш переважно, Het-метил, найбільш переважно, фураніл-, піридил- або хінолінілметил. Даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (lb) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де q дорівнює 1 або 2. Більш переважно, q дорівнює 1. Даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (lb) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де Het у визначенні замісника R4 або R5 являє собою піридиніл або бензофураніл. Для сполук формули (Іа) або формули (lb), в яких Ζ являє собою радикал формули (а), даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (lb) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де R4 та R5, кожен, незалежно, являє собою атом водню або алкіл, більш переважно, атом водню, метил або етил та, найбільш переважно, метил. Даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (lb) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють радикал, вибраний з піролідино, піперидино, піперазино, морфоліно, 4тіоморфоліно, 2,3-дигідроізоіндол-1-ілу, тіазолідин-3-ілу, 1,2,3,6-тетрагідропіридилу, 1-аза-4-оксациклогептилу, 1,4-діазациклогептилу або 1,2,3,4тетрагідроізохінолін-2-ілу, необов'язково заміщеного одним або двома замісниками, більш переважно одним замісником, вибраним з алкілу, арилалкілу, арилу, піридилу або піримідинілу. Для сполук формули (Іа) або формули (lb), в яких Ζ являє собою радикал формули (Ь), даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (Ib) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де R8 являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від І до 4 атомів вуглецю, переважно, метил або етил. 94051 18 Даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (lb) або будь-якої її підгрупи, яку зазначеновище як переважний варіант здійснення даного корисної моде6 лі, де R являє собою феніл або Het, наприклад, бензофураніл або піридиніл, кожний з яких необов'язково заміщений одним або двома замісниками, незалежно вибраними з атома галогену або алкілу. Даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (lb) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де R7 являє собою атом водню або галогену, наприклад, атом хлору. Даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (lb) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де R9 являє собою алкіл, більш переважно, С16алкіл, зокрема, метил. Даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (lb) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де Ζ являє собою радикал формули (а). Даний Корисна модель, переважно, відноситься до сполуки формули (Іа) або формули (lb) або будь-якої її підгрупи, яку зазначено вище як переважний варіант здійснення даного корисної моделі, де Ζ являє собою радикал формули (b). Переважну групу сполук утворюють такі сполуки формули (Іа), їх фармацевтично прийнятні кислотно-адитивні та основно-адитивні солі, їх четвертинні аміни, їх стереохімічні ізомерні форми, їх таутомерні форми, їх Ν-оксидні форми або їх проліки, в яких p дорівнює 0 або 1; R2 являє собою алкілокси, арил, арилокси або Het; R3 являє собою алкіл, арилалкіл, арил, моно- або діалкіламіноалкіл або Het-алкіл; q дорівнює 1 або 2; R4 та R5, кожен, незалежно, являє собою атом водню; алкіл; алкілоксіалкіл; арилалкіл; Het-алкіл; моно- або діалкіламіноалкіл; Het; або арил; або ж R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють радикал, вибраний з піролідино, піперидпно, піперазино, морфоліно, 4-тіоморфоліно, 2,3-дигідроізоіндол-1-ілу, тіазолідин-3-ілу, 1,2,3,6тетрагідропіридилу, 1-аза-4-оксациклогептилу, 1,4діазациклогептилу або 1,2,3,4-тетрагідроізохінолін2-ілу, необов'язково заміщеного одним або двома замісниками, більш переважно одним замісником, вибраним з алкілу, арилалкілу, арилу, піридилу або піримідинілу; R6 являє собою феніл або Het; R7 являє собою атом водню або галогену; R8 являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 4 атомів вуглецю; R9 являє собою алкіл; R10 являє собою оксо. Найбільш переважну групу сполук утворюють такі сполуки формули (Іа), їх фармацевтично прийнятні кислотно-адитивні та основно-адитивні солі, їх четвертинні аміни, їх стереохімічно ізомерні форми, їх таутомерні форми, їх N-оксидні форми або їх проліки, в яких p дорівнює 0 або 1; R1 являє собою атом галогену, зокрема, атом брому, або ал 19 кіл, зокрема, метил, переважно, у положенні 6; R2 являє собою алкілокси, зокрема, метилокси, або арил, зокрема, феніл; R3 являє собою арил, зокрема, феніл, арилалкіл, зокрема, бензил, або Het4 алкіл, зокрема, хінолін-5-ілметил; q дорівнює 1; R 5 та R , кожен, незалежно, являє собою алкіл, зокрема, метил, етил або ізопропіл, або ж R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють радикал 4-тіоморфоліно, піперидино або піперазино, заміщений алкілом, зокрема, метилом, у положенні 4, або арилалкілом, зокрема, бензилом; R6 являє собою арил, зокрема, феніл, необов'язково заміщений атомом галогену, зокрема, атомом фтору, переважно, у положенні 2, або ж R6 являє собою бензофураніл; R7 являє собою атом водню; a R8 являє собою насичений вуглеводневий радикал з прямим або розгалуженим ланцюгом, що містить від 1 до 4 атомів вуглецю, зокрема, етил. Іншу найбільш переважну групу сполук, з погляду їх активності проти мікобактерій, утворюють такі сполуки формули (Іа), їх фармацевтично прийнятні кислотно-адитивні та основно-адитивні солі, їх четвертинні аміни, їх стереохімічно ізомерні форми, їх таутомерні форми, їх N-оксидні форми або їх проліки, в яких p дорівнює 1; Ζ являє собою радикал формули (a); R1 являє собою атом брому або метил, переважно, у положенні 6; R2 являє собою метилокси або феніл; R3 являє собою феніл, необов'язково заміщений метилоксигрупою, або бензил; q дорівнює 1; R4 та R5, кожний, являє 4 5 собою метил, етил або ізопропіл, або ж R та R разом з атомом азоту, до якого вони приєднані, утворюють радикал 4-тіоморфоліно, радикал піперидино, заміщений метилом у положенні 4, або радикал піперазино, заміщений бензилом у положенні 4; R6 являє собою феніл або бензофураніл; та R7 являє собою атом водню. Ще одну найбільш переважну групу сполук, з погляду їх активності проти бактерій, відмінних від мікобактерій, утворюють такі сполуки формули (Іа), їх фармацевтично прийнятні кислотноадитивні та основно-адитивні солі, їх четвертинні аміни, їх стереохімічно ізомерні форми, їх таутомерні форми, їх N-оксидні форми або їх проліки, в яких p дорівнює 0 або 1; R1 являє собою атом брому або метил, переважно, у положенні 6; R2 являє собою метилокси або феніл; R3 являє собою феніл, бензил або хінолін-5-ілметил; q дорівнює 1; R4 та R5, кожний, являє собою метил, або ж R4 та R5 разом з атомом азоту, до якого вони приєднані, утворюють радикал піперазино, заміщений метилом у положенні 4; R6 являє собою феніл, необов'язково заміщений атомом фтору в положенні 2; R7 являє собою атом водню; a R8 являє собою етил. Найбільш переважно, за активністю відносно бактерій, відмінних від мікобактерій, сполуку вибирають з: 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно)-N-(4-метилпіперазин-1іл)ацетаміду; N-[(6-бром-2-метоксихінолін-3-іл)фенілметил]N',N'-диметил-N-фенілетан-1,2-діаміну; 94051 20 N-бензил-N-[(6-бром-2-фенілхінолін-3іл)фенілметил]-N',N'-диметилетан-1,2-діаміну; 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно)-1-(4-метилпіперазин-1іл)етанону; 2-{[(6-бром-2-метоксихінолін-3іл)фенілметил]хінолін-5-ілметиламіно}-1-(4метилпіперазин-1-іл)етанону; 2-{бензил-[(6-бром-2-метоксихінолін-3іл)фенілметил]аміно)-1-(4-метилпіперазин-1іл)етанону; N-бензил-N-[(6-бром-2-метоксихінолін-3-iл)-(2фторфеніл)метил]-N',N'-диметилетан-1,2-діаміну; етилового ефіру {бензил-[(6-бром-2метоксихінолін-3-іл)фенілметил]аміно}оцтової кислоти; та 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-1-піперидин-1-ілетанону; та їх фармацевтично прийнятних кислотноадитивних та основно-адитивних солей, їх четвертинних амінів, їх стереохімічно ізомерних форм, їх таутомерних форм, їх N-оксидних форм або їх проліків. Найбільш переважно, за активністю відносно мікобактерій, сполуку вибирають з: 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-1-(4-бензилпіперазин-1іл)етанону; N-[(6-бром-2-метоксихінолін-3-іл)фенілметил]N-(2-метоксифеніл)-N',N'-диметилетан-1,2-діаміну; 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-N,N-диметилацетаміду; N-бензил-N-[(6-бром-2-фенілхінолін-3іл)фенілметил]-N,N'-диметилетап-1,2-діаміну; 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно}-1-(4-метилпіперидин-1іл)етанону; 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно)-N,N-диетилацетаміду; 2-{бензил-[(6-бром-2-фенілхінолін-3іл)фенілметил]аміно)-N,N-диметилацетаміду; 2-{[бензофуран-2-іл-(2-фенілхінолін-3іл)метил]бензиламіно}-N-ізопропіл-Nметилацетаміду; 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил]аміно]-1-тіоморфолін-4-ілетанону; та 2-{бензил-[(6-метил-2-фенілхінолін-3іл)фенілметил|аміно)-N-ізопропіл-Nметилацетаміду; та їх фармацевтично прийнятних кислотноадитивних та основно-адитивних солей, їх четвертинних амінів, їх стереохімічно ізомерних форм, їх таутомерних форм, їх N-оксидних форм або їх проліків. Фармакологія Несподівано було виявлено, що сполуки за даним винаходом придатні для лікування бактеріальних захворювань, особливо включаючи мікобактеріальні захворювання, зокрема, захворювання, що викликані такими патогенними мікобактеріями, як Mycobaclerium tuberculosis (включаючи його латентну та стійку до дії ліків форму), М. bovis, Μ. aνium та М. marinum. Таким чином, даний Корисна модель відноситься також до сполук формули (Іа) 21 або формули (lb), як зазначено вище, їх фармацевтично прийнятних кислотно-адитивних та основно-адитивних солей, їх четвертинних амінів, їх стереохімічно ізомерних форм, їх таутомерних форм, їх N-оксидних форм або їх проліків для застосування як лікарський засіб. Крім того, даний Корисна модель відноситься також до застосування сполук формули (Іа) або формули (lb), їх фармацевтично прийнятних кислотно-адитивних та основно-адитивних солей, їх четвертинного амінів, їх стереохімічно ізомерних форм, їх таутомерних форм, їх N-оксидних форм або їх проліків, а також будь-яких їх фармацевтичних композицій, як зазначено нижче, для одержання лікарського засобу, призначеного для лікування бактеріального захворювання, включаючи мікобактеріальне захворювання. Таким чином, відповідно до іншого аспекту, даний Корисна модель забезпечує спосіб лікування пацієнта, що страждає від бактеріального захворювання, або пацієнта, що має ризик їм занедужати, включаючи мікобактеріальне захворювання, що включає введення пацієнту терапевтично ефективної кількості сполуки або фармацевтичної композиції за даним винаходом. Крім їх активності відносно мікобактерій, сполуки за даним винаходом активні також проти інших бактерій. У загальному випадку бактеріальні патогени можуть бути класифіковані як грампозитивні або грам-негативні патогени. Сполукиантибіотики, активні як проти грам-позитивних, так і грам-негативних патогенів, у загальному випадку розглядають як сполуки, що мають широкий спектр дії. Сполуки заданим винаходом розглядають як активні проти грам-позитивних та/або грамнегативних бактеріальних патогенів. Зокрема, сполуки за даним винаходом активні проти, щонайменше, однієї грам-позитивної бактерії, переважно, активні проти декількох грам-позитивних бактерій, більш переважно, активні проти однієї або декількох грам-позитивних та/або однієї або декількох грам-негативних бактерій. Сполуки за даним винаходом мають бактерицидну або бактеріостатичну активність. Приклади грам-позитивних та/або грамнегативних аеробних та анаеробних бактерій включають стафілококи, наприклад, S. aureus; ентерококи, наприклад, K. faecalis; стрептококи, наприклад, S. pneumoniae, S.mutans, S. pyogens; бацили, наприклад, Bacillus subtilis; лістерії, наприклад, Listeria monocytogenes; збудники гемофільної інфекції, наприклад, Н. influenza; збудники інфекції Moraxella, наприклад, M. catarrhalis; збудники псевдомонозу, наприклад, Pseudomonas aeruginosa; та збудники Escherichia, наприклад, E. соlі. Особливо важливими є грам-позитивні патогени, наприклад, стафілококи, ентерококи та стрептококи, унаслідок розвитку стійких штамів, що однаково важко лікувати та знищувати, наприклад, в умовах лікарні після зараження ними. Прикладами подібних штамів є стійкі до дії метициліну Slaphylococcus аureus (MRSA), стійкі до дії метициліну коагулаза-негативні стафілококи (MRCNS), стійкі до дії пеніциліну Streptococcus рnеumоnіаe та мультирезистентні Enterococcus faecium. 94051 22 Сполуки за даним винаходом виявляють також активність проти стійких бактеріальних штамів. Сполуки за даним винаходом найбільш активні проти Staphylococcus aureus, у тому числі стійких Staphylococcus aureus, таких як, наприклад, стійкі до дії метициліну Staphylococcus aureus (MRSA), та Streptococcus pneumoniae. Зокрема, сполуки відповідно до даного корисної моделі виявляють активність проти таких бактерій, життєздатність яких залежить від правильного функціонування F1F0 АТФ синтази. Не прив'язуючись до якої-небудь теорії, повідомляють, що активність сполук відповідно до даного корисної моделі полягає в інгібуванні F1F0 АТФ синтази, зокрема, інгібуванні F0 комплексу F1F0 АТФ синтази, більш конкретно, інгібуванні підодиниці F0 комплексу F1F0 АТФ синтази, що приводить до загибелі бактерії через виснаження клітинних рівнів АТФ бактерії. Бактеріальні інфекції, які можна лікувати за допомогою сполук за даним винаходом, включають, наприклад, інфекції центральної нервової системи, інфекції зовнішнього вуха, інфекції середнього вуха, такі як гострий середній отит, інфекції краніальних пазух, очні інфекції, інфекції порожнини рота, такі як інфекції зубів, ясeн та слизуватої оболонки, інфекції верхніх дихальних шляхів, інфекції нижніх дихальних шляхів, сечостатеві інфекції, шлунково-кишкові інфекції, гінекологічні інфекції, сепсис, інфекції кісток та суглобів, інфекції шкіри та структури шкіри, бактеріальний ендокардит, опіки, антибактеріальну профілактику хірургічних операцій, а також антибактеріальну профілактику пацієнтів з пригнічена імунною системою, таких як пацієнти, що одержують хіміотерапію від раку або пацієнти з пересадженими органами. У даному описі під фразою, що "дані сполуки здатні лікувати бактеріальну інфекцію", мається на увазі, що такі сполуки здатні лікувати інфекцію, викликану одним або більше бактеріальними штамами. У даному описі під фразою, що "бактеріальна інфекція не є мікобактеріальною інфекцією", мається на увазі, що бактеріальна інфекція відрізняється від інфекції, викликаної одним або більше штамами мікобактерій. Даний Корисна модель також відноситься до композиції, що містить фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість сполуки заданим винаходом. Сполуки за даним винаходом можуть бути виготовлені в різних фармацевтичних формах для введення Як підходящі композиції можуть бути приведені всі композиції, що звичайно використовуються для системного введення лікарських засобів Для того, щоб одержати фармацевтичну композицію відповідно до даного корисної моделі, ефективну кількість конкретної сполуки, необов'язково у формі адитивної солі, як активний інгредієнт ретельно змішують з фармацевтично прийнятним носієм, що може мати різні форми в залежності від форми препарату, що вводиться. Такі фармацевтичні композиції бажано знаходяться у одиничних дозованих формах, що підходять, зокрема, для перорального введення або для парентеральних ін'єк 23 цій. Наприклад, при одержанні композицій у вигляді пероральної дозованої форми можуть бути використані будь-які звичайні фармацевтичні середовища, такі як, наприклад, вода, гліколі, олії, спирти та т.п., для одержання пероральних рідких препаратів, таких як суспензії, сиропи, еліксири, емульсії та розчини; або тверді носії, такі як крохмалі, цукри, каолін, розріджувачі, лубриканти, зв'язуючі речовини, агенти дезинтеграції та т.п., для одержання порошків, пігулок, капсул та таблеток. Завдяки легкості введення, таблетки та капсули є найбільш переважними пероральними одиничними дозованими формами, для одержання яких, зрозуміло, використовують тверді фармацевтичні носії. При одержанні парентеральних композицій носій звичайно включає стерильну воду, щонайменше вона складає більшу його частину, хоча можуть бути включені й інші інгредієнти, наприклад, для поліпшення розчинності. Можуть бути отримані, наприклад, розчини для ін'єкцій, де носій містить розчин солі, розчин глюкози або суміш розчину солі та глюкози. Можуть бути також отримані суспензії для ін'єкцій, де можуть бути використані підходящі рідкі носії, суспендуючі агенти та т.п.Також можуть бути використані тверді препарати, які перетворюють безпосередньо перед застосуванням, на рідкі препаративні форми. В залежності від способу введення фармацевтична композиція переважно містить від 0,05 до 99% мас., більш переважно від 0,1 до 70% мас., активного інгредієнта, та від 1 до 99,95% мас., більш переважно від 30 до 99,9% мас., фармацевтично прийнятного носія, при цьому всі значення процентного вмісту приведені з розрахунку на загальну масу композицію. Фармацевтична композиція може додатково містити різні інші, відомі з рівня техніки інгредієнти, наприклад, лубрикант, стабілізуючий агент, буферний агент, емульгуючий агент, регулятор в'язкості, поверхнево-активну речовину, консервант, ароматизатор або барвник. Особливо переважним є одержання вищенаведених фармацевтичних композицій у вигляді одиничної дозованої форми з метою полегшення введення та рівномірності дозування. Як використовується у даному описі, термін "одинична дозована форма" означає фізично дискретні одиниці, прийнятні як одиничне дозування, при цьому кожна одиниця містить заздалегідь визначену кількість активного інгредієнта, розраховану таким чином, щоб здійснювати потрібну терапевтичну дію в сполученні з потрібним фармацевтичним носієм. Прикладами таких одиничних дозованих форм є таблетки (включаючи таблетки з насічками або покриттям), капсули, пігулки, пакетики з порошком, облатки, супозиторії, розчини або суспензії для ін'єкцій та т.п., а також їх різноманітні різновиди. Добова доза сполуки відповідно до даного корисної моделі, безумовно, буде змінюватися в залежності від сполуки, що застосовують, способу введення, бажаного лікування та діагностованого мікобактеріального захворювання. Проте у загальному випадку задовільні результати будуть отримані, коли сполуку за даним винаходом вводять з 94051 24 денною дозою, що не перевищує 1 грам, зокрема, у діапазоні від 10 до 50мг/кг маси тіла. Оскільки встановлено, що сполуки формули (Іа) або формули (lb) активні проти бактеріальної інфекції, то сполуки за даним винаходом можуть бути об'єднані з іншими антибактеріальними засобами з метою ефективної боротьби з бактеріальними інфекціями. Таким чином, даний Корисна модель також відноситься до комбінації (а) сполуки за даним винаходом та (b) одного або декількох інших антибактеріальних засобів. Даний Корисна модель також відноситься до комбінації (а) сполуки за даним винаходом та (b) одного або декількох інших антибактеріальних засобів для використання як лікарський препарат. Даний Корисна модель також відноситься до застосування комбінації або фармацевтичної композиції, як зазначено вище, для лікування бактеріальної інфекції. Фармацевтична композиція, що містить фармацевтично прийнятний носій та, як активний інгредієнт, терапевтично ефективну кількість (а) сполуки за даним винаходом та (b) одного або декількох інших антибактеріальних засобів, також включена в даний Корисна модель. , Масове співвідношення (а) сполуки за даним винаходом та (b) іншого(них) антибактеріального(их) засобу(ів), коли їх надають у вигляді комбінації, може бути встановлене фахівцем в даній галузі техніки. Зазначене співвідношення та точна доза та частота введення залежать від використаної конкретної сполуки за даним винаходом та іншого(их) антибактеріального(их) засобу(ів), конкретного стану, що лікують, серйозності стану, що лікують, віку, статі, дієти, часу введення та загального фізичного стану конкретного пацієнта, способу введення, а також іншого лікарського засобу, що індивід може приймати, як добре відомо фахівцю у даній галузі техніки. Крім того, буде очевидним, що ефективна добова кількість може бути знижена або збільшена в залежності від відповідної реакції пацієнта, лікування якого проводять, та/або в залежності від оцінки лікаря, що призначає сполуки за даним винаходом. Сполуки за даним винаходом та один або декілька інших антибактеріальних засобів можуть бути об'єднані в одному препараті, або ж вони можуть бути виготовлені у вигляді окремих препаратів, так що їх можна вводити одночасно, роздільно або послідовно. Таким чином, даний Корисна модель також відноситься до продукту, що містить (а) сполуку за даним винаходом та (b) один або декілька інших антибактеріальних засобів, як комбінованого препарату для одночасного, роздільного або послідовного застосування при лікуванні бактеріальної інфекції. Іншими антибактеріальними засобами, що можуть бути об'єднані зі сполуками формули (Іа) або формули (lb), є відомі в даній галузі антибактеріальні засоби. Іншими антибактеріальними засобами с антибіотики β-лактамової групи, такі як природні пеніциліни, напівсинтетичні пеніциліни, природні цефалоспорини, напівсинтетичні цефалоспорини, цефаміцини, 1-оксацефеми, клавула 25 нові кислоти, пенеми, карбапенеми, нокардицини, монобактами; тетрацикліни, ангідротетрацикліни, антрацикліни; аміноглікозиди; нуклеозиди, такі як N-нуклеозиди, С-нуклеозиди, карбоциклічні нуклеозиди, бластицидин S; макроліди, такі як 12-членні кільцеві макроліди, 14-членні кільцеві макроліди, 16-членні кільцеві макроліди; анзаміцини; пептиди, такі як блеоміцини, граміцидини, поліміксини, бацитрацини, пептидні антибіотики з великими циклами, що містять лактонові зв'язки, актиноміцини, амфоміцин, капреоміцин, дистаміцин, ендурацидини, мікаміцин, неокарциностатин, стендоміцин, біоміцин, віргиніаміцин; циклогексимід; циклосерин; варіотин; саркоміцин А; новобіоцин; гризеофульвін; хлорамфенікол; мітоміцини; фумагилін; монензипи, піролнітрин; фосфоміцин; фузидієва кислота; D-(р-гідроксифеніл)гліцин, D-фенілгліцин; енедіїни. Конкретними антибіотиками, що можуть бути об'єднані зі сполуками формули (Іа) або формули (lb) за даним винаходом, наприклад, є бензилпеніцилін (калію, прокаїну, бензатину), феноксиметилпеніцилін (калію), фенетицилін калію, пропіцилін, карбеніцилін (динатрію, феніл натрію, інданіл натрію), сульбеніцилін, тикарцилін динатрію, метицилін натрію, оксацилін натрію, клоксацилін натрію, диклоксацилін, флуклоксацилін, ампіцилін, мезлоцилін, піперацилін натрію, амоксицилін, циклацилін, гектацилін, сулбактамнатрій, талампицилін гідрохлорид, бакампіцилін гідрохлорид, півмецилінам, цефалексин, цефаклор, цефалогліцин, цефадроксил, цефрадин, цефроксадин, цефапірин натрію, цефалотин натрію, цефацетрил натрію, цефсулодин натрію, цефалоридин, цефатризин, цефоперазон натрію, цефамандол, вефотіам гідрохлорид, цефазолін натрію, цефтизоксим натрію, цефотаксим натрію, цефменоксим гідрохлорид, цефуроксим, цефтриаксон натрію, цефтазидим, цефокситин, цефметазол, цефогетан, латамоксеф, клавуланова кислота, іміпенем, азтреонам, тетрациклін, хлортетрациклін гідрохлорид, диметилхлортетрациклін, окситетрациклін, метациклін, діоксициклін, ролітетрациклін, міноциклін, даунорубіцин гідрохлорид, доксорубіцин, акларубіцин, канаміцин сульфат, бекаміцин, іобраміцин, гентаміцин сульфат, дибекацин, амікацин, мікрономі 94051 26 цин, рибостаміцин, неоміцин сульфат, паромоміцин сульфат, стрептоміцин сульфат, дигідрострептоміцин, дестоміцин А, гігроміцин В, апраміцин, сизоміцин, нетилміцин сульфат, спектиноміцин гідрохлорид, астроміцин сульфат, валідаміцин, касугаміцин, поліоксин, бластицидин S, еритроміцин, еритроміцин естолат, олеандоміцин фосфат, трацетилолеандоміцин, кигазаміцин, джозаміцин, спіраміцин, тилозин, івермектин, мідекаміцин, блеоміцин сульфат, пепломіцин сульфат, граміцидин S, полімиксин В, бацитрацин, колістин сульфат, колістинметасульфонат натрію, ентраміцин, мікаміцин, віргиніаміцин, капреоміцин сульфат, біоміцин, енвіоміцин, ванкоміцин, актиноміцин D, неокарциностатин, бестатин, пепстатин, монензин, лазалоцид, саліноміцин, амфотерицин В, ністатин, натаміцин, трихоміцин, мітраміцин, лінкоміцин, кліндаміцин, кліндаміцин пальмітат гідрохлорид, флавофосфоліпол, циклосерин, пецилоцин, гризеофульвін, хлорамфенікол, хлорамфенікол пальмітат, мітоміцин С, піролнітрин, фосфоміцин, фузидієва кислота, бікозаміцин, тіамулін, сиканін. Іншими мікобактеріальними засобами, що можуть бути об'єднані зі сполуками формули (Іа) або формули (lb), є, наприклад, рифампіцин (=рифампін); ізоніазид; піразинамід; амікацин; етіонамід; моксифлоксацин, етамбутол; стрептоміцин; пара-аміносаліцилова кислота; циклосерин; капреоміцин; канаміцин; тіоацетазон; РА-824; хінолони/фторхінолони, такі як, наприклад, офлоксацин, ципрофлоксацин, спарфлоксации; макролідп, такі як, наприклад, кларитроміцин, клофазимін, амоксицилін із клавулановою кислотою; рифаміцини; рифабутин; рифапентин. Загальні способи одержання Сполуки відповідно до даного корисної моделі звичайно можуть бути отримані за допомогою послідовності стадій, кожна з яких відома фахівцю в даній галузі. Сполуки формули (Іа), де Ζ являє собою радикал формули (а), в якому X являє собою -СН2-, представлені нижче формулою (Іа1), можуть бути отримані взаємодією сполуки формули (II) зі сполукою формули (III) у відповідності зі схемою реакцій 1, наведеною нижче: Схема 1 (де Υ являє собою групу, що відходить, таку як атом брому, атом хлору, гідроксил, птолуолсульфонілокси або метансульфонілокси). Якщо Υ являє собою атом брому, то реакцію загалом проводять у присутності основи, такої як карбонат калію, карбонат натрію, Еt4N, у підходящому розчиннику, такому як ацетонітрил, диметилформамід, N-метилпіролідон або диглим. Якщо Υ являє собою гідрокси, то реакцію загалом проводять у присутності P(Ph)3 та діізопропілазодикарбоксилату (DIAD) або діетилазодикарбоксилату (DEAD) у підходящому розчиннику, такому як тетрагідрофуран. Сполуки формули (Іа), де Ζ являє собою радикал формули (b), представлені нижче формулою (Іа2), можуть бути отримані взаємодією сполуки формули (II) зі сполукою формули (IV) у відповідності зі схемою реакцій 2, наведеною нижче: 27 Реакцію можна проводити в умовах, що аналогічні наведеним вище на Схемі 1. Сполуки формули (1а2) можна перетворити на проміжні сполуки формули (V), що потім можуть вступати у взаємодію зі сполукою формули (VI) з На стадії (а) сполуки формули (Іа2) можна гідролізу вати, наприклад, обробкою водним розчином гідроксиду літію в органічному розчиннику, такому як тетрагідрофуран. На стадії (b) проміжна сполука формули (V) взаємодіє з амінною сполукою формули (VI), наприклад, у присутності Nетил-N'-(3-диметиламінопропіл)карбодііміду (EDCI) та 1-гідроксибензотриазолу (НОВТ) у присутності основи, такої як триетиламін, у підходящому розчиннику, такому як дихлорметан та/або тетрагідрофуран. Проміжна сполука формули (lІ), де R6 являє собою арил, a Y являє собою атом брому, представлена нижче формулою (llа1), може бути отримана бромуванням сполуки формули (VII) відповідно до наведеної нижче схеми реакцій 4а: 94051 28 утворенням сполук формули (Іа), де Ζ являє собою радикал формули (а), в якому X являє собою СО-, представлених нижче формулою (Іа3), як показано далі на схемі реакцій 3: Бромування сполуки формули (VII) можна проводити, наприклад, дією N-бромсукцииіміду (NBS) та дибензоїлпероксиду в підходящому розчиннику, такому як тетрахлорид вуглецю. Відповідна сполука формули (II), де Υ являє собою атом хлору, може бути отримано аналогічним чином. Проміжна сполука формули (II), де R6 являє собою арил, a Y являє собою гідрокси, представлена нижче формулою (llа2), може були отримана реакцією сполуки формули (Vlla) зі сполукою формули (Vllb) відповідно до наведеної нижче схеми реакцій 4b: 29 94051 30 Проміжна сполука формули (II), де R6 являє собою Het, a Y являє собою гідрокси або атом брому, представлена нижче формулами (ІІb1) та (llb2), може бути отримана відповідно до наведеної нижче схеми реакцій 5а: На стадії (а) сполука формули (VIII) взаємодіє зі сполукою HetH, наприклад, при використанні нбутиллітію, у підходящому розчиннику, такому як тетрагідрофуран або Et2O, у результаті чого вводиться радикал Het. На стадії (b) перетворення гідроксильного радикала на радикал брому можна здійсниш, наприклад, дією на сполуку формули (llb1) бромуючого агента, такого як трибромід фосфору або водний розчин бромистоводневої кислоти, у підходящому розчиннику, такому як дихлорметан. Відповідна сполука формули (II), де Υ являє собою атом хлору, може бути отримана аналогічним чином. Проміжна сполука формули (II), де R6 являє собою Het, a Y являє собою толуолсульфонілокси або метансульфонілокси, позначені нижче як RSO2O, при цьому проміжна сполука представлена нижче формулою (llb3), може бути отримана відповідно до наведеної нижче схеми реакцій 5b: Реакцію сполуки формули (X) зі сполукою формули (XI) звичайно проводять з використанням ціаноборгідриду натрію в присутності кислоти, такої як оцтова кислота, та в підходящому розчиннику, такому як метанол. Перетворення гідроксильного радикала на радикал ефіру мезилату або тозилату можна здійснити, наприклад, обробкою сполуки (llb1) метансульфонілхлоридом або птолуолсульфонілхлоридом, відповідно, у присутності основи, такої як триетиламін, та в підходящому розчиннику, такому як дихлорметан. Проміжна сполука формули (IV), де R3 являє собою арилметил або Het-метил, представлена нижче формулою (IVa), де R3a являє собою арил або Het, може бути отримана взаємодією сполуки формули (X) зі сполукою формули (XI) відповідно до наведеної нижче схеми реакцій 6: Як альтернатива, проміжна сполука формули (IV) може бути отримана реакцією сполуки формули (XII) зі сполукою формули (XIII) відповідно до наведеної нижче схеми реакцій 7: 31 У сполуці формули (ХІl) на наведеній вище схемі L являє собою підходящу групу, що відходить, таку як атом хлору, а реакцію в загальному випадку проводять у присутності основи, такої як карбонат калію або карбонат натрію, та в присутності підходящого розчинника, такого як ацетонітрил, диметилформамід, N-метилпіролідон або диглим. 94051 32 Сполуку формули (Іа), де R2 являє собою піролідино, представлена нижче формулою (lа4), можна одержати взаємодією сполуки формули (XI), де R2a являє собою атом галогену, наприклад, хлору, з піролідином відповідно до наведеної нижче схеми реакцій 8: Схема 8 Вихідну сполуку формули (XI) можна одержати аналогічно тому, як описано для одержання сполук формули (І) та показано на Схемі 1. Сполуки формули (І), де R1 являє собою атом галогену, наприклад, брому, можуть бути перетворені на відповідні сполуки формули (l), дє R1 являє собою алкіл, наприклад, метил, обробкою підходящим алкілуючим агентом, таким як СН3В(ОН)2 або (CH3)4Sn, у присутності Pd(PPh3)4 у підходящому розчиннику, такому як толуол або 1,2диметоксіетан (DME). Аналогічні сполуки формули (І), де R1 являє собою атом галогену, наприклад, брому, можуть бути перетворені на відповідні сполуки формули (І), де R являє собою піридил, обробкою 3-(1,3,2-діоксаборинан-2-іл)піридином у присутності Pd(PPh3)4 та основи, такої як карбонат натрію, у підходящому розчиннику, такому як DME. Сполуки формули (lb) можуть бути отримані аналогічно тому, як описано вище для відповідних сполук формули (Іа). Сполуки формули (Іа) або формули (lb) можуть бути перетворені на відповідні N-оксиди за допомогою стандартного способу, наприклад, за допомогою обробки 3-хлорнадбензойною кислотою в підходящому розчиннику, такому як дихлорметан. Очевидно, що в приведених вище та надалі реакціях продукти реакції можуть бути виділені з реакційного середовища та, якщо необхідно, можу ι ь бути додатково очищені відповідно до методів, що загалом відомі з рівня техніки, таких як екстракція, кристалізація та хроматографія. Очевидно також, що продукти реакції, що існують у більш, ніж одній енантіомерній формі, можуть бути виділені з їх суміші відомими способами, наприклад, препаративною хроматографією, такою як ВЕРХ. Як правило, сполуки формули (Іа) або формули (lb) можуть бути розділені на їх ізомерні форми. Представлені нижче приклади ілюструють даний Корисна модель, не обмежуючи його. Експериментальна частина Далі в контексті даного опису "DME" означає 1,2-диметоксіетан, "NBS" означає Nбромсукцинімід, ДМФА означає Ν,Νдиметилформамід, ТГФ означає тетрагідрофуран, "DIPE" означає діізопропіловий ефір, "ВТЕАС" означає хлорид бензилтриетиламонію, "EDCI" означає 1-(3-диметиламінопропіл)-3етилкарбодіімід.НСl, "НОВТ" означає 1гідроксибензотриазол, "DIAD" означає діізопропілазодикарбоксилат, а "polymerlab NCO" означає метилізоціанат полістиролу. А. Одержання проміжних сполук Приклад А1 а) Одержання проміжної сполуки 1 Суміш 5-бром-1Н-індол-2,3-діону (0,066моль) у 3N розчині NaOH (150мл) перемішують при 80°С протягом 30хв., а потім охолоджують до кімнатної температури. Додають 1,3-дифеніл-1-пропанон (0,066моль) та суміш нагрівають протягом ночі до температури 80°С, потім охолоджують та підкислюють до значення рН5 оцтовою кислотою. Осад відфільтровують, промивають водою та діізопропіловим ефіром та сушать. Вихід: 15г проміжної сполуки 1 (55%). 33 94051 34 b) Одержання проміжної сполуки 2 Суміш проміжної сполуки 1 (15г) у дифеніловому ефірі (150мл) перемішують протягом ночі при температурі 300°С. Отриману суміш очищають за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан: 100). Чисті фракції збирають та розчинник випарюють. Вихід: 3,0г проміжної сполуки 2 (22%). c) Одержання проміжної сполуки 3 Суміш проміжної сполуки 2 (0,0027моль), 1бром-2,5-піролідиндіону (0,0027моль) та дибензоїлпероксиду (0,00005моль) у ССl4 (10мл) перемішують та кип'ятять зі зворотним холодильником протягом 1 години, а потім виливають у Н2О та екстрагують СH2Cl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 1г проміжної сполуки 3 (80%). Приклад А2 а) Одержання проміжної сполуки 4 Бензолпропаноїлхлорид (0,488моль) додають по краплях при кімнатній температурі до розчину 4-бромбензоламіну (0,407моль) у Et3N (70мл) та CH2Cl2 (700мл) та суміш перемішують протягом ночі при кімнатній температурі. Суміш виливають у воду та концентрований розчин NH4OH та екстрагують СН2Сl2. Органічний шар сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок кристалізують з діетилового ефіру. Залишок (119,67г) розчиняють у СН2Сl2 та промивають 1N розчином НСI. Органічний шар сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 107,67г проміжної сполуки 4 (87%). b) Одержання проміжної сполуки 5 Реакцію проводять двічі. РОСl3 (1,225моль) додають по краплях при температурі 10°С в ДМФА (0,525моль). Потім при кімнатній температурі додають проміжну сполуку 4 (0,175моль). Суміш перемішують протягом ночі при температурі 80°С, виливають на лід та екстрагують СН2Сl2. Органічний шар сушать (над MgSO4), відфільтровують та розчинник випарюють. Продукт використовують без подальшого очищення. Вихід: 77,62г проміжної сполуки 5 (67%). c) Одержання проміжної сполуки 6 Суміш проміжної сполуки 5 (0,233моль) у 30%ому розчині CH3ONa у СН3ОН (222,32мл) та СН3ОН (776мл) перемішують при кип'ятінні зі зворотним холодильником протягом ночі, виливають на лід та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок очищають за допомогою колоночної хроматографії на силікагелі (елюент: СН2Сl2/циклогексан 20/80, а потім 100/0; 20-45мкм). Чисті фракції поєднують та розчинник випарюють. Вихід: 25г проміжної сполуки 6 (33%). d) Одержання проміжної сполуки 7 Суміш проміжної сполуки 6 (0,03моль), 1-бром2,5-піролідиндіону (0,03моль) та дибензоїлпероксиду (0,1г) у CCl4 (100мл) перемішують при кип'ятінні зі зворотним холодильником протягом 1 години. Додають 10%-ий K2СO3 та суміш екстрагують СН2СІ2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 12,2г проміжної сполуки 7 (98%). Приклад A3 Одержання проміжної сполуки 8 Суміш проміжної сполуки 6-бром-3-(бромфенілметил)2-хлорхіноліну (одержують аналогічно A2.d) (0,0036моль), N,N-диметил-N'-(фенілметил)-1,2етандіаміну (0,0036моль) та K2СО3 (0,0036моль) у CH3CN (20мл) перемішують при температурі 80°С протягом 12 годин. Розчинник випарюють. Суміш екстрагують СН2СІ2/Н2О. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (2,3г) очищають за допомогою колоночної хроматографії на силікагелі (елюент: СН2Сl2/СН3OН 98/2; 70-200мкм). Збирають необхідні фракції та розчинник випарюють. Вихід: 0,4г проміжної сполуки 8. Приклад А4 а) Одержання проміжної сполуки 9 35 Суміш 6-бром-2-хлорхіноліну (0,06моль) у 30%-ому розчині CH3ONa у СН3ОН (70мл) та СН3ОН (140мл) перемішують при кип'ятінні зі зворотним холодильником протягом ночі, виливають у Н2О та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (12,6г) очищають за допомогою колоночної хроматографії на силікагелі (елюент: СН2Сl2/циклогексан 40/60; 1535мкм) Збирають необхідні фракції та розчинник випарюють. Вихід: 7,5г проміжної сполуки 9. b) Одержання проміжної сполуки 34 1,6Μ розчин hBuLi (0,03моль) у потоці азоту додають по краплях при температурі в інтервалі від -20°С до -10°С до розчину 2,2,6,6тетраметилпіперидину (0,03моль) у ТГФ (90мл). Суміш перемішують при -20°С протягом 20хв., потім охолоджують до -70°С. По краплях додають розчин проміжної сполуки 9 (0,025моль) у ТГФ (39,6мл). Суміш перемішують при -70°С протягом 1 години. По краплях додають розчин 2фторбензальдегіду (0,03моль) у ТГФ (11,1мл). Суміш перемішують при -70°С протягом 3 годин та 30хв., а потім залишають нагріватися до кімнатної температури, перемішують протягом ночі при кімнатній температурі, виливають у Н2О та екстрагують EtOAc. Органічний шар промивають насиченим розчином NaCl, сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 9,96г. Цю фракцію очищають за допомогою колоночної хроматографії на силікагелі (елюювання з градієнтом концентрації: циклогексан/СН2СІ2 від 50/50 до 100/0; 15-40мкм). Збирають дві фракції та розчинник випарюють. Вихід: 2,52г фракції А та 0,75г фракції 2. Третю фракцію одержують, промиваючи колонку СH3OH. Розчинник випарюють. Вихід: 4,10г проміжної сполуки 34 (45%). Приклад А5 a) Одержання проміжної сполуки 10 При температурі 5°С повільно додають РОСl3 (327мл) до ДМФА (120мл). Після завершення додавання додають N-(4метилфеніл)бензолпропанамід (0,501моль). Суміш перемішують при температурі 80°С протягом ночі, потім охолоджують до кімнатної температури та 94051 36 виливають на лід. Додають EtOAc. Суміш перемішують протягом 1 години, додаючи лід, а потім екстрагують ЕtOАс. Органічний шар відокремлюють, промивають водою, сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 182,2г проміжної сполуки 10. b) Одержання проміжної сполуки 11 Суміш проміжної сполуки 10 (0,0112моль), фенілборонової кислоти (0,034моль), Pd(PPh3)4 (0,0011мл) та 2Μ розчину Na2CO3 (0,056моль) у DME (50мл) перемішують при температурі 90°С, виливають у Н2О та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (5г) кристалізують з DIPE. Осад відфільтровую!ь та сушать. Вихід: 1г (29%). Цю фракцію очищають за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 90/10, 15-0мкм). Збирають чисті фракції та випарюють. Вихід: 2г проміжної сполуки 11 (58%). с) Одержання проміжної сполуки 12 Суміш проміжної сполуки 11 (0,0088моль) та NBS (0,0098моль) у 1,2-дихлоретані (50мл) перемішують при кип'ятінні зі зворотним холодильником протягом 3 годин, виливають у воду та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 3,6г проміжної сполуки 12. Приклад А6 a) Одержання проміжної сполуки 13 LiOH, H2O (0,0035моль) додають до суміші кінцевої сполуки 146 (одержують відповідно до В1.а) (0,0018мл) у ТГФ (10мл) та Н2О (10мл). Суміш перемішують протягом ночі при температурі 60°С. ТГФ випарюють. Додають 3N розчин НСI. Осад відфільтровують та сушать. Вихід: 1г проміжної сполуки 13 (100%). b) Одержання проміжної сполуки 14 37 Проміжну сполуку 14 одержують аналогічно способу одержання проміжної сполуки 13, проте як вихідну сполуку використовують кінцеву сполуку 131 (одержують відповідно до В2.а). Вихід: проміжна сполука 14 (86%). c) Одержання проміжної сполуки 15 Суміш кінцевої сполуки 145 (одержують відповідно до В2.с) (0,0008моль) та LiOH, Н2О (0,0026моль) у ТГФ (8мл) та Н2О (2мл) перемішують при кімнатній температурі протягом 12 годин, а потім перемішують при температурі 60°С протягом 12 годин та виливають у воду. Додають 5N розчин НСI, поки рН не досягне значення 5. Суміш екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 0,45г проміжної сполуки 15 (97%). d) Одержання проміжної сполуки 16 Суміш кінцевої сполуки 137 (одержують відповідно до В2.b) (0,0069моль) та LiOH, Н2О (0,0143моль) у ТГФ (20мл) та Н2О (20мл) перемішують при кімнатній температурі протягом 12 годин, а потім перемішують при температурі 60°С протягом 24 годин та виливають у воду. ТГФ випарюють. Залишок розчиняють у суміші Н2О/3N НСI. Суміш екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 3г проміжної сполуки 16 (56%). e) Одержання проміжної сполуки 17 94051 38 Суміш кінцевої сполуки 150 (одержують відповідно до Bl.b) (0,0007моль) та LiOH, Н2О (0,0023моль) у ТГФ (10мл) та Н2О (10мл) перемішують при кімнатній температурі протягом 12 годин та виливають у Н2О. Додають 3N розчин НСI. Суміш екстрагують СН2СІ2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 0,3г проміжної сполуки 17. f) Одержання проміжної сполуки 18 Суміш кінцевої сполуки 151 (одержують відповідно до B2.d) (0,0038моль) та LiOH, Н2О (0,0077моль) у Н2О (20мл) та ТГФ (20мл) перемішують при кімнатній температурі протягом 4 днів. Додають Н2О та EtOAc. Додають 3N розчин NaOH. Органічний шар промивають насиченим розчином NaCl, сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 1,6г проміжної сполуки 18 (90%). g) Одержання проміжної сполуки 37 Суміш кінцевої сполуки 130 (одержують відповідно до B2.h) (0,0015моль) та LiOH, Н2О (0,0045моль) у ТГФ (8мл) та Н2О (8мл) перемішують при температурі 65°С протягом 24 годин, а потім охолоджують до кімнатної температури. Додають 3N розчин НСI. Суміш випарюють насухо. Вихід: 0,85г проміжної сполуки 37 (100%). Приклад А7 a) Одержання проміжної сполуки 19 Суміш проміжної сполуки 6 (одержують відповідно до А2.с) (0,0076моль) та CuCN (0,028моль) у ДМФА (25мл) перемішують при кип'ятінні зі зворотним холодильником протягом 16 годин, потім охолоджують до кімнатної температури та виливають у воду з льодом. Осад відфільтровують, розчиняють у суміші Н2О/етилендіамін та екстрагують СН2СІ2. Органічний шар промивають насиченим розчином NaCl, сушать (над MgSO4), відфільтровують та розчинник випарюють. Суміш 39 94051 40 фільтрують через силікагель (елюент: СН2Сl2). Фільтрат випарюють насухо. Вихід: 1,1г проміжної сполуки 19 (53%). b) Одержання проміжної сполуки 20 Суміш проміжної сполуки 19 (0,0066моль), NBS (0,0066моль) та дибензоїлпероксиду (0,0003моль) у 1,2-дихлорметані (30мл) перемішують при температурі 80°С протягом 3 годин, а потім охолоджують до кімнатної температури. Додають H2О та СН2Сl2. Органічний шар промивають H2О, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (3,5г) очищають за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 92/8; 15-40мкм). Збирають чисті фракції та розчинник випарюють. Вихід: 1,9г проміжної сполуки 20 (81%). Приклад А8 a) Одержання проміжної сполуки 21 1,6Μ розчин hBuLi у гексані (0,0103моль) в потоці азоту додають при температурі -70°С до розчину 3-бромпіридину (0,0103моль) у діетиловому ефірі (20мл). Суміші дають нагрітися до -45°С, а потім знову охолоджують до -70°С. Додають розчин 2-феніл-3-хінолінкарбоксальдегіду (0,0008моль) у ТГФ (20мл). Суміш при перемішуванні протягом 2 годин нагрівають від -70°С до кімнатної температури. Додають Н2О. Суміш екстрагують EtOAc. Органічний шар промивають насиченим розчином NaCl, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок розчиняють у діетиловому ефірі. Суміш відфільтровують, промивають діетиловим ефіром та сушать при 50°С у вакуумі. Вихід: 2,1г проміжної сполуки 22 (79%). b) Одержання проміжної сполуки 23 Суміш 2-хінолінкарбоксальдегіду (0,0019моль), гідрохлориду етилового ефіру гліцину (0,002моль) та NaBH3CN (0,0028моль) у СН3ОН (1мл) та СН3СООН (20мл) перемішують при кімнатній температурі протягом 3 годин, виливають у Н2О та 10%-ий K2СО3 та екстрагують сумішшю СН2Сl2/CH3OH. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок очищають за допомогою колоночної хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH 98/2/0,1; 15-40мкм). Збирають дві фракції та розчинник випарюють. Вихід: 1,7г проміжної сполуки 21 (37%). b) Одержання проміжної сполуки 27 Суміш проміжної сполуки 22 (0,0046моль) у РВr3 (3мл) та толуолі (45мл) перемішують при кип'ятінні зі зворотним холодильником протягом 1 години та 30хв., а потім охолоджують до кімнатної температури. Осад відфільтровують, промивають діетиловим ефіром та сушать при 60°С у вакуумі. Вихід: 2,4г проміжної сполуки 23 (>100%) (температура плавлення: 161°С). Приклад Α10 a) Одержання проміжної сполуки 24 Ціаноборгідрид натрію (0,0334моль) додають порціями до суміші 5-хінолінкарбоксальдегіду (0,0223моль), гідрохлориду етилового ефіру гліцину (0,0245моль) в оцтовій кислоті (0,5мл) та метанолі (80мл) при 0°С. Суміш перемішують при кімнатній температурі протягом 4 годин, а потім виливають у 10%-ий розчин K2СО3 та екстрагують СН2Сl2. Органічний шар сушать над сульфатом магнію, відфільтровують та розчинник випарюють. Залишок очищають за допомогою колоночної хроматографії на силікагелі (елюент: CH2Cl2/MeOH/NH4OH 97,5/2,5/0,1). Збирають чисті фракції та розчинник випарюють. Вихід: 2,3г проміжної сполуки 27 (43%). Приклад А9 a) Одержання проміжної сполуки 22 Суміш проміжної сполуки 5 (одержують відповідно до А2.b) (0,009моль) у НСI (6Ν) (50мл) перемішують при кип'ятінні протягом ночі. Осад відфільтровують, промивають Н2О, потім DIPE та сушать. Вихід: 2,8г проміжної сполуки 24. b) Одержання проміжної сполуки 25 41 Суміш проміжної сполуки 24 (0,0089моль), ІСН3 (0,026моль) та ВТЕАС (0,0044моль) у NaOH (40мл) та ТГФ (30мл) перемішують протягом ночі при кімнатній температурі. Суміш екстрагують ЕtOАс. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 1,5г проміжної сполуки 25 (79%). c) Одержання проміжної сполуки 26 Суміш проміжної сполуки 25 (0,0043моль) та NBS (0,0048моль) у 1,2-дихлоретані (25мл) перемішують при кип'ятінні зі зворотним холодильником протягом 3 годин та виливають у Н2О. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 2г проміжної сполуки 26. Приклад А11 a) Одержання проміжної сполуки 28 94051 42 рюють. Вихід: 1,3г проміжної сполуки 29 (100%) (температура плавлення 110°С). Приклад А12 Одержання проміжної сполуки 30 Суміш 3,5-дифторбензиламіну (4,2ммоль), етилхлорацетату (4,2ммоль) та карбонату калію (4,2ммоль) в ацетонітрилі (7мл) перемішують при температурі 80°С протягом 18 годин. Суміш охолоджують, виливають у H2О та екстрагують СН2Сl2. Органічний шар сушать над сульфатом магнію, відфільтровують та розчинник випарюють. Вихід: 0,58г проміжної сполуки 30 (60%). Приклад А13 a) Одержання проміжної сполуки 31 Суміш 4-броманіліну (0,011моль), бензилмалонової кислоти (0,011моль) та оксихлориду фосфору (10мл) нагрівають при температурі 80°С протягом 5 годин, а потім випарюють насухо. Залишок розчиняють у суміші води та СН2Сl2, підлужують, екстрагують СН2Сl2, сушать над сульфатом магнію, відфільтровують та розчинник випарюють. Вихід: 2,48г проміжної сполуки 31 (62%). b) Одержання проміжної сполуки 32 Фенол (0,066моль) додають порціями до суміші 60%-ого NaH (0,069моль) у 1,4-діоксані (200мл) та ДМФА (80мл), а потім додають проміжну сполуку 5 (одержують відповідно до А2.b) (0,033моль), та суспензію нагрівають при кип'ятінні зі зворотним холодильником протягом 20 годин. Суміш охолоджують, виливають у 10%-ий розчин K2СО3 та екстрагують СН2СІ2. Органічний шар сушать над сульфатом магнію, відфільтровують та розчинник випарюють. Залишок очищають за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан/СН2Сl2 70/30). Збирають чисті фракції та розчинник випарюють. Вихід: 7,3г проміжної сполуки 28 (57%) (температура плавлення: 111°С). b) Одержання проміжної сполуки 29 І Суміш проміжної сполуки 28 (0,0026моль), NBS (0,0028моль) та дибензоїлпероксиду (0,00005моль) перемішують при температурі 80°С протягом 3 годин, виливають у Н2О та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випа Суміш проміжної сполуки 31 (0,011моль) та 30%-ого розчину метоксиду натрію (0,011моль) у МеОН кип'ятять зі зворотним холодильником протягом 3 годин, а потім охолоджують до кімнатної температури та виливають у воду з льодом. Осад відфільтровують, сушать та очищають за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан/СН2Сl2 70/30). Чисті фракції збирають та розчинник випарюють. Вихід: 1,6г проміжної сполуки 32 (40%). с) Одержання проміжної сполуки 33 Суміш проміжної сполуки 32 (0,0053моль), NBS (0,0053моль) та дибензоїлпероксиду (0,00002моль) у трифтортолуолі (31мл) перемішують при температурі 80°С протягом 5 годин та 43 охолоджують до кімнатної температури. Додають Н2О та СН2Сl2. Органічний шар промивають водою, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (2,68г) кристалізують з діетилового ефіру. Осад відфільтровують та висушують. Вихід: 2,4г проміжної сполуки 33 (85%) (температура плавлення: 117°С). Приклад А14 а) Одержання проміжної сполуки 35 1,6Μ розчин hBuLi у гексані (0,0257моль) в потоці азоту додають при температурі -70°С до розчину бензофурану (0,0257моль) у ТГФ (30мл). Суміш перемішують при температурі -70°С протягом 3 годин. Додають розчин 2-фенілхінолін-3карбальдегіду (одержують відповідно до методики, приведеної в заявці на патент США 2004009976 (опублікована 2004), зміст якої включений в даний Корисна модель шляхом посилання) (0,0129моль) у ТГФ (30мл). Суміш перемішують при -70°С протягом 3 годин, а потім виливають на лід при -20°С та екстрагують ЕtOАс. Органічний шар промивають насиченим водним розчином NaCl, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок кристалізують з діетилового ефіру. Осад відфільтровують. Вихід: 3,75г проміжної сполуки 35 (83%) (температура плавлення: 184°С). b) Одержання проміжної сполуки 36 РВr3 (0,0006моль) додають по краплях при кімнатній температурі до розчину проміжної сполуки 35 (0,0005моль) у СН2Сl2 (5мл). Суміш перемішують при кімнатній температурі протягом 30хв., а потім випарюють насухо. Вихід: проміжна сполука 36. В. Одержання кінцевих сполук Приклад В1 а) Одержання сполуки 146 94051 44 Суміш проміжної сполуки 3 (одержують відповідно до А1.с) (0,0004моль), етилового ефіру N(фенілметил)гліцину (0,0008моль) та K2СО3, (0,0013моль) у CH3CN (6мл) перемішують при температурі 80°С протягом ночі. Додають Н2О. Суміш екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,3г) очищають за допомогою колоночної хроматографії на кромасилі (елюент. циклогексан/ЕtOАс 90/10; 10мкм). Чисті фракції збирають та розчинник випарюють. Вихід: 0,165г кінцевої сполуки 146 (66%). b) Одержання сполуки 150 Суміш кінцевої сполуки 146 (одержують відповідно до В1.а) (0,0007моль), тетракіс(трифенілфосфін)паладію (0,00007моль) та (CH3)4Sn (0,0014моль) у толуолі (8мл) перемішують при кип'ятінні зі зворотним холодильником протягом 2 годин, виливають у Η2Ο та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок очищають за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 90/10; 15-40мкм). Чисті фракції збирають та розчинник випарюють. Вихід: 0,109г кінцевої сполуки 150 (31%). c) Одержання сполуки 152 Суміш кінцевої сполуки 146 (одержують відповідно до В1.а) (0,53ммоль), Pd(PPh3)4 (0,053ммоль), циклічного ефіру, утвореного піридинбороновою кислотою та 1,3-пропандіолом (0,0016моль), та водною розчину карбонату натрію (2М, 0,0027моль) у диметилгліколі (7мл) перемішують при температурі 90°С протягом 2 годин, а потім виливають у воду та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок очищають за допомогою колоночної хроматографії на силікагелі (елюент: СН2Сl2/МеОН: 95/5). Чисті фракції збирають та розчинник випарюють. Вихід: 62мг кінцевої сполуки 152 (21%). Приклад В2 a) Одержання сполуки 131 45 Суміш проміжної сполуки 7 (одержують відповідно до A2.d) (0,24ммоль), гідрохлориду етилового ефіру саркозину (0,24ммоль) та K2СО3 (0,24ммоль) у CH3CN (5мл) перемішують при температурі 80°С протягом 18 годин. Суміш охолоджують та виливають у воду та екстрагують СН2Сl2. Органічний шар сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок кристалізують з діізопропілового ефіру. Осад відфільтровують та сушать Вихід: кінцева сполука 131 (100%). b) Одержання сполуки 137 Суміш проміжної сполуки 7 (одержують відповідно до A2.d) (0,004моль), етилового ефіру N(фенілметил)гліцину (0,0009моль) та K2СО3, (0,0014моль) у CH3CN (8мл) перемішують при температурі 80°С протягом ночі, виливають у Н2О та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,3г) очищають за допомогою колоночної хроматографії на силікагелі (елюені: циклогексан/ЕtOАс 90/10; 15-40мкм). Чисті фракції збирають та розчинник випарюють. Вихід: 0,054г кінцевої сполуки 137 (21%). c) Одержання сполуки 145 Суміш проміжної сполуки 7 (одержують відповідно до A2.d) (0,0098моль), проміжної сполуки 27 (одержують відповідно до А8.b) (0,0098моль) та K2СO3 (0,0108моль) у CH3CN (80мл) перемішують при температурі 80°С протягом 12 годин. Розчинник випарюють. Суміш екстрагують СН2Сl2/H2О. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (5,4г) очищають за допомогою колоночної хроматографії на силікагелі (градієнтне елюювання: СН2Сl2/СН3ОН від 98/2 до 99/1; 1540мкм). Чисті фракції збирають та розчинник випарюють. Вихід 0,66г кінцевої сполуки 145 (12%) (температура плавлення: 96°С). d) Одержання сполуки 151 94051 46 Суміш проміжної сполуки 20 (одержують відповідно до А7.b) (0,0053моль), етилового ефіру N(фенілметил)гліцину (0,008моль) та K2СО3 (0,008моль) у CH3CN (20мл) перемішують при кип'ятінні зі зворотним холодильником протягом 18 годин, охолоджують до кімнатної температури та виливають у суміш Н2О та ЕtOАс. Органічний шар промивають насиченим розчином NaCl, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (3г) кристалізують з діетилового ефіру. Осад відфільтровують та сушать. Вихід: 1,85г кінцевої сполуки 151 (74%) (температура плавлення: 148°С). e) Одержання сполуки 129 Розчин проміжної сполуки 23 (одержують відповідно до А9.b) (0,0037моль) в етиловому ефірі N-(фенілметил)гліцину (7мл) перемішують при 125°С протягом 6 годин, потім охолоджують до кімнатної температури, виливають у Н2О та екстрагують ЕtOАс. Органічний шар промивають водою, потім насиченим водним розчином NaCl, сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 0,4г. Зазначену фракцію очищають за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 60/40; 1540мкм). Збирають дві фракції та розчинник випарюють. Вихід: 2,65г фракції 1 та 0,35г фракції 2 (19%). Фракцію 1 розчиняють у суміші СН2Сl2/метилізоціанат полістиролу. Суміш перемішують при кімнатній температурі протягом 2 годин та фільтрують. Фільтрат випарюють. Вихід: 0,32г кінцевої сполуки 129 (18%). f) Одержання сполуки 153 Суміш проміжної сполуки 26 (одержують відповідно до А10.с) (0,0012моль), гідрохлориду етилового ефіру N-метилгліцину (0,0019моль) та K2СО3, (0,0024моль) у CH3CN (15мл) перемішують при температурі 80°С протягом 6 годин. Розчинник випарюють насухо. Залишок розчиняють у суміші Н2О та СН2Сl2. Органічний шар відокремлюють, 47 сушать (над MgSO4), відфільтровують та розчинник випарюють. Вихід: 0,46г кінцевої сполуки 153. g) Одержання сполуки 132 Суміш проміжної сполуки 33 (одержують відповідно до А13.с) (0,0027моль), гідрохлориду етилового ефіру N-метилгліцину (0,0027моль) та K2СO3, (0,004моль) у CH3CN (12мл) перемішують при кип'ятінні зі зворотним холодильником протягом 23 годин. Додають гідрохлорид етилового ефіру N-метилгліцину (1 еквівалент), а потім K2СO3 (1 еквівалент). Суміш перемішують при кип'ятінні зі зворотним холодильником протягом 24 годин, потім охолоджують до кімнатної температури та виливають у суміш Н2О та EtOAc. Органічний шар промивають насиченим розчином NaCl, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (1,15г) очищають за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 95/5; 15-40мкм). Збирають необхідні фракції та розчинник випарюють. Вихід: 0,68г кінцевої сполуки 132 (52%). h) Одержання сполуки 130 Суміш проміжної сполуки 36 (одержують відповідно до А14.b) (0,0056моль), етилового ефіру N-(фенілметил)гліцину (0,0171моль) та K2СО3 (0,0171моль) у CH3CN (50мл) перемішують при кип'ятінні зі зворотним холодильником протягом 18 годин, потім виливають у Н2О та екстрагують СН2Сl2. Органічний шар промивають насиченим розчином NaCl, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (5г) очищають за допомогою колоночної хроматографії на силікагелі (елюент: циклогексан/ЕtOАс 90/10). Чисті фракції збирають та розчинник випарюють. Вихід: 0,79г кінцевої сполуки 130 (27%). і) Одержання сполуки 143 94051 48 Кінцеву сполуку 143 одержують аналогічно методиці, наведеній в В2.с, з проміжної сполуки 21. j) Одержання сполуки 148 Кінцеву сполуку 148 одержують аналогічно методиці, наведеній в В2.с, з проміжної сполуки 29. k) Одержання сполуки 141 Кінцеву сполуку 141 одержують аналогічно методиці, наведеній в В2.с, з проміжної сполуки 30. Приклад В3 а) Одержання сполуки 53 Суміш проміжної сполуки 13 (одержують відповідно до А6.а) (0,0003моль), диметиламіну (0,0005моль), EDCI (0,0005моль), НОВТ (0,0005моль) та Et3N (0,0005моль) у СН2Сl2/ТГФ (8мл) перемішують при кімнатній температурі протягом 3 годин, виливають у Н2О та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,2г) кристалізують з DIPE. Осад відфільтровують та сушать. Вихід: 0,053г кінцевої сполуки 53 (температура плавлення: 110°С). b) Одержання сполуки 30 49 Суміш 94051 проміжної сполуки ({бензил-[(6-бром-2 феноксихінолін-3-іл)фенілметил]аміно} оцтової кислоти) (одержують аналогічно методиці, наведеній в А6.с) (0,0002моль), гідрохлориду N-метил2-пропанаміну (0,0003моль), EDCl (0,0004моль) та НОВТ (0,0004моль) у СН2Сl2 (3мл) та ТГФ (3мл) перемішують при кімнатній температурі протягом 12 годин, а потім виливають у Н2О та СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,25г) очищають за допомогою колоночної хроматографії на кромасилі (15мкм). Чисті фракції збирають та розчинник випарюють. Вихід: кінцева сполука 30 (37%). c) Одержання сполуки 3 Суміш проміжної сполуки 14 (одержують відповідно до А6.b) (0,0002моль), гідрохлориду метиламіну (0,0002моль), EDCI (0,0003моль) та НОВТ (0,0003моль) у СН2Сl2 (2мл), ТГФ (2мл) та триетиламіну (0,1мл) перемішують при кімнатній температурі протягом 12 годин, потім виливають у Н2О та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,15г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: від СН2СЬ 100 до СН2Сl2/СН3OН 90/10; 5мкм). Чисті фракції збирають та розчинник випарюють. Вихід: 0,063г кінцевої сполуки 3 (62%) (температура плавлення: 190°С). d) Одержання сполуки 41 Суміш проміжної сполуки 17 (одержують відповідно до А6.е) (0,0008моль), М-метил-2пропанаміну (0,001моль), EDCl (0,0012моль) та НОВТ (0,0012моль) у СН2Сl2 (5мл) та ТГФ (5мл) перемішують при кімнатній температурі протягом 12 годин, а потім виливають у Н2О та СН2Сl2 та перемішують протягом 5хв. Органічний шар відо 50 кремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,42г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2Сl2/СH3ОН 99/1; 5мкм). Збирають дві фракції та розчинник випарюють. Вихід: 0,14г фракції 1 та 0,064г фракції 2. Фракцію 1 кристалізують із суміші DIPE/діетиловий ефір. Осад відфільтровують та сушать. Вихід: 0,138г кінцевої сполуки 41 (31%) (температура плавлення: 126°С). e) Одержання сполуки 45 Суміш проміжної сполуки 17 (одержують відповідно до А6.е) (0,0002моль), диметиламіну (0,0003моль), Et3N (0,0004моль), EDCI (0,0003моль) та НОВТ (0,0003моль) у СН2Сl2 (2мл) та ТГФ (2мл) перемішують при кімнатній температурі протягом 12 годин, а потім виливають у Н2О та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,1г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2Сl2/СН3OН 99/1; 10мкм). Збирають дві фракції та розчинник випарюють. Вихід: 0,056г фракції А та 0,1г фракції В. Фракцію А розчиняють у діетиловому ефірі. Суміш випарюють. Вихід: 0,055г кінцевої сполуки 45 (52%). f) Одержання сполуки 36 Суміш проміжної сполуки 37 (одержують відповідно до A6.g) (0.0004моль), N-метил-2пропанаміну (0,0004моль), EDCl (0,0006моль) та НОВТ (0,0006моль) у СН2Сl2 (5мл) та ТГФ (5мл) перемішують при кімнатній температурі протягом 3 годин. Додають Н2О. Суміш екстрагують СН2Сl2, а потім фільтрують. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,12г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2Сl2/СH3ОН від 100/0 до 98/2; 5мкм). Чисті фракції збирають та розчинник випарюють. Вихід: 0,073г кінцевої сполуки 36 (33%). Приклад В4 a) Одержання сполуки 104 51 Суміш проміжної сполуки 16 (одержують відповідно до A6.d) (0,0006моль), 1-метилпіперазину (0,0009моль), EDCI (0,0009моль) та НОВТ (0,0009моль) у СН2Сl2 (8мл) та ТГФ (8мл) перемішують при кімнатній температурі протягом 1 години, а потім виливають у Н2О та екстрагують СН2СІ2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,4г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2Сl2/СН3OН 95/5; 5мкм). Чисті фракції збирають та розчинник випарюють. Залишок кристалізують із суміші DIPE/діетиловий ефір. Осад відфільтровують та сушать. Вихід: 0,107г кінцевої сполуки 104 (31%) (температура плавлення: 152°С). b) Одержання сполуки 69 Суміш проміжної сполуки 17 (одержують відповідно до А6.е) (0,0002моль), 4метилпіперазинаміну (0,0002моль), EDCI (0,0003моль) та НОВТ (0,0003моль) у СН2Сl2 (3мл) та ТГФ (3мл) перемішують при кімнатній температурі протягом 12 годин, а потім випарюють насухо. Залишок розчиняють у ЕtOН. Осад відфільтровують та сушать. Вихід: 0,3г. Зазначену фракцію очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2Сl2/CH3OH/NH4OH 95/5/0,1; 10мкм). Збирають дві фракції та розчинник випарюють. Вихід: 0,082г фракції А (34%) та 0,03г фракції В. Фракцію А очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2Сl2/CH3OH/NH4OH 98/2/0,2; 3,5мкм). Чисті фракції збирають та розчинник випарюють Вихід: 0,05г кінцевої сполуки 69 (21%). c) Одержання сполуки 72 Суміш проміжної сполуки 17 (одержують відповідно до А6.е) (0,0021моль), N-метилпіперазину (0,0003моль), EDCl (0,0033моль) та НОВТ (0,0033моль) у СН2Сl2 (2мл) та ТГФ (2мл) перемішують при кімнатній температурі протягом 12 го 94051 52 дин, виливають у Н2О та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,1г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2Сl2/СН3ОН/NН4ОН 96/4/0,1; 10мкм). Збирають дві фракції та розчинник випарюють. Вихід: 0,06г фракції А та 0,007г фракції В. Фракцію А розчиняють у діетиловому ефірі. Суміш випарюють. Вихід: 0,056г кінцевої сполуки 72 (48,5%). d) Одержання сполуки 66 ι Суміш проміжної сполуки 17 (одержують відповідно до А6.е) (0,0008моль), піперидину (0,001моль), EDCI (0,0012моль) та НОВТ (0,0012моль) у СН2Сl2 (5мл) та ТГФ (5мл) перемішують при кімнатній температурі протягом 12 годин, виливають у Н2О та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,46г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2Сl2/СН3OН 99/1; 5мкм). Збирають дві фракції та розчинник випарюють. Вихід: 0,094г фракції А та 0,048г фракції В. Фракцію А кристалізують із суміші DIPE/діетиловий ефір. Осад відфільтровують та сушать. Вихід: 0,094г кінцевої сполуки 66 (21%) (температура плавлення: 78°С). e) Одержання сполуки 114 Суміш проміжної сполуки 15 (одержують відповідно до А6.с) (0,0001моль), N-метилпіперазину (0,0002моль), EDCI (0,0002моль) та НОВТ (0,0002моль) у СН2Сl2 (3мл) та ТГФ (3мл) перемішують при кімнатній темпера і урі протягом 12 годин, потім виливають у Н2О/СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,11г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2Сl2/СН3ОН 95/5; 5мкм). Чисті фракції збирають та розчинник випарюють. Залишок сушать з діетиловим ефіром. Вихід: 0,062г кінцевої сполуки 114 (55%). f) Одержання сполуки 122 53 Суміш проміжної сполуки 18 (одержують відповідно до А6.1) (0,0004моль), піролідину (0,0006моль), EDCI (0,0006моль) та НОВТ (0,0006моль) у СН2Сl2 (4мл) та ТГФ (4мл) перемішують при кімнатній температурі протягом 18 годин. Додають Н2О та СН2Сl2. Суміш фільтрують. Фільтрат випарюють. Залишок очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2Сl2/СН3OН 95/5; 10мкм). Чисті фракції збирають та розчинник випарюють. Залишок (0,14г) кристалізують з діетилового ефіру. Осад відфільтровують та сушать при 50°С у вакуумі. Вихід: 0,068г кінцевої сполуки 122 (32%) (температура плавлення: 161°С). g) Одержання сполуки 70 Суміш проміжної сполуки 17 (одержують відповідно до А6.е) (0,0008моль), тіоморфоліну (0,001моль), EDCI (0,0012моль) та НОВТ (0,0012моль) у СН2Сl2 (5мл) та ТГФ (5мл) перемішують при кімнатній температурі протягом 12 годин та виливають у Н2О та СН2Сl2, потім перемішують протягом 5хв. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,48г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2Сl2/СН3ОН 99/1; 5мкм). Чисті фракції збирають та розчинник випарюють. Залишок (0,117г) кристалізують із суміші DIPE/діетиловий ефір. Осад відфільтровують та сушать. Вихід: 0,029г кінцевої сполуки 70 (25%) (температура плавлення: 144°С). Приклад В5 Одержання сполуки 59 Суміш кінцевої сполуки 105 (одержують аналогічно методиці, наведеній в В4.а) (0,0002моль), метилборонової кислоти (0,0005моль), Pd(PPh3)4 (0,00002моль) та 2Μ розчину Na2CO3 (0,0011моль) у DME (2,9мл) перемішують при температурі 90°С протягом 6 годин, а потім охолоджують до кімнатної температури. Додають Н2О. Суміш екстрагують 94051 54 СН2СІ2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчини ик випарюють, одержуючи 0,238 г. Зазначену фракцію очищають за допомогою колоночної хроматографії на силікагелі (елюент: СН2Сl2/СH3ОН 99/1; 10мкм). Збирають дві фракції та розчинник випарюють. Вихід: 0,08г фракції А та 0,06г фракції В. Фракцію В кристалізують з DIPE. Осад відфільтровують та сушать. Вихід: 0,047г кінцевої сполуки 59 (33%) (температура плавлення: 126°С). Приклад В6 Одержання сполуки 154 3-Хлорбензолнадкарбонову кислоту (0,0005моль) додають при 5°С до розчину кінцевої сполуки 105 (одержують аналогічно методиці, наведеній в В4.а) (0,0005моль) у СН2Сl2 (7мл). Суміш перемішують при кімнатній температурі протягом 24 годин, виливають у Н2О та екстрагують СН2Сl2. Органічний шар промивають водою, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,3г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2СІ2/СН3ОН від 100/0 до 98/2; 5мкм) Збирають дві фракції та розчинник випарюють. Вихід: 0,07г фракції А та 0,013г кінцевої сполуки 154 (4%). Приклад В7 Одержання сполуки 29 Суміш проміжної сполуки 8 (одержують відповідно до A3.а) (0,0002моль) у піролідині (0,5мл) перемішують при температурі 140°С протягом 12 годин. Залишок очищають за допомогою колоночної хроматографії на кромасилі (елюент: CH2CI2/CH3OH/NH4OH 98/2/0,1; 10мкм). Збирають чисті фракції та розчинник випарюють. Залишок розчиняють у діетиловому ефірі та сушать. Вихід: 0,08г кінцевої сполуки 29 (58%). Приклад В8 а) Одержання сполуки 51 Суміш проміжної сполуки 3 (одержують відповідно до А1.с) (0,0006моль), N,N-диметил-N' 55 (фенілметил)-1,2-етандіаміну (0,0009моль) та K2CO3 (0,0009моль) у CH3CN (6мл) перемішують протягом ночі при температурі 80°С, потім виливають у Н2О та екстрагують ЕtOАс. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,44г) очищають за допомогою колон очної хроматографії на силікагелі (елюент: CH2CI2/CH3OH/NH4OH 98/2/0,5; 20мкм). Збирають чисті фракції та розчинник випарюють. Вихід: 0,17г кінцевої сполуки 51 (47%). b) Одержання сполуки Суміш проміжної сполуки 7 (одержують відповідно до A2.d) (0,0012моль), N,N-диметил-Nфеніл-1,2-етандіаміну (0,0018моль) та K2СO3 (0,0018моль) у CH3CN (10мл) перемішують протягом ночі при температурі 80°С, потім виливають на лід та екстрагують СН2СІ2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,86г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: CH2CI2/CH3OH/NH4OH 97/3/0,1; 15-40мкм). Збирають дві фракції та розчинник випарюють. Вихід: 0,64г фракції Λ та 0,01г фракції В. Фракцію А кристалізують з DIPE. Осад відфільтровують та сушать. Вихід: 0,03г кінцевої сполуки 18 (температура плавлення: 120°С). Приклад В9 Одержання сполуки 22 DIAD (0,0027моль) при температурі 0°С в потоці азоту додають по краплях до суміші проміжної сполуки 34 (одержують відповідно до А4.b) (0,0014моль), N,N-диметил-N'-(фенiлметил)-1,2етандiаміну (0,0027моль) та PPh3 (0,0027моль) у ТГФ (15мл). Суміш перемішують при кімнатній температурі протягом ночі, виливають у Н2О та екстрагують СН2Сl2. Органічний шар відокремлюють, сушать (над MgSOa), відфільтровують та розчинник випарюють. Залишок (2,6г) очищають за допомогою колоночної хроматографії на силікагелі (елюент: СН2Сl2/СН3ОН/NН4ОН 97/3/0,1; 1540мкм). Чисті фракції збирають та розчинник випарюють. Залишок (0,086г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: СН2Сl2/СН3ОН/NН4ОН 98/2/0,1; 10мкм). Чисті фракції збирають та розчинник випарюють. Вихід: 0,05г кінцевої сполуки 22 (7%). Приклад В10 a) Одержання сполуки 20 94051 56 Суміш проміжної сполуки 7 (одержують відповідно до A2.d) (0,0013моль) та N,N-диметил-N'-(2метоксифеніл)-1,2-етандiаміну (0,0026моль) перемішують при температурі 90°С протягом 2 годин, а потім розчиняють у Н2О та СН2Сl2. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,5г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: CH2Cl2/CH3OH/NH4OH 95/5/0,1; 10мкм). Чисті фракції збирають та розчинник випарюють. Залишок (0,084г) розчиняють у СН3СОСН3 та перетворюють на сіль щавлевої кислоти. Осад відфільтровують та сушать. Вихід: 0,099г кінцевої сполуки 20 (18%) (температура плавлення: 142°С). b) Одержання сполуки 37 Суміш проміжної сполуки 12 (одержують відповідно до А5.с) (0,0013моль) та N,N,N'-триметил1,2-етандiаміну (0,0026моль) перемішують при температурі 90°С протягом 2 годин, а потім розчиняють у НгО та СЬЬСЬ. Органічний шар відокремлюють, сушать (над MgSO4), відфільтровують та розчинник випарюють. Залишок (0,5г) очищають за допомогою колоночної хроматографії на кромасилі (елюент: CH2CI2/CH3OH/NH4OH 95/5/0,1; 10мкм). Чисті фракції збирають та розчинник випарюють. Залишок (0,084г) розчиняють у СН3СОСН3 та перетворюють на сіль щавлевої кислоти. Осад відфільтровують та сушать. Вихід: 0,099г кінцевої сполуки 37 (18%) (температура плавлення: 142°С). Приклад В11 а) Одержання сполуки 83 Суміш проміжної сполуки 14 (одержують відповідно до А6.b) (0,17ммоль), 4-метилпіперидину (0,255ммоль), 1-гідроксибензотриазолу (0,255ммоль) та гідрохлориду 1-(3диметиламінопропіл)-3-етилкарбодііміду (0,03г, 0,255ммоль) у суміші ТГФ/СН2Сl2 (1:1, 4мл) перемішують при кімнатній температурі протягом 12 годин. Суміш виливають у воду та органічний шар 57 відокремлюють. Продукт очищають за допомогою колоночної хроматографії на силікагелі (колонка Kromasil 5мкм 250×20мм, від СН2Сl2:100 до СН2Сl2/МеOН; 90/10). Чисті фракції збирають та розчинник випарюють. Вихід кінцева сполука 83 (58%). b) Одержання сполуки 47 Суміш проміжної сполуки 17 (одержують відповідно до А6.е) (0,15ммоль), діетиламіну (0,225ммоль), 1-гідроксибензотриазолу (0,225ммоль) та гідрохлориду 1-(3диметиламінопропіл)-3-егилкарбодііміду (0,255ммоль) у суміші ТГФ/СН2СІ2 (1:1, 4мл) перемішують при кімнатній температурі протягом 12 годин. Суміш виливають у воду та органічний шар відокремлюють. Продукт очищають за допомогою колоночної хроматографії на силікагелі (колонка Kromasil 5мкм, 250×20мм, від СН2Сl2:100 до СН2Сl2/МеOН; 95/5). Чисті фракції збирають та 94051 58 розчинник випарюють. Вихід, кінцева сполука 47 (44%). c) Одержання сполуки 2 Суміш проміжної сполуки 7 (одержують відповідно до A2.d) (0,25ммоль), N,N-дiетил-Nметилетилендiаміну (0,25ммоль) та карбонату калію (0,25ммоль) в ацетонітрилі (5мл) перемішують при температурі 80°С протягом 18 годин. Суміш виливають у воду та органічний шар відокремлюють. Продукт очищають за допомогою колоночної хроматографії на силікагелі (колонка Kromasil 5мкм, 250×20мм, від СН2Сl2:100 до СН2Сl2/МеOН; 95/5). Чисті фракції збирають та розчинник випарюють. Вихід: кінцева сполука 2 (69%). У таблицях 1-6 наведені сполуки, які одержують аналогічно методикам, наведеним вище в прикладах (приклад №). 59 94051 60
ДивитисяДодаткова інформація
Назва патенту англійськоюAntibacterial quinoline derivatives
Автори англійськоюGuillemont Jerome Emile George, Lancois David Francis Alain, Pasquier Elisabeth Therese Jea, Andries Koenraad Jozef Lodewij, Koul Anil
Назва патенту російськоюАнтибактериальные производные хинолина
Автори російськоюЖильмон Жером Эмиль Жорж, Ланкуа Давид Френсис Ален, Паскье Элизабет Тереза Жанна, Андриес Конраад Йозеф Лодевийк Марсель, Кул Анил
МПК / Мітки
МПК: C07D 405/12, C07D 401/06, C07D 215/12, C07D 401/12, C07D 401/14, A61P 31/00, C07D 413/06, C07D 417/06, C07D 405/06, C07D 215/48, A61K 31/47, C07D 215/227, C07D 401/04
Мітки: антибактеріальні, хіноліну, похідні
Код посилання
<a href="https://ua.patents.su/43-94051-antibakterialni-pokhidni-khinolinu.html" target="_blank" rel="follow" title="База патентів України">Антибактеріальні похідні хіноліну</a>
Попередній патент: Вибір обслуговуючої базової станції в системі безпровідного зв’язку
Наступний патент: Похідні піридазину
Випадковий патент: Пристрій і спосіб дозування дріжджової суспензії