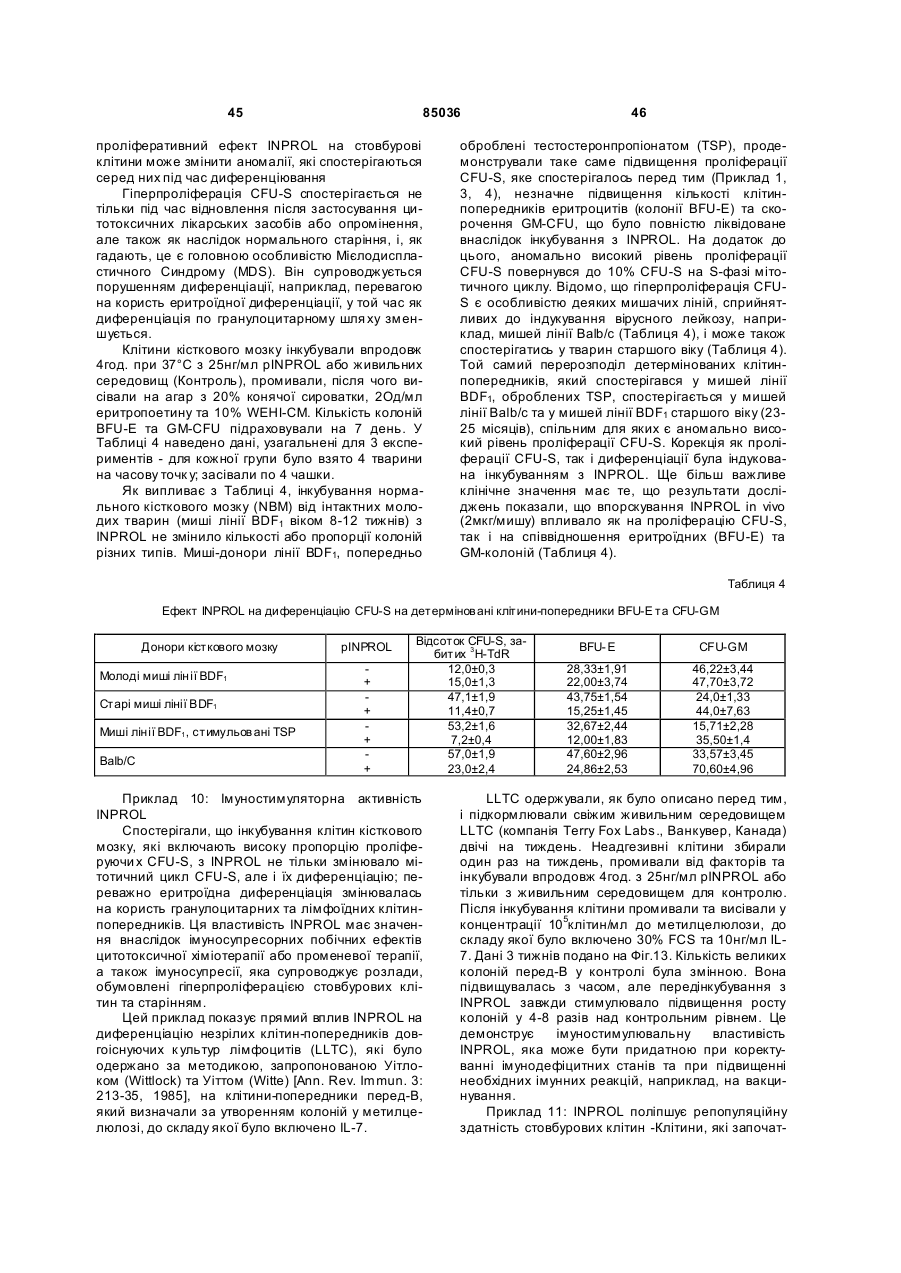
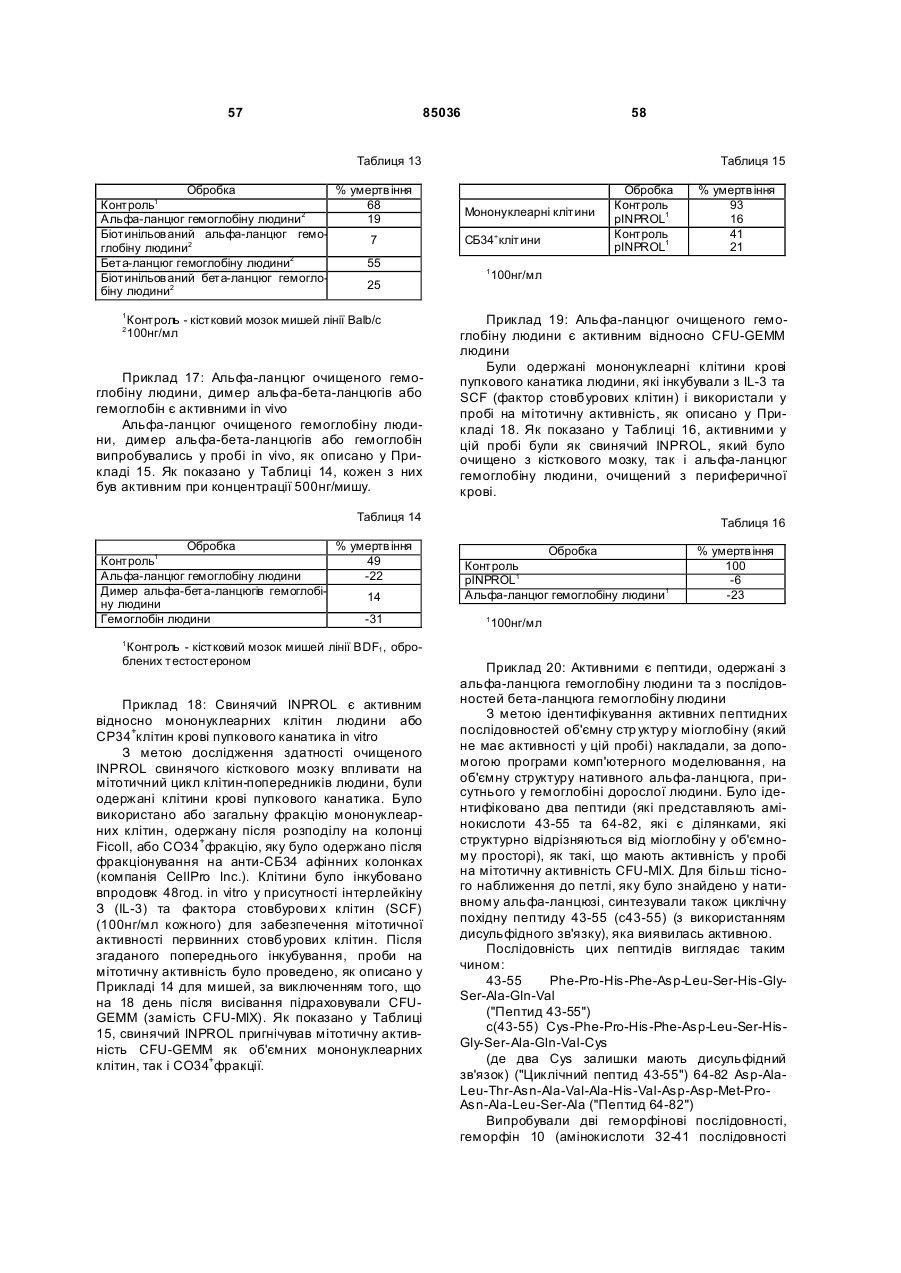
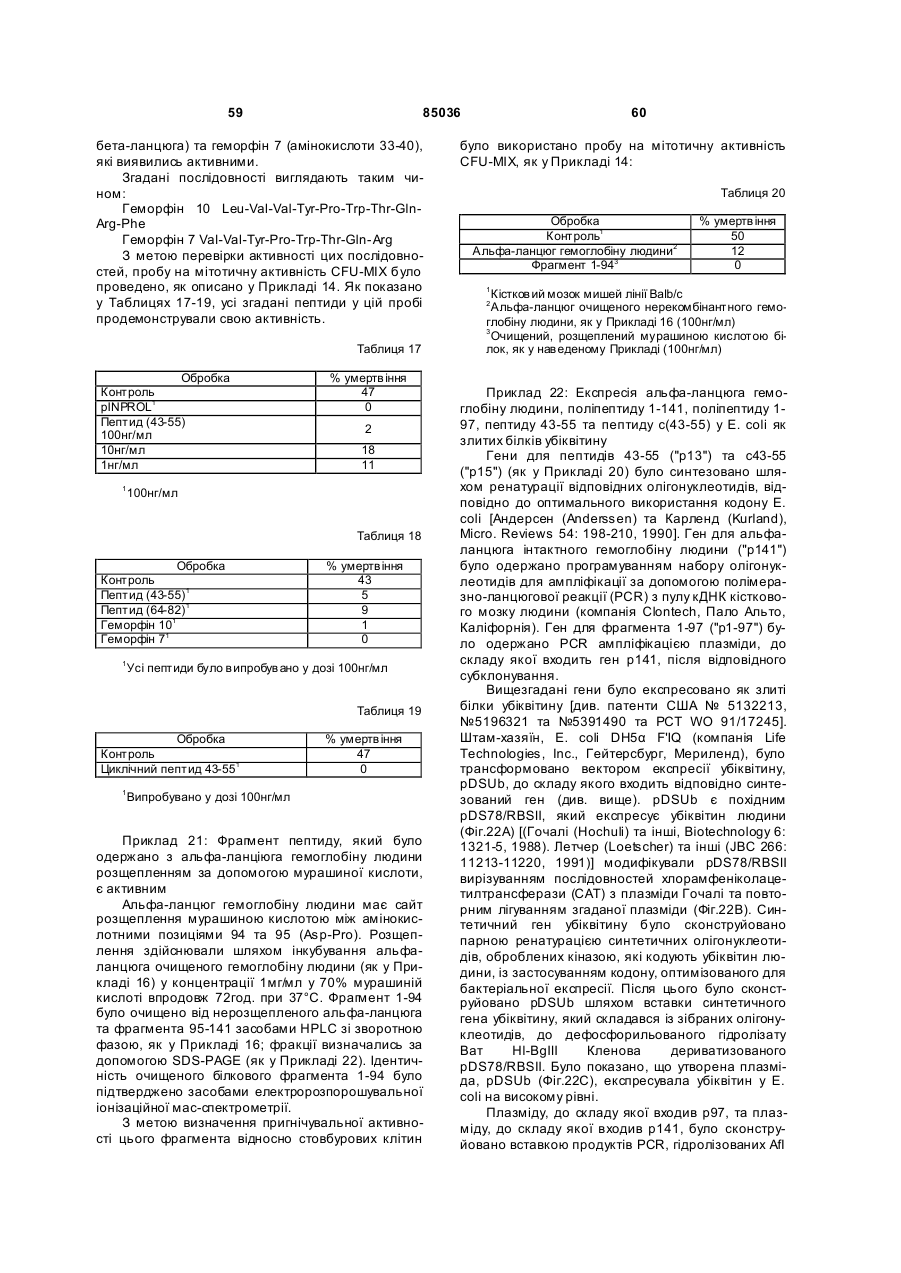
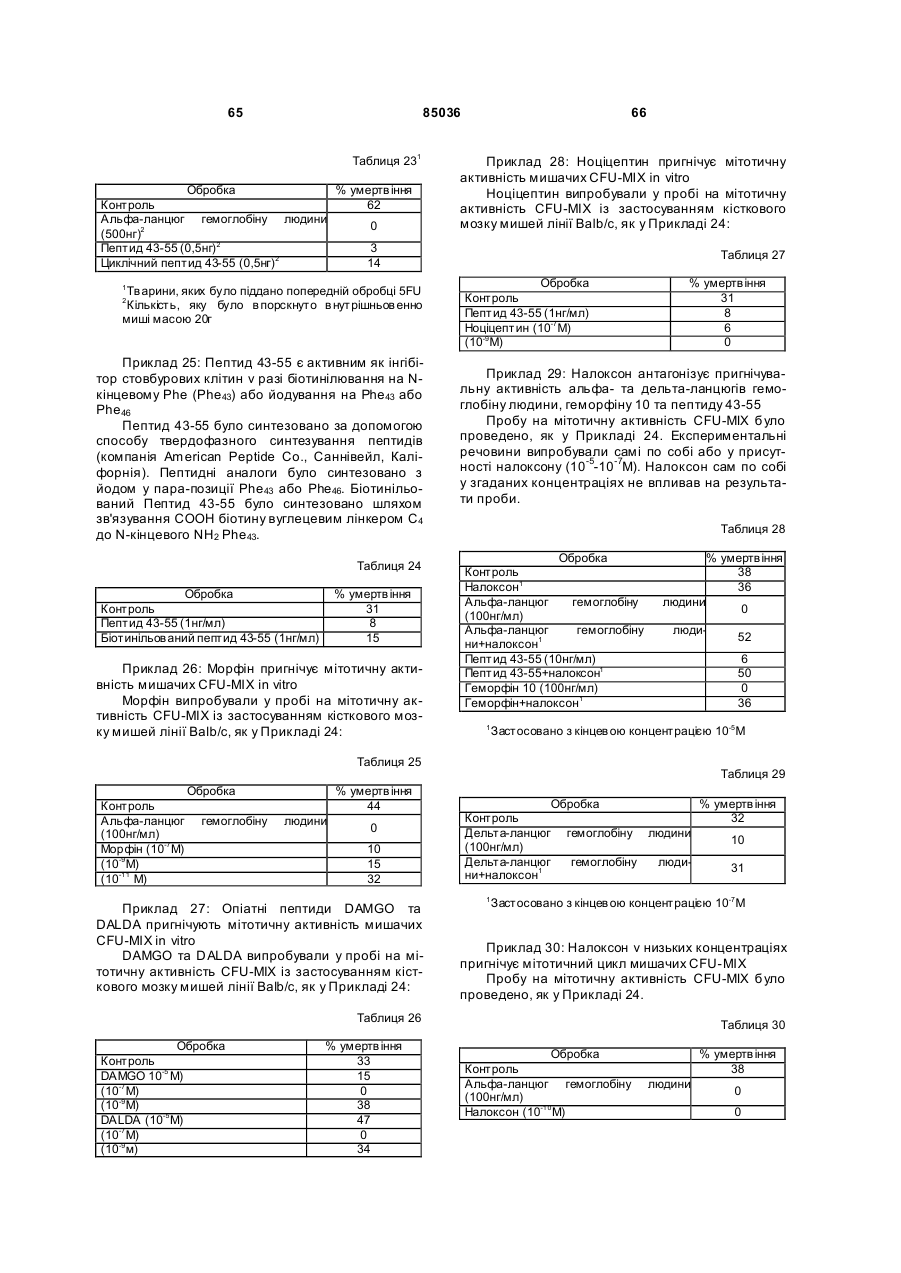
Інгібітор та стимулятор проліферації стовбурових клітин та їх застосування
Формула / Реферат
Пептид, який має послідовність, вибрану з групи, до складу якої входять біотин-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val, (йодо)Рhе-Рrо-Нis-Рhе-Аsр-Leu-Ser-Нis-Gly-Ser-Аlа-Gln-Val, Phe-Pro-His-(йодо)Рhе-Аsр-Leu-Ser-Нis-Gly-Ser-Аlа-Gln-Val та (йодо)Рhе-Рrо-Нis-(йодо)Рhе-Аsр-Leu-Ser-Нis-Gly-Ser-Аl-Gln-Val.
Текст
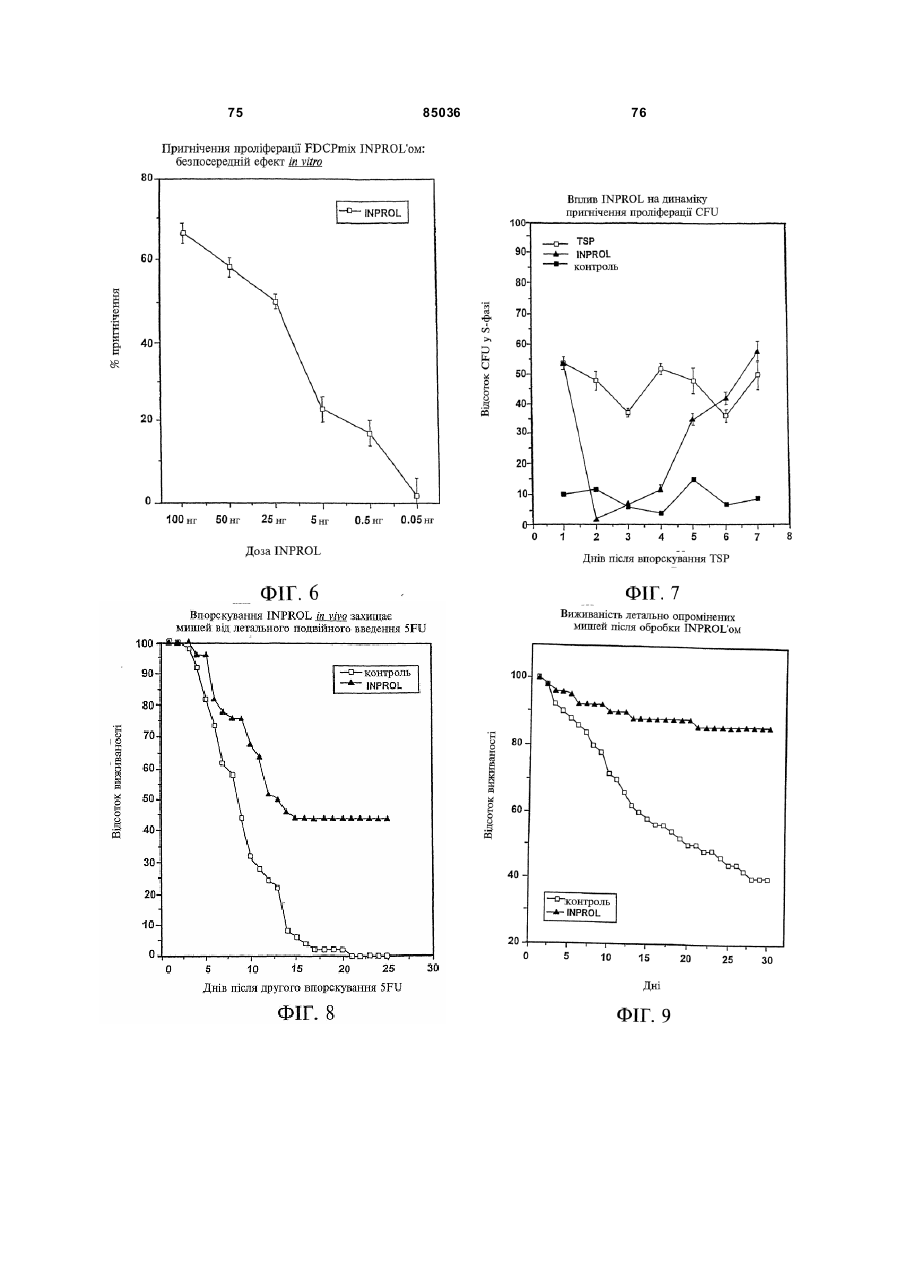
Пептид, який має послідовність, вибрану з групи, до складу якої входять біотин-Phe-Pro-HisPhe-Asp-Leu-Ser-His-Gly-Ser-Ala-Gln-Val, (йодо)Рhе-Рrо-Нis-Рhе-Аsр-Leu-Ser-Нis-Gly-Ser-АlаGln-Val, Phe-Pro-His-(йодо)Рhе-Аsр-Leu-Ser-НisGly-Ser-Аlа-Gln-Val та (йодо)Рhе-Рrо-Нis(йодо)Рhе-Аsр-Leu-Ser-Нis-Gly-Ser-Аl-Gln-Val. (19) UA (11) (21) 20040402942 (22) 06.04.2004 (24) 25.12.2008 (31) 08/627,173 (32) 03.04.1996 (33) US (46) 25.12.2008, Бюл.№ 24, 2008 р. (72) УОЛП СТІВЕН Д., ЦИРЛОВА ІРЕН (73) УЕЛЛСТАТ ТЕРЕПЬЮТІКС КОРПОРЕЙШН (56) WO9325071 A1, 23.12.93. C2 2 85036 1 3 85036 популяції поліпотентних гемопоетичних стовбурових клітин (HSC). Гемопоетичні стовбурові клітини є субпопуляцією гемопоетичних клітин. Гемопоетичні клітини можна одержати, наприклад, з кісткового мозку, крові пупкового канатика або периферичної крові (немобілізованої або мобілізованої за допомогою такого агента, як G-CSF (гранулоцитарний колонієстимулювальний фактор); до гемопоетичних клітин належить популяція стовбурових клітин, клітини-попередники, диференційовані клітини, Α-клітини, стромальні клітини та інші клітини, які вносять свій вклад до середовища, яке є необхідним для продукування зрілих клітин крові. Гемопоетичні клітини-попередники являють собою субпопуляцію стовбурових клітин, які є більш обмеженими щодо своєї здатності до розвитку. Клітини-попередники є здатними до диференціювання тільки за одним або двома напрямками (наприклад, BFU-E (еритроїдна бурсттвірна одиниця) та CFU-E (колонієтвірна одиниця еритроцитів), які забезпечують утворення лише еритроцитів або CFU-GM (гранулоцитарна-макрофагальна колонієтвірна одиниця), які забезпечують утворення гранулоцитів та макрофагів), у той час як стовбурові клітини (наприклад, CFU-MIX (колонієтвірна одиниця змішаної культури клітин) та CFU-GEMM (колонієтвірна одиниця гранулоцитів-еритроцитівмакрофагів-мегакаріоцитів) можуть утворювати численні напрямки диференціювання та/або інші стовбурові клітини. Оскільки гемопоетичні стовбурові клітини є необхідними для розвитку усіх зрілих клітин гемопоетичної та імунної систем, їх виживаність є суттєвою для повторного відтворення повністю функціональної системи захисту хазяїна у суб'єктів, яких було піддано лікуванню хіміотерапевтичними або іншими засобами. Продукування гемопоетичних клітин регулюється цілою низкою факторів, які стимулюють ріст та диференціювання гемопоетичних клітин, причому деякі з них, наприклад, еритропоетин, GMCSF (гранулоцитарно-макрофагальний колонієстимулювальний фактор) та G-CSF, застосовуються зараз у клінічній практиці. Однією частиною контрольної сітки, яку не було піддано екстенсивному характеризуванню, однак, є фізіологічний механізм, який контролює статус мітотичної активності стовбурових клітин [Івз (Ea ves) та інші, Blood 78: 110-117, 1991; Лорд (Lord) у Stem Cells (видавець К.С. Поттен (CS. Potten), стор.401-22, 1997 (видавництво Academic Press, Нью-Йорк)]. У попередніх дослідженнях Лорд та співробітники продемонстрували існування розчинних білкових факторів у нормальних та регенерованих екстрактах кісткового мозку, які можуть пригнічувати або стимулювати проліферацію стовбурових клітин [див. огляд у: Лорд та Райт (Wright), Blood Cells 6: 581-593, 1980; Райт та Лорімор (Lorimore), Cell Tissue Kinet. 20: 191-203, 1987; Маршалл (Marshall) та Лорд, Int. Rev. C yt. 167: 185-261, 1996]. Ці активні продукти було позначено, як інгібітор стовбурових клітин (SCI) та стимулятор стовбурови х клітин (SCS), відповідно. До сього часу з екстрактів кісткового мозку, одержаних, як описано Лордом та іншими (оглядові статті, посилання на які зроблено перед тим), не 4 було очи щено молекул, які відповідали б характеристикам SCS. Очищення SCS або SCI з первинних джерел не було здійснено внаслідок труднощів, пов'язаних з проведенням випробувань in vi vo, які потребують великої кількості опромінених мишей. У намаганні перебороти згадані проблеми, Прагнелл (Pragnell) та співробітники розробили пробу in vivo для визначення первинних гемопоетичних клітин (CFU-A (колонієтвірна одиниця стовбурових клітин крові)) та відібрали лінії клітин, як джерело пригнічувальної активності [див., Грехем (Graham) та інші, Nature 344: 442-444, 1990]. У попередніх дослідженнях макрофаги було ідентифіковано, як можливі джерела SCI [Лорд та інші, Blood Cells 6: 581-593, 1980], та відібрано лінію клітин макрофагів мишей J774.2 [Грехем та інші, Nature 344: 442-444, 1990]. Кондиціоноване середовище з цієї лінії клітин було використано Грехемом та іншими для очищення; було виділено пептид-інгібітор, який виявився ідентичним до попередньо описаного цитокіну - макрофагального медіатора алергічного запалення 1-альфа (MIP1α). Було клоновано рецептори для MIP-1α; подібно іншим хемокінетичним рецепторам, згадані рецептори MIP-1α є рецепторами сьомого трансмембранного домену (або "G-пов'язаними" рецепторами), з'єднаними з білками, які зв'язують гуаніновий нуклеотид (GTP), G пригніч увальног о підкласу ("Gі") [огляд наведено у Мурфі (Murphy), C ytokine & Growth Factor Rev., 7: 47-64, 1996]. Позначення "пригнічувальний" відносно підкласу Gi вказує на його пригнічувальний вплив на аденілатциклазу. МІР-1α було виділено з лінії клітин, а не з первинного матеріалу. У той час як Грехем та інші спостерігали, що антитіла до MIP-1α анулювали активність неочищеного екстракту кісткового мозку, інші дослідники продемонстрували важливість інших пригнічувальних активних продуктів. Наприклад, Грехем та інші [J. Exp. Med., 178: 925-32, 1993] висловили припущення щодо того, що головним інгібітором гемопоетичних стовбурови х клітин є TGFβ (трансформувальний фактор росту), а не MIP-1α. Додатково, Івз та інші (PNAS, 90:1201519, 1993) висловили припущення щодо того, що як MIP-1α, так і TGFβ, є присутніми у нормальному кістковому мозку на субоптимальних рівнях і що пригнічення вимагає синергізму між двома згаданими факторами. Нещодавно були одержані миші, ген MIP-1α у яких було видалено шляхом гомологічної рекомбінації [Кук (Cook) та інші, Science 269: 1583-5, 1995]. У таких мишей не спостерігається явного розладу гемопоетичної системи, що ставило б під сумнів роль MIP-1α, як фізіологічного регулятора мітотичної активності стовбурови х клітин за нормальних гомеостатичних умов. Подібним же чином, незважаючи на те, що трансформувальний фактор росту бета ( TGFβ) також має пригнічувальний вплив на стовбурові клітини, тривалий період часу, якого потребують стовбурові клітини для відповіді на цей цитокін, дозволяє припустити, що він не є ендогенним фактором, присутнім у екстрактах кісткового мозку; додатково, нейтралізуючі антитіла до TGFβ не ліквідують активності SCI у 5 85036 супернатантах кісткового мозку [Гемпсон (Hampson) та інші, Exp. Hemat. 19: 245-249, 1991]. Інші дослідники описують додаткові інгібуючі фактори стовбурових клітин. Фріндел (Frindel) та співробітники виділили тетрапептид з кісткового мозку зародка великої рогатої худоби та з екстрактів печінки, який має інгібіторну активність відносно стовбурови х клітин [Ленфант (Lenfant) та інші, PNAS, 86: 779-782, 1989]. Пауковіц (Paukovits) та інші [Cancer Res. 50: 328-332, 1990] визначили характеристики пентапептиду, який, у своїй мономерній формі, є інгібітором, а у своїй димерній формі - стимулятором мітотичної активності стовбурових клітин. Інші фактори також було заявлено, як інгібітори у різних системах in vitro [див., Райт та Прагаелл у Bailliere's Clinical Haematology. том 5, стор.723-39, 1992 (Bailliere Tinadall, Париж); Маршалл та Лорд, Int. Rev. C yt. 167: 185-261, 1996]. Цирлова (Tsyrlova) та інші, авторське свідоцтво CPCP №1561261, розкриває процес очищення інгібітора проліферації стовбурових клітин. [У міжнародних заявках WO 94/22915 та WO 96/10634] розкривається інгібітор проліферації стовбурови х клітин, і, завдяки цьому, їх у повному обсязі включено до цього опису посиланням. До цього часу жоден з цих факторів не було схвалено до клінічного використання. Існує, однак, необхідність у ефективних інгібіторах стовбурових клітин. Головним токсичним ефектом, пов'язаним з хіміотерапією або променевою терапією, є знищення нормально проліферуючих клітин, наслідком чого може бути супресія кісткового мозку або токсичний вплив на шлунково-кишковий тракт. Ефективний інгібітор стовбурових клітин забезпечить захист цих клітин та дозволить оптимізувати згадані схеми лікування. Подібно тому, як існує підтверджена потреба у різноманітних стимулювальних цитокінах (наприклад, таких цитокінах, як ІL(інтерлейкін)-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-11, IL-13, IL-14, IL-15, G-CSF, GM-CSF, еритропоетин, тромбопоетин, фактор стовбурових клітин, ліганд flk2/flt3 і т.п., які стимулюють мітотичну активність гемопоетичних клітин) у залежності від клінічної ситуації, також, можливо, з'явиться необхідність і у різноманітних інгібуючих факторах для задоволення різних клінічних потреб. Додатково, існує необхідність у швидкому обертанні (реверсуванні) напрямку активності такого інгібітора. Попередні дослідження Лорда та інших (оглядові роботи, посилання на які було зроблено перед тим) продемонстрували, що інгібіторна активність може бути реверсована шляхом додання стимулювального активного продукту. Незважаючи на те, що було ідентифіковано різноманітні стимулювальні цитокіни стовбурових клітин (див. перед тим), жоден з них не був продемонстрований, як такий активний продукт, опис якого наведено Лордом та співробітниками, що є присутнім у екстрактах кісткового мозку або здатним до реверсування активності інгібітора. Гемопоетичні клітини-попередники та стовбурові клітини у нормальних дорослих людей знаходяться, головним чином, у кістковому мозку. За певних умов, наприклад, під час хіміотерапії або лікування цитокінами, наприклад, G-CSF, значна 6 кількість згаданих клітин-попередників та стовбурових клітин виходить до периферичної крові. Цей процес називають "мобілізацією" [огляд у Сіммонс (Simmons) та інші, Stem Cells 12 (додаток 1): 187202, 1994; Шединг (Scheding) та інші, Stem Cells 12 (додаток 1):203-11, 1994; Манген (Mangan), Sem. Oncology, 22: 202-9, 1995; Мултен (Moolten), Sem. Oncology, 22: 271-90, 1995]. Нещодавно опубліковані дані дозволяють зробити припущення, що переважна більшість мобілізованих клітинпопередників не відіграє активної ролі у мітотичному циклі [Роберте (Roberts) та Меткалф (Metcalf), Blood, 86: 1600-, 1995; Донахью (Donahue) та інші, Blood, 87: 1644-, 1996; Зігерт (Siegert) та Серке (Serke), Bone Marrow Trans., 17: 467-, 1996; Учіда (Uchida) та інші, Blood 89: 465-72, 1997]. Гемоглобін є висококонсервативним тетрамерним білком, молекулярна маса якого дорівнює приблизно 64000 Да. Він складається з двох альфа- та дво х бета-ланцюгів. Кожен зі згаданих ланцюгів зв'язує одну молекулу гему (феропротопорфірину IX) залізовмісної простетичної групи. Альфа- та бета-ланцюги хребетних, можливо, були утворені з одного предкового гена, який подвоївся з подальшою дивергенцією; два ланцюги зберігають значний рівень ідентичності послідовностей як між собою, так і між різними хребетними (див. Фіг.16A). У людини, альфаланцюговий кластер на хромосомі 16 вміщує два альфа-гени (альфа 1 та альфа 2), які кодують ідентичні поліпептиди, а також гени, які кодують інші альфаподібні ланцюги: дзета, тета та декілька нетранскрибованих псевдогенів (див. Фіг.16В: кДНК та амінокислотні послідовності альфаланцюга людини). Бета-ланцюговий кластер на хромосомі 11 складається з одного беталанцюгового гена та декількох бетаподібних генів: дельта, епсилон, G-гамма та Α-гамма, а також, щонайменше, двох неекспресованих псевдогенів (див. Фіг.16С: кДНК та амінокислотні послідовності бета ланцюга людини). Експресія цих генів змінюється впродовж розвитку. Під час гемопоезу у людини, який було екстенсивно охарактеризовано, еритробласти зародка успішно синтезують тетрамери двох дзеталанцюгів та двох епсилон-ланцюгів (Gower I), двох альфа-ланцюгів та двох епсилон-ланцюгів (Gower II) або дво х дзета-ланцюгів та дво х гаммаланцюгів (Hb Portland). Впродовж ембріогенезу переважаюча форма являє собою зародковий гемоглобін (Hb F), до складу якого входить два альфа-ланцюги та два гамма-ланцюги. Гемоглобін дорослої людини (два альфа- та два беталанцюги) починає синтезуватись впродовж зародкового періоду; під час народження 50% гемоглобіну знаходиться у дорослій формі і перехід завершується приблизно на 6 місяці життя. Переважаюча більшість гемоглобіну (приблизно 97%) у дорослої людини належить до різновиду з двома альфа- та двома бета-ланцюгами (Hb А) з існуванням незначних кількостей Hb F або дельталанцюга (Hb A2). Для експресування рекомбінантних гемоглобінових ланцюгів у E. соlі та дріжджей використову 7 85036 ють декілька методів [наприклад, Джессен (Jessen) та інші, Methods Enz., 231: 347-364, 1994; Лукер (Looker) та інші, Methods Enz., 231: 364-374, 1994; Огден (Ogden) та інші, Methods Enz., 231: 374-390, 1994; Мартін де Льяно (Martin de Llano) та інші, Methods Enz., 231: 364-374, 1994]. Поки що виділений альфа-ланцюг людини експресувати рекомбінантними методами у значних кількостях неможливо [наприклад, Гофман (Hoffman) та інші, PNAS 87: 8521-25, 1990; Ернан (Hernan) та інші, Biochem. 31: 8619-28, 1992]. Очевидно, виділений альфа-ланцюг не набуває стійкої конформації і швидко деградує у E. соlі. Наслідком коекспресії бета-ланцюга з альфа-ланцюгом є підвищена експресія обох (Гофман та інші, та Ернан та інші, цитовані роботи). Незважаючи на те, що альфаланцюг було експресовано, як злитий білок із частиною бета-ланцюга та сайтом розпізнавання фактора Xa [Нагаї (Nagai) та Торгерсен (Thorgersen), Methods Enz., 231: 347-364, 1994], за цих умов він експресується, як нерозчинне тіло включення. До складу як бета-ланцюга, так і альфаланцюга входять сайти зв'язування гаптоглобіну. Гаптоглобін є білком сироватки з надзвичайно високою спорідненістю до гемоглобіну [наприклад, Патнем (Putnam) у The Plasma Proteins-Structure. Function and Genetic Control (видавець Патнем Ф.В. (Putnam F.W.)), том 2, стор.1-49 (видавництво Academic Press, Нью-Йорк)); Хванг (Hwang) та Грір (Greer), JBC, 255: 3038-3041, 1980]. Транспортування гаптоглобіну до печінки є головним катаболічним шляхом циркулювання гемоглобіну. Для гаптоглобіну існує один зв'язувальний сайт на альфа-ланцюзі (амінокислоти 121-127) та два на бета-ланцюзі (ділянки амінокислот 11-25 та 131146) [Казім (Kazim) та Атассі (Atassi), Biochem. J. 197: 507-510, 1981; Маккормік (McCormick) та Атассі, J. Prot. Chem. 9: 735-742, 1990]. Біологічно активні пептиди з опіатною активністю було одержано шляхом протеолітичного розщеплення гемоглобіну [огляд у Карелін (Karelin) та інші, Peptides, 16: 693-697, 1995]. Альфа-ланцюг гемоглобіну має кислотолабільний сайт розщеплення між амінокислотами 94-95 [Шефер (Shaeffer), J. Biol. Chem. 269: 29530-29536, 1994]. Kperaep (Kregler) та інші [Exp. Hemat. 9: 11-21, 1981] встановили, що гемоглобін має підсилювальний вплив на колонії клітин-попередників кісткового мозку мишей (CFU-C). Такі проби демонструють вплив на популяції клітин-попередників CFUGM та CFU-M (макрофагальна колонієтвірна одиниця), у протилежність до таких стовбурови х клітин, як CFU-MIX. Згадані автори спостерігали активність на обох виділених альфа- та беталанцюгах гемоглобіну. Цю активність було ліквідовано шляхом обробки N-етилмалеімідом, що дало змогу Креглеру та іншим припустити необхідність сульфгідрильних гр уп. Це спостереження, разом з фактом того, що стимуляторна активність була стійкою до розщеплення трипсином, дозволили Креглеру та іншим зробити припущення про те, що за згадану активність відповідає С-кінцевий гідрофобний домен або "центральна" ділянка. Мокатташ (Moqattash) та інші [Acta. Haematol. 92: 182186, 1994] встановили, що рекомбінантний гемо 8 глобін має стимуляторний вплив на кількість клітин-попередників CFU-E, BFU-E та CFU-GM, що співпадало зі спостереженнями відносно геміну. Меллер (Mueller) та інші [Blood 86: 1974, 1995] встановили, що очищений гемоглобін дорослої людини стимулює клітини-попередники еритроцитів таким же самим чином, що і клітинипопередники геміну. Петров (Petrov) та інші [Bioscience Reports 15: 1-14, 1995] розкрив застосування "неідентифікованої мієлопептидної суміші" при лікуванні гемолітичної анемії у мишей лінії Wv/W v. Згадана суміш підвищувала численність колоній селезінки, зокрема, колоній еритроїдного типу. Гем та гемін було піддано екстенсивному дослідженню відносно їх впливу на гемопоез [див. оглядові роботи C. Caeca (S. Sassa) Seminars Hemat. 25: 312-20, 1980 та H. Абрахама (N. Abraham) та інших, Int. J. Cell Cloning, 9: 185-210, 1991]. Гем є необхідним для визрівання еритробластів; гемін (хлорферопротопорфірин IX, тобто гем з додатковим іоном хлориду) in vitro підвищує проліферацію CFU-GEMM, BFU-E та CFU-E. Подібним же чином, гемін підвищує об'єм клітинного вмісту у к ультура х декстерівського типу. "Опіати" є речовинами з аналгетичними властивостями, подібними морфіну, головній активній речовині опію. Опіати можуть бути невеликими органічними молекулами, такими як морфін, інші алкалоїди або синтетичні сполуки, або ендогенними пептидами, наприклад, енкефалінами, ендорфінами, динорфінами та їх синтетичними похідними. Ендогенні опіатні пептиди продукуються in vi vo з більших попередників передпроенкефаліну А у разі Met- та Leu-енкефалінів, перед-проопіомеланокортину у разі α, β та γ ендорфінів, та перед-продінорфіну у разі динорфінів А та В, α-неоендорфіну та β-неоендорфіну. На додаток до цього, пептиди з опіатною активністю можуть бути одержаними з некласичних джерел, наприклад, внаслідок протеолізу або гідролізу білків, наприклад, α або β казеїну, пшеничної клейковини, лактальбуміну, цитохромів або гемоглобіну, або з інших видів, наприклад, жаб'ячої шкіри (дерморфіни) або мозкової речовини надниркових залоз великої рогатої худоби. Такі пептиди називають "екзорфінами", у протилежність до класичних ендорфінів; їх також називають атиповими ошатними пептидами [Зудр у (Zioudrou) та інші, JBC 254: 2446-9, 1979; Кіріон (Quirion) та Вайсс (Weiss), Peptides 4:445, 1983; Лукас (Loukas) та інші, Biochem. 22: 4567, 1983; Брантл (Brantl), Eur. J. Pharm. 106: 213-14, 1984; Брантл та інші, Eur. J. Pharm. 111: 293-4, 1985; Брантл та інші, Eur. J. Pharm. 125: 309-10, 1986; Брантл та Нубер (Neubert), TIPS 7: 6-7, 1986; Гламста (Glamsta) та інші, BBRC 184: 1060-6, 1992; Тешмахер (Teschemacher), Handbook Exp. Pharm. 104: 49928, 1993; Петров та інші, Bioscience Reports 15: 114, 1995; Карелін та інші, Peptides 16: 693-7, 1995]. Крім того, було також показано, що інші ендогенні пептиди, наприклад, сімейства Tyr-MIF (фактор гальмування міграції)-1, також мають ошатну активність [Рід (Reed) та інші, Neurosci. та Biobehav. Rev. 18: 519-25, 1994]. 9 85036 Опіати здійснюють свій вплив шляхом зв'язування ендогенних опіатних рецепторів трьох головних фармакологічних класів - мю, дельта та каппа. Рецептори, які представляють кожний фармакологічний клас, було клоновано і показано, що це є G-зв'язані рецептори, які відносяться до Gi [огляд у: Різін (Reisine) та Белл (Bell), TINS 16: 506-510, 1993; Уль (UhI) та інші, TINS 17: 89-93, 1994; Кнапп (Кпарр) та інші, FASEB J. 9: 516-525, 1995; Сато (Satoh) та Мінамі (Minami), Pharm. Ther. 68: 343-64, 1995; Кіфер (Kieffer), Cell. Моl. Neurobiol. 15: 615-635, 1995; Різін, Neuropharm. 34: 463-472, 1995; Закі (Zaki) та інші, Ann. Rev. Pharm. Toxicol, 36: 379-401, 1996]. Специфічні агоністи та антагоністи є доступними для рецептора кожного типу, наприклад, для мю рецепторів (які вибірково активізуються DAMGO та D ALDA і вибірково антагонізуються CTOP та налоксоназіном), для каппа рецепторів (які вибірково активізуються фумаратом GR 89696 та U-69593 і вибірково антагонізуються norбіналторфіміну гідрохлоридом) та для дельта рецепторів (які вибірково активізуються DADLE та DPDPE і вибірково антагонізуються натріндолом). На додаток до цього, існують антагоністи широкого спектру дії (наприклад, налоксон) та агоністи (наприклад, еторфін), які діють на рецептори усіх трьох підтипів. Як класичні, так і атипові опіатні пептиди можуть піддаватись хімічним змінам або дериватизуватись для зміни їх специфічних властивостей зв'язування опіатних рецепторів [огляд у: Грабі (Нrubу) та Геріг (Gehrig), Med. Res. Rev. 9: 343-401, 1989; Шіллер (Schiller), Prog. Med. Chem. 28: 30140, 1991; Тешмахер, Handbook Exp. Pharm. 104: 499-28, 1993; Handbook of Experimental Pharmacoloogy, А. Герц (A. Hertz) (видавець), томи 104/l та 104/ll, 1993, видавництво Springer Verlag, Берлін; Карелія та інші, Peptides, 16: 693-7, 1995]. До прикладів належать похідні дерморфіну (наприклад, DALDA) та енкефалінів (наприклад, DADLE, D AMGO або DAMME). Пептиди, які за нормальних умов не зв'язуються з ошатними рецепторами, наприклад, соматостатин, також можуть бути дериватизованими для демонстрування специфічного зв'язування опіатних рецепторів (наприклад, CTOP [Хокінс (Hawkins) та інші, J. Pharm. Exp. Ther. 248: 73, 1989]). Аналоги можуть бути також одержаними з алкалоїдів, наприклад, морфіну, зі зміненими властивостями зв'язування рецептора (наприклад, героїн, кодеїн, гідроморфон, оксиморфон, леворфанол, левалорфан, гідрокодон, оксикодон, налорфін, налоксон, налтрексон, бупренорфін, бутанорфанол та налбуфін); на додаток до цього, невеликі молекули, які структурно не пов'язані з морфіном, також можуть діяти на опіатні рецептори (наприклад, меперидин та представники того ж роду альфапродин, дифеноксилат та фентаніл) [див. Handbook of Experimental Pharmacology, цитовано перед тим; The Pharmacological Basis of Therapeutics Гудмана та Гілмана, 7 видання, А.Г. Гілман (A.G. Gilman), Л.С. Гудман (L.S. Goodman), Т.В. Ралл (T.W. Rail) та Ф. Мурад (F. Murad) (видавці) 1985, компанія Macmillan Publishing Co., Нью-Йорк]. 10 Ендогенні ошатні пептиди (енкефаліни, ендорфіни та динорфіни) мають консервативний Nкінцевий тетрапептид Tyr-Gly-Gly-Phe, за яким ідуть Leu або Met та будь-яка залишкова С-кінцева послідовність. Наслідком видалення гідроксильної групи на N-кінцевому Туr (що веде до появи Nкінцевого Phe) є повна втрата активності відносно Met-енкефаліну. Ці стр уктурні дані ведуть до появи гіпотези "інформація-адреса", за якою N-кінцева "інформація" передає біологічну активність, у той час як С-кінцева "адреса" передає специфічність та підсилену активність [Чавкін (Chavkin) та Гольдштейн (Goldstein), PNAS 78: 6543-7, 1981]. Екзорфіни, як правило, мають Туr-Рrо, які заміщують Nкінцеві Tyr-Gl y класичних опіатних пептидів; проліновий залишок, як гадають, надає підвищену стійкість проти амінопептидазного розщеплення [Шіп (Shipp) та інші, PNAS 86: 287-, 1989; Гламста та інші, BBRC 184: 1060-6, 1992]. Нещодавно було клоновано сирітський рецептор ("ORL1") внаслідок спорідненості його послідовності з опіатними рецепторами мю, дельта та каппа [Моллеро (Mollereau) та інші, FEBS 341: 3338, 1994; Фукада (Fukuda) та інші, FEBS 343: 4246, 1994; Бунзов (Bunzow) та інші, FEBS 347: 2848, 1994; Чен (Chen) та інші, FEBS 347: 279-83, 1994; Ванг (Wang) та інші, FEBS 348: 75-79, 1994; Кейт (Keith) та інші, Reg. Peptides 54: 143-4, 1994; Вік (Wick) та інші, Моl. Brain Res. 27: 37-44, 1994; Хелфорд (Halford) та інші, J. Neuroimmun. 59: 91101, 1995]. Було клоновано ліганд для цього рецептора, який називають по-різному-ноціцептином або сирітським FQ (у подальшому він буде називатись "ноціцептин"). Було показано, що він є гептадекапептидом, який було одержано з більшого попередника [Муньє (Меunier) та інші, Nature 377: 532-535, 1995; Райншайд (Reinscheid) та інші, Science 270: 792-794, 1995]. Було показано, що він має проноціцептивні, гіпералгетичні функції in vivo, у протилежність до класичних опіатів, які мають аналгетичні властивості. Ноціцептин має Phe-GlyGly-PheN-кінцеву ділянку, у протилежність до TyrGly-Gl y-PheN-кінцевої ділянки класичних опіатних пептидів, які обговорювались перед тим. У відповідності до вимоги присутності N-кінцевого Туr для опіатної активності у класичних опіатних пептидів, ноціцептин майже не демонструє або демонструє незначну спорідненість до опіатних рецепторів мю, каппа або дельта. Подібним же чином, у ошатного антагоніста широкого спектру дії налоксону відсутня помітна спорідненість до ORL1. Спостерігалось, що енкефаліни мають вплив на гематопоез мишачих in vi vo за умов іммобілізаційного стресу [Гольдберг (Goldberg) та інші, Folia Biol. (Прага) 36: 319-331, 1990]. Leu-енкефалін пригнічував, а met-енкефалін стимулював гемопоез кісткового мозку. Ці ефекти були опосередковані, як гадають Гольдберг та інші, внаслідок впливу на рівні глюкокортикоїдів та міграцію Т-лімфоцитів. Крізанак-Бенгез (Rrizanac-Bengez) та інші [Biomed. & Pharmacother. 46: 367-43, 1992; Biomed. & Pharmacother. 49: 27-31, 1995; Biomed. & Pharmacother. 50: 85-91, 1996] досліджували ефекти цих сполук in vitro. Попередня обробка кісткового мозку мишачих Met- або Leu-енкефаліном 11 85036 або налоксоном впливала на кількість клітинпопередників GM, що спостерігалась під час аналізу колоній. Цей ефект був дуже змінним і наслідком його була супресія, стимуляція або відсутність ефекту; додатково, була відсутня чітка залежність між дозою та реакцією. Ця змінність КрізанакомБенгезом та іншими була віднесена на рахунок циркадних ритмів та А-клітин. Нещодавно було продемонстровано, що миші, мю-опіатний рецептор у яких було видалено за допомогою гомологічної рекомбінації, мають підвищену кількість CFU-GM, BFU-E та CFU-GEMM на стегнову кістку. Клітини-попередники селезінки та кісткового мозку у ци х мишей з видаленим мюрецептором мали більш високу мітотичну активність, у порівнянні до нормальних мишей. Не було визначено, чи були ці ефекти обумовлені прямим або опосередкованим впливом на стовбурові клітини кісткового мозку внаслідок відсутності мюрецептора у цих тварин [Броксмейєр (Broxmeyer) та інші, Blood 88: 338а, 1997]. I. Хіміотерапія та радіотерапія раку Наслідком продуктивного дослідження факторів стимулювання росту є клінічне використання цілого ряду згаданих факторів (еритропоетин, GCSF, GM-CSF тощо). Ці фактори зменшили рівень захворюваності та смертності, пов'язаний з хіміотерапевтичною та променевою терапією. Додаткові клінічні благотворні наслідки для пацієнтів, які піддаються хіміотерапії або опроміненню, можуть бути реалізовані альтернативною стратегією блокування надходження стовбурових клітин до мітотичного циклу, завдяки чому забезпечується їх захист від побічних токсичних ефектів. Реверсування цього захисту забезпечить швидке відновлення функції кісткового мозку після хіміо- або радіотерапії. II. Трансплантування кісткового мозку та стовбурових клітин, ex vivo розмноження стовбурових клітин та десенсибілізування пухлинних клітин Трансплантація кісткового мозку (BMT) є придатним лікуванням для різноманітних гематологічних, автоімунних та злоякісних захворювань. У лікувальних методах, які застосовуються на цей час, використовують гемопоетичні клітини, одержані з крові пупкового канатика, печінки зародка або з периферичної крові (немобілізованої або мобілізованої такими речовинами, як G-CSF або циклофосфамід), а також з кісткового мозку; стовбурові клітини можуть бути неочищеними, частково очищеними (наприклад, шляхом афінної очистки популяції CD34+) або високоочищеними (наприклад, за допомогою клітинного сортера зі збудженням флуоресценції з використанням таких маркерів, як CD34, CD38 або родаміну). Маніпулювання гемопоетичними клітинами ex vi vo використовують зараз для розмноження первинних стовбурови х клітин для одержання популяції, придатної для трансплантації. Оптимізація цієї процедури потребує: (1) достатньої кількості стовбурових клітин, здатних до підтримки довгострокового відновлення гемопоезу; (2) вичерпання Тлімфоцитів, які індукують реакцію "трансплантат проти хазяїна" та (3) відсутності залишкових злоякісних клітин. Ця процедура може бути оптимізо 12 вана шляхом включення інгібітора(-ів) стовбурових клітин та/або стимулятора(-ів) стовбурови х клітин. Ефективність десенсибілізування гемопоетичних клітин цитотоксичними лікарськими засобами для винищення залишкових злоякісних клітин обмежена внаслідок токсичності цих сполук для нормальних гемопоетичних клітин і особливо, стовбурових клітин. Існує необхідність у ефективному захисті нормальних клітин під час десенсибілізування; захист може забезпечуватись шляхом вилучення стовбурових клітин з мітотичного циклу за допомогою ефективного інгібітора. III. Збирання периферичних стовбурових клітин Стовбурові клітини периферичної крові (PBSC) мають ряд потенційних переваг над кістковим мозком для автологічної трансплантації. Пацієнти, позбавлені придатних ділянок для збору кісткового мозку внаслідок розповсюдження пухлини або попередньої радіотерапії, можуть піддаватись збиранню PBSC. Застосування стовбурови х клітин крові виключає необхідність загального анестезування та хірургічних процедур у пацієнтів, які погано їх переносять. Технологія аферезу, необхідна для збирання клітин крові, є ефективною та широкодоступною у більшості значних медичних центрів. Головними обмеженнями згаданого способу є низька нормальна постійна частота стовбурових клітин у периферичній крові та їх високий мітотичний статус після мобілізаційних процедур за допомогою лікарських засобів або факторів росту (наприклад, циклофосфаміду, G-CSF, фактора стовбурови х клітин). Ефективний інгібітор стовбурових клітин буде корисним для повернення цих клітин до неактивного стану, що сприятиме тим самим запобіганню їх втрати внаслідок диференціації. IV. Лікування гіперпроліферативних розладів Характерним для цілого ряду хвороб є гіперпроліферативний стан, при якому розрегульовані стовбурові клітини забезпечують перепродукування клітин на термінальній стадії диференціювання. До таких хвороб належать, але ними не обмежуються, псоріаз, при захворюванні яким відбувається перепродукування епідермальних клітин, стани, які передують утворенню злоякісних пухлин у шлунково-кишковому тракті, які характеризуються появою кишкових поліпів, та синдром набутого імунодефіциту (СНІД), коли первинні стовбурові клітини не є інфікованими вірусом імунодефіциту людини (ВІЛ), але мають високу мітотичну активність, наслідком чого є вичерпання стовбурових клітин. Інгібітор стовбурових клітин буде корисним при лікуванні таких станів. V. Лікування гіпопроліферативних розладів Характерним для цілого ряду хвороб є гіпопроліферативний стан, при якому розрегульовані стовбурові клітини не забезпечують достатнього рівня продукування клітин на термінальній стадії диференціювання. До таких хворобливих станів належать мієлодиспластичні синдроми або апластична анемія, при яких спостерігається недостатній рівень продукування клітин крові, та стани, пов'язані зі старінням, при яких спостерігається дефіцитне відновлення та заміщення клітин. Сти 13 85036 мулятор стовбурових клітин буде корисним при лікуванні таких станів. VI. Перенос генів Зараз у клінічних умовах використовують здатність до переносу генетичної інформації до гемопоетичних клітин. Гемопоетичні клітини є придатними мішенями для генної терапії, що обумовлено легким доступом, широким досвідом маніпулювання та лікування цієї тканини ex vi vo та завдяки здатності клітин крові до проходження через тканини. На додаток до цього, стає можливою корекція певних генетичних дефектів людини шляхом введення функціонального гена до первинних стовбурових клітин гемопоетичної системи людини. Існує декілька обмежень для введення генів до гемопоетичних клітин людини за допомогою векторів на основі ретровірусів або фізичних способів переносу гена: (1) Низька частота стовбурових клітин у гемопоетичних тканинах обумовила необхідність розвитку високоефективних способів переносу генів; та (2) стовбурові клітини з підвищеною мітотичною активністю виявились більш вразливими до векторного інфікування, однак підвищення частоти інфікування шляхом стимулювання проліферації стовбурових клітин ростовими факторами викликає негативні наслідки щодо довгострокової експресії генів, оскільки клітини, до складу яких входять трансгени, примушуються до необоротної диференціації і втрачають здатність до самооновлення. Ці проблеми можна поліпшити шляхом використання інгібітора стовбурових клітин для запобігання диференціації та втраті здатності до самооновлення, та стимулятора стовбурових клітин для регулювання вступу стовбурових клітин до мітотичного циклу і, тим самим, полегшити перенос генів, опосередкований ретровірусами. Цей винахід має відношення до сполук, до яких належать пептиди та поліпептиди, які є інгібіторами та/або стимуляторами проліферації стовбурових клітин (INPROL або опіатні сполуки), та їх використання. Цей винахід включає інгібітор проліферації стовбурови х клітин, який характеризується наступними властивостями: (a) Питома активність (ІС50), яка є меншою ніж або дорівнює 20нг/мл у пробі на колонієтвірні одиниці селезінки (CFU-S) мишачих (див. Приклад 4), (b) Молекулярна маса більша 10000 та менша 100000Да (визначена ультрафільтрацією), (c) Активний продукт, чутливий до розщеплення трипсином, (d) Більш гідрофобний, аніж MIP-1α або TGFβ та відокремлюється від обох за допомогою хроматографії зі зворотною фазою (див. Приклад 12), (е) Біологічна активність зберігається після нагрівання впродовж 1год. при 37°C, 55°С або 75°С у водному розчині, та (f) Біологічна активність зберігається після осадження 1% хлористоводневою кислотою у ацетоні. Цей винахід додатково характеризується та відрізняється від інших придатних інгібіторів стовбурових клітин (наприклад, MIP-1α, TGFβ та різноманітних олігопептидів) його здатністю до забезпечення пригнічення у пробі in vitro після 14 короткого передінкубаційного періоду (див. Приклад 5). До складу цього винаходу також входять фармацевтичні композиції, які включають INPROL, для лікування різноманітних розладів. Цей винахід надає спосіб лікування суб'єкта, якому призначено введення засобу, здатного вбити або пошкодити стовбурові клітини, шляхом введення згаданому суб'єктові ефективної кількості композиції, яка пригнічує стовбурові клітини. Стовбуровими клітинами, які захищаються цим способом, можуть бути гемопоетичні стовбурові клітини, які звичайно є присутніми та діляться у кістковому мозку, крові пупкового канатика, печінці зародка або мобілізуються до периферичної крові. У той час як більшість мобілізованих стовбурови х клітин, за результатами аналізу за допомогою клітинного сортера зі збудженням флуоресценції (FACS), знаходиться у неактивному стані, поліпотентні стовбурові клітини знаходяться у стані мітотичної активності та піддаються пригніченню за допомогою INPROL у кількостях, які забезпечують пригнічення стовбурових клітин. У альтернативному варіанті, стовбурові клітини можуть бути епітеліальними, розміщеними, наприклад, у кишках, на вкритій волоссям частині голові або на інших ділянках тіла або статевих клітин, які знаходяться у репродуктивних органах. Спосіб за цим винаходом може бути, у варіанті, якому віддається перевага, застосованим на людині, хоча цим способом передбачається також лікування тварин. Термін "суб'єкт" або "пацієнт", який використано у цьому описі, означає тварину, наприклад, ссавця, у тому числі людину. Цей винахід надає також спосіб лікування суб'єкта з гіпопроліферацією стовбурових клітин шляхом введення згаданому суб'єктові ефективної кількості композиції, яка стимулює стовбурові клітини. Згаданими стовбуровими клітинами, які стимулюються цим способом, можуть бути гемопоетичні стовбурові клітини, які звичайно є присутніми у кістковому мозку, крові пупкового канатика, печінці зародка або мобілізуються до периферичної крові; згадані стовбурові клітини могли бути попередньо переведеними до неактивного стану шляхом застосування INPROL у кількостях, які забезпечують пригнічення стовбурових клітин. INPROL у кількостях, які забезпечують стимулювання стовбурових клітин, надасть змогу стимулювання мітотичної активності стовбурових клітин за потребою, наприклад, після збирання стовбурових клітин для використання під час розмноження ex vivo або in vi vo після трансплантації та приживлення стовбурових клітин. У альтернативному варіанті, стовбурові клітини можуть бути епітеліальними, розміщеними, наприклад, у кишках, на вкритій волоссям частині голови або на інших ділянках тіла або статевими клітинами, які знаходяться у репродуктивних органах. За іншим аспектом, цей винахід надає спосіб захисту та відновлення гемопоетичної, імунної або іншої системи стовбурових клітин пацієнта, якого було піддано хіміотерапії, який включає введення згаданому пацієнтові ефективної кількості INPROL, яка забезпечує пригнічення стовбурових клітин 15 85036 та/або стимулює поздоровлення після хіміотерапії або променевої терапії шляхом введення ефективної кількості INPROL, яка забезпечує стимулювання стовбурових клітин. За додатковим аспектом, цей винахід пропонує спосіб допоміжного лікування раку будь-якого типу, у тому числі такого, який відрізняється твердими пухлинами (наприклад, грудної залози, товстої кишки, легень, тестикулярного, яєчника, печінки, нирок, підшлункової залози, мозку, саркоми), шляхом введення пацієнту, який страждає на рак, ефективної кількості INPROL, яка забезпечує пригнічення стовбурови х клітин, для захисту згаданих стовбурови х клітин кісткового мозку, шлунковокишкового тракту або інших органів від токсичного впливу хіміотерапії або променевої терапії та/або стимулювання поздоровлення після хіміотерапії або променевої терапії шляхом введення певних кількостей INPROL, які забезпечують стимулювання стовбурових клітин. За ще іншим аспектом, цей винахід пропонує спосіб лікування лейкозу (наприклад, хронічного мієлогенного лейкозу, гострого мієлогенного лейкозу, хронічного лімфолейкозу, гострого лімфолейкозу, мієломи, лімфогранулематоза), який включає обробку гемопоетичних клітин, до складу яких входять проліферуючі лейкозні клітини, ефективною кількістю INPROL для пригнічення проліферації нормальних стовбурових клітин, та обробку кісткового мозку цитотоксичним засобом для знищення лейкозних клітин. Цей спосіб може бути підсилено подальшою обробкою кісткового мозку іншими засобами, які стимулюють його проліферацію; наприклад, колонієстимулювальними факторами та/або INPROL у кількостях, які стимулюють стовбурові клітини. За одним із варіантів втілення цього винаходу, цей спосіб здійснюється in vivo. У альтернативному варіанті, цей спосіб також є придатним для ex vivo десенсибілізування та розмноження гемопоетичних клітин для трансплантування. Ще за одним додатковим аспектом, згаданий спосіб включає лікування суб'єкта, який має будьякий розлад, спричинений проліферацією стовбурових клітин. Такі розлади, наприклад, псоріаз, мієлодисплазія, деякі автоімунні захворювання, імунодепресія при старінні, мієлодиспластичний синдром, апластична анемія або вичерпання стовбурових клітин при СНІДі, лікуються шляхом введення згаданому суб'єктові ефективної кількості INPROL для пригнічення або стимулювання проліферації згаданих стовбурови х клітин. Цей винахід надає спосіб оборотного захисту стовбурови х клітин від пошкодження цитотоксичним засобом, здатним убити або пошкодити стовбурові клітини. Згаданий спосіб включає введення суб'єкту, якому призначена обробка таким засобом, ефективної кількості INPROL, яка забезпечує пригнічення стовбурових клітин. Цей винахід надає також спосіб оборотного стимулювання проліферації стовбурови х клітин на етапі відновлення після хіміотерапії або променевої терапії. Згаданий спосіб включає введення суб'єкту, якому призначена обробка таким засо 16 бом, ефективної кількості INPROL, яка забезпечує стимулювання стовбурови х клітин. Цей винахід, крім того, надає: Інгібітор проліферації стовбурових клітин, виділений зі свинячого або іншого кісткового мозку за допомогою наведених далі процедур (див, Приклад 12): (a) Екстрагування кісткового мозку та видалення подрібненої речовини шляхом фільтрування, (b) Теплова обробка при 56°С впродовж 40хв. із подальшим охолодженням на льодяній бані, (c) Видалення осаду шляхом центрифугування при 10000 g впродовж 30хв. при 4°C, (d) Кислотне осадження шляхом додання супернатанту до 10 об'ємів перемішуваного ацетону, який має температуру таїння льоду, до складу якого входить 1% (об'єм.) концентрованої хлористоводневої кислоти, та інкубування при 4°C впродовж 16год, (е) Виділення осаду шляхом центрифугування при 20000g впродовж 30хв. при 4°С та промиванням холодним ацетоном з подальшим висушуванням, (f) Виділення хроматографуванням зі зворотною фазою та контролювання активності шляхом пригнічення утворення колоній клітинами кісткового мозку, попередньо обробленими 5фтор урацилом та інкубуванням у присутності мишачого IL (інтерлейкіну)-3, а також абсорбуванням на 280нм та електрофорезом у поліакриламідному гелі у присутності додецилсульфату натрію (SDSPAGE). Цей винахід також надає: Спосіб очищення інгібітора проліферації стовбурових клітин, який по суті є позбавленим інших білкових матеріалів, який включає етапи, наведені перед тим, а також докладно описані далі. Цей винахід також надає: Спосіб лікування людей або тварин, де інгібітор проліферації стовбурови х клітин забезпечує полегшення імуносупресії, спричиненої гіперпроліферацією стовбурових клітин. Цей винахід також надає: Спосіб лікування людей або тварин, де INPROL у кількостях, які стимулюють стовбурові клітини, забезпечує полегшення супресії кісткового мозку, спричиненої гіпопроліферацією стовбурових клітин. Цей винахід також надає: Спосіб лікування людей або тварин, де згаданий інгібітор проліферації стовбурових клітин вводиться після індукування проліферації стовбурових клітин шляхом піддання впливу цитотоксичного лікарського засобу або опромінювання. Стовбурові клітини, звичайно, знаходяться у неактивному стані, але стимулюються до вступу до мітотичного циклу після хіміотерапії. Це робить їх більш чутливими до другого введення хіміотерапевтичного засобу; згаданий спосіб захищає їх від цієї обробки. Цей винахід також надає: Спосіб лікування людей або тварин, де стимулятор проліферації стовбурових клітин (наприклад, INPROL у кількостях, які забезпечують сти 17 85036 мулювання стовбурових клітин) вводиться перед або після INPROL у кількостях, які забезпечують пригнічення стовбурових клітин, для підсилення відновлення кісткового мозку. Кількості INPROL, які забезпечують пригнічення стовбурових клітин, уповільнюють швидкість проходження стовбуровими клітинами мітотичного циклу та захищають їх від хіміотерапевтичних засобів та опромінювання; кількості INPROL, які забезпечують стимулювання стовбурови х клітин, реверсують згадане пригнічення та підсилюють відновлення кісткового мозку. У альтернативному варіанті, кількості INPROL, які забезпечують стимулювання стовбурових клітин, можуть застосовуватись для підсилення відновлення функціонування кісткового мозку, у той час як кількості, які забезпечують пригнічення стовбурових клітин, використовуються на наступному етапі для повернення згаданих стовбурови х клітин до неактивного стану після досягнення відновлення функціонування кісткового мозку. Цей винахід також надає: Спосіб лікування людей або тварин, де згаданий інгібітор проліферації стовбурових клітин вводять як ад'ювант перед або під час вакцинації з метою підвищення імунної реакції. Цей винахід також надає: Спосіб лікування імунодефіциту у ссавців, який включає введення згаданому ссавцеві імуностимулювальної кількості INPROL. Цей винахід також надає: Спосіб лікування болю у ссавця, який включає введення згаданому ссавцеві кількості INPROL, яка індукує аналгезію. Цей винахід також надає: Спосіб лікування людей або тварин, які одержують цитотоксичні лікарські засоби або піддаються променевій терапії, який включає введення ефективної кількості інгібітора проліферації стовбурових клітин для захисту стовбурових клітин від пошкодження. Цей винахід також надає: Спосіб лікування людей або тварин, які одержують цитотоксичні лікарські засоби або піддаються променевій терапії, який включає введення ефективної кількості INPROL, яка забезпечує стимулювання стовбурових клітин, для прискорення виздоровлення після лікування. Цей винахід включає також фармацевтичну композицію, до складу якої входять гемоглобін та фармацевтично прийнятний носій. Цей винахід включає також фармацевтичну композицію, до складу якої входять (а) поліпептид, який вибрано з групи, до складу якої входять альфа-ланцюг гемоглобіну, бета-ланцюг гемоглобіну, гамма-ланцюг гемоглобіну, дельта-ланцюг гемоглобіну, епсилон-ланцюг гемоглобіну та дзеталанцюг гемоглобіну, поліпептид, до складу якого входять амінокислоти 1-97 альфа-ланцюга гемоглобіну людини ("пептид 1-97") та поліпептид, до складу якого входять амінокислоти 1-94 альфаланцюга гемоглобіну людини ("пептид 1-94") та (b) фармацевтично прийнятний носій. Такі фармацевтичні композиції можуть складатись з одного поліпептиду, вибраного зі згаданої групи, суміші поліпептидів, вибраних зі згаданої групи, або 18 поліпептидів зі згаданої групи у формі димерів або полімерів з або без гему. Цей винахід включає також пептиди, які мають наведені далі послідовності: Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly- Ser-AlaGln-Val ("Пептид 43-55"), Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-SerAla-Gln-Val-Cys де два Cys залишки об'єднуються дисульфідним зв'язком ("Циклічний пептид 43-55"), Cys-Phe-Pro-His-Phe-Asp-Leu-Ser-His-Gly-SerAla-Gln-Val-Cys де два Cys залишки об'єднуються вуглецевим містком, Asp-Ala-Leu-Thr-Asn-Ala-Val-Ala-His-Val-AspAsp-Met-Pro-Asn-Ala-Leu-Ser-Ala ("Пептид 64-82") та пептид, до складу якого входять перші 97 Nкінцевих амінокислот альфа-гемоглобіну людини, як показано на Фіг.16А. До цього винаходу включено також білкові та пептидні послідовності, до складу яких входять модифіковані варіанти альфа-ланцюга людини, які зберігають інгібіторні та/або стимуляторні властивості відносно стовбурових клітин. Такі модифікації включають, але не обмежуються, видалення або модифікацію С-кінцевого гідрофобного домену (наслідком чого є поліпшення характеристик розчинності) та/або видалення або модифікацію домену зв'язування гаптоглобіну (наслідком чого є поліпшення фармакокінетичних властивостей). Скінцевий гідрофобний домен альфа-гемоглобіну людини складається з ділянки від 98 амінокислоти (фенілаланін) до 141 амінокислоти (аргінін) і включає 23 гідрофобні амінокислоти з загальної кількості 44. Весь домен або одна або декілька з цих гідрофобних амінокислот (6 аланінів, 4 валіни, 8 лейцинів, 2 проліни та 3 фенілаланіни) можуть бути видалені делецією ("видалений делецією" Скінцевий гідрофобний домен). У альтернативному варіанті, одна або декілька з цих амінокислот може бути заміщена неполярною амінокислотою (наприклад, гліцином, серином, треоніном, цистеїном, тирозином, аспарагіном або глутаміном) ("заміщений" С-кінцевий гідрофобний домен). У іншому варіанті втілення використовують такі хімічні модифікації, наприклад, карбоксиметилювання, які послаблюють гідрофобні властивості цієї ділянки та підсилюють розчинність. У іншому варіанті втілення, гідрофобні залишки у послідовності бета-гемоглобіну людини заміщаються відповідними гідрофільними ділянками. Наприклад, кожна з ділянок послідовності бетагемоглобіну людини між амінокислотами 107 (гліцин) та 117 (гістидин) або між амінокислотами 130 (тирозин) та 139 (аспарагін) є відносно гідрофільною і кожна з них або обидві можуть бути заміщеними еквівалентними гідрофобними ділянками альфа-гемоглобіну людини. Домен зв'язування гаптоглобіну знаходиться у межах С-кінцевої гідрофобної ділянки і складається з амінокислот 121-127. Ця ділянка може бути видалена делецією у повному обсязі або на цій ділянці таким самим чином може бути видалена одна або декілька амінокислот ("видалений деле 19 85036 цією" С-кінцевий домен зв'язування гаптоглобіну). Ця ділянка або одна, або декілька амінокислот на цій ділянці можуть бути заміщеними іншими амінокислотами, наприклад, поліаланіном або полігліцином, або іншими амінокислотами, наслідком чого є усунення зв'язування поліпептиду з гаптоглобіном, проте підтримка пригаічувальної активності відносно стовбурових клітин ("заміщений" Скінцевий домен зв'язування гаптоглобіну). Іншими варіантами втілення цього винаходу передбачаються відповідні модифікації беталанцюга гемоглобіну (на С-кінцевій гідрофобній ділянці та/або на одному або обох доменах зв'язування гаптоглобіну (амінокислоти 11-25 та 136146)) та відповідні модифікації дельта-, гамма-, епсилон- та/або дзета-ланцюгів гемоглобіну. До цього винаходу включено також послідовності ДНК, які кодують вищезгадані пептиди, вектори, до складу яких входять згадані послідовності ДНК, та клітини-хазяї, до складу яких входять згадані вектори. Ці пептиди можуть бути синтезованими за допомогою стандартних хімічних способів (наприклад, твердофазним синтезом) або за допомогою рекомбінантних способів (з включенням систем злиття, наприклад, таких, у яких застосовується глутатіон-S-трансфераза [Д.Б. Сміт (D.B. Smith) та К.С. Джонсон (K.S. Johnson), Gene 67: 31-40, 1988], тіоредоксин [Лa Валлі (La Vallie) та інші, Biotechnology 11: 187-193, 1993] або убіквітин [Батт (Butt) та інші, PN AS 86: 2540-4, 1989; Черні (Cherney) та інші, Biochem. 30: 10420-7, 1991; Бейкер (Baker) та інші, JBC 269:25381-6, 1994; патенти США №№5132213; 5196321 та 5391490 та міжнародна заявка WO 91/17245]. Кожну з цих статей, заявок та патентів включено до цього опису як посилання. Цей винахід додатково включає спосіб пригнічення або стимулювання проліферації стовбурових клітин, який включає контактування гемопоетичних клітин зі сполукою, здатною до зв'язування опіатних рецепторів, у варіанті, якому віддається перевага, опіатних рецепторів підкласу мю. Цей винахід додатково включає спосіб пригнічення або стимулювання проліферації стовбурових клітин, який включає контактування гемопоетичних клітин зі сполукою, здатною до зв'язування рецепторів ноціцептину (наприклад, ORLl). Цей винахід додатково включає спосіб пригнічення або стимулювання проліферації стовбурових клітин, який включає контактування гемопоетичних клітин зі сполукою, здатною до зв'язування "опіатоподібних" рецепторів. Пептиди (які було названо "геморфінами") було виділено з гемоглобіну, який демонструє опіатну активність [наприклад, Брантл (Brantl) та інші, Eur. J. Pharm. 125: 309-10, 1986; Девіс (Davis) та інші, Peptides 10: 747-51, 1989; Гофман та інші, PNAS 87: 8521-25, 1990; Ернан та інші, Biochem. 31: 8619-28, 1992; Карелін та інші, Bioch. Biophys. Res. Comm. 202: 410-5, 1994; Жао (Zhao) та інші, Ann. N.Y. Acad. Science 750: 452-8, 1995; Петров та інші, Bioscience Reports 15: 1-14, 1995; Карелін та інші, Peptides 16: 693-697, 1995]. Кожну з цих статей включено до цього опису посиланням. Існують також інші атипові опіатні пептиди та неве 20 ликі молекули [Зудру та інші, JBC 254: 2446-9, 1979; Кіріон та Вайсс, Peptides 4: 445, 1983; Лукас та інші, Biochem. 22: 4567, 1983; Брантл, Eur. J. Pharm. 106: 213-14, 1984; Брантл та інші, Eur. J. Pharm. 111: 293-4, 1985; Брантл та Нубер, TIPS 7: 6-7, 1986; Грабі та Геріг, Med. Res. Rev. 9: 343-401, 1989; Шіллер, Prog. Med. Chem. 28: 301-40, 1991; Гламста та інші, BBRC 184: 1060-6, 1992; Тешмахер, Handbook Exp. Pharm. 104: 499-28, 1993; Handbook Of Experimental Pharmacology, А. Герц (видавець), томи 104/l та 104/ll, 1993, видавництво Springer Verlag, Берлін; Рід та інші, Neurosci. and Biobehav. Rev. 18: 519-25, 1994; Карелін та інші, Peptides 16: 693-7, 1995]. Кожну з цих статей включено до цього опису посиланням. "Опіатоподібні рецептори", як використано у цьому описі, визначаються за їх здатністю до зв'язування опіатів, INPROL, геморфінів, екзорфінів, ноціцептину, членів сімейства Tyr-MIF-1, алкалоїдів та/або інших сполук, які пригнічують або стимулюють проліферацію стовбурових клітин способом, який антагонізується включенням відповідної кількості налоксону (див. Приклади 29 та 38). Цей винахід додатково включає спосіб ідентифікування рецептора(-ів) та лігандів, який включає застосування INPROL (у варіанті, якому віддається перевага, у пептидних формах, наприклад, Пептид 1-94, 1-97, 43-55 або 64-82) у пробі на зв'язування рецепторів. Цей винахід додатково включає спосіб ідентифікування рецептора(-ів) та лігандів, який включає застосування INPROL у пробі на аденілатциклазу. Цей винахід додатково включає спосіб пригнічення або стимулювання проліферації стовбурових клітин, який включає контактування гемопоетичних клітин зі сполукою (наприклад, мастопараном), здатною до активізації GTPзв'язувальних білків, у варіанті, якому віддається перевага, білків Gпригніч увального підтипу. Цей винахід додатково включає спосіб пригнічення або стимулювання проліферації стовбурових клітин, який включає контактування гемопоетичних клітин з пептидом, вибраним з групи пептидів-геморфінів, які мають наведену далі послідовність: Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln-Arg-Phe, Leu-Val-Val-Tyr-Pro~Tip-Thr-Gln-Arg, Leu-Val-Val-Tyr-Pro-Trp-Thr-Gln, Leu-Val-Val-Tyr-Pro-Trp-Thr, Leu-Val-Val-Tyr-Pro-Trp, Leu-Val-Val-Tyr-Pro, Val-Val-Tyr-Pro-Trp-Thr-Gln, Tyr-Pro-Trp-Thr-Gln-Arg-Phe, Tyr-Pro-Trp-Thr-Gln-Arg, Tyr-Pro-Trp-Thr-Gln, та Tyr-Pro-Trp-Thr, Вищенаведені пептиди мають подібність послідовності та/або біологічну активність, подібну до інших атипових опіатних пептидів, наприклад, опіатних пептидів сімейства Туr-MIF-1 [огляд див. Рід та інші, Neurosci. Biobehav. Rev. 18: 519-25, 1994], казеїнопохідних казоморфінів [Брантл та інші, Physiol. Chem. Хоппе-Сейлера (Hoppe-Seyler) 360: 1211-16, 1979; Лукас та інші, Biochem. 22: 4567-4573, 1983; Фіат (Fiat) та Джолз (Jolles), Моl. 21 85036 Сеll. Biochem. 87: 5-30, 1989], пептидів, одержаних з цитохрому b, які називають цитохрофінами [Брантл та інші, Eur. J. Pharm. 111: 293-4, 1985], різних екзорфінів та опіатних пептидів людини та інших видів, за виключенням людини [Зудр у та інші, JBC 254: 2446-9, 1979; Брантл, Eur. J. Pharm. 106: 213-14, 1984; Брантл та інші, Eur. J. Pharm. 125: 309-10, 1986; Брантл та Нубер, TIPS 7: 6-7, 1986; Гламста та інші, BBRC 184: 1060-6, 1992; Тешмахер, Handbook Exp. Pharm. 104: 499-28, 1993; Карелін та інші, Peptides 16: 693-7, 1995], а також до пептидів, одержаних з комбінаторних бібліотек, відібраних за здатністю до зв'язування з ошатними рецепторами [огляд див. Дулі (Dooley) та інші, Peptide Research 8: 124-137, 1995]. Кожну з цих ста тей включено до цього опису посиланням. Цей винахід включає також спосіб пригнічення або стимулювання проліферації стовбурових клітин, який включає контактування гемопоетичних клітин з пептидом, вибраним із групи, до складу якої входять пептиди, пов'язані з Туr-MIF-1, казоморфіни, цитохрофіни та екзорфіни. Зокрема, включено пептиди Туr-MIF-1, які мають послідовності, наведені далі: Tyr-Pro-Try-Gly-NH 2, Tyr-Pro-L ys-Gly-NH 2, Tyr-Pro-Leu-Gly-NH 2, та Pro-Leu-Gly-NH 2. Цей винахід включає також спосіб пригнічення або стимулювання проліферації стовбурових клітин, який включає контактування гемопоетичних клітин з опіатним пептидом, вибраним із групи, до складу якої входять: (D-Аlа2,N-Ме-Рhе4,Сl у-ол5)-Енкефалін (DAMGO), (D-Аrg2,Les 4)-Дерморфін-(1-4)-амід (DALDA), (Phe4)-Дерморфін-(1-4)-амід Ac-Arg-Phe-Met-Trp-Met-Arg-NH 2, Ac-Arg-Phe-Met-Trp-Met-L ys-Nt2, та H-Tyr-Gl y-Gl y-Phe-Met-Arg-Arg-Val-NH 2. Цей винахід включає також спосіб пригнічення або стимулювання проліферації стовбурових клітин, який включає контактування гемопоетичних клітин зі сполукою ошатного антагоніста, який обирають з групи, до складу якої входять морфін, кодеїн, метадон, героїн, меперидин, альфапродин, дифеноксилат, фентаніл, суфентаніл, альфентаніл, леворфанол, гідрокодон, дигідрокодеїн, оксикодон, гідроморфон, пропоксифен, бупренорфін, еторфін, оксиморфону декстопропоксифен та мептазинол. Зокрема, включено морфін у пригнічувальних кількостях, які становлять менше ніж 107 моль. Цей винахід включає також спосіб пригнічення або стимулювання проліферації стовбурових клітин, який включає контактування гемопоетичних клітин з опіатним антагоністом або змішаним агоністом/антагоністом, вибраним із групи, до складу якої входять налоксон, налтрексон, налорфін, пентазоцин, налбуфін та буторфанол. Зокрема, включено налоксон у пригнічувальних кількостях, які складають менше 10-8моль. Цей винахід включає також спосіб стимулювання проліферації стовбурових клітин, який включає контактування гемопоетичних клітин з кількістю білка або пептиду, яка стимулює стовбу 22 рові клітини, який обирають з групи, до складу якої входять INPROL, міоглобін, DAMGO та DALD A. Цей винахід включає також спосіб проведення генної терапії ссавця, який включає: a) видалення гемопоетичних клітин зі згаданого ссавця, b) обробку згаданих гемопоетичних клітин ex vi vo кількістю INPROL, яка стимулює стовбурові клітини, та/або опіатною сполукою, c) трансфікування або інфікування згаданих гемопоетичних клітин попередньо визначеним геном, d) контактування згаданих трансфікованих гемопоетичних клітин ex vi vo з кількістю INPROL, яка пригнічує стовбурові клітини, та/або опіатною сполукою, e) трансплантування згаданому ссавцеві гемопоетичних клітин етапу d, f) факультативн у обробку згаданого ссавця in vi vo кількістю INPROL, яка пригнічує або стимулює стовбурові клітини, та/або опіатною сполукою. Цей винахід включає також спосіб проведення розмноження стовбурових клітин ex vi vo, який включає обробку згаданих гемопоетичних клітин кількістю INPROL, яка пригнічує стовбурові клітини, та, щонайменше, одним стимулювальним цитокіном. INPROL контактує зі згаданими гемопоетичними клітинами перед, під час та/або після контактування з стимулювальним цитокіном. Розмноження стовбурових клітин ex vi vo надає змогу одержання достатніх кількостей стовбурових клітин з обмежених джерел, наприклад, крові пупкового канатика, печінки зародка, автологічного кісткового мозку після хіміотерапії і. т.п. або після очищення (наприклад, за допомогою клітинного сортера зі збудженням флуоресценції з застосуванням таких маркерів, як CD34, CD38 або родамін). Спроможність вибіркового вирощування певних гемопоетичних ліній, крім того, дає змогу клініцистам безпосередньо конструювати трансплантати стовбурових клітин відповідно до потреб конкретного пацієнта. Цей винахід включає також спосіб проведення розмноження стовбурових клітин ex vi vo, який включає обробку згаданих гемопоетичних клітин кількістю INPROL, яка стимулює стовбурові клітини, з або без щонайменше одного додаткового стимулювального цитокіну. INPROL контактує зі згаданими гемопоетичними клітинами перед, під час та/або після контактування з стимулювальним цитокіном(-ами). Застосування стимулятора стовбурових клітин дозволить розмножити стовбурові клітини та/або клітини-попередники, у той час як інгібітор стовбурових клітин буде підтримувати стовбурові клітини у недиференційованому стані. Згадана процедура може також бути оптимізована шляхом застосування INPROL in vivo у кількостях, які пригнічують стовбурові клітини, для підтримки згаданих стовбурових клітин у неактивному стані до їх приживлення, після чого INPROL у кількостях, які стимулюють стовбурові клітини, може бути застосованим для стимулювання регенерації кісткового мозку. Факультативно, гемопоетичні клітини можуть бути розділені на два препарати; один з них обробляють кількостями INPROL, які стиму 23 85036 люють стовбурові клітини, для підсилення розмноження згаданих стовбурови х клітин та/або клітин-попередників, у той час як другий обробляють кількостями INPROL, які пригнічують стовбурові клітини, для підтримки згаданих стовбурови х клітин у недиференційованому стані. Після цього два згадані препарати можуть об'єднуватись і вводитись пацієнту. Цей винахід включає також фармацевтичну композицію, до складу якої входять (a) INPROL та (b) щонайменше одна пригнічувальна сполука, яку обирають з групи, до складу якої входять MIP-1α, TGFβ, TNFα (фактор некротизації пухлин), INFα (інтерферон), INFβ, INFγ, пентапептид пipoGlu-GluAsp-Cys-Lys, тетрапептид N-ацетил-Ser-Asp-LysPro та трипептид глутатіон (Gly-C ys-yGlu). Цей винахід включає також фармацевтичну композицію, до складу якої входять (a) INPROL та (b) щонайменше один стимулювальний цитокін, який обирають з групи, до складу якої входять Щінтерлейкін)-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL11, IL-13, IL-14, IL-15, G-CSF, GM-CSF, M-CSF (макрофагальний колонієстимулювальний фактор), еритропоетин, тромбопоетин, фактор стовбурових клітин, дельтаподібний білок та ліганд flk2/flt3. Цей винахід описує інгібітор стовбурових клітин (INPROL), який відрізняється від відомих у цій галузі, наприклад, MIP-1α, TGFβ, тетрапептиду Фріндела (Frindel) та співробітників або пентапептиду Пауковіца (Paukovits) та співробітників (порівняй, Райт (Wright) & Прагнелл (Pragnell), 1992 (цитовано перед тим)). Природний нативний INPROL має молекулярну масу, яка перевищує 10000 Дальтон (визначено ультрафільтрацією), що відрізняє його від тетрапептиду, а також від пентапептиду. Він є більш гідрофобним, аніж MIP-1α або TGFβ (хроматографічні системи зі зворотною фазою), що відрізняє його від згаданих цитокінів. Додатково, його спосіб дії відрізняється від способу дії будь-якого попередньо описаного інгібітора тим, що він є активним у пробі in vitro тільки у разі використання впродовж передінкубаційного періоду. MIP-1α, наприклад, втрачає ефективність у разі його використання тільки впродовж передінкубаційного періоду (Приклад 5). Додатково, природний INPROL є активним у пробі на визначення "колонієтвірних клітин з високим проліферативним потенціалом" (HPP-PFC), у той час як MIP-1α подібної активності не має (Приклад 6). INPROL відрізняється від стимуляторів, відомих у цій галузі, наприклад, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-9, IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, G-CSF, GM-CSF, M-CSF, еритропоетину, тромбопоетину, фактора стовбурови х клітин та ліганду flk2/flt3. Природний INPROL не має або має незначну схожість послідовності зі згаданими цитокінами. На Фіг.1-4 наведено результати електрофорезу у поліакриламідному гелі у присутності додецилсульфату натрію, якому піддається продукт після кожного етапу очищення. Фіг.1 - Смуга 1 - хімотрипсиноген, Смуга 2 овальбумін, Смуга 3 - BSA (сироватковий альбумін великої рогатої худоби), Смуга 4 – фракція
ДивитисяДодаткова інформація
Назва патенту англійськоюInhibitor and stimulator of haemotopoietic stem cell proliferation and uses thereof
Автори англійськоюWolpe Stephen D., Tsyrlova Irena
Назва патенту російськоюИнгибитор и стимулятор пролиферации стволовых клеток и их использование
Автори російськоюУолп Стивен Д., Цирлова Ирен
МПК / Мітки
МПК: A61K 39/39, A61P 37/00, C07K 14/52, C07K 14/475, A61P 35/00, C07K 7/08, C07K 5/107, A61K 31/00, C07K 7/06, A61K 38/19, C07K 14/805, A61K 38/16, A61P 43/00
Мітки: застосування, стовбурових, стимулятор, інгібітор, клітин, проліферації
Код посилання
<a href="https://ua.patents.su/44-85036-ingibitor-ta-stimulyator-proliferaci-stovburovikh-klitin-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Інгібітор та стимулятор проліферації стовбурових клітин та їх застосування</a>
Попередній патент: Спосіб виготовлення облицювальної плитки
Наступний патент: Фасонний виріб, виготовлений з гідравлічного в’язкого матеріалу із застосуванням технології паперового виробництва
Випадковий патент: Спосіб виготовлення абразивного інструменту