Промотор для епідерміс-специфічної трансгенної експресії в рослинах
Номер патенту: 86781
Опубліковано: 25.05.2009
Автори: Дудлер Роберт, Панструга Ральф, Швайцер Патрік, Шульце-Леферт Пауль
Формула / Реферат
1. Промоторний регіон зі специфічністю до рослинного епідермісу, що включає першу послідовність, що походить із промотору гену GSTA1 та являє собою SEQ ID No 1, та другу послідовність, що походить із інтрону гену WIR1a та являє собою SEQ ID No 2, причому перша послідовність та/або друга послідовність промоторного регіона має ідентичність послідовності від щонайменше 90 % з промоторними послідовностями, наведеними в SEQ ID No 1 та/або SEQ ID No 2.
2. Промоторний регіон за пунктом 1, який відрізняється тим, що його вибрано з групи, яка складається з:
a) промоторних регіонів, які включають послідовності нуклеїнової кислоти, вказаної в SEQ ID No 3,
b) промоторних регіонів, які включають функціональну частину послідовності нуклеїнової кислоти, вказаної в SEQ ID No 3, та
c) промоторних регіонів, які мають послідовність, яка гібридизується у жорстких умовах гібридизації з послідовністю нуклеїнової кислоти, вказаною в SEQ ID No 3, або має ідентичність послідовності від щонайменше 90 % з промоторною послідовністю, наведеною в SEQ ID No 3.
3. Рекомбінантна молекула нуклеїнової кислоти, що включає промоторний регіон за пунктом 1 або 2.
4. Рекомбінантна молекула нуклеїнової кислоти за пунктом 3, яка додатково включає транскрипційні термінаторні послідовності.
5. Спосіб одержання трансгенних рослин з епідермісспецифічною експресією трансгену, який включає етапи:
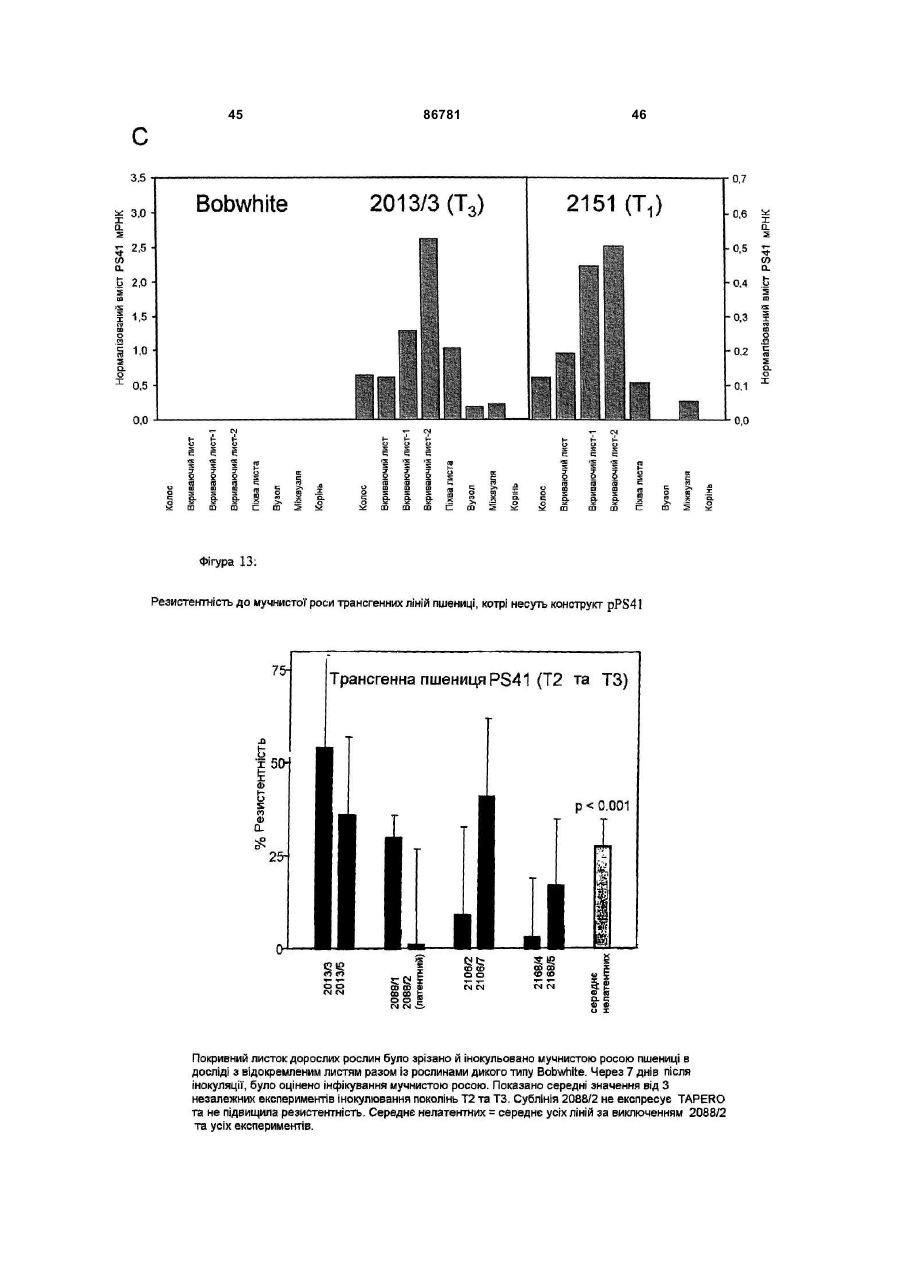
a) одержання рекомбінантної молекули нуклеїнової кислоти за пунктом 3 або 4,
b) перенесення рекомбінантної молекули нуклеїнової кислоти з а) у рослинні клітини та
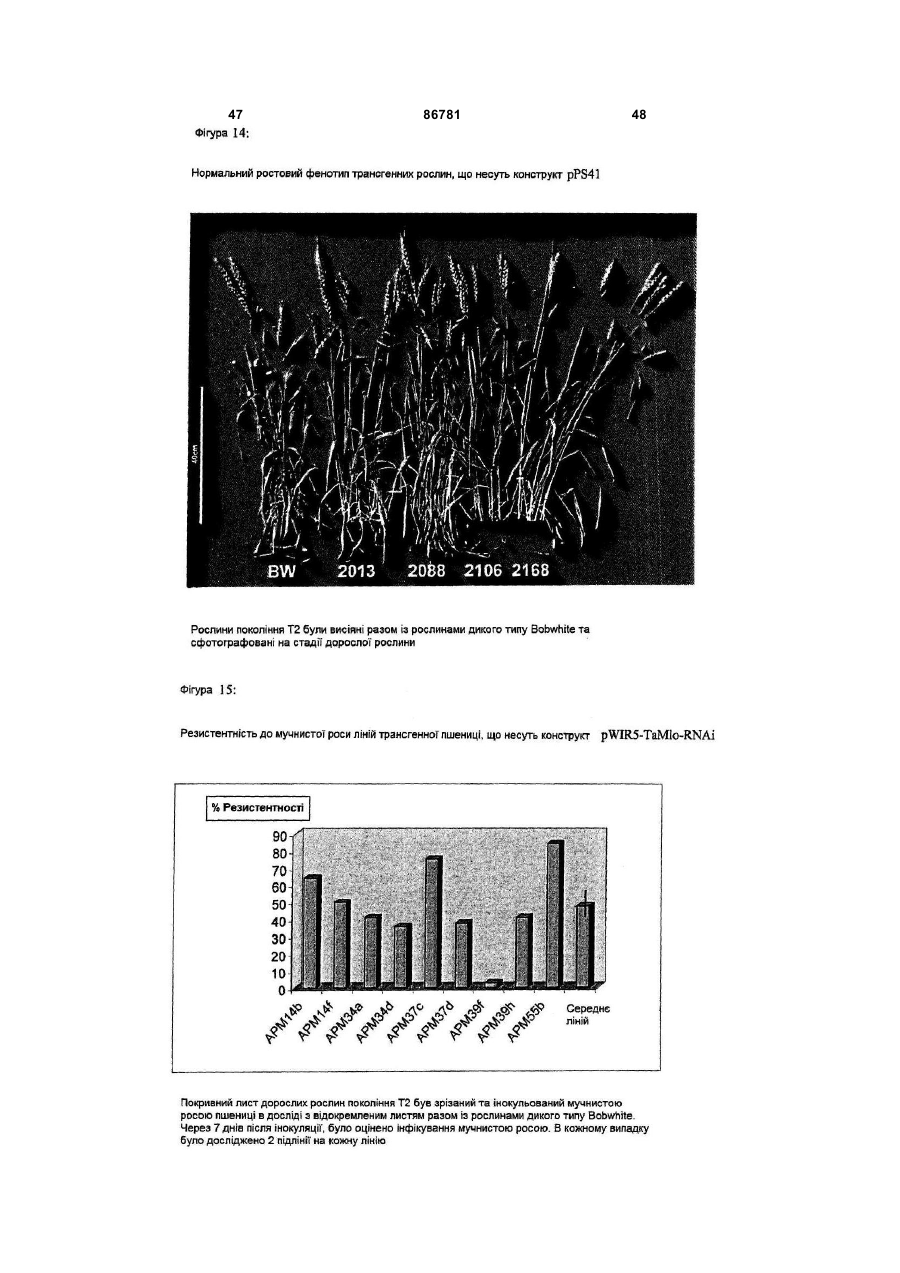
c) регенерацію цілої трансформованої рослини та, при бажанні, розмноження рослин.
6. Трансгенні рослини, які містять рекомбінантну молекулу нуклеїнової кислоти за пунктом 3 або 4 або одержані способом за пунктом 5, а також трансгенні частини цих рослин та їх трансгенний розмножувальний матеріал, такий, як протопласти, рослинні клітини, калус, насіння, бульби або живці, а також трансгенні нащадки цієї рослини.
7. Трансгенні рослини за пунктом 6, які являють собою однодольні рослини.
8. Трансгенні рослини за пунктом 7, які являють собою Роасеае.
9. Трансгенні рослини за пунктом 8, які являють собою пшеницю або ячмінь.
Текст
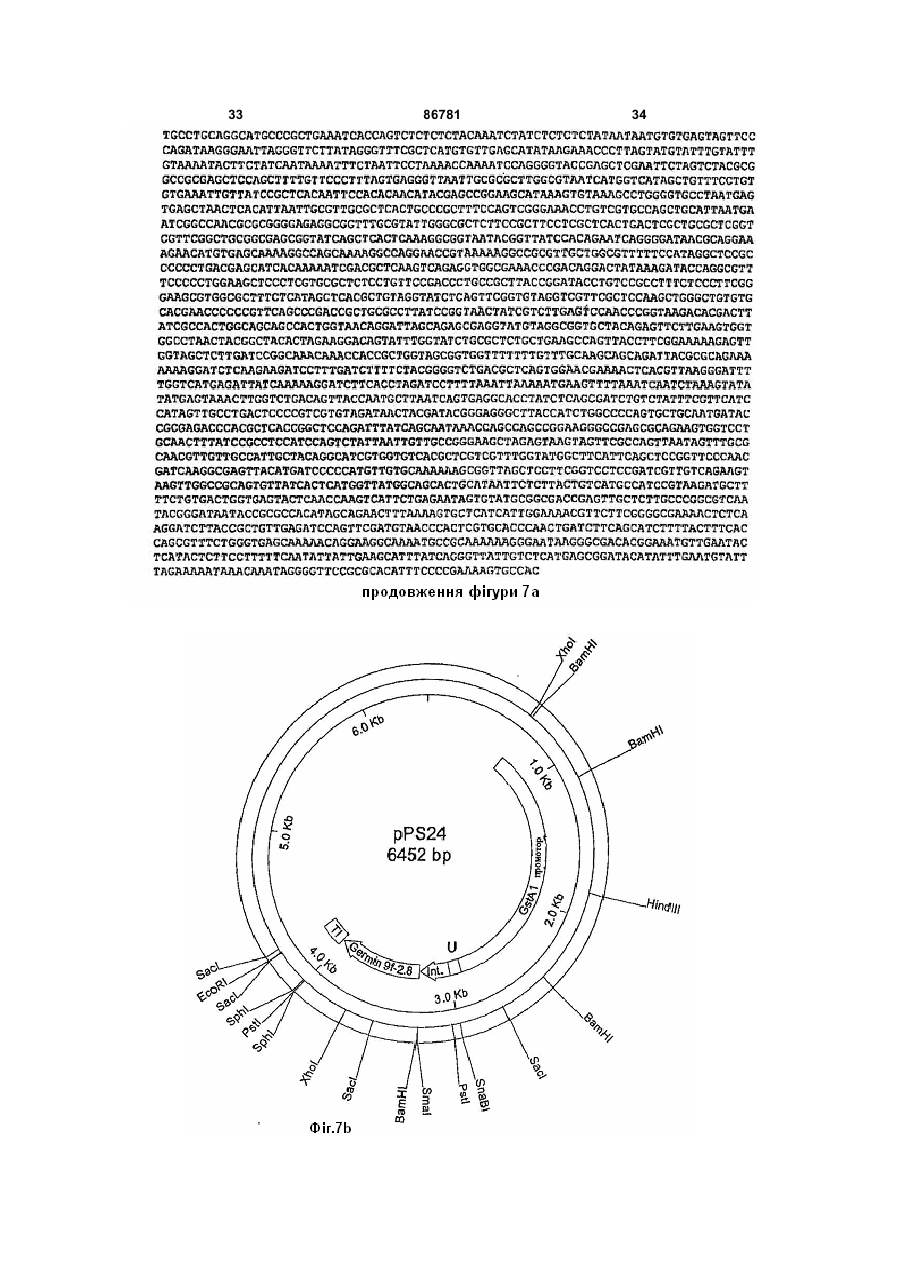
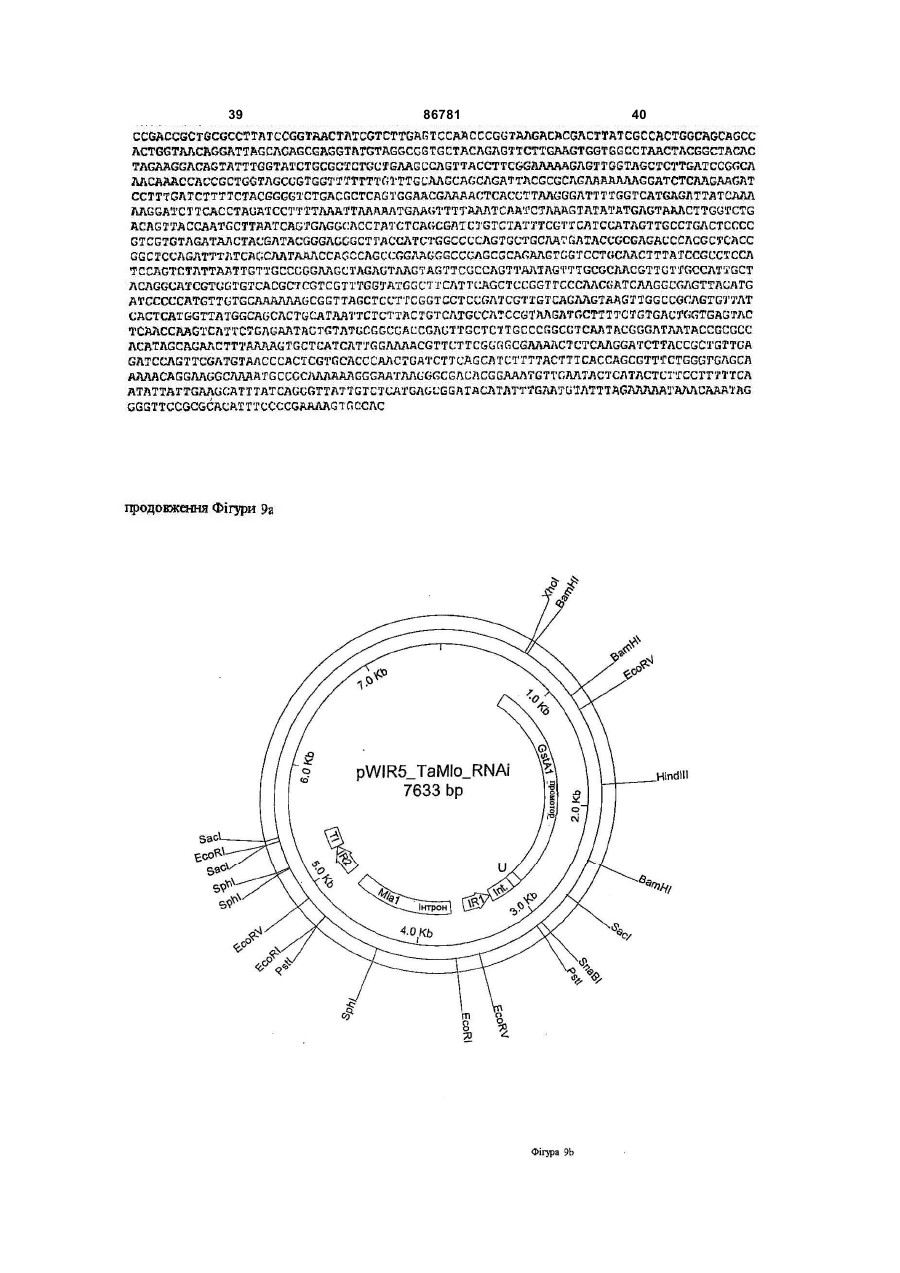
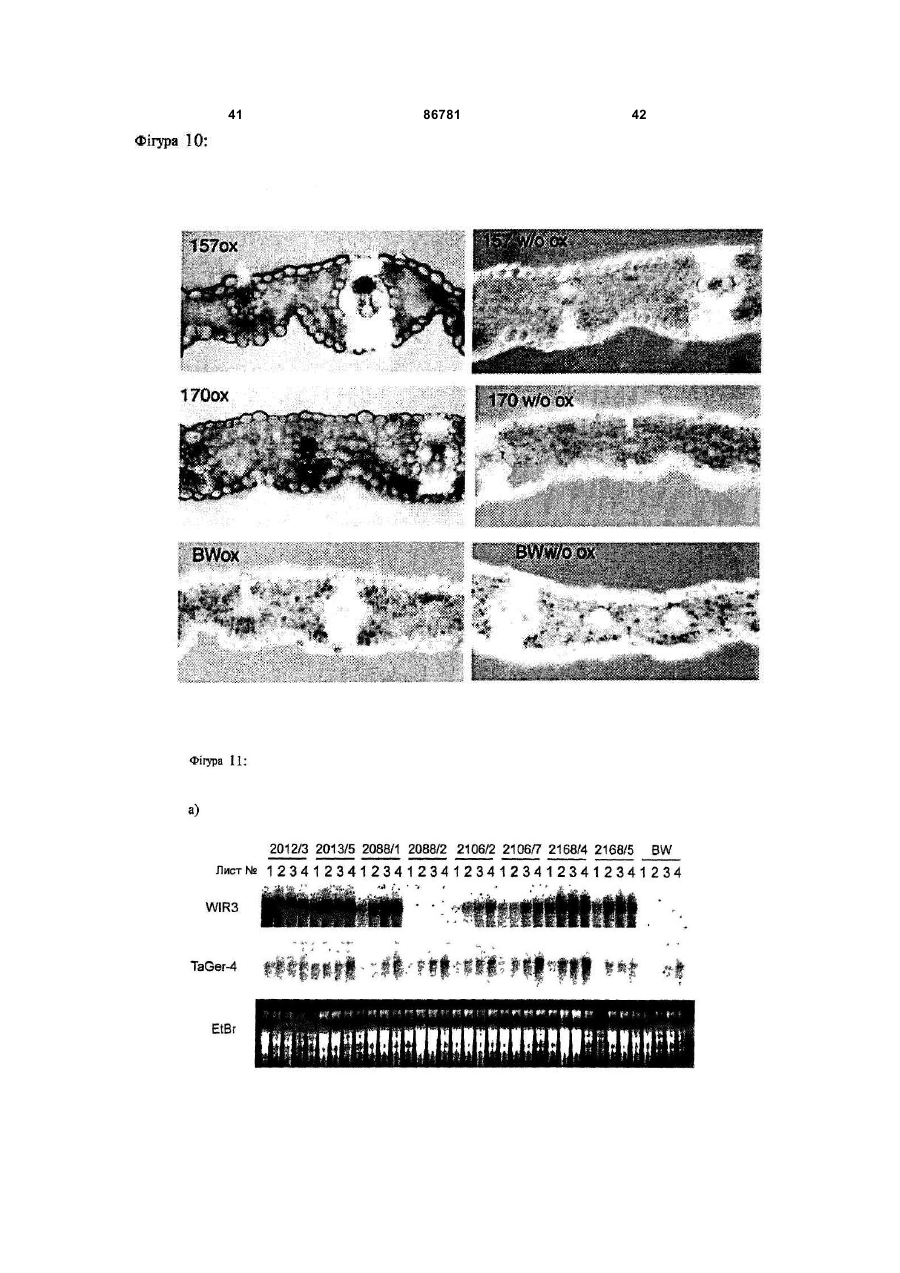
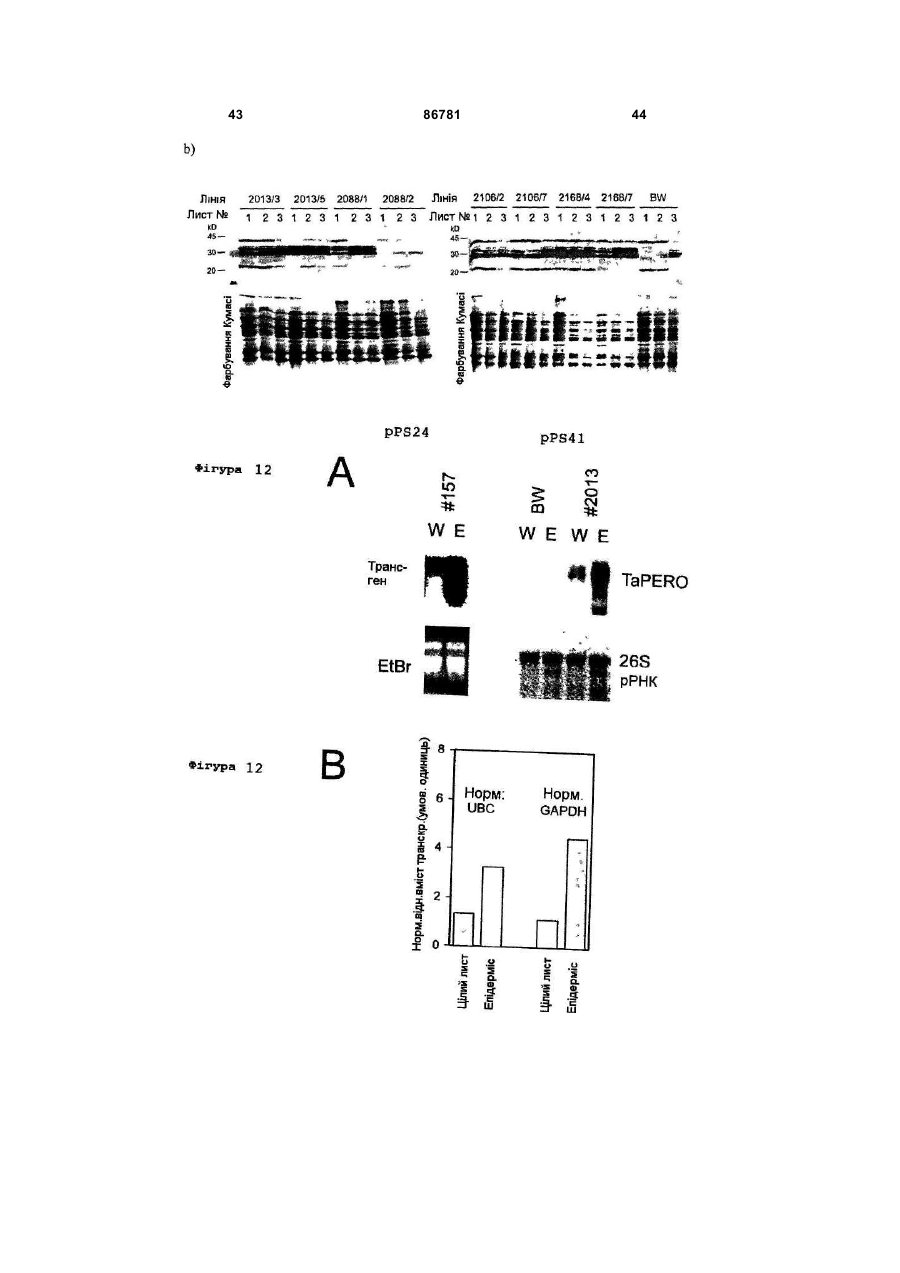
1. Промоторний регіон зі специфічністю до рослинного епідермісу, що включає першу послідовність, що походить із промотору гену GSTA1 та являє собою SEQ ID No 1, та другу послідовність, що походить із інтрону гену WIR1a та являє собою SEQ ID No 2, причому перша послідовність та/або друга послідовність промоторного регіона має ідентичність послідовності від щонайменше 90 % з промоторними послідовностями, наведеними в SEQ ID No 1 та/або SEQ ID No 2. 2. Промоторний регіон за пунктом 1, який відрізняється тим, що його вибрано з групи, яка складається з: a) промоторних регіонів, які включають послідовності нуклеїнової кислоти, вказаної в SEQ ID No 3, C2 2 UA 1 3 86781 4 послідовностей нуклеїнових кислот або трансгенів, сіннєспецифічні, бульбоспецифічні та специфічні які можуть сприяти резистентності до патогенів, а для плодів промотори. Промотори, що індукуються також рослин та рослинних клітин, трансформоваможуть бути активовані наприклад хімічною індукних цими молекулами нуклеїнових кислот та споцією, індукцією світлом або іншими активаторами. собів їх одержання. Бажаним також є модулювати експресію гену Як промотори, в цілому позначено ті ДНКспецифічно в епідерміс. Епідерміс представляє ділянки гену, які розташовані вище точки початку собою покривну тканину поверхневих органів витранскрипції та якими регулюється момент ініціації щих рослин. Як таке, завдання епідермісу полягає та частота ініціації транскрипції та, таким чином, в тому, щоб з одного боку забезпечувати водо- та інтенсивність експресії та тип експресії контрольомасообмін рослини та, з іншого боку, перешкоджаваного гену. До промоторів приєднується РНКти проникненню патогенів у рослини. Ці функції полімераза та специфічні, активовані РНКможуть бути цілеспрямовано модульовані шляхом полімеразою фактори транскрипції для того, щоб зміни генної експресії у епідермісі за допомогою ініціювати транскрипцію разом з основним транспідходящих промоторів та генів, що ними регулюкрипційним комплексом. Ефективність промоторів ються. часто підвищують та регулюють додатковими ДНКУ дводольних рослин вже були описані епідепослідовностями, такими як енхансерні послідоврміс-специфічні промотори. Так могло бути поканості, розташування яких на відміну від промоторів зано, що промотор CER6- (CUT1-) гена із Arabiне регламентоване. Ці регуляторні елементи моdopsis, що кодує конденсаторний фермент синтезу жуть знаходитись вище, нижче або в інтроні гену, воску, може спричиняти епідермісспецифічну ексщо повинен бути експресований. пресію репортерного гену n-глюкуронідази (Hooker В технології рекомбінантних ДНК промотори et al. (2002), Significance of the expression of the вводять в експресійні вектори, для того, щоб регуCER6 condensing enzyme for cuticular wax producлювати експресію трансгену, котрий як правило не tion in Arabidopsis, Plant Physiol. 129(4), S. 1568є природно регульованим цим промотором геном. 1580; Kunst et al. (2000), Expression of the waxПри цьому це суттєво залежить від специфічності specific condensing enzyme CUT1 in Arabidopsis, промотору, яка визначає, в який момент, в якому Biochem. Soc. Trans. 28(6), S. 651-654). типі тканини і з якою інтенсивністю експресуватиТим не менш досі не вдалося ідентифікувати меться ген, перенесений за допомогою методів придатні епідермісспецифічні промотори в одногенної інженерії. дольних рослинах, які є особливо придатними для В рослинництві часто використовується техекспресії трансгенів однодольних, особливо Роанологія рекомбінантних ДНК для того, щоб пересеае (злаків). Тому дотепер для того, щоб експреносити певні корисні властивості в технічні культусувати протеїн у епідермісі, використовували конри, що повинно приводити до підвищення врожаю, ститутивні промотори, такі, як убіквітиновий наприклад за рахунок підвищення стійкості до папромотор із кукурудзи (дивись наприклад Oldach et тогенів, або до покращення властивостей врожайal. (2001), Heterologous expression of genes mediatної продукції. При цьому часто є бажаним, щоб ing enhanced fungal resistance in transgenic wheat, перенесений ген експресувався не всюди, а тільки Моl Plant Microbe Interact. 14(7), S. 832-838). Одв тих тканинах, в яких є бажаною трансгенна актинак, як описано вище, це може призводити до невність, так як присутність трансгенного продукту в бажаних побічних ефектів у трансгенних рослин іздеяких тканинах може призводити до негативного за присутності трансгенного продукту й в інших впливу на нормальні фізіологічні процеси. Так мотканинах або органах крім епідермісу. гло бути приблизно показано, що надекспресія Звідси, завданням винаходу є виготовлення аніонної пероксидази під контролем діючого всюди засобу, який забезпечить епідермісспецифічну 35S-промотору призводить до зів'янення трансекспресію генів у однодольних рослин, переважно генних рослин тютюну, так як відбувається змену зернових культур. шення росту коренів та із-за цього утворюється Це завдання вирішується шляхом представменша кількість коренів (Lagrimini et al. (1997) The лення форм здійснення винаходу, охарактеризоconsequence of peroxidase overexpression in transваних у формулі винаходу. genic plants on root growth and development. Plant Таким чином, даний винахід стосується проМоl Biol. 33 (5), S. 887-895). Надекспресія sрі2моторного регіону зі специфічністю до рослинного пероксидази під контролем схожого діючого всюди епідермісу, що включає першу послідовність, що убіквітинового промотору призводить до зниження походить з промотору гену глутатіон-Sформування епікотилю та зменшення росту у довтрансферази А1 (GSTA1), та другу послідовність, жину порівняно з контрольними рослинами (Elfщо походить з інтрону гену WIR1a. GSTA1 стосуstrand, M. et al. (2001) Overexpression of the enється генів, як вони описані в Dudler et al. (1991), A dogenous peroxidase-like gene spi 2 in transgenic pathogen-induced wheat gene encodes a protein Norway spruce plants results in increased total perhomologous to glutathione-S-transferases, Моl. Plant oxidase activity and reduced growth. Plant Cell ReMicrobe Interact. 4(1), S. 14-18. Зокрема ці гени ports 20 (7), S. 596-603). He дивлячись на негативпредставляють собою гени пшениці, однак також ний вплив на фізіологічні процеси часто буває вони можуть представляти собою гомологічні гени необхідним, щоб трансгенний продукт був також з інших зернових культур, перш за все, з ячменю, присутнім у частинах рослин, які заготовлюються. зі схожим характером експресії та аналогічним Тому в минулі роки було виділено промотори, генним продуктом. WIR1a позначає гени, як вони які діють або тканиноспецифічно або індуковано. описані в Bull et al. (1992), Sequence and expresДо тканиноспецифічних промоторів належать наsion of a wheat gene that encodes a novel protein 5 86781 6 associated with pathogen defense, Моl. Plant Miвдвічі, переважно, щонайменше в п'ять разів, та crobe Interact. 5(6), S. 516-519. особливо бажано, щонайменше десятикратно і Переважно, перша послідовність представляє найбільш бажано у п'ятдесят разів порівняно з собою SEQ ID No 1 та друга послідовність предіншими типами клітин. Рівень експресії може бути ставляє собою SEQ ID No 2. визначений звичайною in situ-технологією. Між першою та другою послідовностями моПоняття „рослинний епідерміс" є відомим для жуть також розташовуватися нетрансльовані пофахівця. Додаткова інформація може бути знайслідовності, які мають довжину від 10bр (пар осдена у будь-якій книзі з анатомії або фізіології ронов) до 1000bр, переважно від 20bр до 800bр, слин, як зокрема в Strasburger, Lehrbuch der особливо переважно від 30bр до 500bр та найBotanik, 35. Auflage 2002, Spektrum Akademischer більш переважно між 40bр та 300bр. Verlag. Особливо бажано коли промоторний регіон Було несподівано виявлено, що промоторний згідно з винаходом представляє собою промоторрегіон, який містить як регуляторну послідовність з ний регіон, вибраний з групи, що складається з: GSTA1-гену пшениці, так і інтронну послідовність з a) промоторних регіонів, які містять послідовWIR1a-гену пшениці, викликає епідермісспецифічність нуклеїнової кислоти, наваденої в SEQ ID No ну експресію кодуючої послідовності нуклеїнової 3; кислоти, що знаходиться під його контролем. b) промоторних регіонів, які містять функціоКрім промоторного регіону, який має послідовнальну частину послідовності нуклеїнової кислоти, ність нуклеїнової кислоти, представленої в SEQ ID наведеної в SEQ ID No 3 або No 3, запропонований винахід стосується також c) промоторних регіонів, які мають послідовпромоторних регіонів, які мають функціональні ність, яка гібридизується у жорстких умовах гібричастини цієї послідовності та які викликають в росдизації з послідовністю нуклеїнової кислоти, вкалинах епідермісспецифічну експресію контрольозаною в SEQ ID No 3. ваної ними кодуючої послідовності нуклеїнової В межах представленого винаходу під промокислоти. торним регіоном розуміють послідовність нуклеїПід „функціональною частиною" розуміють у нової кислоти, яка містить регуляторну послідовзв'язку з цим послідовності, при яких не дивлячись ність, необхідну для експресії кодуючої на дещо відмінну послідовність нуклеїнової кислопослідовності (трансгену). Регуляторні послідовти транскрипційний комплекс ще зв'язується та ності утворюють ту частину гену, яка визначає може досягатися епідермісспецифічна експресія. експресію кодуючої послідовності, а значить, перш Функціональні частини промоторної послідовності за все, рівень експресії та тип експресії. Регулятомістять також такі промоторні варіанти, промоторрні послідовності містять щонайменше один мотив на активність якиху порівнянні з диким типом є послідовності до якого приєднуються специфічні послабленою або підсиленою. Під функціональтранскрипційні фактори та РНК-полімераза, для ною частиною розуміють зокрема також природні поєднання у транскрипційний комплекс та ефектиабо синтетичні варіанти послідовності промоторвно ініціюють транскрипцію послідовності нуклеїного регіону, представленого в SEQ ID No 3. Мунової кислоти, контрольованої промоторним регіотації включають заміщення, додавання, делеції, ном. заміни та/або вставки одного або більшої кількості Промоторні регіони згідно з винаходом базунуклеотидних залишків. Функціональні частини ються на спостереженні, що шляхом злиття пропромоторних регіонів включають в межах предстамотору GSTA1-гену пшениці з інтронними послідовленого винаходу варіанти SEQ ID No 3 природновностями WIR1a-гену пшениці можуть бути го походження а також синтетичного, наприклад, одержані промотори з новими властивостями. нуклеотидні послідовності, одержані за допомогою При аналізі активації репортерного гену в лисхімічного синтезу. тках пшениці з І-глюкоронідазним-(GUS)-геном з Е. Промотор, що використовується, містить у косоlі у якості репортерного гену, було протестовано жному випадку ТАТА-бокс (положення 2163 - 2169 різноманітні комбінації WIR1a-промотору та у SEQ ID No 1 та 3) та бажано також два СААТWIR1a-інтрону та GST-промотору. Несподівано бокси (положення 1047 -1051 або 1895 - 1899 у виявилося, що GST-промотор та WIR1a-інтрон SEQ ID No 1 та 3). Далі, у промоторі міститься щопроявляють синергетичний ефект на активність найменше один, переважно, щонайменше два або репортерного гену. Підвищення транскрипційної три, особливо бажано, щонайменше чотири, п'ять активності було сумірним з транскрипційною актиабо шість, та найбільш бажано сім та вісім наступвністю, що досягається неспецифічним експресуних мотивів послідовностей: ючим 358-промотором. a) GTGGGGG Під поняттям „епідермісспецифічний" у межах b) ACGTGGA представленого винаходу розуміють, що послідовc) ТССАССТ ність нуклеїнової кислоти, яка знаходиться під конd) TATCCAT тролем промоторного регіону згідно з винаходом e) CATGCATG експресується в епідермісі пагонів рослин. Зокреf) TGTAAAG ма, епідермісспецифічність у сенсі представленого g) CCTACCA винаходу також присутня тоді, коли промоторний h) AATAGTA регіон згідно з винаходом сприяє переважній ексПереважно, мотиви послідовностей знахопресії стороннього гену в епідермісі порівняно з дяться у позиціях, які відповідають наступним поіншими типами клітин, та в епідермісі досягається зиціям у SEQ ID No 1 та 3: значне підвищення експресії, як то щонайменше -а)185-191та217-223bр 7 86781 8 -b) 455-461bр жуть бути досягнуті шляхом додавання дестабілі-с) 508-514bр зуючих агентів, таких як, наприклад формамід. -d) 564-570bp Придатні жорсткі умови гібридизації описують-e) 1514-1521bр ся також, наприклад, в Sambrook et al., дивись ви-f) 1520-1526bp ще. Таким чином, гібридизація може відбуватися -g)1569-1575bp приблизно при наступних умовах: -h)1610-1616bp - буфер гібридизації: 2х SSC, 10х розчин ДенВизначити промоторну активність варіантів харда (фікол 400 + ПЕГ + БСА; співвідношення промоторного регіону можна за допомогою марке1:1:1), 0,1% SDS, 5 мМ EDTA, 50 мМ Na2HPO4, 250 рних генів, кодуюча послідовність яких знаходитьмкг/мл ДНК сперми оселедця; 50 мкг/мл тРНК або ся під контролем промоторного регіону, який треба 0,25 М натрійфосфатного буферу рН 7,2, 1 мМ дослідити. Підходящими маркерними генами є, EDTA, 7% SDS при температурі гібридизації від наприклад, Р-глюкуронідазний-(GUS)-ген з Е. соlі, 65°С до 68°С ген флюоресценції, як зокрема ген зеленого флу- буфер для відмивання: 0,2х SSC, 0,1% SDS оресцентного білку(GFP) із Aequoria victoria, ген при температурі відмивання від 65°С до 68°С. люциферази з Photinus pyralis або Переважно, такі промоторні варіанти мають галактозидазний-(ІасZ)-ген з Е. соlі. Абсолютна ідентичність послідовності від щонайменше 50%, промоторна активність визначається шляхом поріпереважно, щонайменше 70%, особливо переважвняння з активністю рослин дикого типу. Тканинна но, щонайменше 90% та найбільш бажано, щоабо клітинна специфічність легко визначається найменше 95% з промоторною послідовністю, нашляхом порівняння рівнів експресії зазначених веденою в SEQ ID No 3 або з її частинами вище маркерних генів у відповідних тканинах або відносно цілої ДНК-послідовності, представленої в клітинах. SEQ ID No 3. Переважно, ідентичність послідовноПредставлений винахід стосується також простей такого роду промоторних послідовностей вимоторних регіонів з послідовністю нуклеїнової кисзначають шляхом порівняння з послідовністю нуклоти, яка гібридизується при жорстких умовах гіблеїнової кислоти, наведеної в SEQ ID No 3. Якщо ридизації з послідовністю нуклеїнової кислоти, дві послідовності нуклеїнової кислоти різної довпредставленою в SEQ ID No 3. Поняття „гібридижини порівнюють одна з одною, ідентичність позація при жорстких умовах" у контексті цього винаслідовностей стосується переважно процентної ходу означає, що гібридизація in vitro проводиться частки нуклеотидних залишків короткої послідовв умовах, які є достатньо жорсткими, для того, ності, які є ідентичними з відповідними нуклеотидщоб забезпечити специфічну гібридизацію. Такі ними залишками довгої послідовності. жорсткі умови гібридизації є відомими фахівцеві та Ідентичність послідовностей визначається можуть бути взяті з літератури (Sambrook et al. звичайним чином з використанням різноманітних (2001), Molecular Cloning: A Laboratory Manual, 3. порівняльних програмам таких, як, наприклад, Auflage, Cold Spring Harbor Laboratory Press, Cold CLUSTAL. Загалом, для визначення ідентичності Spring Harbor, New York). послідовностей у розпорядження фахівцеві предУ загальному значенні "специфічно гібридизуставлені придатні алгоритми, наприклад, загальється" означає, що молекула у жорстких умовах нодоступною є програма під переважно приєднується до певної нуклеотидної http://www.ncbi.nlm.nih.gov/BLAST (наприклад, попослідовності, якщо ця послідовність має у комсилання „Standard nucleotide-nucleotide BLAST плексній суміші (наприклад цілу) ДНК або РНК. [blastn]"). Поняття „жорсткі умови" застосовується в цілому Ступінь вказаної вище для SEQ ID No 3 продля умов, при яких послідовність нуклеїнової кисцентної ідентичності є дійсним так само для перлоти гібридизується переважно з її цільовою пошої та другої послідовностей промоторних регіонів слідовністю, та зовсім незначною мірою або зовсім згідно з винаходом, які наведені в SEQ ID No 1 та не гібридизується з іншими послідовностями. Жо2. рсткі умови є частково залежними від послідовноУ одній з переважних форм здійснення винасті та за різних обставин бувають різними. Довші ходу промоторний регіон згідно з винаходом має послідовності гібридизуються специфічно при виповну послідовність, наведену в SEQ ID No 3 із щих температурах. В цілому, жорсткі умови підби2552 нуклеотидів. ралися таким чином, що температура знаходилася Представлений винахід стосується також хиблизько 5nС нижче термічної точки плавлення мерних генів із оперативно зв'язаних промоторних (Тm) для специфічної послідовності при визначерегіонів згідно з винаходом та кодуючої послідовній іонній силі та визначеному рН. Тm - це темпеності, експресія якої, природнім чином не регулюратура (при певній іонній силі, рН та концентрації ється промоторними регіонами згідно з винаходом, нуклеїнових кислот), при якій з цільовою молекуі яка в химерному гені регулюється промоторними лою у стані рівноваги гібридизується 50% молекул, регіонами згідно з винаходом, а також стосується комплементарних до цільової молекули. Типово, рекомбінантних молекул нуклеїнових кислот, які жорсткі умови є такими, при яких концентрація солі містять ці химерні гени. складає щонайменше приблизно 0,01 - 1,0 М конВираз „послідовність нуклеїнової кислоти, ексцентрації іонів натрію (або інша сіль) при рН між пресія якої регулюється промоторними регіонами 7,0 та 8,3, та температура дорівнює щонайменше згідно з винаходом" означає, що експресія послі30°С для коротких молекул (означає наприклад довності нуклеїнової кислоти під контролем про10-50 нуклеотидів). Додатково, жорсткі умови момоторного регіону згідно з винаходом може бути підвищена у клітинах, у яких промоторний регіон є 9 86781 10 активним, щонайменше на коефіцієнт п'ять, переклітинах та рослинах промотор-залежну експресію важно щонайменше на коефіцієнт 10 та особливо молекули нуклеїнової кислоти, що знаходиться під бажано щонайменше на коефіцієнт 50 у порівнянні контролем промоторного регіону згідно з винахоз клітинами дикого типу. дом. У переважній формі реалізації рекомбінантна Послідовність нуклеїнової кислоти, експресія молекула нуклеїнової кислоти згідно з винаходом якої регулюється послідовністю нуклеїнової кислододатково містить транскрипційні термінаторні ти згідно з винаходом, може представляти собою послідовності. Під „транскрипційними термінаторкодуючий регіон трансгену, наприклад гену резисними послідовностями" розуміють при цьому потентності, генний продукт якого є бажаним в епіслідовності ДНК, які знаходяться на 3'- кінці кодудермісі. Експресією трансгену може бути підвищеючої послідовності та викликають припинення но вміст кодованого ним генного продукту транскрипції РНК-полімеразою. щонайменше на коефіцієнт 2, переважно, щонайДалі винахід стосується способу одержання менше на коефіцієнт 5, особливо бажано, щонайтрансгенних рослин з епідермісспецифічною ексменше на коефіцієнт 10 та найбільш бажано, щопресією послідовності нуклеїнової кислоти, що найменше на коефіцієнт 50. регулюється промоторним регіоном згідно з винаПромоторний регіон згідно з винаходом може ходом, який включає етапи: однак бути також поміщений в РНКі-конструкти a) одержання рекомбінантної молекули нукледля РНК-інтерференції, для того, щоб досягти епіїнової кислоти, в якій промоторний регіон згідно з дермісспецифічного сайленсінгу певних генів, генвинаходом знаходиться в операбельному з'єднанні продукти яких в епідермісі повинні бути відсутні ні з кодуючою послідовністю, або присутні у незначній, порівняно зі звичайною, b) перенесення рекомбінантної молекули нуккількості. Звичайно, останнє може також бути долеїнової кислоти з а) у рослинні клітини та сягнуто за допомогою класичних антисенс- або c) регенерацію цілої трансформованої росликосупресорних конструктів з застосуванням прони та, при бажанні, розмноження рослин. моторних регіонів згідно з винаходом. СайленсінгДля приготування введення стороннього гену конструктами знижують експресію ендогенного у вищі рослини або їхні клітини у розпорядженні є гену щонайменше на 50%, переважно, щонаймевелика кількість векторів для клонування, які міснше на 70%, особливо переважно, щонайменше тять сигнал реплікації для Е. coli та маркерний ген на 90% та особливо переважно, щонайменше на для відбору трансформованих бактеріальних клі95%. тин. Наприклад, такими векторами є pBR322, pUCУ конструкті, який необхідно використовувати групи, М13mр-групи, pACYC184 та ін. Химерний для РНК-інтерференції, знаходяться зазвичай паген може бути введений у вектор по підходящим ліндромні ДНК-послідовності, які після транскрипсайтам рестрикції. Одержана плазміда потім викоції формують дволанцюгову РНК. Ця дволанцюгористовувалася для трансформації клітин Е. coli. ва РНК Dicer-ферментом процесується до Трансформовані клітини Е. coli культивували у коротких РНК-відрізків, які приєднуються до ендопідходящому середовищі та потім збирали та лізугенної РНК і розщеплення яких досягається за вали, та отримували знов плазміду. У якості методопомогою RISC (РНК-індукованого сайленсінгдів для аналізу одержуваних плазмідних ДНК в комплексу) (Hannon (2002) RNA interference, цілому використовувалися рестрикційні аналізи, Nature, Bd. 418, S. 244-251). гель-електрофорези та подальші біохімічні молеВплив ген-сайленсінг-конструктів на експресію кулярнобіологічні методи. Після кожної маніпуляції ендогенного гену може бути підтверджений за доплазмідна ДНК може розщеплюватися та одержапомогою молекулярно біологічних методів, які шиний з неї ДНК-фрагмент зв'язується з іншими ДНКроко застосовуються і добре відомі фахівцеві. Так, послідовностями. для дослідження рівня РНК у розпорядженні знаЯк уже згадувалося, для введення ДНК у росходяться нозерн-блотинг та метод ревертазнолинну клітину-хазяїн у розпорядження представполімеразної ланцюгової реакції, білок може бути лено велику кількість технічних прийомів, серед визначений вестерн-блотингом, імунофлюоресцеяких фахівець без труднощів може визначити концією або, якщо протеїн є ферментом, ферментжен раз підходящий метод. Ці технічні прийоми ними аналізами. включають трансформацію рослинних клітин за Під поняттям „трансген" у межах представледопомогою Т-ДНК з використанням Agrobacterium ного винаходу охоплено ті гени, генний продукт tumefaciens або Agrobacterium rhizogenes у якості яких повинен вироблятися у епідермісі або повизасобу для трансформації, злиття протопластів, нен пригнічуватися сайленсінгом генів. ін'єкції, електропорації, пряме генне перенесення Послідовність нуклеїнової кислоти, експресія виділеної ДНК в протопласти, введення ДНК за якої знаходиться під контролем промотору згідно з допомогою біолістичних методів а також інші можвинаходом, представляє собою переважно посліливості, які є вже добре розробленими за останні довність нуклеїнової кислоти, яка сприяє резистероки та належать до рутинних методів, що викоринтності до патогенів, так як епідерміс є першим стовуються фахівцем у сфері рослинної молекубар'єром, який повинен бути подоланий патогеном лярної біології або рослинної біотехнології. Біолопід час проникнення у рослину. гічні методи переносу генів застосовуються в У межах представленого винаходу під понятпершу чергу при однодольних рослинах. Фахівець тям „рекомбінантна молекула нуклеїнової кислоти" знайде корисну інформацію для виконання, наприрозуміють вектор, який містить химерний ген згідклад, в Vasil et al. (1992) Bio/Technology, 10, S. 667но з винаходом або промоторний регіон згідно з 674; Vasil et al. (1993) Віо Technology, 11, S. 1153винаходом, та який може викликати у рослинних 1158; Nehra et al. (1994) Plant J. 5, S. 285-297; 11 86781 12 Becker et al. (1994) Plant J., 5, S. 299-307; Altpeter нти стебел, коріння, а також протопласти або et al. (1996) Plant Cell Reports 16, S. 12-17; Ortiz et культивовані у суспензії рослинні клітини) у підхоal. (1996) Plant Cell Reports 15, S. 877-81; Rascoдящому середовищі, яке може містити антибіотик Gaunt et al. (2001) J. Exp. Bot. 52; S. 865-874. або біоцид для відбору трансформованих клітин, При ін'єкції та електропорації ДНК у рослинні можуть потім бути регенеровані знову цілі росликлітини, до плазмід, що використовуються, per se ни. не ставиться ніяких спеціальних вимог. Те саме є Якщо введена ДНК однократно інтегрована в справедливим для прямого переносу генів. Могеном рослинної клітини, то вона там як правило жуть бути використані прості плазміди, як напристабільна та залишається також в нащадках вихіклад pUC-похідні. дної трансформованої клітини. Вона містить як Однак із такого роду трансформованих клітин правило маркер для відбору, який обумовлює реповинні регенерувати цілі рослини, рекомендовазистентність трансформованих рослинних клітин ною є присутність придатного для відбору маркерпроти біоциду або антибіотику, як то канаміцин, G ного гену. Фахівцеві відомі широковживані селек418, блеоміцин, гігроміцин, метотрексат, гліфосат, тивні маркери (маркери для відбору), і для нього стрептоміцин, сульфонілкарбамід, гентаміцин або не виникає труднощів підібрати підходящий марфосфінотріцин та інші. Тому індивідуально підікер. браний маркер повинен дозволяти відбір трансЗалежно від способу введення жаданого гену формованих клітин від клітин, у яких відсутня ввев рослинні клітини, може існувати потреба у подадена ДНК. Крім того також є підходящими льших ДНК-послідовностях. Наприклад, для альтернативні маркери, як то маркери живлення трансформації рослинної клітини використовуєтьабо скринінг-маркери (такі як GFP, зелений флюося Ті- або Ri-плазміда, отже повинна бути зв'язана рисцирующий протеїн). Зрозуміло можна також щонайменше правий край, часто однак і правий і повністю відмовитись від селективних маркерів, лівий край Т-ДНК, що міститься у Ті- або Riщо зрозуміло призведе до дещо підвищеної скриплазміді як фланкуюча ділянка з введеними генанінгової недостатності. У випадку, якщо бажаними ми. Використовуючи для трансформації агробакє вільні від маркеру трансгенні рослини, фахівець терії, необхідно клонувати ДНК що вводять у спетакож має у своєму розпорядженні стратегії, які ціальні плазміди, а саме, або в проміжний, або в забезпечують додаткове видалення маркерного бінарний вектор. Проміжні вектори можуть бути гену, наприклад, котрансформацію або послідовінтегровані гомологічною рекомбінацією у Ті- або ність специфічну рекомбінацію. Ri-плазміду агробактерій на основі послідовносРегенерація трансгенних рослин із трансгентей, які є гомологічними до послідовностей у Тних рослинних клітин здійснюється за допомогою ДНК. Міститься крім того необхідний для переносу звичайних регенераційних методів з використанТ-ДНК vir-регіон. ням відомих поживних середовищ. Одержані таПроміжні вектори звичайно не можуть реплікуким чином рослини можуть бути потім досліджені ватися в агробактеріях. За допомогою допоміжної за допомогою звичайних способів, включаючи моплазміди проміжний вектор може бути перенесено лекулярнобіологічні методи, такі як PCR, блотна Agrobacterium tumefaciens (кон'югація). На проаналізи, на присутність та тканиноспецифічність тивагу цьому, бінарні вектори можуть реплікувативведеної послідовності нуклеїнової кислоти, ексся як в Е.соlі так і в агробактеріях. Вони включають пресія якої контролюється промотором згідно з селективний маркер та лінкер або полілінкер, котрі винаходом, або дослідженням РНК та білку, що вставлені в правий та лівий граничний регіон Тзнаходяться під її впливом. ДНК. Вони можуть бути трансформовані безпосеКрім того, винахід стосується трансгенних роредньо в агробактерії. Агробактерії, що є придатслин, які містять послідовність нуклеїнової кислоними у якості клітин-хазяїв повинні містити плазміти, яка регулюється промоторним регіоном згідно з ду, котра містить Т-ДНК з вміщеним у ній винаходом та яка експресується специфічно у епіхимерним геном, котрий переносять у рослинну дермісі. клітину. Може бути присутньою додаткова Т-ДНК. Рослини згідно з винаходом є переважно одТакі трансформовані Agrobakterium використовунодольними рослинами, зокрема такими зерновиють для трансформації рослинних клітин. Викорими культурами, як кукурудза та овес, особливо стання Т-ДНК для трансформації рослинних клітин бажано, пшеницею або ячменем, а також трансє широко дослідженим та в достатній мірі описане генними частинами цих рослин та їхнім трансгенв усіх відомих оглядових статтях та довідниках по ним розмножувальним матеріалом, таким, як протрансформації рослин. Для однодольних рослин топласти, рослинні клітини, калус, насіння, бульби для ефективного Agrobakterium-опосередкованого або живці, а також трансгенні нащадки цієї рослипереносу генів необхідно використовувати змінені ни. Однак також в інші Роасеае (злакові), як, напротоколи, як вони приблизно описані в Cheng et приклад, фуражні трави можуть бути введені проal. (1997) Plant Physiol. 115, S. 971-980; Khanna and моторні регіони згідно з винаходом для одержання Daggard (2003) Plant Cell Reports 21, S. 429-436; відповідних рослин з епідермісспецифічною ексWu et al. (2003) Plant Cell Reports 21, S. 659-668; пресією трансгенів. Hu et al. (2003) Plant Cell Reports 21, S. 1010-1019. Під контролем епідермісспецифічного промоДля перенесення ДНК у рослинну клітину рослинні тора згідно з винаходом можуть бути експресовані експлантати можуть культивуватися раціональним гени для продукування епікутикулярного воску, чином з Agrobacterium tumefaciens або для того, щоб підвищити стійкість рослин до висиAgrobacterium rhizogenes. З інфікованого рослинхання. Крім того під контролем промотора згідно з ного матеріалу (наприклад частини листків, сегмевинаходом для підвищення УФ-резистентності 13 86781 14 можуть бути експресовані гени продукування ангрибків у рослину. Це можна здійснити, наприклад, тоціанів або інших УФ-абсорбуючих речовин. Як за допомогою описаного вище РНКі-методу. Те, вже було викладено вище, експресують переважщо інтерференція експресії Mlo-гену є придатною но гени стійкості до патогенів під контролем продля запобігання проникненню грибка мучнистої мотору згідно з винаходом. роси в рослину, було показано in vitro на сегменЯк патогени, серед інших описані бактерії, вітах листків із ячменю, які бомбардували вольфраруси та грибки, які інфікують рослини та внаслідок мовими частинками, які були покриті МІо-длРНК цього негативно впливають на обмін речовин рос(Schweizer et al. (2000), Double-stranded RNA interлин. feres with gene function at the single-cell level in ceДо цих рослинних патогенів належать грибки, reals, The Plant Journal, 24 (6), S. 895-903). Тим не які у зернових культур таких, як пшениця та ячмінь менш до цих пір не могло бути показано, що епісеред інших викликають захворювання справжньої дермісспецифічна інтерференція Mlo-експресії в мучнистої роси та Halmbruchk-захворювання. Ці трансгенних рослинах має подібний ефект. захворювання можуть послужити причиною значНаступними рослинними генами, які сприяють них втрат прибутків (до 50%) в залежності від інтевзаємодії патогену з рослиною та в наслідок цього нсивності ураження. можуть спричиняти проникнення патогену у росТрадиційно зі згаданими вище, а також подалину є, наприклад, транспортер амінокислот або льшими рослинними грибковими захворюваннями цукрів або інвертази. Ці гени є підходящими також борються шляхом застосування фунгіцидів, які для здійснення сайленсінгу генів. Таким чином мають відомі недоліки, такі як проникнення у ґрунпредставлений винахід стосується способу одертові води та накопичення у харчовому ланцюгові. жання патогенрезистентних рослин, який включає У останні роки однак також ідентифіковано деетапи: які гени, які можуть обумовлювати резистентність a) одержання рекомбінантної молекули нуклепроти певних або декількох збудників. Поняття їнової кислоти, в якій промотор згідно з винаходом „обумовлювати резистентність до патогенів", як знаходиться в операбельному з'єднанні з молекуйого тут застосовують, означає, що рослини, у лою нуклеїнової кислоти, яка обумовлює стійкість яких підвищена експресія згаданих генів, у порівдо патогену, нянні з рослинами, у яких експресія згаданих генів b) перенесення рекомбінантної молекули нукє нормальною, є менш чутливими до інфікування леїнової кислоти з а) у рослинні клітини та визначеними патогенами. До генів, які обумовлюc) регенерацію цілої трансформованої рослиють патогенний захист, належать також такі гени, ни та, при бажанні, розмноження рослин. експресія яких запускається при зараженні патогеПереважно, послідовність нуклеїнової кислоти, ном. що обумовлює резистентність до патогенів предДо цих генів відносяться пероксидази та оксаставляє собою кодуючий регіон пероксидазного латоксидази. Оксалатоксидази, які відносяться до або оксалат-оксидазного гену або, послідовність, сімейства гермінартних протеїнів, каталізують окияка інтерферує з ендогенною МІо-РНК. слення оксалату, внаслідок чого утворюється пеНаступні приклади служать для пояснення вироксид водню. Пероксид водню діє мікробіцидно находу та не повинні розумітися як такі, що обмета може викликати лігніфікацію клітинних стінок, жують винахід. внаслідок чого запобігається проникнення шкідниРисунки: ків. Крім того це може викликати в незначних кон1) послідовність нуклеїнової кислоти GSTA1центраціях гіперчутливу загибель клітин. Пероксипромотору (SEQ ID No 1) дази використовують для клітинного окислення 2) послідовність нуклеїнової кислоти WIR1aсубстрату та внаслідок цього для знезараження інтрону (SEQ ID No 2) або молекулярний кисень, або пероксид водню. 3) послідовність нуклеїнової кислоти переважПатогени, проти яких експресія оксалатного промоторного регіону (SEQ ID No 3) оксидаз та пероксидаз в епідермісі рослин може 4) послідовність нуклеїнової кислоти TAPERO обумовлювати резистентність, включають напри(пероксидаза) кДНК (SEQ ID No 4) клад: справжню мучнисту росу, Fusarium spp., 5) TAPERO-експресійний вектор pPS41 Rynchosporium secalis та Pyrenophora teres. a) послідовність нуклеїнової кислоти (SEQ ID Наступними генами, які в змозі обумовлювати No 5) стійкість до патогенів є хітинази, Аg-AFP, GSTA1 b) векторна карта тa WIR1a. 6) послідовність нуклеїнової кислоти Germin Експресією послідовності нуклеїнової кислоти, 9f-2.8 (оксалат-оксидаза) кДНК (SEQ ID No 6) яка кодує ці ферменти в епідермісі трансгенних 7) Germin-експресійний вектор pPS24 рослин за допомогою промоторних регіонів згідно a) послідовність нуклеїнової кислоти (SEQ ID з винаходом можуть бути одержані рослини зі No 7) стійкістю до патогенів. b) векторна карта На противагу генам, що обумовлюють резис8) послідовність Mlo-RNAi-конструкту (SEQ ID тентність до патогенів, існують також власне росNo 8) линні гени, які сприяють проникнення патогену. До 9) Mlo-RNAi-експресійний вектор pWIR5-TaMloних належить Mlo-ген, який кодує SiebenRNAi трансмембранний рецептор, який очевидно сприяє a) послідовність нуклеїнової кислоти (SEQ ID проникненню грибка мучнистої роси у епідерміс. У No 9) цьому випадку є доцільним інтерферувати експреb) векторна карта сію МІо-гену для того, щоб запобігти проникненню 15 86781 16 10) In situ оксалат-оксидазна активність в дорослих рослин відрізали та інокулювали мучнирРS24-трансгенних рослинах стою росою пшениці в „detached leaf assay", разом Листя Bobwhite рослин дикого типу Bobwhite з рослинами дикого типу Bobwhite. 7 днів після (BW) та трансгенних ліній №157 та №170 розрізаінокуляції оцінювали ураження мучнистою росою. ли упоперек та in situ підтверджували оксалатСереднє значення з 3 незалежних експериментів оксидазну активність, ліва колонка = реакція з окпо інокуляції з рослинами Т2 та Т3 генерацій. Субсалат-субстратом; права колонка = контрольна лінія 2088/2 не експресувала TAPERO та не мала реакція без оксалат-субстрату. Інтенсивне фіолепідвищеної резистентності. Середнє значення тове забарвлення вказує на оксалатоксидазну "non-silenced" = середнє значення із всіх ліній крім активність у епідермісі трансгенних ліній. 2088/2 та всіх експериментів. 11) Виявлення TAPERO-трансгену в pPS4114) Ріст паростків рРS41-трансгенних рослин трансгенних рослинах Рослини Т2 генерації висівали разом з рослиa) в Northern Blot нами дикого типу Bobwhite та фотографували на Виявлення накопичення TAPERO РНК шляхом стадії дорослих рослин. гібридизації WIR3 проби при Northern blots із 15) Дослідження стійкості до мучнистої роси трансгенних ліній пшениці Т2 генерації, яка несе pWIR5-TaMlo-RNAi-трансгенних рослин конструкт pPS4. Аналізували по 2 сублінії із 4 відіПокриваючий листок дорослих рослин Т2 гебраних ліній плюс дикий тип (BW) на стадії дороснерації відрізали та інокулювали мучнистою росою лих рослин. Листок 1 = покриваючий лист. Листя 2пшениці в „detached leaf assay", разом з рослина4 = більш старі. TaGer-4 зонд гібридизувався з ми дикого типу Bobwhite. 7 днів після інокуляції групою стрес-індукованих генів пшениці та викориоцінювали ураження мучнистою росою. Тестували стовувався для тестування плейотропних побічних по 2 сублінії на лінію. явищ TAPERO-надекспресії. Не було виявлено Приклади: ніякого побічного впливу. EtBr = контроль гелів, У наступних прикладах проводились стандарзабарвлений бромідом етидію. тні молекулярнобіологічні методи, такі як трансb) у Western Blot формація Е.соlі, рестрикційне розщеплення, лігуВиявлення накопичення TAPERO-протеїну за вання, виділення ДНК, ПЛP(PCR) та інші, як вони є допомогою реакції антитіл на Western Blots трансвідомими з рівня техніки згідно Sambrook et al. генних ліній пшениці Т2 генерації, яка несе конс(2001), vide supra. Для всіх PCR-реакцій використрукт pPS41. Трансгенний продукт TAPERO має товувалася „корегуюча" Pwo полімераза (Roche). очікуваний розмір 31 kD. В Bobwhite, листок 3, мо1) Одержання промоторного конструкту з жна спостерігати підвищену базальну активність GSTA1-промотору та WIR1a-інтрону (pPS18) TAPERO-гену. Листок 1 = покриваючий лист. БарОдержання здійснювалося багатостадійно чевник кумасі = контроль гелів, забарвлений кумасі рез наступні конструкти-попередники: pPS1, pPS3, голубим R250. pPS15. Всі конструкти містили GUS репортерний 12) Виявлення епідермісспецифічної трансген, для можливості їх тестування безпосередньо генної експресії в транзиторних дослідженнях. А) методом Northern Blot pPS1: Виявлення накопичення оксалатоксидазної Промоторний фрагмент 1.9 kb гену WIR1a ви(зліва) та TaPERO (справа)-мРНК в епідермісі лисрізали Pstl із рекомбінантного pBluescript клону та тків трансгенних рослин, які несуть pPS24- або клонували в Pstl-місце розриву експресійної касети pPS41 -конструкт зі специфічнмими зондами. W = перед GUS-геном. Експресійна касета базувалася РНК із цілого листка; Е = РНК із епідерміса листка. на pBluescript та містила GUS-ген, що слідує за EtBr = гель, забарвлений бромідом етидію як конттермінатором транскрипції GSTA1-гену пшениці. роль; 26S РНК = постгібридизація блотів з зондом Так як GUS-ген та GSTA1-термінатор транскрипції проти 26S рибосомальної РНК як контроль. вже не містилися у кінцевому конструкті, що викоB) методом Real-time reverse PCR ристовувався (дивись приклад 2), від детального Визначали концентрацію TaPERO мРНК в ціопису цієї експресійної касети відмовилися. Кінцелому листку та епідермісі трансгенної лінії № 2013 вий конструкт містив трансляційне WIR1a::GUS (трансформованої конструктом pPS41). Дані станзлиття. дартизували за допомогою контрольних генів UBC pPS3: (убіквітин-конюгуючий фермент) та GAPDH (гліцеЗ використанням адапторного праймеру 5' ральдегід-фосфат дегідрогеназа), які конститутивATA TAT CTG CAG GGA GCC ACG GCC GTC САС но експресуються. Експресія, яка залишається в та 5' ТАТ ССС GGG CCC GTG ССТ GGA CGG GAA цілому листку, походить від не знятого верхнього виготовляли PCR фрагмент із приблизно 240 bр та листкового епідермісу та з флоеми (побічна активкінці якого різали Smal та Pstl (на адапторі). PCR ність промотору). „матрицею" служив геномний клон WIR1a. PCRC) методом Real-time reverse PCR фрагмент містив останні 15 амінокислот першого Аналізували рослини дикого типу (Bobwhite) та екзону WIR1a та інтрон, включаючи „splice site" трансгенні лінії №2013 та №2151 (трансформовані акцептор та лігований в pPS1, розрізаний Pstl (чаpPS 41-конструктом) на стадії дорослих рослин. стковий) та Smal а також очищений агарозним Промотор експресувався перш за все в листки та електрофорезом. Одержаний конструкт містив колоски. В стеблі та коріннях трансген експресуватрансляційне WIR1a::GUS злиття з WIR1 інтроном вся тільки слабо, або не експресувався. перед GUS геном. До того ж була введена делеція 13) Дослідження стійкості до мучнистої роси амінокислот №18-35 першого екзону WIR1a, для рРS41-трансгенних рослин Покриваючий листок 17 86781 18 запобігання секреції WIR1a::GUS злитого протеїну TAPERO-геном (Асс. №Х56011), під контролем (шляхом видалення сигнального пептиду). GstAl-промотору, в якому оксалат-оксидазний ген pPS15: був замінений на TAPERO-ген. Як pPS24, pPS41 WIR1a-промотор заміщували PCRмістив термінатор транскрипції CamV 35S гену. фрагментом GSTA1-промотору. З цією метою с) Експресійний вектор pWIR5-TaMlo-RNAi pPS3 переварювали з Xhol та SnaBI (частковий) та (експресія Mlo-RNAi-конструкту під контролем очищували векторну смужку агарозним електропромотору згідно з винаходом) форезом. GSTA1-промоторний фрагмент приблиСпочатку виділяли субклонований у вектор зно 2.3 kb довжиною ампліфікували з адапторним pGEM-Teasy 3. інтрон гену резистентності МІа1 із праймером 5'АТА ТАТ СТС GAG ТСТ AGA ACT ячменю (приблизно 1.1 kb) за допомогою EcoRI та AGT GGA ТСС та 5'АТА ТАТ ТАС GTA GTT TGT Pstl та лігували в так само EcoRI та Pstl розрізаний CCG TGA ACT TCA з геномного клону GSTA1 за вектор pBSw41 (pBluescript-похідна з частковою допомогою PCR та різали на кінцях Xhol та SnaBI. ТаМІо1 кДНК, клонована Candace Elliott в межах її PCR -фрагмент лігували з гелелюйованою pPS3 дисертації; GenBank номер доступу AF361933). Із смужкою, в результаті трансляційного злиття інтцього конструкту виділяли інтрон МІа1 разом з ронвмісного WIR1a генного фрагменту з GUS, під частиною кодуючої послідовності ТаМІо1-гену у контролем GSTA1 промотору. вигляді приблизно 1.55 kb Pstl/Mscl-фрагменту (= pPS18: фрагмент 1). Паралельно цьому ампліфікували pPS15 перетравлювали Pstl та SnaBI (часткофрагмент розміром приблизно 450 bр за допомовий), векторну смужку очищали агарозним електгою PCR із плазміди pBSw41 олігонуклеотидом Т3 рофорезом та лігували з двонанцюговим олігонку(стандартна праймерна послідовність для леотидом (5'GTA CAC AGG CAG СТА GCT СТС pBluescript) та ТаМІо1-1 (5' GTC GCA TGC CTG GAA ACC TCG СТС GAA ACG СА плюс 5'САТ GTG ТСС АСА CGA ААТ GTG С 3', Sphl сайти рестрикТСС GTC GAT CGA GAG СТТ TGG AGC GAG СТТ ції підкреслено). Далі PCR-фрагмент перетравлюTGC GT). Заміщувалася частина гену WIR1a при / вали рестрикційними ферментами Pstl та Sphl (= трансляційному старті (46 bр вище до 53 bр нижче фрагмент 2). Вектор pPS24 (промотор + оксалатпочатку трансляції) з 42 bp 5'UTR WIR1a-гену крім оксидаза, дивись вище) розмикали за допомогою кодону ініціювання трансляції ATG. Кінцевий консрестрикційного перетравлення Smal та Sphl та трукт містив транскрипційне злиття інтронвмісного відкидали вирізаний оксалат-оксидазний генний WIR1a-генного фрагменту з GUS, під контролем фрагмент. Потім у трикомпонентному лігуванні GSTA1 промотору. лігували описані вище фрагменти 1 та 2 в 2) Одержання конструктів, що застосовуються Smal/Sphl розрізаний вектор pPS24. При цьому a) Експресійний вектор pPS24 (оксалатлігуванні кінці Mscl та Smal розрізаних компонентів оксидазна експресія під контролем промотору згіє сумісними, так як обидва представляють собою дно з винаходом) так звані „тупі кінці" (blunt ends). Одержаний консФрагмент Hindlll/Sphl gf-2.8-reHy пшениці довтрукт (pTaMlo1 RNAi) містить приблизно 300 bр жиною 745 bр (оксалат-оксидаза; Асе. № М63223), гену ТаМІо1 а також приблизно 150 bр полілінякий містить відкриту рамку зчитування (ORF) субкер/адаптор-послідовності у вигляді „інвертованого клонували у рослинну експресійну касету pGY1, повтору", відділений МІа1-інтроном. Контроль цієї що дає конструкт pGermin (описується в Schweizer транскрипційної одиниці підпорядкований промоet al., 1999. Для цього клонування оксалаттору GstA1. оксидазний фрагмент лігували в проміжний векПримітка: Описаний тут як ТаМІо1 ген з істотор, для того, щоб можна було лігувати фрагмент ричних причин отримав пізніше позначення ТаМІза допомогою сайтів рестрикції ВаmНІ та Pstl в оА1 (Elliott et al., 2002). Моl. Plant Microbe Interact. pGY1. Із pGermin лігували фрагмент Smal/EcoRI 15: 1069-1077 (2002). приблизно 1 kb довжиною, який містить оксалаток3) Трансформація рослин пшениці сидазний ген та термінатор CamV 35S, в Рослини пшениці (культивар Bobwhite) вироSmal/EcoRI-розрізаний та очищений агарозним щували у фітокамерах 40 днів при 15°С протягом електрофорезом вектор pPS18. Одержаний консдня та 12°С вночі в умовах короткого дня (10h/d, трукт містив транскрипційне злиття інтронвмісного близько 600 mЕ) та надалі в теплиці при 18/16°С та генного фрагменту WIR1a з оксалатоксидазним щонайменше 16-годинному фотоперіоді. Колоски геном під контролем промотору GstAl На відміну або безпосередньо використовували, або зберігавід pPS18 конструкт вже містив не термінатор ли до 5 днів при 4°С. Видалені з колосків зернівки транскрипції GstA1, a CamV 35S гену. поверхнево стерилізували протягом 2 хвилин 70% b) Експресійний вектор pPS41 (TAPEROетанолом та далі від 15 до 20 хвилин в 5% розчині експресія під контролем промотора згідно з винагіпохлориту натрію/ 0,1% Tween 20 та на заверходом) шення чотири рази промивали стерильним бідисІз pWIR3 (містить транскрипційне злиття між тилятом (Aqua bidest). промлтором CamV 35S та TAPERO; Schweizer et Недозрілі ембріони величиною від 0,5 до 1,5 al., 1999) виділяли TAPERO-фрагмент довжиною мм відпрепаровували із зернівок у стерильних приблизно 1.2 kb рестрикційним перетравленням умовах та клали у чашки Петрі щитком наверх на Smal та Pstl. TAPERO-фрагмент лігували у вектор калусіндукуюче середовище (основне середовище pPS24, перетравлений Smal та Pstl (частковий) та за Murashige Skoog (1962) з 2 мг/л 2,4-D, 40 г могоочищений агарозним електрофорезом. В резульгідрату мальтози, 500 мг/л L-глутаміну, 100 мг/л таті цього отримували транскрипційне злиття інгідролізату казеїну, 5 mM CuSO4 та 0,25% трон-вмісного генного фрагменту WIR1a з Phytagel). Культури інкубували при 25°С у темноті. 19 86781 20 На п’ятий - сьомий день після видалення ембекспресією оксалат-оксидази мали забарвлені у ріонів здійснювалася біолістична трансформація. фіолетовий колір клітинні стінки. За чотири - шість годин до бомбардування частин5) Виявлення TAPERO-трансгену в рРS41ками майже проліферуючі ембріони переносили на трансгенних рослинах методом Northern-Blot нове середовище зі зниженим водним потенціаЛистки Bobwhite та рРS41-трансгенних рослин лом (як вказано вище, доповнене 0,3 М манітолом) Т2 генерації (по приблизно 1 г сирої ваги, FG), та інкубували при 25°С в темноті. обидві на стадії покриваючого листа, гомогенізуПлазміда рАНС20 (Christensen and Quail 1996), вали у рідкому азоті, до утворення мілкого порошяка містить bar-ген, що кодує фосфінотріцинацеку. Порошок додавали до 3 мл РНК-екстракційного тилтрансферазу, змішувалив молярному співвідбуферу (0,5 М Tris-CI рН 8,0; 0,25 М Na-EDTA; 5% ношенні 1:1 з вектором для котрансформації. (в/О) SDS) та 1,5 мл фенолу у насиченому буфері Всього осаджували далі 10 мкл плазмідного ДНК(15 мл пластикові пробірки) та добре збовтували. розчину на частинку із 25 мкл 60 мг/л суспензії Екстракт центрифугували 30 хв. при 4000 об/хв золота. Для бомбардування наносили 30 мкг час5000 об/хв, 20°С (swing out, Heraeus Varifuge). Дотинку в 5 мкл етанолі на макроносій. Бомбардудавали 1,5 мл хлороформу (без відливання надовання здійснювалося згідно з даними виробника садової рідини) та пробірку декілька разів інвертуDuPontPDS-1000/He. вали. Екстракт центрифугували 30 хв. при 4000 Через 12-16 годин після бомбардування часоб/хв - 5000 об/хв, 20°С та над осадову рідину тинками, експлантати переносили на нове калусіобережно відливали в нову пробірку (15 ml пласндукуюче середовище (як для попередньої культикова пробірка). РНК осаджували додаванням 3 тури ембріонів) та інкубували 10 днів при 25°С в мл 6 М LiCI (протягом ночі, 4°С). Осаджену РНК темноті. центрифугували 30 хв при 12500 об/хв, 4°С Калуси після цього переносили на середовище (Festrotor, Hermle Z360K), осад РНК відновлювали для диференціації (базове середовище за Muraв 500-1000 мкл 70% етанолу (РНК не розщеплювалася) та переносили в пробірки Eppendorf. Проshige and Skoog (1962) з 20 г/л сахарози, 5 mM би центрифугували 10 хв при 14000 об/хв, 4°С CuSO4, 0,25% Phytagel та 3 мг/л Bialaphos) та інку(Festrotor, Eppendorf Centrifuge 5417R) та відділяли бували при 16-годинному фотоперіоді при 200 mЕ супернатант. РНК-центрифугат висушуали 5 хв та 25°С. при 37°С, в 100 мкл-200 мкл ТЕ aufgenommen та Після 2 тижнів здійснювалося перенесення карозчиняли 5-10 хв при 75°С. Денатуруючий гель лусу, що не потемнів на середовище для регенеелектрофорез РНК в формальдегідвмісних гелях рації (базове середовище за Murashige and Skoog та перенесення на нейлонові мембрани (Hybond (1962) з 20 г/л сахарози, 0,25% Phytagel та 4 мг/л N, Amersham) здійснювали згідно зі стандартним Bialaphos) та подальше інкубування з 16-годинним протоколом (Sambrook et al., vide supra). Вносили фотоперіодом при 200 mЕ та 25°С. 10 мкг РНК на кожну пробу. Після наступних 2 тижнів утворені патостки Радіоактивне маркування D 32P-dCTP здійсроз'єднували, переносили у культуральні пробірки нювали методом „random prime labelling" з викориз регенераційним середовищем та культивували станням набору (Roche). Гібридизування здійснюдалі з 16-годинним фотоперіодом при 200 mЕ та вали протягом ночі при 65°С в CHURCH буфері 25°С. (0,5 М фосфат Na рН 7,2; 1 % (м/о) БСА; 7 % (м/о) Ідентифікація трансгенних регенератів здійсSDS; 1 мМ Na2ETDA). Блоти промивали 2 х 15 хв у нювалася РАТ-тестом на активність екстрактів з розчині для промивання (0.1 х SSC; 0,1 5 м/о) листя згідно Spencer et al. (1990) або ампліфікаціSDS) при 65°С та після цього експонували протяєю трансгенспецифічних послідовностей з геномгом 16-48 годин перед Phosporimagerної ДНК рослин-кандидатів та/або Southern Blot з пластинками. Експоновані пластинки сканували використанням відповідного зонду. пристроєм Phosphorimager (FujiFilm FLA 3000) та Трансформаційна ефективність методу залеяк дисплейний файл переводили у TIFF формат. жала від якості вихідного матеріалу між 0,5 - 3 6) Виявлення TAPERO-трансгену в рРS41трансгенними рослинами на 100 культивованих трансгенних рослинах методом Western-Blot ембріонів. Верхівки листків Bobwhite та рРS414) In situ оксалат-оксидазна активність в ространсгенних рослин Т2 генерації, обидві на стадії линах з рР524-конструктом покриваючого листа, гомогенізували в IWF буфері Листкові сегменти рослин дикого типу Bob(32 мМ фосфату Na; 84 мМ цитрату; рН 2.8; на white або рР524-трансгенних рослин пшениці Т3 кінчику шпателю полівінілполіпірролідону). Гомогенерації просякували під вакуумом оксалат оксигенат центрифугували протягом 15 хв при 13.000 даза-індикаторним розчином (2,5 мМ щавелевої об/хв та 4°С. Над осадову рідину змішували з 0,5 кислоти, 3,5 мМ вільного EDTA, 0,6 мг/мл 4-хлор-1г/мл ацетату амонію та розчинний у кислоті білок нафтолу, 50 мкг/мл пероксидази хрону, 20% об. осаджували протягом ночі при 4°С. Білок центриетанолу, Tris буфер при рН 4,0) та інкубували профугували 30 хв при 13000 об/хв та 4°С. Білковий тягом ночі при +37°С. Після видалення індикаторцентрифугат відновлювали в 50 мкл/g FG ресусного розчину листки інкубували подальші 24 годипензійного буферу (50 мМ Tris-CI рН 7,5; 20 % (об.) ни при +4°С в Н2О. Після цього листки скальпелем гліцерину). До 20 мкл проби додавали 5 мкл 4вручну поперечно розрізали на тонкі сегменти та кратного концентрованого SDS пробного буферу, розглядали під мікроскопом. Фазово-контрастна та проби змішували з настільки (1-5 мкл) насичесвітлова мікроскопія проводилася на Zeiss ним Tris-розчином, поки не відбувалася зміна заAxiophot при 100-кратному збільшенні. Клітини з барвлення бромфенолового голубого на голубий. 21 86781 22 На кожну полосу відділяли 12,5 мкл термообробльну половину листової пластинки відрізали та леної проби в денатуруючому SDSпереносили на 0,5% (м/о) фітоагар, з вмістом 20 поліакриламідному гель-електрофорезу (15% розррm бензимідазолу, розміщували в полікарбонатділяючий гель) стандартним методом з викорисних чашках величиною 20 х 20 см. На чашку помітанням Minigel-апарату фірми Bio-Rad. Після елекщали трансгенну сублінію (по 20 листків) плюс трофорезу гелі фарбували кумасі (як контроль) дикий тип Bobwhite (по 6 листків). Листкові сегменабо переносили за стандартною методикою на ти інокулювали спорами мучнистої роси в інокулянітроцелюлозну мембрану. Мембрани інкубували ційній колоні, в яку задували спори з 4 сильно іноза стандартною методикою з первинними поліклокульованих листків пшениці в колоні. Через 5 хв. нальними антитілами (розведення 1:2000), до білчашки видаляли, закривали та інкубували при ку Рrх8 із ячменю (білок, гомологічний з TAPERO), 20°С та непрямому денному освітленні. Сім днів що походить від вторинного антитіла (розведення після інокуляції оцінювали зараження мучнистою 1:2000), до кролячих антитіл та зв'язаним з лужросою з використанням системи оцінювання за ною фосфатазою. TAPERO протеїнові смужки викласами (Schweizer et al., 1995). Резистентність являли локалізованою активністю лужної фосфаоцінювали відносно контрольних листків, розміщетази (BCIP/NBT розчин для забарвлення; готові них на відповідних фітоагарових пластинках. планшети(таблетки) (Roche)). Література: 7) Доведення епідермісспецифічної трансгенChristensen and Quail (1996) Transgenic Res. 5: ної експресії Northern-Blot-аналізом та Real-Time213-218. PCR-аналізом Elliott et al., (2002). Molecular Plant Microbe InЕкстракцію РНК та Northern-Blot-аналіз провоteractions 15: 1069-1077. дили як описано в прикладі 5. Real-Time-PCRMurashige and Skoog (1962) Physiologia PlantaAnalyse здійснювався LightCyclerD-приладом rum 15: 473-497. (Roche, Мангейм, Німеччина) згідно з даними виSchweizer, P., Vallelian-Bindschedler, L, and робника. Mosinger, E. (1995). Heat-induced resistance in bar8) Стійкість до мучнистої роси в pPS41- або ley to the powdery mildew fungus Erysiphe graminis pWIR5-TaMlo-RNAi-трансгенних рослинах f.sp. hordei, Physiological and Molecular Plant PaДля тесту на резистентність використовували thology 47, 51-66. дорослі, вирощені в теплиці pPS41-або pWIR5Schweizer, P., Pokorny, J., Abderhalden, O., and TaMlo-RNAi-трансгенні рослини пшениці з повнісDudler, R. (1999). A transient assay system for the тю розвиненими, недавно вирісшим покриваючим functional assessment of defense-related genes in листом. Контролем служили одночасно вирощені wheat, Моl Plant-Microbe Interacts, 647-654. рослини дикого типу культивару Bobwhite. АпікаSpencer et al. (1990) TAG 79: 625-631. 23 86781 24 25 86781 26 27 86781 28 29 86781 30 31 86781 32 33 86781 34 35 86781 36 37 86781 38 39 86781 40 41 86781 42 43 86781 44 45 86781 46 47 86781 48 49 86781 50 51 86781 52 53 86781 54 55 86781 56 57 86781 58 59 86781 60
ДивитисяДодаткова інформація
Назва патенту англійськоюPromoter for epidermis-specific transgenic expression in plants
Автори англійськоюSCHWEIZER PATRICK, DUDLER ROBERT, SCHULZE-LEFERT PAUL, PANSTRUGA RALPH
Назва патенту російськоюПромотор для эпидермис-специфической трансгенной экспрессии в растениях
Автори російськоюШвайцер Патрик, Дудлер Роберт, Шульце-Леферт Пауль, Панструга Ральф
МПК / Мітки
МПК: C12N 15/82
Мітки: рослинах, трансгенної, промотор, епідерміс-специфічної, експресії
Код посилання
<a href="https://ua.patents.su/44-86781-promotor-dlya-epidermis-specifichno-transgenno-ekspresi-v-roslinakh.html" target="_blank" rel="follow" title="База патентів України">Промотор для епідерміс-специфічної трансгенної експресії в рослинах</a>
Попередній патент: Спосіб задання коефіцієнта підсилення інваріантної активної схеми на операційному підсилювачі
Наступний патент: Застосування галоїдного похідного гідроксамової кислоти в лікуванні нейродегенеративних захворювань центральної нервової системи
Випадковий патент: Спосіб підвищення сорбційної здатності плівок-підкладок в електронній мікроскопії ентеровірусів