Похідні плевромутиліну для лікування захворювань, викликаних мікробами
Номер патенту: 97836
Опубліковано: 26.03.2012
Автори: Хейл-Майєр Вернер, Бадегрубер Рудольф, Булусу Атчіута Рама Чандра Мурті, Манг Роземарі, Новак Роджер, Ференцік Матіас, Стрікманн Дірк
Формула / Реферат
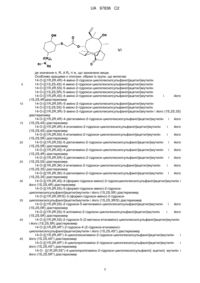
1. Сполука формули (І)
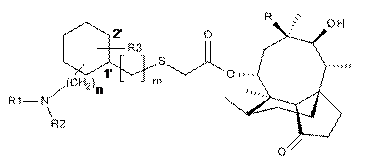 , (І)
, (І)
де
n дорівнює числу від 0 до 4;
m дорівнює 0 або 1, за умови, що атом сірки й R3 знаходяться у віцинальному положенні (якщо m = 0, тоді R3 знаходиться в положенні 2', а якщо m = 1, тоді R3 знаходиться в положенні 1');
R представляє етил або вініл;
R1 представляє атом водню або (С1-6)алкіл,
R2 представляє атом водню або
- (С3-6)циклоалкіл, або
- незаміщений (С1-6)алкіл, або
- (С1-6)алкіл, заміщений однією або декількома групами із числа таких, як
- гідрокси, переважно одна або дві,
- метокси,
- атом галогену,
- (С3-6)циклоалкіл, або
R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне гетероциклічне кільце, що містить щонайменше 1 атом азоту або 1 атом азоту і 1 додатковий гетероатом, наприклад, вибраний з N або О, або
R1 представляє гідрокси і R2 представляє форміл;
R3 представляє ОН, OR4, атом галогену, або
- за умови, що R3 приєднаний у положенні 2', R3 представляє -О-(СН2)р-О- з р рівним 2 або 3;
R4 представляє незаміщений (С1-6)алкіл або (С3-6)циклоалкіл.
2. Сполука формули (II)
 , (II)
, (II)
де значення n, R, R1, R2 й R3 ті ж, що зазначені в п. 1.
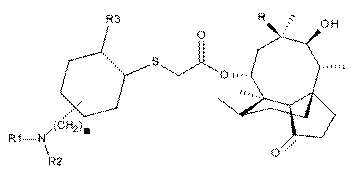
3. Сполука формули (III)
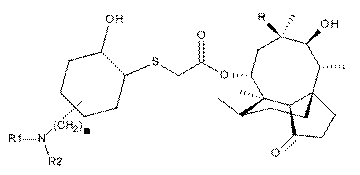 , (III)
, (III)
де значення n, R, R1 й R2 ті ж, що зазначені в п. 1.
4. Сполука формули (IV)
 , (IV)
, (IV)
де значення n, R1 й R2 ті ж, що зазначені в п. 1.
5. Сполука формули (V)
 , (V)
, (V)
де значення n, R1 й R2 ті ж, що зазначені в п. 1.
6. Сполука формули (VI)
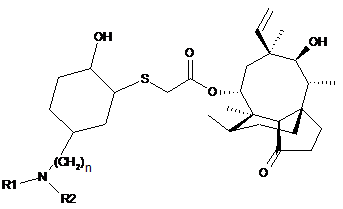 , (VI)
, (VI)
де значення n, R1 й R2 ті ж, що зазначені в п. 1.
7. Сполука за одним з пп. 1-6, вибрана, із групи, що включає
14-О-{[(1R,2R,4R)-4-аміно-2-гідроксициклогексилсульфаніл]ацетил}мутилін,
14-О-{[(1S,2S,4S)-4-аміно-2-гідроксициклогексилсульфаніл]ацетил}мутилін,
14-О-{[(1R,2R,5S)-5-аміно-2-гідроксициклогексилсульфаніл]ацетил}мутилін,
14-O-{[(1S,2S,5R)-5-аміно-2-гідроксициклогексилсульфаніл]ацетил}мутилін,
14-О-{[(1R,2R,4S)-4-аміно-2-гідроксициклогексилсульфаніл]ацетил}мутилін і його (1S,2S,4R)діастереомер,
14-O-{[(1R,2R,5R)-5-аміно-2-гідроксициклогексилсульфаніл]ацетил}мутилін,
14-O-{[(1S,2S,5S)-5-aмiнo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн,
14-O-{[(1R,2R,3R)-3-aмiнo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн i йoгo (1S,2S,3S)діастереомер,
14-О-{[(1R,2R,4R)-4-діетиламіно-2-гідроксициклогексилсульфаніл]aцeтил}мyтилiн і його (1S,2S,4S)діастереомер,
14-O-{[(1R,2R,4R)-4-eтилaмiнo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн і його (1S,2S,4S)діастереомер,
14-O-{[(1R,2R,5S)-5-етиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутилін і його (1S,2S,5R)діастереомер,
14-O-{[(1R,2R,5S)-5-дieтилaмiнo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн і його (1S,2S,5R)діастереомер,
14-О-{[(1R,2R,4S)-4-діетиламіно-2-гідроксициклогексилсульфаніл]aцeтил}мyтилiн і його (1S,2S,4R)діастереомер,
14-О-{[(1R,2R,5R)-5-діетиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутилін і його (1S,2S,5S)діастереомер,
14-О-{[(1R,2R,3R)-3-етиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутилін і його (1S,2S,3S)діастереомер,
14-О-{[(1R,2R,3R)-3-діетиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутилін і його (1S,2S,3S)діастереомер,
14-O-{[(1R,2R,4S)-4-(формілгідроксіаміно)-2-гідроксициклогексилсульфаніл]ацетил}мутилін і його (1S,2S,4R)діастереомер,
14-O-{[(1R,2R,5S)-5-(формілгідроксіаміно)-2-гідроксициклогексилсульфаніл]ацетил}мутилін і його (1S,2S,5R)діастереомер,
14-O-{[(1R,2R,3R/S)-3-(формілгідроксіаміно)-2-гідроксициклогексилсульфаніл]ацетил}мутилін і його (1S,2S,3R/S)діастереомер,
14-O-{[(1R,2R,5S)-2-гiдpoкcи-5-мeтилaмiнoциклoгeкcилcyльфaнiл]aцeтил}мyтилiн і йoгo (1S,2S,5R)діастереомер,
14-O-{[(1R,2R,5S)-5-aлiлaмiнo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн і йoгo (1S,2S,5R)діастереомер,
14-O-{[(1R,2R,5S)-2-гiдpoкcи-5-(2-мeтoкcіeтилaмiнo)циклoгeкcилcyльфaнiл]aцeтил}мyтилiн і його (1S,2S,5R)діастереомер,
14-O-{[(1R,2R,4R*)-2-гiдpoкcи-4-(2-гiдpoкcіeтилaмiнo)циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,4S*)діастереомер,
14-O-{[(1R,2R,4R*)-4-циклoгeкcилaмiнo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн i його (1S,2S,4S*)діастереомер,
14-O-{[(1R,2R,4R*)-4-циклoпpoпiлaмiнo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн i його (1S,2S,4S*)діастереомер,
14-O-{[(1R,2R,5S*)-4-циклoпpoпiлaмінo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн i його (1S,2S,5R*)діастереомер,
14-O-{[(1R,2R,4S*)-4-циклoпpoпiлaмінo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилін i його (1S,2S,4R*)діастереомер,
14-O-{[(1R,2R,5R*)-2-гiдpoкcи-5-мopфoлiн-4-iлциклoгeкcилcyльфaнiл]aцeтил}мyтилiн i його (1S,2S,5S*)діастереомер,
14-O-{[(1R,2R,5S*)-2-гiдpoкcи-5-мopфoлiн-4-iлциклoгeкcилcyльфaнiл]aцeтил}мyтилiн i його (1S,2S,5R*)діастереомер,
14-O-{[(1R,2R,5S)-5-aмінo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}-19,20-дигiдpoмyтилiн i його (1S,2S,5R)діастереомер,
14-О-{[(1R,2R,5S)-5-етиламіно-2-гідроксициклогексилсульфаніл]ацетил}-19,20-дигідромутилін і його (1S,2S,5R)діастереомер,
14-О-{[(1R,2R,5R)-5-аміно-2-гідроксициклогексилсульфаніл]ацетил}-19,20-дигідромутилін і його (1S,2S,5S)діастереомер,
14-О-{[(1R,2R)-4-амінометил-2-гідроксициклогексилсульфаніл]ацетил}мутилін і його (1S,2S)діастереомери,
14-О-{[5-аміно-2-хлорциклогексилсульфаніл]ацетил}мутилін,
14-О-{[4-аміно-2-хлорциклогексилсульфаніл]ацетил}мутилін,
14-О-[(4-аміно-1-гідроксициклогексилметилсульфаніл)ацетил]мутилін,
14-О-{[(1R,2R)-2-гідрокси-5-(3-метиламінопропіл)циклогексилсульфаніл]ацетил}мутилін і його (1S,2S)діастереомери,
14-О-{[(1R,2R)-2-гідрокси-4-(3-метиламінопропіл)циклогексилсульфаніл]ацетил}мутилін і його (1S,2S)діастереомери,
14-О-{[(1R,2R)-5-(3-амінопропіл)-2-гідроксициклогексилсульфаніл]ацетил}мутилін і його (1S,2S)діастереомери,
14-О-{[(1R,2R)-4-(3-амінопропіл)-2-гідроксициклогексилсульфаніл]ацетил}мутилін і його (1S,2S)діастереомер,
14-О-{[(6R,8R)-8-аміно-1,4-діоксаспіро[4.5]дец-6-илсульфаніл]ацетил}мутилін і його (6S,8S)діастереомер,
14-О-{[4-аміно-2-метоксициклогексилсульфаніл]ацетил}мутилін,
14-О-{[5-аміно-2-метоксициклогексилсульфаніл]ацетил}мутилін.
8. Сполука за будь-яким з пп. 1-7 у формі солі й/або сольвату.
9. Сполука за будь-яким з пп. 1-8 для використання як речовини лікарського засобу.
10. Спосіб лікування хвороб, викликаних мікробами, що включає введення суб’єктові, що потребує даного лікування, ефективної кількості сполуки за будь-яким з пп. 1-8.
11. Композиція лікарського засобу, що містить сполуку за будь-яким з пп. 1-8 у сполученні з щонайменше одним фармацевтичним ексципієнтом.
12. Композиція лікарського засобу за п. 11, що додатково містить інший фармацевтично активний агент.
Текст
Реферат: Винахід стосується сполук формули (І) R 2' OH O R3 (CH2)n R1 1' S m O N R2 O , (I) де n дорівнює числу від 0 до 4; m дорівнює 0 або 1, за умови, що атом сірки й R3 знаходяться у віцинальному положенні (якщо m = 0, тоді R3 знаходиться в положенні 2', а якщо m = 1, тоді R3 знаходиться в положенні 1'); R представляє етил або вініл; UA 97836 C2 (12) UA 97836 C2 R1 представляє атом водню або (С1-6)алкіл, R2 представляє атом водню або - (С3-6)циклоалкіл, або - незаміщений (С1-6)алкіл, або - (С1-6)алкіл, заміщений однією або декількома групами із числа таких, як - гідрокси, переважно одна або дві, - метокси, - атом галогену, - (С3-6)циклоалкіл, або R1 і R2 разом з атомом азоту, до якого вони приєднані, утворюють 5-7-членне гетероциклічне кільце, що містить щонайменше 1 атом азоту або 1 атом азоту і 1 додатковий гетероатом, наприклад, вибраний з N або О, або R1 представляє гідрокси і R2 представляє форміл; R3 представляє ОН, OR4, атом галогену, або - за умови, що R3 приєднаний у положенні 2', R3 представляє -О-(СН2)р-О- з р рівним 2 або 3; R4 представляє незаміщений (С1-6)алкіл або (С3-6)циклоалкіл. UA 97836 C2 Даний винахід стосується в органічних сполук, а саме, плевромутилінів. Плевромутилін, сполуки формули А 5 10 15 20 25 30 35 являє собою антибіотик природного походження, наприклад, утворений basidomycetes Pleurotus multilus і P. Passeckerianus, дивися, наприклад, The Merck Index, 13th edition, item 7617. Розроблено ряд додаткових плевромутилінів, що мають основну кільцеву структуру плевромутиліну, які містять заступники в гідроксильній групі, наприклад, як протимікробні речовини. З WO 02/04414 A1 відомі похідні плевромутиліну, наприклад, 14-О-[(аміноциклогексан-2-іл(і3-іл)-сульфаніл)-ацетил]-мутиліни; з WO 07/014409 A1 відомі, наприклад, 14-О-[(моно- або диалкіламіно)-циклоалкілсульфаніл)-ацетил]-мутиліни і з WO 07/000004 A1 відомі, наприклад, [((ацил-гідрокси-аміно)-циклоалкілсульфаніл)-ацетил]-мутиліни. Автори винаходу виявили плевромутиліни із цікавою дією в сполученні з несподіваною чудовою метаболічною стабільністю. Похідні плевромутиліну, відповідно до винаходу, являють собою сполуку формули (1) де n дорівнює числу від 0 до 4; m дорівнює 0 або 1, за умови, що атом сірки і R3 перебувають у вицинальному положенні (якщо m = 0, тоді R3 перебуває в положенні 2 , а якщо m = 1, тоді R3 перебуває в положенні 1); R представляє етил або вініл; R1 представляє атом водню або (C1-6)алкіл, R2 представляє атом водню або -(C3-6)циклоалкіл, або -незаміщений (C1-6)алкіл, або -(C1-6)алкіл, заміщений однією або декількома групами із числа таких, як - гідрокси, переважно одна або дві, - метокси, - атом галогену, - (C3-6)циклоалкіл, або R1 й R2 разом з атомом азоту, до якого вони приєднані, утворять 5-7 членне гетероциклічне кільце, що містить, щонайменше, 1 атом азоту або 1 атом азоту і 1 додатковий гетероатом, наприклад, обраний з N або О, або R1 представляє гідрокси і R3 представляє форміл; R3 представляє ОН, OR4, атом галогену, або - за умови, що R3 приєднаний у положенні 2', R3 представляє -О-(СН2)р-О- з р рівним 2 або 3; R4 представляє незаміщений (C1-6)алкіл або (C3-6)циклоалкіл. Кращі сполуки даного винаходу є сполуками формули (II) 1 UA 97836 C2 де значення n, R, R1, R2 й R3 ті ж, що зазначено вище. Більш кращі сполуки даного винаходу є сполуками формули (III) 5 є де значення n, R, R1 й R2 ті ж, що зазначено вище. Найбільш кращі сполуки даного винаходу - сполуки формули (IV) - сполуки формули (V) 10 і сполуки формули (VI) 2 UA 97836 C2 5 10 15 20 25 30 35 40 45 де значення n, R1 й R2 ті ж, що зазначено вище. Особливо кращими є сполуки, обрані із групи, що включає 14-О-{[(1R,2R,4R)-4-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін 14-О-{[(1S,2S,4S)-4-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін 14-О-{[(1R,2R,5S)-5-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін 14-О-{[(1S,2S,5R)-5-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін 14-О-{[(1R,2R,4S)-4-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,4R)діастереомер 14-О-{[(1R,2R,5R)-5-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін 14-О-{[(1S,2S,5S)-5-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін 14-О-{[(1R,2R,3R)-3-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,3S) діастереомер 14-О-{[(1R,2R,4R)-4-діетиламіно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,4S) діастереомер 14-О-{[(1R,2R,4R)-4-етиламіно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,4S) діастереомер 14-О-{[(1R,2R,5S)-5-етиламіно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,5R) діастереомер 14-О-{[(1R,2R,5S)-5-діетиламіно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,5R) діастереомер 14-О-{[(1R,2R,4S)-4-діетиламіно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,4R) діастереомер 14-О-{[(1R,2R,5R)-5-діетиламіно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,5S) діастереомер 14-О-{[(1R,2R,ЗК)-3-етиламіно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,3S) діастереомер 14-О-{[(1R,2R,ЗК)-3-діетиламіно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,3S) діастереомер 14-О-{[(1R,2R,4S)-4-(форміл-гідрокси-аміно)-2-гідроксциклогексилсульфаніл]ацетил}мутилін і його (1S,2S,4R) діастереомер 14-О-{[(1R,2R,5S)-5-(форміл-гідрокси-аміно)-2-гідроксициклогексилсульфаніл]ацетил}мутилін і його (1S,2S,5R) діастереомер 14-О-{[(1R,2R,3R/S)-3-(фopмiл-гiдpoкcи-aмiнo)-2-гiдpoкcициклогексилсульфаніл]ацетил}мутилін і його (1S,2S,3R/S) діастереомер 14-О-{[(1R,2R,5S)-2-гідрокси-5-метиламіно-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,5R) діастереомер 14-О-{[(1R,2R,5S)-5-аліламіно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,5R) діастереомер 14-О-{[(1R,2R,5S)-2-гідрокси-5-(2-метокси-етиламіно)-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,5R) діастереомер 14-О-{[(1R,2R,4R*)-2-гiдpoкcи-4-(2-гiдpoкcи-eтилaмiнo)циклогексилсульфаніл]ацетил}мутилін і його (1S,2S,4S*) діастереомер 14-О-{[(1R,2R,4R*)-4-циклoгeкcилaмiнo-2-гiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}мyтилiн і його (1S,2S,4S*) діастереомер 14-О-{[(1R,2R,4R*)-4-циклoпpoпiлaмiнo-2-гiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}мyтилiн і його (1S,2S,4S*) діастереомер 14-О- {[(1R,2R,5S*)-4-циклопропіламіно-2-гідрокси-циклогексилсульфаніл] ацетил} мутилін і його (1S,2S,5R*) діастереомер 3 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 14-О-{[(1R,2R,4S*)-4-циклопропіламіно-2-гідрокси-циклогексилсульфаніл]ацетил} мутилін і його (1S,2S,4R*) діастереомер 14-О-{[(1R,2R,5R*)-2-гiдpoкcи-5-мopфoлiн-4-iл-циклoгeкcилcyльфaнiл]aцeтил}мyтилiн і його (1S,2S,5S*) діастереомер 14-О-{[(1R,2R,5S*)-2-гiдpoкcи-5-мopфoлiн-4-iл-циклoгeкcилcyльфaнiл]aцeтил}мyтилiн і його (1S,2S,5R*) діастереомер 14-О-{[(1R,2R,5S)-5-aмiнo-2-гiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}-19,20-дигідромутилін і його (1S,2S,5R) діастереомер 14-O-{[(1R,2R,5S)-5-eтилaмiнo-2-гiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}-19,20дигідромутилін і його (1S,2S,5R) діастереомер 14-O-{[(1R,2R,5R)-5-aмiнo-2-гiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}-19,20-дигiдpoмyтилiн і його (1S,2S,5S) діастереомер 14-О-{[(1 R,2R)-4-aмiнoмeтил-2-гiдpoкcи-циклoгeкcилcyльфaнiл]ацетил} мутилін і його (1S,2S) діастереомер 14-О-{[5-аміно-2-хлор-циклогексилсульфаніл]ацетил}мутилін 14-О-{[4-аміно-2-хлор-цикл огексилсульфаніл]ацетил}мутилін 14-О-[(4-аміно-1-гідрокси-циклогексилметилсульфаніл)ацетил]мутилін 14-О-{[(1R,2R)-2-гiдpoкcи-5-(3-мeтилaмiнo-пpoпiл)-циклoгeкcилcyльфaнiл]aцeтил}мyтилiн і його (1S,2S) діастереомер 14-О-{[(1R,2R)-2-гідрокси-4-(3-метиламіно-пропіл) циклогексилсульфаніл]ацетил}мутилін і його (1S,2S) діастереомер 14-О-{[(1R,2R)-5-(3-аміно-пропіл)-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S) діастереомер 14-О-{[(1R,2R)-4-(3-аміно-пропіл)-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і його (1S,2S) діастереомер 14-О-{[(6R,8R)-8-аміно-1,4-діокса-спіро[4.5]дец-6-ілсульфаніл]ацетил}мутилін і його (6S,8S) діастереомер 14-О-{[4-аміно-2-метокси-циклогексилсульфаніл]ацетил}мутилін і 14-О-{[5-аміно-2-метокси-циклогексилсульфаніл]ацетил}мутилін. Сполуку, представлену даним винаходом, у даному документі також названо "сполуки(ами) (відповідно до винаходу) . Сполука даного винаходу включає сполуку в будь-якій формі, наприклад у вільній формі, у формі солі, у формі сольвату і у формі солі й сольвату. Відповідно до іншого аспекту, даний винахід стосуться сполук даного винаходу у формі солі і/або сольвату. Солі включають переважно фармацевтично прийнятні солі, хоча фармацевтично неприйнятні солі включені з метою, наприклад, одержання витягу, очищення. Сіль сполуки даного винаходу включає адитивну сіль основи або кислоти. Фармацевтично прийнятні основні солі включають солі амонію, такі як триметиламонієві солі, солі лужних металів, такі як солі натрію й калію, солі лужноземельних металів, такі як солі кальцію й магнію, і солі з органічними основами, що включають солі первинних, вторинних і третинних амінів, такі як ізопропіламін, діетиламін, етаноламін, триметиламін, дициклогексиламін і N-метил-Dглюкамін, переважно натрієві солі. Адитивні солі кислоти включають солі сполук даного винаходу з кислотою, наприклад, гідрофумаровой кислотою, фумаровой кислотою, винною кислотою, етан-1,2-дисульфоновою кислотою, малеїновою кислотою, нафталін-1,5сульфоновою кислотою, оцтовою кислотою, малеїновою кислотою, бурштиновою кислотою, саліциловою кислотою, азелаїновою кислотою, 2-[(2,6-дихлорфеніл)аміно]бензоуксусною кислотою, соляною кислотою, дейтерохлорноватою кислотою, переважно соляною кислотою. Сполука даного винаходу у вільній формі може бути перетворена у відповідне сполуку у формі солі й навпаки. Сполука даного винаходу у вільній формі або у формі його солі і/або у формі сольвату може бути перетворена у відповідну сполуку у вільній формі або у формі солі в несольватуємій формі й навпаки. Сполука даного винаходу може існувати у формі ізомерів й їхніх сумішей, наприклад, оптичних ізомерів, диастереоізомерів, цис/транс конформерів. Сполука даного винаходу може, наприклад, містити асиметричні атоми вуглецю і може, таким чином, існувати у формі енантиомерів або диастереоізомерів і їхніх сумішей, наприклад, рацематів або диастереомірних сумішей. Будь який асиметричний атом вуглецю може перебувати в (R)-,(S)-або (R,S)конфігурації, переважно в (R)- або (S)-конфігурації. Наприклад, у сполуці формули І атом вуглецю циклоалкільного кільця, до якого приєднана група (CH2)m S, атом вуглецю циклоалкільного кільця, до якого приєднана група R3, і атом вуглецю циклоалкільного кільця, до якого приєднана група ((CH 2)n N(R1R2), є асиметричними 4 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 атомами вуглецю. Замісники, приєднані до даного асиметричного атома вуглецю, можуть, таким чином, існувати в (R) і (S) конфігурації, включаючи їх суміші. Наприклад, якщо в сполуці формули І група R2 є заміщеним алкілом, і даний замісник приєднаний до атома вуглецю бічного ланцюжка даного алкілу, то атом вуглецю, до якого даний замісник приєднаний, є асиметричним атомом вуглецю й даний замісник може бути у формі (R)- і (S)-конфігурації, включаючи їх суміші. Конфігурація замісників, приєднаних до асиметричних атомів вуглецю трициклічних мутилінів, є переважно такою же, що й у природного плевромутиліну. Ізомерні суміші можуть бути розділені відповідним чином, наприклад, згідно, наприклад, аналогічно традиційному методу, з одержанням чистих ізомерів. Даний винахід включає сполуку даного винаходу в будь-якій ізомерній формі й у будь-який ізомерній суміші. Даний винахід також включає таутомери сполук даного винаходу, коли такі таутомери існують. Сполуки даного винаходу проявляють фармакологічну активність і є, тому, придатними для використання як лікарські засоби. Наприклад, сполуки даного винаходу показують антимікробну, наприклад, антибактеріальну, дію проти грампозитивних бактерій, таких як коагулазопозитивні Staphylococci, наприклад, Staphylococcus aureus, коагулазонегативні Staphylococci, наприклад, Staphylococcus epidermidis, Staphylococcus haemolyticus, і Streptococci, наприклад, Streptococcus pyogenes, Streptococcus pneumonia, Enterococci, наприклад, Enterococcus faecium, і Listeria monocytogenes, і проти грамопозитивних бактерій, таких як Moraxella, наприклад, Moraxella catarrhalis, і Haemophilus, наприклад, Haemophilus inuenza, і Legionella, наприклад, Legionella pneumophila, Neisseriaceae, наприклад, Neisseria gonorrhoeae, а також проти Mycoplasms, Chlamydia й облігатних анаеробних мікроорганізмів, наприклад, Bacteroides fragilis, Clostridium difficile, Fusobacterium spp., і Propionibacterium spp. In vitro активність проти аеробних бактерій визначена методом розведення агару або методом мікророзведень відповідно до Документів інституту клінічних і лабораторних стандартів,(CLSI, що був MCCLS) М7-А7, Том 26, № 2: "Методи випробування на антимікробну сприйнятливість при розведенні для бактерій, що ростуть аеробно-затверджений стандарт; сьоме видання (2206) ; і випробування проти анаеробних бактерій проводили відповідно до Документів інституту клінічних і лабораторних стандартів,(CLSI, що був MCCLS) M11-А6, Том 24, № 2: "Методи випробування на антимікробну сприйнятливість анаеробних бактерій затверджений стандарт; шосте видання (2204) і дію in vivo оцінювали на модельованому сепсисі миші проти Staphylococcus aureus. Сполуки даного винаходу є, такими, що підходять для лікування й профілактики захворювань, викликаних мікробами, наприклад, бактеріями. Хвороби, які можна також лікувати, включають, наприклад, хвороби, викликані Helicobacter, такими як Helicobacter pylori, і хвороби, викликані Mycobacterium tuberculosis. Хвороби, які також можна лікувати, включають загальні запальні захворювання, де мікроби викликають дане запалення, наприклад, у тому числі вугровий висип. В іншому аспекті даний винахід стосується сполук даного винаходу, які використовуються як лікарський засіб, переважно як антимікробний засіб, таких як антибіотик, наприклад, і антианаеробний засіб. В іншому аспекті даний винахід стосується сполук даного винаходу для використання при лікуванні вугрового висипу. Ще в одному аспекті даний винахід стосується сполук даного винаходу для використання в складі лікарського препарату для лікування хвороб, викликаних мікробами, таких як бактеріальні, наприклад, - хвороб, викликаних бактеріями, наприклад, обраними з Staphylococci, Streptococci, Enterococci; - хвороб, викликаних бактеріями, наприклад, обраних з Moraxella, Legionella, Neisseriaceae; - хвороб, викликаних Helicobacter; - хвороб, викликаних Mycobacterium tuberculosis; - наприклад, хвороб, викликаних Mycoplasms, Chlamydia і облигатними анаеробними мікроорганізмами; і для лікування вугрового висипу. В іншому аспекті даний винахід стосується методу лікування хвороб, викликаних мікробами, що включає введення суб'єктові, що потребує даного лікування, ефективної кількості сполуки даного винаходу, наприклад, у формі фармацевтичної композиції. В іншому аспекті даний винахід стосується методу лікування вугровго висипу, що включає введення суб'єктові, що потребує даного лікування, ефективної кількості сполуки даного 5 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходу, наприклад, у формі фармацевтичної композиції. Лікування включає лікування і профілактику. Для антимікробного й противоугревого лікування відповідна доза буде, безумовно, мінятися залежно від, наприклад, хімічної природи й фармакокінетичних властивостей використаної сполуки даного винаходу, індивідуального реципієнта, типу введення й природи і важкості стану, що підлягає лікуванню. Однак, загалом , для задовільних результатів для великих ссавців, наприклад, людей, зазначена денна доза перебуває в діапазоні від приблизно 0,5 мг до 3 г сполуки даного винаходу, зручно уведеного, наприклад, невеликими дозами до чотирьох разів у день. Сполука даного винаходу може бути уведена будь-яким зручним шляхом, наприклад, ентеральным, наприклад, включаючи назальне, трансбуккальне, ректальне, пероральне введення; парентеральним, наприклад, включаючи внутрішньовенне, внутрім'язове, підшкірне введення; або локальним, наприклад, включаючи epicutaneous, внутріносовим, внутрішньотрахеальним введенням, наприклад, у формі таблеток з покриттям і без покриття, капсул, розчинів або суспензій для ін'єкцій, наприклад, у вигляді ампул, пляшечок, у формі кремів, гелів, паст, порошків для вдихання, пінок, тинктур, губної помади, крапель, спреїв, або у формі суппозиториїв, наприклад, аналогічно макролідам, таким як еритроміциньї, наприклад, кларитроміцин або азитроміцин. Сполука даного винаходу може бути уведена у формі фармацевтично прийнятної солі, наприклад адитивної солі кислоти або адитивної солі основи, наприклад, солі металу, або у вільній формі, необов'язково у формі сольвату. Сполука даного винаходу у формі солі проявляє активність того ж порядку, що й сполука у вільній формі, необов'язково у формі сольвату. Сполука даного винаходу може бути використана для фармацевтичного лікування згідно із даним винаходом сама по собі або в комбінації з одним або декількома іншими фармацевтично активними агентами. Такі інші фармацевтичні активні агенти включають, наприклад, інші антибіотики й протизапальні агенти і, якщо сполука даного винаходу використана для лікування вугрового висипу, інші фармацевтичні агенти включають додаткові агенти, які є активними проти вугрового висипу. Комбінації включають фіксовані комбінації, у яких два або декілька фармацевтично активні агенти містяться в одному і тому ж самому складі; комплекти, у яких два або декілька фармацевтично активні агенти в окремих складах продаються в одній упаковці, наприклад, з інструкцією із застосування; і вільній комбінації, у якій фармацевтично активні агенти упаковані окремо , але прикладена інструкція з одночасного або послідовного введення. В іншому аспекті даний винахід стосується фармацевтичної композиції, що включає сполуку даного винаходу у вільній формі або у формі фармацевтично прийнятної солі і/або у формі сольвату в сполученні з, щонайменше , одним фармацевтичним ексипієнтом, наприклад, носієм або розріджувачем, наприклад, що включає наповнювачі, в'яжучі, розпушувачі, стабілізатори плинності, пом’якшувачі, цукри і підсолоджувачі, віддушки, консерванти, стабілізатори, змочувальні агенти і/або емульгатори солюбілізатори, солі для регулювання осмотического тиску і/або буфери. В іншому аспекті даний винахід стосується фармацевтичної композиції згідно із даним винаходом, що додатково включає інший фармацевтично активний агент. Дані фармацевтичні композиції можуть бути отримані згідно, наприклад, аналогічно, традиційному методу, наприклад, змішанням, гранулюванням, нанесенням покриття, розчиненням або ліофілізацією. Форма стандартної дози може містити, наприклад, від приблизно 0,5 мг до приблизно 2000 мг, така як від 10 мг до приблизно 500 мг. Сполуки даного винаходу додатково придатні як ветеринарні агенти, наприклад, ветеринарні активні сполуки, наприклад, для профілактики й лікування мікробних, наприклад, бактеріальних захворювань, у тварин, таких як наприклад, домашньої птиці, свиней й телят, і для розбавляючих рідких середовищ для штучного запліднення і для методів занурення яєць. В іншому аспекті даний винахід стосується сполук даного винаходу для використання як ветеринарний агент. У додатковому аспекті даний винахід стосується сполук даного винаходу для одержання ветеринарної композиції, що може бути використана як ветеринарний агент. В іншому аспекті даний винахід стосується ветеринарного методу профілактики і лікування мікробних, наприклад, бактеріальних захворювань, що включає введення реципієнтові, що потребує даного лікування, ефективної кількості сполуки даного винаходу, наприклад, у формі ветеринарної композиції. Представлені нижче по тексту приклади 1-37 показують величини MICs , млн. д., крім іншого): 6.13 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.53 (d, 1H, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.72 (d, 1Н, 2’-OH, J = 4Hz), 4.50 (d, 1Н, 11-ОН, J = 6Hz), 3.47 (m, 1Н, 2-Н), 3.45 - 3.20 (m, 3Н, 11-Н, 22-Н), 2.98 (m, 1Н, 1’-Н), 2.80 (m, 1Н, 5'-H), 2.40 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.06 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 508 + + + + (MH ), 530 (MNa ), 1015 (2MH ), 1037 (2MNa ), 506 (M-H) , 542 (МСI ). 1 (b): H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 6.13 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.53 (d, 1H, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.72 (d, 1Н, 2'-ОН, J = 4Hz), 4.50 (d, 1H, 11-ОН, J = 6Hz), 3.47 (m, 1Н, 2'-Н), 3.45 - 3.20 (m, 3Н, 11-Н, 22-Н), 2.98 (m, 1Н, 1’-Н), 2.80 (m, 1Н, 5'-H), 2.40 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.06 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, + + + + 16-CH3, J = 7Hz). MS-ESI (m/z): 508 (MH ), 530 (MNa ), 1015 (2MH ), 1037 (2MNa ), 506 (M-H) , 542 (МСI ). Приклад 3 Гідрохлорид 14-О-{[(1R,2R,4S)-4-аміно-2-гідроксициклогексилсульфаніл]ацетил}мутиліну і гідрохлорид (1S,2S,4R) діастереомера 14-О-{[(1R,2R,4S)-4-aмiнo-2-гiдpoкcи-циклoгeкcилcyльфaнiл] ацетил }мутилін + (1S,2S,4R) діастереомер (152 мг, 0,30 ммоль) із прикладу 2, стадія А, обробляли відповідно до методу прикладу 1, стадія С, і одержували гідрохлорид 14-О-{[(1R,2R,4S)-4-аміно-2-гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,4R) діастереомера (148 мг, вихід 91%) у вигляді безбарвної аморфної твердої речовини. 1 + H ЯМР (500 МГЦ,, DMSO-d6, , млн..д, крім іншого): 7.8 (bs, 3Н, NH 3 ), 6.14, 6.13 (2dd, 1H, 19-Н, J = 11Hz and 18Hz), 5.55 (d, 1Н, 14-Н, J = 8Hz), 5.20 (d, 1Н, 2'-ОН), 5.05 (m, 2Н, 20-Н), 4.53 (d, 1Н, 11-ОН, J = 6Hz), 3.88 (m, 1H, 2'-Н), 3.42 (t, 1H, 11-Н, J = 6Hz), 3.32 (m, 2Н, 22-Н), 3.22 (m, 1H, 4'-Н), 2.92 (m, 1Н, 1’-Н), 2.40 (bs, 1Н, 4-Н), 1.35 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, + + 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 508 (MH ), 530 (MNa ), 1015 + + (2MH ), 1037 (2MNa ), 542 (МСI ). Приклад 4 - 14-О-{[(1R,2R,5R)-5-aмiнo-2-гiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,5S) діастереомер Стадія А. Трет-бутилдиметил(цис-3.4-епоксициклогексилокси)силан До розчину 3-циклогексен-1-олу (Amburgey, J.C.; Shuey, S.W.; Pedersen, I. G.; Hiskey R., Bioorganic Chemistry 1994,22,172-197) (10 г, 102 ммоль) в 200 мл дихлорметану додавали ацетилацетонат ванадилу (0,5 г, кат.) і трет-бутилгідропероксид (20,4 мл, 5,5М у декані, 112 ммоль) і перемішували протягом ночі при кімнатній температурі. Отриману реакційну суміш обробляли трет-бутилдиметилсилилхлоридом (16,9 г, 112 ммоль), имидазолом (9,02 г, 132 ммоль) і 4-диметиламінопіридином (2,49 г, 20 ммоль) при 4°С и перемішували протягом 5 годин при кімнатній температурі. Реакційну суміш розбавляли дихлорметаном і потім екстрагували 10% розчином NaHCO3 і насиченим розчином солі. Органічний шар висушували над сульфатом натрію й фільтрували. Фільтрат концентрували при зниженому тиску і піддавали хроматографії (діоксид кремнію, циклогексан/етилацетат = 15/1), у результаті чого одержували третбутилдиметил(цис-3,4-епоксициклогексилокси)силан (Rf = 0,35,18,3 г, вихід 79%) у вигляді безбарвного масла. 1 H ЯМР (500 МГЦ, DMSO-d6, , млн..д): 3.55 (m, 1Н), 3.00 (m, 2Н), 2.15 (m, 1Н), 2.00 (m, 1Н), 1.80 (m, 1H), 1.50 (m, 1Н), 1.35 (m, 1Н), 1.35 (m, 1Н), 1.25 (m, 1Н), 0.83 (s, 9Н, tert-butyl), 0.0 (s, 9Н, Si(CH3)2). Стадія В. 14-О-{[(1R,2R,5S)-5(трет-бутилдиметилсилокси)-2-гідроксициклогексилсульфаніл]ацетил}мутилін+(1 S,2S,5R) діастереомер Трет-бутилдиметил(цис-3,4-епоксициклогексилокси)силан (6,41 г, 28 ммоль) обробляли плевромутилінтіолом відповідно до методу прикладу 1, стадія А2. Неочищений 14-О{[(1R,2R,5S)-5(трет-бутилдиметилсилокси)-2гідроксциклогексилсульфаніл]ацетил}мутилін+(1S,2S,5R) діастереомер одержували у вигляді безбарвної аморфної піни, яку безпосередньо використовували для проведення наступної стадії. 1 H ЯМР (400 МГЦ, DMSO-d6, , млн.д., крім іншого): 6.13 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.52 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.78 (dd, 1Н, 2-ОН, J = 5Hz and 6Hz), 4.48 (d, 1Н, 11-ОН, J = 6Hz), 3.88 (m, 1Н, 5'-Н), 3.15 - 3.45 (m, 4Н, 2'-Н, 11-Н, 22-CH2), 2.92 (m, 1Н, 1’-Н), 2.38 11 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.86 (s, 9Н, tert-butyl), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz), 0.0 (s, 6Н, Si(CH3)2). Стадія C 14-О-{[(1R,2R,5S)-2,5-]дигiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,5R) діастереомер До розчину 14-О-{[(1R,2R,5S)-5(трет-бутилдиметилсилокси)-2-гідроксициклогексилсульфаніл]ацетил}мутиліну + (1S,2S,5R) діастереомера (9,46 г, 15,1 ммоль) в 25 мл тетрагідрофурану додавали суміш оцтової кислоти й води (3:1,100 мл) і перемішували протягом 0 2 днів при 40 C. Реакційну суміш концентрували майже досуха при зниженому тиску, залишок розчиняли в етилацетаті й піддавали хроматографії (діоксид кремнію, циклогексан/етилацетат=1/3) і одержували 14-О-{[(1R,2R,5S)2,5дигідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (R f = 0,27, 7,07 г, вихід 92%) у безбарвному аморфному спіненомуї вигляді. 1 H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 6.12 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.53 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.72 (dd, 1H, 2’-OH, J = 2Hz and 5Hz), 4.48 (d, 1Н, 11-ОН, J = 6Hz), 4.43 (t, 1Н, 5'-ОН), 3.68 (m, 1Н, 5'-H), 3.45 - 3.20 (m, 4Н, 2'-Н, 11-Н, 22-Н), 2.94 (m, 1H, 1’-Н), 2.38 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.06 (s, 3Н, 18-CH3), 0.82 (d, 3Н, 17-CH3, J = + + 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 531 (MNa ), 1039 (2MNa ). Стадія D. 14-О-{[(1R,2R,5S)-2-гідрокси-5-метансульфонілоксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер До розчину 14-О-{[(1R,2R,5S)-2,5-]дигiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}мyтилiнy + (1S,2S,5R) діастереомера (6,07 г,11,9 ммоль) в 36 мл піридину додавали метансульфонілхлорид (1,1 мл, 14,3 ммоль), і отриману суміш перемішували протягом ночі при кімнатній температурі. Потім розчинник випарювали при зниженому тиску; залишок розбавляли 1N HCl і тричі екстрагували етилацетатом. Об'єднані органічні шари промивали насиченим розчином солі, сушили над сульфатом натрію й фільтрували. Фільтрат концентрували й очищали колоночно. хроматографією (діоксид кремнію, циклогексан/етилацетат = 1/1) і одержували 14-О-{[(1R,2R,5S)-2-]гідрокси-5метансульфонілоксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (R f = 0,15,2,55 г, вихід 36%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (400MHz, DMSO-d6) 5, млн. д, крім іншого): 6.12 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.07 (m, 2Н, 20-Н), 5.00 (t, 1H, 2-ОН, J = 5Hz), 4.78 (m, 1H, 5'-H), 4.50 (d, 1Н, 11-ОН, J = 6Hz), 3.55 - 3.25 (m, 4Н, 2'-Н, 11-Н, 22-Н), 2.91 (m, 1Н, 1’-Н), 2.38 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.80 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). Стадія Е. 14-О-{ [(1R,2R,5R)-5-азидо-2-гідрокси-5-метансульфонілоксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5S) діастереомер Розчин 14-О-{[(1R,2R,5S)-2-гідрокси-5метансульфонілоксициклогексилсульфаніл]ацетил}мутиліну + (1S,2S,5R) діастереомера (2,55 г, 4,35 ммоль) і азид натрію (0,85 г, 13 ммоль) в 30 мл диметилформаміду нагрівали протягом 6 годин при 80°С. Реакційну суміш розбавляли водою й насиченим розчином соли й тричі екстрагували етилацетатом. Об'єднані органічні шари промивали водою й насиченим розчином солі, сушили над сульфатом натрію й фільтрували. Розчинник видаляли при зниженому тиску, і одержували неочищений 14-О-{[(1R,2R,5R)-5-азидо-2-гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5S) діастереомер (кількісний вихід, циклогексан/ети л ацетат = 1/1, Rf=0,35) у вигляді аморфної спіненої речовини, яку безпосередньо використовували на наступній стадії. 1 H ЯМР (400MHz, DMSO-d6, , млн.д.,, крім іншого): 6.15, 6.13 (2dd, 1H, 19-Н, J = 11Hz and 18Hz), 5.56, 5.54 (2d, 1H, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.90 (d, 1Н, 2'-ОН, J = 5Hz), 4.50, 4.49 (2d, 1Н, 11-ОН, J = 6Hz), 3.50 - 3.25 (m, 5Н, 2'-Н, 5'-Н, 11-Н, 22-Н), 2.64 (m, 1Н, 1’-Н), 2.40 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.06 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). Стадія F. 14-О-{[(1R,2R,5R)-5-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін + (1S,2S,5S) діастереомер Трифенілфосфін (1,18 г, 4,50 ммоль) додавали до розчину 14-О-{[(1R,2R,5R)-5-азидо-2гідрокси-циклогексилсульфаніл]ацетил}мутиліну + (1S,2S,5S) діастереомера (2,4 г, 4,50 ммоль) в 30 мл тетрагідрофурану й перемішували протягом ночі при кімнатній температурі. Потім додавали воду (приблизно 3 мл) і реакційну суміш нагрівали протягом 1 години в колбі зі зворотним холодильником. Після випарювання розчинника залишок розчиняли водою й насиченим розчином соли й тричі екстрагували етилацетатом. Об'єднані органічні шари сушили над сульфатом натрію, фільтрували й піддавали хроматографії (діоксид кремнію, 12 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 етилацетат/метанол/35% розчин аміаку = 100/100/1) і одержували 14-О-{[(1R,2R,5R)-5-аміно-2гідрокси-циклогексилсульфаніл]ацетил}мутилін + (1S,2S,5S) діастереомер (R f = 0,3,1,74 г, вихід 79%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (400MHz, DMSO-d6, , млн.д., крім іншого): 7.25, 6.65 (2bs, 1Н, NH), 6.14 (dd, 1Н, 19Н, J = 11Hz and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.04 (m, 2Н, 20-Н), 4.50 (bs, 1Н, 11-ОН), 3.55 3.10 (m, 5Н, 2-Н, 5'-Н, 11-Н, 22-Н), 2.58 (m, 1Н, 1’-Н), 2.40 (bs, 1H, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.62 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 508 + + + (MH ), 530 (MNa ), 1037 (2MNa ). Приклад 4А - 14-О-{[(1R,2R,5R)-5-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін і 14-О-{[(1S,2S,5S)-5-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін Суміш 14-О-{[(1R,2R,5R)-5-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутиліну + (1S,2S,5S) діастереомера (4 г, 7,87 ммоль) із прикладу 4, стадія F, розділяли на хіральній колонці (250 х 20 MM CHIRALPAC IС, н-гептан/тетрагідрофуран/діетиламін = 70/30/0,1) і одержували 14-О-{[(1S*,2S*,5S*)-5-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін (сполука, яка пізно вимивається, 1,1г, вихід 28%, без поправок) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (400MHz, DMSO-d6, , млн. д., крім іншого): 6.13 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.06 (m, 2Н, 20-Н), 5.76 (d, 1Н, 2'-ОН, J = 7Hz), 4.50 (d, 1Н, 11-ОН, J = 7Hz), 3.55 - 3.15 (m, 5Н, 2'-Н, 11-Н, 5'-Н, 22-Н), 2.48 (m, 1Н, 1’-Н), 2.40 (bs, 1H, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.62 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI + + (m/z): 508 (MH ), 1037 (2MNa ), 506 (M-H) , 542 (МСl ). (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = + + 7Hz). MS-ESI(m/z): 508 (MH ), 1015 (2MH ), 542 (MCI ). Приклад 6 14-О-{[(1R,2R,4R)-4-діетиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,4S) діастереомер й 14-О-{[(1R,2R,4R)-4етиламіно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін + (1S,2S,4S) діастереомер До розчину 14-О-{[(1R,2R,4R)-4-аміно-2-гідрокси-циклогексилсульфаніл]ацетил}мутиліну + (1S,2S,4S) діастереомера (900 мг, 1,77 ммоль) із прикладу 1, стадія В, в 10 мл дихлорметану додавали ацетальдегід (2,77 мл, 1M у дихлорметані) і оцтову кислоту (77 мкл, 1,77 ммоль) і перемішували протягом 30 хвилин при кімнатній температурі. Отриману реакційну суміш обробляли триацетоксиборгідридом натрію (750 мг, 3,54 ммоль) і перемішували протягом ночі при кімнатній температурі, розбавляли дихлорметаном і потім екстрагували розчином NaHCO3 і насиченим розчином солі. Органічний шар висушували над сульфатом натрію й фільтрували. Фільтрат піддавали хроматографії (діоксид кремнію, = етилацетат/метанол/35% розчин аміаку + 50/50/1) і одержували 14-О-{[(1R,2R,4R)-4-діетиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,4S) діастереомер (а) (92 мг, вихід 9%) і 14-О{[(1R,2R,4R)-4-етиламіно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін + (1 S,2S,4S) діастереомер (b) (163 мг, вихід 17%) у безбарвному аморфному спіненому вигляді. 1 (a): H ЯМР (400MHz, DMSO-d6) , млн.д, крім іншого): 6.14 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.55 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.83 (d, 1Н, 2'-ОН, J = 4Hz), 4.47 (d, 1Н, 11-ОН, J = 6Hz), 3.42 (m, 1H, 11-Н), AB-system (А = 3.50,3.42, В= 3.30 ,3.27,22-Н, J = 15Hz), 3.25 (m, 1Н, 2'Н), 2.50 (m, 2Н, 1’-Н, 4'-Н), 2.40 (m, 5Н, NCH2, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.92 (t, 6Н, NCH2CH3, J = 7Hz), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI + + (m/z): 564 (MH ), 586 (MNa ), 562 (M-H) . 1 (b): H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 6.13 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.54 (d, 1H, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.48 (d, 1Н, 11-ОН, J = 6Hz), 3.42 (m, 1Н, 11-Н), ABsystem А = 3.48, B = 3.25, 22-Н, J = 15Hz), 2.55 (m, 2Н, 1’-Н, 4-Н), 2.40 (bs, 1Н, 4-Н), 1.35 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.95 (t, 3Н, NCH2CH3, J = 7Hz), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, + + 3Н, 16-CH3, J = 6Hz). MS-ESI (m/z): 536 (MH ), 558 (MNa ), 534 (M-H) . Приклад 7 Гідрохлорид 14-О-{[(1R,2R,5S)-5-етиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5R) діастереомера Стадія А. Складний трет-бутиловый ефір N-етил-N-(циклогекс-3-еніл)карбамінової кислоти До розчину складного трет-бутилового ефіру циклогекс-3-енілкарбамінової кислоти (Kampferer, P.; Vasella, A. Helvetica Chimica Acta 2004, 87, 2764-2789) (4,34 г, 22 ммоль) в 20 мл ДМСО додавали гідрид натрію (880 мг, 60% дисперсія, 22 ммоль) і після однієї години при перемішуванні етилйодид (1,78 мл, 22 ммоль). Ще після 2 годин перемішування при кімнатній температурі реакційну суміш концентрували при зниженому тиску. Залишок розбавляли водою й насиченим розчином соли й тричі екстрагували етилацетатом. Органічні шари висушували над сульфатом натрію й фільтрували. Фільтрат концентрували при зниженому тиску й після хроматографії (діоксид кремнію, циклогексан/етилацетат=12/1) одержували зазначену в 13 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 заголовку сполуку (Rf = 0,30,2,88 г, вихід 58%) у вигляді безбарвної твердої речовини. 1 H ЯМР (400MHz, CDCl3, , млн.д): 5.61 (m, 2Н, double bond), 4.08 (bs, 1Н, NCH), 3.15 (m, 2Н, NCH2), 2.15,1.75 (2m, 6Н), 1.47 (s, 9Н, tert-butyl), 1.13 (t, 3Н, NCH2CH3, J = 7Hz). Стадія В. Складний трет-бутиловый ефір N-етил-N-(цис-3,4-епоксициклогексил)карбамінової кислоти Складний трет-бутиловый ефір N-етил-N-(циклогекс-3-еніл)карбамінової кислоти (2,87 г, 12,7 ммоль) розчиняли в 75 мл дихлорметану й обробляли 3-хлорнадбензойною кислотою (4,50 г, 70%, 19 ммоль). Після перемішування при кімнатній температурі протягом 20 годин реакційну суміш концентрували при зниженому тиску. Залишок розбавляли етилацетатом і потім послідовно екстрагували 10% розчином NaHCO3, насиченим розчином NaHCO3 і насиченим розчином солі. Органічний шар висушували над сульфатом натрію й фільтрували. Фільтрат концентрували при зниженому тиску й після хроматографії (діоксид кремнію, циклогексан/діоксан=5/1) одержували зазначенуе в заголовку сполуку ((R f=0,2,1,50 г, вихід 49%). 1 H ЯМР (400MHz, CDCl3, , млн.д): 4.0 (bs, 1Н, NCH), 3.14 (m, 2Н, NCH 2), 3.06 (bs, 2Н, epoxide), 2.13, 2.08,1.88,1.60,1.36 (4т, 6Н), 1.47 (s, 9Н, tert-butyl), 0..08 (t, 3Н, NCH2CH3). Стадія С. 14-О-{ [(1R,2R,5S)-5-(трет-бутоксикарбонілетиламіно)-2-гідроксициклогексилсульфаніл] ацетил} мутилін + (1S,2S,5R) діастереомер Складний трет-бутиловый ефір N-етил-N-(цис-3,4-епоксициклогексил)карбамінової кислоти (1,5 г, 6,2 ммоль) обробляли плевромутилінтіолом відповідно до методу прикладу 1, стадія A1. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/діоксан=3/1) одержували 14-О-{[(1R,2R,5S)-5-(трет-бутоксикарбонілетиламіно)-2-гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (R f=0,4, 2,57 г, вихід 65%) у безбарвному аморфному спіненому вигляді. МС-ЭСИ (m/z): 536 (MH+), 558 (MNa+), 534 (M-H)-. Стадія D. 14-О-{[(1R,2R,5S)-5-eтилaмiнo-2-гiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,5R) діастереомер 14-О-{[(1R,2R,5S)-5-(трет-бутоксикарбонілетиламіно)-2-гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (2,57 г, 4,04 ммоль) обробляли відповідно до методу прикладу 1, стадія В. Після обробки й проведення хроматографії реакційної суміші (діоксид кремнію, етилацетат/метанол/35% розчин аміаку = 100/100/1) одержували 14-О-{[(1R,2R,5S)-5-етиламіно-2-гідроксициклогексилсульфаніл]ацетил} мутилін + (1S,2S,5R) діастереомер (Rf=0,3,1,08 г, 50%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (500MHz, CDCl3, , млн.д, крім іншого): 6.48 (dd, 1Н, 19-Н, J = 10Hz and 18Hz), 5.77 (m, 1H, 14-Н), 5.36 (m, 1H, 20-Н), 5.22 (d, 1Н, 20-Н, J = 17Hz), 3.45 (d, 1Н, 2'-Н), 3.37 (d, 1Н, 11-Н, J = 6Hz), 3.25 (m, 1H, 22-Н), 2.97 (m, 1H, 1’-Н), 2.91 (m, 1Н, 5'-H), 2.63 (q, 2Н, NCH2, J = 7Hz), 2.10 (bs, 1Н, 4-Н), 1.46 (s, 3Н, 15-CH3), 1.18 (s, 3Н, 18-CH3), 1.12 (t, 3Н, NCH2CH3, J = 7Hz), 0.98 (d, 3Н, 17-CH3, J = 7Hz), 0.73 (d, 3Н, 16-CH3, J = 7Hz). Стадія Е. Гідрохлорид 14-О-{[(1R,2R,5S)-5-eranаміно-2-гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5R) діастереомера 14-О- {[(1 R,2R,5S)-5 -етиламіно-2-гідрокси-циклогексилсульфаніл] ацетил }мутилін + (1S,2S,5R) діастереомер (86 мг, 0,16 ммоль) обробляли відповідно до методу прикладу 1, стадія С, з одержанням гідрохлориду 14-О-{[(1R,2R,5S)-5-етиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлориду (1S,2S,5R) діастереомера (83 мг, вихід 90%) у вигляді безбарвної аморфно спіненої речовини. 1 + H ЯМР (400MHz, CDCl3,, млн.д, крім іншого): 9.3 (bs, 2Н, NH2 ), 6.45 (m, 1Н, 19-Н), 5.73 (d, 1Н, 14-Н, J = 10Hz), 5.35 (m, 1Н, 20-Н), 5.22 (d, 1Н, 22-Н, J = 18Н), 3.85 (m, 1Н, 2'-Н), 3.33 (m, 3Н, 11-Н, 22-Н), 3.07 (m, 2Н, NCH2), 2.10 (bs, 1H, 4-Н), 1.50 (t, 3Н, NCH2CH3, J = 7Hz), 1.45 (s, 3Н, 15CH3), 1.18 (s, 3Н, 18-CH3), 0.90 (d, 3Н, 17-CH3, J = 7Hz), 0.73 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI + (m/z): 536 (MH ), 570 (МСl ). Приклад 8. Гідрохлорид 14-О-{[(1R,2R,5S)-5-діетиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5R) діастереомера Стадія А. 14-О-{[(1R,2R,5S)-5-дieтилaмiнo-2-гiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,5R) діастереомер 14-О-{[(1R,2R,5S)-5 -етиламіно-2-гідрокси-циклогексилсульфаніл] ацетил} мутилін + (1S,2S,5R) діастереомер (250 мг, 0,47 ммоль) із прикладу 7, стадія D, обробляли ацетальдегідом (53 мкл, 0,93 ммоль) відповідно до методу прикладу 6. Після обробки й хроматографії реакційної суміші (діоксид кремнію, етилацетат/метанол= 1/1) одержували 14-О{[(1R,2R,5S)-5-дieтилaмiнo-2-riдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,5R) діастереомер (Rf=0,2,230 мг, 87%) у безбарвному аморфному спіненому вигляді. 14 UA 97836 C2 H ЯМР (400MHz, CDCl3, , млн.д, крім іншого): 6.48 (dd, 1Н, 19-Н, J = 11Hz and 17Hz), 5.77 (d, 1Н, 14-Н, J= 8Hz), 5.36 (m, 1Н, 20-Н), 5.22 (d, 1Н, 20-Н, J = 17Hz), 3.57,3.36, 3.21, 3.03, 2.72 (5m, 6Н, 1’-Н, 2'-Н, 5-Н, 11-Н, 22-Н), 2.59 (m, 4Н, NCH2), 2.11 (bs, 1Н, 4-Н), 1.46 (s, 3Н, 15-CH3), 1.18 (s, 3Н, 18-CH3), 0.98 (t, 6Н, NCH2CH3, J = 7Hz), 0.88 (d, 3Н, 17-CH3, J = 7Hz), 0.73 (d, 3Н, 16CH3, J = 7Hz). Стадія В. Гідрохлорид 14-О-{[(1R,2R,5S)-5-діетиламіно-2-гідроксициклогексилсульфаніл] ацетил }мутиліну + гідрохлорид (1S,2S,5R) діастереомера 14-О-{[(1R,2R,55)-5-діетиламіно-2-гідрокси-циклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (230 мг, 0,41 ммоль) обробляли відповідно до методу прикладу 1, стадія С, з одержанням гідрохлориду 14-О-{[(1R^,5S)-5-діетиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлориду (1S,2S,5R) діастереомера (223 мг, вихід 91%) у вигляді безбарвної аморфної речовини. 1 + H ЯМР (400MHz, CDCl3,, млн.д, крім іншого): 11.5 (bs, 3Н, NH ), 6.46 (dd, 1Н, 19-Н, J = 11Hz and 17Hz), 5.74 (d, 1Н, 14-Н, J = 8Hz), 5.34 (m, 1H, 20-Н), 5.22 (d, 1Н, 22-Н, J = 17Н), 3.98 (m, 1Н, 2'-Н), 3.60 - 2.90 (m, 9Н, 1’-Н, 5'-Н, 11-Н, 22-Н, NCH2), 2.10 (bs, 1Н, 4-Н), 1.48 (m, 9Н, NCH2CH3,15-CH3), 1.18 (s, 3Н, 18-CH3), 0.89 (d, 3Н, 17-CH3, J = 7Hz), 0.73 (d, 3Н, 16-CH3, J = + + + 7Hz). MS-ESI (m/z): 564 (MH ), 586 (MNa ), 1149 (2MNa ), 598 (МСl ). Приклад 9 - 14-О-{[(1R,2R,4S)-4-діетиламіно-2-гідроксициклогексилсульфаніл] ацетил} мутилін + (1S,2S,4R) діастереомер 14-О-{[(1R,2R,4S)-4-aмiнo-2-гiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}мутилін + (1S,2S,4R) діастереомер (680 мг, 1,34 ммоль) із прикладу 2, стадія А, обробляли відповідно до методу прикладу 6. Після обробки й хроматографії реакційної суміші (діоксид кремнію, етилацетат/метанол= 1/1) одержували 14-О-{[(1R,2R,4S)-4-діетиламіно-2-гідроксициклогексилсульфаніл] ацетил} мутилін + (1S,2S,4R) діастереомер (R f=0,2,129 мг, 17%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (500MHz, DMSO-d6, , млн.д, крім іншого): 6.13 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.70 (d, 1H, 2'-ОН), 4.49 (d, 1H, 11-ОН, J = 6Hz), 3.70 (m, 1H, 2'-Н), 3.42 (t, 1H, 11-Н, J = 6Hz), AB-system (A = 3.36, B = 3.22, 22-H, J = 15Hz), 2.72 (m, 2H, 1'-H, 4'-H), 2.47 (m, 2H, NCH2), 2.40 (bs, 1Н, 4-Н), 1.35 (s, 3Н, 15-CH3), 1.04 (s, 3Н, 18-CH3), 0.95 (t, 3Н, NCH2CH3, J = 7Hz), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.62 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI + + (m/z): 536 (MH ), 558 (MNa ), 534 (M-H) . Приклад 10 14-О-{[(1R,2R,5R)-5-діетиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5S) діастереомер 14-О-{[(1R,2R,5R)-5-aмiнo-2-гiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}мутилін+(1S,2S,5S) діастереомер (420 мг, 0,827 ммоль) із прикладу 4, стадія F, обробляли відповідно до методу прикладу 6. Після обробки й хроматографії реакційної суміші (діоксид кремнію, етилацетат/метанол/35% розчин аміаку=50/50/1) одержували 14-О-{[(1R,2R,5R)-5-діетиламіно-2гідрокси-циклогексилсульфаніл]ацетил}мутилін + (1S,2S,5S) діастереомер (R f=0,2, 95 мг, 20%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (400MHz, DMSO-d6,, млн.д, крім іншого): 6.13 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.55 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.79 (m, 1Н, 2'-0Н), 3.55 - 3.15 (m, 2'-Н, 5'-Н, 11-Н, 22-Н), 2.58 (m, 1Н, 1’-H), 2.40 (m, 5Н, NCH2,4-Н), 1.37 (s, 3Н, 15-CH3), 1.06 (s, 3Н, 18-CH3), 0.92 (t, 3Н, NCH2CH3, J = 7Hz), 0.83 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI(m/z): + + 564(MH ), 586 (MNa ), 562(M-H) , 598 (MCI ). Приклад 11 14-О-{[(1R,2R,3R)-3-етиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,3S) діастереомер Стадія А. Складний трет-бутиловый ефір 14-О-{[(1R,2R,3R)-2-гідрокси-3-(2,4,6триметилбензилсульфаніл)циклогексил]карбамінової кислоти + (1S,2S,3S) діастереомер До розчину складного трет-бутилового ефіру (цис)-2,3-епоксициклогексилкарбамінової кислоти (O'Brien, P.;Childs, А., С; Ensor, G. Organic Letters 2003,5(26), 4955-4957) (14,9 г, 68,9 ммоль) і 2,4,6-триметилбензилмеркаптану (11,5 г, 68,9 ммоль) в 50 мл метанолу додавали 10N розчин NaOH (5 мл, 50 ммоль) і отриману суміш перемішували протягом 16 годин при кімнатній температурі. Реакційну суміш розбавляли водою й насиченим розчином соли й тричі екстрагували етилацетатом. Органічні шари висушували над сульфатом натрію й фільтрували. Фільтрат піддавали хроматографії (діоксид кремнію, циклогексан/етилацетат=5/1) і одержували складний трет-бутиловый ефір {[(1R,2R,3R)-2-гідрокси-3-(2,4,6триметилбензилсульфаніл)циклогексил]карбаміново] кислоти + (1S,2S,3S) діастереомер (Rf=0,25,5,92 г, вихід 23%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (400MHz, DMSO-d6,, млн.д): 6.78 (s, 2Н, aromat.-H), 6.15 (bd, ОН), 4.95 (bd, NH), 3.75 (d, 1Н, SCH2), 3.68 (m, 2Н), 3.02 (m, 1Н, SCH), 2.30 (s, 9Н, CH 3), 2.30,1.90,1.40 (3m, 6Н), 1.35 1 5 10 15 20 25 30 35 40 45 50 55 60 15 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 (s, 9Н, tert-butyl). Стадія В. Складний трет-бутиловий ефір {[(1R,2R,3R)-2-(тpeт-бутилдиметилсиланілокси)-3(2,4,6-триметилбензилсульфаніл)циклогексил]карбамінової кислоти + (1S,2S,3S) діастереомер Розчин складного трет-бутилового ефіру {[(1R,2R,3R)-2-гідрокси-3-(2,4,6триметилбензилсульфаніл)циклогексил]карбамінової кислоти + (1S,2S,3S) діастереомер (2,46 г, 6, 49 ммоль) в 50 мл диметилформаміду обробляли трет-бутилдиметилсилілхлоридом (978 мг, 0 6, 49 ммоль) і імідазолом (557 мг, 8,11 ммоль) і перемішували при 80 C протягом 5 днів. Реакційну суміш концентрували при зниженому тиску. Залишок розбавляли 0,1N HCl і тричі екстрагували етилацетатом. Об'єднані органічні шари промивали насиченим розчином солі, висушували над сульфатом натрію й фільтрували. Після хроматографії (діоксид кремнію, циклогексан/етилацетат =10/1) одержували складний трет-бутиловый ефір {[(1R,2R,3R)-2-(третбутилдиметилсилан8локси)-3-(2,4,6триметилбензилсульфаніл)циклогексил]карбаміново] кислоти + (1S,2S,3S) діастереомер (Rf = 0,25, 3,0 u, вихід 94%). 1 H ЯМР (500MHz, DMSO-d6, , млн.д): 6.80 (s, 2Н, aromat-H), 6.20 (bd, NH), 3.90,3.75,3.63 (3m, 4Н, NCH, ОСН, SCH2), 2.98 (m, 1Н, SCH), 2.30 (s, 9Н, CH3), 1.90,1.50,1.33 (3m, 6Н), 1.35 (s, 9Н, C-tert-butyl), 0.85 (s, 9Н, Si-terf-butyl), 0.0 (s, 6Н, Si(CH3)2). Стадія C Складний трет-бутиловый ефір {[(1R,2R,3R)-2-(тpeт-бутилдиметилсиланiлокси)-3(2,4,6-триметилбензилсульфаніл)циклогексил]карбамінової кислоти + (1S,2S,3S) діастереомер Розчин складного трет-бутилового ефіру {[(1R,2R,3R)-2-(тpeт-бутилдиметилсиланілокси)-3(2,4,6-триметилбензилсульфаніл)циклогексил]карбамінової кислоти + (1S,2S,3S) діастереомера (3,0 г, 6,08 ммоль) обробляли етилйодидом відповідно до методу прикладу 7, стадія А. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат = 3/1) одержували складний трет-бутиловый ефір {[(1R,2R,3R)-2-(трет-бутилдиметилсиланілокси)-3(2,4,6-триметилбензилсульфаніл)циклогексил]карбамінової кислоти + (1S,2S,3S) діастереомер (1,20 г, 38%). MC-ECI (m/z): 544 (MNa+), 1065 (2MNa+). Стадія D. Складний трет-бутиловый ефір {[(1R,2R,3R)-2-(тpeт-бутилдиметилсиланілокси)-3меркаптоциклогексил]етижарбамінової кислоти + (1S,2S,3S) діастереомер Розчин складного трет-бутилового ефіру {[(1R,2R,3R)-2-(тpeт-бутилдиметилсиланілокси)-3(2,4,6-триметилбензилсульфаніл)циклогексил]етилкарбамінової кислоти + (1S,2S,3S) діастереомера (1,20 г, 2,30 ммоль) в 10 мл тетрагідрофурану й 20 мл рідкого аміаку обробляли в атмосфері аргону при -78 °С натрієм (106 мг, 4,60 ммоль) і перемішували при -78°С протягом однієї години. Потім додавали твердий хлорид амонію, і реакційну суміш нагрівали до кімнатної температури, розбавляли тетрагідрофураном і продували азотом. Суміш, що залишилася, фільтрували й концентрували при зниженому тиску, у результаті чого одержували неочищений складний трет-бутиловый ефір {[(1R,2R,ЗR)-2-(тpeт-бyтилдимeтилcилaнiлoкcи)-3мepкaпoциклoгeкcил]eтилкapбaмiнoвoї кислоти + (1S,2S,3S) діастереомер (кількісний вихід), що безпосередньо використали на наступній стадії. MC-ECI (m/z): 412 (MNa+), 801 (2MNa+). Стадія Е. 14-О-{[(1R,2R,3R)-3-(тpeт-бутоксикарбонілетмламіно)-2-(тpeтбутилдиметилсиланілокси) циклогексилсульфаніл]ацетил}мутилін + (1S,2S,3S) діастереомер Неочищений складний бутиловый ефір {[(1R,2R,3R)-2-(трет-бутилдиметилсиланілокси)-3меркапоциклогексил]етилкарбамінової кислоти + (1S,2S,3S) діастереомер (895 мг, 2,30 ммоль) розчиняли в 30 мл тетрагідрофурану й послідовно обробляли плевромутилінтозилятом (979 мг,1,84 ммоль) і трет-бутоксидом калію (206 мг, 1,84 ммоль), і отриману суміш перемішували протягом 16 годин при кімнатній температурі. Після випарювання розчинника залишок розбавляли 1N HCl і тричі екстрагували етилацетатом. Об'єднані органічні шари промивали розчином NaHCO3 і насиченим розчином солі, висушували над сульфатом натрію й фільтрували. Після хроматографії (діоксид кремнію, циклогексан/етилацетат = 10/1) одержували 14-О-{[(1R,2R,3R)-3-(тpeт-бутоксикарбонілетиламіно)-2-(третбутилдиметилсиланілокси)циклогексилсульфаніл]ацетил}мутилін + (1S,2S,3S) діастереомер (R f = 0,5,468 мг, вихід 27%). 1 H ЯМР (400MHz, DMSO-d6,, млн.д, крім іншого): 6.14 (dd, 1H, 19-Н, J = 11Hz and 18Hz), 5.55 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.49 (m, 1Н, 11-ОН), 3.94 (m, 1Н, 2'-H), 3.43 (t, 1Н, 11-Н, J = 6Hz), 3.28,3.04 (2m, 5Н, 1’-Н, 22-Н, NCH2), 2.40 (bs, 1Н, 4-Н), 1.40 (s, 9Н, tert-butyl), 1.36,1.35 (2s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.87 (s, 9Н, Si-tert-butyl), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.64,0.62 (2d, 3Н, 16-CH3, J = 7Hz) 0.05, -0.05 (2s, 6Н, Si(CH3)2). Стадія F. 14-О-{[(1R,2R,3R)-3-елиламіно-2-(тpeтбутилдиметилсиланілокси)циклогексилсульфаніл] ацетил} мутилін + (1S,2S,3S) діастереомер й 14-О-{[(1R,2R,ЗR)-3-eтилaмiнo-2-riдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн 16 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 + (1S,2S,3S) діастереомер 14-О-{[(1R,2R,3R)-3-(тpeт-бутоксикарбонілетмламіно)-2-(тpeтбутилдиметилсиланілокси)циклогексилсульфаніл]ацетил}мутилін + (1S,2S,3S) діастереомер (468 мг, 0,624 ммоль) обробляли трифторуксусною кислотою протягом ночі відповідно до методу прикладу 1, стадія В. Після обробки й хроматографії реакційної суміші (діоксид кремнію, етилацетат/метанол =1/ 2) одержували 14-О-{[(1R,2R,3R)-3-eTMаміно-2-(тpeтбутилдиметилсиланілокси)циклогексилсульфаніл]ацетил}мутилін + (1S,2S,3S) діастереомер (а) (Rf = 0,6, 144 мг, вихід 36%) і 14-О-{[(т^^)-3-етилшіно-2-гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,3S) діастереомер (b) (R f = 0,25, 177 мг, вихід 53%) у вигляді безбарвних твердих речовин. (a) MC-ECI (m/z): 672 (MNa+), 1321 (2MNa+). 1 (b): H ЯМР (400MHz, DMSO-d6) 5, млн.д, крім іншого): 6.14 (dd, 1H, 19-Н, J = 11Hz and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.76 (m, 1H, 2'-ОН), 4.49,4.48 (2d, 1Н, 11-ОН, J = 6Hz), 3.55 (m, 1Н, 2'-Н), 3.42 (t, 1Н, 11-Н, J = 6Hz), AB-system (vA = 3.37, vB = 3.18, 22-H, J = 15Hz), 3.05 (m, 1H, 3’-Н), 2.66 (m, 1H, 1’-Н), 2.50 (m, 2Н, NCH2), 2.40 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15CH3), 1.05 (s, 3Н, 18-CH3), 0.98 (t, 3Н, NCH2CH3, J = 7Hz), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.62 (d, + + + + 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 536 (MH ), 558 (MNa ), 1071 (2MH ), 1093 (2MNa ), 534 (M-H) . Приклад 12 14-О-{[(1R,2R,ЗК)-3-діетиламіно-2-гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,3S) діастереомер Стадія А. 14-О-{[(1R,2R,ЗК)-3-діетиламіно)-2-(третбутилдиметилсиланілокси)циклогексилсульфаніл]ацетил}мутилін + (1S,2S,3S) діастереомер 14-О-{[(1R,2R,3R)-3-eTMаміно-2-(тpeтбутилдиметилсиланілокси)циклогексилсульфаніл]ацетил}мутилін + (1S,2S,3S) діастереомер (144 мг, 0,222 ммоль) із прикладу 11, стадія F, обробляли ацетальдегідом (25 мкл, 0,444 ммоль) відповідно до методу прикладу 6. Після обробки й хроматографії реакційної суміші (діоксид кремнію, етилацетат/метанол = 2/1) одержували 14-О-{[(1R,2R,3R)-3-елиламіно)-2-(третбутилдиметилсиланілокси)циклогексилсульфаніл]ацетил}мутилін + (1S,2S,3S) діастереомер (R f = 0,5,110 мг, 73%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (400MHz, DMSO-d6,, млн.д, крім іншого): 6.14 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.53 (d, 1Н, 14-Н, J = 7Hz), 5.05 (m, 2Н, 20-Н), 4.98 (m, 1Н, 11-ОН), 3.97 (m, 1Н, 2'-Н), 3.42 (t, 1Н, 11-Н, J = 6Hz), 3.24 (m, 2Н, Н-22), 3.00 (m, 1Н, 1’-Н), 2.70 (m, 1Н, 3’-H), 2.55 (m, 4Н, NCH2), 2.40 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.87 (m, 15Н, NCH2CH3, Si-tert-butyl), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.62,0.60 (2d, 3Н, 16-CH3, J = 7Hz), 0.07 (s, 6Н, Si(CH3),). Стадія В. 14-О-{[(1R,2R,ЗR)-3-дieтилaмiнo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,3S) діастереомер До розчину 14-О-{[(1R,2R,3R)-3-діетиламіно)-2-(тpeтбутилдиметилсиланілокси)циклогексилсульфаніл] ацетил }мутиліну + (1S,2S,3S) діастереомера (101 мг, 0,149 ммоль) в 5 мл тетрагідрофурану додавали тетрабутиламонійфторид (0,44 мл, 1 M y тетрагідрофурані, 0,447 ммоль). Після перемішування при кімнатній температурі протягом 2 днів реакційну суміш концентрували при зниженому тиску, розбавляли розчином NaHCO3 і двічі екстрагували етилацетатом. Об'єднані органічні шари висушували над сульфатом натрію й фільтрували. Фільтрат піддавали хроматографії (діоксид кремнію, етилацетат/метанол =1/2) і одержували 14-O-{[(1R,2R,ЗR)-3-дieтилaмiнo-2-гiдpoкcи-циклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,3S) діастереомер (Rf = 0,2, 8 мг, вихід 10%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 6.15, 6.14 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.99,4.42 (2m, 2Н, 11-ОН, 2-ОН), 3.87 (m, 1Н, 2'-Н), 3.42 (t, 1Н, 11-Н, J = 6Hz), 3.25 (m, 2Н, Н-22), 3.05 (m, 1Н, 1’-Н), 2.60 (m, 3Н, 3'-Н, NCH2), 2.40 (bs, 1Н, 4-Н), 1.35 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.90 (m, 6Н, NCH2CH3), 0.81 + + (d, 3Н, 17-CH3, J = 7Hz), 0.62,0.61 (2d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 564 (MH ), 586 (MNa ), + 1149 (2MNa ), 562 (М-Н) . Приклад 13 - 14-О-{[(1R,2R,4S)-4-(формілгідроксиаміно)-2-гідроксициклогексилсульфаніл] ацетил} мутилін + (1S,2S,4R) діастереомер Стадія A1. 14-О-{[(7R,8R)-7-гідрокси-1,4-діокса-спіро[4.5]дец-8-ілсульфаніл]ацетил}мутилін + (7S,8S) діастереомер 7,8-епокси-1,4-діокса-спіро[4.5]декан (Zhang, L.; Koreeda, М. Organic Letters 2002,4(21), 3755375S) (6,25 г, 40 ммоль) і плевромутилінтіол (8 г, 20 ммоль) обробляли відповідно до методу прикладу 1, стадія А2. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат = 1/1) одержували 14-О-{[(7R,8R)-7-гідрокси-1,4-діокса-спіро[4.5]дец-8 17 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 ілсульфаніл]ацетил}мутилін + (7S,8S) діастереомер (R f = 0,3, 8,40 г, вихід 76%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (500MHz, DMSO-d6, , млн.д, крім іншого): 6.14 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.55 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.95 (d, 1Н, 2'-ОН, J = 6Hz), 4.50 (d, 1Н, 11-ОН, J = 6Hz), 3.82 (m, 4Н, OCH2CH2O), 3.55 - 3.25 (m, 4Н, 2'-Н, 11-Н, Н-22), 2.58 (m, 1Н, 1’-Н), 2.40 (bs, 1H, 4-Н), 1.35,1.34 (2s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.62 (d, 3Н, + 16-CH3, J = 7Hz). MS-ESI (m/z): 573 (MNa ), 549 (M-H) . Або стадія А2.14-О-{[(7R,8R)-7-гідрокси-1,4-діокса-спіро[4.5]дец-8ілсульфаніл]ацетил}мутилін + (7S,8S) діастереомер й 14-О-{[(7R,8R)-8-гідрокси-1,4_діоксаспіро[4.5]дец-7-ілсульфаніл]ацетил}мутилін + (7S,8S) діастереомер 7,8-епокси-1,4-діокса-спіро[4.5]декан (6,24 г, 39,95 ммоль) і плевромутилінтіол (16,4 г, 41,7 ммоль) обробляли відповідно до методу прикладу 1, стадія A3. Після обробки й хроматографії реакційної суміші (діоксид кремнію, етилацетат/толуол = 1/1) одержували суміш 14-О-{[(7R,8R)7-гiдpoкcи-1,4-дioкca-cпipo[4.5]дeц-8-iлcyльфaнiл]aцeтил}мyтилiнy + (7S,8S) діастереомера, а також 14-О-{[(7R,8R)-8-гідрокси-1,4-діокса-спіро[4.5]дец-7-ілсульфаніл]ацетил}мутиліну + (7S,8S) діастереомера (Rf = 0,24,4,40 г, вихід 20%) у вигляді безбарвної твердої речовини. 1 H ЯМР (500MHz, DMSO-d6, , млн.д, крім іншого): 6.14, 6.12 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.55, 5.53 (2d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.95, 4.87 (d+dd, 1Н, 2-ОН, J = 6Hz), 4.50,4.49 (2d, 1H, 11-ОН, J = 6Hz), 3.83 (m, 4Н, OCH2CH2O), 3.55 - 3.25 (m, 4Н, 2'-Н, 11-Н, Н-22), 2.77, 2.57 (2m, 1H, 1’-Н), 2.40 (bs, 1Н, 4-Н), 1.36,1.36 (2s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 + (d, 3Н, 17-CH3, J = 7Hz), 0.62 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 573 (MNa ), 549 (M-H) . Стадія В. 14-O- {[(7R,8R)-7-(тpeт-бyтилдифeнiлcилaнiлoкcи)-1,4-діокса-спіро [4.5]дец-8ілсульфаніл] ацетил} мутилін + (7S,8S) діастереомер Розчин 14-О-{[(7R,8R)-7-гідрокси-1,4-діокса-спіро[4.5]дец-8-ілсульфаніл]адетил}мутиліну+ (7S,8S) діастереомера (8,4 г, 15,3 ммоль) зі стадії A1 в 50 мл диметилформаміду обробляли трет-бутилдифенілсилілхлоридом (5,16 мл, 19,8 ммоль) і імідазолом (1,66 г, 24,4 ммоль) і перемішували протягом ночі при 80C Реакційну суміш концентрували при зниженому тиску. Залишок розбавляли водою й насиченим розчином соли й тричі екстрагували етилацетатом. Об'єднані органічні шари промивали водою й насиченим розчином солі, висушували над сульфатом натрію й фільтрували. Після хроматографії (діоксид кремнію, циклогексан/етилацетат = 1/1) одержували 14-О-{[(7R,8R)-7-(тpeт-бутилдифенілсиланілокси)1,4-діокса-спіро[4.5]дец-8-ілсульфаніл]ацетил}мутилін + (7S,8S) діастереомер (R f = 0,7, 8,03 г, вихід 67%. 1 H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 1.1 - 7.35 (m, 10Н, aromat.-H), 6.15, 6.13 (2dd, 1H, 19-Н, J = 11Hz and 18Hz), 5.57,5.53 (2d, 1H, 14-H, J = 7Hz), 5.05 (m, 2H, 20-H), 4.50 (m, 1H, 11-OH), 3.30 (m, 1H, 2'-H), 3.70 - 2.80 (m, 8H, OCH2CH2O, 1’-Н, 11-Н, 22-H), 2.40 (bs, 1H, 4-H), 1.39,1.36 (2s, 3H, 15-CH3), 1.05 (s, 3H, 18-CH3), 1.00 (s, 9H, Si-tert-butyl), 0.81 (d, 3H, 17-CH3, J = + 7Hz), 0.62,0.60 (2d, 3H, 16-CH3, J = 7Hz). MS-ESI (m/z): 811 (MNa ). Стадія С. 14-О-{[(1R2R)-2-(трет-бутилдифенілсиланілокси)-4оксоциклогексилсульфаніл]ацетил} мутилін + (1S,2S) діастереомер 14-О-{[(7R,8R)-7-(тpeт-бyтилдифeнiлcилaнiлoкcи)-1,4-дioкca-cпipo[4.5]дeц-8ілсульфаніл]ацетил}мутилін + (7S,8S) діастереомер (8,03 г, 10,2 ммоль) розчиняли в 100 мл дихлорметану й обробляли монтморилонітом K10 (10 г) протягом 3 днів при кімнатній температурі. Після фільтрування через цілить реакційну суміш концентрували при зниженому тиску й піддавали хроматографії (діоксид кремнію, циклогексан/етилацетат = 2/1) і одержували 14-О-{[(1R,2R)-2-(трет-бутилдифенілсиланілокси)-4-оксо-циклогексилсульфаніл]ацетил}мутилін + (1S,2S) діастереомер (Rf = 0,38, 5,24 г, вихід 69%). 1 H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 7.65 - 7.40 (m, 10Н, aromat.-H), 6.15, 6.13 (2dd, 1H, 19-Н, J = 11Hz and 18Hz), 5.53 (d, 1H, 14-H, J = 7Hz), 5.00 (m, 2H, 20-H), 4.47 (m, 1H, 11OH), 4.24 (m, 1H, 2'-H), 3.41 (t, 1H, 11-H, J = 6Hz), 3.20 - 3.00 (m, 2H, 22-H), 2.60 (m, 1H, 1’-Н), 2.40 (bs, 1H, 4-H), 1.35,1.33 (2s, 3H, 15-CH3), 1.06 (s, 3H, 18-CH3), 0.97 (s, 9H, Si-tert-butyl), 0.81 (d, 3H, 17-CH3, J = 7Hz), 0.58 (d, 3H, 16-CH3, J = 7Hz). Стадія D. 14-О-{[(1R,2R)-2-(тpeт-бyтилдифeнiлcилaнiлoкcи)-4гідроксиіміноциклогексилсульфаніл] ацетил} мутилін + (1S,2S) діастереомер До розчину 14-О-{[(1R,2R)-2-(тpeт-бутилдифенілсиланілокси)-4оксоциклогексилсульфаніл]ацетил}мутиліну + (1S,2S) діастереомера (2,50 г, 3,36 ммоль) в 10 мл диметилформаміду додавали гідрохлорид гідроксиламіну (233 мг, 3,36 ммоль) і триетиламін (0,47 мл, 3,36 ммоль) і перемішували при кімнатній температурі протягом ночі. Реакційну суміш концентрували і при зниженому тиску, розбавляли водою й насиченим розчином соли й тричі екстрагували етилацетатом. Об'єднані органічні шари двічі промивали водою й висушували над 18 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 сульфатом натрію й фільтрували. Розчинник видаляли при зниженому тиску й одержували неочищений 14-О-{[(1R,2R)-2-(тpeтвідповідно до методу прикладу 1, стадія А2. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат = 2/1) одержували (7R,8R)-8-(2,4,6-триметилбензилсульфаніл)-1,4-діокса-спіро[4.5]декан-7-ол + (7S,8S) діастереомер (Rf = 0,4, 33 м, вихід 85%) у вигляді масла. MC-ECI (m/z): 345 (MNa+), 667 (2MNa+). Стадія В. Складний (7R,8R)-7-(2,4,6-тpимeтилбeнзилcyльфaнiл)-1,4-дioкca-cпipo[4.5]дeц-8іловий ефір оцтової кислоти + (7S,8S) діастереомер До розчину трифенілфосфіну (26,5 г, 101 ммоль) в 500 мл тетрагідрофурану в атмосфері аргону додавали ізопропілазодикарбоксилат (19,6 мл, 101 ммоль) і перемішували протягом 30 хвилин. Потім додавали (7R,8R)-8-(2,4,6-триметилбензилсульфаніл)-1,4-діокса-спіро[4.5]декан7-ол + (7S,8S) діастереомер (27,7 г, 86 ммоль) в 150 мл тетрагідрофурану й оцтову кислоту (7,7 0 мл, 135 ммоль) і реакційну суміш нагрівали при 80 C протягам 24 годин. Отриману реакційну суміш концентрували при зниженому тиску й піддавали хроматографії (діоксид кремнію, циклогексан/етилацетат/метанол = 3/1), у результат чого одержували складний (7R,8R)-7-(2,4,6тpимeтилбeнзилcyльфaнiл)-1,4-дioкca-cпipo[4.5]дeц-8-iлoвий ефір оцтової кислоти + (7S,8S) діастереомер (Rf = 0,4, 7,0 г, вихід 22%). 1 H ЯМР (500MHz, CDCl3,, млн.д): 6.81 (s, 2Н, aromat.-H), 4.85 (m, 1Н, СНО), 3.96 (m, 4Н, OCH2CH2O), AB-system (A = 3.83, B = 3.79, J = 11Hz, SCH2), 2.99 (m, 1H, CHS), 2.36 (s, 6H, CH3), 2.23 (s, 3Н, CH3), 2.18 (m, 1H), 2.12 (m, 1H), 2.11 (s, 3Н, COCH3), 1.90 - 1.58 (m, 4H). MS-ESI + (m/z): 387 (MNa ). Стадія С. (7R,8R)-7-меркапто-1,4-діокса-спіро[4.5]декан-8-ол + (7S,8S) діастереомер Складний (7R,8R)-7-(2,4,6-тpимeтилбeнзилcyльфaнiл)-1,4-дioкca-cпipo[4.5]дeц-8-iлoвий ефір оцтової кислоти + (7S,8S) діастереомер (6,33 г, 17,4 ммоль) обробляли натрієм (1,6 г, 69,5 ммоль) відповідно до методу прикладу 11, стадія D. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат = 1/1) одержували (7R,8R)-7-меркапто-1,4діокса-спіро[4.5]декан-8-ол + (7S,8S) діастереомер (Rf = 0,4,1,36 г, 38%). 1 H ЯМР (400MHz, DMSO-d6, , млн.д): 4.89 (d, 1H, ОН), 3.83 (m, 4Н, OCH 2CH2O), 3.17 (m, 1H, СНО), 2.76 (m, 1H, CHS), 2.43 (s, 1H, SH), 1.90 - 1.30, 6Н). MS-ESI (m/z): 189 (M-H) . Стадія D. 14-О-{[(7R,8R)-8-гiдpoкcи-1,4-дioкca-cпipo[4.5]дeц-7-iлcyльфaнiл]aцeтил}мyтилiн + (7S,8S) діастереомер (7R,8R)-7-меркапто-1,4-діокса-спіро[4.5]eKaH-8-on + (7S,8S) діастереомер (1,36 г, 7,15 ммоль) обробляли плевромутилінтозилятом (3,8 г, 7,15 ммоль) відповідно до методу прикладу 11, стадія Е. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат = 1/1) одержували 14-О-{[(7R,8R)-8-гідрокси-1,4-nдіокса-спіро[4.5]дец-7ілсульфаніл]ацетил}мутилін + (7S,8S) діастереомер (Rf = 0,25,1,90 г, 48%) у безбарвному аморфному спіненому вигляді. MC-ECI (m/z): 573 (MNa+), 1123 (2MNa+), 549(M-H), 585 (MCl). Стадія E. 14-О-{[(7R,8R)-8-(трет-бутиддифенілсиланілокси)-1,4-діокса-спіро[4.5]дец-7ілсульфаніл]ацетил}мутилін + (7S,8S) діастереомер 14-О-{[(7R,8R)-8-гідрокси-1,4-діокса-спіро[4.5]дец-7-ілсульфаніл]ацетил}мутилін + (7S,8S) діастереомер (1,90 г, 3,45 ммоль) обробляли відповідно до методу прикладу 13, стадія В. Після обробки й хроматографії реакційної суміші (діоксид кремнію, цикл огексан/ети л ацетат = 3/2) одержували 14-О-{[(7R,8R)-8-(трет-бутилдифенілсиланілокси)-1,4-діокса-спіро[4.5]дец-7ілсульфаніл]ацетил}мутилін + (7S,8S) діастереомер (R f = 0,6,1,65 г, 61%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 1.1 - 7.35 (m, 10Н, aromat.-H), 6.13, 6.12 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.53 (d, 1Н, 14-Н, J = 7Hz), 5.05 (m, 2Н, 20-Н), 4.50 (m, 1Н, 11ОН), 3.78 (m, 4Н, OCH2CH2O), 3.70 (m, 1Н, 1’-Н), 3.42 (m, 1Н, 11-Н), 3.05 (m, 3Н, 2'-Н, 22-Н), 2.40 (bs, 1Н, 4-Н), 1.36,1.34 (2s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 1.00 (s, 9Н, Si-terMratyl), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.60,0.58 (2d, 3Н, 16-CH3, J = 7Hz). Стадія F. 14-О-{[(1R,2R)-2-(трет-бутилдифенілсиланілокси)-5оксоциклогексилсульфаніл]ацетил}мутилін + (1S,2S) діастереомер 14-О{[(7R,8R)-8-(трет-бутилдифенілсиланілокси)-1,4-діокса-спіро [4.5] дец-7ілсульфаніл]ацетил}мутилін + (7S,8S) діастереомер (1,65 г, 2,09 ммоль) обробляли відповідно до методу прикладу 13, стадія С. Неочищений 14-О-{[(1R,2R)-2-(тpeтбутилдифенілсиланілокси)-5-оксоциклогексилсульфаніл] ацетил} мутилін + (1 S,2S) діастереомер (1,34 г, вихід 86%, циклогексан/етилацетат = 2/1, R f= 0,3) одержували у вигляді безбарвної аморфної спіненої речовині, яку безпосередньо використали на наступній стадії. 1 H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 1.1 - 7.35 (m, 10Н, aromat.-H), 6.11, 6.09 19 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.48 (d, 1Н, 14-Н, J = 7Hz), 4.98 (m, 2Н, 20-Н), 4.47 (m, 1H, 11ОН), 4.03 (m, 1H, V-H), 3.45 - 2.95 (m, 4Н, 11-Н, 2'-Н, 22-Н), 2.37 (bs, 1Н, 4-Н), 1.31, 1.29 (2s, 3Н, 15-CH3), 1.02 (s, 12Н, 18-CH3, Si-tert-butyl), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.53 (d, 3Н, 16-CH3, J = + 7Hz). MS-ESI (m/z): 767 (MNa ), 779 (МСl ). Стадія G. 14-О-{[(1R,2R)-2-(трет-бутилдифенілсиланілокси)-5гідроксиіміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S) діастереомер 14-О-{[(1R,2R)-2-(трет-бутилдифенілсиланілокси)-5оксоциклогексилсульфаніл]ацетил}мутилін + (1S,2S) діастереомер (1,34 г, 1,80 ммоль) обробляли відповідно до методу прикладу 13, стадія D. Неочищений 14-О-{[(1R,2R)-2-(тpeтбутилдифенілсиланілокси)-5-гідроксиіміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S) діастереомер (кількісний вихід, циклогексан/етилацетат = 1/1, R f = 0,6) одержували у вигляді безбарвної аморфної спіненої речовини, яку безпосередньо використали на наступній стадії. Стадія Н. 14-О-{[(1R,2R,5S)-2-(трет-бутилдифенілсиланілокси)-5гідроксиаміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер й 14-О-{[(1 R,2R,5 R)-2-(тpeт-бутилдифенілсиланілокси)-5гідроксиаміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5S) діастереомер 14-О{[(1R,2R,5R)-2-(трет-бутилдифенілсиланілокси)-5гідроксиіміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S) діастереомер (2,55 г, 3,36 ммоль) обробляли відповідно до методу прикладу 13, стадія Е. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат = 1/3) одержували 14-О{[(1R,2R,5S)-2-(трет-бутилдифенілсиланілокси)-5гідроксиаміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (а) (R f = 0,4, 220 мг, вихід 16%) і 14-О-{[(1R,2R,5R)-2-(трет-бутилдифенілсиланілокси)-5гідроксиаміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5S) діастереомер (b) (R f = 0,25, 560 мг, вихід 41%). 1 (a): H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 7.65 - 7.35 (m, 10Н, aromat.-H), 7.00 (bs, 1Н, NH/OH), 6.11,6.09 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.50 (d, 1Н, 14-Н, J = 8Hz), 5.00 (m, 2Н, 20-Н), 4.47 (m, 1Н, 11-ОН), 3.80 (m, 1Н, 2'-Н), 3.40 (t, 1Н, 11-Н, J = 6Hz), 3.00 (m, 1Н, 1’-Н), AB-system А = 3.93, B = 3.80, 22-Н, J = 15Hz), 2.68 (m, 1Н, 5'-H), 2.40 (bs, 1H, 4-Н), 1.31,1.29 (2s, 3Н, 15-CH3), 1.00 (s, 12Н, 18-CH3, Si-tert-butyl), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.55 (d, 3Н, 16-CH3, J = 7Hz). 1 (b): H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 7.7 - 7.35 (m, 10Н, aromat.-H), 6.97 (s, 1H, NH/OH), 6.16, 6.14 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.56 (m, 2Н, 14-Н), 5.40 (bs, 1Н, NH/OH), 5.07 (m, 2Н, 20-Н), 4.49,4.48 (2d, 1H, 11-ОН, J = 6Hz), 3.48 (m, 1Н, 2'-Н), 3.43 (t, 1Н, 11-Н, J = 6Hz), 3.24 (m, 2Н, 22-Н), 2.79 (m, 1H, V-H), 2.40 (bs, 1Н, 4-Н), 2.33 (m, 1H, 5'-H), 1.38,1.35 (2s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.98 (s, 9Н, Si-terf-butyl), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63, 0.61 (2d, 3Н, 16-CH3, J = 6Hz). Стадія I. 14-О-{[(1R,2R,5S)-2-(тpeт-бутилдифенілсиланілокси)-5(формілгідроксиаміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер 14-О{[(1R,2R,5S)-2-(трет-бутилдифенілсиланілокси)-5гідроксиаміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (215 мг, 0,282 ммоль) обробляли відповідно до методу прикладу 13, стадія F. Після виділення осаду, що випав, фільтруванням одержали 14-О-{[(1R,2R,5S)-2-(трет-бутилдифенілсиланілокси)-5(формілгідроксиаміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (135 мг, вихід 61%, циклогексан/етилацетат = 1/3, Rf = 0,65) у вигляді безбарвної твердої речовини. 1 H ЯМР (400MHz, DMSO-d6) 5, млн.д, крім іншого): 9.8, 9.3 (2bs, 1Н, NOH), 8.2,7.9 (2bs, 1Н, СНО), 7.60 - 7.35 (m, ІОН, aromat.-H), 6.11, 6.09 (2dd, 1H, 19-H, J = 11Hz and 18Hz), 5.50 (d, 1H, 14-H, J = 8Hz), 5.00 (m, 2H, 20-H), 4.47 (d, 1H, 11-OH, J = 6Hz), 3.40 (t, 1H, 11-H, J = 6Hz), 2.37 (bs, 1H, 4-H), 1.32,1.30 (2s, 3H, 15-CH3), 1.03 (s, 12H, 18-CH3, Si-tert-butyl), 0.82,0.80 (d, 3H, 17CH3, J = 7Hz), 0.55 (d, 3H, 16-CH3, J = 6Hz). Стадія J. 14-О-{[(1R,2R,5S)-5-(формілгідроксиаміно)-2гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер 14-О-{[(1R,2R,5S)-2-(трет-бутилдифенілсиланілокси)-5(формілгідроксиаміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (130 мг, 0,164 ммоль) обробляли відповідно до методу прикладу 13, стадія G. Після виділення осаду, що випав, фільтруванням одержали 14-О-{[(1R,2R,5S)-5-(формілгідроксиаміно)-2гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (77 мг, вихід 85%, дихлорметан/метанол = 9/16 Rf = 0,4) у вигляді безбарвної твердої речовини. 1 H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 9.7,9.3 (2bs, 1H, NOH), 8.2, 7.9 (2s, 1Н, СНО), 6.13 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.53 (d, 1Н, 14-Н, J = 8Hz), 5.06 (m, 2Н, 20-Н), 4.91 20 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 (d, 1Н, 2'-ОН), 4.49 (d, 1H, 11-ОН, J = 6Hz), 4.2,3.7 (2m, 2Н, 2'-Н, 5'-Н), 3.41 (t, 1Н, 11-Н, J = 6Hz), 3.28 (m, 2Н, 22-Н), 3.13 (m, 1Н, 1’-Н), 2.40 (bs, 1H, 4-Н), 1.35 (s, 3Н, 15-CH3), 1.06 (s, 12Н, 18+ CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 6Hz). MS-ESI (m/z): 574 (MNa ), 1125 + (MNa ), 550 (M-H) , 1101 (2M-H) . Приклад 15 14-О-{[(1R,2R,3R/S)-3-формілгідроксиаміно)-2гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,3R/S) діастереомер Стадія А. 14-О-{[(6R,7R)-6-гiдpoкcи-1,4-дioкca-cпipo[4.5]дeц-7-iлcyльфaнiл]aцeтил}мyтилiн + (6S,7S) діастереомер 6,7-епокси-1,4-діокса-спіро[4.5]декан (Vankar, Y.D.; Reddy M.V.; Chaudhuri, N.C. Tetrahedron 1994,50(37), 11057-11078)(16,24 г, 104 ммоль) і плевромутилінтіол (20,5 г, 52 ммоль) обробляли відповідно до методу прикладу 1, стадія A1. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/діоксан = 2/1) одержували 14-О-{[(6R,7R)-6-гідрокси-1,4-діоксаспіро[4.5]дец-7-ілсульфаніл]ацетил}мутилін + (6S,7S) діастереомер (R f = 0,5,15,6 г, вихід 55%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (400MHz, DMSO-d6,, млн.д, крім іншого): 6.13 (dd, 1H, 19-Н, J = 11Hz and 18Hz), 5.53 (d, 1Н, 14-Н, J = 7Hz), 5.05 (m, 2Н, 20-Н), 4.90 (m, 1H, 2-ОН), 4.47 (m, 1Н, 11-ОН), 3.97 (m, 1Н, 2'-Н), 3.32 (m, 1H, 11-Н), 3.50 - 3.20 (m, 2Н, 22-Н), 2.80 (m, 1Н, 1’-Н), 2.40 (bs, 1Н, 4-Н), 1.35,1.34 (2s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.62 (d, 3Н, 16-CH3, J = 6Hz). Стадія В. 14-О-{[(1R,2R)-2-гідрокси-3-оксоциклогексилсульфаніл]ацетил}мутилін + (1S,2S) діастереомер 14-О-{[(6R,7R)-6-гідрокси-1,4-діокса-спірор[4.5]дец-7-ілсульфаніл]ацетил}мутилін + (6S,7S) діастереомер (15,6 г, 28,4 ммоль) обробляли відповідно до методу прикладу 13, стадія C Після обробки й хроматографії реакційної суміші (діоксид кремнію, цикл огексан/ети л ацетат = 1/1) одержували 14-О-{[(1R,2R)-2-гідрокси-3-оксоциклогексилсульфаніл]ацетил}мутилін + (1S,2S) діастереомер (Rf = 0,4, 3,14 г, вихід 22%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 6.13 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.55 (d, 1Н, 14-Н, J = 8Hz), 5.23 (m, 1Н, 2'-ОН), 5.05 (m, 2Н, 20-Н), 4.49 (d, 1H, 11-ОН, J = 6Hz), 4.00 (m, 1H, 2'-Н), 3.50 - 3.30 (m, 3Н, 11-Н, 22-Н), 2.86 (m, 1Н, 1’-Н), 2.40 (bs, 1Н, 4-Н), 1.35 (s, 3Н, 15-СНз), 1.06 (s, 3Н, 18-CH3), 0.80 (d, 3Н, 17-CH3, J = 7Hz), 0.61 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI + + (m/z): 529 (MNa ), 1035 (2MNa ). Стадія С. 14-О-{[(1R,2R)-2-гiдpoкcи-3-гiдpoкcиiмiнoциклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S) діастереомер 14-О-{[(1R,2R)-2-гiдpoкcи-3-oкcoциклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S) діастереомер 3,14 г, 6,19 ммоль) обробляли відповідно до методу прикладу 13, стадія D. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат = 1/1) одержували 14-О-{[(1R,2R)-2-гідрокси-3-гідроксиіміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S) діастереомер (Rf = 0,2,1,75 г, вихід 54%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 10.5 (s, 1Н, NOH), 6.13, 6.12 (2dd, 1Н, 19Н, J = 11Hz and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.33 (d, 1Н, 2-ОН, J = 4Hz), 5.05 (m, 2Н, 20-Н), 4.50 (m, 1Н, 11-ОН), 3.96 (m, 1Н, 2-Н), 3.42 (t, 1Н, 11-Н, J = 6Hz), 3.25 (m, 2Н, 22-Н), 3.14 (m, 1H, 1’-Н), 2.40 (bs, 1Н, 4-Н), 1.35 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). Стадія D. 14-О-{[(1R,2R,3R/S)-2-гідрокси-3гідроксиаміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,3R/S) діастереомер 14-О-{[(1R,2R)-2-гiдpoкcи-3-гiдpoкcиiмiнoциклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S) діастереомер (1,75 г, 3,35 ммоль) обробляли відповідно до методу прикладу 13, стадія Е. Після обробки й хроматографії реакційної суміші (діоксид кремнію, етилацетат/метанол = 10/1) одержували 14-О-{[(1R,2R,3R/S)-2-гідрокси3гідроксиаміноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,3R/S) діастереомер (R f = 0,2, 1,34 г, вихід 65%) у безбарвному аморфному спіненому вигляді. 1 H ЯМР (400MHz, DMSO-d6,, млн.д, крім іншого): 7.1 (bs, 1Н, NH/OH), 6.12, 6.11 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.53 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.90 (ш ДН, 2'-OH), 4.5 (m, 1Н, 11-ОН), 3.41 (t, 1Н, 11-Н, J = 6Hz), 3.73,3.53,3.30,3.14,3.01, 2.87 (6m, 5Н, 1’-Н, 2'-Н, 3’-Н, 22-Н), 2.40 (bs, 1Н, 4-Н), 1.35 (2s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). Стадія Е. 14-О-{[(1R,2R,3R/S)-3-(формілгідроксиаміно)-2гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,3R/S) діастереомер 14-О-{[(1R,2R,ЗR/S)-2-гiдpoкcи-3-гiдpoкcиaмiнoциклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,3R/S) діастереомер (899 мг, 1,72 ммоль) обробляли відповідно до методу прикладу 13, 21 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 стадія F. Після відділення осаду фільтруванням одержували 14-О-{[(1R,2R,3R/S)-3(формілгідроксиаміно)-2-гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,3R/S) діастереомер (724 мг, вихід 76%, дихлорметан/метанол = 9/1, R f = 0,5) у вигляді безбарвної твердої речовини. 1 H ЯМР (400MHz, DMSO-d6,8, млн.д, крім іншого): 9.6,9.9.4,9.1 (3bs, 1Н, NOH), 8.2, 7.9 (2s, 1Н, СНО), 6.13,6.11 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.24 (m, 1H, 2'-ОН), 5.05 (m, 2Н, 20-Н), 4.49 (m, 1Н, 11-ОН), 3.86,3.60 (2m, 1Н, 2'-Н), 3.39 (t, 1Н, 11-Н, J = 6Hz), 3.28,3.13, 2.64 (3m, 4Н, 1’-Н, 3’-Н, 22-Н), 2.38 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.06 (s, 12Н, 18+ CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 574 (MNa ), 1125 + (2MNa ), 550 (M-H) , 1101 (2М-Н) . Приклад 16 Гідрохлорид 14-О-{[(1R,2R,5S)-2-гідрокси-5метиламіноциклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5R) діастереомера Стадія А. Складний трет-бутиловий ефір N-метил-N-(циклогекс-3-еніл)карбамінової кислоти Складний трет-бутиловий ефір циклогекс-3-енілкарбамінової кислоти (Kampferer, P.; Vasella, A. Helvetica Chimica Acta 2004, 87, 2764-2789) (3 г, 15,2 ммоль) і метилйодид (0,95 мл, 15,2 ммоль) обробляли протягом 1 години відповідно до методу прикладу 7, стадія А. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат = 10/1) одержували зазначену в заголовку сполуку (Rf = 0,22,2,04 г, вихід 64%) у вигляді безбарвної твердої речовини. 1 H ЯМР (200MHz, CDCl3,, млн.д): 5.64 (bs, 2Н, double bond), 4.17 (bs, 1Н, NCH), 2.74 (s, 3Н, NCH3), 2.13,1.70 (2m, 6Н), 1.47 (s, 9Н, tert-butyl). Стадія В. Складний трет-бутиловый ефір N-метил-N-(цис-3,4епоксициклогексил)карбамінової кислоти Складний трет-бутиловый ефір №метил-№(циклогекс-3-еніл)карбамінової кислоти (2 г, 9,5 ммоль) і 3-хлорнадбензойну кислоту (2,2 г,70%, 8,9 ммоль) обробляли протягом 1 години відповідно до методу прикладу 7, стадія В. Після обробки одержували неочищену сполуку, зазначену в заголовку (діоксид кремнію, циклогексан/етилацетат = 3/1, R f = 0,25,1,79 г, вихід 79%. 1 H ЯМР (200MHz, CDCl3,, млн.д): 4.0 (bs, 1Н, NCH), 3.15 (bs, 2Н, epoxide), 2.67 (s, 3Н, NCH3), 2.30 -1.10 (m, 6Н), 1.45 (s, 9Н, tert-butyl). Стадія C 14-О-{[(1R,2R,5S)-5-(трет-бутоксикарбонілметиламіно-2гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер Складний трет-бутиловый ефір N-метил-N-(цис-3,4-епоксициклогексил)карбамінової кислоти (1,7 г, 7,5 ммоль) обробляли плевромутилінтіолом (2,95 г, 7,5 ммоль) відповідно до методу прикладу 1, стадія A3. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат = 2/1) одержували 14-О-{[(1R,2R,5S)-5-(тpeтбутоксикарбонілметиламіно)-2-гідроксициклогексилсульфаніл]ацетил}мутилін + (1 S,2S,5R) діастереомер (Rf = 0,23,1,3 г, вихід 28%) у вигляді безбарвної твердої речовини. 1 H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 6.12 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.9 (d, 1Н, 2'-ОН, J = 4Hz), 4.47 (d, 1Н, 11-ОН, J = 6Hz), 3.97 (m, 1Н, 5'-Н), 3.70 (bs, 1H, 2'-Н), 3.42 (m, 1Н, 11-Н), 3.28 (m, 2Н, 22-Н), 3.11 (m, 1Н, VH), 2.62 (s, 3Н, NCH3), 2.40 (bs, 1Н, 4-Н), 1.37 (s, 9Н, tert-butyl), 1.35 (s, 3Н, 15-CH3), 1.04 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). Стадія D. 14-О-{[(1R,2R,5S)-2-гiдpoкcи-5-мeтилaмiнoциклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,5R) діастереомер 14-О-{[(1R,2R,5S)-5-(тpeт-бутоксикарбонілметиламіно)-2гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (1,3 г, 2,1 ммоль) обробляли відповідно до методу прикладу 1, стадія В. Після обробки й хроматографії реакційної суміші (діоксид кремнію, дихлорметан/метанол/ізопропанол /вода/оцтова кислота = 80/20/6/3/2) з наступною екстракцією основою одержували 14-О-{[(1R,2R,5S)-2-гідрокси-5метиламіноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (Rf = 0,4, 690 мг, 63%) у вигляді безбарвної твердої речовини. 1 H ЯМР (500MHz, DMSO-d6, , млн.д, крім іншого): 6.14 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.06 (m, 2Н, 20-Н), 4.81 (bs, 1Н, 2'-ОН), 4.52 (d, 1Н, 11-ОН, J = 6Hz), 3.51 (m, 1Н, 2'-Н), 3.43 (m, 1H, 11-Н), 3.30 (m, 2Н, 22-Н), 3.00 (m, 1Н, 1’-Н), 2.63 (m, 1Н, 5'-H), 2.41 (bs, 1H, 4-Н), 2.29 (s, 3Н, NCH3), 1.37 (s, 3Н, 15-CH3), 1.06 (s, 3Н, 18-CH3), 0.82 (d, 3Н, 17-CH3, J = 7Hz), 0.64 (d, 3Н, 16-CH3, J = 7Hz). Стадія Е. Гідрохлорид 14-О-{[(1R,2R,5S)-2-гідрокси-5-метиламіноциклогексилсульфаніл] ацетил }мутиліну + гідрохлорид (1S,2S,5R) діастереомера 14-О- {[(1R,2R,5S)-2-гідрокси-5 -метиламіноциклогексилсульфаніл] ацетил} мутилін + 22 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 (1S,2S,5R) діастереомер (690 мг, 1,32 ммоль) обробляли відповідно до методу прикладу 1, стадія 3, і одержували гідрохлорид 14-О-{[(1R,2R,5S)-2-гідрокси-5метиламіноциклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5R) діастереомера (731 мг, кількісний вихід) у вигляді безбарвної твердої речовини. 1 + H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 8.65 (bs, 2Н, NH2 ), 6.14 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.54 (d, 1H, 14-Н, J = 8Hz), 5.06 (m, 2Н, 20-Н), 4.51 (d, 1Н, 11-ОН, J = 6Hz), 3.72 (m, 1H, 2'-Н), 3.43 (m, 1Н, 11-Н), 3.37 - 3.00 (m, 4Н, 22-Н, 1’-Н, 5'-H), 2.50 (s, 3Н, NCH3), 2.40 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.06 (s, 3Н, 18-CH3), 0.82 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16+ CH3, J = 7Hz). MS-ESI(m/z): 522(MH ),556 (MCI). Приклад 17 Гідрохлорид 14-О-{[(1R,2R,5S) -5-аліламіно-2гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5R) діастереомера Стадія А. Складний трет-бутиловый ефір N-аліл-N-(циклогекс-3-еніл)карбамінової кислоти Складний трет-бутиловый ефір циклогекс-3-енілкарбамінової кислоти (Kampferer, P.; Vasella, A. Helvetica Chimica Acta 2004, 87,2764-2789) (3 м, 15,2 ммоль) і алілйодид (1,4 мл, 15,2 ммоль) обробляли протягом ночі відповідно до методу прикладу 7, стадія А. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат =10/1) одержували зазначену в заголовку сполуку (Rf = 0,55, 2,0 г, вихід 55 %) у вигляді безбарвної твердої речовини. 1 H ЯМР (200MHz, CDCl3,, млн.д): 5.60 (m, 2Н, double bond), 5.80, 5.10, 3.64 (3m, 5Н, allyl), 4.18 (bs, 1Н, NCH), 2.14,1.74 (2m, 6Н), 1.45 (s, 9Н, tert-butyl). Стадія В. Складний трет-бутиловый ефір N-аліл-N-(цис-3,4-епоксициклогексил)карбамінової кислоти Складний трет-бутиловый ефір N-аліл-N-(циклогекс-3-еніл)карбамінової кислоти (2 г, 8,4 ммоль) і 3-хлорнадбензойну кислоту (2,2 г, 70%, 8,9 ммоль) обробляли протягом ночі відповідно до методу прикладу 7, стадія В. Після обробки одержували неочищену зазначену в заголовку сполук (діоксид кремнію, циклогексан/етилацетат = 3/1, R f = 0,31, 1,90 г, вихід 89%). 1 H ЯМР (200MHz, CDCl3,, млн.д): 5.76, 5.10, 3.66 (3m, 5Н, allyl), 4.04 (bs, 1Н, NCH), 3.12 (bs, 2Н, epoxide), 2.30 - 1.20 (m, 6Н), 1.47 (s, 9Н, terf-butyl). Стадія С. 14-О-{[(1R,2R,5S)-5-(трет-бутоксикарбонілаліламіно-2гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер Складний трет-бутиловый ефір N-аліл-N-(цис-3,4-епоксициклогексил)карбамінової кислоти 1,9 г, 7,5 ммоль) обробляли плевромутилінтіолом (2,95 г, 7,5 ммоль) відповідно до методу прикладу 1, стадія А2. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат = 3/1 - > 1/1) одержували суміш 14-О-{[(1R,2R,5S)-5-(тpeтбутоксикарбонілаліламіно-2-гідроксициклогексилсульфаніл]ацетил}мутиліну + (1S,2S,5R) діастереомера й плевромутиліндисульфіду (циклогексан/етилацетат = 1/1, Rf = 0,21, 2,49 г). 1 H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 6.12 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.74 (m, 1H, NCH2CHCH2), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 4Н, 20-Н, NCH2CHCH2), 4.87 (d, 1Н, 2'-ОН, J = 3Hz), 4.49 (d, 1Н, 11-ОН, J = 6Hz), 3.95 (m, 1Н, 5'-Н), 3.68 (bs, 3Н, 2'-Н, NCH2CHCH2), 3.42 (t, 1Н, 11-Н, J = 6Hz), 3.26 (m, 2Н, 22-Н), 3.09 (m, 1Н, 1’-Н), 2.39 (bs, 1Н, 4-Н), 1.37 (s, 9Н, tert-butyl), 1.35 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 + + (d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 670 (MNa ), 1317 (2MNa ), 646 (M-H) . Стадія D. 14-О-{[(1R,2R,5S)-5-aлiлaмiнo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,5R) діастереомер Суміш 14-О-{[(1R,2R,5S)-5-(трет-бутоксикарбонілалілшіно-2гідроксициклогексилсульфаніл]ацетил}мутиліну + (1S,2S,5R) діастереомера й плевромутиліндисульфіду (2,4 г) обробляли відповідно до методу прикладу 1, стадія В. Після обробки й хроматографії реакційної суміші (діоксид кремнію, дихлорметан/метанол/ізопропанол/вода/оцтова кислота = 80/20/6/3/2) з наступною екстракцією основою одержували 14-О-{[(1R,2R,5S)-5-anmаміно-2гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (R f = ).5, 250 мг) у вигляді безбарвної твердої речовини. 1 H ЯМР (500MHz, DMSO-d6,, млн.д, крім іншого): 6.14 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.82 (m, 1Н, NCH2CHCH2), 5.55 (d, 1Н, 14-Н, J = 8Hz), 5.10 (m, 4Н, 20-Н, NCH2CHCH2), 4.77 (m, 1Н, 2-ОН), 4.51 (d, 1H, 11-ОН, J = 6Hz), 3.50 - 3.10 (m, 6Н, 2'-Н, 11-Н, 22-Н, NCH2CHCH2), 2.99 (m, 1Н, 1’-Н), 2.68 (m, 1H, 5'-H), 2.40 (bs, 1Н, 4-Н), 1.37 (s, 3Н, 15-CH3), 1.06 (s, 3Н, 18-CH3), 0.82 (d, + 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 548 (MH ), 546 (M-H) , 582 (МСl ). Стадія Е. Гідрохлорид 14-О-{[(1R,2R,5S)-5-аліаміно-2-гідроксицикл огексилсульфаніл] ацетил }мутиліну + гідрохлорид (1S,2S,5R) діастереомера 23 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 14-О-{[(1R,2R,5S)-5-aлiлaмiнo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1 S,2S,5R) діастереомер (250 мг, 1,46 ммоль) обробляли відповідно до методу прикладу 1, стадія С, і одержували гідрохлорид 14-О-{[(1R,2R,5S)-2-гідрокси-5-етиламіноциклогексилсульфаніл] ацетил }мутиліну + гідрохлорид (1S,2S,5R) діастереомера (273 мг, кількісний вихід без поправок) у вигляді безбарвної твердої речовини. 1 + H ЯМР (400MHz, DMSO-d6, 5, млн.д, крім іншого): 8.85 (bs, 2Н, NH2 ), 6.13 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.87 (m, 1Н, NCH2CHCH2), 5.55 (d, 1Н, 14-Н, J = 8Hz), 5.47,5.37 (2d, 2Н, NCH2CHCH2, J = 17Hz and 10Hz), 5.06 (m, 2Н, 20-Н), 4.51 (d, 1H, 11-ОН, J = 6Hz), 3.72 (m, 1H, 2'Н), 3.56 (d, 2Н, NCH2CHCH2, J = 6Hz), 3.43 (t, 1Н, 11-Н, J = 6Hz), 3.34 (m, 2Н, 22-Н), 3.13 (m, 2Н, 1’-Н, 5'-H), 2.40 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.06 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = + 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 548 (MH ), 582 (МСl ). Приклад 18 Гідрохлорид 14-О-{[(1R,2R,5S)-2-гідрокси-5-(2метоксиетиламіноциклогексилсульфаніл] ацетил }мутиліну + гідрохлорид (1S,2S,5R) діастереомера Стадія А. Складний трет-бутиловый ефір N-(2-метоксиетил)-N-(циклогекс-3еніл)карбамінової кислоти Складний трет-бутиловый ефір циклогекс-3-енілкарбамінової кислоти (Kampferer, P.; Vasella, A. Helvetica Chimica Acta 2004, 87,2764-2789) (3 г, 15,2 ммоль) і 2-бромоетилметиловий простий ефір (1,43 мл, 15,2 ммоль) обробляли протягом ночі відповідно до методу прикладу 7, стадія А. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат = 7/1) одержували зазначену в заголовку сполуку (R f = 0,33,1,2 г, вихід 31%) у вигляді безбарвної твердої речовини. 1 H ЯМР (200MHz, CDCl3,, млн.д): 5.61 (m, 2Н, double bond), 4.10 (bs, 1Н, NCH), 3.50 - 3.15 (m, 7Н, NCH2CH2OCH3), 2.15,1.72 (2m, 6Н), 1.47 (s, 9Н, tert-bvXy\). Стадія В. Складний трет-бутиловый ефір N-(2-метоксиетил)-N-(цис-3,4епоксициклогексил)карбамінової кислоти Складний трет-бутиловый ефір N-(2-метоксиетил)-N-(циклогекс-3-еніл)карбамінової кислоти (1,2 г, 4,7 ммоль) і 3-хлолрнадбензойну кислоту (1,2 г, 70%, 4,87 ммоль) обробляли протягом двох днів відповідно до методу прикладу 7, стадія В. Після обробки одержували неочищену зазначену в заголовку сполуку (діоксид кремнію, циклогексан/етилацетат = 3/1, R f = 0,33,1,08 г, вихід 85%). 1 H ЯМР (200MHz, CDCl3,, млн.д): 3.94 (bs, 1H, NCH), 3.50 - 3.05 (m, 9Н, NCH2CH2OCH3, epoxide), 2.30 -1.20 (m, 6Н), 1.45 (s, 9Н, tert-butyl). Стадія С. 14-О-{[(1R,2R,5S)-5-(трет-бутоксикарбоніл)-2-(метоксиетил)аміно)-2гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер Складний трет-бутиловый ефір N-(2-метоксиетил)-N-(цис-3,4епоксициклогексил)карбамінової кислоти (1,08 г, 4,0 ммоль) обробляли плевромутилитіолом (1,57 г, 4,0 ммоль) відповідно до методу прикладу 1, стадія А2. Після обробки й хроматографії реакційної суміші (діоксид кремнію, циклогексан/етилацетат = 1/2) одержували 14-О{[(1R,2R,5S)-5-(трет-бутоксикарбоніл)-2-(метоксиетил)аміно)-2гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (R f = 0,5, 500 мг, вихід 19%) у вигляді безбарвної твердої речовини. 1 H ЯМР (400MHz, DMSO-d6,, млн.д, крім іншого): 6.13 (2dd, 1H, 19-Н, J = 11Hz and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 2Н, 20-Н), 4.88 (d, 1Н, 2-ОН, J = 4Hz), 4.48 (d, 1Н, 11-ОН, J = 6Hz), 3.85 (m, 1Н, 5'-H), 3.68 (bs, 1Н, 2'-Н), 3.42 (t, 1Н, 11-Н, J = 6Hz), 3.35 - 3.05 (m, 10Н, 22-Н, NCH2CH2OCH3, 1’-Н), 2.40 (bs, 1Н, 4-Н), 1.38 (s, 9Н, terf-butyl), 1.35 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). Стадія D. 14-О-{[(1R,2R,5S)-2-гідрокси-5-(2-метоксиетиламіно)циклогексилсульфаніл] ацетил} мутилін + (1S,2S,5R) діастереомер 14-О-{[(1R,2R,5S)-5-(трет-бутоксикарбоніл)-2-(метоксиетил)аміно)-2гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (500 мг, 0,75 ммоль) обробляли відповідно до методу прикладу 1, стадія В. Після обробки й хроматографії реакційної суміші (діоксид кремнію, дихлорметан/метанол/ізопропанол/ вода/оцтова кислота = 80/20/6/3/2) з наступною екстракцією основою одержували 14-О-{[(1R,2R,5S)-2-гідрокси-5-(2метоксиетиламіно)циклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R) діастереомер (R f = 0,6, 330 мг, 78%) у вигляді безбарвної твердої речовини. 1 H ЯМР (500MHz, DMSO-d6,, млн.д, крім іншого): 6.14 (dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.06 (m, 2Н, 20-Н), 4.74 (m, 1Н, 2'-ОН), 4.51 (2d, 1Н, 11-ОН, J = 6Hz), 3.50 - 3.20 (m, 9Н, 11-Н, 2'-Н, 22-Н, NCH2CH2OCH3), 2.97 (m, 1Н, 1’-Н), 2.63 (m, 3Н, 5'-Н, NCH2CH2OCH3), 2.40 (bs, 1Н, 4-Н), 1.37 (s, 3Н, 15-CH3), 1.06 (s, 3Н, 18-CH3), 0.82 (d, 3Н, 17-CH3, 24 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 J = 7Hz), 0.63 (d, 3Н, 16-CH3, J = 7Hz). Стадія Е. Гідрохлорид 14-О-{[(1R,2R,5S)-2-гідрокси-5-(2метоксиетиламіноциклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5R) діастереомера 14-О-{[(1R,2R,5S)-2-гiдpoкcи-5-(2-мeтoкcиeтилaмiнo)циклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,5R) діастереомер (330 мг, 0,58 ммоль) обробляли відповідно до методу прикладу 1, стадія С и одержували гідрохлорид 14-О-{[(1R,2R,5S)-2-гідрокси-5-(2метоксиетиламіноциклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5R) діастереомера (335 мг, кількісний вихід, без поправок) у вигляді безбарвної твердої речовини. 1 + H ЯМР (400MHz, DMSO-d6, , млн.д, крім іншого): 8.65 (bs, 2Н, NH2 ), 6.13 (2dd, 1Н, 19-Н, J = 11Hz and 18Hz), 5.55 (d, 1Н, 14-Н, J = 8Hz), 5.06 (m, 2Н, 20-Н), 4.51 (d, 1Н, 11-ОН, J = 6Hz), 3.71 (m, 1Н, 2'-Н), 3.57 (m, 5Н, NCH2CH2OCH3), 3.42 (t, 1Н, 11-Н, J = 6Hz), 3.33 (m, 2Н, 22-Н), 3.203.00 (m, 4Н, 1’-Н, 5'-Н, NCH2CH2OCH3), 2.40 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18+ CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (2d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 566 (MH ), 600 (МСl ). Приклад 19 Гідрохлорид 14-О-{[(1R,2R,4R*)-2-гідрокси-4-(2гідроксиетиламіно)циклогексилсульфаніл] ацетил }мутиліну + гідрохлорид (1S,2S,4S*) діастереомера Стадія А. 14-О-{[(1R,2R,4R/S)-2-(тpeт-бyтилдифeнiлcилaнiлoкcи)-4-(2гідроксиетиламіно)циклогексилсульфаніл] ацетил} мутилін + (1S,2S,4R/S) діастереомер До розчину 14-О-{[(1R,2R)-2-(трет-бутилдифенілсиланілокси)-4оксоциклогексилсульфаніл]ацетил}мутиліну + (1S,2S) діастереомера (1,50 г, 2,01 ммоль) із прикладу 13, стадія С, в 20 мл дихлорметану додавали зтаноламін (0,12 мл, 2,01 ммоль) і ызопропоксид титану (IV) (0,7 мл, 2,52 ммоль) і перемішували протягом 2 годин при кімнатній температурі. Отриману реакційну суміш обробляли ціаноборгідридом натрію (126 мг, 2 ммоль) протягом ночі при кімнатній температурі, розбавляли додатковою кількістю дихлорметану й екстрагували розчином NaHCO3. Органічний шар висушували над сульфатом натрію й фільтрували. Фільтрату піддавали хроматографії (діоксид кремнію, дихлорметан/метанол =30/1), у результаті чого одержували 14-О-{[(1R,2R,4R/S)-2-(тpeт-бутилдифенілсиланілокси)-4(2-гідроксиетиламіно)циклогексилсульфаніл]ацетил}мутилін + гідрохлорид (1S,2S,4R/S) діастереомер (Rf = 0,3, 230 мг, вихід 14%). 1 H ЯМР (500MHz, CDCl3,, млн.д, крім іншого): 7.8 - 7.30 (m, 10Н, aromat.-H), 6.47 (m, 1Н, 19Н), 5.75,5.69 (2d, 1H, 14-Н, J = 8Hz), 5.40-5.15 (m, 1Н, 20-Н), 4.04, 3.65 (2m, 1Н, 2'-Н), 3.64,3.51 (2m, 2Н, NCH2CH2OH), 3.36 (m, 1Н, 11-Н), 2.74,2.54 (2m, 2Н, NCH2CH2OH), 2.11 (bs, 1Н, 4-Н), 1.44,1.45 (2s, 3Н, 15-CH3), 1.17,1.16 (s, 3Н, 18-CH3), 1.08 (s, 9Н, Si-tert-butyl), 0.88 (2d, 3Н, 17+ CH3), 0.75 - 0.65 (m, 3Н, 16-CH3). MS-ESI (m/z): 790 (MH ), 824 (MCl ). Стадія В. 14-О-{[(1R,2R,4R*)-2-гідрокси-4-(2гідроксиетиламіно)циклогексилсульфаніл] ацетил} мутилін + (1S,2S,4S*) діастереомер До розчину 14-О-{ [(Ш^,4Ш8)-2-(трет-бутилдифенілсиланілокси)-4-(2гідроксиетиламіно)циклогексилсульфаніл] ацетил }мутиліну + (1S,2S,4R/S) діастереомера (230 мг, 0,29 ммоль) в 15 мл ацетонітрилу додавали HF (40% водяний розчин, 2 краплі) і перемішували протягом ночі при кімнатній температурі. У реакційну суміш додавали розчин NaHCO3 й екстрагували дихлорметаном. Об'єднані органічні шари висушували над сульфатом натрію, фільтрували й концентрували при зниженому тиску. Після хроматографії (діоксид кремнію, дихлорметан/метанол = 6/1) одержували зазначену в заголовку сполуку (Rf = 0,4, 50 мг, вихід 31%). 1 H ЯМР (400MHz, CDCl3,, млн.д, крім іншого): 6.48 (dd, 1Н, 19-Н, J = 11Hz and 17Hz), 5.76, 5.68 (2d, 1Н, 14-Н, J = 8Hz), 5.40 - 5.15 (m, 1Н, 20-Н), 3.66 (t, 2Н, NCH2CH2OH, J = 5Hz), 3.50 3.15 (m, 4Н, 2-Н, 11-Н, 22Н), 2.80 (m, 2Н, NCH2CH2OH), 2.63 (m, 2Н, l'-Н, 4'-H), 2.11 (bs, 1Н, 4-Н), 1.46 (s, 3Н, 15-CH3), 1.18 (s, 3Н, 18-CH3), 0.89 (d, 3Н, 17-CH3), 0.73 (2d, 3Н, 16-CH3). MS-ESI + (m/z): 552 (MH ). Стадія C Гідрохлорид 14-О-{[(1R,2R,4R*)-2-rupoKcn-4-(2гідроксиетиламіно)циклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,4S*) діастереомера 14-О-{[(1R,2R,4R*)-2-r^poKCH-4-(2гідроксиетиламіно)циклогексилсульфаніл]ацетил} мутилін + (1S,2S,4S*) діастереомер (50 мг, 0,091 ммоль) обробляли відповідно до методу прикладу 1, стадія С, і одержували гідрохлорид 14-О-{[(1R,2R,4R*)-2-гідрокси-4-(2гідроксиетиламіно)циклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,4S*) діастереомера (43 мг, вихід 80%) у вигляді безбарвної твердої речовини. 25 UA 97836 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 H ЯМР (500MHz, CDCl3,, млн.д, крім іншого): 6.46 (dd, 1Н, 19-Н, J = 11Hz and 17Hz), 5.76 (d, 1Н, 14-Н, J = 8Hz), 5.37 (d, 1Н, 20-Н, J = 11Hz), 5.23 (d, 1Н, 20-Н, J = 17Hz), 3.95 (m, 2Н, NCH2CH2OH, J = 5Hz), 3.58 (m, 1Н, 2'-Н), 3.40 - 3.10 (m, 5Н, 11-Н, 22Н, NCH2CH2OH), 2.72 (m, 1Н, V-K), 2.11 (bs, 1Н, 4-Н), 1.46 (s, 3Н, 15-CH3), 1.18 (s, 3Н, 18-CH3), 0.89 (d, 3Н, 17-CH3, J = 7Hz), + 0.73 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 552 (MH ), 586 (MCI). Приклад 20 Гідрохлорид 14-О-{[(1R,2R,4R*)-4-4moioreKcraаміно-2гідроксициклогексилсульфаніл]ацетил}мугиліну + гідрохлорид (1S,2S,4S*) діастереомера Стадія А. 14-О-{[(1R^^*)-2-(трет-бутилдифенілсиланілокси)-4-(2гідроксиетиламіно)циклогексилсульфаніл] ацетил} мутилін + (1S,2S,4S*) діастереомер Здійснили взаємодію 14-О-{ [(Ш^)-2-(трет-бутилдифенілсиланілокси)-4оксоциклогексилсульфаніл]ацетил}мутиліну + (1S,2S) діастереомера (1,50 г, 2,01 ммоль) із прикладу 13, стадія С, із циклогексиламіном (0,23 мл, 1,01 ммоль) відповідно до методу прикладу 19, стадія А. Після обробки й хроматографії реакційної суміші (діоксид кремнію, дихлорметан/метанол = 30/1) одержали 14-О-{[(1R,2R,4R*)-2-(тpeт-бутилдифенілсиланілокси)-4(циклогексиламіноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,4S*) діастереомер (R f = 0,13,150 мг, вихід 9%). 1 H ЯМР (500MHz, CDCl3, 5, млн.д, крім іншого): 7.8 - 7.3 (m, 10Н, aromat.-H), 6.48 (dd, 1Н, 19Н, J = 11Hz and 17Hz), 5.76 (d, 1Н, 14-Н, J = 8Hz), 5.40 - 5.15 (m, 1Н, 20-Н), 3.62 (m, 1H, 2'-Н), 3.40 - 3.10 (m, 3Н, 11-Н, 22-Н), 2.77 (m, 1Н, 1’-Н), 2.11 (bs, 1Н, 4-Н), 1.46 (s, 3Н, 15-CH3), 1.16 (s, 3Н, 18-СНз), 1.07 (s, 9Н, Si-tert-butyl), 0.88 (2d, 3Н, 17-CH3), 0.74,0.73 (2d, 3Н, 16-CH3). MS+ ESI (m/z): 828 (MH ), 862 (МСl ). Стадія В. 14-О-{[(1R,2R,4R*)-4-циклогексил-2-гідроксициклогексилсульфаніл] ацетил} мутилін + (1S,2S,4S*) діастереомер 14-О-{[(1R,2R)-2-(трет-бутилдифенілсиланілокси)-4циклогексиламіноциклогексилсульфаніл] ацетил} мутилін + (1S,2S,4S*) діастереомер (100 мг, 0,121 ммоль) обробляли HF (40% водяний розчин, 30 краплі) протягом 5 годин відповідно до методу прикладу 19, стадія В. Після обробки й хроматографії реакційної суміші (діоксид кремнію, дихлорметан/метанол = 10/1) одержували зазначену в заголовку сполуку (R f = 0,13, 23 мг, вихід 32%). 1 H ЯМР (500MHz, CDCl3,, млн.д, крім іншого): 6.46 (dd, 1Н, 19-Н, J = 11Hz and 17Hz), 5.75 (m, 1Н, 14-Н), 5.40 - 5.15 (m, 1Н, 20-Н), 3.49 (m, 1Н, 2'-Н), 3.35 (m, 1Н, 11-Н), AB-system (А = 3.30, в = 3.20, 22-Н, J = 15Hz), 3.01 (m, 1Н, 4'-Н), 2.67 (m, 1Н, 1’-Н) 2.09 (bs, 1Н, 4-Н), 1.45 (s, 3Н, 15-CH3), 1.16 (s, 3Н, 18-CH3), 0.87 (d, 3Н, 17-CH3, J = 7Hz), 0.72 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI + (m/z): 591 (MH ). Стадія С. Гідрохлорид 14-О-{[(1R,2R,4R*)-4-циклогексил-2гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,4S*) діастереомера 14-О-{[(1R,2R,4R*)-4-циклoгeкcил-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,4S*) діастереомер (23 мг, 0,039 ммоль) обробляли відповідно до методу прикладу 1, стадія С, і одержували гідрохлорид 14-О-{[(1R,2R,4R*)-4-циклогексил-2гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,4S*) діастереомера (26 мг, кількісний вихід, без поправок) у вигляді безбарвної твердої речовини. 1 + H ЯМР (500MHz, CDCl3,, млн.д, крім іншого): 9.3 (bs, 2Н, NH2 ), 6.46 (dd, 1Н, 19-Н, J = 11Hz and 17Hz), 5.75 (d, 1Н, 14-Н, J = 8Hz), 5.38 (d, 1Н, 20-Н, J = 12Hz), 5.22 (d, 1Н, 20-Н, J = 17Hz), 3.50 - 3.00 (m, 6Н, 2'-Н, 11-Н, 22Н, NcHex), 2.65 (m, 2Н, 1’-Н, За'-Н), 2.10 (bs, 1Н, 4-Н), 1.45 (s, 3Н, 15-CH3), 1.18 (s, 3Н, 18-CH3), 0.88 (d, 3Н, 17-CH3, J = 7Hz), 0.73 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI + (m/z): 591 (MH ), 624 (МСl ). Приклад 21 - 14-О-{[(1R,2R,4R*)-4-4Hioionponmаміно-2-гідроксициклогексилсульфаніл] ацетил} мутилін + (1S,2S,4S*) діастереомер Стадія А. 14-О-{[(1R,2R,4R*)-2-(трет-бутилдифенілсиланілокси)-4циклопропіламіноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,4S*) діастереомер Здійснювали взаємодію 14-О-{[(1R,2R)-2-(трет-бутилдифенілсиланілокси)-4оксоциклогексилсульфаніл] ацетил} мутиліну + (1S,2S) діастереомера (750 мг, 1,01 ммоль) із прикладу 13, стадія С, із циклопропіламіном (0,07 мл, 1,01 ммоль) в 40 мл дихлорметану відповідно до методу прикладу 19, стадія А. Після обробки ціаноборгідридом натрію додавали этанол (0,7 мл) і суміш перемішували протягом ночі при кімнатній температурі. Після обробки й хроматографії реакційної суміші (діоксид кремнію, дихлорметан/метанол = 30/1) одержували 14О-{[(1R,2R,4R*)-2-(трет-бутилдифенілсиланілокси)-4циклопропіламіноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,4S*) діастереомер (Rf = 0,35,283 мг, вихід 36%). 1 H ЯМР (500MHz, DMSOd6,5, млн.д, крім іншого): 7.65 - 7.35 (m, 10Н, aromat.-H), 6.12 (m, 1Н, 19-Н), 5.5.2,5.51 (2d, 1Н, 14-Н, J = 8Hz), 5.00 (m, 1Н, 20-Н), 4.50 (t, 1Н, 11-ОН, J = 5.5Hz), 3.94 (m, 26 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 1Н, 2'-Н), 3.41 (m, 1Н, 11-Н), 3.05 - 2.80 (m, 4Н, 22-Н, 1’-Н, 4'-Н), 2.39 (bs, 1Н, 4-Н), 1.86 (m, 1Н, сРг), 1.33 (2s, 3Н, 15-CH3), 1.12 (s, 12Н, 18-CH3, Si-tert-butyl), 0.81 (d, 3Н, 17-CH3, J = 7Hz), + 0.57,0.56 (2d, 3Н, 16-CH3, J = 7Hz), 0.25,0.06 (2m, 4Н, cPr). MS-ESI (m/z): 786 (MH ), 784(M-H) . Стадія В. 14-О-{[(1R,2R,4R*)-4-циклопропіламіно-2-гідроксициклогексилсульфаніл] ацетил} мутилін + (1S,2S,4S*) діастереомер 14-О-{[(1R,2R,4R*)-2-(трет-бутилдифенілсиланілокси)-4циклопропіламіноциклогексилсульфаніл]ацетил}мутилін + (1S,2S,4S*) діастереомер (223 мг, 0,284 ммоль) обробляли протягом ночі тетрабутиламонійфторидом відповідно до методу прикладу 13, стадія G. Після обробки й хроматографії реакційної суміші (діоксид кремнію, дихлорметан/метанол =10/1) одержували зазначену в заголовку сполуку (R f = 0,2,10 мг, вихід 6%). 1 H ЯМР (500MHz, DMSO-d6, , млн.д, крім іншого): 6.13 (dd, 1Н, 19-Н, J = 11Hz and 17Hz), 5.50 (d, 1Н, 14-Н, J = 7Hz), 5.05 (m, 1Н, 20-Н), 4.87 (m, 1Н, 20-Н), 4.50 (d, 1Н, 11-ОН, J = 6Hz), 3.55 - 3.20 (m, 4Н, 22-Н, 2'-Н, 11-Н), 2.50 (m, 2Н, 1’-Н, 4'-H), 2.40 (bs, 1Н, 4-Н), 2.01 (m, 1Н, сРг), 1.35 (s, 3Н, 15-CH3), 1.04 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.62 (d, 3Н, 16-CH3, J = + + + 6Hz), 0.32, 0.15 (2m, 4Н, сРr). MS-ESI (m/z): 548 (MH ), 1095 (2MH ), 1117 (2MNa ), 582 (МСl ). Приклад 22 Гідрохлорид 14-О-{[(1R,2R,5S*)-4-4Hioionponmаміно-2гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5R*) діастереомера Стадія А. 14-О-{[(1R,2R)-2-гiдpoкcи-4-oкcoциклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S) діастереомер й 14-О-{[(1R,2R)-2-гiдpoкcи-5-oкcoциклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1 S,2S) діастереомер 14-О-{[(7R,8R)-7-гiдpoкcи-1,4-дioкca-cпipo[4.5]дeц-8-iлcyльфaнiл]aцeтил}мyтилiн + (7S,8S) діастереомер, а також 14-О-{[(7R,8R)-8-гідрокси-1,4-діокса-спіро[4.5]дец-7ілсульфаніл]ацетил}мутилін + (7S,8S) діастереомер (3,96 г, 7,19 ммоль) розчиняли в 50 мл діоксану й обробляли 4N HCl (5 мл, 20 ммоль) протягом 6 годин при кімнатній температурі. Реакційну суміш концентрували при зниженому тиску, обробляли розчином NaHCO 3 і тричі екстрагували етилацетатом. Органічні шари висушували над сульфатом натрію й піддавали хроматографії (діоксид кремнію, циклогексан/діоксан = 2/1) і одержували суміш зазначених у заголовку сполук (Rf = 0,30, 860 мг, вихід 24%). 1 H ЯМР (500MHz, DMSOd6,6, млн.д, крім іншого): 6.13 (m, 1Н, 19-Н), 5.56, 5.54 (2d, 1Н, 14-Н, J = 8Hz), 5.38,5.32 (2m, 1Н, 2'-0Н), 5.05 (m, 2Н, 20-Н), 4.50 (d, 1Н, 11-ОН, J = 5Hz), 3.95, 3.83 (2m, 1Н, 2'-Н), 3.50 - 3.20 (m, 3Н, 11-Н, 22-Н), 3.17,3.07 (2m, 1H, 1’-Н), 2.40 (bs, 1H, 4-Н), 1.35,1.33 (2s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.63,0.62 (2d, 3Н, 16-CH3). 529 + (MNa ), 505 (M-H) . Стадія В. 14-О-{[(1R,2R,5S*)-5-циклопропіламіно-2гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,4R*) діастереомер й 14-О-{[(1R,2R,4S*)4-циклoпpoпiлaмiнo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,4R*) діастереомер Здійснювали взаємодію 14-О-{[(1R,2R)-2-гідрокси-4оксоциклогексилсульфаніл]ацетил}мутиліну + (1S,2S) діастереомера й 14-О-{[(1R,2R)-2гідрокси-5-оксоциклогексилсульфаніл]ацетил}мутиліну + (1S,2S) діастереомера (250 мг, 0,493 ммоль) із циклопропіламіном (0,03 мл,0,493 ммоль) в 15 мл дихлорметану відповідно до методу прикладу 19, стадія А. Після обробки ціаноборгідридом натрію додавали этанол (0,7 мл) і суміш перемішували протягом ночі при кімнатній температурі. Після обробки й хроматографії реакційної суміші (діоксид кремнію, дихлорметан/метанол = 20/1) одержували 14-О- {[(1 R,2R,5S*)-4-циклопропіламіно-2-гідроксициклогексилсульфаніл] ацетил} мутилін + (1S,2S,5R*) діастереомер (а) (дихлорметан/метанол =10/1, Rf = 0,22, 34 мг, вихід 13%) і 14-О-{[(1R,2R,4S*)4-циклопропіламіно-2-гідроксицикл огексилсульфаніл]ацетил} мутилін + (1S,2S,4R*) діастереомер (b) (дихлорметан/метанол = 10/1, Rf = 0,13,26 мг, вихід 4%). 1 (a): H ЯМР (500MHz, DMSO-d6, , млн.д, крім іншого): 6.13 (m, 1Н, 19-Н, J = 11 and 18Hz), 5.53 (d, 1Н, 14-Н, J = 8Hz), 5.06 (m, 1H, 20-Н), 4.67 (t, 1Н, 2'-ОН), 4.47 (d, 1Н, 11-ОН, J = 6Hz), 3.50 - 3.20 (m, 4Н, 11-Н, 2'-Н, 22-Н) 2.92 (m, 1Н, 1’-Н), 2.71 (m, 1Н, 5'-Н), 2.39 (bs, 1Н, 4-Н), 1.96 (m, 1H, сРг), 1.36 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), 0.62 (d, 3Н, + 16-CH3, J = 7Hz), 0.32,0.16 (2m, 4Н, cPr). MS-ESI (m/z): 548 (MH ), 546 (M-H) . 1 (b): H ЯМР (500MHz, DMSO-d6, , млн.д, крім іншого): 6.13 (m, 1Н, 19-Н, J = H and 18Hz), 5.54 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 1H, 20-Н), 4.70 (d, 1Н, 2-ОН; J = 5Hz), 4.47 (d, 1Н, 11-ОН, J = 6Hz), 3.68 (m, 1H, 2'-Н), 3.45 - 3.15 (m, 3Н, 11-Н, 22-Н) 2.86 (m, 1Н, 4-Н), 2.71 (m, 1H, Y-Н), 2.39 (bs, 1Н, 4-Н), 1.96 (m, 1Н, сРг), 1.35 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = + 7Hz), 0.62 (d, 3Н, 16-CH3, J = 7Hz), 0.32,0.15 (2m, 4Н, сРг). MS-ESI (m/z): 548 (MH ), 546 (M-H) . Стадія C Гідрохлорид 14-О-{[(1R,R2,5S*)-5-циклопропіламіно-2гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5R*) діастереомера 27 UA 97836 C2 5 10 15 20 25 30 35 40 45 50 55 60 14-О-{[(1R,2R,58*)-4-циклопропіламіно-2-гідроксициклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R*) діастереомер (34 мг, 0,062 ммоль) обробляли відповідно до методу прикладу 1, стадія С, і одержували гідрохлорид 14-О-{[(1R,2R,5R*)-4-циклопропіламіно-2гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5S*) діастереомера (24 мг, вихід 66%) у вигляді безбарвної твердої речовини. 1 H ЯМР (500MHz, DMSOd6, , млн.д, крім іншого): 6.13 (m, 1Н, 19-Н, J = 11 and 18Hz), 5.55 (d, 1Н, 14-Н, J = 8Hz), 5.05 (m, 1Н, 20-Н), 5.00 (m, 1Н, 2'-ОН), 4.54 (d, 1Н, 11-ОН, J = 6Hz), 3.66 (m, 1Н, 2'-Н), 3.45 - 3.05 (m, 5Н, 11-Н, 22-Н, 1’-Н, 5'-Н), 2.41 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.06 (s, + 3Н, 18-CH3), 0.82 (d, 3Н, 17-CH3, J = 7Hz), 0.63 (m, 7Н, 16-CH3, сРr). MS-ESI (m/z): 548 (MH ), 582 (МСl ). Приклад 23 Гідрохлорид 14-О-{[(1R,2R,4S*)-4-ninaionponmаміно-2гідроксициклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,4R*) діастереомера 14-О{[(1R,2R,4S*)-4-циклoпpoпiлaмiнo-2-гiдpoкcициклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,4R*) діастереомер (10 мг, 0,018 ммоль) із прикладу 21, стадія В, обробляли відповідно до методу прикладу 1, стадія С, і одержували зазначене в заголовку сполук (20 мг, кількісний вихід, без поправок) у вигляді безбарвної твердої речовини. 1 + H ЯМР (500MHz, DMSO-d6, , млн.д, крім іншого): 8.6 (bs, 2Н, NH2 ), 6.13 (m, 1Н, 19-Н, J = 11 and 18Hz), 5.55 (d, 1Н, 14-Н, J = 8Hz), 5.26 (m, 1Н, 2'-ОН), 5.05 (m, 1Н, 20-Н), 4.52 (d, 1Н, 11-ОН, J = 6Hz), 3.93 (m, 1Н, 2'-Н), 3.45 - 3.20 (m, 4Н, 11-Н, 22-Н, 4'-Н), 2.95 (m, 1H, 1’-Н), 2.64 (m, 1Н, сРг), 2.40 (bs, 1Н, 4-Н), 1.36 (s, 3Н, 15-CH3), 1.05 (s, 3Н, 18-CH3), 0.81 (d, 3Н, 17-CH3, J = 7Hz), + 0.74 (m, 4Н, сРг), 0.62 (d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 548 (MH ), 582 (МСl ). Приклад 24 Гідрохлорид 14-О-{[(1R,2R,5R*)-2-гідрокси-5-морфолін-4ілциклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5S*) діастереомера Стадія А. 14-О-{[(1R,2R,5R*)-2-гідрокси-5-морфолін-4ілциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5S*) діастереомер й 14-О-{[(1R,2R,5S*)-2гідрокси-5-морфолін-4-ілциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R*) діастереомер 14О-{[(1R,2R)-2-гiдpoкcи-4-oкcoциклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S) діастереомер й 14-О-{[(1R,2R)-2-гiдpoкcи-5-oкcoциклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S) діастереомер (270 мг, 0,533 ммоль) із прикладу 22, стадія А, обробляли морфоліном (0,05 мл, 0,533 ммоль) в 10 мл дихлорметану відповідно до методу прикладу 19, стадія А. Після додавання ціаноборгідриду натрію додавали этанол (0,6 мл) і суміш перемішували протягом ночі при кімнатній температурі. Після обробки й хроматографії реакційної суміші (діоксид кремнію, дихлорметан/метанол = 20/1) одержували 14-О-{[(1R,2R,5R*)-2-гідрокси-5-морфолін-4ілциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5S*) діастереомер (а) (дихлорметан/метанол = 10/1, Rf = 0,32,23 мг, вихід 7%) і 14-О-{[(1R,2R,5S*)-2-гідрокси-5морфолін-4ілциклогексилсульфаніл]ацетил}мутилін + (1S,2S,5R*) діастереомер (b) (дихлорметан/метанол = 10/1), Rf = 0,27,40 мг, вихід 13%). 1 (a): H ЯМР (500MHz, CDCl3, млн.д, крім іншого): 6.41 (m, 1Н, 19-Н), 5.77,5.75 (2d, 1Н, 14-Н, J = 8Hz), 5.35 (dd, 1Н, 20-Н, J = 3 and 11Hz), 5.21 (d, 1H, 20-Н, J = 17Hz), 3.70 (s, 4Н, morpholine), 3.40 - 3.15 (m, 4Н, 2'-Н, 11-Н, 22Н), 2.53 (m, 5Н, 1’-Н, morpholine), 2.10 (bs, 1Н, 4-Н), 1.45 (s, 3Н, 15-CH3), 1.17 (s, 3Н, 18-CH3), 0.87 (d, 3Н, 17-CH3, J = 7Hz), 0.73,0.72 (2d, 3Н, 16-CH3, J = 7Hz). + + MS-ESI (m/z): 578 (MH ), 600 (MNa ), 576 (M-H) ", 612 (МСl ). 1 (b): H ЯМР (500MHz, CDCl3,, млн.д, крім іншого): 6.47 (m, 1Н, 19-Н), 5.77, 5.75 (2d, 1H, 14Н, J = 8Hz), 5.40 - 5.15 (m, 2Н, 20-Н), 3.70 (s, 4Н, morpholine), 3.47 (m, 1Н, 2'-Н), 3.35 (m, 1Н, 11Н), 3.22 (m, 2Н, 22-Н), 2.98 (m, 1Н, 1’-Н), 2.54, 2.45 (2m, 4Н, morpholine), 2.10 (bs, 1Н, 4-Н), 1.45 (s, 3Н, 15-CH3), 1.17 (s, 3Н, 18-CH3), 0.88 (d, 3Н, 17-CH3, J = 6Hz), 0.72 (d, 3Н, 16-CH3, J = 7Hz). + + MS-ESI (m/z): 578 (MH ), 600 (MNa ), 576 (M-H) , 612 (МСl ). Стадія В. Гідрохлорид 14-О-{[(1R,2R,5R*)-2-гідрокси-5-морфолін-4ілциклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5S*) діастереомера 14-О-{[(1R,2R,5R*)-2-гiдpoкcи-5-мopфoлiн-4-iлциклoгeкcилcyльфaнiл]aцeтил}мyтилiн + (1S,2S,5S*) діастереомер (10 мг, 0,017 ммоль) обробляли відповідно до методу прикладу 1, стадія С, і одержували гідрохлорид 14-О-{[(1R,2R,5R*)-2-гідрокси-5-морфолін-4ілциклогексилсульфаніл]ацетил}мутиліну + гідрохлорид (1S,2S,5S*) діастереомера (20 мг, кількісний вихід, без поправок) у вигляді безбарвної твердої речовини. 1 + H ЯМР (500MHz, CDCl3, млн.д, крім іншого): 13 (bs, 1Н, NH ), 6.47 (m, 1Н, 19-Н), 5.78, 5.76 (2d, 1Н, 14-Н, J = 9Hz), 5.36 (dd, 1Н, 20-Н, J = 4 and 11Hz), 5.23 (d, 1Н, 20-Н; J = 17Hz), 4.40, 3.98 (2bs, 4Н, morpholine), 3.45 - 3.20 (m, 4Н, 2'-Н, 11-Н, 22-Н), 2.91, 2.56 (2m, 5Н, morpholine, 1’-Н), 2.11 (bs, 1Н, 4-Н), 1.46 (s, 3Н, 15-CH3), 1.20,1.19 (2s, 3Н, 18-CH3), 0.89 (d, 3Н, 17-CH3, J = 7Hz), + + 0.74,0.73 (2d, 3Н, 16-CH3, J = 7Hz). MS-ESI (m/z): 578 (MH ), 600 (MNa ), 612 (МСl ). Приклад 25 Гідрохлорид 14-О-{[(1R,2R,5S*)-2-гідрокси-5-морфолін-4 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPleuromutilin derivatives for the treatment of diseases mediated by microbes
Автори англійськоюMang, Rosemarie, Heil-Mayer, Werner, Badegruber, Rudolf, Strickmann, Dirk, Novak, Rodger, Ferencic, Mathias, Bulusu, Atchyuta, Rama, Chandra, Murty
Назва патенту російськоюПроизводные плевромутилина для лечения заболеваний, вызванных микробами
Автори російськоюМанг Розэмари, Хэйл-Майер Вэрнэр, Бадэгрубэр Рудольф, Стрикманн Дирк, Новак Роджэр, Фэрэнцик Матиас, Булусу Атчиута Рама Чандра Мурти
МПК / Мітки
МПК: A61K 31/215, A61P 31/00, C07C 323/20
Мітки: захворювань, лікування, плевромутиліну, мікробами, викликаних, похідні
Код посилання
<a href="https://ua.patents.su/46-97836-pokhidni-plevromutilinu-dlya-likuvannya-zakhvoryuvan-viklikanikh-mikrobami.html" target="_blank" rel="follow" title="База патентів України">Похідні плевромутиліну для лікування захворювань, викликаних мікробами</a>
Попередній патент: Посудина реактора газифікації (варіанти)
Наступний патент: Сполуки хіноліну для лікування порушень, які реагують на модуляцію рецептора серотоніну 5-ht6
Випадковий патент: Компенсатор механічних навантажень