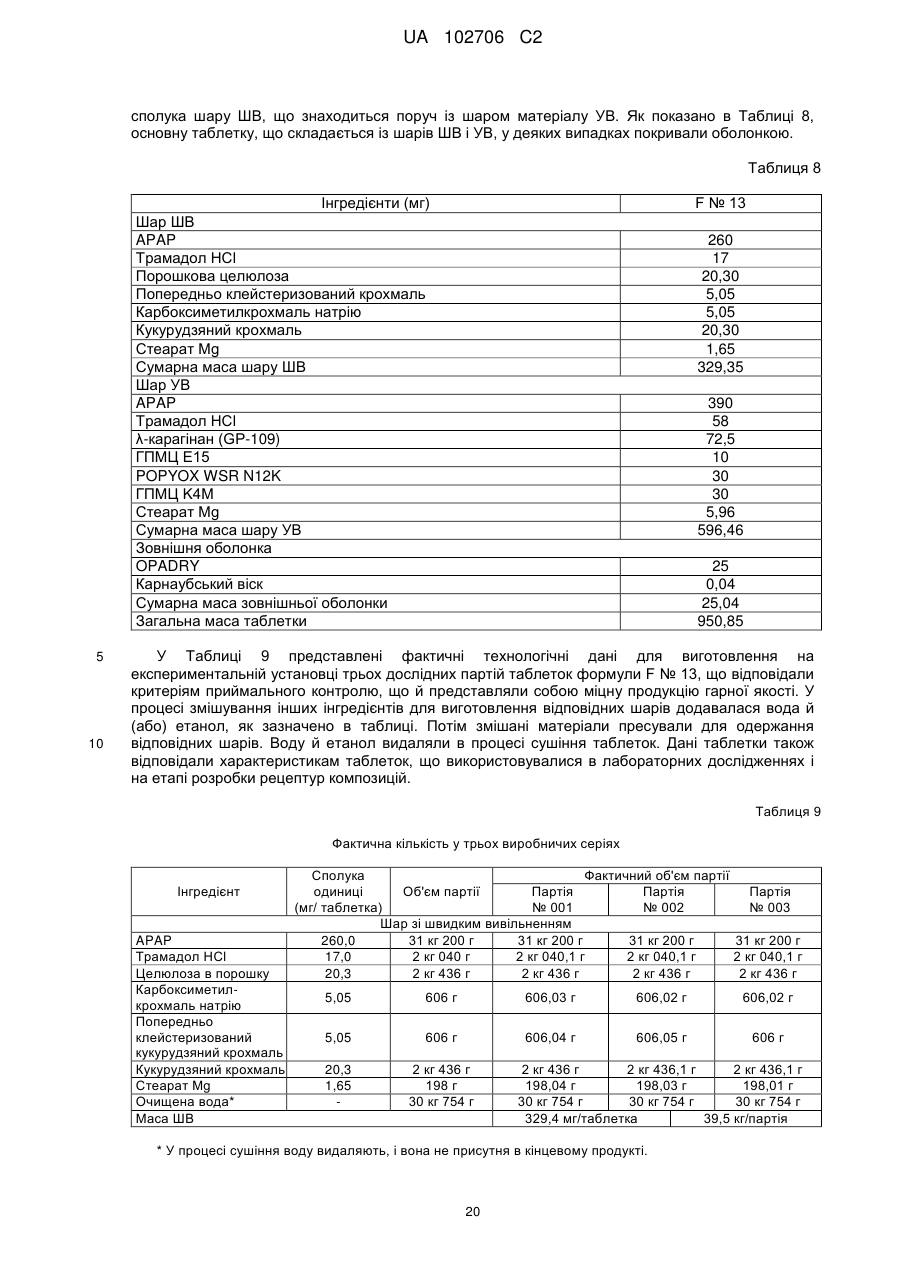
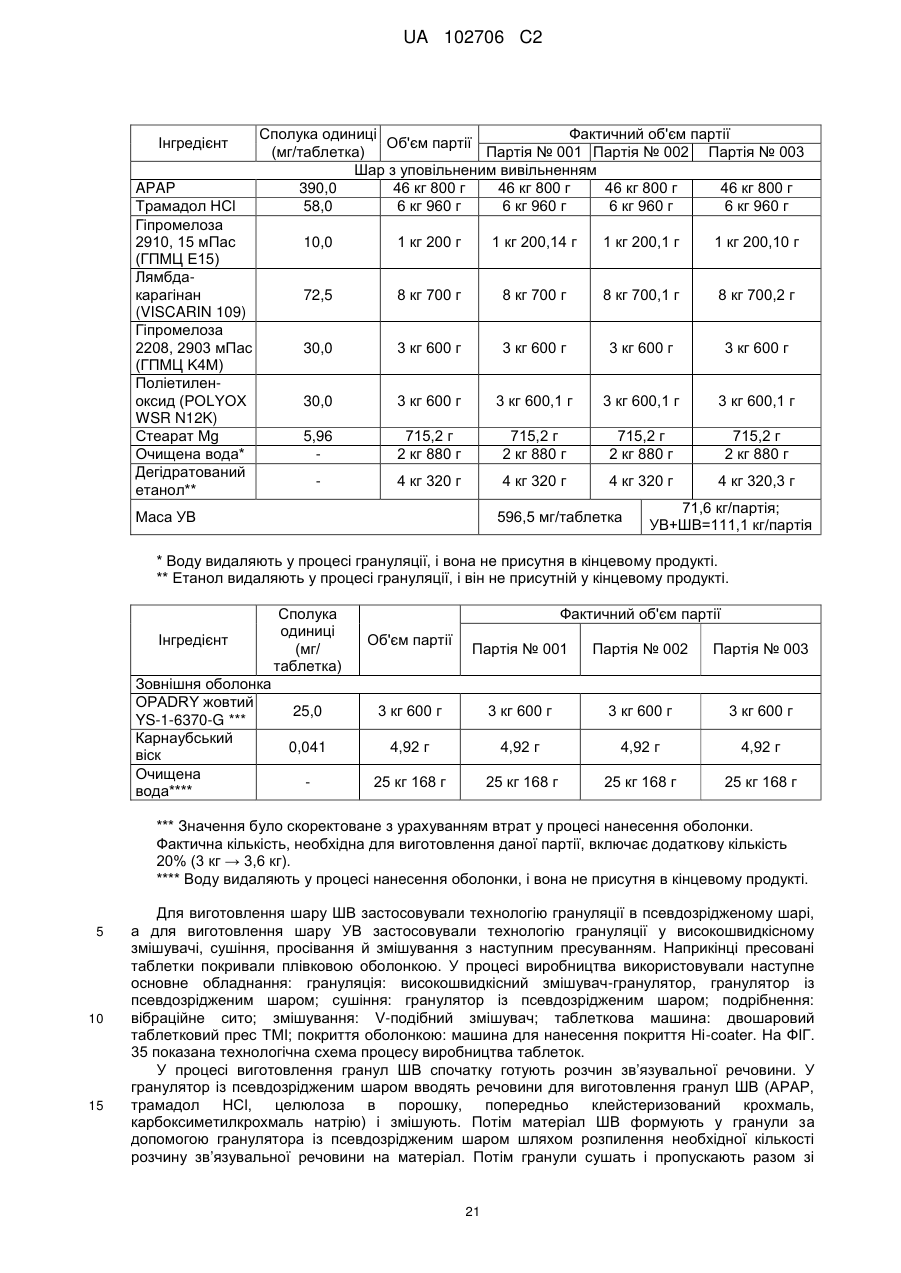
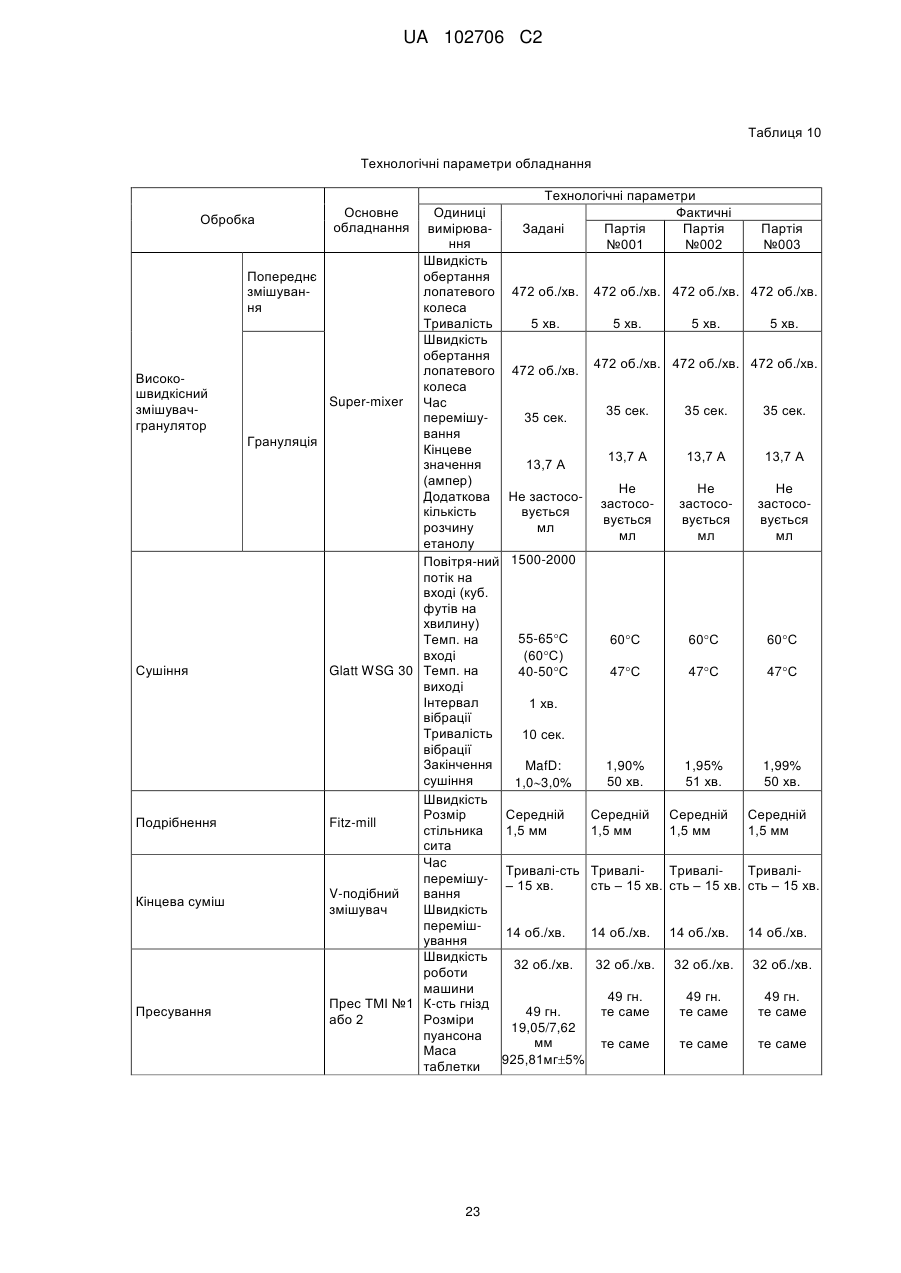
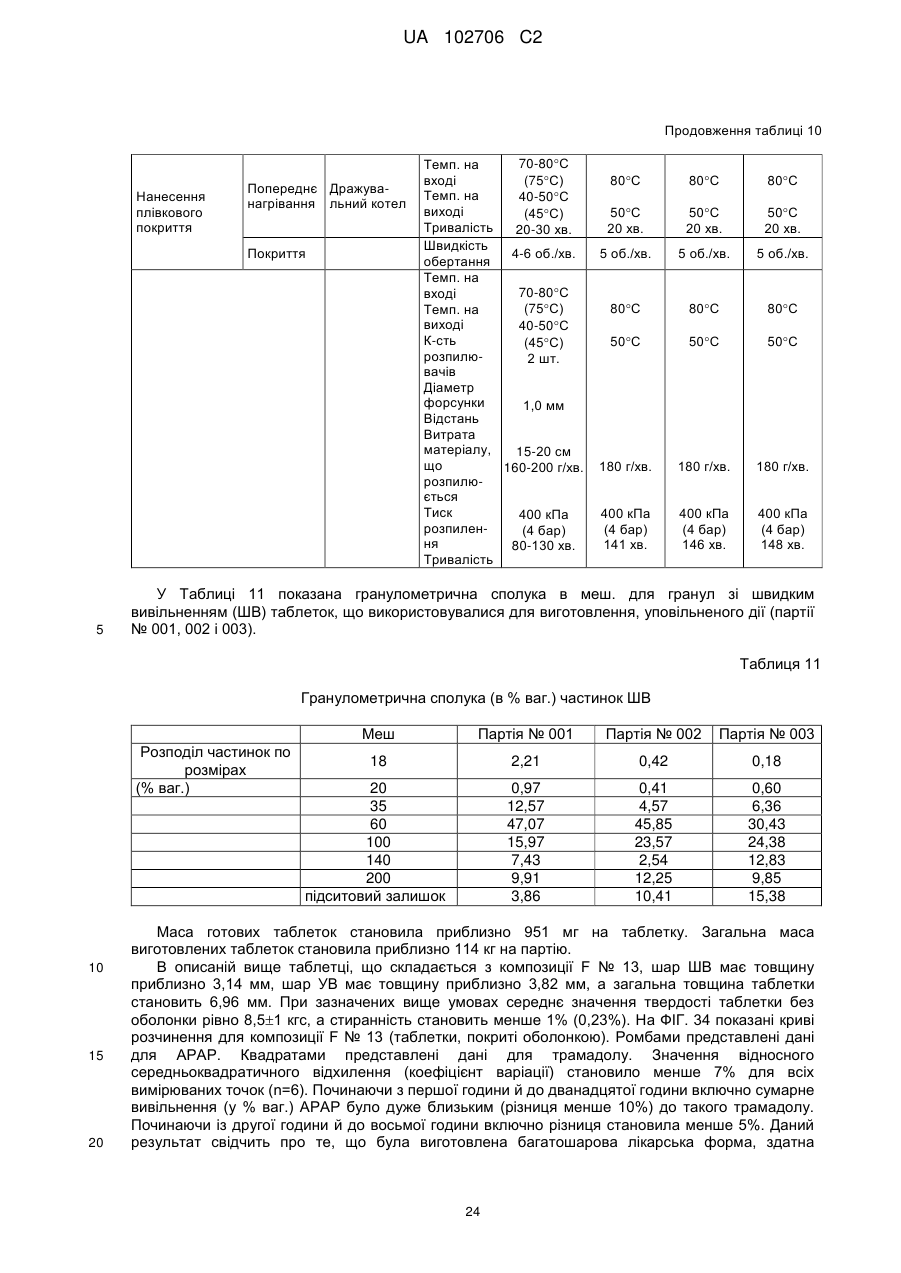
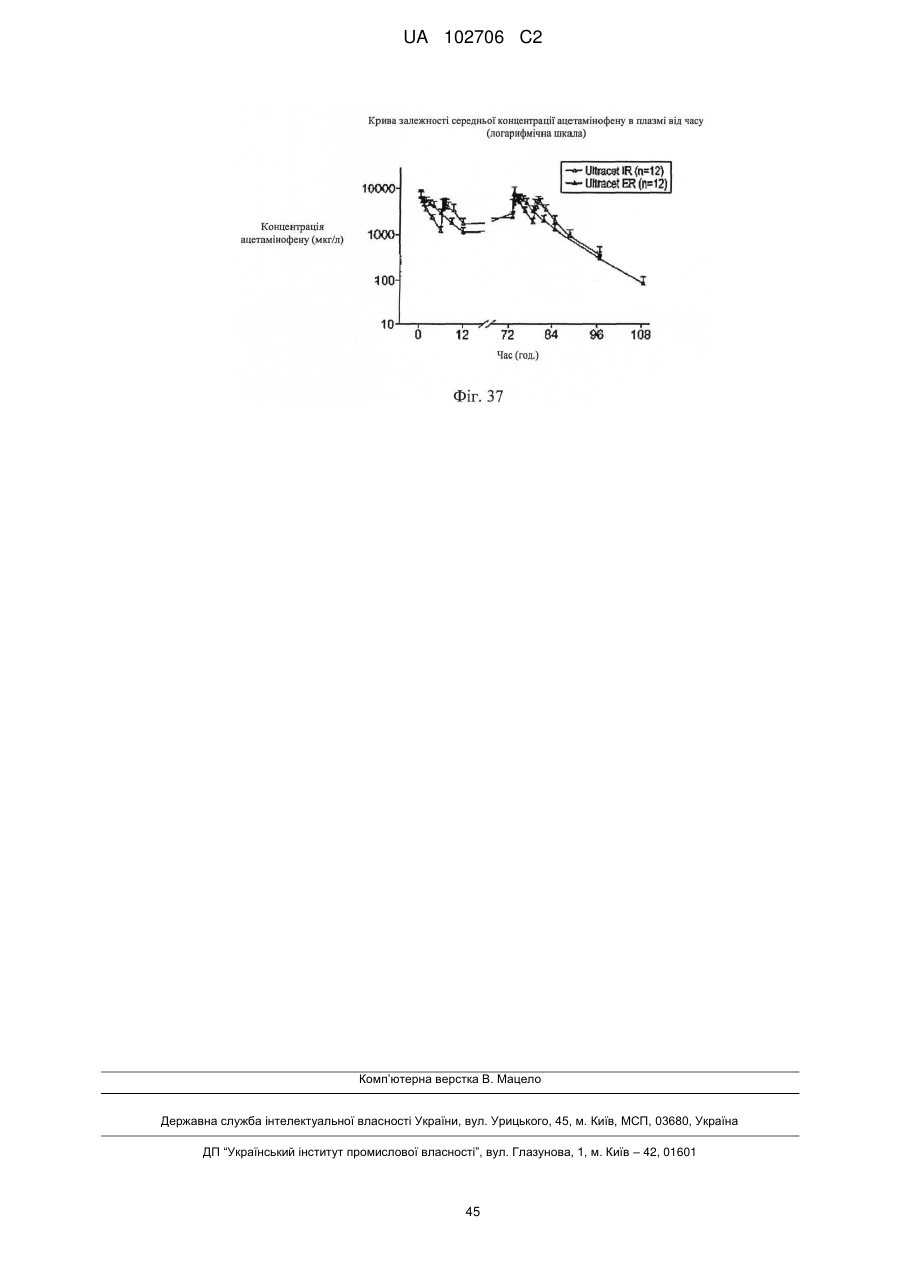
Лікарська форма ацетамінофену та комплексу трамадолу з уповільненою дією для перорального прийому
Номер патенту: 102706
Опубліковано: 12.08.2013
Автори: Дун Лян-чан, Хванг Сунг Дзоо, Дай Вей-го, Лі Донг Хо, Кім Дзає Хіун, Чой Тає-хонг
Формула / Реферат
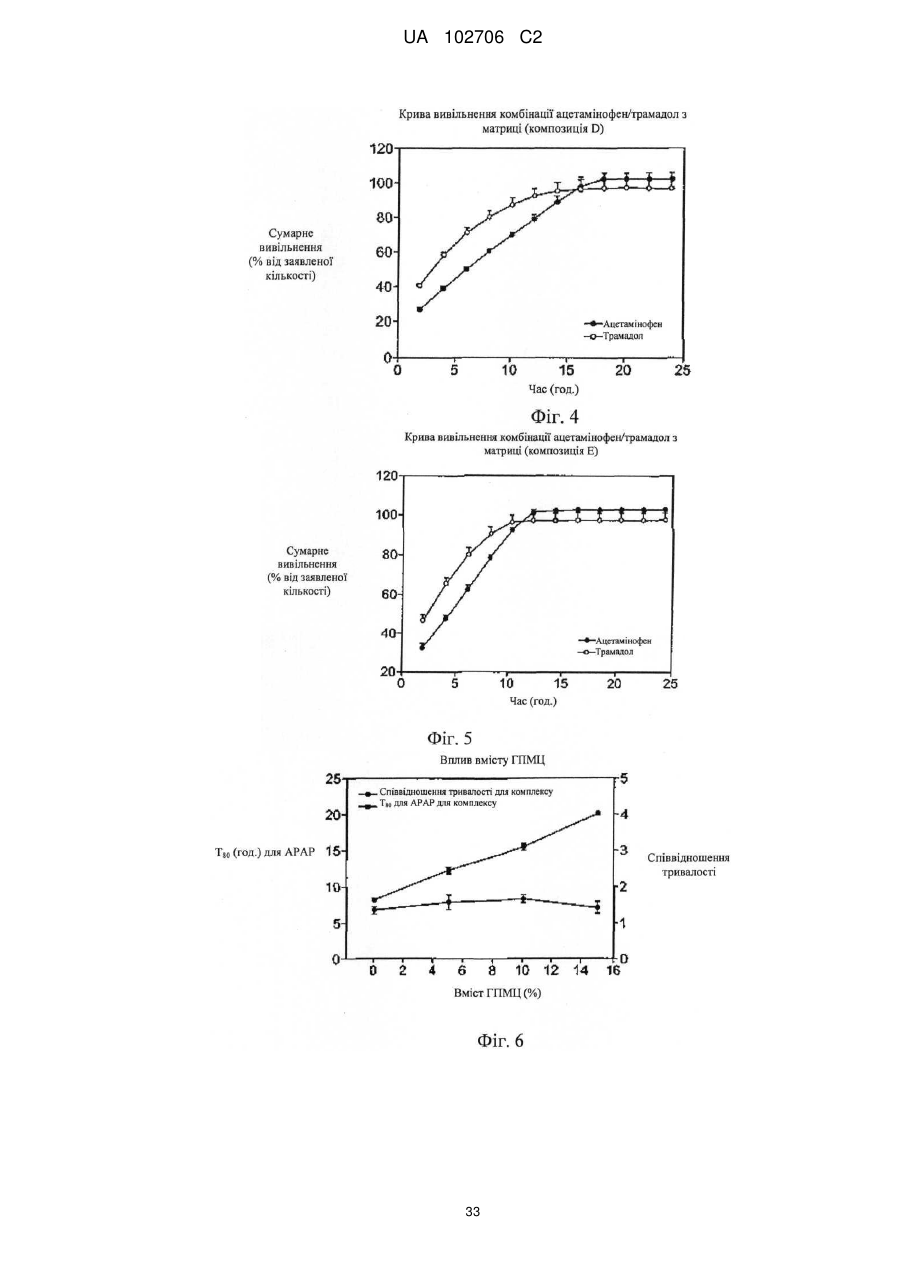
1. Фармацевтична композиція, що містить ацетамінофен і комплекс трамадолу, одержаний утворенням комплексу трамадолу з карагінаном, яка характеризується узгодженим уповільненим вивільненням при розчиненні, що забезпечує узгоджене наростаюче вивільнення трамадолу й наростаюче вивільнення ацетамінофену із часом.
2. Композиція за п. 1, у якій комплекс трамадолу отриманий утворенням комплексу карагінану й солі трамадолу.
3. Композиція за п. 1, у якій уповільнене вивільнення трамадолу й ацетамінофену триває від 4 до 12 годин протягом усього періоду вивільнення.
4. Композиція за п. 1, у якій уповільнене вивільнення трамадолу й ацетамінофену триває 10 годин або більше протягом усього періоду вивільнення.
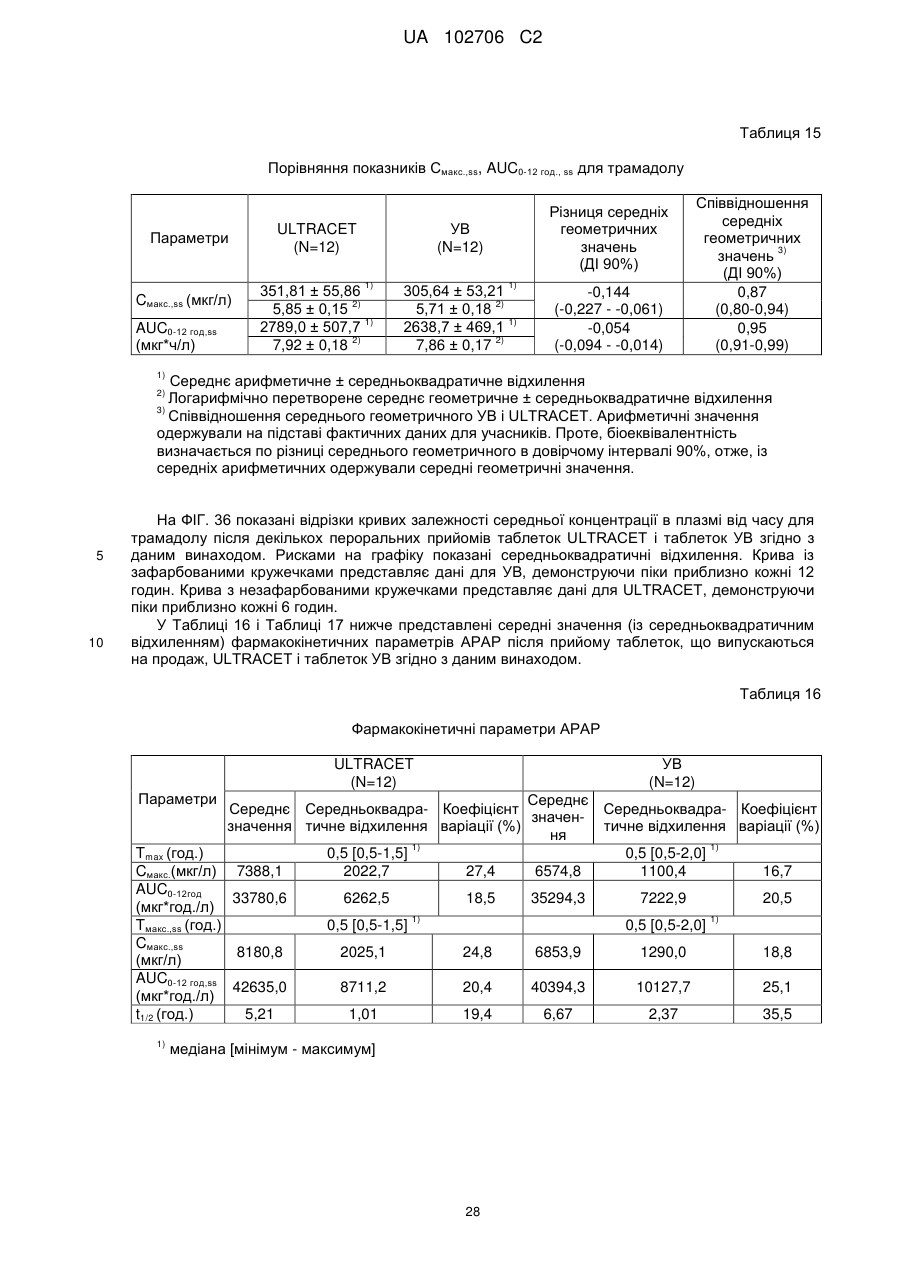
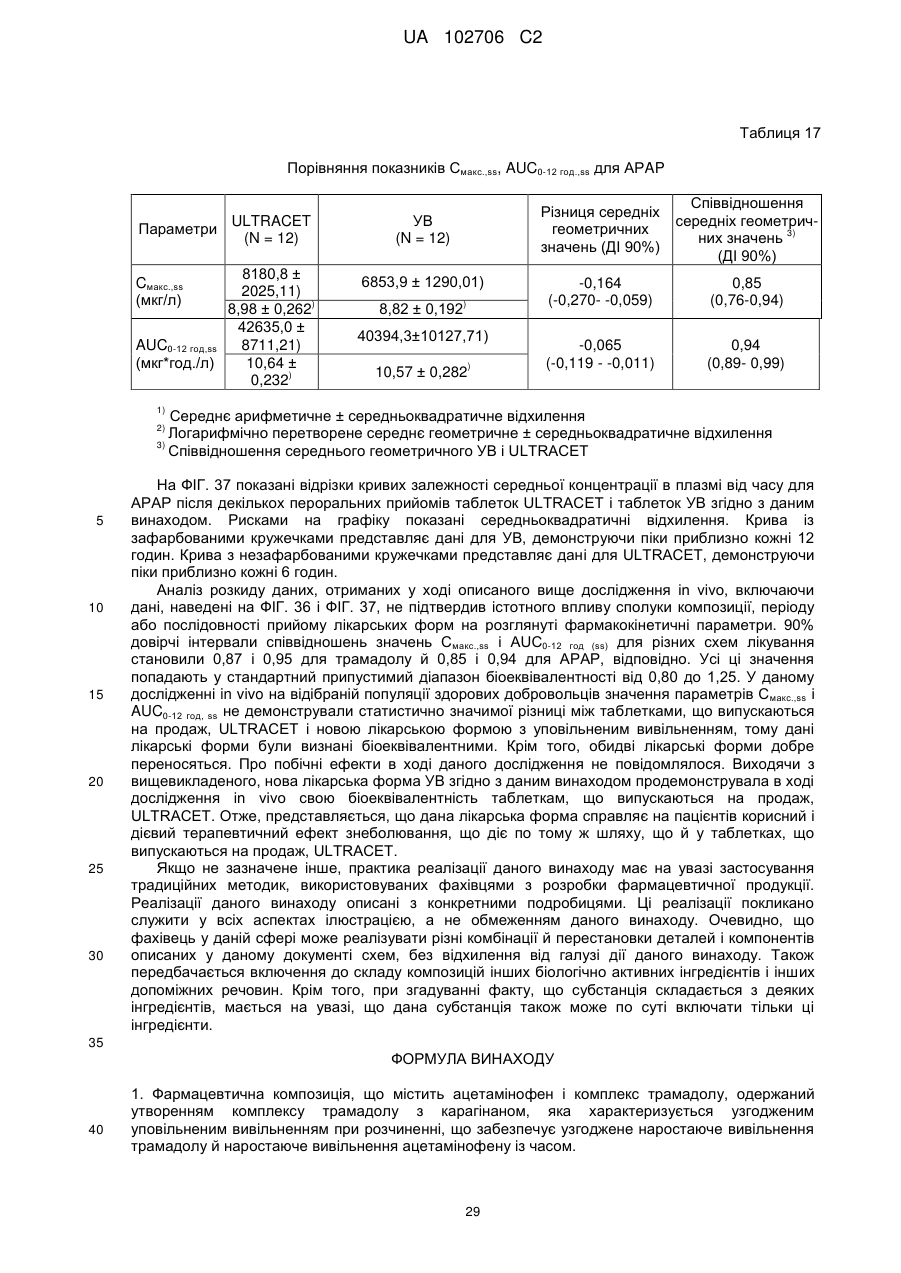
5. Композиція за п. 1, у якій при уповільненому вивільненні в момент часу, коли сумарне вивільнення трамадолу становить 40 % ваг., сумарне вивільнення ацетамінофену (у % ваг.) відрізняється від сумарного вивільнення трамадолу менше ніж на 25 % ваг.
6. Композиція за п. 1, у якій при уповільненому вивільненні, починаючи з моменту часу, в який сумарне вивільнення трамадолу становить 40 % ваг., сумарне вивільнення ацетамінофену (у % ваг.) ніколи не відрізняється від сумарного вивільнення трамадолу більше ніж на 20 % ваг.
7. Композиція за п. 1, у якій при уповільненому вивільненні, починаючи з моменту часу, у який сумарне вивільнення трамадолу становить 40 % ваг., сумарне вивільнення ацетамінофену (у % ваг.) ніколи не відрізняється від сумарного вивільнення трамадолу більше ніж на 10 % ваг.
8. Композиція за п. 1, у якій при уповільненому вивільненні після першої години уповільненого вивільнення протягом щонайменше 12 годин сумарне вивільнення ацетамінофену (у % ваг.) ніколи не відрізняється від сумарного вивільнення трамадолу (у % ваг.) більше ніж на 10 % ваг.
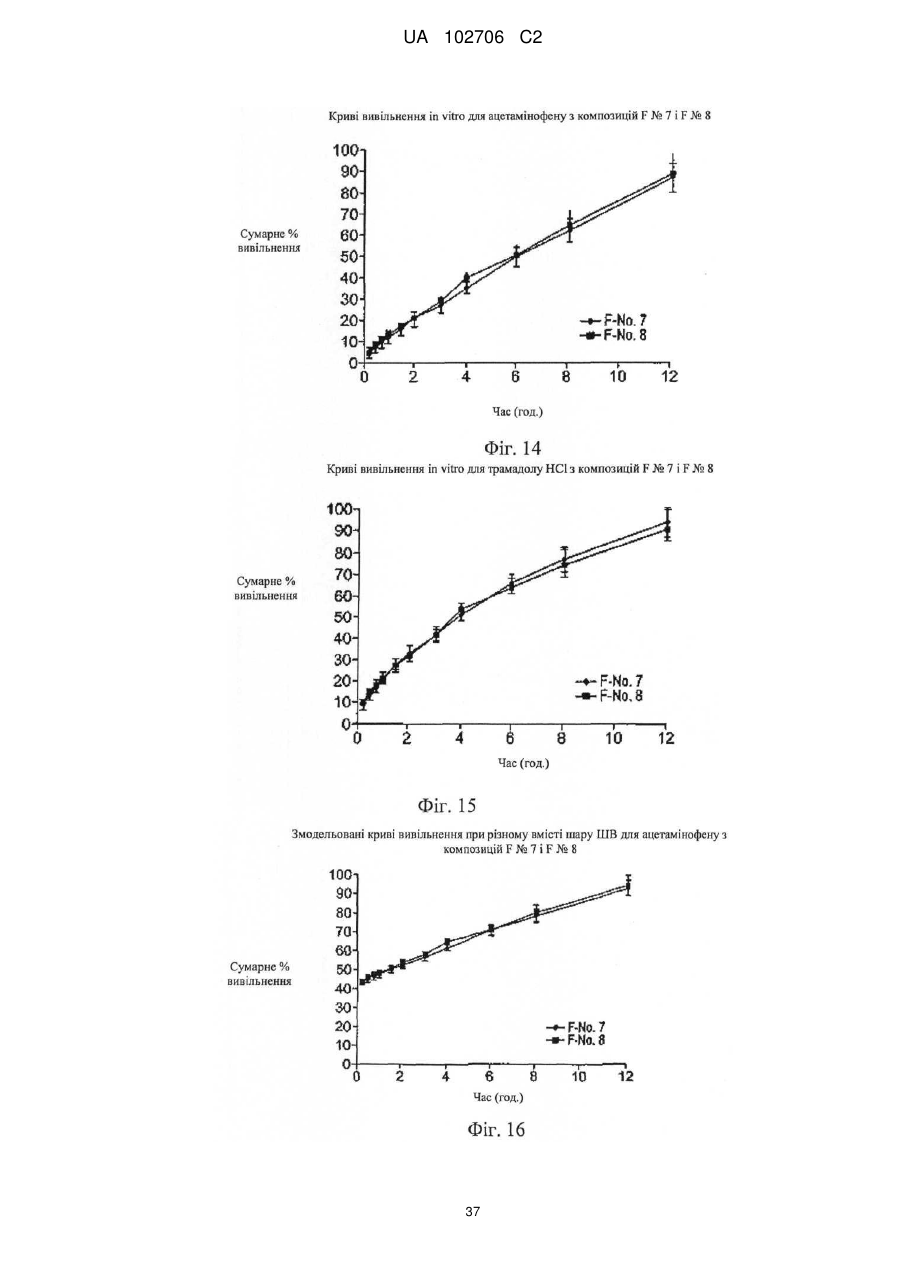
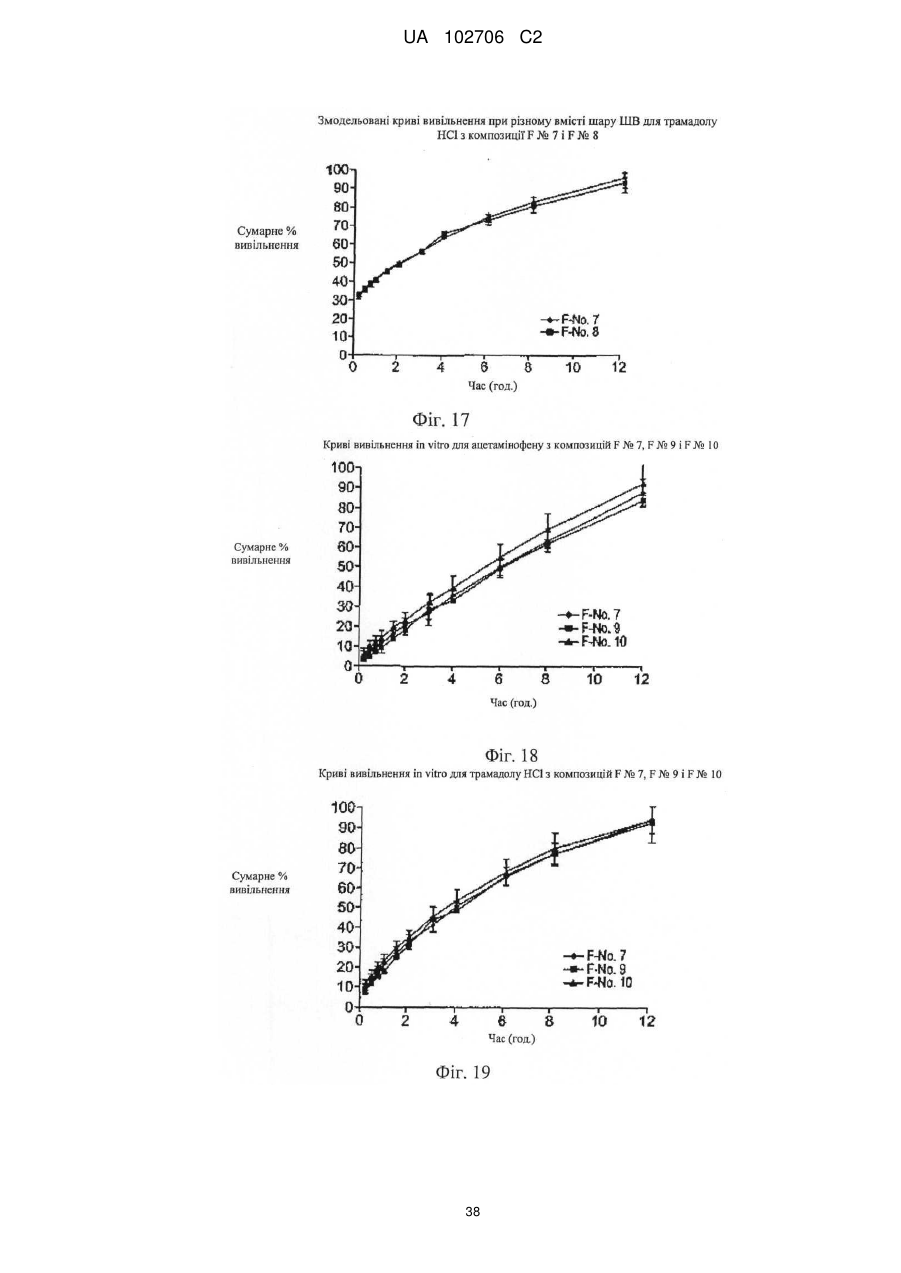
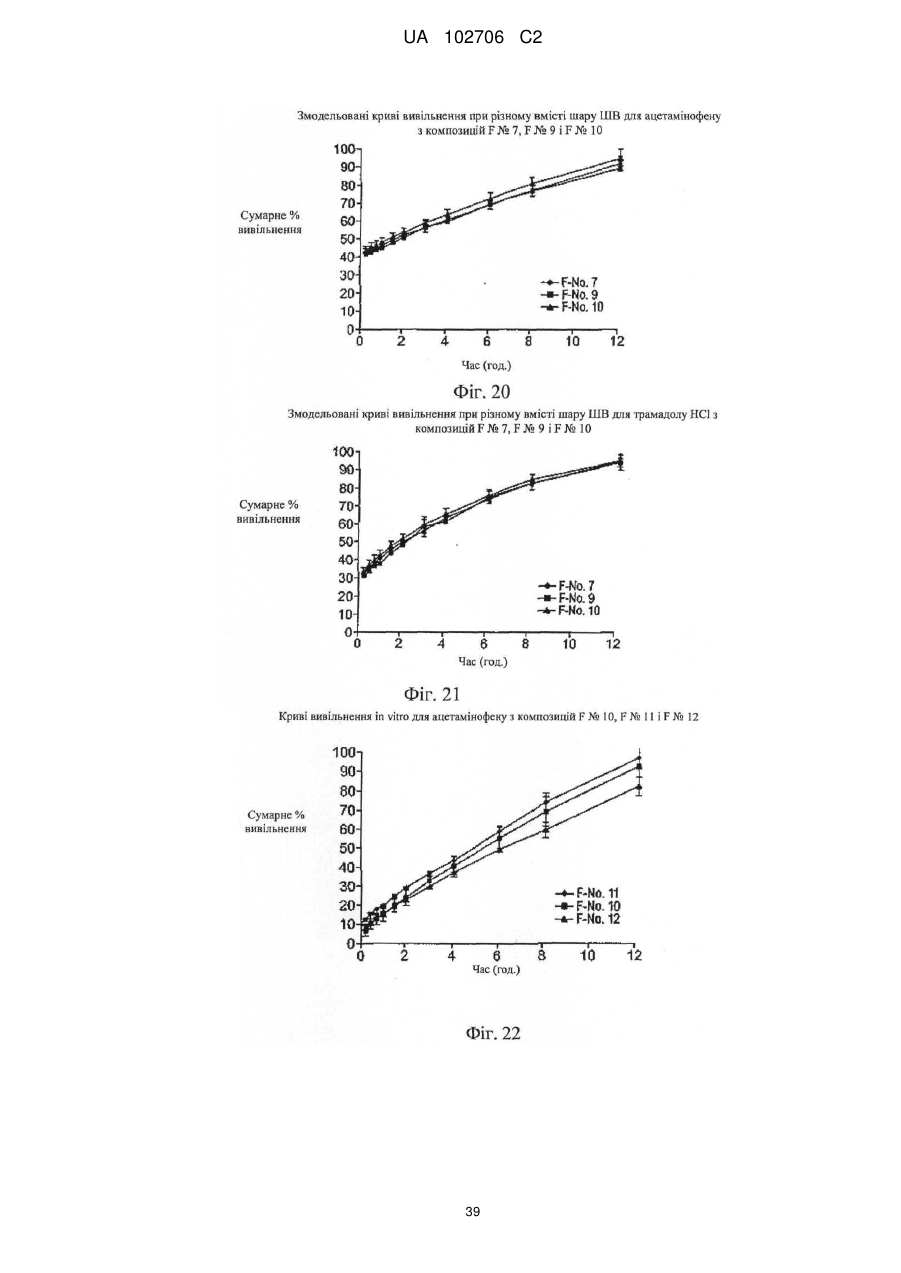
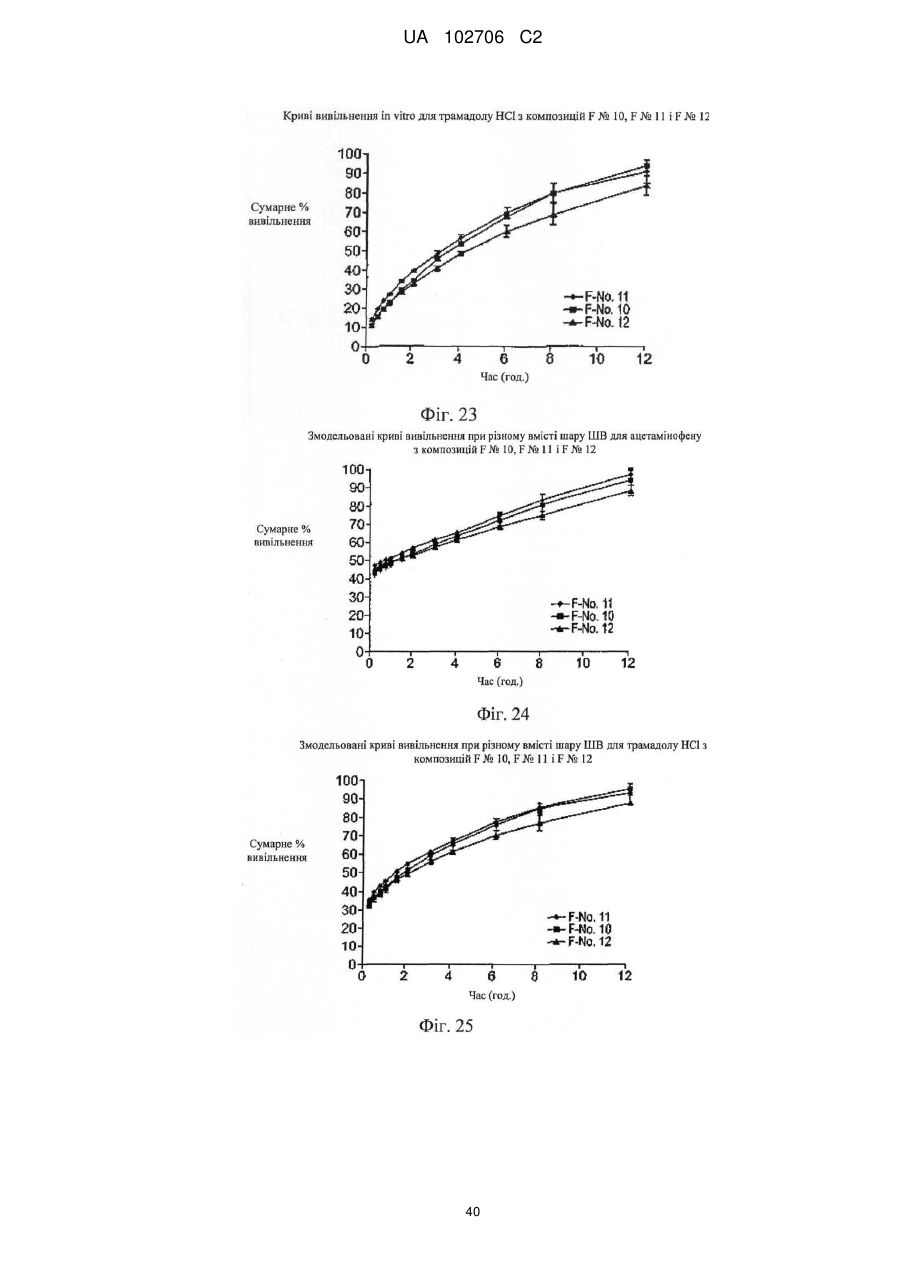
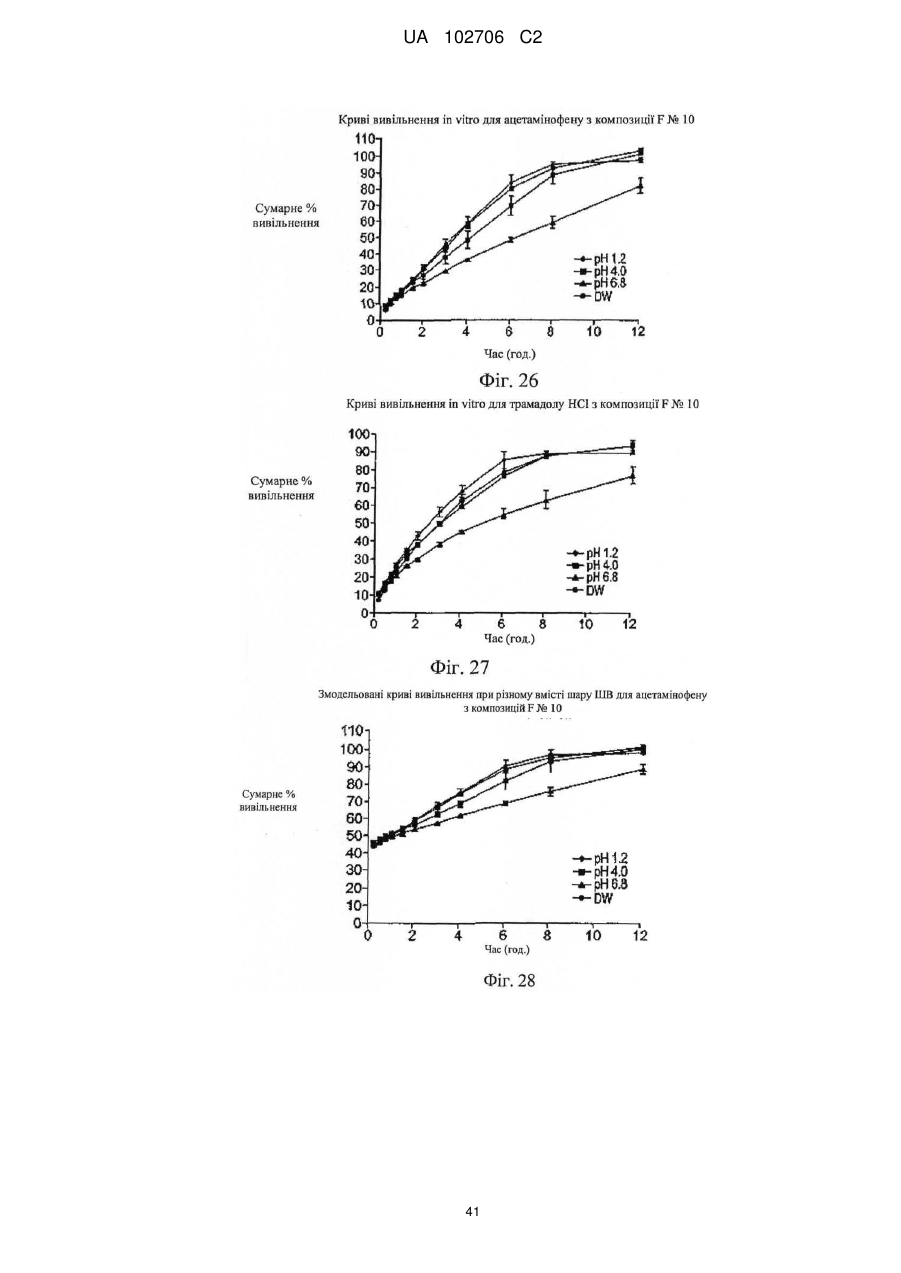
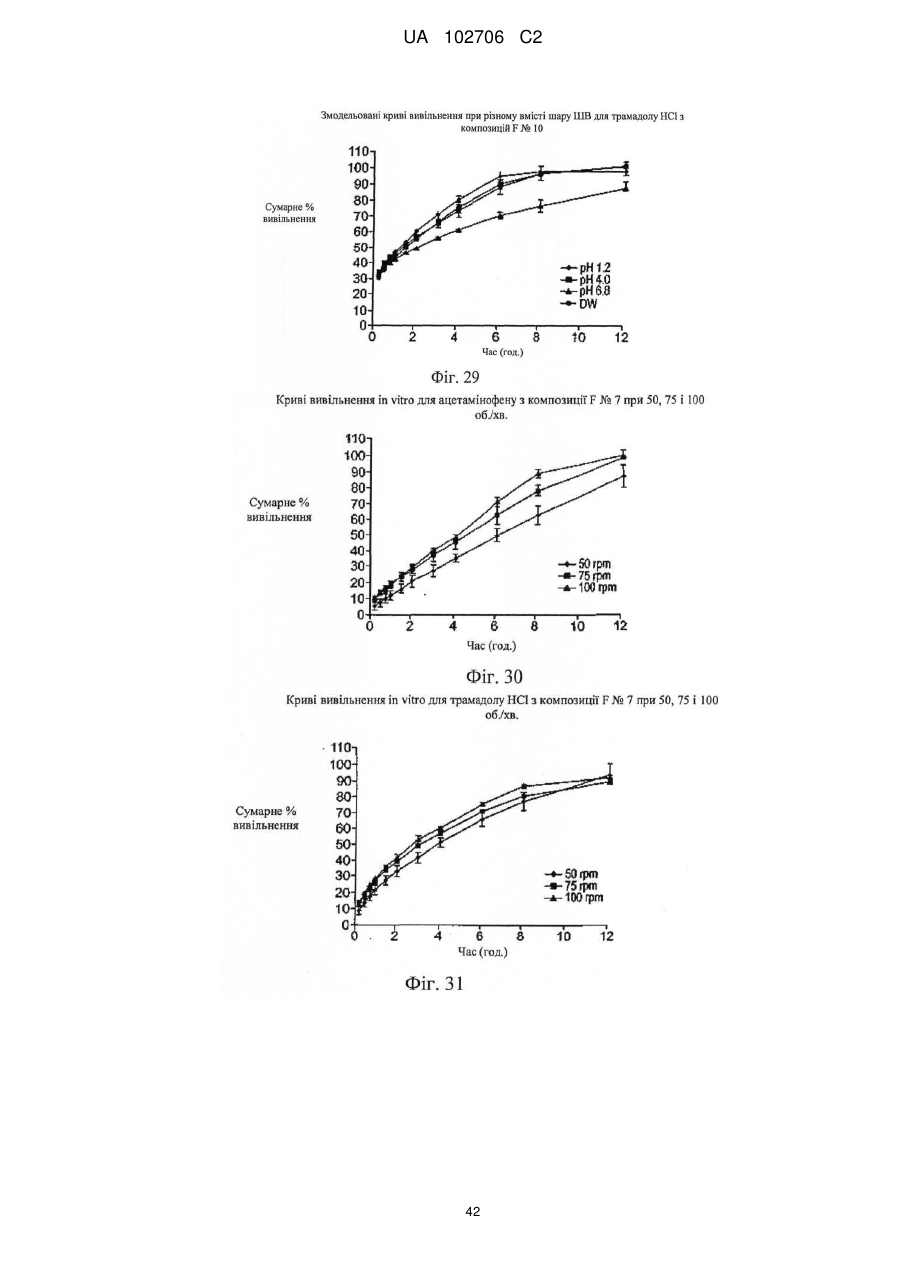
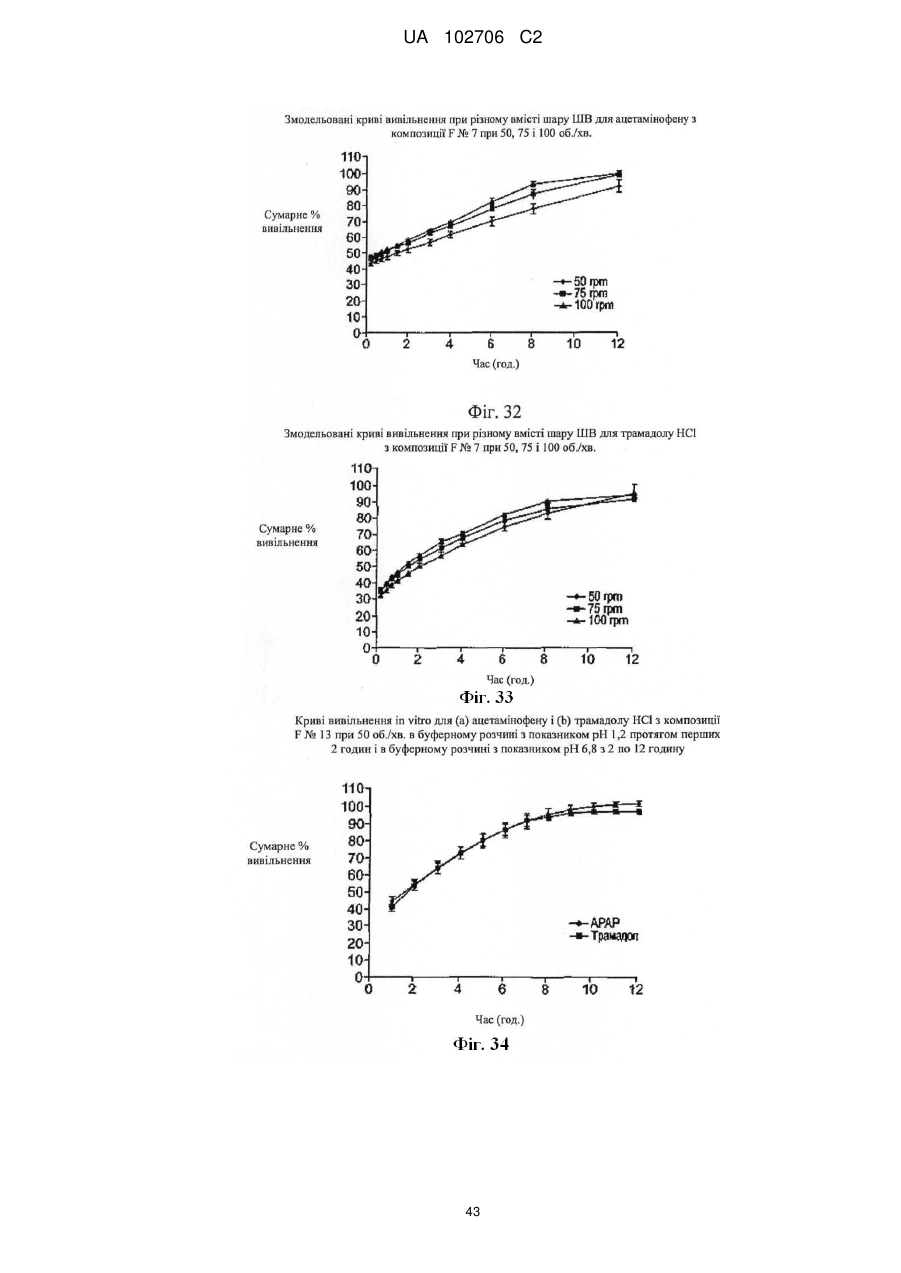
9. Композиція за п. 1, у якій сумарне вивільнення лікарських препаратів при уповільненому вивільненні визначають за допомогою лопатевого обладнання ІІ згідно з Фармакопеєю США (метод USP II) при 37 °C і 50 об./хв./900 мл in vitro з використанням як середовища розчинення з показником рН 6,8 відтворюваної інтестинальної рідини без ферментів.
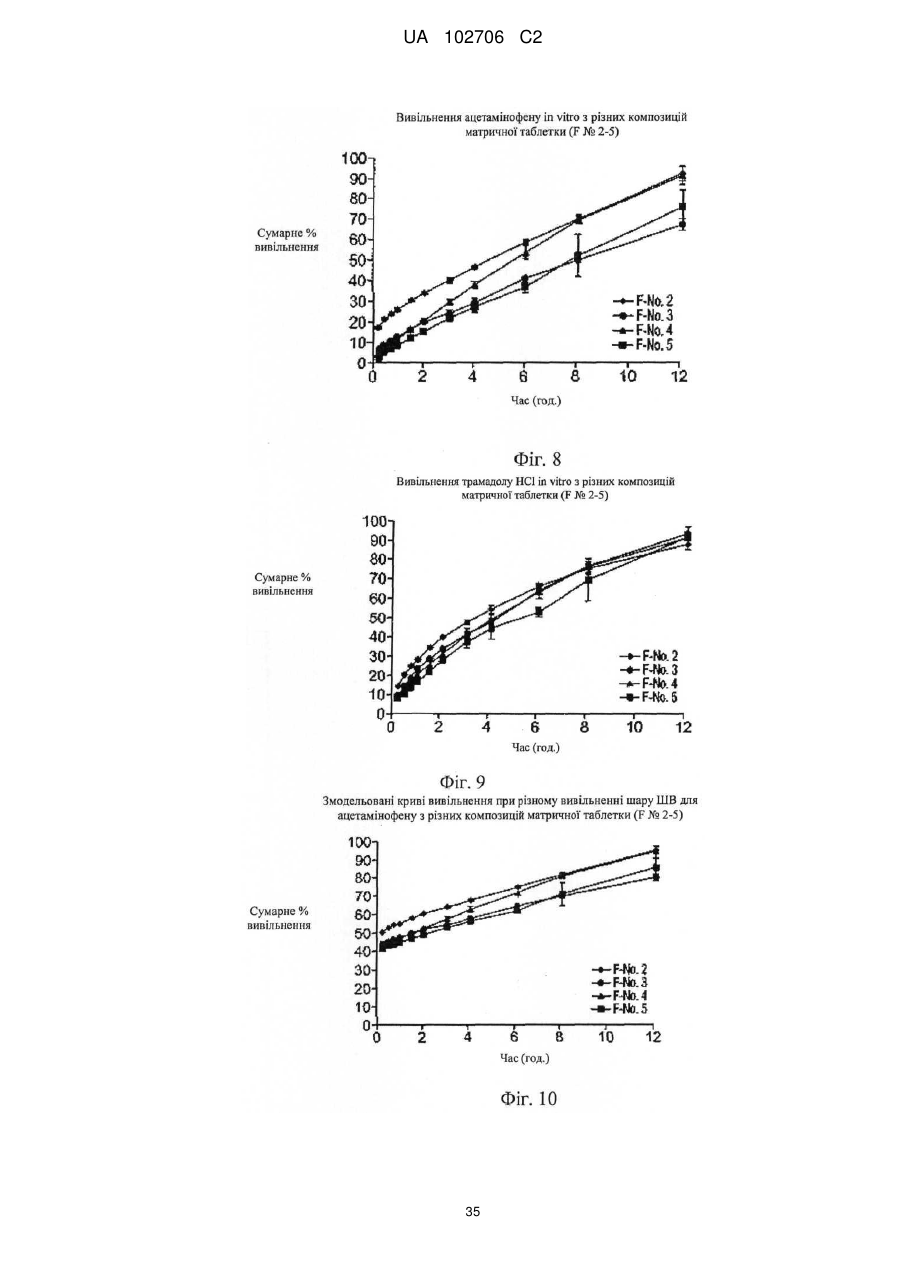
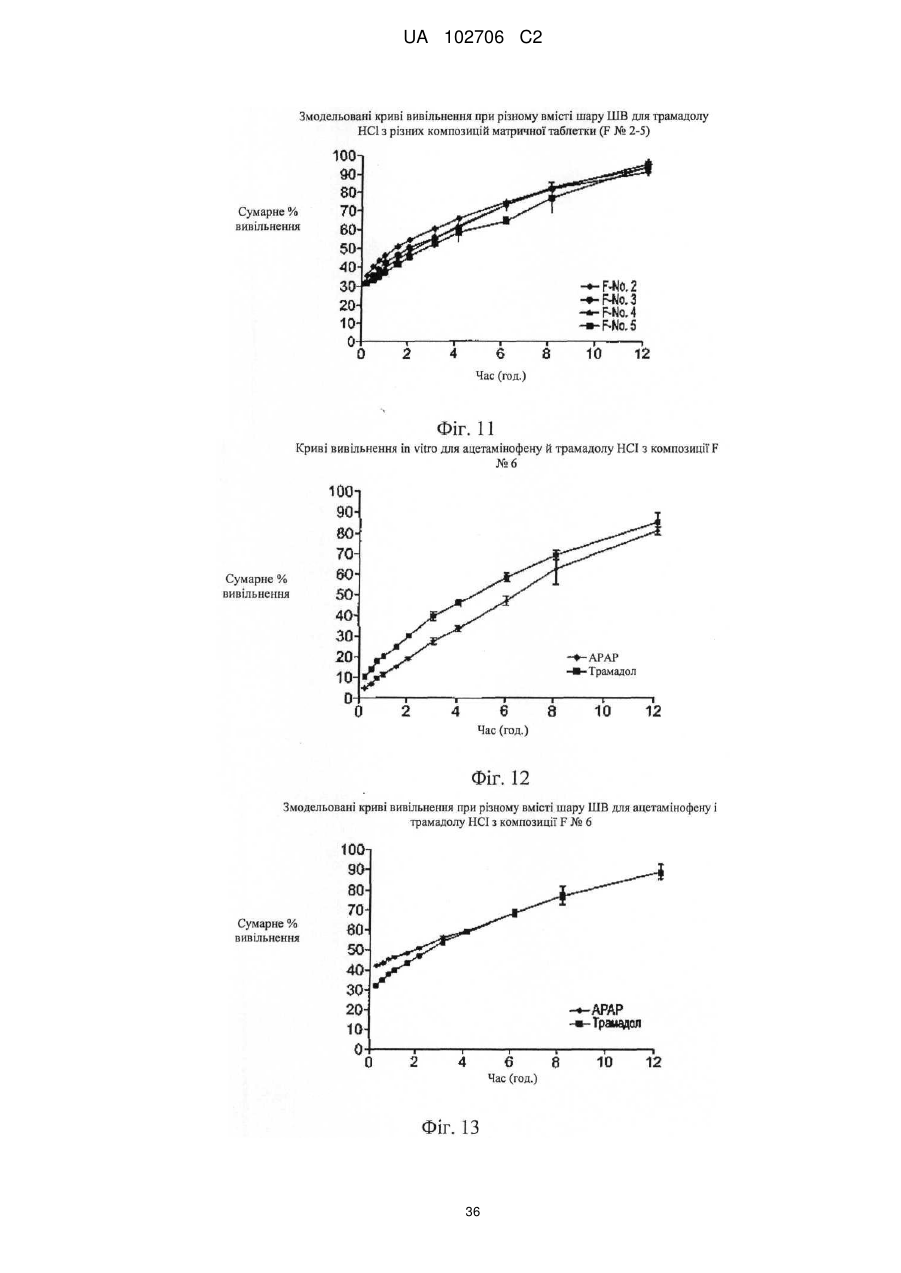
10. Композиція за п. 1, що містить шар з уповільненим вивільненням, приєднаний до шару зі швидким вивільненням, причому шар з уповільненим вивільненням включає ацетамінофен і комплекс трамадолу, а шар зі швидким вивільненням включає ацетамінофен і трамадол переважно не зв'язаний у комплекс.
11. Композиція за п. 1, що містить шар з уповільненим вивільненням, приєднаний до шару зі швидким вивільненням, причому шар з уповільненим вивільненням включає розпушувач, ацетамінофен і комплекс трамадолу, при цьому комплекс трамадолу являє собою комплекс із лямбда-карагінану й трамадолу НСl, а шар зі швидким вивільненням включає гідрофільну полімерну добавку, що уповільнює вивільнення, ацетамінофен і трамадол, переважно не зв'язаний у комплекс.
12. Композиція за п. 11, у якій гідрофільну полімерну добавку, що уповільнює вивільнення, вибирають із групи, що складається з полісахаридів або їх похідних, агару, агарози, камеді; а шар з уповільненим вивільненням включає гідроксипропілметилцелюлозу й наповнювач.
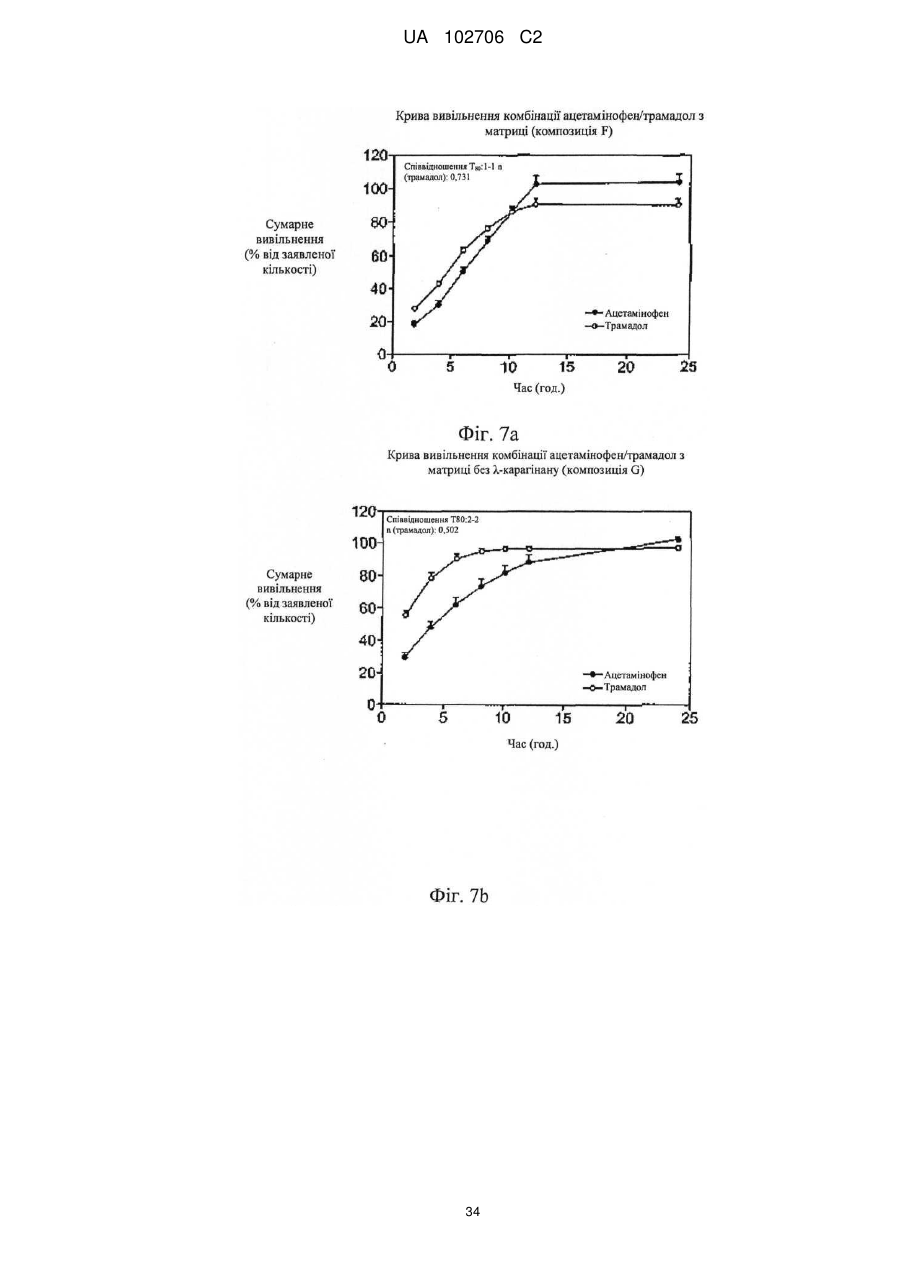
13. Композиція за п. 1, що містить шар з уповільненим вивільненням, приєднаний до шару зі швидким вивільненням, причому шар з уповільненим вивільненням включає розпушувач, ацетамінофен і комплекс трамадолу, при цьому комплекс трамадолу являє собою комплекс із лямбда-карагінану й трамадолу НСl, а шар зі швидким вивільненням включає гідрофільну полімерну добавку, яка уповільнює вивільнення, ацетамінофен і трамадол, переважно, не зв'язаний у комплекс.
14. Композиція за п. 13, у якій у шарі з уповільненим вивільненням вагове співвідношення ацетамінофену й трамадолу у вигляді комплексу трамадолу становить від 1:1 до 20:1.
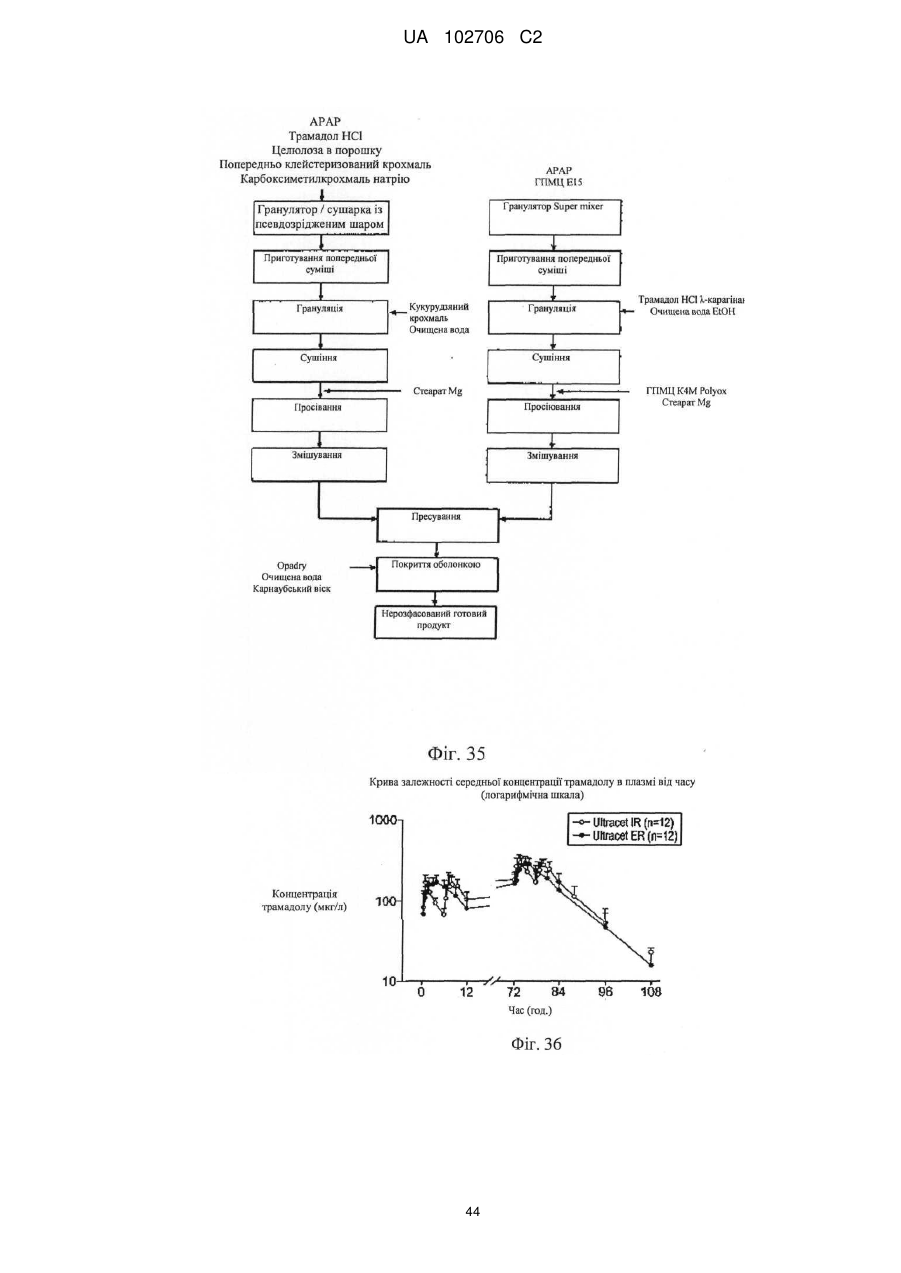
15. Композиція за п. 13, у якій у шарі з уповільненим вивільненням вагове співвідношення ацетамінофену й трамадолу у вигляді комплексу трамадолу становить від 5:1 до 10:1.
16. Композиція за п. 1, де фармацевтична композиція, що містить ацетамінофен і комплекс трамадолу, являє собою шар, у якому вивільнення як ацетамінофену, так і трамадолу не підкоряється законам Фіка.
17. Композиція за п. 1, де фармацевтична композиція, що містить ацетамінофен і комплекс трамадолу, являє собою шар, у якому при вивільненні ацетамінофену й трамадолу показник вивільнення n для трамадолу дорівнює приблизно від 0,5 до 0,7, а показник вивільнення n для ацетамінофену дорівнює від 0,6 до 0,9 у рівнянні Корсмейєра.
18. Композиція за п. 1, де фармацевтична композиція, що містить ацетамінофен і комплекс трамадолу, являє собою шар, у якому при вивільненні ацетамінофену й трамадолу відношення значення Т80 ацетамінофену до значення Т80 для трамадолу становить від 0,9 до 1,1 при Т80, що дорівнює 8 годин або більше.
19. Спосіб виготовлення лікарської форми фармацевтичної композиції, що включає
виготовлення комплексу трамадолу, одержаного утворенням комплексу трамадолу з карагінаном;
виготовлення пресованої лікарської форми, що містить комплекс трамадолу й ацетамінофен, причому пресована лікарська форма характеризується узгодженим уповільненим вивільненням при розчиненні, що забезпечує узгоджене наростаюче вивільнення трамадолу й наростаюче вивільнення ацетамінофену із часом.
20. Спосіб за п. 19, що включає використання солі трамадолу й карагінану для виготовлення комплексу трамадолу.
21. Спосіб за п. 19, що включає використання солі трамадолу й карагінану для виготовлення комплексу трамадолу у вигляді пасти, висушування пасти й одержання з неї гранул.
22. Спосіб за п. 19, що включає використання солі трамадолу й карагінану для виготовлення комплексу трамадолу у вигляді пасти, висушування пасти, одержання з неї гранул і пресування гранул для виготовлення пресованої лікарської форми.
23. Спосіб за п, 19, що включає використання солі трамадолу й лямбда-карагінану для виготовлення комплексу трамадолу, одержання з нього гранул, пресування гранул для виготовлення пресованої лікарської форми й нанесення додаткового шару поверх згаданої пресованої лікарської форми, причому додатковий шар включає гідрофільну полімерну добавку, що сповільнює вивільнення, ацетамінофен і трамадол, переважно не зв'язаний у комплекс.
24. Спосіб за п. 23, що включає виготовлення пресованої лікарської форми з ваговим співвідношенням ацетамінофену до комплексу трамадолу від 1:1 до 20:1.
25. Спосіб за п. 23, що включає виготовлення пресованої лікарської форми з ваговим співвідношенням ацетамінофену до комплексу трамадолу від 5:1 до 10:1.
26. Спосіб за п. 23, при якому у процесі уповільненого вивільнення в момент часу, коли сумарне вивільнення трамадолу становить 40 % ваг., сумарне вивільнення ацетамінофену (у % ваг.) відрізняється від сумарного вивільнення трамадолу менше ніж на 25 % ваг.
27. Спосіб за п. 23, при якому у процесі уповільненого вивільнення, починаючи з моменту часу, коли сумарне вивільнення трамадолу дорівнює 40 % ваг., сумарне вивільнення ацетамінофену (у % ваг) ніколи не відрізняється від сумарного вивільнення трамадолу більше ніж на 20 % ваг.
28. Спосіб за п. 19, що включає використання щонайменше двох різних типів гідроксипропілметилцелюлози при виготовленні пресованої лікарської форми.
29. Застосування комплексу трамадолу у виробництві лікарського засобу для лікування болю, причому лікарський засіб містить комплекс трамадолу, одержаний утворенням комплексу трамадолу з карагінаном, і ацетамінофен, лікарський засіб характеризується узгодженим уповільненим вивільненням трамадолу й ацетамінофену при пероральному прийомі пацієнтом лікарського засобу, що забезпечує узгоджене наростаюче вивільнення трамадолу й наростаюче вивільнення ацетамінофену із часом.
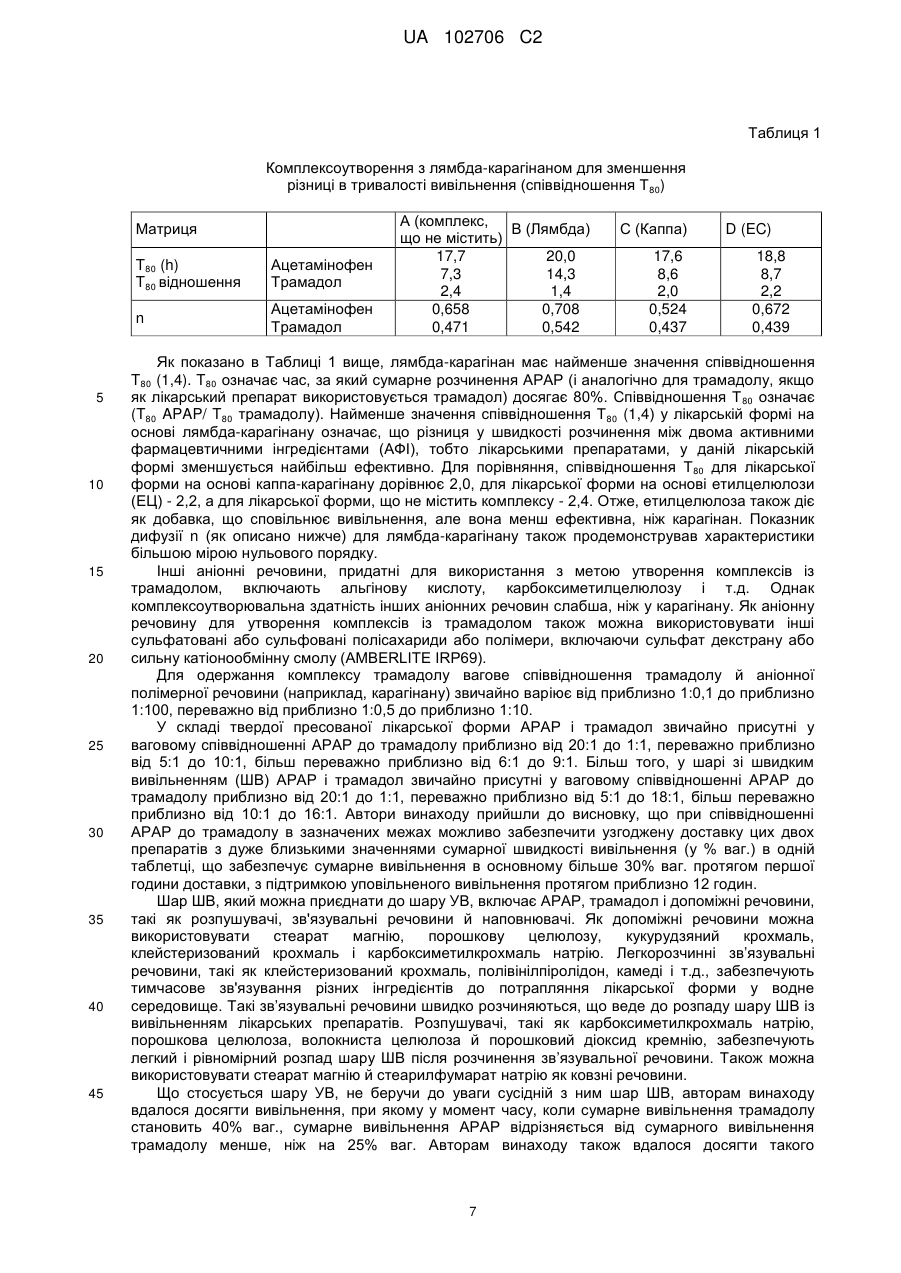
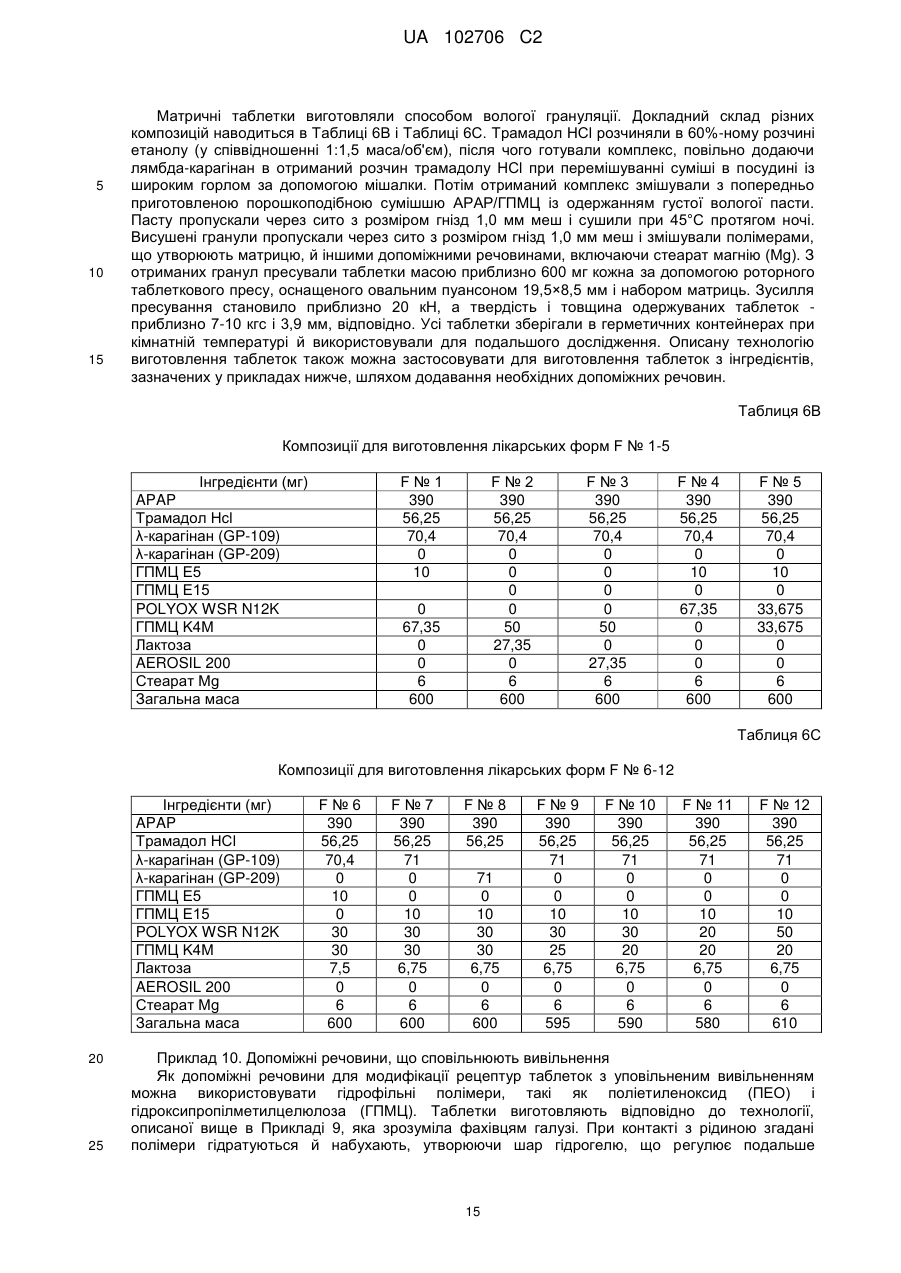
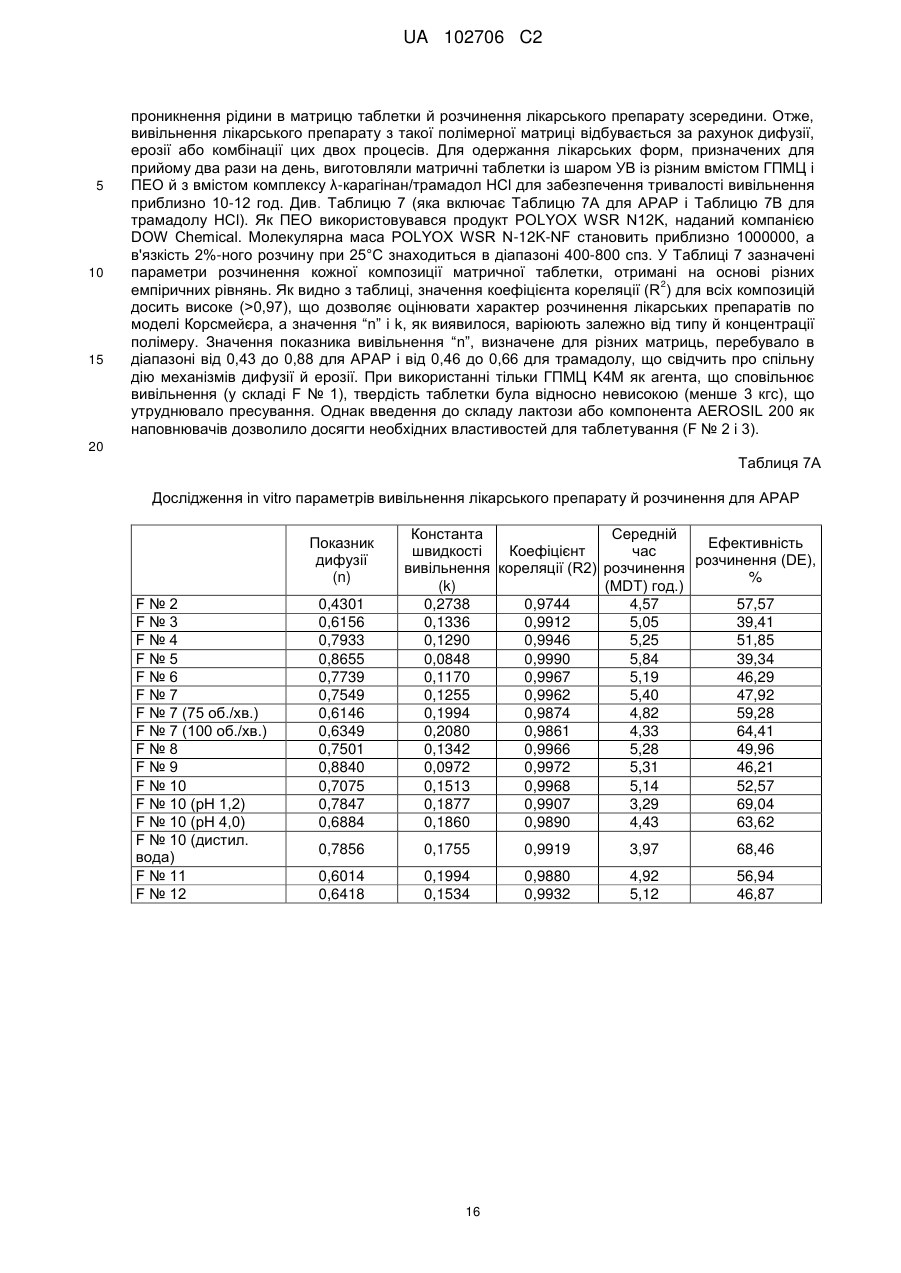
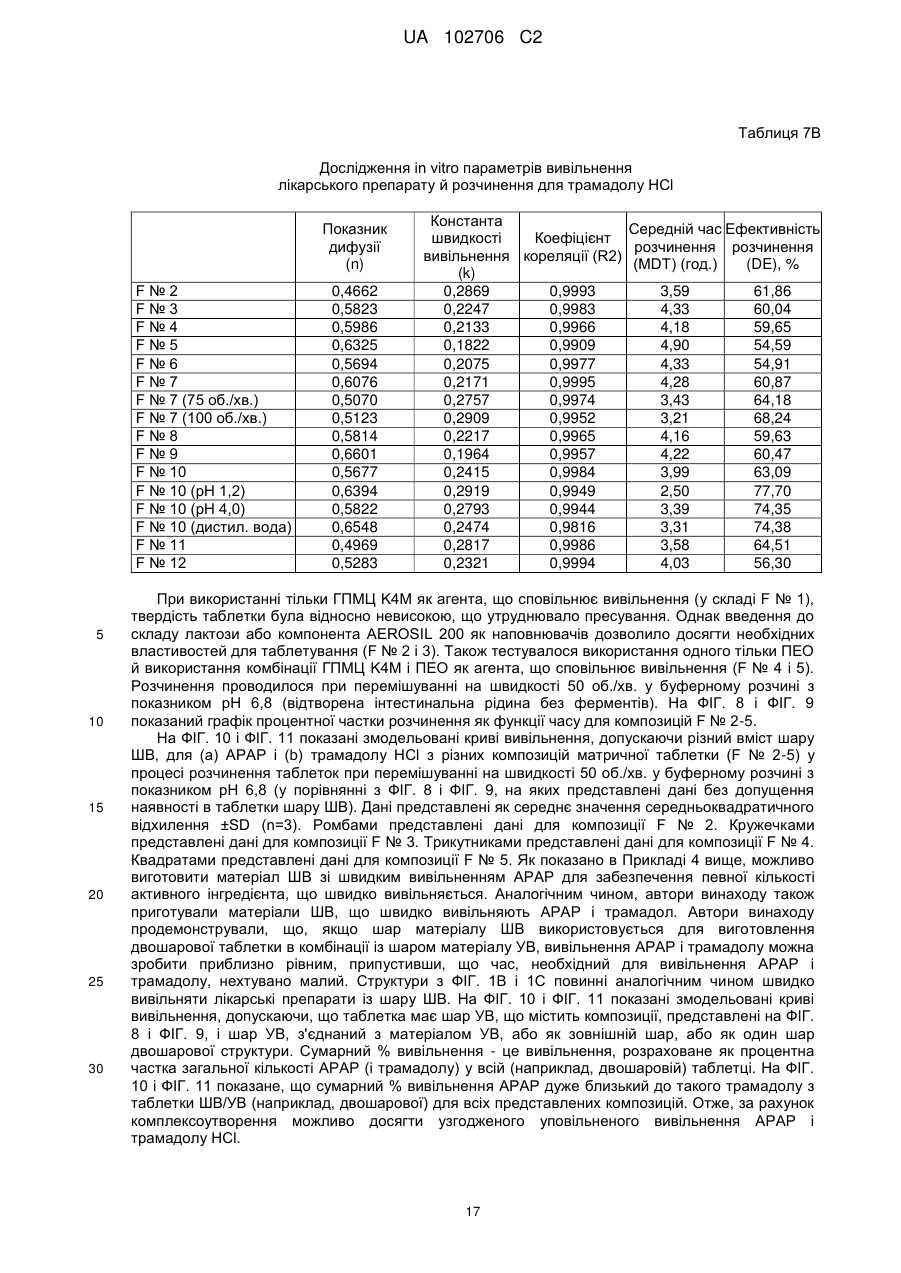
Текст
Реферат: Винахід стосується лікарської форми, що містить ацетамінофен і комплекс трамадолу, одержаний утворенням комплексу трамадолу з карагінаном, з уповільненою дією для перорального прийому. UA 102706 C2 (12) UA 102706 C2 UA 102706 C2 5 10 15 20 25 30 35 40 45 50 55 60 ТЕХНІЧНА ГАЛУЗЬ Даний винахід стосується уповільненої дії лікарських засобів. Зокрема, даний винахід стосується лікарських форм уповільненої дії, що включають комбінацію ацетамінофену й трамадолу. ПЕРЕДУМОВИ СТВОРЕННЯ ВИНАХОДУ Хронічний біль, такий як люмбаго й раптові спалахи болю при остеоартриті, є основною проблемою, пов'язаною зі здоров'ям, що спричиняє страждання окремим людям, що наносить велику втрату економіці, а також тягне за собою величезні прямі й непрямі витрати для суспільства в цілому. За наявним даними, у Сполучених Штатах Америки приблизно 60-80% дорослого населення хоча б раз у житті відчували напади хронічного болю в попереку. У даний час проблема хронічному болю набуває все більшої важливості, з урахуванням старіння населення в багатьох країнах. Для лікування хронічного болю звичайно застосовуються нестероїдні протизапальні препарати (НПЗП), однак їх ефективність обмежена. Крім того, прийом НПВП часто супроводжується значним ризиком для здоров'я, включаючи ймовірність ураження шлунково-кишкового тракту, розвитку виразок, кровотечі, аж до летального результату. Отже, у медичній сфері існує потреба в удосконалених препаратах для лікування зазначеного хронічного болю. У той час як НПВП проявляють периферичну дію, препарат трамадол (2(диметиламінометил)-1-(3-метоксифеніл)-циклогексан-1-ол, C16H25NO2) являє собою анальгетик центральної дії. Механізм дії трамадолу ще до кінця не вивчений; але результати досліджень in vivo свідчать про подвійний механізм: зв'язуванні вихідної молекули і її метаболіту з мюопіоїдними рецепторами й слабке інгібування зворотного захоплення норепінефрину й серотоніну. Протягом багатьох років для лікування хронічного болю найбільш переважним вибором був ацетамінофен, (N-(4-гідроксифеніл) ацетамід, C8H9NO2) (або APAP), наприклад, що випускається під широко відомою маркою TYLENOL. Хоча механізм дії APAP залишається неясним, очевидно, він також має центральну дію й викликає вибіркове інгібування синтезу простагландину в ЦНС, інгібування синтезу оксиду азоту, що стимулюється медіаторами Nметил-D-аспартатом або субстанцією P, і інгібування виділення в спинний мозок простагландину Е-2. Трамадол і APAP були об'єднані для одержання комбінованої лікарської форми. У патенті США № RE39221 описується, що в даній комбінації застосовуються менші кількості обох препаратів - трамадолу й APAP - у порівнянні з кількостями, необхідними для досягнення того ж ступеня аналгезії, як якби кожний із препаратів використовувався окремо. Компанія Ortho-McNeil Pharmaceutical розробила патентовану лікарську форму з негайним вивільненням для перорального прийому, що містить комбінацію трамадолу й APAP (37,5/325 мг) (ULTRACET), яка була схвалена Управлінням США по контролю якості харчових продуктів і лікарських засобів в 2001 році для зняття гострого болю. Даний продукт не викликає побічних ефектів, що виникають при прийомі НПЗП, наприклад, шлунково-кишкових виразок або кровотечі. Крім того, результати клінічних випробувань продемонстрували синергічний ефект даної комбінації, що забезпечує подовження часу дії зазначеної лікарської форми в порівнянні з APAP і більш швидкий початок дії в порівнянні із трамадолом. Препарат ULTRACET необхідно приймати кожні 4-6 годин. Ацетамінофен (далі APAP) (молекулярна маса 151,163 г/моль) і трамадол (далі може позначатися як ТРД) (молекулярна маса 263,375 г/моль) являють собою слабкі основи зі значеннями pKa 9,38 і 9,41, відповідно. Розчинність APAP у воді становить приблизно 14 мг/мл, тоді як трамадол HСl легко розчиняється у воді. Після прийому усередину APAP і трамадол HСl швидко всмоктуються, і обидва препарати зазнають інтенсивного пресистемного метаболізму. Хоча усмоктування APAP після прийому лікарського препарату відбувається, головним чином, у тонкому кишечнику, він, очевидно, також добре всмоктується з товстого кишечнику. Лікарська форма APAP з уповільненою дією для перорального прийому (препарат TYLENOL® ER, що випускається компанією McNeil Consumer Healthcare) була випущена на ринок в 1995 році. Це двошарова матрична таблетка, що містить 325 мг APAP у шарі зі швидким вивільненням і додатково 325 мг APAP у шарі з уповільненим вивільненням. Уповільнена дія APAP досягається шляхом регулювання вивільнення лікарського препарату з гідрофільної полімерної матриці. Що стосується трамадолу, біодоступність лікарських форм із уповільненою дією, що випускаються на сьогодні, трамадолу HСl ULTRAM® ER і трамадолу HСl CONTRAMID® OAD, свідчить про його прийнятне всмоктування в нижніх відділах шлунково-кишкового тракту. Ці два препарати, що мають зручну схему прийому один раз на день, забезпечують ефективне зняття болю протягом 24 годин. Препарат ULTRAM® ER складається з ядра, покритого сумішшю напівпроникного полімеру й водорозчинної добавки для підвищення проникності. Рівномірне й 1 UA 102706 C2 5 10 15 20 25 30 35 40 45 50 55 60 поступове вивільнення трамадолу HСl з таблетки досягається за рахунок регулювання вивільнення мембранним покриттям. CONTRAMID® OAD - це матрична таблетка із пресованим покриттям. Як матриця ядра таблетки використовується зшитий крохмаль із високим вмістом амілази, що забезпечує повільне вивільнення лікарського препарату, у той час як пресоване покриття забезпечує порівняно швидке вивільнення. Проте, у розробці лікарських форм із уповільненою дією, що містять комбінацію APAP/трамадол HСl (або на основі гідрофільної полімерної матриці, як, наприклад, препарат TYLENOL® ER, або у вигляді таблеток, покритих оболонкою, як, наприклад, препарати ULTRAM® ER і CONTRAMID® OAD) є технічні труднощі. Для лікарських препаратів з високою розчинністю у воді, до яких належить трамадол HСl, часто спостерігається небажане “вибухове” вивільнення, обумовлене швидким проникненням розчиненої лікарської речовини крізь гідрофільну гелеву структуру. Крім того, через велику відмінність двох лікарських препаратів у відношенні водорозчинності застосування оболонки для забезпечення уповільненого вивільнення практично недоцільно для досягнення синхронізованого вивільнення APAP і трамадолу HСl. Були зроблені спроби досягти уповільненого вивільнення APAP і трамадолу, наприклад, описані в публікації WO2004026308 і в патенті США № US20040131671. Однак добре узгодженого вивільнення досягти складно. Таким чином, існує потреба в створенні лікарської форми уповільненої дії, що містить трамадол і APAP, що забезпечує синхронізоване (або узгоджене) вивільнення двох зазначених препаратів протягом тривалого часу, для того, щоб сумарні масові частки вивільнення обох препаратів не занадто різнилися. Усі зазначені в даному документі джерела, патенти й публікації включені в даний документ у повному об'ємі за допомогою посилання. КОРОТКИЙ ОПИС Даний винахід представляє спосіб продовження вивільнення й лікарську форму з уповільненим вивільненням APAP і трамадолу. У лікарській формі згідно з даним винаходом міжіонна взаємодія лікарська речовина/полімер між трамадолом і аніонним полімером забезпечує повільне вивільнення трамадолу, результатом якого є узгоджене вивільнення APAP і трамадолу. В одному аспекті даний винахід являє собою фармацевтичну композицію, що містить APAP і комплекс трамадолу, причому дана композиція характеризується узгодженим уповільненим вивільненням при розчиненні, наприклад, при пероральному прийомі препарату, що забезпечує узгоджене наростаюче (тобто сумарне) вивільнення трамадолу й наростаюче вивільнення APAP із часом. Композиція може являти собою таблетку або частину таблетки, яка при потраплянні в шлунково-кишковий тракт повільно розчиняється з виділенням трамадолу й APAP відповідно до узгодженої кривої вивільнення. Композиція містить переважно комплекс трамадолу, причому комплексоутворення переважно здійснюється із застосуванням карагінану. Як трамадол переважно використовується сіль трамадолу, більш переважно - гідрохлорид (HСl). В іншому аспекті композиція містить комплекс трамадолу й APAP і характеризується постійним вивільненням і трамадолу, і APAP протягом 4-12 годин, особливо через 6-12 годин, протягом усього періоду уповільненої доставки, для якої розроблена дана лікарська форма. Необхідно відзначити, що при одержанні схвалення на лікарський препарат у відповідному контролюючому органі (наприклад, в Управлінні США по контролю якості харчових продуктів і лікарських засобів) для лікування пацієнтів лікарська форма може бути схвалена за умови її регулярного прийому в певному дозуванні через установлені інтервали часу. Таким чином, у заявці на одержання дозволу й у дозволі, що видається на ту або іншу лікарську форму, повинні вказуватися інтервали між прийомом чергових доз, з урахуванням яких розроблена така лікарська форма. В одному аспекті даний винахід являє собою спосіб виготовлення лікарської форми на основі фармацевтичної композиції, причому такий спосіб включає стадії формування комплексу трамадолу й формування пресованої лікарської форми, що включає комплекс трамадолу й APAP. Дана пресована лікарська форма характеризується узгодженим уповільненим вивільненням при пероральному прийомі пацієнтом, що забезпечують узгоджену наростаючу доставку трамадолу й наростаючу доставку APAP із часом. Композиція може являти собою таблетку або частину (наприклад, один шар) таблетки, що забезпечує постійне, узгоджене й уповільнене вивільнення (УВ) трамадолу й APAP. В одному аспекті лікарська форма являє собою двошарову таблетку, у якій два шари зв’язані між собою один поверх іншого: один шар з уповільненим вивільненням (УВ), що містить APAP і комплекс трамадолу, і шар зі швидким вивільненням (ШВ), що містить APAP і не зв'язаний у комплекс трамадол. В іншому аспекті лікарська форма включає матеріал УВ, що містить APAP і комплекс трамадолу, оточений з усіх 2 UA 102706 C2 5 10 15 20 25 30 35 40 45 50 55 боків шаром УВ, що містять APAP і не зв'язаний у комплекс трамадол, або що знаходиться між двома такими шарами ШВ. В одному аспекті даний винахід являє собою застосування комплексу трамадолу при виготовленні лікарського засобу для лікування болю, а також спосіб знеболювання із застосуванням даного лікарського засобу. Зазначений лікарський засіб містить комплекс трамадолу й APAP і характеризується узгодженим уповільненим вивільненням трамадолу й APAP при розчиненні, наприклад, у випадку перорального прийому лікарського засобу пацієнтом, що забезпечує узгоджену наростаючу доставку трамадолу й наростаючу доставку APAP із часом. Автори винаходу з'ясували, що деякі аніонні полімери, особливо карагінани, знижують розчинність лікарських препаратів і їх дифузійну здатність або розчинення, що забезпечує постійне, уповільнене вивільнення трамадолу. Таким чином, виготовлення комбінації APAP і трамадолу в комплексі з карагінаном дозволило досягти уповільненого вивільнення трамадолу, що точно відповідає кривій вивільнення APAP відносно процентної частки сумарного вивільнення даних лікарських препаратів. Така узгоджена доставка обох лікарських препаратів протягом тривалого періоду часу має значні переваги в порівнянні з лікарськими формами, що випускалися на ринок раніше, які вимагали частого прийому дози препарату й викликали сильні коливання концентрації APAP і трамадолу в плазмі крові. Вивільнення лікарських препаратів з лікарської форми з уповільненим вивільненням обумовлене контрольованим вивільненням двох різних лікарських препаратів, один з яких при неконтрольованому вивільненні, як правило, виділяється швидше, ніж інший. Неможливо передбачити, що можливо сповільнити вивільнення лікарського препарату, що швидко вивільняється, для відповідності його швидкості вивільнення лікарському препарату, що порівняно повільно вивільняється. Отже, дивно, що використання підібраного аніонного комплексоутворювального полімеру, особливо карагінану, дозволяє досягти уповільненого вивільнення, при якому швидкості вивільнення APAP і трамадолу точно відповідають один одному. Автори винаходу виявили, що комплексоутворення веде до зміни кінетики вивільнення, від вивільнення за законами Фіка (n = приблизно 1,14 см (0,45 дюймів) у рівнянні Корсмейєра) до вивільнення більшою мірою нульового порядку (n прямує до 1 у рівнянні Корсмейєра), а також до уповільнення швидкості вивільнення. Отже, зв'язування трамадолу в комплекс із карагінаном, особливо з лямбда-карагінаном, зменшує різницю у швидкості вивільнення між трамадолом і APAP, тим самим синхронізуючи їх швидкості вивільнення. Лікарська форма переважно містить також дві інші допоміжні речовини: поліетиленоксид (ПЕО) і гідроксипропілметилцелюлозу (ГПМЦ) K4M як добавку, що сповільнює вивільнення в комбінації з комплексоутворювальним агентом карагінаном. Без додавання ПЕО процес пресування в таблетки комплексу суміші утруднюється в результаті розшарування й (або) руйнування пресованої заготовки по діагональних площинах; крім того, складно досягти необхідної твердості пресованої таблетки. Крім цього, пресована таблетка УВ без ПЕО меншою мірою демонструвала характеристики кінетики нульового порядку при розчиненні, ніж таблетки з ПЕО, навіть при синхронізації вивільнення лікарських препаратів за рахунок зв'язування в комплекс із карагінаном. Отже, ПЕО сприяє досягненню кінетики вивільнення APAP і трамадолу, близької до кінетики нульового порядку, а також забезпечує кращу здатність до пресування і технологічність суміші. Також був виявлений позитивний вплив ГПМЦ K4M на здатність до пресування таблетки й поліпшення характеристик уповільненого вивільнення як APAP, так і трамадолу. КОРОТКИЙ ОПИС ФІГУР На ФІГ. 1A показаний вид у розрізі частини лікарської форми, що містить APAP і трамадол згідно з даним винаходом, у формі двошарової таблетки. На ФІГ. 1B показаний вид у розрізі іншого варіанта здійснення даного винаходу у вигляді таблетованої лікарської форми, що містить APAP і трамадол, у якій шар УВ оточений шаром ШВ згідно з даним винаходом. На ФІГ. 1C показаний вид у розрізі іншого варіанта здійснення даного винаходу у вигляді таблетованої лікарської форми, що містить APAP і трамадол згідно з даним винаходом, у якій шар УВ знаходиться між двома шарами ШВ. На ФІГ. 2 показана крива вивільнення комбінації APAP/трамадол з матриці, що містить комплекс трамадолу й не зв'язаний у комплекс трамадол. На ФІГ. 3, 4 і 5 показані криві вивільнення для лікарських форм C, D і E, що містять, відповідно, різні кількості гідроксипропілметилцелюлози K4M (ГПМЦ K4M). На ФІГ. 6 показане значення T80 для APAP і співвідношення тривалості вивільнення для трамадолу, що ілюструє вплив дозування ГПМЦ. 3 UA 102706 C2 5 10 15 20 25 30 35 40 45 50 55 На ФІГ. 7a і 7b показані криві вивільнення трамадолу й APAP з композицій F і G, відповідно, що ілюструють вплив застосування трамадолу в комплексі з карагінаном і трамадолу, не зв'язаного в комплекс. На ФІГ. 8 представлений графік кривої вивільнення APAP з 4 лікарських форм (F № 2-5), що містять такі наповнювачі як лактоза, AEROSIL і поліетиленоксид. На ФІГ. 9 представлений графік кривої вивільнення трамадолу HСl з 4 лікарських форм (F № 2-5) з ФІГ. 8, що містять такі наповнювачі як лактоза, AEROSIL і поліетиленоксид. На ФІГ. 10 представлений графік кривої вивільнення APAP для 4 лікарських форм (F № 2-5) з ФІГ. 8, що містять такі наповнювачі як лактоза, AEROSIL і поліетиленоксид і виконаних у вигляді двошарових таблеток із шаром ШВ і шаром УВ. На ФІГ. 11 представлений графік кривої вивільнення трамадолу HСl з 4 лікарських форм (F № 2-5) з ФІГ. 8, що містять такі наповнювачі як лактоза, AEROSIL і поліетиленоксид і виконаних у вигляді двошарових таблеток із шаром ШВ і шаром УВ. На ФІГ. 12 представлений графік кривої вивільнення APAP і трамадолу HСl з лікарської форми F № 6. На ФІГ. 13 представлений графік кривої вивільнення APAP і трамадолу HСl з лікарської форми F № 6, виконаної у вигляді двошарової таблетки із шаром ШВ і шаром УВ. На ФІГ. 14 представлений графік кривої вивільнення APAP з лікарської форми F № 7 і лікарської форми F № 8. На ФІГ. 15 представлений графік кривої вивільнення трамадолу HСl з лікарської форми F № 7 і лікарської форми F № 8. На ФІГ. 16 представлений графік кривої вивільнення APAP з лікарської форми F № 7 і лікарської форми F № 8, виконаних у вигляді двошарової таблетки із шаром ШВ і шаром УВ. На ФІГ. 17 представлений графік кривої вивільнення трамадолу HСl з лікарської форми F № 7 і лікарської форми F № 8, виконаних у вигляді двошарової таблетки із шаром ШВ і шаром УВ. На ФІГ. 18 представлений графік кривої вивільнення APAP з лікарської форми F № 7, лікарської форми F № 9 і лікарської форми F № 10. На ФІГ. 19 представлений графік кривої вивільнення трамадолу HСl з лікарської форми F № 7, лікарської форми F № 9 і лікарської форми F № 10. На ФІГ. 20 представлений графік кривої вивільнення APAP з лікарської форми F № 7, лікарської форми F № 9 і лікарської форми F № 10, виконаних у вигляді двошарових таблеток із шаром ШВ і шаром УВ. На ФІГ. 21 представлений графік кривої вивільнення трамадолу HСl з лікарської форми F № 7, лікарської форми F № 9 і лікарської форми F № 10, виконаних у вигляді двошарових таблеток із шаром ШВ і шаром УВ. На ФІГ. 22 представлений графік кривої вивільнення APAP з лікарської форми F № 10, лікарської форми F № 11 і лікарської форми F № 12. На ФІГ. 23 представлений графік кривої вивільнення трамадолу HСl з лікарської форми F № 10, лікарської форми F № 11 і лікарської форми F № 12. На ФІГ. 24 представлений графік кривої вивільнення APAP з лікарської форми F № 10, лікарської форми F № 11 і лікарської форми F № 12, виконаних у вигляді двошарових таблеток із шаром ШВ і шаром УВ. На ФІГ. 25 представлений графік кривої вивільнення трамадолу HСl з лікарської форми F №10, лікарської форми F № 11 і лікарської форми F № 12, виконаних у вигляді двошарових таблеток із шаром ШВ і шаром УВ. На ФІГ. 26 представлений графік кривої вивільнення APAP з лікарської форми F № 10 у буферах з різними показниками pН і в дистильованій воді. На ФІГ. 27 представлений графік кривої вивільнення трамадолу HСl з лікарської форми F № 10 у буферах з різними показниками pН і в дистильованій воді. На ФІГ. 28 представлений графік кривої вивільнення APAP з лікарської форми F № 10, виконаної у вигляді двошарової таблетки із шаром ШВ і шаром УВ, у буферах з різними показниками pН і в дистильованій воді. На ФІГ. 29 представлений графік кривої вивільнення трамадолу HСl з лікарської форми F № 10, виконаної у вигляді двошарової таблетки із шаром ШВ і шаром УВ, у буферах з різними показниками pН і в дистильованій воді. На ФІГ. 30 представлений графік кривої вивільнення APAP з лікарської форми F № 7 при різних швидкостях (об./хв.) перемішування при розчиненні. На ФІГ. 31 представлений графік кривої вивільнення трамадолу HСl з лікарської форми F № 7 при різних швидкостях (об./хв.) перемішування при розчиненні. 4 UA 102706 C2 5 10 15 20 25 30 35 40 45 50 55 60 На ФІГ. 32 представлений графік кривої вивільнення APAP з лікарської форми F № 7, виконаної у вигляді двошарової таблетки із шаром ШВ і шаром УВ, при різних швидкостях (об./хв.) перемішування при розчиненні. На ФІГ. 33 представлений графік кривої вивільнення трамадолу HСl з лікарської форми F № 7, виконаної у вигляді двошарової таблетки із шаром ШВ і шаром УВ, при різних швидкостях (об./хв.) перемішування при розчиненні. На ФІГ. 34 показані криві розчинення лікарської форми F № 13 для вивільнення (a) APAP і (b) трамадолу HСl з F № 13 при швидкості перемішування 50 об./хв., у буфері з показником pН 1,2 протягом перших 2 годин і в буфері з показником pН 6,8 через 2-12 годин. На ФІГ. 35 показана схема технологічного процесу для виробництва двошарових таблеток згідно з варіантом здійснення даного винаходу F № 13. На ФІГ. 36 показана графічне зображення частини кривих залежності середньої плазмової концентрації від часу для трамадолу після декількох пероральних прийомів таблеток ULTRACET і таблеток УВ згідно з даним винаходом. На ФІГ. 37 показана графічне зображення частини кривих залежності середньої плазмової концентрації від часу для APAP після декількох пероральних прийомів таблеток ULTRACET і таблеток УВ згідно з даним винаходом. ДОКЛАДНИЙ ОПИС Даний винахід стосується лікарської форми, яка забезпечує узгоджену доставку APAP і трамадолу в організм пацієнта при пероральному прийомі. Більш конкретно, даний винахід стосується лікарської форми, яка забезпечує узгоджену доставку APAP і трамадолу в організм пацієнта через шлунково-кишковий тракт за допомогою уповільненого вивільнення препаратів під час розчинення лікарської форми, при якому вивільнення препаратів відбувається поступово протягом тривалого періоду часу. При описі даного винаходу будуть використовуватися наведені нижче терміни, що визначаються наступним чином. У даному описі й у прикладених пунктах формули винаходу форми однини включають і множинні позначення, якщо тільки зміст тексту не визначає іншого. Якщо в тексті не зазначене інше, у контексті даної публікації термін “трамадол” позначає основу трамадолу, сіль трамадолу або похідне трамадолу, що має властивість катіонів утворювати комплекси з карагінаном за допомогою межіонної взаємодії. Кількість трамадолу, що згадується в даній публікації, стосується еквівалента трамадолу HСl. Термін “біологічно активний компонент” тлумачиться в найбільш широкому змісті й позначає будь-яку речовину, що має який-небудь біологічний, цілющий, терапевтичний або інший передбачуваний ефект, наприклад, ефект підвищення проникності, знеболювання й контрацепції. У контексті даної публікації термін “лікарський препарат” стосується будь-якої речовини, призначеної для одержання якого-небудь біологічного, цілющого, терапевтичного або іншого передбачуваного ефекту. На ФІГ. 1A показане схематичне зображення поперечного розрізу двошарової таблетки, тобто таблетки, що складається із двох шарів. У двошаровій таблетці обидва шари знаходяться у прямому й безпосередньому контакті, один шар розташований поверх іншого шару. В одному варіанті здійснення таблетка 20 включає шар з уповільненим вивільненням (УВ) 24 (що містить частинки комплексу трамадолу 28), з'єднаний із шаром зі швидким вивільненням (ШВ) 22. Лікарська форма має тільки два шари, що містять активні фармацевтичні інгредієнти (АФІ) (APAP і трамадол). В іншому варіанті здійснення структура, показана на ФІГ. 1A, може входити до складу лікарської форми, зображеної в розрізі на ФІГ. 1B. Така лікарська форма може мати традиційну форму драже, довгастої таблетки, сферичну форму, циліндричну форму і т.д., кожна з яких називається в даній публікації для зручності “таблетка”, якщо для терміну “таблетка” не наводиться іншого особливого визначення. У лікарській формі, показаній на ФІГ. 1B, таблетка 30 включає шар з уповільненим вивільненням (УВ) 24 (що містить частинки комплексу трамадолу 28), оточений шаром зі швидким вивільненням (ШВ) 22. Таким чином, шар УВ може бути ядром (переважно у формі шару або таблетки), оточеним шаром ШВ. Крім того, таблетка може складатися із шару УВ, що знаходиться між двома шарами ШВ, як таблетка 40, показана на ФІГ. 1C. Таблетка будь-якої форми може додатково включати зовнішню оболонку (або покриття, хоча воно не показане на ФІГ. 1A-1C). Зовнішня оболонка оточує шар ШВ 22 і будьяку речовину із шару УВ, не оточену шаром ШВ. В одному аспекті лікарська форма згідно з даним винаходом являє собою тверду пресовану лікарську форму, що повільно виділяє APAP і трамадол протягом тривалого часу за допомогою уповільненого вивільнення. Наприклад, тверда пресована лікарська форма може являти собою одношарову або двошарову таблетку або являти собою ядро, оточене зовнішнім шаром зі швидким вивільненням (або негайним вивільненням). У цілому, тверда пресована лікарська 5 UA 102706 C2 5 10 15 20 25 30 35 40 45 50 55 форма включає комплекс трамадолу, що повільно виділяє активний компонент трамадол у шлунково-кишковий тракт й всмоктується з нього. Утворення комплексу на основі карагінану й основного лікарського препарату описане в публікації Aguzzi et al., “Influence of Complex solubility on Formulations based on Lambda Carrageenan and Basic Drugs”, AAPS Pharmscitech 2002; 3(3) Article 27. Комплекс трамадолу включає препарат трамадол, який являє собою основу трамадолу, його сіль або складний ефір. Як препарат трамадолу використовується будь-яка з перерахованих речовин: (1R,2R або 1S,2S)-(диметиламінометил)-1-(3-метоксифеніл)циклогексанол (трамадол), його похідне на основі N-оксиду (“N-оксид трамадолу”), його похідне на основі O-десметилу (“O-десметил-трамадол”), а також суміші зазначених сполук. Він також включає окремі стереоізомери, суміші стереоізомерів, у тому числі рацемічні суміші, фармацевтично прийнятні солі амінів, наприклад, гідрохлорид, цитрат, ацетат, а також сольвати й поліморфи трамадолу. Трамадол випускається в продаж компанією Grunenthal. Способи виробництва трамадолу відомі у відповідній галузі, як, наприклад, описано в патенті США № 3652589 і в публікації RE39221, які включені в дану публікацію за допомогою посилання. Oдесметил-трамадол одержують шляхом обробки трамадолу як вільної основи в умовах реакції O-десметилювання, наприклад, шляхом його взаємодії із сильною основою, такою як NaОН або KOH, тіофенолом і діетиленгліколем (ДЕГ) при нагріванні до точки кипіння. Див. публікацію Wildes et al., J. Org. Chem., 36, 721 (1971). Як препарат трамадолу для утворення комплексу з аніонним полімером переважним є трамадол HСl. Передбачається, що використання основи трамадолу або різних солей у комбінації із трамадолом, наприклад, різних галогенних солей і т.д. трамадолу, не виявить значного впливу на утворення комплексу трамадолу з карагінаном і, отже, не приведе до істотної різниці у швидкості вивільнення готової таблетки УВ. Фахівці галузі можуть скорегувати рецептуру відповідним чином виходячи із даного опису без необхідності проведення зайвих експериментів. Як комплексоутворювальні полімери використовуються розчинні у воді гелеутворювальні аніонні полімери; вони містять бокові групи, такі як сульфати, карбоксилати, фосфати або інші негативно заряджені групи, що взаємодіють з катіонним лікарським препаратом. Як комплексоутворювальний полімер переважно використовується полісахаридна речовина з боковими аніонними групами (інакше кажучи, аніонний полісахарид, особливо сульфатований полісахарид). Особливо переважним є карагінан. Карагінани - це сульфатовані полісахариди, одержувані з морських водоростей. Звичайно карагінани розділяються на кілька типів: каппа, йота й лямбда, усі з яких утворюють гелі з водою при кімнатній температурі. Різні типи карагінанів можуть утворювати гелі, що мають різні характеристики м'якості або твердості. Утворення комплексу λ-карагінану з основними лікарськими препаратами описане в публікації Aguzzi et al. (AAPS Pharmscitech 2002; 3(3) Article 27), включеній в даний документ за допомогою посилання. Комплексоутворювальні полімери біологічно сумісні й нетоксичні. Вони мають досить високу молекулярну масу, що дозволяє приготувати гель на основі активного компонента. Хоча автори даного винаходу не бажають бути зв'язаними якою-небудь конкретною теорією, вважається, що катіонний лікарський препарат взаємодіє з аніонними боковими групами аніонного полімеру, що веде до електростатичних взаємодій між ланцюжками полімеру, у результаті яких ланцюжки полімеру розташовуються таким чином, що проникнення полярного розчинника (наприклад, води) у структуру гелю до трамадолу уповільнюється. Як правило, молекулярна маса лямбдакарагінану становить приблизно 100000~500000 дальтон. Лямбда-карагінан випускається на продаж у двох різновидах, що відрізняються в'язкістю. Один різновид - це VISCARIN® GP 109 виробництва компанії FMC (низьков’язкий карагінан, що має в'язкість приблизно 760 сантипуаз -1 (спз), вимірювана при 37°C і швидкості зсуву 20 с ), а інший - VISCARIN® GP 209 (високої -1 густини, що має в'язкість приблизно 1600 спз, вимірювану при 37°C і швидкості зсуву 20 с ). У ході даного дослідження було виявлено, що VISCARIN® GP 109 є більш зручним. Переважний тип карагінану - це лямбда-карагінан з низькою молекулярною масою. Також можна використовувати інші карагінани, наприклад, каппа-карагінан. Лямбда-карагінан характеризується найбільшою кількістю сульфатних груп у порівнянні з аналогічними різновидами каппа- і йота-карагінану. Було продемонстровано, що лямбда-карагінан інтенсивно взаємодіє з лікарськими препаратами, що мають гарну розчинність, і автори винаходу довели, що він дуже добре взаємодіє із трамадолом. У таблиці нижче показано, що карагінан ефективний як комплексоутворювальний агент із трамадолом для уповільнення вивільнення трамадолу. 6 UA 102706 C2 Таблиця 1 Комплексоутворення з лямбда-карагінаном для зменшення різниці в тривалості вивільнення (співвідношення T 80) Матриця T80 (h) T80 відношення n 5 10 15 20 25 30 35 40 45 Ацетамінофен Трамадол Ацетамінофен Трамадол А (комплекс, В (Лямбда) що не містить) 17,7 20,0 7,3 14,3 2,4 1,4 0,658 0,708 0,471 0,542 С (Каппа) 17,6 8,6 2,0 0,524 0,437 D (EC) 18,8 8,7 2,2 0,672 0,439 Як показано в Таблиці 1 вище, лямбда-карагінан має найменше значення співвідношення T80 (1,4). T80 означає час, за який сумарне розчинення APAP (і аналогічно для трамадолу, якщо як лікарський препарат використовується трамадол) досягає 80%. Співвідношення T 80 означає (T80 APAP/ T80 трамадолу). Найменше значення співвідношення T 80 (1,4) у лікарській формі на основі лямбда-карагінану означає, що різниця у швидкості розчинення між двома активними фармацевтичними інгредієнтами (АФІ), тобто лікарськими препаратами, у даній лікарській формі зменшується найбільш ефективно. Для порівняння, співвідношення T80 для лікарської форми на основі каппа-карагінану дорівнює 2,0, для лікарської форми на основі етилцелюлози (ЕЦ) - 2,2, а для лікарської форми, що не містить комплексу - 2,4. Отже, етилцелюлоза також діє як добавка, що сповільнює вивільнення, але вона менш ефективна, ніж карагінан. Показник дифузії n (як описано нижче) для лямбда-карагінану також продемонстрував характеристики більшою мірою нульового порядку. Інші аніонні речовини, придатні для використання з метою утворення комплексів із трамадолом, включають альгінову кислоту, карбоксиметилцелюлозу і т.д. Однак комплексоутворювальна здатність інших аніонних речовин слабша, ніж у карагінану. Як аніонну речовину для утворення комплексів із трамадолом також можна використовувати інші сульфатовані або сульфовані полісахариди або полімери, включаючи сульфат декстрану або сильну катіонообмінну смолу (AMBERLITE IRP69). Для одержання комплексу трамадолу вагове співвідношення трамадолу й аніонної полімерної речовини (наприклад, карагінану) звичайно варіює від приблизно 1:0,1 до приблизно 1:100, переважно від приблизно 1:0,5 до приблизно 1:10. У складі твердої пресованої лікарської форми APAP і трамадол звичайно присутні у ваговому співвідношенні APAP до трамадолу приблизно від 20:1 до 1:1, переважно приблизно від 5:1 до 10:1, більш переважно приблизно від 6:1 до 9:1. Більш того, у шарі зі швидким вивільненням (ШВ) APAP і трамадол звичайно присутні у ваговому співвідношенні APAP до трамадолу приблизно від 20:1 до 1:1, переважно приблизно від 5:1 до 18:1, більш переважно приблизно від 10:1 до 16:1. Автори винаходу прийшли до висновку, що при співвідношенні APAP до трамадолу в зазначених межах можливо забезпечити узгоджену доставку цих двох препаратів з дуже близькими значеннями сумарної швидкості вивільнення (у % ваг.) в одній таблетці, що забезпечує сумарне вивільнення в основному більше 30% ваг. протягом першої години доставки, з підтримкою уповільненого вивільнення протягом приблизно 12 годин. Шар ШВ, який можна приєднати до шару УВ, включає APAP, трамадол і допоміжні речовини, такі як розпушувачі, зв'язувальні речовини й наповнювачі. Як допоміжні речовини можна використовувати стеарат магнію, порошкову целюлозу, кукурудзяний крохмаль, клейстеризований крохмаль і карбоксиметилкрохмаль натрію. Легкорозчинні зв’язувальні речовини, такі як клейстеризований крохмаль, полівінілпіролідон, камеді і т.д., забезпечують тимчасове зв'язування різних інгредієнтів до потрапляння лікарської форми у водне середовище. Такі зв’язувальні речовини швидко розчиняються, що веде до розпаду шару ШВ із вивільненням лікарських препаратів. Розпушувачі, такі як карбоксиметилкрохмаль натрію, порошкова целюлоза, волокниста целюлоза й порошковий діоксид кремнію, забезпечують легкий і рівномірний розпад шару ШВ після розчинення зв’язувальної речовини. Також можна використовувати стеарат магнію й стеарилфумарат натрію як ковзні речовини. Що стосується шару УВ, не беручи до уваги сусідній з ним шар ШВ, авторам винаходу вдалося досягти вивільнення, при якому у момент часу, коли сумарне вивільнення трамадолу становить 40% ваг., сумарне вивільнення APAP відрізняється від сумарного вивільнення трамадолу менше, ніж на 25% ваг. Авторам винаходу також вдалося досягти такого 7 UA 102706 C2 5 10 15 20 25 30 35 40 45 50 55 60 вивільнення, при якому у ході уповільненого вивільнення, починаючи з моменту часу, у який сумарне вивільнення трамадолу становить 40% ваг., сумарне вивільнення APAP (у % ваг.) ніколи не відрізняється від сумарного вивільнення трамадолу більше ніж на 20% ваг. Авторам винаходу також вдалося досягти вивільнення, при якому у момент часу, коли сумарне вивільнення трамадолу становить 40% ваг., сумарне вивільнення APAP (у % ваг.) ніколи не відрізняється від сумарного вивільнення трамадолу більше ніж на 10% ваг. Крім того, авторам винаходу вдалося досягти того, що при уповільненому вивільненні після першої години для уповільненого вивільнення протягом, щонайменше, 12 годин, сумарне вивільнення APAP (у % ваг.) ніколи не відрізняється від сумарного вивільнення трамадолу (у % ваг.) більше ніж на 10% ваг. Значення сумарного вивільнення при уповільненому вивільненні можна визначити за допомогою Обладнання II по Фармакопеї США (USP II) при 37°C і 50 об./хв./900 мл in vitro у буферному розчині для розчинення при pН 6,8 (стандартна відтворена інтестинальна рідина по Фармакопеї США, але без ферментів). Частину таблетки (наприклад, один із шарів двошарової таблетки) згідно з даним винаходом переважно виготовляють шляхом пресування частинок, причому частинки або гранули містять активний фармацевтичний інгредієнт, а також інші припустимі допоміжні речовини. Матеріали, що входять до складу шару з уповільненим вивільненням, пресують із одержанням пресованої одиниці, а потім покривають шаром зі швидким вивільненням, одержуючи таблетку, показану на ФІГ. 1A і т.д. Дані частинки переважно мають середній діаметр приблизно від 30 мкм до 3000 мкм, більш переважно приблизно від 100 мкм до 1000 мкм, а найбільш переважно - приблизно від 150 мкм до 400 мкм. Термін “діаметр частинок” для частинок некруглої форми звичайно стосується більшого розміру частинки. Переважно, щоб комплекс трамадолу мав розміри частинок з діаметром частинки приблизно від 30 мкм до 3000 мкм, більш переважно від 100 мкм до 900 мкм, а найбільш переважно - від 150 мкм до 300 мкм. Шар з уповільненим вивільненням або ядро може містити різні нерозчинні у воді речовини, наприклад, допоміжні речовини. Приклади таких нерозчинних у воді речовин включають полімери, у тому числі гідрофобні полімери. Приклади застосовних нерозчинних у воді речовин включають, у тому числі, одну або декілька з перерахованих далі речовин: етилцелюлоза, бутилцелюлоза, ацетат целюлози, пропіонат целюлози й тому подібні. Шар УВ або ядро одержують шляхом змішування активного фармацевтичного інгредієнта й щонайменше одного агента, здатного обмежити вивільнення активного інгредієнта, а також інших інгредієнтів. Приміром, шар УВ або ядро може містити велику безліч допоміжних речовин, включаючи розріджувачі, регулятори сипучості (гліданти), зв’язувальні речовини, розчинники для гранулювання, гранулюючи добавки, антисліжувачі, буфери й ковзні речовини. Наприклад, можливі розріджувачі включають одну або декілька з наступних речовин: цукри, наприклад, сахароза, лактоза, маніт, глюкоза; крохмаль; мікрокристалічна целюлоза; сорбіт, мальтодекстрин, солі кальцію й натрію, наприклад, фосфат кальцію; сульфат кальцію; сульфат натрію або аналогічний безводний сульфат; лактат кальцію; інші похідні лактози, наприклад, безводна лактоза; а також моногідрат лактози. Одним переважним розріджувачем є лактоза. Зв’язувальна речовина (зв’язувальні речовини) використовується (використовуються) для зв'язування речовин (наприклад, речовин, що входять до складу шару УВ). Відповідні зв’язувальні речовини включають один або декілька з наступних прикладів: полівініловий спирт, поліакрилова кислота, поліметакрилова кислота, полівінілпіролідон, сахароза, сорбіт, гідроксіетилцелюлоза, гідроксипропілметилцелюлоза (ГПМЦ), гідроксипропілцелюлоза, поліетиленгліколі, аравійська камедь, желатин, агар, поліетиленоксид (ПЕО) і т.д. У рецептурах лікарських форм переважно використовується ГПМЦ, оскільки вона виявляє тенденцію до подовження часу вивільнення. ГПМЦ E5 має набагато більш низьку молекулярну масу, ніж ГПМЦ K4M, і служить як зв’язувальна речовина. В'язкість розчину із вмістом 2% ГПМЦ Е5 становить приблизно 5 спз, а розчину із вмістом 2% ГПМЦ ДО4М - приблизно 4000 спз. Через різницю у в'язкості ГПМЦ E5 є переважною зв’язувальною речовиною для грануляції при виготовленні лікарських форм зі швидким вивільненням (ШВ), а ГПМЦ K4M переважно використовується в складі лікарських форм із уповільненим вивільненням. Іншою переважною речовиною є поліетиленоксид. При вивільненні препарату з лікарської форми спочатку вода проникає в структуру полімеру; потім у відповідь на проникнення води відбувається релаксація полімерного ланцюга. У результаті молекули лікарського препарату дифундують крізь полімер по мірі його набрякання. Зв’язувальні речовини, такі як ГПМЦ і ПЕО, також мають властивість утворення гелю, що утруднює проникнення рідини до лікарського препарату, завдяки чому вивільнення препарату з лікарської форми уповільнюється. Завдяки своїй високій молекулярній масі й в'язкості ГПМЦ і ПЕО є корисними інгредієнтами для лікарських форм уповільненої дії. 8 UA 102706 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ковзні речовини й антисліжувачі включають, у тому числі, одну або декілька з наступних речовин: тальк, стеарат магнію, стеарат кальцію, колоїдний діоксид кремнію, стеаринову кислоту, воски, гідрогенізовану рослинну олію, поліетиленгліколі, бензоат натрію, лаурилсульфат натрію, лаурилсульфат магнію й dl-лейцин. Корисними ковзними речовинами є добавки на основі діоксиду кремнію, наприклад, AEROSIL, який являє собою колоїдний діоксид кремнію, що випускається на продаж, - ультрамікроскопічний пірогенний діоксид кремнію з розмірами частинок приблизно 15 нм. У деяких випадках на таблетку може наноситися одна або декілька зовнішніх оболонок для захисту таблетки під час фасування й упакування, транспортування, а також для полегшення процесу проковтування. Такі зовнішні оболонки переважно швидко розпадаються, дозволяючи швидке вивільнення активних інгредієнтів із шару зі швидким вивільненням. Оболонка може включати одну або декілька речовин для нанесення покриття на таблетку. Прийнятні речовини для нанесення покриття включають желатин, сахариди (наприклад, моносахариди, дисахариди, полісахариди, такі як крохмаль, похідні целюлози). Інші придатні речовини для нанесення покриття включають багатоатомні спирти, такі як ксиліт, маніт, сорбіт, поліалкіленгліколі й т. п. Такі речовини для нанесення покриття й способи їх застосування відомі фахівцям галузі. Прикладами відповідних матеріалів для нанесення покриття є продукти SURELEASE і OPADRY (обидва виробництва компанії Colorcon, м. Уест-Пойнт, штат Пенсільванія, США). Устаткування й способи нанесення покриттів на таблетки добре відомі в галузі виробництва таблеток. Крім того, у деяких випадках як захисне покриття для одержання більш глянсової поверхні може застосовуватися воскоподібна речовина, наприклад, карнаубський віск. Технологія виробництва лікарських форм у вигляді таблеток згідно з даним винаходом передбачає використання традиційних технічних прийомів, застосовуваних при виготовленні таблеток. В одному аспекті з матеріалу з уповільненим вивільненням одержують шар з уповільненим вивільненням, після чого його покривають шаром зі швидким вивільненням, а потім (у деяких випадках) однією або декількома зовнішніми оболонками. Матеріал УВ також може являти собою ядро таблетки. Матеріал УВ одержують шляхом спресовування частинок інгредієнтів у пресовану форму. Переважно пресована форма варіанта здійснення даного 2 винаходу має твердість приблизно від 4 до 20 кгс/см . Крім того, інгредієнти у вигляді частинок або гранул можна одержати шляхом грануляції із застосуванням однієї або декількох технологій або відповідних технічних прийомів, включаючи грануляцію в грануляторах різних видів: гранулятор з низьким ступенем зсуву, гранулятор із псевдозрідженим шаром, гранулятор з високим ступенем зсуву й тому подібні. Таблетки згідно з даним винаходом можуть бути виготовлені будь-яким способом, відомим у галузі. Традиційні способи виробництва таблеток включають пряме пресування (“сухе змішування”), суху грануляцію з наступним пресуванням і вологу грануляціюз наступним пресуванням. Переважно таблетку або шар таблетки виготовляють способом прямого пресування, який передбачає пряме пресування суміші активних інгредієнтів. Наприклад, після змішування порошкоподібну суміш завантажують у порожнину матриці таблеткового пресу (такого як роторний прес), який пресує матеріал у вигляді таблеток. У контексті даної публікації таблетки можуть мати традиційну довгасту форму, що має прямокутний перетин з округленими кутами, сферичну форму, дископодібну форму драже й т. п. Матеріали пресуються у форму таблетки до твердості переважно приблизно від 2 до 6 кгс, із переважним значенням приблизно 4 кгс для сухої таблетки. У даному винаході шар ШВ, шар УВ або таблетки пресували із застосуванням технології вологої грануляції, до твердості 6 кгс або вище. Після виготовлення частинок або гранул перед пресуванням частинок матеріал сушать в умовах, достатніх для одержання гранул із переважним вмістом води не більше 0,5% ваг. У даному винаході для гранул ШВ і УВ після сушіння в ході аналізу на втрату в масі при висушуванні отримані результати вмісту вологи від 1,0% до 3,0%. Матеріали сушать при переважній температурі приблизно 50°C. Сушіння переважно проводиться в температурному інтервалі приблизно від 40°C до 50°C протягом необхідного часу, наприклад, 12-16 годин, до видалення рідини, наприклад, розчинників і (або) води. У лабораторних масштабах час сушіння становить 12-16 годин. У промислових масштабах час сушіння може бути коротше, наприклад, приблизно від 0,5 до 2 годин, за рахунок використання сушарки із псевдозрідженим шаром. При виготовленні двошарової таблетки один шар наноситься поверх іншого шару, наприклад, шар матеріалу ШВ наноситься на шар УВ (або приєднується до шару УВ) або навпаки. Аналогічним чином, лікарська форма, що складається із шару УВ, що знаходиться між двома шарами ШВ, може бути виготовлена таким же способом. Аналогічно зовнішній шар матеріалу ШВ може наноситися на ядро для одержання таблетки УВ, що складається із шару 9 UA 102706 C2 5 10 15 20 25 30 35 40 45 50 55 60 ШВ, що оточує ядро УВ, так що таблетка забезпечує швидке вивільнення, а також уповільнене вивільнення для знеболювання при лікуванні пацієнта. Обладнання й способи формування таблеток, що містять кілька шарів, або таблеток, що складаються із твердого ядра, покритого шаром, що оточує його, добре відомі в галузі виробництва таблеток. Наприклад, нанесення шару зі швидким вивільненням на ядро з уповільненим вивільненням досягається цілим рядом різних технологій грануляції. Крім того, двошарові таблетки можна виготовляти за допомогою двошарового таблеткового пресу. Один спосіб виготовлення двошарових таблеток полягає в пресуванні гранул або частинок в один шар (наприклад, матеріалу УВ) з наступним пресуванням гранул або частинок для іншого шару (наприклад, матеріалу ШВ) на першому шарі з одержанням двошарової структури, що подібна до таблетки. Для одержання тришарової таблетки на обрану сторону (наприклад, на сторону УВ) двошарової структури, подібної до таблетки, може наноситися пресуванням третій шар (наприклад, шар ШВ). Як правило, із усієї кількості активного інгредієнта у всій таблетці згідно з даним винаходом приблизно 30-90% ваг., переважно, приблизно 40-80% ваг., більш переважно приблизно 50-70% ваг. препарату APAP знаходиться в ядрі УВ таблетки. З іншого боку, як правило, у ядрі УВ таблетки знаходиться приблизно 30-100% ваг., переважно приблизно 50-90% ваг., більш переважно приблизно 60-80% ваг. трамадолу. Кількість активних інгредієнтів (APAP і трамадолу), що залишилася, може знаходитися в шарі ШВ поруч із шаром УВ для забезпечення швидкого підйому рівня вмісту лікарських препаратів у сироватці крові з метою досягнення терапевтичного ефекту. Методики й обладнання Нижче описане типове приблизне обладнання й методики, рекомендовані для виготовлення, оцінки й застосування лікарських форм згідно з даним винаходом. Лямбда (λ) карагінан наводиться як наочний приклад. Матричні таблетки виготовляли методом вологої грануляції. Докладний склад різних композицій наводиться в таблицях, представлених нижче. У цілому, у процесі виготовлення лікарських форм трамадол HСl розчиняли в 60%-ному розчині етанолу (у співвідношенні 1:1,5 маса/об'єм), після чого виготовляли комплекс, повільно додаючи λ-карагінан до отриманого розчину трамадолу HСl при перемішуванні суміші в посудині із широким горлом за допомогою мішалки. Потім отриманий комплекс змішували з попередньо приготовленою порошкоподібною сумішшю APAP/ГПМЦ із одержанням густої вологої пасти. Пасту пропускали через сито з розміром гнізд 1,0 мм і сушили при 45°C протягом ночі. Висушені гранули пропускали через сито з розміром гнізд 1,0 мм і змішували з полімерами, що утворюють матрицю, й іншими допоміжними речовинами, включаючи стеарат Mg. З отриманих гранул пресували таблетки масою приблизно 600 мг кожна за допомогою роторного таблеткового пресу, оснащеного овальним пуансоном 19,5 мм х 8,5 мм і набором матриць. Зусилля пресування становило приблизно 20 кН, а твердість і товщина одержуваних таблеток приблизно 7-10 кгс і 3,9 мм, відповідно. Усі таблетки зберігали в герметичних контейнерах при кімнатній температурі й використовували для подальшого дослідження. Для змішування й розтирання активних інгредієнтів і допоміжних речовин застосовували змішувач K5SS (виробництва компанії Kitchen Aid, США). Для грануляції й просівання сполук використовували гранулятор AR400 тип FGS (виробництва компанії Erweka, Німеччина). Для пресування таблеток, відповідно, використовували роторний таблетковий прес ZP198 (виробництва компанії Shanghai Tianhe Pharmaceutical Machinery Co., Ltd., Китай). Для проведення випробування на розчинення пресованих таблеток in vitro використовували систему контролю розчинення VK7000 (виробництва компанії VANKEL, Німеччина), а для кількісного аналізу використовували рідинний хроматограф LC-10A HPLC виробництва компанії SHIMADZU. Систему контролю розчинення можна використовувати при тестуванні як способом I по Фармакопеї США (USP I кошик, що обертається), так і способом II по Фармакопеї США (USP II, обладнання з лопатами). Опис способів випробування на розчинення по Фармакопеї США наводиться в розділі “Dissolution”, The United States Pharmacopeia, 30th ed., pp. 277-284, The United States Pharmacopeial Convention, м. Роквіл, штат Мериленд, 2007 р. У відповідній галузі відомо, що випробування на розчинення, такі як USP I і USP II, дають можливість правдоподібно спрогнозувати розчинення лікарських препаратів in vivo у шлунково-кишковому тракті людини. Завдяки успішному співставленню результатів in-vitro/in-vivo керівництво FDA включило випробування на розчинення методами USP як одне з необхідних випробувань для розробки пероральних лікарських форм. Див., наприклад, (1) Dressman, Jennifer B.; Amidon, Gordon L.; Reppas, Christos; Shah, Vinod P, реферат публікації “Dissolution testing as a prognostic tool for oral drug absorption: immediate release dosage forms”, Pharmaceutical Research (1998), 15(1), 11-22, Plenum Publishing Corp.; (2) Shah, Vinod P., реферат публікації “The role of dissolution testing in 10 UA 102706 C2 5 10 15 20 25 30 35 40 45 50 55 the regulation of pharmaceuticals: the FDA perspective”, Pharmaceutical Dissolution Testing (2005), 81-96, Taylor & Francis, Boca Raton, Florida; і(3) Uppoor, V. R. S., реферат публікації “Regulatory perspectives on in vitro (dissolution)/in vivo (bioavailability) correlations”, Керівництво клінічної фармакології й біофармацевтики, Керівництво США по контролю якості харчових продуктів і лікарських засобів (FDA), Центр оцінки й досліджень біопрепаратів, м. Роквіл, штат Мериленд, США, журнал Journal of Controlled Release (2001), 72(1-3), 127-132, Elsevier Science Ireland Ltd. Типовим карагінаном є λ-карагінан. λ-карагінани (VISCARIN® GP109, VISCARIN® GP209) були отримані від компанії FMC Biopolymers. ГПМЦ 2910 (METHOCEL® K4M,), ГПМЦ 2208(METHOCEL™ E5, METHOCEL™ E15) і поліетиленоксид (POLYOX® WSR N12K) були надані компанією COLORCON. Дослідження вивільнення in vitro лікарських препаратів із приготовлених матричних таблеток проводилися протягом 12 годин із застосуванням системи контролю розчинення VK7000 відповідно до методу USP II (на обладнанні з лопатами) в умовах 50-100 об./хв./900 мл при 370,5°C у різних середовищах розчинення (буферні розчини з показниками pН 1,2, pН 4,0, pН 6,8 і дистильована вода, приготовлені відповідно до Фармакопеї США). Як буферний розчин з показником pН 6,8 використовували відтворену інтестинальну рідину по Фармакопеї США без ферментів; як буферний розчин з показником pН 1,2 використовували відтворений шлунковий сік по Фармакопеї США без ферментів; як буферний розчин з показником pН 4,0 використовували розчин оцтової кислоти концентрацією 0,05 моль/л і розчин ацетату натрію концентрацією 0,05 моль/л, відрегульований до pН 4,0. Зразки середовищ розчинення (буферних розчинів з показниками pН 1,2, pН 4,0, pН 6,8 і дистильованої води) відбирали через рівні проміжки часу й фільтрували через мембрану 0,45 мкм, після чого в середовищі вивільнення вимірювали концентрацію трамадолу HСl і APAP методом ВЕРХ в описаних нижче умовах. Як колонку для аналізу методом ВЕРХ використовувався колонку Xterra RP8 (4,6×5,0 мм, 5 мкм, виробництва компанії Waters, США), а як рухому фазу використовувався розчин, що містить 0,5%-ний водний розчин NaСl/метанол (85/15). Швидкість потоку рухомої фази становила 1 мл/хв., а об'єм проби, що вводиться, - 10 мкл. Як детектор використовували УФ детектор SHIMADZU SPD-10A при встановленій довжині хвилі детектування 275 нм. Кількість лікарського препарату, присутнього в зразках, розраховували з використанням відповідних градуювальних графіків, побудованих на основі еталонних зразків. Кількість препарату, розчинену за певний період часу, наносили на графік у вигляді кривої залежності процентної частки вивільнення від часу. Дані про результати розчинення обробляли відповідно до наведеного нижче широко відомого показового рівняння (рівняння Корсмейєра в математичному моделюванні), яке використовується в даній галузі для опису характеру вивільнення лікарського препарату з полімерної системи. n Mt/M∞ = kt де Mt/M∞ - часткове вивільнення лікарського препарату в момент часу t; k - константа швидкості вивільнення, що включає макромолекулярні полімерні системи й лікарський препарат, а величина показника вивільнення “n” - показник дифузії, що вказує на механізм вивільнення лікарського препарату. Значення n для таблетки, якщо n=0,45, свідчить про класичне вивільнення за законами Фіка (випадок I, вивільнення, контрольоване дифузією), 0,450,97), що дозволяє оцінювати характер розчинення лікарських препаратів по моделі Корсмейєра, а значення “n” і k, як виявилося, варіюють залежно від типу й концентрації полімеру. Значення показника вивільнення “n”, визначене для різних матриць, перебувало в діапазоні від 0,43 до 0,88 для APAP і від 0,46 до 0,66 для трамадолу, що свідчить про спільну дію механізмів дифузії й ерозії. При використанні тільки ГПМЦ K4M як агента, що сповільнює вивільнення (у складі F № 1), твердість таблетки була відносно невисокою (менше 3 кгс), що утруднювало пресування. Однак введення до складу лактози або компонента AEROSIL 200 як наповнювачів дозволило досягти необхідних властивостей для таблетування (F № 2 і 3). 20 Таблиця 7A Дослідження in vitro параметрів вивільнення лікарського препарату й розчинення для APAP Показник дифузії (n) F№2 F№3 F№4 F№5 F№6 F№7 F № 7 (75 об./хв.) F № 7 (100 об./хв.) F№8 F№9 F № 10 F № 10 (pН 1,2) F № 10 (pН 4,0) F № 10 (дистил. вода) F № 11 F № 12 0,4301 0,6156 0,7933 0,8655 0,7739 0,7549 0,6146 0,6349 0,7501 0,8840 0,7075 0,7847 0,6884 Константа Середній Ефективність швидкості Коефіцієнт час розчинення (DE), вивільнення кореляції (R2) розчинення % (k) (MDT) год.) 0,2738 0,9744 4,57 57,57 0,1336 0,9912 5,05 39,41 0,1290 0,9946 5,25 51,85 0,0848 0,9990 5,84 39,34 0,1170 0,9967 5,19 46,29 0,1255 0,9962 5,40 47,92 0,1994 0,9874 4,82 59,28 0,2080 0,9861 4,33 64,41 0,1342 0,9966 5,28 49,96 0,0972 0,9972 5,31 46,21 0,1513 0,9968 5,14 52,57 0,1877 0,9907 3,29 69,04 0,1860 0,9890 4,43 63,62 0,7856 0,1755 0,9919 3,97 68,46 0,6014 0,6418 0,1994 0,1534 0,9880 0,9932 4,92 5,12 56,94 46,87 16 UA 102706 C2 Таблиця 7B Дослідження in vitro параметрів вивільнення лікарського препарату й розчинення для трамадолу HСl Показник дифузії (n) F№2 F№3 F№4 F№5 F№6 F№7 F № 7 (75 об./хв.) F № 7 (100 об./хв.) F№8 F№9 F № 10 F № 10 (pН 1,2) F № 10 (pН 4,0) F № 10 (дистил. вода) F № 11 F № 12 5 10 15 20 25 30 0,4662 0,5823 0,5986 0,6325 0,5694 0,6076 0,5070 0,5123 0,5814 0,6601 0,5677 0,6394 0,5822 0,6548 0,4969 0,5283 Константа Середній час Ефективність швидкості Коефіцієнт розчинення розчинення вивільнення кореляції (R2) (MDT) (год.) (DE), % (k) 0,2869 0,9993 3,59 61,86 0,2247 0,9983 4,33 60,04 0,2133 0,9966 4,18 59,65 0,1822 0,9909 4,90 54,59 0,2075 0,9977 4,33 54,91 0,2171 0,9995 4,28 60,87 0,2757 0,9974 3,43 64,18 0,2909 0,9952 3,21 68,24 0,2217 0,9965 4,16 59,63 0,1964 0,9957 4,22 60,47 0,2415 0,9984 3,99 63,09 0,2919 0,9949 2,50 77,70 0,2793 0,9944 3,39 74,35 0,2474 0,9816 3,31 74,38 0,2817 0,9986 3,58 64,51 0,2321 0,9994 4,03 56,30 При використанні тільки ГПМЦ K4M як агента, що сповільнює вивільнення (у складі F № 1), твердість таблетки була відносно невисокою, що утруднювало пресування. Однак введення до складу лактози або компонента AEROSIL 200 як наповнювачів дозволило досягти необхідних властивостей для таблетування (F № 2 і 3). Також тестувалося використання одного тільки ПЕО й використання комбінації ГПМЦ K4M і ПЕО як агента, що сповільнює вивільнення (F № 4 і 5). Розчинення проводилося при перемішуванні на швидкості 50 об./хв. у буферному розчині з показником pН 6,8 (відтворена інтестинальна рідина без ферментів). На ФІГ. 8 і ФІГ. 9 показаний графік процентної частки розчинення як функції часу для композицій F № 2-5. На ФІГ. 10 і ФІГ. 11 показані змодельовані криві вивільнення, допускаючи різний вміст шару ШВ, для (a) APAP і (b) трамадолу HСl з різних композицій матричної таблетки (F № 2-5) у процесі розчинення таблеток при перемішуванні на швидкості 50 об./хв. у буферному розчині з показником pН 6,8 (у порівнянні з ФІГ. 8 і ФІГ. 9, на яких представлені дані без допущення наявності в таблетки шару ШВ). Дані представлені як середнє значення середньоквадратичного відхилення ±SD (n=3). Ромбами представлені дані для композиції F № 2. Кружечками представлені дані для композиції F № 3. Трикутниками представлені дані для композиції F № 4. Квадратами представлені дані для композиції F № 5. Як показано в Прикладі 4 вище, можливо виготовити матеріал ШВ зі швидким вивільненням APAP для забезпечення певної кількості активного інгредієнта, що швидко вивільняється. Аналогічним чином, автори винаходу також приготували матеріали ШВ, що швидко вивільняють APAP і трамадол. Автори винаходу продемонстрували, що, якщо шар матеріалу ШВ використовується для виготовлення двошарової таблетки в комбінації із шаром матеріалу УВ, вивільнення APAP і трамадолу можна зробити приблизно рівним, припустивши, що час, необхідний для вивільнення APAP і трамадолу, нехтувано малий. Структури з ФІГ. 1B і 1C повинні аналогічним чином швидко вивільняти лікарські препарати із шару ШВ. На ФІГ. 10 і ФІГ. 11 показані змодельовані криві вивільнення, допускаючи, що таблетка має шар УВ, що містить композиції, представлені на ФІГ. 8 і ФІГ. 9, і шар УВ, з'єднаний з матеріалом УВ, або як зовнішній шар, або як один шар двошарової структури. Сумарний % вивільнення - це вивільнення, розраховане як процентна частка загальної кількості APAP (і трамадолу) у всій (наприклад, двошаровій) таблетці. На ФІГ. 10 і ФІГ. 11 показане, що сумарний % вивільнення APAP дуже близький до такого трамадолу з таблетки ШВ/УВ (наприклад, двошарової) для всіх представлених композицій. Отже, за рахунок комплексоутворення можливо досягти узгодженого уповільненого вивільнення APAP і трамадолу HСl. 17 UA 102706 C2 5 10 15 20 25 30 35 40 45 50 55 60 Результати також свідчать про те, що застосування комбінації ПЕО й ГПМЦ K4M (F № 5) як агента, що сповільнює вивільнення, показали мінімальний % ефективності вивільнення (DE) і максимальне значення середнього часу вивільнення (MDT) серед вищеописаних матриць, що говорить про більш високу здатність уповільнення вивільнення лікарських препаратів. Використання ПЕО Композиції F № 5 і F № 6 показали перевагу використання ГПМЦ K4M і ПЕО для одержання невисоких значень % DE і більших значень MDT. Композиція F № 6 містить ГПМЦ K4M і ПЕО в співвідношенні 1:1. На ФІГ. 12 показане порівняння кривих сумарного вивільнення APAP і трамадолу HСl. На ФІГ. 13 показані змодельовані криві вивільнення із двошарової таблетки із зовнішнім шаром ШВ і ядром УВ (композиція F № 6), розраховані на основі даних з ФІГ. 12. На Фіг. 12 і ФІГ. 13 ромбами представлені дані для APAP. Квадратами представлені дані для трамадолу. Вивільнення APAP і трамадолу HСl на ФІГ. 12 явно слідує моделі Корсмейєра 2 (коефіцієнт кореляції R =0,9967 і 0,9977, відповідно). Як видно з показника вивільнення (n=0,7739 і 0,5694 для APAP і трамадолу HСl, відповідно), механізм вивільнення, очевидно, являє собою аномальний транспорт (що не підкоряється законам Фіка). Дані показують практично постійну швидкість вивільнення, що підходить до уповільненого вивільнення. Лікарська форма з уповільненим вивільненням, що забезпечує можливість підтримки постійної швидкості вивільнення, ймовірно, відбиває сумарний ефект як дифузії лікарського препарату, так і ерозії полімеру. Оскільки й ерозія, і набухання відбуваються в матриці одночасно після її поміщення в середовище розчинення, це приводить до по суті постійного вивільнення. Постійне вивільнення в таких ситуаціях відбувається, оскільки збільшення довжини шляху молекули, що дифундує, обумовлене набуханням, компенсується безперервною ерозією матриці. Різні типи λ-карагінану На ФІГ. 14 показаний графік сумарної кількості вивільненого APAP, а на ФІГ. 15 показаний графік сумарної кількості вивільненого трамадолу HСl залежно від часу для композицій з уповільненим вивільненням F № 7 і F № 8, що містять різні типи λ-карагінану. Ромбами представлені дані для композиції F № 7. Квадратами представлені дані для композиції F № 8. Між матрицями, що містять різні типи λ-карагінану (VISCARIN® GP-109 і VISCARIN® GP-209), не спостерігалося істотних відмінностей у швидкості вивільнення лікарських препаратів, що свідчить про незначну різницю в їхній здатності до утворення комплексів із трамадолом HСl. На ФІГ. 16 і ФІГ. 17 показане сумарне вивільнення лікарських препаратів зі змодельованої двошарової таблетки, розраховане на основі даних з ФІГ. 15 і ФІГ. 15, відповідно. І в цьому випадку крива вивільнення для трамадолу HСl дуже близька до такої для APAP, що свідчить про те, що двошарова лікарська форма з ядром з уповільненим вивільненням, виготовлена відповідно до рецептур композицій F № 7 і F № 8, забезпечує узгоджене уповільнене вивільнення двох препаратів. Вплив ГПМЦ K4M Склад композицій F № 7, F № 9 і F № 10 розроблений як матеріал УВ із різними дозуваннями ГПМЦ K4M при фіксованому дозуванні ПЕО (30 мг) для вивчення впливу агента, що сповільнює вивільнення, на характеристики вивільнення лікарських препаратів. Усі композиції продемонстрували вивільнення протягом 10-12 год. На ФІГ. 18 показаний графік сумарної кількості вивільненого APAP, а на ФІГ. 19 показаний графік сумарної кількості вивільненого трамадолу HСl залежно від часу для композицій з уповільненим вивільненням F № 7, F № 9 і F № 10. На ФІГ. 20 і ФІГ. 21 показане сумарне вивільнення лікарського препарату зі змодельованої двошарової таблетки, розраховане на основі даних з ФІГ. 18 і ФІГ. 19, відповідно. Ромбами представлені дані для композиції F № 7. Квадратами представлені дані для композиції F № 9. Трикутниками представлені дані для композиції F № 10. Результати показують, що збільшення кількості ГПМЦ K4M веде до невеликого уповільнення вивільнення лікарського препарату. Знову, крива вивільнення для трамадолу HСl дуже близька до такої для APAP, що свідчить про те, що двошарова лікарська форма з ядром з уповільненим вивільненням, виготовлена відповідно до рецептур композицій F № 7, F № 9 і F № 10, забезпечує узгоджене уповільнене вивільнення даних двох препаратів. Вплив ПЕО Склад композицій F № 10, F № 11 і F № 12 розроблений як матеріал УВ із різними дозуваннями ПЕО при фіксованому дозуванні ГПМЦ К4М (20 мг) для вивчення впливу агента, що сповільнює вивільнення, на характеристики вивільнення лікарських препаратів. Усі композиції продемонстрували вивільнення протягом 10-12 год. На ФІГ. 22 показаний графік сумарної кількості вивільненого APAP, а на ФІГ. 23 показаний графік сумарної кількості вивільненого трамадолу HСl залежно від часу для композицій з уповільненим вивільненням F № 10, F № 11 і F № 12. На ФІГ. 24 і ФІГ. 25 показане сумарне вивільнення лікарського препарату 18 UA 102706 C2 5 10 15 20 25 30 35 40 45 50 55 60 зі змодельованої двошарової таблетки, розраховане на основі даних з ФІГ. 22 і ФІГ. 23, відповідно. Ромбами представлені дані для композиції F № 11. Квадратами представлені дані для композиції F № 10. Трикутниками представлені дані для композиції F № 12. Результати показують, що збільшення кількості ПЕО веде до невеликого уповільнення вивільнення лікарського препарату. Крива вивільнення для трамадолу HСl також дуже близька до такої для APAP, що свідчить про те, що двошарова лікарська форма з ядром з уповільненим вивільненням, виготовлена відповідно до рецептур композицій F № 10, F № 11 і F № 12, забезпечує узгоджене уповільнене вивільнення двох препаратів. Вплив показника pН Для вивчення впливу показника pН середовища розчинення на швидкість вивільнення лікарських препаратів з гідрофільних матриць досліджувалася швидкість розчинення в буферних розчинах з показниками pН 1,2, pН 4,0, pН 6,8 і в дистильованій воді для композиції F № 10 при перемішуванні на швидкості 50 об./хв. Отримані дані показані на ФІГ. 26 і 27 для APAP і трамадолу HСl, відповідно. Ромбами представлені дані для показника pН 1,2. Квадратами представлені дані для показника pН 4,0. Трикутниками представлені дані для показника pН 6,8. Кружечками представлені дані для дистильованої води (DW). Для композиції F № 10 швидкості вивільнення й APAP, і трамадолу HСl були вище при кислих показниках pН, що узгоджується з тим, що її значення MDT нижче, а % DE вище в кислому середовищі. Ці результати можна пояснити за рахунок ерозії поверхні матриці або розпаду матричної таблетки в кислих середовищах до утворення шару гелю навколо ядра таблетки, що веде до більш швидкого вивільнення лікарських препаратів. Криві вивільнення при pН 6,8 демонстрували більш повільне розчинення, ніж інші. Вивільнення протягом першої години було низьким для всіх зразків УВ, що свідчить про те, що такі композиції вивільняють тільки невелику частину лікарських препаратів, коли таблетка проходить через шлунок. На ФІГ. 28 і ФІГ. 29 показане сумарне вивільнення лікарських препаратів зі змодельованої двошарової таблетки в буферних розчинах з різними показниками pН і в дистильованій воді, розраховане на основі даних з ФІГ. 26 і ФІГ. 27, відповідно. Знову отримані результати підтверджують можливість створення лікарської форми з узгодженим вивільненням APAP і трамадолу. Вплив швидкості (об./хв.) перемішування Зразок матеріалу УВ, що застосовувався для виготовлення композиції F № 7, досліджували в ході випробувань на розчинення при перемішуванні зі швидкістю 50 об./хв., 75 об./хв. і 100 об./хв.. Отримані дані показані на ФІГ. 30 і 31 для APAP і трамадолу HСl, відповідно. Ромбами представлені дані для швидкості 50 об./хв.. Квадратами представлені дані для швидкості 75 об./хв. Трикутниками представлені дані для швидкості 100 об./хв. Загальна швидкість вивільнення лікарських препаратів з матриці значно вища при більш високій швидкості перемішування (об./хв.), що підтверджується меншим значенням MDT (4,33 год. для APAP і 3,21 год. для трамадолу HСl) і більш високим % DE (64,41% для APAP і 68,24% для трамадолу HСl) при 100 об./хв. для композиції F № 7 у порівнянні з показниками при 50 об./хв.: значення MDT 5,40 год. для APAP і 4,28 год. для трамадолу HСl і % DE 47,92% для APAP і 60,87% для трамадолу HСl. У цілому, при контакті з рідиною гідрофільний полімер утворює шар гідрогелю; розчинення лікарського препарату спостерігається за рахунок комбінації ефекту дифузії й ерозії, з переважним впливом дифузії лікарського препарату. Однак перемішування на високій швидкості веде до більш сильної ерозії матриці, ніж при простій гідратації полімеру, внаслідок чого полегшується процес дифузії й розчинення лікарського препарату. На ФІГ. 32 і ФІГ. 33 показане сумарне вивільнення лікарських препаратів зі змодельованої двошарової таблетки, розраховане на основі даних з ФІГ. 30 і ФІГ. 31, відповідно. Знову отримані результати підтверджують можливість створення лікарської форми з узгодженим вивільненням APAP і трамадолу. Уповільнена дія двошарової таблетки in vitro На підставі наведених вище результатів була виготовлена двошарова таблетка, що містить шар ШВ і шар спресованого комплексу трамадолу HСl і APAP, виготовлена відповідно до рецептури композиції F № 13 з Таблиці 8, шляхом застосування технології, описаної в Прикладі 9, для одержання шару УВ і нанесення на нього шару ШВ. Пресування здійснювали шляхом двошарового пресування для спресовування разом шару ШВ і шару УВ при одночасній подачі матеріалу ШВ і матеріалу УВ у машину для двошарового пресування. Для виробництва таблеток відомі й широко застосовуються багато різновидів пресів для пресування матеріалу з одержанням двошарових або багатошарових таблеток. Для виготовлення двошарових таблеток згідно з даним винаходом фахівці галузі можуть використовувати стандартний прес, наприклад, преси виробництва компанії Carver. Таблетки відповідно до рецептури композиції F № 13 виготовляли на експериментальній установці партією вагою 38 кг. У Таблиці 8 також наведена 19 UA 102706 C2 сполука шару ШВ, що знаходиться поруч із шаром матеріалу УВ. Як показано в Таблиці 8, основну таблетку, що складається із шарів ШВ і УВ, у деяких випадках покривали оболонкою. Таблиця 8 Інгредієнти (мг) Шар ШВ APAP Трамадол HСl Порошкова целюлоза Попередньо клейстеризований крохмаль Карбоксиметилкрохмаль натрію Кукурудзяний крохмаль Стеарат Mg Сумарна маса шару ШВ Шар УВ APAP Трамадол HСl λ-карагінан (GP-109) ГПМЦ E15 POPYOX WSR N12K ГПМЦ K4M Стеарат Mg Сумарна маса шару УВ Зовнішня оболонка OPADRY Карнаубський віск Сумарна маса зовнішньої оболонки Загальна маса таблетки 5 10 F № 13 260 17 20,30 5,05 5,05 20,30 1,65 329,35 390 58 72,5 10 30 30 5,96 596,46 25 0,04 25,04 950,85 У Таблиці 9 представлені фактичні технологічні дані для виготовлення на експериментальній установці трьох дослідних партій таблеток формули F № 13, що відповідали критеріям приймального контролю, що й представляли собою міцну продукцію гарної якості. У процесі змішування інших інгредієнтів для виготовлення відповідних шарів додавалася вода й (або) етанол, як зазначено в таблиці. Потім змішані матеріали пресували для одержання відповідних шарів. Воду й етанол видаляли в процесі сушіння таблеток. Дані таблетки також відповідали характеристикам таблеток, що використовувалися в лабораторних дослідженнях і на етапі розробки рецептур композицій. Таблиця 9 Фактична кількість у трьох виробничих серіях Інгредієнт APAP Трамадол HСl Целюлоза в порошку Карбоксиметилкрохмаль натрію Попередньо клейстеризований кукурудзяний крохмаль Кукурудзяний крохмаль Стеарат Mg Очищена вода* Маса ШВ Фактичний об'єм партії Сполука одиниці Об'єм партії Партія Партія Партія (мг/ таблетка) № 001 № 002 № 003 Шар зі швидким вивільненням 260,0 31 кг 200 г 31 кг 200 г 31 кг 200 г 31 кг 200 г 17,0 2 кг 040 г 2 кг 040,1 г 2 кг 040,1 г 2 кг 040,1 г 20,3 2 кг 436 г 2 кг 436 г 2 кг 436 г 2 кг 436 г 5,05 606 г 606,03 г 606,02 г 606,02 г 5,05 606 г 606,04 г 606,05 г 606 г 20,3 1,65 2 кг 436 г 198 г 30 кг 754 г 2 кг 436 г 2 кг 436,1 г 2 кг 436,1 г 198,04 г 198,03 г 198,01 г 30 кг 754 г 30 кг 754 г 30 кг 754 г 329,4 мг/таблетка 39,5 кг/партія * У процесі сушіння воду видаляють, і вона не присутня в кінцевому продукті. 20 UA 102706 C2 Інгредієнт APAP Трамадол HСl Гіпромелоза 2910, 15 мПас (ГПМЦ E15) Лямбдакарагінан (VISCARIN 109) Гіпромелоза 2208, 2903 мПас (ГПМЦ K4M) Поліетиленоксид (POLYOX WSR N12K) Стеарат Mg Очищена вода* Дегідратований етанол** Фактичний об'єм партії Сполука одиниці Об'єм партії (мг/таблетка) Партія № 001 Партія № 002 Партія № 003 Шар з уповільненим вивільненням 390,0 46 кг 800 г 46 кг 800 г 46 кг 800 г 46 кг 800 г 58,0 6 кг 960 г 6 кг 960 г 6 кг 960 г 6 кг 960 г 10,0 1 кг 200 г 1 кг 200,14 г 1 кг 200,1 г 1 кг 200,10 г 72,5 8 кг 700 г 8 кг 700 г 8 кг 700,1 г 8 кг 700,2 г 30,0 3 кг 600 г 3 кг 600 г 3 кг 600 г 3 кг 600 г 30,0 3 кг 600 г 3 кг 600,1 г 3 кг 600,1 г 3 кг 600,1 г 5,96 715,2 г 2 кг 880 г 715,2 г 2 кг 880 г 715,2 г 2 кг 880 г 715,2 г 2 кг 880 г 4 кг 320 г 4 кг 320 г 4 кг 320 г 4 кг 320,3 г Маса УВ 596,5 мг/таблетка 71,6 кг/партія; УВ+ШВ=111,1 кг/партія * Воду видаляють у процесі грануляції, і вона не присутня в кінцевому продукті. ** Етанол видаляють у процесі грануляції, і він не присутній у кінцевому продукті. Інгредієнт Зовнішня оболонка OPADRY жовтий YS-1-6370-G *** Карнаубський віск Очищена вода**** Сполука одиниці (мг/ таблетка) Фактичний об'єм партії Об'єм партії 25,0 Партія № 001 Партія № 002 Партія № 003 3 кг 600 г 3 кг 600 г 3 кг 600 г 3 кг 600 г 0,041 4,92 г 4,92 г 4,92 г 4,92 г 25 кг 168 г 25 кг 168 г 25 кг 168 г 25 кг 168 г *** Значення було скоректоване з урахуванням втрат у процесі нанесення оболонки. Фактична кількість, необхідна для виготовлення даної партії, включає додаткову кількість 20% (3 кг → 3,6 кг). **** Воду видаляють у процесі нанесення оболонки, і вона не присутня в кінцевому продукті. 5 10 15 Для виготовлення шару ШВ застосовували технологію грануляції в псевдозрідженому шарі, а для виготовлення шару УВ застосовували технологію грануляції у високошвидкісному змішувачі, сушіння, просівання й змішування з наступним пресуванням. Наприкінці пресовані таблетки покривали плівковою оболонкою. У процесі виробництва використовували наступне основне обладнання: грануляція: високошвидкісний змішувач-гранулятор, гранулятор із псевдозрідженим шаром; сушіння: гранулятор із псевдозрідженим шаром; подрібнення: вібраційне сито; змішування: V-подібний змішувач; таблеткова машина: двошаровий таблетковий прес TMI; покриття оболонкою: машина для нанесення покриття Hi-coater. На ФІГ. 35 показана технологічна схема процесу виробництва таблеток. У процесі виготовлення гранул ШВ спочатку готують розчин зв’язувальної речовини. У гранулятор із псевдозрідженим шаром вводять речовини для виготовлення гранул ШВ (APAP, трамадол HСl, целюлоза в порошку, попередньо клейстеризований крохмаль, карбоксиметилкрохмаль натрію) і змішують. Потім матеріал ШВ формують у гранули за допомогою гранулятора із псевдозрідженим шаром шляхом розпилення необхідної кількості розчину зв’язувальної речовини на матеріал. Потім гранули сушать і пропускають разом зі 21 UA 102706 C2 5 10 15 20 25 30 35 40 стеаратом магнію через розмельно-просіювальну машину для досягнення необхідного розміру частинок. Одержувані гранули ШВ змішують в V-подібному змішувачі. У процесі виготовлення гранул УВ трамадол HСl розчиняють в 60%-ному розчині етанолу з додаванням лямбдакарагінану для утворення комплексу. APAP і ГПМЦ E15 змішують у грануляторі Supermixer. Пасту, що містить комплекс трамадолу і попередньо приготовлену суміш APAP/ГПМЦ E15 гранулюють у високошвидкісному змішувачі-грануляторі. Вологі гранули пропускають через просіювальну машину для досягнення необхідного розміру частинок. Гранули сушать у сушарці із псевдозрідженим шаром. Висушені гранули разом з іншими добавками (ГПМЦ K4M, POLYOX) і стеаратом магнію пропускають через просіювальну машину, а потім змішують для одержання суміші УВ. Суміш ШВ і суміш УВ пресують у таблетки масою приблизно 925,8 мг за допомогою відповідного двошарового таблеткового пресу (наприклад, двошарового пресу TMI або аналогічного обладнання) і прес-інструмента для штампування таблеток з тисненим логотипом (49 наборів: верхній і нижній пуансон і матриця). Було виготовлено три серії (партії) таблеток. Розміри пуансонів, що застосовувалися в прес-інструменті для виготовлення таблеток, наступні: довжина: 19,05 мм; ширина: 7,62 мм; радіус закруглення: 5,5 мм. Рідину для нанесення покриття готували шляхом змішування відповідної кількості жовтого барвника OPADRY жовтий YS-1-6370-G з очищеною водою. Таблетки (ядра таблеток) завантажували в дражувальний котел. У дражувальному котлі ядра таблеток нагрівали й покривали оболонкою з рідини для нанесення покриття за допомогою відповідної машини для нанесення покриття (наприклад, Hicoater або аналогічного обладнання). Після завершення розпилення обертання котла продовжували для забезпечення сушіння таблеток. Під час обертання шар таблеток покривали карнаубським воском. Рідина для нанесення покриття може являти собою розчин, у якому усі інгредієнти повністю розчинені в розчиннику, або вона може містити деякі інгредієнти у вигляді твердих частинок, диспергованих у рідині. Рідини для нанесення покриття добре відомі у відповідній галузі, і фахівці галузі знають, які альтернативи можна використовувати, опираючись на описані приклади, наведені в даній публікації. Нижче перераховане основне обладнання, що застосовувалося в процесі виготовлення таблеток: 1. Грануляція: Високошвидкісний змішувач-гранулятор (Supermixer: 30 кг) Гранулятор із псевдозрідженим шаром (Glatt WSG 30:30 кг) 2. Сушіння: Гранулятор із псевдозрідженим шаром (Glatt WSG 30:30 кг) 3. Подрібнення: вібраційне сито 4. Готування сухої суміші: V-подібний змішувач (100 л) 5. Таблеткова машина: прес TMI 6. Покриття оболонкою: Дражувальний котел (30 кг) У Таблиці 10 наведені технологічні параметри зазначеного вище обладнання, що застосовувалися в процесі виробництва таблеток партії № 001, 002 і 003. У процесі сушіння таблетки висушували до заданого значення процентного вмісту вологи після сушіння (Mafd), що дорівнює від 1% ваг. до 3% ваг. Фахівцям галузі відомі способи застосування перерахованого вище обладнання для виготовлення таблеток в умовах, відповідних до параметрів, зазначених у Таблиці 10. У Таблиці 10 значення заданих параметрів застосовували до кожної партії, і фактичні значення можуть незначно варіюватися (як видно з таблиці). 22 UA 102706 C2 Таблиця 10 Технологічні параметри обладнання Технологічні параметри Фактичні Одиниці Обробка вимірюваЗадані Партія Партія ння №001 №002 Швидкість Попереднє обертання змішуванлопатевого 472 об./хв. 472 об./хв. 472 об./хв. ня колеса Тривалість 5 хв. 5 хв. 5 хв. Швидкість обертання 472 об./хв. 472 об./хв. лопатевого 472 об./хв. Висококолеса швидкісний Super-mixer Час змішувач35 сек. 35 сек. перемішу35 сек. гранулятор вання Грануляція Кінцеве 13,7 А 13,7 А значення 13,7 А (ампер) Не Не Додаткова Не застосозастосозастосокількість вується вується вується розчину мл мл мл етанолу Повітря-ний 1500-2000 потік на вході (куб. футів на хвилину) 55-65С 60С 60С Темп. на (60С) вході Сушіння Glatt WSG 30 Темп. на 40-50С 47С 47С виході Інтервал 1 хв. вібрації Тривалість 10 сек. вібрації Закінчення MafD: 1,90% 1,95% сушіння 50 хв. 51 хв. 1,03,0% Швидкість Розмір Середній Середній Середній Подрібнення Fitz-mill стільника 1,5 мм 1,5 мм 1,5 мм сита Час Тривалі-сть ТриваліТриваліперемішу– 15 хв. сть – 15 хв. сть – 15 хв. V-подібний вання Кінцева суміш змішувач Швидкість переміш14 об./хв. 14 об./хв. 14 об./хв. ування Швидкість 32 об./хв. 32 об./хв. 32 об./хв. роботи машини 49 гн. 49 гн. Прес ТМІ №1 К-сть гнізд 49 гн. Пресування те саме те саме або 2 Розміри 19,05/7,62 пуансона мм те саме те саме Маса 925,81мг5% таблетки Основне обладнання 23 Партія №003 472 об./хв. 5 хв. 472 об./хв. 35 сек. 13,7 А Не застосовується мл 60С 47С 1,99% 50 хв. Середній 1,5 мм Тривалість – 15 хв. 14 об./хв. 32 об./хв. 49 гн. те саме те саме UA 102706 C2 Продовження таблиці 10 Нанесення плівкового покриття Попереднє Дражуванагрівання льний котел Покриття 5 70-80С Темп. на вході (75С) Темп. на 40-50С виході (45С) Тривалість 20-30 хв. Швидкість 4-6 об./хв. обертання Темп. на 70-80С вході (75С) Темп. на виході 40-50С К-сть (45С) розпилю2 шт. вачів Діаметр форсунки 1,0 мм Відстань Витрата матеріалу, 15-20 см що 160-200 г/хв. розпилюється Тиск 400 кПа розпилен(4 бар) ня 80-130 хв. Тривалість 80С 80С 80С 50С 20 хв. 50С 20 хв. 50С 20 хв. 5 об./хв. 5 об./хв. 5 об./хв. 80С 80С 80С 50С 50С 50С 180 г/хв. 180 г/хв. 180 г/хв. 400 кПа (4 бар) 141 хв. 400 кПа (4 бар) 146 хв. 400 кПа (4 бар) 148 хв. У Таблиці 11 показана гранулометрична сполука в меш. для гранул зі швидким вивільненням (ШВ) таблеток, що використовувалися для виготовлення, уповільненого дії (партії № 001, 002 і 003). Таблиця 11 Гранулометрична сполука (в % ваг.) частинок ШВ Меш Розподіл частинок по розмірах (% ваг.) 10 15 20 Партія № 001 Партія № 002 Партія № 003 18 2,21 0,42 0,18 20 35 60 100 140 200 підситовий залишок 0,97 12,57 47,07 15,97 7,43 9,91 3,86 0,41 4,57 45,85 23,57 2,54 12,25 10,41 0,60 6,36 30,43 24,38 12,83 9,85 15,38 Маса готових таблеток становила приблизно 951 мг на таблетку. Загальна маса виготовлених таблеток становила приблизно 114 кг на партію. В описаній вище таблетці, що складається з композиції F № 13, шар ШВ має товщину приблизно 3,14 мм, шар УВ має товщину приблизно 3,82 мм, а загальна товщина таблетки становить 6,96 мм. При зазначених вище умовах середнє значення твердості таблетки без оболонки рівно 8,51 кгс, а стиранність становить менше 1% (0,23%). На ФІГ. 34 показані криві розчинення для композиції F № 13 (таблетки, покриті оболонкою). Ромбами представлені дані для APAP. Квадратами представлені дані для трамадолу. Значення відносного середньоквадратичного відхилення (коефіцієнт варіації) становило менше 7% для всіх вимірюваних точок (n=6). Починаючи з першої години й до дванадцятої години включно сумарне вивільнення (у % ваг.) APAP було дуже близьким (різниця менше 10%) до такого трамадолу. Починаючи із другої години й до восьмої години включно різниця становила менше 5%. Даний результат свідчить про те, що була виготовлена багатошарова лікарська форма, здатна 24 UA 102706 C2 5 10 15 20 25 30 35 40 забезпечувати узгоджене вивільнення APAP і трамадолу. У даному варіанті здійснення значення швидкості вивільнення трамадолу й APAP були дуже близькими. Співвідношення значень T60, T70, T80, T90 для APAP відносно трамадолу становлять менше 2, фактично - менше 1,5 і в основному наближаються до 1. З результатів випробувань на визначення швидкості вивільнення ясно, що у двошаровій таблетці шар ШВ розпадається зі швидким вивільненням лікарських препаратів (у лічені хвилини, наприклад, за 15 хвилин). Тривалість вивільнення лікарських препаратів із шару ШВ украй мала в порівнянні з вивільненням із шару УВ, яке триває 8 годин і більше. Отже, є підстави припускати, що швидкість вивільнення лікарських препаратів із шару УВ у складі двошарової таблетки буде близька до швидкості вивільнення із шару УВ у ході випробувань на розчинення in vitro, у яких тестувався тільки шар УВ. Оскільки шар УВ у композиції F № 13 практично ідентичний аналогічному шару в композиції F № 7, показник вивільнення n буде дорівнювати приблизно 0,75 для APAP і 0,6 для трамадолу в УВ. Було з'ясовано, що зв'язування трамадолу в комплекс із аніонним полімером, переважно карагінаном, для одержання шару з уповільненим вивільненням у таблетці забезпечує контрольоване вивільнення, що не підкоряється законам Фіка й (або) відповідає випадку II (обумовлене ерозією), що уможливлює вивільнення, узгоджене з APAP. Для порівняння характеристик різних таблеток переважно проводиться визначення значень середнього часу розчинення (MDT), T80 і показника вивільнення n у рівнянні Корсмейєра в ході випробувань in vitro з використанням апарату USP II (лопатевого) відповідно до описаної нижче методики. Лопата знаходиться в позиції 25 мм від внутрішньої стінки дна ємності. Як середовище розчинення використовується розчин фосфатного буфера з показником pН 6,8, приготовлений згідно з Фармакопеєю США (відтворена інтестинальна рідина без ферментів), умови розчинення - 50 об./хв./900 мл при 37±0,5°C. Зразки середовища розчинення відбирають через рівні проміжки часу й фільтрують крізь мембранний фільтр 0,45 мкм, після чого вимірюють концентрації трамадолу HСl і APAP у середовищі вивільнення методом ВЕРХ із використанням як рухомої фази водного буферного розчину/розчину метанолу. Рухому фазу (буфер з показником pН 2,7:метанол = 73:27) пропускають через 0, 45 нмікронний фільтр виробництва компанії Millipore (модель HAWP 04700) або аналогічний фільтр і дегазують шляхом барботування гелієм. Готують еталонний зразок середовища розчинення (100%) 37,5/325 мг. Для цього навіску ацетамінофену масою точно 36,11 мг (чистої речовини) (±1%) поміщають у мірну колбу об'ємом 50 мл, додають 10,0 мл матричного розчину трамадолу гідрохлориду, розчиняють і доводять до мітки фосфатним буфером з показником pН 6,8. Для приготування матричного розчину трамадолу навіску трамадолу гідрохлориду масою точно 41,66 мг (чистої речовини) (±1%) поміщають у мірну колбу об'ємом 100 мл, розчиняють і доводять до мітки фосфатним буфером з показником pН 6,8. Для аналізу методом ВЕРХ використовували колонку SUPELCO LC-8-DB 150 x 4,6 мм; 5 мкм. Об'єм проби, що вводиться, становив 10 мкл, а швидкість потоку - 2,5 мл/хв. при часі хроматографування 16 хвилин; час утримування для APAP: приблизно 1,2 хв.; час утримання для трамадолу гідрохлориду: приблизно 4,0 хв. Використовуваний детектор: програмувальний УФ детектор Waters 490 (APAP 280 нм - 1,0 AUFS (оптичних одиниць на всю шкалу); трамадолу гідрохлорид 215 нм - 0,5 AUFS). Температура колонки становила приблизно 35°С. Метод USP II є стандартизованим. Фахівці галузі можуть знайти опис методу USP II у Фармакопеї США. Розрахунок процентної частки заявленої кількості (La, нормоване) лікарського препарату в зразку виконується по формулі 45 % розчиненого 50 55 A sam Cstd 100 A std Ct100 де Asam = площа піка трамадолу гідрохлориду або ацетамінофену для випробуваного зразка, Astd = площа піка трамадолу гідрохлориду або ацетамінофену для стандарту, Cstd = концентрація стандарту в мг/мл, Ct100 = теоретична 100%-на концентрація в мг/мл, La = заявлена кількість трамадолу гідрохлориду або APAP. Що стосується шару УВ, у даному винаході автори змогли одержати показник вивільнення n у рівнянні Корсмейєра для трамадолу на рівні приблизно вище 0,45, навіть вище 0,7 і навіть вище 0,85. Показник вивільнення n для APAP переважно становить приблизно від 0,46 до 1, більш переважно приблизно від 0,6 до 0,9, більш переважно приблизно від 0,6 до 0,8. Показник вивільнення n для трамадолу переважно становить приблизно від 0,46 до 0,7, більш переважно приблизно від 0,5 до 0,7, більш переважно від приблизно 0,5 до 0,65. 25 UA 102706 C2 5 Автори винаходу також змогли досягти у двошаровій таблетці значень співвідношення T 80 для APAP відносно трамадолу, що прагнуть до 1. Переважно, співвідношення T 80 становить приблизно менше 2, переважно приблизно менше 1,5 а більш переважно приблизно від 1,5 до 1. Більш переважно, щоб значення співвідношення T 80 перебувало в межах від 0,9 до 1,1. Також переважно, щоб значення T80 становило від 8 до 12 годин, більш переважно приблизно від 10 до 12 годин. У Таблиці 12 показані значення T80, отримані для композиції F № 13. Таблиця 12 Значення T80 для таблеток на основі композиції F № 13 Тривалість 1 2 T80 1,096 1,009 10 15 20 25 3 1,007 4 5 6 7 8 9 10 11 12 0,997 0,995 0,998 1,002 1,010 1,021 1,032 1,042 1,047 Уповільнена дія двошарової таблетки in vivo Таблетки уповільненої дії (виготовлені відповідно до дослідної рецептури, наведеної в Таблиці 9) порівнювали із широко відомою фірмовою лікарською формою на основі комбінації трамадол/APAP (ULTRACET) у ході дослідження за участю здорових чоловіків-добровольців, що проводився в Кореї для визначення відносної біодоступності й інших фармакокінетичних характеристик. Таблетка ULTRACET містить 37,5 мг трамадолу гідрохлориду й 325 мг APAP. Таблетки ULTRACET випускаються в продаж. Як неактивні інгредієнти таблетка містить целюлозу в порошку, попередньо клейстеризований кукурудзяний крохмаль, карбоксиметилкрохмаль натрію, крохмаль, очищену воду, стеарат магнію, світло-жовтий барвник OPADRY® світло-жовтий і карнаубський віск. Опис і інструкції із застосування таблеток ULTRACET наводяться в інструкції до даного препарату, у якій представлений загальний опис даного препарату й показання до його застосування, наприклад, у Заявці на схвалення нового лікарського засобу Керівництва США по контролю над харчовими продуктами й лікарськими препаратами № 021123 (інструкція із застосування затверджена 16 квітня 2004 р., ©OMP 2003), у повному об'ємі включеній в дану публікацію за допомогою посилання. Рандомізоване перехресне дослідження з багаторазовим прийомом, двома схемами лікування, двома періодами й двома послідовностями прийому препаратів проводилося в Кореї за участю здорових чоловіків-добровольців, що отримували досліджувані препарати натще, з перервою в 4 дні між періодами дослідження для виведення препарату з організму, як показано в Таблиці 13 нижче. Таблиця 13 Послідовність прийому препаратів Послідовність 1 (AB) Послідовність 2 (BA) N (к-сть учасників) Перший період (4 дня) Другий період (4 дня) 6 6 ULTRACET (A) Таблетка УВ (B) Таблетка УВ (B) ULTRACET (A) 30 35 40 45 Після відбірного дослідження на початку послідовності прийому лікарського препарату кожний учасник одержував вибраний лікарський препарат у відповідності зі схемою першого 4денного періоду, за яким ішла перерва в 4 дні без прийому лікарського препарату, а потім 4 дні прийому лікарського препарату у відповідності зі схемою другого періоду. Учасників спостерігали протягом 4 днів після закінчення прийому лікарських препаратів для реєстрації результатів аналізів проб крові. Протягом послідовностей прийому лікарських препаратів учасники приймали усередину таблетки, що випускаються на продаж, ULTRACET (позначені символом A у Таблиці 13) і таблетки УВ (позначені символом B у Таблиці 13) 14 разів із інтервалом в 6 год. і 7 разів із інтервалом в 12 год., відповідно, згідно зі схемою, наведеною в Таблиці 13. Проби крові відбирали відповідно до заздалегідь визначеного графіка після прийому чергової дози препарату. Дані з Таблиці 13 використовували для визначення біодоступності лікарських препаратів, що входять до складу таблеток. У контексті даної публікації термін “біодоступність” означає швидкість і ступінь, з якого й до якого активний інгредієнт або активна складова препарату всмоктується з лікарської форми й досягає місця прикладення дії. Ці швидкість і ступінь визначаються на підставі фармакокінетичних параметрів, таких як пік концентрації лікарського препарату в крові або в плазмі (Cмакс.) і площа під кривою залежності концентрації лікарського препарату в крові або в плазмі від часу (AUC). 26 UA 102706 C2 5 10 15 20 25 30 У фармакокінетиці термін “AUC” означає площу під кривою, отриманою для пацієнта шляхом побудови графіка залежності концентрації лікувального препарату в сироватці від часу, вимірюваної з моменту початку прийому препарату й до моменту часу “t” після початку прийому. У випадку стабільного режиму прийому лікарського препарату Aucss - це площа під кривою для періоду прийому при періодичному прийомі доз препарату до нескінченного часу. Значення параметра AUC одержують шляхом аналізу проб сироватки крові пацієнта. У контексті даної публікації термін “Cмакс.” позначає пік концентрації лікарського препарату в крові або плазмі. Час “tмакс.” позначає час досягнення піка концентрації лікарського препарату в крові або плазмі. Термін “t1/2” являє собою період напіввиведення й позначає час, необхідне для зниження концентрації лікарського препарату в плазмі наполовину. Концентрації комбінації APAP/трамадол у плазмі визначалися за допомогою валідованого методу рідинної хроматографії з тандемною мас-спектрометрією. Для кожного учасника будували криву залежності “концентрація - час”, на підставі якої визначали первинні параметри (Cмакс., Tмакс., AUC0-12год.) у перший день після прийому дози препарату й вторинні параметри (Cмакс.(ss), Tмакс.(ss), AUC0-12год.,ss і t1/2) у стабільному стані шляхом фармакокінетичного аналізу без компартменталізації з використанням програмного забезпечення WINNONLIN® 5.2.1 (виробництва компанії Pharsight Co, штат Каліфорнія, США). Наприклад, біоеквівалентність визначалася на підставі нормативних вимог, встановлених Керівництвом Кореї й США по контролю якості харчових продуктів і лікарських засобів (припустимий діапазон біоеквівалентності, 0,80-1,25). Для досягнення біоеквівалентності таблетками, що випускаються в продаж, ULTRACET 90% довірчий інтервал (ДІ) співвідношення середнього значення Cмакс. у стабільному стані для нової таблетки УВ і такого для таблетки ULTRACET з такою ж концентрацією активних інгредієнтів повинен знаходитися в діапазоні від 80% до 125% (тобто бути дорівнювати від 0,8 до 1,25) при a=0,05; а 90% довірчий інтервал (ДІ) співвідношення середнього значення Aucss для нової таблетки УВ і такого для таблетки, що випускається на продаж, ULTRACET повинен знаходитися в межах від 80% до 125%. У дослідженні брало участь 12 добровольців. Середній вік учасників становив 24,4±5,2 роки, а середня маса тіла 65,1±6,0 кг. У Таблиці 14 і Таблиці 15 нижче представлені середні значення (із середньоквадратичним відхиленням) фармакокінетичних параметрів трамадолу після прийому таблеток, що випускаються на продаж, ULTRACET і таблеток УВ згідно з даним винаходом. Таблиця 14 Фармакокінетичні параметри трамадолу Параметри Tмакс. (год.) Cмакс.(мкг/л) AUC0-12 год (мкг*год./л) Tмакс.,ss (год.) Cмакс.,ss (мкг/л) AUC0-12 год,ss (мкг*год./л) t1/2 (год.) 1) ULTRACET (N=12) СередньоСереднє квадра- Коефіцієнт значення тичне варіації (%) відхилен ня 1) 1,0 [1,0-3,5] 206,13 29,06 14,1 1380,1 207,6 1,0 [0,5-2,0] 15,0 УВ (N=12) СередньоСереднє квадратичне значення відхилення 179,30 4,0 [2,0-6,0] 28,88 1501,0 Коефіцієнт варіації (%) 1) 307,9 1) 3,0 [1,0-4,0] 16,1 20,5 1) 351,81 55,86 15,9 305,64 53,21 17,4 2789,0 507,7 18,2 2638,7 469,1 17,8 7,08 1,94 27,4 7,01 0,96 13,7 медіана [мінімум - максимум] 27 UA 102706 C2 Таблиця 15 Порівняння показників Cмакс.,ss, AUC0-12 год., ss для трамадолу Параметри УВ (N=12) ULTRACET (N=12) 1) Cмакс.,ss (мкг/л) AUC0-12 год,ss (мкг*ч/л) Різниця середніх геометричних значень (ДІ 90%) 351,81 ± 55,86 2) 5,85 ± 0,15 1) 2789,0 ± 507,7 2) 7,92 ± 0,18 1) 305,64 ± 53,21 2) 5,71 ± 0,18 1) 2638,7 ± 469,1 2) 7,86 ± 0,17 -0,144 (-0,227 - -0,061) -0,054 (-0,094 - -0,014) Співвідношення середніх геометричних 3) значень (ДІ 90%) 0,87 (0,80-0,94) 0,95 (0,91-0,99) 1) Середнє арифметичне ± середньоквадратичне відхилення Логарифмічно перетворене середнє геометричне ± середньоквадратичне відхилення 3) Співвідношення середнього геометричного УВ і ULTRACET. Арифметичні значення одержували на підставі фактичних даних для учасників. Проте, біоеквівалентність визначається по різниці середнього геометричного в довірчому інтервалі 90%, отже, із середніх арифметичних одержували середні геометричні значення. 2) 5 10 На ФІГ. 36 показані відрізки кривих залежності середньої концентрації в плазмі від часу для трамадолу після декількох пероральних прийомів таблеток ULTRACET і таблеток УВ згідно з даним винаходом. Рисками на графіку показані середньоквадратичні відхилення. Крива із зафарбованими кружечками представляє дані для УВ, демонструючи піки приблизно кожні 12 годин. Крива з незафарбованими кружечками представляє дані для ULTRACET, демонструючи піки приблизно кожні 6 годин. У Таблиці 16 і Таблиці 17 нижче представлені середні значення (із середньоквадратичним відхиленням) фармакокінетичних параметрів APAP після прийому таблеток, що випускаються на продаж, ULTRACET і таблеток УВ згідно з даним винаходом. Таблиця 16 Фармакокінетичні параметри APAP УВ (N=12) ULTRACET (N=12) Параметри Середнє Середнє Середньоквадра- Коефіцієнт Середньоквадра- Коефіцієнт значензначення тичне відхилення варіації (%) тичне відхилення варіації (%) ня 1) 1) Tmax (год.) 0,5 [0,5-1,5] 0,5 [0,5-2,0] Cмакс.(мкг/л) 7388,1 2022,7 27,4 6574,8 1100,4 16,7 AUC0-12год 33780,6 6262,5 18,5 35294,3 7222,9 20,5 (мкг*год./л) 1) 1) Tмакс.,ss (год.) 0,5 [0,5-1,5] 0,5 [0,5-2,0] Cмакс.,ss 8180,8 2025,1 24,8 6853,9 1290,0 18,8 (мкг/л) AUC0-12 год,ss 42635,0 8711,2 20,4 40394,3 10127,7 25,1 (мкг*год./л) t1/2 (год.) 5,21 1,01 19,4 6,67 2,37 35,5 1) медіана [мінімум - максимум] 28
ДивитисяДодаткова інформація
Назва патенту англійськоюExtended release oral administered dosage form of acetaminophen and tramadol
Автори англійськоюDai, Wei-guo, Dong, Liang-chang, Choi, Tae-hong, Hwang, Sung Joo, Kim, Jae, Hyun, Lee, Dong, Ho
Назва патенту російськоюЛекарственная форма ацетаминофена и комплекса трамадола с замедленным действием для перорального приема
Автори російськоюДай Вей-го, Дун Лян-чан, Чой Тае-хонг, Хванг Сунг Дзоо, Ким Дзае Хиун, Ли Донг Хо
МПК / Мітки
МПК: A61P 25/00, A61K 9/48, A61K 9/20, A61K 31/135, A61K 31/167
Мітки: лікарська, ацетамінофену, дією, прийому, комплексу, форма, перорального, трамадолу, уповільненою
Код посилання
<a href="https://ua.patents.su/47-102706-likarska-forma-acetaminofenu-ta-kompleksu-tramadolu-z-upovilnenoyu-diehyu-dlya-peroralnogo-prijjomu.html" target="_blank" rel="follow" title="База патентів України">Лікарська форма ацетамінофену та комплексу трамадолу з уповільненою дією для перорального прийому</a>
Попередній патент: Плівкотвірний розчин на основі сечовини для лікування нігтьового псоріазу
Наступний патент: Кулеструминний пристрій для буріння свердловин
Випадковий патент: Спосіб зовнішнього утеплення стінового огородження