Комбінація фітоканабіноїдів та темозоламіду для лікування гліоми
Номер патенту: 109271
Опубліковано: 10.08.2015
Автори: Росс Рут Алєксандра, Пароларо Даньєла, де Петрочелліс Лучано, Гай Джеффрі, Массі Паола, Райт Стефен, Форд Леслі Енн, Саттон Алан, Торрес Софія, Лоренте Мар, Анаві-Коффер Шерон, Іццо Анджело Антоніо, Стотт Колін, Гусман Мануель, ді Марцо Вінченцо, Поттер Девід, Веласко Гільєрмо, де Мейєр Етьєнн, Кікуті Тецуро, Авьєлло Габріелла, Лігресті Алєссіа, Бореллі Франческа, Морьєлло Аньєлло Скьяно
Формула / Реферат
1. Комбінація фітоканабіноїдів тетрагідроканабінолу (ТНС) і канабідіолу (CBD) разом з темозоламідом для застосування в лікуванні гліоми, де рівень дози фітоканабіноїдів і/або темозоламіду є субефективним для лікування гліоми, якщо їх використовувати окремо.
2. Застосування комбінації фітоканабіноїдів тетрагідроканабінолу (ТНС) і канабідіолу (CBD) разом з темозоламідом для виготовлення лікарського засобу для лікування гліоми, де рівень дози фітоканабіноїдів і/або темозоламіду є субефективним для лікування гліоми, якщо їх використовувати окремо.
3. Комбінація або застосування комбінації фітоканабіноїдів за п. 1 або 2, де комбінація фітоканабіноїдів і темозоламіду упакована для введення окремо, одночасно або послідовно.
4. Спосіб лікування пацієнта з гліомою, що включає введення пацієнту терапевтично ефективної кількості комбінації фітоканабіноїдів тетрагідроканабінолу (ТНС) і канабідіолу (CBD) разом з темозоламідом, де використовують субефективний рівень дози фітоканабіноїдів і/або темозоламіду.
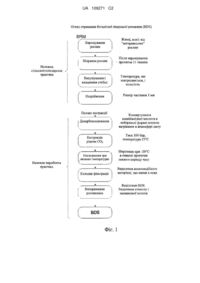
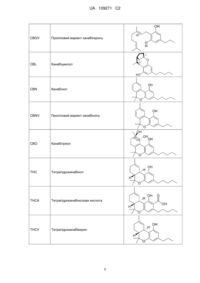
Текст
Реферат: Винахід стосується застосування фітоканабіноїдів тетрагідроканабінолу (ТНС) і канабідіолу (СВD) разом з темозоламідом для лікування гліоми. UA 109271 C2 (12) UA 109271 C2 UA 109271 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід стосується застосування фітоканабіноїдів, або у виділеній формі, або в формі ботанічної лікарської речовини (BDS), для профілактики або лікування злоякісної пухлини. Як правило, злоякісна пухлина, що підлягає лікуванню, являє собою злоякісну пухлину: передміхурової залози, молочної залози, шкіри, гліому, товстого кишечнику, легені або метастаз в кістку або в лімфатичний вузол. Фітоканабіноїди можна використовувати в комбінації з іншими способами лікування злоякісної пухлини. РІВЕНЬ ТЕХНІКИ Злоякісна пухлина являє собою клас захворювань, які виникають внаслідок того, що клітини стають іморталізованими; вони не відповідають на звичайні сигнали до припинення росту, що є нормальною функцією ремоделювання в організмі, що вимагає, щоб клітини гинули по сигналу. Апоптоз, або запрограмована загибель клітин, може стати дефектним і, коли це відбувається, може виникнути злоякісна трансформація. Іморталізовані клітини ростуть за межі їх норми і вторгаються в сусідні тканини. Злоякісні клітини також можуть метастазувати і розповсюджуватися в інші області в організмі через кровотік або лімфатичну систему. Злоякісні клітини часто формують масу, відому як пухлина. Існує приблизно 200 різних типів злоякісної пухлини; злоякісні пухлини можуть виникати в будь-якому типі тканин організму, хоча багато злоякісних пухлин метастазують в інші тканини організму. Існує множина різних причин злоякісної пухлини, і вони включають: канцерогени, вік, генетичні мутації, проблеми з імунною системою, режим харчування, масу тіла, спосіб життя, фактори навколишнього середовища, такі як забруднювачі, деякі віруси, наприклад, вірус папіломи людини (HPV) залучений до раку шийки матки, і також відомо, що деякі бактерійні інфекції викликають злоякісні пухлини. Існує множина різних варіантів лікування злоякісної пухлини і необхідне лікування часто визначається типом і стадією злоякісної пухлини. Варіанти лікування включають: лікування хіміотерапевтичними засобами, лікування гормональними засобами, променеву терапію, хірургічну операцію, додаткові способи терапії і їх комбінації. Рак передміхурової залози є найбільш поширеним типом злоякісної пухлини у чоловіків, і він становить 24 % від всіх злоякісних пухлин у чоловіків в Великобританії. У 2006 тільки в Великобританії було діагностовано понад 35000 нових випадків раку передміхурової залози. Передміхурова заліза являє собою залозу чоловічої репродуктивної системи, і симптоми злоякісної пухлини передміхурової залози можуть включати біль, ускладнення сечовипускання, проблеми зі статевим актом і еректильну дисфункцією. Рак передміхурової залози може метастазувати в кістки і/або лімфатичні вузли. Варіанти лікування для раку передміхурової залози включають хірургічну операцію, променеву терапію, хіміотерапію і гормональне лікування. Гормональне лікування звичайно залучає лікування антиандрогенами, такими як ципротерону ацетат, флутамід або бікалутамід, або окремо, або в комбінації з хіміотерапевтичним засобом. Ці способи лікування діють, зупиняючи продукування тестостерону (андрогену), що може сповільнити ріст пухлини або навіть зменшити пухлину. Коли клітини раку передміхурової залози відповідають на антиандрогени, їх називають "гормончутливим" раком передміхурової залози. На жаль, після лікування антиандрогенами протягом декількох років рак передміхурової залози перестає відповідати на гормональне лікування і його називають "гормон-нечутливим" раком передміхурової залози. На цій стадії росту пухлини не можна контролювати гормональним лікуванням. Для тестування ефективності різних сполук при лікуванні або гормон-чутливого, або гормоннечутливого раку передміхурової залози можна використовувати дві різних клітинних лінії. Клітинна лінія LNCaP являє собою клітини гормон-чутливого раку передміхурової залози, які походять з метастазу в надключичний лімфатичний вузол чоловіка у віці 50 років в 1977 році. Клітинна лінія DU-145 являє собою клітини гормон-нечутливого раку передміхурової залози, які були отримані з метастазу в головний мозок. Відомо, що рівні експресії обох канабіноїдних рецепторів, CB1 і CB2, є значно вищими в клітинах СА-вірус папіломи людини-10 (трансформовані вірусом клітини, що походять з тканини аденокарциноми передміхурової залози людини), і в інших клітинах передміхурової залози людини LNCaP, DU-I45, PC3 і CWR22RN1, в порівнянні з епітеліальними клітинами передміхурової залози людини і клітинами PZ-HPV-7 (трансформовані вірусом клітини, що походять з нормальної тканини передміхурової залози людини) (Sarfaraz, 2005). Крім того відомо, що обробка WIN-55,212-2 (змішаний агоніст CB1/CB2) гормон-чутливих клітин LNCaP приводила до залежного від дози (1-10 ммоль/л) і часу (24-48 годин) інгібування росту клітин. Блокування рецепторів CB1 і CB2 їх антагоністами SR141716 (CB1) і SR144528 (CB2) значною мірою перешкоджало цьому ефекту. 1 UA 109271 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ці результати вказують на те, що на основі WIN-55,212-2 або інших агоністів канабіноїдних рецепторів можуть бути розроблені нові лікарські засоби для лікування раку передміхурової залози. Коноплі відносять як до канцерогену, так і до засобу проти злоякісної пухлини. Зокрема, відомо, що куріння конопель є канцерогенним, оскільки дим конопель містить щонайменше 50 різних відомих канцерогенних сполук, багато з яких являють собою ті ж речовини, які зустрічаються в курильному тютюні. Відомо, що один з цих канцерогенів, бензопірен, викликає злоякісну пухлину, оскільки він змінює ген, що називається p53, що є геном-супресором пухлини. Коноплі містять речовину тетрагідроканабінол (THC), яка, як було показано, забезпечує стимуляцію бензопіреном зміни гена p53. Однак дослідники відкрили, що деякі канабіноїди, в тому числі THC і канабідіол (CBD), здатні стимулювати повторне виникнення апоптозу, так що деякі пухлини відповідають на сигнали, припиняють ділитися і гинуть. Про процес апоптозу судять по виявленню декількох ознак, включаючи: зниження об'єму клітин, конденсацію ядерного хроматину, зміну розподілу фосфоліпідів в фосфоліпідах плазматних мембран, і розщеплення хроматину на фрагменти ДНК, які називаються ДНК-драбинами. Іншим способом росту пухлин є забезпечення їх живлення: вони посилають сигнали для стимуляції ангіогенезу - росту нових кровоносних судин. Канабіноїди також можуть вимикати ці сигнали. Було показано, що канабіноїди мають антипроліферативний ефект на різні злоякісні клітинні лінії. Канабіноїди THC, THCA, CBD, CBDA, CBG і CBC і канабіноїди BDS THC і CBD тестували на восьми різних клітинних лініях, що включають DU-145 (гормон-чутливий рак передміхурової залози), MDA-MB-231 (рак молочної залози), CaCo-2 (рак ободової і прямої кишки) і C6 (клітини гліоми). Дані для кожного канабіноїду при кожному з різних типів злоякісної пухлини варіювали, однак, як правило, найкращі дані спостерігали для CBD або CBD BDS. Значення IC 50 для всіх канабіноїдів відносно DU-145 були досить високими, що має на увазі, що жоден з протестованих канабіноїдів не був особливо ефективним відносно інгібування гормон-нечутливого раку передміхурової залози (Ligresti, 2006). У виживання, росту і поширення злоякісних пухлин передміхурової залози і інших злоякісних пухлин залучено декілька каналів перехідного потенціалу рецептора (TRP). TRPM8 експресується в чутливих нейронах, де він відповідає на холод і на охолоджуючі речовини, особливо ментол, але також він рясно експресується в передміхуровій залозі. Зокрема, TRPM8 надекспресується в клітинах гормон-чутливого раку передміхурової залози, однак експресія TRPM8 практично повністю припиняється після того, як злоякісна пухлина стає гормоннечутливою, і у пацієнтів, яким проводять антиандрогену терапію. Експресія TRPM8 стимулюється андрогенами в клітинних лініях гормон-чутливого раку передміхурової залози (LNCaP). Існують дані, що експресія TRPM8 потрібна для виживання клітин раку передміхурової залози. Механізм такої дії TRPM8, ймовірно, пов'язаний з його здатністю модулювати внутрішньоклітинний кальцій, і, можливо, навіть розподіл кальцію в клітині. Останнє може бути важливим внаслідок локалізації TRPM8 в клітинах раку передміхурової залози. Хоча він зустрічається на клітинній мембрані, він також зустрічається на ендоплазматичній мережі; таким чином, будь-який потенційний лікарський засіб, що націлений на рецептор TRPM8, повинен бути здатний добре забезпечувати доступ у внутрішньоклітинний простір. Було показано, що ендогенний канабіноїд анандамід є антагоністом TRPM8 (De Petrocellis, 2007). Автори також показали, що стимуляція рецепторів CB1 забезпечувала тимчасовий антагонізм відносно рецепторів TRPM8, експресованих на тих же клітинах. У заявці WO 2008/129258 описане застосування екстрактів рослин, що місять канабіноїди, для профілактики або лікування захворювань або станів, які пом'якшуються шляхом блокади одного або декількох типів каналів TRP. Описані різні потенціали рослинних екстрактів, що містять канабіноїди, відносно зв'язування каналів TRPA1 і TRPM8. Захворювання і стану, що підлягають профілактиці або лікуванню, включають: невропатичний біль, запалення, звуження судин або злоякісну пухлину. Рецептор TRPM8 також був знайдений при ракові молочної залози, товстого кишечнику і шкіри. Було показано, що CBD здатний пригнічувати експресію інгібітору зв'язуючого ДНК білка, ld1, в клітинах раку молочної залози людини (McAllister, 2007). Концентрації CBD, ефективні відносно інгібування експресії ld-1, корелювали з концентраціями, використаними для інгібування проліферативного і інвазивного фенотипу клітин раку молочної залози. CBD був здатний інгібувати експресію ld-1 на рівні мРНК і білка залежним від концентрації чином. 2 UA 109271 C2 5 10 15 20 25 30 35 40 45 50 55 Також було показано, що CBD інгібує проліферацію і інвазію злоякісних клітин людини шляхом диференціального модулювання каскадів ERK і ROS, і що безперервна активація каскаду ERK приводить до пригнічення експресії ld-1. Також було продемонстровано, що CBD активує сприяючий диференціюванню агент, ld-2. При використанні клітинної лінії миші 4T1 і моделі метастазуючого раку молочної залози, CBD значно знижував поширення метастазів. По суті такий CBD може являти собою перспективне лікування раку молочної залози у пацієнтів з вторинними пухлинами (McAllister, 2009). Недавні дані вказують на те, що CBD є антагоністом GPR55; це дає імовірність того, що цей рецептор може лежати в основі ефектів CBD на клітини пухлини молочної залози і інших пухлин. GPR55 зв'язаний з G12/13 і подальшою активацією малих GTP-аз RhoA, rac1 і cdc42; цей каскад важливий для реорганізації цитоскелета і міграції клітин. Збільшена експресія G12/13 була виявлена в клітинах раку молочної залози ранньої стадії, взятих шляхом біопсії, і інгібування G13 знижує рівень метастазування клітин раку молочної залози in vivo (Kelly et al, 2007). Антипроліферативні ефекти CBD також оцінювали на клітинних лініях гліоми людини U87 і U373 (Massi, 2004). Антипроліферативний ефект CBD корелював з індукцією апоптозу при визначенні цитофлуориметричним аналізом і фарбуванням одноланцюжкової ДНК, яка не поверталася назад антагоністами канабіноїдів. Крім того, CBD, що вводиться п/до мишам nude в дозі 0,5 мг/миша, значно інгібував ріст пішкірно імплантованих клітин гліоми людини U87. Був зроблений висновок, що CBD здатний забезпечувати значну протипухлинну активність як in vitro, так і in vivo, таким чином, вказуючи на можливе застосування CBD як хіміотерапевтичний засіб. У заявці WO/2006/037981 описане застосування канабіноїду CBD для попередження міграції або метастазирования пухлинних клітин з області росту, що не контролюється, в область, віддалену від вихідної області пухлини. CBD викликав залежне від концентрації інгібування міграції клітин гліоми U87, підрахованих в камері Бойдена. Оскільки ці клітини експресують обидва канабіноїдні рецептори, CB1 і CB2, на мембрані, група також оцінювала їх залучення до спрямованого проти міграції ефекту CBD. Було показано, що канабіноїди відіграють фундаментальну роль в контролі виживання клітин/клітинної загибелі. Було описано, що канабіноїди можуть індукувати проліферацію, зупинку росту або апоптоз в ряді клітин, включаючи нейрони, лімфоцити і різні трансформовані нервові і що не є нервовими клітини, і що канабіноїди індукують апоптоз клітин гліоми в культурі і регресію злоякісних гліом in vivo (Guzman, 2001). Проводили попереднє клінічне дослідження THC у пацієнтів з рецидивуючою мультиформною гліобластомою. Це попереднє випробування фази I складалося з дев'яти пацієнтів з рецидивуючою мультиформною гліобластомою, яким вводили THC всередину пухлині. У пацієнтів виявилася неуспішною попередня стандартна терапія (хірургічна операція і променева терапія) і вони мали чіткі ознаки прогресування пухлини. Первинним результатом дослідження було визначення безпеки внутрішньочерепного введення THC. Також вони оцінювали дію THC на тривалість виживання і різні параметри пухлинних клітин. Середня виживаність групи після початку введення канабіноїдів становила 24 тижні (95 % довірчий інтервал: 15-33). У заявці WO 2008/144475 описано лікування клітинно-проліферативних порушень, включаючи злоякісну пухлину, похідними канабідіолу, або окремо, або в комбінації з THC або його похідним. У заявці WO 03/063847 описане застосування CBDA або CBDVA як активної фармацевтичної речовини. Вміст цієї заявки стосується лікування нудоти, блювання і захитування. У заявці WO 2009/147439 описане застосування комбінації канабіноїдів, зокрема, тетрагідроканабінолу (THC) і канабідіолу (CBD), для виготовлення лікарського засобу для застосування в лікуванні злоякісної пухлини. Зокрема, злоякісна пухлина, що підлягає лікуванню, являє собою пухлину головного мозку, більш конкретно, гліому; ще більш конкретно, мультиформну гліобластому (GBM). У заявці WO 2009/147438 описане застосування одного або декількох канабіноїдів, зокрема, THC і/або CBD, в комбінації з неканабіноїдним хіміотерапевтичним засобом, для виготовлення лікарського засобу для застосування в лікуванні злоякісної пухлини. Зокрема, злоякісна пухлина, що підлягає лікуванню, являє собою пухлину головного мозку, більш конкретно, гліому, ще більш конкретно, множинну гліобластому (GBM). Неканабіноїдний хіміотерапевтичний засіб може являти собою селективний модулятор рецепторів естрогена або алкілуючий засіб. 3 UA 109271 C2 5 10 У літературі і відповідних патентних заявках продемонстрована загальна корисність канабіноїдів в галузі дослідження і лікування злоякісної пухлини. Задачею даного винаходу є пошук вдосконалених і/або альтернативних способів лікування злоякісної пухлини. Для цього надані основні дані, що відображають застосування виділених фітоканабіноїдів і фітоканабіноїдних ботанічних лікарських речовин (BDS) в різних аспектах лікування злоякісної пухлини, і результати екстрапольовані для ідентифікації груп фітоканабіноїдів, або виділених, або в формі BDS, які виявилися більш перспективними, ніж інші, в конкретних способах лікування. ВИЗНАЧЕННЯ І СКОРОЧЕННЯ Визначення деяких з термінів, використаних для опису винаходу, детально представлені нижче. Фітоканабіноїди, описані в даній заявці, приведені нижче разом з їх стандартними скороченнями. CBC Канабіхромен CBCV Канабіхроменова кислота CBD Канабідіол CBDA Канабідіолова кислота CBDV Канабідиварин CBG Канабігерол 4 UA 109271 C2 CBGV Пропіловий варіант канабігеролу CBL Канабіциклол CBN Канабінол CBNV Пропіловий варіант канабінолу CBO Канабітриол THC Тетрагідроканабінол THCA Тетрагідроканабінолова кислота THCV Тетрагідроканабіварин 5 UA 109271 C2 THCVA 5 10 15 20 25 30 35 40 45 50 Тетрагідроканабіваринова кислота Таблиця, представлена вище, не є вичерпною, і в ній вказані тільки канабіноїди, які представлені в даній заявці для порівняння. У цей час ідентифіковано понад 60 різних канабіноїдів, і ці канабіноїди можуть бути поділені на різні групи таким чином: фітоканабіноїди; ендоканабіноїди і синтетичні канабіноїди. "Фітоканабіноїди" являють собою канабіноїди природного походження, і вони можуть бути знайдені в рослині конопель. Фітоканабіноїди можуть являти собою виділені канабіноїди або бути присутнім як ботанічна лікарська речовина. "Виділений канабіноїд" визначають як фітоканабіноїд, який екстрагований з рослини конопель і очищений до такої міри, щоб були видалені всі додаткові компоненти, такі як вторинні і несуттєві канабіноїди і неканабіноїдна фракція. "Ботанічна лікарська речовина" або "BDS" визначена в Guidance for Industry Botanical Drug Products Draft Guidance, серпень 2000 року, Міністерство охорони здоров'я і соціального забезпечення США, Центр за оцінкою і дослідженням лікарських засобів Управління по контролю за продуктами і лікарськими засобами, як: "лікарський засіб, що походить з однієї або декількох рослин, водоростей або мікроскопічних грибів. Його отримують з ботанічних вихідних матеріалів за допомогою одного або декількох з наступних процесів: порошкування, виварювання, експресія, водна екстракція, екстракція в етанолі або інші схожі процеси". Ботанічна лікарська речовина не включає у високій мірі очищену або хімічно модифіковану речовину, що походять з природних джерел. Таким чином, у випадку конопель, BDS, що походять з рослин конопель, не включають у високій мірі очищені канабіноїди фармакопейної категорії. "Ендоканабіноїди" являють собою канабіноїди, які продукуються ендогенно в організмі людини або тварини. Активація або пригнічення системи ендоканабіноїдів може бути придатна для лікування деяких захворювань або станів. "Синтетичні канабіноїди" являють собою сполуки, які мають подібну до канабіноїдів структуру, але виготовлені з використанням хімічних способів. Залежно від способу виготовлення, синтетичний канабіноїд може містити рацемічну суміш канабіноїдів, на противагу виділеному канабіноїду, який являє собою один енантіомер. Фітоканабіноїди можуть зустрічатися або в нейтральній формі (декарбоксильована форма), або в формі карбонової кислоти, залежно від способу, що використовується для екстракції канабіноїдів. Наприклад відомо, що нагрівання форми карбонової кислоти приводить до декарбоксилювання більшої частини форми карбонової кислоти в нейтральну форму. Фітоканабіноїди також можуть зустрічатися як або пентиловий (5 атомів вуглецю), або пропіловий (3 атоми вуглецю) варіант. Спочатку вважали, що пропіловий і пентиловий варіанти мають схожі властивості, однак в недавніх дослідженнях було виявлено, що це може не відповідати істині. Наприклад, відомо, що фітоканабіноїд THC є агоністом рецептора CB1, в той час як було відкрито, що пропіловий варіант THCV є антагоністом рецептора CB1, що означає, що він має практично протилежні ефекти. Вважається, що в даному винаході BDS має два компоненти: компонент, що містить фітоканабіноїди, і компонент, що не містить фітоканабіноїдів. Переважно компонент, що містить фітоканабіноїди, є більшим компонентом, що складає більше ніж 50 % (мас./мас.) всього BDS, і компонент, що не містить фітоканабіноїдів, є меншим компонентом, що складає менше 50 % (мас./мас.) всього BDS. Кількість компонента, що містить фітоканабіноїди, в BDS може складати більше ніж 55 %, 60 %, 65 %, 70 %, 75 %, 80 % до 85 % або більше ніж весь екстракт. Справжня кількість, ймовірно, залежить від вихідного матеріалу, що використовується, і способу екстракції, що використовується. "Основний фітоканабіноїд" в BDS являє собою фітоканабіноїд, який присутній в кількості, що перевищує кількість інших фітоканабіноїдів. Переважно основний фітоканабіноїд присутній в кількості більшій ніж 40 % (мас./мас.) всього екстракту. Більш переважно основний фітоканабіноїд присутній в кількості більшій ніж 50 % (мас./мас.) всього екстракту. Ще більш 6 UA 109271 C2 5 10 15 20 25 30 35 40 45 50 55 60 переважно основний фітоканабіноїд присутній в кількості більшій ніж 60 % (мас./мас.) всього екстракту. Кількість основного фітоканабіноїду в BDS переважно складає більше ніж 75 % фракції, що містить фітоканабіноїди, ще більш переважно більше ніж 85 % фракції, що містить фітоканабіноїди, і ще більш переважно більше ніж 95 % фракції, що містить фітоканабіноїди. У деяких випадках, таких як випадки, коли основної канабіноїд являє собою або CBDV, або THCVA, кількість основного фітоканабіноїду в BDS є нижчою. У цьому випадку кількість фітоканабіноїду переважно складає більше ніж 55 % фракції, що містить фітоканабіноїди. "Вторинний фітоканабіноїд/и" в BDS являє собою фітоканабіноїд/и, який присутній в значних співвідношеннях. Переважно вторинний фітоканабіноїд присутній в кількості більшій ніж 5 % (мас./мас.) всього екстракту, більш переважно більше ніж 10 % (мас./мас.) всього екстракту, ще більш переважно більше ніж 15 % (мас./мас.) всього екстракту. Деякі BDS мають два або більше вторинних фітоканабіноїдів, які присутні в значних кількостях. Однак не все BDS мають вторинний фітоканабіноїд. Наприклад, CBG BDS не має вторинного фітоканабіноїду в його екстракті. "Несуттєвий фітоканабіноїд/и" в BDS може бути описаний як частина всіх фітоканабіноїдних компонентів, що залишилася після обліку основних і вторинних фітоканабіноїдів. Переважно несуттєві фітоканабіноїди в цілому присутні в кількості меншій ніж 10 % (мас./мас.) всього екстракту, ще більш переважно меншій ніж 5 % (мас./мас.) всього екстракту, і найбільш переважно несуттєвий фітоканабіноїд присутній в кількості меншій ніж 2 % (мас./мас.) всього екстракту. Як правило, компонент, що не містить фітоканабіноїдів, BDS містить терпени, стерини, тригліцериди, алкани, сквалени, токофероли і каротиноїди. Ці сполуки можуть грати важливу роль в фармакології BDS або окремо, або в комбінації з фітоканабіноїдом. "Фракція терпенів" може мати значення і може бути класифікована по типу терпену: монотерпен або сесквітерпен. Ці терпеніві компоненти можуть бути далі визначені аналогічно канабіноїдам. Кількість компонента, що не містить фітоканабіноїдів, в BDS може складати менше ніж 45 %, 40 %, 35 %, 30 %, 25 %, 20 % до 15 % або менше ніж весь екстракт. Справжня кількість, ймовірно, залежить від вихідного матеріалу, що використовується і способу екстракції, що використовується. "Основний монотерпен/и" в BDS являє собою монотерпен, який присутній в кількості, що перевищує кількості інших монотерпенів. Переважно основний монотерпен/и присутній в кількості більшій ніж 20 % (мас./мас.) від загального вмісту терпенів. Більш переважно, основний монотерпен присутній в кількості більшій ніж 30 % (мас./мас.) від загального вмісту терпенів, ще більш переважно, більшій ніж 40 % (мас./мас.) від загального вмісту терпенів, і ще більш переважно, більшій ніж 50 % (мас./мас.) від загального вмісту терпенів. Основний монотерпен переважно являє собою мірцен або пінен. У деяких випадках може існувати два основні монотерпени. У цьому випадку основні монотерпени переважно являють собою пінен і/або мірцен. "Основний сесквітерпен" в BDS являє собою сесквітерпен, який присутній в кількості, яка перевищує кількості всіх інших терпенів. Переважно основний сесквітерпен присутній в кількості більшій ніж 20 % (мас./мас.) від загального вмісту терпенів, ще більш переважно більшій ніж 30 % (мас./мас.) від загального вмісту терпенів. Цей основний сесквітерпен переважно являє собою каріофілен і/або гумулен. Сесквітерпенові компоненти можуть мати "вторинний сесквітерпен". Вторинний монотерпен являє собою переважно пінен, який переважно присутній в кількості більшій ніж 5 % (мас./мас.) від загального вмісту терпенів, більш переважно вторинний терпен присутній в кількості більшій ніж 10 % (мас./мас.) від загального вмісту терпенів. Вторинний сесквітерпен переважно являє собою гумулен, який переважно присутній в кількості більшій ніж 5 % (мас./мас.) від загального вмісту терпенів, більш переважно вторинний терпен присутній в кількості більшій ніж 10 % (мас./мас.) від загального вмісту терпенів. Альтернативно ботанічні екстракти можна отримувати шляхом додавання виділених фітоканабіноїдів в неканабіноїдную рослинну фракцію, яка може бути отримана з рослини з нульовим вмістом канабіноїдів або що не містить не CBG BDS. КОРОТКИЙ ОПИС СУТІ ВИНАХОДУ Відповідно до першого аспекту даного винаходу передбачений екстракт рослини конопель, включаючий компонент, що містить фітоканабіноїди, і компонент, що не містить фітоканабіноїдів, для застосування в медицині, де компонент, що містить фітоканабіноїди, 7 UA 109271 C2 5 10 15 20 25 30 35 40 45 50 55 складає щонайменше 50 % (мас./мас.) екстракту рослини конопель і компонент, що не містить фітоканабіноїдів, містить монотерпенову фракцію і сесквітерпенову фракцію, де основна субфракція монотерпенів вибрана з мірценів або піненів і основна субфракція сесквітерпену вибрана з каріофіленів або гумуленів. Відповідно до другого аспекту даного винаходу передбачене застосування екстракту рослини конопель, що включає компонент, який містить фітоканабіноїди, і компонент, що не містить фітоканабіноїдів, для застосування у виготовленні лікарського засобу для застосування в медицині, де компонент, що містить фітоканабіноїди, складає щонайменше 50 % (мас./мас.) екстракту рослини конопель і компонент, що не містить фітоканабіноїдів, містить монотерпенову фракцію і сесквітерпенову фракцію, де основна субфракція монотерпенів вибрана з мірценів або піненів і основна субфракція сесквітерпенів вибрана з каріофіленів або гумуленів. Відповідно до третього аспекту даного винаходу передбачений спосіб лікування пацієнта, що включає введення пацієнту терапевтично ефективної кількості екстракту рослини конопель, що включає компонент, який містить фітоканабіноїди, і компонент, що не містить фітоканабіноїдів, де компонент, що містить фітоканабіноїди, складає щонайменше 50 % (мас./мас.) екстракту рослини конопель і компонент, що не містить фітоканабіноїдів, містить монотерпенову фракцію і сесквітерпенову фракцію, де основна субфракція монотерпенів вибрана з мірценів або піненів і основна субфракція сесквітерпенів вибрана з каріофіленів або гумуленів. Переважно основна субфракція монотерпенів містить мірцени і вторинна субфракція монотерпенів містить пінени. У іншому варіанті здійснення основна субфракція монотерпенів являє собою як мірцени, так і пінени. Переважно основна субфракція сесквітерпенів містить каріофілени і вторинна субфракція сесквітерпенів містить гумулени. Переважно основний фітоканабіноїд вибраний з групи, яка складається з: THCV, CBDV, CBGV, THCVA, THCA, CBDA, CBG, THC, CBD і CBC. Переважно компонент, що не містить фітоканабіноїдів, додатково містить одну або декілька сполук з групи, яка складається з: дитерпенів; тритерпенів; стеринів; тригліцеридів; алканів; скваленів; токоферолів і каротиноїдів. У одному варіанті здійснення екстракт рослини конопель містить основний фітоканабіноїд CBG, і компонент, що містить фітоканабіноїди, становить 61-75 % (мас./мас.) екстракту рослини конопель. Переважно екстракт додатково містить більше ніж 88 % (мас./мас.) CBG в загальній фракції фітоканабіноїдів. У наступному варіанті здійснення екстракт рослини конопель містить основний фітоканабіноїд THC, і компонент, що містить фітоканабіноїди, становить 77-94 % (мас./мас.) екстракту рослини конопель. Переважно екстракт додатково містить 78-95 % (мас./мас.) THC в загальній фракції фітоканабіноїдів. У наступному варіанті здійснення екстракт рослини конопель містить основний фітоканабіноїд CBD, і компонент, що містить фітоканабіноїди, становить 76-96 % (мас./мас.) екстракту рослини конопель. Переважно екстракт додатково містить 72-88 % (мас./мас.) CBD в загальній фракції фітоканабіноїдів. У наступному варіанті здійснення екстракт рослини конопель містить основний фітоканабіноїд CBC, і компонент, що містить фітоканабіноїди, становить 49-60 % (мас./мас.) екстракту рослини конопель. Переважно екстракт додатково містить 71-87 % (мас./мас.) CBC в загальній фракції фітоканабіноїдів. Більш переважно екстракт додатково містить вторинні фітоканабіноїди CBD і CBL. Ще більш переважно CBD становить 6,5-8 % (мас./мас.) загальній фракції фітоканабіноїдів і CBL становить 5,8-7,1 (мас./мас.) загальної фракції фітоканабіноїдів. У наступному варіанті здійснення екстракт рослини конопель містить основний фітоканабіноїд THCV і компонент, що містить фітоканабіноїди, становить 74-90 % (мас./мас.) екстракту рослини конопель. Переважно екстракт додатково містить 71-87 % (мас./мас.) THCV в загальній фракції фітоканабіноїдів. Більш переважно екстракт додатково містить вторинний фітоканабіноїд THC. Ще більш переважно THC становить 14,8-18 % (мас./мас.) загальної фракції фітоканабіноїдів. У наступному варіанті здійснення екстракт рослини конопель містить основний фітоканабіноїд CBDV і компонент, що містить фітоканабіноїди, становить 64-78 % (мас./мас.) екстракту рослини конопель. Переважно екстракт додатково містить 52-64 % (мас./мас.) CBDV в загальній фракції фітоканабіноїдів. Більш переважно екстракт додатково містить вторинні фітоканабіноїди CBD і CBCV. Ще більш переважно CBD становить 22,4-27,4 % (мас./мас.) 8 UA 109271 C2 5 10 15 20 25 30 35 40 45 50 55 загальній фракції фітоканабіноїдів і CBCV становить 5,5-6,7 (мас./мас.) загальної фракції фітоканабіноїдів. У наступному варіанті здійснення екстракт рослини конопель містить основний фітоканабіноїд CBGV і компонент, що містить фітоканабіноїди, становить 54-66 % (мас./мас.) екстракту рослини конопель. Переважно екстракт додатково містить 68-84 % (мас./мас.) CBGV в загальній фракції фітоканабіноїдів. Більш переважно екстракт додатково містить вторинний фітоканабіноїд CBG. Ще більш переважно CBG становить 19-23 % (мас./мас.) загальної фракції фітоканабіноїдів. У наступному варіанті здійснення екстракт рослини конопель містить основний фітоканабіноїд THCA, і компонент, що містить фітоканабіноїди, становить 54-66 % (мас./мас.) екстракту рослини конопель. Переважно екстракт додатково містить 71-86 % (мас./мас.) THCA в загальній фракції фітоканабіноїдів. Більш переважно екстракт додатково містить вторинний фітоканабіноїд THC. Ще більш переважно THC становить 13,4-16,4 % (мас./мас.) загальної фракції фітоканабіноїдів. У наступному варіанті здійснення екстракт рослини конопель містить основний фітоканабіноїд CBDA і компонент, що містить фітоканабіноїди, містить 71-86 % (мас./мас.) екстракту рослини конопель. Переважно екстракт додатково містить 78-86 % (мас./мас.) CBDA в загальній фракції фітоканабіноїдів. Більш переважно екстракт додатково містить вторинний фітоканабіноїд CBD. Ще більш переважно CBD становить 6,1-7,5 % (мас./мас.) загальної фракції фітоканабіноїдів. У наступному варіанті здійснення екстракт рослини конопель містить основний фітоканабіноїд THCVA, і компонент, що містить фітоканабіноїди, становить 62-75 % (мас./мас.) екстракту рослини конопель. Переважно екстракт додатково містить 53-65 % (мас./мас.) THCVA в загальній фракції фітоканабіноїдів. Більш переважно екстракт додатково містить вторинний фітоканабіноїд THCV. Ще більш переважно THCV становить 17,3-21,2 % (мас./мас.) загальної фракції фітоканабіноїдів. У четвертому аспекті даного винаходу передбачений один або декілька фітоканабіноїдів, або у виділеній формі, або в формі ботанічної лікарської речовини (BDS), як профілактика або для лікування злоякісної пухлини. У п'ятому аспекті даного винаходу передбачений один або декілька фітоканабіноїдів, взятих з групи, вибраної з: THCV, CBDV, THCVA, THCA, CBDA, CBD, CBG і CBC, для застосування в лікуванні раку передміхурової залози, де THCVA присутній як виділений фітоканабіноїд, THCA, CBDA CBD, CBG або CBC присутні в формі BDS, і THCV або CBDV присутні або у виділеній формі, або в формі BDS. Відповідно до шостого аспекту даного винаходу передбачене застосування одного або декількох фітоканабіноїдів, взятих з групи, вибраної з: THCV, CBDV, THCVA, THCA, CBDA, CBD, CBG і CBC, для застосування у виготовленні лікарського засобу для лікування раку передміхурової залози, де THCVA присутній як виділений фітоканабіноїд, THCA, CBDA CBD, CBG або CBC присутні в формі BDS, і THCV або CBDV присутні або у виділеній формі, або в формі BDS. Відповідно до сьомого аспекту даного винаходу передбачений спосіб лікування пацієнта з раком передміхурової залози, що включає введення пацієнту ефективної кількості одного або декількох фітоканабіноїдів, вибраних з групи, яка складається з: THCV, CBDV, THCVA, THCA, CBDA, CBD, CBG і CBC, де THCVA, у разі наявності, присутній як виділений фітоканабіноїд, THCA, CBDA, CBD, CBG або CBC присутні в формі BDS, і THCV або CBDV присутні або у виділеній формі, або в формі BDS. У одному варіанті здійснення один або декілька фітоканабіноїдів являють собою фітоканабіноїди в формі пропілових варіантів. У другому варіанті здійснення один або декілька фітоканабіноїдів знаходяться в формі кислоти. У наступному варіанті здійснення один або декілька фітоканабіноїдів знаходяться в нейтральній або декарбоксильованій формі. У переважному варіанті здійснення фітоканабіноїд являє собою CBG і має форму BDS. Переважно рак передміхурової залози являє собою гормон-чутливий рак передміхурової залози. У іншому варіанті здійснення фітоканабіноїд являє собою THCVA у виділеній формі. У наступному варіанті здійснення рак передміхурової залози являє собою гормоннечутливий рак передміхурової залози і фітоканабіноїд являє собою CBD і знаходиться в формі BDS, або фітоканабіноїд являє собою CBDV і знаходиться в формі BDS. 9 UA 109271 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переважно один або декілька фітоканабіноїдів використовують в комбінації з хіміотерапевтичним засобом і/або антиандрогеном або як допоміжна терапія для них. Переважно хіміотерапевтичний засіб являє собою інгібітор мітозу. Переважно інгібітор мітозу являє собою засіб з класу таксанових лікарських засобів. Більш переважно інгібітор мітозу, взятий з класу таксанових лікарських засобів, взятий з групи: доцетаксел; ларотаксел; ортатаксел; паклітаксел і тасетаксел. Коли один або декілька фітоканабіноїдів використовують в комбінації з хіміотерапевтичним засобом і/або антиандрогеном, фітоканабіноїд переважно являє собою CBG або CBD, який може бути в формі BDS. У наступному варіанті здійснення один або декілька фітоканабіноїдів використовують для цілі сповільнення росту або зменшення об'єму пухлини при раку передміхурової залози. Відповідно до восьмого аспекту даного винаходу передбачене застосування одного або декількох пропілових фітоканабіноїдів або кислотних фітоканабіноїдів для застосування в пригніченні передачі сигналу ERK і забезпечення однієї або декількох з: антипроліферативна дія, антиметастатична дія або антиангіогенна дія у пацієнта-людини. Відповідно до дев'ятого аспекту даного винаходу передбачене застосування одного або декількох пропілових фітоканабіноїдів або кислотних фітоканабіноїдів для виготовлення лікарського засобу для пригнічення передачі сигналу ERK і забезпечення однієї або декількох з: антипроліферативна дія, антиметастатична дія або антиангіогенна дія у пацієнта-людини. Відповідно до десятого аспекту даного винаходу передбачений спосіб лікування пацієнта зі злоякісною пухлиною, що включає введення одного або декількох пропілових фітоканабіноїдів або кислотних фітоканабіноїдів для пригнічення передачі сигналу ERK і забезпечення однієї або декількох з: антипроліферативна дія, антиметастатична дія або антиангіогенна дія у пацієнталюдини. Переважно один або декілька фітоканабіноїдів вибрані з групи, яка складається з: THCV, CBGV, CBDV, CBGA і CBDA. Переважно один або декілька фітоканабіноїдів знаходяться у виділеній формі. Переважно один або декілька пропілових або кислотних фітоканабіноїдів призначені для застосування в лікуванні раку легені, раку передміхурової залози або раку молочної залози. Переважно один або декілька пропілових або кислотних фітоканабіноїдів призначені для застосування в лікуванні метастазів в кістку або лімфатичний вузол. Відповідно до одинадцятого аспекту даного винаходу передбачене застосування однієї або декількох фітоканабіноїдних кислот, виключаючи CBDA або CBDVA, для застосування в медицині. Відповідно до дванадцятого аспекту даного винаходу передбачене застосування однієї або декількох фітоканабіноїдних кислот для лікування злоякісної пухлини. Відповідно до тринадцятого аспекту даного винаходу передбачене застосування однієї або декількох фітоканабіноїдних кислот для виготовлення лікарського засобу для застосування в лікуванні злоякісної пухлини. Відповідно до чотирнадцятого аспекту даного винаходу передбачений спосіб лікування пацієнта зі злоякісною пухлиною, що включає введення пацієнту терапевтичної кількості однієї або декількох фітоканабіноїдних кислот. Переважно одна або декілька фітоканабіноїдних кислот знаходяться в формі BDS. Переважно злоякісна пухлина, що підлягає лікуванню, являє собою злоякісну пухлину передміхурової залози, молочної залози, товстого кишечнику, легкого, гліому або злоякісну пухлину шкіри. Переважно фітоканабіноїдна кислота взята з групи, яка складається з: THCA, CBGA і CBDA. Більш переважно передбачена комбінація фітоканабіноїду THCA з CBDA і/або CBGA. Відповідно до п'ятнадцятого аспекту даного винаходу передбачений виділений CBD, CBG, CBDV, CBD BDS, CBG BDS і/або CBDV BDS для застосування в лікуванні передзлоякісного симптому раку товстого кишечнику. Відповідно до шістнадцятого аспекту даного винаходу передбачене застосування виділеного CBD, CBG, CBDV, CBD BDS, CBG BDS і/або CBDV BDS для виготовлення лікарського засобу для лікування передзлоякісного симптому раку товстого кишечнику. Відповідно до сімнадцятого аспекту даного винаходу передбачений спосіб лікування пацієнта з передзлоякісним симптомом раку товстого кишечнику, що включає введення пацієнту терапевтично ефективної кількості виділеного CBD, CBG, CBDV, CBD BDS, CBG BDS і/або CBDV BDS. У одному варіанті здійснення виділений CBD, CBG, CBDV, CBD BDS, CBG BDS і/або CBDV BDS використовують при лікуванні аберантних крипт в кишечнику. 10 UA 109271 C2 5 10 15 20 25 30 35 40 45 50 55 60 У наступному варіанті здійснення виділений CBD, CBG, CBDV, CBD BDS, CBG BDS і/або CBDV BDS використовують для лікування поліпів товстого кишечнику. Відповідно до вісімнадцятого аспекту даного винаходу передбачена комбінація фітоканабіноїдів разом з хіміотерапевтичним засобом, який не є канабіноїдом, для застосування в лікуванні гліоми. Відповідно до дев'ятнадцятого аспекту даного винаходу передбачене застосування комбінації фітоканабіноїдів з хіміотерапевтичним засобом, який не є канабіноїдом, для виготовлення лікарського засобу для лікування гліоми. Відповідно до двадцятого аспекту даного винаходу передбачений спосіб лікування пацієнта з гліомою, що включає введення пацієнту терапевтично ефективної кількості комбінації фітоканабіноїдів разом з хіміотерапевтичним засобом, який не є канабіноїдом. Переважно комбінація фітоканабіноїдів і хіміотерапевтичного засобу, який не є канабіноїдом, упакована для введення окремо, одночасно або послідовно. Переважно фітоканабіноїди являють собою THC і CBD. Переважно рівень дози фітоканабіноїдів є субефективним для лікування гліоми, якщо його застосовувати окремо. Переважно хіміотерапевтичний засіб являє собою темазоламід. Переважно рівень дози темазоламіду є субефективним для лікування гліоми, якщо його застосовують окремо. КОРОТКИЙ ОПИС КРЕСЛЕНЬ Варіанти здійснення винаходу додатково описані далі з посиланням на прикладені креслення, на яких: На Фіг. 1 представлений огляд отримання ботанічної лікарської речовини (BDS); На Фіг. 2 представлений ефект канабіноїдів на апоптоз в клітинній лінії гормон-нечутливого раку передміхурової залози (DU-145) і клітинній лінії гормон-чутливого раку передміхурової залози (LNCaP); На Фіг. 3 представлений ефект справжнього BDS з канабіноїдом і BDS з відновленим вмістом канабіноїду відносно антагонізму TRPM8; На Фіг. 4 (a-f) представлений ефект канабіноїдів окремо або в комбінації з хіміотерапевтичним засобом в клітинній лінії гормон-нечутливого раку передміхурової залози (DU-145) і клітинній лінії гормон-чутливого раку передміхурової залози (LNCaP) в моделі з підшкірним ксенотрансплантатом; На Фіг. 5 (a-c) представлений ефект канабіноїдів виділеного CBD і CBD BDS, на канцерогенез в товстому кишечнику у миші; і На Фіг. 6 (a-c) представлений ефект канабіноїдів: виділеного CBG, виділеного CBDV, CBG BDS і CBDV BDS на канцерогенез в товстому кишечнику у миші. ДОКЛАДНИЙ ОПИС Застосування фітоканабіноїдів, або виділених, або з усіма їх компонентами, що спільно екстрагуються, описано в наступних прикладах. Приклад 1 Ботанічне отримання і виготовлення канабіноїдного BDS Ботанічний вихідний матеріал (BRM) отримують із сортів Cannabis sativa L. (хемотипів), які були розроблені для спеціалізованого продукування високих рівнів даного фітоканабіноїду як основного фітоканабіноїду. Канабіноїд CBG є молекулою-попередником в шляху біосинтезу THC, CBD і CBC. Потім з цих канабіноїдів отримують інші канабіноїди. Основний канабіноїд, що продукується в рослині, присутній в рослинному матеріалі в формі карбонової кислоти, також як будь-які інші вторинні або несуттєві канабіноїди. Форму карбонової кислоти канабіноїду звичайно декарбоксилюють в нейтральну форму в ході переробки BRM в ботанічну лікарську речовину (BDS). Рослини, що використовуються для отримання канабіноїдного BDS, можуть являти собою або рослини дикого типу, або рослини, спеціально виведені для продукування одного канабіноїду як основного канабіноїду. Ці рослини називають "хемотипами". Наприклад, в статті (De Meijer & Hammond, 2005) описане селективне виведення рослини з високим вмістом CBG. Рослини дикого типу, які продукують велику кількість CBG, знайдені в європейських популяціях волокнистих конопель. Ботанічні лікарські речовини (BDS) отримують з BRM, і вони являють собою екстракти, придатні для подальшого приготування складу і/або для дослідницьких цілей. Ці екстракти називають ботанічною лікарською речовиною. Короткий огляд способу поданий на Фіг. 1. Умови процесу екстракції оптимізовані для найбільш сприятливого балансу вмісту канабіноїдів і неканабіноїдної фракції, а також задовільного виходу. Наприклад, вміст канабіноїду CBG BDS 11 UA 109271 C2 5 10 15 20 25 30 являє собою практично 100 % CBG, причому присутні тільки дуже невеликі кількості інших канабіноїдів. BDS, що не містять канабіноїдів, можна отримувати з CBG BDS або рослини з нульовим вмістом канабіноїдів, такої як USO-31. Оскільки CBG є основним канабіноїдом, присутнім в CBG BDS, можна видалити присутній CBG досить легко з використанням стандартних способів, відомих в даній галузі, таких як колонкова хроматографія. Екстракт, що не містить CBG, можна використовувати для оцінки того, який фармакологічний ефект, при його наявності, асоційований з неканабіноїдною фракцією. Можна фракціонувати BDS повністю, так щоб окремі сполуки можна було видалити для очищення, а інші знову об'єднати для отримання, після видалення розчинника, BDS, що не містить вибраної сполуки(сполук). Отриманим таким чином екстракт, що не містить CBG, дозволяє оцінку якої-небудь синергії між канабіноїдними і неканабіноїдними фракціями. Також можна отримувати виділені фітоканабіноїди. Як указано вище, можна використовувати колонкову хроматографію для виділення CBG з CBG BDS, досягаючи більше ніж 99 % чистоти. Потім BDS і виділений фітоканабіноїд можна використовувати для порівняння ефективності і якої-небудь синергії між основним фітоканабіноїдом і іншими фітоканабіноїдами і неканабіноїдними складовими в BDS. Приклад 2 Фітоканабіноїдні і неканабіноїдні компоненти в BDS У наступному прикладі проілюстровані різні фітоканабіноїдні компоненти, з яких складається кожний з описаних BDS. У кожній таблиці основний фітоканабіноїд позначений жирним шрифтом. BDS екстрагували з використанням рідкого CO 2, а потім використовували спосіб високоефективної рідинної хроматографії (ВЕРХ) для аналізу різних канабіноїдних компонентів в кожному канабіноїдному BDS. У таблицях нижче описані середні кількості основного, вторинних і несуттєвих фітоканабіноїдів в кожному показовому BDS. Кваліфікованому фахівцеві буде зрозуміло, що, оскільки BDS екстрагують з рослин конопель, їх склад, безумовно, варіює до деякої міри. Як правило, рівень варіювання кожного з фітоканабіноїдних компонентів знаходиться в діапазоні ±10 % (мас./мас.). Однак, залежно від вихідного рослинного матеріалу і способу екстракції, що використовується, ці кількості можуть варіювати на від ±5 % аж до±50 % (мас./мас.). Таблиця 2.1.1 Кількість BDS канабігеролу в цілому і діапазон Кількість (% мас./мас.) 0,33 66,96 0,03 0,07 CBGV CBG THC CBC CBG (споріднена речовина) Всього канабіноїдів Всього неканабіноїдів 35 Діапазон (±10 %) 0,30-0,36 60,3-73,7 0,027-0,033 0,06-0,08 Діапазон (±25 %) 0,25-0,41 50,2-83,7 0,023-0,038 0,05-0,09 Діапазон (±50 %) 0,17-0,50 33,5-100,0 0,015-0,045 0,035-0,105 1,35 CBG BDS 1,22-1,49 1,01-1,69 0,68-2,03 68,74 31,26 Загальна фракція CBG BDS, що містить фітоканабіноїди, становить приблизно 61-75 % (мас./мас.) всього BDS. Таблиця 2.1.2 BDS канабігеролу по проценту канабіноїдів Кількість (% від всіх канабіноїдів) 0,48 97,41 0,04 0,10 1,96 CBG BDS CBGV CBG THC CBC CBG (споріднена речовина) 12 UA 109271 C2 Кількість основного фітоканабіноїду в CBG BDS як процент фракції, що містить фітоканабіноїди, становить приблизно 88-100 % (мас./мас.). Таблиця 2.2.1 Кількість BDS тетрагідроканабінолу в цілому і діапазон THC BDS CBO CBG CBD THCV CBN THC (споріднені речовини) THC CBC THCA Всього канабіноїдів Всього неканабіноїдів Кількість (% мас./мас.) 0,2 2,0 1,0 1,1 3,0 Діапазон (±10 %) 0,18-0,22 1,8-2,2 0,9-1,1 0,99-1,21 2,7-3,3 Діапазон (±25 %) 0,15-0,25 1,5-2,5 0,75-1,25 0,83-1,38 2,25-3,75 Діапазон (±50 %) 0,1-0,3 1,0-3,0 0,5-1,5 0,55-1,65 1,5-4,5 0,6 0,54-0,66 0,45-0,75 0,3-0,9 74,0 2,0 1,5 85,40 14,60 66,6-81,4 1,8-2,2 1,35-1,65 55,5-92,5 1,5-2,5 1,13-1,88 37,0-100,0 1,0-3,0 0,75-2,25 5 Загальна фракція THC BDS, що містить фітоканабіноїди, становить приблизно 77-94 % (мас./мас.) всього BDS. Таблиця 2.2.2 BDS тетрагідроканабінолу по проценту канабіноїді в THC BDS Кількість (% від всіх канабіноїдів) CBO 0,23 CBG 2,34 CBD 1,17 THCV 1,29 CBN 3,51 THC (споріднені речовини) 0,70 THC 86,65 CBC 2,34 THCA 1,76 10 Кількість основного фітоканабіноїду в THC BDS як процент фракції, що містить фітоканабіноїди, становить приблизно 78-95 % (мас./мас.). 13 UA 109271 C2 Таблиця 2.3.1 Кількість BDS канабідіолу в цілому і діапазон Кількість (% мас./мас.) Діапазон (±25 %) Діапазон (±50 %) 0,27-0,33 0,23-0,38 0,15-0,45 1,9 1,3 2,5 0,2 70,0 5,5 5,6 87,30 12,70 CBD (споріднені речовини) CBDV CBDA CBG CBN CBD THC CBC Всього канабіноїдів Всього неканабіноїдів Діапазон (±10 %) 0,3 CBD BDS 1,71-2,09 1,17-1,43 2,25-2,75 0,18-0,22 63,0-77,0 4,95-6,05 5,04-6,16 1,43-2,38 0,98-1,63 1,88-3,13 0,15-0,25 52,5-87,5 4,13-6,88 4,20-7,00 0,95-2,85 0,65-1,95 1,25-3,75 0,1-0,3 35,0-100,0 2,75-8,25 2,80-8,40 Загальна фракція CBD BDS, що містить фітоканабіноїди, становить приблизно 79-96 % (мас./мас.) всього BDS. 5 Таблиця 2.3.2 BDS канабідіолу по проценту канабіноїдів Кількість (% від всіх канабіноїдів) 0,34 2,18 1,49 2,86 0,23 80,18 6,30 6,41 CBD BDS CBD (споріднені речовини) CBDV CBDA CBG CBN CBD THC CBC Кількість основного фітоканабіноїду в CBD BDS як процент фракції, що містить фітоканабіноїди, становить приблизно 72-88 % (мас./мас.). Таблиця 2.4.1 Кількість BDS канабіхромену в цілому і діапазон CBC BDS Кількість (% мас./мас.) Діапазон (±10 %) Діапазон (±25 %) Діапазон (±50 %) CBG 0,91 0,82-1,00 0,68-1,14 0,46-1,37 CBD 3,96 3,56-4,36 2,97-4,95 1,98-5,94 CBCV 0,74 0,67-0,81 0,56-0,93 0,37-1,11 THC 1,76 1,58-1,94 1,32-2,20 0,88-2,64 CBC (споріднені 0,13 0,12-0,14 0,10-0,16 0,07-0,20 речовини) CBC 42,95 38,65-47,25 32,22-56,69 21,48-64,43 CBCA 0,56 0,50-0,62 0,42-0,70 0,28-0,84 CBL 3,54 3,19-3,89 2,67-4,43 1,77-5,31 Всього канабіноїдів 54,55 Всього неканабіноїдів 45,45 10 Загальна фракція CBD BDS, що містить фітоканабіноїди, приблизно 49-60 % (мас./мас.) всього BDS. 14 UA 109271 C2 Таблиця 2.4.2 BDS канабіхромену по проценту канабіноїдів Кількість (% від всіх канабіноїдів) 1,67 7,26 1,36 3,23 0,24 78,74 1,03 6,49 CBC BDS CBG CBD CBCV THC CBC (споріднені речовини) CBC CBCA CBL 5 Кількість основного фітоканабіноїду в CBC BDS як процент фракції, що містить канабіноїди, становить приблизно 71-87 % (мас./мас.). CBC BDS також має два вторинні канабіноїди: CBD, який присутній в кількості приблизно 6,5-8 % (мас./мас.) від фракції, що містить фітоканабіноїди, і CBL, який присутній в кількості приблизно 5,8-7,1 % (мас./мас.) від фракції, що містить фітоканабіноїди. Таблиця 2.5.1 Кількість BDS тетрагідроканабіварину в цілому і діапазон THCV BDS CBGV CBNV THCV CBCV THC-C4 CBN THCVA THC Невідомі речовини Всього канабіноїдів Всього неканабіноїдів 10 Кількість (% мас./мас.) 0,15 1,30 64,49 0,65 0,82 0,15 0,36 13,43 0,58 81,93 18,07 Діапазон (±10 %) Діапазон (±25 %) Діапазон (±50 %) 0,14-0,17 1,20-1,40 58,04-70,94 0,59-0,72 0,74-0,90 0,14-0,17 0,32-0,40 12,09-14,77 0,52-0,64 0,11-0,19 1,00-1,60 48,37-80,61 0,49-0,81 0,62-1,03 0,11-0,19 0,27-0,45 10,07-16,79 0,44-0,73 0,07-0,23 0,65-1,95 32,25-96,74 0,33-0,98 0,41-1,23 0,07-0,23 0,18-0,54 7,72-20,15 0,29-0,87 Загальна фракція THCV BDS, що містить фітоканабіноїди, становить приблизно 74-90 % (мас./мас.) всього BDS. Таблиця 2.5.2 BDS тетрагідроканабіварину по проценту канабіноїдів Кількість (% від всіх канабіноїдів) 0,18 1,59 78,71 0,79 1,00 0,18 0,44 16,39 0,71 THCV BDS CBGV CBNV THCV CBCV THC-C4 CBN THCVA THC Невідомі речовини Кількість основного фітоканабіноїду в THCV BDS як процент фракції, що містить фітоканабіноїди, становить приблизно 71-87 % (мас./мас.). THCV BDS також має вторинний 15 UA 109271 C2 канабіноїд THC, який присутній на рівні приблизно 14,8-18 % (мас./мас.) фракції, що містить фітоканабіноїди. Таблиця 2.6.1 Кількість BDS канабідиварину в цілому і діапазон CBDV BDS Кількість (% мас./мас.) Діапазон (±10 %) Діапазон (±25 %) Діапазон (±50 %) CBDVA 0,14 0,13-0,15 0,11-0,18 0,07-0,21 CBDV 41,19 37,07-45,31 30,89-51,49 20,60-61,79 CBDA 0,07 0,06-0,08 0,05-0,09 0,04-0,11 CBG 0,59 0,53-0,65 0,44-0,74 0,30-0,89 CBD 17,70 15,93-19,47 13,28-22,13 8,85-26,55 THCV 3,06 2,75-6,12 2,30-3,83 1,53-4,59 CBCV 4,35 3,92-4,79 3,26-5,44 2,18-6,53 THC 0,88 0,79-0,97 0,66-1,10 0,44-1,32 CBDV (споріднені 2,20 1,98-2,42 1,65-2,75 1,10-3,30 речовини) CBC 0,93 0,84-1,02 0,70-1,16 0,47-1,40 Всього канабіноїдів 71,11 Всього неканабіноїдів 28,89 5 Загальна фракція CBDV BDS, що містить канабіноїди, становить приблизно 64-78 % (мас./мас.) всього BDS. Таблиця 2.6.2 BDS канабідиварину по проценту канабіноїдів Кількість (% від усіх канабіноїдів) 0,20 57,92 0,10 0,83 24,89 4,30 6,12 1,24 3,09 1,31 CBDV BDS CBDVA CBDV CBDA CBG CBD THCV CBCV THC CBDV (споріднені речовини) CBC 10 Кількість основного фітоканабіноїду в CBDV BDS як процент фракції, що містить канабіноїди, становить приблизно 52-64 % (мас./мас.). CBDV BDS також має два вторинні канабіноїди: CBD, який присутній на рівні приблизно 22,4-27,4 % (мас./мас.) від фракції, що містить канабіноїди, і CBCV, який присутній на рівні приблизно 5,5-6,7 % (мас./мас.) від фракції, що містить канабіноїди. Таблиця 2.7.1 Кількість BDS пропілового варіанту канабігеролу в цілому і діапазон CBGV BDS Кількість (% мас./мас.) Діапазон (±10 %) Діапазон (±25 %) Діапазон (±50 %) CBGV 45,92 41,33-50,51 34,44-57,40 22,96-68,88 CBG 12,79 11,51-14,07 9,59-15,99 6,40-19,19 THC 0,08 0,07-0,09 0,06-0,10 0,04-0,12 CBC 0,21 0,19-0,23 0,16-0,25 0,11-0,32 CBG (споріднені 1,45 1,31-1,60 1,09-1,81 0,73-2,18 речовини) Всього канабіноїдів 60,45 Всього неканабіноїдів 39,55 16 UA 109271 C2 Загальна фракція CBGV BDS, що містить фітоканабіноїди, становить приблизно 54-66 % (мас./мас.) всього BDS. Таблиця 2.7.2 BDS пропілового варіанту канабігеролу по проценту канабіноїдів Кількість (% від всіх канабіноїдів) 75,96 21,16 0,13 0,35 2,40 CBGV BDS CBGV CBG THC CBC CBG (споріднені речовини) 5 Кількість основного фітоканабіноїду в CBGV BDS як процент фракції, що містить канабіноїди, становить приблизно 68-84 % (мас./мас.). CBGV BDS також має вторинний канабіноїд CBG, який присутній на рівні приблизно 19-23 % (мас./мас.) від фракції, що містить канабіноїди. 10 Таблиця 2.8.1 Кількість BDS тетрагідроканабінолової кислоти в цілому і діапазон THCA BDS Кількість (% мас./мас.) Діапазон (±10 %) Діапазон (±25 %) Діапазон (±50 %) CBO 0,06 0,05-0,07 0,05-0,08 0,03-0,09 CBG 1,91 1,72-2,10 1,43-2,39 0,96-2,87 CBD 0,30 0,27-0,33 0,23-0,38 0,15-0,45 THC (споріднені 0,16 0,14-0,18 0,12-0,20 0,08-0,24 речовини) THCV 0,05 0,04-0,06 0,04-0,06 0,03-0,08 CBN 1,11 1,00-1,22 0,83-1,39 0,56-1,67 THC 8,93 8,04-9,82 6,70-11,16 4,47-13,40 CBL 0,17 0,15-0,19 0,13-0,21 0,09-0,26 CBC 0,26 0,23-0,29 0,20-0,33 0,13-0,39 THCA 46,98 42,28-51,68 35,24-58,73 23,49-70,47 Всього канабіноїдів 59,93 Всього неканабіноїдів 40,07 Загальна фракція THCA BDS, що містить фітоканабіноїди, становить приблизно 54-66 % (мас./мас.) всього BDS. Таблиця 2.8.2 BDS тетрагідроканабінолової кислоти по проценту канабіноїдів Кількість (% від усіх канабіноїдів) 0,10 3,19 0,50 0,27 0,08 1,85 14,90 0,28 0,43 78,39 THCA BDS CBO CBG CBD THC (споріднені речовини) THCV CBN THC CBL CBC THCA 15 17 UA 109271 C2 Кількість основного фітоканабіноїду в THCA BDS як процент фракції, що містить канабіноїди, становить приблизно 71-86 % (мас./мас.). THCA BDS також має вторинний канабіноїд THC, який присутній в кількості приблизно 13,4-16,4 % (мас./мас.) від фракції, що містить канабіноїди. 5 Таблиця 2.9.1 Кількість BDS канабідіолової кислоти в цілому і діапазон CBDA BDS Кількість (% мас./мас.) Діапазон (±10 %) Діапазон (±25 %) Діапазон (±50 %) CBDV 0,23 0,21-0,25 0,17-0,29 0,12-0,37 CBDA 68,14 61,33-74,95 51,11-85,18 34,07-100,0 CBD 5,36 4,82-5,90 4,02-6,70 2,68-8,04 CBN 0,19 0,17-0,21 0,14-0,24 0,1-0,29 THC 0,53 0,48-0,58 0,40-0,66 0,27-0,80 CBL 0,29 0,26-0,32 0,22-0,36 0,15-0,44 CBC 0,38 0,34-0,42 0,29-0,48 0,19-0,57 CBD (споріднені 3,31 2,98-3,64 2,48-4,14 1,66-4,98 речовини) Всього канабіноїдів 78,43 Всього неканабіноїдів 21,57 Загальна фракція CBDA BDS, що містить фітоканабіноїди, становить приблизно 71-86 % (мас./мас.) всього BDS. Таблиця 2.9.2 BDS канабідіолової кислоти по проценту канабіноїдів 10 CBDA BDS Кількість (% від всіх канабіноїдів) CBDV 0,29 CBDA 86,88 CBD 6,83 CBN 0,24 THC 0,68 CBL 0,37 CBC 0,48 CBD (споріднені речовини) 4,22 Кількість основного фітоканабіноїду в CBDA BDS як процент фракції, що містить канабіноїди, становить приблизно 78-96 % (мас./мас.). CBDA BDS також має вторинний канабіноїд CBD, який присутній на рівні 6,1-7,5 % (мас./мас.) фракції, що містить канабіноїди. Таблиця 2.10.1 Кількість BDS тетрагідроканабіваринової кислоти в цілому і діапазон THCVA BDS Кількість (% мас./мас.) Діапазон (±10 %) Діапазон (±25 %) Діапазон (±50 %) CBDVA 1,44 1,30-1,58 1,08-1,80 0,72-2,16 CBNV 0,35 0,32-0,39 0,26-0,44 0,18-0,53 THCV 13,17 11,85-14,49 9,88-16,46 6,59-19,76 CBCV 1,97 1,77-2,17 1,48-2,46 0,99-2,96 THC-C4 0,36 0,32-0,40 0,27-0,45 0,18-0,54 THCVA 40,61 36,55-44,67 30,46-50,76 20,31-50,76 THC 3,53 3,18-3,88 2,65-4,41 1,77-5,30 CBC 0,20 0,18-0,22 0,15-0,25 0,1-0,3 THCA 6,29 5,66-6,92 4,72-7,86 3,15-9,44 Невідомі речовини 0,45 0,41-0,50 0,38-0,56 0,23-0,68 Всього канабіноїдів 68,37 Всього неканабіноїдів 31,63 18 UA 109271 C2 Загальна фракція THCVA BDS, що містить фітоканабіноїди, становить приблизно 37-45 % (мас./мас.) всього BDS. Таблиця 2.10.2 BDS тетрагідроканабіваринової кислоти по проценту канабіноїдів Кількість (% від усіх канабіноїдів) 2,11 0,51 19,26 2,88 0,53 59,40 4,90 0,29 9,20 0,66 THCVA BDS CBDVA CBNV THCV CBCV THC-C4 THCVA THC CBC THCA Невідомі речовини 5 10 Кількість основного фітоканабіноїду в THCVA BDS як процент від фракції, що містить канабіноїди, становить приблизно 53-65 % (мас./мас.). THCVA BDS також містить вторинний канабіноїд THCV, який присутній на рівні приблизно 17,3-21,2 % (мас./мас.) від фракції, що містить канабіноїди. У таблиці нижче представлений детальний огляд кількості канабіноїдної і неканабіноїдної фракції в кожному канабіноїдному BDS і кількість канабіноїду як процент всіх канабіноїдів в кожному BDS. Як раніше обговорювалося, кваліфікованому фахівцеві буде зрозуміло, що ці величини варіюють внаслідок природної природи вихідного рослинного матеріалу. Таблиця 2.11.1 Огляд канабіноїдних BDS BDS CBG THC CBD CBC THCV CBDV CBGV THCA CBDA THCVA Фракція канабіноїдів (% мас./мас.) 68,7 85,4 87,3 54,5 81,9 71,1 60,5 59,9 78,4 68,4 Фракція неканабіноїдів (% мас./мас.) 31,3 14,6 12,7 45,5 18,1 28,9 39,5 40,1 21,6 31,6 Кількість основного канабіноїду (% від всіх канабіноїдів) 97,4 86,7 80,2 78,7 78,7 57,9 76,0 78,4 86,9 59,4 15 20 25 Є бажаною максимізація кількості основного фітоканабіноїду у фракції, що містить фітоканабіноїди, однак в деяких випадках може існувати синергія між основними і вторинними канабіноїдами, яка може приводити до посилення медичних ефектів. Це також є бажаним для діапазону, в якому варіює процент фракції, що містить канабіноїди, фракції. що не містить фітоканабіноїди, і кількість основного фітоканабіноїду. У більшості випадків це варіювання є невеликим і знаходиться в діапазоні ±5 %, аж до±10 %, аж до±25 % і переважно не більше ніж ±50 %. Неканабіноїдні компоненти фітоканабіноїдного BDS можуть грати важливу роль в фармакології BDS. По суті профіль терпенів класифікований нижче. У представлених нижче таблицях проілюстрований профіль терпенів хемовару CBD, який є типовим представником рослини з високим вмістом фітоканабіноїдів. П'ять рослин збирали свіжими і екстрагували з використанням парової дистиляції. Основний монотерпен і сесквітерпен виділені напівжирним шрифтом. 19 UA 109271 C2 Таблиця 2.12.1 Кількість монотерпенів по проценту загальної фракції терпенів і діапазони Кількість (% від фракції терпенів) 10,56 39,46 4,14 4,04 58,20 Монотерпени Пінен (альфа і бета) Мірцен Лімонен Бета-оцимен Усього Діапазон (±10 %) Діапазон (±25 %) Діапазон (±50 %) 9,50-11,62 35,51-43,41 3,73-4,55 3,64-4,44 7,92-13,20 29,60-49,33 3,11-5,18 3,03-5,05 5,28-15,84 19,73-59,19 2,07-6,21 2,02-6,06 Фракція, що містить монотерпени, становить приблизно 52-64 % (мас./мас.) від всієї фракції терпенів. 5 Таблиця 2.12.2 Кількість монотерпенів по проценту від моно терпенів Монотерпени Пінен (альфа і бета) Мірцен Лімонен Бета-оцимен 10 Кількість (% від фракції терпенів) 18,14 67,80 7,12 6,94 Кількість основного монотерпену мірцену у фракції монотерпенів як процент від фракції монотерпенів становить приблизно 61-75 % (мас./мас.). Фракція монотерпенів також має вторинний монотерпен пінен, який присутній на рівні приблизно 16,3-20 % (мас./мас.) фракції монотерпенів. Таблиця 2.12.3 Кількість сесквітерпену по проценту загальної фракції терпенів і діапазони Сесквітерпени Каріофілени (t і оксид) Берготамен Гумулен Аромадендрен Селінен Анон Фарнезен (Z, Е і альфа) альфа-гур'юнен Бісаболен Неролідол Діепіцедрен-1-оксид Альфа-бісаболол Усього Кількість (% від фракції терпенів) 29,27 0,18 7,97 0,33 0,59 0,44 1,55 0,12 0,39 0,43 0,38 0,16 41,80 Діапазон (±10 %) Діапазон (±25 %) Діапазон (±50 %) 26,34-32,20 0,16-0,20 7,17-8,77 0,30-0,36 0,53-0,65 0,40-0,48 1,40-1,71 0,11-0,13 0,35-0,43 0,39-0,47 0,34-0,42 0,14-0,18 21,95-36,59 0,14-0,23 5,98-9,96 0,25-0,41 0,44-0,74 0,33-0,55 1,16-1,94 0,09-0,15 0,29-0,49 0,32-0,54 0,29-0,48 0,12-0,20 14,64-43,91 0,09-0,27 3,99-11,96 0,17-0,50 0,30-0,89 0,22-0,66 0,78-2,33 0,06-0,18 0,20-0,59 0,22-0,65 0,19-0,57 0,08-0,24 Фракція, що містить сесквітерпени, становить приблизно 27-32 % (мас./мас.) від загальної фракції терпенів. 15 20 UA 109271 C2 Таблиця 2.12.4 Кількість сесквітерпенів по проценту від сесквітерпенів Сесквітерпени Каріофілени (t і оксид) Берготамен Гумулен Аромадендрен Селінен Анон Фарнезен (Z, Е і альфа) альфа-гур'юнен Бісаболен Неролідол Діепіцедрен-1-оксид Альфа-бісаболол 5 10 Кількість (% від фракції сесквітерпенів) 70,02 0,43 19,07 0,79 1,41 1,05 3,71 0,29 0,93 1,03 0,91 0,38 У патентній заявці номер PCT/GB2008/001837 описано продукування рослини з "нульовим вмістом канабіноїдів". Ці рослини отримували селекційним виведенням для отримання рослини Cannabis sativa L, що містить в основному кількісно схожий профіль терпенів з продукуючою канабіноїди рослиною Cannabis sativa L, але яка була позбавлена яких-небудь канабіноїдів. Ці рослини можна використовувати для отримання рослинних екстрактів, що не містять канабіноїдів, які є придатними контрольними рослинами в експериментах і клінічних дослідженнях. Розподіл профілю терпенів, що продукуються в рослинах, може бути знайдений в таблиці нижче. Первинні монотерпени і сесквітерпен виділені напівжирним шрифтом. Таблиця 2.13.1 Кількість монотерпенів по проценту від загальної фракції терпенів і діапазони Монотерпени Пінен (альфа і бета) Мірцен Лімонен Ліналол Вербенол (цис і транс) Усього Кількість (% від фракції терпенів) 29,34 29,26 5,32 4,50 3,45 71,87 Діапазон (±10 %) Діапазон (±25 %) Діапазон (±50 %) 26,41-32,27 26,33-32,19 4,79-5,85 4,05-4,95 3,11-3,80 22,01-36,68 21,95-36,58 3,99-6,65 3,38-5,63 2,59-4,31 14,67-44,01 14,63-43,89 2,66-7,98 2,25-6,75 1,73-5,18 Фракція, що містить монотерпени, становить приблизно 65-79 % (мас./мас.) від усієї фракції терпенів. 15 Таблиця 2.13.2 Кількість монотерпенів по проценту від моно терпенів Монотерпени Пінен (альфа і бета) Мірцен Лімонен Ліналол Кількість (% від фракції монотерпенів) 40,82 40,71 7,41 6,26 Було виявлено, що рослина з нульовим вмістом канабіноїдів містить два основні монотерпени: пінен і мірцен. Кількість основного монотерпену мірцену у фракції монотерпенів як процент від фракції монотерпенів становить приблизно 37-45 % (мас./мас.). Кількість 21 UA 109271 C2 основного монотерпену пінену у фракції монотерпенів як процент від фракції монотерпенів становить приблизно 37-45 % (мас./мас.). Таблиця 2.13.3 Кількість сесквітерпену по проценту загальної фракції терпенів і діапазони Сесквітерпени Каріофілени (t і оксид) Берготамен Фарнезен (Z, Е і альфа) Гумулен (і епоксид II) дельта-гвайєн Бісаболен Усього 5 Кількість (% від фракції терпенів) 10,89 2,51 3,43 5,04 2,40 3,85 28,12 Діапазон (±10 %) Діапазон (±25 %) Діапазон (±50 %) 9,80-11,98 2,26-2,76 3,09-3,77 4,54-5,54 2,16-2,64 3,47-4,24 8,17-13,61 1,88-3,14 2,57-4,29 3,78-6,30 1,80-3,00 2,89-4,81 5,45-16,34 1,26-3,77 1,72-5,15 2,52-7,56 1,20-3,60 1,93-5,78 Фракція, що містить сесквітерпени, становить приблизно 25-31 % (мас./мас.) від загальної фракції терпенів. Таблиця 2.12.4 Кількість сесквітерпенів по проценту від сесквітерпенів Сесквітерпени Каріофілени (t і оксид) Берготамен Фарнезен (Z, Е і альфа) Гумулен (і епоксид II) дельта-гвайєн Бісаболен 10 15 20 25 30 Кількість (% від фракції сесквітерпенів) 38,73 8,93 12,20 17,92 8,53 13,69 Кількість основного сесквітерпену каріофілену у фракції сесквітерпенів як процент фракції сесквітерпенів становить приблизно 35-43 % (мас./мас.). Фракція сесквітерпенів також має вторинний сесквітерпен гумулен, який присутній на рівні приблизно 16-20 % (мас./мас.) від фракції сесквітерпенів. Приклад 3 Ефект фітоканабіноїдів на апоптоз в клітинній лінії гормон-нечутливого раку передміхурової залози (DU-145) і клітинній лінії гормон-чутливого раку передміхурової залози (LNCaP) Ефект CBDV BDS, CBD BDS, THCVA BDS, THCV BDS, виділений THCV і виділеного THCVA на апоптоз двох клітинних ліній раку передміхурової залози тестували з використанням хемілюмінесцентного аналізу вивільнення каспази 3/7. Тестували дві різні концентрації канабіноїдів; низьку дозу (10 мкМ) і високу дозу (25 мкМ). Хемілюмінесценція, яка була виявлена для кожного фітоканабіноїду, детально представлена на Фіг. 2. У клітинній лінії гормон-нечутливого раку передміхурової залози (DU-145) найвища хемілюмінесценція і по суті найвищі проапоптотичні ефекти були знайдені у випадку низької дози CBDV BDS і високої дози очищеного канабіноїду - виділеної THCVA-25 мкМ. Високі дози THCV BDS, CBD BDS і виділений THCV також продемонстрували рівні апоптозу вище ніж у контролю. У клітинній лінії гормон-чутливого раку передміхурової залози (LNCaP) найвища хемілюмінесценція і по суті найвищий проапоптотичний ефект були знайдені у випадку високої дози виділеної THCVA. Також було показано, що низька і висока доза CBDV BDS мають апоптотичні ефекти на злоякісні клітини. Ця дані мають на увазі, що як фітоканабіноїдні BDS, так і виділений фітоканабіноїд, можуть бути придатні для лікування злоякісної пухлини, оскільки вони здатні надавати апоптотичного ефекту на злоякісні клітини. Приклад 4 Ефект фітоканабіноїдів на зв'язану з G-білком рецептор GPR55 22 UA 109271 C2 Був проведений аналіз ERK Alphascreen з використанням клітин GPR55-HEK. Різні протестовані канабіноїди виявляли різні фармакологічні профілі відносно GPR55, як проілюстровано в таблиці 4.1 нижче. Таблиця 4.1 Ефект фітоканабіноїдів відносно GPR55 Сполука CBD (контроль) THCV CBGA CBGV CBDA CBDV Ефект відносно GPR55 Антагоніст Антагоніст (в низьких концентраціях) Зворотний агоніст Антагоніст Антагоніст Антагоніст 5 10 15 Було показано, що значне зниження каскаду передачі сигналу ERK приводить до індукції апоптозу (Chang et al., 2003). Ці дані вказують на те, що всі протестовані фітоканабіноїди можуть здійснювати антагонізм експресії GPR55 злоякісними клітинами, що робить їх хорошими сполуками-мішенями для застосування в лікуванні злоякісної пухлини. Приклад 5 Ефект фітоканабіноїдів на інгібування моноацилгліцеридліпази (MAGL) і діацилгліцеридліпази (DAGL) Ефекти фітоканабіноїдних BDS THCA, CBN, CBGA, CBDA і CBCV тестували для визначення того, чи здатні вони інгібувати ферменти MAGL і DAGL, які здатні гідролізувати ендогенний канабіноїд 2-AG до арахідонової кислоти і гліцерину. Результати цих експериментів детально представлені в таблиці 5.1 нижче. Таблиця 5.1 Ефект фітоканабіноїдів на інгібування моноацилгліцеридліпази (MAGL) і діацилгліцеридліпази (DAGL) Зразок MAG IC50 THCA 46 мкМ CBN >50 мкМ CBGA >50 мкМ CBDA >50 мкМ CBCV >50 мкМ 20 25 30 Максимальна протестована концентрація (% інгібування) 100 мкМ (81,9 %) 50 мкМ (31,5 %) 50 мкМ (17,2 %) 50 мкМ (18,5 %) 50 мкМ (4,8 %) DAGL IC50 25 мкМ >50 мкМ 30 мкМ 23 мкМ >50 мкМ Максимальна протестована концентрація (% інгібування) 50 мкМ (79,3 %) 50 мкМ (26,9 %) 100 мкМ (67,5 %) 100 мкМ (91,4 %) 50 мкМ (18,9 %) Як можна бачити фітоканабіноїд THCA був найефективним відносно інгібування DAGL, і всі фітоканабіноїдні кислоти (THCA, CBDA і CBGA) були ефективними відносно інгібування MAGL. Ці дані мають на увазі, що ці фітоканабіноїди можуть бути придатні для лікування злоякісної пухлини, оскільки вони здатні запобігати гідроліз ендогенного канабіноїду 2-AG і по суті можуть перешкоджати утворенню злоякісних клітин. Був проведений додатковий експеримент, щоб визначити, чи є фітоканабіноїдні BDS ефективнішими відносно інгібування MAGL, ніж їх відповідні очищені аналоги. Для цього експерименту використовували CBG BDS, оскільки цей BDS було легше усього очистити і відновити. Використовували чотири різні тестовані вироби: CBG BDS, виділений CBG, CBG BDS, що не містить CBG, і BDS з відновленим вмістом CBG, причому в BDS, що не містить CBG (отримане згідно з прикладом 1), додавали виділений CBG в тій же концентрації CBG, що і в CBG BDS. У таблиці 5.2 нижче детально представлені отримані дані. 23 UA 109271 C2 Таблиця 5.2 Ефект BDS, очищених сполук і відновленого BDS відносно інгібування моноацилгліцеридліпази (MAGL) Максимум, протестований відносно % інгібування MAGL Виділений CBG 195,2 мкМ 100 мкМ (31,49 %) CBG BDS 64,33 мкМ 100 мкМ (57,93 %) BDS, що не містить CBG 187,0 мкМ 100 мкМ (36,55 %) BDS з відновленим вмістом CBG 70,28 мкМ 100 мкМ (59,31 %) Як можна бачити з таблиці 5.2 вище, CBG BDS має схожу ефективність з відновленим BDS. Ці дані демонструють синергічний ефект між основним фітоканабіноїдом і іншими канабіноїдними і неканабіноїдними компонентами в BDS. Ці дані передбачають, що застосування фітоканабіноїдних BDS, що містять неканабіноїдний компонент, є ефективним відносно лікування злоякісної пухлини, чому застосування виділених фітоканабіноїдів. Приклад 6 Ефект фітоканабіноїдного BDS і BDS з відновленим вмістом фітоканабіноїду на антагонізм TRPM8 CBG BDS і BDS з відновленим вмістом CBG, як описано в прикладі 5, вище, використовували для визначення їх ефективності відносно антагонізму TRPM8. Також для повноти були протестовані BDS, що не містить CBG, і очищений CBG. Виявляли процентну відповідь проти 0,25 мкМ іциліну, і він детально поданий на Фіг. 3. Як можна бачити, як CBG BDS, так і BDS з відновленим вмістом CBG, дали значно вищий рівень відповіді, ніж або виділеним CBG, або BDS, що не містить CBG. Ці дані знову демонструють синергію між основним фітоканабіноїдом і іншими компонентами в BDS. Ці дані передбачають, що застосування фітоканабіноїдного BDS може бути ефективним варіантом лікування при злоякісній пухлині. Приклад 7 Ефект фітоканабіноїдів в клітинній лінії гормон-нечутливого раку передміхурової залози (DU145) і в клітинній лінії гормон-чутливого раку передміхурової залози (LNCaP) на життєздатність клітин (аналіз MTT) 4 Клітини висівали в присутності FBS в планшет multiwall з 6 ямками зі щільністю клітин 8×10 5 клітин/ямку (DU-145) або 1×10 клітин/ямку (LNCaP). Через 7 годин клітини позбавляли підпитки дигідротестостероном (DHT) на 15 годин і обробляли зростаючими концентраціями сполук протягом 24 або 48 годин (відсутність сироватки підтримували протягом обробок). Життєздатність клітин оцінювали фарбуванням MTT. Фітоканабіноїдні BDS і їх відповідні виділені фітоканабіноїди тестували як в клітинах гормоннечутливого (DU-145) раку передміхурової залози, так і в клітинах гормон-чутливого (LNCaP) раку передміхурової залози. Для цього експерименту було вибрано три різні фітоканабіноїди: CBG BDS і виділену сполуку, CBC BDS і виділену сполуку і CBD BDS і виділену сполуку. У таблиці 7.1 детально представлені дані, що спостерігаються в позбавлених підпитки клітинах. Як можна бачити, в кожному випадку BDS мало значно більший ефект відносно життєздатності клітин раку передміхурової залози, ніж його відповідний виділений фітоканабіноїд. Таблиця 7.1 ЗРАЗОК 5 10 15 20 25 30 35 EC50 відносно MAGL Ефект фітоканабіноїдного BDS на життєздатність клітин (аналіз MTT) - клітини, позбавлені підпитки дигідротестостероном (DHT) Зразок CBG CBG BDS CBC CBC BDS CBD CBD BDS DU-145 IC50 відносно життєздатності клітин 24 год. 48 год. 11,8 мкМ 5,8 мкМ 5,3 мкМ 4,8 мкМ 7,5 мкМ 5,6 мкМ 4,9 мкМ 4,5 мкМ 5,5 мкМ 4,9 мкМ 5,0 мкМ 3,6 мкМ 24 LNCaP IC50 відносно життєздатності клітин 24 год. 48 год. 10,8 мкМ 8,1 мкМ 7,0 мкМ 4,7 мкМ 10,8 мкМ 6,0 мкМ 6,3 мкМ 5,3 мкМ 5,3 мкМ 5,6 мкМ 5,5 мкМ 4,3 мкМ UA 109271 C2 Експеримент повторювали в клітинах гормон-нечутливого (DU-145) раку передміхурової залози і клітинах гормон-чутливого (LNCaP) раку передміхурової залози, які не були позбавлені підпитки DHT. У таблиці 7.2 нижче проілюстровані тільки CBG BDS і виділений CBG. 5 Таблиця 7.2 Ефект CBG і CBG BDS на життєздатність клітин (аналіз MTT) - клітини, не позбавлені підпитки DHT Зразок CBG CBG-BDS Зразок CBG CBG-BDS 10 15 20 25 30 35 40 45 LNCaP IC50 відносно життєздатності клітин >25 мкМ 21,2 мкМ DU-145 IC50 відносно життєздатності клітин >25 мкМ 24 мкМ Як продемонстровано в таблиці 7.2 вище, присутність DHT в не позбавлених підпитки клітинах значно змінює ефективність фітоканабіноїдного BDS і виділених фітоканабіноїдів. Дані, описані вище, знову ілюструють, що фітоканабіноїдні BDS є ефективнішими і по суті кращими сполуками для застосування в лікуванні злоякісної пухлини. Приклад 8 Ефект фітоканабіноїдів окремо або в комбінації з хіміотерапевтичним засобом або антиандрогеном в клітинній лінії гормон-нечутливого раку передміхурової залози (DU-145) і клітинній лінії гормон-чутливого раку передміхурової залози (LNCaP) в моделі з підшкірним ксенотрансплантатом. Використовували в цьому експерименті фітоканабіноїди CBG BDS і CBD BDS, щоб продемонструвати ефективність фітоканабіноїдних BDS in vivo. Злоякісні клітини підтримували in vitro у відповідному культуральному середовищі, і їх збирали, промивали в культуральному середовищі і ресуспендували в матригелі, щоб вони 7 були готовими для введення in vivo. 1-2×10 клітин в 200 мкл ін'єктували підшкірно в лівий бік мишей. Мишей піддавали анестезії і підшкірно в задню частину шиї кожної миші імплантували 0,5-мг гранулу 5-альфа-дигідротестостерону (вивільнення протягом 21 доби) для забезпечення росту пухлини, і рану закривали. Після досягнення імплантованою пухлиною 100-200 мм (2-3 тижні) мишей розподіляли в їх групи введення. Введення починали на 17 добу. Фітоканабіноїдне BDS вводили в/о один раз на добу в дозах 1, 10 і 100 мг/кг канабіноїдного BDS протягом подальших 25 діб. У наступному експерименті вводили хіміотерапевтичний засіб таксотер (5 мг/кг) в/в раз на тиждень, окремо або в комбінації з 100 мг/кг фітоканабіноїдного BDS. Хіміотерапевтичний засіб таксотер використовували як приклад класу таксанових лікарських засобів, які є інгібіторами мітозу. У наступному експерименті оцінювали дію CBD BDS в дозі 100 мг/кг CBD в комбінації або з 25 мг/кг, або 50 мг/кг антиандрогену бікалутаміду. Антиандроген бікалутамід є прикладом гормонального лікарського засобу, що використовується для лікування раку передміхурової залози. Гормональна терапія перешкоджає продукуванню конкретних гормонів організмом. Для росту раку передміхурової залози (коли він перебуває в гормон-чутливій стадії) потрібний чоловічий гормон тестостерон (андроген). Клітини раку передміхурової залози мають рецептори на їх поверхні, які, коли гормон зв'язується з ними, дозволяють злоякісній клітині рости. Антиандроген бікалутамід структурно схожий з тестостероном і перешкоджає зв'язуванню тестостерону зі злоякісною клітиною. Без тестостерону злоякісні клітини ростуть повільніше або можуть повністю припиняти рости і по суті в результаті пухлина може зменшуватися. Мишей оцінював кожну добу досвідчений фахівець протягом 4-5 тижнів. Розміри пухлини реєстрували на 7 добу (вимірювання штангенциркулем довжини і ширини і обчислення площі поперечного перерізу і об'єму) і їх реєстрували три рази на тиждень і масу тіла вимірювали раз на тиждень. Еквівалент дози для людини (HED) можна оцінювати з використанням наступної формули: 25 UA 109271 C2 HED Доза для тварини ( мг / кг), помножена на 5 10 15 20 25 30 K m тварини K m людини Km для миші становить 3 і Km для людини становить 37. На Фіг. 4 (a-f) детально представлений середній об'єм пухлини і маса тіла, зареєстрований в цих експериментах. На Фіг. 4 a) показано, що швидкість росту пухлини інгібувалась CBG BDS дозозалежним чином. Дози BDS як 10 мг/кг, так і 100 мг/кг, були значущими в порівнянні з групою носія. Крім того, таксотер значно інгібував як швидкість росту пухлини, так і кінцевий об'єм пухлини, причому в групі, в якій проводили лікування як CBG BDS, так і таксотером, спостерігався невеликий синергічний ефект. На Фіг. 4 b) показано, що швидкість росту пухлини інгібувалась CBD BDS дозозалежним чином. Дози BDS як 10 мг/кг, так і 100 мг/кг, були значущими в порівнянні з групою носія. Аналогічно експериментам з CBG BDS, таксотер значно інгібував як швидкість росту, так і кінцевий об'єм пухлини, причому в групі, в якій проводили лікування як CBD BDS, так і таксотером, спостерігався невеликий синергічний ефект. На Фіг. c) і d) показано, що існує невелике інгібування об'єму пухлини в клітинах гормоннечутливого (DU-145) раку передміхурової залози. Дані, подані на Фіг. 4 е) і f), детально описують об'єм і масу пухлинних клітин при введенні CBD BDS в комбінації з антиандрогеном бікалутамідом. Ці дані демонструють, що комбінація цих двох засобів, зокрема, при нижчому рівні дози бікалутаміду, здатна викликати пухлини більшого об'єму і маси, ніж або бікалутамід, або CBD BDS окремо. Всі ці дані демонструють, що фітоканабіноїдні BDS є у високій мірі ефективними сполуками для лікування злоякісної пухлини, зокрема, коли їх комбінують з іншою сполукою, такою як антиандроген або хіміотерапевтичний засіб. Приклад 9 Ефект фітоканабіноїдів на життєздатність клітин раку молочної залози (аналіз з Alamar blue) Клітини висівали в присутності FBS в планшети multiwell з 6 ямками і обробляли зростаючими концентраціями сполук протягом 72 годин. Життєздатність клітин оцінювали фарбуванням за допомогою Alamar blue. Виділені фітоканабіноїди тестували на клітинній лінії раку молочної залози MDA-MB-231 для визначення того, чи є фітоканабіноїди ефективними при інших типах злоякісної пухлини, відмінних від раку передміхурової залози. Різні виділені фітоканабіноїди, вибрані для цього експерименту, являли собою: CBGA, CBDA, CBDV, CBD, THCV і THC. У таблиці 9.1 нижче детально представлена ефективність канабіноїдів відносно знищення клітин раку молочної залози. 35 Таблиця 9.1 Ефект фітоканабіноїдів на життєздатність клітин раку молочної залози. Сполука IC50 (мкМ) 2,2 3,9 5,0 5,0 6,5 >10,0 CBGA CBDA CBDV CBD THCV THC 40 45 Фітоканабіноїдні кислоти як CBGA, так і CBDA, виявилися найефективними відносно знищення клітин раку молочної залози і по суті є хорошими мішенями для застосування цих сполук для лікування злоякісної пухлини. Ці дані демонструють, що, несподівано, фітоканабіноїдні кислоти більше ніж на 50 % кращі, ніж вільні фітоканабіноїди. Приклад 10 Ефект фітоканабіноїдів на канцерогенез в товстому кишечнику у мишей Фітоканабіноїди виділені CBD, CBG і CBDV, і BDS, відповідні CBD, CBG і CBDV, оцінювали відносно їх ефекту на профілактику і лікування раку товстого кишечнику у мишей. Вогнища аберантних криптів (ACF), поліпи і пухлини індукували у мишей за допомогою канцерогенної речовини азоксиметану. Фітоканабіноїди вводили (в/о) мишам три рази на тиждень протягом трьох місяців. Інгібітор COX-2 целекоксиб використовували як позитивний контроль. 26 UA 109271 C2 5 10 15 20 25 30 На Фіг. 5 (a-c) детально представлені результати, отримані з експериментів з виділеним CBD і CBD BDS. На Фіг. 5 a) можна бачити, що CBD BDS здатне на статистично значущому рівні знижувати кількість ACF на мишу в порівнянні з контролем. На Фіг. 5 b) показано, що CBD BDS є ефективним відносно зниження кількості поліпів на мишу на статистично значущому рівні в порівнянні з контрольними тваринами. На Фіг. 5 с) показано, що очищена сполука CBD значно знижувала кількість пухлин на тварину. На Фіг. 6 (a-c) продемонстровані дані, отримані для виділеного CBG і CBDV, в доповнення до даних, отриманих для CBG BDS і CBDV BDS. Все фітоканабіноїди виявляли захисний ефект проти експериментально індукованого канцерогенезу в товстому кишечнику, як показано на Фіг. 6 a), причому виділений CBG дав найбільш статистично значущі результати. На Фіг. 6 b) продемонстровано, що захисний ефект був ще більш вираженим відносно утворення ACF з 4 або більше криптами. Ці типи крипт передбачають кінцеве виникнення раку товстого кишечнику і утворення пухлин. Як показано, виділені CBG забезпечили найбільш статистично значущі дані, що демонструють такий захисний ефект, що у тварин, яким вводили виділений CBG, не утворювалося ACF більше ніж з 4 криптами. На Фіг. 6 с) детально представлена кількість пухлин, які виникали у кожної тварини. Знову, дані, отримані у мишей, яким вводили виділений CBG, були такими, що у цих тварин не утворювалося пухлин. В цілому, ці дані демонструють захисні ефекти фітоканабіноїдів відносно попередження раку товстого кишечнику. Значення має фітоканабіноїд CBG, який виявляє сильний захисний ефект проти раку товстого кишечнику, зокрема, коли він у виділеній формі. Приклад 11 Ефект фітоканабіноїдів в клітинах гліоми людини на життєздатність клітин (аналіз MTT) 4 Клітини висівали в присутності FBS в планшети multiwell з 6 ямками зі щільністю 8×10 клітин/ямку. Клітини гліоми обробляли зростаючими концентраціями сполук і оцінювали життєздатність клітин фарбуванням MTT. Досліджували CBD BDS і виділений CBD, CBG і CBDV. У таблиці 11.1 детально представлені виявлені дані. Як можна бачити, CBD BDS забезпечило найкращий результат при найнижчій концентрації, будучи дещо ефективнішим, ніж його відповідний виділений фітоканабіноїд. Таблиця 11.1 Ефект фітоканабіноїдів на життєздатність клітин (аналіз MTT) Зразок CBD CBD BDS CBG CBDV 35 40 45 IC50 відносно життєздатності клітин гліоми 8,92 мкМ 8,83 мкМ 12,40 мкМ 12,40 мкМ Як можна бачити, ці дані вказують на те, що як CBD BDS, так і виділений CBD, можуть бути придатними терапевтичними засобами при пухлинах головного мозку, включаючи гліому. Приклад 12 Ефект канабіноїдів THC і CBD окремо і в комбінації один з одним і/або з хіміотерапевтичним засобом темазоламідом на життєздатність клітинних ліній гліоми людини (аналіз MTT) Синергічна дія комбінованого введення фітоканабіноїдів THC і CBD в рівних кількостях тестували в клітинних лініях гліоми людину. Комбіноване введення двох фітоканабіноїдів приводило до синергічного зниження життєздатність клітин гліоми людини в ході аналізу MTT. У таблиці 12.1 нижче показано, що субефективні рівні доз THC і CBD (0,7 мкМ) приводять до статистично значущого зниження життєздатності клітин, коли два канабіноїди комбінують. Життєздатність клітин значно знижується при збільшенні рівня дози THC і CBD. 27 UA 109271 C2 Таблиця 12.1 Життєздатність клітин гліоми U87, оброблених THC, CBD і THC:CBD (1:1) Сполука Контроль THC CBD THC:CBD (1:1) THC CBD THC:CBD (1:1) THC CBD THC:CBD (1:1) Рівень дози (мкМ) 0,7 0,7 0,7 (кожний) 0,9 0,9 0,9 (кожний) 1,2 1,2 1,2 (кожний) Життєздатність клітин (%) 100 100 115 90 92 95 70 80 70 35 Подальші експерименти проводили з використанням темазоламіду (TMZ), ці дані представлені в таблиці 12.2 нижче. хіміотерапевтичного засобу 5 Таблиця 12.2 Життєздатність клітин гліоми U87, оброблених THC, CBD, THC:CBD (1:1) і TMZ Життєздатність клітин (%) 100 115 98 82 55 70 65 38 Сполука Контроль THC (1 мкМ) CBD (1 мкМ) TMZ (100 мкМ) THC:CBD (1 мкМ кожні) THC (1 мкМ) + TMZ (100 мкМ) CBD (1 мкМ) + TMZ (100 мкМ) THC:CBD (1 мкМ кожні) + TMZ (100 мкМ) 10 Комбіноване введення субмаксимальних доз THC, CBD і TMZ приводило до синергічного зниження життєздатність клітин гліоми U87. Приклад 13 Ефект канабіноїдів THC і CBD окремо і в комбінації один з одним і/або з хіміотерапевтичним засобом темазоламідом на життєздатність ксенотрансплантатів гліоми людини У таблиці 13.1 нижче детально представлені дані, зареєстровані, коли фітоканабіноїди THC і CBD тестували окремо або в комбінації відносно ксенотрансплантованих пухлин гліоми людини. 15 Таблиця 13.1 Об'єм пухлини після лікування THC, CBD і THC:CBD (1:1) Сполука Контроль THC CBD THC:CBD (1:1) THC CBD THC:CBD (1:1) THC CBD Рівень дози (мг/кг) 3,7 3,7 3,7 (кожний) 7,5 7,5 7,5 (кожний) 15,0 15,0 Об'єм пухлини (збільшення від 1 діб) 10,3 8,7 9,1 8,9 8,5 8,9 5,7 5,8 7,6 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPhytocannabinoids in the treatment of cancer
Автори англійськоюParolaro, Daniela, Massi, Paola, Izzo, Angelo Antonio, Borelli, Francesca, Aviello, Gabriella, Di Marzo, Vincenzo, De Petrocellis, Luciano, Moriello, Aniello, Ligresti, Alessia, Ross, Ruth Alexandra, Ford, Lesley Ann, Anavi-Goffer, Sharon, Guzman, Manuel, Velasco, Guillermo, Lorente, Mar, Torres, Sofia, Kikuchi, Tetsuro, Guy, Geoffrey, Stott, Colin, Wright, Stephen, Sutton, Alan, Potter, David, De Meijer, Etienne
Автори російськоюПароларо Даньела, Масси Паола, Иццо Анджело Антонио, Борелли Франческа, Авьелло Габриелла, ди Марцо Винченцо, дэ Петрочеллис Лучано, Морьелло Аньелло Скьяно, Лигрести Алессиа, Росс Рут Александра, Форд Лесли Энн, Анави-Коффер Шерон, Гусман Мануель, Веласко Гильермо, Лоренте Мар, Торрес София, Кикути Тецуро, Гай Джеффри, Стотт Колин, Райт Стефен, Саттон Алан, Поттер Дэвид, дэ Мэйер Этьенн
МПК / Мітки
МПК: A61K 36/185, A61K 31/138, A61P 35/00, A61K 31/352
Мітки: темозоламіду, фітоканабіноїдів, лікування, гліоми, комбінація
Код посилання
<a href="https://ua.patents.su/47-109271-kombinaciya-fitokanabinodiv-ta-temozolamidu-dlya-likuvannya-gliomi.html" target="_blank" rel="follow" title="База патентів України">Комбінація фітоканабіноїдів та темозоламіду для лікування гліоми</a>
Попередній патент: Комбінації активних сполук, що містять проквіназид, біксафен та/або протіоконазол
Наступний патент: Штабель з певної кількості ідентичних магазинних візків, які входять один всередину іншого
Випадковий патент: Пристрій для вивчення процесу усадки текстильних матеріалів